Что такое молекула? Какие молекулы существуют
Что такое молекула?
В первый раз слово «молекула» большинство из нас услышали в школе на уроках природоведения. Это одно из основополагающих понятий современной химии, которое сделало возможным дальнейшее познание окружающей среды. Что же такое молекула, из чего она состоит и зачем вообще нужно изучать молекулы?
Что же такое молекула, из чего она состоит и зачем вообще нужно изучать молекулы?
Откуда взялось слово «молекула»?Из чего состоит молекула?Чему равна масса молекулы?
Откуда взялось слово «молекула»?
Как и большинство химических терминов, слово «молекула» имеет в основе латынь. Оно образовано из двух слов: «мoles», имеющего значение массы, тяжести и «-cule» — уменьшительного суффикса. Дословное значение – маленькая масса.
В современной химии молекула – мельчайшая частица какого-либо вещества. Даже одна молекула любого вещества обладает всеми свойствами, которые характерны для этого вещества.
Если молекулу разделить на составные части, вещество, которое она составляла, уничтожится, распавшись на более простые элементы – атомы. На этой основе сформирован весь свод понятий, образующих современную химическую науку и практику.
Из чего состоит молекула?
Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» — атомов химических элементов. Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: h3O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.
Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода. Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Чему равна масса молекулы?
Конечно, таких чувствительных весов, которые позволяли бы взвесить одну молекулу вещества, не существует в арсенале современной науки. Масса молекул и атомов вычисляется другими способами. Принято считать, что масса молекулы любого вещества равна сумме масс всех атомов, из которых состоит это вещество.
Но как узнать, сколько весит атом? Это можно узнать из Периодической таблицы элементов Менделеева, где указана масса каждого элемента. Правда, указана не в привычных нам килограммах, а в специальных единицах атомной массы.
Т.е. чтобы подсчитать, сколько весит молекула вещества, нужно взять его формулу, сложить атомные массы всех входящих в нее элементов и умножить на вес атомной единицы массы.
www.vseznaika.org
Какие явления доказывают, что молекулы движутся ?
Диффузия. Тепловые явления, в принципе, можно объяснить и без гипотезы движения молекул. Броуновское движение НЕ доказывает, а только позволяет ПРЕДПОЛОЖИТЬ, что причиной хаотического движения частиц служит движение молекул. Размер броуновских частиц может быть больше, чем размер микроорганизмов или простейших, которые тоже могут толкать эти частицы.
тепло и тепловыделение
Броуновское движение. коротко, правильно и расписывать ненадо! красткость - сестра таланта!
Между молекулами существуют силы взаимного притяжения, которые действуют на расстоянии, равном диаметру самой молекулы. Если бы этих сил не было, то предметы не сохраняли бы свою форму, а рассыпались. Если внести в класс открытый флакон с духами, то через некоторое время запах духов распространится по всему классу. Это доказывает, что молекулы беспорядочно движутся во всех направлениях и молекулы одного вещества способны проникать между молекулами другого вещества. Такое явление называется диффузией. . Диффузия происходит и в твердых телах. Это доказывает такой опыт: две отполированные плоские пластинки из золота и свинца, положенные друг на друга, выдерживались при комнатной температуре в течение 5 лет. За это время пластинки срослись, образовав единое целое, причем молекулы золота проникли в свинец, а молекулы свинца — в золото на глубину до 1 см. Скорость диффузии зависит от агрегатного состояния вещества и температуры. С повышением температуры скорость диффузии возрастает, а с понижением — уменьшается. Диффузия, как и броуновское движение, является наглядным доказательством непрерывного движения молекул во всех веществах
самый простой. в кружку с горячим чаем кинь сахар и оставь. сахар со временем растворится.
тело двигается и молекулы в мести с ни тоже двигаются.
touch.otvet.mail.ru
Молекула
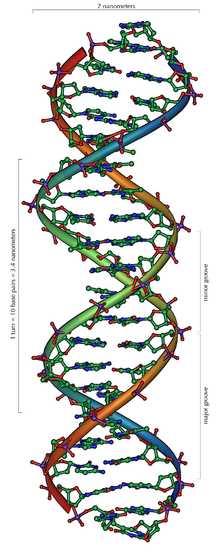
Структура части двойной спирали ДНК
Молекула (новолат. molecula, уменьшительно от лат. moles - Масса) - способна к самостоятельному существованию частица простого или сложного вещества, что имеет ее основные химические свойства, которые определяются ее составом и строением.
1. Строение и состав молекулы
Молекула состоит из атомов, а если точнее, то с атомных ядер, окруженных определенным числом внутренних электронов, и внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа ее получения. В случае одноатомных молекул (например, инертных газов) понятия молекулы и атома совпадают.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов. Молекула может иметь положительно и отрицательно заряженные атомы ( ионы).
Состав молекулы передается химическими формулами. Эмпирическая формула устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Геометрическая структура молекулы определяется равновесным расположением атомных ядер. Энергия взаимодействия атомов зависит от расстояния между ядрами. На очень больших расстояниях эта энергия равна нулю. Если при сближении атомов образуется химическая связь, то атомы сильно притягиваются друг к другу (слабое притяжение наблюдается и без образования химической связи), при дальнейшем сближении начинают действовать электростатические силы отталкивания атомных ядер. Препятствием к сильному сближению атомов является также невозможность совмещения их внутренних электронных оболочек.
Равновесные расстояния в двухатомных и многоатомных молекулах и расположения атомных ядер определяются методами спектроскопии, рентгеновского структурного анализа, электронографии и нейтронографии, которые позволяют получить сведения о распределении электронов (электронной плотности) в молекуле. Рентгенографическое излучения молекулярных кристаллов дает возможность установить геометрическое строение очень сложных молекул, даже молекул белков.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентная, радиус (в случае ионной связи - ионный радиус), который характеризует размеры электронной оболочки атома (иона), образующего химическую связь в молекуле.
Размер молекулы, т.е. размер ее электронной оболочки, является величиной в определенной степени условным. Существует вероятность (хотя и очень мала) найти электроны молекулы и на большем расстоянии от его атомного ядра. Практические размеры молекулы определяются равновесной расстоянием, на которое они могут быть сближены при плотной упаковке молекулы в молекулярном кристалле и в жидкости. На больших расстояниях молекулы притягиваются друг к другу, на меньших - отталкиваются. Размеры молекулы можно найти с помощью рентгеноструктурного анализа молекулярных кристаллов. Порядок величины этих размеров может быть определен с коэффициентов диффузии, теплопроводности и вязкости газов и с плотности вещества в конденсированном состоянии. Расстояние, на которое могут сблизиться валентно не связанные атомы одного и того же или разных молекул, может быть охарактеризована средними значениями так называемых ван дер ваальсовых радиусов (Ǻ).
Ван дер Ваальса радиусы существенно превышают коваленти. Зная величины ван дер ваальсовых, ковалентных и ионных радиусов, можно построить наглядные модели молекул, которые бы отражали форму и размеры их электронных оболочек.
Ковалентные химические связи в молекуле расположены под определенными углами, которые зависят от состояния гибридизации атомных орбиталей. Так, для молекул насыщенных органических соединений характерно тетраедральне (четырехгранный) расположение связей, образуемых атомом углерода, для молекул с двойной связью (С = С) - плоское расположение атомов углерода, для молекул соединений с тройной связью (С С) - линейное расположение связей.
Таким образом, многоатомная молекула имеет определенную конфигурацию в пространстве, т.е. определенную геометрию расположения связей, которая не может быть изменена без их разрыва. Молекула характеризуется той или иной симметрией расположения атомов. Если молекула не имеет плоскости и центра симметрии, то она может существовать в двух конфигурациях, которые представляют собой зеркальные отражения друг друга (зеркальные антиподы, или стереоизомеры. Все важнейшие биологические функциональные вещества в живой природе существуют в форме одного определенного стереоизомеров.
Молекулы, содержащие единичные связи, или сигма-связи, могут существовать в различных конформациях, возникающих при поворотах атомных групп вокруг единичных связей. Важные особенности макромолекул синтетических и биологических полимеров определяются именно их конформационными свойствами.
2. Взаимодействие атомов в молекуле
Природа химических связей в молекуле оставалась загадкой вплоть до создания квантовой механики - классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были созданы в 1927 году Гайтлера и Лондоном на примере простейшей молекулы Н 2. Позже, теория и методы расчетов были значительно усовершенствованы.
Химические связи в молекулах подавляющего большинства органических соединений является ковалентными. Среди неорганических соединений существуют ионные и донорно-акцепторные связи, которые реализуются в результате обобществления пары электронов атома.
Энергия образования молекулы из атомов во многих рядах сходных соединений приближенно аддитивна. То есть можно считать, что энергия молекулы - это сумма энергий ее связей, имеющих постоянные значения таких рядах.
Аддитивность энергии молекулы выполняется не всегда. Примером нарушения аддитивности есть плоские молекулы органических соединений с так называемыми сопряженными связями, т.е. с кратными связями, чередующимися с единичными. В таких случаях валентные электроны, определяющие кратность связей, так называемые p-электроны, становятся общими для всей системы сопряженных связей, делокализованных. Такая делокализация электронов приводит к стабилизации молекулы. Выравнивание электронной плотности вследствие коллективизации p-электронов по связям выражается в укорочении двойных связей и удлинение одинарных. В правильном шестиугольнике межуглеродными связей бензола все связи одинаковы и имеют длину, среднюю между длиной одинарной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах.
Современная квантовомеханическая теория химических связей учитывает частичную делокализации не только p-, но и s-электронов, которая наблюдается в любых молекулах.
В подавляющем большинстве случаев суммарный спин валентных электронов в молекуле равен нулю, т.е. спины электронов попарно насыщены. Молекулы, содержащие неспаренные электроны - свободные радикалы (например, атомный водород Н, метил CH 3), обычно неустойчивы, поскольку при их сочетании друг с другом происходит значительное снижение энергии вследствие образования ковалентных связей.
3. Межмолекулярное взаимодействие
Межмолекулярное взаимодействие - взаимодействие между электрически нейтральными молекулами в пространстве. В зависимости от полярности молекул характер межмолекулярного взаимодействия разный. межмолекулярного взаимодействия. Природа последнего оставалась неясной до создания квантовой механики.
Ориентационный тип межмолекулярного взаимодействия возникает между двумя полярными молекулами, то есть такими, которые имеют собственный дипольный момент. Взаимодействие дипольных моментов и определяет результирующую силу - притяжения или отталкивания. В случае, если дипольные моменты молекул располагаются на одной линии, взаимодействие молекул будет интенсивная.
Индукционный тип межмолекулярного взаимодействия возникает между одним полярной и одной неполярной молекулами. При этом типе взаимодействия полярная молекула поляризует неполярную молекулу так, что заряд неполярной молекулы, противоположную действующему на нее заряда полярной молекулы, смещается до последнего: в общем, положительный заряд смещается по направлению электрического поля, которое создает полярная молекула, а отрицательный - против. Это обусловливает поляризацию неполярной молекулы, т.е. явления смещения связанной электронной оболочки относительно центра положительного заряда.
Дисперсионный тип межмолекулярного взаимодействия возникает между двумя неполярными молекулами. Всего, дипольные моменты неполярных молекул равны нулю, однако в определенный момент времени, есть вероятность распределения электронов по всему объему молекулы неравномерно. Вследствие этого возникает мгновенный дипольный момент. При этом, мгновенный диполь или поляризует соседние неполярные молекулы, или взаимодействует с мгновенным диполем другой нейтральной молекулы.
См.. также: электрические силы взаимодействия
4. Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекул - постоянным дипольным моментом и поляризуемость.
Дипольный момент означает несовпадение "центров тяжести" положительных и отрицательных зарядов в молекуле (электрическую асимметрию молекулы). То есть молекулы, которые имеют центр симметрии, например H 2, лишены постоянного дипольного момента, и наоборот.
Поляризуемость - способность электронной оболочки любой молекулы перемещаться под действием электрического поля, в результате чего в молекуле образуется приведенный дипольный момент. Значение дипольного момента и поляризовности находят экспериментально с помощью измерения диэлектрической проницаемости.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны и определяются поляризуемость молекулы этого вещества. С поляризуемость непосредственно связаны преломления и рассеяния света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
5. Магнитные свойства молекул
Молекулы и макромолекулы подавляющего большинства химических соединений является диамагнитными. Магнитная восприимчивость молекул (χ) для отдельных органических соединений может быть выражена как сумма значений χ для отдельных связей.
Молекулы, которые имеют постоянный магнитный момент, является парамагнитными. К ним относятся молекулы с непарным количеством электронов на внешней оболочке (например, NO и любые свободные радикалы), молекулы, содержащие атомы с незапертой (незаполненными) внутренними оболочками (переходные металлы и т.д.). Магнитная восприимчивость парамагнитных веществ зависит от температуры, поскольку тепловое движение препятствует ориентации магнитных моментов в магнитном поле.
6. Спектры и строение молекул
Электрические, оптические, магнитные и другие свойства молекул связана с волновыми функциями и энергиями различных состояний молекул. Информацию о состояния молекул и вероятности перехода между ними дают молекулярные спектры.
Частоты колебаний в спектрах определяются массами атомов, их расположением и динамикой межатомных взаимодействий. Частоты в спектрах зависят от моментов инерции молекул, определения которых со спектроскопических данных позволяет получить наиболее точные значения межатомных расстояний в молекуле. Общее число линий и полос в колебательном спектре молекулы зависит от ее симметрии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество соединенных связей, характеризуются длинноволновыми полосами поглощения, попадающие в видимую область. Вещества, которые построены из таких молекул, характеризуются пестротой; к таким веществам относятся все органические красители.
7. Скорость молекул
8. Молекулы в химии, физике и биологии
Понятие молекулы является основным для химии, и большей частью сведений о строении и функциональность молекул наука обязана химическим исследованиям. Химия определяет строение молекул на основе химических реакций и, наоборот, на основе строения молекулы, определяет каким будет ход реакций.
Строению и свойствам молекулы определяются физические явления, которые изучаются молекулярной физикой. В физике понятие молекулы используется для объяснения свойств газов, жидкостей и твердых тел. Подвижностью молекул определяется способность вещества к диффузии, ее вязкость, теполопровиднисть и т.д.. Первый прямой экспериментальное доказательство существования молекул было получено французьским физиком Ж. Перреном в 1906 году во время изучения броуновского движения.
Поскольку все живые организмы существуют на основе тонко сбалансированной химической и нехимической взаимодействия между молекулами, изучение строения и свойств молекул имеет фундаментальное значение для биологии и естествознания в целом.
Развитие биологии, химии и молекулярной физики привели к возникновению молекулярной биологии, которая исследует основные явления жизни, исходя из строения и свойств биологически функциональных молекул.
9. Производные сроки
Молекулярный ( рус. молекулярный , англ. molecular , нем. molekular ) - То, что касается молекулы;
Примеры:
- молекулярная физика - раздел физики, в котором изучаются структура, силы межмолекулярного взаимодействия, характер теплового движения частиц (атомов, молекул, ионов), механические и тепловые свойства веществ в различных агрегатных состояниях;
- молекулярные спектры - спектры излучения и поглощения, а также комбинационного рассеяния, возникающих вследствие переходов между энергетическими состояниями молекул;
- молекулярные сита - пористые адсорбенты, в которых размеры пор или вход в поры близки к размерам молекул;
- молекулярные силы - силы взаимодействия между молекулами
- молекулярный генератор - см. лазер, мазер;
- молекулярные кристаллы - кристаллы, состоящие из молекул, которые связаны между собой межмолекулярными силами (например, нафталин).
- Молекулярный мотор - биологические молекулярные машины, которые используются для движения молекулярных объектов в живых организмах. Вообще говоря, мотор (двигатель) определяется как устройство, которое потребляет энергию в любой форме и преобразует ее в движение или механическую работу.
См.. также
Литература
nado.znate.ru
Атомы и молекулы
Атомы — это маленькие частицы, из которых состоит вещество. Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.
Представление об атомах
Мысль о том, что всё в природе состоит из атомов, возникла давно. Еще 2500 лет назад древнегреческие философы полагали, что вещество состоит из таких частиц, которые нельзя разделить. Само слово «атом» восходит к греческому слову «атомос», что значит «неделимый». В Древней Греции (см. статью «Загадочные жители Греции«) философы обсуждали гипотезу о том, что всё вещество в мире состоит из неделимых частиц. Правда, Аристотель в этом сомневался.
Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
В начале нашего столетия ученые начали строить модели атомов. Эрнест Резерфорд (1871 — 1937) показал, что отрицательно заряженные электроны обращаются вокруг положительно заряженного ядра. Нильс Бор (1885 — 1962) утверждал, что электроны обращаются по определенным орбитам. В 1932 г. Джеймс Чедвик (1891 — 1974) установил, что ядро атома состоит из частиц, которые он назвал протонами и нейтронами.
 Структура атома
Структура атома
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными. Центром атома является его ядро. Оно состоит из элементарных частиц двух видов — протонов и нейтронов. Есть в атоме также другие элементарные частицы — электроны; они вращаются вокруг ядра. Существует множество разных элементарных частиц. Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.Электроны в атоме находятся на разных энергетических уровнях, или оболочках. Каждая оболочка состоит из определенного числа электронов. Когда очередная оболочка заполняется, новые электроны попадают на следующую оболочку. Большую часть объема атома занимает пустое пространство между элементарными частицами. Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Атомный номер и атомная масса
Атомный номер — это число протонов в атомном ядре. Как правило, в состав атома входит одинаковое число протонов и электронов, поэтому по атомному номеру можно судить и о том, сколько в атоме электронов. В разных атомах содержится разное количество протонов. В ядре атома фосфора 15 протонов и 16 нейтронов, значит, его атомный номер 15. В ядре атома золота 79 протонов и 118 нейтронов: следовательно, атомный номер золота 79.
Чем больше протонов и нейтронов имеет атом, тем больше его масса (величина, показывающая количество вещества в составе атома). Сумму числа протонов и числа нейтронов мы называем атомной массой. Атомная масса фосфора — 31. При исчислении атомной массы электроны в расчет не принимаются, так как их масса ничтожно мала по сравнению с массой атома. Существует особый прибор — масс-спектрометр. Он позволяет определить для каждого данного атома его массу.
Изотопы
У большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12 есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов.
Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количествах.
Молекулы
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры. Молекула — это мельчайшая частица вещества, которая может существовать самостоятельно. Она состоит из атомов, удерживающихся вместе при помощи связей. Например, у молекулы воды два атома водорода связанны с атомом кислорода. Атомы удерживаются вместе благодаря электрическим зарядам частиц, из которых они состоят. Описывая строение молекул, ученые прибегают к помощи моделей. Как правило, они пользуются структурными и пространственными моделями. Структурные модели представляют связи, удерживающие атомы вместе, в виде палочек. В пространственных моделях атомы плотно соединены друг с другом. Конечно, модель не похожа на настоящую молекулу. Модели строятся для того, чтобы показать, из каких атомов та или иная молекула состоит.
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО2. Двойка Атомы обозначает число атомов кислорода в молекуле.
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев. Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол. Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.
www.polnaja-jenciklopedija.ru
Существуют ли молекулы? | blog.rudnyi.ru/ru
Мои комментарии к
Наконец-то появился светhttp://olgaw.livejournal.com/94718.html
19 февраля 2013, 21:01:43
Вам должно понравиться описание книги Коха http://nature-wonder.livejournal.com/210247.html
«Коха, как убежденного редукциониста, мучает отсутствие смысла жизни – он хорошо понимает эту связь – и признается ближе к концу, что все-таки предпочитает в него верить. Какой-то смысл во всем этом преобразовании материи должен быть, ему неизвестно какой, но это дает ему силы жить дальше.»
22 февраля 2013, 20:02:14
Я не читал саму книгу, поскольку мнение редукционистов мне в целом понятно. Здесь мое внимание привлекло признание факта, что в последовательном редукционизме нет места такому понятию как смысл жизни.
Меня сейчас привлекает позиция Ван Фраассена, который начинает свое рассмотрение с факта, что физикализм/материализм начиная с атомов и молекул приходит к тому, что есть хорошие и плохие теории. Так вот, слово хороший или плохой означает возникновение позиции (скажем хорошей позиции), которая затем защищается от противоложной позиции (плохой позиции). Как пример можно привести высказывание на похоронах Фрэнсиса Крика его сына сказал, что у отца всю жизнь была мечта забить последний гвоздь в гроб витализма (Фрэнсис Крик был старшим коллегой Коха ). Однако откуда из атомов и молекул возникает такая позиция остается непонятным.
Ван Фраассен соотвественно предлагает начать наоборот с признания факта, что вот у людей существуют разные позиции и далее рассмотреть, что же из этого следует.
23 февраля 2013, 21:41:19
С другой стороны люди рождаются и умирают. Поэтому вопросы есть ко всем сторонам.
Ван Фраассен относится к антиреалистам. Он признает все научные достижения но отрицает существование соответствующих онтологических сущностей. Скажем в его новой книге Научное представление он относит изображения в микроскопе к коллективных галлюционациям (как например радуга). Я опробовал пару раз эту идею на знакомых биологах, очень забавно.
24 февраля 2013, 18:14:24
В ваших предложениях уже много метафизики. Ван Фраассен как раз пытается обойтись без нее. У него вот сосна действительно с зелеными иголочками, а молекулы у него не существуют.
28 февраля 2013, 21:43:52
«Молекулы существуют» — это типичное утверждение из области метафизики. Почему, собственно говоря, нельзя просто сказать, что молекулы были полезной концепцией, которая способствовала развитию химии и привела к созданию многих новых материалов. С исторической точки зрения молекулы были именно представлением, которые химики успешно использовали в своей работе для описания веществ с точки зрения химического строения. С точки зрения Ван Фраассена придавать представлению отнологический характер как раз не следует.
Интересно отметить, что смысл предложения «Молекулы существуют» с точки зрения самой физики не очень понятен. Вот например цитата от Роберта Лафлина (книга A different Universe, Другая Вселенная), которая так описывает переход от квантового мира к наблюдаемому нами макромиру
«К наиболее важным эффектам становления фазы является возникновение существования объектов. Этот момент легко не заметить, так как мы привыкли думать о кристаллизации в терминологии упаковки ньютоновских сфер. Атомы однако это не ньютоновские сферы, а эфирные квантово-механические специи, которым не хватает наиболее центральной из всех свойств объекта — определенной позиции. Именно поэтому попытки описать свободные атомы в терминах ньютоновской механики приводят к глупостям типа того, что атомы не существует ни здесь, не там, а одновременно везде. Именно агрегация атомов в крупные объекты придает смысл описанию атомов на языке ньютоновской механики, а не наоборот. Можно было бы сравнить данное явление с еще неснятым фильмом Спилберга, в котором огромное количество маленьких приведений берутся за руки и из-за этого становятся телесными».
Действительно, что же существует на самом деле: протоны и нейтроны, кварки или суперстурны? Это похоже пока остается открытым вопросом.
1 марта 2013, 20:20:40
Видите, проблемы есть везде. Вы же сами говорите, что материализм и сознание непримиримы. В этом отношении как раз вопрос состоит в том, как совместить сознание и существование молекул.
Наука в конечном итоге имеет эмпирическую основу и Ван Фраассен предлагает не забывать об этом. Здесь важно решить, что взять в качестве отправной точки. Ван Фраассен в отличие от скептиков и материалистов в качестве такой точки выбирает небольшой мирок в котором живет человек и где иголки на соснах существуют там, где человек их наблюдает. По-моему, вполне нормальная исходная точка зрения, которая полностью согласуется с историей науки.
2 марта 2013, 14:19:38
Спасибо за ваши ответы. Когда вы найдете способ соединить молекулы и нематериальное сознание, пожалуйста напишите.
Я не уверен, что можно доверить физикам решение о том, что онтологически существует и что нет. Я уже привел цитату из книги Роберта Лафлина по поводу квантовых объектов (к слову сказать он лауреат Нобелевской премии по физике). Вам также будет интересно в этом отношении познакомится с многомировая интерпретацей квантовой механики, которая в настоящее время становится популярной у физиков. Например из российской Википедии
«Многомировая интерпретация (англ. Many-worlds interpretation) — это интерпретация квантовой механики, которая предполагает существование, в некотором смысле, «параллельных вселенных», в каждой из которых действуют одни и те же законы природы и которым свойственны одни и те же мировые постоянные, но которые находятся в различных состояниях. В действительности, термин «многомировая» только вводит в заблуждение; многомировая интерпретация не предполагает реального наличия именно других миров, она предлагает лишь один реально существующий мир, который описывается единой волновой функцией, которую, однако, для завершения процесса измерения какого-либо квантового события, необходимо разделить на наблюдателя (который проводит измерение) и объект, описываемых каждый своей волновой функцией. Однако сделать это можно по-разному, а потому в результате получаются разные значения измеряемой величины и, что характерно, разные наблюдатели. Поэтому считается, что при каждом акте измерения квантового объекта, наблюдатель как бы расщепляется на несколько (предположительно, бесконечно много) версий. Каждая из этих версий видит свой результат измерения и, действуя в соответствии с ним, формирует собственную предшествующую измерению историю и версию Вселенной. С учетом этого данную интерпретацию как правило и называют многомировой, а саму многовариантную Вселенную — Мультиверсом.»
В данной интерпретации выражение Молекулы существуют похоже означает не совсем то, что вы имеете в виду. Поэтому если вы считаете, что физики говорят истину, то вначале пожалуйста познакомьтесь с тем, что говорят современные физики. Например вот информация из российской Википедии о том, что говорит профессор Массачусетского технологического института Макс Тегмарк по поводу основ бытия
‘Тегмарк также сформулировал собственную «Окончательную теорию всего», единственный постулат которой состоит в том, что «все математически непротиворечивые структуры существуют физически». Эта простая теория без свободных параметров подразумевает, что в математических структурах, достаточно сложных, чтобы содержать способные к самоосознанию подстуктуры, эти последние будет воспринимать себя живущими в «реальном» физическом мире. Эта идея обозначается как «математическая гипотеза Вселенной»‘
Соотвественно, Ван Фраассен предпочитает не вводить ненужные метафизические сущности.
blog.rudnyi.ru
Молекула
Молекула (франц. molecule, от лат. moles — масса) — это наименьшая способная к самостоятельному существованию частица вещества, обладающая его химическими свойствами.
Учение о строении и свойствах молекул приобрело исключительный интерес для познания субмикроскопической структуры клеток и тканей, а также механизма биологических процессов на молекулярном уровне. Большие успехи в изучении структуры молекул и, в частности, молекул таких биополимеров, как белки и нуклеиновые кислоты, показали, что важнейшие функции этих веществ в организмах осуществляются на уровне отдельных молекул и поэтому должны исследоваться как молекулярные явления. Установлено, например, что такие функции белков, как ферментативная, структурная, сократительная, иммунная, транспортная (обратимое связывание и перенос жизненно необходимых веществ) разыгрываются на молекулярном уровне и непосредственно определяются структурой и свойствами молекул этих веществ. Наследственность и изменчивость организмов связаны с особой структурой и свойствами молекул нуклеиновых кислот, в которых зафиксирована вся генетическая информация, необходимая для синтеза белков организма. Небольшие отклонения в структуре или составе молекул ряда биологически важных веществ или изменения в молекулярном механизме некоторых обменных процессов являются причиной возникновения ряда заболеваний (например, серповидноклеточная анемия, наследственная галактоземия, сахарный диабет и др.), называемых молекулярными болезнями.
Молекула каждого вещества состоит из определенного числа атомов (см.) одного химического элемента (простое вещество) или различных элементов (сложное вещество), объединенных посредством химических (валентных) связей. Состав молекулы выражают химической формулой, в которой знаки элементов указывают вид атомов, образующих молекулу, а числа, стоящие справа внизу, показывают, сколько атомов каждого элемента входит в состав молекулы. Так, из химической формулы глюкозы С6h22O6 следует, что молекула глюкозы состоит из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Молекулы инертных газов и паров некоторых металлов одноатомны. Это самые простые молекулы. Наиболее сложными являются молекулы белков (см.), нуклеиновых кислот (см.) и других биополимеров, состоящие из многих тысяч атомов.
Для нахождения химической формулы молекулы необходимо определить приблизительный молекулярный вес (см.) исследуемого вещества и простейшую (эмпирическую) формулу его молекулы. Последнюю выводят из процентного состава данного вещества и атомных весов (см.) химических элементов, входящих в состав этого вещества. Так, например, химическим анализом установлено, что бензол состоит из 92,26% углерода и 7,74% водорода. Отсюда следует, что отношение числа атомов углерода к числу атомов водорода в молекуле бензола равно: где 12,011 и 1,008 — атомные веса углерода и водорода соответственно. Следовательно, простейшая формула бензола должна быть СН. Сопоставляя простейшую формулу бензола с его приблизительным молекулярным весом (78,1), найденным опытным путем, определяют его действительную, или истинную, формулу С6Н6.
Размеры молекул выражают в А. Так например, диаметр молекулы воды, предполагая, что она имеет сферическую форму, составляет 3,8 А. Молекулы высокомолекулярных веществ значительно больше, например линейные размеры больших и малых осей палочковидных молекул фибриногена быка равны 700 и 40 А, а вируса табачной мозаики — 2800 и 152 А соответственно. Мерой относительной массы молекулы является молекулярный вес (см.), величина которого колеблется от нескольких единиц до миллионов.
Последовательность, в которой атомы связаны в молекуле (химическое строение молекул по А. М. Бутлерову), изображают так называемыми структурными формулами. Например, химическое строение уксусной кислоты С2Н4O2 представляют следующей структурной формулой:где каждая линия обозначает единицу валентности (см.), число линий, подходящих к атому, равно его валентности в данном соединении.
Химическое строение молекулы, находимое на основании определения молекулярного веса, химического состава и изучения химических свойств исследуемого вещества и окончательно подтверждаемое его синтезом из веществ, химическое строение которых известно, является важным фактором, определяющим свойства вещества, в частности его фармакологическое действие, токсичность и биологические функции. Различие в свойствах изомеров (см. Изомерия) является примером зависимости свойств веществ от химического строения их молекул. Атомный состав молекул изомеров одинаков, так, например, диметиловый эфир и этиловый спирт, будучи изомерами, имеют одинаковые химические формулы С2Н6O, однако структурные формулы их различны:чем и объясняются их различные свойства.
Способность атома образовывать то или иное число химических связей с другими атомами в молекулах называют валентностью данного атома. При образовании химической (валентной) связи происходит перегруппировка внешних (валентных) электронов взаимодействующих атомов, в результате которой внешние электронные оболочки атомов в молекуле приобретают устойчивую структуру, свойственную атомам инертных газов (см.) и состоящую обычно из восьми электронов (электронный октет). В зависимости от способа перегруппировки валентных электронов различают несколько основных типов химических связей.
Ионная (электровалентная) связь возникает между атомами элементов, сильно различающихся по химическим свойствам, например между атомами щелочных металлов и атомами галогенов. При этом атом металла отдает электрон атому галогена (рис. 1).
Рис. 1. Образование молекулы хлористого натрия.
Атом, отдающий электрон, становится положительно заряженным ионом. Атом, принимающий электрон, становится отрицательно заряженным ионом. Возникающие таким путем противоположно заряженные ионы взаимно притягиваются, образуя молекулу. Молекулы и соединения с ионными связями (например, соли и окислы металлов первой и второй групп периодической системы элементов) называются гетерополярными. Ионная связь характеризуется большой прочностью (энергия связи), т. е. работой, необходимой для разрыва молекулы на отдельные ионы.
Ковалентная (атомная) связь возникает при взаимодействии одинаковых или близких по свойствам атомов. При этом каждый из соединяющихся атомов отдает по одному или по нескольку валентных электронов на образование пары (или нескольких пар электронов), которая становится общей для обоих атомов. Обобщенная пара электронов, охватывая в своем движении ядра соединяющихся атомов, удерживает их один возле другого. К молекулам с ковалентной связью относятся молекулы простых газов, окислов и водородных соединений не металлов и многих органических соединений:Точками обозначены электроны, находящиеся на внешних электронных оболочках атомов, химическими знаками — ядра атомов со всеми электронными оболочками, кроме внешних. Пара электронов, связывающих атомы, соответствует валентной черте в обычных структурных формулах.
Молекулы, в которых электрические центры тяжести отрицательных (электроны) и положительных (ядра атомов) зарядов совпадают, называют гомеополярными. К ним относятся, например, молекулы простых газов, углеводородов. Если электрические центры тяжести отрицательных и положительных зарядов в молекулах не совпадают, молекулы называют полярными (например, молекулы воды, аммиака, галогеноводородов, спиртов, кетонов, альдегидов, эфиров). Полярная молекула ведет себя как диполь, т. е. система из двух электрических зарядов е+ и е- , одинаковых по величине, но противоположных по знаку, расположенных на пекотором расстоянии h один от другого (рис. 2).
Рис. 2. Схема диполя.
Произведение e·h=μ называют дипольным моментом молекулы. Последний является мерой полярности молекулы. Вещества, состоящие из полярных молекул, имеют более высокие температуру кипения, теплоемкость, теплоту парообразования и поверхностное натяжение, чем вещества, состоящие из гомеополярных молекул. Взаимодействие между полярными молекулами является одной из причин ассоциации молекул в жидкостях, а взаимодействие полярных молекул растворителя с полярными молекулами или ионами растворенного вещества — сольватации последних. Скорость диффузии полярных молекул через мембрану клеток меньше таковой для гомеополярных молекул.
Координационная (семиполярная, донорно-акцепторная) связь — это разновидность ковалентной связи, возникает между атомами, входящими в состав разных молекул, у одного из которых имеется неподеленная пара электронов, а у другого не хватает двух электронов для образования устойчивой внешней электронной оболочки. Такого рода связи характерны для комплексных соединений. Так, например, соединение молекулы аммиака Nh4 с молекулой фтористого бора BF3 в комплексную молекулу аммиаката фтористого бора осуществляется неподеленной парой электронов азота
Атом азота служит донором, атом бора акцептором электронной пары.
Водородная связь осуществляется между атомом водорода, ковалентно связанным с атомом F, О или N, и атомами F, О или N, находящимися в других молекулах. Прочность водородной связи невелика (5—10 ккал/моль), однако достаточна для образования ассоциаций молекул в жидкостях и растворах. В воде, например, такие ассоциации имеют следующее строение (водородные связи обозначены пунктиром):
Водородные связи возникают не только между молекулами, но и между атомами внутри одной и той же молекулы; это так называемые внутримолекулярные водородные связи (водородные мостики). Примером такой связи может служить водородная связь между атомом водорода и атомом кислорода в молекуле o-метилсалицилата:
Вследствие наличия этой связи свойства o-метилсалицилата резко отличаются от свойств m- и n-изомеров. Наличие водородных мостиков в молекулах нуклеиновых кислот, белков и других полимеров во многом определяет лабильность этих молекул. Водородные связи играют значительную роль в субмикроскопической структуре протоплазмы.
При помощи рентгено-, электроно-, нейтронографии, молекулярной спектроскопии и ядерного магнитного резонанса удалось установить пространственное расположение отдельных атомов в молекуле, т. е. геометрическую конфигурацию молекул ряда веществ, в том числе молекул биологически важных веществ.
Определение пространственной конфигурации молекул слагается из определения так называемые остова молекулы, т. е. пространственного расположения ядер образующих ее атомов, и распределения электронов в пределах данной молекулы.
Остов молекулы находят на основании данных о длине связи и величине валентных углов, определяемых с помощью указанных выше методов. Длина связи представляет собой расстояние между центрами двух атомов в молекуле, связанных друг с другом ковалентной связью. Меньший по величине угол, образуемый прямыми, соединяющими центры двух атомов А1 и А2 с центром третьего атома А3 в данной молекуле, называют валентным углом. Остов молекулы не является абсолютно жестким. Например, в молекулах органических соединений атомы углерода могут вращаться около ординарных (простых) связей, при этом меняется взаимное положение ядер, но остаются постоянными последовательность соединения атомов в молекуле, длина связей и валентные углы. Такие различные формы молекул, возникающие в результате поворота атома углерода вокруг ординарной связи, называют конформациями. Различные конформации одной и той же молекулы легко и обратимо переходят друг в друга, чем объясняются отсутствие изомеров вращения и переход молекул в форму, наиболее соответствующую для протекания той или иной реакции.
Распределение электронов в молекулах находят главным образом с помощью теоретических расчетов, в основе которых лежат два основных принципа квантовой химии. Первый из них утверждает, что электроны в атомах и молекулы могут находиться лишь на дискретных и совершенно определенных энергетических уровнях. Согласно второму принципу электроны в атомах и молекулы нельзя рассматривать как точечные частицы, положение и скорость которых в молекуле (или атоме) можно точно определить для каждого момента времени. В действительности, как учит квантовая механика, можно определить лишь вероятность нахождения электрона в некоторых областях пространства в данный момент времени. Поэтому можно представить, что заряд электрона как бы «размазан» в определенной области пространства в виде электронного облака, распределение которого в пространстве определяется соответствующей математической функцией (называемой волновой функцией электрона или его молекулярной орбиталью (или атомной орбиталью, если его распределение определяют в атоме).
Выло показано, что не все электроны в молекуле одинаково существенны для ее химических свойств. Так, например, в молекуле с большим числом двойных связей, к которым относится подавляющее большинство соединений, играющих доминирующую роль в процессах жизнедеятельности, электроны можно разделить на два типа. К первому типу относятся σ-электроны, участвующие в образовании ординарных связей, ко второму — п-электроны, участвующие в образовании двойных связей. Первые образуют жесткий скелет молекулы и локализованы попарно между соседними атомами. Вторые образуют значительно более расплывчатое облако, охватывающее всю периферию молекулы. В таких молекулах все основные их свойства обусловлены п-электронами, которые более лабильны сравнительно с σ-электронами и поэтому с большей легкостью могут участвовать в различного рода процессах.
www.medical-enc.ru
Что такое молекула?
Если Вы еще не знаете, что такое молекула, тогда эта статья именно для Вас. Еще много лет назад люди начали догадываться, что каждое вещество состоит из отдельных маленьких частиц. Как было доказано немного позже, эти частицы называются атомами. Как правило, атомы не могут существовать отдельно, поэтому они объединяются в молекулы. И атомы, и молекулы очень маленькие. Например, в составе пылинки есть огромнейшее количество атомов.
Несмотря на то, что вещества бывают самыми разнообразными, количество атомов все же ограничено. Атомы объединяются между собой разными способами, в результате чего из тех самых атомов формируются молекулы различных веществ, которые нас окружают. Это и дает нам полный ответ на вопрос о том, из чего состоит молекула.
Также вас может заинтересовать, что меньше молекулы. На этот вопрос есть однозначный ответ. В состав молекулы могут входить два или больше атома, которые связаны между собой ковалентной связью. Именно атом и является наименьшей частицей по сравнению с молекулой.
Свойства молекул
Рассмотрим свойства молекулы на примере такого вещества, как сахар. Если его размолоть на самые мелкие крупинки, в его составе все равно будет множество идентичных молекул сахара. Каждая крупинка при этом сбережет все свойства данного вещества. Даже в том случае, если раздробить сахар на отдельные молекулы, например, растворить его в воде, вещество никуда не исчезнет и будет проявлять свои свойства. Это можно проверить, попробовав, что вода стала сладкой. Конечно, если продолжить дробление сахара и дальше, разрушив при этом молекулы или забрав от них несколько атомов, произойдет разрушение вещества. Стоит отметить, что атомы не исчезнут, а войдут в состав других молекул. Сам сахар как вещество уже не будет существовать и превратится в другое вещество.
Вечных веществ не бывает. Так же, как и не бывает вечных молекул. Однако атомы считаются практически вечными.
Хотя молекулы и очень маленькие по размеру, их устройство все же можно вы
elhow.ru
















