Вакцина против рака. Бороться с опухолью могут иммунные клетки больного. Вакцина против рака
Вакцина против рака. Бороться с опухолью могут иммунные клетки больного | Здоровая жизнь | Здоровье
Меланома. Саркома. Рак прямой кишки. Каждый из этих диагнозов звучит как приговор. Традиционные методы лечения не помогают. Девять из десяти больных погибают в первый же год после диагноза. Остановить прогрессирование болезни – значит спасти жизнь. Пусть на время, пусть на 10–15 лет, но всё-таки…
Иммунная система пациента с агрессивной формой рака словно вывешивает белый флаг и в упор не видит опасные для жизни клетки. Но научить её распознавать клетки новообразования и бороться с ними всё-таки возможно.
Лаборатория в составе отделения биотерапии опухолей была создана в НИИ онкологии имени Н. Н. Петрова в 1998 году. Уже через пять лет учёные получили свой первый патент – на иммунотерапию костномозговыми дендритными клетками больных солидными опухолями. Ещё через пять лет, в 2003 году, запатентована аутологичная вакцина на основе костномозговых дендритных клеток в сочетании с фотодинамической терапией для лечения химиорезистентных диссеминированных солидных опухолей. В 2010 году специалисты НИИ получают разрешение применять своё изобретение в клинической деятельности. В 2014‑м создаётся научный отдел онкоиммунологии.
А если иммунитет очнётся?
Новое – это хорошо забытое старое. Уникальные противоопухолевые вакцины учёные из НИИ онкологии имени Н. Н. Петрова создают в конце XX – начале XXI века. Но мало кто помнит, что ещё в XIX веке медицинская наука обратила внимание на интересную закономерность: пациенты, у которых есть опухоль, заболевают инфекцией и… выздоравливают. Опухоль разрушается!
А почему разрушается опухоль? Впоследствии выяснилось: потому что активируется иммунная система. Она как будто приходит в сознание и начинает видеть не только вирусы или бактерии, но и опухолевые клетки, которые до поры до времени успешно уклонялись от иммунного надзора. Новое направление в медицине начало развиваться, но вскоре изобрели лучевую терапию, а затем химиотерапию. Эти методы стали давать результаты, и об иммунной системе на время забыли.
Но прошло много лет, и стало понятно, что химиотерапия и лучевая терапия – ещё не панацея. Необходимы дополнительные методы лечения, которые восстановят противоопухолевый иммунный ответ. К исследованию клеток иммунной системы вернулись вновь.
Когда опухоль сильнее лимфоцита
Кстати, а почему иммунитет оказывается беспомощным перед опухолевой клеткой? Наш организм похож на общество: наиболее активно и эффективно отстаивают свои права те, у кого они не так уж и нарушены.
 «Опухолевые клетки секретируют факторы, которые уменьшают активность лимфоцитов, – рассказывает заведующая научным отделом онкоиммунологии, доктор медицинских наук, ведущий научный сотрудник Ирина Александровна Балдуева. – Бывает так, что когда лимфоцит контактирует с опухолевой клеткой, то… не лимфоцит разрушает опухолевую клетку, а опухолевая клетка запускает механизм клеточной смерти лимфоцита. Она оказывается сильнее. Своей изменчивостью, своим желанием защитить себя. В опухолевом очаге 3,5 см генетики насчитывают более ста тысяч мутаций. По некоторым опухолевым клеткам нельзя уже определить, от мужчины они или от женщины…»
«Опухолевые клетки секретируют факторы, которые уменьшают активность лимфоцитов, – рассказывает заведующая научным отделом онкоиммунологии, доктор медицинских наук, ведущий научный сотрудник Ирина Александровна Балдуева. – Бывает так, что когда лимфоцит контактирует с опухолевой клеткой, то… не лимфоцит разрушает опухолевую клетку, а опухолевая клетка запускает механизм клеточной смерти лимфоцита. Она оказывается сильнее. Своей изменчивостью, своим желанием защитить себя. В опухолевом очаге 3,5 см генетики насчитывают более ста тысяч мутаций. По некоторым опухолевым клеткам нельзя уже определить, от мужчины они или от женщины…»
Из-за мутаций и быстрого роста опухоли иммунная система перестаёт узнавать опасные клетки, которые когда-то были родными, а теперь стали чужеродными. Есть даже теория, что опухолевым клеткам помогают… нормальные, здоровые клетки, расположенные по соседству. Они начинают синтезировать факторы роста, благодаря которым развивается новообразование.
Надо успеть
У каждого пациента своя вакцина. Та, которая подействует именно на его опухоль. Для этого учёные тщательно изучают опухолевые клетки, взятые у больного. Измельчив биоматериал с помощью специальной автоматической машины, пытаются полностью охарактеризовать опухоль – выявить все особенности её поведения, все иммуносуппрессирующие факторы, которые она продуцирует. Нет, это совсем не опечатка.
Опухолевые клетки в отличие от многих из нас всеми силами цепляются за жизнь. Не сработал один механизм подавления иммунной системы – она вырабатывает другой. Не сработал другой – создаёт третий. На экране клеточного видеокомпьютера видно, как стремительно делятся клетки рака толстой кишки. Специальные ножи лабораторной автоматической машины, раскрошившие опухоль на отдельные клетки, новообразованию, кажется, нипочём.
 «Конечно, то, что вы видите сейчас, – это процесс, ускоренный в несколько раз. Но как растёт опухоль здесь, в лаборатории, так она растёт и в организме пациента. И надо успеть начать лечить заболевшего человека», – замечает кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Татьяна Леонидовна Нехаева. И продолжает знакомить с процессом воссоздания клеток иммунной системы, способных вернуть к жизни уже ни на что не реагирующую иммунную систему.
«Конечно, то, что вы видите сейчас, – это процесс, ускоренный в несколько раз. Но как растёт опухоль здесь, в лаборатории, так она растёт и в организме пациента. И надо успеть начать лечить заболевшего человека», – замечает кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Татьяна Леонидовна Нехаева. И продолжает знакомить с процессом воссоздания клеток иммунной системы, способных вернуть к жизни уже ни на что не реагирующую иммунную систему.
Чтобы успеть, необходимо приготовить вакцинный препарат и ввести больному человеку его первую инъекцию. На создание препарата требуется десять дней – если процесс пройдёт удачно с первой же попытки.
За два первых месяца лечения пациент получит вакцину четырежды. В препарате будут активированные дендритные клетки, которые научат лимфоциты распознавать опухоль. Так стартует иммунный ответ.
Как рождается вакцина
Противоопухолевая вакцина создаётся из собственных клеток иммунной системы больного. Со стороны начало работы очень похоже на обычный анализ крови из вены. В биоматериале учёные по специальным методикам выделят предшественников периферических дендритных клеток – моноциты. А потом начнётся самое сложное. Моноциты необходимо дифференцировать в дендритные клетки. Для этого нужны специальные факторы роста клеток человека (никак не факторы роста для экспериментальных животных), в частности, интерлейкин‑4, гранулоцитарно-макрофагальный колониестимулирующий фактор и особая бессывороточная питательная среда (без ксеногенных факторов лабораторных животных) для получения индивидуальной вакцины человека. В такие условия моноциты помещаются на десять дней. Через неделю их забирают на анализ – проточную цитометрию. Если процесс прошёл правильно, лаборатория обнаружит в материале предшественников – незрелые дендритные клетки. Если же нет, придётся начинать всё сначала. И дай бог успеть вовремя. Так бывает у начинающих учёных без опыта работы, наличия импортных ростовых факторов и специальной дендритноклеточной питательной среды.
Следующий шаг – превратить дендритные клетки из круглых, незрелых, в зрелые, древовидные. Дендритная клетка растёт, когда «ловит» специфические антигены и представляет их на своей поверхности, поясняет Татьяна Нехаева. Если в период роста дендритной клетке добавить антигены бактериальные, то она поможет иммунной системе сформировать антибактериальный иммунитет. Если же клетка получит антигены опухоли, формируется сильный противоопухолевый иммунный ответ.
Созревшая дендритная клетка, уже представляющая частицы опухоли на своей поверхности, становится основным компонентом противоопухолевой вакцины.
Теперь, когда пациента вакцинируют, самое главное – способность полученных дендритных клеток к миграции. После введения вакцины в организм больного клетки направятся в лимфоузлы и там смогут представить опухолевые антигены клеткам иммунной системы, Т‑лимфоцитам. Т‑лимфоциты получат «отпечаток» опасности и, узнав врага в лицо, начнут с ним бороться. А врач будет следить за тем, как развивается противоопухолевый иммунный ответ в организме пациента, и думать, как его усилить, чтобы излечить болезнь.
Надо просто любить эти клеточки…
«Клетки ведут себя точно так же, как само поведение человека. У пациента с повышенной нервозностью состояние клеток будет соответствовать его душевному состоянию. И наоборот. Один из наших пациентов до болезни служил в разведке, длительное время работал за рубежом. Его индивидуальная вакцина оказалась образцовой! Снимки можно было помещать хоть на картинки в учебниках», – рассказывает Ирина Балдуева.
Приготовление вакцинного препарата – процесс не только и не столько химический. Если не любить отдельные живые клетки, если не относиться к ним бережно и заботливо, как к маленьким детям, лекарство не получится. И пациент не выздоровеет.
А причины могут быть самые разные: «молодой» учёный забыл добавить ростовые факторы, ошибся с дозировкой, не проверил состояние вакцинных клеток, проглядел инфекцию, непонятным образом проникшую в стерильный асептический блок…
Доктор медицинских наук Ирина Александровна Балдуева, разрабатывающая противоопухолевые вакцины в НИИ онкологии им. Н. Н. Петрова с 1998 года, замечает: важен не только настрой больного на выздоровление, но и настрой специалиста, который создаёт вакцинный препарат. И пусть это кажется странным, но клетки иммунной системы получаются активными и жизнеспособными только тогда, когда к ним относятся с особой любовью.
Одиночество опасно для жизни
Наши клетки – это мы сами в миниатюре. Сегодня в науке уже известно: когда человек в депрессии, по-другому работает не только мозг, но и все без исключения органы и системы. Возможности нашего организма безграничны – и многое вопреки всем достижениям медицинской науки зависит от того, какой приказ отдаст подсознание.
 «Если больной НЕ хочет жить, то медицина бессильна, – говорит кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Алексей Викторович Новик. – У меня была пациентка, которая заболела раком яичника. Её внучке было три года. И женщина поставила себе цель: хочу выдать любимую внучку замуж, увидеть, как начинается её семейная жизнь». Несмотря на страшный диагноз, бабушка прожила ещё 18 лет. И успела поздравить внучку со счастливым браком.
«Если больной НЕ хочет жить, то медицина бессильна, – говорит кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Алексей Викторович Новик. – У меня была пациентка, которая заболела раком яичника. Её внучке было три года. И женщина поставила себе цель: хочу выдать любимую внучку замуж, увидеть, как начинается её семейная жизнь». Несмотря на страшный диагноз, бабушка прожила ещё 18 лет. И успела поздравить внучку со счастливым браком.
Другой случай из практики врачей НИИ онкологии им. Н. Н. Петрова. На сей раз печальный. Молодую женщину спасти не удалось. А всё началось с того, что во время медового месяца её муж случайно задел наручными часами родинку у неё на спине. На месте содранной родинки началось кровотечение. Несомненно, кровотечение остановили. Но вскоре развилась агрессивная форма меланомы. Далее было всё очень банально – пациентку бросил муж, ставший невольным виновником заболевания. Это подкосило женщину ещё больше. Не помогли ни поддержка родителей, ни усилия врачей. Красивая и очень молодая женщина с онкологическим диагнозом твёрдо решила, что жить ей незачем.
Пациент не должен оставаться один – это одно из главных условий выздоровления. Когда человек небезразличен своим близким, то и лечение идёт намного эффективнее. Другой вопрос, что одиночество и брошенность каждый понимает по-своему. Есть люди, для которых при расставании с супругом или возлюбленным перестают существовать и друзья, и родные, и смысл жизни. А кто-то считает, что у меня есть три кошки и я буду жить ради них. «Выздороветь ради счастливой будущей жизни вас и очень важных для вас близких людей», – напутствует своих пациентов доктор Ирина Александровна Балдуева.
На стенах кабинета Ирины Александровны Балдуевой – прекрасные картины. Многие из них создал её пациент – художник, капитан 2-го ранга в отставке. Несмотря на ампутированную руку, Борис Матвеевич пишет новые пейзажи, руководит Фондом культуры и учит рисованию маленьких детей из неполных семей. Денег за уроки он не берёт.
www.aif.ru
«Вакцина» против рака вылечила 97 % опухолей у мышей. Что это значит для человека?
Ученые разработали новую противораковую «вакцину», которая вылечила 97 процентов опухолей у мышей, и в скором времени планируют протестировать ее на людях. Однако эксперты говорят, что мы все еще очень далеки от разработки лекарства, которое можно будет назначать онкобольным людям.
Новое исследование
К концу этого года исследователи из Стэнфордского университета планируют исследовать новую терапию на 35 пациентах с лимфомой, согласно SFGate, новостному порталу в Сан-Франциско. «Вакцина» работает как стимулятор иммунной системы организма, заставляя ее бороться с раковыми клетками. В ходе исследования, которое проводилось на мышах с различными раковыми заболеваниями, в том числе лимфомой, раком груди и толстой кишки, «вакцина» устраняла опухоли у 87 мышей из 90, даже когда метастазы распространялись на другие органы.

Доктор Алиса Полис, региональный директор хирургии груди в Northwell Health Cancer Institute в Вестчестере (штат Нью-Йорк), которая не участвовала в исследовании, назвала новость об испытании на людях этого лечения «захватывающей». Однако она предупредила, что результаты исследований на животных не всегда срабатывают для людей.
"В течение многих лет ученым удавалось вылечить раковые образования у многих мышей", - рассказала доктор Полис. Более того, испытание нового лечения планируют проводить на пациентах с лимфомой, поэтому может пройти много лет, прежде чем врачи узнают, работает ли это и для других видов рака, таких как рак груди или толстой кишки.

Противораковая «вакцина»?
Технически новое лекарство не является вакциной, так как этот термин используется для веществ, способствующих выработке долговременного иммунитета против болезни. Однако в SFGate сообщается, что эта терапия действительно связана с вакциноподобной инъекцией. По данным Американского общества клинической онкологии, термин «противораковая вакцина» может относиться к лечению, способному предотвратить развитие рака и уничтожить раковые клетки, которые уже есть в организме.
На самом деле новое лечение - это один из видов иммунотерапии. Оно состоит из двух агентов, задача которых - стимулировать Т-клетки (иммунные клетки) для борьбы с раком. Как правило, на первых стадиях болезни Т-клетки распознают раковые клетки как аномальные, и начинают их атаковать. Но чем больше вырастает опухоль, тем ниже активность Т-клеток, поэтому они больше не могут сдерживать рак.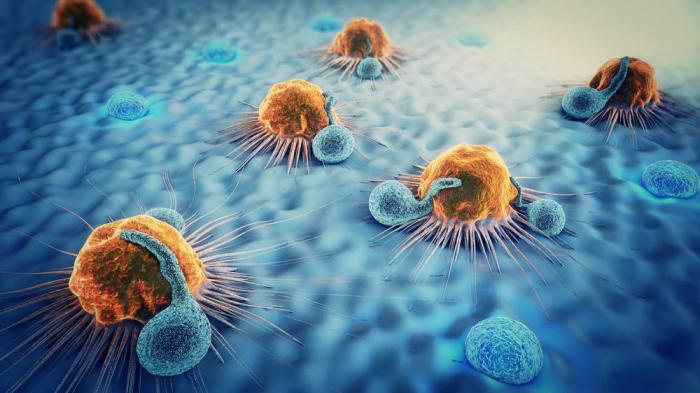
Реактивация клеток иммунной системы
Новое лекарство способствует реактивации Т-клеток, когда «вакцину» вводят непосредственно в опухоль. Исследователи объясняют, что, так как Т-клетки уже находятся внутри опухолей, они предварительно подвергаются скринингу, чтобы распознать специфичные для рака белки.
В ходе исследований на животных введение препарата в одну опухоль приводило к устранению метастаз в других частях тела. Подобное действие объясняется тем, что реактивированные Т-клетки начинают мигрировать в другие части тела и разрушать опухоли, которые там появляются.
В ходе исследования, результаты которого были опубликованы 31 января в журнале Science Translational Medicine, ученые испытывали лечение на мышах, которых предварительно модифицировали на генетическом уровне, чтобы у них развился рак молочной железы. Препарат вводили в первую опухоль, которая появлялась у животного, и во многих случаях он предотвращал появление новых опухолей.
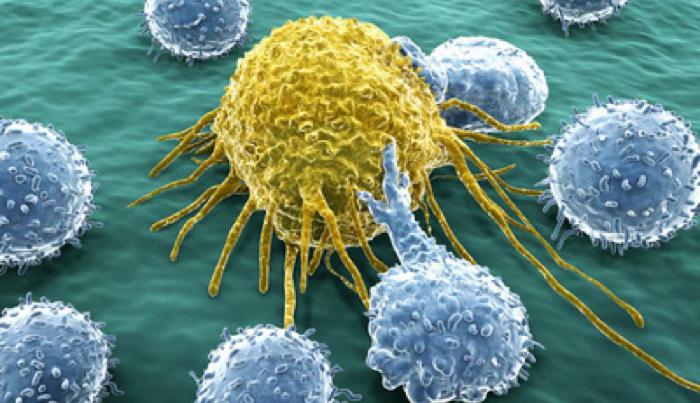
Перспективы иммунотерапии
Иммунотерапию нельзя назвать новым видом лечения рака. Раньше несколько других ее типов были одобрены для лечения онкологии. К примеру, недавно одобренная для лейкемии и лимфомы терапия Т-клетками под названием CAR включает изъятие некоторых типов иммунных клеток из тела пациента и их изменение на генетическом уровне для борьбы с раком.
Ученые говорят, что если сравнивать с терапией Т-клетками CAR, у нового лечения есть преимущества, прежде всего в том, что врачам не нужно удалять и настраивать иммунные клетки пациента для борьбы с раком. «"Вакцина" атакует конкретные цели, и ученым не приходится точно настраивать, какие белки должны распознавать Т-клетки», говорит доктор Рональд Леви, профессор онкологии в Школе медицины Стэнфордского университета и старший автор исследования в области трансляционной медицины.

Также интересно, что эта «вакцина» может работать и в случае с раком толстой кишки и молочной железы, так как в настоящее время для этих двух видов рака не существует иммунотерапии.
«Мы еще на шаг приблизились к разработке иммунотерапии для этих видов рака, - сообщила доктор Полис. - Но нам предстоит еще долгий путь».
Новое испытание на людях является только первой фазой исследования, а это значит, что ученые будут проверять безопасность лечения, а не его эффективность.
fb.ru
Иммунотерапия и вакцина против рака
Защитная система (иммунная система) расходует большую часть своей силы на разделение здоровых клеток и «чужих» клеток. Для того, чтобы это было возможным, иммунная система использует контрольные точки на клеточном уровне. Для активации защитной системы необходимо, чтобы молекулы, оказывающие влияние на контрольные точки, были в активной или пассивной позиции. Лекарства, которые призваны активизировать защитную систему и сумели открыть новую эру в лечении рака после 2012 года, называются иммунотерапией.
Целью иммунотерапии в лечении онкологических заболеваний служит стимулировать иммунную систему для сражения с раком, укрепление и восстановление иммунной системы. Иммунотерапевтические препараты, несмотря на то, что являются сравнительно новыми, путем активизации иммунной системы, опираются на довольно старые теории лечения рака, и на самом деле иммунотерапия – это первый нехирургический метод лечения рака, который был открыт еще до появления химиотерапии и радиотерапии.
В ходе работ, которые проводятся в области лечения онкологических заболеваний уже на протяжении примерно 100 лет, ученые сконцентрировались на изучении методов, способных напрямую убивать раковые клетки. Считалось, что один из самых важных механизмов собственной защиты организма - иммунная система (защитная система) – обладает недостаточной силой, и полагали, что недостаточность иммунной системы провоцирует укрепление раковых клеток.
Два конца нашей иммунной системы, которая есть в нашем организме, подобны острому лезвию ножа. При чрезмерной и бесконтрольной работе возникают различные заболевания, которые развиваются, разрушая различные органы – данный феномен мы можем назвать избыточной активностью иммунной системы. При недостаточной работе иммунной системы мы становимся подвержены различным инфекциям, также могут возникать такие негативные проявления, как склонность к развитию рака.

126 лет назад нью-йоркский хирург Вильям Коли обнаружил, что тяжело больной пациент с онкологическим заболеванием на продвинутой стадии заразился инфекций, после чего последовала высокая температура, а затем вдруг рак стал регрессировать. Он предположил, что бактериальная инфекция, которой заразился больной, каким-то образом сыграла роль в уменьшении раковой опухоли, после чего он искусственным образом ввел живую бактерию другому больному. Это испытание привело к успеху, и больной прожил еще 26 лет, умерев не из-за онкологического заболевания. Коли подумал, что он близок на пути к открытию. Он продолжал проводить исследования и использовать бактерии. Коли и другие доктора, работавшие в той же области, вылечили более 1000 больных таким методом. Токсины Коли, при которых вызывается острая инфекция с повышением температуры для лечения рака, получили название прививки от рака на основе смешенных бактерий. Коли добился успеха при первом опыте, но последующие испытания не всегда заканчивались также благополучно.
Никто не знал, почему токсины Коли, то есть - почему острая инфекция, которая сопровождается температурой, помогали в борьбе против рака и почему они иногда не помогали. Даже и сам Коли не мог дать этому никаких объяснений. Затем стало ясно, что токсины Коли образуют острую инфекцию с повышением температуры, активируя тем самым иммунную систему и запуская различные механизмы в организме человека. Так и в современной иммунотерапии развиваются похожие, но различные механизмы. В 1900 годах была разработана радиотерапия, затем химиотерапия, и интерес к токсинам Коли оставил в тени ранее открытые методы. До тех пор, пока в 1990-х годах не возник профессор Джеймс Эллисон, питавший надежду разработать лекарство, задействующее иммунную систему в борьбе против рака. Внимание Эллисона привлекла специальная биологическая молекула, которая называется CTLA-4. В работе, которую провел Эллисон и его коллеги, удалось доказать, что данная молекула, расположенная на самых важных клетках иммунной системы, именуемых Т-клетками, тормозит активность клеток Т (ингибирует их действие), и препятствует иммунной системе распознавать рак. Было известно, что Т клетки играют критическую, ключевую роль в регулировании агрессии (способности нападения) иммунной системы. Он заинтересовался тем, поможет ли устранение такого препятствия в лечении онкологического заболевания, и приступил к испытаниям над крысами, больными раком. В статье, опубликованной в 1996 году, Джим Эллисон, Макси Краммел и Дана Лич продемонстрировали, что у крыс, у которых активация молекулы CTLA-4 предотвращалась посредством специального антитела, рост опухоли удалось остановить.
Это исследование стало источником воодушевления для разработки лекарств, открывающих новую эпоху в лечении онкологии, которые известны как регуляторы контрольной точки иммунной системы (checkpoint regulators). После такого прогресса «Ипилимумаб» (на рынке известен под названием «Ервой»), представляющее собой антитело, предотвращающее действие молекулы CTLA-4, продемонстрировало положительный эффект для больных злокачественной меланомой – видом рака, который считается в высшей степени агрессивным видом рака кожи продвинутой (4) стадии, и помогло спасти жизнь тысячам пациентов.

После такого важного поворота развития ученые начали поиск других способов, способных активировать иммунную систему через контрольные точки, и проводить испытания с молекулами на различных видах рака. Исследования, которые проводились в начале 2000 годов, показали, что рак, для того, чтобы скрыться от иммунной системы, использует, помимо CTLA-4, также поверхностные молекулы клетки под названием PD-1 и PD-L1. Молекула PD-1 находится только на поверхности клеток иммунной системы, и при прикреплении к собственным стимулирующим молекулам (ligand) клетки иммунной системы косвенно влияют на ослабление иммунной системы, приводя ее в пассивный вид. Сегодня используетсят 2 иммунотерапевтических препарата, которые препятствуют соединение PD-1 к собственным стимулирующим молекулам: «Ниволумаб» (продается на рынке под названием «Опдиво») и «Пембролизумаб» (продается на рынке под названием «Кейтруда»). Молекула PD-L1 – это симулирующая молекула протеиновой структуры, которая расположена одновременно и на поверхности клеток иммунной системы, и на поверхности раковых клеток, и при соединении к рецептору PD-1 (приемник) приводит клетки иммунной системы в пассивное состояние. Было установлено, что опухоли, у которых имеется большое количество молекул PD-L1 на поверхности клеток – их принято называть опухоли с позитивным PD-L1 – имеют более агрессивную структуру, при этом иммунотерапевтические препараты являются более эффективными в борьбе именно с такими видами рака. Единственным лекарственным препаратом, препятствующим соединение молекулы PD-L1 к PD-1, и получившим разрешение на использование в настоящее время, является «Атезолизумаб» (продается на рынке под названием «Тецентрик»).

Масштабы использования иммунотерапевтических препаратов в лечении онкологических заболеваний растут с каждым днем. Иммунотерапевтические оекарства, являющиеся регуляторами контрольных точек иммунной системы, получили разрешение на применение при следующих видах рака (по порядку):
- Злокачественная меланома – рак кожи(«Ипилимумаб» 2011, «Ниволумаб» и «Пембролизумаб» 2014)
- Рак легких, («Ниволумаб» и «Пембролизумаб» 2015)
- Рак почек (ренальные клетки) , («Ниволумаб» 2015)
- Лимфома Ходжкина, («Ниволумаб» 2016)
- Рак мочевого пузыря (уротелиальные виды рака), («Атезолизумаб» 2016)
- Рак головы и шеи («Пембролизумаб» 2016)
При слове «вакцина» большинству из нас приходят на умпрививки, которые используются для защиты здоровья человека от различных инфекционных заболеваний. На сегодняшний день вакцины от краснухи, ветрянки, столбняка, гриппа и гепатита спасли жизнь миллионам людей. В этих прививках используются ослабленные или убитые вирусы (некоторые бактерии) для того, чтобы активировать иммунную систему. Таким образом, организм приобретает иммунитет против вредных микроорганизмов, не сталкиваясь с ними. Многие вакцины против рака работают подобным образом, они учат иммунную систему человека реагировать и нападать на раковые клетки. Вакцины против рака принято делить на две группы: защитные и лечебные. Ниже будут подробно рассмотрены обе эти группы вакцин. В нашей статье мы расскажем о двух лечебных вакцинах, получивших международное признание и разрешение от Американского агентства по контролю за пищевыми продуктами и лекарственными препаратами (FDA).
Вакцина против рака предстательной железы Sipuleucel-T (Provenge)
Несмотря на то, что при раке предстательной железы, распространившемся по организму, за счет гормоно подавляющей терапии (тестостерон) обеспечивается контроль в течение долгих лет, все же у больных наблюдается возобновление заболевания в результате увеличения уровня ПСА или развития новых очагов заболевания. Такие случаи мы можем назвать «рак предстательной железы с устойчивостью к гормонам». Иммунотерапевтическое лечение рака предстательной железы призвано подключаться в данную группу больных. Spiluecel-T (Provenge) – это первая разработанная вакцина против рака. Spileucel-T – это вакцина, разработанная в результате пятнадцатилетних исследований, получившая утверждение от Американского агентства по контролю за пищевыми продуктами и лекарственными препаратами (FDA). Данная вакцина, разработанная против рака предстательной железы, внесла положительный вклад в общую выживаемость в 4 месяца в ходе проведенных исследований, и в 2010 году получила разрешение от Американского агентства по контролю за пищевыми продуктами и лекарственными препаратами (FDA).
Каким образом вводится вакцина Sipuleucel-T?
Вакцина создается индивидуально для каждого человека. Сначала забирается кровь из организма пациента, далее посредством специальных аппаратов из крови выделяются белые кровяные тельца (сражающиеся клетки нашей иммунной системы), оставшуюся кровь вводят пациенту обратно (процедура лейкафереза). Белые кровяные тельца, называемые отделенными дентритными клетками, в лабораторной среде начинают стимулироваться посредством специфического антигена простаты – белка рака предстательной железы (РАР) и факторов роста иммунных клеток (GM-CSF). Можно использовать после подготовки, спустя три дня. Вакцина вводится с перерывом в две недели, всего три раза.
Кому подходит лечение посредством вакцин?
Лечение вакциной подходит больным раком предстательной железы на продвинутой стадии, с распространением в организме, с устойчивостью к гормональному лечению. Несмотря на то, что в ходе проведенных исследований наблюдалось преимущество с точки зрения выживаемости, все же нельзя говорить о том, что в данном случае вакцина является панацеей. После лечения может не наблюдаться снижения уровня специфического антигена простаты (ПСА).
Вакцина против злокачественного меланомного рака кожи Talimogene Laherparepvec (IMLYGIC)
В этой вакцине используются генетические модифицированные вирусы, на получила утверждение от Американского агентства по контролю за пищевыми продуктами и лекарственными препаратами (FDA) 25 октября 2015 года. Вакцина разрешается к использованию в местном (локальном) лечении повреждений ткани при меланоме, распространившейся в лимфатическом узле, под кожей или на коже, которую невозможно удалить во время операции и которая возобновилась после проведения первого хирургического вмешательства. В вакцинах использованы генетически модифицированные вирусы (ниже представлена подробная информация об онколитических вирусных вакцинах). Вакцина против меланомы под названием Talimogene laherparepvec вводится непосредственно меланомную внутрь опухоли, которая возобновилась и которую невозможно удалить хирургическим способом. В исследовании данной вакцины, получившей утверждение от Американского агентства по контролю за пищевыми продуктами и лекарственными препаратами (FDA), приняло участие 436 больных меланомой. Одной группе этих больных вводилась вакцина Imlygic, другой группе был применен колоно-стимулирующий фактор granulocyte-macrophage (GM-CSF). В результате у 16% тех, кому применялась вакцина Imlygic, наблюдалось значительное уменьшение в повреждении кожи и лимфатического узла, при этом тех же результатов у другой группы (GM-CSF) удалось достичь лишь в объеме 2%. Вместе с тем, при talimogene laherparepvec не удалось добиться увеличения выживаемости или значительной регрессии при меланоме, распространенной в мозг, кости, печень, легкие или в другие органы.
Дальнейшая информация для тех, кто интересуется наукой: все разновидности иммунотерапии, которая используется при онкологических заболеваниях, и другие прививки от рака
1. Активаторы иммунной системы, не свойственные заболеванию
Первым вдохновением для современной иммунотерапии явились токсины Коли, и ученые нацелились на увеличение ответной реакции иммунной системы на различные виды патогенов и рака. В результате такого рода практик была получена ответная реакция со стороны иммунной системы, не присущая заболеванию (неспецифическая), которое необходимо было вылечить. Такие неспецифические иммунотерапии до сих пор помогают нам в лечении некоторых видов рака.
Вакцина BCG
Первым иммунотерапевтическим лекарством стало BCG (Bacillus Calmette-Guerin) – ослабленная форма бактерии, которая приводит к возникновению туберкулеза (БЦЖ). На протяжении 20 лет вакцина БЦЖ использовалась в качестве вакцины против туберкулеза. К 1990 году после десятилетних испытаний данной вакцины при многих видах рака было получено разрешение на использованием только при раке мочевого пузыря, и в настоящее время это является основным лечением данного вида рака.
Цитокины
Цитокины представляют собой молекулы, которые используются при взаимодействии клеток иммунной системы между собой. Они используются в качестве иммунотерапевтических препаратов (неспецифических), не свойственных заболеванию. Они играют роль в распознавании опухоли со стороны иммунной системы. Наиболее известные факторы нейкроза опухоли -(TNFα) и İnterferon alfa (IFNα),- способствуя остановке роста и самоуничтожению клеток, напрямую воздействуют на раковые клетки. İnterLökin-2 (IL-2) и GM-CSF активизируют природные уничтожающие клетки иммунной системы (природный убийца = NK), клетки T и дентрические клетки. Среди этих молекул, IL-2 используется при злокачественной меланоме и при раке почек. INFα используется при меланоме, хронической миелоцитозной меланоме, при волосатоклеточном лейкозе, при фолликулярной лимфоне не-Ходжкина, и при саркоме Капоши.
Адъюванты
Адъюванты также являются неспецифическими иммунными стимуляторами, и часто используются вместе с вакцинами для того, чтобы создать более мощную ответную реакцию иммунной системы. Часто используемые адъюванты являются продуктами бактерий молекул и агонистами TLR (Toll-like receptor). Кроме того, GM-CSF, стимулирующий дентрические клетки, являющийся одним из важных элементов иммунной системы, часто используется в качестве адъюванта вакцины от рака.2. Иммунотерапия с помощью антител
Иммунотерапевтические препараты, о которых уже упоминалось выше, как правило, стимулируют клетки иммунной системы, не нацеливаясь при этом на определенный антиген (специфическая молекула белка). В этом разделе мы рассмотрим иммунотерапевтические препараты, которые называются «специфической иммунотерапией» за то, что они нацеливаются именно на определенный антиген.
Моноклональные антитела
Антитела представляют собой белки, которые производятся иммунной системой, задачей которых является наша защита от патогенных и раковых клеток. Начиная с 1970-х годов эти очищенные молекулы высокой избирательности, способные образовываться в лабораторной среде, принято называть «моноклональными антителами». Область применения моноклональных антител довольно широка.
- Антитела могут соединить сигнальные молекулы, которые используют раковые клетки для роста и размножения
- Прикрепляясь к раковым клеткам, позволяет иммунной системе их распознавать и выступать средством их уничтожения
- Могут активировать дополнения, которые приводят к взрыву опухолевых клеток
www.oncotrust.ru
Вакцины против рака: перспективы - Онкология

При упоминании слова «вакцина» большинство людей сразу думает о кори, ветряной оспе или гриппе. В этих вакцинах для вызова иммунного ответа организма используются ослабленные, убитые микроорганизмы или типичные для них молекулы. После попадания вакцины в организм иммунная система учится реагировать на подобный «раздражитель» в режиме тренировки, запоминает патоген и при столкновении с реальной инфекцией быстро побеждает. Часть противораковых вакцин работает по похожему принципу, только бороться приходится уже со своими клетками.
Ученые давно разрабатывают вакцины, которые могли бы предупредить либо вылечить рак. Одни из первых опытов принадлежали Уильяму Коли с его «токсинами».
Иммунотерапия рака — лечение опухолей с помощью антител — одно из самых перспективных направлений в терапии рака, сложившееся несколько десятков лет назад. Но первые опыты задействования иммунитета в борьбе с раком гораздо старше. «МедНовости» проследили историю иммунотерапии от Средневековья до разработки современных препаратов. Продолжение следует.
Другие пытались вызвать ответ иммунной системы на опухоли, используя БЦЖ — бациллу Кальметта-Герена (Bacille Calmette-Guérin, BCG) для профилактики туберкулеза. Это живая аттенюированная вакцина с богатым составом, и было бы удивительно, если бы она не оказывала сильного воздействия на иммунную систему в целом. Однако с 1935 года большинство попыток лечения ею рака показали неутешительный результат. Несмотря на это, при обработке данных всех опубликованных докладов, стало ясно, что, если БЦЖ вводили в самом раннем возрасте или вакцинация обеспечивала мощную защиту от туберкулеза, — то вакцина предотвращала лейкемию .
Сотрудники Калифорнийского университета в Сан-Франциско сообщили, что вакцина против гемофильной инфекции типа В, защищающая от бактериального менингита, снижает риск развития самого распространенного у детей типа рака крови — острого лимфобластного лейкоза.
Профилактические вакцины от рака
Небольшая часть онкологий вызвана вирусами. Поэтому вакцины, защищающие от этих вирусов, могут использоваться и как противораковые. Они нацелены не на раковые клетки, а именно на инфекцию.

Вирус папилломы человека. Фото: Shutterstock.
С 1970-х годов стало ясно, что вирус папилломы человека (ВПЧ, или HPV) может привести к малигнизации клеток. Этой проблемой занимался Харальд цур Хаузен (Harald zur Hausen) и его коллеги. В 2001 году в интервью он заявил. что перспективы вакцин против рака многообещающие: «Сейчас по всему миру 10 миллионов случаев рака в год. В будущем должна появиться возможность предотвратить 1,25 млн из них с помощью вакцинации».
ВПЧ — самая распространенная вирусная инфекция половых путей. Всего известно более 100 типов этого вируса, и как минимум 13 из них могут привести к онкологии. Его связывают с раком шейки матки, ануса, влагалища, пениса и некоторыми другими. Сейчас есть две одобренных профилактических вакцины против нескольких типов ВПЧ: Гардасил (одобрена FDA в 2006 году) и Церварикс (одобрен в 2009 году). Обе включают в себя вирусоподобную частицу рекомбинантного белка капсида L1. Совещательный комитет по иммунизационной практике США (The Advisory Committee on Immunization Practices of the US CDC) рекомендует рутинные прививки девочкам и мальчикам в 11-12 лет, но можно привить ребенка с 9 лет. Те, кто не был привит в раннем возрасте, могут привиться и позже.
К сожалению, противораковые прививки от ВПЧ единственные в своем роде. Например, у пациентов с хроническим вирусом гепатита В (ВГВ, или HBV) повышается риск рака печени. Но вакцины против ВГВ пока не разработано .
Помимо этого, большинство видов онкозаболеваний не вызвано вирусами. Врачи пока не уверены, можно ли и для них создать превентивные вакцины. Некоторые разработки уже есть, но они находятся на ранних стадиях, и о результатах говорить пока рано. Кроме того, как считается, даже при успехе до внедрения в рутинную клиническую практику пройдет много времени.
Вакцины, борющиеся с раком
Цель вакцин от рака отличается и от обычных, и от профилактических противоопухолевых, борющихся с вирусами. Прививка такой смеси должна показать иммунной системе, как побороть уже существующую болезнь. К сожалению, подавляющее большинство таких разработок находится на различных стадиях клинических испытаний и еще не применяется широко. Из-за этого вылечивание рака простой прививкой все еще остается делом будущего.
Исследователи используют несколько стратегий действия вакцины.
Первая опция — это вакцины с раковыми клетками. Клетки опухоли, удаленной во время операции, изменяют в лабораторных условиях и вводят пациенту. Иммунные клетки реагируют не только на вколотую вакцину с убитыми раковыми клетками, но и на похожие — то есть, на раковые клетки, оставшиеся в организме. Если вакцина вводится тому же пациенту, у которого вырезали опухоль, ее называют «аутологичной». Если же «донор» и реципиент раковых клеток — разные люди, то это аллогенная вакцина.
Исследователи из университета Томаса Джефферсона (Thomas Jefferson University) в 2014 году проводили клинические испытания подобной вакцины на 12 пациентах с рецидивирующей глиобластомой. Раковые клетки участников обрабатывали в лаборатории препаратом AS-ODN, который выключает рецептор IGF-R1. Было показано, что этот рецептор стимулирует рост и метастазирование опухоли, а его блокировка может привести к ее самоуничтожению. У половины пациентов был выявлен иммунный ответ на вакцину. Ученые объясняют это тем, что у остальных иммунитет мог быть ослаблен предшествующей химиотерапией. Следующий этап клинических испытаний проводится в 2015 году.
Второй тип — это вакцины с антигенами. Для стимуляции иммунной системы в них используются не целые раковые клетки, а один или несколько антигенов, белков либо пептидов. Эти вакцины делают не для конкретного пациента, а против определенного типа рака.
О процессе разработки терапевтической вакцины от меланомы (рака кожи) и результатах ее испытания «МедНовостям» рассказал профессор, доктор наук, заведующий лабораторией генетических основ клеточных технологий Института общей генетики РАН Сергей Киселев.
В Америке же в 2014 году проводили исследования по безопасности вакцины против рака груди. Разработка ученых из школы медицины университета Вашингтона (Washington University School of Medicine) «натаскивает» белые клетки крови на маммаглобин-А. Этот белок экспрессируется практически исключительно в молочной железе, и в 40-80% опухолей его уровень аномально высок. У половины из 14 женщин с метастатическим раком молочной железы и высокой концентрацией маммаглобина-А рак не прогрессировал в течение года после вакцинирования (в контрольной группе таких исходов было значимо меньше). Побочные эффекты были незначительными. Исследования планируется продолжить.

Уильям Гилландерс, Университет Томаса Джефферсона. Фото: Robert Boston / Washington University School of Medicine
Одна из стратегий — генные вакцины. Их нельзя отнести к отдельному типу, но для их создания нужны векторы — нуклеотидные последовательности, которые вставляют в чужой геном. Таким образом, используя собственный ферментный аппарат клетки-мишени, ученые заставляют ее производить нужный белок. Для этого часто используют фрагменты ДНК вирусов, бактерий, дрожжевых клеток. Использование таких вакцин позволяет не только заставить клетку производить дополнительные опухолевые антигены, но и вызвать усиление иммунного ответа, поскольку генный материал взят от, например, бактерии. Вдобавок, их производство проще и дешевле.
Уже было проведено клиническое исследование II фазы Prostvac-V/F в конце 2014 года для пациентов с раком простаты, устойчивым к гормональной терапии. Prostvac-V основан на вирусе коровьей оспы и модифицирован так, чтобы производить ПСА (простатспецифический антиген) и три других белка, заметных для иммунной системы (триада костимулирующих молекул — TRICOM). Prostvac-F же делают из вируса оспы кур. Он содержит тот же генетический материал, но вводится несколько раз.
Наконец, самые успешные, пожалуй, — это вакцины с использованием дендритных клеток. Эти клетки помогают иммунной системе «увидеть» опухоль. Они разрушают раковые клетки и выставляют на своей поверхности их «кусочки». Т-клетки распознают антигены и начинают иммунную реакцию против содержащих их клеток.

Дентритная клетка. Фото: National Institutes of Health / Wikimedia
Sipuleucel-Т (Provenge) для лечения рака предстательной железы единственная получила одобрение FDA. Она используется для тех пациентов, кому не помогает гормональная терапия.
Принцип ее действия таков: клетки иммунной системы выделяют из крови пациента и преобразовывают их в дендритные клетки, обрабатывая их специальной смесью молекул. Кроме того, новоявленным дендритным клеткам предъявляют простатическую кислую фосфатазу (РАР). Затем их несколько раз внутривенно вводят обратно пациенту, чем и вызывают ответ организма на опухоль. Несмотря на то, что вакцина не лечит рак простаты, она продлевает пациенту жизнь в среднем на несколько месяцев.
Активно исследуются и другие вакцины с дендритными клетками. Nature Reviews Cancer пишут, что в этом году Митчелл, Батич (Mitchell, Batich) и коллеги показали, что ответ на вакцину у больных с глиобластомой может быть усилен за счет пре-кондиционирования с Td анатоксином (столбняк/дифтерия — tetanus/diphtheria), антигеном, вызывающим сильную реакцию организма.
Перспективы
С совершенствованием научной техники и накоплением знаний оказалось, что иммунная система гораздо сложнее, чем предполагалось, и раковые клетки «хитрее» в маскировке. Но, несмотря на это, появляется все больше удачных разработок вакцин от рака. Все большее предпочтение отдается персонализированным вакцинам — нацеленным на мутации конкретного пациента. Так, недавно американские ученые сообщали об успешных клинических испытаниях вакцины против меланомы.
Проведены первые клинические испытания персонализированных вакцин против меланомы. Сделанные с учетом индивидуальных мутаций пациентов вакцины вызвали сильный ответ иммунной системы.
Прогресс не стоит на месте. Например, ученые создали трехмерную самособирающуюся конструкцию для «обучения» иммунных клеток. В опыте на мышах в поры конструкции загрузили опухолевые белки, которые надо было предьявить иммунной системе, и потом получили мощный ответ организма.
Сами ученые возлагают на вакцины большие надежды. «В последние годы исследователи и общественность начали осознавать роль, которую иммунная система играет в профилактике и лечении рака», — говорит Крейг Хупер (Craig Hooper), профессор Департамента биологии рака Университета Томаса Джефферсона (Thomas Jefferson University). Эстебан Селис (Esteban Celis), профессор иммунологической программы центра Моффитта (Moffitt's Immunology Program), считает. что такие вакцины — хорошая альтернатива традиционным методам лечения, приводящим к серьезным побочным эффектам и часто бесполезным на поздних стадиях болезни.
В 2013 году вакцины от рака возглавили десятку научных прорывов.
Иммунотерапия онкологических заболеваний возглавила рейтинг наиболее значительных научных достижений 2013 года, составленный журналом Science и опубликованный в его номере от 20 декабря. В топ-10 также вошли еще семь открытий в области медицины, генетики и биологии.
Читайте также:
therapycancer.ru
Вакцина от рака
Рак — тяжелое заболевание, которое во многих случаях приводит к летальному исходу, вакцина от рака может помочь справиться с заболеванием. В настоящее время ученые всего мира пытаются найти лекарство от этого недуга.

Какие бывают прививки от рака
Вся сложность и опасность этой болезни в том, что иммунитет человека не распознает раковые клетки, не принимает их за угрозу для себя и не уничтожает их. А еще у них имеется собственная защита, которая отталкивает человеческие Т-клетки, не позволяя им убить себя. Помочь организму справиться с заболеванием могут прививки. Они бывают:
- профилактические;
- терапевтические.
Профилактические прививки
Профилактические прививки делают с целью предотвращения болезни. К примеру, рак шейки матки возникает из-за наличия у женщины определенного типа вируса папилломы человека (ВПЧ). И вакцинирование делается именно против этого вируса. Сегодня есть две профилактические вакцины от рака шейки матки, которые испытывались многочисленными проверками и были одобрены международной ассоциацией врачей. Это Гардасил и Церварикс. Эти прививки можно делать с 9 до 25-26 лет. Следует отметить, что от уже имеющегося вируса прививка не спасает.
«Более эффективной вакцинация будет до того, как организм уже инфицирован ВПЧ. При наличии вируса папилломы человека тоже можно прививаться, но прививка тогда не будет полностью защищать от болезни, поэтому важно делать её до начала половой жизни.» Ирина Антонович, эпидемиолог центра гигиены и эпидемиологии.

Но в основной своей массе рак не вызывается вирусами, поэтому данные прививки являются единственными в своем роде. Профилактические вакцины против других видов рака находятся в стадии разработок, исследований и испытаний их эффективности.
Терапевтические прививки
Терапевтические вакцины призваны помочь организму справиться с уже существующим раковым заболеванием. Опять же, почти все они пока только разрабатываются, и до применения их в широких массах пройдет немало времени.
Прививки делятся по способу борьбы с раковыми клетками.
- Вакцины с убитыми раковыми клетками. Пациенту вводится лекарство с убитыми раковыми клетками. Иммунитет реагирует на них и учится справляться с подобными клетками, которые есть в организме. Если вводятся свои же раковые клетки, то вакцина называется аутологичной. Если от другого пациента — то это аллогенная вакцина.
- Вакцины с антигенами. При их использовании берется не вся раковая клетка, а только ее часть — антигены, белки, пептиды либо их комбинации. Такие вакцины создаются не для какого-то пациента, а от конкретного вида заболевания.
- Генные вакцины. С их помощью в организме усиливается выработка дополнительных антиопухолевых антигенов и усиливается общий иммунный ответ на болезнь.
- Вакцины с дендритными клетками. Такие прививки являются самыми успешными по своим результатам. Дендритные клетки помогают организму распознать опухоль и начать с ней бороться. Дендриты убивают раковые клетки и оставляют их кусочки у себя на поверхности. Т-клетки, которые отвечают за противодействие новообразованиям в организме человека, распознают антигены этих кусочков. Иммунитет начинает работать против клеток, в которых содержится подобный антиген.
Перспективы
Через некоторое время вакцина от рака станет хорошей альтернативой существующим методам лечения этого заболевания, которые часто оказываются малоэффективными, а на последних стадиях и бесполезными. Все больше внимания уделяется вакцинам персонализированным, то есть для конкретного больного.

Сегодня уже внедрены в практику прививки от рака простаты, она называется sipuleucel-T. Скоро в лечении будут использоваться вакцины от рака груди, меланомы, глиобластомы и других.
«Альтернативы для иммунотерапии рака нет. Все остальные способы только задерживают течение болезни, а полное излечение возможно только с помощью иммунной системы.» В. Козлов, академик, руководитель научно-исследовательского института клинической иммунологии.
privivkainfo.ru
Ученым удалось создать вакцину против рака
В ходе двух небольших исследований ученые продемонстрировали эффективность противораковой вакцины, которая помогает пациентам бороться с болезнью, используя их иммунную систему, которая начинает атаковать раковые клетки.
Экспериментальная вакцина
В обоих исследованиях ученые использовали экспериментальную противораковую вакцину для лечения пациентов, у которых развилась смертельная форма меланомы (рака кожи). Оба исследования показали полное исчезновение опухоли у большей части пациентов после того, как им дали противораковую вакцину. Для пациентов второй группы использовался другой тип лечения, который обеспечивает улучшение способности иммунной системы бороться с раком. У некоторых пациентов этой группы опухоли также полностью исчезли.
Сейчас исследователи заняты разработкой аналогичных вакцин против таких видов рака, как глиобластома (один из типов рака мозга), рак почек, клеток крови и яичников. Об этом рассказывает доктор Кэтрин Ву, которая является ученым Института рака Dana-Farber в Бостоне. Она возглавляла одно из исследований. «Многие пациенты, страдающие от других видов рака, могут получить выгоду от вакцинации», — сказала Ву. 
Активация защитных клеток
Любое лечение рака должно быть нацелено на раковые клетки и щадить здоровые. В данном подходе ученые хотят получить вакцины, способные переносить молекулы, которые влияют только на раковые клетки. Подобные вакцины смогут помочь иммунной системе «видеть» в раковых клетках угрозу, побуждая ее привлекать защитные клетки (в том числе и Т-лимфоциты) для избавления от рака.
Использование аномальных белков
Для борьбы с меланомой отдельные исследовательские группы работали с двумя разными типами вакцин. Результаты тестов они опубликовали 5 июля в журнале Nature.
Меланома часто сопровождается мутациями, вызванными воздействием на кожу ультрафиолетовых лучей. Эти мутации часто приводят к появлению аномальных белков — неоантигенов, которых больше нет в теле человека. Врачи считают, что они могут оказаться полезными мишенями для вакцины. Об этом заявил доктор Корнелиус Мелиф из Лейденского университета в Нидерландах, который не принимал участия в исследованиях.
Особенности первого исследования
В ходе первого исследования Ву и ее коллеги провели вакцинацию шести пациентов, которые ранее перенесли операцию по удалению опухоли. Используемая вакцина персонализировалась учеными для каждого отдельного пациента: они провели анализ ДНК раковых и здоровых клеток пациентов, чтобы найти специфические мутации опухоли и связанные с ними неоантигены.
Затем ученые использовали компьютерное моделирование, чтобы спрогнозировать, какие неоантигены иммунные клетки смогут различать лучше всего. Затем они ввели вакцину пациентам. Каждая вакцина содержала до 20 специфических для каждого пациента неоантигенов.
После проведения процедуры ученые смогли подтвердить безопасность вакцины, а также ее способность вызывать иммунные реакции у больных. Через 25 месяцев после проведения процедуры вакцинации у четырех пациентов не было обнаружено никаких признаков рака. Двое других пациентов, страдающих от прогрессивной формы меланомы, позднее прошли курс так называемой контрольной терапии, которая блокирует механизмы, благодаря которым рак может подавлять иммунную систему. После дополнительного лечения у обоих пациентов наблюдалась полная регрессия опухоли.
«Мы были рады увидеть последовательную и сильную реакцию у шести пациентов, — прокомментировала Ву. — Это доказывает, что вакцины способны мобилизовать постоянную армию Т-клеток организма».
Как проводилось второе исследование
В другом исследовании, которое проводил доктор Угур Сахин из Университета Йоханнеса Гутенберга в Майнце, Германия, ученые проанализировали раковые опухоли 13 пациентов и выбрали до 10 мутаций у каждого человека для разработки вакцин, созданных из молекул РНК. Это соединения, которые отвечают за кодирование инструкций, используемых для образования таких белков, как неоантигены.
В ходе работы с пациентами ученые обнаружили, что вакцины способны усилить их иммунные реакции. 8 из 13 смогли полностью избавиться от опухолей через два года лечения. У оставшихся пяти произошли рецидивы. Однако у одного пациента из этих пяти наблюдалась регрессия после приема контрольной терапии.
Побочные эффекты
В ходе первого исследования ученые отметили побочные эффекты, вызванные лечением. Чаще вмего они проявлялись в виде симптомов гриппа, усталости и сыпи на месте инъекции. Во время второго исследования не было отмечено серьезных побочных эффектов.
Первая фаза испытаний
Оба исследования являются первой фазой клинических испытаний, в которой задействовано небольшое количество пациентов. Это важно, чтобы проверить безопасность лечения. Также цель ученых во время первой фазы — найти лучшую дозу нового препарата с наименьшими побочными эффектами. Результаты подобных мелкомасштабных исследований необходимо подтвердить для большого количества пациентов.
Хотя еще слишком рано праздновать полную победу над раком, однако, похоже, ученые находятся в начале этого пути.
fb.ru
Создана вакцина против рака
Для производства вакцины ученые использовали индуцированные плюрипотентные стволовые клетки (iPSC), которые генерируются из зрелых клеток определенного типа.
Более 10 лет назад в Японии было впервые доказана возможность генетического перепрограммирования зрелых клеток таким образом, чтобы они вели себя подобно плюрипотентным стволовым клеткам.
Плюрипотентные клетки способны принимать любую форму и выполнять всевозможные функции, приобретая нужную организму хозяина специализацию.
Самый известный пример – эмбриональные стволовые клетки, которые превращаются в специализированные «кирпичики» различных органов и тканей.
Доктор Джозеф Ву (Joseph Wu) из Института биологии стволовых клеток и регенеративной медицины в Стэнфордском университете утверждает, что иммунизация животных эмбриональной тканью позволяет предотвратить развитие злокачественных опухолей. Такое предположение было высказано почти сто лет назад, и ученые из разных стран длительное время пытались использовать эмбриональные стволовые клетки в качестве вакцины от рака.
Но основная проблема противораковых вакцин заключалась в ограниченном количестве антигенов, чужеродных агентов для активации иммунного ответа.
В публикации на страницах Cell Stem Cell говорится, что использование iPSC из собственного генетического материала пациентов дает целый ряд иммуногенных преимуществ, открывая нам дорогу к реальной иммунопрофилактике рака.
Тренировка иммунной системы против рака
Доктор Ву и его коллеги взяли клетки мышей и создали из них iPSC, которые затем вводили обратно в организм животных, уже в составе комплексной вакцины от рака. Вакцина была поливалентной, то есть защищала сразу от нескольких типов рака. Как поясняют авторы, основным преимуществом iPSC является универсальность – нет нужды искать идеальные антигены для нацеливания на определенный тип опухолевых клеток.Дело в том, что многие из антигенов плюрипотентных стволовых клеток можно обнаружить в злокачественных клетках при раке легких, кожи, молочной железы и др.
«Мы предлагаем иммунной системе познакомиться с большим количеством опухолевых антигенов, которые заключены в перепрограммированных стволовых клетках. Это делает наш подход малочувствительным к иммунным «трюкам» раковых клеток», - рассказал доктор Ву.
Но вернемся к результатам эксперимента.
Когда животные получили инъекции iPSC, их тело отреагировало выработкой антител против злокачественных опухолей разных типов. Вакцина фактически сделала лабораторных животных неуязвимыми к онкозаболеваниям!
Чтобы подтвердить эффект, ученые ввели iPSC грызунам с раком молочной железы. Из 75 животных 70% полностью победили опухоль, а у 30% животных удалось добиться значительного уменьшения размеров в течение 4 недель после введения вакцины. Аналогичными были результаты на мышах с раком легких и кожи (меланомой).
«Больше всего мы были удивлены реактивацией иммунной системы (…) Этот подход имеет огромный клинический потенциал в плане предотвращения рецидива рака после пройденного лечения и профилактики образования метастазов», - добавил Джозеф Ву.
Если изобретение войдет в клиническую практику, в скором будущем собственные стволовые клетки будут не только лечить рак, но и предотвращать его в группах риска.
Быть может, скоро мы перестанем бояться смертельной болезни?
medbe.ru
















