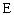Кристаллические структуры. Электронное строение атомов. Квантовые ячейки фосфора
1.7. Квантовые ячейки
Итак, каждое из четырех квантовых чисел "отвечает" за определенный аспект характеристики электронного состояния. Набор всех четырех квантовых чисел позволяет полностью охарактеризовать состояние электрона в атоме с позиций квантово-механическоймодели.
Существует очень простая и наглядная система обозначений, в которой принято символически изображать каждую орбиталь клеткой (так называемой квантовой ячейкой) (рис. 1.5.), а значения спинового квантового числа ото-
ждествлять с направлением стрелки: ↑ (ms = +½),↓ (ms = -½).
Согласно правилу Хунда (принципу максимальной мультиплетности)
абсолютное значение суммарного спинового числа электронов данного энергетического подуровня должно быть максимальным.
s-подуровень
p-подуровень
d-подуровень
f-подуровень
Рис. 1.5. Квантовые ячейки
Другими словами, в основном состоянии атома (такое состояние отвечает его минимальной энергии) максимальное число квантовых ячеек должно быть занято электронами, поэтому при построении схемы распределения электронов по квантовым ячейкам следует сначала помещать по одному электрону в каждую из них (спины всех электронов данного подуровня должны быть па-
раллельными), и только после того, как одиночные электроны заполнят все ячейки, в них помещается второй электрон с антипараллельным спином.
Например, единственно верным вариантом распределения четырех электронов на d-энергетическийподуровень является следующий:
↑↑ ↑ ↑
d-подуровень
т.к. именно в этом случае суммарное спиновое число достигает максимального значения: +½+½+½+½ = +4/2.
Электроны с одинаковыми значениями квантового числа ms (т.е. электроны с параллельными спинами) называютнеспаренными. Именно эти электроны играют решающую роль в процессе образования химической связи между атомами, определяя их валентные состояния.
Если же число электронов превышает количество квантовых ячеек, то нахождение электронов в одной и той же квантовой ячейке возможно лишь в том случае, если значения спиновых квантовых чисел этих электронов противоположны (такие электроны с антипараллельными спинами называют спаренными). Например, семь электронов заполняют ячейкиd-состоянияследующим образом:
↑↓ | ↑↓ | ↑↓ | ↑ |
|
|
|
|
|
|
d-подуровень
При получении атомом дополнительной энергии он переходит из основного в возбужденное состояние. При этом электроны из полностью заполненных орбиталей переходят на вакантные орбитали того же энергетического подуровня. Число неспаренных электронов при этом увеличивается, и валентные возможности атома изменяются.
Из принципа Паули следует, что в одной и той же квантовой ячейке (квантовые числа n, ℓ, mℓ для таких электронов уже совпадают) могут находиться максимум два электрона с противоположными значениями спинового
квантового числа ms. Это позволяет установить предельную емкость каждого энергетического подуровня (рис. 1.6.).
s-подуровень |
|
| ↑ ↓ |
|
|
| 2 | электрона | |
p-подуровень |
|
|
|
|
|
| 6 | электронов | |
|
|
|
|
|
| ||||
| ↑ ↓ | ↑ ↓ | ↑ ↓ |
|
| ||||
d-подуровень |
|
|
|
|
|
| 10 электронов | ||
|
|
|
|
|
| ||||
↑ ↓ | ↑ ↓ | ↑ ↓ | ↑ ↓ | ↑ ↓ |
| ||||
f-подуровень |
|
|
|
|
|
|
| 14 электронов | |
|
|
|
|
|
|
| |||
↑ ↓ | ↑ ↓ | ↑ ↓ | ↑ ↓ | ↑ ↓ | ↑ ↓ | ↑ ↓ | |||
|
|
|
|
|
|
|
|
|
|
Рис. 1.6. Максимальная емкость энергетических подуровней
Итак, каждый энергетический подуровень имеет ограничения по количеству электронов, которые его заполняют.
1.8. Электронные формулы атомов
Представить электронное строение многоэлектронного атома – это значит в условной форме дать распределение электронов этого атома по энергетическим уровням и подуровням, т.е. составить так называемую электронную формулу атома. Электронная формула – это своего рода шифр, основу которого составляют квантовые числа. Электронная формула атома строится из блоков вида:
nℓx,
где: n – главное квантовое число (номер энергетического уровня, его зна чение указывается цифрой 1,2,3, 4,5,...), ℓ – орбитальное квантовое число (его значение обозначается соответствующей латинской буквой s, p, d, f), x – число электронов, находящихся в данном квантовом состоянии.
Например, запись 4d7 означает, что семь электронов занимают четвертый энергетический уровень,d-подуровень,т.е. для этих семи электронов n=4 и ℓ=2.
Электронная формула атома составляется для его основного состояния, т.е. для состояния, которому отвечает минимальная энергия. При составлении электронных формул следует производить заполнение энергетических подуровней в порядке роста их энергии, низшие по энергии подуровни всегда заполняются первыми (принцип наименьшей энергии).
Энергия подуровней растет в соответствии с ростом суммарного значения квантовых чисел n + ℓ, а в случае их равенства первым заполняется подуровень с меньшим значением n.
Порядок заполнения легко вывести из диаграммы, представленной на рис. 1.7.
1s | Ó |
|
|
|
|
|
|
2s | Ó | 2p Ó |
|
|
|
| |
3s | Ó | 3p Ó | 3d | Ó |
|
| |
4s | Ó | 4p Ó | 4d | Ó | 4f | Ó | |
5s | Ó | 5p | Ó | 5d | Ó | 5f | Ó |
6s | Ó | 6p | Ó | 6d | Ó | 6f |
|
7s | Ó | 7p | Ó | 7d |
| 7f |
|
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f,...
энергия
Рис. 1.7. Диаграмма энергетических подуровней
В этой диаграмме в столбик выписаны энергетические подуровни каждого из семи уровней. При движении справа налево по диагонали данной диаграммы Вы получаете порядок, в котором следует заполнять энергетические подуровни электронами при составлении электронных формул атомов.
Учитывая рассмотренные выше закономерности, электронные формулы атомов алюминия (порядковый номер элемента 13, атом содержит 13 электронов) и скандия (порядковый номер элемента 21, атом содержит 21 электрон) можно представить в виде:
13Al 1s2 2s2 2p6 3s2 3p1
21Sc 1s2 2s2 2p6 3s2 3p6 4s2 3d1 или21Sc 1s2 2s2 2p6 3s2 3p6 3d1 4s2,
если чисто формально скомпоновать подуровни третьего энергетического уровня вместе.
Электронные формулы многоэлектронных атомов можно представить в более краткой форме, если учесть, что полностью застроенные оболочки характеризуют электронное состояние благородных газов – элементов, завершающих каждый период периодической системы Д. И. Менделеева:
He (1s2),
Ne (1s22s22p6),
Ar (1s22s22p63s23p6),
Kr (1s22s22p63s23p63d104s24p6),
Xe (1s22s22p63s23p63d104s24p64d105s25p6),
Rn (1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6).
Поэтому в электронных формулах можно указать символ соответствующего благородного газа в квадратных скобках, а далее привести рас-
пределение тех электронов атома, число которых превышает число электронов в атоме этого благородного газа. Для рассмотренных выше полных электронных формул алюминия и скандия такая модификация дает следующий результат:
13Al [Ne] 3s2 3p1
21Sc [Ar] 3d1 4s2
Электроны внешнего (последнего) энергетического уровня и, как правило, предвнешнего (предпоследнего) уровня d-подуровня,если он застроен не-
полностью, называют валентными электронами.
Так, валентными электронами Al считаются 3s2 3p1, а Sc - 3d14s2.
Наряду с электронными формулами атомов используют и так называемые электронно-графические формулы, основанные на рассмотренных выше представлениях о квантовых ячейках. В этом случае каждый энергетический подуровень представляется набором соответствующих квантовых ячеек, которые заполняют электронами согласно требованиям принципа Паули и правила Хунда.
Например, электронно-графическиеформулы атомов алюминия и скандия выглядят так:
13Al | ↑↓ |
| ↑↓ |
| ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
| ↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1s2 |
| 2s2 |
|
| 2p 6 |
|
| 3s2 |
|
| 3p1 | |
21Sc | ↑↓ |
| ↑↓ |
|
| ↑↓ | ↑↓ | ↑↓ |
|
| ↑↓ |
| ↑↓ | ↑↓ | ↑↓ | |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1s2 |
| 2s2 |
|
|
|
| 2p6 |
|
|
|
| 3s2 |
|
| 3p6 |
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
| ↑ |
|
|
|
|
|
|
|
|
|
|
|
| ↑↓ |
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
| 3d1 |
|
|
|
|
|
|
|
| 4s2 |
|
|
|
|
| ||
studfiles.net
Строение атома фосфора (P), схема и примеры
Общие сведения о строении атома фосфора
Относится к элементам p-семейства. Неметалл. Обозначение – P. Порядковый номер – 15. Относительная атомная масса – 30,974 а.е.м.
Электронное строение атома фосфора
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
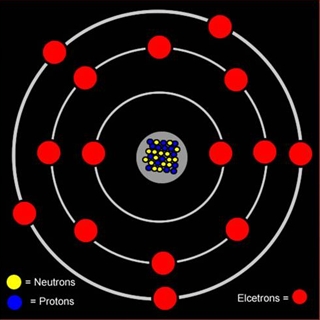
Рис.1. Схематическое строение атома фосфора.
Распределение электронов по орбиталям выглядит следующим образом:
+15 P)2)8)5;
1s22s22p63s23p3.
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
3 |
0 |
0 |
+1/2 |
|
s |
3 |
0 |
0 |
-1/2 |
|
p |
3 |
1 |
-1 |
+1/2 |
|
p |
3 |
1 |
0 |
+1/2 |
|
p |
3 |
1 |
1 |
+1/2 |
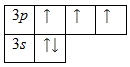
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
Именно поэтому для фосфора также характерна степень окисления +5.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Квантовые числа элементов. — МегаЛекции
Состояние каждого электрона в атоме характеризуется 4 квантовыми числами:
а) Главное квантовое число n - определяет число уровней в атоме и совпадает с номером периода, в котором находится элемент.
Например: n = 2, значит в атоме две оболочки с электронами, следовательно, элемент находится во втором периоде.
Главное квантовое число n - определяет общий запас энергии электрона и его расстояние от ядра. Чем дальше электрон удален от атома, тем больше запас энергии. При n = 1 энергия электрона минимальна.
n = 1 К – уровень
n = 2 L – уровень
n = 3 M – уровень
n = 4 N – уровень
n = 5 O – уровень
n = 6 Р – уровень
n = 7 Q – уровень
б) Побочное квантовое число l -определяет форму электронного облака. Его значение на 1 меньше, чем у главного квантового числа.
По значению побочного квантового числа определяются подуровни.
Например: если n = 1 l = 0, то это s - подуровень
n = 2 l = 0,1, то это s,р - подуровни
n = 3 l = 0,1,2, то это s,р,d - подуровни
n = 4 l = 0,1,2,3 то это s,р,d,f - подуровни
в) Магнитное квантовое число m –определяет направление вытянутости электронного облака в магнитном поле. Это векторная величина имеет положительные и отрицательные значения в пределах побочного квантового числа.
Например: l = 0, m = 0, то это s – подуровень - одна ячейка
l = 1, m = –1, 0,+1 р – подуровнь - 3 ячейки
l = 2, m = –2, –1, 0,+1,+2 d – подуровнь - 5 ячеек
г) Квантовое спиновое число Sопределяет направление вращения электрона вокруг собственной оси. Если S = + 1/2, то электрон вращается вокруг собственной оси по часовой стрелке и условно обозначается ↑.
Если S = – 1/2, то электрон вращается вокруг собственной оси против часовой стрелки и условно обозначается ↓.
Строение атома и распределение электронов по оболочкам у элементов малых и больших периодов.
В 1913 году ученый-Н. Бор развил квантовую теорию строения атома. В основу теории положил следующие постулаты: электрон может двигаться вокруг ядра атома не по любым орбитам, а по вполне определенным. Число орбит элемента определяется номером периода. Периодов семь, то значит, различают 1,2,3,4,5,6,7 уровни энергии, которые называются квантовыми слоями и обозначаются: К, L, М, N, О, P, Q.
Уровни подразделяются на подуровни, которые обозначаются буквами латинского алфавита s, р, d, f.
Первому энергетическому уровню соответствует s – подуровень, второму уровню – два подуровня: s, р, третьему уровню – три подуровня: s, р, d, четвертому уровню – четыре подуровня: s, р, d, f.
Согласно второму принципу Паули: два электрона могут занять одну и ту же орбиту при условии, что их спины имеют противоположные направления
Согласно принципу Паули:
· первый уровень содержит не более 2 электронов
· второй – не более 8,
· третий – не более 18,
· четвертый – не более 32 электронов
Если в атоме какой-либо уровень окажется незаполненным, то электроны в нем распределяются в соответствии с правилом Хунда:
квантовые ячейки заполняются сначала по одному электрону, а затем по другому с противоположно направленным спином.
а) схема строения атома H +1 )1е
б) графическое изображение электронной оболочки атома элемента водорода
1sв) электронная формула элемента водорода 1s1
Азот - N заряд ядра +7 )2е )5е 1s2 2s22р3
2s
1s
Кислород – O заряд ядра +8 )2е )6е 1s2 2s22р4
2s
1s
Калий – Кзарядядра +19 )2е )8е )8е )1е 1s2 2s22р63s23p64s1
4s
| ↑↓ | ||
| ↑↓ | ↑↓ | ↑↓ |
3s
| ↑↓ | ||
| ↑↓ | ↑↓ | ↑↓ |
2s
1s
Контрольные вопросы:
1.Какие предпосылки послужили основой открытия Периодического закона?
2.Как таблица Менделеева структурируется по горизонтали? Какие периоды выделяют в таблице Менделеева?
3.Как таблица Менделеева структурируется по вертикали? Охарактеризуйте главную и побочную подгруппы.
4.Какие из химических элементов в таблице Менделеева связаны с Россией?
5.Охарактеризуйте координаты элемента №33 и №41 в таблице Менделеева
6.Что объединяет элементы главной и побочной подгрупп? Приведите примеры
7.Расположите следующие элементы: фосфор, магний, хлор – в порядке возрастания неметаллических свойств. Расположите эти элементы в порядке возрастания металлических свойств.
8.Расположите следующие элементы: сурьма, фосфор, висмут – в порядке возрастания неметаллических свойств. Расположите эти элементы в порядке возрастания металлических свойств.
9.Расположите следующие элементы: магний, барий, стронций, бериллий – в порядке увеличения радиусов атомов. Как изменяются металлические св-ва элементов в этом ряду?
10.Напишите электронные формулы следующих атомов: кислорода, магния, фосфора, аргона, ванадия.
Тема.1.3: Строение вещества
Перечень изучаемых вопросов:
1. Ковалентная химическая связь. Механизм образования. Электроотрицательность. Ковалентные полярная и неполярная связи. Молекулярные и атомные кристаллические решетки.
2. Ионная химическая связь. Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.. Ионные кристаллические решетки.
3. Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь. Физические свойства металлов.
4. Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь, ее роль в формировании структур биополимеров.
5. Чистые вещества и смеси.Понятие о смеси веществ. Гомогенные и гетерогенные смеси. Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Дисперсные системы.Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Понятие о коллоидных системах.
Ковалентная химическая связь. Механизм образования ковалентной связи (обменный и донорно-акцепторный). Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи. Молекулярные и атомные кристаллические решетки.
Ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии.
Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный, дативный.
При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими.например, при образовании молекулы трифторида бора из атомов три атомные орбитали бора, на каждой из которых имеется по одному электрону, перекрываются с тремя атомными орбиталями трех атомов фтора (на каждой из них также находится по одному неспаренному электрону). В результате спаривания электронов в областях перекрывания соответствующих атомных орбиталей появляется три пары электронов, связывающих атомы в молекулу.
По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов. По донорно-акцепторному механизму происходит, например, присоединение фторид-иона к молекуле трифторида бора. Вакантная р-орбиталь бора (акцептора электронной пары) в молекуле BF3 перекрывается с р-орбиталью иона F−, выступающего в роли донора электронной пары. В образовавшемся ионе [BF4]− все четыре ковалентные связи бор−фтор равноценны по длине и энергии, несмотря на различие в механизме их образования.
Атомы, внешняя электронная оболочка которых состоит только из s- и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Примером проявления дативного механизма приобразования связи служит взаимодействие двух атомов хлора. Два атома хлора в молекуле Cl2 образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, происходит перекрывание 3р-орбитали атом Cl-1, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-2, а также перекрывание 3р-орбитали атом Cl-2, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-1. Действие дативного механизма приводит к увеличению прочности связи. Поэтому молекула Cl2 является более прочной, чем молекула F2, в которой ковалентная связь образуются только по обменному механизму:
| Молекулы | F2 | Cl2 | Br2 | I2 |
| Энергия связи, кДж/моль |
Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе общие электронные пары.
megalektsii.ru
Кристаллические структуры. Валентность | Задания 66
Распределение электронов по квантовым ячейкам атома
Задание 66.Сколько не спаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?Решение:Распределение электронов внешнего энергетического уровня … 3s23p5 (учитывая правило Хунда 3s23px23py23pz1) по квантовым ячейкам имеет вид:а) Заполнение внешнего энергетического уровня атома хлора в основном состоянии:
;
При таком состоянии валентность (спинвалентность) атома углерода равна 1.
б) Заполнение внешнего энергетического уровня атома хлора в возбуждённом состоянии при переходе одного 3py-электрона на d-подуровень:
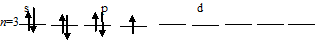
При таком состоянии валентность (спинвалентность) атома углерода равна 3.
в) Заполнение внешнего энергетического уровня атома хлора в возбуждённом состоянии при переходе одного 3py- и одного 3px-электрона на d-подуровень:
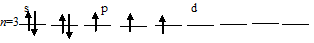
При таком состоянии валентность (спинвалентность) атома углерода равна 5.
г) Заполнение внешнего энергетического уровня атома хлора в возбуждённом состоянии при переходе одного 3py-, одного 3px- и одного s-электрона на d-подуровень:
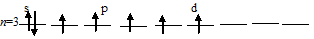
При таком состоянии валентность (спинвалентность) атома углерода равна 7.
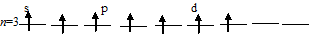
Заполнение внешнего энергетического уровня атома
Задача 67. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?Решение:Распределение электронов внешнего энергетического уровня атома серы … 3s23p4 (учитывая правило Хунда 3s23px23py13pz1) по квантовым ячейкам имеет вид:
а) Заполнение внешнего энергетического уровня атома серы в основном состоянии:
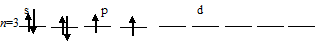
При таком состоянии валентность (спинвалентность) атома серы равна 2.
б) Заполнение внешнего энергетического уровня атома серы в возбуждённом состоянии при переходе одного 3py-электрона на d-подуровень:
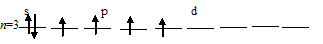
При таком состоянии валентность (спинвалентность) атома серы равна 4.
в) Заполнение внешнего энергетического уровня атома серы в возбуждённом состоянии при переходе одного 3py- и одного s-электрона на d-подуровень:
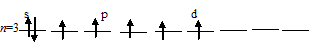
При таком состоянии валентность (спинвалентность) атома серы равна 6.
Электрический момент диполя
Задача 68. Что называют электрическим моментом диполя? Какая из молекул НСI, НВг, НI имеет наибольший момент диполя? Почему?Решение:Ковалентная связь, которая образована разными атомами, называется полярной. Например, H — Cl; центр тяжести отрицательного заряда (связанного с электронами) не совпадает с центром тяжести положительного заряда (связанного с зарядом ядра атома). Электронная плотность общих электронов смещена к одному из атомов, имеющего большее значение электроотрицательности, в большей степени. В H : Cl общая электронная пара смещена в сторону наиболее электроотрицательного атома хлора. Полярность связи количественно оценивается дипольным моментом ( ), который является произведением длины диполя (l) – расстояния между двумя равными по величине и противоположными по знаку зарядами +g и –g на абсолютную величину заряда: . Дипольный момент - величина векторная и направлен по оси диполя от отрицательного заряда к положительному. Дипольный момент связи даёт ценную информацию о поведении молекулы в целом. Он служит количественной мерой её полярности. Молекула, тем более полярна, чем больше смещена общая электронная пара к одному из атомов, т. е. чем выше эффективные заряды атомов и чем больше длина диполя l. Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. Например, дипольные моменты в ряду НСI —НВг — НI будут уменьшаться, что связано с уменьшением разности электроотрицательности атомов при переходе от НСI, НВг, НI. Следовательно молекула НСI имеет наибольший момент диполя. Дипольные моменты НСI, НВг, НI равны, соответственно 1,04; 0,79; 0,38 D. Дипольные моменты молекул обычно измеряют в дебаях (D)* : 1D = 3,33 . 10-30 Кл .м.
Ионные, атомные, молекулярные, металлические кристаллические решетки
Задание 69. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы, каких веществ - алмаз, хлорид натрия, диоксид углерода, цинк - имеют указанные структуры?Решение:а) Кристаллическая структура, в узлах которой находятся анионы и катионы называется ионной. Расстояния между противоположно заряжёнными ионами меньше, чем расстояния между одноимёнными ионами, поэтому электростатические силы межионного притяжения преобладают над силами отталкивания. Так электростатические силы не обладают ни насыщенностью, ни направленностью. Каждый ион взаимодействует не только с иона-ми своего непосредственного окружения, но и со всеми другими ионами кристалла. Эффективные заряды ионов в кристаллах с ионной кристаллической решёткой всегда боль-ше, поэтому кулоновское взаимодействие остаётся сильным и создаёт строго упорядоченное чередование катионов и анионов в пространстве, т. е. ионную решётку. К числу ионных кристаллических решёток относится решётка NaCl. В кристалле NaCl восемь хлорид-ионов образуют восемь вершин куба, а шесть других хлорид-ионов лежат в центрах шести граней этого куба. Таким образом, хлорид-ионы образуют кубическую гранецентрированную решётку. Меньшие по размерам катионы натрия занимают октаэдрические пустоты в решётке, образованной хлорид-ионами. Решётка образованная катионами натрия, также является кубической гранецентрированной. В данной кристаллической решётке каждый катион натрия окружён шестью хлорид-ионами, а каждый хлорид-ион окружает шесть катионов натрия, т. е. координационное число обоих ионов равно шести.
б) Атомной кристаллической структурой называется кристалл, в узлах решётки которого находятся атомы. Связь в таких кристаллах чисто ковалентная. Например, в алмазе каждый атом углерода имеет четыре -связи и тетраэдрически окружён четырьмя такими же атомами углерода. Углерод в алмазе находится в состоянии sp3-гибридизации, поэтому все связи между атомами в алмазе одинаковы (длина - связи равна 154 пм), а угол меж-ду атомами равен 109,50. Каждый атом углерода связан с четырьмя другими.
в) Кристаллические структуры, в узлах решеток которых находятся молекулы, называются молекулярными кристаллами. Взаимное притяжение в данных кристаллах между молекулами обусловлено или слабыми ван-дер-вальсовыми силами, или водородными связями, которые гораздо слабее сил, действующих в ионных, атомных и металлических кристаллах. Так, в узлах кристаллического СО2 («сухой лёд») содержатся молекулы СО2, которые плотно упакованы в гранецентрированную кристаллическую решётку. Между молекулами СО2 в кристалле действуют ван-дер-вальсовы силы.
г) Металлическая кристаллическая структура – это такая решётка, структурной единицей которой является атом. В кубических решётках каждый атом окружён восемью другими атомами (кубическая объёмноцентрированная решётка), а в других – двенадцатью (гексагональная решётка). Таким образом, каждый атом может образовывать со своими непосредственными соседями 8 или 12 связей, располагая для этого обычно небольшим числом валентных электронов. В этих условиях возникает большое число многоцентровых орбиталей с малым числом электронов на них. Орбитали охватывают значительное число атомов, они делокализованы. Электроны на этих орбиталях обобществлены сразу многими атомами.
Таким образом, кристаллические решётки металлов образуются положительно заряжёнными катионами и «погружены» в электронный газ. Валентные электроны в пределах металлического металла перемещаются почти свободно. Электронный газ компенсирует силы электростатического отталкивания положительных ионов и является причиной устойчивости, прочности металлического состояния. Концентрация свободных электронов в электронном газе металлов составляет 1022 – 1023 электронов в 1 см3. Металлическую кристаллическую структуру имеет и цинк, как металл.
Метод валентных связей (ВС)
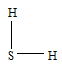
Задание 70. Как метод валентных связей (ВС) объясняет угловое строение молекулы Н2S и линейное молекулы СО2?Решение:а) Сера в основном состоянии имеет два неспаренных р-электрона (3s23px23py13pz1). Вследствие электростатического отталкивания два р-электронных облака всегда располагаются перпендикулярно друг другу. При образовании молекулы h3S два p-облака атома серы перекрываются с s-облаками атомов водорода, образуя две ковалентные связи, угол между которыми близок к 900 (рис.1.), что хорошо согласуется с взаимным расположением двух р-орбиталей. занятых неспаренными электронами.
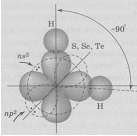
Рис.1.Схема перекрывания электронных облаков в молекулах соединений водорода с серой, селеном,теллуром.
Таким образом, молекула h3S имеет угловое строение, что можно представить структурной формулой:
б) Углерод в основном состоянии имеет два неспаренных р-электрона (2s22px12py12pz0). Вследствие электростатического отталкивания два р-электронных облака всегда располагаются перпендикулярно друг другу, т. е. углерод в основном состоянии может быть двухвалентным. Молекула СО2 содержит на один атом углерода два атома кислорода, т.е. углерод с двумя атомами кислорода соединён посредством четырёх ковалентных связей. Установлено, что СО2 имеет линейное строение. Такая форма молекулы СО2 объясняется тем, что в атоме углерода две sp-гибридные орбитали и две негибридные орбитали. Все они перекрываются с р-орбиталями атомов кислорода. При этом две sp-гибридные орбитали дают с р-орбиталями каждого атома кислорода две  -связи, угол между которыми равен 1800 (рис.2.). Негибридизированные две р-орбитали атома углерода дают с р-орбиталями каждого атома кислорода две
-связи, угол между которыми равен 1800 (рис.2.). Негибридизированные две р-орбитали атома углерода дают с р-орбиталями каждого атома кислорода две  -связи, расположенных в перпендикулярных друг другу плоскостях.
-связи, расположенных в перпендикулярных друг другу плоскостях.
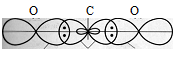
Рис. 2. Трёхатомная молекула СО2.
Структурная формула СО2 имеет вид:
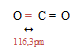
buzani.ru
Квантовая ячейка - Справочник химика 21
Бериллий. Атом бериллия имеет электронное строение 15 2 распределение электронов по квантовым ячейкам представлено для него схемой [c.158]
Электронная конфигурация атома. На основе указанных положений можно записать электронную конфигурацию любой атомной частицы (атома, иона). Для этого сначала определяют число ее электронов, а затем размещают их по уровням, подуровням и квантовым ячейкам в соответствии с приведенными правилами. Например, требуется написать электронную конфигурацию атома хлора. Порядковый номер его равен 17. Отсюда следует, что он содержит 17 электронов. На основе приведенных закономерностей заполнение идет следующим образом максимально заполняются подуровни 15 (два электрона), 25 (два электрона), 2р (шесть электронов), 35 (два электрона). Остальные пять электронов размещаются на подуровне Зр. Следовательно, электронная конфигурация имеет вид [c.59]
Правило Гунда. Размещение электронов по квантовым ячейкам подчиняется правилу Гунда, согласно которому электроны в пределах данного подуровня (з-, р-, с1-, /-) располагаются сначала каждый в отдельной квантовой ячейке в виде (одиноких) неспа- [c.57]
Фтор. Схема электронного строения атома 1 тронов по квантовым ячейкам [c.160]
Бор. Электронное строение невозбужденного атома 1я 2з 2р. Распределение электронов по квантовым ячейкам выражается схемой [c.158]
Неон. Электронное строение атома и распределение электронов по квантовым ячейкам [c.160]
Пример 4. Представьте графически расположение пяти внешних электронов атома азота по квантовым ячейкам. [c.19]
Написать формулы комплексных соединений железа гексацианоферрата (II) калия и гексацианоферрата (III) калия и распределить электроны атома железа по квантовым ячейкам при образовании комплексов. Какое из этих соединений является парамагнитным [c.206]
Катионы К"+ связываются в растворе с гидратирующими их молекулами воды донорно-акцепторной связью донором являются атомы кислорода, имеющие две свободные электронные пары, акцептором — катионы, имеющие свободные квантовые ячейки, Чем больше заряд иона и чем меньще его размер, тем значительнее будет поляризующее действие К"+ на Н2О. [c.265]
Азот. Электронное строение атома азота з 28 2р отвечает распределению электронов по квантовым ячейкам [c.159]
Волнистые линии на схеме показывают, что в молекуле водорода каждый электрон занимает место в квантовых ячейках обоих атомов, т. е. движется в силовом иоле, образованном двумя силовыми центрами — ядрами атомов водорода ) [c.121]
В связи со сказанным энергию можно рассматривать на основе квантовых чисел, согласно которым п характеризует энергетический уровень, I — энергетический подуровень данного уровня, гп1 — число квантовых ячеек подуровня, — число состояний электрона в квантовой ячейке. [c.57]
Проведенный выше обзор валентности элементов второго периода периодической системы позволяет понять причину отличия этих элемеитов от других. Особенно сильно это отличие выражено у трех элементов — азота, кислорода и фтора. Кроме особенностей,. обусловленных малым радиусом атомов и ионов, отличия данных элементов связаны также и с тем, что их внешние электроны находятся во втором слое, в котором имеются только четыре квантовые ячейки. Поэтому данные элементы не могут проявлять высокие валентности, которые известны для их аналогов. [c.83]
Иерн. Электронное строение атома неона и распределение электронов по квантовым ячейкам (рис. 1.34) таковы, что в атоме неона нет неспаренных электронов. Неон, подобно гелию, не образует молекул с другими атомами его валентность равна нулю. Для возбуждения атома Ые необходима очень большая энергия, так как возбуждение сопряжено с переходом электронов на новый электронный слой. [c.83]
Подуровень делится на квантовые ячейки (энергетические состояния), Число ячеек в каждом подуровне определяется числом возможных значений т, т. е. равно 2/-fl (см. с. 69). [c.70]
Каждой клеточке (называемой квантовой ячейкой) соответствует определенная орбиталь . В первой схеме все р-электроны имеют разные значения во второй — у двух р-электронов они одинаковы. Квантовая механика и анализ спектров показывают, что заполнение квантовых ячеек, отвечающее низшему энергетическому состоянию атома, происходит следующим образом. При заполнении оболочки электроны сначала располагаются по ячейкам, отвечающим различным значениям магнитного квантового числа, и только после того как все ячейки в оболочке заполнены при дальнейшем прибавлении электронов в ячейках появляется по два электрона с противоположно направленными спинами. Иными словами, заполнение электрон ныу пбоппир - происходит таким образом, ч то о ы суммарный спин О ы л КТ с1 к с и м о л и п ы-м" . Эт [c.29]
Таким образом, метод молекулярных орбиталей показывает, что при связывании двух атомов в молекулу реализуются два состояния электрона - две молекулярные орбитали (им отвечают функции 01 и 02), одна с более низкой энергией Е, а другая с более высокой энергией Е . Это можно иллюстрировать энергетической диаграммой, представленной на рис. 1.46 такие диаграммы часто используют в методе МО. Квадрат (его часто заменяют кружком) около уровня энергии означает квантовую ячейку - орбиталь, которая может быть занята одним электроном или двумя электронами с противоположно направленными спинами (иногда квантовые ячейки не изображают, а непосред- [c.107]
Фтор. Распределение электронов по квантовым ячейкам (см. рис. 1.34) показывает, что в атоме фтора имеется только один неспарепный электрон, поэтому фтор одновалентен. [c.83]
Из этого примера видно, что ион водорода присоединяется к уже готовой электронной паре, принадлежащей до реакции только одному из соединяющихся элементов — азоту. Следовательно, химическая связь, осуществляемая за счет неподеленной пары электронов одного атома и свободной квантовой ячейки другого, называ-е 1ся координативной, или донорно-акцепторной. Атом или ион, предоста1Вляющий неподеленную электронную пару, называется донором, а присоединяющийся к этой электронной паре — акцептором. В ионе аммония МН4]+ донором является атом азота, а акцептором — ион водорода. Ион, образованный за счет координативной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, — комплексными соединениями. [c.81]
Представим теперь, что два электрона (фермиона) находятся в одном состоянии, т. е. имеют одинаковые наборы квантовых чисел (находятся в одной квантовой ячейке ). Пусть, например, а = р или а = т. Тогда детерминант (5.18) будет иметь две одинаковые строки и обратится в нуль (Фд = ()). Это означает, что такое состояние не существует. Детерминант (5.18) будет отличен от нуля только при условии а ф ф. .. Ф т. Согласно этому частицы, описываемые антисимметричными функциями, не могут находиться в одинаковых состояниях (одинаковых квантовых ячейках). В таких квантовых ячейках может содержаться самое большее по одной частице или ячей- [c.23]
Квантовые ячейки изображены со сдвигом по вертикали, чтобы наглядно показать возрастание энергии в ряду 11-, 25-, 2р-состояний. Соответствующие схемы в третьей [c.32]
Более длительное свечение, как известно, связано с переходом вещества в метастабильное бирадикальное состояние. (Ему соответствуют примесные уровни 4—3, рис. 40.) Здесь мы встречаемся с изменением электронной конфигурации вещества, причем последнее приобретает новую, сравнительно устойчивую электронную структуру. Согласно А. Н. Теренину, при переходе возбужденного электрона в зону проводимости (переход р — q, рис. 40) сохраняется антипараллельное расположение спинов, но электроны размещаются в отдельных квантовых-ячейках [c.127]
Волновая функция, описывающая состояние электрона в атоме, и полностью характеризуемая конкретными значениями квантовых чисел п, I п ггц, называется пространственной атомной орбиталью или просто атомной орбиталью. Для такой атомной орбитали принято сокращенное обозначение — АО, которым пользуются повсеместно при обсуждении свойств и строения атомов и молекул. Состояние, описываемое АО, условно обозначают в виде квадрата квантовой ячейки) П, в виде окружности О или черты-. Последний способ обозначения [c.58]
Электронное строение атома Не может быть выражено схемой, представленной на рис. 1.34, которая показывает, что два электрона находятся в одной квантовой ячейке. Два электрона с противоположными спинами, запимаюи [ие одну квантовую ячейку, называют спаренными. [c.81]
Ниже приведено распределение электронов по квантовым ячейкам в некоторых октаэдрических комплексах в слабом и сильном полях. В тех случаях, когда число электронов в ионе комплексообразователя больше, чем число орбиталей с низкой энергией имеют место различия. Этв связано с тем, что в случае слабого поля Р>Д и электроны в квантовых ячейках распределяются в соответствии с правилом Гунда. Ион металла находится в состоянии с высоким спином. В случае сильного поля в пределах подуровня при распределении электронов соблюдается правило Гунда. При переходе от одного подуровня к другому электрону выгоднее находиться в занятых одним электроном квантовых ячейках с более низкой энергией. [c.119]
Как мы знаем (см. стр. 48), электроны распределяются по квантовым ячейкам — орбиталям — в соответствии с правилом Хунда при достаточном количестве ячеек в каждой из них располагается по одному электрону. Это Объясняется тем, что электроны отталкиваются друг от друга и потому стремятся занять различные орбитали. Для того чтобы перевести электрон с орбитали, где он один, на другую орбиталь, где уже имеется электрон, требуется затрата некоторого количества энергии Р величина Р может быть определена квантовомеханическим расчетом. В связи с этим при наличии в ионе комплексообразователя большего количества электронов, чем число орбиталей с низкой энергией, могут возникать две ситуации. Прид [c.223]
Как было отмечено ранее (в разд. 1.4), электроны распределяются по квантовым ячейкам (орбиталям) в соответствии с прави-ж)м Хунда при достаточном числе ячеек в каждой из них располагается по одному электрону. Это объясняется тем, что электроны отталкиваются друг от друга и потому стремятся з анять разные орбитали. Для того чтобы перевести электрон с орбитали, где он один, на другую орбиталь, где уже имеется электрон, требуется затрата некоторого количества энергйи Р. Величина Р может быть определена квантовомеханическим расчетом. При наличии в ионе комплексообразователя большего числа электронов, чем число орбиталей с низкой энергией, возможны два варианта заполнения орбиталей электронами. При А центрального иона в комплексе занимают те же орбитали, что и в свободном ионе. Ион комплексообразователя находится в состоянии с высоким спином. Если же А > Я, то поле лигандов вызывает переход электронов в уже занятые ячейки с более низкой энергией. В результате спаривания электронов суммарный спин уменьшается, т. е. ион-комплексообразователь переходит в состояние с низким спином. [c.125]
В условиях высоких давлеиия и температуры (6,0 4-8,5 ГПа, 15001800°С) гексагональный нитрид бора переходит в кубическую алмазоподобную модификацию (бесцветные неэлектропроводные кристаллы). Ее технические названия эльбор и кубонит (СССР), боразон (США). Это вещество широко используется в качестве сверхтвердого материала, оно лишь немного уступает по твердости алмазу, но значительно превосходит его по термостойкости— выдерживает нагревание на воздухе до 2000 °С (алмаз сгорает при 800 °С). В кубическом ВЫ, как и в алмазе, окружение атомов тетраэдрическое (хр -гибридизация). Одна из связей в кубическом ВЫ донорно-акцепторная, она образуется за счет неподеленной электронной пары N и свободной квантовой ячейки В. [c.334]
Возможен несколько иной ход рассуждений, приводящий к тому же результату. Нево.збуждениый атом углерода имеет два неспаренных электрона, которые мог,ут образовать две общие электронные пары с двумя неспареннымн электронами атома кислорода (см. рис. 1.34). Однако имеющиеся в атоме кислорода два спаренных р-электрона могут образовать третью химическую связь, поскольку в атоме углерода имеется одна незаполненная квантовая ячейка, которая может принять эту пару электронов. [c.96]
Написать формулы комплексных соединений никеля хлорида гекса-амминникеля (И) и хлорида гексацианоиикеля (II) и распределить электроны атома никеля по квантовым ячейкам при образовании комплексов. Какое из этих соединений является парамагнитным Какова геометрическая форма молекул этих соединений [c.207]
Свойства и получение. Атом углерода в валентном состоя-ВИИ s 2spxPgPz имеет четыре, неспаренных электрона и во внешнем электронном слое отсутствуют как свободные квантовые ячейки, так и неподеленные электронные пары (только для одного элемента, кроме углерода,— водорода характерно состояние атома, имеющее з ти особенности). Такое электронное строение атома и расположение углерода посередине шкалы электроотрицательностей обусловливают уникальные свойства данного элемента, благодаря которым существует огромное многообразие органических соединений. [c.352]
Ркс. 3.42, Распр. деленне электронов по квантовым ячейкам в атоме азота н образованных ВЗ него ионах. [c.394]
Принцип реализации перестановочной симметрии оказался также полезным и при изучении систем, построенных из бозонов. В отличие от фермионов в таких системах, описываемых полными симметричными функциями, квантовая ячейка может вместить любое число частиц. Системы, подчиняющиеся статистике Бозе — Эйнштейна, ведут себя совсем иначе, чем системы, подчиняющиеся статистике Ферми — Дирака. [c.24]
Донорно-акцепторная. .связь. Рассмотрим теперь химическую свйзь в молекуле оксида углерода СО. Распределение электронов по квантовым ячейкам в возбужденном атоме углерода [c.177]
chem21.info
Квантовый компьютер на основе кремниевых микросхем: миф или реальность?
Ученые из Университета Нового Южного Уэльса в Австралии еще больше приблизились к созданию квантового компьютера, работающего на основе кремниевых микросхем и принципов квантовой механики, парадоксы которой не дают физикам спать и порой наводят на мысль о существовании Бога. Им удалось доказать возможность размещения квантового бита (кубит) в ядре атома фосфора, который содержится в современных компьютерных микросхемах.
Данное открытие является значимым по двум основным причинам: первое — созданный кубит отличается высокой стабильностью и, что более важно, второе — для этого был использован кремний, а не вакуум, поэтому его можно контролировать как обычный компьютерный чип.
Напомним, что в конце прошлого года эта же группа ученых доказала возможность размещения квантового бита в электронном спине атома фосфора, размещенного внутри кремниевого транзистора. Теперь они сделали фактически то же самое, но с ядром фосфора, внутри того же кремниевого транзистора.
Как известно большинству, каждый атом состоит из протонов, нейтронов (за исключением водорода, который не имеет нейтронов), а также электронов. Протоны имеют положительный заряд, нейтроны являются нейтральными, а электроны имеют отрицательный заряд. Количество протонов в ядре определяет с каким элементом мы имеем дело (один протон = водород, шесть = углерод, восемь = кислород), а число нейтронов определяет изотоп (по существу, является ли он стабильным или радиоактивным). Главное то, что природа атомного ядра (если забыть о ядерной реакции деления и ядерной реакции синтеза), которое является микроскопическим, плотным и стабильным, практически неизменная. Другое дело электроны, которые зачастую меняют орбиты, перепрыгивают между атомами и полностью отделяются от своих атомов, превращая последних в положительно заряженные частицы — положительные ионы. По словам ученых, атомное ядро в 1 миллион раз меньше самого атома и в 2 тысячи раз менее «дружелюбно», чем орбитальные электроны. Это все лирика, вернемся к кубитам.
В настоящее время существует несколько способов создания кубитов, но самым распространенным является манипулирование спином электрона (магнетизм). Измеряя или изменяя спиновое состояние электрона можно записать или измерить состояние кубита. Можно также измерить спиновое состояние ядер атомов, что и сделали на примере ядра атома фосфора ученые из Университета Нового Южного Уэльса.
Преимущество в использовании ядра заключается в том, что оно практически равнодушно к внешнему магнитному воздействию, поэтому кубит отличается стабильностью. Здесь есть только один недостаток – довольно сложно измерить магнетизм того, что подвигается воздействию в 2000 раз хуже, чем электрон. Для измерения значения кубита ученые использовали ядерный магнитный резонанс. Данное явление также используется в магнитно-резонансной томографии (МРТ) для изменения спинового состояния одного ядра. Определить состояние кубита очень трудно по причине незначительного магнитного поля, создаваемого ядром, но ученым это удалось путем использования процесса под названием преобразование спина в заряд.
С новым кубитом ученые смогли значительно повысить показатель надежности считывания информации до 99,99 процента, при этом показатель когерентности составил рекордных 60 миллисекунд. Для сравнения, когерентность кубита, созданного IBM, составляет 0,1 миллисекунды.
Конечно, ядерные кубиты не заменят кубиты в электронном спине, но они могут действовать как своего рода квантовая память или помочь ученым в создании двухкубитных логических схем. По мнению ученых, первые квантовые компьютеры появятся в ближайшие десять лет.
hi-news.ru
Физики успешно провели вычисления на кремниевом квантовом компьютере
Физики из Австралии успешно применили недавно созданные ими пары кубитов на базе кремния для проведения простейших квантовых вычислений, что подтвердило возможность использования полупроводников для создания универсальных квантовых компьютеров.
МОСКВА, 17 ноя – РИА Новости. Австралийские физики, недавно "склеившие" два кремниевых кубита, успешно использовали их для проведения квантовых вычислений, что показало возможность использования полупроводников для создания универсальных квантовых компьютеров, говорится в статье, опубликованной в журнале Nature Nanotechnology.
"Точность, с которой нам удалось записывать информацию в эти кубиты, является абсолютным рекордом. Это означает, что мы теперь можем приступить к расширению этих квантовых устройств, добавляя в него новые кубиты, и использовать их для все более сложных квантовых вычислений, таких как поиск лекарств, обработка баз данных и моделирование молекул", — заявил Андреа Морелло (Andrea Morello) из университета Нового Южного Уэльса в Сиднее (Австралия).
Андреа Морелло и его коллеги по университету уже несколько лет разрабатывают компоненты, необходимые для сборки полноценного квантового компьютера. Так, в 2010 году они создали квантовый одноэлектронный транзистор, а в 2012 году — полноценный кремниевый кубит на основе атома фосфора. В 2013 году они собрали новую версию кубита, которая позволяла почти со 100% точностью считывать данные из него и оставалась стабильной очень долго.
 Физики создали первый кремниевый модуль квантового процессора
Физики создали первый кремниевый модуль квантового процессора Оставался один шаг – научиться объединять подобные кубиты, используя те же полупроводниковые технологии, что и сами ячейки квантовой памяти. Эта задача была реализована в конце октября, когда ученые заменили атом фосфора на редкий изотоп кремния – кремний-29, и поменяли структуру кубитов.
В своей новой работе группа Морелло проверила, можно ли использовать подобные пары кубитов для проведения вычислений, научившись "нарушать" строгие ограничения, накладываемые на работу квантовых систем теоремой Белла.
Их новые кубиты представляют собой своеобразный шаг назад – они представляют собой одиночный одноэлектронный транзистор на базе атома фосфора, в котором спин самого атома играет роль одного кубита, а спин электрона – роль второй вычислительной "ячейки" квантовой системы.
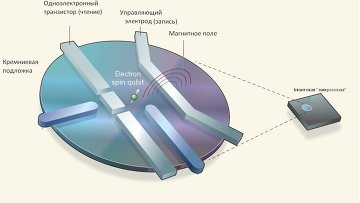 Физики научились записывать и считывать данные из кремниевого кубита
Физики научились записывать и считывать данные из кремниевого кубита Используя микроволновые излучатели, ученые научились манипулировать состоянием этой пары кубитов таким образом, что состояние спина электрона жестким образом зависело от того, что содержал в себе "атомный" кубит. Это резко повысило точность записи и чтения информации из кубита, достигнув фантастической точности в 96%, что является абсолютным рекордом на сегодняшний день.
Это позволяет произвольным образом манипулировать состоянием кубитов и использовать их для проведения вычислений и формулировки квантовых вычислительных алгоритмов. Морелло и его коллеги провели при его помощи первые подобные вычисления, реализовав логическую операцию CNOT в подобном кубите.
Точность ее работы, если проводить каждое вычисление по 30 раз, приближается к 100%, что позволяет приступить к созданию более полезных и практически применимых квантовых схем, способных проводить реальные вычисления, заменяя фосфор другими атомами, вроде висмута, способные служить основой для большего числа кубитов.
ria.ru