Содержание
Профессор РАН из Красноярска занимается уникальными биополимерами для медицины и борется с предрассудками в научном сообществе
Многие знают, что пластик в природе разрушается более 100 лет, а большинство биоразлагаемых пакетов не такие уж разлагаемые: они распадаются на фрагменты из того же пластика, и попадают в желудки птиц и рыб, вызывая их гибель. С каждым годом объем пластикового мусора только растет. Что делать? Искать ответ у самой природы, уверена Екатерина.
О науке
Смотреть на бактерии как на «фабрику» по производству пластика и других ценных продуктов начали еще в конце прошлого века, и на сегодня разработки уже позволяют нам планировать, как мы будем использовать изделия из биопластиков в повседневной жизни, в том числе, в медицине.
Екатерина Шишацкая работает в Сибирском федеральном университете и занимается изучением определенных типов совместимых с организмом термопластичных полимерных материалов, синтезируемых бактериями. Эти полимеры вырабатываются бактериальной культурой, внутри клеток, в условиях несбалансированного роста, они состоят из мономеров карбоновых кислот и при разрушении не вредят организму. Термопластичность – свойство материалов, позволяющее сохранять нужную форму изделия после расплавления и охлаждения. Чтобы придать форму шариковой ручке или одноразовому стакану, на заводе пластик расплавляется, становится жидким, затем кристаллизуется и снова твердеет, и получается то, что мы хотели. В случае медицинских имплантатов и изделий происходит все тоже самое. Екатерина называет создаваемый ею медицинский материал магическим, потому что он формируется внутри бактерии, как будто в живой фабрике.
Эти полимеры вырабатываются бактериальной культурой, внутри клеток, в условиях несбалансированного роста, они состоят из мономеров карбоновых кислот и при разрушении не вредят организму. Термопластичность – свойство материалов, позволяющее сохранять нужную форму изделия после расплавления и охлаждения. Чтобы придать форму шариковой ручке или одноразовому стакану, на заводе пластик расплавляется, становится жидким, затем кристаллизуется и снова твердеет, и получается то, что мы хотели. В случае медицинских имплантатов и изделий происходит все тоже самое. Екатерина называет создаваемый ею медицинский материал магическим, потому что он формируется внутри бактерии, как будто в живой фабрике.
– Я считаю, что все наши технологии в будущем должны быть такими, – говорит Екатерина. – Мы не должны вредить окружающему миру, не должны вмешиваться в процессы, которые происходили в природе до того, как появился человек и его промышленные производства с их отходами.
Сейчас многие ученые по всему миру занимаются исследованиями, которые позволяют изменять гены различных организмов. Культура бактерий, с которыми работает Екатерина, была выделена из природных экосистем, и сегодня микробы «выдрессированы» так, что до 90–95 % от массы их клетки составляет полимерный материал. Красноярским ученым не нужно вмешиваться в геном, чтобы создать необходимые бактерии. Они просто определенным образом влияют на среду и таким образом получают высокую продуктивность культуры.
– Но получение материала – это только половина сказки. Дело в том, что наработанный бактериями материал может разрушаться, оставляя после себя лишь воду и углекислый газ. Сегодня многие направляют бактерии на борьбу с загрязнениями почвы, водоемов, океанов, и это здорово. Моя задача – разрушать материал внутри организма млекопитающего, а значит, такой материал может служить основой, каркасом для искусственных тканей и органов человека.Да, я немного волшебница, я из лаборатории, где все такие, – улыбается Екатерина.
Она и ее коллеги проводят бактериальный биосинтез годами, но не перестают удивляться получаемым результатам. Мама Екатерины – доктор биологических наук Татьяна Волова, как и дочь, очень упрямая. Она синтезирует свои полимеры в бактериях уже больше сорока лет и сейчас разрабатывает «умные» сельскохозяйственные препараты. Екатерина решила пойти другим путем и сделать что-то для медицины. То, что можно будет применить уже завтра.
Фото: Екатерина Шишацкая – доктор биологических наук, профессор РАН, заведующая кафедрой медицинской биологии Института фундаментальной биологии и биотехнологии Сибирского федерального университета, лауреат премии Президента РФ в области науки и инноваций для молодых ученых и лауреат программы L’Oreal-UNESCO для «Женщин в науке» за 2009 год, имеет двух сыновей. Грант РНФ: «Изучение молекулярных маркеров моноцитов-макрофагов у больных атеросклерозом при взаимодействии с бионанополимерными материалами» (2017–2019 гг. ). Источник: Ирина Якунина
). Источник: Ирина Якунина
О медицине
– В мире есть три значимые причины смертности: это травмы в результате чрезвычайных происшествий, патологий сердечно-сосудистой системы и злокачественных новообразований, тех, что называют «раком». По этим трем причинам люди гибнут каждую минуту. Мы выбрали направление лечения сердечно-сосудистых болезней, – рассказывает героиня.
В нашей стране каждая вторая смерть вызвана сердечно-сосудистыми заболеваниями или так или иначе связана с ними. Атеросклеротические поражения занимают большую часть из всех случаев. Смерть в результате атеросклероза и ишемической болезни сердца, головного мозга и других жизненно важных органов развивается на фоне поражения стенок кровеносных сосудов. Сосуды сужаются, сжимаются, и развивается ишемия органа – дефицит кислорода. С ишемией сердца можно бороться несколькими способами, и многие даже не медики сегодня знают, что такое стенты для коронарных сосудов – очень маленькие сетчатые трубочки-имплантаты из металла, расправляющие суженный сосуд и не позволяющие ему сжиматься вновь.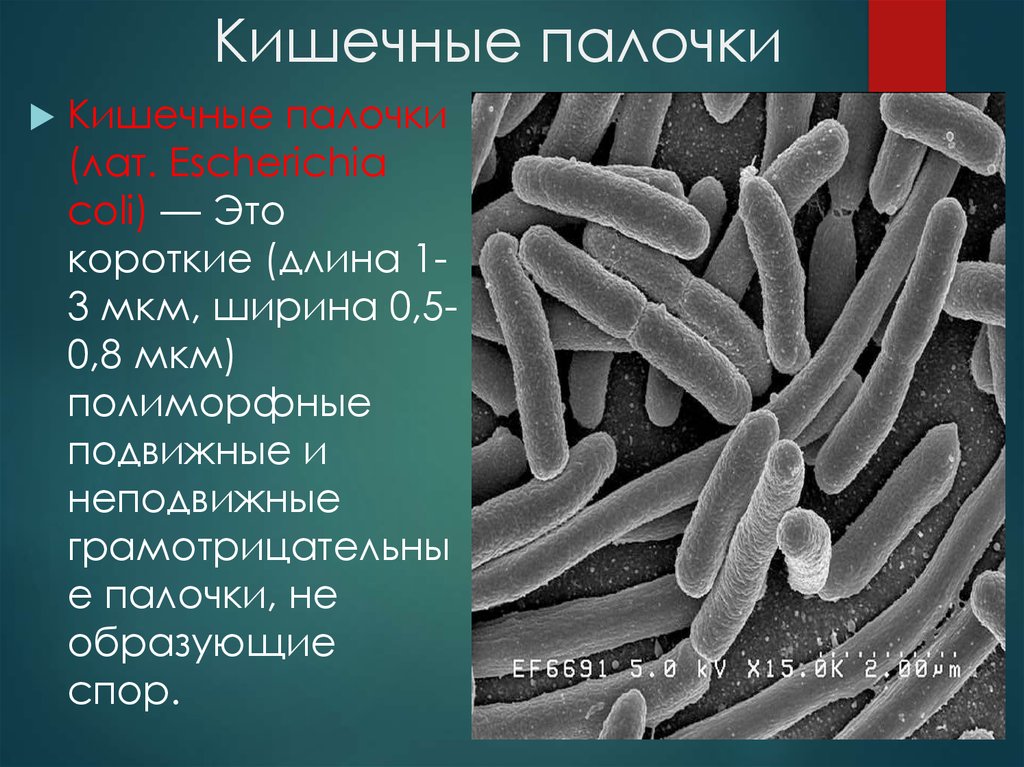
Процедура стентирования проводится довольно часто и дает высокую эффективность. Но впоследствии, когда сосуд уже «вылечен» и стент не нужен, он начинает действовать как чужеродное тело, вызывая воспаление. Если сосуд сужен на большом протяжении, то его проще заменить – поставить сосуд, взятый у самого пациента, или синтетический. Или биоинженерный, но это пока в будущем. Наконец, если таких сосудов много, если ткань самого сердца уже очень ослаблена в результате многолетнего заболевания, нужно менять все сердце.
При всех этих клинических ситуациях всегда есть значительные нарушения, например, нарушается способность организма регулировать себя самому (гомеостаз), поэтому, если просто убрать больные сосуды и вместо них поставить новые биоинженерные, организм их заново «испортит». Это происходит, потому что порочная цепь выработки факторов воспаления, некроза и других патологических молекул уже сформировалась. Снова отложится холестерин, сформируются бляшки и начнется ишемия. Соответственно, к материалу для реконструкции органов сердечно-сосудистой системы при атеросклерозе очень высокие требования: он должен «гасить» воспаление, как бы возвращать организм обратно, в здоровое состояние, после того, как изделие – стент или сосуд – из этого материала имплантировали больному.
Соответственно, к материалу для реконструкции органов сердечно-сосудистой системы при атеросклерозе очень высокие требования: он должен «гасить» воспаление, как бы возвращать организм обратно, в здоровое состояние, после того, как изделие – стент или сосуд – из этого материала имплантировали больному.
Известно, что наши клетки реагируют на сигналы механического усилия извне и, таким образом, в теории каким-то определенным сигналом можно запрограммировать ответ клетки. Материал имплантата может «вылечить» ткань, которая формируется при контакте с ним.
При развитии атеросклероза очень важную роль играют определенные клетки крови – моноциты, которых в организме всего 4–6%. Они – предшественники тканевых макрофагов. Человек поправляется после болезни или у него заживает царапина после пореза, благодаря в том числе и этим клеткам – их количество обратимо увеличивается, они секретируют факторы заживления, происходит регенерация. Но при сложных и длительных заболеваниях макрофаги «ломаются» и вместо заживления их избыток вызывает воспаление, грубое рубцевание и другие отрицательные проявления, которые организму не нужны. При атеросклерозе в сосуде откладывается холестерин, кальций, формируется бляшка, что приводит к сужению просвета и затруднению тока крови. При этом в бляшках созревает популяция «плохих» макрофагов, которые усугубляют локальные патологические проявления и секретируют в кровь факторы воспаления и некроза тканей, что, в свою очередь, провоцирует рост бляшек повсюду.
При атеросклерозе в сосуде откладывается холестерин, кальций, формируется бляшка, что приводит к сужению просвета и затруднению тока крови. При этом в бляшках созревает популяция «плохих» макрофагов, которые усугубляют локальные патологические проявления и секретируют в кровь факторы воспаления и некроза тканей, что, в свою очередь, провоцирует рост бляшек повсюду.
– Чтобы провести исследование мы берем образец моноцитов у пациента до установки ему обычного коронарного стента, высеиваем их на подложку из биопластика с определенным составом и нано-профилем поверхности, и проводим скрининг различных параметров: как меняется форма, или фенотип, клеток, уровень и качественный состав молекулярных показателей, характерных для моноцитов-макрофагов при атеросклерозе. Потом пробы повторяются – уже после того, как в коронарные сосуды поставлены стенты, и у нас есть возможность оценить разницу в сдвигах патофизиологических событий. Сегодня, после примерно 20 месяцев работы, мы отмечаем очень выраженные различия – и в зависимости от состояния пациента, и от состава и поверхности полимерного материала.
Источник: Ирина Якунина
Основной полимер в группе полигидроксиалканоатов – поли-3-гидроксибутират, состоящий из мономеров гидроксимасляной кислоты. Масляная кислота есть в теле человека, она усваивается при пищеварении в тонком кишечнике вместе с другими питательными веществами. Когда исследователи под руководством Шишацкой имплантируют полимер гидроксимасляной кислоты, она распадается на более мелкие цепочки, олигомеры, и мономеры, которые разрушаются до конечных продуктов – воды и углекислоты.
– Сделать из поли-3-гидроксибутират стенты и сосуды технически можно, как и многое другое, но по механическим свойствам это жесткий, хрупкий и гидрофобный (не любящий воду – прим. ред) материал. Мы делаем полимер разного состава, двух, трех, и даже четырёхкомпонентные, чтобы получить что-то более приятное для клеток – более мягкое, эластичное, растяжимое и гидрофильное – мы добавляем разные мономеры, которые встраиваются в основную полимерную цепь, из этой же группы карбоновых кислот, и получаем гетерополимеры.Это тоже огромная интересная задача – понять, как бактерия собирает, нанизывает мономеры – в каком именно порядке, есть ли вообще этот порядок или его нет. Бактерии собирают молекулы в цепь при помощи специальных ферментов – полимераз, получаются очень длинные цепочки, как бусы из разноцветных бусин, и материал обладает совсем другими свойствами. В нашей стране мы, наверное, монополисты, потому что никто так не «дрессирует» бактерии, чтобы получить разные молекулы ПГА, как мы, – заключает Екатерина.
Екатерина по-особенному бережливо, трепетно относится к объекту своего исследования. Она не просто изучает клетки, она прислушивается к ним. Клетка – очень нежная структура, а значит, ей нужно создать такое окружение, в котором ей будет максимально комфортно выполнять задачи, стоящие перед ней. В этом и заключается главная проблема поиска в тканевой инженерии.
Чтобы выполнять такую работу, ученые заручились поддержкой медиков. Но это удалось сделать не с первой попытки.
Но это удалось сделать не с первой попытки.
– Мы давно работаем по разным направлениям – разным тканям. Материал для больных атеросклерозом решили делать, прочитав условия конкурса РНФ и проанализировав свои возможности, потому что мы уже пробовали наносить наш полимер на металлические стенты. Написали заявку, но получили грант не сразу. В первый раз, подавая заявку на грант по поддержке научных групп, мы не слишком хорошо прописали часть, касающуюся работы непосредственно в клинике, потому что сами плохо знали ее, а врачи недостаточно активно помогали, хотя мы бегали за ними, как энтомолог с сачком за бабочкой, – вспоминает Екатерина. – Тогда для нас важна была схема забора крови: мы сами не могли грамотно расставить временные точки, чтобы они совпадали с патогенетическими этапами развития заболевания. Мы не знали, какую именно группу больных с ишемией в результате атеросклероза выбрать – их несколько, и схемы ведения и лечения пациентов разные.Мы не знали, какой орган-мишень нам подойдет, чтобы мы технически могли выполнить исследование корректно. В результате остановились на группе пациентов с хронической ишемией сердца, так как они поступают на лечение в плановом порядке и их легче отследить впоследствии. Выручило врожденное упрямство – со второй попытки грант получить удалось. Мы начали подготовку сильно заранее, потратили время на знакомство с другими коллегами-медиками, представили им нашу работу и обозначили ту ее часть, которую не сможем выполнить без их помощи, – и все получилось.
Источник: Ирина Якунина
Совместно с кардиологами был разработан протокол исследования, и теперь специальная машина доставляет в университет, где располагается лаборатория Екатерины, кровь из местного кардиоцентра.
О женщинах в науке
Премия L’Oreal-UNESCO «Для женщин в науке» стремится привлечь внимание к проблеме неравенства в научной среде и повысить статус женщин-исследователей. Ряд исследований, опубликованных недавно в журнале Nature, говорит о том, что женщин в науке меньше, чем мужчин, так, в России это соотношение 40% к 60%. При этом количественный показатель не самый важный – даже если число женщин-ученых и больше, то они редко занимают высокие посты и чаще получают заниженные, по сравнению с мужчинами той же квалификации и того же уровня зарплаты.
Ряд исследований, опубликованных недавно в журнале Nature, говорит о том, что женщин в науке меньше, чем мужчин, так, в России это соотношение 40% к 60%. При этом количественный показатель не самый важный – даже если число женщин-ученых и больше, то они редко занимают высокие посты и чаще получают заниженные, по сравнению с мужчинами той же квалификации и того же уровня зарплаты.
– Когда в конце 2009 года я прилетела из Красноярска в Москву получать эту премию, кто-то из журналистов задавал мне вопросы и вскользь озвучил проблему неравенства полов в науке. До этого момента я даже не задумывалась об этом. Какая проблема? Посмотрите, сколько женщин работает вокруг, в институтах! Множество. А в ответ: а руководящие позиции-то женщины не занимают. Тогда я и поняла, что проблема существует. Я ориентировалась на свою область – медицину, там женщин очень много, и на позициях среднего звена и выше среднего звена тоже. Это уровень зав. отделением, зав. поликлиникой, зам.главного врача. Даже главных врачей-женщин больше, чем женщин-директоров научно-исследовательских институтов и ректоров. В нашей стране проблема стоит острее, чем во многих других странах, при этом в периферийных городах хуже, чем в центральных. И после этого момента постепенно я стала замечать, что существует какой-то шовинизм в науке. Я с очень неприятным удивлением сталкивалась с этим, видела, что когда прихожу куда-то, что-то людям говорю, я с ними разговариваю на равных, а они со мной – нет. Официальная встреча, люди в приличной одежде, вроде бы, культурные, сидят за столом, разговаривают, и все по делу, но мне нужно сказать им больше слов, чтобы они меня поняли, да еще и с какой-то определенной интонацией и тембром. Иначе не слышат, факт. Получается, что женщин на этой встрече две – я и та, которая сидит в приемной и носит кофе, при этом отношение к обеим примерно одно. У женщин есть физиологические особенности, определяющие тип мышления и структурирование работы, но это не аргумент.
Очень неправильно широким плечом отодвигать тех, кто слабее физически. Во всех сферах общественной жизни в наше время женственность учитывается как плюс, а не минус, сейчас это обязательное требование к обществу, признак его развитости, и наука тут не должна отставать.
Сама Екатерина не раз получала намеки на то, что она должна не выделяться, молчать и улыбаться. По словам Екатерины, в этом суть научного-исследовательской работы – эмоциональная вовлеченность исследователя, а в эмоциональности женщинам равных нет.
Екатерина достигла успехов не только в науке, но и в политике: она пять лет работала депутатом Законодательного Собрания Красноярского края. Тогда женщин было пять, в текущем созыве – всего две. От дальнейшей работы в региональной политике Шишацкая отказалась, выбрав науку.
– При помощи стипендий и премий нам необходимо продолжать искусственно поддерживать гендерное равенство, пока процесс не станет естественным, – считает Екатерина.– Если мы не будем этого делать, многим умным девушкам просто не дадут реализовать свои амбиции и планы. Сегодня практически нет никакого джентльменства, нет уважения к женскому полу ни среди политиков, ни среди ученых – когда никто не видит, отодвинут и не постесняются. Этим вопросом надо заниматься, и тогда женщины смогут занять ту самую нишу, вровень с мужчинами, которая должна быть. Женщина имеет больше жестких обязанностей в повседневной жизни, чем мужчина, поэтому она должна тратить меньше часов на свою, в том числе научную работу, и при этом получать равную оплату. Кто из знакомых вам женщин спокойно оставит ребенка в садике, потому что не может его забрать вовремя из-за эксперимента? Или, например, тебе самое время пойти в декрет, а на работе скажут, что этого делать нельзя, потому что получили большой грант и пару лет никаких отпусков не предвидится.
Источник: Ирина Якунина
В лаборатории, где работает Екатерина, – матриархат: большинство научных сотрудников женского пола, а мужчины работают на сервисных позициях. Екатерина уверяет, что так получилось не специально. Как правило, девочки более спокойные и упрямые, и корректно воспринимают замечания по работе. Вид деятельности в такой лаборатории, это рутинная работой с культурами, множество различных манипуляций, требующих большого внимания к мелочам, и, кроме прочего, нужно иметь хорошую мелкую моторику и четкую координацию движений.
Екатерина уверяет, что так получилось не специально. Как правило, девочки более спокойные и упрямые, и корректно воспринимают замечания по работе. Вид деятельности в такой лаборатории, это рутинная работой с культурами, множество различных манипуляций, требующих большого внимания к мелочам, и, кроме прочего, нужно иметь хорошую мелкую моторику и четкую координацию движений.
– Такие люди – совсем не сталевары, – отмечает Шишацкая – надо уметь подмечать мельчайшие изменения в системе и уметь их скорректировать, либо поддержать. Раньше автоматических датчиков в культиваторах не было, и надо было «почувствовать» временную точку, когда добавить субстрат, или взять пробу. Жить одной жизнью с культурой клеток – это определенного рода медитация.
Сама Екатерина в свободное время любит выполнять мелкие работы – бисероплетение, вышивание, вязание.
– Я считаю, что моим примером учить девочку правильно себя вести в обществе не стоит.Пример активной успешной женщины чаще воспринимается, как «бой-баба», а в науке такой образ женщины не уместен, здесь делом занимаются не ради денег, не пропихиваясь и толкаясь, а потому, что интересно. Пока наука интересна женщинам, и пока в ней много активных и любознательных, и при этом хорошо воспитанных и спокойных мужчин, наука будет в полном порядке.
История взята из книги РНФ «Я ученый!»: http://www.rscf.ru/ru/node/rnf-prezentoval-sbornik-istoriy-o-rossiyskikh-uchenykh
Теги
Интервью
НИК «НаноБио» — Научные группы
Изучение механизмов работы систем CRISPR-Cas I типа
Изучение CRISPR-Cas систем и применение их в биотехнологии
Изучение роли системы CRISPR-Cas в физиологии бактерии Clostridioides difficile
Исследование развития инфекции клеток гигантскими бактериофагами
Изучение молекулярных механизмов систем рестрикции-модификации и других защитных систем бактерий от вирусов на уровне одиночных бактериальных клеток
Изучение механизмов деления бактерий
Кинетика сверхбыстрых процессов в молекулах и кластерах
Изучение механизмов работы систем CRISPR-Cas I типа
Описание исследований
Системы CRISPR-Cas являются системами адаптивного иммунитета прокариот и защищают клетки от бактериофагов. На этапе адаптации клетки встраивают фрагменты фаговой ДНК – спейсеры – в CRISPR-кассету в геноме. CRISPR-кассета транскрибируется с образованием коротких крРНК, каждая из которых содержит один спейсер. Белки Cas связываются с крРНК, образуя так называемый эффекторный комплекс, который распознаёт участки комплементарные спейсеру в крРНК и инициирует их расщепление. Этот процесс называется интерференцией.
На этапе адаптации клетки встраивают фрагменты фаговой ДНК – спейсеры – в CRISPR-кассету в геноме. CRISPR-кассета транскрибируется с образованием коротких крРНК, каждая из которых содержит один спейсер. Белки Cas связываются с крРНК, образуя так называемый эффекторный комплекс, который распознаёт участки комплементарные спейсеру в крРНК и инициирует их расщепление. Этот процесс называется интерференцией.
Мы занимаемся изучением механизмов CRISPR-адаптации в бактерии Escherichia coli.
Основные публикации:
Shiriaeva, A.A., Savitskaya, E., Datsenko, K.A., Vvedenskaya, I.O., Fedorova, I., Morozova, N., Metlitskaya, A., Sabantsev, A., Nickels, B.E., Severinov, K., et al. Detection of spacer precursors formed in vivo during primed CRISPR adaptation. Nature Communications, 2019, 10, 4603.
Kurilovich, E., Shiriaeva, A., Metlitskaya, A., Morozova, N., Ivancic-Bace, I., Severinov, K.
 , and Savitskaya, E. Genome Maintenance Proteins Modulate Autoimmunity Mediated Primed Adaptation by the Escherichia coli Type I-E CRISPR-Cas System. Genes, 2019, 10, 872.
, and Savitskaya, E. Genome Maintenance Proteins Modulate Autoimmunity Mediated Primed Adaptation by the Escherichia coli Type I-E CRISPR-Cas System. Genes, 2019, 10, 872.Shiriaeva, A., Fedorov, I., Vyhovskyi, D., and Severinov, K. (2020). Detection of CRISPR adaptation. Biochemical Society Transactions, 2020, 48(1), 257-269 (a review article with original experimental data).
Руководитель группы
Анна Ширяева, PhD
[email protected]
Анастасия Киселёва
Студент ИБСиБ, ВШБиПП
Юлия Цой
Студент ИБСиБ, ВШБиПП
Никита Ваулин
Студент ИФНиТ
Изучение CRISPR-Cas систем и применение их в биотехнологии
Описание исследований
CRISPR-Cas — защитные системы бактерий и архей, которые помогают им справляться с натиском бактериофагов и других мобильных генетических элементов. Работа этих систем основана на действии Cas нуклеаз — белков, в комплексе с направляющими РНК способными распознать геном бактериофага и внести в него разрыв. Это приводит к деградации генома вируса и прекращению распространения инфекции в бактериальной популяции.
Работа этих систем основана на действии Cas нуклеаз — белков, в комплексе с направляющими РНК способными распознать геном бактериофага и внести в него разрыв. Это приводит к деградации генома вируса и прекращению распространения инфекции в бактериальной популяции.
Оказалось, что используя направляющие РНК конкретной последовательности можно направлять Cas нуклеазы на любые участки генома, как бактерий, так и эукариот (растений, животных и даже человека) и вносить в ДНК специфические разрывы. Такой подход можно использовать для генетической инженерии — направленного изменения генома для придания желаемых свойств организму.
CRISPR-Cas системы очень разные, их эволюция прошла долгий и уникальный путь.
Наша группа занимается изучением многообразия CRISPR-Cas систем и поиска новых способов их применения в биотехнологии.
Основные публикации:
Fedorova, I.*; Arseniev, A.
 *; Selkova, P.; Pobegalov, G.; Goryanin, I.; Vasileva, A.; Musharova, O.; Abramova, M.; Kazalov, M.; Zyubko, T.; Artamonova, T.; Artamonova, D.; Shmakov, S.; Khodorkovskii, M.; Severinov, K. DNA Targeting by Clostridium Cellulolyticum CRISPR-Cas9 Type II-C System. Nucleic Acids Research, 2020, 48(4), 2026–2034. DOI: 10.1093/nar/gkz1225.
*; Selkova, P.; Pobegalov, G.; Goryanin, I.; Vasileva, A.; Musharova, O.; Abramova, M.; Kazalov, M.; Zyubko, T.; Artamonova, T.; Artamonova, D.; Shmakov, S.; Khodorkovskii, M.; Severinov, K. DNA Targeting by Clostridium Cellulolyticum CRISPR-Cas9 Type II-C System. Nucleic Acids Research, 2020, 48(4), 2026–2034. DOI: 10.1093/nar/gkz1225.Selkova,P.*; Vasileva,A.*; Pobegalov, G.; Musharova, O.; Arseniev, A.; Kazalov, M.; Zyubko, T.; Shcheglova, N.; Artamonova, T.; Khodorkovskii, M.; Severinov, K. and Fedorova, I. Position of Deltaproteobacteria Cas12e nuclease cleavage sites depends on spacer length of guide RNA. RNA biology, 2020. DOI: 10.1080/15476286.2020.1777378.
Iana Fedorova*, Aleksandra Vasileva*, Polina Selkova, Marina Abramova, Anatolii Arseniev, Georgii Pobegalov, Maksim Kazalov, Olga Musharova, Ignatiy Goryanin, Daria Artamonova, Tatyana Zyubko, Sergey Shmakov, Tatyana Artamonova, Mikhail Khodorkovskii, and Konstantin Severinov, PpCas9 from Pasteurella pneumotropica — a compact Type II-C Cas9 ortholog active in human cells.
 Nucleic Acids Research, 2020 in press.
Nucleic Acids Research, 2020 in press.
Руководитель группы
Яна Фёдорова, PhD
[email protected]
Анатолий Арсениев
Полина Селькова
Александра Васильева
Марина Абрамова
Наталия Щеглова
Макс Казалов
Анастасия Малых
Яна Гатиева
Ирина Французова
(бывший член группы)
Изучение роли системы CRISPR-Cas в физиологии бактерии Clostridioides difficile
Описание исследований
Clostridioides difficile (синоним Clostridium difficile) – это анаэробная, грамположительная, спорообразующая бактерия, которая является одной из самых распространенных патогенных клостридий. C. difficile вызывает внутрибольничные кишечные инфекции, связанные с применением антибиотиков.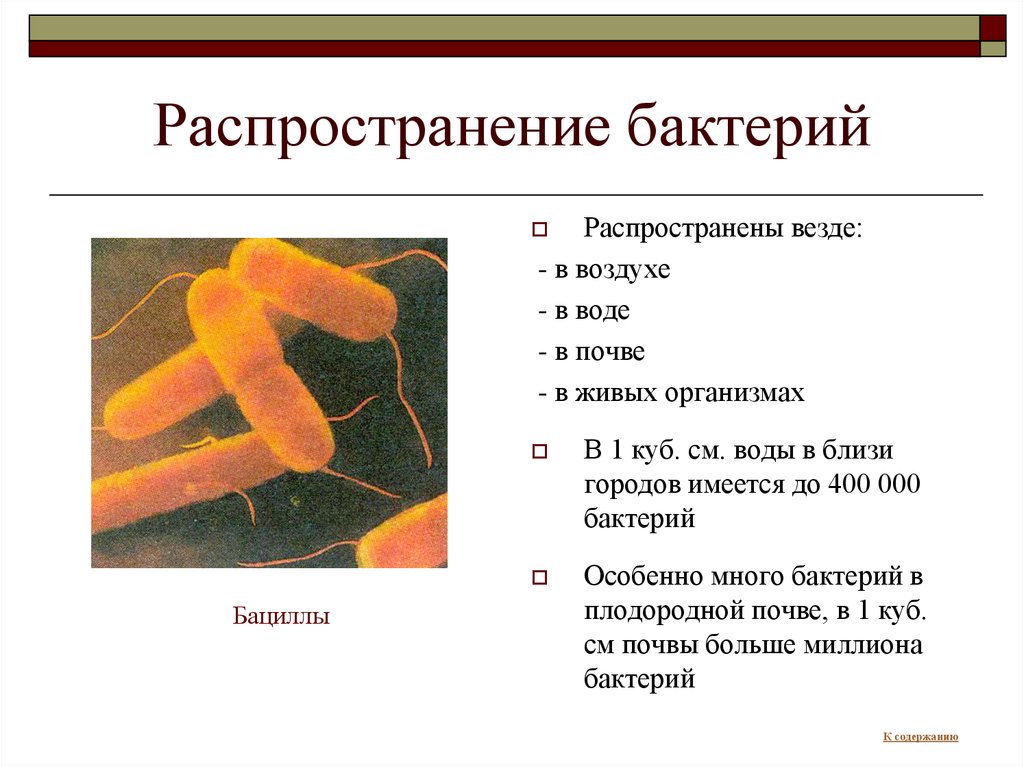 В последнее время число серьёзных инфекций, вызванных C. difficile, значительно возросло в связи с появлением гипервирулентных эпидемических штаммов и штаммов, устойчивых к действию антибиотиков. Поэтому сейчас особенно важен поиск новых подходов для лечения таких кишечных инфекционных заболеваний.
В последнее время число серьёзных инфекций, вызванных C. difficile, значительно возросло в связи с появлением гипервирулентных эпидемических штаммов и штаммов, устойчивых к действию антибиотиков. Поэтому сейчас особенно важен поиск новых подходов для лечения таких кишечных инфекционных заболеваний.
Во время своего инфекционного цикла C. difficile взаимодействует с бактериофагами и другими мобильными генетическими элементами в кишечнике организма-хозяина, используя специальные системы контроля генетического обмена, среди которых недавно обнаруженная активная система СRISPR-Cas. СRISPR-Cas – это системы адаптивного иммунитета бактерий и архей, которые защищают их клетки от инфекции бактериофагов и проникновения других генетических паразитов. СRISPR-Cas система у C. difficile характеризуется нестандартными свойствами, которые не встречаются у других бактерий. Данная система у C. difficile состоит из множественных активно экспрессирующихся CRISPR-кассет, часть из которых находится в профагах, нескольких наборов cas генов подтипа I-B, а также систем токсин-антитоксин I типа, ассоциированных с некоторыми кассетами. Такая сложно устроенная система может играть роль в вирулентности, устойчивости к стрессам, антибиотикам, и в других особенностях физиологии C. difficile. Поэтому ее СRISPR-Cas система может быть использована как основа при разработке новых лекарств.
Такая сложно устроенная система может играть роль в вирулентности, устойчивости к стрессам, антибиотикам, и в других особенностях физиологии C. difficile. Поэтому ее СRISPR-Cas система может быть использована как основа при разработке новых лекарств.
Наша группа изучает особенности функционирования и регуляции системы CRISPR-Cas у лабораторных штаммов C. difficile. Мы изучаем механизмы действия данной системы при защите клеток C. difficile от генетических паразитов. Также мы исследуем регуляцию CRISPR-Cas в различных условиях роста C. difficile и ищем возможные дополнительные функции данной системы в физиологии этой бактерии.
Основные публикации:
Maikova A.*, Peltier J.*, Boudry P., Hajnsdorf E., Kint N., Monot M., Poquet I., Martin-Verstraete I., Dupuy B. and Soutourina O. Discovery of new type I toxin–antitoxin systems adjacent to CRISPR arrays in Clostridium difficile.
 Nucleic Acids Res. 2018; 46(9):4733-4751. DOI:10.1093/nar/gky124
Nucleic Acids Res. 2018; 46(9):4733-4751. DOI:10.1093/nar/gky124Maikova A., Severinov K. and Soutourina O. New insights into functions and possible applications of Clostridium difficile CRISPR-Cas system. Front. Microbiol. 2018; 9:1740. DOI: 10.3389/fmicb.2018.01740
Maikova A., Kreis, V., Boutserin, A., Severinov, K. and Soutourina, O. Using endogenous CRISPR-Cas system for genome editing in the human pathogen Clostridium difficile. Appl. Environ. Microbiol. 2019; 85(20):e01416-19. DOI: 10.1128/AEM.01416-19
Peltier, J., Hamiot, A., Garneau, J.R., Boudry P., Maikova A., Hajnsdorf E., Fortier L.-C., Dupuy B. and Soutourina O. Type I toxin-antitoxin systems contribute to the maintenance of mobile genetic elements in Clostridioides difficile. Commun. Biol. 2020; 3(718). DOI:10.1038/s42003-020-01448-5
Руководитель группы
Анна Майкова, PhD
ann-maikova@yandex. ru
ru
Наталья Березенкова
Маргарита Прохорова
Исследование развития инфекции клеток гигантскими бактериофагами
Описание исследований
Бактериофаги — это вирусы бактерий, представляющие из себя вне бактериальной клетки молекулу нуклеиновой кислоты, упакованной в белковую оболочку. Когда же бактериофаг встречает бактерию, в которой может размножаться, то он переносит внутрь этой бактерии свою наследственную информацию, что запускает программу формирования новых фаговых частиц.
Нашим основным объектом исследования является гигантский бактериофаг phiKZ и родственные ему фаги. За 60 минут, которые проходят с момента впрыска фаговой ДНК phiKZ до выхода новосинтезированных фаговых частиц, кардинально перестраиваютcя все процессы внутри клетки и существенно меняют морфологию бактерии: бактериальный нуклеоид меняет свое положение, уступая центральное место сферическому компартменту, напоминающий ядро эукариотической клетки. Данный компартмент покрыт белковой оболочкой, внутрь которой упаковывается фаговая ДНК и часть белков, участвующих в транскрипции и репликации, кроме того он удерживается в центре клетки за счет тубулин-подобных фаговых белков. Для транскрипции своего генома фаг phiKZ исключительно свои ДНК-зависимые РНК-полимеразы, которых у него две.
Данный компартмент покрыт белковой оболочкой, внутрь которой упаковывается фаговая ДНК и часть белков, участвующих в транскрипции и репликации, кроме того он удерживается в центре клетки за счет тубулин-подобных фаговых белков. Для транскрипции своего генома фаг phiKZ исключительно свои ДНК-зависимые РНК-полимеразы, которых у него две.
Наша группа изучает процессы, происходящие внутри клетки на фоне инфекции фагом phiKZ и механизмы, отвечающие за их осуществление.
Основные публикации:
Danilova Y.A.; Belousova V.V.; Moiseenko A.V.; Vishnyakov I.E.; Yakunina M.V.; Sokolova O.S. Maturation of Pseudo-Nucleus Compartment in P. aeruginosa, Infected with Giant phiKZ Phage, Viruses 2020, 12, 1197
Orekhova, M., Koreshova, A., Artamonova, T., Khodorkovskii, M., Yakunina, M. The study of the phiKZ phage non-canonical non-virion RNA polymerase, Biochemical and Biophysical Research Communications, 2019, doi: 10.
 1016/j.bbrc.2019.02.132
1016/j.bbrc.2019.02.132Lavysh D, Sokolova M, Minakhin L, Yakunina M, Artamonova T, Kozyavkin S, Makarova KS, Koonin EV, Severinov K. The genome of AR9, a giant transducing Bacillus phage encoding two multisubunit RNA polymerases, Journal of Virology – 2016. – Vol. 495. – P. 185-196.
Yakunina M, Artamonova T, Borukhov S, Kira S. Makarova, Severinov K, Minakhin, L. A non-canonical multisubunit RNA polymerase encoded by a giant bacteriophage, Nucleic Acids Research. — 2015. — Vol. 43. – P. 10411-10420.
Natàlia de Martín Garrido, Orekhova M., Yuen Ting Emilie Lai Wan Loong, Anna Litvinova, Kailash Ramlaul, Tatyana Artamonova, Alexei S Melnikov, Pavel Serdobintsev, Christopher H S Aylett, Maria Yakunina. Structure of the bacteriophage PhiKZ non-virion RNA polymerase, Nucleic Acids Research, 2021, Volume 49, Volume 49, Issue 13, P. 7732–7739, doi: 10.1093/nar/gkab539
Руководитель группы
Мария Якунина, к. б.н.
б.н.
[email protected]
Инна Курдюмова
Дарья Антонова
Анна Ничипоренко
Андрей Усатых
Владимир Шутов
Анастасия Зотова
Изучение молекулярных механизмов систем рестрикции-модификации и других защитных систем бактерий от вирусов на уровне одиночных бактериальных клеток
Описание исследований
В живой природе бактерии постоянно подвергаются заражению вирусами, которых называют бактериофагами. Такие вирусы способны чрезвычайно эффективно уничтожать целые бактериальные популяции. Для своей защиты от вирусной инфекции бактерии выработали множество молекулярных механизмов, действующих на совершенно разные части бактериофага на разных стадиях его развития в клетке.
Одними из самых распространённых защитных систем бактерий являются системы рестрикции-модификации. Такие системы действуют за счёт активности эндонуклеазы рестрикции, которая вносит двунитевой разрыв в специфические сайты узнавания на ДНК и метилтрансферазной активности, которая метилирует геном бактерии, защищая его от деградации эндонуклеазой рестрикции. Несмотря на высокий уровень защиты, обеспечиваемый этими системами, в некоторых случаях ДНК инфицирующего бактериофага избегает деградации и подвергается модификации. В результате возникает модифицированное вирусное потомство, полностью устойчивое к действию системы рестрикции-модификации.
Такие системы действуют за счёт активности эндонуклеазы рестрикции, которая вносит двунитевой разрыв в специфические сайты узнавания на ДНК и метилтрансферазной активности, которая метилирует геном бактерии, защищая его от деградации эндонуклеазой рестрикции. Несмотря на высокий уровень защиты, обеспечиваемый этими системами, в некоторых случаях ДНК инфицирующего бактериофага избегает деградации и подвергается модификации. В результате возникает модифицированное вирусное потомство, полностью устойчивое к действию системы рестрикции-модификации.
Мы изучаем влияние вариации экспрессии генов систем рестрикции-модификации на эффективность защиты одиночных бактерий от вируса. Также мы занимаемся изучением механизмов работы других систем защиты бактерий от вируса на уровне одиночных бактерий.
Основные публикации:
Morozova N, Sabantsev A, Bogdanova E, Fedorova Y, Maikova A, Vedyaykin A, et al. Temporal dynamics of methyltransferase and restriction endonuclease accumulation in individual cells after introducing a restriction-modification system.
 Nucleic Acids Research, 2016, 44(2), 790-800. DOI: 10.1093/nar/gkv1490.
Nucleic Acids Research, 2016, 44(2), 790-800. DOI: 10.1093/nar/gkv1490.A. Strotskaya, E. Savitskaya, A. Metlitskaya, N. Morozova, K. Datsenko, E. Semenova, K. Severinov. The action of Escherichia coli CRISPR–Cas system on lytic bacteriophages with different lifestyles and development strategies. Nucleic Acids Research, 2017, 45(4), 1946-1957. DOI: 10.1093/nar/gkx042.
B. Wilcox, I. Osterman, M. Serebryakova, D. Lukyanov, E. Komarova, B. Gollan, N. Morozova, Yu. Wolf, K. Makarova, S. Helaine, P. Sergiev, S. Dubiley, S. Borukhov, K. Severinov. Escherichia coli ItaT is a type II toxin that inhibits translation by acetylating isoleucyl-tRNAIle. Nucleic Acids Research, 2018, 46(15), 7873–7885. DOI: 10.1093/nar/gky560.
Smirnov, S.V., Morozova, N.E., Khodorkovskii, M.A., Severinov, K.V. Fluorescence microscopy study of the effect of Esp1396I restriction-modification system proteins concentrations on protection against lambda phage.
 Journal of Physics: Conference Series, 2018, 1135(1), 012016. DOI: 10.1088/1742-6596/1135/1/012016.
Journal of Physics: Conference Series, 2018, 1135(1), 012016. DOI: 10.1088/1742-6596/1135/1/012016.J. Gordeeva, N. Morozova, N. Sierro, A. Isaev, T. Sinkunas, K. Tsvetkova, M. Matlashov, L. Truncaitė, R.D. Morgan, N.V. Ivanov, V. Siksnys, L. Zeng, K. Severinov. BREX system of Escherichia coli distinguishes self from non-self by methylation of a specific DNA site. Nucleic Acids Research, 2019, 47(1), 253–265. DOI: doi.org/10.1093/nar/gky1125.
Antonova, D.A., Morozova, N.E., Shiryaeva, A.A., Khodorkovskii, M.A. Regulation of type II restriction-modification system Esp1396I. Journal of Physics: Conference Series, 2019, 1400(3), 033024. DOI: 10.1088/1742-6596/1400/3/033024.
Znobishcheva, E.A., Morozova, N.E., Khodorkovskii, M.A. Fluorescent labeling of bacteriophage T7 by CRISPR-Cas9. Journal of Physics: Conference Series, 2019; 1400(3), 033005. DOI: 10.1088/1742-6596/1400/3/033005.

Руководитель группы
Наталия Морозова, к.б.н.
[email protected]
Александр Кириллов
Елена Знобищева
Оксана Котовская
Изучение механизмов деления бактерий
Описание исследований
Цитоскелет – это белковый «каркас» клетки. Долгое время белки цитоскелета считались принадлежностью лишь эукариотических клеток – действительно, зачем бактериям цитоскелет, если они покрыты жесткой клеточной стенкой? Тем не менее, за последние 30 лет у бактерий были обнаружены гомологи всех основных белков цитоскелета эукариот – актина, тубулина и промежуточных филаментов. Эти белки в бактериях принимают участие в различных жизненно важных процессах, в том числе в поддержании формы клетки, сегрегации молекул ДНК, клеточном делении. Одним из важнейших белков бактериального цитоскелета является FtsZ – ключевой белок деления, являющийся гомологом тубулина.
Как именно белок FtsZ участвует в делении бактерий? Многое об этом ещё неизвестно, однако в хорошо изученных видах бактерий, например, в Escherichia coli, роль белка FtsZ в целом ясна. FtsZ в клетке полимеризуется и формирует Z-кольцо, которое является каркасом, своеобразными «строительными лесами» для других белков деления. Именно эти белки, как считается, выполняют основную работу по строительству перегородки между будущими дочерними клетками и некоторые другие функции, а FtsZ лишь направляет эти белки, обеспечивая их слаженную работу. Однако не следует полагать, что о делении бактерий уже всё известно. Какова точная структура Z-кольца? Деформируют ли полимеры FtsZ оболочку клетки? Как делятся бактерии, у которых нет белка FtsZ? На эти и многие другие вопросы ещё предстоит найти ответы.
Наша группа занимается изучением свойств белка FtsZ: мы визуализируем структуры, которые формирует этот белок в бактериальных клетках и в пробирке; определяем, с какими белками он взаимодействует; выясняем, чем отличаются роли и функции белка FtsZ в разных видах бактерий. Кроме того, мы имеем цель выяснить, как делятся бактерии, которые не имеют белка FtsZ. Наконец, нам интересны белки бактерий, которые формируют цитоскелет-подобные структуры.
Кроме того, мы имеем цель выяснить, как делятся бактерии, которые не имеют белка FtsZ. Наконец, нам интересны белки бактерий, которые формируют цитоскелет-подобные структуры.
Основные публикации:
Vedyaykin, A.D., I.E. Vishnyakov, V.S. Polinovskaya, M.A. Khodorkovskii, and A.V. Sabantsev, New insights into FtsZ rearrangements during the cell division of Escherichia coli from single-molecule localization microscopy of fixed cells, Microbiologyopen, 2016, 5(3): 378-386.
Vedyaykin, A.D., A.V. Sabantsev, M.A. Khodorkovskii, A.R. Kayumov, and I.E. Vishnyakov, Recombinant FtsZ Proteins from Mollicutes Interact with Escherichia coli Division Machinery, Bionanoscience, 2016, 6(4): 443-446.
I.E.Vishnyakov, A.D. Vedyaykin, M.A. Khodorkovskii, S.N. Borchsenius, The identification of a protein involved in formation of cytoskeleton-like structures in Mycoplasma gallisepticum cells, 2017, FEBS JOURNAL, 284, 203-203.

A.D. Vedyaykin, E.V. Ponomareva, M.A. Khodorkovskii, S.N. Borchsenius, I.E. Vishnyakov, Mechanisms of Bacterial Cell Division, Microbiology, 2019, 88 (3), 245-260.
A.D. Vedyaykin, A.V. Sabantsev, I.E. Vishnyakov, N.E. Morozova, M.A. Khodorkovskii, Recovery of division process in bacterial cells after induction of SulA protein which is responsible for cytokinesis arrest during SOS-response, Cell and Tissue Biology, 2017, 11 (2), 89-94.
A.D. Vedyaykin, V.S. Polinovskaya, A.V. Sabantsev, M.A. Khodorkovskii, S.N. Borchsenius, I.E. Vishnyakov, Influence of FtsZ proteins from some mycoplasma species on the division process in Escherichia coli cells, Cell and Tissue Biology, 2017, 11 (5), 389-398.
A.D. Vedyaykin, N.A. Rumyantseva, M.A. Khodorkovskii, I.E. Vishnyakov, SulA is able to block cell division in Escherichia coli by a mechanism different from sequestration, Biochemical and Biophysical Research Communications, 2020, Volume 525, Issue 4, 14 May 2020, Pages 948-953.

Руководитель группы
Алексей Ведяйкин, к.б.н.
[email protected]
Иннокентий Вишняков, к.б.н.
Дарья Голофеева
Наталья Румянцева
Дина Беленькая
Кинетика сверхбыстрых процессов в молекулах и кластерах
Описание исследований
Для исследования быстро протекающих процессов используются импульсы света фемтосекундной длительности. Такие импульсы создаются с помощью фемтосекундного лазера на титан-сапфире. Лазерные импульсы (800нм) преобразуются с помощью генератора гармоник (400 и 266 нм) и генератора белого света (излучение суперконтинуума 400-1000 нм). Измерения проводятся методом «возбуждение-зондирование» с помощью линии оптической задержки. Первый импульс приводит к возбуждению объекта, второй импульс приходит к объекту с задержкой и используется для анализа состояния в котором находится объект. Изменяя задержку можно получить информацию о процессах происходящих в исследуемом объекте.
Изменяя задержку можно получить информацию о процессах происходящих в исследуемом объекте.
В нашей группе проводятся исследования быстропротекающих процессов в люминесцентных зондах и кластерах инертных газов. Отметим, что при использовании лазерных фемтосекундных импульсов легко наблюдаются различные нелинейные оптические процессы, в частности многофотонное поглощение.
Люминесцентные зонды широко используются для измерения различных параметров (температура, концентрация кислорода, pH) в биологических исследованиях, медицине, аэрокосмической промышленности и микроэлектронике. Люминесцентный зонд это молекула (или частица) оптические свойства которой сильно зависят от измеряемой величины. Как правило измеряется интенсивность свечения или время жизни возбуждённого состояния.
Одним из способов значительного улучшения свойств люминесцентных зондов является использование их в составе молекулярных диад. Молекулярная диада представляет собой два хромофорных центра, соединённых небольшим ковалентным мостиком. В такого типа молекулярных системах после возбуждения одного хромофорного центра возможен перенос энергии между хромофорами. Использование молекулярных диад, где хромофоры имеют разные функции и обмениваются энергией позволяет варьировать свойства систем в целом (изменить положение полос поглощения и/или эмиссии, увеличить/уменьшить диапазон измерений и.т.д.). Наши исследования направлены на определение механизмов передачи энергии в молекулярных диадах, находящихся в электронно-возбуждённом состоянии.
В такого типа молекулярных системах после возбуждения одного хромофорного центра возможен перенос энергии между хромофорами. Использование молекулярных диад, где хромофоры имеют разные функции и обмениваются энергией позволяет варьировать свойства систем в целом (изменить положение полос поглощения и/или эмиссии, увеличить/уменьшить диапазон измерений и.т.д.). Наши исследования направлены на определение механизмов передачи энергии в молекулярных диадах, находящихся в электронно-возбуждённом состоянии.
Кластеры инертных газов являются удобным объектом модельным объектом для изучения процессов релаксации в многоатомных системах. Для целого ряда многоатомных систем, находящихся в электронно-возбуждённом состоянии основным механизмом релаксации являются безызлучательные процессы. Как правило, их скорость значительно превышает скорость радиационного распада. В многоатомных молекулах со сравнительно большими энергиями связи между атомами основным и часто единственным механизмом безызлучательной релаксации является электронно-колебательное взаимодействие. В кластерах (многоатомных молекулах, нанокаплях) со сравнительно небольшими энергиями связи между атомами появляются дополнительные каналы релаксации (десорбция атомов, ионизация, фрагментация). При этом доминирующий канал релаксации зависит не только от энергии связи между атомами, но и от размера объекта и энергии возбуждения. Несмотря на активное изучение данных процессов в кластерах даже качественные механизмы релаксации на сегодняшний день не всегда ясны. В кластерах ксенона нами был обнаружен ICD-подобный процесс. Данный процесс возможен при одновременном возбуждении двух атомов входящих в кластер. Перенос энергии между двумя соседними возбужденными атомами приводит к ионизации кластера. Характерное время ионизации кластера ксенона в этом процессе составляет ~ 5 пс.
В кластерах (многоатомных молекулах, нанокаплях) со сравнительно небольшими энергиями связи между атомами появляются дополнительные каналы релаксации (десорбция атомов, ионизация, фрагментация). При этом доминирующий канал релаксации зависит не только от энергии связи между атомами, но и от размера объекта и энергии возбуждения. Несмотря на активное изучение данных процессов в кластерах даже качественные механизмы релаксации на сегодняшний день не всегда ясны. В кластерах ксенона нами был обнаружен ICD-подобный процесс. Данный процесс возможен при одновременном возбуждении двух атомов входящих в кластер. Перенос энергии между двумя соседними возбужденными атомами приводит к ионизации кластера. Характерное время ионизации кластера ксенона в этом процессе составляет ~ 5 пс.
Основные публикации:
P.Y. Serdobintsev, A.S. Melnikov, A.A. Pastor, N.A. Timofeev, M.A. Khodorkovskiy, J. Chem. Phys., 2018, V.148, 194301
I.
 Balmaev, P. Serdobintsev, A. Melnikov, A. Pastor, M. Khodorkovskiy, Journal of Physics: Conference Series 1410 (1), 012135
Balmaev, P. Serdobintsev, A. Melnikov, A. Pastor, M. Khodorkovskiy, Journal of Physics: Conference Series 1410 (1), 012135Kisel K.S., Melnikov A.S., Grachova E.V., Hirva P., Tunik S. P., Koshevoy I.O., Chemistry–A European Journal, 2017, V.23, P.11301-11311
Belyaev A., Kolesnikov I., Melnikov A.S., Gurzhiy V.V., Tunik S.P., Koshevoy I.O., New Journal of Chemistry, 2019, V.43, P.13741-13750
Рис. 1. Люминесценция в водном растворе флуоресцеина при двухфотонном возбуждении 800 нм
Рис. 2. Настройка генератора белого света
Рис. 3 Аппаратная функция, измеренная по эффекту наведённого двулучепреломления. Ширина на половине высоты 98 фс
Рис. 4. Эксперимент «возбуждение-зондирование» в струе спиртового раствора Кумарина
Руководитель группы
Алексей Сергеевич Мельников, к.ф.-м.н.
[email protected]
Павел Юрьевич Сердобинцев, к.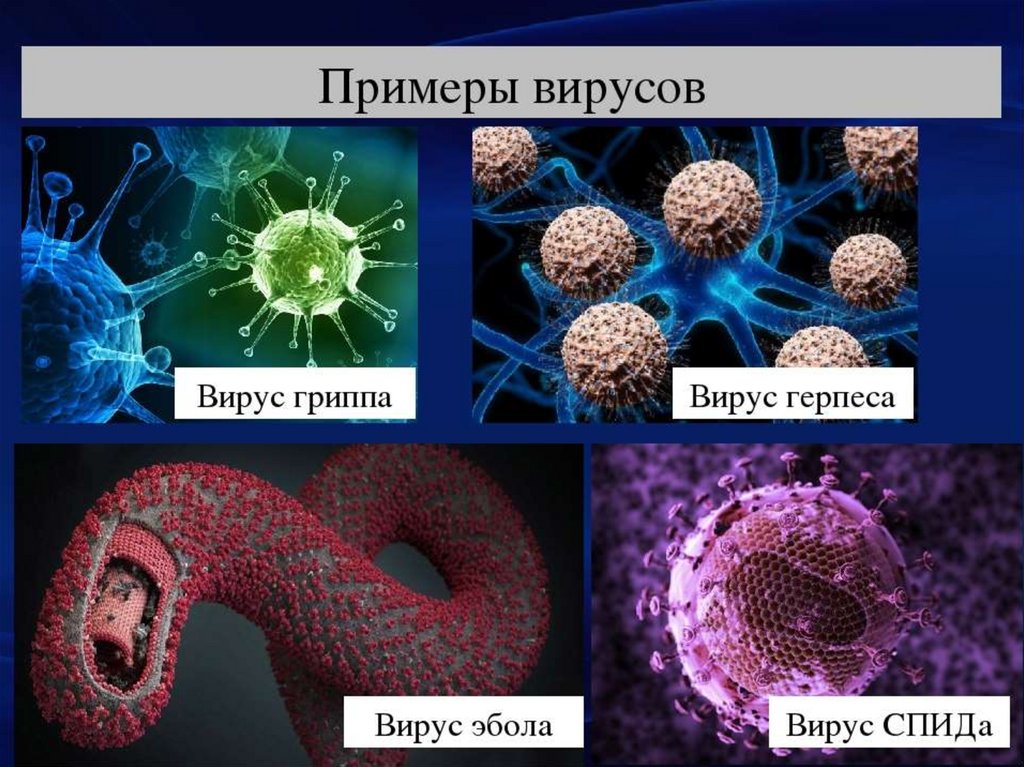 ф.-м.н.
ф.-м.н.
Революция в утилизации отходов: бактерия, пожирающая пластик
- Мэри Халтон
- Отдел науки, Би-би-си
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Для просмотра этого контента вам надо включить JavaScript или использовать другой браузер
Подпись к видео,
Британские ученые открыли «пожиратель пластика»
Ученым удалось усовершенствовать существующий в природе фермент, который способен разлагать некоторые из наиболее распространённых полимеров, загрязняющих окружающую среду.
Наиболее распространенный пластический материал — PET, или полиэтилен, — который используется при производстве бутылок, в течение сотен лет остается неизменным на свалках. Он крайне медленно распадается под воздействием природных факторов.
Модифицированный фермент, получивший обозначение PETase, начинает разлагать этот полимер в течение нескольких дней. Это может привести к революции в деле утилизации пластмассовых отбросов.
Это может привести к революции в деле утилизации пластмассовых отбросов.
- Как пластик стал жертвой собственного успеха
- Англичанам придется сдавать бутылки и банки
- Мусорный остров: крестовый поход против пластика в океане
Только в Британии в течение года приобретается около 13 миллиардов пластмассовых бутылок, из которых более 3 миллиардов никогда не утилизируются и оказываются на свалках.
Находка на свалке
Первоначально этот фермент был обнаружен в Японии. Он является продуктом жизнедеятельности бактерии Ideonella sakaiensis, которая пожирает полиэтилен PET в качестве основного источника энергии.
Автор фото, David Jones
Японские ученые сообщили в 2016 году, что они обнаружили разновидность этой бактерии на заводе по переработке пластиковых бутылок в портовом городе Сакаи.
«Полимер PET стал появляться в огромных количествах только за последние 50 лет, и это не слишком длительный срок для развития бактерий, которые способны поглощать этот искусственный материал», — говорит профессор Джон Макгиан из Портсмутского университета, который участвовал в исследовании.
PET (полиэтилентерефталат) принадлежит к группе сложных полиэфиров, встречающихся в естественных условиях.
«Они присутствуют в листьях растений, — отмечает профессор. — В течение миллионов лет развились бактерии, которые питаются такими полиэфирами».
Автор фото, David Jones
Подпись к фото,
Полимеры класса PET обычно используются в производстве пластиковых бутылок
Однако обнаружение бактерии, способной перерабатывать именно полиэтилены класса PET, было неожиданностью для биохимиков. Была сформирована международная группа ученых, которые поставили целью определение природы и путей эволюции фермента PETase.
Бактерия пожирает пластик
Биохимики создали трехмерную компьютерную модель фермента, применив мощный рентгеновский лазер.
Разобравшись в молекулярной структуре этого фермента, ученые отметили, что эффективность действия PETase можно улучшить, внеся изменения в его поверхностную структуру.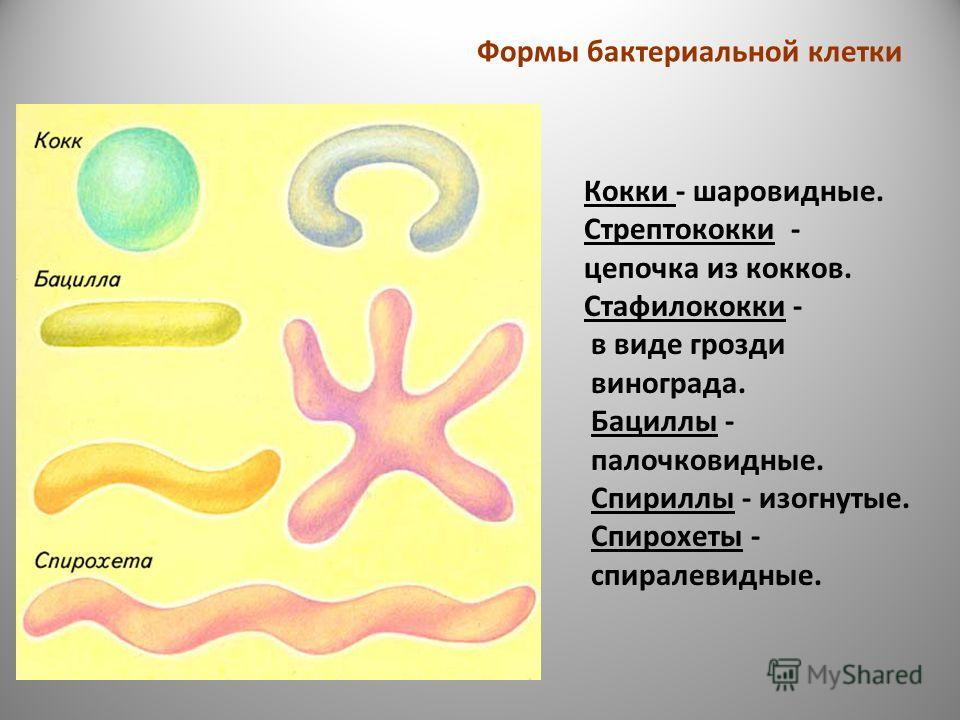
Автор фото, H Lee Woodcock
Подпись к фото,
Модель молекулы фермента PETase позволила усовершенствовать ее эффективность
Это указывает на то, что встречающийся в природе фермент не оптимизирован, и что существует возможность его улучшения.
Фермент PETase испытывался также на полимерах класса PEF, основанных на биоматериалах растительного происхождения, но тоже очень медленно распадающихся в естественных условиях.
«Нас поразило то, что этот фермент еще лучше воздействует на полимеры PEF, чем на полимеры PET», — заявил профессор Макгиан.
Анализ — Дэвид Шукман, отдел науки Би-би-си
В состав группы исследователей в Портсмутском университете входят аспиранты и даже студенты, и когда я побывал в их лаборатории, то не мог не разделить их энтузиазма. Они знают, что изобретение полимера класса PET потребовало больших усилий химиков, и гордятся тем, что им удалось найти способ его ускоренного разложения. Этот полимер используется при производстве миллиардов пластиковых бутылок во всем мире. Нынешнее поколение молодых химиков осознаёт проблему пластикового загрязнения и прилагает все усилия для ее решения.
Этот полимер используется при производстве миллиардов пластиковых бутылок во всем мире. Нынешнее поколение молодых химиков осознаёт проблему пластикового загрязнения и прилагает все усилия для ее решения.
Однако на пути трансформации этого открытия в практически применимую технологию будет немало препятствий. Во-первых, предстоит разработать способы недорогого производства такого фермента в промышленных масштабах; во-вторых, необходимо получить надежные методы его применения и контроля над его действием.
Утилизация замкнутого цикла
Сложные полиэфиры, получаемые при переработке нефти, широко используются при производстве пластиковых бутылок и одежды. Существующие методы их утилизации основаны на снижении их качества на каждом этапе переработки. Например, пластиковые бутылки сначала превращаются в волокно, используемое в производстве одежды, затем в производстве ковров, после чего они часто заканчивают свой путь на свалке.
Автор фото, Dennis Schroeder/NREL
Подпись к фото,
Измененный фермент PETase в течение нескольких дней разлагает пластиковые отходы — изображение с электронного микроскопа
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Фермент PETase обращает этот процесс вспять, превращая сложные полиэфиры в более простые молекулы, которые можно использовать заново.
«Такие молекулы могут использоваться при производстве других полимеров, таким образом исключая из процесса нефть… В этом случае мы создаем замкнутый цикл производства и переработки, что необходимо при полной утилизации», — отмечает профессор Макгиан.
Этот фермент еще далек от промышленного использования. Необходимо ускорить его действие — в настоящее время он требует нескольких дней. В случае промышленного использования утилизация с его помощью должна занимать часы, а не дни.
Но профессор Макгиан надеется, что полученные результаты означают начало крупного сдвига в проблеме утилизации пластиковых отходов.
«В настоящее время остро ощущается потребность уменьшения объемов пластиковых отходов, которые заканчивают свой путь на свалках или попадают в окружающую среду, и если нам удастся применить новые методы, то мы получим решение этой проблемы в будущем», — говорит ученый.
Пять важнейших открытий вирусологии — Российская газета
Самая суть: Вирусы открыл русский учёный, спасая табак от мозаики.
История открытия
В отличие от бактерий, которых ещё в 1676 году описал основатель научной микроскопии Антони ван Левенгук, вирусы в световой микроскоп видны не были. А электронный создали лишь спустя 40 лет после открытия вирусов. Как же их вообще удалось заметить? Благодаря табаку, точнее, его болезни, которая была страшной проблемой для фермеров.
В современный световой микроскоп крупные вирусы увидеть можно. Они выглядят так же, как выглядели бактерии для Левенгука. Просто точки. Но бактерии при этом активно двигаются.
Некротические пятна на листьях табака резко снижали урожай, а главное, из таких листьев не получалось сделать сигары. Производители с подобным положением дел мириться не могли и спонсировали исследования патологии. В 1886 году немецкий агроном Адольф Майер доказал, что «мозаичное заболевание табака», как он окрестил эту напасть, легко передаётся с соком растения, а значит, тут замешан инфекционный агент. Поскольку прогревание при 80 ºС обеззараживало исходный биоматериал (Пастер, напомним, уже изобрёл пастеризацию), Майер решил, что возбудитель болезни — бактерия.
Производители с подобным положением дел мириться не могли и спонсировали исследования патологии. В 1886 году немецкий агроном Адольф Майер доказал, что «мозаичное заболевание табака», как он окрестил эту напасть, легко передаётся с соком растения, а значит, тут замешан инфекционный агент. Поскольку прогревание при 80 ºС обеззараживало исходный биоматериал (Пастер, напомним, уже изобрёл пастеризацию), Майер решил, что возбудитель болезни — бактерия.
Российского ботаника Дмитрия Ивановского болезнь табака волновала ничуть не в меньшей степени. Полагая, что этот недуг вызывают бактерии, Ивановский планировал осадить их на специальном фильтре, поры которого меньше этих организмов. Такая процедура позволяла полностью удалить из раствора все известные патогены. Но экстракт заражённых листьев сохранял инфекционные свойства и после фильтрации!
Этот парадокс, описанный Ивановским в работе 1892 года, стал отправной точкой в развитии вирусологии. При этом сам учёный думал, что сквозь его фильтр прошли мельчайшие бактерии либо выделяемые ими токсины, то есть вписывал своё открытие в рамки существующего знания. Впрочем, это частности. Приоритет Ивановского в открытии вирусов не оспаривается.
Впрочем, это частности. Приоритет Ивановского в открытии вирусов не оспаривается.
Спустя 6 лет голландский микробиолог Мартин Бейеринк, не зная поначалу о работе Ивановского, провёл серию аналогичных экспериментов. То, что патоген проходит сквозь бактериальный фильтр и не может, подобно бактериям, размножаться в питательной среде, привело Бейеринка к выводу, что перед ним новый, неизвестный науке инфекционный агент. Учёный окрестил его «вирусом» (от лат. virus — яд), повторно введя это слово в научный оборот: прежде оно использовалось для обозначения всего агрессивного и токсичного.
Вирус табачной мозаики стал нашим проводником в абсолютно новую область биологии — вирусологию. И в знак признания особых заслуг перед человечеством был первым среди вирусов исследован на электронном микроскопе.
Вирус табачной мозаики до сих пор любим вирусологами: на его основе легко делать вакцины. Одну из них — от COVID-19 — сейчас разрабатывают на биологическом факультете МГУ имени М.В. Ломоносова.
Ломоносова.
Что мы знаем сегодня
Вирусы присутствуют во всех земных экосистемах и поражают все типы организмов: от животных до бактерий с археями. При этом учёные до сих пор спорят, являются ли вирусы живыми существами. Серьёзные аргументы есть и за, и против.
Конечно да! У вирусов есть геном, они эволюционируют и способны размножаться, создавая собственные копии путём самосборки.
Решительно нет! У них неклеточное строение, а именно этот признак считается фундаментальным свойством живых организмов. А ещё у них нет собственного обмена веществ — для синтеза молекул, как и для размножения, им необходима клетка-хозяин.
Впрочем, большинство учёных склонны рассматривать этот спор как чисто схоластический.
2. Как устроены вирусы
Самая суть: Вирус — это генетическая инструкция в белковом контейнере. Расшифровать строение вирусов удалось, превращая их в кристаллы.
История открытия
К началу 1930-х годов всё ещё оставалось непонятным, что такое вирус и как он устроен. И по-прежнему не было микроскопа, в который его можно было бы разглядеть. В числе прочих высказывалась гипотеза, что вирус — это белок. А структуру белков в то время изучали, преобразуя их в кристаллы. Если бы вирус удалось кристаллизовать, то его строение можно было бы изучать методами, разработанными для исследования кристаллов.
И по-прежнему не было микроскопа, в который его можно было бы разглядеть. В числе прочих высказывалась гипотеза, что вирус — это белок. А структуру белков в то время изучали, преобразуя их в кристаллы. Если бы вирус удалось кристаллизовать, то его строение можно было бы изучать методами, разработанными для исследования кристаллов.
В 1932 году Уэнделл Мередит Стэнли отжал сок из тонны больных листьев табака и воздействовал на него разными реагентами. После трёх лет опытов он получил белок, которого не было в здоровых листьях. Стэнли растворил его в воде и поставил в холодильник. Наутро вместо раствора он обнаружил игольчатые кристаллы с шелковистым блеском. Стэнли растворил их в воде и натёр полученным раствором здоровые листья табака. Через некоторое время они заболели. Эти опыты открыли учёным путь к получению и изучению чистых препаратов вируса, а самому Стэнли принесли Нобелевскую премию.
Структуру вируса расшифровала Розалинд Франклин — та самая «леди ДНК», которая впервые получила чёткую рентгенограмму структуры ДНК и умерла за четыре года до вручения Нобелевки за это невероятно важное открытие.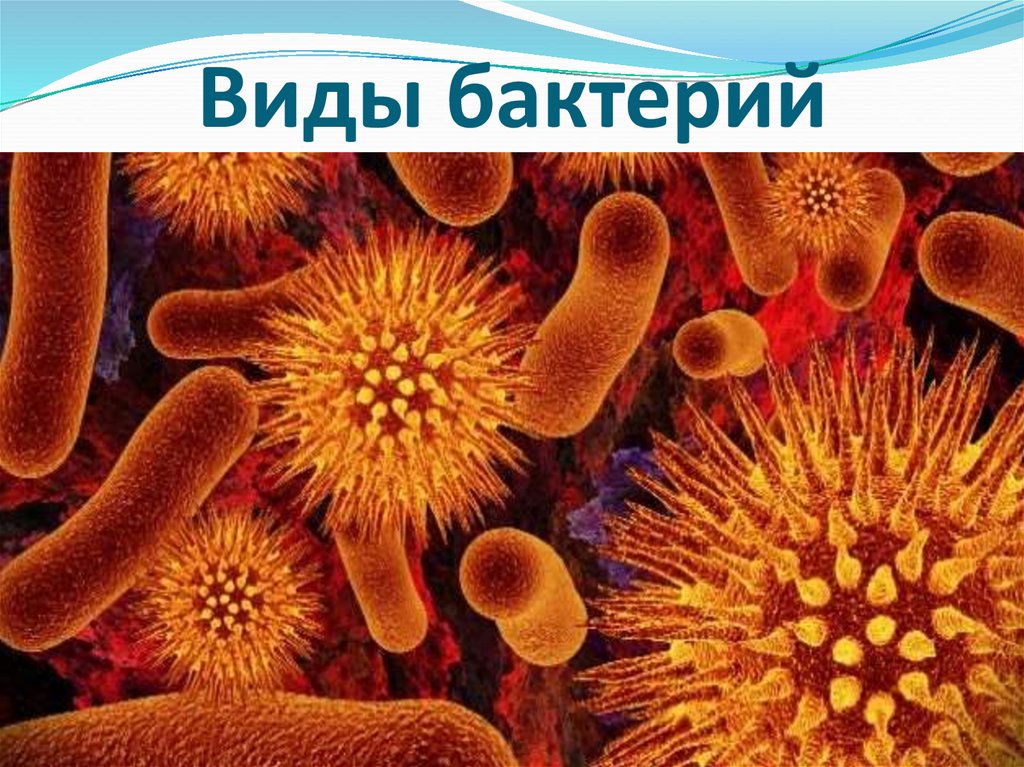 Рассматривая вирус табачной мозаики в рентгеновских лучах, Розалинд поняла, что он представляет собой белковый контейнер, к внутренним стенкам которого прикреплена спираль РНК.
Рассматривая вирус табачной мозаики в рентгеновских лучах, Розалинд поняла, что он представляет собой белковый контейнер, к внутренним стенкам которого прикреплена спираль РНК.
Что мы знаем сегодня
Постепенно накопились данные, позволившие разработать классификации вирусов. Выяснилось, что вирусы различаются по типу молекул ДНК или РНК, на которых записана их генетическая программа. Другое различие — по форме белкового контейнера, который называется капсид. Бывают спиральные, продолговатые, почти шарообразные капсиды и капсиды сложной комплексной формы. Многие капсиды имеют ось симметрии пятого порядка, при вращении вокруг которой пять раз совпадают со своим первоначальным положением (как у морской звезды).
У некоторых вирусов капсид заключён в дополнительную оболочку, суперкапсид, которая состоит из слоя липидов и специфичных вирусных белков. Последние часто формируют выросты-шипы — ту самую «корону» коронавируса. Вирусы с такой оболочкой называют «одетыми», а без неё — «голыми».
Необходимость кристаллизовать вирусы для их изучения отпала лишь недавно с появлением атомных силовых микроскопов и лазеров, генерирующих сверхкороткие импульсы.
3. Кто такие фаги
Самая суть: Большая часть вирусов — «пожиратели бактерий», хоть никого и не жрут. Фаг может убить бактерию, а может сделать из неё зомби. Для нас это хорошо.
История открытия
В конце XIX века британский бактериолог Эрнест Ханкин, сражавшийся с холерой в Индии, изучал воды рек Ганг и Джамна, которые местные жители считали целебными. Ханкин, энтузиаст кипячения воды и теории Пастера о том, что болезни вызываются микроорганизмами, а не миазмами (вредоносными испарениями — так думали врачи ещё в середине XIX века), обнаружил, что суеверные индусы правы: какой-то неопознанный объект непонятным образом обеззараживает воду священных рек без всякого кипячения.
Лишь спустя двадцать лет неопознанному объекту придумали название: Феликс Д’Эрелль из Института Пастера предложил называть этих существ «бактериофагами», в переводе с греческого — «пожирателями бактерий». Он пришёл к выводу, что бактериофаги — вирусы, паразитирующие на бактериях.
Он пришёл к выводу, что бактериофаги — вирусы, паразитирующие на бактериях.
Сейчас их нередко зовут просто фагами. Эти вирусы прикрепляются к стенкам бактерий и впрыскивают в них свой генетический материал. Попав внутрь, генетическая программа вируса запускает производство новых вирусов. В итоге одни ферменты бактерии создают копии вирусного генома, другие — строят по вшитым в него инструкциям белки, третьи — собирают мириады клонов. Порабощённая фагом бактерия превращается в фабрику по созданию его клонов, которые могут выходить наружу вместе с метаболитами или «взрывать» бактериальную клетку. Так или иначе полчища клонов освобождаются и отправляются заражать всё новые бактерии.
Для бактерии встреча с фагами не всегда заканчивается печально: бактериофаги бывают вирулентными и умеренными. Если клетке не повезёт и она повстречает вирулентного фага, то погибнет (у биологов этот процесс называется лизисом). Фаг использует такую клетку как ясли для своего потомства. Умеренные фаги обычно более дружелюбны.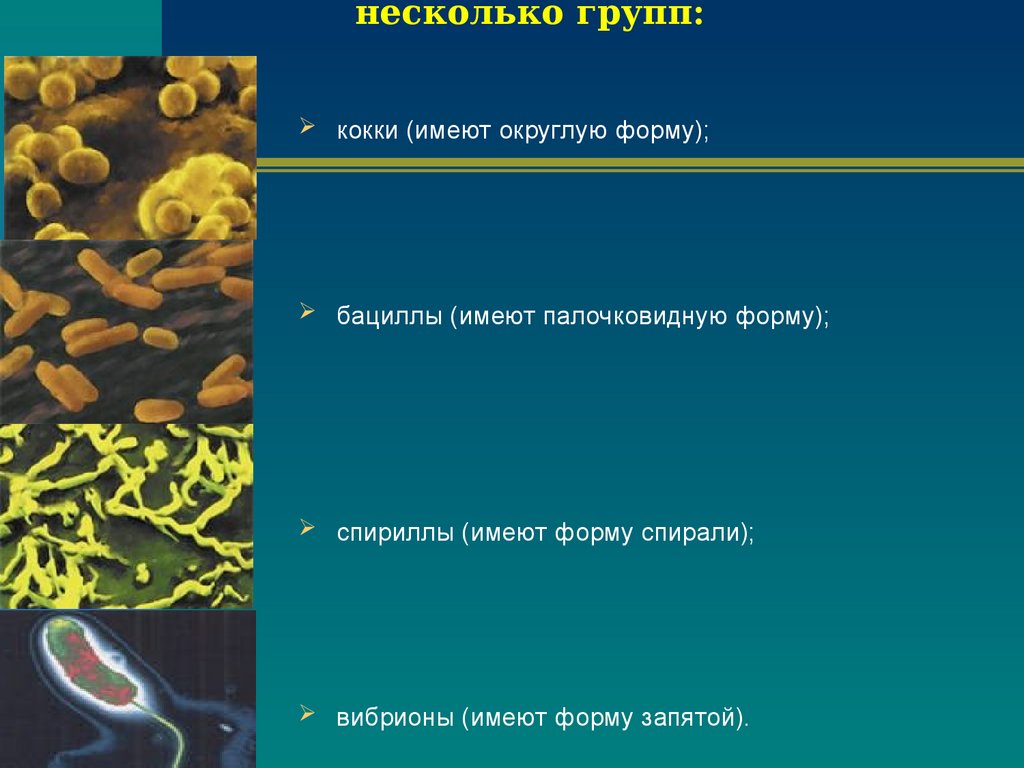 Они делают из бактерии зомби: она переходит в особую форму — профаг, когда вирус интегрируется в геном клетки и сосуществует с ней. Это сожительство может стать симбиозом, в котором бактерия приобретёт новые качества и эволюционирует.
Они делают из бактерии зомби: она переходит в особую форму — профаг, когда вирус интегрируется в геном клетки и сосуществует с ней. Это сожительство может стать симбиозом, в котором бактерия приобретёт новые качества и эволюционирует.
Способность вирусов уничтожать вредоносные бактерии привлекла к ним внимание учёных. Впервые фагов, этих цепных собак биологов, натравили на стафилококк ещё в 1921 году. Их активно изучали в Советском Союзе. Основоположник этого направления грузинский микробиолог Георгий Элиава был учеником Феликса Д’Эрелля. По его инициативе в 30-е годы был создан Институт исследования бактериофагов в Грузии, а позднее фаготерапия в СССР получила одобрение на самом высоком уровне. Были разработаны стрептококковый, сальмонеллёзный, синегнойный, протейный и другие фаги.
Западные учёные отнеслись к фагам с меньшим энтузиазмом. Фаги очень чувствительные и в неподходящих условиях внешней среды теряют супергеройские способности. А тут как раз открыли и успешно применили первый антибиотик, и о фагах надолго позабыли.
Что мы знаем сегодня
В последнее время интерес к фагам стал возрождаться. Невероятная адаптивность позволила бактериям развить устойчивость к антибиотикам, в результате чего появились супербактерии, резистентные ко всем видам лекарств. Ежегодно от болезней, вызванных такими патогенами, умирает около 700 тысяч человек. И фаги могут нам помочь. Главный недостаток бактериофагов — они умеют атаковать только конкретные виды бактерий, поэтому, чтобы справиться со всеми, с кем необходимо, требуется разработка широкого спектра фагов.
В 2005 году биологи из Университета Сан-Диего показали, что вирусы — самые распространённые биологические объекты на планете, и больше всего среди них именно бактериофагов.
Всего на данный момент описано более 6 тысяч видов вирусов, но учёные предполагают, что их миллионы.
4. Как создали первую вакцину
Самая суть: Вакцинация — одно из величайших изобретений человечества, благодаря которому многие смертельные заболевания остались в истории. Но почему слово «вакцина» происходит от слова «корова»?
Но почему слово «вакцина» происходит от слова «корова»?
История открытия
Главное событие в истории вакцинации произошло в конце XVIII века, когда английский врач Эдвард Дженнер использовал коровью оспу для предотвращения оспы натуральной — одного из самых страшных заболеваний в истории, смертность от которого тогда достигала полутора миллионов человек в год.
Коровья оспа передавалась дояркам, протекала легко и оставляла на руках маленькие шрамы. Сельские жители хорошо знали, что переболевшие коровьей оспой не болеют человеческой, и эта закономерность стала отправной точкой для исследований Дженнера.
Предотвращение распространения Variola vera — натуральной оспы — главное событие в истории вакцинации Фото: iStock
Хотя идея была не нова: ещё в Х веке врачи придумали вариоляцию — прививку оспенного гноя от заболевшего к здоровому. На Востоке вдыхали растёртые в порошок корочки, образующиеся на местах пузырьков при оспе. Из Китая и Индии эта практика расходилась по миру вместе с путешественниками и торговцами. А в Европу XVIII века вариоляция пришла из Османской империи: её привезла леди Мэри Уортли-Монтегю — писательница, путешественница и жена британского посла. Так что самому Дженнеру оспу привили ещё в детстве. Вариоляция действительно снижала смертность в целом, но была небезопасна для конкретного человека: в 2% случаев она приводила к смерти и иногда сама вызывала эпидемии.
А в Европу XVIII века вариоляция пришла из Османской империи: её привезла леди Мэри Уортли-Монтегю — писательница, путешественница и жена британского посла. Так что самому Дженнеру оспу привили ещё в детстве. Вариоляция действительно снижала смертность в целом, но была небезопасна для конкретного человека: в 2% случаев она приводила к смерти и иногда сама вызывала эпидемии.
Фото: Луи Пастер
Но вернёмся к коровам. Предположив близкое родство вирусов коровьей и натуральной оспы, Дженнер решился на публичный эксперимент. 14 мая 1796 года он привил коровью оспу здоровому восьмилетнему мальчику, внеся экстракт из пузырьков в ранки на руках. Мальчик переболел лёгкой формой оспы, а введённый через месяц вирус настоящей оспы на него не подействовал. Дженнер повторил попытку заражения через 5 месяцев и через 5 лет, но результат оставался тем же: прививка коровьей оспы защищала мальчика от оспы натуральной.
Дженнеру потребовались годы, чтобы убедить коллег-врачей в необходимости вакцинации, — и эпидемии оспы в Европе наконец были остановлены. Идеи Дженнера развивал великий Луи Пастер: он ввёл термин «вакцина» (от латинского vacca — корова), описал научную сторону вакцинации, создал вакцины против сибирской язвы, бешенства, куриной холеры и убедил мир, что прививки необходимы для предотвращения многих болезней.
Идеи Дженнера развивал великий Луи Пастер: он ввёл термин «вакцина» (от латинского vacca — корова), описал научную сторону вакцинации, создал вакцины против сибирской язвы, бешенства, куриной холеры и убедил мир, что прививки необходимы для предотвращения многих болезней.
Что мы знаем сегодня
В 1980 году Всемирная организация здравоохранения объявила о полном устранении натуральной оспы. Это первое заболевание, которое победили с помощью массовой вакцинации.
После прививки в организме вырабатывается такой же иммунитет, как после перенесённого заболевания. При этом даже не нужно встречаться с живым патогеном. Обычно в вакцинах содержится его часть, например поверхностный белок, или сам вирус, но ослабленный или убитый. Такой агент, его называют антигеном, учит иммунную систему распознавать его как врага и уничтожать в будущем. В следующий раз, когда в организм попадёт настоящий вирус или бактерия, специфичные антитела — иммунные белки — «подсветят» его для клеток иммунной системы, которые тут же мобилизуются и уничтожат патоген.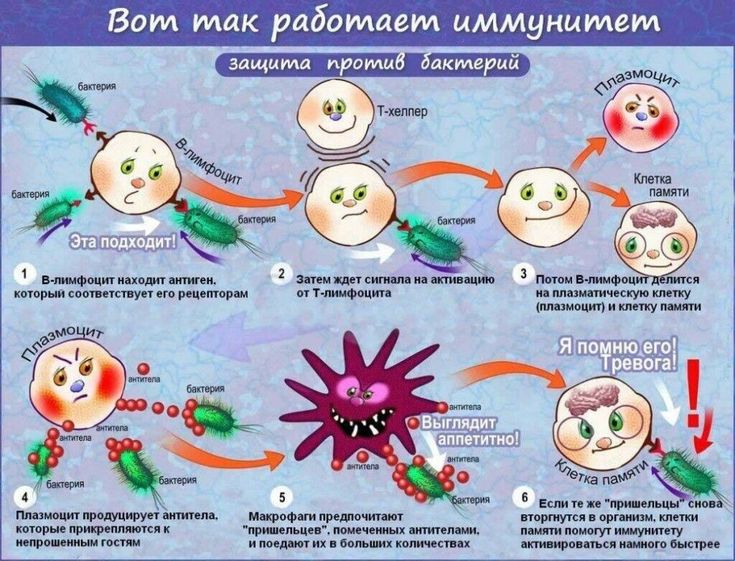
Сейчас существует более сотни вакцин, защищающих от 40 вирусных и бактериальных заболеваний. Иммунизация спасает миллионы жизней, поэтому наши дети не умирают от столбняка, поцарапавшись на улице.
Современные вакцины, прошедшие все стадии клинических испытаний, безопасны — они могут вызвать сильную иммунную реакцию у некоторых людей, но никак не тяжёлую форму болезни с летальным исходом или тем более эпидемию.
5. Как вирусы поселились в нашей ДНК
Самая суть: В геноме человека затаились древние вирусы. Они составляют более 8% нашей ДНК. И мы им многим обязаны.
История открытия
В 1960-х годах учёные поняли, что некоторые вирусы могут вызывать рак. Одним из них был вирус птичьего лейкоза, угрожавший всему птицеводству. Вирусологи выяснили, что он относится к группе так называемых ретровирусов, внедряющих свой генетический материал в ДНК клетки-носителя. Такая ДНК будет производить новые копии вируса, но если вирус по ошибке встроился не в то место ДНК, клетка может стать раковой и начать делиться. Вирус птичьего лейкоза оказался очень странным ретровирусом. Учёные находили его белки в крови совершенно здоровых куриц.
Вирус птичьего лейкоза оказался очень странным ретровирусом. Учёные находили его белки в крови совершенно здоровых куриц.
Робин Вайс, вирусолог из Университета Вашингтона, первым понял, что вирус мог интегрироваться в ДНК курицы, стать её неотъемлемой и уже неопасной частью. Вайс и его коллеги обнаружили этот вирус в ДНК многих пород кур. Отправившись в джунгли Малайзии, они изловили банкивскую джунглевую курицу, ближайшую дикую родственницу домашней, — она несла в ДНК тот же вирус! Когда-то давно иммунная система куры-предка сумела подавить вирус, и, обезвреженный, он стал передаваться по наследству. Учёные назвали такие вирусы эндогенными, то есть производимыми самим организмом.
Вскоре выяснилось, что эндогенных ретровирусов полно в геномах всех групп позвоночных. А в 1980 году их обнаружили и у человека.
Что мы знаем сегодня
Согласно данным исследователей из Мичиганского университета, на долю эндогенных ретровирусов приходится более 8% нашего генома. При этом обнаружены далеко не все вирусные последовательности, которые осели в геноме человека. Искать их сложно: они встречаются у одного и отсутствуют у другого.
Искать их сложно: они встречаются у одного и отсутствуют у другого.
Некоторые эндогенные вирусы остаются опасными, но большинство уже неспособно запустить вирусную программу и захватить мир. До недавнего времени их считали «генетическим мусором». Но оказалось, что порой интеграция вирусов в ДНК ведёт к появлению полезных генетических программ. Например, многие участки ДНК, которые регулируют активность генов, участвующих во врождённом иммунитете, являются ретровирусами. А недавно российские учёные обнаружили у человека эндогенный ретровирус, регулирующий работу мозга и отсутствующий у других приматов, — получается, мы обязаны вирусам какими-то важнейшими своими особенностями! Правда, этот же вирус, возможно, привёл к возникновению шизофрении.
Друзья или враги нам эндогенные ретровирусы, сказать сложно, потому что нет уже деления на нас и них, — мы соединились в одно существо.
Тест Бактерии для подготовки к ЦТ и ЕГЭ
Тест. Бактерии.
1. Наука о микроскопических организмах называется:
1) микология;
2) микробиология;
3) бактериология;
4) цитология.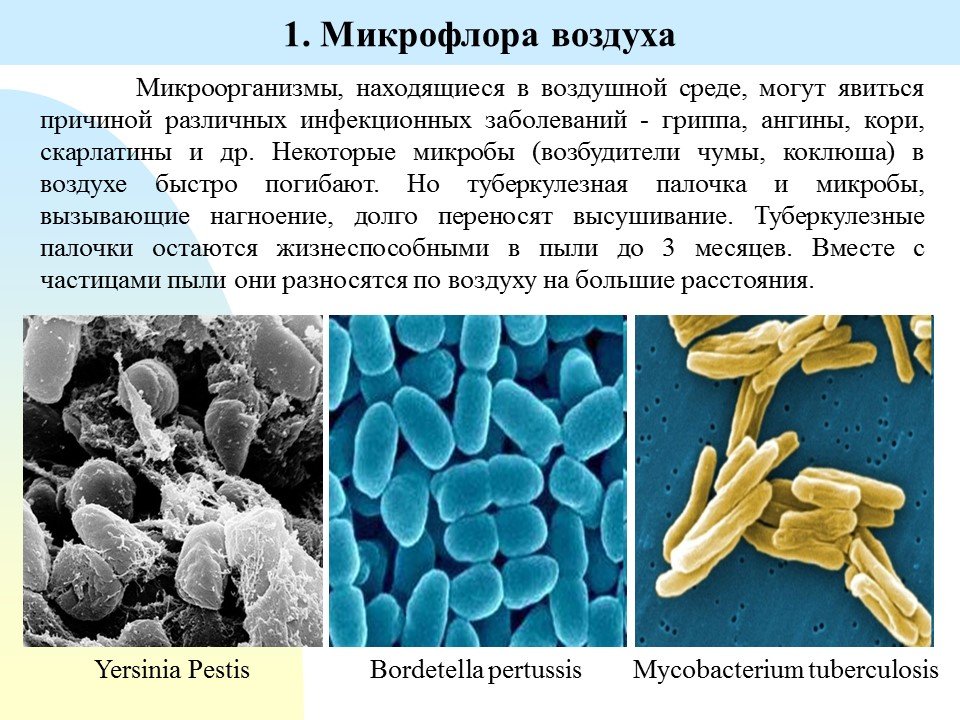
2. Бактерии, имеющие форму палочки, называются:
1) кокки;
2) спириллы;
3) вибрионы;
4) бациллы.
3. Организмы, которые не имеют оформленного ядра, относятся к:
1) многоядерным;
2) прокариотам;
3) эукариотам;
4) не знаю.
4. Бактерии, которые питаются органическими веществами живых организмов, называются:
1) сапрофиты;
2) хемотрофы;
3) фототрофы;
4) паразиты.
5. Бактерии размножаются делением материнской клетки:
1) на две новые клетки;
2)на три новые клетки;
3) на четыре новые клетки;
6. Некоторые виды бактерий способны десятки лет сохранять жизнеспособность, так как они:
1) имеют постоянную форму тела;
2) участвуют в круговороте веществ;
3) питаются органическими веществами;
4) при неблагоприятных условиях образуют спору.
7. Клубеньковые бактерии обогащают почву:
1) соединениями азота;
2) соединениями серы;
3) углекислым газом;
4) кислородом.
8. Заболевание, вызываемое бактериями:
1) грипп;
2) холера;
3) чесотка;
4) лишай.
9. Что не относится к мерам борьбы с болезнетворными бактериями:
1) соблюдение правил личной гигиены;
2) термическая обработка пищи и воды;
3) прививки и вакцины;
4) употребление овощей прямо с грядки.
10. Бактерии легко переносят жару и мороз, так как
1) быстро размножаются
2) не дышат, не растут
3) могут не питаться
4) могут образовывать споры
11. Наука о бактериях называется:
1) орнитология; 2) бактериология;
3) цитология; 4) паразитология.
12.Бактерии, имеющие форму запятой, называются:
1)кокки; 2) спириллы; 3) вибрионы; 4) бациллы.
13.Ядерное вещество у бактерий:
1) находится в вакуолях;
2) находится в ядре;
3) распределено в цитоплазме;
4) не знаю.
14.Бактерии, которые питаются органическими веществами мёртвых организмов или выделениями живых организмов, называются:
1) сапрофиты; 2) хемотрофы;
3) фототрофы; 4) паразиты.
15.Споры бактерий служат:
1) для размножения;
2) для выживания в неблагоприятных условиях;
3) для питания;
4) для дыхания.
16.Аэробы – это бактерии, которые живут в среде:
1) бескислородной;
2) кислородной;
3) то в кислородной, то в бескислородной;
4) им это безразлично.
17.Тесная связь между организмами, полезная как одному, так и другому, называется:
1) паразитизм; 2) симбиоз; 3) аутизм; 4) не знаю.
18.Заболевание, вызываемое бактериями:
1) краснуха; 2) чума; 3) чесотка; 4) лишай. 19.Болезнетворные бактерии могут вызвать заболевания:
1) людей; 2) животных; 3) растений; 4) всех перечисленных организмов
20.Что не относится к мерам борьбы с болезнетворными бактериями:
1)употребление немытых фруктов;
2) применение антибиотиков;
3)применение иода;
4) кипячение воды.
21.Поверхностный слой клеточной стенки бактерий часто вырабатывает дополнительный слой — капсулу. для чего служит бактериальная капсула?
для чего служит бактериальная капсула?
1)содержит наследственную информацию клетки
2)выполняет защитную функцию, защищает клетку от высыхания и поедания другими организмами
3)для проведения в клетку воды и растворенных в ней веществ
4)для передвижения клетки
22.Бактерии — организмы
1)многоклеточные
2)одноклеточные и многоклеточные
3)всегда одноклеточные
4)колониальные.
23.Наследственная информация бактерии находится
1)в жгутиках
2)в центральной части цитоплазмы
3)в ядре
4)в рибосомах.
24. Бактериальная клетка в отличие от растительной клетки
1)не содержит ядра
2)не имеет цитоплазму
3)не имеет рибосомы
4)сложно устроена.
25. Бактерии передвигаются при помощи
1)капсулы
2)движения цитоплазмы
3)жгутиков
4)нет правильного ответа
26. Заражение болезнетворными бактериями может происходить
1) капельно-воздушным путём
2) при употреблении продуктов и воды, содержащих болезнетворные бактерии.
3) при контакте с больными людьми и животными
4) всё перечисленное верно
27. В симбиоз с бобовыми растениями могут вступать
1)цианобактерии
2)клубеньковые бактерии
3)все почвенные бактерии
4)любые бактерии.
28. Бактерии-сапротрофы способны сами 1)производить органические вещества
2)способны к фотосинтезу
3)питаются готовыми органическими веществами отмерших организмов
4)питаются готовыми органическими веществами живых организмов.
29. Цианобактерии в отличие от других групп бактерий
1)способны выделять кислород в процессе фотосинтеза
2)питаются готовыми органическими веществами
3)содержат ядро
4)способны существовать в бескислородной среде
30. Бактерии можно обнаружить
1)в воде
2)в воздухе
3)в почве
4)всё перечисленное верно
31.Органеллы бактериальных клеток – это:
1) ядро , митохондрии , пластиды;
2) комплекс Гольджи , эндоплазматическая сеть , рибосомы;
3) рибосомы;
4) хлоропласты , рибосомы.
32. Нуклеоид – это:
1) ДНК – содержащая зона клетки прокариот;
2) ядро; 3) азотистое основание.
33. По способу питания бактерии являются:
1) автотрофами; 2) гетеротрофами; 3) миксотрофами; 4) 1 и 2 вместе; 5) 1 , 2 и 3 вместе.
34. Что такое конъюгация у бактерий?
1) нерасхождение клеток после деления;
2) образование колонии;
3) способ прямой передачи участка ДНК от одной бактериальной клетки к другой.
35. Азотфиксация – это:
1) расщепление органических веществ бактериями с выделением аммиака;
2) процесс превращения бактериями аммонийных солей в нитраты;
3) процесс превращения бактериями аммиака в аммонийные соли и нитраты;
4) связывание азота воздуха и перевод его в соединения , доступные растениям .
36. Колонии шаровидных бактерий в форме гроздей — это:
1) стрептококки; 2) диплококки; 3) стафилококки; 4)сарцины.
37. Мезосома бактерий – это:
1) впячивания мембраны , на которых локализованы дыхательные и фотосинтезирующие ферменты;
2) органеллы выделения;
3) места отложения в запас питательных веществ;
4) органеллы , участвующие в делении бактериальной клетки.
38. В благоприятных условиях бактериальная спора:
1) делится; 2) сливается с другой спорой;
3) набухает и прорастает в новую клетку бактерии.
39. Автотрофные бактерии являются:
1) фотосинтетиками; 2) хемосинтетиками;
3) фото- и хемосинтетиками.
40. Метаболические пути бактерий , сопровождающиеся синтезом АТФ:
1) брожение; 2) фотосинтез; 3) 1 и 2 вместе; 4) дыхание; 5) 1 , 2 и 4 вместе.
41. Минерализация – это:
1) процесс превращения перегноя в минеральные вещества , которые доступны растениям;
2) накапливание минеральных веществ в телах живых организмов;
3) пропитка оболочек растительных клеток солями кальция и кремнеземом.
42. Сапрофитные бактерии осуществляют:
1) гниение; 2) брожение; 3) фотосинтез; 4) 1 и 2 вместе; 5) хемосинтез.
43. Найдите соответствие между группой бактерий и соответствующими им признаками:
Группа бактерий
А) болезнетворные
Б) молочнокислые
Характерные признаки
1. сапротрофы
сапротрофы
2. паразиты
3. возбудители заболеваний
4. наличие ядерного вещества
5. получение продуктов питания
6. наличие ядра
Ответы. Бактерии.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||||||||
1 | х | х | ||||||||||||||||||
2 | х | х | х | |||||||||||||||||
3 | ||||||||||||||||||||
4 | х | х | х | х | х | |||||||||||||||
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | ||||||||||
1 | х | х | ||||||||||||||||||
2 | х | х | х | х | х | х | ||||||||||||||
3 | х | х | ||||||||||||||||||
4 | х | |||||||||||||||||||
22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | ||||||||||
1 | х | х | х | |||||||||||||||||
2 | х | х | ||||||||||||||||||
3 | х | х | х | х | ||||||||||||||||
4 | х | х | ||||||||||||||||||
33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | |||||||||||
1 | х | х | х | |||||||||||||||||
2 | ||||||||||||||||||||
3 | х | х | х | х | ||||||||||||||||
4 | х | х | ||||||||||||||||||
5 | х | |||||||||||||||||||
43.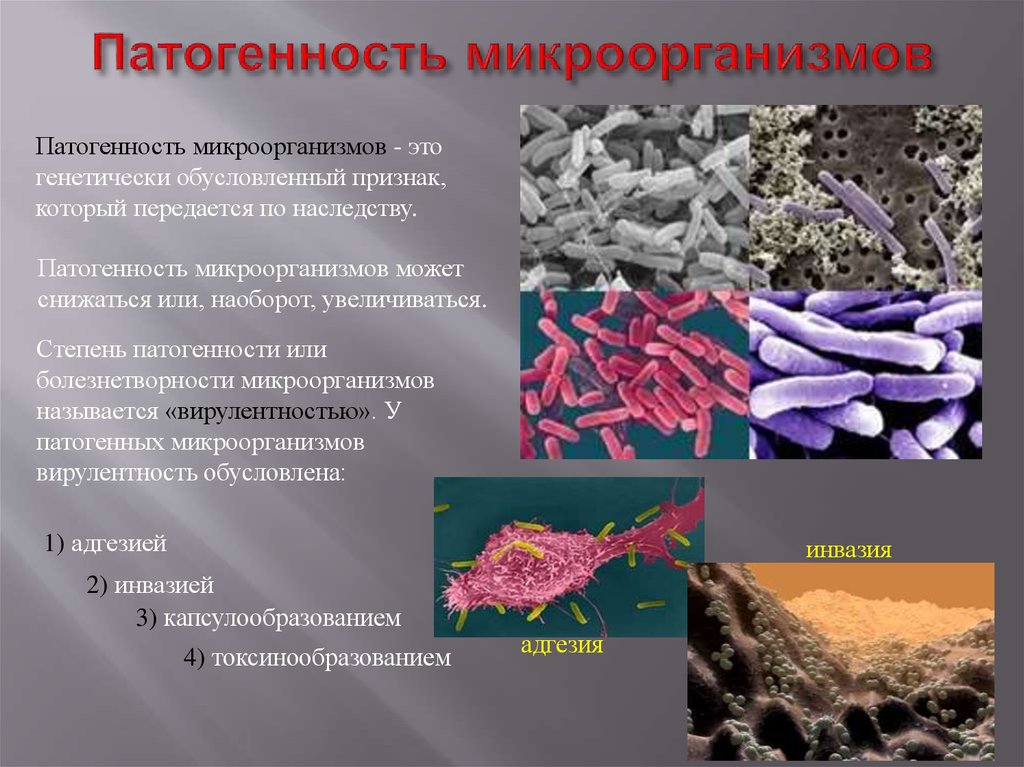 А-2,3,4 Б-1,4,5
А-2,3,4 Б-1,4,5
Микробиология XXI века – аналитический портал ПОЛИТ.РУ
Мы публикуем текст лекции доктора биологических наук, заместителя директора Института микробиологии им. С.Н. Виноградского РАН, заведующей лабораторией гипертермофильных микробных сообществ в том же Институте Елизаветы Александровны Бонч-Осмоловской«Микробы или их сообщества: что является объектом микробиологии в XXI веке?», прочитанной 10 марта 2011 года в Политехническом музее в рамках проекта «Публичные лекции Полит.ру».
Текст лекции
Во-первых, хочу поблагодарить организаторов за то, что меня пригласили. Это очень почетно, кроме того, оказалось, что очень интересно посмотреть на свою область науки со стороны, каким-то свежим взглядом, и представить, как это воспримут люди, которые занимаются совсем другими вещами. Так что за это тоже спасибо. Для меня это было не только интересно, но даже, я думаю, и полезно. Во-вторых, хочу немедленно откреститься от того, что сказал Борис, потому что хотела я говорить о микробиологии сугубо сегодняшней и завтрашней, но настолько интересна ее история, что меня, наоборот, понесло в далекое прошлое. Но, однако, до сегодняшнего дня я тоже добралась.
Но, однако, до сегодняшнего дня я тоже добралась.
Борис Долгин: У нас будет возможность продолжить в вопросах.
Елизавета Бонч-Осмоловская: Микробиологией я занимаюсь всю свою жизнь, рабочую, научную, то есть больше 30 лет. И на моей памяти произошло несколько таких крутых поворотов, переломов, которые в корне меняли представление людей, работающих в этой науке, о том, чем они занимаются и к чему они стремятся. По-моему, это все очень интересно, и об этом я и собираюсь вам рассказать. Содержание моего рассказа будет следующее.
Начать я хочу с определения общей микробиологии и того, чем она занимается, потому что, по моему опыту, у большинства людей, особенно у не биологов, представление о микробиологии несколько другое, и общая микробиология находится явно где-то на задворках в этом представлении. Хочу эту ситуацию исправить. Попутно хочу рассказать о микробной экологии и о том, чем она отличается от общей экологии, потому что она тоже совершенно особая, совершено другая наука. И потом, как я уже сказала, исторический экскурс будет по ХХ веку, так как все-таки в ХХ веке прошла моя основная научная жизнь, и я расскажу о тех удивительных событиях, которые свершились на моей памяти в ХХ веке. А самое интересное началось в последнее десятилетие, и в корне перевернуло всю микробиологическую науку; об этом говорится в следующем пункте — о филогенетической систематике. Ну и, наконец, о XXI веке, и о том, что делается сейчас, потому что уже прошло 10 лет от ХХI века, и мы довольно глубоко продвинулись по нему. Расскажу о том, куда двинулась микробиология и куда она двигается дальше. Это будет уже в конце. Хочу сразу извиниться перед теми из вас, кому все, что я рассказываю, покажется очень банальным и очевидным. Наверняка такие люди здесь есть, но я все-таки постаралась подготовить такой рассказ, который всем будет более или менее понятен.
И потом, как я уже сказала, исторический экскурс будет по ХХ веку, так как все-таки в ХХ веке прошла моя основная научная жизнь, и я расскажу о тех удивительных событиях, которые свершились на моей памяти в ХХ веке. А самое интересное началось в последнее десятилетие, и в корне перевернуло всю микробиологическую науку; об этом говорится в следующем пункте — о филогенетической систематике. Ну и, наконец, о XXI веке, и о том, что делается сейчас, потому что уже прошло 10 лет от ХХI века, и мы довольно глубоко продвинулись по нему. Расскажу о том, куда двинулась микробиология и куда она двигается дальше. Это будет уже в конце. Хочу сразу извиниться перед теми из вас, кому все, что я рассказываю, покажется очень банальным и очевидным. Наверняка такие люди здесь есть, но я все-таки постаралась подготовить такой рассказ, который всем будет более или менее понятен.
Елизавета Бонч-Осмоловская
(фото Н. Четвериковой)
Прежде всего, хочу начать с нескольких определений, чтобы было ясно, о чем мы говорим. Слово «микроорганизм» все знают. Кстати, мой сын, прочитав аннотацию к моей лекции, упрекнул меня в том, что слишком все сложно написано, и вместо «микроорганизма» надо говорить «микроб», чтобы не отпугнуть слушателей. Но мне кажется, что все-таки «микроорганизм» тоже более или менее понятно. «Микроб» — это просторечие, которое мы употребляем, когда хотим быстренько сказать «микроорганизм», это одно и то же, и ни то ни другое, в общем, научным термином не является. Имеются в виду очень маленькие существа, которых не видно невооруженным глазом и можно увидеть только под микроскопом. Сюда относятся отнюдь не только бактерии, и никак нельзя микроорганизмы или микробов приравнивать к бактериям. Микроорганизмы — это и микроскопические грибы, и микроскопические водоросли, и вирусы, то есть все вот эти мельчайшие и невидимые существа. Но я сразу хочу предупредить, что говорить-то я буду «микроб», но иметь в виду буду бактерий и архей, о которых тоже скажу позже. Это организмы, которые в нашей микробиологической науке называются словом «прокариоты», то есть безъядерные организмы, в отличие от микроскопических грибов и водорослей, у которых есть ядра (они эукариоты).
Слово «микроорганизм» все знают. Кстати, мой сын, прочитав аннотацию к моей лекции, упрекнул меня в том, что слишком все сложно написано, и вместо «микроорганизма» надо говорить «микроб», чтобы не отпугнуть слушателей. Но мне кажется, что все-таки «микроорганизм» тоже более или менее понятно. «Микроб» — это просторечие, которое мы употребляем, когда хотим быстренько сказать «микроорганизм», это одно и то же, и ни то ни другое, в общем, научным термином не является. Имеются в виду очень маленькие существа, которых не видно невооруженным глазом и можно увидеть только под микроскопом. Сюда относятся отнюдь не только бактерии, и никак нельзя микроорганизмы или микробов приравнивать к бактериям. Микроорганизмы — это и микроскопические грибы, и микроскопические водоросли, и вирусы, то есть все вот эти мельчайшие и невидимые существа. Но я сразу хочу предупредить, что говорить-то я буду «микроб», но иметь в виду буду бактерий и архей, о которых тоже скажу позже. Это организмы, которые в нашей микробиологической науке называются словом «прокариоты», то есть безъядерные организмы, в отличие от микроскопических грибов и водорослей, у которых есть ядра (они эукариоты). Но я буду прокариот называть для простоты «микробами». Мы обычно всегда говорим друг другу: «Ну, как там наш микробчик? Что у нас там с нашими микробчиками?» И, конечно, имеем в виду бактерий и архей, с которыми работаем, и так я и здесь собираюсь говорить. Грибы и микроскопические водоросли тоже, безусловно, абсолютно достойны того, чтобы о них рассказать, но, во-первых, я не специалист, и, во-вторых, вы потом увидите, что мой рассказ пойдет несколько в другую сторону.
Но я буду прокариот называть для простоты «микробами». Мы обычно всегда говорим друг другу: «Ну, как там наш микробчик? Что у нас там с нашими микробчиками?» И, конечно, имеем в виду бактерий и архей, с которыми работаем, и так я и здесь собираюсь говорить. Грибы и микроскопические водоросли тоже, безусловно, абсолютно достойны того, чтобы о них рассказать, но, во-первых, я не специалист, и, во-вторых, вы потом увидите, что мой рассказ пойдет несколько в другую сторону.
Начать я хочу с Левенгука, хотя это не означает, что я буду так последовательно двигаться по всем векам, начиная с XVII. Но не начать с него невозможно, потому что вообще вся история микробиологии — это история совершенствования методов. Как изучать невидимые объекты? Левенгук был первым, кто увидел их.
Готовясь к этой лекции, я узнала, что таких линз, которые сделал Левенгук, потом никто не смог сделать. Они были маленькие, крошечные и совершенно особенные. Только в 1970-м г. в Новосибирске удалось российским, советским тогда ученым, сделать аналогичные линзы, но не вытачиванием, а плавлением какого-то стекловолокна.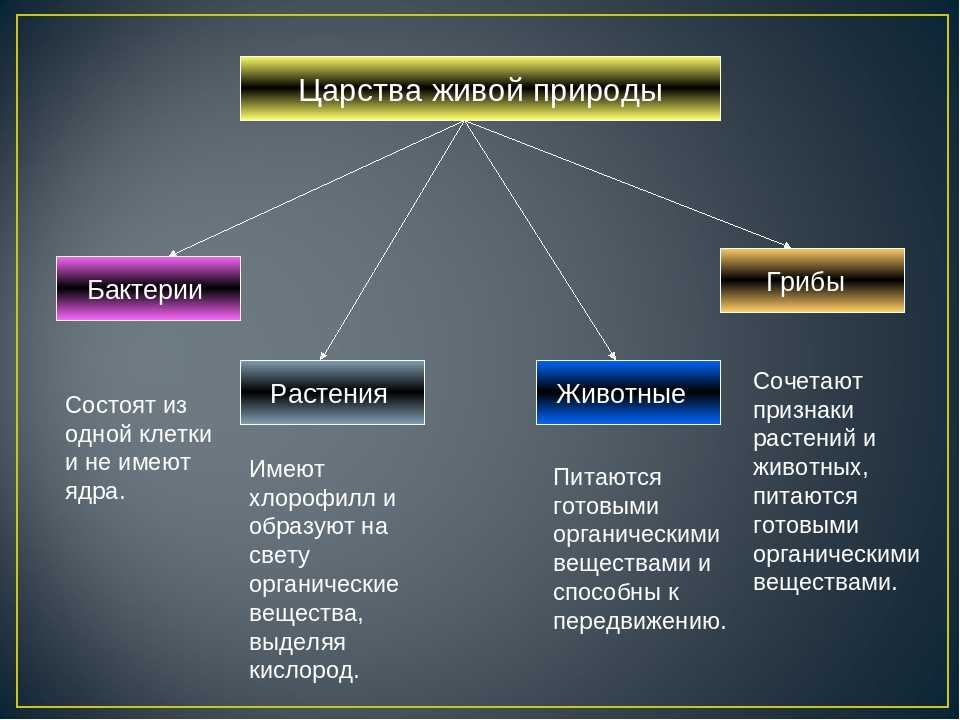 А Левенгук их вытачивал. И он решил посмотреть, почему хрен такой едкий и, посмотрев на растертый хрен в свой микроскоп, увидел — не знаю уж, в хрене или где-то еще, — огромный живой мир. И с этого началась микробиология.
А Левенгук их вытачивал. И он решил посмотреть, почему хрен такой едкий и, посмотрев на растертый хрен в свой микроскоп, увидел — не знаю уж, в хрене или где-то еще, — огромный живой мир. И с этого началась микробиология.
Это наш институт — Институт Микробиологии им. Сергея Николаевича Виноградского Российской Академии Наук. Находится на улице Вавилова, весьма скромное здание. Но вот именно там мы занимаемся общей микробиологией. Есть еще институт в Пущино, в котором традиционно в большей степени занимаются промышленной, прикладной микробиологией. Есть институт в Саратове, где тоже занимаются общей микробиологией. Но все-таки в первую очередь ей занимаются именно в нашем институте, а также во многих университетах, включая московский — кафедры микробиологии есть везде.
Говоря об общей микробиологии, я в первую очередь хотела как-то дистанцироваться от микробиологии в понимании общества, потому что для людей микробиология — это в первую очередь медицинская микробиология, которая занимается болезнетворными микробами.
Борис Долгин: И слово это помнят, конечно, из «Открытой книги» Вениамина Каверина.
Елизавета Бонч-Осмоловская: Да, и есть еще другая замечательная книга — «Охотники за микробами» Поля де Крюи, которая тоже посвящена медицинской микробиологии. Безусловно, победа над инфекциями, которые вызывают микроорганизмы, — это главная победа человечества за всю его историю. Тут двух мнений быть не может, и медицинская микробиология — это замечательная наука, но традиционно она от общей микробиологии отделена. У нас разные институты, разные журналы, разные конференции. Может быть, так сложилось, потому что в этих разделах науки совершено разные требования к безопасности. Есть еще микробиология, о которой нам телевизор постоянно сообщает, показывая нам микробов, которые живут в нашем кишечнике, попадая туда из йогурта, и с этим общая микробиология тоже не имеет дела, это пищевая микробиология.
Общая микробиология занимается общими свойствами всех микроорганизмов: строением микробной клетки, метаболизмом, то есть тем, что свойственно всем микробам, независимо от того, патогенные они или не патогенные, молочнокислые, или какие-то еще.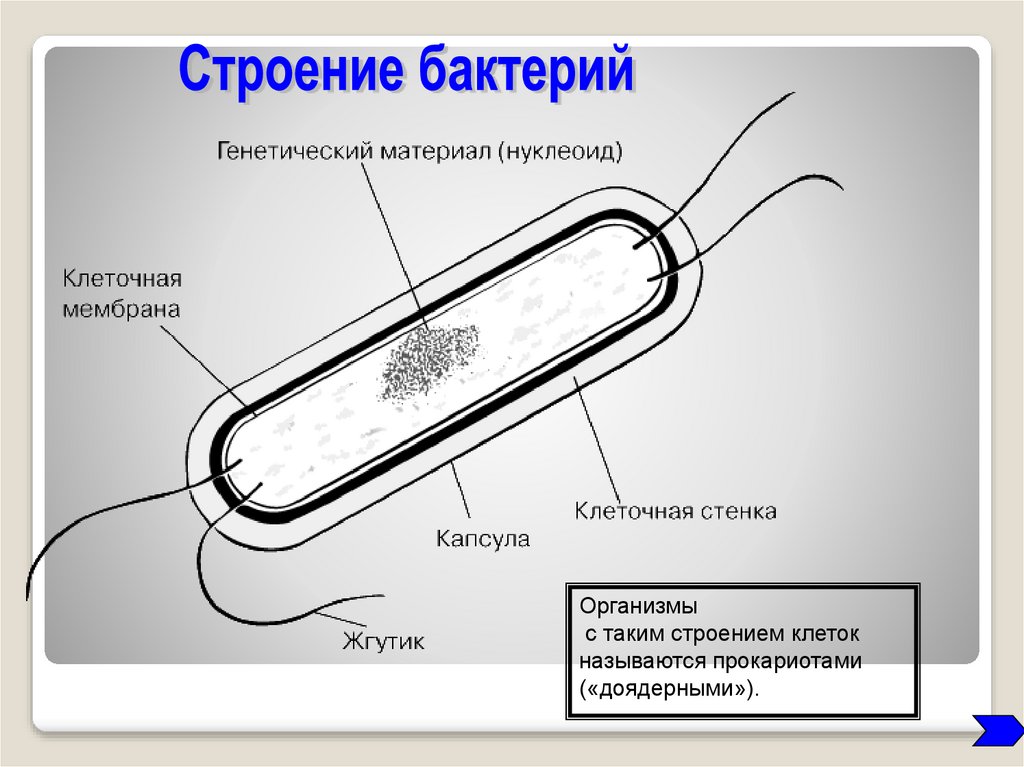 Метаболизм — это процессы получения энергии и построения клеточного вещества. И, наконец, очень важная вещь, фактически, это микробная экология и есть — взаимодействие микроорганизмов друг с другом и с внешней средой. Наконец, систематика микроорганизмов — это тоже предмет общей микробиологии. Это то, что, наверное, со стороны кажется ужасно скучным. На самом деле — это безумно увлекательно и очень интересно, и я об этом позже расскажу. Систематика — обязательная часть общей микробиологии, потому что сама микробиология относится к классической, так называемой организменной биологии, потому что ее объект — это организм, некое живое существо, автономное, которое живет само по себе и каким-то образом взаимодействует с внешним миром и с другими существами. Но в силу их малых размеров, очень маленьких, конечно, требуются совершенно другие подходы, которые делают микробиологию совершенно особенной наукой.
Метаболизм — это процессы получения энергии и построения клеточного вещества. И, наконец, очень важная вещь, фактически, это микробная экология и есть — взаимодействие микроорганизмов друг с другом и с внешней средой. Наконец, систематика микроорганизмов — это тоже предмет общей микробиологии. Это то, что, наверное, со стороны кажется ужасно скучным. На самом деле — это безумно увлекательно и очень интересно, и я об этом позже расскажу. Систематика — обязательная часть общей микробиологии, потому что сама микробиология относится к классической, так называемой организменной биологии, потому что ее объект — это организм, некое живое существо, автономное, которое живет само по себе и каким-то образом взаимодействует с внешним миром и с другими существами. Но в силу их малых размеров, очень маленьких, конечно, требуются совершенно другие подходы, которые делают микробиологию совершенно особенной наукой.
Я не буду ничего говорить о строении микробной клетки, потому что она очень проста.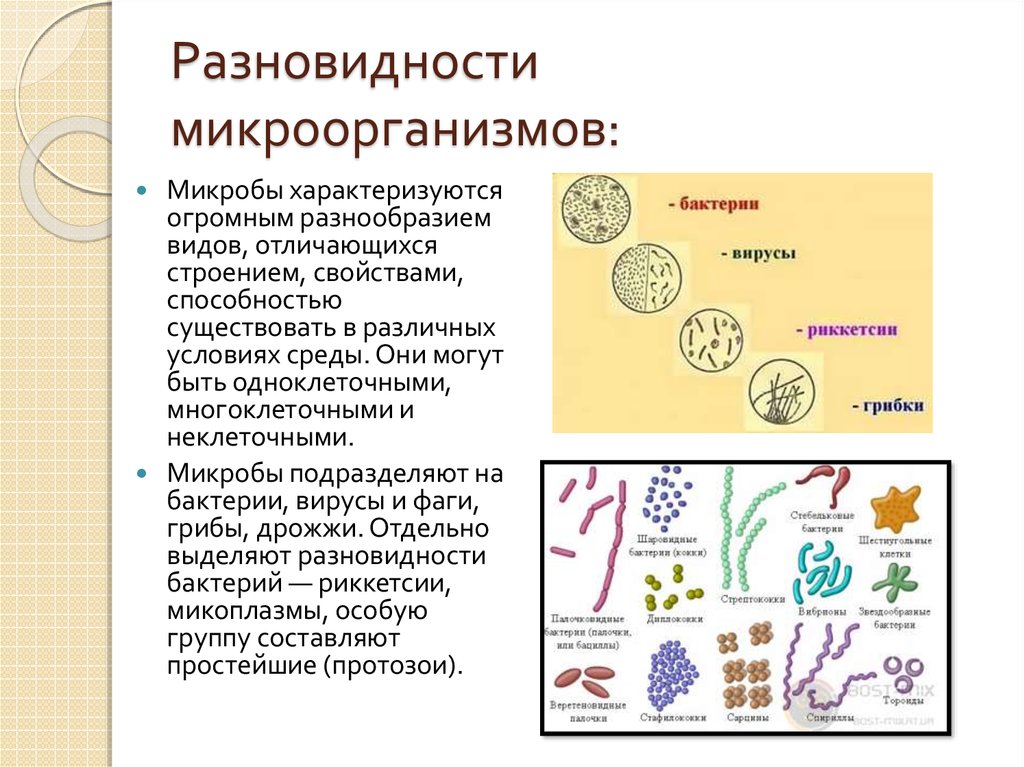 Кстати, я забыла упомянуть, что микробы не просто малы. Если попытаетесь увидеть микробов в микроскоп, в который обычно считают эритроциты при анализе крови — вы ничего не увидите, потому что микробные клетки гораздо меньше. Нужно специальное устройство, так называемый «фазовый контраст» для того, чтобы можно было хорошо рассмотреть микробные клетки. Они от 10 до 100 раз меньше клеток высших организмов. И они очень просто устроены. У них, как я вам уже сказала, нет ядра, нет никаких внутриклеточных органелл. Это простейшая клетка, но при этом микробы живы и здоровы, и особенности, которые кладутся в основу систематики, — другие. Систематика микроорганизмов, конечно, в первую очередь учитывает форму клетки: палочки или кокки (то есть шарики), или цепочки, или что-то еще. Но буквально этим все и исчерпывается. А великое разнообразие микробов состоит в огромном разнообразии внутриклеточных процессов, за счет которых они живут.
Кстати, я забыла упомянуть, что микробы не просто малы. Если попытаетесь увидеть микробов в микроскоп, в который обычно считают эритроциты при анализе крови — вы ничего не увидите, потому что микробные клетки гораздо меньше. Нужно специальное устройство, так называемый «фазовый контраст» для того, чтобы можно было хорошо рассмотреть микробные клетки. Они от 10 до 100 раз меньше клеток высших организмов. И они очень просто устроены. У них, как я вам уже сказала, нет ядра, нет никаких внутриклеточных органелл. Это простейшая клетка, но при этом микробы живы и здоровы, и особенности, которые кладутся в основу систематики, — другие. Систематика микроорганизмов, конечно, в первую очередь учитывает форму клетки: палочки или кокки (то есть шарики), или цепочки, или что-то еще. Но буквально этим все и исчерпывается. А великое разнообразие микробов состоит в огромном разнообразии внутриклеточных процессов, за счет которых они живут.
И в этом смысле микробы между собой отличаются гораздо больше, чем какие-то позвоночные животные, например, слон и мышь, которые нам кажутся такими разными, а на самом деле по организации внутриклеточной механики гораздо ближе между собой, чем одинаковые на вид микроорганизмы. И вот описание микробов требует в первую очередь изучения их метаболизма. Растения получают энергию за счет оксигенного фотосинтеза, то есть фотосинтеза, при котором образуется кислород. Животные используют органическое вещество растений или других животных, и за счет аэробного дыхания окисляют это органическое вещество, получают энергию для жизни. А посмотрите, что делается у микробов. Во-первых, у них есть, конечно, все то же самое: и окисление органических веществ за счет аэробного дыхания, и оксигенный фотосинтез. Но у них есть и аноксигенный фотосинтез, когда вместо кислорода образуется сера. Помимо аэробного дыхания, есть анаэробное окисление органических веществ, то есть брожение. Есть хемосинтез, о котором я буду дальше говорить — это использование энергии неорганических соединений — совершенно поразительное свойство. Кроме того, они могут окислять различные органические и неорганические субстраты в процессе анаэробного дыхания — с использованием различных неорганических окислителей (не кислорода).
И вот описание микробов требует в первую очередь изучения их метаболизма. Растения получают энергию за счет оксигенного фотосинтеза, то есть фотосинтеза, при котором образуется кислород. Животные используют органическое вещество растений или других животных, и за счет аэробного дыхания окисляют это органическое вещество, получают энергию для жизни. А посмотрите, что делается у микробов. Во-первых, у них есть, конечно, все то же самое: и окисление органических веществ за счет аэробного дыхания, и оксигенный фотосинтез. Но у них есть и аноксигенный фотосинтез, когда вместо кислорода образуется сера. Помимо аэробного дыхания, есть анаэробное окисление органических веществ, то есть брожение. Есть хемосинтез, о котором я буду дальше говорить — это использование энергии неорганических соединений — совершенно поразительное свойство. Кроме того, они могут окислять различные органические и неорганические субстраты в процессе анаэробного дыхания — с использованием различных неорганических окислителей (не кислорода). То есть микроорганизмы просто для того, чтобы жить и извлекать энергию, осуществляют великое разнообразие процессов, которые в неживой природе не идут. Или идут очень медленно.
То есть микроорганизмы просто для того, чтобы жить и извлекать энергию, осуществляют великое разнообразие процессов, которые в неживой природе не идут. Или идут очень медленно.
Здесь вы видите портрет великого, замечательного русского ученого Сергея Николаевича Виноградского, в честь которого назван наш институт. Это и есть тот человек, который открыл колоссальный мир разнообразных энергетических процессов, за счет которых живут микроорганизмы, открыл хемосинтез. Это произошло довольно рано: вы видите, что он родился в 1853 году, а в 1887 как раз и произошло открытие хемосинтеза. Он обнаружил, что есть микроорганизмы, которые живут за счет окисления сероводорода кислородом воздуха. Кроме этого он фактически заложил основы микробной экологии и биогеохимии, занимался почвенной микробиологией, азотфиксацией, в общем, сделал очень много, причем довольно рано. Потом науку бросил, и лет 10 занимался сельским хозяйством, где-то на юге России пытался создать идеальное сельское хозяйство. Потом после революции он эмигрировал, и, так как у него другой профессии не было, работал в Институте Пастера в Париже. Виноградский прожил, как вы видите, очень долгую жизнь и в Институте Пастера еще тоже много всего сделал. Но, конечно, хемосинтез считается его величайшим открытием, и в 1987 году в Гёттингене, в Германии, был большой симпозиум, посвященный столетию открытия хемосинтеза Виноградским. К этому времени уже было открыто, в дополнение к открытым Виноградским, много других уникальных энергетических процессов, осуществляемых микроорганизмами.
Потом после революции он эмигрировал, и, так как у него другой профессии не было, работал в Институте Пастера в Париже. Виноградский прожил, как вы видите, очень долгую жизнь и в Институте Пастера еще тоже много всего сделал. Но, конечно, хемосинтез считается его величайшим открытием, и в 1987 году в Гёттингене, в Германии, был большой симпозиум, посвященный столетию открытия хемосинтеза Виноградским. К этому времени уже было открыто, в дополнение к открытым Виноградским, много других уникальных энергетических процессов, осуществляемых микроорганизмами.
Здесь я сделала вот такую схемку: с левой стороны неорганические источники энергии, их очень много. А с правой стороны — окислители. Вы понимаете, что для любого процесса жизнедеятельности нужен восстановитель — источник энергии и нужен окислитель, между которыми электроны бегут, и энергия запасается уже для жизнедеятельности этого организма. Вот эти все разноцветные стрелочки — это все процессы, которые найдены у микробов. А то, что пунктиром, — это то, что пока еще в лабораторных условиях не получено, и найдено только в природе. Это такие задачки на будущее. Вы видите, что водород — это универсальный донор, который используется с большим количеством самых разных окислителей. А кислород, наоборот, универсальный окислитель, который окисляет все, что только можно. Но есть и другие пары. И моя лаборатория тоже приложила руку к поиску новых процессов, я потом об этом тоже немножко скажу. Вот здесь сбоку я написала еще другие микробные процессы — чтобы показать необыкновенное разнообразие микробов, разнообразие химических процессов, которые они совершают: либо для получения энергии, либо для построения своих клеток — вот, например, фиксация азота, тоже исключительное свойство прокариот, благодаря которому они могут усваивать азот из воздуха. Или разложение целлюлозы, например — тоже чисто микробный процесс, хотя тут главенствующую роль, конечно, играют не прокариоты, а микроскпоические грибы. Целлюлоза — это основной полимер, создаваемый растениями, — ежегодно образуется огромное количество тонн целлюлозы.
А то, что пунктиром, — это то, что пока еще в лабораторных условиях не получено, и найдено только в природе. Это такие задачки на будущее. Вы видите, что водород — это универсальный донор, который используется с большим количеством самых разных окислителей. А кислород, наоборот, универсальный окислитель, который окисляет все, что только можно. Но есть и другие пары. И моя лаборатория тоже приложила руку к поиску новых процессов, я потом об этом тоже немножко скажу. Вот здесь сбоку я написала еще другие микробные процессы — чтобы показать необыкновенное разнообразие микробов, разнообразие химических процессов, которые они совершают: либо для получения энергии, либо для построения своих клеток — вот, например, фиксация азота, тоже исключительное свойство прокариот, благодаря которому они могут усваивать азот из воздуха. Или разложение целлюлозы, например — тоже чисто микробный процесс, хотя тут главенствующую роль, конечно, играют не прокариоты, а микроскпоические грибы. Целлюлоза — это основной полимер, создаваемый растениями, — ежегодно образуется огромное количество тонн целлюлозы. И этот углерод возвращается в круговорот только благодаря микробам, которые могут разрушать целлюлозу как в аэробных условиях (уже упомянутые мною грибы, а также бактерии), так и в анаэробных (то есть бескислородных — только бактерии). Разложение углеводородов — это тоже микробный процесс. Я тут выбрала просто несколько самых ярких примеров, а их еще очень много. Например, разложение ксенобиотиков — искусственных химических соединений, созданных человеком. Это, конечно, тоже очень важный процесс — ведь если бы ксенобиотики не разлагались, они накапливались бы в природе. Тем не менее, микробы могут их разлагать. То есть микроорганизмы не только поддерживают себя, совершая эти химические процессы в виде своих основных реакций жизнедеятельности, но и являются двигателями глобальных циклов элементов на земле — восстанавливают окисленные соединения, окисляют восстановленные, и все это крутится.
И этот углерод возвращается в круговорот только благодаря микробам, которые могут разрушать целлюлозу как в аэробных условиях (уже упомянутые мною грибы, а также бактерии), так и в анаэробных (то есть бескислородных — только бактерии). Разложение углеводородов — это тоже микробный процесс. Я тут выбрала просто несколько самых ярких примеров, а их еще очень много. Например, разложение ксенобиотиков — искусственных химических соединений, созданных человеком. Это, конечно, тоже очень важный процесс — ведь если бы ксенобиотики не разлагались, они накапливались бы в природе. Тем не менее, микробы могут их разлагать. То есть микроорганизмы не только поддерживают себя, совершая эти химические процессы в виде своих основных реакций жизнедеятельности, но и являются двигателями глобальных циклов элементов на земле — восстанавливают окисленные соединения, окисляют восстановленные, и все это крутится.
Переходим к микробной экологии.
Вот это классическая трофическая цепь, всем известная по экологии высших организмов, где есть продуценты органического вещества, есть те, кто их потребляет, затем растительноядные животные, потом консументы второго порядка — хищники, кажется, есть еще хищники, которые едят хищников.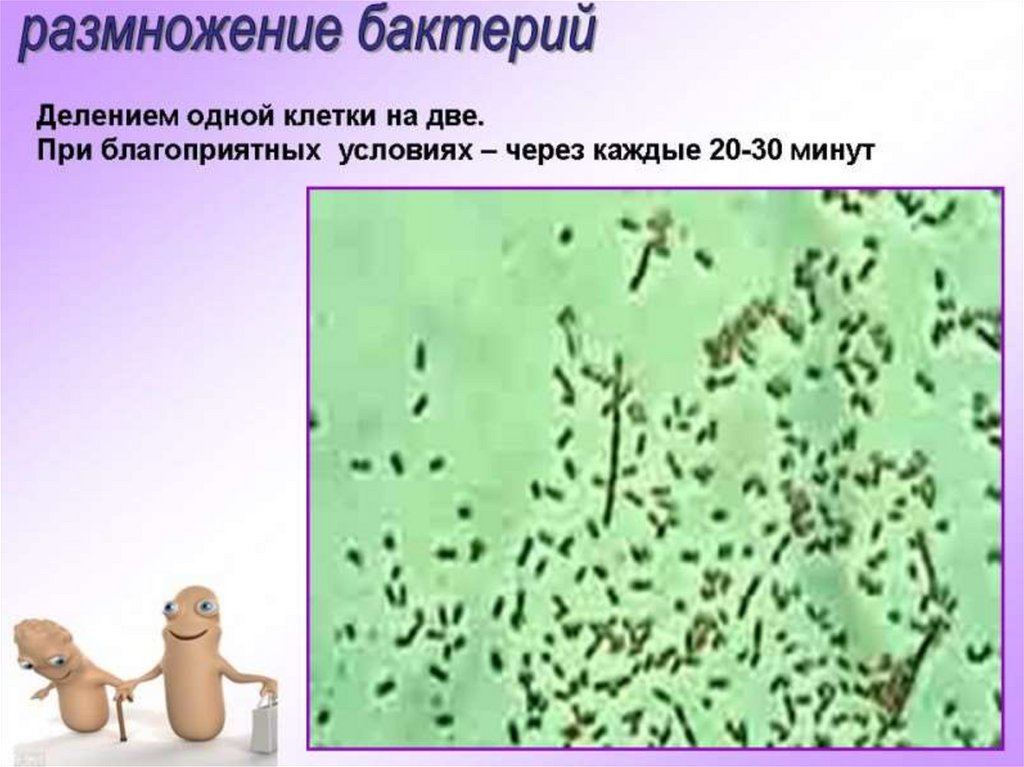 Во всяком случае, в водной среде может быть и гораздо больше ступенек. Но у микробов все совершено по-другому.
Во всяком случае, в водной среде может быть и гораздо больше ступенек. Но у микробов все совершено по-другому.
То есть отчасти они участвуют и в этих пищевых цепях, потому что являются пищей простейших, а их самих едят более крупные беспозвоночные, а тех — рыбы, затем рыб едят хищные рыбы и так далее, и так далее. То же самое и в почве. Но кроме того микробы разлагают отмершие растительные и животные организмы, а также клетки других микробов, а том числе продуцентов — хемо- и фотосинтетиков. Но дальше происходит нечто совсем другое. Микробная трофическая цепь основана не на поедании одного организма другим, а на использовании одним микроорганизмом продукта другого. Какой-то субстрат разлагается, образуется продукт, который является субстратом для следующей группы микробов. Потом продукты этих микробов являются субстратом для следующей группы микробов, и так далее.
И это и есть микробная трофическая цепь, а все эти микробы вместе называются микробным сообществом. То есть, микробное сообщество — это группа микроорганизмов, связанная в первую очередь пищевыми взаимоотношениями, но пищевыми именно в терминах микробной экологии.
То есть, микробное сообщество — это группа микроорганизмов, связанная в первую очередь пищевыми взаимоотношениями, но пищевыми именно в терминах микробной экологии.
Особенно сложные трофические цепи существуют в анаэробных условиях. В аэробных условиях основная часть органического вещества окисляется сразу до углекислоты и воды. В анаэробных же — бескислородных — условиях, во-первых, сначала происходит гидролиз биополимеров (в моем примере полисахариды, но это могли бы быть и белки, и жиры и все что угодно), причем гидролитики обеспечивают мономерами — сахарами — не только себя, но еще большое количество всяких приспешников. Потом происходит брожение этих сахаров, образуются кислоты, спирты и газы: водород и углекислота. Из водорода и углекислоты образуется метан. Кислоты и спирты разлагаются также до водорода и углекислоты, из которых тоже образуется метан. Вот этот этап, пожалуйста, запомните, я потом к нему вернусь, потому что он очень важный. Такое сложное микробное сообщество действует идеально слаженно. Получают преимущество не только те, кто в конце пищевой цепочки, но и те, кто в начале, тоже пользуются тем, что присутствует много других микроорганизмов, потому что у них происходит обмен всевозможными витаминами и прочим — то, что у нас условно называется «факторами роста». Не все микроорганизмы могут синтезировать себе для жизни все, что им нужно, поэтому в сообществах происходит обмен. Но существует еще и некая термодинамическая зависимость, о которой я скажу позже.
Получают преимущество не только те, кто в конце пищевой цепочки, но и те, кто в начале, тоже пользуются тем, что присутствует много других микроорганизмов, потому что у них происходит обмен всевозможными витаминами и прочим — то, что у нас условно называется «факторами роста». Не все микроорганизмы могут синтезировать себе для жизни все, что им нужно, поэтому в сообществах происходит обмен. Но существует еще и некая термодинамическая зависимость, о которой я скажу позже.
До того, как полностью перейти к сообществам, вернусь немножко назад, чтобы рассказать еще об одном великом микробиологе, который, конечно же, был медицинским микробиологом, — это Кох, который исследовал возбудителя туберкулеза, названного «палочкой Коха». Но кроме этого он еще сделал такое великое открытие, которое обусловило развитие микробиологии на очень долгое время, фактически, на целый век. Он придумал, как получить чистую культуру. «Чистая культура» — это очень важное микробиологическое понятие: это популяция совершено одинаковых клеток, которые можно исследовать как один организм. Ведь как иначе исследовать процессы, которые в происходят в микроорганизме, если это клетка величиной в микрон, то есть 0,001 мм. Как можно его исследовать? Никак, тем более микробы в природе, как я только что сказала, присутствуют в виде такой вот дикой смеси. Как их можно исследовать? Теперь уже можно, но тогда Кохом была придумана такая замечательная вещь, как твердая среда. Вообще «среда» — это то, на чем искусственно размножаются микробы, выращиваются в лабораторных условиях. То, что мы получаем в лаборатории, мы называем словом «культура»; как существуют культурные растения, так бывают и культурные микробы. На всех языках «культура» так и будет «culture». На одной из больших конференций по микробной экологии даже была такая сессия, которая называлась «domestication of microorganisms», то есть «одомашнивание микробов». Если нам удалось микроба воспроизводить в лабораторных условиях, создать ему такую среду, чтобы клетки делились, а среда — это все необходимые минералы, субстраты и прочее, то он у нас живет в лаборатории в виде такой культуры, и мы его можем пересевать, то есть наливать немного из пробирки, где уже много клеток, в новую, где их нет, и клетки будут делиться.
Ведь как иначе исследовать процессы, которые в происходят в микроорганизме, если это клетка величиной в микрон, то есть 0,001 мм. Как можно его исследовать? Никак, тем более микробы в природе, как я только что сказала, присутствуют в виде такой вот дикой смеси. Как их можно исследовать? Теперь уже можно, но тогда Кохом была придумана такая замечательная вещь, как твердая среда. Вообще «среда» — это то, на чем искусственно размножаются микробы, выращиваются в лабораторных условиях. То, что мы получаем в лаборатории, мы называем словом «культура»; как существуют культурные растения, так бывают и культурные микробы. На всех языках «культура» так и будет «culture». На одной из больших конференций по микробной экологии даже была такая сессия, которая называлась «domestication of microorganisms», то есть «одомашнивание микробов». Если нам удалось микроба воспроизводить в лабораторных условиях, создать ему такую среду, чтобы клетки делились, а среда — это все необходимые минералы, субстраты и прочее, то он у нас живет в лаборатории в виде такой культуры, и мы его можем пересевать, то есть наливать немного из пробирки, где уже много клеток, в новую, где их нет, и клетки будут делиться.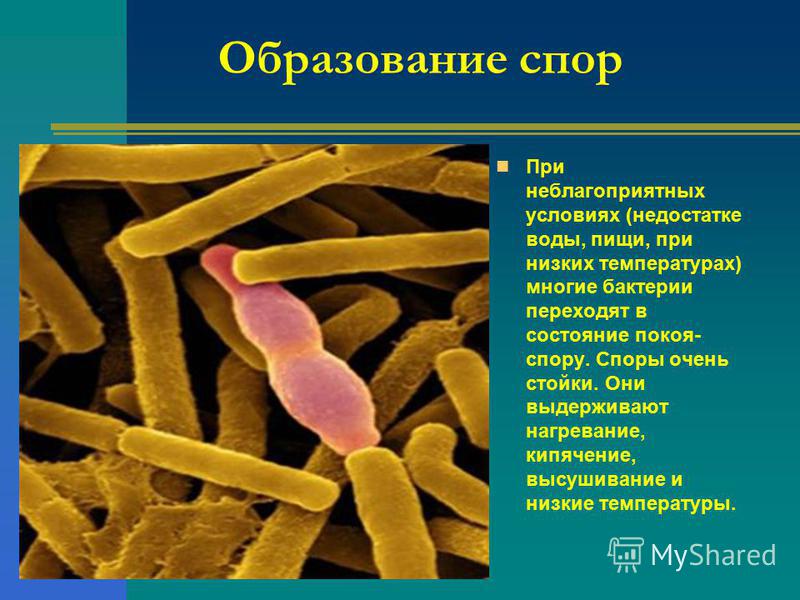 Но если вы просто какой-то почвой эту среду засеете, и кстати, все это знают по своему холодильнику — попробуй забудь там какой-нибудь компот — вот у вас уже и культура. Да даже и без холодильника еще лучше, еще быстрее, — так вот, клетки там все будут разные. Что придумал Кох? Он придумал в эту среду добавлять желирующий агент — желатин или агар. Теперь все, конечно, в основном пользуются агаром. Почему? Потому что агар очень трудно разлагается микроорганизмами, и микробы будет расти не на нем, а на том, что вы туда добавите. И таким образом вы будете знать, что ваш микроб ест. И вот на слайде чашка Петри — стеклянное блюдечко с крышечкой. Эта крышка так плотно лежит, что внутри все стерильно, воздух с посторонними микробами туда не попадает. На агаре появляются «колонии» — это точечки. По поверхности агара растерли каплю жидкой культуры, то есть среды, в которой были клетки микробов. Так подсчитали концентрацию, чтобы попало такое количество клеток, чтобы они оказались на достаточно большом расстоянии друг от друга.
Но если вы просто какой-то почвой эту среду засеете, и кстати, все это знают по своему холодильнику — попробуй забудь там какой-нибудь компот — вот у вас уже и культура. Да даже и без холодильника еще лучше, еще быстрее, — так вот, клетки там все будут разные. Что придумал Кох? Он придумал в эту среду добавлять желирующий агент — желатин или агар. Теперь все, конечно, в основном пользуются агаром. Почему? Потому что агар очень трудно разлагается микроорганизмами, и микробы будет расти не на нем, а на том, что вы туда добавите. И таким образом вы будете знать, что ваш микроб ест. И вот на слайде чашка Петри — стеклянное блюдечко с крышечкой. Эта крышка так плотно лежит, что внутри все стерильно, воздух с посторонними микробами туда не попадает. На агаре появляются «колонии» — это точечки. По поверхности агара растерли каплю жидкой культуры, то есть среды, в которой были клетки микробов. Так подсчитали концентрацию, чтобы попало такое количество клеток, чтобы они оказались на достаточно большом расстоянии друг от друга. Эти клетки, которые попали на поверхность агара в чашке и начали размножаться. Образовали видимые глазом колонии. Каждая колония вырастала из одной клетки, и все составляющие ее клетки абсолютно одинаковые. Если после этого вы колонию возьмете прожженной на горелке металлической проволочкой (чтобы не было других микробов) и перенесете ее либо на другую чашку, либо в бутылочку или пробирку, то там вырастут абсолютно одинаковые клетки и все, вы с ними можете работать. Это называется «чистая культура». «Чистая культура» — это знамя, флаг микробиологии ХХ века, это то, к чему стремились все микробиологи, да и до сих пор не снята с повестки дня тема чистой культуры. Это то, что нужно, чтобы описать новый организм, чтобы исследовать его любые свойства. Чистая культура совершено необходима. Вот этим мы обязаны Коху.
Эти клетки, которые попали на поверхность агара в чашке и начали размножаться. Образовали видимые глазом колонии. Каждая колония вырастала из одной клетки, и все составляющие ее клетки абсолютно одинаковые. Если после этого вы колонию возьмете прожженной на горелке металлической проволочкой (чтобы не было других микробов) и перенесете ее либо на другую чашку, либо в бутылочку или пробирку, то там вырастут абсолютно одинаковые клетки и все, вы с ними можете работать. Это называется «чистая культура». «Чистая культура» — это знамя, флаг микробиологии ХХ века, это то, к чему стремились все микробиологи, да и до сих пор не снята с повестки дня тема чистой культуры. Это то, что нужно, чтобы описать новый организм, чтобы исследовать его любые свойства. Чистая культура совершено необходима. Вот этим мы обязаны Коху.
Именно методом получения колоний на чашках Петри и были выделены в чистую культуры и описаны разнообразнейшие аэробные микробы — водородные бактерии, метан-окисляющие, СО-окисляющие, всевозможные хемосинтетики, осуществляющие разнообразнейшие процессы.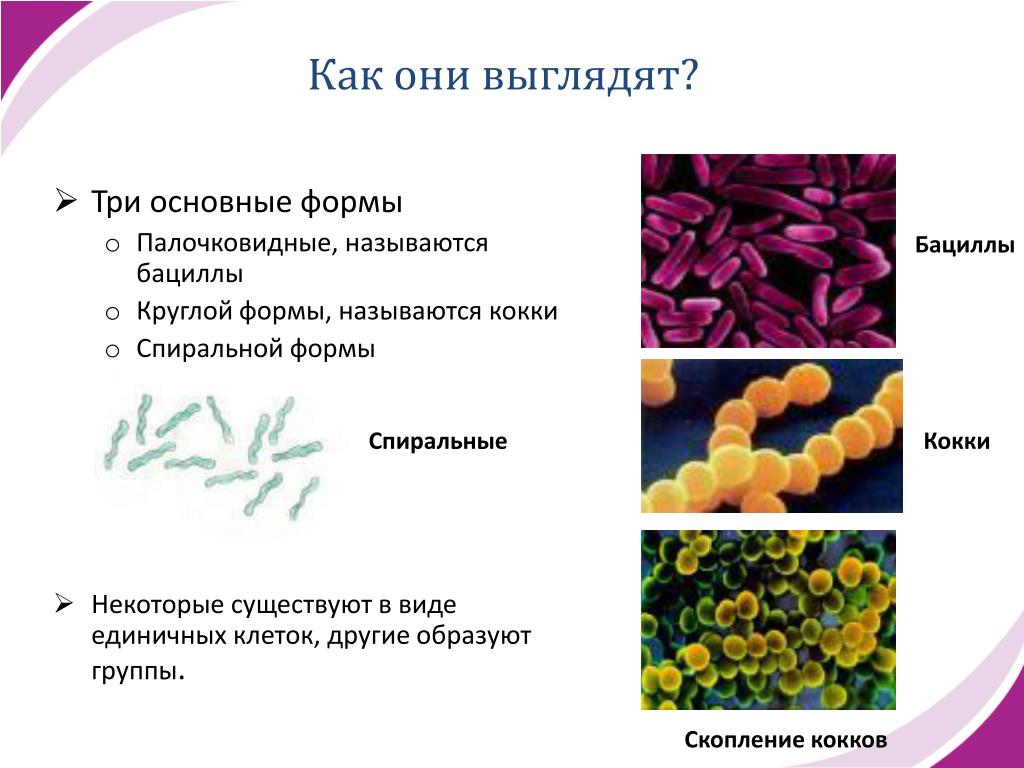 А потом в 1970-е годы, уже на моей памяти, когда я была в аспирантуре, был великий бум анаэробов. С ними, конечно, очень сложно возиться и сложно работать. В принципе и в первую половину ХХ века ими занимались, например, разными бродильщиками, наливали сверху слой масла, чтобы не допустить кислород. Но очень многие анаэробы настолько чувствительны к кислороду, что они никогда не вырастут, если есть хоть какие-то окислители в среде.
А потом в 1970-е годы, уже на моей памяти, когда я была в аспирантуре, был великий бум анаэробов. С ними, конечно, очень сложно возиться и сложно работать. В принципе и в первую половину ХХ века ими занимались, например, разными бродильщиками, наливали сверху слой масла, чтобы не допустить кислород. Но очень многие анаэробы настолько чувствительны к кислороду, что они никогда не вырастут, если есть хоть какие-то окислители в среде.
И вот американский микробиолог Хангейт придумал технику, с которой мы до сих пор работаем, до сих пор так называемые пробирки Хангейта закупаем в Америке. Это пробирка с пластмассовым винтовым колпачком, в котором дырочка, и с пробкой из бутиловой резины, которая протыкается шприцом. И уже шприцом мы переносим из среду из пробирки в пробирку, а если добавить агар и закрутить эту пробирку в таком специальном станочке, то агар растечется по стенкам и застынет, и из отдельных клеток вырастут колонии. А пробирка может быть внутри заполнена любым газом. И таким образом можно получить микробов, которые, например, используют водород в анаэробных условиях и образуют метан или что-то другое. А вот это уже более позднее изобретение — это анаэробный бокс, камера. Вот шлюз, через который туда заносятся колбы и прочее, с чем будут работать. И с помощью перчаток в этом боксе работают. То есть, видите, интерес к каким-то новым областям диктовал новую техническую идею, и тут же эта область получала толчок, рывок. В 1970-1980 гг. было открыто множество новых микробов, масса новых анаэробных процессов, тоже был такой великий бум.
И таким образом можно получить микробов, которые, например, используют водород в анаэробных условиях и образуют метан или что-то другое. А вот это уже более позднее изобретение — это анаэробный бокс, камера. Вот шлюз, через который туда заносятся колбы и прочее, с чем будут работать. И с помощью перчаток в этом боксе работают. То есть, видите, интерес к каким-то новым областям диктовал новую техническую идею, и тут же эта область получала толчок, рывок. В 1970-1980 гг. было открыто множество новых микробов, масса новых анаэробных процессов, тоже был такой великий бум.
На схеме показано, какие есть разнообразные химические процессы: восстановление железа водородом, восстановление сульфата водородом и серой и так далее. Есть даже такие экзотические, как, например, окисление СО нитратом или железом. Чтоб вам было немножко понятнее, скажу, что есть узкоспециализированные группы, которые только один какой-то процесс осуществляют, в частности метаногены — восстановление углекислоты водородом — это очень важный для планеты процесс, и очень специализированная группа микроорганизмов его осуществляет. Он довольно сложный, он требует многих ферментов, многих генов, поэтому уровень специализации очень высокий. А некоторые процессы, например, — восстановление элементной серы, разбросаны по миру микробов и встречаются у многих.
Он довольно сложный, он требует многих ферментов, многих генов, поэтому уровень специализации очень высокий. А некоторые процессы, например, — восстановление элементной серы, разбросаны по миру микробов и встречаются у многих.
С помощью этого слайда я хочу вам показать, как выглядит описание микроба. Выглядит скучновато, но на самом деле описание новых микробов — дело исключительно азартное, с очень большим адреналином, страсти там кипят нешуточные. Потому что как доказать, что микроб, которого ты получил, — новый? Во-первых, нужно описать так называемые фенотипические, то есть внешние признаки и сравнить с уже известными. Во-вторых, нужно сравнить его генетические характеристики с другими микробами, которые уже известны. И не только известны, а то, что в микробиологии называется «валидно описаны», — опубликованы в одном-единственном журнале «The International Journal of Systematic and Evolutionary Microbiology» — «Международный Журнал Систематической и Эволюционной Микробиологии». Если удалось доказать, что микроб отличается от известных, то его описание тоже публикуют в этом журнале, и следующие исследователи уже должны будут с ним сравнивать своих микробов. Систематика микробов — это виды, роды, семейства, порядки, классы и главное — это филы. Вот к филам мы скоро и подойдем. А здесь, на слайде — просто кусочек нашей статьи, где описано, как выглядит клетка, какая температура роста и какой рН (кислотность среды), какие субстраты — водород и формиат, восстанавливает серу и так далее.
Если удалось доказать, что микроб отличается от известных, то его описание тоже публикуют в этом журнале, и следующие исследователи уже должны будут с ним сравнивать своих микробов. Систематика микробов — это виды, роды, семейства, порядки, классы и главное — это филы. Вот к филам мы скоро и подойдем. А здесь, на слайде — просто кусочек нашей статьи, где описано, как выглядит клетка, какая температура роста и какой рН (кислотность среды), какие субстраты — водород и формиат, восстанавливает серу и так далее.
А теперь я снова возвращаюсь к схеме разложения органического вещества и хочу рассказать об одном важном этапе — превращении кислот и спиртов в водород и углекислоту. Дело в том, что эти реакции термодинамически невозможны. Энергия, которая здесь образуется, недостаточна, и они не могут быть реакциями жизнедеятельности. Но термодинамика меняется, если водород, который образуется в этих реакциях, немедленно потребляется, и тогда эти реакции становятся возможными. То есть получается, что в чистой культуре мы не можем получить микробов, которые, допустим, растут на этаноле, образуя водород и углекислоту. Но в природе это происходит постоянно, потому что водород — роскошный субстрат, который немедленно используется, что делает возможным разложение спиртов и кислот, и, как следствие, полное разложение органического вещества. Другое следствие — то, что такое сообщество связанно сложнейшими и тончайшими отношениями, и те, кто в конце, тянут за собой тех, кто во главе. Это явление называется «межвидовой перенос водорода», и оно было открыто тоже на моей памяти в конце 1970-х годов. Это, конечно, было совершенно замечательное открытие, потому что оно нам было таким первым звоночком: уж не радуйтесь вы так своим чистым культурам! Совершенно не обязательно микробы так себя ведут в природе, как они ведут себя у вас в пробирке.
Но в природе это происходит постоянно, потому что водород — роскошный субстрат, который немедленно используется, что делает возможным разложение спиртов и кислот, и, как следствие, полное разложение органического вещества. Другое следствие — то, что такое сообщество связанно сложнейшими и тончайшими отношениями, и те, кто в конце, тянут за собой тех, кто во главе. Это явление называется «межвидовой перенос водорода», и оно было открыто тоже на моей памяти в конце 1970-х годов. Это, конечно, было совершенно замечательное открытие, потому что оно нам было таким первым звоночком: уж не радуйтесь вы так своим чистым культурам! Совершенно не обязательно микробы так себя ведут в природе, как они ведут себя у вас в пробирке.
Елизавета Бонч-Осмоловская
(фото Н. Четвериковой)
Теперь последнее отступление назад. Это моя область, и я не могла вам о ней не рассказать: это экстремофильные микробы. В общем, получается, что логика моего рассказа чисто хронологическая: я двигаюсь по последней четверти ХХ века, и за это время в микробиологии было несколько крупных прорывов: анаэробы, межвидовой перенос водорода, экстремофилы. До поры до времени всех интересовали только те микробы, которые живут так же, как и мы, при той же температуре, при том же рН. Может быть, это шло от медицинской микробиологии, может, просто другое не приходило в голову. И вдруг где-то в конце 70-х и в 80-е годы стали открывать микробов, которые растут в условиях, которые для высших существ совершенно непригодны. Это еще одна удивительная особенность мира прокариот — их физико-химические границы жизни гораздо шире, чем для остальных живых организмов. Посмотрите, вот они все называются «…филы», а экстремофилы — потому что они любят экстрим, экстремальные условия. На самом деле это антропоцентричный термин, потому что это для нас экстремальные условия, а для них самые что ни на есть нормальные. Есть термофилы, которые растут при высокой температуре, и 122ºС — это на сегодняшний день рекорд. Есть ацидофилы, которые растут при низком рН, то есть при высокой кислотности среды, и здесь нижний рекорд — это 0. Психрофилы («любящие холод») — это очень размытая группа, и вообще к экстремофилам их, строго говоря, нельзя относить, потому что мировой океан имеет в основном холодную температуру, где-то +4ºС.
До поры до времени всех интересовали только те микробы, которые живут так же, как и мы, при той же температуре, при том же рН. Может быть, это шло от медицинской микробиологии, может, просто другое не приходило в голову. И вдруг где-то в конце 70-х и в 80-е годы стали открывать микробов, которые растут в условиях, которые для высших существ совершенно непригодны. Это еще одна удивительная особенность мира прокариот — их физико-химические границы жизни гораздо шире, чем для остальных живых организмов. Посмотрите, вот они все называются «…филы», а экстремофилы — потому что они любят экстрим, экстремальные условия. На самом деле это антропоцентричный термин, потому что это для нас экстремальные условия, а для них самые что ни на есть нормальные. Есть термофилы, которые растут при высокой температуре, и 122ºС — это на сегодняшний день рекорд. Есть ацидофилы, которые растут при низком рН, то есть при высокой кислотности среды, и здесь нижний рекорд — это 0. Психрофилы («любящие холод») — это очень размытая группа, и вообще к экстремофилам их, строго говоря, нельзя относить, потому что мировой океан имеет в основном холодную температуру, где-то +4ºС. И он населен микробами, так что их там, может быть, еще побольше, чем нас с вами. Психрофилы и по таксономическому составу, и по свойствам гораздо более размыты, чем все остальные группы. Алкалофилы — это те, кто любит щелочные условия, и галофилы — это те, кто живут при повышенной солености, даже в насыщенном растворе соли — до 30%.
И он населен микробами, так что их там, может быть, еще побольше, чем нас с вами. Психрофилы и по таксономическому составу, и по свойствам гораздо более размыты, чем все остальные группы. Алкалофилы — это те, кто любит щелочные условия, и галофилы — это те, кто живут при повышенной солености, даже в насыщенном растворе соли — до 30%.
И вот фотография двух замечательных человек — Вольфрам Циллиг и Карл Штеттер, я и того, и другого знала, и у Штеттера даже работала в Германии, в Регенсбурге. Они открыли гипертермофилов. Открыли совершенно случайно, но потом очень много сделали и написали очень яркую страницу в микробиологии ХХ века. Моя лаборатория занимается термофильными микроорганизмами уже 15 лет. Мы выделяем новых термофильных микробов из горячих источников Камчатки, Байкала, мелководных гидротерм Тихого океана, а также глубоководных гидротерм.
Здесь — природные места обитания гипертермофилов — наземные и подводные гидротермы. Глубоководные гидротермы — еще одно великое открытие конца ХХ века, но конечно, не только микробиологии. Это общебиологическое открытие. Был открыт мир хемосинтеза. Через сто лет после открытия хемосинтеза Виноградским, на большой глубине в океане были открыты целые биоценозы, новые биосферы, где микроорганизмы используют сероводород, идущий из подводных вулканов, из подводных гидротерм. Далее целые большие сообщества беспозвоночных существуют, потребляя биомассу этих микроорганизмов.
Это общебиологическое открытие. Был открыт мир хемосинтеза. Через сто лет после открытия хемосинтеза Виноградским, на большой глубине в океане были открыты целые биоценозы, новые биосферы, где микроорганизмы используют сероводород, идущий из подводных вулканов, из подводных гидротерм. Далее целые большие сообщества беспозвоночных существуют, потребляя биомассу этих микроорганизмов.
А вот еще одно место обитание термофилов — подземная биосфера. На слайде — экскурсия ученых разных специальностей в золотодобывающие шахты в Южной Африке. Термофилы живут под землей, на глубине порядка 2-3 тыс. метров, где тепло поступает от магмы, температура 60-85оС, и там огромное количество микробов. Понять, как существует это микробное сообщество, что является субстратом — я считаю, это задача №1 ближайшего времени.
Это замечательные мои сотрудники, где-то 5 лет назад снята фотография. Аспиранты уже все стали кандидатами и все остались у нас в лаборатории. А вот слева — новые аспиранты, которые в этом году осваивали Камчатку и очень активно работают.
А вот это — такая краткая схема, которая показывает, что хемосинтез для вулканических местообитаний особенно актуален, так как там и водород, и сероводород, и метан, и аммиак имеют глубинное происхождение, а не биологическое, как во всех остальных экосистемах на Земле. Микробы, которые растут на этих субстратах, являются истинными первичными продуцентами, они являются двигателями вот этой экосистемы, чисто микробной, которая могла развиваться на древней Земле, и — теоретически — на других планетах. Особенно интересно про одноуглеролные соединения — СО, метанол, формиат, так как оказалось, что и они в вулканических местообитаниях образуются абиогенно, в результате химических превращений некоторых минералов, и тоже могут использоваться термофилами, открытыми в нашей лаборатории. Мы даже открыли новый энергетический процесс — образование водорода из формиата, который раньше считался невозможным.
В конце 1970-х — начале 1980-х гг. произошло ключевое событие, не только в микробиологии, я думаю, но и во всей биологии. Был разработан способ определения родства уровня организмов путем сравнения определенных участков их геномов. Таким образом, в микробиологии впервые была создана филогенетическая система. Филогенетическая — отражающая происхождение, кто от кого произошел. До этого систематика прокариот висела в воздухе. Вид и род — это как то еще можно было описать. А вот как их потом объединить в высшие таксоны? Ничего не получалось, и вместо дерева, как у высших организмов, получался даже не куст, получалась сетка, в которой все со всеми связаны. Считалось, что филогенетическая система вообще невозможна. И, тем не менее, она была создана Карлом Вёзе. Конечно, это стало возможным только потому, что люди научились определять генетические последовательности, поначалу с огромным трудом. Но как только научились это делать, открыли явные закономерности, и это стало сразу двигать вперед и саму систему, и дальнейший технический прогресс. Вот это первое его дерево, где помимо бактерий, есть археи, которых раньше все считали бактериями, потому что это точно такие же палочки и кокки, по внешнему виду — ничего особенного.
Был разработан способ определения родства уровня организмов путем сравнения определенных участков их геномов. Таким образом, в микробиологии впервые была создана филогенетическая система. Филогенетическая — отражающая происхождение, кто от кого произошел. До этого систематика прокариот висела в воздухе. Вид и род — это как то еще можно было описать. А вот как их потом объединить в высшие таксоны? Ничего не получалось, и вместо дерева, как у высших организмов, получался даже не куст, получалась сетка, в которой все со всеми связаны. Считалось, что филогенетическая система вообще невозможна. И, тем не менее, она была создана Карлом Вёзе. Конечно, это стало возможным только потому, что люди научились определять генетические последовательности, поначалу с огромным трудом. Но как только научились это делать, открыли явные закономерности, и это стало сразу двигать вперед и саму систему, и дальнейший технический прогресс. Вот это первое его дерево, где помимо бактерий, есть археи, которых раньше все считали бактериями, потому что это точно такие же палочки и кокки, по внешнему виду — ничего особенного. Но по молекулярно-биологическим характеристикам они оказались так же удалены от бактерий, как и те, и другие от эукариот. Счастливейшим образом это предположение подтвердилось рядом других признаков.
Но по молекулярно-биологическим характеристикам они оказались так же удалены от бактерий, как и те, и другие от эукариот. Счастливейшим образом это предположение подтвердилось рядом других признаков.
Вот еще одно дерево, на котором желтым выделены термофилы, и видно, что они как раз находятся у корня дерева, хотя сам корень пока неизвестен.
Дальше начинается самое интересное. Вот схема полимеразной цепной реакции, ПЦР. Точно так же, как в чистой культуре мы размножаем искусственно одного микроба в пробирке в больших количествах, чтобы его исследовать, так и ПЦР состоит в том, что какой-то конкретный участок генома искусственно размножается и получается уже в достаточно большом препаративном количестве, когда его уже можно прочитать.
На следующем слайде показано, как ДНК расходится при нагревании, достраиваются новые цепи, потом они снова нагреваются, расходятся, достраиваются новые, и за 35 циклов вы уже получаете 68 млрд. копий, и с этим количеством уже можно работать. Таким образом характеризуется и филогенетическое положение микробов — из всего генома вырезается реперный участок, размножается и определяется нуклеотидная последовательность. Но совершенно фантастический результат это имело для микробной экологии.
Таким образом характеризуется и филогенетическое положение микробов — из всего генома вырезается реперный участок, размножается и определяется нуклеотидная последовательность. Но совершенно фантастический результат это имело для микробной экологии.
На этом слайде Норман Пейс — микробиолог, который очень много сделал в этой области, и вот филогенетическое дерево, которое получено из горячего источника Йеллоустонского национального парка. Пейс и его сотрудники с помощью ПЦР выделили из природы тот конкретный консервативный участок генома, который был выбран Вёзе как филогенетический маркер. Не из чистой культуры, как это делалось раньше, а просто выделил всю ДНК из природного материала, затем этот кусочек размножил и разделил на группы одинаковых копий. Неважно, каким образом, есть несколько способов, важно, что он их разделил, отсеквенировал — и получил картину сообщества, слепок этого сообщества. И что же обнаружилось? Вот видите это небольшое количество латинских названий — это те микробы, которых мы знаем в культуре. А остальное, некие номера и индексы — это микробы совершенно неизвестные. Одновременно, а может, и раньше, этим стали заниматься и другие исследователи, и уже в середине 90-х годов обнаружилось, что культивируемые микроорганизмы — это малая толика того, что существует в природе. И, соответственно, по свойствам тех микробов, которые у нас есть в культуре, мы не имеем права судить о природных сообществах. Это был мощный удар по классической микробиологии, а точнее — по той ее части, которая претендовала на то, чтобы быть экологией. Получилось, что мы все эти годы занимались совершенно непонятно чем, делали какие-то теоретические построения, которые, как оказалось, ничего общего не имеют с тем, что происходит на самом деле. Например, бациллы (это такая группа, палочки, образующие споры) считались главными почвенными микробами, потому что, действительно, они прекрасно растут на чашках Петри, на органической среде, и при посевах их было больше всего. А на самом деле их в почве очень мало, просто основные «игроки» не растут в лабораторных условиях.
А остальное, некие номера и индексы — это микробы совершенно неизвестные. Одновременно, а может, и раньше, этим стали заниматься и другие исследователи, и уже в середине 90-х годов обнаружилось, что культивируемые микроорганизмы — это малая толика того, что существует в природе. И, соответственно, по свойствам тех микробов, которые у нас есть в культуре, мы не имеем права судить о природных сообществах. Это был мощный удар по классической микробиологии, а точнее — по той ее части, которая претендовала на то, чтобы быть экологией. Получилось, что мы все эти годы занимались совершенно непонятно чем, делали какие-то теоретические построения, которые, как оказалось, ничего общего не имеют с тем, что происходит на самом деле. Например, бациллы (это такая группа, палочки, образующие споры) считались главными почвенными микробами, потому что, действительно, они прекрасно растут на чашках Петри, на органической среде, и при посевах их было больше всего. А на самом деле их в почве очень мало, просто основные «игроки» не растут в лабораторных условиях.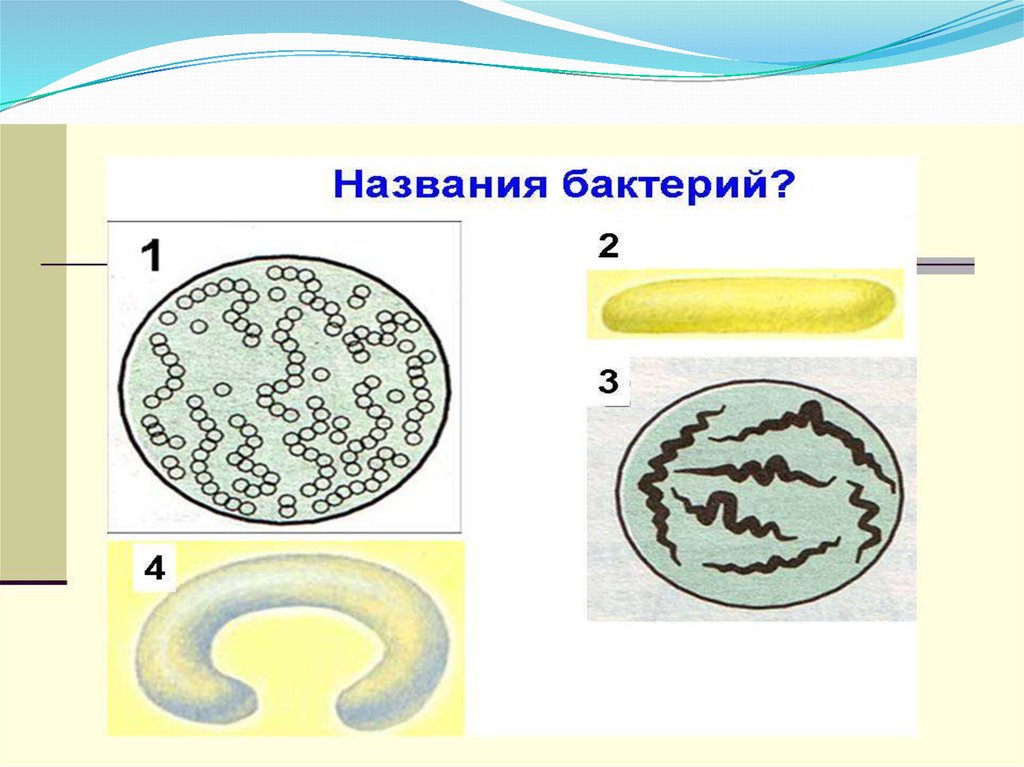
Конечно, можно случайно выделить экологически значимого микроба. Так, например, молекулярные методы, о которых я только что говорила, показали, что в глубоководных гидротермах очень многих неких так называемых эпсилон-протеобактерий, которые являются кормом для беспозвоночных, которые там растут, но ни один известный микроб в эту группу не входил. А мы совершенно случайно выделили такого микроба, который как раз оказался представителем этой группы. Просто все искали мезофилов, а это оказался термофил. И мы назвали эту бактерию Nautilia lithotrophica, потому что она растет на водороде, восстанавливая серу, она была первым представителем вот этой вот огромной группы.
Еще один интересный пример тоже из нашей практики — это микроб, который представляет отельную филогенетическую ветвь, или филу. Мы его выделили из глубоководных гидротерм и назвали Caldithrix abissy (в переводе — горячая нить из глубин). Но на дереве есть еще маленькая веточка, это родственная бактерия, которая была обнаружена с помощью молекулярных методов в мелководных гидротермах около острова Милос в Греции, то есть даже не бактерия, а соответствующий участочек ДНК, но интересно, что их там было очень много, то есть массовый, экологически значимый вид. Мы поехали на Милос, пользуясь тем, что были на конференции в Греции, взяли пробы и выделили другого Caldithrix, теперь уже из мелководных гидротерм.
Мы поехали на Милос, пользуясь тем, что были на конференции в Греции, взяли пробы и выделили другого Caldithrix, теперь уже из мелководных гидротерм.
То есть бывают везения, но микробиология уже разработала методы, с помощью которых можно подобраться к этим самым «некультивирвуемым микробам». Ведь во многих случаях они некультивирвуемые только потому, что никто не подобрал правильных условий. Это вообще, конечно, похоже на увлекательный детектив. Вот мы получили какие-то молекулярные данные — и что? Как с ними быть? Как искать этого микроба, как его хотя бы увидеть? Придумали такой метод «FISH», флюоресцентная гибридизация in situ (Fluorescence in situ hybridization). Это означает, что к специфичному для какой-то группы кусочку генома прицепили флуоресцентную краску. Когда такой препарат добавляют в смешанную культуру микробов или в природную пробу, то эта краска, войдя в клетки, прицепится именно к тем микроорганизмам, у которых есть в геноме вот этот кусочек, и таким образом они выявятся из общей популяции.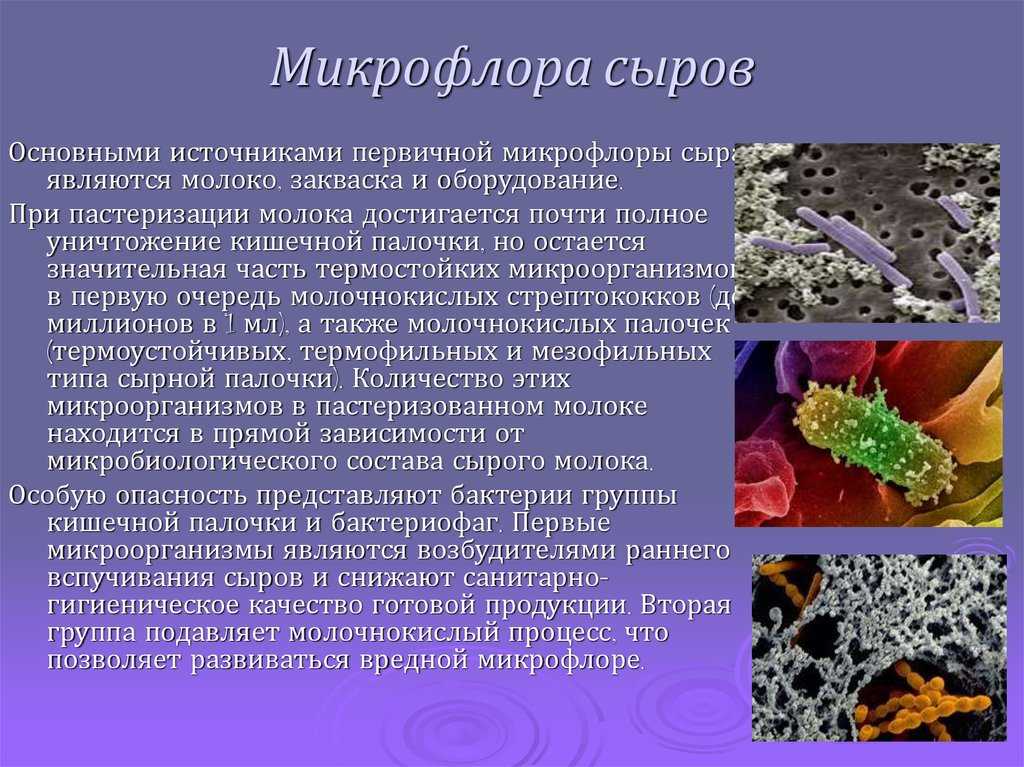 Их можно посчитать, можно увидеть, как они выглядят. Вот пример — анаэробное окисление метана, о котором я в самом начале говорила, там было пунктиром нарисовано окисление метана за счет восстановления сульфата или нитрата. С помощью FISH показали, что в нем участвуют метаногенные археи, которые, видимо, работают в другую строну, метан не образуют, а окисляют, и сульфатредуцирующие бактерии.
Их можно посчитать, можно увидеть, как они выглядят. Вот пример — анаэробное окисление метана, о котором я в самом начале говорила, там было пунктиром нарисовано окисление метана за счет восстановления сульфата или нитрата. С помощью FISH показали, что в нем участвуют метаногенные археи, которые, видимо, работают в другую строну, метан не образуют, а окисляют, и сульфатредуцирующие бактерии.
Ну, а вот это — идеальная схема молекулярно-экологического исследования. Выделяется ДНК из какого-то природного источника, потом консервативный участок генома, который у нас является филогенетическим маркером, выделяется, и с помощью пиросеквенирования — это такой процесс очень быстрого секвенирования, когда можно очень большой объем одновременно отсеквенировать, и с помощью компьютера разделить на группы, — в результате мы получаем количественное соотношение, видим, что какая-то новая группа очень многочисленна, значит, ее-то и надо пытаться получить в лабораторной культуре. Так как мы уже знаем ее этот штрих-код, этот паспорт, этот консервативный участочек, который является филогенетическим маркером, мы делаем соответствующий флуоресцентный зонд (зонд, или проба — это специфичная последовательность с привязанной к ней краской).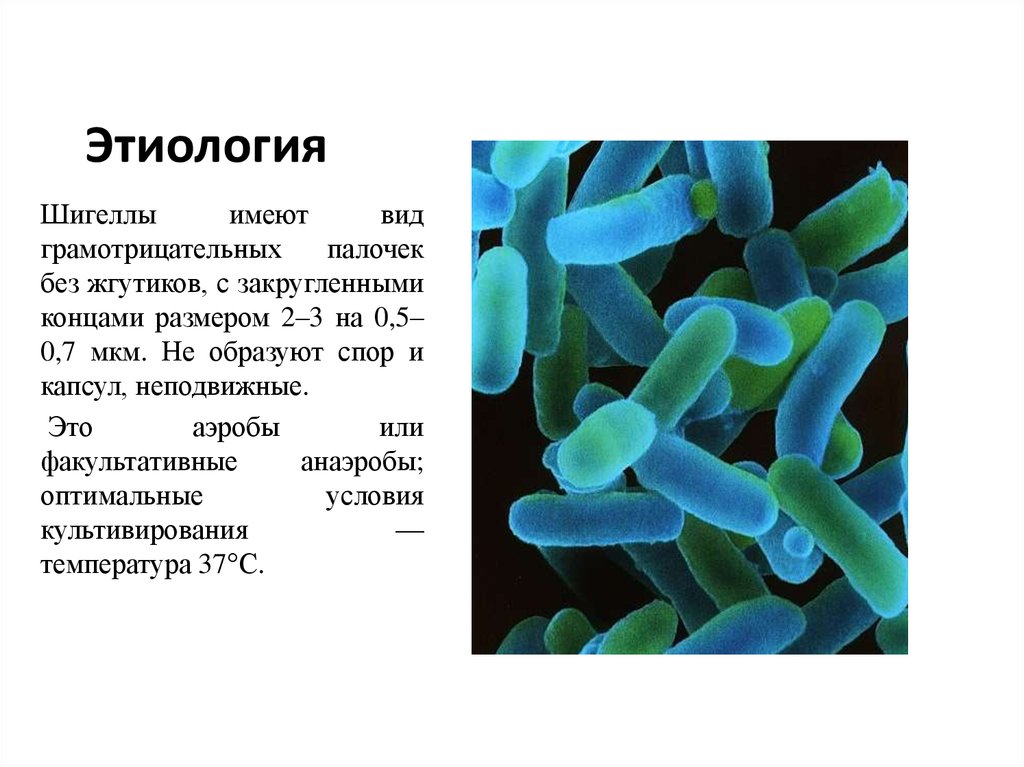 Покрасили природную пробу, и увидели, что вот так вот выглядят эти микробы. Сделали культуры из этой же пробы и, контролируя свои действия с помощью зонда, меняя условия, получили, наконец, чистую культуру. Вот это идеальная схема, и даже и у нас в стране есть люди, которые уже так работают. То есть они выделяют именно то, что важно для этого микробного сообщества. Конечно, проблема в том, что непонятно, какой выбрать субстрат, как начать культивировать? Ты увидел, что чего-то много, ты знаешь, что это очень ценно, ты знаешь, что это интересно, но как к этому двигаться? Можно и к этому как-то подобраться.
Покрасили природную пробу, и увидели, что вот так вот выглядят эти микробы. Сделали культуры из этой же пробы и, контролируя свои действия с помощью зонда, меняя условия, получили, наконец, чистую культуру. Вот это идеальная схема, и даже и у нас в стране есть люди, которые уже так работают. То есть они выделяют именно то, что важно для этого микробного сообщества. Конечно, проблема в том, что непонятно, какой выбрать субстрат, как начать культивировать? Ты увидел, что чего-то много, ты знаешь, что это очень ценно, ты знаешь, что это интересно, но как к этому двигаться? Можно и к этому как-то подобраться.
Вот это последний слайд, это уже в XXI век мы окончательно переместились. Что делается сейчас, как формулируется главная задача? Это — связь филогении и функции. Филогения — это ответ на вопрос «кто это?» — и мы получаем ответ с помощью молекулярных методов. Функция — это ответ на вопрос «что делают?». Как подобраться к ответу на него? Во-первых, существует метагеномика — это секвенирование больших участков генома. И если там окажется какой-то функциональный ген и филогенетический маркер, тогда мы можем их связать между собой. Уже несколько крупнейших открытий сделано подобным образом. Стабильно-изотопная проба: если в филогенетических маркерах обнаруживаются стабильные изотопы, которые были даны смеси микробов в виде какого-то субстрата, значит, тоже мы связали конкретного микроба с конкретной функцией. Количественная ПЦР — эта та самая ПЦР, о которой я вам рассказывала, но в некоторой модификации она может использоваться как количественный метод. Тогда мы тоже сможем узнать, что какого-то микроба много в каких-то определенных условиях, и тоже связать с функцией. Очень важно, что сейчас уже огромные базы данных созданы, потому что каждая последовательность, природная или из какой-то культуры, отправляется в общий банк данных, и чем дальше, тем их больше, тем легче работать, потому что ты можешь найти какой-то аналог тому, что ты нашел. Уже и по функциональным генам, которые обуславливают какие-то процессы, тоже есть огромные базы, и можно таким образом понять, что это за микроб, который какую-то определенную функцию выполняет.
И если там окажется какой-то функциональный ген и филогенетический маркер, тогда мы можем их связать между собой. Уже несколько крупнейших открытий сделано подобным образом. Стабильно-изотопная проба: если в филогенетических маркерах обнаруживаются стабильные изотопы, которые были даны смеси микробов в виде какого-то субстрата, значит, тоже мы связали конкретного микроба с конкретной функцией. Количественная ПЦР — эта та самая ПЦР, о которой я вам рассказывала, но в некоторой модификации она может использоваться как количественный метод. Тогда мы тоже сможем узнать, что какого-то микроба много в каких-то определенных условиях, и тоже связать с функцией. Очень важно, что сейчас уже огромные базы данных созданы, потому что каждая последовательность, природная или из какой-то культуры, отправляется в общий банк данных, и чем дальше, тем их больше, тем легче работать, потому что ты можешь найти какой-то аналог тому, что ты нашел. Уже и по функциональным генам, которые обуславливают какие-то процессы, тоже есть огромные базы, и можно таким образом понять, что это за микроб, который какую-то определенную функцию выполняет. Ну и, наконец, последнее — это секвенирование генома индивидуальной клетки, это тоже сейчас уже делается, то есть удается размножить не кусочек генома, а весь геном целиком. Тут другой вопрос — как выбрать эту клетку для секвенирования? На это тоже есть ответ, но уже не буду сейчас в это вдаваться.
Ну и, наконец, последнее — это секвенирование генома индивидуальной клетки, это тоже сейчас уже делается, то есть удается размножить не кусочек генома, а весь геном целиком. Тут другой вопрос — как выбрать эту клетку для секвенирования? На это тоже есть ответ, но уже не буду сейчас в это вдаваться.
В общем, я заканчиваю на оптимистической ноте: «Охота за микробами продолжается!»
Обсуждение лекции
Борис Долгин: Спасибо большое. Я бы для начала, может быть, спросил вот о чем. Не опасно ли такое разделение между микробиологией общей и медицинской? Не получается ли дублирование каких-то вещей в части методов, в части, может быть, того же самого филогенетического анализа, если они этим занимаются? И в связи с этим же. Ведь они-то, наверное, были избавлены от культа чистой культуры, хотя бы отчасти. Потому что они-то вынуждены были работать в поле человеческого организма.
Елизавета Бонч-Осмоловская
(фото Н. Четвериковой)
Елизавета Бонч-Осмоловская: Нет, чистая культура — это была совершенно необходимая вещь на определенном этапе. Чистые культуры и были придуманы Кохом именно для медицинских целей.
Чистые культуры и были придуманы Кохом именно для медицинских целей.
Борис Долгин: Как инструмент?
Елизавета Бонч-Осмоловская: Да. Микроорганизм невозможно изучить, не получив его одинаковые клетки в большом количестве. Это тогда был единственный способ. Что касается того, что что-то значительное может оказаться неизвестным, я думаю, что такой опасности нет, потому что есть общие научные журналы, которые все великое выхватывают и печатают. И я не думаю, что что-то ускользнет от нас. Но мой опыт говорит о том, что совершенно разные вещи нас интересуют. Медики очень много занимаются вирулентностью, патогенностью, генетическими детерминантами патогенности и так далее. И даже таксономия там гораздо более детальная, потому что там действительно все безумно важно, и штаммовые различия имеют огромное значение. А у нас все крупными мазками, то есть совершенно в разных плоскостях работаем.
Михаил Гельфанд: Во-первых, продолжение этого вопроса. У меня как раз есть такое ощущение, что сейчас эти науки будут сливаться, потому что какое-нибудь изучение сообщества бактерий, которые живут в кишках у человека, и которых там больше, чем самого человека, — это явно уже, так сказать, по задачам медицинская микробиология, а по методам — общая.
У меня как раз есть такое ощущение, что сейчас эти науки будут сливаться, потому что какое-нибудь изучение сообщества бактерий, которые живут в кишках у человека, и которых там больше, чем самого человека, — это явно уже, так сказать, по задачам медицинская микробиология, а по методам — общая.
Елизавета Бонч-Осмоловская: Да, конечно.
Михаил Гельфанд: Во-первых, я хотел сказать, просто для протокола, что не Вёзе придумал молекулярную филогенетику, а идея принадлежит, как все идеи в биологии, Крику, а первое технические воплощение — Цукеркандлю и Полингу. Вёзе просто придумал, что надо смотреть на рибосомную РНК, и что это можно и к микробам применять. Ну, это чтобы просто картинка была правильная.
Елизавета Бонч-Осмоловская: Ну, да.
Михаил Гельфанд: А содержательный вопрос и, по-моему, интересный вот какой. Вы говорили, что микробы намного проще, чем эукариоты. Но при этом у них же есть все. Во-первых, у них есть вся биохимия, которая есть у эукариот.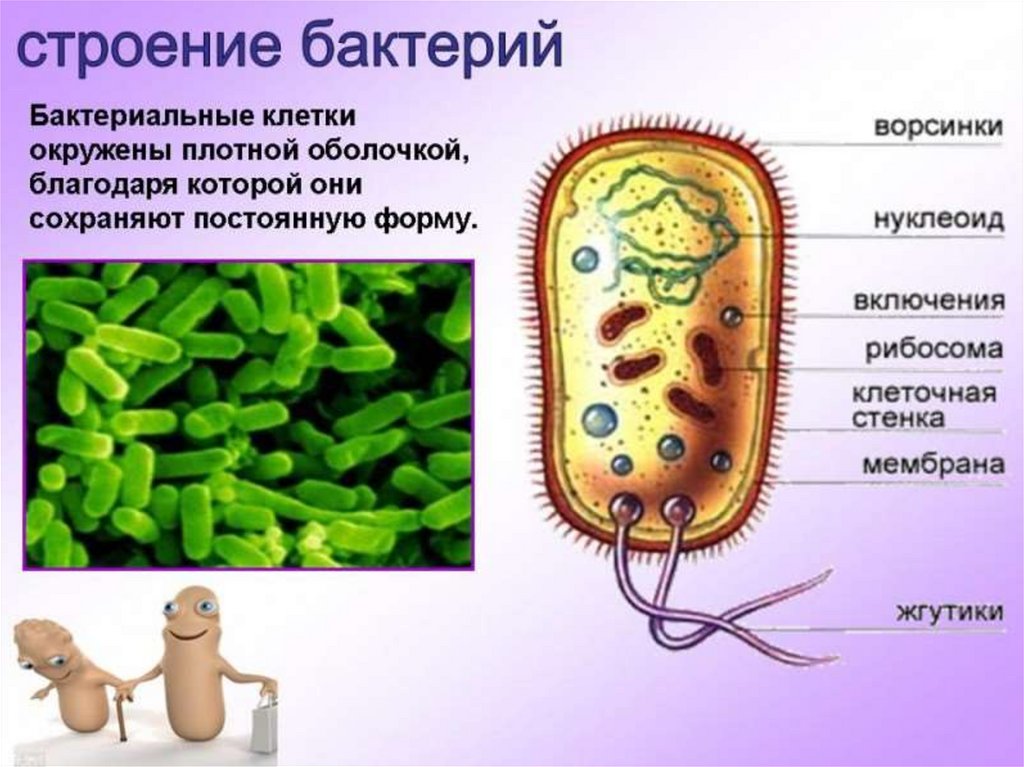 Любая реакция, которая найдется у эукариот, рано или поздно найдется у бактерии, у которой она стянута. И по структуре тоже. Есть какие-то, я не помню, кто там с нуклеотидами, какое-то такое вроде как ядро, но не совсем. Есть бактерии, которые имеют специализацию клеток, у цианобактерий. С одной стороны, что им помешало стать эукариотами? Вот почему бактерии не стали многоклеточными, как эукариоты? Что им помешало стать сложными? Я прошу прощения, я плохо сформулировал. По частям у них как бы все есть, а такой сложности, какая есть у эукариотической клетки целиком, вроде бы все-таки нет.
Любая реакция, которая найдется у эукариот, рано или поздно найдется у бактерии, у которой она стянута. И по структуре тоже. Есть какие-то, я не помню, кто там с нуклеотидами, какое-то такое вроде как ядро, но не совсем. Есть бактерии, которые имеют специализацию клеток, у цианобактерий. С одной стороны, что им помешало стать эукариотами? Вот почему бактерии не стали многоклеточными, как эукариоты? Что им помешало стать сложными? Я прошу прощения, я плохо сформулировал. По частям у них как бы все есть, а такой сложности, какая есть у эукариотической клетки целиком, вроде бы все-таки нет.
Елизавета Бонч-Осмоловская: Они стали. Они превратились в многоклеточных. Они стали органеллами. Ведь считается, что митохондрии и хлоропласты — это все прокариоты, симбионты, которые потом стали органеллами эукариотной клетки. Другое дело, почему они остались в своем теперешнем состоянии? Вот это, может быть, надо спросить. Потому что они заняли свои ниши. Интересно другое, почему вот эти замечательные свойства микробов, способность, например, фиксировать азот, почему она не передалась высшим существам? Как бы хорошо они жили.
Борис Долгин: А не могла появиться просто уже после разделения?
Михаил Гельфанд: Нет, конечно, потому что у протеобактерий — это митохондрии, а фиксируют азот те же самые бактерии.
Елизавета Бонч-Осмоловская: Почему вот все эти замечательные качества, почему они все остались в мире бактерий? Мне кажется, что вот эти все многочисленные энергетические процессы, это сейчас можно воспринимать как такой музей. Вот эти все эксперименты природы или Творца. То-сё, пятое-десятое. А потом, когда нашли фотосинтез и кислородное дыхание, и уже сюда устремилась эволюция.
Борис Долгин: В сторону энергоэффективности?
Елизавета Бонч-Осмоловская: Да, потому что именно эти процессы дают достаточное количество энергии, чтобы организм был достаточно большой, и сложный, и многоклеточный.
Борис Долгин: Любимым вопросом моего коллеги Дмитрия Ицковича является: «За что вы собираетесь получить Нобелевскую премию?» Хотя бы в метафорическом смысле. Вы, ваши коллеги. Что из ваших открытий кажется вам действительно кардинальным, ключевым? Вы явно упоминали это, но как-то чуть-чуть относили на периферию, как будто бы стесняясь. Можно ли как-то подробнее?
Вы, ваши коллеги. Что из ваших открытий кажется вам действительно кардинальным, ключевым? Вы явно упоминали это, но как-то чуть-чуть относили на периферию, как будто бы стесняясь. Можно ли как-то подробнее?
Елизавета Бонч-Осмоловская: Я сказала об этой новой реакции, которую мы нашли. Этот процесс известен очень давно — как процесс, который микробы осуществляют, но жить за счет него не могут. Это образование водорода из формиата. Потому что во всех учебниках написано, что он не дает энергии. Есть некая величина, которой обозначается энергетический выход реакции, и она должна быть сильно отрицательной, а тут она даже чуть-чуть положительная, то есть эта реакция не может являться энергодающим процессом для живого организма. А мы нашли таких микробов, и оказалось, что реакция эта дает достаточно энергии. Там просто условия очень сильно влияют на пограничные области, где плюс-минус, и в наших условиях эта величина была достаточно отрицательна. И микробы, которых мы нашли, — это как раз гипертермофилы из глубоководных гидротерм, которые растут за счет этой реакции. Но это все-таки частные вещи. Мне бы хотелось сделать, и я мечтаю, что, может быть, это мои молодые сотрудники сделают, — мне бы хотелось найти автономное прокариотное сообщество, которое живет за счет хемосинтеза, которое не зависит от современной биосферы. А это, кстати, очень трудная задача, потому что, например, кислород в глубоководных гидротермах, где беспозвоночные живут за счет хемосинтезирующих микробов, все-таки к ним приходит с океанской водой, где он образовался в результате фотосинтеза.
Но это все-таки частные вещи. Мне бы хотелось сделать, и я мечтаю, что, может быть, это мои молодые сотрудники сделают, — мне бы хотелось найти автономное прокариотное сообщество, которое живет за счет хемосинтеза, которое не зависит от современной биосферы. А это, кстати, очень трудная задача, потому что, например, кислород в глубоководных гидротермах, где беспозвоночные живут за счет хемосинтезирующих микробов, все-таки к ним приходит с океанской водой, где он образовался в результате фотосинтеза.
Борис Долгин: А где такое могло бы сохраниться?
Елизавета Бонч-Осмоловская: Я очень надеюсь на подземные местообитания, где много микробов, и за счет чего они там живут, совершенно неизвестно. Там где нефть — это более или менее понятно, потому что там вообще очень много органического вещества, и там есть сообщества, которые на этом органическом веществе живут. Но микробные сообщества есть и там, где уже не осадочные породы, а скалы. И там тоже происходят какие-то процессы — то ли радиолиз воды, в результате чего образуется водород, который используют микробы, то ли реакции серпинтизации, о чем я говорила, в результате которых абиогенно образуются очень простые маленькие органические субстраты, за счет которых эти микробы растут. Я бы хотела найти такое сообщество и показать, что оно полноценно существует.
Я бы хотела найти такое сообщество и показать, что оно полноценно существует.
Борис Долгин: Что ему не нужны, в общем-то, более сложные организмы?
Елизавета Бонч-Осмоловская: Да, мы всегда в заявках на гранты так и пишем — что вот аналог древних или внеземных экосистем. Это очень хорошо работает.
Борис Долгин: А кому вы пишете заявки на грант?
Елизавета Бонч-Осмоловская: На самом деле, я всегда, когда пишу, верю довольно слабо. Но, побывав в этих подземных южноафриканских шахтах, я как-то подумала, что хорошо бы правда найти что-то подобное. Заявки куда только не пишем. Везде приходится.
Андрей Летаров: Я проникся глубоким уважением за эту последнюю фразу. Обычно пишут о какой-то угрозе, оценка угрозы колонизации Земли внеземными экосистемами такого типа. Но все-таки вопрос мой не про это. Я вспомнил, что когда я был студентом, на лекции по микробиологии рассказывали примерно следующую историю. Что некие исследователи заинтересовались устойчивостью бактерий к высоким гидростатическим давлениям. И оказалось, что наиболее устойчивых бактерий им удалось найти не в образцах из глубоководных слоев воды, а из цветочного горшка, который у них в лаборатории стоял на окне. И вопрос у меня вот какой. А как вы отнеслись бы к идее некого создания экстремофильных ниш с заранее заданными условиями и, собственно говоря, ожидания того, что там поселится кто-нибудь забавный? Вот, например, у меня есть давняя мечта поставить во дворе нашего с вами института бочку с богатой питательной средой, поместить в нее кипятильник и полгода к ней не подходить, а потом, соответственно, сделать метагеном того, что там вырастит.
Что некие исследователи заинтересовались устойчивостью бактерий к высоким гидростатическим давлениям. И оказалось, что наиболее устойчивых бактерий им удалось найти не в образцах из глубоководных слоев воды, а из цветочного горшка, который у них в лаборатории стоял на окне. И вопрос у меня вот какой. А как вы отнеслись бы к идее некого создания экстремофильных ниш с заранее заданными условиями и, собственно говоря, ожидания того, что там поселится кто-нибудь забавный? Вот, например, у меня есть давняя мечта поставить во дворе нашего с вами института бочку с богатой питательной средой, поместить в нее кипятильник и полгода к ней не подходить, а потом, соответственно, сделать метагеном того, что там вырастит.
Голос из зала: Любая ТЭЦ так работает.
Елизавета Бонч-Осмоловская: Наш институт как раз на задворках ТЭЦ находится, и на нас постоянно проливаются какие-то кислотные дожди. Поэтому эта бочка очень будет хорошо там функционировать. Ван-Ниль, по-моему, говорил, что все есть везде. Я вообще-то в это верю. Хотя у нас был такой проект по теплосети, в 1990-е годы, когда за все хватались, чтобы хоть немножко себя поддержать. Мы должны были понять, почему трубы в московской теплосети коррозируют, какие микробы вызывают эту коррозию. Я, конечно, очень надеялась, что мы выделим каких-то замечательных микробов. Но микробы были самые обычные, не те, которые есть в вулканических местообитаниях. А молекулярных методов, к сожалению, у нас еще не было. Может, стоит, вообще, все повторить. Конечно, интересно. Вот кстати, есть пример замечательный: мы из Курьяновской водоочистной станции взяли пробу и оттуда выделили микроба, который называется Sulfophobococcus zilligi, обитающая в Исландии гипертермофильная архея. И вдруг она обнаруживается у нас на Курьяновской станции. Откуда? Мы все время друг друга подозреваем, что что-то мы занесли из своих закромов и потом открыли заново. Но этого микроба у нас не было никогда, мы специально выписали исходный штамм для сравнения из немецкой коллекции.
Я вообще-то в это верю. Хотя у нас был такой проект по теплосети, в 1990-е годы, когда за все хватались, чтобы хоть немножко себя поддержать. Мы должны были понять, почему трубы в московской теплосети коррозируют, какие микробы вызывают эту коррозию. Я, конечно, очень надеялась, что мы выделим каких-то замечательных микробов. Но микробы были самые обычные, не те, которые есть в вулканических местообитаниях. А молекулярных методов, к сожалению, у нас еще не было. Может, стоит, вообще, все повторить. Конечно, интересно. Вот кстати, есть пример замечательный: мы из Курьяновской водоочистной станции взяли пробу и оттуда выделили микроба, который называется Sulfophobococcus zilligi, обитающая в Исландии гипертермофильная архея. И вдруг она обнаруживается у нас на Курьяновской станции. Откуда? Мы все время друг друга подозреваем, что что-то мы занесли из своих закромов и потом открыли заново. Но этого микроба у нас не было никогда, мы специально выписали исходный штамм для сравнения из немецкой коллекции. Так что вот, Курьяновская станция, пожалуйста.
Так что вот, Курьяновская станция, пожалуйста.
Елена Сулимина, ассистент кафедры термодинамики РГУ Нефти и Газа им. Губкина: Я как раз в ходе диссертации изучала процессы коррозии, только с термодинамической точки зрения, и микробная коррозия — это тоже большой раздел этого процесса. Но вопрос в будущем, мы все, как вы уже заметили, мы все перешли в XXI век и сейчас мы должны думать: да, мы замечательно изучаем все в пробирках, в лаборатории, но главный вопрос, даже первая глава в диссертации — это практическое применение. То есть как мы можем использовать все эти наши достижения, если микробов используем, например, для очистки от заражения нефтепродуктами. Вот как максимально полезно для человечества, для нашей планеты их использовать, какие могут быть практические решения и предложения, если они еще и не реализованы, то вы хотя бы предлагаете?
Михаил Гельфанд: Это вас институт нефти и газа такому учит?
Елена Сулимина: Да, учит. Наши исследования, прежде всего, — думать, что, зачем и как? Что ты делаешь, зачем и нужно ли это кому-то?
Наши исследования, прежде всего, — думать, что, зачем и как? Что ты делаешь, зачем и нужно ли это кому-то?
Борис Долгин: А если окажется, что не нужно, что делать? Но понятно, как исследовать.
Елена Сулимина: Заходишь в патентное бюро, и это очень печально, когда видишь очень много патентов: люди сделали, а это практически не применяется.
Борис Долгин: Патент — это исключительно в прикладной науке.
Елена Сулимина: Но наша наука прикладная — и ваша тоже, я уверена, если находятся исландские микробы потом в другой какой-то станции Курьяновской.
Елизавета Бонч-Осмоловская: Наша наука абсолютно не прикладная. Мы занимаемся фундаментальной наукой, но мне всегда очень хотелось, чтобы моя работа как-то пригодилась и использовалась. И я хочу сказать вам очень важную вещь. Не нужно придумывать, куда бы девать то, что вы сделали. Нужно идти с другой стороны. Нужно, чтобы у вас был заказчик, который вам скажет: мне нужно это и это. А вы выполните эту работу. Потому что мы не знаем рынка, мы не знаем промышленности, мы не знаем их потребностей. Все что мы выдумаем, это будет что-то такое для министерства науки, может быть, это все сгодится для отчетов, но это никогда не будет применено. Мы вообще очень много сил на это положили, и очень нам хотелось, чтобы наши микробы использовались и, действительно, три или четыре фермента из наших микробов используются, все в молекулярной биологии. Потому что как раз для полимеразной цепной реакции нужны термостабильные ферменты, чтобы их можно было нагревать — и чтобы они продолжали работать. И вот две компании — одна немецкая, другая литовская — из наших микробов сделали продукты. Но мы сами ни за что бы, никогда бы в жизни этого не добились, это совершенно другая специальность.
А вы выполните эту работу. Потому что мы не знаем рынка, мы не знаем промышленности, мы не знаем их потребностей. Все что мы выдумаем, это будет что-то такое для министерства науки, может быть, это все сгодится для отчетов, но это никогда не будет применено. Мы вообще очень много сил на это положили, и очень нам хотелось, чтобы наши микробы использовались и, действительно, три или четыре фермента из наших микробов используются, все в молекулярной биологии. Потому что как раз для полимеразной цепной реакции нужны термостабильные ферменты, чтобы их можно было нагревать — и чтобы они продолжали работать. И вот две компании — одна немецкая, другая литовская — из наших микробов сделали продукты. Но мы сами ни за что бы, никогда бы в жизни этого не добились, это совершенно другая специальность.
Борис Долгин: Тут вопрос заказчика на самом деле.
Елизавета Бонч-Осмоловская: Да. И с этим в нашей стране большая проблема.
Борис Долгин: С воспитанием квалифицированного заказчика, который будет знать, кому и как это делать.
Елизавета Бонч-Осмоловская: Потому что у нас нет заказчика, у нас нет промышленности, у нас нет людей, которым такое нужно.
Голос из зала: Ну, как? В нефти и газе до фига заказчиков.
Елизавета Бонч-Осмоловская: Не знаю. Что-то они к нам пока не обращались.
Елена Сулимина: Касательно экологии, я хочу сказать, что из нашего института ребята, которые изучают экологию, постоянно приводят какие-то статьи, что есть возможность использовать, допустим, для той же экологической катастрофы в Мексиканском заливе. Огромнейшие разливы. Но бонами мы можем сто лет собирать эту нефть, которая осела. А если заселить туда целые миллиарды колоний микробов, может, они и справятся. Как те же микробы, которых вы изучаете, они живут за счет углеводородов, может быть, так и надо и предложить ребятам помочь?
Елизавета Бонч-Осмоловская
(фото Н. Четвериковой)
Елизавета Бонч-Осмоловская: Это просто вопрос: какая у вас цель. У нас в институте есть компания, и они, по-моему, довольно успешны, производят препарат, который вот эти всякие нефтяные загрязнения уничтожает. Но нужно все остальное бросить и заниматься только этим, и ты тогда добьешься успеха. Это очень серьезное дело. Вот так вот, между делом, не получится. Я считаю, что мы свое дело делаем. Мы находим новых микробов, и, если говорить о прикладном значении этих новых достижений, теперь можно гены новые уже искать прямо в природе, оттуда их вытаскивать и использовать. Вот мы как раз в таком новом проекте участвуем, европейском. Так что, может быть, что-то хорошее и сделаем, потому что этот проект вместе с представителями фирм.
У нас в институте есть компания, и они, по-моему, довольно успешны, производят препарат, который вот эти всякие нефтяные загрязнения уничтожает. Но нужно все остальное бросить и заниматься только этим, и ты тогда добьешься успеха. Это очень серьезное дело. Вот так вот, между делом, не получится. Я считаю, что мы свое дело делаем. Мы находим новых микробов, и, если говорить о прикладном значении этих новых достижений, теперь можно гены новые уже искать прямо в природе, оттуда их вытаскивать и использовать. Вот мы как раз в таком новом проекте участвуем, европейском. Так что, может быть, что-то хорошее и сделаем, потому что этот проект вместе с представителями фирм.
Елена Сулимина: И Нобелевскую премию потом?
Елизавета Бонч-Осмоловская: Нет, нет. За прикладную работу там совсем другие награды.
Борис Долгин: На самом деле это очень важный момент — о необходимости разделения труда между теми, кто непосредственно добывает новые знания, и теми, кто умеет, кто имеет некоторый взгляд для проектирования того, из каких потребностей может понадобиться что-то из нового знания. Кто будет достаточно эрудирован в этом знании, но и эрудирован в потребностях, кто может соединить их.
Кто будет достаточно эрудирован в этом знании, но и эрудирован в потребностях, кто может соединить их.
Алексей Гиляров, биофак МГУ: У меня, Елизавета Александровна, такой вопрос. Вот вы сказали, что только 5% микроорганизмов известно в этом сообществе. И сейчас вы наверняка знаете, что время от времени появляются статьи, где утверждается, что вообще основное разнообразие жизни видовое — это, прежде всего, микробное разнообразие. Хотя до сих пор мы учим студентов, что это все-таки в основном членистоногие, в частности, насекомые. Но поскольку тут, я думал, вообще одни биологи, а оказывается, не только биологи, поэтому я поясню, что виды — они у высших животных, у растений — это все-таки организмы, которые могут между собой скрещиваться и давать плодовитое потомство, а вот про бактерий есть известная…
Борис Долгин: Это внутри вида.
Алексей Гиляров: Внутри вида, да, конечно. То есть вид — это то, что скрещивается и дает плодовитое потомство. А есть такая статья, наверняка вам известная, не помню сейчас точно фамилий авторов, она в PNASе, в трудах американской академии была опубликована, чем бактерия вообще отличается от эукариот. Там маленькие размеры, быстро размножаются и так далее, но там есть замечательная фраза, которую я студентам тоже говорю, — это частота именно полового процесса — обмена генами. И там есть такая фраза, что с точки зрения бактерий — прокариот — эукариоты, в том числе и мы с вами — это сексуальные маньяки, склонные к инцесту. Они делают это слишком часто и со слишком близкими родственниками. Ну, а у бактерий все это не так. Вот вопрос у меня все же по поводу числа видов бактерий. И вообще, может быть, не надо говорить «вид» про бактерий. А говорить какой-нибудь «kind», и вместо species какое-то слово придумать? Спасибо.
А есть такая статья, наверняка вам известная, не помню сейчас точно фамилий авторов, она в PNASе, в трудах американской академии была опубликована, чем бактерия вообще отличается от эукариот. Там маленькие размеры, быстро размножаются и так далее, но там есть замечательная фраза, которую я студентам тоже говорю, — это частота именно полового процесса — обмена генами. И там есть такая фраза, что с точки зрения бактерий — прокариот — эукариоты, в том числе и мы с вами — это сексуальные маньяки, склонные к инцесту. Они делают это слишком часто и со слишком близкими родственниками. Ну, а у бактерий все это не так. Вот вопрос у меня все же по поводу числа видов бактерий. И вообще, может быть, не надо говорить «вид» про бактерий. А говорить какой-нибудь «kind», и вместо species какое-то слово придумать? Спасибо.
Елизавета Бонч-Осмоловская: Но это такой важный и сложный вопрос, потому что род у бактерий, действительно, реален. А вот вид — это некоторый такой фантом, но, тем не менее, пока виды сохраняются. Есть очень четкие критерии молекулярные и рода и вида. Род основан как раз на этом филогенетическом маркере, введенным Вёзе, а вид — это уровень гомологии ДНК, который не должен превышать 70%. И это более или менее подтверждается, как правило, и фенотипическими признаками. Просто с фенотипической систематикой у бактерий всегда было очень трудно, потому что без явной иерархии признаков это ужасно субъективно. Это же не высшее существо, у которых все как-то по полочкам. А у бактерий, например, нам кажется, что очень важна автотрофия. И вдруг оказывается, что ген автотрофного роста может быть как раз перенесен от одного микроорганизма другому. И тут все так сложно, но, тем не менее, вид держится, и очень много людей выступают в защиту вида.
Есть очень четкие критерии молекулярные и рода и вида. Род основан как раз на этом филогенетическом маркере, введенным Вёзе, а вид — это уровень гомологии ДНК, который не должен превышать 70%. И это более или менее подтверждается, как правило, и фенотипическими признаками. Просто с фенотипической систематикой у бактерий всегда было очень трудно, потому что без явной иерархии признаков это ужасно субъективно. Это же не высшее существо, у которых все как-то по полочкам. А у бактерий, например, нам кажется, что очень важна автотрофия. И вдруг оказывается, что ген автотрофного роста может быть как раз перенесен от одного микроорганизма другому. И тут все так сложно, но, тем не менее, вид держится, и очень много людей выступают в защиту вида.
Михаил Гельфанд: Я не знаю, здесь место устраивать научный диспут?
Борис Долгин: Почему нет?
Михаил Гельфанд: Тогда, значит, формальное определение бактериального вида — это то у чего рибосомная РНК похожа на 97% и больше.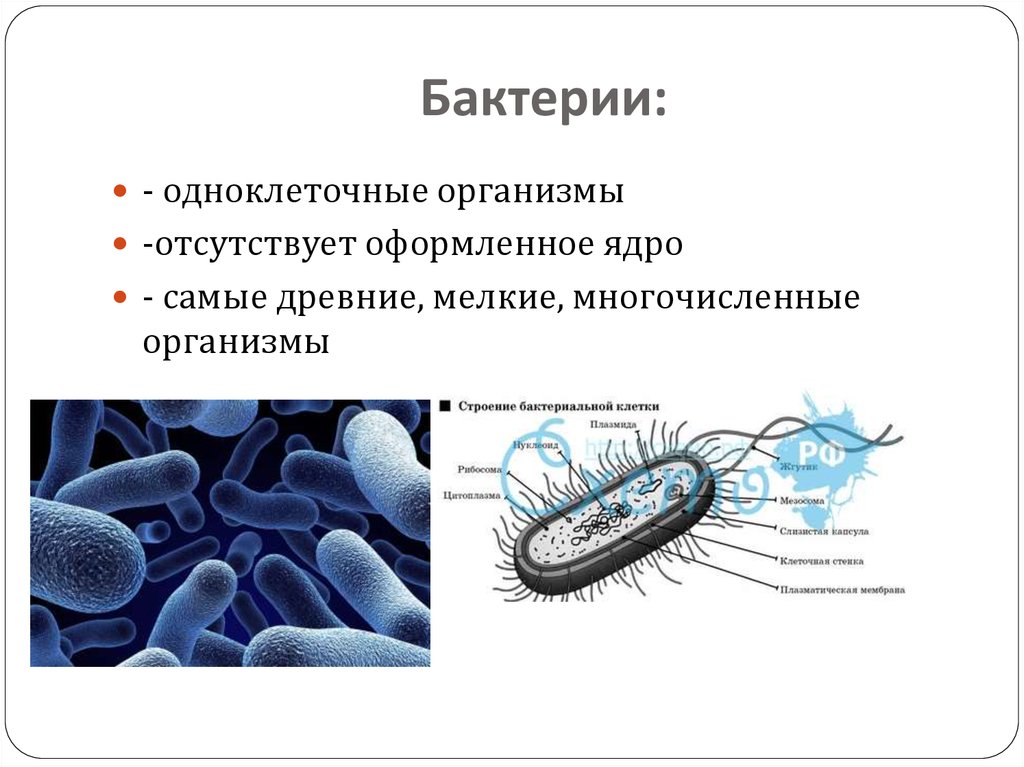
Елизавета Бонч-Осмоловская: Нет, неправильно.
Михаил Гельфанд: Ну, хорошо. В тех статьях, которые я читал, так было написано. Видом будем считать вот это. И с этой точки зрения… Хорошо. Если род реален, тогда откуда взялось такое колоссальное количество переименований как раз родовых названий, после того как появилась молекулярная систематика? Это первый вопрос. И второй вопрос: кишечная палочка и шигелла, которая одна Escherichia, а другая Shigella — это вроде бы разные роды, но ежу ясно, что это один вид, причем довольно близкий.
Елизавета Бонч-Осмоловская: Насчет того, что появилось очень много новых родов…
Михаил Гельфанд: Переименование, когда из рода в род перекидывают туда и обратно.
Елизавета Бонч-Осмоловская: Да. Например, почти все термофилы стали из видов отдельными родами, потому что оказалось, что термофилия — это очень важный таксономический признак.
Борис Долгин: В каком смысле оказалось? То есть что заставило изменить представление?
Елизавета Бонч-Осмоловская: Молекулярные исследования были поддержаны фенотипом. Собственно, я считаю, что если нам верить Вёзе, и есть такой генетический маркер, то таким образом мы получаем иерархию фенотипических признаков и видим, какие важны для таксономии, а какие не важны. Что касается вида, то вид — это большая проблема: что считать одним видом, что считать разными. И это ужасно субъективно. Вот у медицинских микробиологов — там какой-нибудь другой сусбстрат использует — все — уже новый вид. Потому что для них это важно. А у нас, конечно, это не так. Но, мне кажется, что пока надо придерживаться гомологии 70%, а 16S РНК может быть и 99% и даже 99,9%, если гомология достаточно низкая.
Собственно, я считаю, что если нам верить Вёзе, и есть такой генетический маркер, то таким образом мы получаем иерархию фенотипических признаков и видим, какие важны для таксономии, а какие не важны. Что касается вида, то вид — это большая проблема: что считать одним видом, что считать разными. И это ужасно субъективно. Вот у медицинских микробиологов — там какой-нибудь другой сусбстрат использует — все — уже новый вид. Потому что для них это важно. А у нас, конечно, это не так. Но, мне кажется, что пока надо придерживаться гомологии 70%, а 16S РНК может быть и 99% и даже 99,9%, если гомология достаточно низкая.
Михаил Гельфанд: С точки зрения 70% две кишечных палочки будут, так сказать…
Елизавета Бонч-Осмоловская: Но при этом гомология должна быть меньше 70%. А насчет E. coli я думаю, что ей просто уже пора ставить памятник, и поэтому не хотят ее с какой-то Shigella объединять. Чисто такой историко-культурный феномен, я думаю.
Тимофеев, коммерческая компания: Говорят, на Венере очень плохая экосистема, там большая температура и очень кислотная среда. Ваши термофильные ацедофилы могли бы ситуацию исправить?
Борис Долгин: Плохая для кого экосистема? Для человека?
Тимофеев: Непригодная для жизни.
Борис Долгин: То есть для жизни человека. Это антропоцентрический взгляд.
Тимофеев: Я просто читал, слышал о том, что есть какие-то планы, да и вообще в целом, что бактерии могут изменять среду, в том числе и наш кислород, который в нашей атмосфере изначально является продуктом жизнедеятельности бактерий. Может, можно как-то изменить?
Елизавета Бонч-Осмоловская: Это, наверное, имеются в виду цианобактерии. Это прокариоты, но у которых кислородный фотосинтез. Да, я один раз участвовала в таком безумном проекте по организации жизни на Венере, который был очень щедро оплачен какими-то людьми, которые собирались туда переселяться.
Борис Долгин: А что получилось в результате?
Елизавета Бонч-Осмоловская: Мы предложили, что там будет летать такой плавающий остров, на котором будут находиться микробы, которые будут восстанавливать серную кислоту, там облака из серной кислоты. А цианобактерии, кажется, будут этот сероводород окислять. Насколько я понимаю, проблема на Венере в том, что там нет воды, там очень мало воды. Там почему-то водород улетел. А на Земле водород оказался связанным в воду, и потом этот водород идет в органическое вещество, и кислород освобождается, а на Венере неоткуда взять водород для органического вещества. Но как-то мы вышли из положения. Мы им все придумали. Так что ждите.
Евгений Лысенко: Немножко вернусь в вопросик по прокариотам и эукариотам. Такой, может быть, немножко наивный вопрос, но некоторое время назад засел у меня в голове, можете ли вы на него ответить? Если бы цианобактерии не изобрели фотосинтез в том виде, в каком они его изобрели, мог бы существовать весь нынешний очень сложный мир эукариотических организмов?
Елизавета Бонч-Осмоловская: Я думаю, что нет.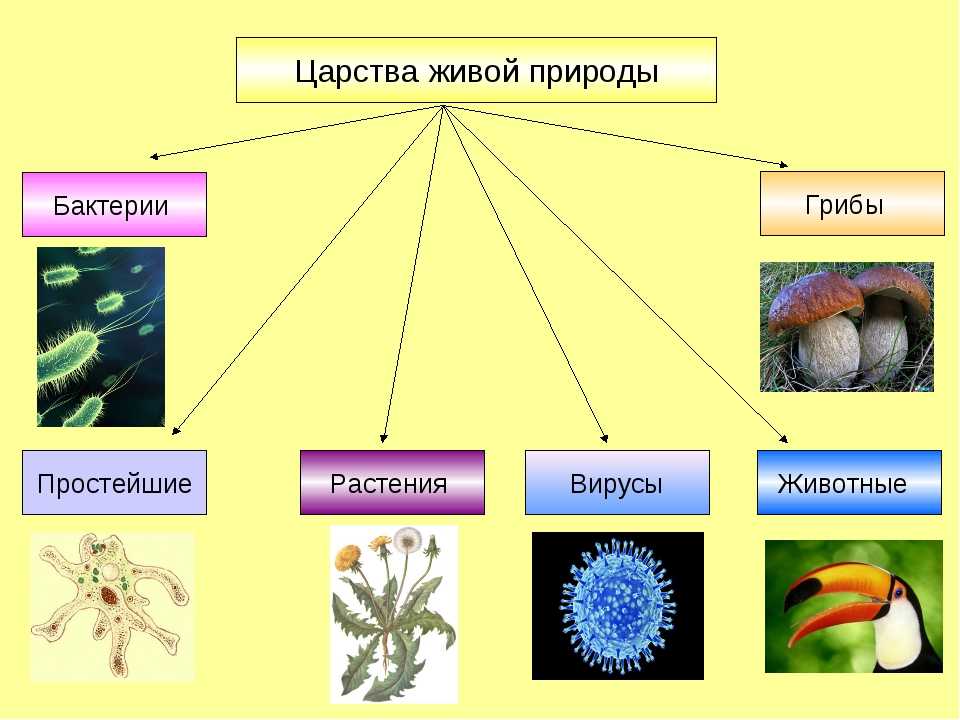 Потому что, видите, все-таки эволюция пошла. Иначе те все тупиковые ветки продолжали бы как-то развиваться, но этого не произошло. И это не потому, что их вытеснили эукариоты с кислородным дыханием, места всем хватило бы, но, тем не менее, этого не произошло. Энергии недостаточно. Они только себя поддерживают в своем таком очень примитивном состоянии. Так что спасибо цианобактериям, что они нам надышали кислорода.
Потому что, видите, все-таки эволюция пошла. Иначе те все тупиковые ветки продолжали бы как-то развиваться, но этого не произошло. И это не потому, что их вытеснили эукариоты с кислородным дыханием, места всем хватило бы, но, тем не менее, этого не произошло. Энергии недостаточно. Они только себя поддерживают в своем таком очень примитивном состоянии. Так что спасибо цианобактериям, что они нам надышали кислорода.
Андрей Летаров: Можно не столько вопрос, сколько некоторую реплику?
Борис Долгин: Можно.
Андрей Летаров: Перед тем как ее произнести, я опять-таки из соображений уважения к нашим далеким предкам, я имею в виду, конечно, не бактерий, а коллег, которые работали в прошлой эпохе, хотел отметить два маленьких замечания. На самом деле Сергей Николаевич Виноградский не открыл Beggiatoa, ее описали в XVIII веке, к сожалению, не помню имени автора. Может быть, Эринберг .
Елизавета Бонч-Осмоловская: Но хемосинтез-то он открыл.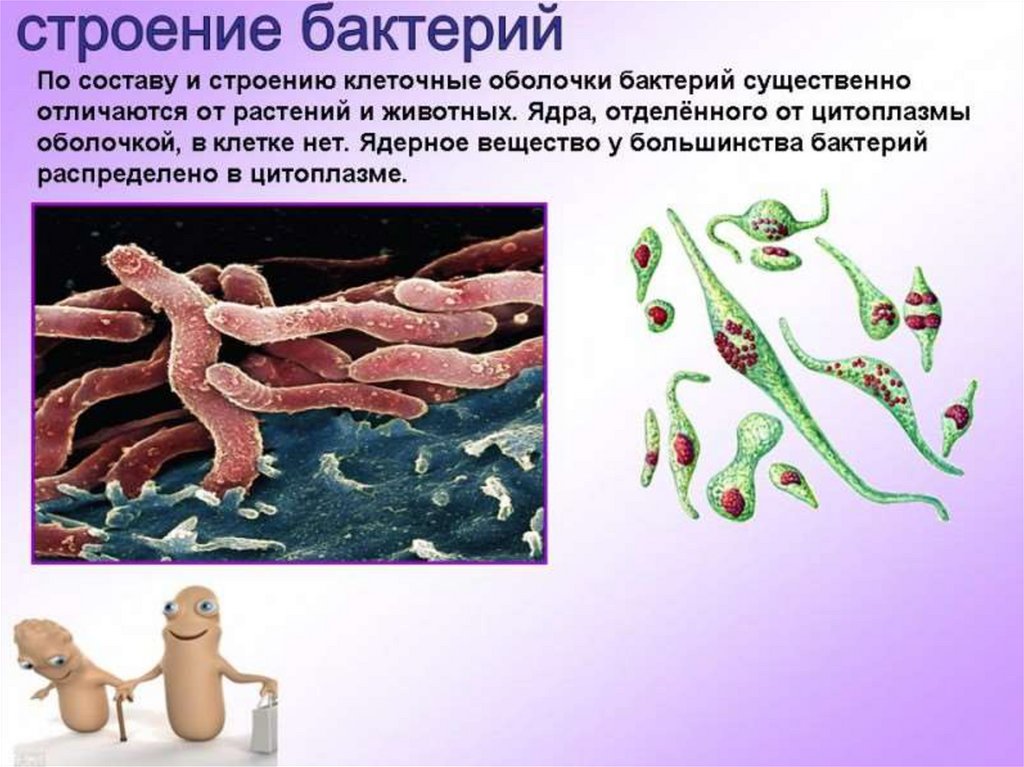
Андрей Летаров: Хемосинтез, безусловно, он. Но саму бактерию он не открывал. Ровно как и нитрификацию, этот процесс использовался для наработки селитры в военных целях значительно раньше, чем он родился. Хотя, конечно, возбудителя описал он. Это так, к слову. А собственно замечание, которое я хотел сделать: у меня есть ощущение, что в реальности микробиология в нашем веке, в XXI веке, будет развиваться не совсем в том ключе, который описала Елизавета Александровна. То есть и в этом тоже, конечно, но, по моему ощущению, исследование бактерий в сообществах — это направление станет важным. Но, тем не менее, некой боковой ветвью развития, так сказать, мейнстримом микробиологии, если иметь в виду под мейнстримом ту область, в которой работает большая часть ученых микробиологов и потребляется большая часть ресурсов, выделяемых на эти исследования. В реальности мне кажется, что следует, наоборот, ждать сближения медицинской, общей и всех прочих видов микробиологии. Осознание того, что бактерии на самом деле устроены не настолько просто. По этому поводу сейчас появляется очень много совершенно ошеломляющих данных. И, на мой взгляд, установление цепочек от того, как устроена клетка, к тому, что происходит с ней в сообществе, будет источником наиболее красивых картинок, о которых лет через 30, возможно, кто-то будет рассказывать в лектории «Полит.ру», если этот проект просуществует так долго.
По этому поводу сейчас появляется очень много совершенно ошеломляющих данных. И, на мой взгляд, установление цепочек от того, как устроена клетка, к тому, что происходит с ней в сообществе, будет источником наиболее красивых картинок, о которых лет через 30, возможно, кто-то будет рассказывать в лектории «Полит.ру», если этот проект просуществует так долго.
Борис Долгин: Надеемся.
Андрей Летаров: Например, если мы обратимся к микроорганизмам, о которых вы говорили, среди любимых вами архей, например, есть микроорганизмы, которые имеют вид квадратиков, очень было бы любопытно, например, услышать объяснения того, каким образом они узнают, где у них углы и каким образом отмеряют, прямые углы или не прямые. Это вопрос, на который можно найти совершенно четкий и рациональный ответ. И это может иметь довольно существенные экологические последствия, потому что если у какого-то штамма этих бактерий что-то с этим механизмом не так, они, естественно, будут образовывать другие слои и, может быть, иначе жить под своим солнцем. И тут-то, по всей видимости, выяснится, что и в свободноживущих сообществах, а не только связанных с животными, человеком, штаммовые различия могут быть важными, но не для того, чтобы выяснить, что употребляет бактерия, что выделяет, а, например, чтобы выяснить, к каким именно частицам, скажем, почвенных минералов она будет липнуть. Или как будет взаимодействовать с другими компонентами каких-нибудь бактериальных факторов.
И тут-то, по всей видимости, выяснится, что и в свободноживущих сообществах, а не только связанных с животными, человеком, штаммовые различия могут быть важными, но не для того, чтобы выяснить, что употребляет бактерия, что выделяет, а, например, чтобы выяснить, к каким именно частицам, скажем, почвенных минералов она будет липнуть. Или как будет взаимодействовать с другими компонентами каких-нибудь бактериальных факторов.
Елизавета Бонч-Осмоловская: Я думаю, все это будет определяться тем, что является вашим предметом исследования. Если ваш предмет клетка — это одно. Если ваш предмет — сообщество — это другое. Если ваш предмет — биоценоз — это третье. Это очень-очень важно — сформулировать свою задачу. К тому, что вы сказали о том, что наука пойдет по исследованию каких-то сложных взаимодействий, я могу еще более яркий пример привести: оказывается, микроорганизмы передают друг другу электроны, с помощью таких «проводов», которые они специально для этого выращивают. И они функционируют фактически как биологические донор и акцептор. Соответственно, они могут передавать электроны и на катод, и принимать их с анода. Этим всем сейчас очень активно занимаются. Но я думаю, все возможно. Нет, меня другое интересует. Один академик недавно сказал, что такой науки, как микробиология, больше не существует.
И они функционируют фактически как биологические донор и акцептор. Соответственно, они могут передавать электроны и на катод, и принимать их с анода. Этим всем сейчас очень активно занимаются. Но я думаю, все возможно. Нет, меня другое интересует. Один академик недавно сказал, что такой науки, как микробиология, больше не существует.
Борис Долгин: В каком смысле?
Елизавета Бонч-Осмоловская: В таком, что она практически перестала существовать, так как молекулярная биология даст ответы на все вопросы. Это меня, конечно, очень разволновало. Другое впечатление — на конференции, на которой я была, человек рассказывал о секвенировании генома индивидуальной клетки. И он начал свой рассказ с такой фразы: «must of microorganisms existing in nature wouldn’t and shouldn’t be isolated», — то есть, что большая часть микробов, существующих в природе, не будут выделены и не должны быть выделены в чистую культуру. Существует очень большая часть сообщества микробиологов, которая считает, что чистая культура — это лабораторный артефакт, достаточно с ним повозились, достаточно поразвлеклись, хватит, теперь нужно заниматься делом. И это такая, конечно, вещь популярная и довольно широко распространяющаяся. Денег сейчас уже не дают на Западе на выделение чистых культур.
И это такая, конечно, вещь популярная и довольно широко распространяющаяся. Денег сейчас уже не дают на Западе на выделение чистых культур.
Вопрос из зала: Это очевидное совершенно утверждение, потому что видов бактерий в любом определении больше, чем живущих на земле людей, скорее всего. Поэтому чисто физически их всех невозможно в чистую культуру выделить.
Елизавета Бонч-Осмоловская: Конечно, тем более, китайцы взялись за дело, и теперь журнал, где описываются новые таксоны, стал журналом китайской микробиологии. Я всегда считала, и своим молодым сотрудникам говорю, которые, конечно, одержимы всякими честолюбивыми идеями что-то новое описать: главное — это новый фенотип, все-таки, надо искать, надо искать новые процессы.
Александр: Хотел узнать, вы рассказывали про замечательный механизм сероводородной реакции, которая не дает энергии, только потребляет. И получается, что микроорганизм, который осуществляет эту реакцию, живет в сообществе микроорганизмов, чтобы результирующая энергия, то есть комплекс этих организмов, была положительной, ну то есть продолжалась жизнь и они бы реплицировались. Так вопрос: является ли это, по вашему мнению, хорошим подтверждением механизма групповой селекции, если, собственно, один микроорганизм является убыточным, но в рамках комплекса организмов он как раз позволяет выживать? И еще одно замечание, уточнение. Экстремофилы, как вы сказали, находятся на глубинах океана, в глубоких слоях земли, ближе, под корой, глубже и до них, собственно альфа-излучение добирается, то есть ионизирующее излучение из космоса добирается тяжело. И что собственно движет их эволюцией? Второй вопрос. И последний вопрос. С получением новой информации об экстремофилах, полученной в последние годы, гипотеза активной и пассивной панспермии — увеличивается ли ее вес? Как вы считаете, имеет ли эта идея вес больший в свете новой информации? Спасибо.
Так вопрос: является ли это, по вашему мнению, хорошим подтверждением механизма групповой селекции, если, собственно, один микроорганизм является убыточным, но в рамках комплекса организмов он как раз позволяет выживать? И еще одно замечание, уточнение. Экстремофилы, как вы сказали, находятся на глубинах океана, в глубоких слоях земли, ближе, под корой, глубже и до них, собственно альфа-излучение добирается, то есть ионизирующее излучение из космоса добирается тяжело. И что собственно движет их эволюцией? Второй вопрос. И последний вопрос. С получением новой информации об экстремофилах, полученной в последние годы, гипотеза активной и пассивной панспермии — увеличивается ли ее вес? Как вы считаете, имеет ли эта идея вес больший в свете новой информации? Спасибо.
Елизавета Бонч-Осмоловская: На первый вопрос я скажу: конечно, да. И существуют такие пары микробов, которые невозможно разделить, и они только за счет этих реакций и живут, и фактически это уже к многоклеточному организму приближается. Я думаю, таких примеров еще больше, просто только сейчас мы начинаем к ним подбираться. На второй вопрос насчет мутагенеза, нет, экстремофилы совершенно не обязательно живут в глубинах земли, они в самых разных местах живут, и спонтанные мутации происходят и сами по себе. И потом происходит обмен генетическим материалом. Ну а, кроме того, эволюция — очень медленный процесс. Они эволюционировали 4 млрд. лет до теперешнего момента, поэтому это все, наверное, очень трудно смоделировать. Насчет панспермии — я знаю, что экстремофилы необыкновенно устойчивы к холодной температуре, гипертермофилы, например, устойчивы к высушиванию тоже. Но устойчивых микробов много, так что этот вопрос периодически возникает, но доказательств пока никаких нет.
Я думаю, таких примеров еще больше, просто только сейчас мы начинаем к ним подбираться. На второй вопрос насчет мутагенеза, нет, экстремофилы совершенно не обязательно живут в глубинах земли, они в самых разных местах живут, и спонтанные мутации происходят и сами по себе. И потом происходит обмен генетическим материалом. Ну а, кроме того, эволюция — очень медленный процесс. Они эволюционировали 4 млрд. лет до теперешнего момента, поэтому это все, наверное, очень трудно смоделировать. Насчет панспермии — я знаю, что экстремофилы необыкновенно устойчивы к холодной температуре, гипертермофилы, например, устойчивы к высушиванию тоже. Но устойчивых микробов много, так что этот вопрос периодически возникает, но доказательств пока никаких нет.
Вопрос из зала: Скажите, пожалуйста, появятся ли новые микробы в Большом андронном коллайдере? Как вы считаете?
Елизавета Бонч-Осмоловская: Ну, они, конечно, из ничего появиться не могут. Можно так вопрос поставить: что произойдет с микробами, которые туда попали, будут ли они как-то быстро-быстро эволюционировать? Вообще, эволюция в таких условиях может довольно быстро идти. Но это новое свойство должно закрепиться все-таки, микробы должны размножиться, и им для этого нужна, как минимум, вода. Я не знаю как там с водой в коллайдере. Я подозреваю, что ее там нет, среды для микробов. Так что, может, там какая-то мутация и произойдет, но он не сможет создать какую-то линию. Останется так. Не знаю.
Но это новое свойство должно закрепиться все-таки, микробы должны размножиться, и им для этого нужна, как минимум, вода. Я не знаю как там с водой в коллайдере. Я подозреваю, что ее там нет, среды для микробов. Так что, может, там какая-то мутация и произойдет, но он не сможет создать какую-то линию. Останется так. Не знаю.
Лев Московкин: Спасибо. У меня такие дилетантские вопросы, типа андронного коллайдера. Меня просили узнать, могут ли анаэробы жить в древесине? Что-то там такое нашли. И своей шахтой вы мне напомнили старую идею, может, она дурацкая, о том, что золото — биолит, это вообще возможно? То есть золото металлическое образовалось в некоторых случаях посредством каких-то бактерий. Я такое слышал. Сам я в это не очень верю. И еще такой вопрос, консервативные компоненты понятно, а оперативный и горизонтальный перенос — это везде за счет плазмид, или какие-то другие еще есть механизмы, есть ли какие-то чужие признаки типа лекарственной устойчивости, к вам попадали? Спасибо.
Елизавета Бонч-Осмоловская: Первый вопрос был про анаэробов в древесине — конечно. Конечно, да. Я поняла смысл этого вопроса. Древесина — это целлюлоза, в которой присутствует еще лигнин, и лигнин очень плохо разлагается в анаэробных условиях. Вы знаете, что бывает, например, мореный дуб, все то, что попадает в анаэробные условия под водой, оно хранится. Но, конечно, сейчас это задача №1 — найти микроба, который будет анаэробно разлагать древесину и производить из нее этанол — биотопливо. Но в целом, я думаю, что поскольку наш практический опыт говорит, что в анаэробных условиях древесина не разлагается, такие микробов если и есть, то их очень мало, и действуют они очень медленно. Насчет золота. Микробы не могут элементы превращать один в другой. Они только могут, допустим, золото извлечь из руды. Каким образом? Эта технология была разработана в нашем институте, и сейчас завод работает на этой технологии, на золоторудном месторождении. Золото вкраплено в руду, руда состоит из сульфида. Микробы окисляют этот сульфид, и золото выходит в раствор. А потом из этого раствора золото добывают. То есть из очень бедной золотом руды, таким образом, его удается извлечь.
Микробы окисляют этот сульфид, и золото выходит в раствор. А потом из этого раствора золото добывают. То есть из очень бедной золотом руды, таким образом, его удается извлечь.
Борис Долгин: С какими-то еще рудами такое возможно?
Елизавета Бонч-Осмоловская: Да, да. Это называется «микробное выщелачивание», и оно вовсю используется. Это такой практический процесс — медь и железо, все так получают, то есть бедные руды таким образом используют. Ну и насчет латерального переноса, тут я, конечно, большой профан, но мне кажется, фаги переносят генетический материал. Или это то же самое, что плазмиды?
Андрей Летаров: Есть несколько этих видов. На самом деле классически считается, что существует три основных пути переноса — это с помощью такого прямого аналога полового процесса, который может быть зависим и от плазмидных генов и от хромосомных. Соответственно, за счет прямого переноса кусочков ДНК, так называемая трансформация, так передается, как правило…
Елизавета Бонч-Осмоловская: Конъюгация какая-то есть.
Андрей Летаров: Конъюгация определяется либо плазмидными генами, либо не плазмидными. Плазмидных больше, но тут бывают разные варианты. Соответственно, с помощью трансформации у некоторых видов, то есть поглощение ДНК из других резервных клеток прямо со среды. Не многие виды к этому способны, но те, которые способны, переносят так не плазмиды, а просто кусочки геномной ДНК. И, наконец, с помощью вирусов, фагов, возможен перенос так называемой трансдукции. Это зависит от специфики вопроса. Вкратце так.
Борис Долгин: Большое спасибо, Елизавета Александровна.
Елизавета Бонч-Осмоловская: Большое спасибо всем.
Количество видов в бактериях — PMC
- Список журналов
- Рукописи авторов HHS
- PMC3160642
Proc Calif Acad Sci. Авторская рукопись; доступно в PMC 2011 24 августа.
Авторская рукопись; доступно в PMC 2011 24 августа.
Опубликовано в окончательной редакции как:
Proc Calif Acad Sci. 2005 г., 3 июня; 56 (6 Приложение 1): 62–71.
PMCID: PMC3160642
NIHMSID: NIHMS222630
PMID: 21874075
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности , показано, относится к бактериям. Формальное определение видов бактерий, более консервативное, чем модифицированное BSD, основано на гибридизации ДНК. Исходя из этого, я подсчитал, что в 30 граммах плодородной лесной почвы содержится миллион видов бактерий, и предполагаю, что во всем мире будет по крайней мере миллиард видов.
Бактерии являются основным компонентом клеточной жизни на Земле и встречаются повсюду, от вершин гор Антарктиды до глубоководных жерл. Они находятся в глубоких недрах, в открытом океане и повсюду на каждой вашей поверхности. Рефрен для студентов состоит в том, что только около 10 процентов клеток, движущихся вместе с вами, являются эукариотическими, остальные — бактериальными симбиотами. Но поскольку бактериальные клетки намного меньше эукариотических, они составляют лишь около 10% вашего веса. (Итак, завтра, когда вы встанете на весы, вы сможете вычесть 10 процентов из веса весов, потому что он на самом деле не ваш.)
Но поскольку бактериальные клетки намного меньше эукариотических, они составляют лишь около 10% вашего веса. (Итак, завтра, когда вы встанете на весы, вы сможете вычесть 10 процентов из веса весов, потому что он на самом деле не ваш.)
Из трех крупных ветвей клеточной жизни две относятся к бактериям: эубактерии и археи. Третья ветвь — это эукариоты, из которых растения, животные и грибы составляют три царства. Эубактерии делятся на 40 царств, а археи — на два царства. Вопрос, на который я попытаюсь ответить в этой статье, заключается в том, сколько видов бактерий может существовать. Прежде чем мы сможем оценить количество видов бактерий, которые могут существовать в мире, мы должны определить, являются ли виды бактерий реальными существами и как их можно определить.
Бактерии отличаются от эукариот существенной характеристикой жизненного цикла. Бактерии гаплоидны и всегда размножаются бесполым путем делением. У них есть другие механизмы пола, переноса генов между линиями, такие как трансформация, трансдукция и конъюгация.
Воздействие секса на бактерии иное, чем на животных. У бактерий передается лишь небольшая часть генома, в отличие от животных, у которых 50% генома потомства передается от самца во время полового акта. Секс у бактерий может быть между клонами одного и того же вида, близкородственными или отдаленно родственными видами, тогда как у животных секс почти всегда ограничивается представителями одного и того же вида. Во время секса у бактерий передаются фрагменты генов или целые гены и заменяются присутствующие аллели путем гомологичной рекомбинации, а не образуются гетерозиготы женских и мужских аллелей, как у животных. Кроме того, у бактерий новые гены могут быть добавлены в геном путем негомологичной рекомбинации.
Различие между половым и бесполым, которое проводится у растений и животных, не имеет смысла для бактерий. Количество половых контактов или латеральный перенос генов между линиями у бактерий может варьироваться от очень небольшого до значительного. Borrelia burgdorferi , возбудитель болезни Лайма, является почти полностью клональным, очень редко передающим небольшие фрагменты ДНК (Dykhuizen and Baranton 2001). В Heliobacter pylori (Suerbaum et al. 1998), возбудителе язвы желудка, и Neisseria gonorrhoeae (O’Rourke and Spratt 1994), возбудитель гонореи, имеет настолько много полов, что аллели разных генов находятся в равновесии по сцеплению.
В Heliobacter pylori (Suerbaum et al. 1998), возбудителе язвы желудка, и Neisseria gonorrhoeae (O’Rourke and Spratt 1994), возбудитель гонореи, имеет настолько много полов, что аллели разных генов находятся в равновесии по сцеплению.
Существует определенная гибкость бактериального генома в отношении того, какие гены присутствуют, даже внутри вида. Эта часть, составляющая от нуля до примерно 20% генома (Ochman et al. 2000; Daubin et al. 2003a), представлена генами, которые переносятся в клетку путем негомологичной рекомбинации и довольно легко снова теряются. К этому классу генов принадлежат ДНК-паразиты, такие как вставочные последовательности, транспозоны, лизогенные фаги, малые плазмиды и, возможно, системы рестрикционных модификаций. Существуют также гены, участвующие в локальной адаптации к конкретным условиям окружающей среды, такие как гены островков патогенности, гены устойчивости к антибиотикам в плазмидах (мини-хромосомах), гены устойчивости к токсинам и тяжелым металлам, а также гены и опероны, выполняющие различные специализированные функции. Как правило, гены в этом пуле транзиентов являются либо ДНК-паразитами, либо генами, адаптированными к местным условиям (Eberhard 19).90). Гены, которые обычно полезны организму во всех средах, в которых он живет, обнаруживаются во всех штаммах и обычно связаны с главной хромосомой. Некоторые из этих генов специфичны для одного вида или небольшой группы видов, но большинство широко распространено среди бактерий. Эти гены, такие как участвующие в синтезе белка, метаболизме ДНК, выработке и использовании энергии и т. д., часто называют генами домашнего хозяйства.
Как правило, гены в этом пуле транзиентов являются либо ДНК-паразитами, либо генами, адаптированными к местным условиям (Eberhard 19).90). Гены, которые обычно полезны организму во всех средах, в которых он живет, обнаруживаются во всех штаммах и обычно связаны с главной хромосомой. Некоторые из этих генов специфичны для одного вида или небольшой группы видов, но большинство широко распространено среди бактерий. Эти гены, такие как участвующие в синтезе белка, метаболизме ДНК, выработке и использовании энергии и т. д., часто называют генами домашнего хозяйства.
Некоторые люди (например, Gogarten et al. 2002) были настолько очарованы этим новым аспектом бактерий, быстрым и, возможно, широко распространенным переносом ДНК между видами, что они предположили, что бактериальные клетки просто содержат сосуды для доступных генетических вариаций. в генофонде бактерий. Часть этого пула, наблюдаемая в любом конкретном кластере (видах?), — это просто гены, которые избирательно полезны в текущей среде. Таким образом, бактериальная филогения представляла бы экологию больше, чем историю.
Таким образом, бактериальная филогения представляла бы экологию больше, чем историю.
Я не думаю, что это правда, но скорее виды бактерий могут быть определены способами, очень похожими на способы определения видов животных. В 1991 г. я предложил определить вид бактерий как вариант определения биологического вида (Dykhuizen and Green 1991). Чтобы сформулировать и обновить это определение, я буду определять вид как группу особей, в которой наблюдаемый латеральный перенос генов внутри группы намного больше, чем перенос между группами, так что филогенетическая история сохраняется при сравнении геномов. Ниже я проиллюстрирую, что я подразумеваю под этим определением. Но перед этим я хочу сделать два замечания. Во-первых, я думаю, что сходство между видами у бактерий и у животных происходит потому, что виды реальны и в обоих случаях обусловлены одной и той же базовой биологией. Хотя до сих пор неясно, что представляет собой эта базисная биология, как не было ясно, что представляет собой базисная биология — линнеевская иерархическая система классификации, описанная до дарвиновской теории происхождения, — я изложу свое представление о том, что представляет собой эта базисная биология позже. Второй включает в себя идею «наблюдаемого переноса» в определении. Скорость наблюдаемого переноса будет зависеть как от скорости переноса, так и от отбора за или против штаммов, содержащих этот перенос. Как правило, скорость переноса уменьшается с увеличением филогенетического расстояния (Majewski and Cohan 19).98), и отбор в отношении переносимой ДНК будет увеличиваться с увеличением филогенетического расстояния (Cohan et al. 1994), так что перенос наблюдается внутри видов, а не между видами (см. ниже). Конечно, если окружающая среда изменится, как, например, люди, использующие огромное количество антибиотиков для здоровья и роста себя и своих животных, даже редкие переносы ДНК из филогенетически удаленных источников будут подвергаться строгому отбору, если они обеспечивают устойчивость. Способность включать ДНК вне вида является преимуществом, которое обычно отличает бактерии от животных. У животных и растений включение ДНК из разных таксонов маловероятно, но может произойти при эндосимбиозе.
Второй включает в себя идею «наблюдаемого переноса» в определении. Скорость наблюдаемого переноса будет зависеть как от скорости переноса, так и от отбора за или против штаммов, содержащих этот перенос. Как правило, скорость переноса уменьшается с увеличением филогенетического расстояния (Majewski and Cohan 19).98), и отбор в отношении переносимой ДНК будет увеличиваться с увеличением филогенетического расстояния (Cohan et al. 1994), так что перенос наблюдается внутри видов, а не между видами (см. ниже). Конечно, если окружающая среда изменится, как, например, люди, использующие огромное количество антибиотиков для здоровья и роста себя и своих животных, даже редкие переносы ДНК из филогенетически удаленных источников будут подвергаться строгому отбору, если они обеспечивают устойчивость. Способность включать ДНК вне вида является преимуществом, которое обычно отличает бактерии от животных. У животных и растений включение ДНК из разных таксонов маловероятно, но может произойти при эндосимбиозе.
Первый пример, подтверждающий BSD, включает Escherichia coli и Salmonella . Хорошо известно, что существует рекомбинация между штаммами E. coli (Dykhuizen and Green 1991; Guttman and Dykhuizen 1994). Однако есть также свидетельства того, что перенос между E. coli и Salmonella незначителен или отсутствует, а перенос от более отдаленно родственных видов бактерий ни к одному из этих двух близкородственных видов отсутствует. Поскольку это обычно не осознается, я подробно опишу доказательства. показывает расстояние в последовательности между гомологичными генами этих двух видов, построенное по показателю смещения кодонов (Sharp 1991). Смещение кодонов относится к предпочтительному использованию одних кодонов по сравнению с другими, даже если все кодоны кодируют одну и ту же аминокислоту. Часто используемые гены демонстрируют большую предвзятость, чем менее используемые гены. Активно используемые гены синтезируют больше белка, предъявляя более высокие требования к пулам заряженных тРНК.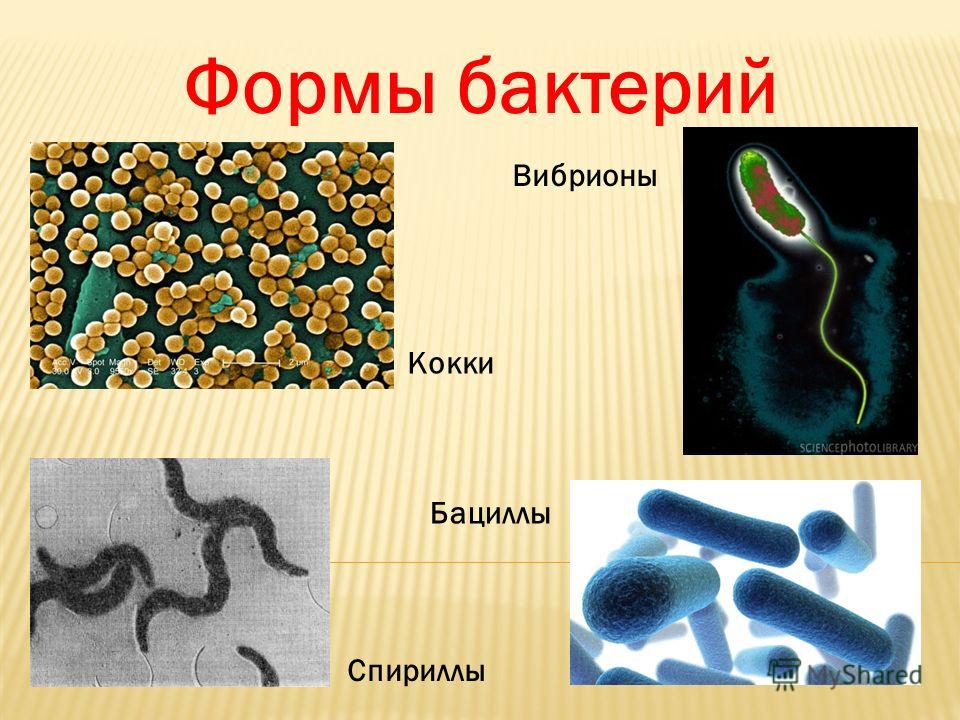 Предпочтительными кодонами являются кодоны для типов тРНК с наибольшим пулом, а непредпочтительными кодонами являются кодоны с наименьшим пулом тРНК. Таким образом, существует отбор для использования предпочтительных кодонов, который сильнее в часто используемых генах. Поскольку предпочтение кодона в E. coli и Salmonella одинаковы, гены с высоким смещением кодонов будут расходиться медленнее, чем гены с низким смещением кодонов ().
Предпочтительными кодонами являются кодоны для типов тРНК с наибольшим пулом, а непредпочтительными кодонами являются кодоны с наименьшим пулом тРНК. Таким образом, существует отбор для использования предпочтительных кодонов, который сильнее в часто используемых генах. Поскольку предпочтение кодона в E. coli и Salmonella одинаковы, гены с высоким смещением кодонов будут расходиться медленнее, чем гены с низким смещением кодонов ().
Открыть в отдельном окне
График смещения кодонов из-за расхождения последовательностей между генами, обнаруженными в E. coli и Salmonella. CAI (индекс адаптации кодонов) является мерой смещения кодонов. Ks — количество замен на синонимичные сайты, где расстояние скорректировано для множественных попаданий с использованием двухпараметрической модели Кимуры (Кимура 19).80). Этот рисунок изменен с рисунка 1 Sharp 1991. Смещение кодонов объясняет 50% вариаций расхождения синонимичных сайтов. Незаштрихованные кружки — это гены, которые могли быть латерально перенесены после расщепления вида.
Как собака, которая не лаяла, очень ясно, в чем она не показывает. В верхней правой и нижней левой частях нет точек (кроме четырех незакрашенных кружков). Если ген был перенесен в любой вид от более отдаленного родственного вида, расстояние между 9Копии 0013 E. coli и Salmonella будут намного больше, чем ожидалось, из-за наблюдаемой систематической ошибки кодонов. Если бы произошел недавний перенос между E. coli и Salmonella , копия гена, которая развивалась у одного вида с момента разделения двух видов, была бы заменена копией гена другого вида, и расстояние было бы слишком большим. небольшой, учитывая смещение кодонов. Кружки на рисунке отмечены автором как имеющие слишком маленькое расстояние с учетом смещения и возможные случаи латерального переноса генов между видами. Однако он предполагает, что для трех незакрашенных кружков слева частота мутаций ниже, потому что эти гены являются смежными и находятся недалеко от источника, что дает меньшее, чем ожидалось, расстояние, а не то, что эти гены перешли между видами задолго до того, как виды разделились. . Это предположение получило широкую поддержку (Ochman 2003). Открытый кружок справа представляет генов tufA и tufB . Это очень высокосинтезированные гены, которые, как ожидается, будут иметь сильное смещение кодонов. Положение и филогения дупликаций делают очень маловероятным, что небольшое расстояние было вызвано недавним латеральным переносом, а не сильным селективным ограничением (Sharp 1991). В заключение, несмотря на то, что существуют убедительные доказательства того, что существует рекомбинация между линиями генов домашнего хозяйства внутри E. coli , нет никаких доказательств переноса генов между E. coli и Salmonella. Таким образом, мы можем рассматривать их как два различных вида согласно моему определению видов. Используя последовательности всего генома, Daubin и соавторы (2003b) показали рекомбинацию внутри Escherichia coli и Chlamydophila pneumoniae , но отсутствие рекомбинации по крайней мере между семью видами.
. Это предположение получило широкую поддержку (Ochman 2003). Открытый кружок справа представляет генов tufA и tufB . Это очень высокосинтезированные гены, которые, как ожидается, будут иметь сильное смещение кодонов. Положение и филогения дупликаций делают очень маловероятным, что небольшое расстояние было вызвано недавним латеральным переносом, а не сильным селективным ограничением (Sharp 1991). В заключение, несмотря на то, что существуют убедительные доказательства того, что существует рекомбинация между линиями генов домашнего хозяйства внутри E. coli , нет никаких доказательств переноса генов между E. coli и Salmonella. Таким образом, мы можем рассматривать их как два различных вида согласно моему определению видов. Используя последовательности всего генома, Daubin и соавторы (2003b) показали рекомбинацию внутри Escherichia coli и Chlamydophila pneumoniae , но отсутствие рекомбинации по крайней мере между семью видами. Таким образом, кажется, что мое определение видов будет надежным.
Таким образом, кажется, что мое определение видов будет надежным.
Salmonella enterica , как считается, имеет очень ограниченный рекомбинационный обмен (Feil et al. 2001, Maynard Smith 1995). Этот вывод был основан на изучении двух экземпляров каждого из восьми подвидов. Чтобы показать рекомбинацию внутри таксона, нужно как минимум три особи. Таким образом, этот тест не мог определить рекомбинацию внутри подвида. Браун и др. (2003) недавно показали, что внутри одного из подвидов происходит обширная рекомбинация. Таким образом, можно сделать вывод, что Salmonella enterica , вероятно, представляют собой восемь отдельных видов.
Мы предположили, что если нет генетического обмена между видами, то все генные деревья должны быть конгруэнтны (Дыхуйзен и Грин 1991). Лоуренс и др. (1991) показали конгруэнтность дерева генов для трех генов у ряда видов энтеробактерий. Совсем недавно эта работа была расширена с использованием полных геномов (Lerat et al. 2003). Они обнаружили соответствие для 203 из 205 генных деревьев 11 видов. Два исключения были непоследовательны из-за одного события латерального переноса генов (LGT). Вывод Lerat et al. (2003) очень сильно поддерживает наше определение вида бактерий: «Наш анализ показывает, что однокопийные ортологичные гены устойчивы к горизонтальному переносу даже в группах бактерий, подверженных высоким показателям LGT» (стр. 101).
Они обнаружили соответствие для 203 из 205 генных деревьев 11 видов. Два исключения были непоследовательны из-за одного события латерального переноса генов (LGT). Вывод Lerat et al. (2003) очень сильно поддерживает наше определение вида бактерий: «Наш анализ показывает, что однокопийные ортологичные гены устойчивы к горизонтальному переносу даже в группах бактерий, подверженных высоким показателям LGT» (стр. 101).
Neisseria представляют собой группу видов, которые в основном являются комменсалами слизистых оболочек млекопитающих. Существует группа из семи видов, которые обычно связаны с людьми, шесть из которых встречаются в задней части рта, а седьмой, N. gonorrhoeae, — в мочеполовых путях. Эти бактерии естественно способны к трансформации на протяжении всего своего жизненного цикла и имеют высокий уровень LGT (Spratt et al., 1995). N. meningitidis и N. gonorrhoeae являются близкородственными, с ДНК кодирующих генов >98% идентичности последовательностей. Хотя внутри каждого вида происходит обширный генетический обмен (Maynard Smith et al. 1993), обмен между ними незначителен (Vazquez et al. 1993), что соответствует определению биологических видов. Предположительно, это связано с тем, что они физически изолированы, живя в разных частях тела. Шесть видов, живущих в горле, действительно обмениваются ДНК, хотя они более отдаленно связаны сходством последовательностей среди видов, начиная от 9от 1% до 77%. Из-за жесткой селекции фрагменты гена пенициллин-связывающего белка от двух естественно устойчивых к пенициллину видов были включены в N. meningitidis , что сделало его устойчивым к пенициллину, хотя расхождение составляет 14% для одного вида и 23 % для другого (Спратт и др., 1995). Ясно, что сильный отбор может включать в геном генетический материал других видов. Однако что происходит, когда нет сильного отбора? Когда гены домашнего хозяйства секвенируются у этих видов, во многих генах присутствуют фрагменты других видов. Эти фрагменты являются недавними переносами, которые еще не были очищены отбором, потому что, когда фрагменты удаляются, генные деревья обычно совпадают (Maynard Smith 19).
Хотя внутри каждого вида происходит обширный генетический обмен (Maynard Smith et al. 1993), обмен между ними незначителен (Vazquez et al. 1993), что соответствует определению биологических видов. Предположительно, это связано с тем, что они физически изолированы, живя в разных частях тела. Шесть видов, живущих в горле, действительно обмениваются ДНК, хотя они более отдаленно связаны сходством последовательностей среди видов, начиная от 9от 1% до 77%. Из-за жесткой селекции фрагменты гена пенициллин-связывающего белка от двух естественно устойчивых к пенициллину видов были включены в N. meningitidis , что сделало его устойчивым к пенициллину, хотя расхождение составляет 14% для одного вида и 23 % для другого (Спратт и др., 1995). Ясно, что сильный отбор может включать в геном генетический материал других видов. Однако что происходит, когда нет сильного отбора? Когда гены домашнего хозяйства секвенируются у этих видов, во многих генах присутствуют фрагменты других видов. Эти фрагменты являются недавними переносами, которые еще не были очищены отбором, потому что, когда фрагменты удаляются, генные деревья обычно совпадают (Maynard Smith 19). 95). Если бы фрагменты были включены в прошлом, генные деревья не совпадали бы. Таким образом, фрагменты должны были быть отобраны против.
95). Если бы фрагменты были включены в прошлом, генные деревья не совпадали бы. Таким образом, фрагменты должны были быть отобраны против.
Это подтверждается исключением. Ген adk зашифрован (Feil et al. 1995). Почему мы видим обширную рекомбинацию в этом гене, а не в других? Я думаю, что ответ в том, что adk имеет только одну полиморфную аминокислоту в роду, тогда как другие гены имеют много. Таким образом, я заключаю, что имеет место отбор фрагментов других видов из-за аминокислотных различий, т. е. геном коадаптирован. Это поддерживает границы видов. Из-за этого общего свойства клеточной жизни, коадаптированного генного комплекса, определения видов могут быть очень похожими для бактерий, животных и растений.
Принимая во внимание, что существует множество определений видов (например, Cohan 2002), я хочу использовать формальное определение видов бактерий, поскольку оно полезно и консервативно. В нем говорится: «Филогенетическое определение видов обычно включает штаммы с примерно 70% или более родством ДНК-ДНК и с 5°C или менее Δt м .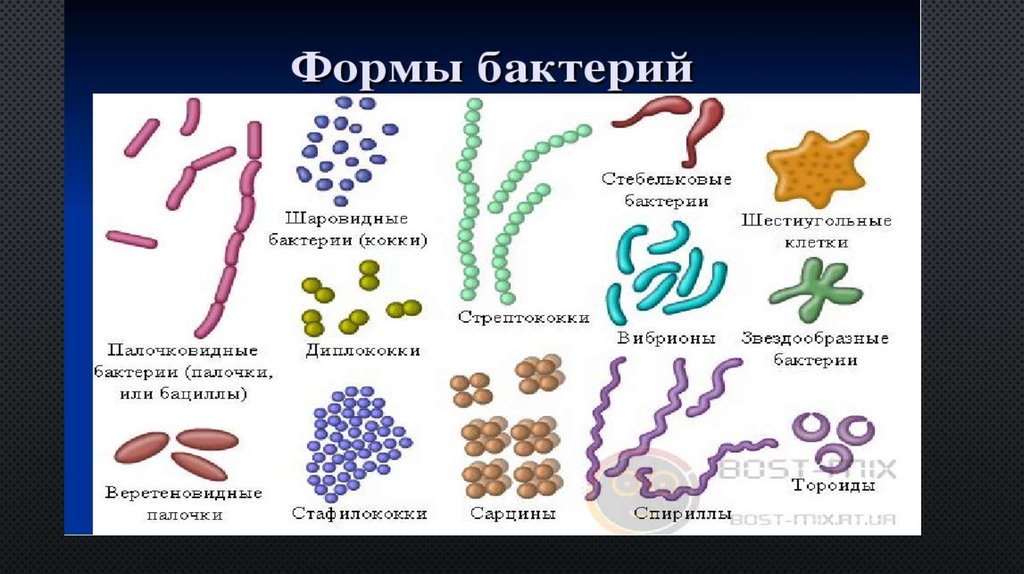 Необходимо учитывать обе единицы» (Wayne et al. 1987:463). Таким образом, два штамма являются разными видами, если менее 70% ДНК будут повторно ассоциироваться после того, как они были расплавлены до отдельных цепей. Этот критерий необходим, поскольку до 30% ДНК бактериальной клетки может быть временным. Кроме того, несовпадения будут снижать температуру плавления реассоциированной ДНК. Для того чтобы два штамма были разными видами, это снижение должно быть более 5°С. Это означает разницу в последовательности ДНК на 7–8 % (Caccone et al. 19).88). Таким образом, согласно этому консервативному определению, N. gonorrhoeae и N. meningitidis будут считаться одним и тем же видом.
Необходимо учитывать обе единицы» (Wayne et al. 1987:463). Таким образом, два штамма являются разными видами, если менее 70% ДНК будут повторно ассоциироваться после того, как они были расплавлены до отдельных цепей. Этот критерий необходим, поскольку до 30% ДНК бактериальной клетки может быть временным. Кроме того, несовпадения будут снижать температуру плавления реассоциированной ДНК. Для того чтобы два штамма были разными видами, это снижение должно быть более 5°С. Это означает разницу в последовательности ДНК на 7–8 % (Caccone et al. 19).88). Таким образом, согласно этому консервативному определению, N. gonorrhoeae и N. meningitidis будут считаться одним и тем же видом.
Мы можем использовать это определение для оценки количества видов бактерий в сообществе. Скорость реассоциации одноцепочечной ДНК с ее гомологом зависит от концентрации гомолога. По мере увеличения количества различных фрагментов ДНК время увеличивается. показывает повторную ассоциацию ДНК E. coli и ДНК тимуса теленка. Геном теленка больше, чем геном E. coli , следовательно, для реассоциации ДНК тимуса теленка требуется гораздо больше времени, чем для ДНК E. coli. Кинетика повторной ассоциации измеряется по концентрации ДНК в молях на литр (C 0 ), умноженной на время в секундах (t). Это значение кроватки. Если концентрацию ДНК поддерживать постоянной, то количество молекул каждой уникальной последовательности уменьшается по мере увеличения размера генома. Например, если концентрация ДНК составляет 12 пг, раствор будет содержать 4000 копий генома в 0,003 пг, но только 4 копии генома в 3 пг. В этом примере ДНК в большом геноме потребуется в среднем в 1000 раз больше времени, чтобы найти свой гомолог. Значение Cot, когда половина ДНК реассоциирована, дает оценку размера генома. Если мы подумаем о бактериях из природного сообщества как об одном виде бактерий, насколько большим будет их «геном»? Количество видов в сообществе можно оценить, разделив этот «геном» на средний размер бактериального генома.
coli и ДНК тимуса теленка. Геном теленка больше, чем геном E. coli , следовательно, для реассоциации ДНК тимуса теленка требуется гораздо больше времени, чем для ДНК E. coli. Кинетика повторной ассоциации измеряется по концентрации ДНК в молях на литр (C 0 ), умноженной на время в секундах (t). Это значение кроватки. Если концентрацию ДНК поддерживать постоянной, то количество молекул каждой уникальной последовательности уменьшается по мере увеличения размера генома. Например, если концентрация ДНК составляет 12 пг, раствор будет содержать 4000 копий генома в 0,003 пг, но только 4 копии генома в 3 пг. В этом примере ДНК в большом геноме потребуется в среднем в 1000 раз больше времени, чтобы найти свой гомолог. Значение Cot, когда половина ДНК реассоциирована, дает оценку размера генома. Если мы подумаем о бактериях из природного сообщества как об одном виде бактерий, насколько большим будет их «геном»? Количество видов в сообществе можно оценить, разделив этот «геном» на средний размер бактериального генома.
Открыть в отдельном окне
Кинетика регибридизации ДНК. Этот рисунок является модификацией рисунка 3 Torsvek, et al. (1990а). Геном E. coli составляет около 4,5 мегабаз, а уникальная ДНК коров примерно в 1000 раз больше, чем у человека. Таким образом, первоначальная гибридизация ДНК почвенных бактерий в тот же момент, когда начинается регибридизация тимуса теленка, предполагает, что наиболее распространенные виды в почве составляют около одной десятой процента от общего числа. Крайняя правая линия представляет собой кинетику повторной ассоциации для гомогенного образца, такого как ДНК тимуса теленка, сдвинутого таким образом, что он имеет тот же уровень Cot, что и почвенные бактерии при 50% повторной ассоциации. Это показывает, что разные виды ДНК из почвы имеют очень разные частоты.
Torsvik, Goksøyr and Dane (1990a) выделили 30 граммов верхнего слоя почвы из букового леса к северу от Бергена, Норвегия. Почва содержала 1,5 × 10 90 149 10 90 150 бактерий на грамм при микроскопическом наблюдении.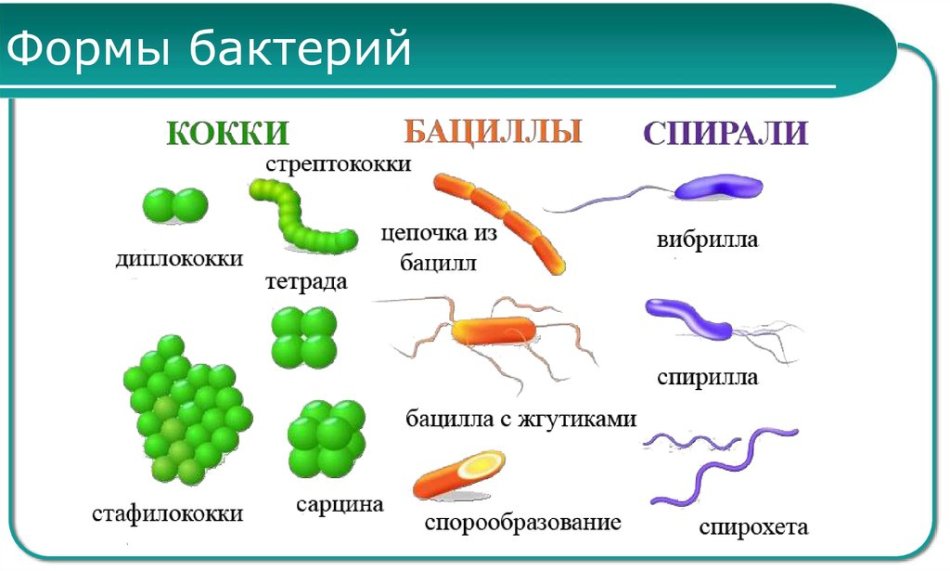 Менее 1% из них могут быть выращены. После того, как эукариоты и вирусы были устранены, из бактерий была извлечена ДНК. ДНК разрезали, расплавляли и давали возможность реассоциироваться при температуре, которая была на 25°C ниже температуры плавления. Как видно на , реассоциация началась примерно в то же время, что и ДНК тимуса теленка, что означает, что наиболее распространенный вид составляет менее 1% популяции. Реассоциация на уровне 50 процентов в 10 раз сложнее, чем ДНК тимуса теленка. Это дает расчетную сложность 2,7 × 10 10 п.н. Если вы возьмете средний размер генома почвенных бактерий в 6,8 × 10 6 п.н. (Torsvik et al. 1990b), что немного больше, чем E. coli , вы получите оценку около 4000 распространенных видов. Редкие виды до сих пор не подверглись повторной гибридизации. На самом деле 4000 занижено, потому что реассоциация на 25 градусов ниже температуры плавления. Если эту реассоциированную ДНК расплавить, только 10 % реассоциированной ДНК будут соответствовать определению вида (Δt м менее 5°С).
Менее 1% из них могут быть выращены. После того, как эукариоты и вирусы были устранены, из бактерий была извлечена ДНК. ДНК разрезали, расплавляли и давали возможность реассоциироваться при температуре, которая была на 25°C ниже температуры плавления. Как видно на , реассоциация началась примерно в то же время, что и ДНК тимуса теленка, что означает, что наиболее распространенный вид составляет менее 1% популяции. Реассоциация на уровне 50 процентов в 10 раз сложнее, чем ДНК тимуса теленка. Это дает расчетную сложность 2,7 × 10 10 п.н. Если вы возьмете средний размер генома почвенных бактерий в 6,8 × 10 6 п.н. (Torsvik et al. 1990b), что немного больше, чем E. coli , вы получите оценку около 4000 распространенных видов. Редкие виды до сих пор не подверглись повторной гибридизации. На самом деле 4000 занижено, потому что реассоциация на 25 градусов ниже температуры плавления. Если эту реассоциированную ДНК расплавить, только 10 % реассоциированной ДНК будут соответствовать определению вида (Δt м менее 5°С). Это говорит о том, что мы недооценили количество видов в десять раз. Используя штаммы, выделенные из почвы, Torvick et al. (1990b) показали, что гибридизация ДНК дает в десять раз меньшее количество видов. Таким образом, мы получаем 40 000 обычных видов.
Это говорит о том, что мы недооценили количество видов в десять раз. Используя штаммы, выделенные из почвы, Torvick et al. (1990b) показали, что гибридизация ДНК дает в десять раз меньшее количество видов. Таким образом, мы получаем 40 000 обычных видов.
Обычных видов всегда меньше, чем редких. Если виды ранжировать по количеству особей так, чтобы наиболее распространенный вид был первым, а самый редкий вид последним, то мы можем разделить виды на два класса, каждый из которых содержит половину особей в выборке. Отношение числа редких видов к числу обычных видов дает нам оценку общего числа видов, когда мы можем только оценить число обычных видов. Рассмотрим пример с 52 видами. Два наиболее распространенных вида составляют половину числа особей. Тогда отношение редких видов к обычным составляет 25 к 1. Это примерно среднее соотношение, встречающееся в литературе для животных и растений (Дыхуйзен 19).98). Отношение, рассчитанное по данным Рут Патрик (1968) о природных сообществах диатомей, равно 25, если использовать данные только одного экспериментального бокса, и 35, если объединить данные всех восьми боксов.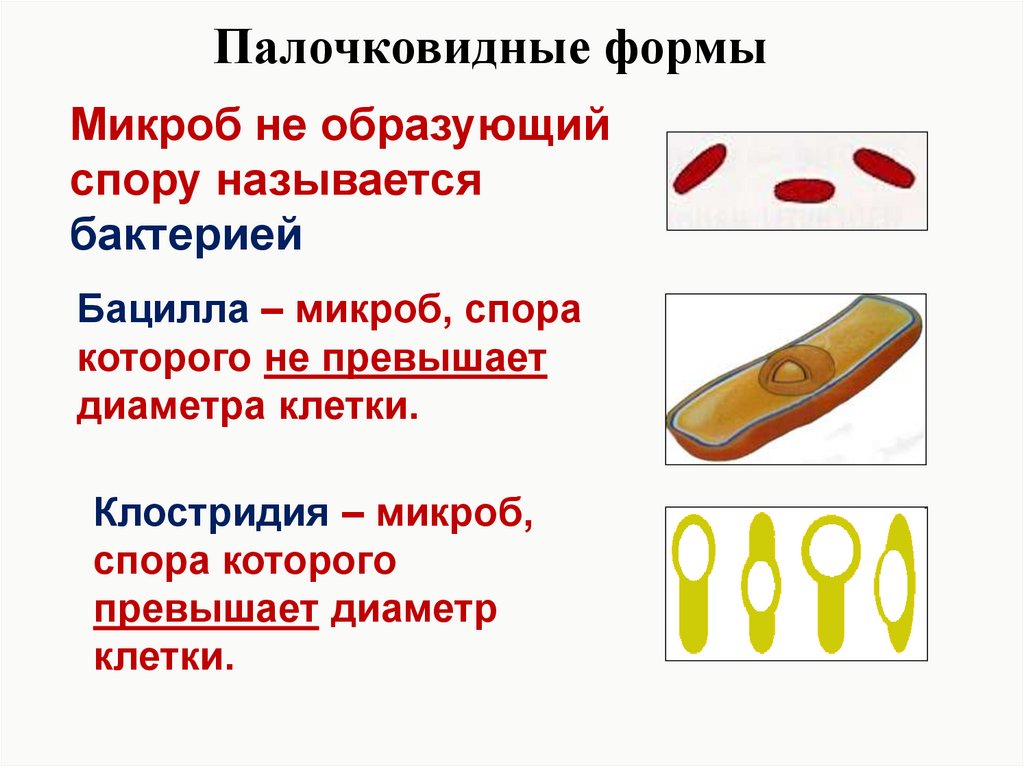 Таким образом, в первом приближении мы будем использовать отношение 25 для оценки количества видов в 30 граммах почвы. Это в 25 раз больше 40 000 или миллион видов. В этой оценке есть оговорки. Например, большая часть редкости может заключаться в редких генах, которые латерально переносятся туда и обратно, а не в редких видах. Таким образом, нам нужен другой способ оценки количества видов в этих 30 граммах почвы. Это обеспечивается работой Кертиса и сотрудников (2002).
Таким образом, в первом приближении мы будем использовать отношение 25 для оценки количества видов в 30 граммах почвы. Это в 25 раз больше 40 000 или миллион видов. В этой оценке есть оговорки. Например, большая часть редкости может заключаться в редких генах, которые латерально переносятся туда и обратно, а не в редких видах. Таким образом, нам нужен другой способ оценки количества видов в этих 30 граммах почвы. Это обеспечивается работой Кертиса и сотрудников (2002).
Кертис и др. (2002) предложили использовать логарифмические нормальные кривые обилия видов для характеристики бактериальных сообществ. Если известно общее количество бактерий и количество наиболее распространенных видов и если предположить, что самый редкий вид присутствует в виде одной особи, то можно оценить общее количество видов. В 30 граммах почвы содержится 5 × 10 11 бактерий, а наиболее распространенные виды составляют от 1% до 0,1% от этого числа. Читая рисунок 4 Curtis et al. (2002), возможные значения количества наиболее распространенных видов дают оценку, которая охватывает значение миллиона видов в этих 30 граммах почвы.
Мы очень мало знаем о том, сколько существует сообществ бактерий и каково их разнообразие. Хотя в 30 граммах богатой почвы Норвегии может быть миллион видов бактерий, это может быть одно из самых разнообразных сообществ, поскольку оно находится в богатой питательными веществами, структурированной и стабильной среде. Я ожидаю, что в сходных почвах (где я не знаю, что я подразумеваю под «похожим») будут одни и те же виды, так что число видов, присутствующих в этом типе почвы во всем мире, будет около десяти миллионов на 3000 кг почвы (Кертис). и др., 2002). Бактериальные сообщества в супесчаных, супесчаных, суглинистых и глинистых суглинках в Англии были протестированы с помощью ДНК-ДНК-гибридизации, и было обнаружено, что они различаются (Griffiths et al. 19).96). Существует некоторая перекрестная гибридизация между определенными типами почв. Когда происходит некоторая перекрестная гибридизация, происходит ли это из-за того, что сообщества содержат одни и те же виды с очень разной плотностью, или из-за того, что некоторые виды являются общими для сообществ, но большинство из них разные? Другой способ задать этот вопрос: «Являются ли редкие виды в одной среде обычными в другой, или редкие виды редки, а обычные виды обычны?» Данные Патрика (1968) для ряда сообществ простейших в очень сходных экспериментальных условиях позволяют предположить, что верно последнее. Финли и др. (2002) предполагает, что это верно для пресноводных простейших. Это может быть не так для диатомовых водорослей, потому что окружающая среда в океане не структурирована, как в почве и озерах с пресной водой. Однако я предполагаю, что это верно и для бактерий, т. е. редкие виды бывают редкими и обычными, общими даже в разных типах почв. Таким образом, разные типы почв, вероятно, представляют разные сообщества бактерий. Сколько типов почвы существует в мире, которые поддерживают различные сообщества бактерий? Дают ли разные растения на одном и том же типе почвы разные сообщества? Нам потребуется больше данных, чтобы ответить на эти вопросы, чтобы иметь возможность оценить, сколько видов почвенных бактерий существует в мире.
Финли и др. (2002) предполагает, что это верно для пресноводных простейших. Это может быть не так для диатомовых водорослей, потому что окружающая среда в океане не структурирована, как в почве и озерах с пресной водой. Однако я предполагаю, что это верно и для бактерий, т. е. редкие виды бывают редкими и обычными, общими даже в разных типах почв. Таким образом, разные типы почв, вероятно, представляют разные сообщества бактерий. Сколько типов почвы существует в мире, которые поддерживают различные сообщества бактерий? Дают ли разные растения на одном и том же типе почвы разные сообщества? Нам потребуется больше данных, чтобы ответить на эти вопросы, чтобы иметь возможность оценить, сколько видов почвенных бактерий существует в мире.
Кертис и др. (2002) предположили, что в океане обитает около двух миллионов видов. Это получено путем оценки 163 видов в миллилитре морской воды из Саргассова моря, а затем экстраполяции этого на два миллиона в океане. Однако Саргассово море имеет совсем другое бактериальное сообщество, чем пролив Лонг-Айленд (Lee and Fuhrman, 1990). Даже в пределах Саргассова моря сообщества на поверхности и на глубине 500 метров различаются (Lee and Fuhrman, 1990). В то время как нет кросс-гибридизации между Саргассовым морем и проливом Лонг-Айленд, она была для различных сообществ на поверхности и на глубине 500 метров. Опять же, имеет ли место перекрестная гибридизация, потому что одни и те же виды присутствуют на двух глубинах, но в разных соотношениях, или некоторые виды перекрываются, что дает некоторую перекрестную гибридизацию, но большинство видов различаются? Если предположить последнее, то оценка Curtis et al. (2002), вероятно, сильно занижена.
Даже в пределах Саргассова моря сообщества на поверхности и на глубине 500 метров различаются (Lee and Fuhrman, 1990). В то время как нет кросс-гибридизации между Саргассовым морем и проливом Лонг-Айленд, она была для различных сообществ на поверхности и на глубине 500 метров. Опять же, имеет ли место перекрестная гибридизация, потому что одни и те же виды присутствуют на двух глубинах, но в разных соотношениях, или некоторые виды перекрываются, что дает некоторую перекрестную гибридизацию, но большинство видов различаются? Если предположить последнее, то оценка Curtis et al. (2002), вероятно, сильно занижена.
На этом симпозиуме Нэнси Ноултон упомянула о большом разнообразии бактерий на кораллах и представила доказательства видовой специфичности (Rohwer et al. 2002). Мы также знаем, что в глубоких недрах есть сообщество бактерий. Даже на глубине 500 м Министерство энергетики США продолжает находить бактерии в своих глубоких колодцах. Антарктические породы содержат бактерии, которые метаболизируют только три-четыре часа в год, когда на них прямо падает солнце; иначе они замерзнут. Везде есть бактерии. Таким образом, должно быть много сообществ и, следовательно, очень много видов.
Везде есть бактерии. Таким образом, должно быть много сообществ и, следовательно, очень много видов.
Исходя из всего этого, я предполагаю, что существует миллиард видов, и чем больше я привыкаю к этому числу, тем больше мне кажется, что оно сильно занижено. Но пока это все, на что я способен, учитывая так мало данных. Таким образом, существует слишком много видов бактерий, чтобы их можно было сосчитать. Возвращаясь к аргументу Пауля Эрлиха, нам нужны другие меры биоразнообразия, особенно для бактериальных сообществ, чем отбор проб и подсчет каждого вида. Возможно, мы сможем использовать измерения реассоциации ДНК или какой-нибудь метод, включающий ПЦР, чтобы получить оценки разнообразия. Эти меры могут быть использованы с течением времени для наблюдения за стабильностью сообщества и здоровьем экосистемы. Кроме того, кажется, что ПЦР-амплификация непосредственно из бактериальных сообществ, секвенирование этих продуктов ПЦР и оценка количества видов с использованием статистики разреженности из этих последовательностей занижает видовое разнообразие примерно в десять раз.
Сколько существует названных видов бактерий?
Существует около 30 000 официально названных видов, находящихся в чистой культуре, физиология которых исследована. В настоящее время виды определяются с помощью ПЦР, амплифицирующих рибосомные гены и секвенирования. Критерием определения вида является различие рибосомных генов не менее чем на 3%. Этот метод, вероятно, даже более консервативен, чем методы реассоциации ДНК/ДНК для определения видов. Вероятно, мы определяем виды по рибосомной последовательности на уровне родов или семейств.
Что известно о распространении видов бактерий по всему миру?
Почти ничего. Мы кое-что знаем о биогеографии инфекционных болезней. Многие из них распространены по всему миру с очень небольшой дифференциацией населения, например, E. coli . Некоторые из них очень специфичны для конкретных регионов. Так, например, спирохета, вызывающая болезнь Лайма, в основном встречается на прибрежной плоскости восточного побережья Соединенных Штатов от островов у побережья штата Мэн до Мэриленда, а также в районе центрального Висконсина, южной Миннесоты и в верхней части полуострова США. Мичиган. Есть также регион в центральной долине Калифорнии. В других районах плотность этой спирохеты низкая, но кажется, что биотический цикл в этих регионах предотвращает высокую плотность как клещей, так и болезни Лайма. В частности, вдоль северо-восточного побережья Соединенных Штатов кажется, что высокая плотность болезни Лайма соответствует региону последнего крупного оледенения. Эта корреляция, вероятно, связана с более низким биоразнообразием (особенно рептилий) после оледенения. Я должен добавить одну вещь. У бактериальных экологов есть девиз, который, я думаю, не совсем правильный, но имеет некоторое значение. Девиз заключается в том, что все есть везде, главное — окружающая среда. Таким образом, в Йеллоустоне вы найдете те же виды, что и в горячих источниках Исландии.
Мичиган. Есть также регион в центральной долине Калифорнии. В других районах плотность этой спирохеты низкая, но кажется, что биотический цикл в этих регионах предотвращает высокую плотность как клещей, так и болезни Лайма. В частности, вдоль северо-восточного побережья Соединенных Штатов кажется, что высокая плотность болезни Лайма соответствует региону последнего крупного оледенения. Эта корреляция, вероятно, связана с более низким биоразнообразием (особенно рептилий) после оледенения. Я должен добавить одну вещь. У бактериальных экологов есть девиз, который, я думаю, не совсем правильный, но имеет некоторое значение. Девиз заключается в том, что все есть везде, главное — окружающая среда. Таким образом, в Йеллоустоне вы найдете те же виды, что и в горячих источниках Исландии.
Что произойдет по мере сокращения биоразнообразия?
Я размышляю прямо сейчас, но я думаю, что по мере сокращения биоразнообразия у нас будет больше эпидемий. Что произойдет, так это то, что другие оставшиеся виды будут расти в количестве, и организмы, которые их заражают, конечно же, будут увеличиваться в количестве. Это означает, что у них больше шансов прыгнуть к людям, которые являются огромным и неиспользованным ресурсом. Мы делаем так, чтобы нефтяные месторождения Ирака выглядели второстепенным игроком в том, что касается энергетических ресурсов для бактерий.
Это означает, что у них больше шансов прыгнуть к людям, которые являются огромным и неиспользованным ресурсом. Мы делаем так, чтобы нефтяные месторождения Ирака выглядели второстепенным игроком в том, что касается энергетических ресурсов для бактерий.
Сколько видов бактерий встречается у людей?
Когда я начинаю свои занятия, я говорю, что бактерии на вас составляют 90 процентов клеток, с которыми вы ходите. Только 10 процентов клеток, с которыми вы ходите, — это вы. Но они намного меньше. Они составляют всего 10 процентов биомассы. Таким образом, вы потеряете только 10 процентов своего веса, если избавитесь от всех своих бактерий. Я не думаю, что мы действительно знаем, сколько видов встречается у людей. Речь идет о 400–500 во рту вокруг зубного налета. Кажется, что около 100 в вашем кишечном тракте обеспечивают нормальное функционирование кишечника. Безмикробные мыши плохо функционируют. Так что это не очень удачный ответ, но, по крайней мере, мы говорим о сотнях. Многие из них, вероятно, уникальны для человека.
Выполняет ли кто-нибудь подобную работу среди одноклеточных эукариотических организмов?
О такого рода мерах внутри системы я так не думаю. Одноклеточные эукариотические организмы уже намного крупнее бактерий. Есть попытка сделать это, выбирая отдельных и наблюдая, к какому виду они относятся. Проводится много работы по таксономии одноклеточных эукариот. Это очень интересно.
Я благодарю Калифорнийскую академию наук за предоставленную мне возможность представить этот материал и Нину Яблонски за терпение. Я благодарю Майкла Фельдгардена за корректуру и обсуждение. Меня поддержал грант NIH #GM60731. Эта статья является вкладом № 1136 аспирантуры по экологии и эволюции в Университете Стоуни-Брук.
- Браун Э.В., Маммель М.К., Леклерк Дж.Э., Себула Т.А. Ограниченные границы для обширного горизонтального переноса генов среди патогенов Salmonella . Труды Национальной академии наук США. 2003; 100:15676–15681. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Caccone A, DeSalle R, Powell JR.
 Калибровка по изменению термостабильности дуплексов ДНК и степени несовпадения пар оснований. Журнал молекулярной эволюции. 1988; 27: 212–216. [PubMed] [Академия Google]
Калибровка по изменению термостабильности дуплексов ДНК и степени несовпадения пар оснований. Журнал молекулярной эволюции. 1988; 27: 212–216. [PubMed] [Академия Google] - Коэн FM. Что такое виды бактерий? Ежегодный обзор микробиологии. 2002; 56: 457–487. [PubMed] [Google Scholar]
- Cohan FM, King EC, Zawadzki P. Улучшение вредных плейотропных эффектов адаптивной мутации в Bacillus subtilis . Эволюция. 1994; 48:81–95. [PubMed] [Google Scholar]
- Curtis TP, Sloan WT, Scannelli JW. Оценка прокариотического разнообразия и его пределы. Труды Национальной академии наук США. 2002; 99:10494–10499. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Добин В., Лерат Э., Перьер Г. Источник латерально переносимых генов в бактериальных геномах. Геномная биология. 2003а. п. Р57. http://genomebiology.com/2003/4/9/R57. [Бесплатная статья PMC] [PubMed]
- Добин В., Моран Н.А., Очман Х. Филогенетика и сплоченность бактериальных геномов. Наука. 2003б; 301:829–832.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Dykhuizen DE. Еще раз о Санта-Росалии: почему существует так много видов бактерий? Антони ван Левенгук. 1998;73:25–33. [PubMed] [Google Scholar]
- Dykhuizen DE, Baranton G. Последствия низкой скорости горизонтального переноса в Borrelia . Тенденции микробиологии. 2001; 9: 344–350. [PubMed] [Google Scholar]
- Dykhuizen DE, Green L. Рекомбинация в Escherichia coli и определение биологических видов. Журнал бактериологии. 1991; 173:7257–7268. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Eberhard WG. Эволюция бактериальных плазмид и уровни отбора. Ежеквартальный обзор биологии. 1990;65:3–22. [PubMed] [Google Scholar]
- Фейл Э., Карпентер Г., Спратт Б.Г. Электрофоретическая изменчивость аденилаткиназы Neisseria meningitidis обусловлена межвидовой и внутривидовой рекомбинацией. Труды Национальной академии наук США. 1995;92:10535–10539. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фейл Э.
 Дж., Холмс Э.К., Бессен Д.Э., Чан М.С., Дэй Н.П.Дж., Энрайт М.С., Гольдштейн Р., Худ Д.В., Калия А., Мур К.Э., Чжоу Д.Дж., Спратт Б.Г. Рекомбинация в природной популяции патогенных бактерий: краткосрочные эмпирические оценки и долгосрочные филогенетические последствия. Труды Национальной академии наук США. 2001;98:182–187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж., Холмс Э.К., Бессен Д.Э., Чан М.С., Дэй Н.П.Дж., Энрайт М.С., Гольдштейн Р., Худ Д.В., Калия А., Мур К.Э., Чжоу Д.Дж., Спратт Б.Г. Рекомбинация в природной популяции патогенных бактерий: краткосрочные эмпирические оценки и долгосрочные филогенетические последствия. Труды Национальной академии наук США. 2001;98:182–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Finley BJ, Monaghan EB, Maberly SC. Гипотеза. Скорость и масштабы распространения пресноводных диатомовых водорослей зависят от их глобальной численности. Протист. 2002; 153: 261–273. [PubMed] [Google Scholar]
- Gogarten JP, Doolittle WF, Lawrence JG. Прокариотическая эволюция в свете переноса генов. Молекулярная биология и эволюция. 2002;19:2226–2238. [PubMed] [Google Scholar]
- Гриффитс Б.С., Ритц К., Гловер Л.А. Широкомасштабные подходы к определению структуры микробного сообщества почвы. Применение метода гибридизации ДНК сообщества. Микробная экология. 1996;31:269–280. [PubMed] [Google Scholar]
- Guttman DS, Dykhuizen DE.
 Клональная дивергенция в Escherichia coli в результате рекомбинации, а не мутации. Наука. 1994; 266:1380–1383. [PubMed] [Google Scholar]
Клональная дивергенция в Escherichia coli в результате рекомбинации, а не мутации. Наука. 1994; 266:1380–1383. [PubMed] [Google Scholar] - Кимура М. Простой метод оценки эволюционных скоростей замены оснований посредством сравнительных исследований нуклеотидных последовательностей. Журнал молекулярной эволюции. 1980; 16: 111–120. [PubMed] [Google Scholar]
- Лоуренс Дж.Г., Охман Х., Хартл Д.Л. Молекулярные и эволюционные отношения между кишечными бактериями. Журнал общей микробиологии. 1991;137:1911–1921. [PubMed] [Google Scholar]
- Lee S, Fuhrman JA. Гибридизация ДНК для сравнения видового состава природных ассоциаций бактериопланктона. Прикладная и экологическая микробиология. 1990; 56: 739–746. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lerat E, Daubin V, Moran NA. От генных деревьев к филогении организмов у прокариот: пример гамма-протеобактерий. Публичная библиотека научной биологии. 2003; 1:101–109. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маевски Дж.
 , Кохан FM. Влияние репарации несоответствия и образования гетеродуплексов на половую изоляцию у Bacillus . Генетика. 1998; 148:13–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Кохан FM. Влияние репарации несоответствия и образования гетеродуплексов на половую изоляцию у Bacillus . Генетика. 1998; 148:13–18. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Maynard Smith J. Имеют ли бактерии популяционную генетику? В: Baumberg S, Young JPW, Wellington EMH, Saunders JR, редакторы. Популяционная генетика бактерий. Издательство Кембриджского университета; Кембридж, Англия, Великобритания: 1995. стр. 1–12. [Google Scholar]
- Maynard Smith J, Smith NH, O’Rourke M, Spratt BG. Насколько клональны бактерии? Труды Национальной академии наук США. 1993;90:4384–4388. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Очман Х. Нейтральные мутации и нейтральные замены в бактериальных геномах. Молекулярная биология и эволюция. 2003;20:2091–2096. [PubMed] [Google Scholar]
- Ochman H, Lawrence JG, Groisman EA. Боковой перенос генов и природа бактериальных инноваций. Природа. 2000; 405: 299–304. [PubMed] [Google Scholar]
- O’Rouke M, Spratt BG.
 Дополнительные доказательства неклональной структуры популяции Neisseria gonorrhoeae : Обширное генетическое разнообразие внутри изолятов одного и того же электрофоретического типа. Микробиология. 1994; 140:1285–1290. [PubMed] [Google Scholar]
Дополнительные доказательства неклональной структуры популяции Neisseria gonorrhoeae : Обширное генетическое разнообразие внутри изолятов одного и того же электрофоретического типа. Микробиология. 1994; 140:1285–1290. [PubMed] [Google Scholar] - Патрик Р. Структура сообществ диатомей в сходных экологических условиях. Американский натуралист. 1968; 102: 173–183. [Google Scholar]
- Ровер Ф., Сегуритан В., Азам Ф., Ноултон Н. Разнообразие и распространение бактерий, связанных с кораллами. Серия «Прогресс морской экологии». 2002; 243:1–10. [Google Scholar]
- Sharp PM. Определяет расхождение последовательности ДНК между Escherichia coli и Salmonella typhimurium : использование кодонов, положение на карте и согласованная эволюция. Журнал молекулярной эволюции. 1991; 33: 23–33. [PubMed] [Google Scholar]
- Spratt BG, Smith NH, Zhou J, O’Rourke M, Feil E. Популяционная генетика патогенных Neisseria . В: Baumberg S, Young JPW, Wellington EMH, Saunders JR, редакторы.
 Популяционная генетика бактерий. Издательство Кембриджского университета; Кембридж, Англия, Великобритания: 1995. стр. 143–160. [Академия Google]
Популяционная генетика бактерий. Издательство Кембриджского университета; Кембридж, Англия, Великобритания: 1995. стр. 143–160. [Академия Google] - Suerbaum S, Maynard Smith J, Bapumia K, Morelli G, Smith NH, Kunstmann E, Dyrek I, Achtman M. Свободная рекомбинация в пределах Helicobacter pylori . Труды Национальной академии наук США. 1998;95:12619–12624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Torsvik V, Goksøyr J, Dane FL. Высокое разнообразие ДНК почвенных бактерий. Прикладная и экологическая микробиология. 1990а; 56: 776–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Torsvik V, Salte K, Sørheim R, Goksøyr J. Сравнение фенотипического разнообразия и гетерогенности ДНК в популяции почвенных бактерий. Прикладная и экологическая микробиология. 1990б;56:776–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Vazquez JA, de la Fuente L, Berron S, O’Rourke M, Smith NH, Zhou J, Spratt BG. Экологическое разделение и генетическая изоляция Neissweria gonorrhoeae и Neisseria meningitidis .
 Текущая биология. 1993; 3: 567–572. [PubMed] [Google Scholar]
Текущая биология. 1993; 3: 567–572. [PubMed] [Google Scholar] - Wayne LG, Brenner DJ, Colwell RR, Grimont PAD, Kandler O, Krichevsky MI, Moore LH, Moore WEC, Murray RGE, Stackebrandt E, Starr MP, Truper HG. Отчет специальной комиссии по согласованию подходов к бактериальной систематике. Международный журнал систематической бактериологии. 1987;37:463–464. [Академия Google]
Руководство по написанию микробиологии: научный стиль | Написание интенсивной учебной программы
ОБЩИЙ СТИЛЬ
Голос
Большая часть научных работ написана объективно, без особого драматизма или таланта. Обычно демонстрируются результаты, а не текст. Цель научного письма не в том, чтобы развлекать; цель — информировать. Письмо должно быть простым и понятным. Сам стиль написания относительно формальный — следует избегать использования сленга и чрезмерного употребления сокращений.
Поскольку наука и научные исследования должны быть представлены объективно, научное письмо традиционно пишется в пассивном залоге. Местоимения «я», «мы» и «они» обычно не использовались. Например, вместо того, чтобы писать «Я использовал агар МакКонки для выделения бактерии Escherichia coli », более принято писать «Агар МакКонки был использован для выделения бактерии Escherichia coli ». Это по-прежнему правило для материалов и методов, но в последнее время условность меняется, и активный залог сегодня чаще используется в журнальных статьях (см. Day, 19).94).
Местоимения «я», «мы» и «они» обычно не использовались. Например, вместо того, чтобы писать «Я использовал агар МакКонки для выделения бактерии Escherichia coli », более принято писать «Агар МакКонки был использован для выделения бактерии Escherichia coli ». Это по-прежнему правило для материалов и методов, но в последнее время условность меняется, и активный залог сегодня чаще используется в журнальных статьях (см. Day, 19).94).
Время глагола
Большая часть научной письменной речи написана в прошедшем времени, хотя есть и исключения. Все, что совершил исследователь, описывается в прошедшем времени. Сюда входит краткое изложение проведенного эксперимента (реферат), описание материалов и методов, использованных для проведения эксперимента, а также результаты, полученные в результате эксперимента. Настоящее время зарезервировано для выводов исследователя о результатах эксперимента, выводов предыдущих исследователей и любых фактов, общепринятых в научной сфере. Они находятся во введении и части обсуждения.
Они находятся во введении и части обсуждения.
Хотя в большинстве руководств по письму указано, что время должно быть согласовано в предложении или абзаце, есть исключения. Согласно Инструкции для авторов Американского общества микробиологии (ASM) 2001 г. (находится в начале каждого журнала ASM), в некоторых случаях допускается изменение времени в одном предложении. Примеры, указанные ASM как приемлемые, включают:
- «Уайт (3) продемонстрировал и , что клетки XYZ растут при pH 6,8»,
- «Рисунок 2 показывает , что клетки ABC не смогли расти при комнатной температуре»,
- «Воздух был удален и из камеры, и мыши погибли, что доказывает , что мышам нужен воздух»,
- «Значения для клеток ABC являются статистически значимыми, что указывает на то, что лекарство ингибирует ed …»
Микробная номенклатура
Правила именования прокариот установлены Международным комитетом по систематике прокариот (ICSP). Двоичные названия, состоящие из рода и определенного эпитета (обычно называемого видом), используются для большинства микроорганизмов (исключением являются вирусы, см. информацию ниже). Вид — это бинарная комбинация, состоящая из рода, за которым следует определенный эпитет. Другими словами, вы никогда не будете ссылаться на вид без сопутствующего рода. Название рода пишется с большой буквы, а название вида — с маленькой. Имена должны быть выделены курсивом или подчеркнуты в тексте. После того, как полное название микроорганизма было написано один раз, название рода может быть сокращено до заглавной буквы при условии, что нет путаницы с другими родами. Пример: Staphylococcus aureus может быть записан как S. aureus во второй раз, если никакие другие роды в документе не начинаются с буквы «S». Тем не менее, ICSP рекомендует снова указывать полное название в резюме любой публикации.
Двоичные названия, состоящие из рода и определенного эпитета (обычно называемого видом), используются для большинства микроорганизмов (исключением являются вирусы, см. информацию ниже). Вид — это бинарная комбинация, состоящая из рода, за которым следует определенный эпитет. Другими словами, вы никогда не будете ссылаться на вид без сопутствующего рода. Название рода пишется с большой буквы, а название вида — с маленькой. Имена должны быть выделены курсивом или подчеркнуты в тексте. После того, как полное название микроорганизма было написано один раз, название рода может быть сокращено до заглавной буквы при условии, что нет путаницы с другими родами. Пример: Staphylococcus aureus может быть записан как S. aureus во второй раз, если никакие другие роды в документе не начинаются с буквы «S». Тем не менее, ICSP рекомендует снова указывать полное название в резюме любой публикации.
Обозначение «сп.» после рода относится к одному безымянному виду, а обозначение «spp. » после рода относится к более чем одному безымянному виду. Пример: Salmonella spp. относится к более чем одному виду из Сальмонелла . В списках, содержащих ряд видов, принадлежащих к одному и тому же роду, допустимо называть род только один раз, даже если другие виды ранее не упоминались. Пример: Clostridium tetani, C. botulinum, C. perfringens ….
» после рода относится к более чем одному безымянному виду. Пример: Salmonella spp. относится к более чем одному виду из Сальмонелла . В списках, содержащих ряд видов, принадлежащих к одному и тому же роду, допустимо называть род только один раз, даже если другие виды ранее не упоминались. Пример: Clostridium tetani, C. botulinum, C. perfringens ….
Часто бактерии делятся на подвиды, которые обозначаются «внутриподвидовыми подразделениями», такими как: биовар (обычное сокращение: bv.), хемоформ, хемовар, культивар (обычное сокращение: cv.), форма specialis (сокращение: f. sp.), морфовар, патовар (обычное сокращение: pv.), фаговар, фаза, серовар и состояние. Это помещается в латинском тексте перед дополнительным именем, выделенным курсивом. Пример: Rhizobium leguminosarum биовар viciae . В ICSP нет правил, касающихся таксонов ниже подвидов, например, для обозначения штамма, которое должно следовать после рода и вида и может представлять собой комбинацию букв и цифр. Пример: кишечная палочка O157:H7, где O157:H7 обозначает конкретный антигенный штамм E. coli , который используется.
Пример: кишечная палочка O157:H7, где O157:H7 обозначает конкретный антигенный штамм E. coli , который используется.
Правила, регулирующие наименования вирусов, устанавливаются Международным комитетом по таксономии вирусов (ICTV). Споры вокруг названий вирусов продолжаются и не разрешены. Вирусам также присваивается род и вид, а часто и классификация штаммов. Однако существует много трудностей в установлении вирусных видов и вирусных штаммов. Из-за этого ICTV в настоящее время требует, чтобы для обозначения вирусного вида использовалось обычное английское название, а не латинизированный биномиальный термин. Например, ВИЧ классифицируется как семейство Retroviridae, род 9.0013 Лентивирус (обратите внимание на курсив) и вид вируса иммунодефицита человека. Затем вирус обычно называют по его видовому названию.
Генетическая номенклатура
(Следующая информация была скопирована с веб-сайта, созданного Сьюзен Пейн, доцентом кафедры биологии Техасского университета в Арлингтоне. Адрес веб-сайта: http://www.uta.edu/biology/payne/3445/mutants_mutations. хтм).
Адрес веб-сайта: http://www.uta.edu/biology/payne/3445/mutants_mutations. хтм).
Названия генов обозначаются тремя буквами, которые образуют мнемоническое описание функции генов: и для биосинтеза гистидина. Если более чем один генный продукт способствует определенной функции, то используются заглавные буквы. Например, в биосинтезе гистидина участвуют 8 генов hisABCDEFGHI.
Ауксотроф, которому для роста нужен гистидин, будет мутантом его . Таким образом, мутант его может иметь мутации hisA, hisB, hisC и т. д. Фенотип His- или просто His по сравнению с организмом дикого типа, который был бы His+. Обратите внимание, что обозначение фенотипа не выделено курсивом. Генотип обозначает фактическую мутацию: например, hisA (обратите внимание, что обозначения генотипов часто даются до того, как становится известна функция продукта гена). Аллели — это разные формы гена, поэтому разные мутации в гене — это аллели. Аллели обозначены цифрами. Таким образом, hisG251 отличается от hisG252 . Удаления отмечены греческой заглавной буквой Дельта (D). D( hisG-hisD ) представляет собой мутацию, охватывающую генов hisG и hisD .
Таким образом, hisG251 отличается от hisG252 . Удаления отмечены греческой заглавной буквой Дельта (D). D( hisG-hisD ) представляет собой мутацию, охватывающую генов hisG и hisD .
Вставки обозначены цифрой :: Вставки часто вызываются транспозонами или фагами. Таким образом, конкретная инсерция Tn 10 в гене hisG может быть hisG9425 :: Tn 10 . Это означает, что есть вставка Tn 10 в hisG .
Чувствительность к антибиотикам обозначается как s (чувствительная) и r (резистентная). Amp r обозначает штамм, устойчивый к ампициллину.
<< Введение в микробиологию || Формат лабораторного отчета >>
Ученые открыли самые большие из когда-либо виденных бактерий
Реклама
Продолжить чтение основной истории
Материя
Исследователи обнаружили настолько большие клетки бактерий, что их легко увидеть невооруженным глазом, что ставит под сомнение представления о том, какими большими могут быть микробы.
Видео
Нити бактерий под названием Thiomargarita magnifica, помещенные рядом с десятицентовой монетой для масштабирования. Это самая большая бактерия из когда-либо наблюдавшихся, и каждая видимая здесь нить представляет собой отдельную клетку. Видео Томаса ТымлаКредитКредит…Томас Тымл
В карибском мангровом лесу ученые обнаружили разновидность бактерий, которые вырастают до размера и формы человеческой ресницы.
Эти клетки являются самыми крупными бактериями, которые когда-либо наблюдались, в тысячи раз больше, чем более известные бактерии, такие как кишечная палочка. «Это было бы похоже на встречу с другим человеком размером с гору Эверест», — сказал Жан-Мари Фолланд, микробиолог из Объединенного института генома в Беркли, Калифорния.0011
Доктор Фолланд и его коллеги опубликовали результаты своего исследования бактерий под названием Thiomargarita magnifica в четверг в журнале Science.
Ученые когда-то думали, что бактерии слишком просты, чтобы производить большие клетки. Но Thiomargarita magnifica оказывается удивительно сложной. Поскольку большая часть бактериального мира еще не исследована, вполне возможно, что еще более крупные и сложные бактерии ждут своего открытия.
Прошло около 350 лет с тех пор, как голландский шлифовщик линз Антони ван Левенгук обнаружил бактерии, соскоблив зубы. Когда он поместил зубной налет под примитивный микроскоп, он был поражен, увидев плавающие одноклеточные организмы. В течение следующих трех столетий ученые обнаружили еще много видов бактерий, невидимых невооруженным глазом. Клетка кишечной палочки, например, имеет размеры около двух микрон или менее одной десятитысячной дюйма.
Каждая бактериальная клетка представляет собой отдельный организм, а это означает, что она может расти и разделяться на пару новых бактерий. Но бактериальные клетки часто живут вместе. Зубы Ван Левенгука были покрыты желеобразной пленкой, содержащей миллиарды бактерий. В озерах и реках некоторые бактериальные клетки слипаются, образуя крошечные нити.
В озерах и реках некоторые бактериальные клетки слипаются, образуя крошечные нити.
Мы, люди, многоклеточные организмы, наши тела состоят примерно из 30 триллионов клеток. Хотя наши клетки также невидимы невооруженным глазом, они, как правило, намного больше, чем у бактерий. Человеческая яйцеклетка может достигать в диаметре около 120 микрон, или пяти тысячных дюйма.
Клетки других видов могут вырасти еще больше: зеленые водоросли Caulerpa Taxifolia производят клетки в форме лезвий, длина которых может достигать фута.
Филамент Thiomargarita magnifica. Фото… Жан-Мари ВолланБактерии были обнаружены в мангровых зарослях архипелага Гваделупа в Карибском море. Фото… Хьюго Брет чтобы понять это. Животные, растения и грибы принадлежат к одной и той же эволюционной линии, называемой эукариотами. Эукариоты имеют много общих приспособлений, которые помогают им строить большие клетки. Ученые пришли к выводу, что без этих приспособлений бактериальные клетки должны оставаться маленькими.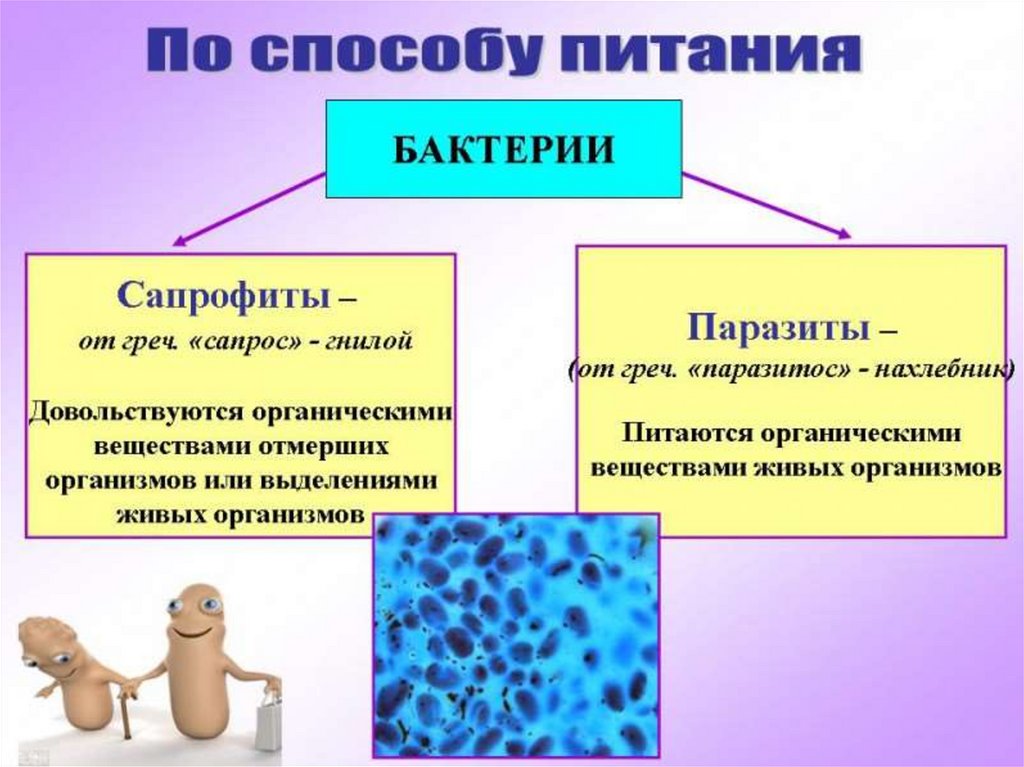
Для начала большой клетке нужна физическая поддержка, чтобы она не разрушилась и не разорвалась. Клетки эукариот содержат жесткие молекулярные провода, которые функционируют как шесты в палатке. Бактерии, однако, не имеют этого клеточного скелета.
Большая клетка также сталкивается с химической проблемой: по мере увеличения ее объема молекулам требуется больше времени, чтобы дрейфовать и встречаться с нужными партнерами для проведения точных химических реакций.
Эукариоты нашли решение этой проблемы, заполнив клетки крошечными отсеками, в которых могут происходить различные формы биохимии. Они хранят свою ДНК свернутой в мешочке, называемом ядром, вместе с молекулами, которые могут считывать гены для создания белков, или белки производят новые копии ДНК при воспроизведении клетки. Каждая клетка вырабатывает топливо внутри мешочков, называемых митохондриями.
Бактерии не имеют компартментов, присутствующих в эукариотических клетках. Без ядра каждая бактерия обычно несет петлю ДНК, свободно плавающую внутри. У них также нет митохондрий. Вместо этого они обычно генерируют топливо с молекулами, встроенными в их мембраны. Такое расположение хорошо работает для крошечных ячеек. Но по мере увеличения объема клетки на ее поверхности не остается места для достаточного количества молекул, вырабатывающих топливо.
У них также нет митохондрий. Вместо этого они обычно генерируют топливо с молекулами, встроенными в их мембраны. Такое расположение хорошо работает для крошечных ячеек. Но по мере увеличения объема клетки на ее поверхности не остается места для достаточного количества молекул, вырабатывающих топливо.
Простота бактерий, казалось, объясняет, почему они такие маленькие: им просто не хватало сложности, необходимой для того, чтобы стать большими.
Однако этот вывод был сделан слишком поспешно, по словам Шайлеша Дейта, основателя Лаборатории исследований сложных систем в Менло-Парке, Калифорния, и соавтора с доктором Волландом. Ученые сделали широкие обобщения о бактериях, изучив лишь небольшую часть бактериального мира.
«Мы только коснулись поверхности, но мы были очень догматичны», — сказал он.
Эта догма начала давать трещины в 1990-х годах. Микробиологи обнаружили, что некоторые бактерии независимо развили собственные компартменты. Они также обнаружили виды, которые были видны невооруженным глазом. Epulopiscium fishelsoni, например, был обнаружен в 1993. Живущая внутри рыбы-хирурга бактерия вырастает до 600 микрон в длину — больше, чем крупинка соли.
Epulopiscium fishelsoni, например, был обнаружен в 1993. Живущая внутри рыбы-хирурга бактерия вырастает до 600 микрон в длину — больше, чем крупинка соли.
Оливье Гро, биолог из Университета Антильских островов, обнаружил Thiomargarita magnifica в 2009 году, исследуя мангровые леса Гваделупы, кластера Карибских островов, которые являются частью Франции. Микроб выглядел как миниатюрные кусочки белых спагетти, образуя слой на мертвых листьях деревьев, плавающих в воде.
Сначала доктор Грос не знал, что он нашел. Он думал, что спагетти могут быть грибками, крошечными губками или какими-то другими эукариотами. Но когда он и его коллеги извлекли ДНК из образцов в лаборатории, оказалось, что это бактерии.
Доктор Грос объединил усилия с доктором Волландом и другими учеными, чтобы более внимательно изучить странные организмы. Они задавались вопросом, были ли бактерии микроскопическими клетками, слипшимися в цепочки.
Это оказалось не так. Когда исследователи заглянули внутрь бактериальной лапши с помощью электронных микроскопов, они поняли, что каждая из них представляет собой отдельную гигантскую клетку.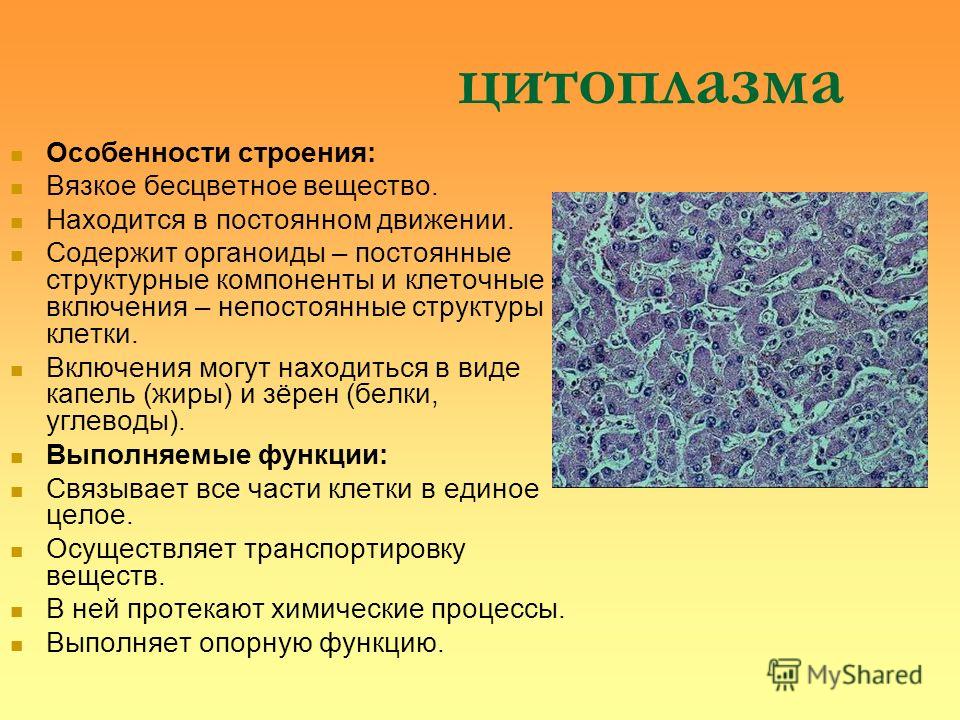 Средняя клетка имела длину около 9000 микрон, а самая большая была 20 000 микрон — достаточной длины, чтобы охватить диаметр копейки.
Средняя клетка имела длину около 9000 микрон, а самая большая была 20 000 микрон — достаточной длины, чтобы охватить диаметр копейки.
Исследования Thiomargarita magnifica продвигаются медленно, потому что доктору Валланту и его коллегам еще предстоит выяснить, как выращивать бактерии в своей лаборатории. На данный момент доктор Грос должен собирать свежий запас бактерий каждый раз, когда команда хочет провести новый эксперимент. Он может найти их не только на листьях, но и на раковинах устриц и пластиковых бутылках, лежащих на богатых серой отложениях в мангровом лесу. Но бактерии, кажется, следуют непредсказуемому жизненному циклу.
«Последние два месяца я не могу их найти», — сказал доктор Грос. — Я не знаю, где они.
Image
Место отбора проб среди мангровых зарослей архипелага Гваделупа. В последнее время бактерии там было трудно найти. Кредит … Пьер Ив Паскаль Гигантская клетка Thiomargarita magnifica размножается, отщипывая ее кончик в крошечные новые клетки, каждая из которых содержит сотни компартментов, заполненных ДНК. Кредит … Оливье. Gros
Кредит … Оливье. Gros
Внутри клеток Thiomargarita magnifica исследователи обнаружили причудливую сложную структуру. В их мембраны встроено множество различных отсеков. Эти отсеки не похожи на те, что есть в наших собственных клетках, но они могут позволить Thiomargarita magnifica вырасти до огромных размеров.
Некоторые отсеки, по-видимому, являются заводами по производству топлива, где микроб может получать энергию из нитратов и других химических веществ, которые он потребляет в мангровых зарослях.
Thiomargarita magnifica также имеет другие компартменты, которые очень похожи на человеческие ядра. Каждый из отделов, которые ученые называют пепинами в честь маленьких семян в таких фруктах, как киви, содержит петлю ДНК. В то время как типичная бактериальная клетка имеет только одну петлю ДНК, у Thiomargarita magnifica их сотни тысяч, каждая из которых спрятана внутри собственного пепина.
Что еще более примечательно, каждый пепин содержит фабрики по созданию белков из своей ДНК. «У них в основном маленькие клетки внутри клеток», — сказала Петра Левин, микробиолог из Вашингтонского университета в Сент-Луисе, которая не участвовала в исследовании.
«У них в основном маленькие клетки внутри клеток», — сказала Петра Левин, микробиолог из Вашингтонского университета в Сент-Луисе, которая не участвовала в исследовании.
Огромный запас ДНК Thiomargarita magnifica может позволить ей создавать дополнительные белки, необходимые для роста. Каждый пепин может продуцировать особый набор белков, необходимых в его собственной области бактерии.
Доктор Фолланд и его коллеги надеются, что после того, как они начнут выращивать бактерии, они смогут подтвердить эти гипотезы. Они также будут решать другие загадки, например, как бактерия умудряется быть такой прочной без молекулярного скелета.
«Вы можете взять одну нить из воды с помощью пинцета и поместить ее в другой сосуд», — сказал доктор Фолланд. «Как он держится и как приобретает форму — это вопросы, на которые мы не ответили».
Д-р Дейт сказал, что могут быть обнаружены и другие гигантские бактерии, возможно, даже больше, чем Thiomargarita magnifica.
«Мы не знаем, насколько большими они могут стать, — сказал он. «Но теперь эта бактерия показала нам путь».
«Но теперь эта бактерия показала нам путь».
Бактериальная номенклатура 101 и как описать новый вид – Справочный центр EzBioCloud
Подпишитесь на нашу рассылку новостей
Получайте обновления и учитесь у лучших
Как контролируются имена?
- Бактериальная номенклатура и наименование регулируются Международным кодексом номенклатуры прокариот (сокращенно Прокариотический кодекс ), но классификация реальных видов — нет. Пожалуйста, загрузите последнюю версию кода здесь. Например, название Escherichia coli регулируется Кодексом прокариот, но не свойствами и таксономической классификацией самого вида. Это означает, что официальной таксономии не существует, и контролируются только названия. Следовательно, термины «действительные виды», «официальные виды» или «официальные виды» не имеют смысла. Подтвердить можно только название, поэтому можно использовать «виды с действительно опубликованным названием».
 я указал это красным цветом , так как в литературе очень много ошибок.
я указал это красным цветом , так как в литературе очень много ошибок. - Что касается животных и растений, номенклатура бактерий (и архей) соответствует биномиальной номенклатуре, введенной Карлом Линнеем.
Как образуется название вида?
- Видовое название должно состоять из двух частей по биномиальной системе: (1) родовое название и (2) видовой эпитет. Эта комбинация представляет собой «название вида» и должна быть уникальной в номенклатурной системе.
- Научные названия всех таксонов должны трактоваться как латинские; названия таксонов выше ранга видов — односложные слова.
Имена организованы в иерархическую систему
- Иерархическая система официальной номенклатуры следующая: (приведены только популярные)
- Тип (или Подразделение): в настоящее время ранг типа не контролируется Прокариотическим Кодексом. Орен и др. было предложено включить «тип» в Кодекс, но это предложение еще не обсуждалось и не было одобрено Международным комитетом по систематике прокариот (ICSP), органом, контролирующим Кодекс прокариот [Подробнее].

- Класс: Тип класса — это один из порядков. Класс назван в честь рода типа порядка типов класса.
- Орден : Тип ордера — один из родов. Название порядка названо в честь типового рода порядка. Например. Отряд Pseudomonales назван в честь типового рода Pseudomonas.
- Семейство : Как правило, название семейства дается в честь типового рода семейства, т.е. Семья Pseudomonadaceae назван в честь типового рода Pseudomonas .
- Род
- Виды
- Подвиды : Подвиды создаются только тогда, когда это необходимо. В Кодексе отсутствует понятие «типовой подвид». Я думаю, что многие подвиды должны быть переоценены с использованием геномики, поскольку они в основном классифицируются по одному или нескольким фенотипам. Например, важный пробиотический вид, Lactobacillus delbrueckii 9.0014 содержит шесть подвидов.

- Тип (или Подразделение): в настоящее время ранг типа не контролируется Прокариотическим Кодексом. Орен и др. было предложено включить «тип» в Кодекс, но это предложение еще не обсуждалось и не было одобрено Международным комитетом по систематике прокариот (ICSP), органом, контролирующим Кодекс прокариот [Подробнее].
| Ранг | Суффикс | Пример |
| Заказ | -эль | Псевдомонады |
| Подзаказ | — ineae | Псевдомонадиновые |
| Семья | -aceae | псевдомонадовые |
| Род | Псевдомонада | |
| Виды | Синегнойная палочка |
- Эти названия даются учеными, которые предлагают вид и относят его к роду. Естественно, в этой иерархической системе могут быть отнесены любые виды; однако это не всегда реализуется. Официально вид должен быть отнесен к известному роду, но отнесение этого рода к семейству, затем к порядку и т. д. не является обязательным.
 Часто это происходит из-за того, что таксономические отношения неоднозначны, поэтому не очень ясно, как группировать роды в более высокие таксономические ранги. Это оставляет много хаоса в бактериальной таксономической системе, и это особенно плохая новость для исследователей микробиома, где исследования проводятся в разных таксономических рангах, таких как семейство или даже тип.
Часто это происходит из-за того, что таксономические отношения неоднозначны, поэтому не очень ясно, как группировать роды в более высокие таксономические ранги. Это оставляет много хаоса в бактериальной таксономической системе, и это особенно плохая новость для исследователей микробиома, где исследования проводятся в разных таксономических рангах, таких как семейство или даже тип.- Например, род Thermicanus был предложен без его отнесения к известному семейству (Gössner et al. 1999). В таксономии NCBI он относится к предварительному семейству Bacillales Family X. Incertae Sedis под номером Bacillales . База данных EzBioCloud присваивает каждому виду полную иерархическую систему, поэтому Thermicanus был присвоен предварительно созданному семейству Thermicanus_f (обратите внимание, что это недопустимое имя и оно не выделено курсивом). Конечно, любой может предложить семью Thermicanaceae путем публикации предложения.
Как можно проверить имя (точнее, правильно его опубликовать)?
- Как упоминалось ранее, имена контролируются Кодом Прокариот.
 Чтобы имя было подтверждено, оно должно быть включено в один из списков, описанных ниже.
Чтобы имя было подтверждено, оно должно быть включено в один из списков, описанных ниже.- Утвержденный список названий бактерий:
- Это было опубликовано в 1980 году Скерманом, Макгоуэном и Снитом и ознаменовало собой новое начало в номенклатуре прокариот.
- Все последующие изменения из этого списка публикуются в International Journal of Systematic and Evolutionary Microbiology (IJSEM) (ранее International Journal of Systematic Bacteriology (IJSB)).
- В IJSEM публикуются два типа обновленных списков, а именно «Список уведомлений» и «Список проверки».
- Список уведомлений:
- IJSEM является официальным журналом Международного комитета по систематике прокариот (ICSP) и Отделения бактериологии и прикладной микробиологии Международного союза микробиологических обществ (IUMS). Это означает, что IJSEM является официальным журналом номенклатуры прокариот. Также обратите внимание, что официальной таксономии бактерий не существует.

- Любые таксономические предложения, которые включают изменения названий (новые таксоны или изменения названий), опубликованные в IJSEM, будут автоматически рассматриваться редакторами списков IJSEM. Если документ соответствует требованиям Прокариотического кодекса, предлагаемые изменения будут перечислены в «Списке уведомлений» и официально «утверждены» .
- См. этот пример.
- IJSEM является официальным журналом Международного комитета по систематике прокариот (ICSP) и Отделения бактериологии и прикладной микробиологии Международного союза микробиологических обществ (IUMS). Это означает, что IJSEM является официальным журналом номенклатуры прокариот. Также обратите внимание, что официальной таксономии бактерий не существует.
- Список проверки:
- Кодекс прокариот также позволяет ученым проверять имена, эффективно публикуемые в журналах, отличных от IJSEM.
- После того, как имя опубликовано, оно называется « фактически опубликовано ».
- Любой, кто заботится о науке, должен убедиться, что любые эффективно опубликованные названия подтверждены, отправив публикацию в формате pdf в IJSEM с доказательством того, что (для видов и подвидов) указанный типовой штамм доступен без ограничений по крайней мере из двух общедоступных коллекций культур, расположенных в разные страны.
 Это может сделать любой, включая авторов. Последствия невыполнения этого требования могут быть разрушительными, поскольку имя «фактически публикуется», но никогда не «9».0411 утверждено ’. Редакторы списков IJSEM добавят имена в Список проверки при условии, что будут выполнены все требования Кодекса прокариот (для новых видов и подвидов, в частности, Правила 27 и 30).
Это может сделать любой, включая авторов. Последствия невыполнения этого требования могут быть разрушительными, поскольку имя «фактически публикуется», но никогда не «9».0411 утверждено ’. Редакторы списков IJSEM добавят имена в Список проверки при условии, что будут выполнены все требования Кодекса прокариот (для новых видов и подвидов, в частности, Правила 27 и 30). - Это пример списка проверки.
- Утвержденный список названий бактерий:
- Недопустимые имена: К сожалению, в некоторых случаях имя не может быть проверено.
- Название широко использовалось до 1980 г., но не включено в утвержденные списки названий бактерий в 1980
- Имя было опубликовано за пределами IJSEM, но никогда не проверялось как:
- Никто не отправил PDF-файл и дополнительную необходимую документацию в IJSEM для проверки.
- Публикация не соответствует минимальным требованиям Кодекса. Эти минимальные требования будут объяснены позже.
- Имена, не опубликованные надлежащим образом, заключаются в кавычки, например: «Selenomonas massiliensis» или «Selenomonas massiliensis», чтобы отличать их от официально опубликованных названий.

- Минимальные и единственные требования для подтверждения названий новых видов и подвидов в соответствии с Прокариотическим кодексом:
- Должен быть указан типовой штамм. Иногда в статье, описывающей новый вид, не упоминается, какой штамм является типовым штаммом. В таких случаях имя не может быть проверено.
- Типовой штамм должен быть депонирован в две коллекции культур в двух разных странах. Это гарантирует, что типовой штамм останется доступным, например, когда коллекция культур прекращает свою деятельность или теряет штамм.
- Типовой штамм должен быть доступен всем через коллекции культур. Патентные штаммы не могут служить типовыми штаммами. Если вы хотите запатентовать штамм и ограничить распространение, он не может служить номенклатурным типом для вида или подвида.
- Должны быть даны правильная этимология и описание (см. ниже).
Почему важно использовать правильные имена
- Названия бактерий разработаны с научной точки зрения, чтобы дать представление о биологическом происхождении, основанном на филогении; это возможно с использованием иерархической таксономической системы.
 Например, мы считаем, что вид Escherichia coli имеет больше общих фенотипических признаков с другими видами Escherichia , чем с видами Bacillus . Поэтому использование правильных имен имеет решающее значение для интерпретации микробиома и других типов данных.
Например, мы считаем, что вид Escherichia coli имеет больше общих фенотипических признаков с другими видами Escherichia , чем с видами Bacillus . Поэтому использование правильных имен имеет решающее значение для интерпретации микробиома и других типов данных. - К сожалению, в текущей номенклатуре все еще есть много имен, которые находятся не в том месте. Например, Clostridium scindens известен своей важной ролью в метаболизме желчных кислот микробиоты кишечника человека и до сих пор носит название 9.0013 Клостридиум . Однако он даже не близок к роду Clostridium и должен быть отнесен к новому роду в семействе Lachnospiraceae . Подлинный Clostridium будет помещен в семейство Clostridiaceae.
- Несколько других примеров, связанных с микробиомом человека, приведены ниже из наших прошлых сообщений в блоге:
- Таксономия кластеров Clostridium XIVa и IV
- Идентификация Ruminococcus sp.
 5_1_39БФАА
5_1_39БФАА - Исправление таксономических названий стандартов микробиома ATCC
Candidatus
- В некоторых случаях основные требования Прокариотического кодекса не могут быть удовлетворены, даже если вид является реальным и важным с научной точки зрения. Согласно формальной номенклатуре, эти виды никогда не будут официально опубликованы. Итак, таксономисты создали термин « Candidatus », чтобы поддержать предварительное наименование.
- Для наименований Candidatus не существует чистых культур или изолятов, следовательно, нет типовых штаммов.
- Candidatus названия не регулируются Прокариотическим кодексом, поэтому они не принадлежат к формальной номенклатуре и не регулируются Прокариотическим кодексом.
- Типичным примером является Candidatus Pelagibacter ubique.
- Этот вид содержит некультивируемые или культивируемые бактерии из океана и, вероятно, является самым распространенным видом на Земле, поэтому он должен быть очень важным [Подробнее].

- Причина того, что это никогда не было подтверждено, заключается в том, что виды можно культивировать, но не таким способом или в таком масштабе, которые могут быть использованы коллекциями культур для длительного хранения. Следовательно, минимальное требование Кодекса не может быть выполнено. Кроме того, видовой эпитет (ubique) неправильно сформирован.
- Этот вид содержит некультивируемые или культивируемые бактерии из океана и, вероятно, является самым распространенным видом на Земле, поэтому он должен быть очень важным [Подробнее].
- Не все таксоны Candidatus хорошо охарактеризованы, поскольку ранг Candidatus не регулируется Кодексом прокариот.
- думаю что минимальные нормы для Candidatus являются:
- Наличие полноразмерной высококачественной последовательности 16S, поскольку этот ген является основой таксономии бактерий и архей; это обязательно!.
- Наличие незагрязненной и достаточно полной последовательности генома (проверяется наличием ядерных генов на уровне домена).
- Должны быть представлены минимальные экологические и метаболические признаки.

- Остальное можно решить субъективно. Тем не менее, Candidatus является предварительным названием на момент написания.
Как назвать новый таксон
- Лучше всего, если название может отражать типичные признаки вида. Например, название Plasticicumulans означает «аккумулирующий пластик». Род был назван таким образом, потому что типовой вид накапливает биопластический полигидроксиалканоат.
- Еще один популярный способ дать название новому таксону — дать ему имя в честь человека. Этот человек должен иметь послужной список вклада в науку. Неэтично называть себя, члена своей семьи или человека, не связанного с наукой (например, президента вашей страны). знаменитый Escherichia и Salmonella были названы в честь микробиологов Эшериха и Лосося.
- Именование по географическому положению также популярно, но не поощряется (хотя я делал это много раз).
- Вам понадобится этимология для вашего нового таксона.
 Предлагаю проконсультироваться со специалистом.
Предлагаю проконсультироваться со специалистом. - Прочтите эту статью покойного Ганса Г. Трюпера, чтобы узнать подробности.
Советы по написанию таксономической статьи с описанием новых видов
- Любой, кто занимается изоляцией бактерий, должен иметь хорошие шансы найти новый вид. Используя секвенирование генома, я бы сказал, что ваши шансы найти новые виды в результате одного исследования изоляции из почвы или воды должны быть почти 100%. Наш долг, как хороших микробиологов, сделать их известными научному миру, описав их как новые виды.
- Предполагая, что вы выделили несколько штаммов, обозначьте тип штамма вашего нового вида. Если у вас есть единственный штамм, этот штамм станет типовым штаммом нового вида.
- Докажите, что это новый вид, с помощью гена 16S рРНК (16S) и секвенирования генома
- Начните с секвенирования 16S и получите полноразмерную высококачественную последовательность.
 Не доверяйте собранной последовательности фирм, занимающихся секвенированием, поскольку эти сервисные компании почти никогда не редактируют окончательную последовательность. Всегда проверяйте хроматограммы (файлы Sanger ab1 ) вручную. Я видел ужасные последовательности 16S, используемые для создания новых видов, которые на самом деле не являются новыми видами.
Не доверяйте собранной последовательности фирм, занимающихся секвенированием, поскольку эти сервисные компании почти никогда не редактируют окончательную последовательность. Всегда проверяйте хроматограммы (файлы Sanger ab1 ) вручную. Я видел ужасные последовательности 16S, используемые для создания новых видов, которые на самом деле не являются новыми видами. - Найдите последовательность в базе данных EzBioCloud 16S на сайте www.ezbiocloud.net. Если вы найдете любое попадание ниже 98,7%, у вас, вероятно, есть новый вид, учитывая, что ваша последовательность хорошего качества [Подробнее].
- Допустим, у вас примерно 99% сходства 16S, не разочаровывайтесь. У вас все еще есть очень хорошие шансы найти новый вид. Я предлагаю вам пройти секвенирование всего генома. Для таксономических целей здесь опубликовано руководство. Рассчитайте средние значения идентичности нуклеотидов (ANI) между изолятом и типом штаммов близкородственных видов в поиске 16S с использованием базы данных EzBioCloud.
 Пороговое значение ANI равно 9.5~96% для видов.
Пороговое значение ANI равно 9.5~96% для видов.
- Начните с секвенирования 16S и получите полноразмерную высококачественную последовательность.
- Если вы действительно подтвердили наличие нового вида, попробуйте получить диагностические фенотипические данные. Это может варьироваться в зависимости от таксонов.
- Получить общую морфологическую и физиологическую характеристику
- Получите отличительные характеристики, которые можно использовать для отделения новых видов от других. Эти данные обычно приводятся в виде таблицы (например, см. таблицу 1 в этой статье в качестве примера).
- Bergey’s Manual — отличный ресурс для получения фенотипических данных родственных видов [Подробнее].
- Добавьте в свое исследование полную последовательность генома типового штамма.
- Как и ген 16S, последовательность генома становится таксономической основой для всех дисциплин микробиологии. Если вы не секвенируете свой новый геном, вы оставляете дыру в системе, которую должен заполнить кто-то другой.

- Если у вас есть аргументы в пользу нового вида и вам не хватает средств на секвенирование генома, CJ Bioscience будет рада помочь вам бесплатно, напишите нам по адресу [email protected].
- В настоящее время сист. заявл. микробиол. и IJSEM требуют последовательности генома типового штамма, по крайней мере, для любой новой классификации.
- Как и ген 16S, последовательность генома становится таксономической основой для всех дисциплин микробиологии. Если вы не секвенируете свой новый геном, вы оставляете дыру в системе, которую должен заполнить кто-то другой.
- Внесите типовые штаммы в две коллекции культур в двух разных странах.
- Чтобы найти подходящие коллекции культур, используйте сайт WFCC.
- Я рекомендую найти коллекции культур, у которых хотя бы есть веб-сайт на английском языке.
- Убедитесь, что вы получили свидетельство о депонировании двух коллекций культур в двух странах. Если они не знают, что такое свидетельство о депонировании, не беспокойтесь и не пытайтесь депонировать в другие коллекции культур. Этот процесс занимает несколько месяцев, поэтому начинайте, как только обнаружите, что у вас появился новый вид.

- Напишите таксономическое предложение в виде рукописи.
- Как и в случае с вашим обычным содержанием в любой статье, должны быть даны правильная этимология и описание (см. пример ниже).
- Отправьте рукопись в IJSEM с двумя сертификатами депонирования типового штамма. Можно подавать в другие журналы, если они публикуют статьи на английском языке. Если она опубликована за пределами IJSEM, убедитесь, что вы отправляете PDF-файл публикации плюс два сертификата депонирования в IJSEM для проверки. Без проверки ваш новый вид не будет должным образом признан другими учеными. На самом деле, во многих случаях это добавляет больше путаницы, чем пользы.
Кто контролирует весь этот процесс?
- В основном международные комитеты микробиологов поддерживают Кодекс (в качестве официального свода правил) и официальный журнал (IJSEM), который публикует списки уведомлений и списки проверки.

- Наиболее важным комитетом является Международный комитет по систематике прокариот (ICSP). ICSP — это орган, который наблюдает за номенклатурой прокариот, определяет правила, по которым прокариоты именуются, и чья Судебная комиссия издает заключения по таксономическим вопросам и поправкам к Кодексу прокариот и т. д.
- Члены и члены Исполнительного совета ICSP избираются из представителей микробиологических обществ каждой страны. Если вы заинтересованы в участии в каком-либо процессе номенклатуры и таксономии прокариот, вам необходимо быть избранным в качестве представителя микробиологического общества и посещать эти мероприятия (встречи ICSP). Пожалуйста, посетите веб-сайт ICSP для получения более подробной информации. Я считаю, что ICSP хотел бы, чтобы больше молодых микробиологов участвовало в процессе таксономии бактерий (помните, что в первую очередь вы должны быть представителем своего общества).
Источники актуальной номенклатуры
- Обратите внимание, что официальной номенклатурой являются только утвержденные списки названий бактерий 1980 г.
 , а также списки уведомлений и валидации в IJSB и IJSEM. Однако в настоящее время IJSEM или другие официально признанные органы не предоставляют систематизированного актуального списка официально опубликованных имен. К счастью, следующие ресурсы поддерживаются должным образом и поэтому полезны. Пожалуйста, имейте в виду, что эти веб-сайты могут содержать человеческие ошибки.
, а также списки уведомлений и валидации в IJSB и IJSEM. Однако в настоящее время IJSEM или другие официально признанные органы не предоставляют систематизированного актуального списка официально опубликованных имен. К счастью, следующие ресурсы поддерживаются должным образом и поэтому полезны. Пожалуйста, имейте в виду, что эти веб-сайты могут содержать человеческие ошибки.- EzBioCloud.net
- Список названий прокариот, стоящих в номенклатуре
Пожалуйста, используйте NCBI, EzBioCloud или соответствующие таксономические базы данных и базы данных последовательностей.
- Firmicutes — это широко изученный тип человеческого микробиома. У большинства людей в кишечнике более 10%. Контролируется ли это официальной номенклатурой бактерий (Кодексом)? Если да, то почему?
- Напишите краткий отчет о Candidatus Liberibacter asiaticus со следующей информацией:
- Таксономическая история
- Биология этого вида
- Геномы и экология
- Какое латинское значение конкретного эпитета salmonicida ? Сколько видов бактерий имеют одинаковый видовой эпитет salmonicida ? Правильно ли, если более двух видов имеют один и тот же видовой эпитет? Найдите еще два названия видов с salmonicida в качестве видового эпитета?
- Nocardia pinensis – вид бактерий, вызывающий серьезные проблемы с активным илом в Австралии.
 Позднее название вида было изменено. Выясните это номенклатурное изменение и зачем оно было нужно (на каком научном основании).
Позднее название вида было изменено. Выясните это номенклатурное изменение и зачем оно было нужно (на каком научном основании).
Я ценю комментарии Барни Уитмена, Рамона Росселло-Мора и анонимного коллеги.
Этот документ является частью моего курса Прокариотическая таксономия и микробиом .
Джон Джонгсик Чун, генеральный директор CJ Bioscience Inc.
Последнее редактирование: 3 февраля 2019 г.
Подпишитесь на нашу рассылку новостей
Получайте обновления и учитесь у лучших
Фамилия
Электронная почта
Еще для изучения
Курс: Таксономия прокариот и микробиом
Это сборник статей и ресурсов по таксономии прокариот и изучению микробиома. Это разработано Джоном Йонгсиком Чуном из Сеульского национального университета,
Джон Йонгсик Чун, доктор философии.
03.11.2018
[Учебное пособие] Изучение микробиоты кимчи
Кимчи — традиционный гарнир из соленых и ферментированных овощей. При правильном брожении pH кимчи из капусты достигает ~4,2.
При правильном брожении pH кимчи из капусты достигает ~4,2.
CJ Bioscience, Inc.
25.10.2017
Поделиться этой публикацией
Поделиться на фейсбуке
Поделиться на LinkedIn
Поделиться в твиттере
Поделиться по электронной почте
Top Ten Bacteria
Обычно я не делаю мемы, но я не мог устоять перед этим, и это дает мне возможность напомнить себе (и вам) о некоторых действительно удивительных недавних исследованиях. Так что без лишних слов…
Top Ten Bacteria – издание Not Exactly Rocket Science
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
10. Carsonella ruddii
Обладатель наименьшего из известных бактериальных геномов, C.ruddii утратил большинство своих генов и при этом свою независимость. Его геном слишком мал, чтобы позволить ему выжить самостоятельно, и ему требуется комната и стол, предоставляемые его насекомыми-хозяевами, чьи геномы теперь содержат генетических доноров C. ruddii.
ruddii.
9. Pseudomonas syringae
Мечтаете о белом Рождестве? Этот вид может помочь. На его поверхности есть белок, который имитирует структуру кристалла льда, выступая в качестве шаблона для других молекул воды, за которые они могут зацепиться. В результате эта бактерия является живым генератором льда, засевающим рост снежинок. И их можно найти в снегу от Франции до США и Антарктиды.
См. верхние восемь внизу страницы
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
8. Epulopiscium spp.
Большой мальчик королевства – размером примерно с эту точку. Обладая тысячами копий собственного генома (в 40 раз больше ДНК, чем содержит человеческая клетка), Epulopiscium может преодолеть ограничения, ограничивающие размер большинства бактерий, и вырасти до огромных размеров. Этот вид получает бонусные баллы за в высшей степени суетливый выбор хозяина — кишечника выпуклоносой рыбы-единорога. Хотите изучить Epulopiscium ? Лучше поработайте над своими навыками подводной охоты.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
7. Salmonella typhimurium
Насекомое, вызывающее пищевое отравление, и, казалось бы, безобидный выбор. Но подумайте еще раз. Отправьте его в космос, и Salmonella станет супер-жуком — более опасным и более устойчивым, чем его земные собратья.
6. Кишечная палочка
Классика. Безусловно, без него не будет полного списка. См. новую книгу Карла Циммера «Микрокосм », где вы найдете множество причин, почему E.coli до сих пор остается одним из самых важных видов в современной науке.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
5. Yersinia pestis
Этот список вполне мог быть сосредоточен только на болезнетворных видах, но я хотел быть более избирательным. Так что до свидания, Vibiro cholerae . Уходите, Bacillus anthracis . Прощайте, Mycobacterium tuberculosis . Уступите место их большому папочке — бактерии, ответственной за бубонную чуму. Если вам абсолютно необходимо убить каждого ублюдка до последнего на континенте, не принимайте никаких заменителей. И ему даже удалось украсть немного лекарственной устойчивости у грабителя №7 и немного лекарственной устойчивости у пикажа №7!
Уступите место их большому папочке — бактерии, ответственной за бубонную чуму. Если вам абсолютно необходимо убить каждого ублюдка до последнего на континенте, не принимайте никаких заменителей. И ему даже удалось украсть немного лекарственной устойчивости у грабителя №7 и немного лекарственной устойчивости у пикажа №7!
4. Myxococcus xanthus
Бактериальный аналог волчьей стаи – эти социальные охотники передвигаются плотными группами, выделяя пищеварительные ферменты, разрушающие клетки на своем пути. Но когда у них заканчивается еда, они демонстрируют самое удивительное кооперативное поведение. Они собираются вместе, образуя «плодовые тела», а некоторые из них даже превозмогают себя на благо своих сверстников, выпуская собственное содержимое, чтобы накормить своих соседей.
3. Deinococcus radiodurans
Выносливее таракана – «ужасная ягода, устойчивая к радиации» может выдержать дозы радиации, в 1500 раз превышающие дозы, которые могут убить человека. Восстановление ДНК является ключом к его удивительным способностям: как и у других видов, радиация разрывает его геном на крошечные фрагменты, но D.radiodurans может с радостью собрать свою разорванную ДНК.
Восстановление ДНК является ключом к его удивительным способностям: как и у других видов, радиация разрывает его геном на крошечные фрагменты, но D.radiodurans может с радостью собрать свою разорванную ДНК.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
2. Desulforudis audaxviator
Одна особая популяция этого «смелого путешественника» превратилась в своего рода экологического отшельника. В недрах одного южноафриканского золотого рудника D.audaxviator обитает в полной изоляции не только от солнечной энергии, но и от всех остальных видов. Это единственное живое существо в этой удивительной экосистеме одного человека.
1. Wolbalchia spp.
Образец эгоизма и, возможно, самый успешный паразит на планете. Кого волнуют виды, которые заражают жалких людей? Если вы хотите найти истинный путь к мировому господству, вам лучше ориентироваться на самую разнообразную группу животных в мире — насекомых. У Wolbachia есть несколько трюков на своей мембране, чтобы убедиться, что она передается от родителя потомству, от превращения хозяина в бесполого до уничтожения всего пола. В одном крайнем случае он даже вставил весь свой геном в геном мухи. См. также LOLbalchia.
В одном крайнем случае он даже вставил весь свой геном в геном мухи. См. также LOLbalchia.
Эксклюзивный контент для подписчиков
Почему люди так одержимы Марсом?
Как вирусы влияют на наш мир
Эпоха собачьих бегов в США подходит к концу будет исследовать красную планету
Почему люди так одержимы Марсом?
Как вирусы формируют наш мир
Эпоха собачьих бегов в США подходит к концу
Узнайте, как люди представляли себе жизнь на Марсе на протяжении всей истории будет исследовать красную планету
Почему люди так одержимы Марсом?
Как вирусы формируют наш мир
Эпоха собачьих бегов в США подходит к концу
Узнайте, как люди представляли себе жизнь на Марсе на протяжении всей истории
Узнайте, как новый марсоход НАСА будет исследовать красную планету
Узнать больше
Бактерии — животные или растения?
- Обновлено
- 19.
 10.21
10.21
- Время чтения
- 6 минут
На этой странице…
Бактерии — самые ранние формы жизни на Земле, возраст которых превышает 4 миллиарда лет. Они обитают практически во всех наземных и морских местообитаниях, их можно встретить даже в антарктических породах!
Бактерии – это животные или растения?
Бактерии не являются ни животными, ни растениями. Учитывая, что бактерии имеют сходные процессы и характеристики с растениями и животными, понятно, почему люди спрашивают: «Бактерии — животные или растения?». Бактерии — это одноклеточные прокариотические организмы по сравнению с животными и растениями, которые являются многоклеточными эукариотическими организмами. Поскольку бактерии являются прокариотами, у них нет ни ядра, ни связанных с мембраной органелл. Напротив, растения и животные состоят из эукариотических клеток, что означает, что они имеют ядро и связанные с мембраной органеллы, такие как митохондрии или аппарат Гольджи.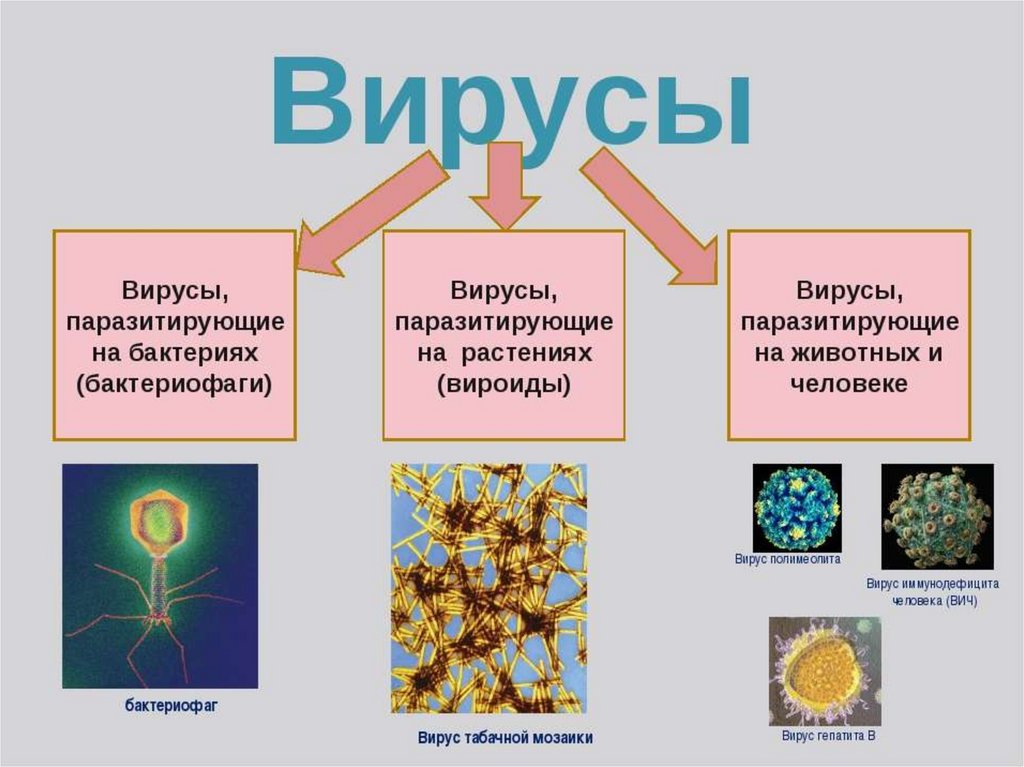
Бактерии кишечной палочки под микроскопом
Изображение: Национальный институт аллергии и инфекционных заболеваний
Creative Commons
Живые существа подразделяются на пять царств: животные принадлежат к царству Animalia, растения принадлежат к царству Plantae, грибы к царству Fungi, простейшие к царству Protista, а бактерии относятся к своему собственному царству, известному как царство Monera.
Бактерии это животные или растения? Это уникальная категория организмов, имеющая собственную систему классификации.
Являются ли бактерии животными?
Нет, бактерии не животные. Хотя бактерии имеют некоторые общие характеристики с животными, например, бактерии продуцируют типичную нуклеиновую кислоту, которая обнаруживается в частях поджелудочной железы, селезенки и спермы человека.
В организме человека 39 триллионов бактериальных клеток, которые составляют около 30% нашего клеточного состава. В кишечнике человека живет более 1000 различных видов бактерий, эти бактерии являются хорошими бактериями, которые поддерживают наше здоровье, помогая нам бороться с болезнями, вырабатывать витамины для нашего организма и переваривать сложные углеводы.
Однако не все бактерии являются хорошими бактериями, боль, которую вы испытываете при ангине, иногда может быть вызвана стрептококком, бактериальной инфекцией горла и миндалин, вызванной бактериями Streptococcus pyogenes .
Streptococcus pyogenes под микроскопом
Изображение: Центр контроля заболеваний
Creative Commons
Когда человеческое тело умирает, первой группой организмов, участвующих в разложении на микроскопическом уровне, являются бактерии, наряду с грибками и плесенью. Это называется гниением. Другие более крупные организмы, такие как личинки мух, жуков, клещей и мотыльков, помогают ускорить разложение, питаясь мертвой массой и разбивая ее на более мелкие части. Это увеличивает площадь поверхности для бактерий, грибков и плесени. Бактерии считаются «первыми колонизаторами», потому что они уже присутствуют в организме перед смертью.
Являются ли бактерии растениями?
Нет, бактерии не растения. Хотя первые ученые хотели отнести бактерии к царству растений из-за их сходства с растениями, современные ученые относят бактерии к своему собственному царству Monera.
Хотя первые ученые хотели отнести бактерии к царству растений из-за их сходства с растениями, современные ученые относят бактерии к своему собственному царству Monera.
Бактерии имеют некоторые общие характеристики с растениями, например, цианобактерии могут фотосинтезировать для получения энергии. Как и растения, цианобактерии используют солнечный свет и углекислый газ для производства пищи и аналогичным образом выделяют кислород в качестве побочного продукта. В отличие от растительных клеток, многие цианобактерии также способны фиксировать азот, то есть превращать газообразный азот в атмосфере в аммиак, нитриты и нитраты, которые могут поглощаться растениями.
Азотфиксирующий узелок на корнях растений
Изображение: Соя Checkoff
Creative Commons
Многие бобовые растения, такие как горох, фасоль, клевер, чечевица и арахис, вступают в симбиотические отношения с азотфиксирующими бактериями. Эти бактерии, называемые ризобиями, располагаются в узелках на корнях этих растений. Когда растения умирают, ризобии выделяют азот в почву, создавая естественное удобрение. Вот почему многие фермеры чередуют посевы на своих полях с азотфиксирующими растениями.
Когда растения умирают, ризобии выделяют азот в почву, создавая естественное удобрение. Вот почему многие фермеры чередуют посевы на своих полях с азотфиксирующими растениями.
В то время как растения могут фотосинтезировать только для получения пищи, многие цианобактерии могут преобразовывать химические вещества, такие как сера, сероводород, аммиак, марганец или железо, для производства пищи. Этот процесс известен как хемосинтез. Эти бактерии можно найти в высокотоксичной среде, такой как глубоководные гидротермальные источники и холодные выходы.
Трубчатые черви, растущие вблизи гидротермальных источников
Изображение: National Geographic
Creative Commons
Отвечая на вопрос, являются ли бактерии животными или растениями, мы можем сделать вывод, что бактерии являются уникальными организмами и заслуживают отдельной системы классификации. Бактерии не являются ни животными, ни растениями.
Австралийский музей специализируется на таксономических и систематических исследованиях.

 Да, я немного волшебница, я из лаборатории, где все такие, – улыбается Екатерина.
Да, я немного волшебница, я из лаборатории, где все такие, – улыбается Екатерина.

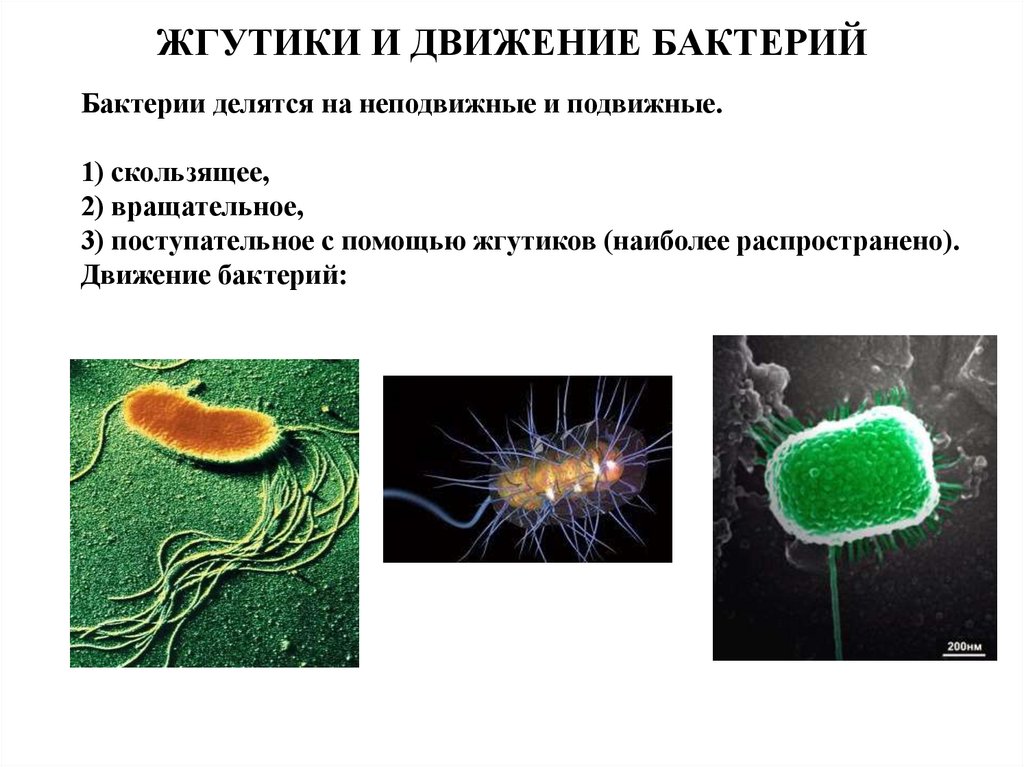 Это тоже огромная интересная задача – понять, как бактерия собирает, нанизывает мономеры – в каком именно порядке, есть ли вообще этот порядок или его нет. Бактерии собирают молекулы в цепь при помощи специальных ферментов – полимераз, получаются очень длинные цепочки, как бусы из разноцветных бусин, и материал обладает совсем другими свойствами. В нашей стране мы, наверное, монополисты, потому что никто так не «дрессирует» бактерии, чтобы получить разные молекулы ПГА, как мы, – заключает Екатерина.
Это тоже огромная интересная задача – понять, как бактерия собирает, нанизывает мономеры – в каком именно порядке, есть ли вообще этот порядок или его нет. Бактерии собирают молекулы в цепь при помощи специальных ферментов – полимераз, получаются очень длинные цепочки, как бусы из разноцветных бусин, и материал обладает совсем другими свойствами. В нашей стране мы, наверное, монополисты, потому что никто так не «дрессирует» бактерии, чтобы получить разные молекулы ПГА, как мы, – заключает Екатерина.
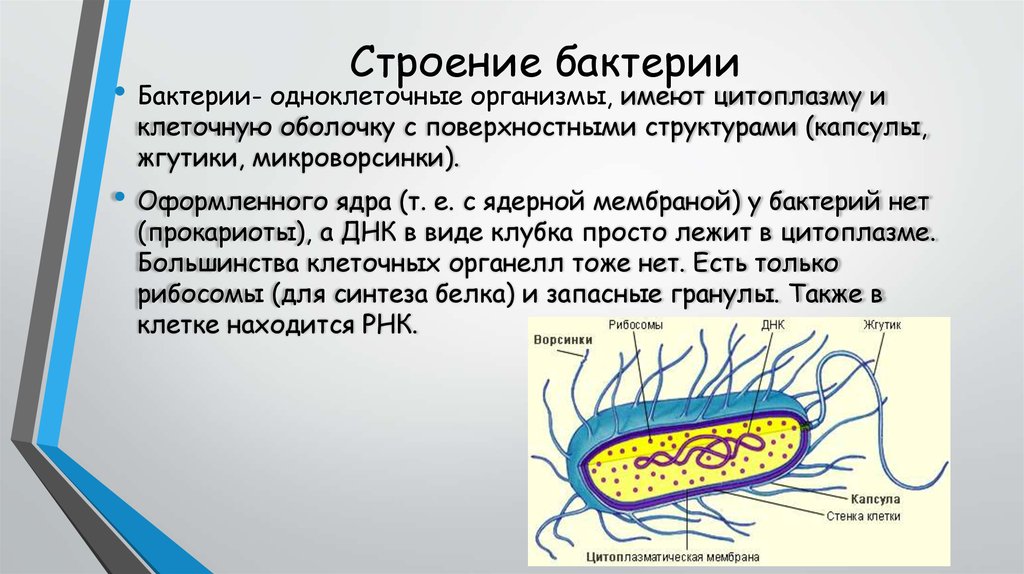 Мы не знали, какой орган-мишень нам подойдет, чтобы мы технически могли выполнить исследование корректно. В результате остановились на группе пациентов с хронической ишемией сердца, так как они поступают на лечение в плановом порядке и их легче отследить впоследствии. Выручило врожденное упрямство – со второй попытки грант получить удалось. Мы начали подготовку сильно заранее, потратили время на знакомство с другими коллегами-медиками, представили им нашу работу и обозначили ту ее часть, которую не сможем выполнить без их помощи, – и все получилось.
Мы не знали, какой орган-мишень нам подойдет, чтобы мы технически могли выполнить исследование корректно. В результате остановились на группе пациентов с хронической ишемией сердца, так как они поступают на лечение в плановом порядке и их легче отследить впоследствии. Выручило врожденное упрямство – со второй попытки грант получить удалось. Мы начали подготовку сильно заранее, потратили время на знакомство с другими коллегами-медиками, представили им нашу работу и обозначили ту ее часть, которую не сможем выполнить без их помощи, – и все получилось.
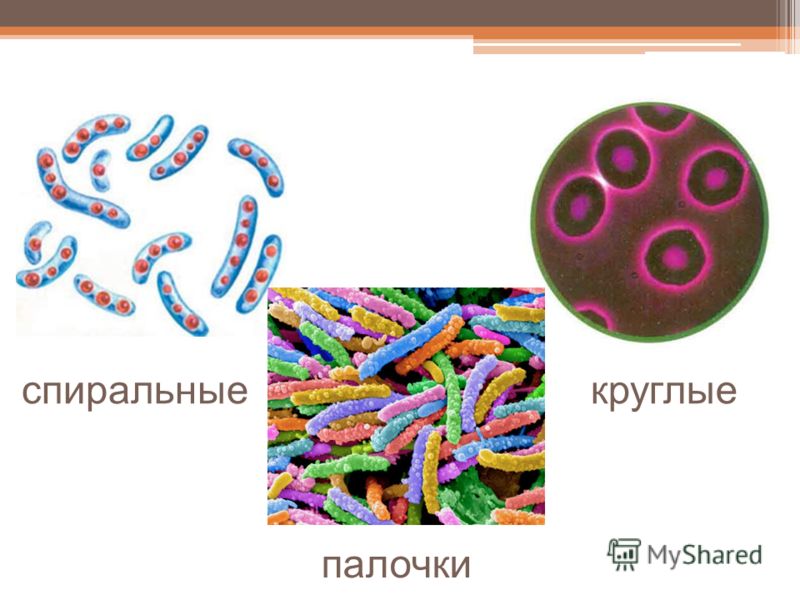 главного врача. Даже главных врачей-женщин больше, чем женщин-директоров научно-исследовательских институтов и ректоров. В нашей стране проблема стоит острее, чем во многих других странах, при этом в периферийных городах хуже, чем в центральных. И после этого момента постепенно я стала замечать, что существует какой-то шовинизм в науке. Я с очень неприятным удивлением сталкивалась с этим, видела, что когда прихожу куда-то, что-то людям говорю, я с ними разговариваю на равных, а они со мной – нет. Официальная встреча, люди в приличной одежде, вроде бы, культурные, сидят за столом, разговаривают, и все по делу, но мне нужно сказать им больше слов, чтобы они меня поняли, да еще и с какой-то определенной интонацией и тембром. Иначе не слышат, факт. Получается, что женщин на этой встрече две – я и та, которая сидит в приемной и носит кофе, при этом отношение к обеим примерно одно. У женщин есть физиологические особенности, определяющие тип мышления и структурирование работы, но это не аргумент.
главного врача. Даже главных врачей-женщин больше, чем женщин-директоров научно-исследовательских институтов и ректоров. В нашей стране проблема стоит острее, чем во многих других странах, при этом в периферийных городах хуже, чем в центральных. И после этого момента постепенно я стала замечать, что существует какой-то шовинизм в науке. Я с очень неприятным удивлением сталкивалась с этим, видела, что когда прихожу куда-то, что-то людям говорю, я с ними разговариваю на равных, а они со мной – нет. Официальная встреча, люди в приличной одежде, вроде бы, культурные, сидят за столом, разговаривают, и все по делу, но мне нужно сказать им больше слов, чтобы они меня поняли, да еще и с какой-то определенной интонацией и тембром. Иначе не слышат, факт. Получается, что женщин на этой встрече две – я и та, которая сидит в приемной и носит кофе, при этом отношение к обеим примерно одно. У женщин есть физиологические особенности, определяющие тип мышления и структурирование работы, но это не аргумент.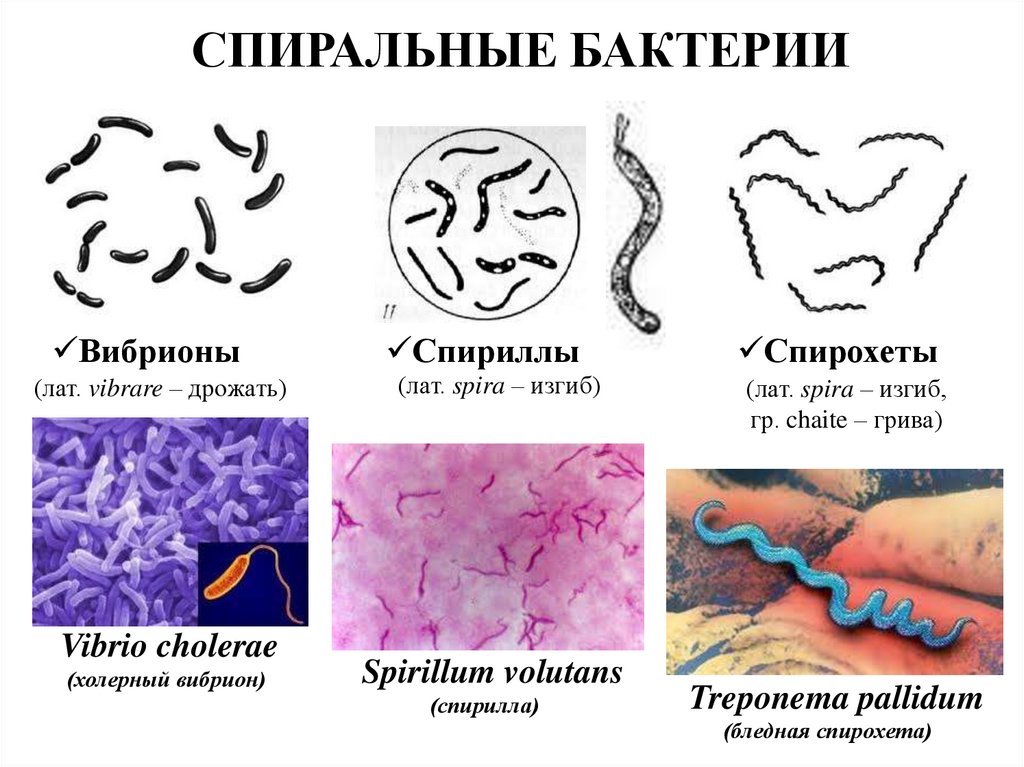 Очень неправильно широким плечом отодвигать тех, кто слабее физически. Во всех сферах общественной жизни в наше время женственность учитывается как плюс, а не минус, сейчас это обязательное требование к обществу, признак его развитости, и наука тут не должна отставать.
Очень неправильно широким плечом отодвигать тех, кто слабее физически. Во всех сферах общественной жизни в наше время женственность учитывается как плюс, а не минус, сейчас это обязательное требование к обществу, признак его развитости, и наука тут не должна отставать.
 – Если мы не будем этого делать, многим умным девушкам просто не дадут реализовать свои амбиции и планы. Сегодня практически нет никакого джентльменства, нет уважения к женскому полу ни среди политиков, ни среди ученых – когда никто не видит, отодвинут и не постесняются. Этим вопросом надо заниматься, и тогда женщины смогут занять ту самую нишу, вровень с мужчинами, которая должна быть. Женщина имеет больше жестких обязанностей в повседневной жизни, чем мужчина, поэтому она должна тратить меньше часов на свою, в том числе научную работу, и при этом получать равную оплату. Кто из знакомых вам женщин спокойно оставит ребенка в садике, потому что не может его забрать вовремя из-за эксперимента? Или, например, тебе самое время пойти в декрет, а на работе скажут, что этого делать нельзя, потому что получили большой грант и пару лет никаких отпусков не предвидится.
– Если мы не будем этого делать, многим умным девушкам просто не дадут реализовать свои амбиции и планы. Сегодня практически нет никакого джентльменства, нет уважения к женскому полу ни среди политиков, ни среди ученых – когда никто не видит, отодвинут и не постесняются. Этим вопросом надо заниматься, и тогда женщины смогут занять ту самую нишу, вровень с мужчинами, которая должна быть. Женщина имеет больше жестких обязанностей в повседневной жизни, чем мужчина, поэтому она должна тратить меньше часов на свою, в том числе научную работу, и при этом получать равную оплату. Кто из знакомых вам женщин спокойно оставит ребенка в садике, потому что не может его забрать вовремя из-за эксперимента? Или, например, тебе самое время пойти в декрет, а на работе скажут, что этого делать нельзя, потому что получили большой грант и пару лет никаких отпусков не предвидится.
 Пример активной успешной женщины чаще воспринимается, как «бой-баба», а в науке такой образ женщины не уместен, здесь делом занимаются не ради денег, не пропихиваясь и толкаясь, а потому, что интересно. Пока наука интересна женщинам, и пока в ней много активных и любознательных, и при этом хорошо воспитанных и спокойных мужчин, наука будет в полном порядке.
Пример активной успешной женщины чаще воспринимается, как «бой-баба», а в науке такой образ женщины не уместен, здесь делом занимаются не ради денег, не пропихиваясь и толкаясь, а потому, что интересно. Пока наука интересна женщинам, и пока в ней много активных и любознательных, и при этом хорошо воспитанных и спокойных мужчин, наука будет в полном порядке.
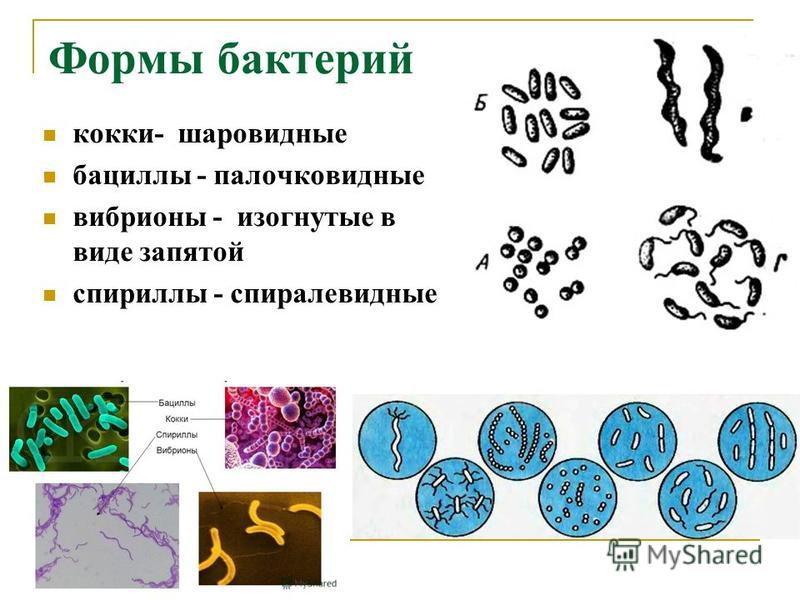 , and Savitskaya, E. Genome Maintenance Proteins Modulate Autoimmunity Mediated Primed Adaptation by the Escherichia coli Type I-E CRISPR-Cas System. Genes, 2019, 10, 872.
, and Savitskaya, E. Genome Maintenance Proteins Modulate Autoimmunity Mediated Primed Adaptation by the Escherichia coli Type I-E CRISPR-Cas System. Genes, 2019, 10, 872.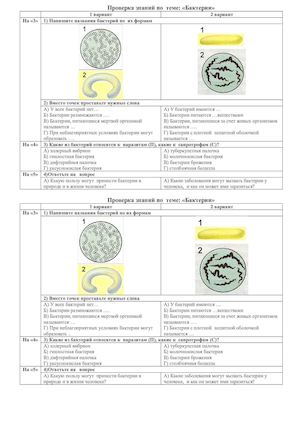 *; Selkova, P.; Pobegalov, G.; Goryanin, I.; Vasileva, A.; Musharova, O.; Abramova, M.; Kazalov, M.; Zyubko, T.; Artamonova, T.; Artamonova, D.; Shmakov, S.; Khodorkovskii, M.; Severinov, K. DNA Targeting by Clostridium Cellulolyticum CRISPR-Cas9 Type II-C System. Nucleic Acids Research, 2020, 48(4), 2026–2034. DOI: 10.1093/nar/gkz1225.
*; Selkova, P.; Pobegalov, G.; Goryanin, I.; Vasileva, A.; Musharova, O.; Abramova, M.; Kazalov, M.; Zyubko, T.; Artamonova, T.; Artamonova, D.; Shmakov, S.; Khodorkovskii, M.; Severinov, K. DNA Targeting by Clostridium Cellulolyticum CRISPR-Cas9 Type II-C System. Nucleic Acids Research, 2020, 48(4), 2026–2034. DOI: 10.1093/nar/gkz1225. Nucleic Acids Research, 2020 in press.
Nucleic Acids Research, 2020 in press. Nucleic Acids Res. 2018; 46(9):4733-4751. DOI:10.1093/nar/gky124
Nucleic Acids Res. 2018; 46(9):4733-4751. DOI:10.1093/nar/gky124 1016/j.bbrc.2019.02.132
1016/j.bbrc.2019.02.132 Nucleic Acids Research, 2016, 44(2), 790-800. DOI: 10.1093/nar/gkv1490.
Nucleic Acids Research, 2016, 44(2), 790-800. DOI: 10.1093/nar/gkv1490. Journal of Physics: Conference Series, 2018, 1135(1), 012016. DOI: 10.1088/1742-6596/1135/1/012016.
Journal of Physics: Conference Series, 2018, 1135(1), 012016. DOI: 10.1088/1742-6596/1135/1/012016.


 Balmaev, P. Serdobintsev, A. Melnikov, A. Pastor, M. Khodorkovskiy, Journal of Physics: Conference Series 1410 (1), 012135
Balmaev, P. Serdobintsev, A. Melnikov, A. Pastor, M. Khodorkovskiy, Journal of Physics: Conference Series 1410 (1), 012135 Калибровка по изменению термостабильности дуплексов ДНК и степени несовпадения пар оснований. Журнал молекулярной эволюции. 1988; 27: 212–216. [PubMed] [Академия Google]
Калибровка по изменению термостабильности дуплексов ДНК и степени несовпадения пар оснований. Журнал молекулярной эволюции. 1988; 27: 212–216. [PubMed] [Академия Google] [PubMed] [Google Scholar]
[PubMed] [Google Scholar] Дж., Холмс Э.К., Бессен Д.Э., Чан М.С., Дэй Н.П.Дж., Энрайт М.С., Гольдштейн Р., Худ Д.В., Калия А., Мур К.Э., Чжоу Д.Дж., Спратт Б.Г. Рекомбинация в природной популяции патогенных бактерий: краткосрочные эмпирические оценки и долгосрочные филогенетические последствия. Труды Национальной академии наук США. 2001;98:182–187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж., Холмс Э.К., Бессен Д.Э., Чан М.С., Дэй Н.П.Дж., Энрайт М.С., Гольдштейн Р., Худ Д.В., Калия А., Мур К.Э., Чжоу Д.Дж., Спратт Б.Г. Рекомбинация в природной популяции патогенных бактерий: краткосрочные эмпирические оценки и долгосрочные филогенетические последствия. Труды Национальной академии наук США. 2001;98:182–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] Клональная дивергенция в Escherichia coli в результате рекомбинации, а не мутации. Наука. 1994; 266:1380–1383. [PubMed] [Google Scholar]
Клональная дивергенция в Escherichia coli в результате рекомбинации, а не мутации. Наука. 1994; 266:1380–1383. [PubMed] [Google Scholar] , Кохан FM. Влияние репарации несоответствия и образования гетеродуплексов на половую изоляцию у Bacillus . Генетика. 1998; 148:13–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Кохан FM. Влияние репарации несоответствия и образования гетеродуплексов на половую изоляцию у Bacillus . Генетика. 1998; 148:13–18. [Бесплатная статья PMC] [PubMed] [Google Scholar] Дополнительные доказательства неклональной структуры популяции Neisseria gonorrhoeae : Обширное генетическое разнообразие внутри изолятов одного и того же электрофоретического типа. Микробиология. 1994; 140:1285–1290. [PubMed] [Google Scholar]
Дополнительные доказательства неклональной структуры популяции Neisseria gonorrhoeae : Обширное генетическое разнообразие внутри изолятов одного и того же электрофоретического типа. Микробиология. 1994; 140:1285–1290. [PubMed] [Google Scholar] Популяционная генетика бактерий. Издательство Кембриджского университета; Кембридж, Англия, Великобритания: 1995. стр. 143–160. [Академия Google]
Популяционная генетика бактерий. Издательство Кембриджского университета; Кембридж, Англия, Великобритания: 1995. стр. 143–160. [Академия Google] Текущая биология. 1993; 3: 567–572. [PubMed] [Google Scholar]
Текущая биология. 1993; 3: 567–572. [PubMed] [Google Scholar] я указал это красным цветом , так как в литературе очень много ошибок.
я указал это красным цветом , так как в литературе очень много ошибок.

 Часто это происходит из-за того, что таксономические отношения неоднозначны, поэтому не очень ясно, как группировать роды в более высокие таксономические ранги. Это оставляет много хаоса в бактериальной таксономической системе, и это особенно плохая новость для исследователей микробиома, где исследования проводятся в разных таксономических рангах, таких как семейство или даже тип.
Часто это происходит из-за того, что таксономические отношения неоднозначны, поэтому не очень ясно, как группировать роды в более высокие таксономические ранги. Это оставляет много хаоса в бактериальной таксономической системе, и это особенно плохая новость для исследователей микробиома, где исследования проводятся в разных таксономических рангах, таких как семейство или даже тип. Чтобы имя было подтверждено, оно должно быть включено в один из списков, описанных ниже.
Чтобы имя было подтверждено, оно должно быть включено в один из списков, описанных ниже.
 Это может сделать любой, включая авторов. Последствия невыполнения этого требования могут быть разрушительными, поскольку имя «фактически публикуется», но никогда не «9».0411 утверждено ’. Редакторы списков IJSEM добавят имена в Список проверки при условии, что будут выполнены все требования Кодекса прокариот (для новых видов и подвидов, в частности, Правила 27 и 30).
Это может сделать любой, включая авторов. Последствия невыполнения этого требования могут быть разрушительными, поскольку имя «фактически публикуется», но никогда не «9».0411 утверждено ’. Редакторы списков IJSEM добавят имена в Список проверки при условии, что будут выполнены все требования Кодекса прокариот (для новых видов и подвидов, в частности, Правила 27 и 30).
 Например, мы считаем, что вид Escherichia coli имеет больше общих фенотипических признаков с другими видами Escherichia , чем с видами Bacillus . Поэтому использование правильных имен имеет решающее значение для интерпретации микробиома и других типов данных.
Например, мы считаем, что вид Escherichia coli имеет больше общих фенотипических признаков с другими видами Escherichia , чем с видами Bacillus . Поэтому использование правильных имен имеет решающее значение для интерпретации микробиома и других типов данных. 5_1_39БФАА
5_1_39БФАА

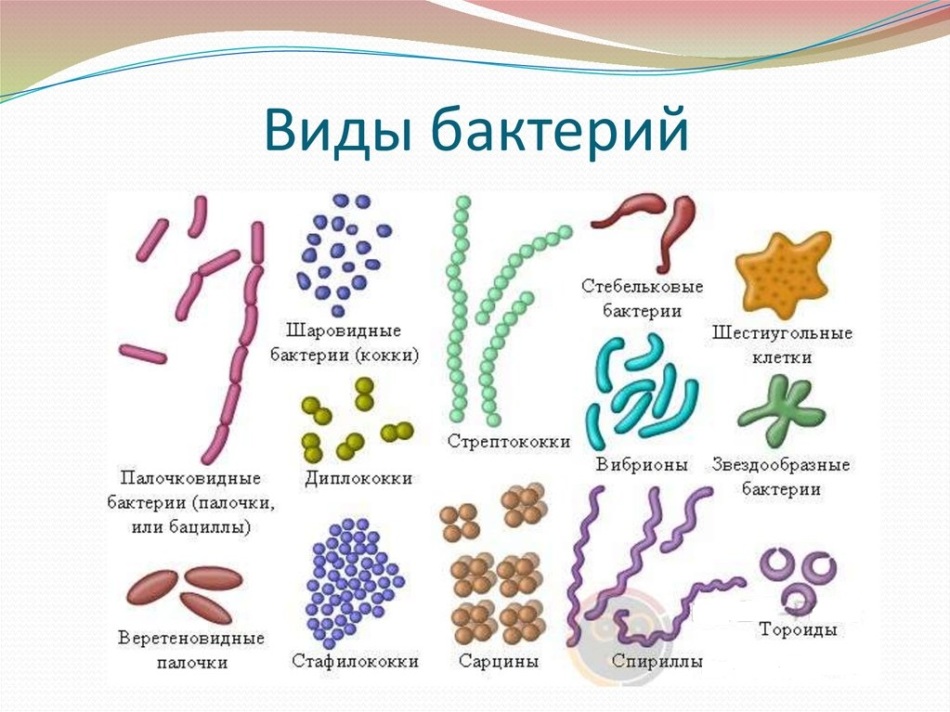 Предлагаю проконсультироваться со специалистом.
Предлагаю проконсультироваться со специалистом. Не доверяйте собранной последовательности фирм, занимающихся секвенированием, поскольку эти сервисные компании почти никогда не редактируют окончательную последовательность. Всегда проверяйте хроматограммы (файлы Sanger ab1 ) вручную. Я видел ужасные последовательности 16S, используемые для создания новых видов, которые на самом деле не являются новыми видами.
Не доверяйте собранной последовательности фирм, занимающихся секвенированием, поскольку эти сервисные компании почти никогда не редактируют окончательную последовательность. Всегда проверяйте хроматограммы (файлы Sanger ab1 ) вручную. Я видел ужасные последовательности 16S, используемые для создания новых видов, которые на самом деле не являются новыми видами. Пороговое значение ANI равно 9.5~96% для видов.
Пороговое значение ANI равно 9.5~96% для видов.


 , а также списки уведомлений и валидации в IJSB и IJSEM. Однако в настоящее время IJSEM или другие официально признанные органы не предоставляют систематизированного актуального списка официально опубликованных имен. К счастью, следующие ресурсы поддерживаются должным образом и поэтому полезны. Пожалуйста, имейте в виду, что эти веб-сайты могут содержать человеческие ошибки.
, а также списки уведомлений и валидации в IJSB и IJSEM. Однако в настоящее время IJSEM или другие официально признанные органы не предоставляют систематизированного актуального списка официально опубликованных имен. К счастью, следующие ресурсы поддерживаются должным образом и поэтому полезны. Пожалуйста, имейте в виду, что эти веб-сайты могут содержать человеческие ошибки. Позднее название вида было изменено. Выясните это номенклатурное изменение и зачем оно было нужно (на каком научном основании).
Позднее название вида было изменено. Выясните это номенклатурное изменение и зачем оно было нужно (на каком научном основании).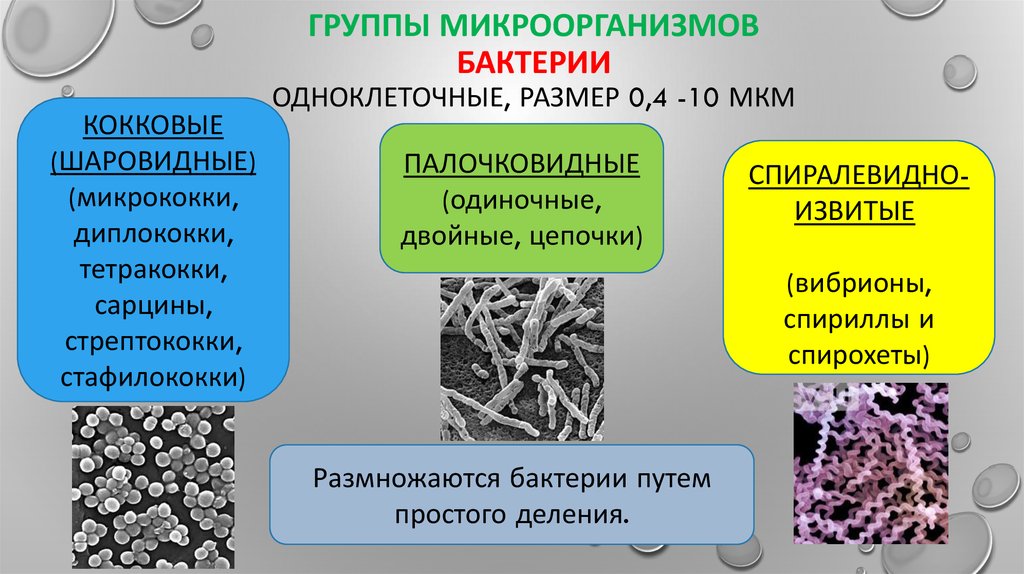 10.21
10.21