Содержание
Как на самом деле выглядит атом и как его можно увидеть (4 фото + видео)
Автор Chert-Best2020-03-01 03:02:09
Человеку трудно представить, насколько крохотны атомы. В обычной офисной бумаге, формата А4, если рассматривать ее толщину, находится 500 тыс. атомов, хотя для наших глаз, ее толщина не превышает и 1 мм.
Один атом в сравнении с яблоком настолько мал, насколько яблоко мало в сравнении с Землей. Тем не менее ученые могут видеть эти мизерные частицы мироздания. Это, конечно, возможно не воочию, а с помощью специальных высокоточных инструментов.
Теорию о том, что вся Вселенная состоит из крошечных частиц, предложил примерно в 400 году до н.э. Демоктрит. Платон продолжил работу над теорией, но в его понимании разные материи, состоят из разных по форме атомов. Первые современные представления о строении субстанций появились в начале XIX века, когда английский ученый Джон Дальтон осуществил прорыв в области строения веществ. Он выяснил, что все вещества всегда содержат целые числа атомов. Именно поэтому формулы имеют вид: Na2SO4 и h3CrO4, а не Na2,8SO4,1 и h3CrO√4. Не может быть четверти атома или половины, а только целый атом.
Он выяснил, что все вещества всегда содержат целые числа атомов. Именно поэтому формулы имеют вид: Na2SO4 и h3CrO4, а не Na2,8SO4,1 и h3CrO√4. Не может быть четверти атома или половины, а только целый атом.
Изучение атомных связей началось с наблюдения за сеткой атомов кристаллов
Дальтон совершил великий прорыв, который объясняет множество химических процессов, хотя его современникам успех казался сомнительным, потому что химики не могли видеть атомы. Они воспринимали их как отрицательные числа или идеальные газы, применяемые при расчетах, но не существующие в реальности. Даже Менделеев отрицал существование атомов долгие годы.
Несмотря на то, что микроскопы появились уже в XVII веке, ученым пришлось ждать появление рентгеновских лучей, которые были открыты в самом конце XIX века. Рассмотреть что-либо в микроскоп можно, если длина волны света в микроскопе не больше того на что мы смотрим. Но длина видимого света в тысячи раз больше атома, поэтому лишь рентгеновские лучи оказались пригодными для изучения микромолекул, так как они намного короче.
Технология наблюдения за атомами при помощи туннельного микроскопа
Сегодня рентгеновское излучение, ставшее прорывом после его открытия Вильгельмом Рентгеном, применяется повсюду, от стоматологических клиник до химических лабораторий. Химические опыты с этим видом излучения сводятся к бомбардировке электромагнитными волнами кристаллов. Эти прочные субстанции из слоев атомов отражают лучи, которые возвращаются к детектору. Основываясь на полученном при соударении рисунке, специалисты выстраивают структуры атомов. Процесс отражения и взаимодействия лучей света называется дифракцией.
В 1950-х кристаллографы начали совершать открытия. Во время работы со структурами на основе исследований, проведенных Розалинд Франклин, Джеймс Уотсон и Френсис Кирк открыли структуру ДНК. Хотя авторство открытия остается спорным, ведь Розалинд не желала, чтобы кто-то видел ее работы, но так или иначе им удалось показать миру, как расположены атомы в структуре ДНК.
Атом
Созданный в 1981 году сканирующий туннельный микроскоп Биннига и Рорера смог уловить сами атомы. СТМ оснащен иглой, которая двигается над поверхностью атомов, улавливая ландшафт. Благодаря СТМ выяснили, что атомы — это не кубы и пирамиды, а сферы разных размеров. В 1989 году ученые смогли манипулировать атомами. Была разработана сверхточная и сверхбыстрая камера, способная улавливать распад и формирование химических связей. Химик Ахмед Зевейл, создатель камеры, вывел науку на новый уровень. С тех пор научный мир получил ответы на многие вопросы: как работает сетчатка глаза, почему парят облака и истощается озоновый слой.
Прошло около 2,5 тыс. лет с того момента, когда первые ученые задумались о существовании мизерных частиц. Но лучше один раз увидеть, чем 100 раз услышать, и у специалистов это получилось. Теперь человечество точно знает, как выглядят атомы, формирующие нашу Вселенную.
com/embed/1JbR3NxdeM0″ frameborder=»0″ allowfullscreen=»allowfullscreen» data-mce-fragment=»1″>
Источник
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете
- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
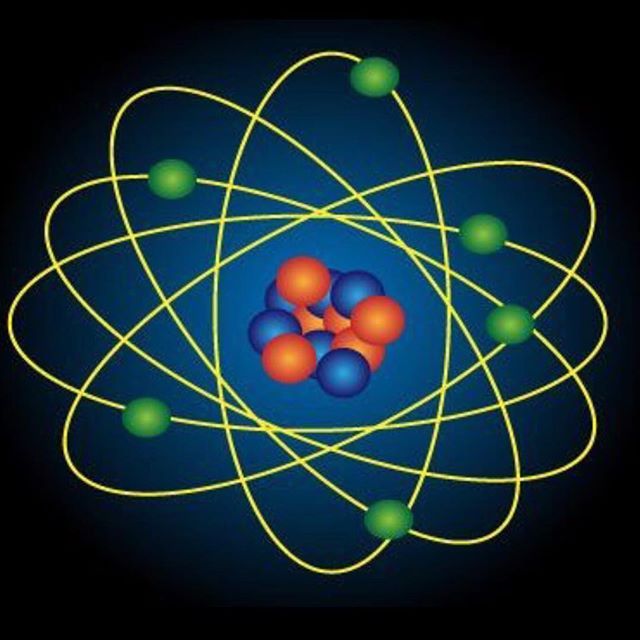
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). 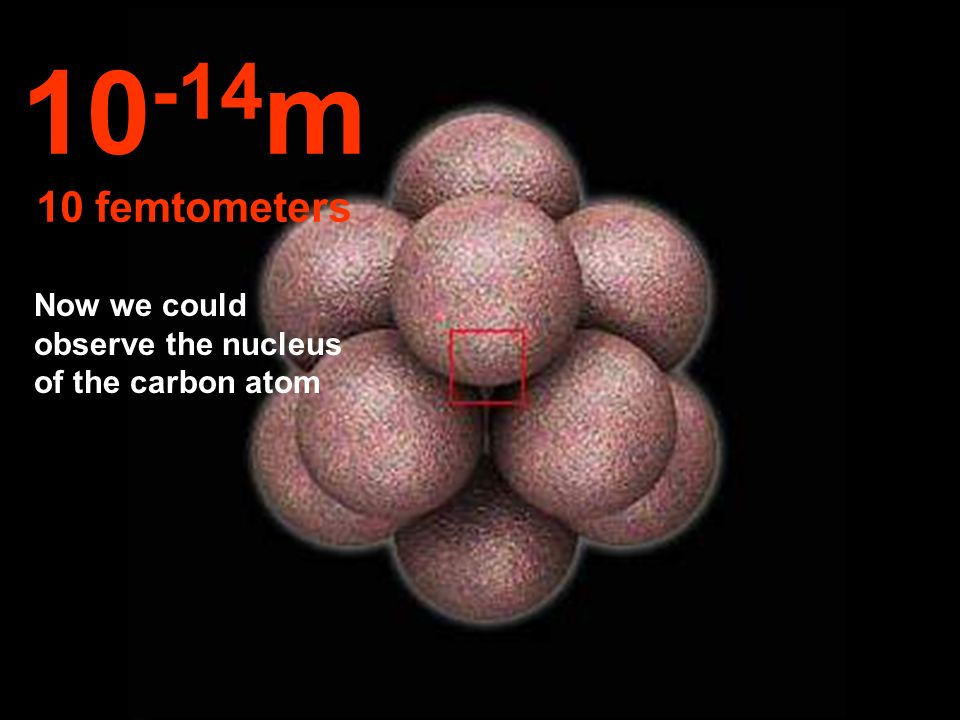 Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а. е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями).
 Нумерация слоев начинается с ближайшего к ядру электронного слоя.
Нумерация слоев начинается с ближайшего к ядру электронного слоя. - На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.

У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.

Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
На что похож атом?
Дон Линкольн, доктор философии, Университет Нотр-Дам
С момента открытия атома многие теории пытались описать, на что похож атом.
 Они сравнивали его со сливовым пудингом, маленьким шариком и даже крошечной солнечной системой. Возможно, его также представляют как ядро с окружающим его облаком мелких и легких частиц.
Они сравнивали его со сливовым пудингом, маленьким шариком и даже крошечной солнечной системой. Возможно, его также представляют как ядро с окружающим его облаком мелких и легких частиц.
изображений атомов варьировались от шоколадного печенья до солнечных систем и футбольных полей.
(Изображение: Anusorn Nakdee/Shutterstock)
Атомы строят все в этом мире. С тех пор, как концепция была раскрыта, ученые пытались изобразить, на что похож атом и что у него внутри. Гипотетический образ атома стал меняться и становиться более реальным, когда были обнаружены частицы внутри него.
Узнайте больше о том, как работает квантовая механика.
Модель сливового пудинга
Первое изображение атома было названо моделью сливового пудинга. В 1897 году британский физик Дж. Дж. Томсон открыл субчастицу атома и назвал ее корпускулой. Сегодня эту частицу называют электроном. Он считал, что масса этой частицы составляет примерно 1/2000 массы атома водорода, несущего отрицательный электрический заряд. Однако он знал, что атом не имеет электрического заряда. Таким образом, он пришел к выводу, что существуют и положительно заряженные частицы.
Однако он знал, что атом не имеет электрического заряда. Таким образом, он пришел к выводу, что существуют и положительно заряженные частицы.
Затем Томсон решил, что атом
был как пудинг с положительным зарядом, а электроны были твердыми
частицы с отрицательным зарядом, рассеянные в пудинге. Следовательно, атом
в этой модели выглядело как шоколадное тесто. Эта модель не дожила до этого
длинная.
Эксперимент Эрнеста Резерфорда
В 1911 году Эрнест Резерфорд и двое
его коллеги-исследователи провели эксперимент, доказавший, что сливовый пудинг
модель неправильная. Они направили альфа-излучение на тонкую золотую фольгу, чтобы увидеть, как частицы
были разбросаны. Вопреки их ожиданиям, не все альфа-частицы прошли
через пудинг, а некоторые даже пришли в норму. Это было так же странно, как стрелять
тяжелое пушечное ядро в папиросную бумагу и смотреть, как оно отскакивает!
Атом представлялся в различных формах, и форма или форма развивались, пока не стали очень близки к реальности..jpg) (Изображение: Н. Винот Нарасингам/Shutterstock)
(Изображение: Н. Винот Нарасингам/Shutterstock)
Затем Резерфорд решил, что
положительный заряд должен быть сосредоточен в центре атома, а не
разбросаны повсюду. Он также пришел к выводу, что электроны должны вращаться
вокруг ядер, на значительных расстояниях. Таким образом, основа современного
были созданы модели атома.
Это стенограмма из серии видео Понимание заблуждений науки . Смотрите прямо сейчас на Wondrium.
Модель Бора
Основываясь на выводах Резерфорда, датский физик Нильс Бор ввел модель Бора. Атом в этой модели рассматривается как солнечная система. Задолго до Резерфорда японский физик Хантаро Нагаока сравнил атомы с Сатурном. Он считал, что электроны действуют как кольца. Однако и идея Резерфорда, и модель Бора были оригинальными, поскольку маловероятно, чтобы кто-либо из них читал работы Нагаоки. В модели большая часть атома представляет собой пустое пространство.
Узнайте больше о раскрытии правды о радиации.
Пустое пространство в атоме
Почти весь атом пуст
пространство. Резерфорд показал, что размер ядра атома составляет примерно 1/10 000 th размера атома. Таким образом, ядро имеет диаметр 10 -14 м.
Считая и ядро, и атом сферическими, можно вычислить
объем через 4/3 раза пи умножить на радиус в кубе. Таким образом, ядро занимает
одна триллионная часть всего объема атома!
Если представить себе ядро как
мрамора с радиусом в один сантиметр, радиус атома должен быть около 100
метров. Футбольное поле с мрамором посередине — невероятных размеров.
для атома. Электроны вращаются вокруг мрамора на определенных расстояниях в пределах
стадион.
Электроны составляют около 1/2000
размер протона. Следовательно, если ядро представляет собой мрамор, радиус электрона
будет почти равно поперечному сечению человеческого волоса. Это означает, что даже в
В масштабах футбольного поля электроны почти невозможно обнаружить.
На что похож атом?
Атом выглядит как крошечная солнечная система с чрезвычайно плотным и тяжелым ядром в центре, вокруг которого вращаются электроны. Модель Бора была близка к реальности, но это самый простой способ представить себе атом.
Модель Бора была близка к реальности, но это самый простой способ представить себе атом.
Атомы содержат значительное пустое пространство рядом с ядром и вращающимися электронами. (Изображение: ktsdesign/Shutterstock)
Рассматривая атом углерода как футбольное поле, а ядро как мрамор, можно представить, что шесть электронов будут летать по стадиону. Таким образом, большая часть стадиона, т. е. атома, представляет собой пустое пространство. Картина становится еще более своеобразной, когда понимаешь, что электроны одновременно везде.
Узнайте больше о мифах об орбитальном движении.
Электроны в атоме
Электроны не крошечные шарики
вращающихся в атоме по своим особым круговым орбитам. Что касается законов квантовой
механика допускает, что электроны одновременно находятся везде в атоме. Это делает
не тревожить пустое пространство, так как каждый электрон имеет свое «сферическое облако» и
расстояние от ядра. Электронные орбиты называются S, P, D, F и G.
исходя из их сложности.
Наконец, атом почти
как сказал Бор, но с гораздо большей сложностью и значительным пустым пространством.
Общие вопросы о том, что
Атом подобен
В: Что такое атом?
Атомы строят все в нашем мире. Раньше считалось, что атомы подобны маленьким шарикам, но сегодня определения другие. Атом состоит из трех основных частиц: протонов, нейтронов и электронов.
В: Что является примером атома?
Все материалы состоят из атомов. Таким образом, атомы подобны строительным блокам всего и могут объединяться, чтобы создавать новые вещества. Водород (H) является одним из наиболее распространенных атомов.
В: Как выглядит атом?
Атом выглядит как очень маленькая солнечная система с тяжелым ядром в центре и электронами, вращающимися вокруг него. Однако электроны находятся в слоях и могут одновременно находиться везде, где позволяет квант.
Продолжайте читать
Базовая структура атома
Поиски теории всего
Темная материя: МАЧО или вимпы?
Как выглядит атом? | Физика Фургон
Категория
Выберите категориюО фургоне физикиЭлектричество и магнитыВсе остальноеСвет и звукДвижение вещейНовая и захватывающая физикаСостояния вещества и энергииКосмосПод водой и в воздухе
Подкатегория
Поиск
Задайте вопрос
Последний ответ: 22.10.2007
В:
Как выглядит атом для стандарта 8-го класса?
— Аноним
A:
Дорогой Винни:
У нас есть очень длинная ветка по теме:
http://van.physics.illinois.edu/qa/listing.php?id=1295.
Ссылка на изображение включена в http://van.physics.illinois.edu/qa/listing.php?id=1280.
Также см. http://van.physics.illinois.edu/qa/listing.php?id=1195.
Большая проблема с ответом на вопрос «как выглядит атом» заключается в том, что для того, чтобы посмотреть на что-то, мы обычно направляем на него свет и наблюдаем отраженный свет. Видимый свет имеет длину волны, которая намного больше, чем у атомов. Невозможно разглядеть мелкие детали предметов, зондируя их волнами большого размера — волны просто обтекают малый предмет. Можно использовать свет с более короткой длиной волны, но энергия на фотон увеличивается с уменьшением длины волны. Как оказалось, когда свет имеет длину волны, сравнимую с размером атома или меньшую, у него достаточно энергии, чтобы изменить атом, перемещая вокруг него электроны. Это одно из следствий принципа неопределенности Гейзенберга. Мы не можем одновременно сказать, где находятся электроны и с какой скоростью они движутся, а значит, мы не можем нарисовать картину с маленьким электроном на одном месте, сидящим на круговой орбите. Нечеткая картинка в нижней части страницы, на которую дается ссылка, ближе к истине, описывая вероятности обнаружения электронов в зависимости от того, где вы их ищете.
Видимый свет имеет длину волны, которая намного больше, чем у атомов. Невозможно разглядеть мелкие детали предметов, зондируя их волнами большого размера — волны просто обтекают малый предмет. Можно использовать свет с более короткой длиной волны, но энергия на фотон увеличивается с уменьшением длины волны. Как оказалось, когда свет имеет длину волны, сравнимую с размером атома или меньшую, у него достаточно энергии, чтобы изменить атом, перемещая вокруг него электроны. Это одно из следствий принципа неопределенности Гейзенберга. Мы не можем одновременно сказать, где находятся электроны и с какой скоростью они движутся, а значит, мы не можем нарисовать картину с маленьким электроном на одном месте, сидящим на круговой орбите. Нечеткая картинка в нижней части страницы, на которую дается ссылка, ближе к истине, описывая вероятности обнаружения электронов в зависимости от того, где вы их ищете.
Ядро, содержащее протоны и нейтроны, имеет аналогичную проблему, но оно намного меньше, чем электронное облако, и, следовательно, энергия фотона, необходимая для разрешения структуры, намного выше. Принцип неопределенности Гейзенберга применим и к нейтронам, и к протонам, так что нечеткое ядро тоже не такое уж плохое представление. Но для демонстрации в классе четкие изображения, показывающие детали, передают важные моменты, что атомы состоят из протонов, нейтронов и электронов, что протоны и нейтроны находятся в ядре, а электроны находятся на больших радиусах.
Принцип неопределенности Гейзенберга применим и к нейтронам, и к протонам, так что нечеткое ядро тоже не такое уж плохое представление. Но для демонстрации в классе четкие изображения, показывающие детали, передают важные моменты, что атомы состоят из протонов, нейтронов и электронов, что протоны и нейтроны находятся в ядре, а электроны находятся на больших радиусах.
Том
(опубликовано 22.10.2007)
Дополнение №1: Как выглядят атомы
В:
Какого цвета атомы?
Мой 6-летний хочет знать! И как они выглядят.
— Эллен Ветмор (40 лет)
Гротон, Массачусетс
A:
Приятно слышать, что у вас такой любопытный 6-летний ребенок! Когда он спрашивает о том, как они выглядят, в вопросе есть как минимум две стороны. Во-первых, какая у них форма, а во-вторых, их цвет.
Оказывается, видимый свет не годится для того, чтобы видеть форму атомов, потому что его длина волны намного больше, чем у атома. Чтобы форма была четко видна, объект должен быть больше, чем длина волны света. Длина волны видимого света составляет от 400 до 700 нанометров (нанометр равен одной миллиардной части метра или от 1/15 000 до 1/200 000 длины человеческого волоса), но самый большой атом имеет диаметр около 270 пикометров или более 1000 раз. меньше видимого света. Итак, хотя отдельные атомы могут отражать видимый свет, поскольку атомы намного меньше самого света, вы никогда не сможете увидеть ничего, кроме размытой точки.
Длина волны видимого света составляет от 400 до 700 нанометров (нанометр равен одной миллиардной части метра или от 1/15 000 до 1/200 000 длины человеческого волоса), но самый большой атом имеет диаметр около 270 пикометров или более 1000 раз. меньше видимого света. Итак, хотя отдельные атомы могут отражать видимый свет, поскольку атомы намного меньше самого света, вы никогда не сможете увидеть ничего, кроме размытой точки.
Чтобы четко визуализировать атомы, используется сканирующий туннельный микроскоп, который использует электроны вместо света, чтобы видеть очень маленькие объекты. Разрешение этих микроскопов достаточно хорошее, чтобы отдельные атомы можно было рассматривать как выпуклости. Одними из самых известных изображений отдельных атомов являются буквы «IBM». Помимо реальных изображений, вы можете взглянуть на некоторые более ранние ответы на вопрос о том, как выглядят атомы, и некоторые предоставленные ссылки. Ниже приведено изображение букв «IBM», написанных из атомов.
Что касается цвета, атомы могут иметь видимые цвета, хотя их трудно увидеть, если у вас их не много. Под цветом объекта люди иногда подразумевают цвет света, отражающегося от него, а иногда — цвет света, который он излучает.
Некоторые атомы имеют очень четкие видимые цвета излучения, например атомы натрия, излучающие желтый свет в некоторых уличных фонарях. Итак, когда вы видите желтое свечение уличного фонаря, это может быть цвет атомов натрия! Некоторые другие обычно не излучают видимый свет.
Все атомы рассеивают часть падающего на них света. Обычно они рассеивают больше синего света, чем красного. Молекулы (пары атомов) в воздухе делают это, поэтому небо голубое. Однако любой атом или молекула не сильно рассеиваются.
Так же, как атомы могут излучать свет, они также могут поглощать свет. Цвета, которые вы видите, когда свет проходит через набор атомов, которые могут поглощать, — это просто цвета, которые не поглощает этот конкретный тип атома.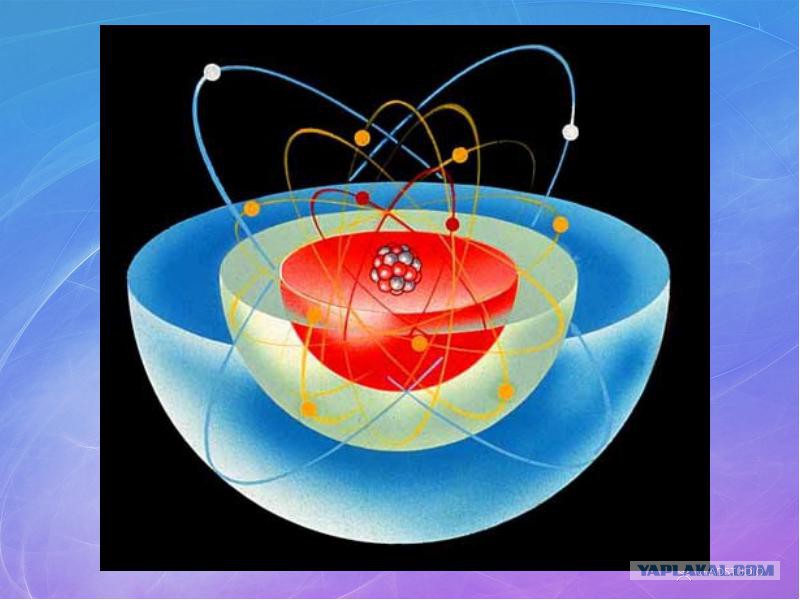

 Нумерация слоев начинается с ближайшего к ядру электронного слоя.
Нумерация слоев начинается с ближайшего к ядру электронного слоя.