Содержание
Создатель «мирного» атома. Курчатов изобрёл бомбу, чтобы избежать войны | Наука | Общество
Дмитрий Писаренко
Примерное время чтения: 7 минут
19110
Еженедельник «Аргументы и Факты» № 1. Мировая экономика: каждый плывёт своим курсом 09/01/2013
Игорь Васильевич Курчатов. / Didenko / Commons.wikimedia.org
Без сомнения, Курчатов был одним из тех людей, кто оказал влияние на ход ХХ в. и его историю.
Ядерная «дробилка»
В XVIII в. некий промышленник Твердышев набирал на свой горный завод рабочую силу. Заехал в Болышево, что в Смоленской губернии, в гости к знакомому помещику. Да обыграл того в карты в пух и прах. Расплатился помещик двумя семьями крепостных — Курчатовыми. Так предки будущего академика оказались на Южном Урале. Дед его, Алексей Константинович, был неграмотен, но арифметикой интересовался. Научился считать и дослужился до казначея завода. Дал образование детям. Так что любовь к науке у молодого Курчатова была в генах.
Научился считать и дослужился до казначея завода. Дал образование детям. Так что любовь к науке у молодого Курчатова была в генах.
Родился он на Урале, но семья вскоре перебралась на юг, в Симферополь. Там Игорь окончил гимназию и вечернюю ремесленную школу по специальности слесаря. Поступил на физмат Таврического университета. За три года завершил 4-летний курс учёбы и блестяще защитился. Но этого Курчатову показалось мало, и он подался в Петроград — сразу на 3-й курс Политеха. А в 1925 г. был принят ассистентом в Физико-технический институт, в лабораторию знаменитого Иоффе, чьё имя сейчас носит легендарный НИИ.
Игорь Курчатов — сотрудник Радиевого института. Ленинград. 1930-е. Фото: Commons.wikimedia.org
Иногда спрашивают: почему именно Курчатова назначили руководить атомным проектом СССР? Ведь он был так молод — на момент начала этих грандиозных научных работ ему не исполнилось и 40! Абрам Фёдорович Иоффе легко бы ответил на этот вопрос. В Физтехе работало много энергичной молодёжи, но Курчатова он называл «первым среди равных». И оставлял вместо себя, когда уезжал в командировки. Говорят, что Сталин предложил Иоффе самому возглавить атомный проект. Но тот ответил: «Я уже стар. А здесь должен быть молодой и такой, который превзошёл бы меня. Это мой ученик Игорь Васильевич Курчатов». К тому моменту Курчатов уже вёл исследования на запущенном в 1937 г. циклотроне — ядерной «дробилке», как его называли. Это был первый в Европе циклический ускоритель тяжёлых заряженных частиц, и, конечно, никто тогда не предполагал, какими важными вскоре станут эти работы для обороны страны. Ведь в Большой советской энциклопедии тех лет было сказано: «Уран практического значения не имеет».
И оставлял вместо себя, когда уезжал в командировки. Говорят, что Сталин предложил Иоффе самому возглавить атомный проект. Но тот ответил: «Я уже стар. А здесь должен быть молодой и такой, который превзошёл бы меня. Это мой ученик Игорь Васильевич Курчатов». К тому моменту Курчатов уже вёл исследования на запущенном в 1937 г. циклотроне — ядерной «дробилке», как его называли. Это был первый в Европе циклический ускоритель тяжёлых заряженных частиц, и, конечно, никто тогда не предполагал, какими важными вскоре станут эти работы для обороны страны. Ведь в Большой советской энциклопедии тех лет было сказано: «Уран практического значения не имеет».
«Когда он только пришёл в Физтех, то занимался проблемой физики твёрдого тела. Это было нужно для плана ГОЭЛРО, требовались новые материалы, — рассказывает Раиса Кузнецова, директор мемориального Дома-музея И. В. Курчатова. — Игорь Васильевич изучал свойства диэлектриков и открыл новый класс явлений, который назвал сегнетоэлектричеством. На этом мог бы и успокоиться, но надо было знать его характер! Когда он познакомился с экспериментальными работами в области ядерной физики, то понял — будущее здесь. Он ведь с юности мечтал узнать, откуда берётся энергия звёзд».
На этом мог бы и успокоиться, но надо было знать его характер! Когда он познакомился с экспериментальными работами в области ядерной физики, то понял — будущее здесь. Он ведь с юности мечтал узнать, откуда берётся энергия звёзд».
Ещё один штрих. В первый же день войны (о создании ядерного оружия тогда даже не задумывались) Курчатов пришёл к Иоффе: «Ухожу в ополчение». У того волосы встали дыбом: «Как вы можете пойти? Вас там убьют!» Курчатов настоял на своём, и его направили заниматься системами размагничивания боевых кораблей. Созданная им и А. П. Александровым за пару месяцев установка помогала защищать советский военно-морской флот от немецких мин.
Разложение атома
С сентября 1941 г. разведка доносила: в Великобритании и США идут интенсивные работы по использованию атомной энергии для военных целей. Появление бомбы огромной разрушительной силы, безусловно, повлияло бы на ход и итоги войны. Через год в СССР возобновляются работы по расщеплению ядра урана, а весной 1943 г. Сталин подписывает распоряжение о создании специальной Лаборатории № 2 АН СССР. Задача — яснее не скажешь: разработка советской атомной бомбы. Учёные взялись за её решение воистину ударными темпами.
Сталин подписывает распоряжение о создании специальной Лаборатории № 2 АН СССР. Задача — яснее не скажешь: разработка советской атомной бомбы. Учёные взялись за её решение воистину ударными темпами.
Все материалы, добытые разведчиками в Англии и США, ложатся на стол к Бороде. Так Курчатова называли давно — бороду он начал носить ещё в молодости. Документов было много. А ему нужно было не только разобраться в их содержании, но и понять, нет ли там дезинформации, не хотят ли «друзья» направить советских физиков по ложному следу.
Тут уместно вспомнить об одном казусе, упоминаемом Владимиром Губаревым, журналистом и писателем: «Как-то в секретариат тов. Сталина обратился американец. Он предложил метод получения энергии из воздуха. Письмо дошло до самого вождя, который распорядился внимательно изучить его. Академикам пришлось подготовить подробное заключение и представить его в ЦК. Там, в частности, говорилось: «Предложение Генри Морея о методе получения энергии из воздуха для промышленных целей несерьёзно, так как проблемой разложения атома занимаются у нас в Союзе академик Иоффе и несколько институтов, а также виднейшие физики мира». О письме и предложении американца «разлагать атом» стало широко известно в академии. С тех пор И. В. Курчатов и его ближайшие сотрудники частенько шутили, что их основное занятие — разложение атома и они от этого получают большое удовольствие». Любой физик сразу поймёт эту шутку. Ядерщики занимаются не разложением атома, а расщеплением его ядра. А точнее — делением.
О письме и предложении американца «разлагать атом» стало широко известно в академии. С тех пор И. В. Курчатов и его ближайшие сотрудники частенько шутили, что их основное занятие — разложение атома и они от этого получают большое удовольствие». Любой физик сразу поймёт эту шутку. Ядерщики занимаются не разложением атома, а расщеплением его ядра. А точнее — делением.
А. Сахаров и И. Курчатов. Фото: Commons.wikimedia.org
В 1946 г. в Лаборатории № 2 пущен первый советский атомный реактор, а в 1949 г. на полигоне в Семипалатинске испытана атомная бомба. По многим достижениям «Курчатов и его команда» превзошли американцев: первыми испытали термоядерную (водородную) бомбу, построили промышленную атомную электростанцию, реактор для подводных лодок и ледоколов. Кстати, испытание водородной бомбы ввергло Курчатова в депрессию. Об этом писал уже упомянутый академик А. П. Александров: «Он был подавлен. Не говорил никаких технических подробностей, но сказал так: я теперь вижу, какую страшную вещь мы сделали. Единственное, что нас должно заботить, чтобы это дело запретить и исключить ядерную войну… Курчатов понимал, что мир находится на грани катастрофы».
Единственное, что нас должно заботить, чтобы это дело запретить и исключить ядерную войну… Курчатов понимал, что мир находится на грани катастрофы».
Именно тогда он стал пропагандировать использование «мирного» атома — на транспорте, в энергетике, авиации. Выступил инициатором создания Объединённого института ядерных исследований в Дубне. Ещё более 60 лет назад Курчатов ломал голову над проблемой управляемого термоядерного синтеза. Ведь если её решить и запустить реактор (а сейчас только начинается строительство международного реактора ИТЭР), люди получат неисчерпаемый источник энергии. По сути, ту самую энергию звёзд.
Дом-музей Игоря Курчатова: памятник истории с личными вещами академика | Фотогалерея
В этом домике жил и работал академик Игорь Васильевич Курчатов.
© АиФ / фото Евгения Талыпова
Общий вид рабочего кабинета Курчатова.
© АиФ / фото Евгения Талыпова
На рабочем столе академика всегда было множество документов.
© АиФ / фото Евгения Талыпова
Такая литература вполне могла лежать на столе Курчатова.
© АиФ / фото Евгения Талыпова
Телефон без диска — это была пряма связь с Берия и Сталиным.
© АиФ / фото Евгения Талыпова
Стол причудливой формы обеспечивал секретность — ученые седели лицом к научном руководителю и не видели документы друг друга.
© АиФ / фото Евгения Талыпова
Столовая-гостиная.
© АиФ / фото Евгения Талыпова
Печка на кухне.
© АиФ / фото Евгения Талыпова
Радио в гостиной.
© АиФ / фото Евгения Талыпова
Спальня.
© АиФ / фото Евгения Талыпова
Дом-музей Игоря Курчатова: памятник истории с личными вещами академика | Фотогалерея
В этом домике жил и работал академик Игорь Васильевич Курчатов.
© АиФ / фото Евгения Талыпова
Общий вид рабочего кабинета Курчатова.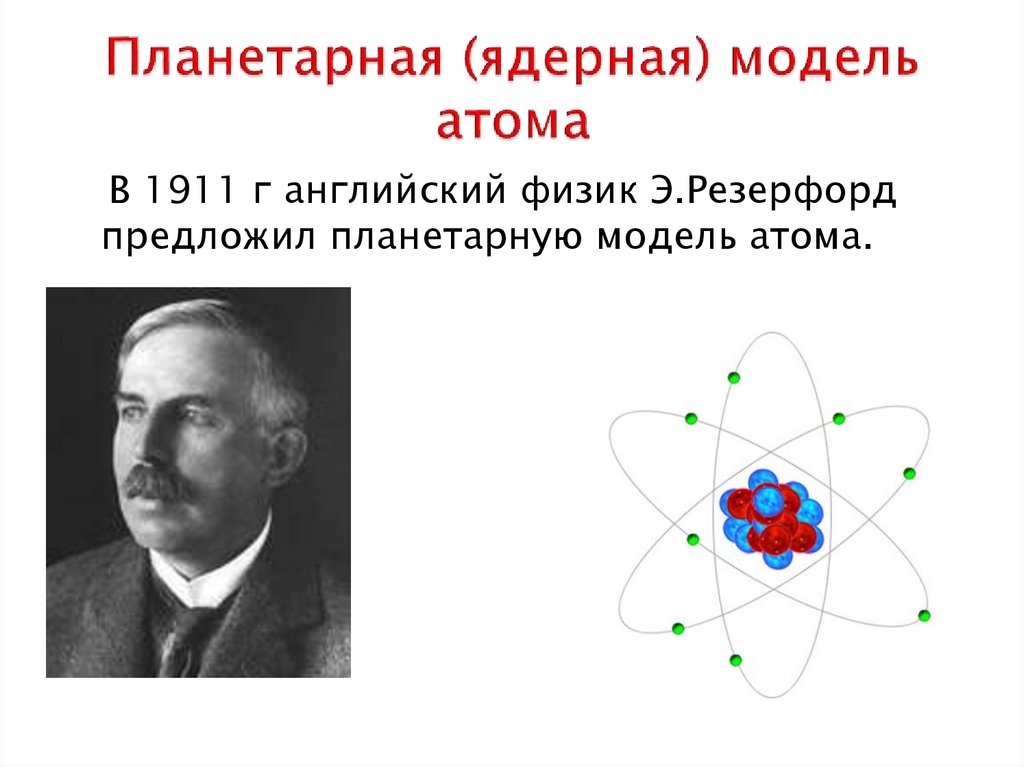
© АиФ / фото Евгения Талыпова
На рабочем столе академика всегда было множество документов.
© АиФ / фото Евгения Талыпова
Такая литература вполне могла лежать на столе Курчатова.
© АиФ / фото Евгения Талыпова
Телефон без диска — это была пряма связь с Берия и Сталиным.
© АиФ / фото Евгения Талыпова
Стол причудливой формы обеспечивал секретность — ученые седели лицом к научном руководителю и не видели документы друг друга.
© АиФ / фото Евгения Талыпова
Столовая-гостиная.
© АиФ / фото Евгения Талыпова
Печка на кухне.
© АиФ / фото Евгения Талыпова
Радио в гостиной.
© АиФ / фото Евгения Талыпова
Спальня.
© АиФ / фото Евгения Талыпова
атомная бомбаИгорь Курчатоввеликие ученые
Следующий материал
Также вам может быть интересно
Ярче тысячи солнц.
 65 лет назад наша страна создала ядерное оружие
65 лет назад наша страна создала ядерное оружиеМир в подарок. Как атомная бомба спасла миллионы жизней
Атомный блеф Сталина. Харьковскую бомбу сделали немцы, а Штаты взорвали ее в Японии
Легенды и мифы вокруг советской атомной бомбы
Новости СМИ2
28 февраля 1913 г.
 Нильс Бор представил новую модель атома
Нильс Бор представил новую модель атома
8044
Добавить в закладки
Фото: https://www.studenterforeningen.dk
Модель атома Бора пришла на смену планетарной модели атома
Эрнеста Резерфорда.
108 лет назад датский физик-теоретик Нильс
Бор предложил свою теорию строения атома, где
электроны не подчиняются законам классической физики. В
боровской модели атома электроны могут находиться только на
разрешенных орбитах и способны мгновенно перескакивать между
орбитами при поглощении и испускании фотонов (совершать
квантовые скачки).
Ранее, летом 1912 года, ученый прислал своему
наставнику Эрнесту Резерфорду черновик статьи,
посвященной проблеме устойчивости атома. По сути, Нильс Бор
впервые смог объяснить, почему электроны не падают на ядро атома:
когда электроны движутся с ускорением по
строго стационарным орбитам, они не
излучают электромагнитных волн, а значит, не теряют
энергию и не сходят с орбиты. Чтобы найти радиусы
Чтобы найти радиусы
устойчивых орбит, пришлось обращаться к новой на тот момент,
квантовой теории Макса Планка.
Справка.
Состояние атома, в котором все электроны находятся на
стационарных орбитах с наименьшей возможной энергией,
называется основным, а все другие состояния —
возбужденными. Стационарным состояниям соответствуют определенные
стационарные орбиты, по которым движутся электроны.
Бором были сформулированы квантовые постулаты, которые резко
расходились с классической механикой и классической
электродинамикой, однако успешно позволяли описать простейший
атом водорода. Нильс Бор впервые показал, что электрон
делает квантовые скачки по орбитам в атоме, и это изменило наше
понимание микромира.
Кроме того, Бор ввел понятие об атомном номере, понял, что такое
изотопы, высказал и осмыслил закон радиоактивного смещения. Он
также внес огромный вклад в понимание некоторых процессов,
происходящих внутри тяжелых атомных ядер, что имело решающее
значение для начала исследований, приведших к освобождению
ядерной энергии.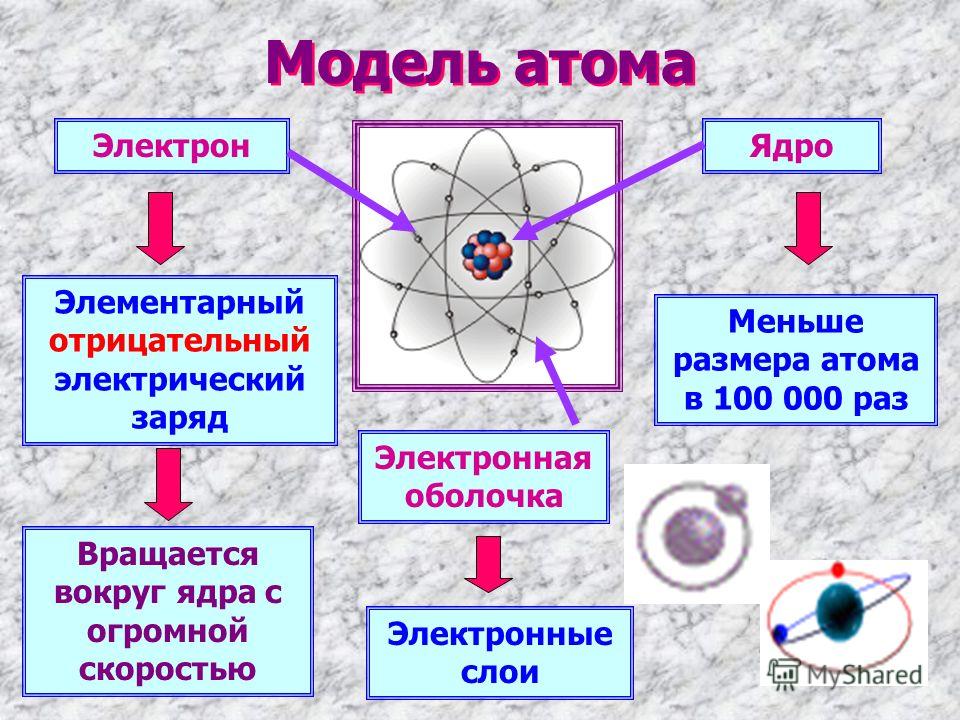 (© «Нильс Бор. Жизнь и творчество», изд-во
(© «Нильс Бор. Жизнь и творчество», изд-во
«Наука», 1967 г.).
Фото: из презентации физика-теоретика Д.И. Казакова.
Согласно теории Бора, электрон вращается вокруг атома по строго стационарным орбитам. Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона.
«Исходным пунктом атомной теории Бора является признание того
факта, что модель атома Резерфорда вместе с классической физикой
не могут объяснить той устойчивости, которой, как мы знаем из
нашего повседневного опыта, обладают атомы. <…> Исходя из
нового положения Бора о существовании атома только в
стационарных состояниях, теперь можно было описать эти
состояния без какой-либо ссылки на такие классические
представления, как электронные орбиты», — писали о вкладе
Бора в развитие физики Х. Меллер и М. Пиль.
Теория датского физика объяснила не только стабильность атомов,
но и линейчатый характер спектров — еще
один важнейший вопрос физики того времени.
Орбитальная модель атома Бора, позже
усовершенствованная Арнольдом Зоммерфельдом, стала
итогом старой квантовой теории.
Рождение новой квантовой теории состоялось в
1925-1926 годах и связано оно было с учеником Нильса Бора —
Вернером Гейзенбергом (и его матричной механикой), а также с
Эрвином Шредингером и Полем Дираком.
«Решающим моментом в атомной модели Резерфорда было то, что она
со всей ясностью показала, что устойчивость атомов нельзя
объяснить на основе классической физики и что квантовый
постулат — единственно возможный выход из острой дилеммы, и
эта острота несоответствия заставила меня абсолютно поверить в
правильность квантового постулата», — говорил сам Нильс
Бор.
В июле 1913 года в одном из старейших научных журналов
Великобритании — Philosophical Magazine — вышла
знаменитая статья Бора,
посвященная строению атомов и молекул. Эта публикация имела
фундаментальное значение для развития теоретической физики.
Автор Янина Хужина
атом
квантование
квантовая модель атома
нильс бор
орбитальная модель атома
орбиты электрона
планетарная модель атома
строение атома
электроны
эрнест резерфорд
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Астрономы нашли самые далекие звезды в нашей галактике
19:20 / Астрономия
Ученые Пермского Политеха разработали экологичный клей для изготовления фанеры
17:30 / Новые технологии
Две сотни научных организаций получат гранты на обновление приборной базы в 2023 году
17:15 / Наука и общество
ЮФУ совместно с ГАО РАН изучают локальную окрестность Солнца
16:30 / Астрономия, Астрофизика
«Интерфакс»: Таит ли «король вирусов» новую угрозу?
15:30 / Здравоохранение
В России еще остались села, зараженные после Чернобыльской аварии, их будут реабилитировать
14:30 / Экология
Биологи выяснили молекулярный механизм возникновения вторичных лейкозов
13:30 / Биология, Медицина
Ученые предложили новый подход к адресному лечению бактериальных инфекций
12:30 / Медицина, Химия
Ученые ТПУ разработали стабильные катализаторы для утилизации и переработки углекислого газа
11:30 / Инженерия, Химия
63 года назад в СССР был создан центр подготовки космонавтов
10:00 / Космонавтика, Наука и общество
Памяти великого ученого. Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
История новогодних праздников
01.08.2014
Смотреть все
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д. Филлипс
- Похожие темы:
- субатомная частица
радиоактивность
изотоп
атомизм
периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метра.
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов. Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье
Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомные частицы.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе.
Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Страница не найдена | OSTI.GOV
Если вы видите эту страницу, это значит, что запрошенный вами URL не может быть найден. Возможно, он не существует или вы неправильно набрали его в своем браузере. Но, если вы считаете, что это наша ошибка, сообщите нам об этом. В противном случае у вас есть несколько вариантов: попробуйте использовать нашу панель навигации в верхней части этой страницы, посетите нашу домашнюю страницу или просмотрите наши продукты ниже.
В противном случае у вас есть несколько вариантов: попробуйте использовать нашу панель навигации в верхней части этой страницы, посетите нашу домашнюю страницу или просмотрите наши продукты ниже.
Посетите любой из продуктов ниже, чтобы найти результаты исследований и разработок Министерства энергетики и многое другое.
Основной инструмент поиска
Рис. 271948: ОСТИ.ГОВ 250
OSTI.GOV является основным инструментом поиска данных Министерства энергетики США по науке, технологиям и инженерным исследованиям. OSTI.GOV содержит более чем 70-летнюю научную и техническую информацию от DOE и учреждений-предшественников DOE и использует инновационный инструмент семантического поиска, позволяющий ученым, исследователям и общественности получать более актуальную информацию. Всего в OSTI.GOV около 3 миллионов записей.
Информация о научных, технических и инженерных исследованиях, финансируемая Министерством энергетики
Специализированные инструменты поиска для конкретных ресурсов
Публичный портал Министерства энергетики США по энергетике и науке (DOE PAGES ® ) — это инструмент поиска научных публикаций, включая рецензируемые журнальные статьи и принятые рукописи, полученные в результате исследований, финансируемых Министерством энергетики.
Научные публикации, полученные в результате исследований, финансируемых Министерством энергетики
DOE Data Explorer — это инструмент поиска наборов данных, коллекций данных и проектов данных, финансируемых DOE.
Данные научных исследований, полученные в результате исследований, финансируемых Министерством энергетики
DOE CODE — это новая платформа программных услуг Министерства энергетики США и средство поиска, заменяющее ESTSC. DOE CODE позволяет пользователям отправлять код, предлагает услуги репозитория и обнаружение программного обеспечения, финансируемого DOE.
Открытый исходный код, инструмент отправки и поиска для программного обеспечения, финансируемого Министерством энергетики
DOE Patents — это всеобъемлющий инструмент поиска патентной информации, полученной в результате исследований и разработок (НИОКР), финансируемых Министерством энергетики. Сюда включены патенты, которые Министерство энергетики спонсировало с помощью различных механизмов финансирования, включая гранты, контракты или соглашения о сотрудничестве.
Сюда включены патенты, которые Министерство энергетики спонсировало с помощью различных механизмов финансирования, включая гранты, контракты или соглашения о сотрудничестве.
Патенты, полученные в результате исследований, финансируемых Министерством энергетики
DOE ScienceCinema — это инструмент поиска мультимедийных научных видеороликов и аудиофайлов из национальных лабораторий Министерства энергетики, других исследовательских центров Министерства энергетики и ЦЕРН (Европейской организации ядерных исследований), использующий технологию поиска с распознаванием речи.
Научные видеоролики, посвященные исследованиям, финансируемым Министерством энергетики США
Федеральное агентство США и международные средства поиска научной и технической информации
Рисунок 276758: SciGov250-min.png
Science.

 65 лет назад наша страна создала ядерное оружие
65 лет назад наша страна создала ядерное оружие