Содержание
«Разберем на атомы. Фотография»: студенты и сотрудники университета отметили Всемирный день фотографии
18 августа на базе университета прошло научно-популярное ток-шоу «РАЗБЕРЕМ НА АТОМЫ. ФОТОГРАФИЯ», приуроченное ко Всемирному дню фотографии и организованное Информационным центром по атомной энергии (ИЦАЭ) Минска.
Студенты и сотрудники БГУФК окунулись в мир фотографии и узнали ответы на такие вопросы, как “Кто изобрел первую фотографию? В чем разница между рентгенографией грудной клетки и флюорографией? Является ли фотография искусством?”.
Особенностью мероприятия стала мини-экспозиция, которая дала участникам возможность “вживую” рассмотреть различные модели фотоаппаратов, познакомиться с технологией трехмерных фотографий с помощью анаглифных 3D стерео-очков, сделать панорамную фотографию и просмотреть ее в VR-очках.
Приглашенные спикеры научного ток-шоу подготовили для аудитории краткие, но занимательные и насыщенные информацией выступления. А самым активным участникам были вручены памятные подарки.
А самым активным участникам были вручены памятные подарки.
Евгения Голикова-Пошка, кандидат искусствоведения, доцент, старший научный сотрудник отдела экранных искусств Центра исследований белорусской культуры, языка и литературы Национальной академии наук Беларуси рассказала интересные факты об истории развития фотографии. Еще задолго до изобретения самой фотографии, стали известны принципы, которые легли в ее основу.
«Французский изобретатель Жозеф Ньепс покрыл оловянную пластину особым раствором сирийского асфальта, и в 1826 году с помощью камеры-обскуры появилась первая в мире фотография – «Вид из окна в Ле Гра». На протяжении восьми часов шла фиксация вида из окна – отметила спикер. – Такая гелиогравюра представляла собой только начальный этап в изобретении фотографии». Также участники узнали об отличиях пленочной фотографии и цифровой.
Борис Никитин, врач-рентгенолог высшей категории медицинского центра «ИдеалМед», рассказал об открытии рентгена, применении рентгенографии в медицине и развитии рентгенодиагностики в Беларуси.
«Изобретенный более ста лет назад уникальный метод исследования внутренних органов – рентгенография – сегодня применяется для диагностики в различных направлениях медицины. С помощью рентгенографии могут быть изучены практически все области тела человека» – подчеркнул эксперт. Также Борис Николаевич отметил, что по показаниям, информативности и технике проведения флюорография и рентген вовсе не одинаковые процедуры.
О работах фотографов, которые сочетают искусство и науку сквозь призму снимков рентгена поведдала Светлана Смульская, кандидат искусствоведения, доцент кафедры теории и истории искусства Белорусского государственного университета культуры и искусств. «X-Ray Photo» или «рентгеновская» фотография является особой практикой в визуальном искусстве.
«Одним из первых, кто решился показать, что цветы прекрасны не только снаружи, но и внутри, был Steven N. Meyers. Свою первую коллекцию из 100 снимков он собирал около 14 лет. Все фотографии сделаны исключительно при помощи медицинских рентгеновских аппаратов» — отметила Светлана.
Всемирный день фотографии ежегодно отмечают 19 августа.
Дата праздника была выбрана в связи с тем, что в этот день в 1839 году широкой общественности был представлен метод получения отпечатка фото – дагерротипа, прототипа фотографии, изобретение которого принадлежит Луи Жаку Манде Дагеру.
Урок 3. Атом: характеристики, важные для биологии
Содержание
С древних времён люди задавались вопросом: «Из чего состоит жизнь?». Философы Древней Греции и Индии предполагали, что мельчайшей частицей всякого вещества в мире, является атом, который, по их мнению, неделим. Истинная природа атома приоткрылась намного позже.
Чтобы понять, как организованы живые системы, мы должны узнать о природе атома, его устройстве, о том, как атомы собираются в молекулы и о способах, которыми эти молекулы соединяются в вещества. Только после этого можно будет говорить о структуре клеток, а затем и организмов. Поэтому знакомство с жизнью на Земле мы начинаем с вопросов биофизики и биохимии.
Во Вселенной любая субстанция, имеющая массу и занимающая место в пространстве, определяется как материя, существующая в форме вещества (физические тела) или в форме поля (свет, гравитация и т.д.). Вещество состоит из очень мелких частиц, называемых атомами. Атом – мельчайшая единица, на уровне которой совершаются основные химические реакции. Из-за их размеров атомы долгое время не могли изучать. Только в начале XVII века учёные смогли осуществить первые эксперименты, раскрывающие физическую природу атомов.
Строение поваренной соли
Автор: OpenStax College, CC BY 3.0
Как устроен атом?
Объекты размером с атом можно «увидеть» только косвенно, используя сложную технологию, такую как туннельная микроскопия. Наглядно показав наличие электронов, Джозеф Джон Томсон впервые доказал, что атом состоит из субатомных частиц. В беседе он назвал модель атома «пудингом с изюмом», где роль изюминок выполняют электроны.
Схема работы сканирующего туннельного микроскопа: control voltages of piezotube; piezoelectric tube with electrodes — трубка с электродами; tunneling current amplifier — амперметр для измерения величины туннельного тока; distance control and scanning unit — модуль для перемещения иглы и контроля расстояния игла-образец; tip — игла; sample — образец, карту рельефа которого требуется построить; tunneling voltage; data processing and display — модуль для обработки результатов измерений и вывода карты рельефа
Автор: Michael Schmid, CC BY-SA 2.:quality(90)/images.vogel.de/vogelonline/bdb/1191300/1191316/original.jpg) 0 at
0 at
Но эта точка зрения была опровергнута. Гипотеза, выдвинутая в 1913 году датским физиком Нильсом Бором, обеспечила хорошую отправную точку для понимания современной атомной теории.
Опираясь на модель Эрнеста Резерфорда, Бор предположил, что каждый атом обладает орбитальным облаком крошечных субатомных частиц, называемых электронами, вращающимися вокруг центра, как в миниатюрной Солнечной системе, и что они излучают и поглощают энергию, переходя с одного облака орбиты на другое.
Электронная конфигурация атома углерода
Автор: Alejandro Porto, CC BY-SA 3.0
В центре каждого атома – маленькое очень плотное ядро, сформированное из двух других видов субатомных частиц: протонов и нейтронов. Современные исследования доказали, что и протоны и нейтроны также не являются неделимыми. Они состоят из кварков.
Обзор физики элементарных частиц
Автор: Headbomb, Creative Commons Attribution-Share Alike 3.0 Unported
Атом и его заряд
Атомы различаются числом протонов в ядре, количество которых определяет атомный заряд, химические свойства и место элемента в периодической таблице Д. И. Менделеева. Внутри ядра скопление протонов и нейтронов удерживается силой, которая работает только на коротких субатомных расстояниях.
И. Менделеева. Внутри ядра скопление протонов и нейтронов удерживается силой, которая работает только на коротких субатомных расстояниях.
Каждый протон несёт положительный (+) заряд, а электрон – отрицательный (-), нейтрон же потому так и называется, что он нейтрален. Если количество электронов в атоме совпадает с количеством протонов, то атом в целом является электрически нейтральным. Химическое поведение атома обусловлено количеством и конфигурацией его электронов.
Атомная масса
Термины «масса» и «вес» часто используются как синонимы, но они имеют несколько разное значение. Масса относится к количеству вещества, а вес описывает силу тяжести, влияющую на субпозицию вещества. Объекты, имеющие одинаковую массу, находясь на Земле будут весить больше, чем если бы они были расположены на Луне, потому что гравитационная сила Земли больше, чем у Луны. Атомная масса равна сумме масс его протонов и нейтронов. Атомы, встречающиеся в природе Земли, содержат от 1до 92 протонов и до 46 нейтронов.
Масса атомов и субатомных частиц измеряется в единицах, называемых дальтонами (Да), или атомных единицах массы (а.е.м.), в химии – «моль». Они очень малы, 1 грамм содержит 602 миллиона миллионов миллиардов а.е.м. (6.02 × 10 23). Протон весит 1,007 Да, нейтрон – 1,009 Да. Электроны весят 1/1840 Да, поэтому они почти не влияют на массу атома.
Сравнительный размер атома гелия и его ядра
Автор: User:Murkt, CC BY-SA 3.0
Электроны
Положительные заряды ядра атома нейтрализуются или уравновешиваются отрицательно заряженными электронами, расположенными в облаках (орбиталях), лежащих на разном расстоянии вокруг ядра. Атомы с одинаковым числом протонов и электронов электрически нейтральны, то есть у них нет чистого заряда. Порядковый номер химического элемента в таблице Менделеева говорит о количестве электронов у его атома.
Электроны удерживаются на своих орбиталях притяжением положительно заряженного ядра. Иногда другие силы преодолевают это притяжение, и атом теряет один или несколько электронов. В других случаях атомы получают дополнительные электроны. Атомы, в которых число протонов не равно числу электронов, называются ионами – это заряженные частицы.
В других случаях атомы получают дополнительные электроны. Атомы, в которых число протонов не равно числу электронов, называются ионами – это заряженные частицы.
Атом, имеющий больше протонов, чем электронов, имеет положительный заряд и называется катионом. Для примера – атом натрия (Na), который потерял один электрон, становится ионом натрия (Na+) с зарядом +1. Атом, имеющий меньше протонов, чем электронов, несёт суммарный отрицательный заряд и называется анионом. Атом хлора (Cl), получивший один электрон, становится хлорид-ионом (Cl-) с зарядом -1.
Природа атома – изотопы
Хотя все атомы одного элемента имеют одинаковое количество протонов, они не могут иметь одинаковое количество нейтронов. Атомы одного элемента, которые обладают разным числом нейтронов, называют изотопами этого элемента.
Большинство элементов в природе существует в виде смеси различных изотопов. Например, углерод (C) имеет 3 изотопа, каждый из которых содержит 6 протонов. Более 99% углерода в природе существует как изотоп, содержащий 6 нейтронов. Общая масса этого изотопа составляет 12 Да (6 от протонов и 6 от нейтронов). Он называется углеродом-12 и обозначается 12 C.
Например, углерод (C) имеет 3 изотопа, каждый из которых содержит 6 протонов. Более 99% углерода в природе существует как изотоп, содержащий 6 нейтронов. Общая масса этого изотопа составляет 12 Да (6 от протонов и 6 от нейтронов). Он называется углеродом-12 и обозначается 12 C.
Большая часть из оставшихся изотопов углерода естественного происхождения составляет углерод-13 – изотоп с 7 нейтронами. Редчайший изотоп углерода – углерод-14, с 8 нейтронами. В отличие от двух других изотопов углерод-14 нестабилен – это означает, что его ядро имеет тенденцию к распаду на элементы с более низкими атомными номерами.
Ядерный распад излучает значительное количество энергии и называется радиоактивным распадом, а изотопы, которые распадаются, называются радиоактивными изотопами. Некоторые радиоактивные изотопы более нестабильны, чем другие, они разлагаются легче. Однако любой изотоп распадается с постоянной скоростью. Обычно время распада выражается как период полураспада – время, необходимое для распада половины атомов в образце.
Углерод-14 часто используется для датировки ископаемых и других материалов, он имеет период полураспада в 5730 лет. Образец, содержащий 1 грамм углерода-14 сегодня, будет содержать 0,5 г углерода-14 через 5730 лет, 0,25 г через 11 460 лет, 0,125 г через 17 190 лет м и т. д.
1: образование углерода-14 2: распад углерода-14 3: «равное» уравнение для живых организмов, а неравное-для мертвых организмов, в которых с-14 затем распадается
Автор: NikNaks, условия просмотра CC BY-SA 3.0
Соотнося различные изотопы углерода и другие элементы в биологических образцах и горных породах, учёные имеют возможность точно определять, когда эти материалы появились.
В современной биологии радиоактивность имеет широкое применение. Радиоактивные изотопы являются одним из способов метки или маркировки конкретной молекулы, чтобы исследовать её изменения, химические реакции в живых клетках и тканях. Недостаток этого метода в том, что энергетические субатомные частицы, испускаемые радиоактивными веществами, могут серьёзно повредить живой клетке, например, стать причиной её мутации, а в больших дозах и гибели. Поэтому доза безопасной радиации обязательно контролируется и регулируется.
Поэтому доза безопасной радиации обязательно контролируется и регулируется.
Электроны определяют химическое поведение атомов
Ключ к химическому поведению атома лежит в числе и расположении на орбиталях его электронов. В модели Бора-Резерфорда показано, что отдельные электроны вращаются вокруг центрального ядра, но она не отражает реальности. Современная физика доказывает, что мы не можем точно определить положение любого отдельного электрона в заданное время.
Форма и расположение в пространстве s-, p-, d- и f-орбиталей.
Автор: haade, CC BY-SA 3.0
На самом деле электрон может быть где угодно, как рядом с ядром, так и далеко от него. Но конкретный электрон вероятнее всего можно найти в определённой зоне атома. Орбиталь – это та область, где скорее всего содержится данный электрон. Некоторые электронные орбитали вблизи ядра сферические (S-орбитали), другие – в виде гантели (p-орбитали). Орбитали, более удалённые от ядра, могут иметь различную форму.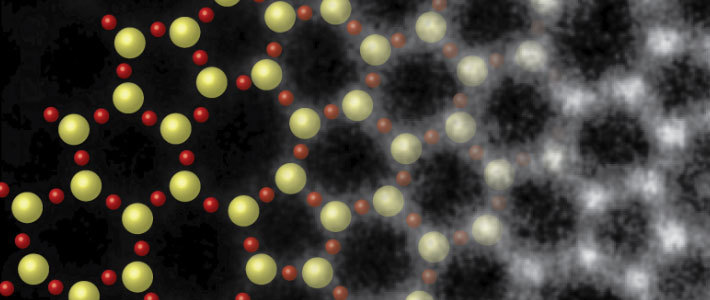 Независимо от расположения, орбиталь не может содержать более 2 электронов.
Независимо от расположения, орбиталь не может содержать более 2 электронов.
Большая часть атома – пустое пространство. Если представить, что ядро размером с мяч для гольфа, то первый ближайший к нему электрон расположится не ближе чем 1,6 км. По этой причине ядра двух атомов никогда не подходят близко друг к другу. И электроны атома, а не его протоны и нейтроны определяют его химические свойства. Это объясняет, почему все изотопы элемента, имеющие одинаковое расположение электронов, химически ведут себя идентично.
Атом содержит дискретные энергетические уровни
Поскольку электроны притягиваются к положительно заряженному ядру, оно должно постоянно удерживать их на своих орбиталях, как нам нужно постоянно держать яблоко в кулаке, чтобы преодолевать силу притяжения Земли. Ядро атома содержит огромный потенциал, при его расщеплении высвобождается гигантское количество энергии, которую человек использует для работы атомных реакторов и атомного оружия.
Если мы отпустим яблоко, оно упадёт, так как уменьшится потенциал его энергии. Но если бы мы внесли яблоко на вершину здания, то увеличили бы потенциал энергии. Электроны тоже имеют потенциал собственной энергии, связанной с их положением. Противостоять притяжению ядра и переместить электрон на более отдалённую орбиту можно, только получив энергию от внешнего источника. В молекулах хлорофилла этим источником является энергия Солнца, она возбуждает электроны, и они отрываются от атома. Чем ближе электрон расположен к ядру, тем большая энергия ему понадобится для преодоления его силы тяжести.
Но если бы мы внесли яблоко на вершину здания, то увеличили бы потенциал энергии. Электроны тоже имеют потенциал собственной энергии, связанной с их положением. Противостоять притяжению ядра и переместить электрон на более отдалённую орбиту можно, только получив энергию от внешнего источника. В молекулах хлорофилла этим источником является энергия Солнца, она возбуждает электроны, и они отрываются от атома. Чем ближе электрон расположен к ядру, тем большая энергия ему понадобится для преодоления его силы тяжести.
Перемещение электрона в обратном направлении – ближе к ядру – имеет обратный эффект: энергия не поглощается, а выделяется в виде лучистой энергии (тепла и света), и электрону остаётся меньше потенциальной энергии.
Испускание света
Автор: Volobuev Ilya, CC BY-SA 4.0
Таким образом, электроны в атоме имеют дискретные энергетические уровни. Эти уровни называют квантами (сингулярные, квантовые), означающими наличие определённого количества энергии. Если использовать аналогию с яблоком снова, то представьте, что оно может быть поднято только до определённого уровня этажей здания. Каждый атом демонстрирует лестницу потенциала – дискретный набор орбиталей с разным запасом энергии, зависящим от расстояния от ядра.
Каждый атом демонстрирует лестницу потенциала – дискретный набор орбиталей с разным запасом энергии, зависящим от расстояния от ядра.
Диаграмма атома фтора, показывающая степень эффективного ядерного заряда.
Автор: Effective_Nuclear_Charge.svg, CC0
Электроны, которые расположены на одинаковом расстоянии от ядра, имеют одинаковую энергию, даже если они занимают разные орбитали. Говорят, что они занимают тот же энергетический уровень. Энергетические уровни обозначаются буквами К, L, М и т.д.
Когда электроны передаются от одного атома другому, они сохраняют свой потенциал энергии. В организмах химическая энергия хранится в высокоэнергетических электронах, которые передаются от одного атома к другому в реакциях, включающих окисление и восстановление. Чаще эти процессы соединены в комбинацию окислительно-восстановительной реакции.
В: Что такое «настоящие изображения» атомов?
Что-то, что IBM сделала из очень плоской, очень чистой, очень холодной меди и нескольких сотен молекул угарного газа.
Физик : Настоящие изображения атомов на самом деле вовсе не изображения.
В физике есть несколько хороших практических правил. Среди лучших: свет ведет себя так, как вы ожидаете, на масштабах, значительно превышающих его длину волны, и странно действует на масштабах ниже. Чтобы сфотографировать предмет, вам нужно, чтобы свет разумно отражался от него и двигался по прямой линии (по сути: ведите себя так, как вы ожидаете). Но длина волны видимого света составляет около половины микрометра (двухмиллионная часть метра), а атомы имеют диаметр около одного ангстрема (десятимиллиардная доля метра). В масштабе атомов видимый свет действует слишком шатко, чтобы его можно было использовать для фотографий.
Атомы буквально слишком малы, чтобы их можно было увидеть.
(слева) Фотография шара 3. (Справа) То, что у нас есть вместо фотографии атома.
Можно попробовать использовать свет с более короткой длиной волны, но и с этим есть проблемы. Когда длина волны света намного короче ширины атома, он принимает форму гамма-лучей, и каждый фотон накапливает достаточно энергии, чтобы отправить атомы в полет и/или лишить их электронов (именно эта характеристика делает гамма-лучи опасными). Использование света для изображения атомов похоже на попытку хорошенько разглядеть птичье гнездо, отбрасывая от него пушечное ядро.
Когда длина волны света намного короче ширины атома, он принимает форму гамма-лучей, и каждый фотон накапливает достаточно энергии, чтобы отправить атомы в полет и/или лишить их электронов (именно эта характеристика делает гамма-лучи опасными). Использование света для изображения атомов похоже на попытку хорошенько разглядеть птичье гнездо, отбрасывая от него пушечное ядро.
Существуют «читы», которые позволяют нам использовать свет, чтобы видеть крошечные. Когда масштабы настолько малы, что свет ведет себя скорее как волна, чем как частица, тогда мы просто используем его волновые свойства (что еще можно сделать?). Если вы получите чертовски много одинаковых копий вещи и расположите их в какую-то повторяющуюся структуру, то структура в целом будет иметь очень специфический способ взаимодействия с волнами. Тщательно подготовленные световые волны, проходящие через эти регулярные структуры, создают предсказуемые интерференционные картины, которые можно спроецировать на экран. С помощью этой техники мы многое узнали о ДНК, кристаллах и многом другом. Это самое близкое к фотографии атома, которое возможно с помощью света, и, честно говоря, это не совсем то, что кто-либо имеет в виду под «фотографией». Это менее похоже на то, как выглядит вещь, и более расплывчато, что полезно для ученых. Хуже того, на самом деле это не изображение реальных отдельных атомов, а информация о повторяющейся структуре атомов, которая принимает форму изображения.
Это самое близкое к фотографии атома, которое возможно с помощью света, и, честно говоря, это не совсем то, что кто-либо имеет в виду под «фотографией». Это менее похоже на то, как выглядит вещь, и более расплывчато, что полезно для ученых. Хуже того, на самом деле это не изображение реальных отдельных атомов, а информация о повторяющейся структуре атомов, которая принимает форму изображения.
Пропуская свет (слева) или даже потоки электронов (справа) через правильную кристаллическую структуру, мы создаем интерференционную картину, которая дает нам информацию о структуре кристалла (но не изображения отдельных атомов). Картинка слева (слева) представляет собой образец, созданный ДНК (вид не имеет значения). Обратите внимание, насколько не очевидна спиральная структура. Изображение справа создано электронным лучом, проходящим через какой-то простой минерал или соль.
Эти методы все еще используются сегодня (относительно дешевы), но с 1981 у нас также был доступ к сканирующему туннельному электронному микроскопу (СТМ). Однако, несмотря на изображения, которые он создает, STM также не делает фотографии. STM видит мир так, как видит мир слепой человек на конце крошечной роботизированной руки.
Однако, несмотря на изображения, которые он создает, STM также не делает фотографии. STM видит мир так, как видит мир слепой человек на конце крошечной роботизированной руки.
Основная философия сканирующего туннельного электронного микроскопа заключается в том, что он позволяет этому чуваку знать о дне этого котла с чили больше, чем вам.
СТМ представляет собой иглу с острием, представляющим собой отдельный атом (буквально, это самая острая вещь из возможных), которую он использует для измерения тонких электрических вариаций (таких как блуждающий атом, сидящий на очень плоской, чистой поверхности). поверхность). Бит «Туннельный электрон» в названии относится к природе электрического взаимодействия, используемого для обнаружения присутствия атомов; когда наконечник приближается к атому, электроны будут квантово туннелировать между ними, и обмен электронами можно обнаружить как ток. Бит «Сканирование» в названии относится к тому, как это используется для создания изображения: сканирование вперед и назад по поверхности снова и снова, пока вы не наткнетесь на каждый атом своей иглой несколько раз. Сгенерированные таким образом изображения не являются фотографиями, это карты того, что испытала игла СТМ, когда она перемещалась по поверхности. СТМ «видит» атомы с помощью этой иглы так же, как вы можете «видеть» дно мутной реки тычковой палкой.
Сгенерированные таким образом изображения не являются фотографиями, это карты того, что испытала игла СТМ, когда она перемещалась по поверхности. СТМ «видит» атомы с помощью этой иглы так же, как вы можете «видеть» дно мутной реки тычковой палкой.
STM и некоторые изображения, которые он создает.
Эта технология существует уже несколько десятилетий и, как и появление синтезатора, породила всевозможные шутки.
Эта запись была размещена в — Физиком, Физикой, Квантовой Теорией. Добавьте постоянную ссылку в закладки.
Прорыв в области визуализации позволяет выделить атомы с самым высоким разрешением
Физика
Просмотр 1 изображения
Исследователи из Корнельского университета сделали самые четкие изображения атомов из когда-либо сделанных. Благодаря новым алгоритмам шумоподавления изображения имеют такое высокое разрешение, что, по словам команды, они почти достигают предельно возможного предела.
Благодаря новым алгоритмам шумоподавления изображения имеют такое высокое разрешение, что, по словам команды, они почти достигают предельно возможного предела.
Были получены изображения атомов в кристалле ортоскандата празеодима (PrScO3), увеличенные в 100 миллионов раз. Атомы отчетливо видны как яркие точки, окруженные красными «облаками», которые, по мнению исследователей, являются размытыми, созданными колебанием самих атомов.
Беспрецедентная ясность достигается сочетанием вещей. Во-первых, это общая техника, известная как электронная птихография, которая работает путем сканирования закономерностей рассеяния электронов материалом-мишенью. Выполняется несколько разных сканирований с областями, которые перекрываются между каждым сканом, и прибор фокусируется на том, какие изменения происходят в этих перекрывающихся областях между сканами. Это позволяет им лучше определять форму объекта, создавшего узор.
Сам детектор, известный как детектор массива пикселей электронного микроскопа (EMPAD), использует размытый луч, чтобы сначала захватить более широкий диапазон данных. Затем это размытие корректируется с помощью ряда алгоритмов, которые реконструируют данные, в конечном итоге создавая изображение с разрешением в масштабе пикометров или одной тысячной нанометра.
Затем это размытие корректируется с помощью ряда алгоритмов, которые реконструируют данные, в конечном итоге создавая изображение с разрешением в масштабе пикометров или одной тысячной нанометра.
«С помощью этих новых алгоритмов мы теперь можем скорректировать все размытие нашего микроскопа до такой степени, что самый большой фактор размытия, который у нас остался, — это тот факт, что сами атомы колеблются, потому что это то, что происходит с атомами в конечная температура», — говорит Дэвид Мюллер, ведущий автор исследования. «Когда мы говорим о температуре, то, что мы на самом деле измеряем, — это средняя скорость, с которой колеблются атомы».
Фактически, команда говорит, что изображения приближаются к физическим пределам для самых высоких разрешений, возможных в этом масштабе. Тем не менее, есть несколько вещей, которые можно сделать, чтобы уменьшить размытие при покачивании — использовать более тяжелые атомы, которые меньше трясутся, или охладить образцы до абсолютного нуля, где это движение прекращается.
