Содержание
Бактериофаги: что это и для чего они нужны
В последнее время бактериофаги привлекают все больше внимания как альтернативный антибиотикам способ лечения. РБК Тренды попросили эксперта рассказать о них все, что известно науке на сегодняшний день
В этой статье о бактериофагах:
- Определение
- Открытие
- Принцип работы
- Возможности бактериофагов
- Потенциал изучения
- Критика исследований
Об эксперте: Константин Мирошников, доктор химических наук, главный научный сотрудник лаборатории молекулярной биоинженерии ИБХ РАН.
Что такое бактериофаги
Бактериофаги — это вирусы бактерий. У всех организмов на Земле есть крошечные, невидимые в оптический микроскоп паразиты — вирусы. Есть они и у одноклеточных.
Цикл размножения бактериальных вирусов обычно заканчивается гибелью микроба. Однако существуют разновидности бактериофагов, которые не уничтожают клетку хозяина напрямую, а, как вирусы более совершенных организмов, оставляют ее истощенной, но жизнеспособной.
Бактерии доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида бактерий имеется множество специализированных типов вирусов. Бактериофаги — это самые многочисленные существа в биосфере. Их изучают уже более ста лет.
Кто открыл бактериофаги
В последней четверти XIX века благодаря микробной теории инфекционных заболеваний Пастера и Коха ускорился прогресс в области экспериментальной микробиологии. В частности, ученые научились культивировать микроорганизмы. Исследователи регулярно наблюдали необычный эффект: растущая культура бактерий внезапно самоуничтожалась по не известным тогда причинам. Существование мельчайшего инфекционного агента, способного проходить через самые тонкие фильтры и вызывать гибель бактерий, выявили в конце 1890-х.
Однако природа этого агента оставалась непонятной. В то же время исследователи активно изучали вирусы. Сопоставить эти две линии экспериментальных находок и обосновать это в дискуссии с научными оппонентами удалось в 1917 году франко-канадскому естествоиспытателю Феликсу Д’ Эрелю.
Главной проблемой ранних работ в области биологии бактериофагов была ограниченность доступных в то время экспериментальных методов. Исследователям приходилось работать с невидимым организмом, многие свойства которого было невозможно интерпретировать. Как выглядит бактериофаг, удалось узнать только в 1940-х годах с появлением электронной микроскопии.
Как работают бактериофаги
Инфекционный цикл бактериофагов проходит по тем же основным этапам, что и у других вирусов. Бактериофаг должен присоединиться к бактериальной клетке и доставить свой генетический материал внутрь нее. Дальнейшие этапы развития инфекции переключают механизмы жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение копий вирусных оболочек, упаковку в них нуклеиновой кислоты вируса и, наконец, разрушение зараженной клетки. У каждого из этих этапов существуют множество нюансов, имеющих глубокий эволюционный и экологический смысл.
Роль бактериофагов в биосфере — регуляция численности и разнообразия одноклеточных микроорганизмов.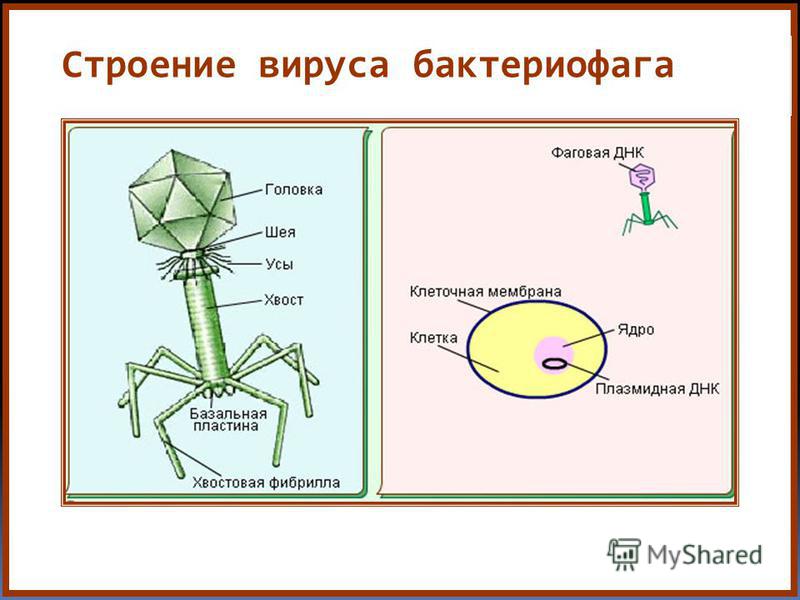 Бактерии и их вирусные паразиты сосуществуют миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
Бактерии и их вирусные паразиты сосуществуют миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
Самые распространенные бактериофаги
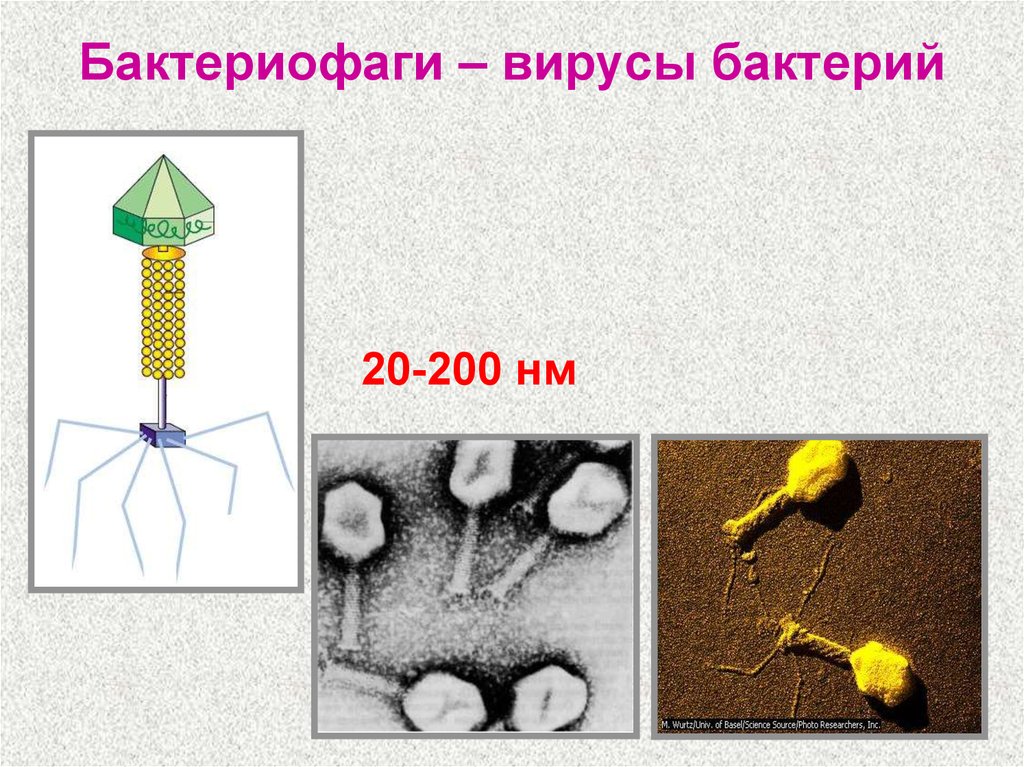
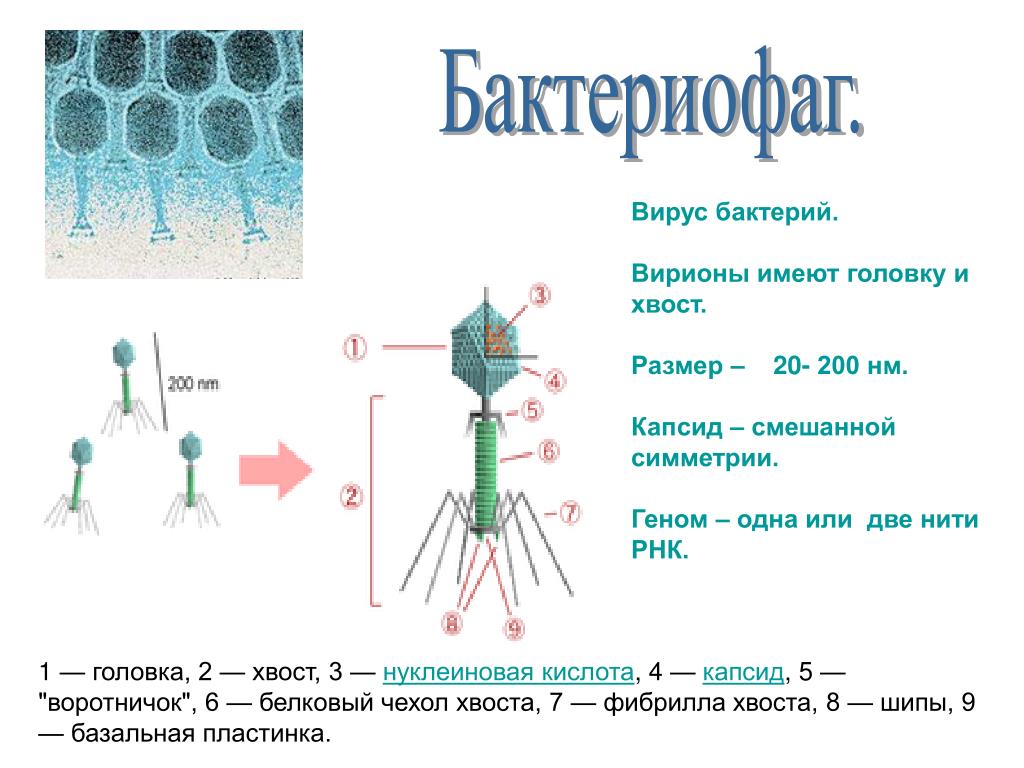
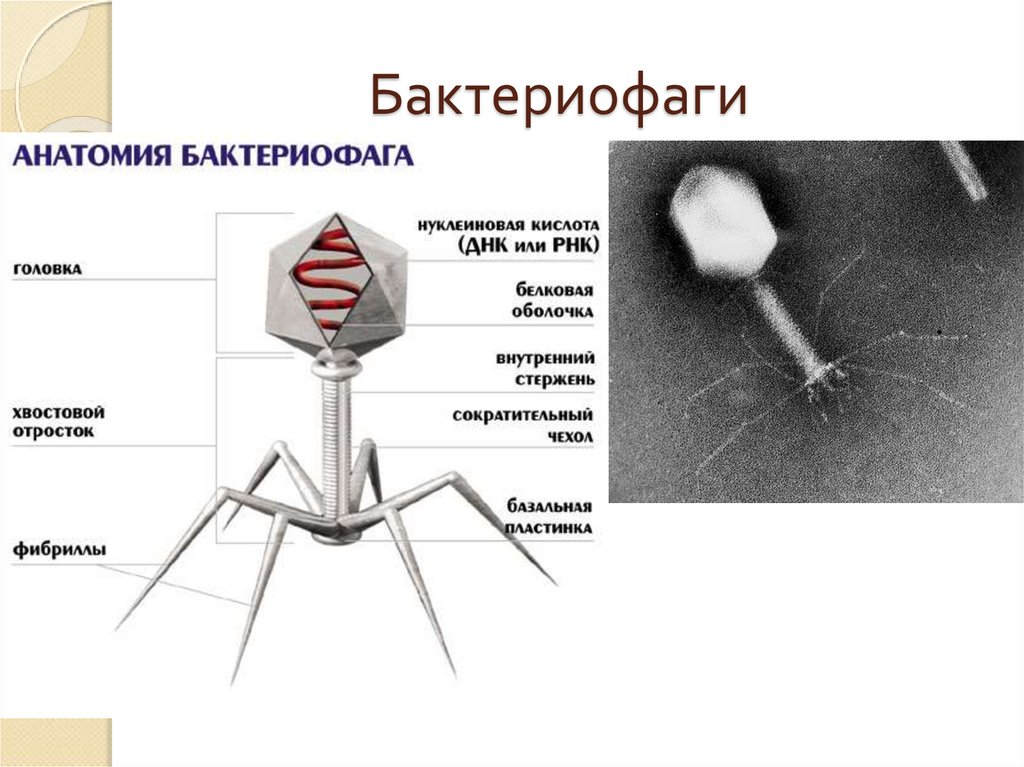
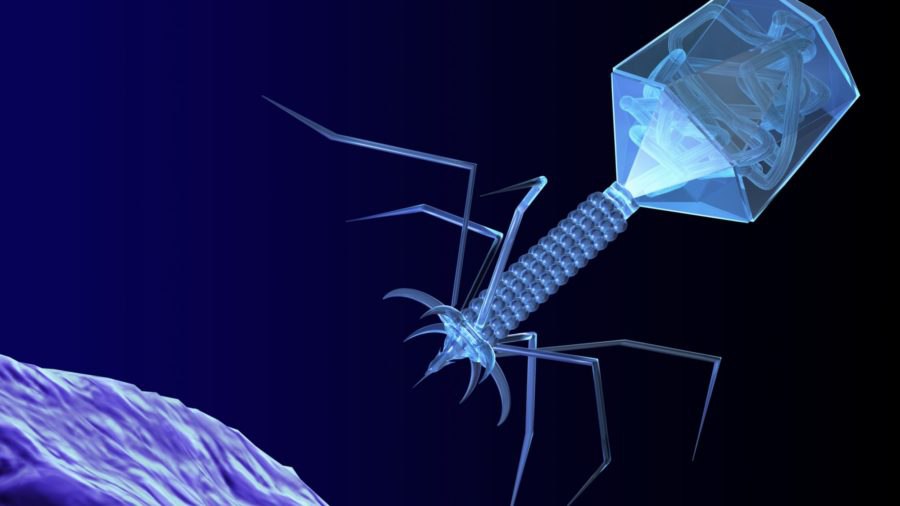
Доминирующий в природе вид бактериофагов — хвостатые. Хвост разной длины и формы обеспечивает присоединение вируса к поверхности бактерии-хозяина, головка служит хранилищем для генома. Геномная ДНК кодирует структурные белки, формирующие «тело» бактериофага и белки, которые обеспечивают размножение фага внутри клетки в процессе инфекции.
Можно сказать, что бактериофаг — это природный высокотехнологичный нанообъект. Например, хвосты фагов представляют собой «молекулярный шприц», который протыкает стенку бактерии и, сокращаясь, впрыскивает свою ДНК внутрь клетки.
На что способны бактериофаги
Во время раннего периода изучения бактериофагов, в 1920–1930-х годах, единственным достоверно понятным их свойством была способность уничтожать бактерии, в том числе и болезнетворные. Этим свойством незамедлительно заинтересовались исследователи в области медицины. Первые попытки лечения фагами дизентерии, раневых инфекций, холеры и тифа были проведены пусть не по современным стандартам, но достаточно аккуратно. Успех выглядел вполне убедительно. Перспективными были попытки бороться с их помощью с бактериальными болезнями животных и растений.
Этим свойством незамедлительно заинтересовались исследователи в области медицины. Первые попытки лечения фагами дизентерии, раневых инфекций, холеры и тифа были проведены пусть не по современным стандартам, но достаточно аккуратно. Успех выглядел вполне убедительно. Перспективными были попытки бороться с их помощью с бактериальными болезнями животных и растений.
Однако после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. На тот момент было известно очень мало о том, что такое бактериофаги, как их производить, очищать и применять их лекарственные формы.
В 1940-х годах более перспективным оказался подход применения в медицине низкомолекулярных веществ, убивающих микроорганизмы, — антибиотиков. Эти вещества были проще в производстве, хранении, а главное — быстро и качественно уничтожали всех микробов в человеческом организме.
Но бактериофаги оказались удивительно удобными модельными объектами для исследования фундаментальных закономерностей бурно развивающейся молекулярной биологии.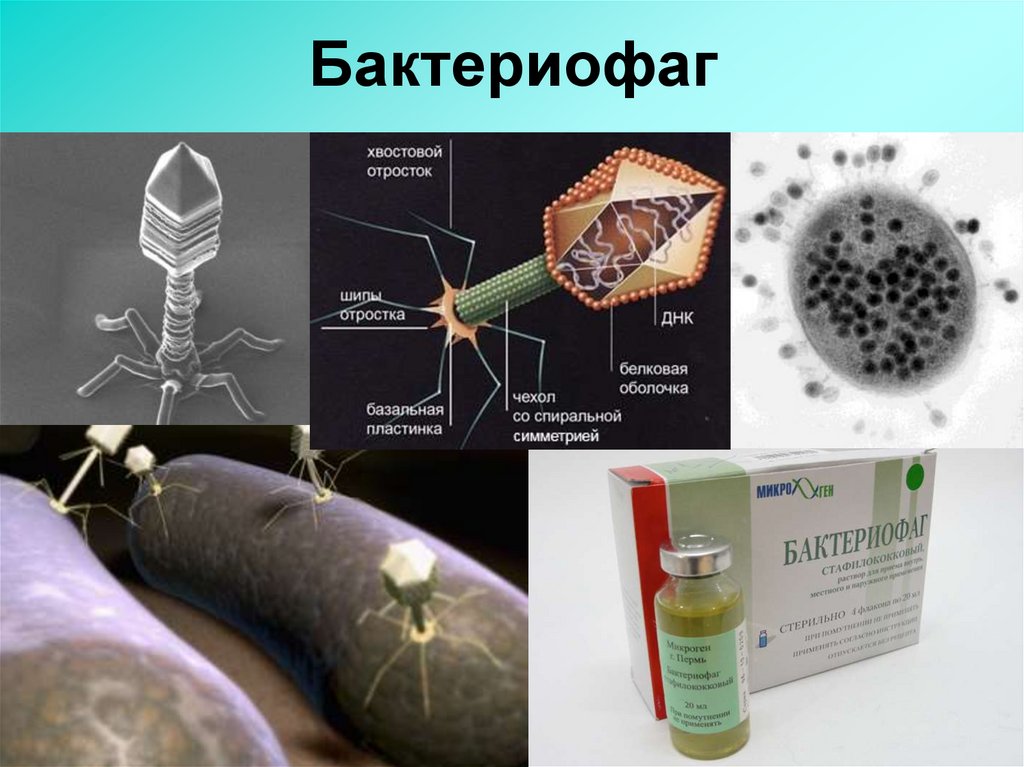 Многие важнейшие открытия, без которых немыслима современная наука, например, рекомбинация ДНК и расшифровка «триплетов» генетического кода, были сделаны с помощью бактериофагов. Выделенные из бактериофагов ферменты стали классикой генетической инженерии.
Многие важнейшие открытия, без которых немыслима современная наука, например, рекомбинация ДНК и расшифровка «триплетов» генетического кода, были сделаны с помощью бактериофагов. Выделенные из бактериофагов ферменты стали классикой генетической инженерии.
Расшифровка геномов организмов тоже началась с небольших геномов фагов. С развитием экспериментальной геномики ученые все больше узнавали о колоссальной роли бактериофагов в экологии и эволюции биосферы. Выполненные в начале 2000-х исследования метагеномов — полного генетического материала биологических сообществ — пролили свет на колоссальное разнообразие бактериофагов в природе. Так, например, была открыта система CRISPR-Cas.
Поскольку бактериофаги легко культивировать и эти вирусы имеют симметричное строение, они оказались удобными моделями для развития методов исследования структуры биомолекул. Например, криоэлектронная микроскопия, ныне золотой стандарт структурной биологии, началась в 1990-х годах с реконструкций внутренних оболочек (капсидов) вирусов бактерий.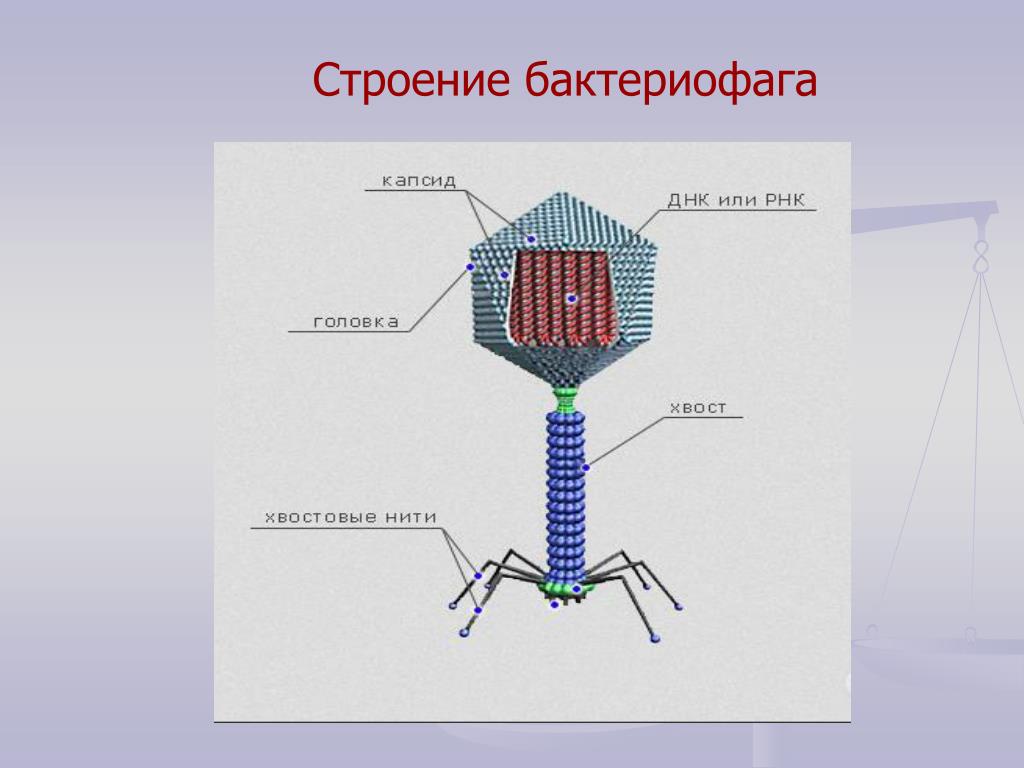 Капсиды некоторых фагов способны самостоятельно собираться в пространственные структуры. Это удобный способ получения биоразлагаемых белковых наночастиц — «капсул» для целенаправленной доставки лекарств.
Капсиды некоторых фагов способны самостоятельно собираться в пространственные структуры. Это удобный способ получения биоразлагаемых белковых наночастиц — «капсул» для целенаправленной доставки лекарств.
Какой потенциал у изучения бактериофагов
Потенциал детальных исследований бактериофагов еще очень велик как в фундаментальном, так и в прикладном контексте.
Возобновляется интерес к бактериофагам как к терапевтическим средствам. В последние десятилетия использование антибиотиков вызывает все больше вопросов. Возникает проблема поиска дополнительных и альтернативных средств борьбы с болезнетворными бактериями. В отличие от ситуации столетней давности, о бактериофагах известно достаточно, чтобы обоснованно выбирать те, которые подходят для терапевтических целей. Изучены многие аспекты поведения фагов в организме человека и их взаимодействия с иммунной системой.
Для разработки и производства эффективного препарата необходимо точно подобрать бактериофаги с полностью расшифрованными геномами, культивировать их по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и провести очистку высокой степени. Однако это все равно дешевле, чем создание современных сложных антибиотиков. Кроме того, использование бактериофагов и антибиотиков в медицинских целях не противоречит друг другу. При совместном их применении наблюдается синергизм — взаимное усиление антибактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Опубликован ряд работ, которые детально описывают успешные случаи излечения с помощью бактериофагов инфекций, устойчивых к антибиотикам.
Однако это все равно дешевле, чем создание современных сложных антибиотиков. Кроме того, использование бактериофагов и антибиотиков в медицинских целях не противоречит друг другу. При совместном их применении наблюдается синергизм — взаимное усиление антибактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Опубликован ряд работ, которые детально описывают успешные случаи излечения с помощью бактериофагов инфекций, устойчивых к антибиотикам.
За что критикуют исследование бактериофагов в научном сообществе
Разумеется, бактериофаги не всесильны. Есть ряд фундаментальных ограничений их использования. Прежде всего — очень высокая специфичность действия. С одной стороны, это достоинство, так как антибактериальный эффект препаратов не затрагивает нормальную микрофлору человеческого организма. Но, с другой, применение бактериофагов требует высокоточной диагностики целевого патогена — возбудителя заболевания. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать индивидуально для каждого конкретного пациента. Но несмотря на то, что о персонифицированной медицине много говорится, эта концепция слишком сложна и дорога на практике.
В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать индивидуально для каждого конкретного пациента. Но несмотря на то, что о персонифицированной медицине много говорится, эта концепция слишком сложна и дорога на практике.
«Слабое звено» фаготерапии — регистрационные и финансовые вопросы. Поскольку разновидности патогенных бактерий в клинической картине постоянно меняются, требуется периодическая адаптация состава фагового препарата к конкретным возбудителям. При наличии коллекций охарактеризованных бактериофагов — некоего «каталога» фагов с полностью расшифрованным геномом — сделать это несложно.
Но по существующим правилам при каждом изменении компонентов необходимо заново проводить сертификационные действия. Требуется разработка принципиально новых стандартов тестирования и регистрации лекарственных препаратов на основе бактериофагов. Это признается специалистами здравоохранения, но нигде в мире пока не реализовано.
Что такое бактериофаги, как они работают и что ими лечат
У всех существ, обитающих на земле, есть микроскопические паразиты – вирусы. Есть свои вирусы и у бактерий. Цикл размножения бактериальных вирусов неизбежно заканчивается гибелью микроба. Чтобы подчеркнуть такую особенность, один из первооткрывателей этого эффекта, Феликс Д’Эрель, придумал специальное название – «бактериофаги», в переводе с греческого – «пожиратели бактерий». Что такое бактериофаги и каково их действие? Ответы на эти вопросы вы найдете в нашем материале.
Есть свои вирусы и у бактерий. Цикл размножения бактериальных вирусов неизбежно заканчивается гибелью микроба. Чтобы подчеркнуть такую особенность, один из первооткрывателей этого эффекта, Феликс Д’Эрель, придумал специальное название – «бактериофаги», в переводе с греческого – «пожиратели бактерий». Что такое бактериофаги и каково их действие? Ответы на эти вопросы вы найдете в нашем материале.
Константин Мирошников
Что же такое бактериофаги? Кратко — это вирусы. В конце ХХ века стало ясно, что бактерии безусловно доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида имеется множество специализированных типов вирусов. По предварительным оценкам, число видов бактериофагов составляет около 1015. Чтобы понять масштаб этой цифры, можно сказать, что если каждый человек на Земле будет каждый день открывать по одному новому бактериофагу, то на описание всех их понадобится 30 лет. Таким образом, бактериофаги — самые малоизученные существа в нашей биосфере.
Что такое бактериофаг и как он выглядит?
Большинство известных сегодня бактериофагов принадлежит к отряду Caudovirales — хвостатые вирусы. Их частицы имеют размер от 50 до 200 нм. Хвост разной длины и формы обеспечивает присоединение вируса к поверхности бактерии-хозяина, головка (капсид) служит хранилищем для генома. Геномная ДНК кодирует структурные белки, формирующие «тело» бактериофага, и белки, которые обеспечивают размножение фага внутри клетки в процессе инфекции. Что же такое эти вирусы или бактериофаги? Можно сказать, что бактериофаг — это природный высокотехнологичный нанообъект. Например, хвосты фагов представляют собой «молекулярный шприц», который протыкает стенку бактерии и, сокращаясь, впрыскивает свою ДНК внутрь клетки.
Как работает бактериофаг?
Словом, бактериофаги — это вирусы бактерий. С этого момента, лизиса, начинается инфекционный цикл. Его дальнейшие этапы состоят из переключения механизмов жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение множества копий вирусных оболочек, упаковки в них ДНК вируса и, наконец, разрушение (лизис) хозяйской клетки.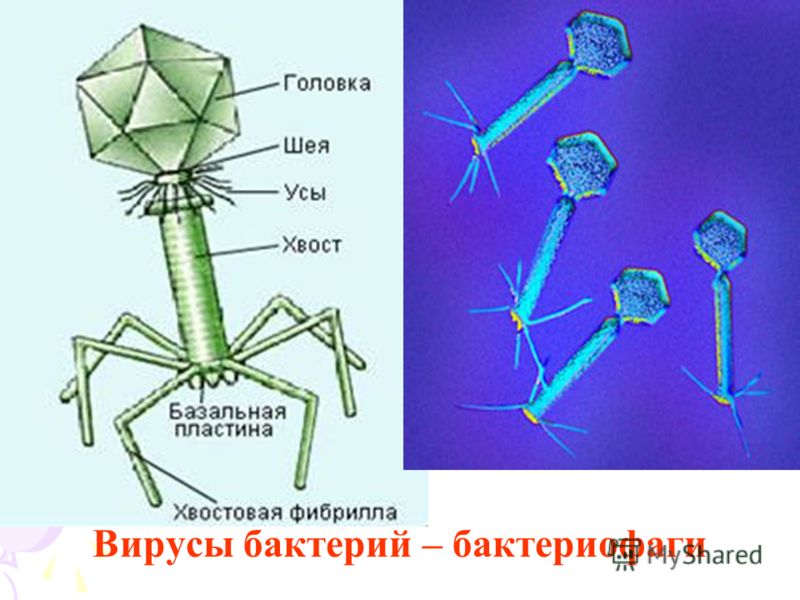 У каждого этапа существует множество нюансов, имеющих глубокий эволюционный и экологический смысл. Ведь бактерии и их вирусные паразиты сосуществуют сотни миллионов, если не миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
У каждого этапа существует множество нюансов, имеющих глубокий эволюционный и экологический смысл. Ведь бактерии и их вирусные паразиты сосуществуют сотни миллионов, если не миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
Помимо постоянного эволюционного соревнования механизмов защиты у бактерий и нападения у вирусов, причиной сложившегося равновесия можно считать и то, что бактериофаги специализировались по своему инфекционному действию. Как работает бактериофаг? Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно — растворяющими) фагами идет быстро и непрерывно. Если потенциальных жертв маловато или внешние условия не слишком подходят для эффективного размножения фагов, то преимущество получают фаги с лизогенным циклом развития. В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, зачастую внедряясь в бактериальный геном.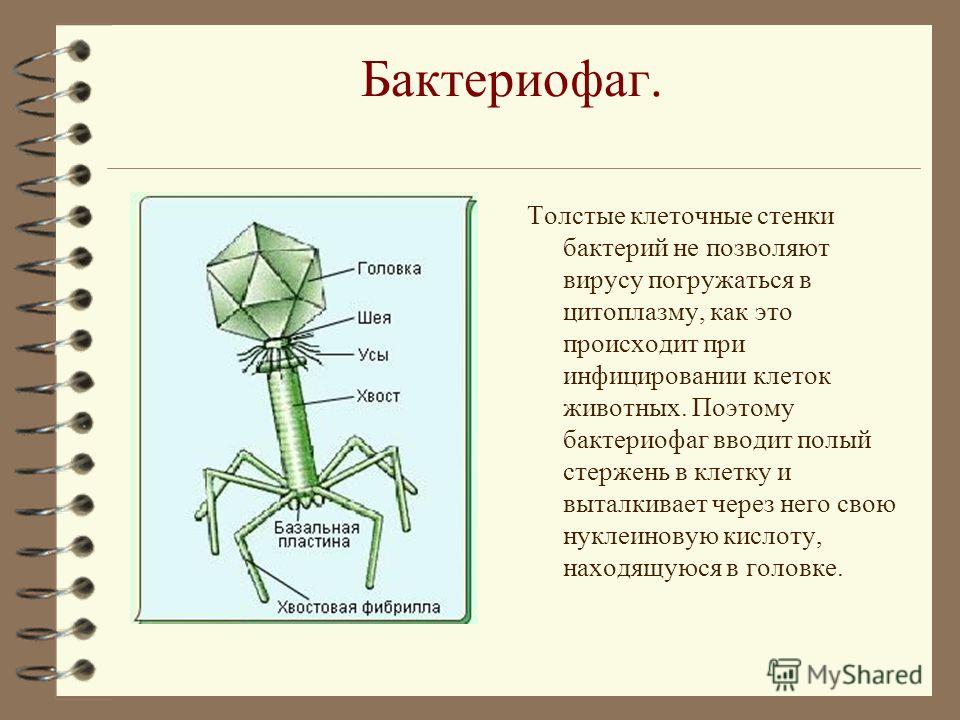
Что делают бактериофаги дальше? В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами — организмами без клеточных ядер.
Что лечат бактериофагами?
Все эти молекулярные тонкости не были известны во втором десятилетии ХХ века, когда были открыты «невидимые инфекционные агенты, уничтожающие бактерий». Но и без электронного микроскопа, с помощью которого в конце 1940-х впервые удалось получить изображения бактериофагов, было понятно, что они способны уничтожать бактерии, в том числе и болезнетворные.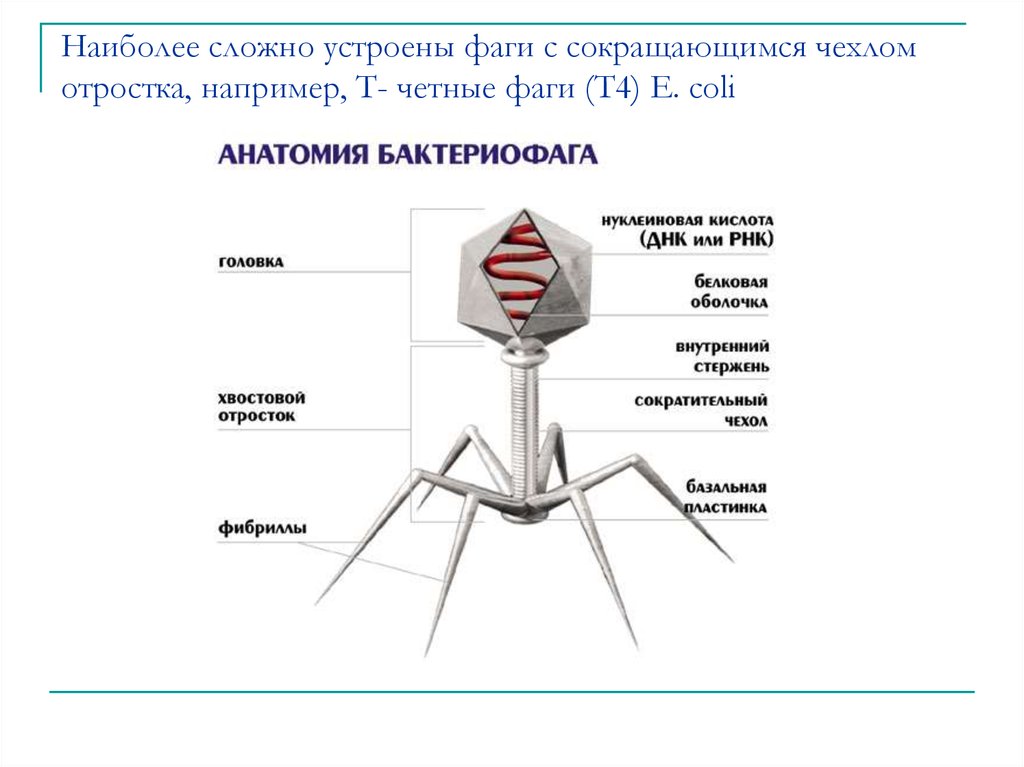 Это свойство было незамедлительно востребовано медициной. Что лечили бактериофагами? Известно, что первые попытки лечения фагами дизентерии, раневых инфекций, холеры, тифа и даже чумы были проведены достаточно аккуратно, и успех выглядел вполне убедительно. Но после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. О том, что такое бактериофаги, как производить, очищать и применять их лекарственные формы, было известно еще очень мало. Достаточно сказать, что по результатам предпринятой в США в конце 1920-х годов проверки во многих промышленных фагопрепаратах собственно бактериофагов вообще не оказалось.
Это свойство было незамедлительно востребовано медициной. Что лечили бактериофагами? Известно, что первые попытки лечения фагами дизентерии, раневых инфекций, холеры, тифа и даже чумы были проведены достаточно аккуратно, и успех выглядел вполне убедительно. Но после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. О том, что такое бактериофаги, как производить, очищать и применять их лекарственные формы, было известно еще очень мало. Достаточно сказать, что по результатам предпринятой в США в конце 1920-х годов проверки во многих промышленных фагопрепаратах собственно бактериофагов вообще не оказалось.
Проблема с антибиотиками
Вторую половину ХХ века в медицине можно назвать «эрой антибиотиков». Однако еще первооткрыватель пенициллина Александр Флеминг в своей нобелевской лекции предупреждал, что устойчивость микробов к пенициллину возникает довольно быстро. До поры до времени антибиотикоустойчивость компенсировалась разработкой новых типов противомикробных лекарств. Но с 1990-х годов стало ясно, что человечество проигрывает «гонку вооружений» против микробов. Виновато прежде всего бесконтрольное применение антибиотиков не только в лечебных, но и в профилактических целях, причем не только в медицине, но и в сельском хозяйстве, пищевой промышленности и быту. В результате устойчивость к этим препаратам начала вырабатываться не только у болезнетворных бактерий, но и у самых обычных микроорганизмов, живущих в почве и воде, делая из них «условных патогенов». Такие бактерии комфортно существуют в медицинских учреждениях, заселяя сантехнику, мебель, медицинскую аппаратуру, порой даже дезинфицирующие растворы. У людей с ослабленным иммунитетом, каких в больницах большинство, они вызывают тяжелейшие осложнения. В отличие от антибиотиков бактериофаги работают избирательно. Они ликвидируют специфичные патогены, не задевая нормальную бактериальную флору.
Но с 1990-х годов стало ясно, что человечество проигрывает «гонку вооружений» против микробов. Виновато прежде всего бесконтрольное применение антибиотиков не только в лечебных, но и в профилактических целях, причем не только в медицине, но и в сельском хозяйстве, пищевой промышленности и быту. В результате устойчивость к этим препаратам начала вырабатываться не только у болезнетворных бактерий, но и у самых обычных микроорганизмов, живущих в почве и воде, делая из них «условных патогенов». Такие бактерии комфортно существуют в медицинских учреждениях, заселяя сантехнику, мебель, медицинскую аппаратуру, порой даже дезинфицирующие растворы. У людей с ослабленным иммунитетом, каких в больницах большинство, они вызывают тяжелейшие осложнения. В отличие от антибиотиков бактериофаги работают избирательно. Они ликвидируют специфичные патогены, не задевая нормальную бактериальную флору.
Неудивительно, что медицинское сообщество бьет тревогу. В прошедшем, 2012 году гендиректор ВОЗ Маргарет Чен выступила с заявлением, предсказывающим конец эры антибиотиков и беззащитность человечества перед инфекционными заболеваниями. Впрочем, практические возможности комбинаторной химии — основы фармакологической науки — далеко не исчерпаны. Другое дело, что разработка противомикробных средств — очень дорогой процесс, не приносящий таких прибылей, как многие другие лекарства. Так что страшилки о «супербактериях» — это скорее предостережение, побуждающее людей к поискам альтернативных решений. Например, известно, что медицинское значение бактериофагов очень высоко.
Впрочем, практические возможности комбинаторной химии — основы фармакологической науки — далеко не исчерпаны. Другое дело, что разработка противомикробных средств — очень дорогой процесс, не приносящий таких прибылей, как многие другие лекарства. Так что страшилки о «супербактериях» — это скорее предостережение, побуждающее людей к поискам альтернативных решений. Например, известно, что медицинское значение бактериофагов очень высоко.
Применение бактериофагов в медицине
Вполне логичным выглядит возрождение интереса к использованию бактериофагов — естественных врагов бактерий — для лечения инфекций. Действительно, за десятилетия «эры антибиотиков» бактериофаги активно служили науке, но не медицине, а фундаментальной молекулярной биологии. Достаточно упомянуть расшифровку «триплетов» генетического кода и процесса рекомбинации ДНК. Сейчас о бактериофагах известно достаточно, чтобы обоснованно выбирать фаги, подходящие для терапевтических целей. Применение бактериофагов в медицине открывает для человечества множество возможностей.
Применение бактериофагов в медицине открывает для человечества множество возможностей.
Достоинств у бактериофагов как у потенциальных лекарств множество. Прежде всего — это их несметное количество. Хотя изменять генетический аппарат бактериофага тоже намного проще, чем у бактерии, и тем более — у высших организмов, в этом нет необходимости. Всегда можно подобрать что-то подходящее в природе. Речь идет скорее о селекции, закреплении востребованных свойств и размножении нужных бактериофагов. Это можно сравнить с выведением пород собак — ездовых, сторожевых, охотничьих, гончих, бойцовых, декоративных… Все они при этом остаются собаками, но оптимизированы под определенный вид действий, нужных человеку. Во-вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека. В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться.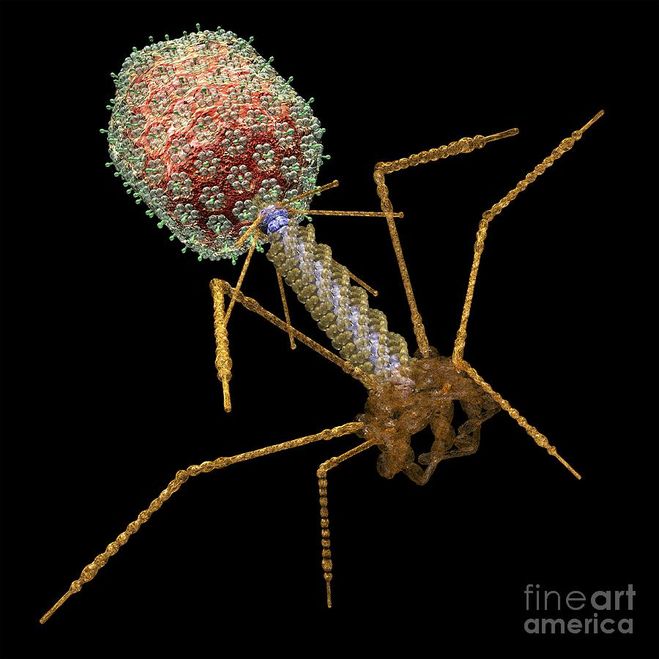 Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий. Последнее явление, «эффект Герксхаймера», нередко наблюдается и при применении антибиотиков.
Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий. Последнее явление, «эффект Герксхаймера», нередко наблюдается и при применении антибиотиков.
Две стороны медали. Недостатки бактериофагов
К сожалению, недостатков при применении бактериофагов в медицине тоже немало. Самая главная проблема проистекает из достоинства — высокой специфичности фагов. Каждый бактериофаг инфицирует строго определенный тип бактерий, даже не таксономический вид, а ряд более узких разновидностей, штаммов. Условно говоря, как если бы сторожевая собака начинала лаять только на одетых в черные плащи громил двухметрового роста, а на лезущего в дом подростка в шортах никак не реагировала.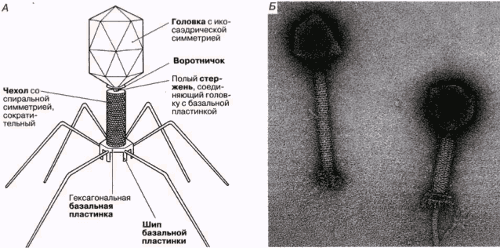 Поэтому для нынешних фаговых лекарств нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различными.
Поэтому для нынешних фаговых лекарств нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различными.
Поскольку бактериофагов в природе несметное количество и они постоянно попадают в организм человека с водой, воздухом, пищей, то иммунитет их просто игнорирует. Более того, существует гипотеза о симбиозе бактериофагов в кишечнике, регулирующем кишечную микрофлору. Добиться какой-то иммунной реакции можно только при длительном введении в организм больших доз фагов. Но таким образом можно добиться аллергии на почти любые вещества. И наконец, очень важно то, что бактериофаги недороги. Разработка и производство препарата, состоящего из точно подобранных бактериофагов с полностью расшифрованными геномами, культивированных по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и прошедших высокую очистку, на порядки дешевле, чем для современных сложных антибиотиков. Это позволяет быстро приспосабливать фаготерапевтические препараты к меняющимся наборам патогенных бактерий, а также применять бактериофаги в ветеринарии, где дорогие лекарства экономически не оправданы.
Это позволяет быстро приспосабливать фаготерапевтические препараты к меняющимся наборам патогенных бактерий, а также применять бактериофаги в ветеринарии, где дорогие лекарства экономически не оправданы.
Для максимально эффективного применения бактериофага в медицине необходима точная диагностика патогенного микроба, вплоть до штамма. Самый распространенный сейчас метод диагностики — культуральный посев — занимает много времени и требуемой точности не дает. Быстрые методы — типирование с помощью полимеразной цепной реакции или масс-спектрометрии — внедряются медленно из-за дороговизны аппаратуры и более высоких требований к квалификации лаборантов. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать против инфекции каждого конкретного пациента, но это дорого и на практике неприемлемо.
Другой важный недостаток в работе бактериофагов — их биологическая природа. Кроме того, что бактериофаги для поддержания инфекционности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке».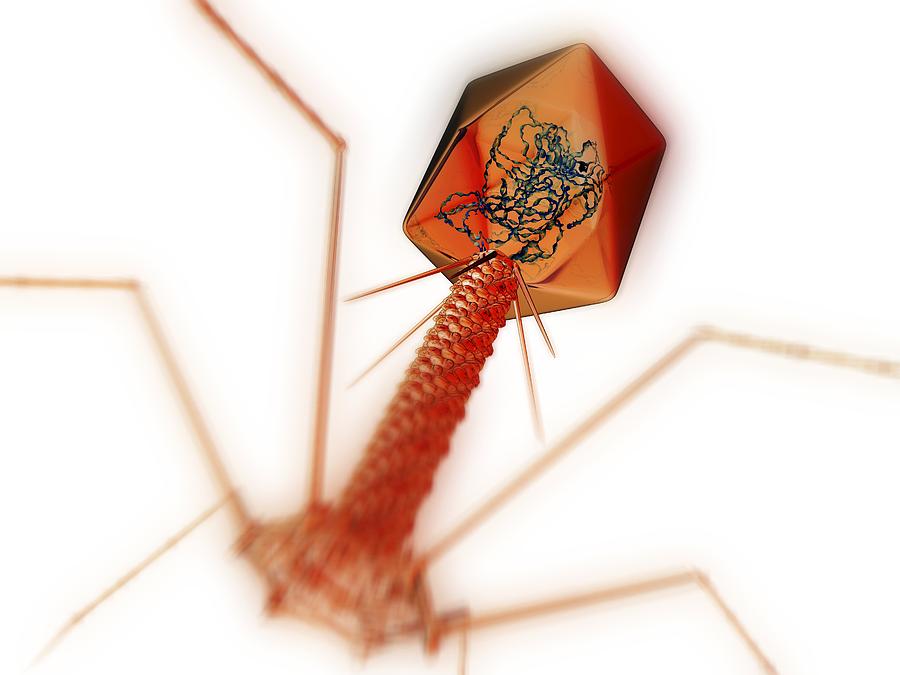 И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает.
И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает.
Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги не работают и против тех микробов, которые развиваются внутри клеток, например возбудителей туберкулеза и проказы.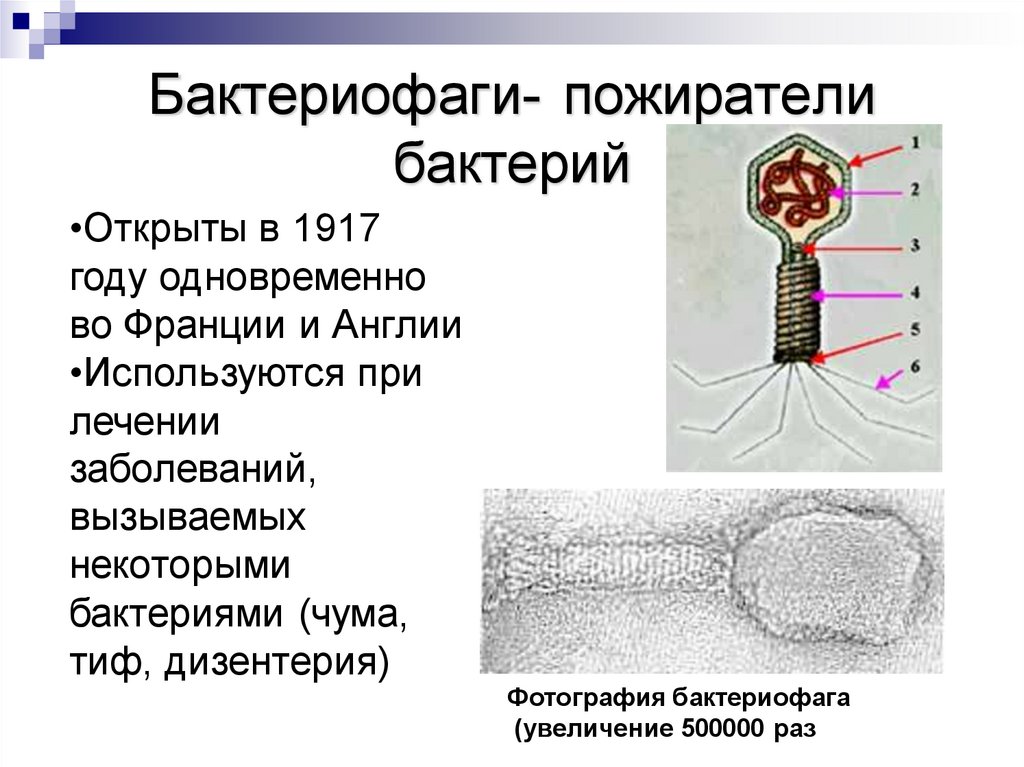 Через стенку человеческой клетки бактериофаг пробраться не может.
Через стенку человеческой клетки бактериофаг пробраться не может.
Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен. Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в медицине, а именно в противомикробной терапии — перспективное направление. Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями.
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 26 сентября 2022 г.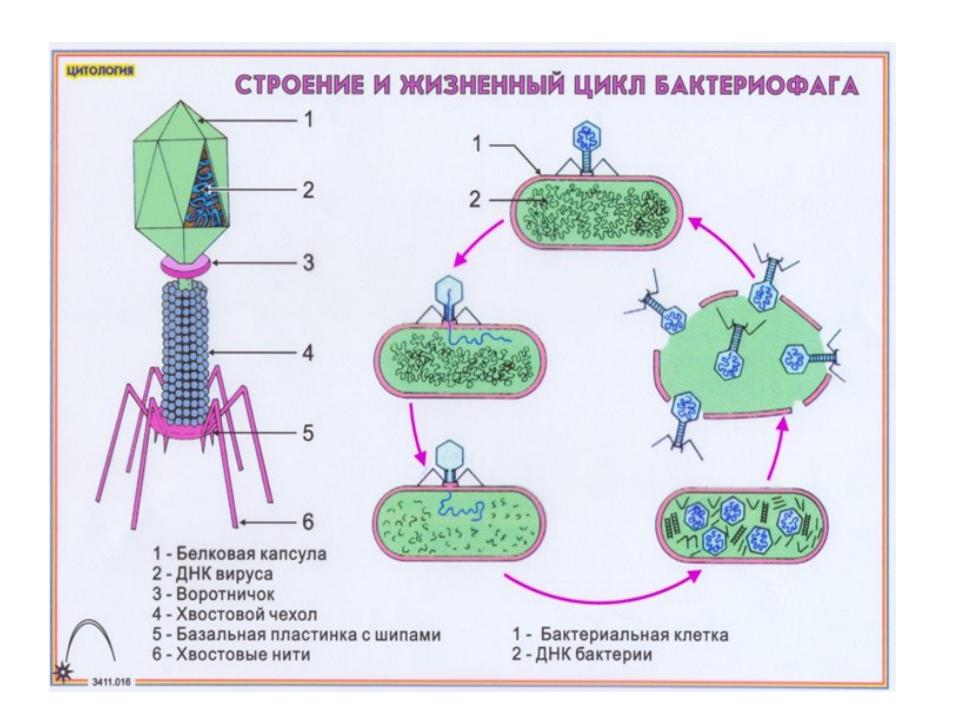
Введение
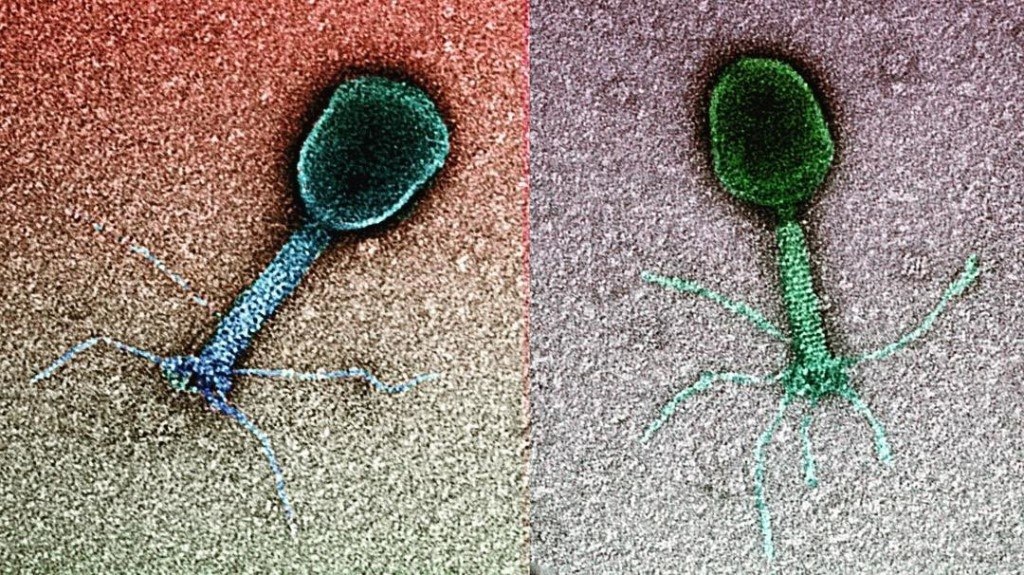
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной.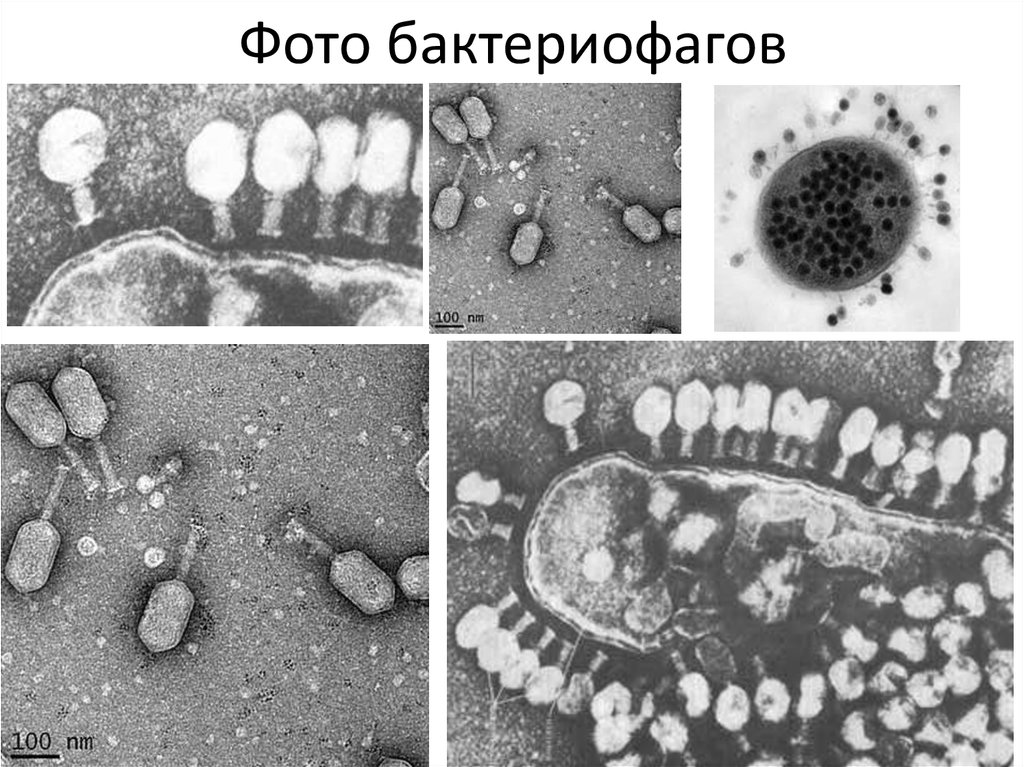 Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации.
 Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8].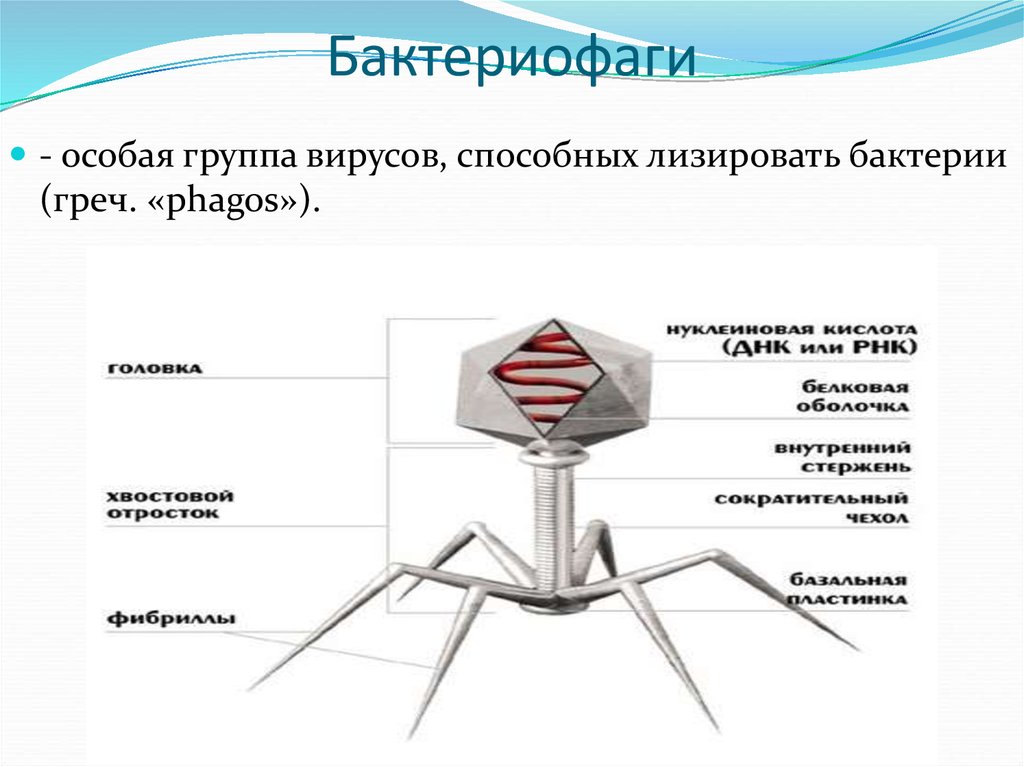 Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9. 0034
0034
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды.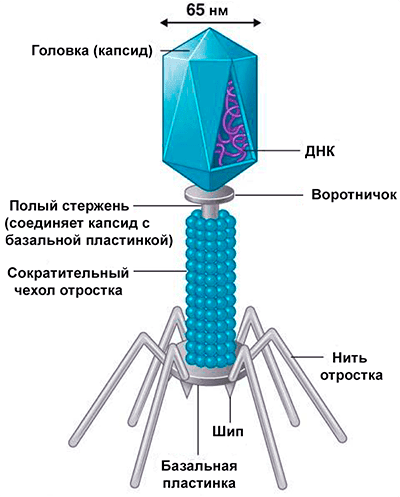 Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты.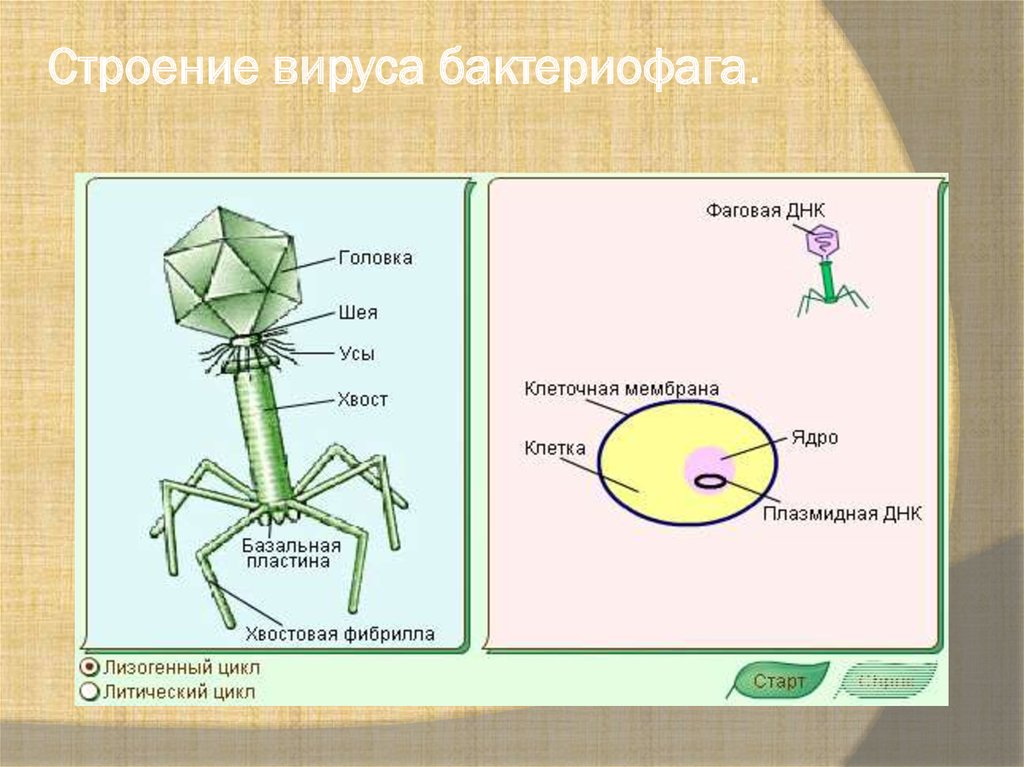 Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Несмотря на то, что бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC.
 CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.

Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие.
 Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol. 2016 апр;32(4):67. [PubMed: 26931607]
- 16.
Schofield DA, Sharp NJ, Westwater C. Платформы на основе фагов для клинического обнаружения бактериальных патогенов человека. Бактериофаг. 2012 01 апреля; 2(2):105-283. [Бесплатная статья PMC: PMC3442824] [PubMed: 23050221]
- 17.
Wiśniewska K, Szewczyk A, Piechowicz L, Bronk M, Samet A, Swieć K. Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М.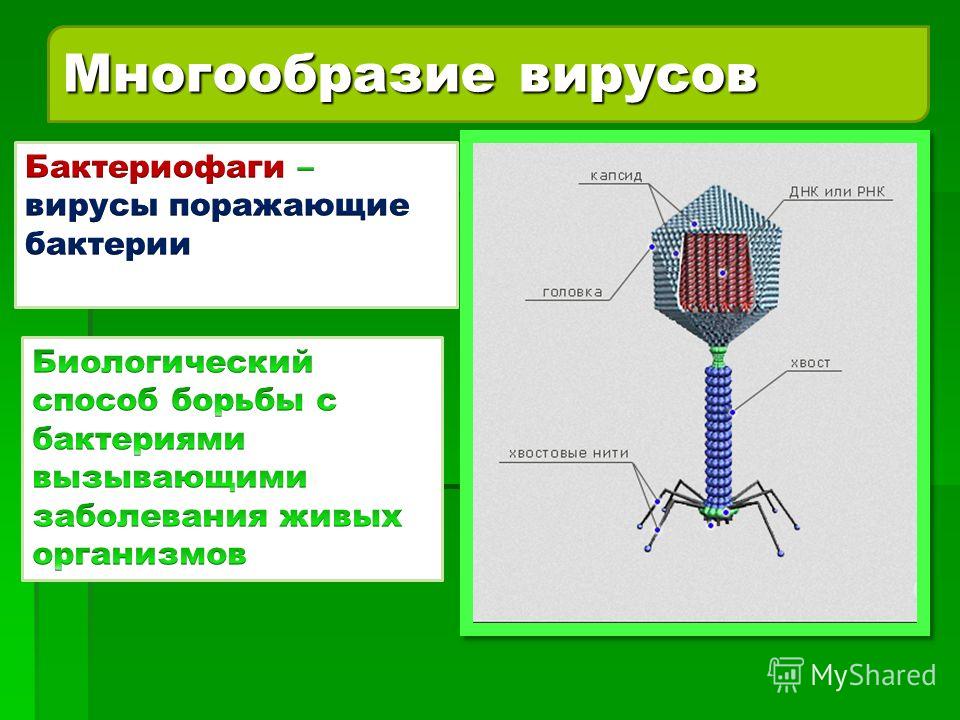 Касман; Ла Донна Портер.
Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 26 сентября 2022 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида.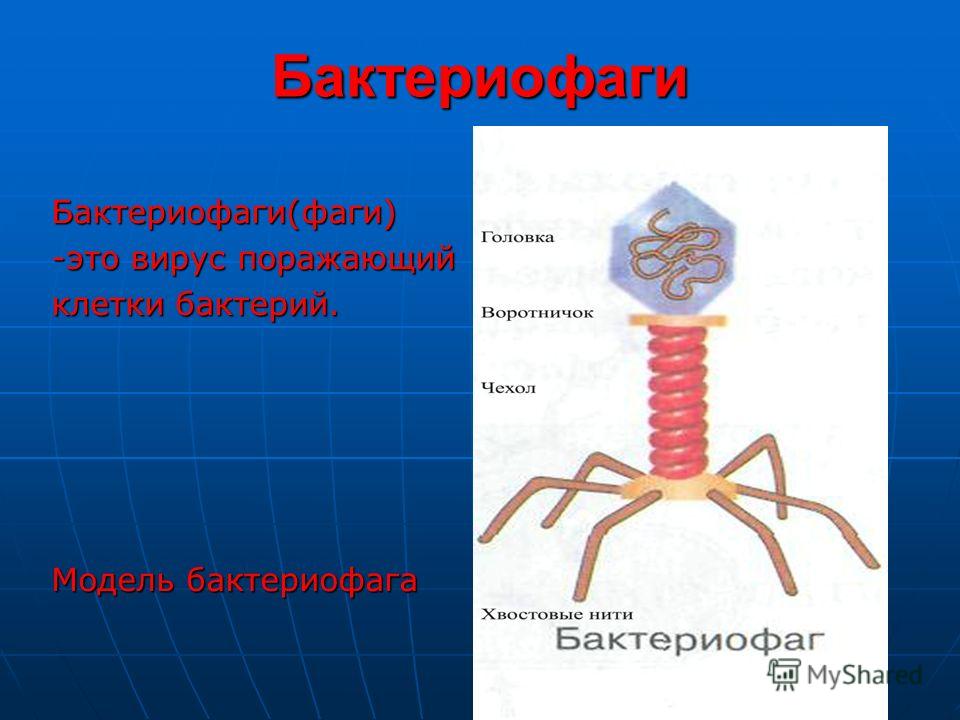 Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами.
Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами.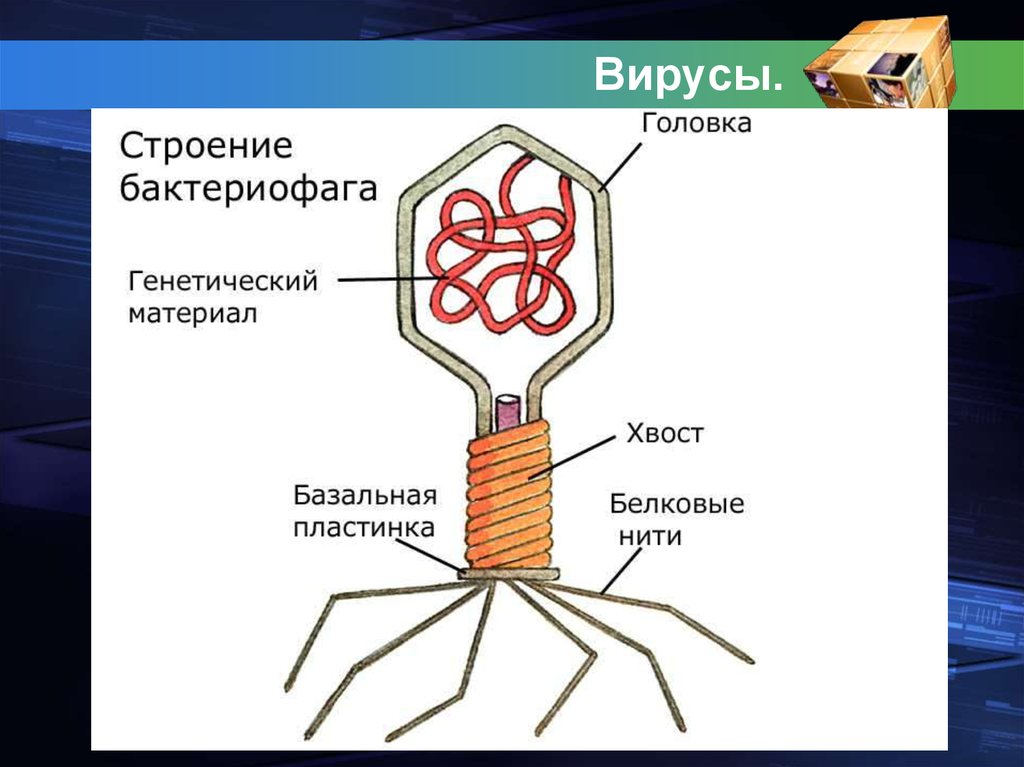 Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации.
 Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9. 0034
0034
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Несмотря на то, что бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC.
 CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.

Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие.


 Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
 CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]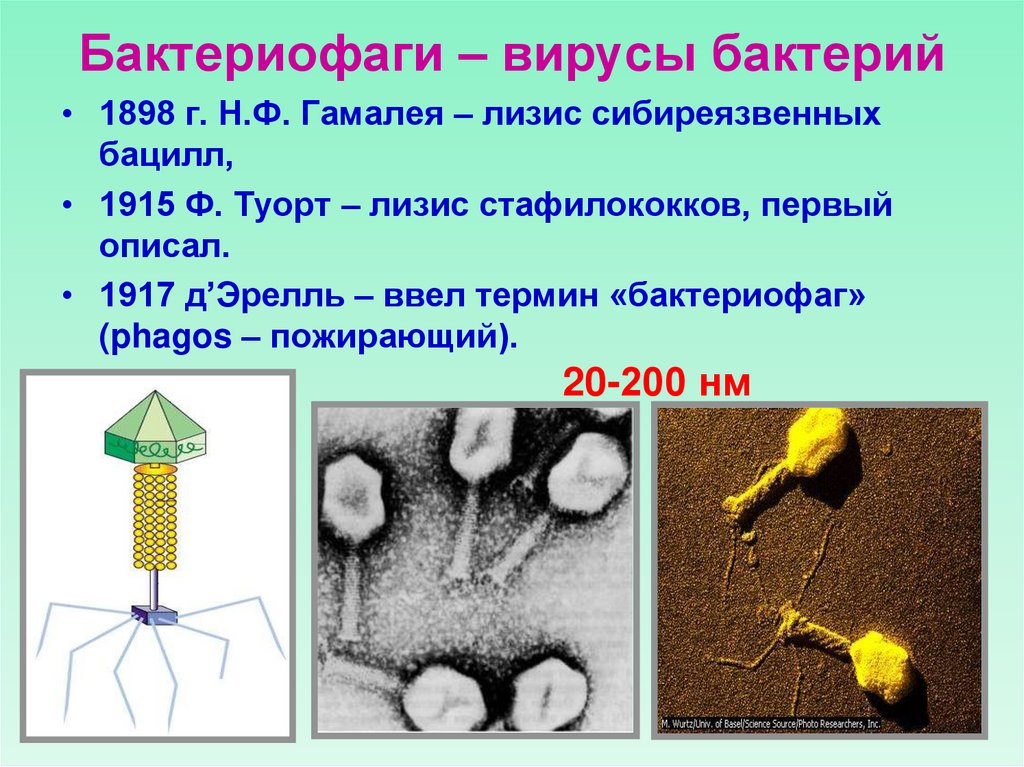
 Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]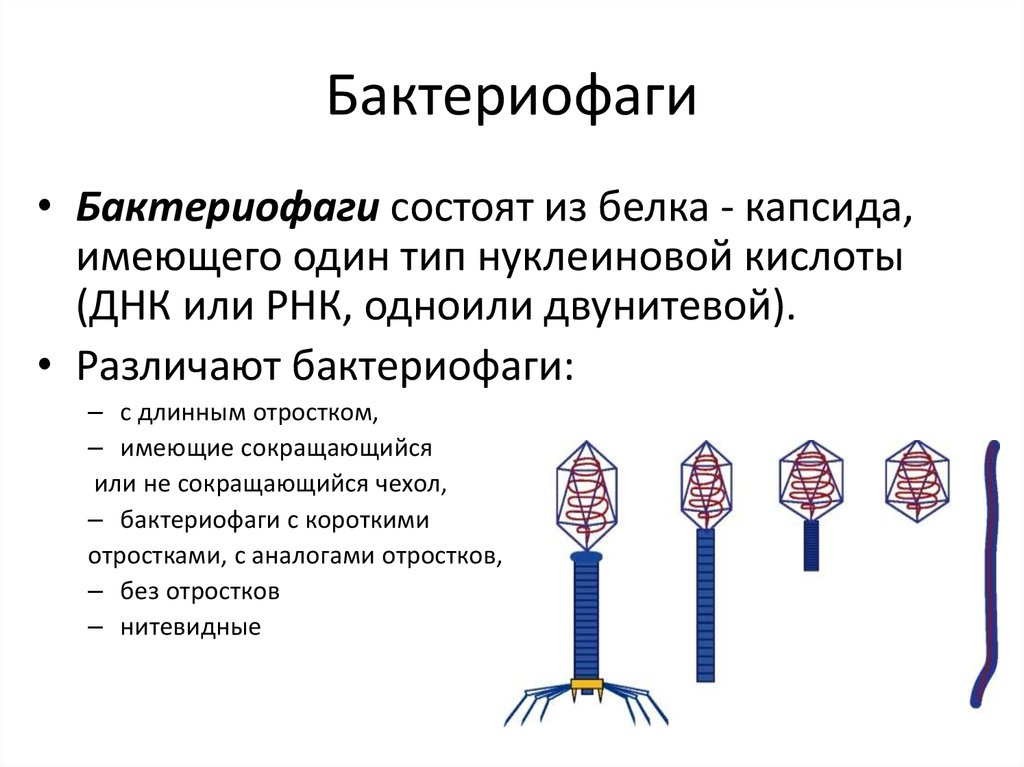 Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
 CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]