Содержание
Вирусы против бактерий
Бактериофаги – одни из самых загадочных препаратов аптечного ассортимента. Сейчас они переживают второе рождение – и в нашей стране, и за рубежом снова возник к ним интерес, в журналах появляется не только пересмотр старых результатов, но и масса новых публикаций. Что можно рассказать покупателю, который заинтересовался именно этими средствами?
Вехи истории
Ученые обнаруживали следы жизнедеятельности бактериофагов задолго до того, как возникла вирусология. Британский бактериолог Эрнест Ханкин еще в 1896 году обратил внимание, что некий агент, способный проходить через очень тонкий фарфоровый фильтр, убивает возбудителя холеры. Развитию науки в новом направлении помешала Первая мировая, поскольку финансирование было перенаправлено разработчикам боевых газов, взрывчатых веществ и других более актуальных вещей.
Первооткрывателями бактериофагов считаются два исследователя – британский бактериолог Фредерик Творт, описавший странный фильтрующийся агент в 1915 году, и канадский микробиолог французского происхождения Феликс Д’Эрелль, независимо от Творта сообщивший о точно такой же находке в 1917-м.

За рубежом бактериофагами интересовались в первую очередь микробиологи, так что их находки не имели прикладного значения. Очень долгое время, например, фаг считался не вирусом, а ферментом. В СССР работы изначально велись медиками, в Грузии в 1923 году был создан будущий Всесоюзный центр фаготерапии, собравший на пике своего расцвета коллекцию из более чем 3 тыс. образцов. Однако затем и у нас, и за рубежом дело фаготерапии было практически уничтожено появившимися антибиотиками. Их массовое распространение после Второй мировой создавало впечатление, что изобретена панацея против инфекций и остальные направления исследований – тупиковые.
О бактериофагах ученые вспомнили, когда перед ними в полный рост встала проблема антибиотикорезистентности. Вирусы снова стали объектом экспериментов, в них увидели реальную альтернативу морально и иногда даже физически устаревшим противомикробным препаратам.
Натуральный враг
Бактериофаг, как следует хотя бы из названия, – вирус, пожирающий бактерии.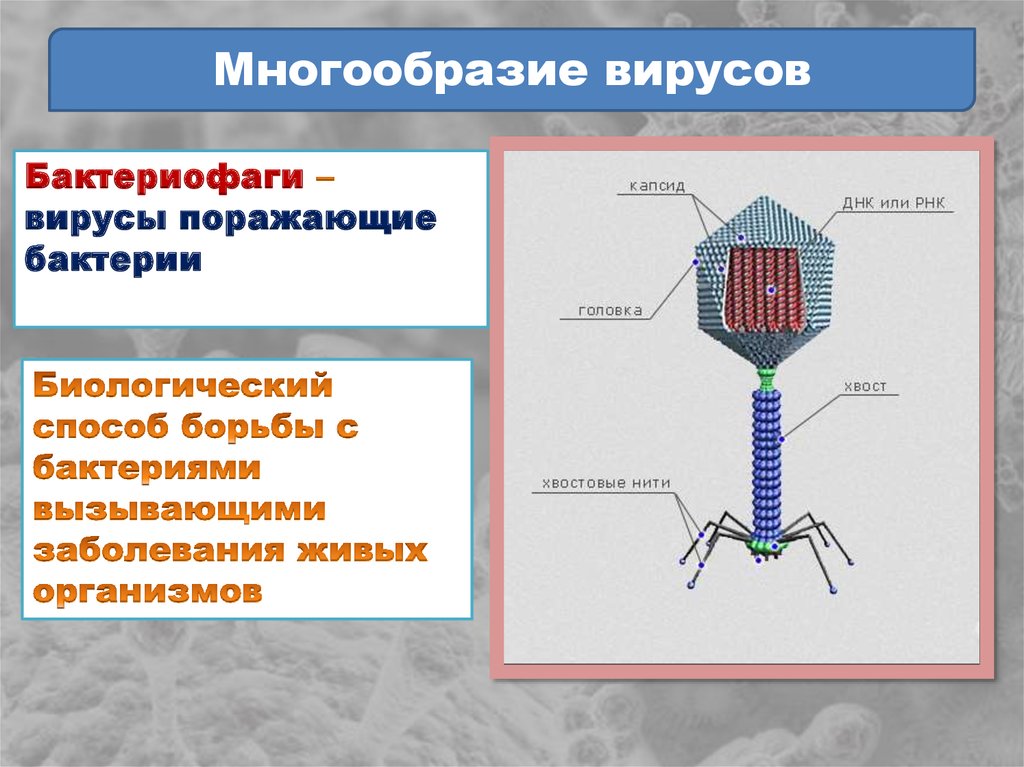 По сути, это такой «грипп бактерий», только летальные исходы случаются куда чаще, чем в человеческом варианте.
По сути, это такой «грипп бактерий», только летальные исходы случаются куда чаще, чем в человеческом варианте.
Фаги гораздо разнообразнее, чем какие-либо другие известные вирусы, нельзя сказать, что они выглядят однотипно. Чаще всего в качестве иллюстрации используется изображение вирусов группы А по классификации Бредли, она же – группа V по классификации Тихоненко. Такие вирусы устроены сложнее всего, в них имеется головка и отросток с множеством дополнительных элементов (рис. 1). Всего групп выделяют шесть, только в одной из них геном фага представлен одноцепочечной РНК, во всех остальных случаях – это одна- или двухцепочечная ДНК.
Бактериофаги нельзя назвать гигантами, но по своим размерам они, скорее, относятся к крупным и занимают промежуточное положение между самыми большими вирусами табачной мозаики и вирусом иммунодефицита человека 1-го типа (рис. 2).
Вирусы группы А (V) вводят свою ДНК в клетку-мишень очень красиво, процесс чем-то напоминает посадку исследовательского модуля на поверхность Луны или Марса – точно так же он сначала «присаживается» на «опоры», а затем прижимается к мембране бактерии своей базальной пластиной, «пробуравливает» оболочку жертвы и впрыскивает в цитоплазму свой геном.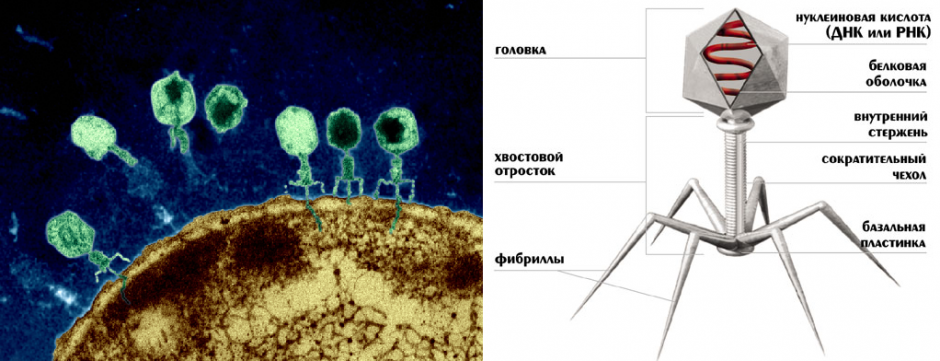 После этого бактериофаг можно считать мертвым, если так вообще можно сказать о вирусах.
После этого бактериофаг можно считать мертвым, если так вообще можно сказать о вирусах.
Быстро или помучиться?
По механизму действия все бактериофаги можно разделить на две большие группы. Первая – литические, или вирулентные фаги, которые в 100% случаев убивают инфицированную клетку сразу. В случае, показанном на рисунке 3, вирус сразу же уничтожает геном бактерии, используя его исключительно для целей собственной репликации. После наработки максимально возможного числа новых вирусных частиц микроб либо сразу гибнет в момент их выхода, просто разрываясь на части, либо погибает в ближайшее время из-за того, что все критически важные внутренние механизмы физически уничтожены.
Вторая группа – лизогенные, или умеренные фаги. Их геном встраивается в геном носителя и может существовать там в стелс-режиме долгое время, передаваясь из поколения в поколение. Активируется эта «бомба с замедленным действием» под влиянием различных неблагоприятных внешних факторов вроде дефицита питательных веществ.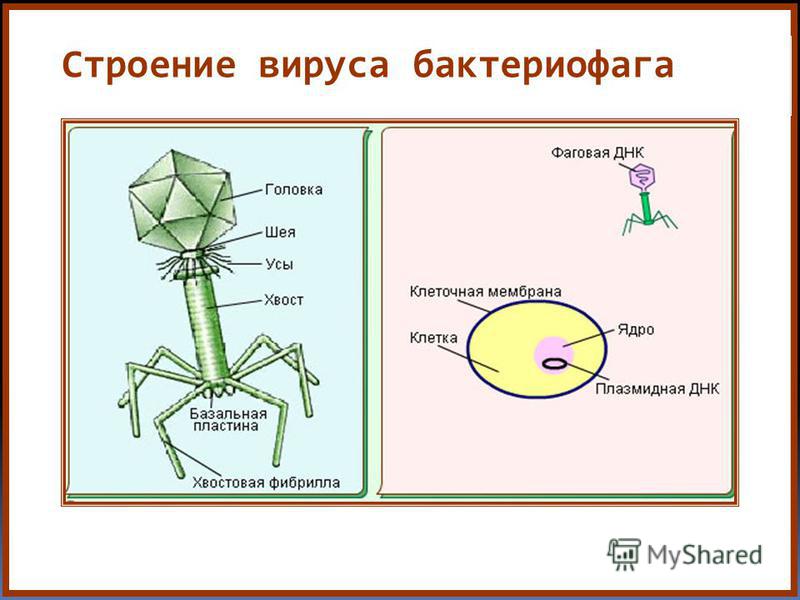 Единичные фаги умеют сочетать оба варианта, отпочковываясь и не разрушая бактериальную клетку сразу, лишь используя часть ее мембраны в качестве оболочки, одновременно оставляя «закладку» в ее геноме. На одного микроба могут напасть сразу несколько фагов с разными механизмами взаимодействия.
Единичные фаги умеют сочетать оба варианта, отпочковываясь и не разрушая бактериальную клетку сразу, лишь используя часть ее мембраны в качестве оболочки, одновременно оставляя «закладку» в ее геноме. На одного микроба могут напасть сразу несколько фагов с разными механизмами взаимодействия.
Плюсы и минусы
К несомненным достоинствам фагов можно отнести их прицельность, они специализируются на конкретных видах бактерий, так что можно отобрать именно те вирусы, которые уничтожают только патогенную флору, в отличие от антибиотиков, «бьющих по площадям», не разбирая при этом, свой или чужой попадает под обстрел.
По той же причине у фагов либо меньше побочных эффектов, либо их совсем нет. С резистентностью история схожая, она если и развивается, то только у конкретной бактерии-мишени. С помощью генной инженерии реально перепрограммировать вирус и натравить его на какого-нибудь другого возбудителя, еще не знакомого с вирусом.
Немаловажным фактором в пользу бактериофагов можно считать дешевизну и простоту их производства, особенно по сравнению с новыми перспективными антибиотиками. Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Недостатки тоже есть, и они тесно связаны с вирусной природой фагов. Прежде всего, их сложно хранить и перевозить, они весьма требовательны к условиям содержания. Кроме того, фаги способны нападать только на свободно плавающие бактерии, внутрь человеческих клеток их никто не пустит. Агрессивная среда желудка уничтожает многие вирусы, не разбирая, кто пришел с миром, а кто нет. И главное, для достижения максимального эффекта терапии бактерию-возбудителя нужно фаготипировать, то есть выделить и в лабораторных условиях доказать, что против нее может быть применен вот этот конкретный вирус.
Тем не менее фаги остаются перспективным направлением разработок, особенно после открытия канадского биолога Джозефа Бонди-Деноми, работающего в Калифорнийском университете. Он обнаружил новый вирус, прицельно уничтожающий синегнойную палочку, к которому устойчивость не развивалась. Изучая феномен, ученый выяснил, что ДНК этого фага защищена белковой оболочкой, с которой не справляется иммунитет бактерии.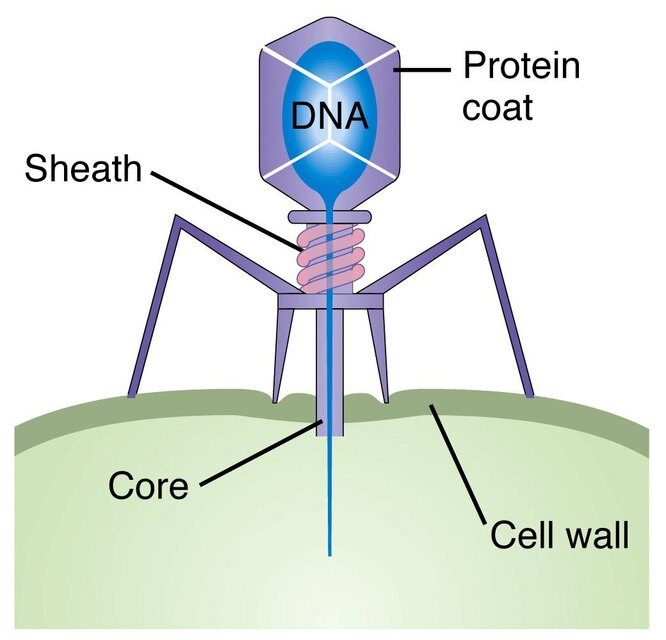 Если такой «чехол» надевать на все остальные ДНК и РНК бактериофагов, они могут стать еще более грозным оружием для своих естественных врагов. Главное, чтобы на человека не переключились.
Если такой «чехол» надевать на все остальные ДНК и РНК бактериофагов, они могут стать еще более грозным оружием для своих естественных врагов. Главное, чтобы на человека не переключились.
Факты
В СССР активно изучали медицинское применение бактериофагов, но публикации были либо на русском, либо на грузинском языках, поэтому мировая наука о них не знала и с удивлением изучает и цитирует их уже в наше время.
Работы по бактериофагам удостоены Нобелевской премии. В 1969 году она была присуждена американским исследователям Максу Дельбрюку, Альфреду Херши и Сальвадору Лурия за открытия, касающиеся механизма репликации и генетической структуры вирусов.
В ГРЛС зарегистрированы и обращаются на российском рынке следующие разновидности бактериофагов: брюшнотифозный, дизентерийный, против клебсиелл и отдельно – против клебсиеллы пневмонии, против кишечной палочки, протейный, сальмонеллезный, стафилококковый и против синегнойной палочки. Самый часто используемый в амбулаторной практике препарат – стафилококковый фаг.
1. Keen E.C. Phage Therapy: Concept to Cure // Frontiers in Microbiology. 2012. 3: 238. doi: 10.3389/fmicb.2012.00238. 2. Keen E.C. Tradeoffs in bacteriophage life histories // Bacteriophage. 2014. 4 (1): e28365. doi: 10.4161/bact.28365. 3. Kutter Elizabeth et al. (2010). Phage Therapy in Clinical Practice: Treatment of Human Infections // Current Pharmaceutical Biotechnology. 11 (1): 69–86. doi: 10.2174/138920110790725401. 4. McGrath S. and van Sinderen D. (editors). Bacteriophage: Genetics and Molecular Biology (1st ed.). Caister Academic Press. 2007. ISBN 978-1-904455-14-1. 5. Stineke van Houte et al. The diversity-generating benefits of a prokaryotic adaptive immune system // Nature. 2016. DOI: 10.1038/nature17436. 6. Поздеев О.К., Федорова Е.Р., Валеева Ю.В. Микробиология. Бактериофаги/Учебно-методическое пособие для студентов медицинских вузов. Казань, 2012.
Алексей Водовозов
Журнал «Российские аптеки» №1-2, 2020
Вам могут понравиться другие статьи:
Подробности
Деликатный подход
Отшелушивание кожи – важный этап ухода за собой, однако достаточно агрессивные абразивные скрабы или кислотные пилинги не всегда подходят.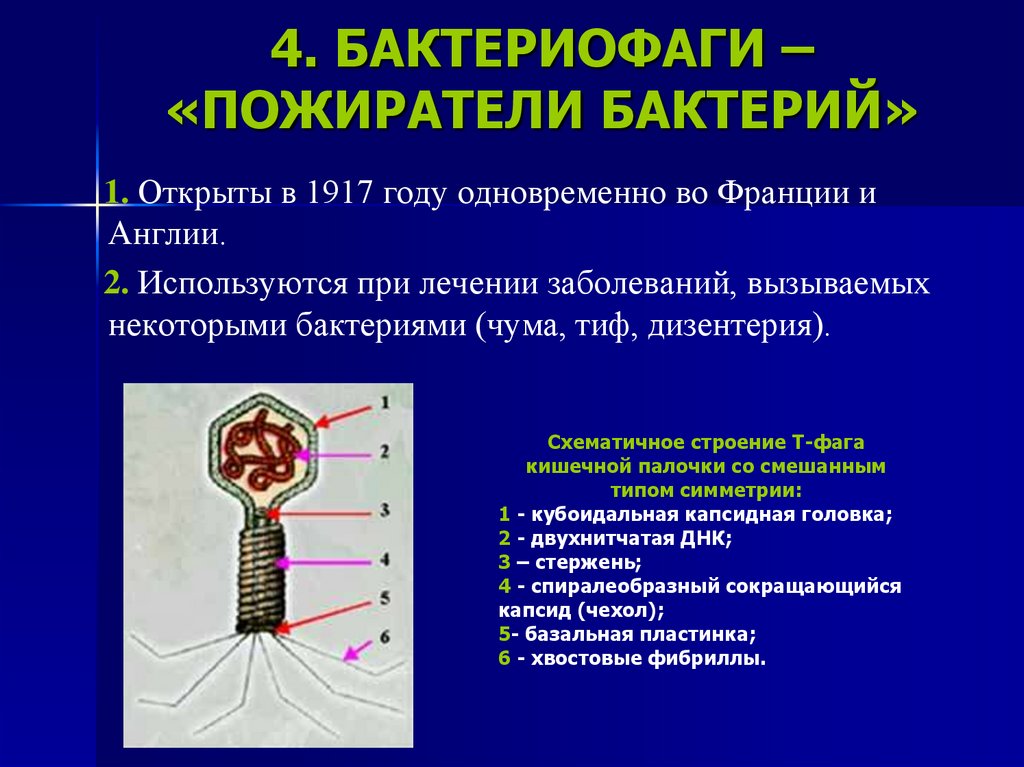 На помощь приходят средства-эксфолианты на …
На помощь приходят средства-эксфолианты на …
Подробнее
Подробности
Поросячье будущее трансплантологии
По СМИ пробежала сенсация: органы свиньи удалось оживить спустя некоторое время после смерти. «Свиных» новостей в последнее время очень много, и это неспроста: похоже, что в ближайшем будущем д…
Подробнее
Подробности
Лекарство – дело персональное
Испытания новых препаратов позволяют лишь частично оценить их эффективность, безопасность, экономическую целесообразность, а также выявить проблемы с совместимостью. И все оттого, что они не уч…
Подробнее
Подробности
Ловим естественный свет
Одним из важных средств профилактики сезонного аффективного расстройства признана домашняя фототерапия.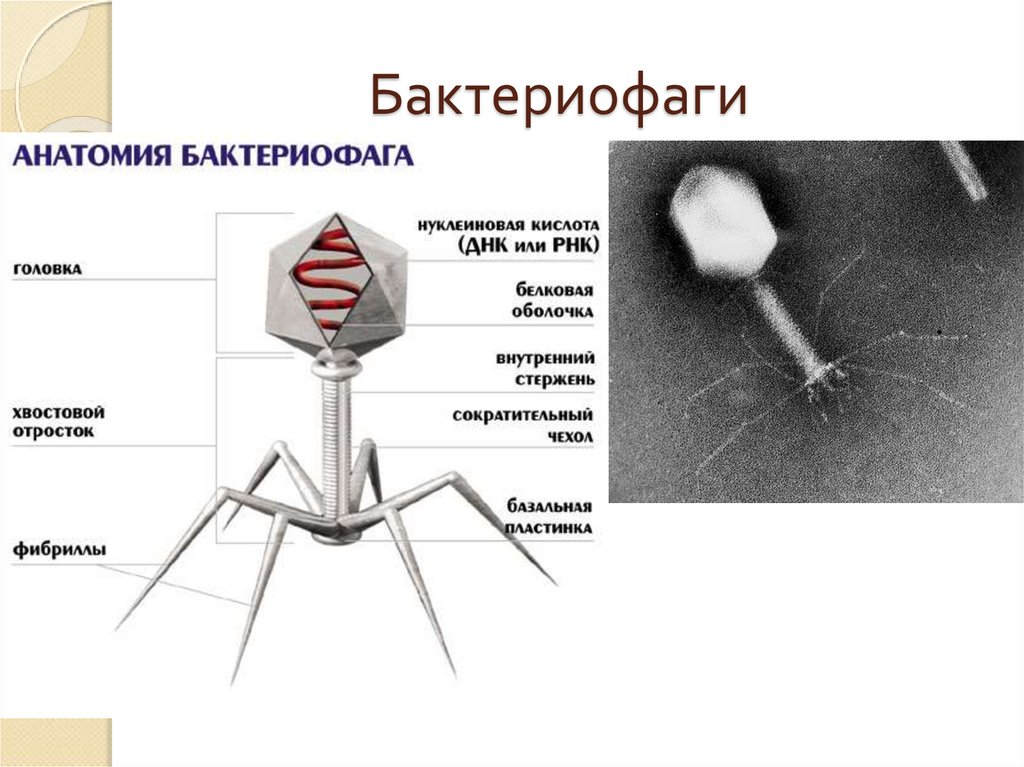 Для ее проведения может потребоваться устройство белого света, дающее освещенность в 10 тыс. …
Для ее проведения может потребоваться устройство белого света, дающее освещенность в 10 тыс. …
Подробнее
Подробности
Время пробовать новое
Не секрет, что по большому счету средства для ухода за кожей и волосами нужно обновлять каждый сезон. Во-первых, уходовая косметика должна учитывать погодные условия.
Подробнее
Подробности
И станет светлее
Осень – время восстановления кожи, в том числе и выравнивания тона, поскольку нередко после лета появляется пигментация. Бороться с последствиями ультрафиолетового воздействия помогут косметические…
Подробнее
У бактерий нашли дополнительные белки для борьбы с вирусами и бактериофагами
Группа ученых из Массачусетского технологического института обнаружила у прокариот белки иммунной системы, которые могут детектировать не только вирусную ДНК, но и белки бактериофага. Такие белки одним участком распознают патоген, а после этого в них активируется фрагмент, который вызывает воспалительный ответ. Подобные иммунные системы известны во всех царствах живых организмов, но в бактериях их обнаружили впервые. Исследование опубликовано в журнале Science.
Такие белки одним участком распознают патоген, а после этого в них активируется фрагмент, который вызывает воспалительный ответ. Подобные иммунные системы известны во всех царствах живых организмов, но в бактериях их обнаружили впервые. Исследование опубликовано в журнале Science.
Борьба организмов с вирусами — это постоянная гонка вооружений. Чтобы эффективно сражаться с инфекцией нужен не один защитный механизм. В бактериях уже находили такие системы как CRISPR/Cas. Они уничтожают бактериофаг, обнаружив лишь небольшой участок его генома. Ученые считают, что у бактерий можно обнаружить еще множество способов избавиться от опасного вируса.
В иммунной системе эукариот давно известны NLR-рецепторы (NOD-like receptors) — ключевые игроки противовирусного ответа. Эти рецепторы состоят из трех участков: центрального, C-концевого, который отвечает за распознавание вируса, и N-концевого — вызывающего воспаление. NLR-белки реагируют на многие вирусные фрагменты: пептидогликаны из вирусной клеточной стенки, вирусную РНК или белки хозяина, измененные патогеном.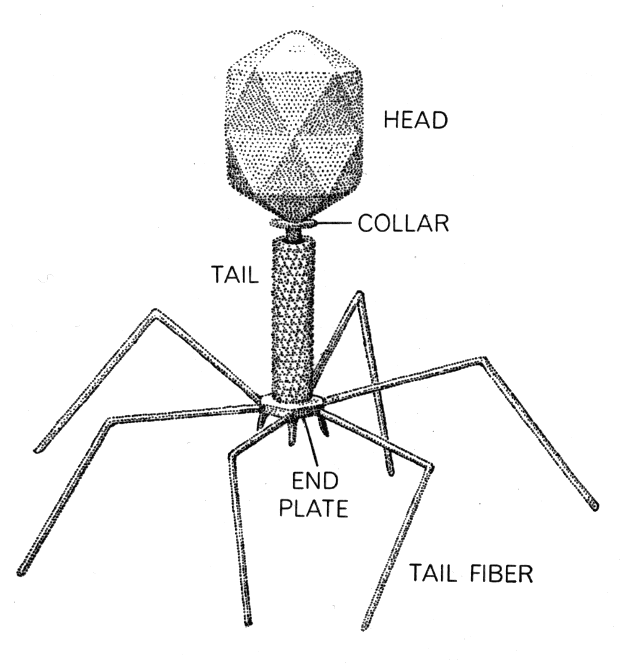 В геноме бактерий тоже находили последовательности, кодирующие подобные рецепторы и они получили название Avs NLR-рецепторы. Однако до сих пор не было известно, как именно работает эта иммунная защита.
В геноме бактерий тоже находили последовательности, кодирующие подобные рецепторы и они получили название Avs NLR-рецепторы. Однако до сих пор не было известно, как именно работает эта иммунная защита.
Группа исследователей из Массачусетского технологического института под руководством Линьи Алекса Гао (Linyi Alex Gao) и Фэня Чжана (Feng Zhang) в предыдущей работе изучила последовательности ДНК сотен тысяч бактерий и архей и выявила гены, кодирующие Avs NLR-рецепторы. В новом исследовании ученые сосредоточились на нескольких таких генах и их механизме действия: SeAvs3 из Salmonella enterica и EcAvs4 из Escherichia coli. Для обоих белков показана противовирусная активность в отношении фага PhiV-1, но неизвестно, как именно вирус активирует Avs белки.
Последовательность фага PhiV-1 клонировали и доставили в клетки E. coli. Предполагалось, что совместная экспрессия белков Avs и их возможных вирусных триггеров приведет к разрушению вирусной ДНК. В присутствии рецепторов Avs деградировала та вирусная ДНК, которая кодировала большую субъединицу вирусной терминазы (gp19) и структурный белок gp8.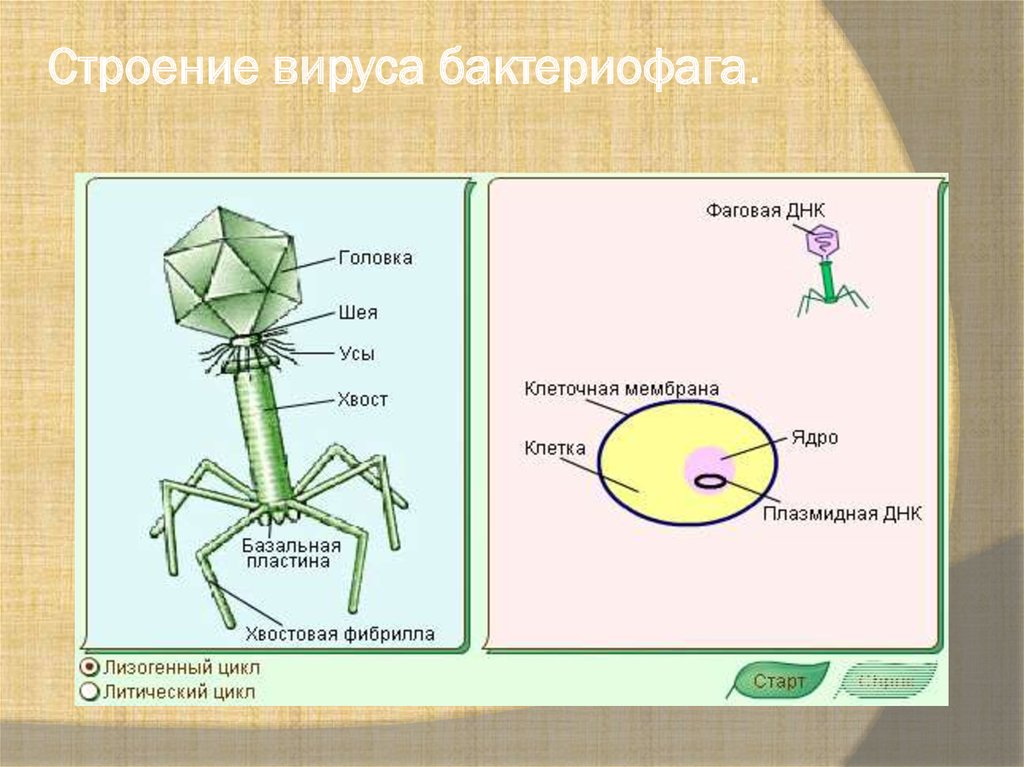 Выяснилось, что белки SeAvs3 и EcAvs4 работали как нуклеазы и уничтожали вирусную ДНК.
Выяснилось, что белки SeAvs3 и EcAvs4 работали как нуклеазы и уничтожали вирусную ДНК.
Также оказалось, что рецепторы SeAvs3 и EcAvs4 распознают широкий спектр вирусных белков. Например, они уничтожали непосредственно протеины gp19 и gp8, а не только фрагменты ДНК, которая их кодирует. Протеины Avs реагировали не на пептидную последовательность, а на особенности третичной структуры белков, поскольку в исследовании изучались терминазы с идентичностью последовательности менее 5 процентов, но каждая из них активировала рецепторы Avs.
С помощью криоэлектронной микроскопии ученые определили структуры комплексов «Avs-фаговый белок» и показали, что Avs образуют тетрамеры, в которых С-концевой домен связывается с одним белком-мишенью.
Обнаруженная иммунная система на основе NLR-рецепторов подчеркивает сходство между защитными стратегиями прокариот и эукариот и расширяет представления о распознавании патоген-специфических белков в царстве бактерий. Однако вирусы и бактериофаги не уступают в гонке вооружений и изобретают новые пути обхода иммунной системы клеток хозяев.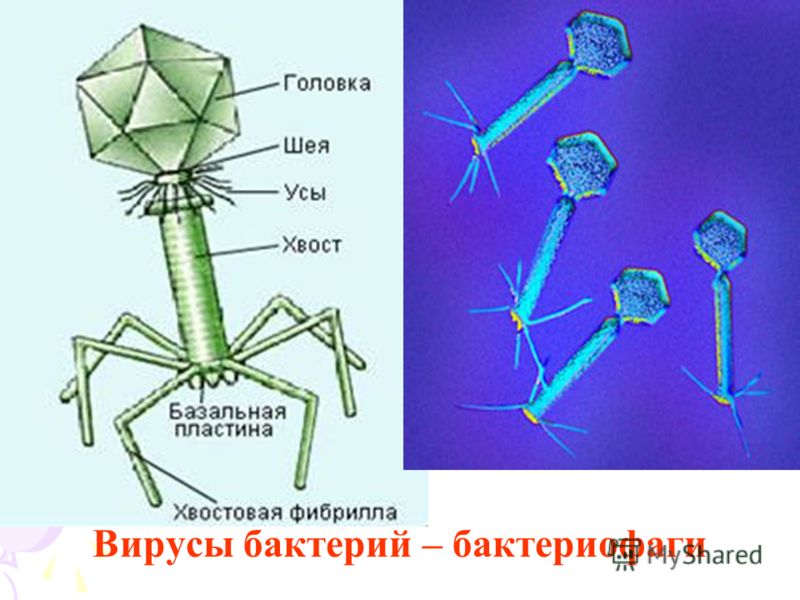 Ранее мы рассказывали, как бактериофаг справляется с иммунитетом бактерий, подавляя активность CRISPR.
Ранее мы рассказывали, как бактериофаг справляется с иммунитетом бактерий, подавляя активность CRISPR.
Ирина Грищенко
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Вирусы — и злодеи, и герои жизни, какой мы ее знаем
- Открытие
Опубликовано: 20 октября 2021 г.
(Бактериофаг)
Иван Эрилл, доцент кафедры биологических наук, UMBC
Вирусы имеют плохую репутацию. Они несут ответственность за пандемию COVID-19 и длинный список болезней , которые преследуют человечество с незапамятных времен. Есть ли что-то, что можно отпраздновать в их честь?
Многие биологи, такие как я, считают, что существует, по крайней мере, один конкретный тип вируса, а именно бактериофаги или вирусы, поражающие бактерии. Когда ДНК этих вирусов захватывается клеткой, она может содержать инструкции, позволяющие этой клетке выполнять новые трюки.
Могучая сила бактериального вируса
Бактериофаги, или сокращенно фаги, контролируют популяции бактерий как на суше, так и на море.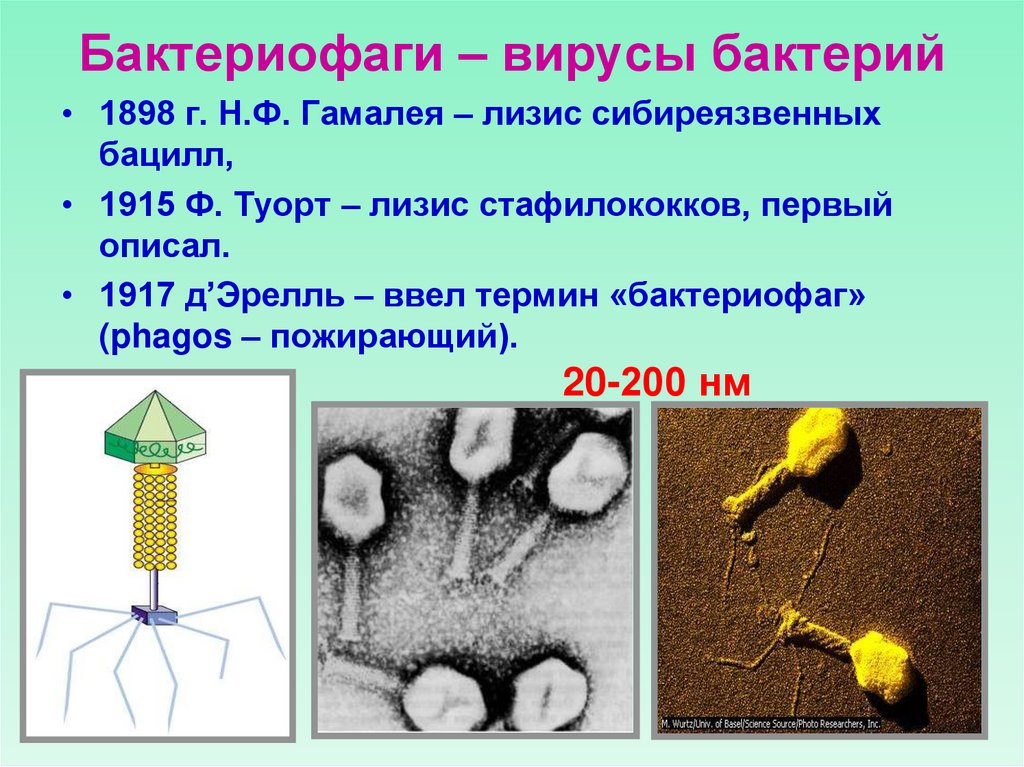 Они убивают до 40 % океанских бактерий каждый день, помогая контролировать бактериальное цветение и перераспределение органического вещества. Бактериофаги — это вирусы, убивающие определенные типы бактерий.
Они убивают до 40 % океанских бактерий каждый день, помогая контролировать бактериальное цветение и перераспределение органического вещества. Бактериофаги — это вирусы, убивающие определенные типы бактерий.
Их способность избирательно убивать бактерии также приводит врачей в восторг. Природные и искусственные фаги успешно использовались для лечения бактериальных инфекций , которые не реагируют на антибиотики. Этот процесс, известный как фаговая терапия, может помочь в борьбе с устойчивостью к антибиотикам.
Недавние исследования указывают на еще одну важную функцию фагов: они могут быть лучшими генетическими мастерами природы, создающими новые гены, которые клетки могут перенастроить для получения новых функций.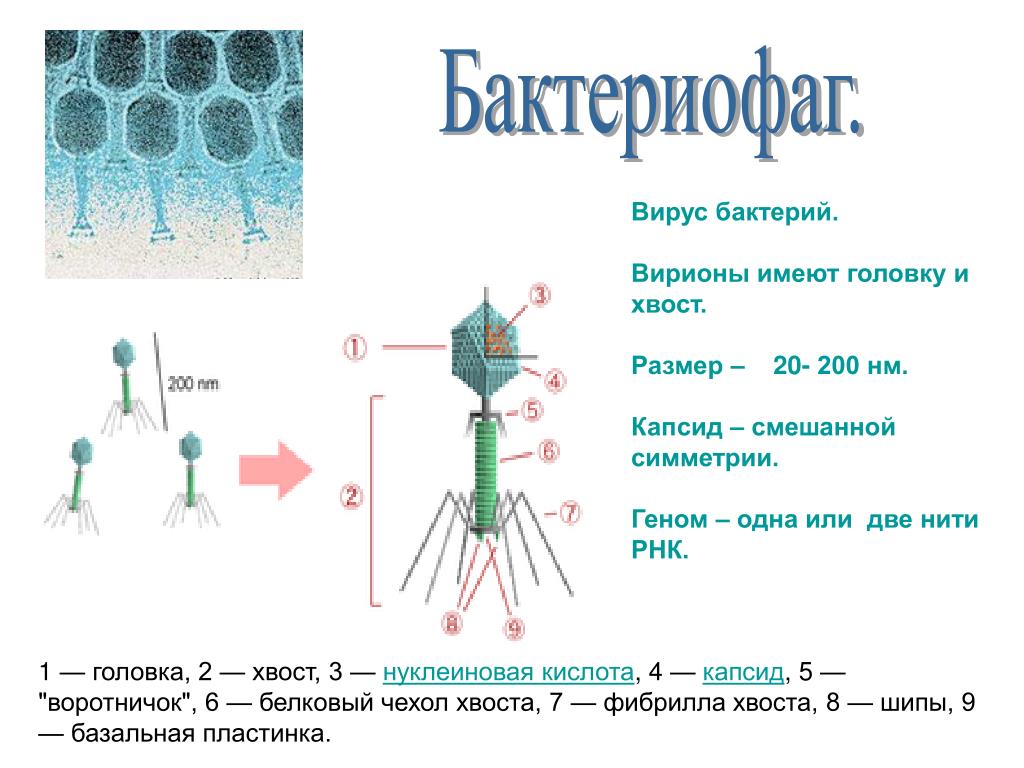
Каспиды бактериофагов могут нести дополнительную ДНК, с которой вирус может возиться. Кристина Дукарт/iStock через Getty Images Plus
Фаги — самая распространенная форма жизни на планете, и их нониллион — это единица с 31 нулем после нее — в любой момент летает по всему миру. Как и все вирусы, фаги также имеют высокую скорость репликации и мутации, что означает, что они образуют множество вариантов с разными характеристиками каждый раз, когда они размножаются.
Большинство фагов имеют твердую оболочку, называемую капсидом, заполненную их генетическим материалом. Во многих случаях в оболочке больше места, чем нужно фагу для хранения ДНК, необходимой для его репликации. Это означает, что у фагов есть место для дополнительного генетического багажа: генов, которые на самом деле не нужны фагу для выживания, и которые он может модифицировать по своему желанию.
Как бактерии переоборудовали вирусный переключатель
Чтобы увидеть, как это работает, давайте более подробно рассмотрим жизненный цикл фага.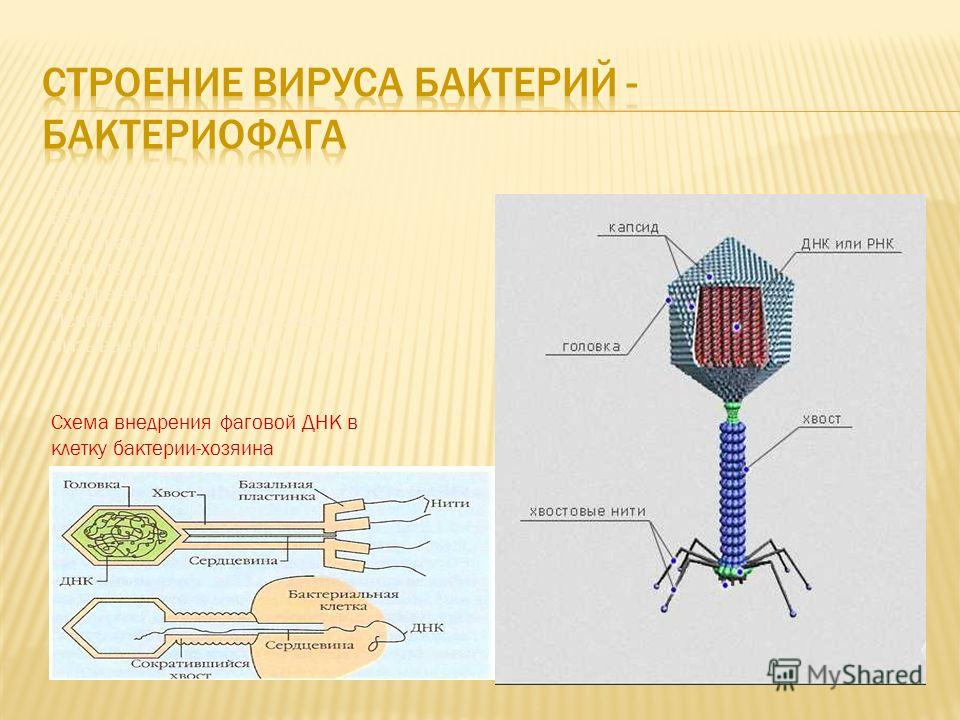
Фаги бывают двух основных видов: умеренные и вирулентные. Вирулентные фаги, как и многие другие вирусы, действуют по программе «внедрение-реплицирование-убийство». Они проникают в клетку, захватывают ее компоненты, копируют себя и вырываются наружу.
Умеренные фаги, напротив, ведут долгую игру. Они сливают свою ДНК с клеточной и могут бездействовать годами, пока что-то не вызовет их активацию. Затем они возвращаются к вирулентному поведению: размножаются и взрываются.
Многие умеренные фаги используют повреждение ДНК в качестве триггера. Это своего рода сигнал «Хьюстон, у нас проблема». Если ДНК клетки повреждена, это означает, что ДНК резидентного фага, скорее всего, пойдет дальше, поэтому фаг мудро решает покинуть корабль. Гены, которые направляют фаги к репликации и взрыву, отключаются, если не обнаружено повреждение ДНК.
Вирулентные фаги следуют литическому циклу размножения вируса, уничтожая своих хозяев, как только завершают репликацию. Умеренные фаги, с другой стороны, следуют лизогенному циклу и остаются бездействующими внутри ДНК своего хозяина до тех пор, пока они не вырвутся наружу. CNX OpenStax/Wikimedia Commons, CC BY
CNX OpenStax/Wikimedia Commons, CC BY
Бактерии переоборудовали механизмы, контролирующие этот жизненный цикл, для создания сложной генетической системы, которую я и мои сотрудники изучаем более двух десятилетий.
Бактериальные клетки также заинтересованы в том, чтобы узнать, разрушается ли их ДНК. Если это так, они активируют набор генов, которые пытаются восстановить ДНК. Это известно как бактериальный ответ SOS, потому что, если он не работает, клетка погибает. Бактерии организуют ответ SOS с помощью белка-переключателя, который реагирует на повреждение ДНК: он включается, если есть повреждение, и остается выключенным, если его нет.
Возможно, неудивительно, что бактериальные и фаговые переключатели эволюционно связаны. Возникает вопрос: кто изобрел переключатель, бактерии или вирусы?
Наши предыдущие исследования и работы других исследователей показывают, что фаги появились первыми. В нашем недавнем отчете мы обнаружили, что SOS-ответ Bacteroidetes , группы бактерий, которая составляет до половины бактерий, живущих в вашем кишечнике, находится под контролем фагового переключателя, который был перенастроен для реализации собственного комплекса бактерий. генетические программы. Это говорит о том, что бактериальные SOS-переключатели на самом деле являются фаговыми переключателями, переоснащенными много тысячелетий назад.
генетические программы. Это говорит о том, что бактериальные SOS-переключатели на самом деле являются фаговыми переключателями, переоснащенными много тысячелетий назад.
Когда умеренный фаг заражает бактериальную клетку и интегрирует свой геном с клеточной ДНК, он обычно бездействует до тех пор, пока не вырвется из клетки. Но как только ДНК фага становится частью ДНК бактерии, мутации могут разрушить генетический материал фага и сделать его неактивным. Это означает, что при повреждении ДНК фаг не сможет восстановиться и вырвется наружу. Со временем бактерия может адаптировать переключатель фага, чтобы контролировать свои собственные гены ответа SOS. Микель Санчес-Осуна/Создано с помощью BioRender.com, CC BY-NC-ND
Не только бактериальные переключатели кажутся изобретениями фагов. Прекрасная детективная работа показала, что бактериальный ген, необходимый для деления клеток, также возник в результате «одомашнивания» гена фагового токсина. Известно или предполагается, что многие бактериальные атакующие системы, такие как токсины и генетические пушки, используемые для их введения в клетки, а также маскировка, которую они используют для уклонения от иммунной системы, имеют фаговое происхождение.
Положительная сторона вирусов
Хорошо, вы можете подумать, что фаги — это здорово, но вирусы, которые нас заражают, определенно не крутые. Тем не менее появляется все больше свидетельств того, что вирусы, поражающие растения и животных, также являются основным источником генетических инноваций в этих организмах. Например, было показано, что одомашненные вирусные гены играют ключевую роль в эволюции плаценты млекопитающих и в поддержании влажности кожи человека.
Недавние данные свидетельствуют о том, что даже ядро клетки, в котором находится ДНК, также могло быть изобретением вируса. Исследователи также предположили, что предки современных вирусов, возможно, первыми использовали ДНК в качестве основной молекулы для жизни. Не маленький подвиг.
Итак, хотя вы, возможно, привыкли думать о вирусах как о типичных злодеях, они, возможно, являются природными источниками генетических инноваций. Люди, вероятно, здесь сегодня из-за них.
*****
Иван Эрилл, адъюнкт-профессор биологических наук, Мэрилендский университет, округ Балтимор
Эта статья перепечатана из The Conversation под лицензией Creative Commons. Прочитайте оригинальную статью.
Прочитайте оригинальную статью.
Заглавное изображение: Бактериофаги — это вирусы, поражающие бактерии и играющие потенциальную роль в эволюции жизни. НАНОКЛАСТЕРИЗАЦИЯ/НАУЧНАЯ ФОТОБИБЛИОТЕКА/Научная фотобиблиотека через Getty Images
Теги: Биологические науки, CNMS, Professorsnottomiss, The Conversation
Поделись этой историей
История о хвосте — ScienceDaily
Новости науки
от исследовательских организаций
- Дата:
- 18 мая 2016 г.
- Источник:
- Федеральная политехническая школа Лозанны
- Резюме:
- Бактериофаги — вирусы, поражающие бактерии. Используя самые современные инструменты, ученые описали «хвост» из миллиона атомов, который бактериофаги используют для разрушения бактериальных поверхностей. Прорыв имеет большое значение для науки и медицины, поскольку бактериофаги широко используются в исследованиях.
- Поделиться:
ПОЛНАЯ ИСТОРИЯ
Бактериофаги — это вирусы, поражающие бактерии.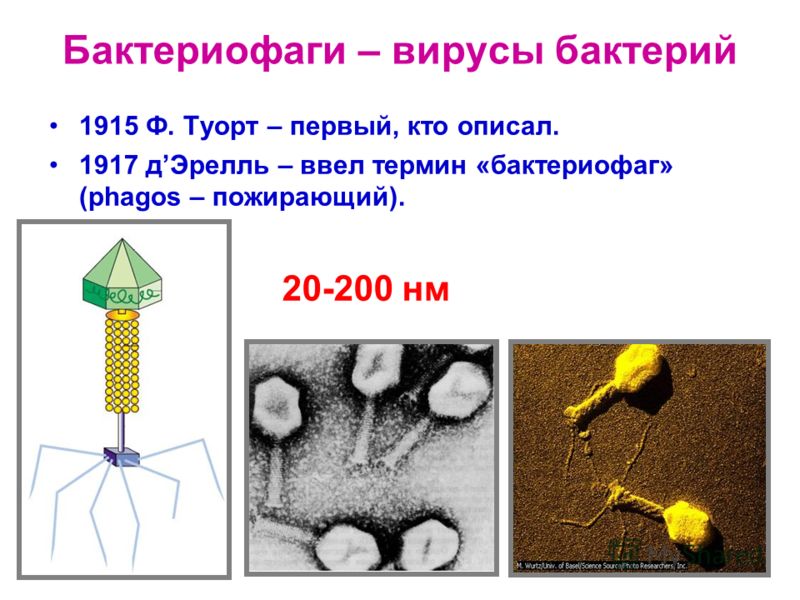 Используя самые современные инструменты, ученые EPFL описали «хвост» из миллиона атомов, который бактериофаги используют для разрушения бактериальных поверхностей. Прорыв имеет большое значение для науки и медицины, поскольку бактериофаги широко используются в исследованиях.
Используя самые современные инструменты, ученые EPFL описали «хвост» из миллиона атомов, который бактериофаги используют для разрушения бактериальных поверхностей. Прорыв имеет большое значение для науки и медицины, поскольку бактериофаги широко используются в исследованиях.
реклама
Для заражения бактерий большинство бактериофагов используют «хвост», который протыкает мембрану бактерии, позволяя генетическому материалу вируса пройти сквозь нее. Самые сложные хвосты состоят из сократительной оболочки, окружающей трубку, наподобие растянутой спиральной пружины на наноуровне. Когда вирус прикрепляется к поверхности бактерии, оболочка сжимается и проталкивает трубку через нее. Все это контролируется базисной пластиной из миллиона атомов на конце хвоста. Ученые EPFL теперь показали в атомных деталях, как базовая пластинка координирует прикрепление вируса к бактерии с сокращением оболочки хвоста. Прорыв совершила обложка Nature и имеет важное значение для науки и медицины.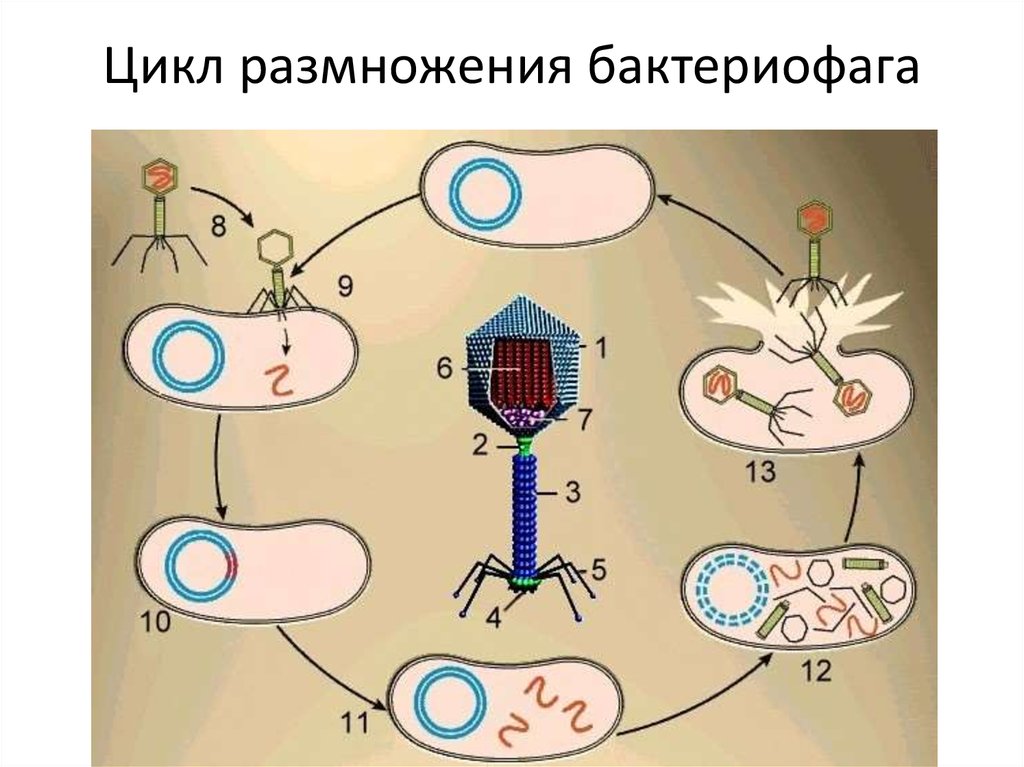
Фаги широко распространены на планете. Они сопровождают бактерии повсюду — в почве, воде, горячих источниках, цветении водорослей, кишечнике животных и т. д. — и оказывают существенное влияние на разнообразие бактериальных популяций, включая, например, микробиом кишечника человека. Фаги также являются незаменимыми инструментами в генетике и молекулярной биологии и даже разрабатываются в качестве альтернативы антибиотикам. Однако механизмы, с помощью которых эти вирусы прикрепляются к своим клеткам-хозяевам и доставляют свой генетический материал, остаются плохо изученными.
Лаборатория Петра Леймана в EPFL создала подробную модель трансформации базовой пластинки фага на уровне атомов, важную структуру, которая контролирует способность фага находить бактерию-мишень и прикрепляться к ней, сокращать свой хвост и ввести его ДНК. Весь комплекс базальная пластинка-хвост-трубка состоит из одного миллиона атомов, составляющих 145 цепочек из 15 различных белков, большинство из которых пришлось моделировать с нуля. Для этого лаборатория Леймана использовала самое современное оборудование Центра клеточной визуализации и наноаналитики (C-CINA) Базельского университета и вычислительные ресурсы отдела высокопроизводительных вычислений EPFL.
Для этого лаборатория Леймана использовала самое современное оборудование Центра клеточной визуализации и наноаналитики (C-CINA) Базельского университета и вычислительные ресурсы отдела высокопроизводительных вычислений EPFL.
Ученые также смогли идентифицировать минимальный набор молекулярных компонентов в базовой пластине, которые работают вместе, как миниатюрные шестеренки, контролируя активность хвоста вируса. Эти компоненты и лежащий в их основе функциональный механизм одинаковы для многих вирусов и даже бактерий, которые используют сходные хвостообразные структуры для введения токсинов в соседние клетки.
«Эти результаты важны для нашего понимания того, как работают эти сократительные хвостоподобные системы», — говорит Лейман. «Но они также устанавливают точку отсчета сложности биологических систем, которые можно описать на атомном уровне». Человеческое тело содержит почти столько же бактерий, сколько человеческих клеток (30-40 триллионов), и микробиота кишечника человека, вероятно, станет важной мишенью для персонализированной медицины в будущем. «Понятно, что нам нужно понять подробные механизмы, с помощью которых эти бактерии взаимодействуют друг с другом, и то, как фаги участвуют в этих взаимодействиях».
«Понятно, что нам нужно понять подробные механизмы, с помощью которых эти бактерии взаимодействуют друг с другом, и то, как фаги участвуют в этих взаимодействиях».
изменить мир к лучшему: спонсируемая возможность
Источник истории:
Материалы предоставлены Федеральной политехнической школой Лозанны . Примечание. Содержимое можно редактировать по стилю и длине.
Ссылка на журнал :
- Николас М. И. Тейлор, Николай С. Прохоров, Рикардо С. Герреро-Феррейра, Михаил М. Шнайдер, Кристофер Браунинг, Кеннет Н. Голди, Хеннинг Сталберг, Петр Г. Лейман. Структура базальной пластинки Т4 и ее функция в запуске сокращения интродьюсера . Природа , 2016; 533 (7603): 346 DOI: 10.1038/nature17971
Цитировать эту страницу :
- MLA
- АПА
- Чикаго
Федеральная политехническая школа Лозанны.
