Содержание
После 10 лет поисков ученые нашли второй ген «короткого сна»
3044
Добавить в закладки
Исследователи из Калифорнийского университета, которые
определили единственный (как считалось раньше) человеческий ген,
способствующий «естественному короткому сну», обнаружили второй
такой же ген – ADRB1, сообщает
пресс-служба университета. О своем открытое ученые сообщили в журнале
Neuron.
Некоторые люди пытаются заставить свой организм спать мало – с
помощью кофе, таблеток. А у некоторых есть генетическая
предрасположенность к короткому сну. Эти люди тратят на сон всего
четыре-шесть часов и высыпаются. В этом случае и говорят о
«естественном коротком сне».
До 2009 года этот тип сна оставался загадкой. Как отмечают
ученые, сон очень тяжело изучать – в том числе из-за
искусственных стимуляторов, которые позволяют людям долго не
спать. Но 10 лет назад команда Ин-Хуэй Фу (Ying-Hui Fu),
Но 10 лет назад команда Ин-Хуэй Фу (Ying-Hui Fu),
профессора неврологии из Калифорнийского университета,
обнаружила, что люди, унаследовавшие определенную мутацию в гене
под названием DEC2, в среднем спали всего 6,25 часа в сутки. А те
участники исследования, у которых не была обнаружена мутация, в
среднем спали чуть больше восьми часов. Это открытие дало первое
убедительное доказательство того, что естественный короткий сон
является – по крайней мере, в некоторых случаях
– генетическим. Но эта мутация встречается редко, поэтому
она могла объяснить лишь некоторые случаи короткого сна.
Теперь ученые нашли ещё одну причину естественного короткого сна.
Прорыв произошел, когда исследователи изучили одну семью, для
членов которой (у трех поколений!) был характерен
непродолжительный сон – меньше шести часов. Однако ни у одного из
членов семьи не была обнаружена мутация гена DEC2. Ученые
использовали метод секвенирования генома и технику, известную как
анализ сцепления генов, которая помогает точно определить
местоположение хромосомных мутаций, связанных с определенной
особенностью, чтобы проверить геном семьи. В результате они
В результате они
обнаружили однобуквенную мутацию в гене, известном как ADRB1,
которая, как и мутация в DEC2, была связан с естественным
коротким сном.
Стремясь понять, как недавно обнаруженная мутация может привести
к короткому сну, исследователи провели серию экспериментов на
выращенных в лаборатории клетках и на мышах. Эксперименты с
клетками показали, что мутантная форма адренергического рецептора
бета-1 – белка, который кодируется геном ADRB1 и играет роль во
множестве важных биологических процессов, – деградирует быстрее,
чем здоровая версия. А значит, не исключено, что и
функционировать он может по-другому. Эта догадка была
подтверждена в экспериментах на мышах.
Исследователи обнаружили, что ген ADRB1 был сильно экспрессирован
в Варолиевом мосту – отделе ствола мозга, который участвует в
регуляции сна. Ученые использовали оптогенетику, при которой
клетки модифицируются таким образом, чтобы они могли
активироваться светом, и направили свет на нейроны в мосту,
чтобы стимулировать те нейроны, в которых экспрессировался ADRB1.
Запуск этих нейронов немедленно вызвал у спящих мышей фазу сна,
во время которой эти нейроны обычно не активны, – демонстрируя,
что они способствуют бодрствованию.
Дополнительные эксперименты показали, что при мутации ADRB1
нейроны, способствующие бодрствованию, легче активируются. Кроме
того, у мышей с мутацией ADRB1 было больше нейронов,
способствующих бодрствованию, чем нейронов, способствующих сну.
При такой структуре мозг легче разбудить и он дольше бодрствует.
Хотя люди с мутацией генов DEC2 или ADRB1 спят меньше, они не
страдают от каких-либо неблагоприятных последствий для здоровья,
связанных с лишением сна. Наоборот, они более энергичны и
оптимистичны, отмечает руководитель исследования Ин-Хуэй
Фу.
[Фото: bowie15 / ru.123rf.com]
геном
гены
короткий сон
мозг
мутация генов
нейроны
сон
Источник:
www.ucsf.edu
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Биологи открыли новую группу микрохищников
19:05 / Биология
Встреча российских научных групп по работе ускорительного комплекса «Супер С-тау фабрика»
18:30 / Физика
Обнаружена ближайшая галактика со свойствами галактики из ранней Вселенной
18:00 / Астрономия
Российские ученые повысили эффективность производства успокоительных лекарств в 2,5 раза
17:47 / Медицина, Химия
Биологи обнаружили, что амилоиды участвуют в важных для сельского хозяйства взаимодействиях растений с бактериями
17:30 / Биология
Прионы дрожжей помогут понять особенности развития нейродегенеративных заболеваний
15:30 / Биология, Медицина
Небольшой светящийся белок позволяет лучше рассмотреть живые ткани
15:00 / Медицина
Ученые ЮФУ обнаружили новое семейство магнитов
14:30 / Химия
Цифровой гербарий МГУ открыт для научных онлайн-волонтеров
13:30 / Биология, Наука и общество
Разработка ученых Пермского Политеха позволит прогнозировать свойства материалов для самолетов и ракет
12:30 / Новые технологии, Физика
Памяти великого ученого. Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
Смотреть все
Мутация, которая позволяет мало спать
Подготовила
Надежда Маркина
Ученые нашли мутацию, которая снижает потребность организма в сне: это мутация в гене β1-адренергического рецептора. Счастливые ее обладатели спят на пару часов меньше, чем остальные, безо всякого вреда для себя.
Подготовила
Надежда Маркина
Сон — явление очень сложное, мы до сих пор не знаем всех биохимических и генетических путей, через которые организм получает сигнал ко сну. Не вполне знаем и то, какие механизмы определяют продолжительность сна. Хотя ранее было описано несколько генетических вариантов, влияющих на длительность сна у животных и человека, в том числе
Не вполне знаем и то, какие механизмы определяют продолжительность сна. Хотя ранее было описано несколько генетических вариантов, влияющих на длительность сна у животных и человека, в том числе
мутация гена DEC2, позволяющая людям спать по шесть часов вместо положенных восьми. Но эта мутация явно не единственная.
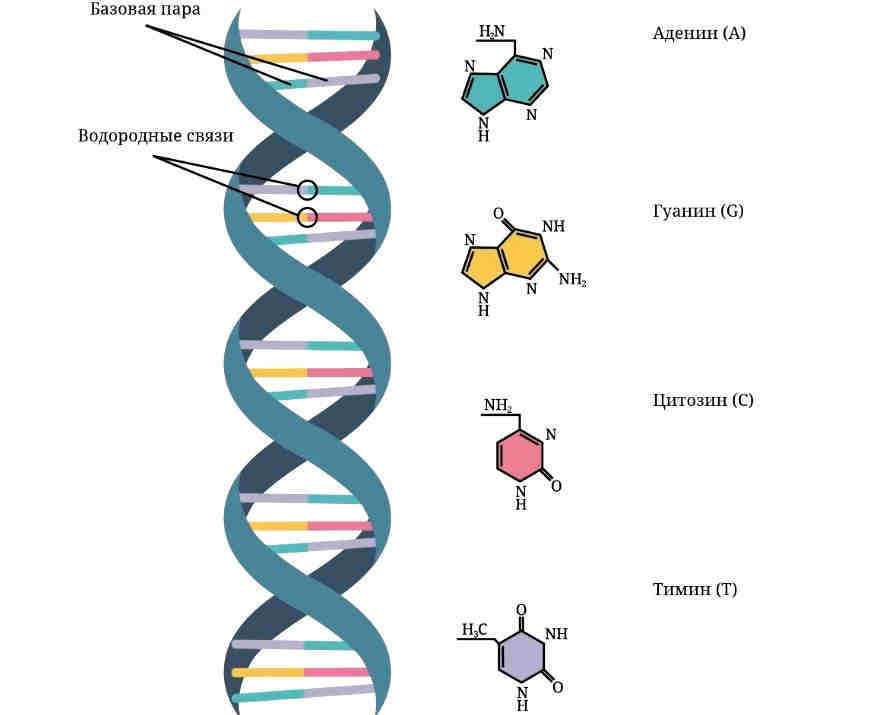
Команда исследователей из Калифорнийского университета в Сан-Франциско в поисках новых генов, влияющих на длительность сна, исследовала несколько семей, в которых наследовалась пониженная потребность в сне — способность спать на пару часов меньше, чем большинство людей. У малоспящих индивидов они обнаружили мутацию на 10-й хромосоме, в гене β1-адренорецептора (ADRB1). Мутация состояла в замене цитозина на гуанин в кодирующей последовательности, в результате чего в молекуле белка-рецептора на место аминокислоты аланина оказался валин.
β1-Адренорецептор работает в норадренергических нейронах, использующих для передачи нервного сигнала в синапсах нейромедиатор норадреналин. Давно показано, что норадренергическая система играет важную роль в регуляции сна. Различают несколько типов адренорецепторов, и если работа ɑ-адренорецепторов описана довольно подробно, то про β-адренорецепторы известно гораздо меньше.
Давно показано, что норадренергическая система играет важную роль в регуляции сна. Различают несколько типов адренорецепторов, и если работа ɑ-адренорецепторов описана довольно подробно, то про β-адренорецепторы известно гораздо меньше.
Эксперименты, проведенные со срезами мозга мышей, продемонстрировали, что ген ADRB1 преимущественно экспрессируется в структуре ствола мозга под названием варолиев мост. А регистрация нейронной активности живых мышей показала, что норадренергические нейроны варолиева моста особенно активны при пробуждении и во время фазы быстрого сна.
Затем ученые получили мутацию ADRB1 у мышей и изучили ее влияние на поведение грызунов. Оказалось, что мутантные мыши стали спать меньше, чем контрольные животные, в среднем на 55 минут. Это было показано измерением их двигательной активности и регистрацией электроэнцефалограммы. Исследователи подтвердили, что норадренергические нейроны варолиева моста мутантных мышей увеличили свою активность, и что если их активировать искусственно, используя методы оптогенетики, мыши просыпаются.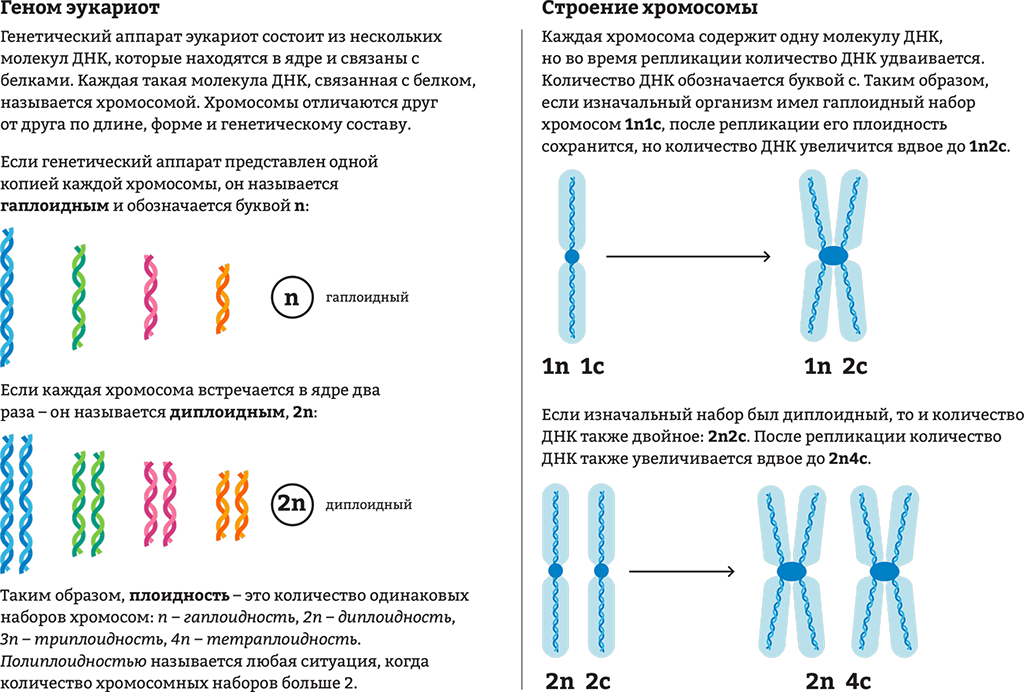
Авторы работы делают вывод о важной роли β1-адренорецепторов в регуляции цикла сон-бодрствование. И, судя по всему, именно популяция нейронов варолиева моста с высоким содержанием β1-адренорецепторов способствует снижению потребности во сне носителей мутации ADRB1. Хотя это не означает, что только данный ген и данные нейроны определяют длительность сна.
«Сон – это сложное явление, говорит Луис Птачек, нейрофизиолог из Калифорнийского университета в Сан-Франциско. – Мы не думаем, что только один ген или одна область мозга говорят нашему организму, спать ему или бодрствовать. Это всего лишь один фрагмент общей картины».
Как бы то ни было, описанная мутация может стать перспективной клинической мишенью для того, чтобы контролировать сон и бодрствование и лечить различные нарушения сна.
Источник
Guangsen Shi et al. A Rare Mutation of β1-Adrenergic Receptor Affects Sleep/Wake Behaviors // Neuron, 2019; DOI:
10. 1016/j.neuron.2019.07.026
1016/j.neuron.2019.07.026
Неврология Наследственные заболевания Генетика Экспрессия генов
Репрессор транскрипции DEC2 регулирует продолжительность сна у млекопитающих
- Список журналов
- Рукописи авторов HHS
- PMC2884988
Наука. Авторская рукопись; доступно в PMC 2010 14 июня.
Опубликовано в окончательной редакции как:
Наука. 2009 г., 14 августа; 325 (5942): 866–870.
doi: 10.1126/science.1174443
PMCID: PMC2884988
NIHMSID: NIHMS202601
PMID: 19679812
, 1 , 2 , 3 , 1, * , 4 , 1, † , 5 , 3 и 1, ‡
Информация об авторе Информация об авторских правах и лицензиях Отказ от ответственности
Лишение сна может ухудшить здоровье и работоспособность человека. Привычное общее время сна и гомеостатическая реакция сна на лишение сна являются количественными характеристиками человека. Генетические локусы для этих признаков были идентифицированы в модельных организмах, но ни одна из этих потенциальных моделей животных не имеет соответствующего генотипа и фенотипа человека. Мы идентифицировали мутацию в репрессоре транскрипции (hDEC2-P385R), которая связана с фенотипом короткого сна человека. Профили активности и записи сна трансгенных мышей, несущих эту мутацию, показали увеличенное время бодрствования и меньшее время сна, чем у контрольных мышей, в зависимости от времени zeitgeber и лишения сна. Эти мыши представляют собой модель гомеостаза сна человека, которая дает возможность исследовать влияние сна на физическое и психическое здоровье человека.
Привычное общее время сна и гомеостатическая реакция сна на лишение сна являются количественными характеристиками человека. Генетические локусы для этих признаков были идентифицированы в модельных организмах, но ни одна из этих потенциальных моделей животных не имеет соответствующего генотипа и фенотипа человека. Мы идентифицировали мутацию в репрессоре транскрипции (hDEC2-P385R), которая связана с фенотипом короткого сна человека. Профили активности и записи сна трансгенных мышей, несущих эту мутацию, показали увеличенное время бодрствования и меньшее время сна, чем у контрольных мышей, в зависимости от времени zeitgeber и лишения сна. Эти мыши представляют собой модель гомеостаза сна человека, которая дает возможность исследовать влияние сна на физическое и психическое здоровье человека.
Хотя сон является жизненно важным процессом, мозговые цепи, регулирующие сон, и клеточные и/или молекулярные механизмы, участвующие в этом сложном процессе, до сих пор остаются загадкой (1–3). Сон или «сонное» поведение присутствует практически у всех видов животных, у которых оно было изучено. Полное лишение сна может привести к летальному исходу, а частичное лишение сна имеет серьезные последствия для когнитивных функций, настроения и здоровья (4–6). Очевидно, что ситуационное усиление поведенческого влечения может кратковременно задерживать сон, но очень мало известно о хроническом частичном сокращении сна как возможном последствии стойкого повышения поведенческого влечения в бодрствовании. Последняя черта, которую иногда называют «гипертимным» темпераментом (7), теоретически является третьим фактором, влияющим на привычки сна.
Сон или «сонное» поведение присутствует практически у всех видов животных, у которых оно было изучено. Полное лишение сна может привести к летальному исходу, а частичное лишение сна имеет серьезные последствия для когнитивных функций, настроения и здоровья (4–6). Очевидно, что ситуационное усиление поведенческого влечения может кратковременно задерживать сон, но очень мало известно о хроническом частичном сокращении сна как возможном последствии стойкого повышения поведенческого влечения в бодрствовании. Последняя черта, которую иногда называют «гипертимным» темпераментом (7), теоретически является третьим фактором, влияющим на привычки сна.
Мышиный Dec2 (mDec2) — отрицательный компонент циркадных часов (8–10). Он принадлежит к основному семейству белков спираль-петля-спираль (bHLH), члены которого могут димеризоваться друг с другом и могут влиять на транскрипцию генов путем связывания со специфическими последовательностями ДНК (11). Выполняя повторное секвенирование генов-кандидатов в ДНК человеческих семей, выделяя аллели для очень раннего времени пробуждения, мы выявили точечную мутацию h DEC2 в небольшой семье с двумя больными людьми (12).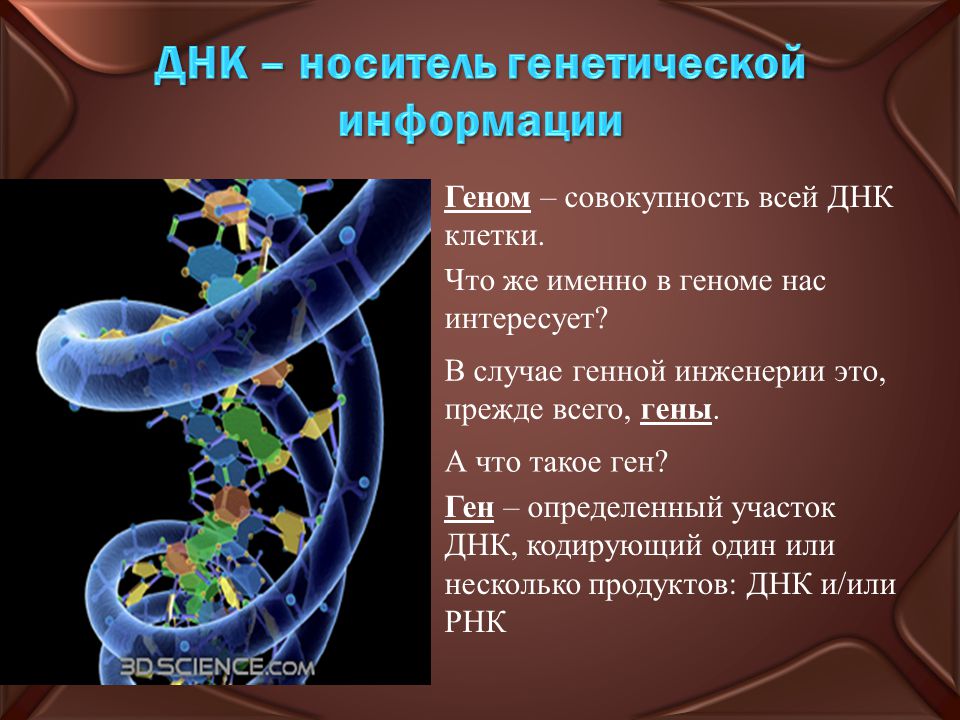 Субъекты, несущие эту мутацию, в течение всей жизни имели более короткие ежедневные промежутки времени сна, чем нормальные люди. У носителей мутации, по самоотчетам, обычное время сна, не связанное с рабочим днем, было намного раньше, чем у неносителей (включая членов семьи, не являющихся носителями, и контрольную группу). Однако время засыпания у этих двух людей такое же, как и у обычных спящих. Обычное общее время сна за 24 часа в день, по самооценке, было намного короче у носителей мутации (в среднем 6,25 часа) по сравнению с неносителями (в среднем 8,06 часа) в этой семье. Таким образом, они представляют собой «естественно недосыпающих», которые обычно спят меньше, чем люди с семейным синдромом продвинутой фазы сна (FASPS) или люди из контрольной группы. Среднее общее время сна взрослых американцев в нерабочие дни составляет примерно 7,4 часа (www.sleepfoundation.org). Мутация изменяет C на G в последовательности ДНК DEC2 , который, как предполагается, вызывает изменение пролина на аргинин в положении аминокислоты 385 DEC2 ().
Субъекты, несущие эту мутацию, в течение всей жизни имели более короткие ежедневные промежутки времени сна, чем нормальные люди. У носителей мутации, по самоотчетам, обычное время сна, не связанное с рабочим днем, было намного раньше, чем у неносителей (включая членов семьи, не являющихся носителями, и контрольную группу). Однако время засыпания у этих двух людей такое же, как и у обычных спящих. Обычное общее время сна за 24 часа в день, по самооценке, было намного короче у носителей мутации (в среднем 6,25 часа) по сравнению с неносителями (в среднем 8,06 часа) в этой семье. Таким образом, они представляют собой «естественно недосыпающих», которые обычно спят меньше, чем люди с семейным синдромом продвинутой фазы сна (FASPS) или люди из контрольной группы. Среднее общее время сна взрослых американцев в нерабочие дни составляет примерно 7,4 часа (www.sleepfoundation.org). Мутация изменяет C на G в последовательности ДНК DEC2 , который, как предполагается, вызывает изменение пролина на аргинин в положении аминокислоты 385 DEC2 (). Это изменение не было обнаружено в более чем 250 контрольных образцах ДНК. Пролин в положении 385 DEC2 (P385) консервативен у млекопитающих, но не у беспозвоночных. P385 расположен в высококонсервативной области внутри богатого пролином домена с неизвестной функцией и близок к С-концевой гистоновой деацетилазе (HDAC)-взаимодействующей области DEC2 (10). Запись активности-отдыха у одного носителя мутации с использованием 10-дневных журналов сна с совпадающей актиграфией запястья продемонстрировала продление активного периода каждый день ().
Это изменение не было обнаружено в более чем 250 контрольных образцах ДНК. Пролин в положении 385 DEC2 (P385) консервативен у млекопитающих, но не у беспозвоночных. P385 расположен в высококонсервативной области внутри богатого пролином домена с неизвестной функцией и близок к С-концевой гистоновой деацетилазе (HDAC)-взаимодействующей области DEC2 (10). Запись активности-отдыха у одного носителя мутации с использованием 10-дневных журналов сна с совпадающей актиграфией запястья продемонстрировала продление активного периода каждый день ().
Открыть в отдельном окне
Точечная мутация DEC2 выявлена в семье с коротким сном. ( A ) Родословная семейства K7430, несущего мутацию DEC2 (P385R). ( B ) P385 локализован в С-концевом домене, богатом пролином, и его фланкирующие последовательности высоко консервативны среди ортологов DEC2 млекопитающих. ( C ) Запись активности с помощью актиграфии запястья для одного носителя мутации демонстрирует продолжительный активный период каждый день.
Таблица 1
Сравнение режимов сна для людей. Возраст относится к тому, когда данные были собраны. Статус: С, носитель мутации; NC, немутационный носитель. Смещение сна — это местное стандартное время «среднего» окончательного утреннего пробуждения, а начало сна — это вечернее время первого засыпания, как утверждают люди, вспоминающие продолжительные отпуска на основе структурированных интервью. Значения ± стандартное отклонение.
| Субъекты | Возраст | Статус | Sleep offset | Sleep onset | Sleep length (hour) |
|---|---|---|---|---|---|
| 44990 | 69 | C | 4:00 | 22:00 | 6. 0 0 |
| 47690 | 44 | C | 4:30 | 22:00 | 6.5 |
| 101174 | 51 | NC | 6:00 | 22:35 | 7.4 |
| 100785 | 51 | NC | 7:00 | 22:45 | 8.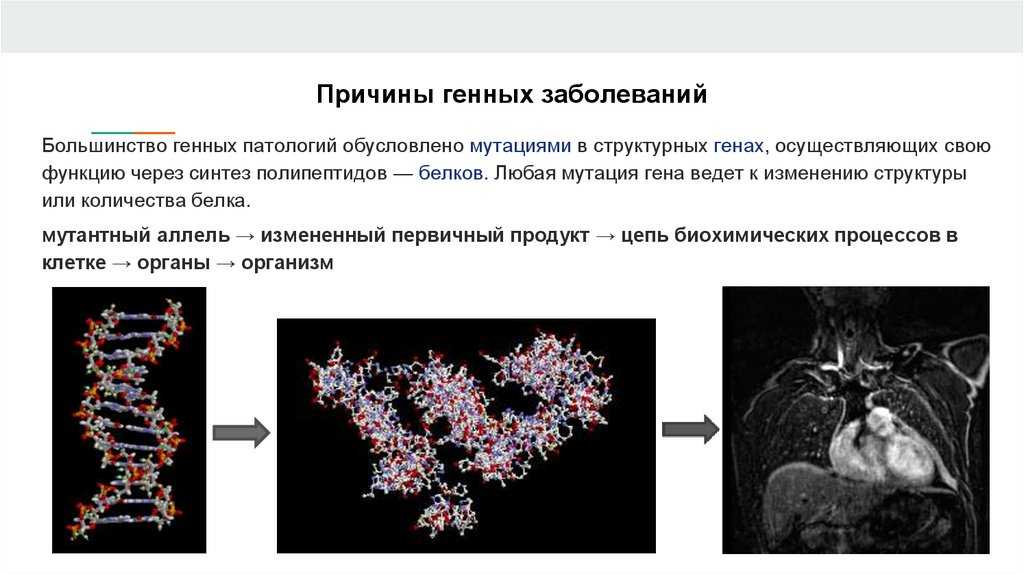 3 3 |
| 100656 | 44 | NC | 5:00 | 21:30 | 7.5 |
| 100654 | 16 | NC | 7:45 | 24:00 | 7.7 |
| 100655 | 10 | NC | 7:00 | 21:35 | 9. 4 4 |
| FASPS | 4:30 ± 1,33 | 19:45 ± 1,33 | 8,66 ± 0,80 ( N = 16) | ||
| Контроль | 6:12 ± 2,45 | 210206 | . = 15) |
Открыть в отдельном окне
Для изучения влияния мутации P385R на активность репрессора Dec2 в анализе люциферазы использовали конструкцию mDec2 дикого типа (WT) или P385R mDec2, и результаты показали, что P385R ослаблял репрессивную активность Dec2 Clk/Bmal1-опосредованной трансактивации (рис.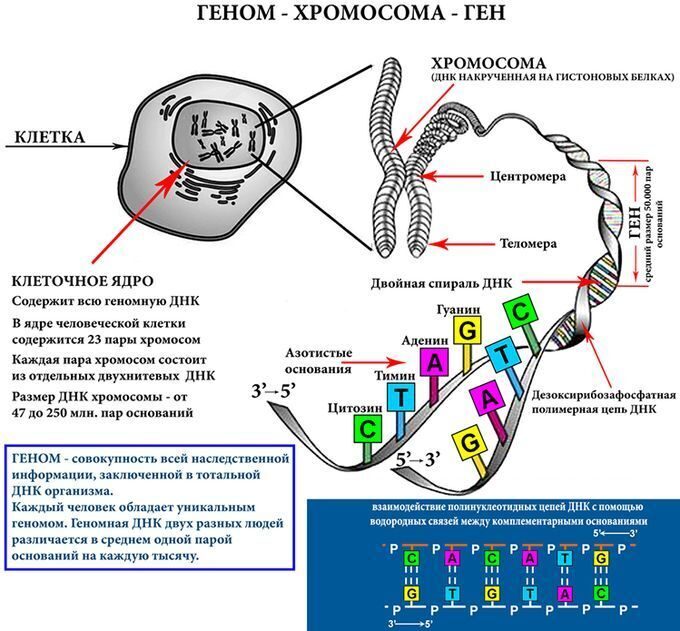 S1A). Снижение репрессивной активности Dec2 было умеренным по сравнению с мутациями R57A/K (в которых аргинин 57 был заменен аланином или лизином), о которых сообщалось ранее (13). Ранее было показано, что Dec2 предпочтительно связывается с элементами E-box класса B (CACGTG) в виде гомодимера и репрессирует транскрипцию генов-мишеней HDAC-зависимым образом (13). Затем влияние HDAC на репрессию мутантного Dec2 анализировали путем мониторинга m Активность люциферазы, управляемая промотором Per2 , с общим ингибитором HDAC трихостатином A (TSA) или без него (рис. S1B). Ингибирование HDAC приводило к сходному увеличению активности люциферазы как для WT, так и для мутантного Dec2. Затем проводили коиммунопреципитацию для mDec2 (WT или P385R) и человеческого сиртуина-1 (hSIRT1). Клетки HEK293 временно котрансфицировали меченым зеленым флуоресцентным белком (GFP) (WT или мутированным) m Dec2 и FLAG-меченым h SIRT1 с последующим вытягиванием FLAG-пептида и обнаружением GFP с антителами на Вестерн-блоттинге.
S1A). Снижение репрессивной активности Dec2 было умеренным по сравнению с мутациями R57A/K (в которых аргинин 57 был заменен аланином или лизином), о которых сообщалось ранее (13). Ранее было показано, что Dec2 предпочтительно связывается с элементами E-box класса B (CACGTG) в виде гомодимера и репрессирует транскрипцию генов-мишеней HDAC-зависимым образом (13). Затем влияние HDAC на репрессию мутантного Dec2 анализировали путем мониторинга m Активность люциферазы, управляемая промотором Per2 , с общим ингибитором HDAC трихостатином A (TSA) или без него (рис. S1B). Ингибирование HDAC приводило к сходному увеличению активности люциферазы как для WT, так и для мутантного Dec2. Затем проводили коиммунопреципитацию для mDec2 (WT или P385R) и человеческого сиртуина-1 (hSIRT1). Клетки HEK293 временно котрансфицировали меченым зеленым флуоресцентным белком (GFP) (WT или мутированным) m Dec2 и FLAG-меченым h SIRT1 с последующим вытягиванием FLAG-пептида и обнаружением GFP с антителами на Вестерн-блоттинге. Результаты показали аналогичные физические взаимодействия между WT или P385R mDec2 и hSIRT1 (рис. S1C). Взятые вместе, эти результаты предполагают, что мутация P385R влияет на активность репрессии транскрипции Dec2 независимо от ее взаимодействия с HDAC/SIRT.
Результаты показали аналогичные физические взаимодействия между WT или P385R mDec2 и hSIRT1 (рис. S1C). Взятые вместе, эти результаты предполагают, что мутация P385R влияет на активность репрессии транскрипции Dec2 независимо от ее взаимодействия с HDAC/SIRT.
Поскольку в этом исследовании участвуют только два человека-носителя мутации, остается вопрос, был ли естественный фенотип короткого сна вызван мутацией DEC2 . Таким образом, мы создали трансгенных (Tg) мышей WT и P385R DEC2 , используя клон человеческой бактериальной искусственной хромосомы (BAC) (RP11-288E19), несущий полный ген h DEC2 , для проверки этой гипотезы. Поскольку DEC2 был установлен как компонент циркадных часов (9, 14), мы сначала решили определить циркадный период (τ) мышей DEC2-P385R . Мыши с делецией Dec2 [нокаутные (KO) мыши] (10) и однопометники дикого типа тестировались параллельно в качестве контроля. Достоверных различий в τ среди мышей разных генотипов не обнаружено (таблица S1).
Поскольку мутация была выявлена у людей с коротким сном, которые, предположительно, имеют соответственно более длительные периоды общей ежедневной активности, мы затем определили продолжительность периода активности (α) для этих мышей. Мыши DEC2-P385R сохраняли характерный для дикого типа режим покоя и активности (бег в основном в темную фазу). Однако α был примерно на 1,2 часа длиннее для DEC2 -мутантных трансгенных мышей (), чем у мышей дикого типа, DEC2-WT Tg мышей и Dec2 KO мышей, что свидетельствует о том, что экспрессия аллеля DEC2-P385R приводит к доминантному увеличению количество бодрствования у мышей. В соответствии с этим представлением, α дополнительно удлинялся (~2,5 часа), когда эндогенные аллели Dec2 были удалены путем скрещивания мышей DEC2-P385R с фоном Dec2 KO.
Открыть в отдельном окне
Базовые характеристики сна-бодрствования однопометных мышей DEC2-P385R и WT. ( A ) Продолжительность активной фазы (α) для мышей указанного генотипа. ( B ) Процент времени в состоянии бодрствования был значительно увеличен у DEC2-P385R ( n = 5) по сравнению с их однопометниками WT ( n = 8), особенно в светлую фазу (ZT 0–12). , ZT 0 = 8 утра). Горизонтальная полоса указывает светлую и темную фазы. Л1, ЗТ 0–6; Л2, ЗТ 6–12; Д1, ЗТ 12–18; Д2, ЗТ 18–24. ( C ) У мышей DEC2-P385R был сокращен процент времени, проведенного в NREM и REM во время световой фазы. Сравнение средней продолжительности и количества эпизодов бодрствования ( D ), NREM ( E ) и REM ( F ) для DEC2-P385R (серая полоса) и однопометников WT (темная полоса). ( G ) Средняя спектральная мощность была рассчитана для каждого из 6-часовых периодов (слева направо: L1, L2, D1 и D2), как показано горизонтальной чертой на (B). Дельта- и тета-мощность NREM сравнивались для двух генотипов.
( A ) Продолжительность активной фазы (α) для мышей указанного генотипа. ( B ) Процент времени в состоянии бодрствования был значительно увеличен у DEC2-P385R ( n = 5) по сравнению с их однопометниками WT ( n = 8), особенно в светлую фазу (ZT 0–12). , ZT 0 = 8 утра). Горизонтальная полоса указывает светлую и темную фазы. Л1, ЗТ 0–6; Л2, ЗТ 6–12; Д1, ЗТ 12–18; Д2, ЗТ 18–24. ( C ) У мышей DEC2-P385R был сокращен процент времени, проведенного в NREM и REM во время световой фазы. Сравнение средней продолжительности и количества эпизодов бодрствования ( D ), NREM ( E ) и REM ( F ) для DEC2-P385R (серая полоса) и однопометников WT (темная полоса). ( G ) Средняя спектральная мощность была рассчитана для каждого из 6-часовых периодов (слева направо: L1, L2, D1 и D2), как показано горизонтальной чертой на (B). Дельта- и тета-мощность NREM сравнивались для двух генотипов. Значимые различия отмечены звездочками. P < 0,05, по одностороннему и двустороннему критерию Стьюдента t . Все данные выражены как среднее значение ± стандартная ошибка среднего. Столбики погрешностей представляют SEM.
Значимые различия отмечены звездочками. P < 0,05, по одностороннему и двустороннему критерию Стьюдента t . Все данные выражены как среднее значение ± стандартная ошибка среднего. Столбики погрешностей представляют SEM.
Для непосредственного изучения сна (по сравнению с ритмами активности) и изучения возможной роли DEC2 в регуляции количества сна были проведены электроэнцефалография (ЭЭГ) и электромиография (ЭМГ). Поскольку мы не наблюдали изменения α у мышей DEC2-WT Tg () и поскольку носители мутаций человека имеют один нормальный аллель с одним мутантным аллелем, мы решили выполнить ЭЭГ и ЭМГ на Мыши DEC2-P385R и их однопометники дикого типа. Мыши обоих полов (самка:самец/1:1) были включены во все исследования ЭЭГ, чтобы исключить возможность половых различий, отмеченных в других отчетах (15). Мыши DEC2-P385R бодрствовали (по данным ЭЭГ) примерно на 8% дольше, чем мыши WT в световой фазе (таблица S2). Фенотип короткого сна у этих мышей выражался в значительном укорочении как небыстрых движений глаз (NREM), так и быстрых движений глаз (REM) во время сна в светлой фазе в течение DEC2-P385R при сравнении с контрольными мышами (и таблица S2).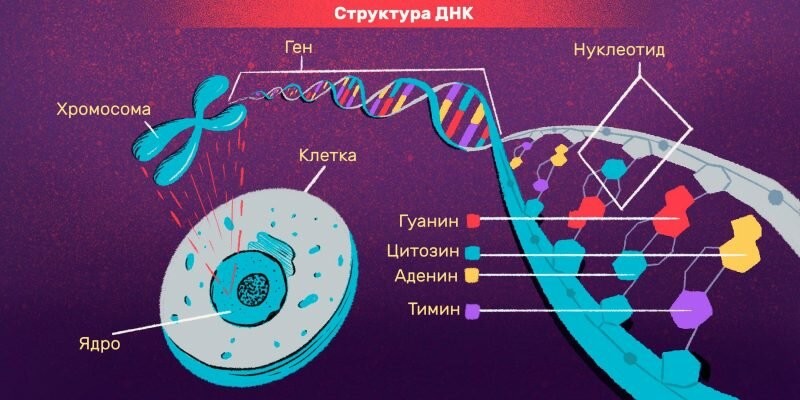 Медленный сон был примерно на 6% меньше, а быстрый сон был меньше примерно на 2% у мышей DEC2-P385R по сравнению с мышами WT во время световой фазы. Архитектура сна дополнительно характеризовалась подсчетом эпизодов сна и бодрствования. В течение 12-часового периода мышей DEC2-P385R демонстрировали больше эпизодов бодрствования, чем мыши WT (193 ± 12 против 133 ± 10, P < 0,05), но средняя продолжительность каждого эпизода была немного короче во время светового дня. фаза (97 ± 10 с против 116 ± 12, P < 0,05) (и таблица S3). В соответствии с этим, мышей DEC2-P385R также демонстрировали больше эпизодов NREM во время световых периодов (190 ± 10 против 139 ± 9, P <0,05), но каждый эпизод был короче (118 ± 3 с против 184 ± 5, P). < 0,05) (и таблица S3). Эпизоды REM были одинаковыми по частоте (41 ± 5 против 53 ± 6) и продолжительности (63 ± 3 с против 64 ± 3) для мышей DEC2-P385R и WT (и таблица S3). Эти результаты позволяют предположить, что структура сна 9Мыши 0013 DEC2-P385R более фрагментированы, чем у мышей WT (особенно во сне NREM).
Медленный сон был примерно на 6% меньше, а быстрый сон был меньше примерно на 2% у мышей DEC2-P385R по сравнению с мышами WT во время световой фазы. Архитектура сна дополнительно характеризовалась подсчетом эпизодов сна и бодрствования. В течение 12-часового периода мышей DEC2-P385R демонстрировали больше эпизодов бодрствования, чем мыши WT (193 ± 12 против 133 ± 10, P < 0,05), но средняя продолжительность каждого эпизода была немного короче во время светового дня. фаза (97 ± 10 с против 116 ± 12, P < 0,05) (и таблица S3). В соответствии с этим, мышей DEC2-P385R также демонстрировали больше эпизодов NREM во время световых периодов (190 ± 10 против 139 ± 9, P <0,05), но каждый эпизод был короче (118 ± 3 с против 184 ± 5, P). < 0,05) (и таблица S3). Эпизоды REM были одинаковыми по частоте (41 ± 5 против 53 ± 6) и продолжительности (63 ± 3 с против 64 ± 3) для мышей DEC2-P385R и WT (и таблица S3). Эти результаты позволяют предположить, что структура сна 9Мыши 0013 DEC2-P385R более фрагментированы, чем у мышей WT (особенно во сне NREM). Хотя у мышей DEC2-P385R наблюдается небольшое увеличение дельта-мощности NREM на ЭЭГ, мы не обнаружили статистически значимой разницы в дельта- и тета-мощности NREM во время дневного или ночного сна, что предполагает, что, несмотря на уменьшение продолжительности сна и непрерывности, глубина сна в исходных условиях у мутантных трансгенных мышей существенно не изменяется (11). Эти результаты показывают, что количество и консолидация бодрствования, NREM и REM в 9Мыши 0013 DEC2-P385R поражаются главным образом во время световой фазы. Единственная существенная разница, наблюдаемая в темной фазе, заключалась в средней продолжительности NREM. Вместе эти результаты убедительно свидетельствуют о том, что изменения в измерениях сна у мышей DEC2-P385R вызваны точечной мутацией P385R.
Хотя у мышей DEC2-P385R наблюдается небольшое увеличение дельта-мощности NREM на ЭЭГ, мы не обнаружили статистически значимой разницы в дельта- и тета-мощности NREM во время дневного или ночного сна, что предполагает, что, несмотря на уменьшение продолжительности сна и непрерывности, глубина сна в исходных условиях у мутантных трансгенных мышей существенно не изменяется (11). Эти результаты показывают, что количество и консолидация бодрствования, NREM и REM в 9Мыши 0013 DEC2-P385R поражаются главным образом во время световой фазы. Единственная существенная разница, наблюдаемая в темной фазе, заключалась в средней продолжительности NREM. Вместе эти результаты убедительно свидетельствуют о том, что изменения в измерениях сна у мышей DEC2-P385R вызваны точечной мутацией P385R.
Затем мы исследовали реакцию мышей DEC2-P385R на лишение сна, чтобы дополнительно изучить роль DEC2 в регуляции сна. ДЭК2-П385Р 9Однопометных мышей 0014 и WT подвергали 6-часовой непрерывной депривации сна. Оба генотипа показали восстановление медленного и быстрого сна в оставшиеся 6 часов светового периода и последующие 12 часов темноты, хотя степень повышения медленного и быстрого сна была намного меньше у мышей DEC2-P385R в течение 12 часов. тьмы (). Во время темновой фазы (D1 и D2) NREM-сон был меньше увеличен у DEC2-P385R (ΔD1, 17,1% и ΔD2, 2,0%) по сравнению с мышами WT (ΔD1, 71,8% и ΔD2, 27,2%) (и таблица S2). ). Точно так же быстрый сон был меньше увеличен в течение DEC2-P385R (ΔD1, 74,4%, ΔD2, 82,3%), чем для мышей WT (ΔD1, 175,2%, ΔD2, 122,4%). Как видно из рисунка, кумулятивные данные о потере сна и восстановлении по отношению к базовым часам сна в периоды депривации и восстановления показывают, что мыши дикого типа потеряли больше сна во время периода депривации сна L1, вероятно, потому, что они больше спали в периоды L1. Таким образом, более медленное восстановление остро утраченного сна у мышей Dec2-P385R еще более примечательно, поскольку они начали экспериментальную депривацию сна с хронически недосыпанием.
Оба генотипа показали восстановление медленного и быстрого сна в оставшиеся 6 часов светового периода и последующие 12 часов темноты, хотя степень повышения медленного и быстрого сна была намного меньше у мышей DEC2-P385R в течение 12 часов. тьмы (). Во время темновой фазы (D1 и D2) NREM-сон был меньше увеличен у DEC2-P385R (ΔD1, 17,1% и ΔD2, 2,0%) по сравнению с мышами WT (ΔD1, 71,8% и ΔD2, 27,2%) (и таблица S2). ). Точно так же быстрый сон был меньше увеличен в течение DEC2-P385R (ΔD1, 74,4%, ΔD2, 82,3%), чем для мышей WT (ΔD1, 175,2%, ΔD2, 122,4%). Как видно из рисунка, кумулятивные данные о потере сна и восстановлении по отношению к базовым часам сна в периоды депривации и восстановления показывают, что мыши дикого типа потеряли больше сна во время периода депривации сна L1, вероятно, потому, что они больше спали в периоды L1. Таким образом, более медленное восстановление остро утраченного сна у мышей Dec2-P385R еще более примечательно, поскольку они начали экспериментальную депривацию сна с хронически недосыпанием. Сразу после лишения сна мутант 9Мыши 0013 DEC2-P385R также имели меньший компенсаторный прирост в NREM по сравнению с мышами WT (), что согласуется с ролью Dec2 в гомеостазе сна. Значительно более низкое изменение плотности мощности дельта NREM после депривации сна было обнаружено у DEC2-P385R по сравнению с мышами WT, что дополнительно подтвердило измененный гомеостаз NREM у мутантных мышей (). Различия в качествах REM между мышами WT и DEC2-P385R были намного меньше, чем у NREM, и не достигали статистической значимости. Эти результаты показывают, что мутация P385R приводит к изменениям восстановления сна и интенсивности NREM после лишения сна у мышей. Эти изменения в гомеостазе сна у мутантных мышей обеспечивают проверяемую гипотезу для будущей работы по изучению того, почему люди с мутацией ведут такой активный образ жизни, несмотря на их постоянно более короткий сон.
Сразу после лишения сна мутант 9Мыши 0013 DEC2-P385R также имели меньший компенсаторный прирост в NREM по сравнению с мышами WT (), что согласуется с ролью Dec2 в гомеостазе сна. Значительно более низкое изменение плотности мощности дельта NREM после депривации сна было обнаружено у DEC2-P385R по сравнению с мышами WT, что дополнительно подтвердило измененный гомеостаз NREM у мутантных мышей (). Различия в качествах REM между мышами WT и DEC2-P385R были намного меньше, чем у NREM, и не достигали статистической значимости. Эти результаты показывают, что мутация P385R приводит к изменениям восстановления сна и интенсивности NREM после лишения сна у мышей. Эти изменения в гомеостазе сна у мутантных мышей обеспечивают проверяемую гипотезу для будущей работы по изучению того, почему люди с мутацией ведут такой активный образ жизни, несмотря на их постоянно более короткий сон.
Открыть в отдельном окне
Изменение регуляции сна у мышей DEC2-P385R . Данные для медленного сна показаны на верхних панелях, а для быстрого сна — на нижних панелях. ( A ) Динамика медленного и быстрого сна в процентах от времени, проведенного каждый час во время и после лишения сна в течение одного дня. ( B ) Процентное изменение времени после лишения сна по сравнению с исходным состоянием для NREM и REM в L2, D1 и D2 для DEC2-P385R и мышей WT. ( C ) Кумулятивная потеря и усиление медленного и быстрого сна по сравнению с исходными условиями для эксперимента по лишению сна. ( D ) Анализ изменений спектральной мощности сна по сравнению с исходными условиями для L2, D1 и D2. Значимые различия отмечены звездочками. P < 0,05, по одностороннему и двустороннему критерию Стьюдента t . Столбики погрешностей представляют SEM.
Данные для медленного сна показаны на верхних панелях, а для быстрого сна — на нижних панелях. ( A ) Динамика медленного и быстрого сна в процентах от времени, проведенного каждый час во время и после лишения сна в течение одного дня. ( B ) Процентное изменение времени после лишения сна по сравнению с исходным состоянием для NREM и REM в L2, D1 и D2 для DEC2-P385R и мышей WT. ( C ) Кумулятивная потеря и усиление медленного и быстрого сна по сравнению с исходными условиями для эксперимента по лишению сна. ( D ) Анализ изменений спектральной мощности сна по сравнению с исходными условиями для L2, D1 и D2. Значимые различия отмечены звездочками. P < 0,05, по одностороннему и двустороннему критерию Стьюдента t . Столбики погрешностей представляют SEM.
Мы провели ЭЭГ и ЭМГ на мышах Dec2 KO и их однопометниках дикого типа. Базовое бодрствование, NREM и REM проценты показали, что Dec2 Мыши KO спят немного больше, чем мыши WT, и разница в основном заключается в темном периоде (таблица S4 и рис. S2). В световой период только NREM-сон у мышей Dec2 KO был более обильным, чем у мышей WT, и лишь незначительно. Восстановление NREM после депривации сна у мышей Dec2 KO было намного медленнее, что означает, что Dec2 является важным фактором, регулирующим восстановление сна.
S2). В световой период только NREM-сон у мышей Dec2 KO был более обильным, чем у мышей WT, и лишь незначительно. Восстановление NREM после депривации сна у мышей Dec2 KO было намного медленнее, что означает, что Dec2 является важным фактором, регулирующим восстановление сна.
Затем мы решили проверить, может ли m Dec2P385R вызывать аналогичный фенотип покоя и сна у Дрозофила . Ближайший гомологичный белок DEC2 в Drosophila [CG17100, заводной апельсин (16, 17)] имеет <18% сходства аминокислотной последовательности, <11% идентичности, а P385 не является консервативным. Поэтому мы создали трансгенных мух с индуцируемой экспрессией UAS- mDec2WT и UAS- mDec2P385R на фоне w1118 . Когда этих мух скрещивали с elav -GAL4, приводя к паннейронной гиперэкспрессии (18), mDec2P385R 9Мухи 0014 продемонстрировали значительно более низкое дневное поведение, похожее на сон, с уменьшенным количеством периодов отдыха и увеличенной продолжительностью периодов отдыха по сравнению с мухами WT (11). Поскольку было показано, что грибовидные тела являются вероятным центром поведения Drosophila (19), мы также сверхэкспрессировали P385R и WT m Dec2 под контролем драйвера грибовидного тела 30Y -GAL4 (20). Следует отметить, что трансгенные мухи mDec2P385R , управляемые 30Y -GAL4, демонстрировали значительно менее похожее на сон поведение со значительно более короткой продолжительностью приступов сна как в светлой, так и в темной фазах, чем 30Y -GAL4.0013 mDec2WT летит (). Однако количество периодов отдыха или сна было значительно выше только в темную фазу для трансгенных мух mDec2P385R . Эти результаты показывают, что поведение мух с экспрессией грибовидного тела mDec2P385R повторяет поведение трансгенных мышей DEC2-P385R (, и ).
Поскольку было показано, что грибовидные тела являются вероятным центром поведения Drosophila (19), мы также сверхэкспрессировали P385R и WT m Dec2 под контролем драйвера грибовидного тела 30Y -GAL4 (20). Следует отметить, что трансгенные мухи mDec2P385R , управляемые 30Y -GAL4, демонстрировали значительно менее похожее на сон поведение со значительно более короткой продолжительностью приступов сна как в светлой, так и в темной фазах, чем 30Y -GAL4.0013 mDec2WT летит (). Однако количество периодов отдыха или сна было значительно выше только в темную фазу для трансгенных мух mDec2P385R . Эти результаты показывают, что поведение мух с экспрессией грибовидного тела mDec2P385R повторяет поведение трансгенных мышей DEC2-P385R (, и ).
Открыть в отдельном окне
Характеристика сходного со сном поведения трансгенных мух со сверхэкспрессией WT (черный) или P385 (серый) mDec2 с драйверами elav -GAL4 ( A ) или 30Y -GAL4 ( B ). Строили профиль суточного сноподобного поведения (количество сна в течение каждого 30-минутного периода), общее время сна, количество эпизодов сна и среднюю продолжительность эпизодов сна в светлое и темное время суток. Значимые различия по одностороннему критерию Стьюдента t отмечены звездочками ( P < 0,05). Столбики погрешностей представляют SEM.
Строили профиль суточного сноподобного поведения (количество сна в течение каждого 30-минутного периода), общее время сна, количество эпизодов сна и среднюю продолжительность эпизодов сна в светлое и темное время суток. Значимые различия по одностороннему критерию Стьюдента t отмечены звездочками ( P < 0,05). Столбики погрешностей представляют SEM.
Сила генетики человека в изучении поведенческих черт человека была продемонстрирована при идентификации мутаций и последующей молекулярной характеристике FASPS (21–23). Как известно в настоящее время, FASPS представляет собой в первую очередь вариант циркадного ритма, ведущий к измененной фазе; общее ежедневное время сна в норме (21, 23, 24). Мы применили аналогичный подход и идентифицировали ген, участвующий в регуляции количества сна. Это дает уникальную возможность для изучения регуляции количества сна у человека. 9Мутация 0013 DEC2-P385R приводила к фенотипу короткого сна, который повторялся в моделях трансгенных мышей и мух, но не обнаруживался у мышей Dec2 KO. Кроме того, этот фенотип был усилен отсутствием эндогенных аллелей Dec2 , что позволяет предположить, что P385R приводит к доминантно-негативной мутации. Наши результаты показывают, что DEC2 играет важную роль в регуляции ежедневного общего времени сна у млекопитающих и что контроль поведения, подобного сну, может сохраняться и регулироваться аналогичным образом еще в эволюции беспозвоночных.
Кроме того, этот фенотип был усилен отсутствием эндогенных аллелей Dec2 , что позволяет предположить, что P385R приводит к доминантно-негативной мутации. Наши результаты показывают, что DEC2 играет важную роль в регуляции ежедневного общего времени сна у млекопитающих и что контроль поведения, подобного сну, может сохраняться и регулироваться аналогичным образом еще в эволюции беспозвоночных.
Мы не обнаружили статистически значимых различий в дельта- или тета-мощности NREM у мышей DEC2-P385R во время дневного или ночного сна, хотя у этих мышей наблюдается тенденция к увеличению дельта NREM. Вполне возможно, что небольшой дефицит сна в краткосрочной перспективе не оказывает существенного влияния на силу сна, в то время как долгосрочное накопление влияет на него. В качестве альтернативы, ослабленное увеличение мощности дельты NREM вместе с медленным и неполным восстановлением сна NREM после депривации сна в DEC2-P385R предполагает, что эти мыши способны справляться с более коротким сном из-за измененного гомеостаза сна. Примечательно, что недавние данные о человеческом сне подчеркивают важность кумулятивного дефицита сна, даже если он возникает только из-за частичной депривации сна. Понимание регулирующих механизмов качества и количества сна будет способствовать разработке вмешательств для облегчения патологий, связанных с нарушением сна.
Примечательно, что недавние данные о человеческом сне подчеркивают важность кумулятивного дефицита сна, даже если он возникает только из-за частичной депривации сна. Понимание регулирующих механизмов качества и количества сна будет способствовать разработке вмешательств для облегчения патологий, связанных с нарушением сна.
Рис. S1 и S2_Таблицы от S1 до S4
Нажмите здесь для просмотра. (230K, pdf)
Мы благодарим A. Sehgal за конструкции драйвера elav-GAL4 Drosophila ; лаборатория Исикава Киотского университета для конструкций pcDNA3-hSIRT1-FLAG, H.-Y. Lee за техническую поддержку и L. J. Ptac(x0030C)ek за содержательные обсуждения и тщательное редактирование рукописи. Эта работа была поддержана грантом NIH HL059596, грантом Conte Center (MH074924) и фондом Sandler Neurogenetics.
Вспомогательные онлайн-материалы: www.sciencemag.org/cgi/content/full/325/5942/866/DC1
1. Fuller PM, Gooley JJ, Saper CB. J Биол Ритмы. 2006; 21:482. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
2. Saper CB, Chou TC, Scammell TE. Тренды Нейроси. 2001; 24:726. [PubMed] [Google Scholar]
3. Pace-Schott EF, Hobson JA. Нат Рев Нейроски. 2002; 3:591. [PubMed] [Google Scholar]
4. Durmer JS, Dinges DF. Семин Нейрол. 2005; 25:117. [PubMed] [Google Scholar]
5. Knutson KL, Van Cauter E. Ann NY Acad Sci. 2008;1129:287. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Ван Донген Х.П., Майслин Г., Маллингтон Дж.М., Динджес Д.Ф. Спать. 2003; 26:117. [PubMed] [Google Scholar]
7. Акискал Х.С., Акискал К.К., Хайкал Р.Ф., Мэннинг Дж.С., Коннор П.Д. J Аффективное расстройство. 2005;85:3. [PubMed] [Google Scholar]
8. Hamaguchi H, et al. Биохим Дж. 2004; 382:43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Honma S, et al. Природа. 2002; 419:841. [PubMed] [Google Scholar]
10. Rossner MJ, et al. ПЛОС Один. 2008;3:e2762. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Massari ME, Murre C. Mol Cell Biol. 2000;20:429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mol Cell Biol. 2000;20:429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Материалы и методы доступны в качестве вспомогательного материала на сайте Science Online.
13. Кондо Дж. и др. Int J Mol Med. 2006;17:1053. [PubMed] [Google Scholar]
14. Noshiro M, et al. J Биол Ритмы. 2005; 20:404. [PubMed] [Google Scholar]
15. Franken P, et al. Proc Natl Acad Sci USA. 2006;103:7118. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Каденер С., Столеру Д., Макдональд М., Наватеан П., Росбаш М. Genes Dev. 2007; 21:1675. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Lim C, et al. Карр Биол. 2007; 17:1082. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Zhang YQ, Rodesch CK, Broadie K. Genesis. 2002; 34:142. [PubMed] [Google Scholar]
19. Джойнер В.Дж., Крокер А., Уайт Б.Х., Сегал А. Природа. 2006; 441:757. [PubMed] [Google Scholar]
20. Ян М.Ю., Армстронг Дж.Д., Вилинский И., Штраусфельд Н. Дж., Кайзер К. Нейрон. 1995;15:45. [PubMed] [Google Scholar]
Дж., Кайзер К. Нейрон. 1995;15:45. [PubMed] [Google Scholar]
21. Jones CR, et al. Нат Мед. 1999;5:1062. [PubMed] [Google Scholar]
22. Toh KL, et al. Наука. 2001; 291:1040. [PubMed] [Google Scholar]
23. Xu Y, et al. Природа. 2005; 434:640. [PubMed] [Google Scholar]
24. Xu Y, et al. Клетка. 2007;128:59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ген DEC2 и сон
Постоянный 4-часовой сон звучит как ад… для большинства людей.
Но для некоторых это то, что нужно их телу.
И когда я говорю некоторые, я имею в виду процент населения, несущего мутацию гена DEC2, которая вызывает «короткий сон». [R]
Людям с этой генетической мутацией требуется всего несколько часов сна в сутки, чтобы чувствовать себя полностью отдохнувшими.
4-6 часов, если быть точным.
Полностью противоречит общепринятому мнению о сне.
Популярно утверждение, что людям необходимо спать 7,5-8 часов в сутки по всем направлениям. Но генам нет дела до популярных утверждений.
Но генам нет дела до популярных утверждений.
Люди с этой генной мутацией утверждают, что если они спят по 7 часов, то чувствуют себя хуже .
Так это действительно генетическое преимущество? Я позволю тебе решить.
Как это работает
DEC2 (кодируется геном BHLHE41) помогает контролировать уровень орексина, гормона, связанного с бодрствованием, а также вознаграждением, настроением и аппетитом. [R]
Нарколепсия — это нечто противоположное короткому сну, вызванное избытком того же самого гормона.
Ин Хуэй Фу возглавила исследовательскую группу, которая впервые обнаружила эту генную мутацию в 2009 году. Она объясняет, что DEC2 — это «хронометр, обеспечивающий соответствие уровня орексина циркадному ритму».
Побочных эффектов также не наблюдается ( открытие слишком недавнее для неопровержимых доказательств ).
«Судя по тому, что нам говорят, короткоспящие очень энергичны», — говорит Фу. «И мы считаем, что они чувствуют себя отдохнувшими, так как могут продолжать весь день и быть активными».
«И мы считаем, что они чувствуют себя отдохнувшими, так как могут продолжать весь день и быть активными».
Объекты исследования, с которыми работает Фу, довольно увлекательны…
Она утверждает, что проводить исследования было немного сложно, потому что носители этого гена «обычно очень занятые люди, и им трудно найти время для этого».
Некоторые участники исследования старше и все еще активны. «Даже в свои 70-80 лет они все еще играют в теннис, танцуют и остаются очень активными… Пока у нас нет оснований подозревать, что это каким-либо образом влияет на их здоровье и долголетие».
Если вы читаете это и думаете, что эти привычки звучат довольно знакомо, вы можете быть носителем.
Он может быть у вас, если…
Вы просыпаетесь раньше остальных? Не потому, что вы приучили себя к этому, а потому, что ваше тело просто делает .
Может быть, утром у вас появляется прилив энергии, который кажется окружающим странным. Может быть, вы чувствуете себя полностью отдохнувшим всего после шести часов сна, в то время как большинство людей чувствовали бы себя зомби, не проспав хотя бы 7 часов.
Может быть, вы чувствуете себя полностью отдохнувшим всего после шести часов сна, в то время как большинство людей чувствовали бы себя зомби, не проспав хотя бы 7 часов.
Вы активный человек в течение дня? Вы заканчиваете одно дело и тут же переходите к следующему?
Не потому, что вам кажется, что вы «должны» это делать. Ты такой, какой ты есть.
Чувствуете ли вы вялость, когда спите более 6 часов? Как будто мир говорит вам спать 7 часов, но каждый раз, когда вы это делаете, вы чувствуете себя еще хуже, чем обычно.
Если что-то из перечисленного описывает вас, возможно, стоит проверить ваш генотип.
Чтобы узнать это, просто выполните поиск в анализаторе SNP в SelfDecode rs121912617 и определите свой генотип. Если у вас генотип TT или GT, вы один из счастливчиков, которых мы называем «короткоспящими».
Я думал, что могу быть переносчиком…
Я постоянно просыпаюсь в 6 утра и уже много лет. Обычно я не засыпаю до 12 часов ночи. Иногда даже позже.
Иногда даже позже.
И не то чтобы я весь день хожу в изнеможении (хотя 3-4 чашки кофе, правда, помогают).
Услышав об исследовании Фу, я подумал, что могу быть носителем.
Я зашел в свой анализатор SNP в SelfDecode, чтобы посмотреть, не попал ли я в число счастливчиков.
Нет, просто старый скучный GG для меня.
Если вы хотите проверить анализатор SNP, чтобы узнать, есть ли у вас мутация DEC2, щелкните здесь, чтобы проверить SelfDecode.
Итак, почему я так мало сплю?
Я был немного шокирован тем, что у меня не было этой мутации DEC2.
Теперь мне захотелось узнать настоящую причину моих бессонных ночей.
Итак, я загрузил отчет о ДНК бессонницы на SelfDecode. В этом отчете рассматриваются 808 802 других генных мутаций, которые могут повлиять на ваш сон.
И там был мой ответ.
Генетическая предрасположенность к бессоннице выше среднего – в 89-м процентиле. Неудивительно, что я мало сплю.