Содержание
Гены: что это и как связаны с характером
Большинство генов у человека и шимпанзе практически идентичны: разница в ДНК составляет всего 1–3%. Но именно эта разница делает нас людьми. Разбираемся, как гены влияют на наши внешность, интеллект и поведение
- Что это
- Доминантные и рецессивные
- Гены и наследственность
- На что влияют
- Мутации
- Изучение генов
Что такое гены
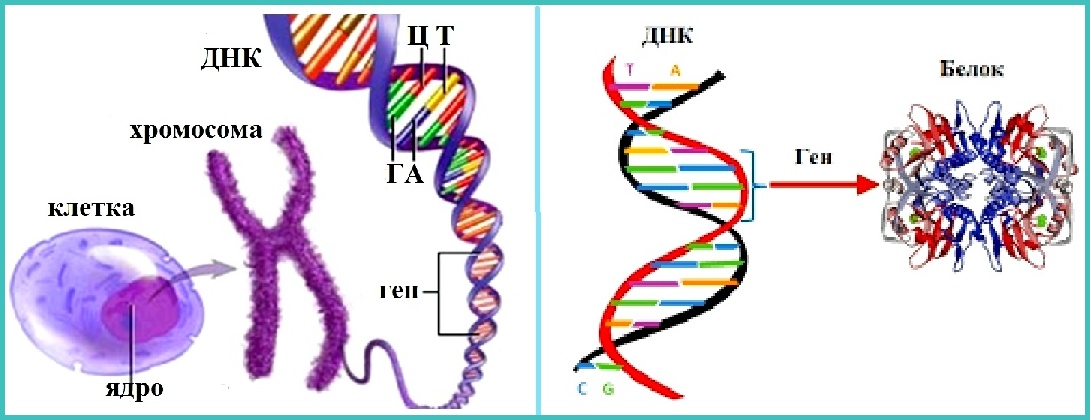
Гены — это небольшие участки молекулы ДНК (дезоксирибонуклеиновой кислоты), в которых закодирована информация о строении одной молекулы белка или РНК (рибонуклеиновой кислоты).
ДНК, РНК и белки — это строительные материалы для всех живых организмов. Поэтому информация, которую несет ген, очень важна: благодаря ей организм «знает», какие белки ему производить. В этом смысле ген часто сравнивают с чертежом или планом, по которому организм строит себя.
Ген — самый маленький кусочек, на который можно разделить ДНК. Его можно «разобрать» на более мелкие химические элементы, но именно ген передается от родителей потомству как одно целое.
Его можно «разобрать» на более мелкие химические элементы, но именно ген передается от родителей потомству как одно целое.
У растений, грибов, животных и человека ДНК находятся в ядре любой клетки организма. Форма ДНК — перекрещивающиеся «нити»-хромосомы. Если мы увеличим ДНК и «растянем» ее на отдельные цепочки то увидим гены — отдельные участки ДНК.
Точное число генов в организме одного человека пока неизвестно: мы знаем только приблизительные данные, например, что генов, кодирующих белки, у человека около 20 тыс.
Еще в середине XIX века Грегор Мендель и другие ученые высказывали предположения, что наследование специфических черт у организмов происходит при помощи особых частиц. В 1889 году голландский ботаник, один из основателей генетики Хуго де Фриз в своей книге «Внутриклеточный пангенезис» (Intracellular Pangenesis) назвал такие частицы «пангенами», а в 1909 году датский биолог Вильгельм Иогансен ввел термин «ген». В 40-е годы XX века американские бактериологи доказали, что передача признаков от одного организма к другому происходит именно при помощи ДНК, а не других белков или химических соединений. Еще через несколько лет были получены первые высококачественные снимки структуры ДНК. С этого момента изучение отдельных участков ДНК — генов — пошло полным ходом.
Еще через несколько лет были получены первые высококачественные снимки структуры ДНК. С этого момента изучение отдельных участков ДНК — генов — пошло полным ходом.
Самый крупный международный проект, когда-либо проводившийся в биологии, — проект «Геном человека». Он был начат в 1990 году в США. Геном — это вся совокупность ДНК человека, включая всю информацию, которая содержится в генах.
Считается, что 85% генома человека к 2003 году были «прочитаны» или, говоря научным языком, секвенированы. И хотя проект уже закрыт, до сих пор термин «полная расшифровка генома человека» употребляют с осторожностью — к 2022 году около 8% генома остается «непрочитанным».
Когда в 2003 проект «Геном человека» был завершен, весь на тот момент расшифрованный человеческий геном был опубликован в 23 томах. Они содержат 3 млрд букв, обозначающих последовательности генов. Все книги находятся в лондонском музее Wellcome Collection.
(Фото: Phys.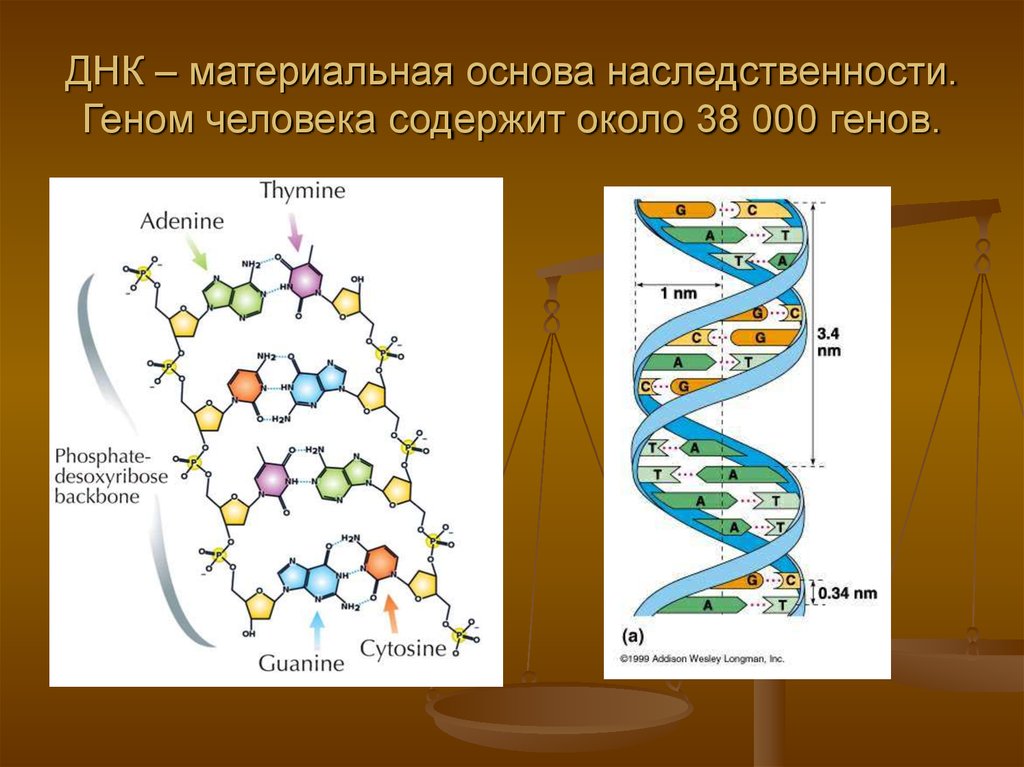 org)
org)
Доминантные и рецессивные гены
Аллели — это варианты одного гена, которых может быть огромное количество. Вариант гена, который подавляет другие, называется доминантным аллелем. Доминантный аллель будет подавлять вторую вариацию — рецессивную.
От родителей ребенку могут перейти и доминантные, и рецессивные варианты гена. Но рецессивный ген проявит себя только в том случае, если он присутствует у обоих родителей. В противном случае его подавит доминантный ген.
Самый популярный пример — цвет глаз. Карий цвет — доминантный признак, а за серые, голубые и зеленые глаза отвечает рецессивный ген. Но и у кареглазых родителей (как на рисунке) может родиться голубоглазый ребенок, хотя вероятность этого небольшая. Это произойдет в случае, если ребенок получил два рецессивных гена.
(Фото: «Лекции по общей биологии», Пименова И.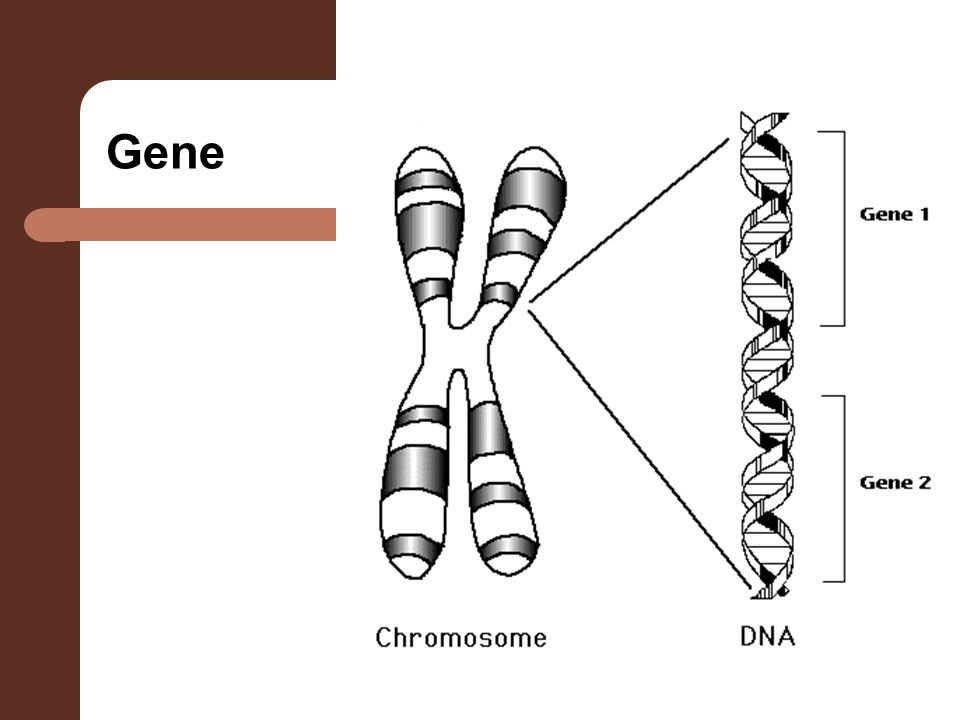 Н., Пименов А.В.)
Н., Пименов А.В.)
По наследству могут передаваться и другие внешние признаки: рост, цвет кожи, волос, какие-то отличительные черты. Это зависит от доминантных генов, которые передаются со стороны отца и матери.
Гены и наследственность
В большинстве клеток человека находится 23 пары хромосом ДНК, то есть 46 на клетку. Исключение составляют «родительские» клетки — сперматозоид и яйцеклетка. У каждой из них «половинный» набор — только 23 штуки. Когда половые клетки объединяются, они формируют зародыш, где гены из разных наборов встречаются друг с другом. И в каждом участке ДНК, ответственном за какой-либо признак, оказываются два гена. Но в виде внешнего признака проявится только доминантный ген, который подавит действие другого, рецессивного гена.
Это описание — очень упрощенная схема наследования. У разных организмов наследование может проявляться по-разному. Например, выделяют типы наследственности с полным и неполным доминированием:
При полном доминировании доминантный ген полностью подавляет рецессивный, который «маскируется», то есть совсем не проявляется. Так наследуется резус-фактор у человека, цвет волос и глаз.
Так наследуется резус-фактор у человека, цвет волос и глаз.
При неполном доминировании встречаются два доминантных или два рецессивных гена, и ни один не может подавить другой. В этом случае появляется новый признак, отличный от родительского. Пример — волнистые волосы как результат взаимодействия кудрявых и прямых волос родителей. Или промежуточные цвета кожи и волос.
Не все типы наследования хорошо изучены: например, некоторые генетические заболевания пока невозможно классифицировать ни по одному из типов. Изучением механизмов наследования, зависимостью заболеваний от генетической предрасположенности и условий окружающей среды занимается медицинская генетика.
На что влияют гены
Гены, полученные от родителей, во многом определяют:
- внешний облик человека: цвет кожи, глаз и волос, форму глаз, носа, ушей, рост, длину рук и размер ноги;
- физические качества: например, типы телосложения или скорость обмена веществ;
- предрасположенность или устойчивость к определенным болезням.

Многие важные параметры зависят не только от генов. Например, последние исследования говорят о том, что продолжительность жизни человека определяется наследственным факторами только на 15–30%, остальное зависит от среды и случайности. И даже эти процентные соотношения неточны: часто генетикам трудно отделить наследственные факторы от влияния среды.
То же касается и умственных способностей. Вопрос, можно ли унаследовать высокий интеллект — предмет ожесточенных споров, в том числе и в науке. Некоторые параметры мозга, например, размеры разных участков мозга, действительно зависят от генов — по меньшей мере на 85%, как говорят некоторые ученые. Но однозначные выводы о непременном наследовании интеллекта, таланта и гениальности сделать пока невозможно. Ученые убеждены, что «хорошие» гены помогают быстрее учиться и легче осваивать трудные дисциплины, но так же сильно на интеллект влияют образование и образ жизни.
Семья Иоганна Себастиана Баха обычно приводится в качестве примера передачи музыкального таланта по наследству.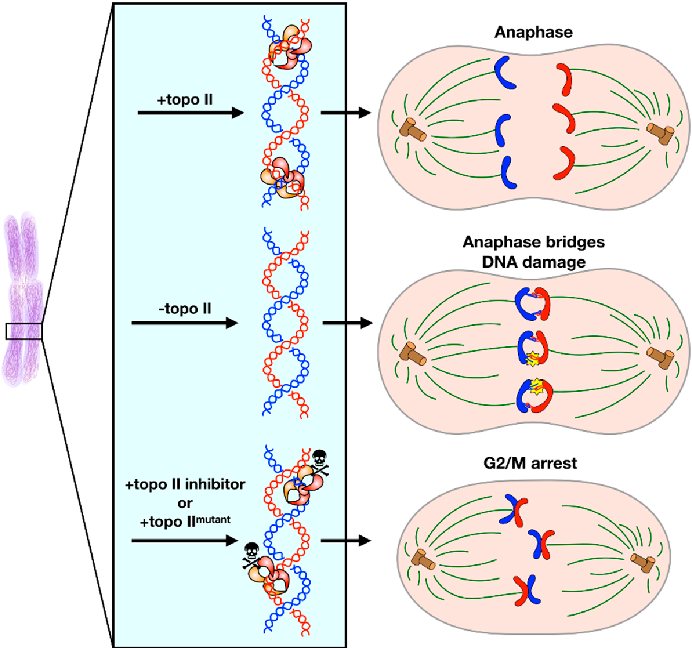 Среди 7 поколений ученые насчитывают более 20 талантливых музыкантов.
Среди 7 поколений ученые насчитывают более 20 талантливых музыкантов.
С психическими заболеваниями все тоже неоднозначно. Пока ученые не обнаружили ни одного гена, который может вызвать ту или иную психическую болезнь. Таких генов не существует — в том смысле, в каком есть гены цвета глаз, или гены, ответственные за определенные генетические заболевания. При этом обнаружены гены, которые увеличивают риск психического заболевания, например шизофрении или биполярного расстройства — на 5% или менее.
Влияют ли гены на характер?
Ученые также ищут связи между генами и поведением человека. Генетика поведения изучает, насколько гены определяют семейные отношения, социальные связи и даже политические убеждения. Несмотря на то, что четкой и однозначной связи между ними не обнаружено, ученые пришли к выводу, что определенные мутации генов могут менять поведение. Муха-дрозофил, у которой был определенный вариант особого гена, искала корм активнее, чем носители другого варианта. У людей ученые нашли участок гена, который соотносится с альтруизмом — взаимопомощью и добротой. Он влияет в том числе и на семейную жизнь: женщины, которым достался муж с «неправильным» вариантом гена, обычно недовольны отношениями в семье.
У людей ученые нашли участок гена, который соотносится с альтруизмом — взаимопомощью и добротой. Он влияет в том числе и на семейную жизнь: женщины, которым достался муж с «неправильным» вариантом гена, обычно недовольны отношениями в семье.
Константин Хоманов, врач-терапевт, клинический фармаколог, основатель приложения «Справочник Врача» и «Мое Здоровье» подчеркивает, что особенности поведения или характер нельзя объяснить только патологиями или особым набором генов. Но иногда изменения в генах могут вызвать нарушения аминокислотного, углеводного, жирового обмена — от этого страдает головной мозг и могут появиться специфические черты личности.
Анна Волкова, биохимик, нутрициолог и специалист по работе с генетическими тестами Basis Genomic Group, рассказывает, что гены определяют характер, склонность к заболеваниям, спортивные таланты, здоровье кожи и даже предпочтения в еде. Все основы нашего метаболизма заложены природой. Например, ген DRD4 отвечает за чувствительность нейронов к дофамину. Дофамин — это гормон радости, азарта, предвкушения и стремления к прекрасному. Есть несколько вариантов этого гена. Если чувствительность к дофамину низкая, то человек предпочитает тихий спокойный образ жизни, а если высокая — это охотник за яркими впечатлениями.
Дофамин — это гормон радости, азарта, предвкушения и стремления к прекрасному. Есть несколько вариантов этого гена. Если чувствительность к дофамину низкая, то человек предпочитает тихий спокойный образ жизни, а если высокая — это охотник за яркими впечатлениями.
Еще один ген — FTO, кодирует белок, участвующий в энергетическом балансе. Если этот ген изменен, то такого белка вырабатывается мало, и человек постоянно испытывает голод. Чувство насыщения запаздывает, что приводит к перееданию и частым обильным перекусам. Предпочтения в еде, скорее всего, будут тоже нездоровые: выпечка, сладости, жирные жареные блюда, фаст-фуд. Носителям такого измененного гена нужно следить за своим рационом, быть физически активными и в целом вести здоровый образ жизни.
Почему возникают мутации генов
Генная мутация — это изменение, происходящее на маленьком участке ДНК, внутри одного гена, которое может быть унаследовано потомками. Изменения на более длинном участке ДНК называются хромосомными. Есть еще геномные мутации — изменения, затрагивающие целые хромосомы в геноме. У человека геномные мутации обычно приводят к тяжелым наследственным заболеваниям: например, к синдрому Шерешевского-Тернера, характеризующемуся физическим, умственным и половым недоразвитием у носителя этой мутации.
Есть еще геномные мутации — изменения, затрагивающие целые хромосомы в геноме. У человека геномные мутации обычно приводят к тяжелым наследственным заболеваниям: например, к синдрому Шерешевского-Тернера, характеризующемуся физическим, умственным и половым недоразвитием у носителя этой мутации.
А вот последствия генных мутаций могут быть разными: некоторые из них связаны с генетическими особенностями или заболеваниями, такими как дальтонизм или гемофилия. Другие мутации дают своим носителями способности, которые пригодились бы каждому: например, люди с мутацией гена hDEC2 чувствуют себя отдохнувшими после всего 4 часов сна.
Редкая мутация дистихиаз была у американской актрисы Элизабет Тейлор. У нее был дополнительный ряд ресниц позади нормально растущих, что делало ее глаза очень выразительными. Эта аномалия довольно редкая у людей, но часто встречается у собак.
(Фото: Pinterest. com)
com)
Что такое мутагенные факторы
Факторы, способствующие появлению мутаций, называются мутагенными. К таким факторам относится, например, радиация: в облученных клетках происходит повреждение ДНК. Еще в 1927 году американский генетик и впоследствии лауреат Нобелевской премии Герман Меллер продемонстрировал, что облучение рентгеновскими лучами приводит к существенному увеличению частоты мутаций у мухи-дрозофилы.
Вирусы как биологический фактор также является причиной мутации — около 8% ДНК человека приходится на фрагменты древних вирусов. Эти фрагменты встроились в геном в древние времена, когда человечество переживало пандемии. Некоторые современные исследования подтверждают, что фрагменты генома коронавируса COVID-19 тоже способны встраиваться в геном человека.
Есть и химические вещества, которые вызывают мутации ДНК — например, бензол, который входит в состав нефти и бензина. Если человек надышится парами бензола, то может умереть. Даже в небольших количествах бензол может вызвать мутации, приводящие к раковым заболеваниям.
Даже в небольших количествах бензол может вызвать мутации, приводящие к раковым заболеваниям.
Мутации — необходимое условие многообразия жизни на планете. Без них живые существа не смогли бы приспособиться к постоянно меняющимся условиям существования. Но у этого есть и своя отрицательная сторона — последствия от мутаций для отдельного организма могут быть фатальными. Радует то, что только небольшой процент генетических изменений вызывает генетические отклонения. Большинство мутаций не оказывают никакого влияния на развитие и здоровье человека.
Зачем изучать свои гены
Генетическое тестирование — это метод, с помощью которого можно выявить мутации в генах. Генетические тесты отличаются друг от друга по технологии: например, полимеразная цепная реакция исследует набор конкретных участков ДНК, а секвенирование нового поколения (NGS) может прочесть за один раз большинство участков полного генома человека. Врач-генетик знает о преимуществах и недостатках методов и посоветует пациенту подходящий, исходя из его проблемы.
Обращаются за генетическим исследованием, чтобы:
- диагностировать заболевание, тип заболевания, а иногда найти причину и варианты лечения — например, при определенных видах онкологии генетическое тестирование очень важно;
- определить риск заболеть определенным заболеваниям;
- измерить риск передачи заболевания потомкам;
- определить непереносимость каких-то лекарств;
- обследовать эмбрион или плод на предмет генетических мутаций.
Примерно один из 200 человек расположен к мутации в генах BRCA1 или BRCA2. Эти мутации в том числе повышают риск развития рака молочной железы, от которого умерла мать Анджелины Джоли. Сама актриса сделала генетическое тестирование, которое показало 87% вероятность развития рака груди и 50% вероятность развития рака яичников в течение жизни. Чтобы снизить риски до минимальных, в 2013 году Анджелине Джоли провели профилактическую двустороннюю мастэктомию и реконструкцию груди.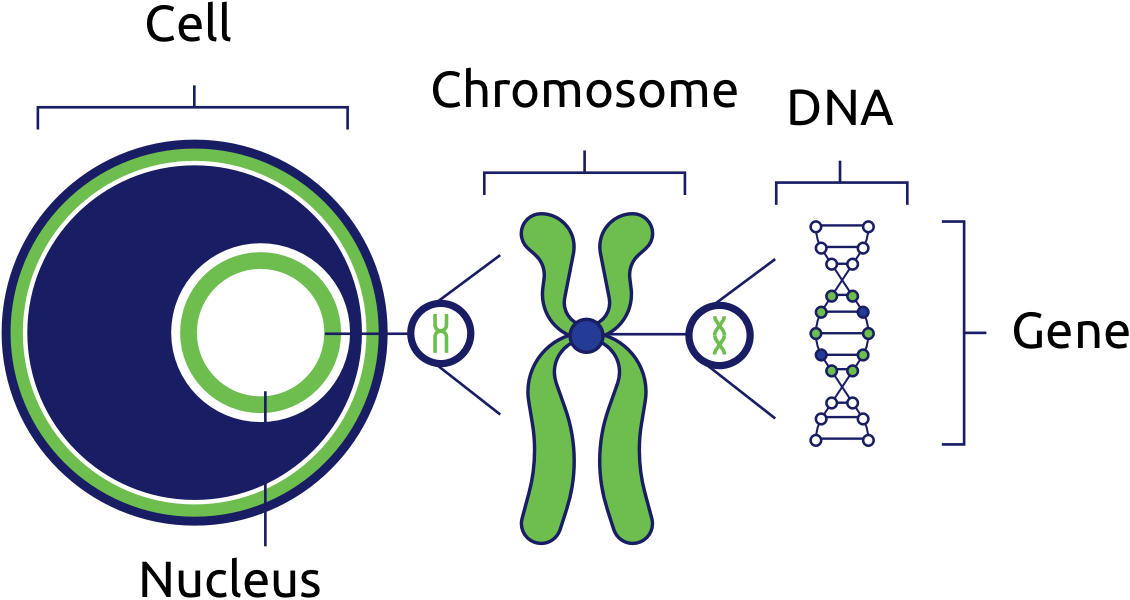
(Фото: Akns-images.eonline.com)
Генетические тесты делают и государственные, и крупные частные лаборатории, их востребованность с каждым годом увеличивается. Константин Хоманов объясняет, что часто по направлению от врача-генетика генетическое тестирование проходят, чтобы поставить верный диагноз у детей, иногда — взрослым. Тесты дают врачу и пациенту информацию для персонализированного лечения — чтобы правильно спланировать беременность или успеть начать лечение ребенка до прогрессирования патологии. Например, лечение самым дорогим лекарством в мире — «Золгесма», которое заменяет отсутствующий или нерабочий ген на его функциональную копию, лучше проводить до двухлетнего возраста. Если диагноз поставлен слишком поздно, то в получении лекарства могут отказать.
Наверное, самые «известные» генетические тесты — это ДНК-тесты на родство. С их помощью можно не только определить отцовство или материнство, но и в целом степень родственных отношений между людьми. Кроме того, пользуются популярностью тесты на определение генетических болезней перед зачатием или ЭКО, в ранние сроки беременности — это так называемый неинвазивный пренатальный тест (НИПТ).
Кроме того, пользуются популярностью тесты на определение генетических болезней перед зачатием или ЭКО, в ранние сроки беременности — это так называемый неинвазивный пренатальный тест (НИПТ).
А еще генетическое тестирование помогает определить свой этнический состав. Национальность человека по ДНК узнать нельзя, так как она определяется не генетикой, а самосознанием. Но зато можно выяснить, сколько различных народов оставили след в геноме. С помощью тестов можно выявить предрасположенность к алкогольной и другим зависимостям и даже суицидальному поведению.
Генетические тестирование пригодится и людям, увлеченным спортом. Анна Волкова поясняет, что есть несколько генов, которые отвечают за выносливость, если они «правильные», то такому человеку подойдет бег на длинные дистанции, плавание, лыжи, коньки, велосипед. При других генетических особенностях можно выбрать другой вид спорта — силовой или забеги на короткие дистанции. Также с помощью специальных генетических тестов можно определить скорость восстановления после физической нагрузки.
Зная о своих генетических особенностях, можно предупредить хронические заболевания или смягчить их проявления. Ведь генетика определяет до 50%, остальное — это наш образ жизни и среда, в которой мы обитаем.
(Фото: Unsplash)
Что такое ДНК и из чего состоит геном человека?
Генетика — сложная наука, но в то же время информация и рассуждения о генах и наследственности окружают нас со всех сторон. Причем звучат они не только от специалистов. Друзья делают генетические тесты, родственники говорят, что у вас могут быть наследственные проблемы со здоровьем, а в новостях пишут о том, что в будущем станет возможно «проектировать» детей на генетическом уровне.
В этой статье расскажем, как обстоят дела на самом деле.
Содержание
- Что такое геном?
- Хромосомы и ДНК
- Нуклеотиды и гены
- Что «записано» в генах и как их прочитать?
- Что такое «мусорная ДНК»
- Чем геном отличается от генотипа
- Чем геномика отличается от генетики
- Что показывают генетические тесты
- Проект «Геном человека»
Что такое геном?
Геном — это совокупность всего генетического материала, который находится в клетке человеческого организма и определяет его характеристики.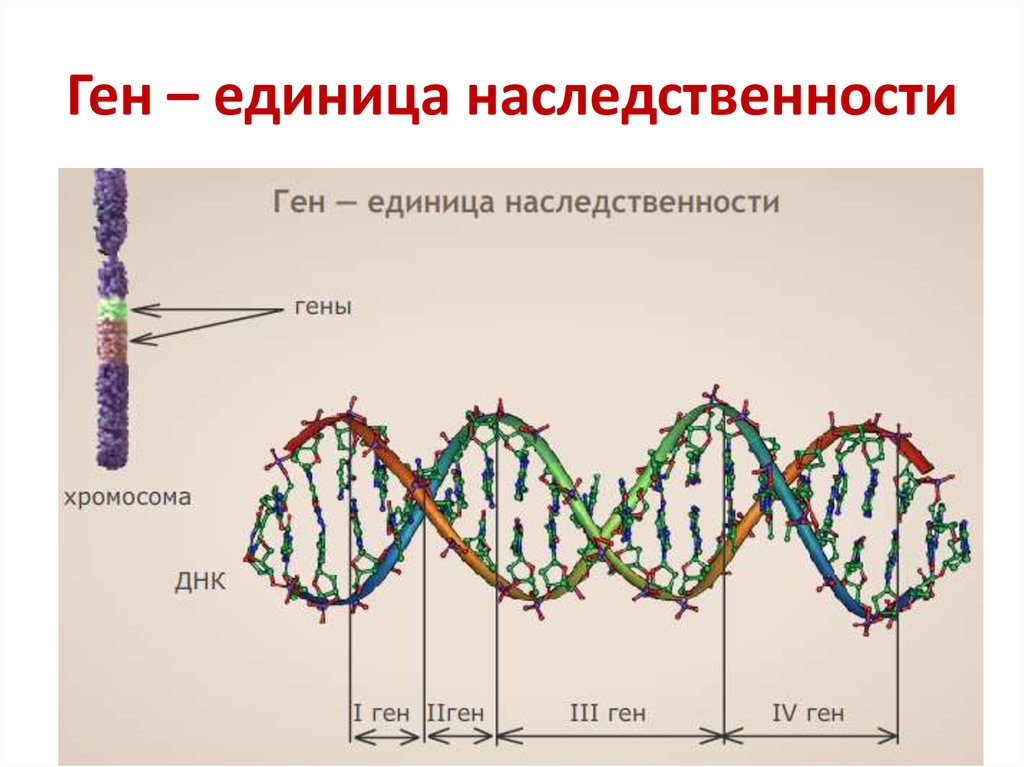
Каждый геном уникален. Именно он определяет, как будет развиваться тело человека, как он будет расти, какая у него будет внешность и как она будет меняться с возрастом.
В геноме также заложено то, как будут работать клетки, ткани и органы тела.
Разберем, из чего состоит геном и как он «хранится» в клетках.
Хромосомы и ДНК
Почти во всех клетках нашего тела есть ядра. Их можно сравнить с «командным центром», который дает клеткам указания расти, делиться или умирать.
Именно в ядре находятся хромосомы. Это структуры, в которых сосредоточена большая часть генетической информации. Каждая хромосома представляет собой одну плотно «упакованную» длинную нить ДНК.
В каждой нормальной клетке человека 23 пары хромосом, то есть всего их 46.
Исключение составляют «родительские» клетки — сперматозоид и яйцеклетка. В каждой из них находится половинный набор хромосом, то есть 23 штуки.
ДНК (дезоксирибонуклеиновая кислота) — это длинная молекула, которую принято называть «двойной спиралью».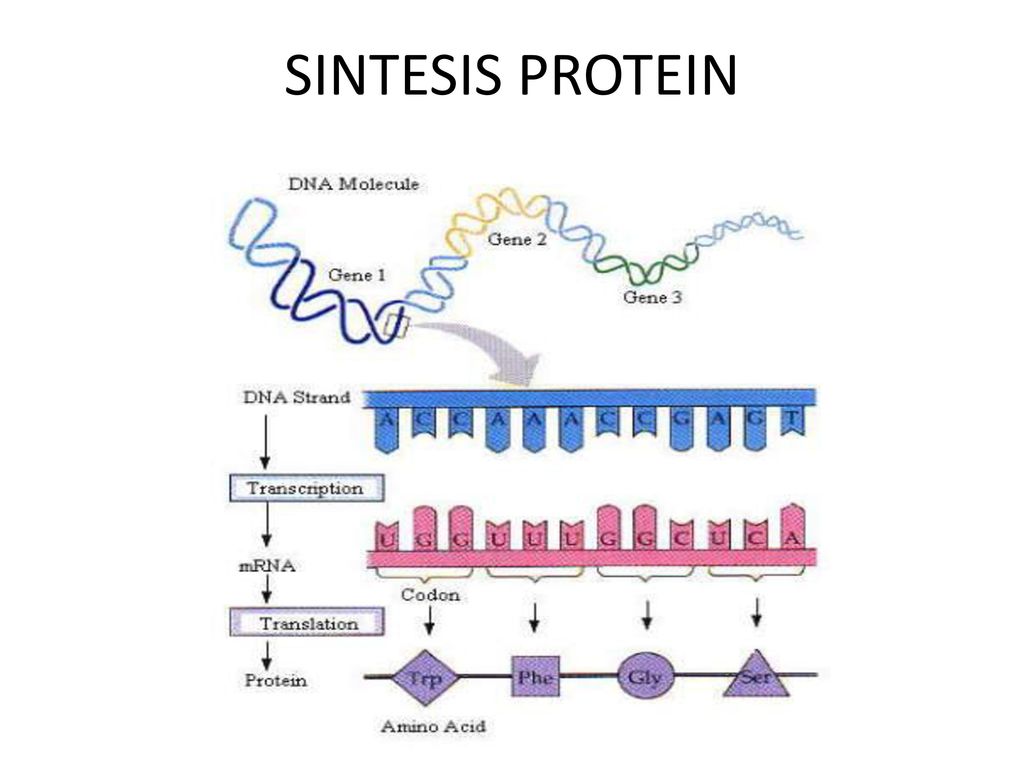 Она хранит биологическую информацию, которая «записана» в виде генетического кода.
Она хранит биологическую информацию, которая «записана» в виде генетического кода.
ДНК — это длинная нить, построенная из нуклеотидов. Гены — отрезки этой нити.
Нуклеотиды и гены
Информация в ДНК записана в виде кода, состоящего из четырех азотистых оснований:
- аденин,
- гуанин,
- цитозин,
- тимин.
Основания одной цепи соединяются с основаниями другой цепи парами (аденин с тимином, цитозин с гуанином). Каждое основание присоединяется к молекуле сахара и молекуле фосфата — вся эта конструкция называется нуклеотидом.
Посмотрите еще раз на двойную спираль ДНК: ее горизонтальные «ступени» — это и есть пары оснований, а вертикальные боковые части — сахара и фосфаты.
Теперь, когда мы поняли, как устроена двойная цепочка ДНК, настало время поговорить о генах. Ген — это основная «единица» наследственной информации, и он представляет собой «кусочек» ДНК, то есть некоторое количество нуклеотидов.
Что «записано» в генах и как их прочитать?
У каждого человека есть две копии большинства генов — по одной от отца и от матери. Большинство генов одинаковы для всех людей, но малая часть (около 1%) немного отличаются от человека к человеку.
Большинство генов одинаковы для всех людей, но малая часть (около 1%) немного отличаются от человека к человеку.
Именно этот 1% генов отвечает за уникальные физические особенности каждого из нас.
Ученым известно, что каждый человек обладает 20—25 тысячами генов. В части генов в виде кода записаны «рецепты» изготовления белков. Именно белки выполняют основные функции для поддержания жизнедеятельности организма: они отвечают за пищеварение, кровообращение, иммунитет, передачу информации между клетками.
Чтобы изготовить белки по записанному в генах коду, специальные соединения — ферменты — «читают» и копируют этот код. В результате получаются длинные одноцепочечные молекулы — РНК (рибонуклеиновые кислоты), но это еще не белок.
РНК лишь несут в себе информацию о первичной структуре белка, поэтому их называют матричными (сокращенно — мРНК). Эти молекулы покидают ядро клетки и перемещаются в ее цитоплазму. Там специальные органы — рибосомы — считывают код мРНК и изготавливают по этому «рецепту» белок.
Что такое «мусорная ДНК»
Лишь около 1% ДНК составляют гены, которые кодируют белки.
Считается, что остальные 98—99% ДНК не несут в себе подобной информации. Поэтому долгое время эту часть ДНК считали бесполезной — отсюда и ее название, «мусорная ДНК».
Однако сейчас известно, что на самом деле она выполняет ряд важных функций. В частности, может «включать» и «выключать» гены, регулируя их активность и, как следствие, выработку белков.
Некоторые участки некодирующей ДНК необходимы для нормального процесса синтеза белков, кроме того, она служит для защиты хромосом — специальные сегменты некодирующей ДНК (теломеры) «закрывают» концы хромосом и предохраняют от разрушения при делении клетки.
Чем геном отличается от генотипа
И геном, и генотип — это совокупность генов организма. Изначально отличие заключалось в масштабе.
Генотип — это совокупность генов одного человека. От генотипа зависят внешние черты — рост, цвет кожи, глаз, тип волос и так далее. Внешние признаки, закодированные в генотипе, называются фенотипом.
Внешние признаки, закодированные в генотипе, называются фенотипом.
Геном — это совокупность всей генетической информации отдельного человека, включая некодирующую и митохондриальную ДНК. Так как отличия между геномами представителей одного и того же вида незначительны, можно также сказать, что
генотип характеризует одну особь, а геном — вид.
Чем геномика отличается от генетики
Изучением ДНК, нуклеотидов и в целом работы генов занимаются геномика и генетика.
Генетика — это наука, которая изучает гены и их вариации, а также процессы наследования генов и изменчивость признаков человека.
Другими словами, генетики изучают, как определенные черты и свойства организма (в том числе и наследственные заболевания) передаются из поколения в поколение, а также как работа разных генов влияет на организм.
Геномика — это более новый термин. Геномика исследует геном, то есть всю совокупность генов организма, в том числе их взаимодействие как друг с другом, так и с окружающей средой.
Геномика включает в себя и изучение заболеваний, но не сугубо генетических, а таких, которые вызываются комбинацией генетических факторов и факторов окружающей среды, например, болезней сердца, астмы, диабета, рака.
Геномика предлагает новые возможности терапии и лечения некоторых сложных заболеваний, а также новые методы диагностики.
Что показывают генетические тесты
Сегодня исследовать свою ДНК очень просто — для этого нужно всего лишь сдать кровь или слюну на генетическое исследование. Но генетические тесты бывают разные.
- Стандартное диагностическое тестирование — используется для подтверждения или исключения определенного генетического заболевания;
- Тест на наличие наследственных заболеваний — проводят до или во время беременности, чтобы определить риск их появления у ребенка;
- Генетический скрининг новорожденных — стандартная процедура, которая проводится для выявления ряда наследственных заболеваний;
- Прогностическое генетическое тестирование — позволяет оценить предрасположенность к развитию ряда заболеваний (например, рака молочной железы) в более позднем возрасте;
- фармакогенетическое тестирование — показывает, может ли генетика человека влиять на его реакцию на лекарства.

Но и это лишь часть возможностей. Так, с помощью генетического теста можно получить более разнообразную информацию.
Генетический тест Атлас позволяет не только узнать о рисках развития ряда заболеваний, но и, например, получить информацию предрасположенности к непереносимости продуктов, вероятности получения спортивных травм. Кроме того, с помощью теста можно узнать о других генетически обусловленных особенностях организма, выяснить, к каким популяциям относились ваши предки и даже найти дальних родственников.
Проект «Геном человека»
Проект«Геном человека» — самый масштабный международный проект по изучению человеческого генома. Он стартовал в 1990 году и формально был завершен в 2003 году. Фактически цели проекта были выполнены только в 2022 году.
Главная цель проекта — полная расшифровка человеческого генома — определение последовательности пар оснований, которые составляют ДНК, а также выявление всех генов и определение их функций.
К 2003 году ученые смогли «прочитать» 92% «букв» в ДНК. Тогда пробелы не считались важными. Оставшиеся 151 миллион пар оснований (примерно 8% генома) относились к «мусорной» ДНК.
Однако за прошедшие годы ученые, используя новейшие технологии, смогли прочитать геном до конца. Оказалось, что остававшиеся непрочитанными 8% генома несут в себе важную информацию, благодаря которой исследователи смогут по-новому интерпретировать полученные ранее данные.
Статьи о генетике в блоге Атласа:
- Что такое эпигенетика
- Генная терапия
- Кто такой врач-генетик и чем он может помочь
- Very Well Health, What Are Genes, DNA, and Chromosomes? 2022
- Your Genome, What is a genome? 2017
- Medline Plus, What is DNA? 2021
- National Human Genome Research Institute, Genome
- National Human Genome Research Institute, Human Genome Project
ДНК. Основные понятия.
Главная \ 3. Пробиотики \ Пробиотики \ ДНК прокариот и эукариот
Справа крупнейшая спираль ДНК человека, выстроенная из людей на пляже в Варне (Болгария), вошедшая в книгу рекордов Гиннесса 23 апреля 2016 года
Дезоксирибонуклеиновая кислота.
 Общие сведения
Общие сведения
Содержание страницы:
- Дезоксирибонуклеиновая кислота
- Строение нуклеиновых кислот
- Репликация
- Строение РНК
- Транскрипция
- Трансляция
- Генетический код
- Геном: гены и хромосомы
- Прокариоты
- Эукариоты
- Строение генов
- Строение генов прокариот
- Строение генов эукариот
- Сравнение строения генов
- Мутации и мутагенез
- Генные мутации
- Хромосомные мутации
- Геномные мутации
- Видео по теме ДНК
- Дополнительный материал
ДНК (дезоксирибонуклеиновая кислота) – своеобразный чертеж жизни, сложный код, в котором заключены данные о наследственной информации. Эта сложная макромолекула способна хранить и передавать наследственную генетическую информацию из поколения в поколение. ДНК определяет такие свойства любого живого организма как наследственность и изменчивость.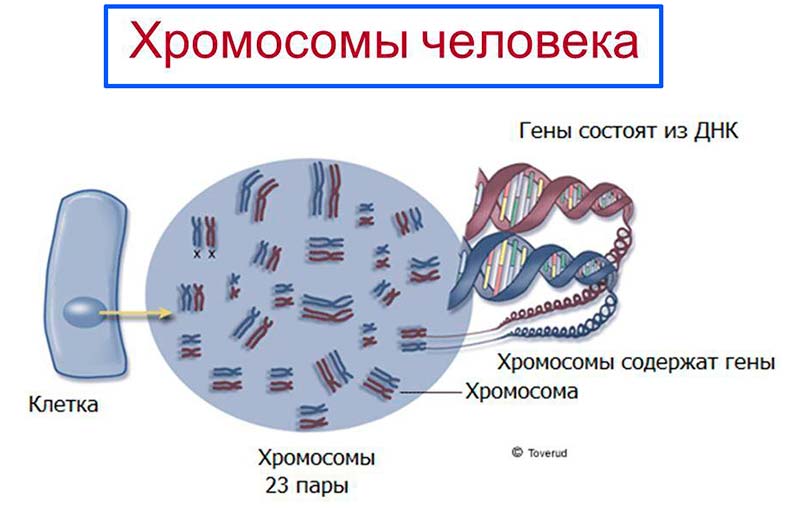 Закодированная в ней информация задает всю программу развития любого живого организма. Генетически заложенные факторы предопределяют весь ход жизни как человека, так и любого др. организхма. Искусственное или естественное воздействие внешней среды способны лишь в незначительной степени повлиять на общую выраженность отдельных генетических признаков или сказаться на развитии запрограммированных процессов.
Закодированная в ней информация задает всю программу развития любого живого организма. Генетически заложенные факторы предопределяют весь ход жизни как человека, так и любого др. организхма. Искусственное или естественное воздействие внешней среды способны лишь в незначительной степени повлиять на общую выраженность отдельных генетических признаков или сказаться на развитии запрограммированных процессов.
Дезоксирибонуклеи́новая кислота (ДНК) — макромолекула (одна из трёх основных, две другие — РНК и белки), обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
В клетках эукариот (животных, растений и грибов) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами.
У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами.
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы (С) и фосфатной (Ф) группы (фосфодиэфирные связи).
Рис. 2. Нуклертид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы
В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула закручена по винтовой линии.
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин).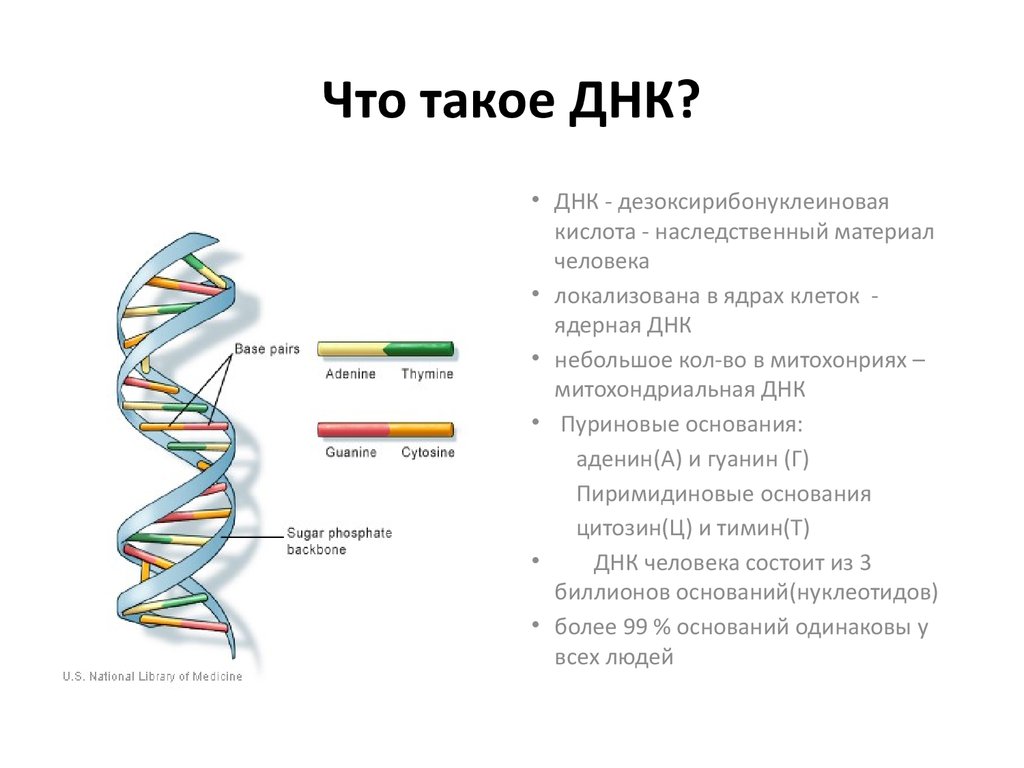 Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином (А-Т), гуанин — только с цитозином (Г-Ц). Именно эти пары и составляют «перекладины» винтовой «лестницы» ДНК (см.: рис. 2, 3 и 4).
Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином (А-Т), гуанин — только с цитозином (Г-Ц). Именно эти пары и составляют «перекладины» винтовой «лестницы» ДНК (см.: рис. 2, 3 и 4).
Рис. 2. Азотистые основания
Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции.
Рис. 3. Репликация ДНК
Расположение базовых комбинаций химических соединений ДНК и количественные соотношения между этими комбинациями обеспечивают кодирование наследственной информации.
Образование новой ДНК (репликация)
- Процесс репликации: раскручивание двойной спирали ДНК — синтез комплементарных цепей ДНК-полимеразой — образование двух молекул ДНК из одной.
- Двойная спираль «расстегивается» на две ветви, когда ферменты разрушают связь между базовыми парами химических соединений.
- Каждая ветвь является элементом новой ДНК. Новые базовые пары соединяются в той же последовательности, что и в родительской ветви.
По завершении дупликации образуются две самостоятельные спирали, созданные из химических соединений родительской ДНК и имеющие с ней одинаковый генетический код. Таким путем ДНК способна перерывать информацию от клетки к клетке.
Более подробная информация:
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
Рис. 4 . Азотистые основания: аденин, гуанин, цитозин, тимин
Дезоксирибонуклеиновая кислота (ДНК) относится к нуклеиновым кислотам. Нуклеиновые кислоты – это класс нерегулярных биополимеров, мономерами которых являются нуклеотиды.
Нуклеиновые кислоты – это класс нерегулярных биополимеров, мономерами которых являются нуклеотиды.
НУКЛЕОТИДЫ состоят из азотистого основания, соединенного с пятиуглеродным углеводом (пентозой) – дезоксирибозой (в случае ДНК) или рибозой (в случае РНК), который соединяется с остатком фосфорной кислоты (H2PO3–).
Азотистые основания бывают двух типов: пиримидиновые основания – урацил (только в РНК), цитозин и тимин, пуриновые основания – аденин и гуанин.
Рис. 5. Структура нуклеотидов (слева), расположение нуклеотида в ДНК (снизу) и типы азотистых оснований (справа): пиримидиновые и пуриновые
Атомы углерода в молекуле пентозы нумеруются числами от 1 до 5. Фосфат соединяется с третьим и пятым атомами углерода. Так нуклеинотиды соединяются в цепь нуклеиновой кислоты. Таким образом, мы можем выделить 3’ и 5’-концы цепи ДНК:
Рис. 6. Выделение 3’ и 5’-концов цепи ДНК
6. Выделение 3’ и 5’-концов цепи ДНК
Две цепи ДНК образуют двойную спираль. Эти цепи в спирали сориентированы в противоположных направлениях. В разных цепях ДНК азотистые основания соединены между собой с помощью водородных связей. Аденин всегда соединяется с тимином, а цитозин – с гуанином. Это называется правилом комплементарности (см. принцип комплементарности).
Правило комплементарности:
| A–T G–C |
Например, если нам дана цепь ДНК, имеющая последовательность
3’– ATGTCCTAGCTGCTCG – 5’,
то вторая ей цепь будет комплементарна и направлена в противоположном направлении – от 5’-конца к 3’-концу:
5’– TACAGGATCGACGAGC– 3’.
Рис. 7. Направленность цепей молекулы ДНК и соединение азотистых оснований с помощью водородных связей
РЕПЛИКАЦИЯ ДНК
Репликация ДНК – это процесс удвоения молекулы ДНК путем матричного синтеза.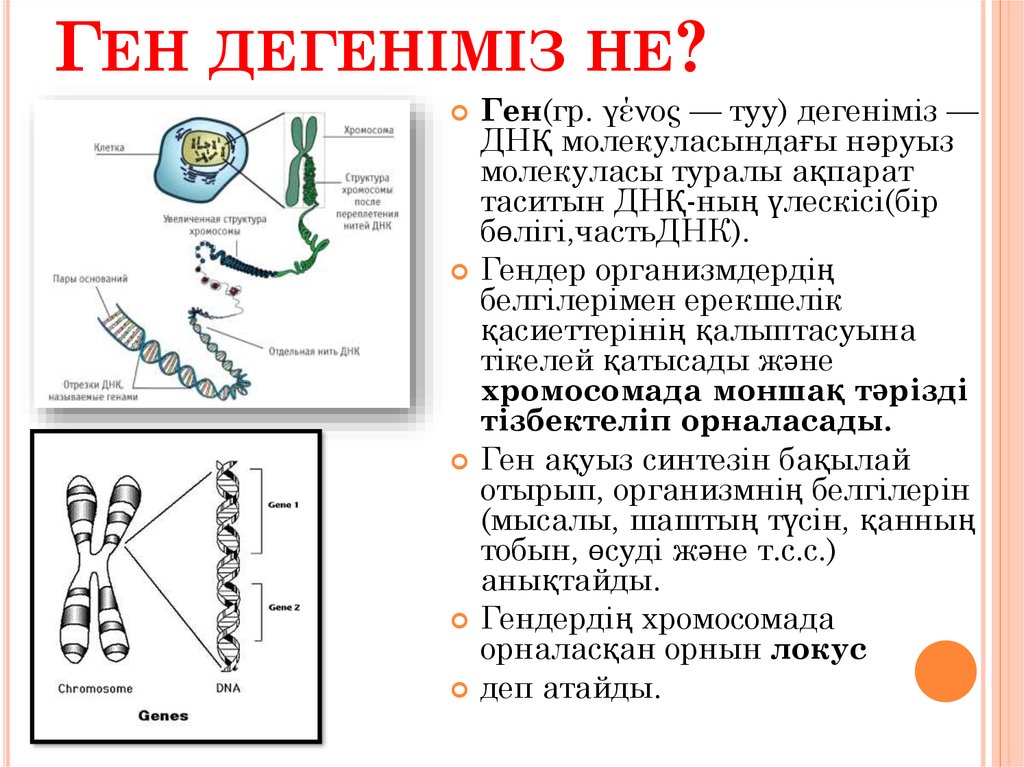 В большинстве случаев естественной репликации ДНК праймером для синтеза ДНК является короткий фрагмент РНК (создаваемый заново). Такой рибонуклеотидный праймер создается ферментом праймазой (ДНК-праймаза у прокариот, ДНК-полимераза у эукариот), и впоследствии заменяется дезоксирибонуклеотидами полимеразой, выполняющей в норме функции репарации (исправления химических повреждений и разрывов в молекле ДНК).
В большинстве случаев естественной репликации ДНК праймером для синтеза ДНК является короткий фрагмент РНК (создаваемый заново). Такой рибонуклеотидный праймер создается ферментом праймазой (ДНК-праймаза у прокариот, ДНК-полимераза у эукариот), и впоследствии заменяется дезоксирибонуклеотидами полимеразой, выполняющей в норме функции репарации (исправления химических повреждений и разрывов в молекле ДНК).
Репликация происходит по полуконсервативному механизму. Это значит, что двойная спираль ДНК расплетается и на каждой из ее цепей по принципу комплементарности достраивается новая цепь. Дочерняя молекула ДНК, таким образом, содержит в себе одну цепь от материнской молекулы и одну вновь синтезированную. Репликация происходит в направлении от 3’ к 5’ концу материнской цепи.
Рис. 8. Репликация (удвоение) молекулы ДНК
ДНК-синтез – это не такой сложный процесс, как может показаться на первый взгляд. Если подумать, то для начала нужно разобраться, что же такое синтез. Это процесс объединения чего-либо в одно целое. Образование новой молекулы ДНК проходит в несколько этапов:
Если подумать, то для начала нужно разобраться, что же такое синтез. Это процесс объединения чего-либо в одно целое. Образование новой молекулы ДНК проходит в несколько этапов:
1) ДНК-топоизомераза, располагаясь перед вилкой репликации, разрезает ДНК для того, чтобы облегчить ее расплетание и раскручивание.
2) ДНК-хеликаза вслед за топоизомеразой влияет на процесс «расплетения» спирали ДНК.
3) ДНК-связывающие белки осуществляют связывание нитей ДНК, а также проводят их стабилизацию, не допуская их прилипания друг к другу.
4) ДНК-полимераза δ (дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5’→3′ на матрице материнской нити ДНК по направлению от ее 3′-конца к 5′-концу (скорость до 100 пар нуклеотидов в секунду). Этим события на данной материнской нити ДНК ограничиваются.
Рис. 9. Схематическое изображение процесса репликации ДНК: (1) Отстающая цепь (запаздывающая нить), (2) Ведущая цепь (лидирующая нить), (3) ДНК-полимераза α (Polα), (4) ДНК-лигаза, (5) РНК-праймер, (6) Праймаза, (7) Фрагмент Оказаки, (8) ДНК-полимераза δ (Polδ), (9) Хеликаза, (10) Однонитевые ДНК-связывающие белки, (11) Топоизомераза.
Далее описан синтез отстающей цепи дочерней ДНК (см. Схему репликативной вилки и функции ферментов репликации)
Нагляднее о репликации ДНК см. видео →
5) Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (альфа) и в направлении 5’→3′ синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК.
Вместо ДНК-полимеразы α к 3′-концу праймера присоединяется ДНК-полимераза ε.
6) ДНК-полимераза ε (эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи.
После этого данный фермент удаляется с цепи.
7) ДНК-полимераза β (бета) встает вместо ДНК-полимеразы ε, движется в том же направлении (5’→3′) и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи.
В результате на матрице материнской нити «лежит» фрагмент дочерней ДНК. Он называется фрагмент Оказаки.
8) ДНК-лигаза производит сшивку двух соседних фрагментов Оказаки, т.е. 5′-конца отрезка, синтезированного ДНК-полимеразой ε, и 3′-конца цепи, встроенного ДНК-полимеразой β.
СТРОЕНИЕ РНК
Рибонуклеиновая кислота (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.
Так же, как ДНК, РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Однако в отличие от ДНК, РНК обычно имеет не две цепи, а одну. Пентоза в РНК представлена рибозой, а не дезоксирибозой (у рибозы присутствует дополнительная гидроксильная группа на втором атоме углевода). Наконец, ДНК отличается от РНК по составу азотистых оснований: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами.
Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией, т.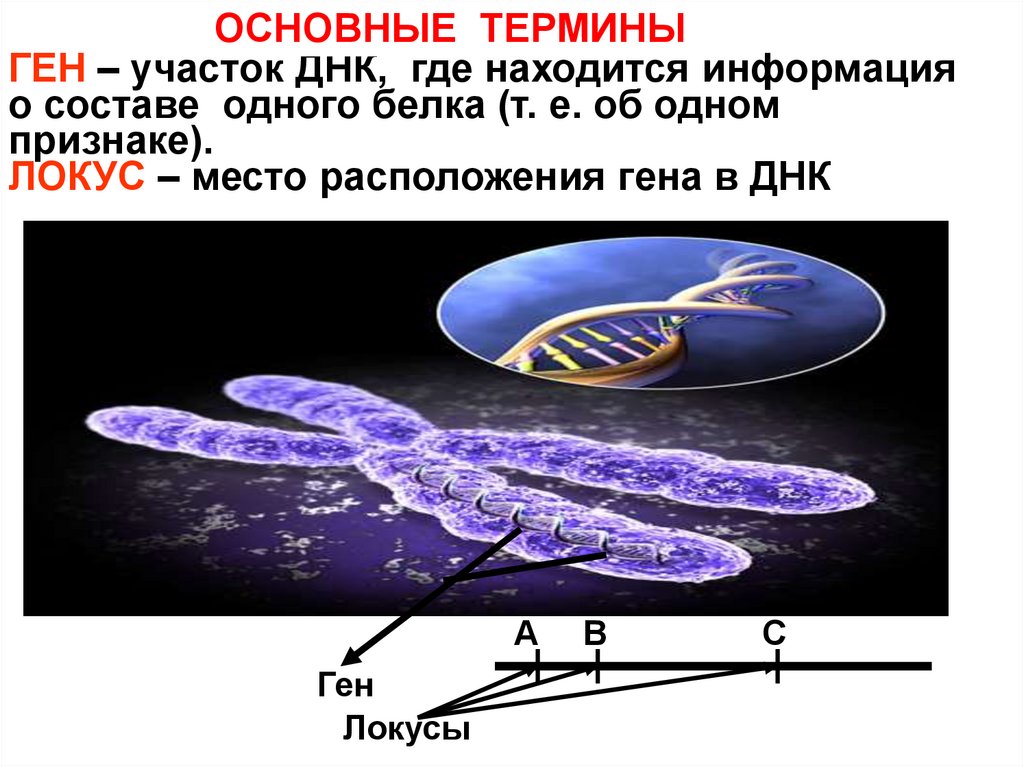 е. синтеза белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
е. синтеза белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
Рис. 10. Отличие ДНК от РНК по азотистому основанию: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
ТРАНСКРИПЦИЯ
Транскрипция – это процесс синтеза РНК на матрице ДНК. ДНК раскручивается на одном из участков. На одной из цепей содержится информация, которую необходимо скопировать на молекулу РНК – эта цепь называется кодирующей. Вторая цепь ДНК, комплементарная кодирующей, называется матричной. В процессе транскрипции на матричной цепи в направлении 3’ – 5’ (по цепи ДНК) синтезируется комплементарная ей цепь РНК. Таким образом, создается РНК-копия кодирующей цепи.
Рис. 11. Схематическое изображение транскрипции
Например, если нам дана последовательность кодирующей цепи
3’– ATGTCCTAGCTGCTCG – 5’,
то, по правилу комплементарности, матричная цепь будет нести последовательность
5’– TACAGGATCGACGAGC– 3’,
а синтезируемая с нее РНК – последовательность
3’– AUGUCCUAGCUGCUCG – 5’.
ТРАНСЛЯЦИЯ
Рассмотрим механизм синтеза белка на матрице РНК, а также генетический код и его свойства. Также для наглядности по ниже приведенной ссылке рекомендуем посмотреть небольшое видео о процессах транскрипции и трансляции, происходящих в живой клетке:
В представленном видоролике (кнопка-ссылка слева) показан процесс образования белка из аминокислот. Наглядно (в анимированном варианте) продемонстрированы процессы транскрипции и трансляции. Биосинтез белка на рибосоме также кратко описан в разделе Аминокислоты белков. Более подробное видео о геноме, ДНК и ее структуре, а также процессах кодировки представленно ниже на данной странице: Видео по теме ДНК |
Рис. 12. Процесс синтеза белка: ДНК кодирует РНК, РНК кодирует белок
Трансляция — это процесс, посредством которого генетическая информация преобразуется в белки, рабочие лошадки клетки. Небольшие молекулы, называемые переносными РНК («тРНК»), играют решающую роль в трансляции; они являются молекулами-адаптерами, которые соответствуют кодонам (строительным блокам генетической информации) с аминокислотами (строительными блоками белков). Организмы несут множество типов тРНК, каждая из которых кодируется одним или несколькими генами («набор генов тРНК»).
Небольшие молекулы, называемые переносными РНК («тРНК»), играют решающую роль в трансляции; они являются молекулами-адаптерами, которые соответствуют кодонам (строительным блокам генетической информации) с аминокислотами (строительными блоками белков). Организмы несут множество типов тРНК, каждая из которых кодируется одним или несколькими генами («набор генов тРНК»).
Вообще говоря, функция набора генов тРНК — переводить 61 тип кодонов в 20 различных типов аминокислот — сохраняется в разных организмах. Тем не менее, состав набора генов тРНК может значительно варьировать между организмами.
ГЕНЕТИЧЕСКИЙ КОД
Генетический код — способ кодирования аминокислотной последовательности белков с помощью последовательности нуклеотидов. Каждая аминокислота кодируется последовательностью из трех нуклеотидов — кодоном или триплетом.
Генетический код, общий для большинства про- и эукариот. В таблице приведены все 64 кодона и указаны соответствующие аминокислоты. Порядок оснований — от 5′ к 3′ концу мРНК.
Порядок оснований — от 5′ к 3′ концу мРНК.
Таблица 1. Стандартный генетический код
1-е ние | 2-е основание | 3-е ние | |||||||
U | C | A | G | ||||||
U | UUU | Фенилаланин (Phe/F) | UCU | Серин (Ser/S) | UAU | Тирозин (Tyr/Y) | UGU | Цистеин (Cys/C) | U |
UUC | UCC | UAC | UGC | C | |||||
UUA | Лейцин (Leu/L) | UCA | UAA | Стоп-кодон** | UGA | Стоп-кодон** | A | ||
UUG | UCG | UAG | Стоп-кодон** | UGG | Триптофан (Trp/W) | G | |||
C | CUU | CCU | Пролин (Pro/P) | CAU | Гистидин (His/H) | CGU | Аргинин (Arg/R) | U | |
CUC | CCC | CAC | CGC | C | |||||
CUA | CCA | CAA | Глутамин (Gln/Q) | CGA | A | ||||
CUG | CCG | CAG | CGG | G | |||||
A | AUU | Изолейцин (Ile/I) | ACU | Треонин (Thr/T) | AAU | Аспарагин (Asn/N) | AGU | Серин (Ser/S) | U |
AUC | ACC | AAC | AGC | C | |||||
AUA | ACA | AAA | Лизин (Lys/K) | AGA | Аргинин (Arg/R) | A | |||
AUG | Метионин* (Met/M) | ACG | AAG | AGG | G | ||||
G | GUU | Валин (Val/V) | GCU | Аланин (Ala/A) | GAU | Аспарагиновая кислота (Asp/D) | GGU | Глицин (Gly/G) | U |
GUC | GCC | GAC | GGC | C | |||||
GUA | GCA | GAA | Глутаминовая кислота (Glu/E) | GGA | A | ||||
GUG | GCG | GAG | GGG | G | |||||
Среди триплетов есть 4 специальных последовательности, выполняющих функции «знаков препинания»:
- *Триплет AUG, также кодирующий метионин, называется старт-кодоном.
 С этого кодона начинается синтез молекулы белка. Таким образом, во время синтеза белка, первой аминокислотой в последовательности всегда будет метионин.
С этого кодона начинается синтез молекулы белка. Таким образом, во время синтеза белка, первой аминокислотой в последовательности всегда будет метионин.
- **Триплеты UAA, UAG и UGA называются стоп-кодонами и не кодируют ни одной аминокислоты. На этих последовательностях синтез белка прекращается.
Свойства генетического кода
1. Триплетность. Каждая аминокислота кодируется последовательностью из трех нуклеотидов – триплетом или кодоном.
2. Непрерывность. Между триплетами нет никаких дополнительных нуклеотидов, информация считывается непрерывно.
3. Неперекрываемость. Один нуклеотид не может входить одновременно в два триплета.
4. Однозначность. Один кодон может кодировать только одну аминокислоту.
5. Вырожденность. Одна аминокислота может кодироваться несколькими разными кодонами.
6. Универсальность. Генетический код одинаков для всех живых организмов.
Пример. Нам дана последовательность кодирующей цепи:
3’– CCGATTGCACGTCGATCGTATA– 5’.
Матричная цепь будет иметь последовательность:
5’– GGCTAACGTGCAGCTAGCATAT– 3’.
Теперь «синтезируем» с этой цепи информационную РНК:
3’– CCGAUUGCACGUCGAUCGUAUA– 5’.
Синтез белка идет в направлении 5’ → 3’, следовательно, нам нужно перевернуть последовательность, чтобы «прочитать» генетический код:
5’– AUAUGCUAGCUGCACGUUAGCC– 3’.
Теперь найдем старт-кодон AUG:
5’– AUAUGCUAGCUGCACGUUAGCC– 3’.
Разделим последовательность на триплеты:
Найдем стоп-кодон и согласно таблице генетического кода запишем последовательность аминокислот:
Центральная догма молекулярной биологии звучит следующим образом: информация с ДНК передается на РНК (транскрипция), с РНК – на белок (трансляция). ДНК также может удваиваться путем репликации, и также возможен процесс обратной транскрипции, когда по матрице РНК синтезируется ДНК, но такой процесс в основном характерен для вирусов.
ДНК также может удваиваться путем репликации, и также возможен процесс обратной транскрипции, когда по матрице РНК синтезируется ДНК, но такой процесс в основном характерен для вирусов.
Рис. 13. Центральная догма молекулярной биологии
ГЕНОМ: ГЕНЫ и ХРОМОСОМЫ
(общие понятия)
Геном — совокупность всех генов организма; его полный хромосомный набор.
Термин «геном» был предложен Г. Винклером в 1920 г. для описания совокупности генов, заключенных в гаплоидном наборе хромосом организмов одного биологического вида. Первоначальный смысл этого термина указывал на то, что понятие генома в отличие от генотипа является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось. Известно, что ДНК, которая является носителем генетической информации у большинства организмов и, следовательно, составляет основу генома, включает в себя не только гены в современном смысле этого слова. Большая часть ДНК эукариотических клеток представлена некодирующими («избыточными») последовательностями нуклеотидов, которые не заключают в себе информации о белках и нуклеиновых кислотах. Таким образом, основную часть генома любого организма составляет вся ДНК его гаплоидного набора хромосом.
Большая часть ДНК эукариотических клеток представлена некодирующими («избыточными») последовательностями нуклеотидов, которые не заключают в себе информации о белках и нуклеиновых кислотах. Таким образом, основную часть генома любого организма составляет вся ДНК его гаплоидного набора хромосом.
Гены — это участки молекул ДНК, кодирующие полипептиды и молекулы РНК
За последнее столетие наше представление о генах существенно изменилось. Ранее геном называли участок хромосомы, кодирующий или определяющий один признак или фенотипическое (видимое) свойство, например цвет глаз.
Рис. 14. Соответствие между кодирующими участками ДНК, мРНК и аминокислотной последовательностью полипептидной цепи. |
В 1940 г. Джордж Бидл и Эдвард Тейтем предложили молекулярное определение гена. Ученые обрабатывали споры гриба Neurospora crassa рентгеновским излучением и другими агентами, вызывающими изменения в последовательности ДНК (мутации), и обнаружили мутантные штаммы гриба, утратившие некоторые специфические ферменты, что в некоторых случаях приводило к нарушению целого метаболического пути. Бидл и Тейтем пришли к выводу, что ген — это участок генетического материала, который определяет или кодирует один фермент. Так появилась гипотеза «один ген — один фермент». Позднее эта концепция была расширена до определения «один ген — один полипептид», поскольку многие гены кодируют белки, не являющиеся ферментами, а полипептид может оказаться субъединицей сложного белкового комплекса.
Бидл и Тейтем пришли к выводу, что ген — это участок генетического материала, который определяет или кодирует один фермент. Так появилась гипотеза «один ген — один фермент». Позднее эта концепция была расширена до определения «один ген — один полипептид», поскольку многие гены кодируют белки, не являющиеся ферментами, а полипептид может оказаться субъединицей сложного белкового комплекса.
На рис. 14 показана схема того, как триплеты нуклеотидов в ДНК определяют полипептид — аминокислотную последовательность белка при посредничестве мРНК. Одна из цепей ДНК играет роль матрицы для синтеза мРНК, нуклеотидные триплеты (кодоны) которой комплементарны триплетам ДНК. У некоторых бактерий и многих эукариот кодирующие последовательности прерываются некодирующими участками(так называемыми интронами).
Современное биохимическое определение гена еще более конкретно. Генами называются все участки ДНК, кодирующие первичную последовательность конечных продуктов, к которым относятся полипептиды или РНК, обладающие структурной или каталитической функцией.
Наряду с генами ДНК содержит и другие последовательности, выполняющие исключительно регуляторную функцию. Регуляторные последовательности могут обозначать начало или конец генов, влиять на транскрипцию или указывать место инициации репликации или рекомбинации. Некоторые гены могут экспрессироваться разными путями, при этом один и тот же участок ДНК служит матрицей для образования разных продуктов.
Мы можем приблизительно рассчитать минимальный размер гена, кодирующего средний белок. Каждая аминокислота в полипептидной цепи кодируется последовательностью из трех нуклеотидов; последовательности этих триплетов (кодонов) соответствуют цепочке аминокислот в полипептиде, который кодируется данным геном. Полипептидная цепь из 350 аминокислотных остатков (цепь средней длины) соответствует последовательности из 1050 п.н. (пар нуклеотидов). Однако многие гены эукариот и некоторые гены прокариот прерываются сегментами ДНК, не несущими информации о белке, и поэтому оказываются значительно длиннее, чем показывает простой расчет.
Сколько генов в одной хромосоме?
Рис. 15. Вид хромосом в прокаритической (слева) и эукариотической клеках. Гистоны (Histones) — обширный класс ядерных белков, выполняющих две основные функции: они участвуют в упаковке нитей ДНК в ядре и в эпигенетической регуляции таких ядерных процессов, как транскрипция, репликация и репарация.
ДНК прокариот устроена более просто: их клетки не имеют ядра, поэтому ДНК находится непосредственно в цитоплазме в форме нуклеоида.
Как известно, бактериальные клетки имеют хромосому в виде нити ДНК, уложенной в компактную структуру – нуклеоид. Хромосома прокариота Escherichia coli, чей геном полностью расшифрован, представляет собой кольцевую молекулу ДНК (на самом деле, это не правильный круг, а скорее петля без начала и конца), состоящую из 4 639 675 п.н. В этой последовательности содержится примерно 4300 генов белков и еще 157 генов стабильных молекул РНК.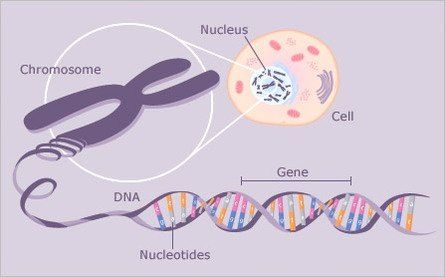 В геноме человека примерно 3,1 млрд пар нуклеотидов, соответствующих почти 29 000 генам, расположенным на 24 разных хромосомах.
В геноме человека примерно 3,1 млрд пар нуклеотидов, соответствующих почти 29 000 генам, расположенным на 24 разных хромосомах.
Прокариоты (Бактерии).
Бактерия E. coli имеет одну двухцепочечную кольцевую молекулу ДНК. Она состоит из 4 639 675 п.н. и достигает в длину примерно 1,7 мм, что превышает длину самой клетки E. coli приблизительно в 850 раз. Помимо крупной кольцевой хромосомы в составе нуклеоида многие бактерии содержат одну или несколько маленьких кольцевых молекул ДНК, свободно располагающихся в цитозоле. Такие внехромосомные элементы называют плазмидами (рис. 16).
Большинство плазмид состоит всего из нескольких тысяч пар нуклеотидов, некоторые содержат более 10000 п. н. Они несут генетическую информацию и реплицируются с образованием дочерних плазмид, которые попадают в дочерние клетки в процессе деления родительской клетки. Плазмиды обнаружены не только в бактериях, но также в дрожжах и других грибах. Во многих случаях плазмиды не дают никаких преимуществ клеткам-хозяевам, и их единственная задача — независимое воспроизведение. Однако некоторые плазмиды несут полезные для хозяина гены. Например, содержащиеся в плазмидах гены могут придавать клеткам бактерий устойчивость к антибактериальным агентам. Плазмиды, несущие ген β-лактамазы, обеспечивают устойчивость к β-лактамным антибиотикам, таким как пенициллин и амоксициллин. Плазмиды могут переходить от клеток, устойчивых к антибиотикам, к другим клеткам того же или другого вида бактерий, в результате чего эти клетки также становятся резистентными. Интенсивное применение антибиотиков является мощным селективным фактором, способствующим распространению плазмид, кодирующих устойчивость к антибиотикам (а также транспозонов, которые кодируют аналогичные гены) среди болезнетворных бактерий, и приводит к появлению бактериальных штаммов с устойчивостью к нескольким антибиотикам. Врачи начинают понимать опасность широкого использования антибиотиков и назначают их только в случае острой необходимости.
Во многих случаях плазмиды не дают никаких преимуществ клеткам-хозяевам, и их единственная задача — независимое воспроизведение. Однако некоторые плазмиды несут полезные для хозяина гены. Например, содержащиеся в плазмидах гены могут придавать клеткам бактерий устойчивость к антибактериальным агентам. Плазмиды, несущие ген β-лактамазы, обеспечивают устойчивость к β-лактамным антибиотикам, таким как пенициллин и амоксициллин. Плазмиды могут переходить от клеток, устойчивых к антибиотикам, к другим клеткам того же или другого вида бактерий, в результате чего эти клетки также становятся резистентными. Интенсивное применение антибиотиков является мощным селективным фактором, способствующим распространению плазмид, кодирующих устойчивость к антибиотикам (а также транспозонов, которые кодируют аналогичные гены) среди болезнетворных бактерий, и приводит к появлению бактериальных штаммов с устойчивостью к нескольким антибиотикам. Врачи начинают понимать опасность широкого использования антибиотиков и назначают их только в случае острой необходимости. По аналогичным причинам ограничивается широкое использование антибиотиков для лечения сельскохозяйственных животных.
По аналогичным причинам ограничивается широкое использование антибиотиков для лечения сельскохозяйственных животных.
См. также: Равин Н.В., Шестаков С.В. Геном прокариот // Вавиловский журнал генетики и селекции, 2013. Т. 17. № 4/2. С. 972–984.
Эукариоты.
Таблица 2. ДНК, гены и хромосомы некоторых организмов
Общая ДНК, п.н. | Число хромосом* | Примерное число генов | |
Escherichia coli (бактерия) | 4 639 675 | 1 | 4 435 |
Saccharomyces cerevisiae (дрожжи) | 12 080 000 | 16** | 5 860 |
Caenorhabditis elegans (нематода) | 90 269 800 | 12*** | 23 000 |
Arabidopsis thaliana (растение) | 119 186 200 | 10 | 33 000 |
Drosophila melanogaster (плодовая мушка) | 120 367 260 | 18 | 20 000 |
Oryza sativa (рис) | 480 000 000 | 24 | 57 000 |
Mus musculus (мышь) | 2 634 266 500 | 40 | 27 000 |
Homo sapiens (человек) | 3 070 128 600 | 46 | 29 000 |
Примечание. Информация постоянно обновляется; для получения более свежей информации обратитесь к сайтам, посвященным отдельным геномным проектам
Информация постоянно обновляется; для получения более свежей информации обратитесь к сайтам, посвященным отдельным геномным проектам
*Для всех эукариот, кроме дрожжей, приводится диплоидный набор хромосом. Диплоидный набор хромосом (от греч. diploos- двойной и eidos- вид) – двойной набор хромосом (2n), каждая из которых имеет себе гомологичную.
**Гаплоидный набор. Дикие штаммы дрожжей обычно имеют восемь (октаплоидный) или больше наборов таких хромосом.
***Для самок с двумя Х хромосомами. У самцов есть Х хромосома, но нет Y, т. е. всего 11 хромосом.
В клетке дрожжей, одних из самых маленьких эукариот, в 2,6 раза больше ДНК, чем в клетке E. coli (табл. 2). Клетки плодовой мушки Drosophila, классического объекта генетических исследований, содержат в 35 раз больше ДНК, а клетки человека — примерно в 700 раз больше ДНК, чем клетки E. coli. Многие растения и амфибии содержат еще больше ДНК. Генетический материал клеток эукариот организован в виде хромосом. Диплоидный набор хромосом (2n) зависит от вида организма (табл. 2).
Генетический материал клеток эукариот организован в виде хромосом. Диплоидный набор хромосом (2n) зависит от вида организма (табл. 2).
Например, в соматической клетке человека 46 хромосом (рис. 17). Каждая хромосома эукариотической клетки, как показано на рис. 17, а, содержит одну очень крупную двухспиральную молекулу ДНК. Двадцать четыре хромосомы человека (22 парные хромосомы и две половые хромосомы X и Y) различаются по длине более чем в 25 раз. Каждая хромосома эукариот содержит определенный набор генов.
Рис. 17. Хромосомы эукариот. а — пара связанных и конденсированных сестринских хроматид из хромосомы человека. В такой форме эукариотические хромосомы пребывают после репликации и в метафазе в процессе митоза. б — полный набор хромосом из лейкоцита одного из авторов книги. В каждой нормальной соматической клетке человека содержится 46 хромосом.
Размер и функция ДНК как матрицы для хранения и передачи наследственного материала объясняют наличие особых структурных элементов в организации этой молекулы. У высших организмов ДНК распределена между хромосомами.
У высших организмов ДНК распределена между хромосомами.
Совокупность ДНК (хромосом) организма называется геномом. Хромосомы находятся в клеточном ядре и формируют структуру, называемую хроматином. Хроматин представляет собой комплекс ДНК и основных белков (гистонов) в соотношении 1:1. Длину ДНК обычно измеряют числом пар комплементарных нуклеотидов (п.н.). Например, 3-я хромосома человека представляет собой молекулу ДНК размером 160 млн п.н.. Выделенная линеаризованная ДНК размером 3*106 п.н. имеет длину примерно 1 мм, следовательно, линеаризованная молекула 3-й хромосомы человека была бы 5 мм в длину, а ДНК всех 23 хромосом (~3*109 п.н., MR = 1,8*1012) гаплоидной клетки – яйцеклетки или сперматозоида – в линеаризованном виде составляла бы 1 м. За исключением половых клеток, все клетки организма человека (их около 1013) содержат двойной набор хромосом. При клеточном делении все 46 молекул ДНК реплицируются и снова организуются в 46 хромосом.
Если соединить между собой молекулы ДНК человеческого генома (22 хромосомы и хромосомы X и Y или Х и Х), получится последовательность длиной около одного метра. Прим.: У всех млекопитающих и других организмов с гетерогаметным мужским полом, у самок две X-хромосомы (XX), а у самцов — одна X-хромосома и одна Y-хромосома (XY).
Большинство клеток человека диплоидны, поэтому общая длина ДНК таких клеток около 2м. У взрослого человека примерно 1014 клеток, таким образом, общая длина всех молекул ДНК составляет 2・1011 км. Для сравнения, окружность Земли — 4・104 км, а расстояние от Земли до Солнца — 1,5・108 км. Вот как удивительно компактно упакована ДНК в наших клетках!
В клетках эукариот есть и другие органеллы, содержащие ДНК, — это митохондрии и хлоропласты. Выдвигалось множество гипотез относительно происхождения ДНК митохондрий и хлоропластов. Общепризнанная сегодня точка зрения заключается в том, что они представляют собой рудименты хромосом древних бактерий, которые проникли в цитоплазму хозяйских клеток и стали предшественниками этих органелл. Митохондриальная ДНК кодирует митохондриальные тРНК и рРНК, а также несколько митохондриальных белков. Более 95% митохондриальных белков кодируется ядерной ДНК.
Митохондриальная ДНК кодирует митохондриальные тРНК и рРНК, а также несколько митохондриальных белков. Более 95% митохондриальных белков кодируется ядерной ДНК.
СТРОЕНИЕ ГЕНОВ
Рассмотрим строение гена у прокариот и эукариот, их сходства и различия. Несмотря на то, что ген — это участок ДНК, кодирующий всего один белок или РНК, кроме непосредственно кодирующей части, он также включает в себя регуляторные и иные структурные элементы, имеющие разное строение у прокариот и эукариот.
Кодирующая последовательность – основная структурно-функциональная единица гена, именно в ней находятся триплеты нуклеотидов, кодирующие аминокислотную последовательность. Она начинается со старт-кодона и заканчивается стоп-кодоном.
До и после кодирующей последовательности находятся нетранслируемые 5’- и 3’-последовательности. Они выполняют регуляторные и вспомогательные функции, например, обеспечивают посадку рибосомы на и-РНК.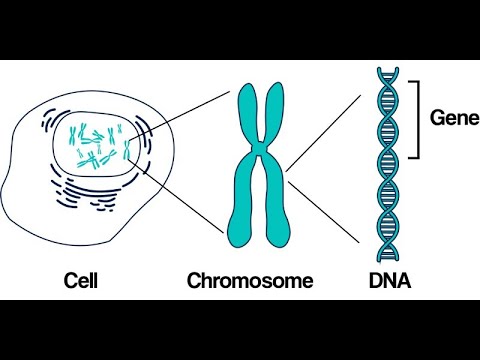
Нетранслируемые и кодирующая последовательности составлют единицу транскрипции – транскрибируемый участок ДНК, то есть участок ДНК, с которого происходит синтез и-РНК.
Терминатор – нетранскрибируемый участок ДНК в конце гена, на котором останавливается синтез РНК.
В начале гена находится регуляторная область, включающая в себя промотор и оператор.
Промотор – последовательность, с которой связывается полимераза в процессе инициации транскрипции. Оператор – это область, с которой могут связываться специальные белки – репрессоры, которые могут уменьшать активность синтеза РНК с этого гена – иначе говоря, уменьшать его экспрессию.
Строение генов у прокариот
Общий план строения генов у прокариот и эукариот не отличается – и те, и другие содержат регуляторную область с промотором и оператором, единицу транскрипции с кодирующей и нетранслируемыми последовательностями и терминатор.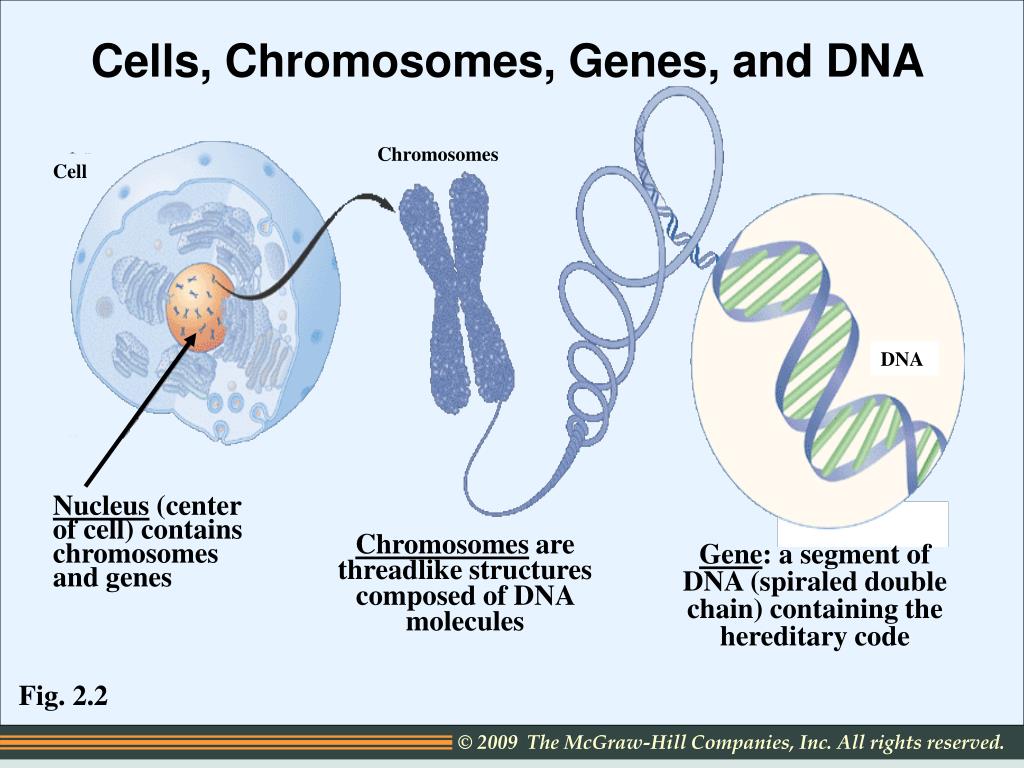 Однако организация генов у прокариот и эукариот отличается.
Однако организация генов у прокариот и эукариот отличается.
Рис. 18. Схема строения гена у прокариот (бактерий) — изображение увеличивается
В начале и в конце оперона есть единые регуляторные области для нескольких структурных генов. С транскрибируемого участка оперона считывается одна молекула и-РНК, которая содержит несколько кодирующих последовательностей, в каждой из которых есть свой старт- и стоп-кодон. С каждого из таких участков синтезируется один белок. Таким образом, с одной молекулы и-РНК синтезируется несколько молекул белка.
Для прокариот характерно объединение нескольких генов в единую функциональную единицу – оперон. Работу оперона могут регулировать другие гены, которые могут быть заметно удалены от самого оперона – регуляторы. Белок, транслируемый с этого гена называется репрессор. Он связывается с оператором оперона, регулируя экспрессию сразу всех генов, в нем содержащихся.
Для прокариот также характерно явление сопряжения транскрипции и трансляции.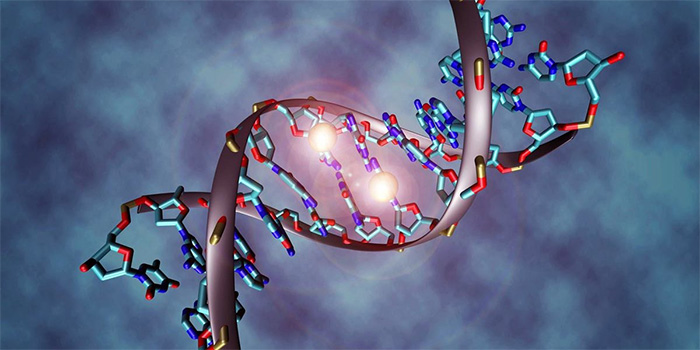
Рис. 19 Явление сопряжения транскрипции и трансляции у прокариот — изображение увеличивается
Такое сопряжение не встречается у эукариот из-за наличия у них ядерной оболочки, отделяющей цитоплазму, где происходит трансляция, от генетического материала, на котором происходит транскрипция. У прокариот во время синтеза РНК на матрице ДНК с синтезируемой молекулой РНК может сразу связываться рибосома. Таким образом, трансляция начинается еще до завершения транскрипции. Более того, с одной молекулой РНК может одновременно связываться несколько рибосом, синтезируя сразу несколько молекул одного белка.
Строение генов у эукариот
Гены и хромосомы эукариот очень сложно организованы
У бактерий многих видов всего одна хромосома, и почти во всех случаях в каждой хромосоме присутствует по одной копии каждого гена. Лишь немногие гены, например гены рРНК, содержатся в нескольких копиях. Гены и регуляторные последовательности составляют практически весь геном прокариот. Более того, почти каждый ген строго соответствует аминокислотной последовательности (или последовательности РНК), которую он кодирует (рис. 14).
Более того, почти каждый ген строго соответствует аминокислотной последовательности (или последовательности РНК), которую он кодирует (рис. 14).
Структурная и функциональная организация генов эукариот гораздо сложнее. Исследование хромосом эукариот, а позднее секвенирование полных последовательностей геномов эукариот принесло много сюрпризов. Многие, если не большинство, генов эукариот обладают интересной особенностью: их нуклеотидные последовательности содержат один или несколько участков ДНК, в которых не кодируется аминокислотная последовательность полипептидного продукта. Такие нетранслируемые вставки нарушают прямое соответствие между нуклеотидной последовательностью гена и аминокислотной последовательностью кодируемого полипептида. Эти нетранслируемые сегменты в составе генов называют интронами, или встроенными последовательностями, а кодирующие сегменты — экзонами. У прокариот лишь немногие гены содержат интроны.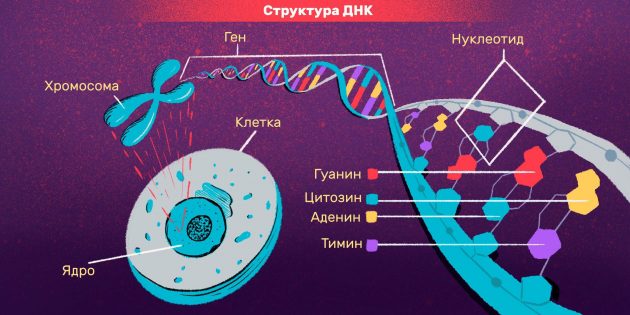
Итак, у эукариот практически не встречается объединение генов в опероны, и кодирующая последовательность гена эукариот чаще всего разделена на транслируемые участки – экзоны, и нетранслируемые участки – интроны.
В большинстве случаев функция интронов не установлена. В целом, лишь около 1,5% ДНК человека являются ≪кодирующими≫, т. е. несут информацию о белках или РНК. Однако с учетом крупных интронов получается, что ДНК человека на 30% состоит из генов. Поскольку гены составляют относительно небольшую долю в геноме человека, значительная часть ДНК остается неучтенной.
Рис. 16. Схема строение гена у эукариот — изображение увеличивается
С каждого гена сначала синтезируется незрелая, или пре-РНК, которая содержит в себе как интроны, так и экзоны.
После этого проходит процесс сплайсинга, в результате которого интронные участки вырезаются, и образуется зрелая иРНК, с которой может быть синтезирован белок.
Рис. 20. Процесс альтернативного сплайсинга — изображение увеличивается
Такая организация генов позволяет, например, осуществить процесс альтернативного сплайсинга, когда с одного гена могут быть синтезированы разные формы белка, за счет того, что в процессе сплайсинга экзоны могут сшиваться в разных последовательностях.
Сравнение строения генов прокариот и эукариот
Рис. 21. Отличия в строении генов прокариот и эукариот — изображение увеличивается
МУТАЦИИ И МУТАГЕНЕЗ
Мутацией называется стойкое изменение генотипа, то есть изменение нуклеотидной последовательности.
Процесс, который приводит к возникновению мутаций называется мутагенезом, а организм, все клетки которого несут одну и ту же мутацию — мутантом.
Мутационная теория была впервые сформулирована Гуго де Фризом в 1903 году. Современный ее вариант включает в себя следующие положения:
1. Мутации возникают внезапно, скачкообразно.
2. Мутации передаются из поколения в поколение.
3. Мутации могут быть полезными, вредными или нейтральными, доминантными или рецессивными.
4. Вероятность обнаружения мутаций зависит от числа исследованных особей.
5. Сходные мутации могут возникать повторно.
6. Мутации не направленны.
Мутации могут возникать под действием различных факторов. Различают мутации, возникшие под действием мутагенных воздействий: физических (например, ультрафиолета или радиации), химических (например, колхицина или активных форм кислорода) и биологических (например, вирусов). Также мутации могут быть вызваны ошибками репликации.
В зависимости от условий появления мутации подразделяют на спонтанные — то есть мутации, возникшие в нормальных условиях, и индуцированые — то есть мутации, которые возникли при особых условиях.
Мутации могут возникать не только в ядерной ДНК, но и, например, в ДНК митохондрий или пластид. Соответственно, мы можем выделять ядерные и цитоплазматические мутации.
В результате возникновения мутаций часто могут появляться новые аллели. Если мутантный аллель подавляет действие нормального, мутация называется доминантной. Если нормальный аллель подавляет мутантный, такая мутация называется рецессивной. Большинство мутаций, приводящих к возникновению новых аллелей являются рецессивными.
По эффекту выделяют мутации адаптивные, приводящие к повышению приспособленности организма к среде, нейтральные, не влияющие на выживаемость, вредные, понижающие приспособленность организмов к условиям среды и летальные, приводящие к смерти организма на ранних стадиях развития.
По последствиям выделяются мутации, приводящие к потери функции белка, мутации, приводящие к возникновению у белка новой функции, а также мутации, которые изменяют дозу гена, и, соответственно, дозу белка синтезируемого с него.
Мутация может возникнуть к любой клетке организма. Если мутация возникает в половой клетке, она называется герминативной (герминальной, или генеративной). Такие мутации не проявляются у того организма, у которого они появились, но приводят к появлению мутантов в потомстве и передаются по наследству, поэтому они важны для генетики и эволюции. Если мутация возникает в любой другой клетке, она называется соматической. Такая мутация может в той или иной степени проявляться у того организма, у которого она возникла, например, приводить к образованию раковых опухолей. Однако такая мутация не передается по наследству и не влияет на потомков.
Мутации могут затрагивать разные по размеру участки генома. Выделяют генные, хромосомные и геномные мутации.
Генные мутации
Мутации, которые возникают в масштабе меньшем, чем один ген, называются генными, или точечными (точковыми). Такие мутации приводят к изменению одного и нескольких нуклеотидов в последовательности. Среди генных мутаций выделяют замены, приводящие к замене одного нуклеотида на другой, делеции, приводящие к выпадению одного из нуклеотидов, инсерции, приводящие к добавлению лишнего нуклеотида в последовательность.
Такие мутации приводят к изменению одного и нескольких нуклеотидов в последовательности. Среди генных мутаций выделяют замены, приводящие к замене одного нуклеотида на другой, делеции, приводящие к выпадению одного из нуклеотидов, инсерции, приводящие к добавлению лишнего нуклеотида в последовательность.
Рис. 23. Генные (точечные) мутации
По механизму воздействия на белок, генные мутации делят на: синонимичные, которые (в результате вырожденности генетического кода) не приводят к изменению аминокислотного состава белкового продукта, миссенс-мутации, которые приводят к замене одной аминокислоты на другую и могут влиять на структуру синтезируемого белка, хотя часто они оказываются незначительными, нонсенс-мутации, приводящие к замене кодирующего кодона на стоп-кодон, мутации, приводящие к нарушению сплайсинга:
Рис. 24. Схемы мутаций
Также по механизму воздействия на белок выделяют мутации, приводящие к сдвигу рамки считывания, например, инсерции и делеции. Такие мутации, как и нонсенс-мутации, хоть и возникают в одной точке гена, часто воздействуют на всю структуру белка, что может привести к полному изменению его структуры.
Такие мутации, как и нонсенс-мутации, хоть и возникают в одной точке гена, часто воздействуют на всю структуру белка, что может привести к полному изменению его структуры.
Рис. 25. Схема мутации, приводящей к сдвигу рамки считывания
Хромосомные мутации
Рис. 26. Хромосомные абберации
Хромосомными мутациями называются мутации, которые затрагивают отдельные гены в рамках одной хромосомы. Различают делеции, когда теряется один или несколько генов, дупликации, когда удваивается тот или иной ген или несколько генов, инверсии, когда участок хромосомы поворачивается на 180 градусов, транслокации, когда гены переходят с одной хромосомы на другую.
Рис. 27. Схемы хромосомных мутаций: делеции, дупликации, инверсии
Рис. 28. Транслокация | Рис. |
Геномные мутации
Наконец, геномные мутации затрагивают весь геном целиком, то есть меняется количество хромосом. Выделяют полиплоидии — увеличение плоидности клетки, и анеуплоидии, то есть изменение количества хромосом, например, трисомии (наличие у одной из хромосом дополнительного гомолога) и моносомии (отсутствие у хромосомы гомолога).
Видео по теме ДНК
РЕПЛИКАЦИЯ ДНК, КОДИРОВАНИЕ РНК, СИНТЕЗ БЕЛКА
(Если видео не отображается оно доступно по ссылке→)
См. дополнительно:
- Общие сведения о секвенировании биополимеров
- Метагеномика и микробиом
- Бактериальный иммунитет и система CRISPR/Cas
- Трансляция белка на рисбосоме (общие сведения)
- Раскрыт секрет спиральной структуры ДНК (новое о ДНК)
- Антимутагенные свойства пробиотиков (в свете защиты ДНК)
- МикроРНК, микробиом кишечника и иммунитет
- Эпигенетика, короткоцепочечные жирные кислоты и врожденная иммунная память
- Замедление старения: роль питательных веществ и микробиоты в модуляции эпигенома (о метилировании ДНК)
Литература в помощь:
Молекулярная биология (необходимый минимум знаний по важному разделу современной биологии) | Атлас биотехнологии и генной инженерии (сокр. (темы междисциплинарной области знаний XXI века) | Нуклеиновые кислоты (справочник ключевых биохимических терминов и понятий) |
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИКАРДИО
- ПРОБИОТИКИ С ПНЖК
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА ЖКТ
- ДИСБИОЗ КИШЕЧНИКА
- МИКРОБИОМ и ВЗК
- МИКРОБИОМ И РАК
- МИКРОБИОМ, СЕРДЦЕ И СОСУДЫ
- МИКРОБИОМ И ПЕЧЕНЬ
- МИКРОБИОМ И ПОЧКИ
- МИКРОБИОМ И ЛЕГКИЕ
- МИКРОБИОМ И ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И ЩИТОВИДНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И КОЖНЫЕ БОЛЕЗНИ
- МИКРОБИОМ И КОСТИ
- МИКРОБИОМ И ОЖИРЕНИЕ
- МИКРОБИОМ И САХАРНЫЙ ДИАБЕТ
- МИКРОБИОМ И ФУНКЦИИ МОЗГА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОБИОМ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- КОРОТКОЦЕПОЧЕЧНЫЕ ЖИРНЫЕ КИСЛОТЫ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- МИКРОБИОМ И ПРЕЦИЗИОННОЕ ПИТАНИЕ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Кто на самом деле открыл ДНК? История изучения гена / Хабр
Открывая ленту новостей, мы часто натыкаемся на такие громкие заголовки: «Тест ДНК на телешоу подтвердил подмену детей в роддоме на Ставрополье», «ДНК возрастом более 115 тысяч лет указала на уязвимость белых медведей перед потеплением климата». Почему же эта молекула получила столько пристального внимания? Давайте же окунёмся в историю науки и посмотрим, как ДНК стала самой главной молекулой XXI века.
Почему же эта молекула получила столько пристального внимания? Давайте же окунёмся в историю науки и посмотрим, как ДНК стала самой главной молекулой XXI века.
| Автор сообщества Фанерозой: биолог и эколог Евгений Будько, а также редактор, Зам. руководителя проекта Фанерозой, биолог Ефимов Самир |
Открытие ДНК
Художник сообщества Фанерозой Мухаммад
Существует распространённое заблуждение, что Джеймс Уотсон и Фрэнсис Крик открыли ДНК в 1950-х годах. В действительности ДНК была открыта за несколько десятилетий до этого. Джеймс и Фрэнсис смогли прийти к революционному выводу о структуре ДНК в 1953 году, проследив за работой первооткрывателей этой молекулы.
Сама история открытия ДНК начинается в 1800-х годах… Но вначале нужно отметить, что история ДНК в науке тесно связано с историей изучения наследственности. Итак, первый кто выдвинул более научно обоснованные идеи о наследственности, которые актуальны по сей день, был Грегор Мендель. В XIX в. он был монахом, а затем аббатом августинского монастыря в Бруно (современный Брно).
В XIX в. он был монахом, а затем аббатом августинского монастыря в Бруно (современный Брно).
В те времена монастырь давал образование тем, кто не мог позволить себе оплатить светское университетское образование. В период с 1854 по 1862г. Мендель обучаясь там, проводил эксперименты по скрещиванию гороха. Проанализировав полученные результаты, он разработал концепцию генетического задатка — вещества, определяющего тот или иной признак. Позже он предположил, что признак определяется не одним задатком, а комбинацией двух.
Августинское аббатство Святого Фомы в Старом Брно
На тот момент результаты исследований Менделя остались почти незамеченными. Повторение опыта на ястребинке не дали тех же результатов, что и с горохом. Это совсем разуверило учёного в важности своих результатов. В итоге исследования Менделя не были восприняты, как фундаментальное исследование. Заслуженное значение эти открытия получили только после их переоткрытия в начале XX в.
Слово «ген» вместо наследственного задатка появилось в 1900-е гг, когда произошло переоткрытие законов Менделя. Это в дальнейшем привело к возникновению вопроса о том, что является материальным носителем генов. Наблюдения показали, что это некая молекула, которая содержится в хромосомах — палочкообразных структурах в ядрах клеток. После исследований Томаса Моргана была установлена хромосомная теория наследственности. Таким образом, можно сказать, что далёкий путь к раскрытию тайн ДНК в науке начинается во 2-й половине XIX в. Сама же эта молекула была впервые идентифицирована уже в 1860-х годах, швейцарским химиком Иоганном Фридрихом Мишером.
Это в дальнейшем привело к возникновению вопроса о том, что является материальным носителем генов. Наблюдения показали, что это некая молекула, которая содержится в хромосомах — палочкообразных структурах в ядрах клеток. После исследований Томаса Моргана была установлена хромосомная теория наследственности. Таким образом, можно сказать, что далёкий путь к раскрытию тайн ДНК в науке начинается во 2-й половине XIX в. Сама же эта молекула была впервые идентифицирована уже в 1860-х годах, швейцарским химиком Иоганном Фридрихом Мишером.
Иоганн Фридрих Мишер
Иоганн намеревался исследовать ключевые компоненты лейкоцитов, главных клеток иммунной системы нашего организма. Основным источником этих клеток были покрытые гноем бинты, взятые из ближайшей медицинской клиники. При изучении лейкоцитов Мишером был разработан метод выделения ядер клеток. В последующем ему удалось выделить из ядер вещество, которому он дал название «нуклеин». При исследовании этого вещества Иоганн понял, что оно обладает неожиданными свойствами, отличными от свойств других белков, с которыми он был знаком. Так, не зная важности своего открытия, Мишер показал миру молекулярную основу всей жизни — ДНК.
Так, не зная важности своего открытия, Мишер показал миру молекулярную основу всей жизни — ДНК.
Флакон, содержащий одну из первых ДНК, выделенных Фридрихом Мишером. Находится в Турбингенском университете (Германия).
В 1877 году эстафету по изучению ДНК принял немецкий биохимик Альбрехт Коссель. Учёный, после успешного завершения университетского образования, был принят на работу своим бывшим научным руководителем Феликсом Гоппе-Зейлером в качестве научного сотрудника в Страсбургский университет. В этот период Гоппе-Зейлер проявлял большой интерес к веществу, которое впервые было выделено в 1869 году его бывшим студентом из Швейцарии Фридрихом Мишером.
Альбрехт Коссель.
Это соединение не походило на органические вещества, которые уже были известны к этому времени. Поэтому выделенный Мишером нуклеин и был проанализирован Косселем. В ходе исследования он установил, что нуклеин состоит из двух компонентов, белкового и небелкового. Второй компонент проявлял свойства кислоты хоть и слабой и получил название нуклеиновая кислота.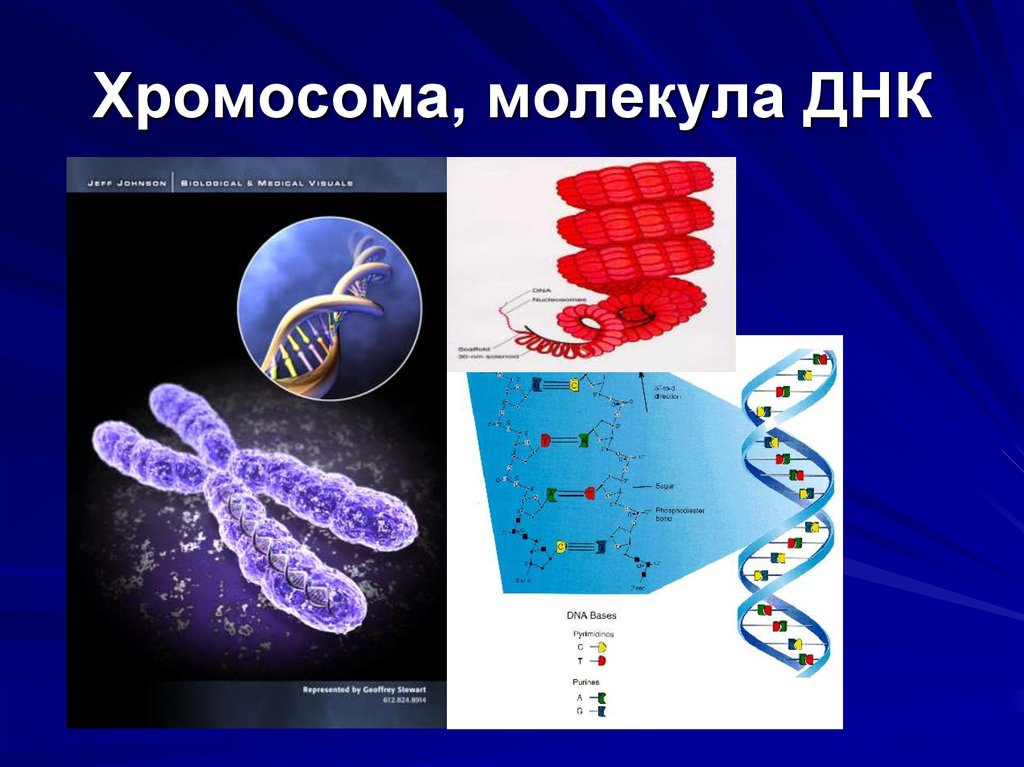
В дальнейшем Коссель со своими учениками открыл азотистые основания. А вот наличие в составе ДНК дезоксиребозы установил Феб Левен из Рокфеллеровского института. Так, в 1881 году вещество приобрело новое название «ДезоксирибоНуклеиновая кислота», которое используется по сей день. Эта работа была хорошо вознаграждена в 1910 году, когда Коссель получил Нобелевскую премию по физиологии и медицине.
Физика и биология
В первой половине двадцатого века господство в науке принадлежало физике. Относительность и квантовая механика дали неслыханный новый импульс поиску универсальных физических законов. К началу 1930-х годов физики были убеждены в своём всемогуществе. Они обратили своё внимание к тому, что раньше даже не могли себе представить, — к самой жизни.
В то время молодой немецкий физик-теоретик Макс Дельбрюк искал область науки, в которой он мог бы сделать карьеру. Учёный попробовал в квантовую химию. Позже он занимался исследованиями в области ядерной физики. Но ни одна из наук не пришлась Дельбрюку по душе.
Но ни одна из наук не пришлась Дельбрюку по душе.
Макс Дельбрюк
Но однажды, в августе 1932 года, занимаясь исследованиями в Институте Бора в Копенгагене, Дельбрюк посетил лекцию, прочитанную Бором на Международном конгрессе по светотерапии. Лекция носила название «Свет и жизнь». В этой лекции известный учёный высказал свои мысли по вопросу жизни в свете последних достижений квантовой механики. Учитывая, что в то время Дельбрюк был новичком в биологии, он был вдохновлён лекцией и решил посвятить себя этой науке.
По возвращении Дельбрюк начал налаживать контакты с биологами. В то время ему особенно нравилось находиться в обществе русских учёных, собственно он и познакомился с известным русским генетиком Николаем Владимировичем Ресовским, который работал в Берлине. Дельбрюк стал приглашать его домой на встречи своих друзей-физиков. На этих собраниях генетик часами обучал их своей науке. Тимофеев-Ресовский рассказывал о плодовой мушке дрозофиле, о мутациях в генах, которые можно вызвать воздействием рентгеновских лучей. Как раз последним вопросом генетик занимался вместе с физиком-экспериментатором Карлом Циммером.
Как раз последним вопросом генетик занимался вместе с физиком-экспериментатором Карлом Циммером.
Николай Тимофеев-Ресовский (слева), Макс Дельбрюк (в центре) и Карл Циммер (справа)
Дельбрюка очень заинтересовала их работа. Он считал, что именно в генетике много того, что связывает её с квантовой механикой. Квантовая механика принесла в физику дискретность, скачкообразность. Но главной особенностью квантовой механики было серьёзное отношение к случайности. В то же самое время биологи обнаружили дискретную неделимую частицу (ген), которая может случайным образом переходить из базового состояния (известного в генетике как «дикий тип») в «мутантное» состояние.
Что же такое ген и как он устроен? Это был один из главных вопросов, о котором спорили на вечерах у Дельбрюка. По словам самого Тимофеева-Ресовского, генетиков эта проблема не особо интересовала на тот момент. Для них гены — такая же фундаментальная частица наследственности, как электроны для физиков. Николай Владимирович говорил:
Николай Владимирович говорил:
«Вот, я вас спрошу, из чего состоит электрон?» Раздался громкий смех. «Вот видите, также смеются генетики, когда их спрашивают, из чего состоит ген. Вопрос о том, что такое ген, выходит за рамки генетики, и его бессмысленно адресовать генетикам. Вы, физики, должны искать ответ на него».
Дельбрюк, в свою очередь, спросил:
«Неужели нет гипотезы о структуре гена?».
Тимофеев-Ресовский на мгновение задумался, потом воскликнул:
«Ну, как же! Мой учитель, Николай Константинович Кольцов, считает, что ген — это полимерная молекула, скорее всего, молекула белка.»
Такая гипотеза не сильно устроила Дельбрюка. Он парировал Николаю Владимировичу:
«Ну и что это объясняет? От того, что мы назовём ген белком, мы поймём, как гены удваиваются? Ведь главная-то загадка в этом! Ты же сам рассказывал нам, как в роду Габсбургов из поколения в поколение переходила характерная форма губы? Что делает возможным столь точное копирование генов в течение веков? Каков механизм? Разве химия даёт нам такие примеры? Во всяком случае, я никогда ничего подобного не слышал.
Нет, тут нужна совершенно иная идея. Тут действительно таится загадка. Великая загадка. Возможно, новый закон природы. Сейчас главный вопрос — как к этому подступиться экспериментально».
Таким образом, генетик Тимофеев-Ресовский и физик по имени Карл Циммер стали участниками сообщества Дельбрюка. Собственно благодаря стараниям Тимофеева-Ресовского — Макс Дельбрюк начал неплохо разбираться в генетике. Его больше не смущала терминология в генетике, которая отпугивала многих физиков.
Результатом работы такого сообщества стала статья, которая получила название «Документ трёх человек», и она оказала большое влияние как на карьеру Дельбрюка, так и на размышления о природе гена (Тимофеев-Ресовский и др., 1935). Вывод, основанный на стабильности гена, измеренной по частоте мутаций при разных дозах ионизирующего излучения по сравнению с разными температурами, заключался в том, что ген, вероятно, представляет собой молекулу. Дельбрюк выразил это следующим образом:
Несколькими годами раньше Г.
Дж. Мюллер обнаружил, что ионизирующие излучения вызывают мутации, и работа берлинской группы очень ясно показала, что эти мутации вызываются либо отдельными парами ионов, либо их небольшими кластерами. Обсуждение этих открытий в нашей небольшой группе укрепило представление о том, что гены обладают своего рода стабильностью, аналогичной стабильности химических молекул. Оглядываясь назад, на наши нынешние знания, можно было бы счесть это тривиальным утверждением: чем ещё могут быть гены, как не молекулами? Однако в середине тридцатых годов это не было тривиальным утверждением. Гены в то время были алгебраическими единицами комбинаторной науки генетики, и было совсем неясно, что эти единицы были молекулами, поддающимися анализу с точки зрения структурной химии. Они могли оказаться субмикроскопическими стационарными системами, Кэрнс и др. 1966 ).
Работа этой троицы оказала значительное влияние на дальнейшее развитие науки. Нужно отметить, что на тот момент работа Т.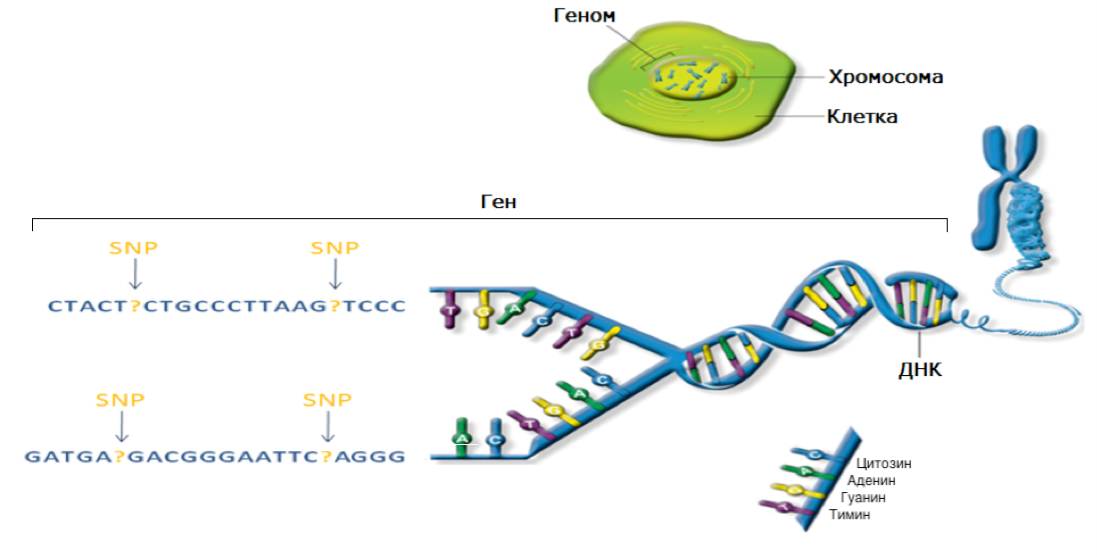 Моргана и его группы «Теория гена», давала подробное объяснение способов наследования этих единиц, но не давала намёка на то, что они из себя представляли и как работали. Генетики тогда не видели связи своей науки с физикой и химией. Область биохимической генетики, прямой предшественницы молекулярной биологии, также находилась в очень зачаточном состоянии. Но эта статья, напечатанная хоть и в малоизвестном журнале, стала очень популярной. Особенно важен тот факт, что статью заметил всемирно известный физик Эрвин Шрёдингер.
Моргана и его группы «Теория гена», давала подробное объяснение способов наследования этих единиц, но не давала намёка на то, что они из себя представляли и как работали. Генетики тогда не видели связи своей науки с физикой и химией. Область биохимической генетики, прямой предшественницы молекулярной биологии, также находилась в очень зачаточном состоянии. Но эта статья, напечатанная хоть и в малоизвестном журнале, стала очень популярной. Особенно важен тот факт, что статью заметил всемирно известный физик Эрвин Шрёдингер.
Эта статья стала основой для двух глав рассуждений в книге Шрёдингера «Что такое жизнь?» Данная брошюра была написана на основе лекций, которые учёный прочитал при содействии Дублинского института перспективных исследований в Тринити-колледже в феврале 1943г.
Эрвин Шрёдингер
Являясь одним из основоположников квантовой физики, Эрвин Шрёдингер попытался в своей работе показать взгляд классического физика на биологию. В частности, были сделаны первые шаги к переходу от квантовой физики к квантовой биологии — направлению, которое рассматривает живые системы с точки зрения квантовой теории. Шрёдингер популяризовал и развил идеи Дельбрюка и Тимофеева-Ресовского о связи генетики и квантовой механики.
Шрёдингер популяризовал и развил идеи Дельбрюка и Тимофеева-Ресовского о связи генетики и квантовой механики.
В своей работе учёный писал:
«Взаимодействия атомов в жизненно важных частях организма фундаментальным образом отличаются от всех соединений атомов, которые до настоящего времени являлись объектом экспериментальных и теоретических исследований физиков и химиков. Однако это различие, которое я считаю фундаментальным, может показаться малозначимым любому, кроме физика, сознающего, что законы химии и физики — сугубо статистические… Не-физик вряд ли окажется способен хотя бы уловить — не говоря уже о том, чтобы оценить — различие в «статистической структуре», выраженное столь абстрактными терминами. Чтобы придать утверждению живость и цвет, позвольте мне упомянуть то, что позднее будет описано намного детальнее, а именно самую значимую оставляющую живой клетки — хромосомную фибриллу, которую можно назвать апериодическим кристаллом. До настоящего времени в физике мы имели дело лишь с периодическими кристаллами».

Не имея представления о том, что такое ферменты и что они кодируются ДНК, Шрёдингеру удалось создать труд, в котором он задаёт, казалось бы, наивные, но самые главные вопросы. Непосвящённого эти вопросы могут отпугнуть, а остроумный исследователь начнёт со рвением на них отвечать. Даже не найдя достоверных ответов на свои вопросы, Эрвин Шрёдингер зажёг интерес к изучению материала наследственности. Главное, что читатели Шрёдингера узнали о работах Дельбрюка.
Великий бактериофаг
Что такое гены? Этот вопрос, в конце концов, заинтересовал Макса Дельбрюка. Больше всего его интересовало, как гены удваиваются (реплицируются) во время деления клетки. Физики, думающие о биологии, склонны искать простые системы, поддающиеся анализу. Дельбрюк не был исключением. Взгляд учёного привлекли бактериофаги — вирусы бактерий. Дельбрюк считал их ключом к разгадке всех интересовавших его вопросов.
Эти удивительные частицы, которые вне клетки не проявляют признаков живого и выглядят просто как большие молекулы. Из бактериофагов даже выращивают кристаллы. Но когда вирус попадает в клетку, то через 20 минут клеточная оболочка лопается, и из неё вываливается сотня абсолютно точных копий исходной частицы. Дельбрюка осенило, что на бактериофагах гораздо легче будет изучать процесс репликации (удвоения генов), чем на бактериях, не говоря уже о животных; возможно, удастся понять наконец, как устроен ген. Так, физик-теоретик превратился в биолога-экспериментатора. Но его мышление осталось чисто физическим.
Из бактериофагов даже выращивают кристаллы. Но когда вирус попадает в клетку, то через 20 минут клеточная оболочка лопается, и из неё вываливается сотня абсолютно точных копий исходной частицы. Дельбрюка осенило, что на бактериофагах гораздо легче будет изучать процесс репликации (удвоения генов), чем на бактериях, не говоря уже о животных; возможно, удастся понять наконец, как устроен ген. Так, физик-теоретик превратился в биолога-экспериментатора. Но его мышление осталось чисто физическим.
В 1937 году из-за прихода к власти нацистов Дельбрюк покидает Германию. В том же году Фонд Рокфеллера начал финансировать работы по применению физико-химических идей и методов в биологии. Представители фонда предложили Максу Дельбрюку переехать в США, где он продолжил свои исследования по репликации фагов. Представитель фонда в Европе посетил Дельбрюк в 1936 году, чтобы узнать, готов ли он покинуть Европу. Макс выбрал Калифорнийский технологический институт как подходящее место и написал Моргану.
В результате «документа трёх человек» Т. Х. Морган пригласил Дельбрюка в Калифорнийский технологический институт на должность научного сотрудника. На тот момент это был рискованный шаг для генетика, т.к. физики-теоретики в биологических лабораториях были редкостью. В дальнейшем Дельбрюк продолжит свою работу на физическом факультете Университета Вандербильта в Нэшвилле, Теннесси.
В США Дельбрюк собрал группу энтузиастов, которые заинтересовались его идеей изучения природы наследственности на бактериофагах. Так возникла «фаговая группа». Год от года участники группы всё больше узнавали, как протекает фаговая инфекция и как на это влияют внешние условия. В ходе ряда уникальных экспериментов были изучены мутационный процесс у бактерий и бактериофагов. Именно за работы этого периода, много лет спустя, Дельбрюк был удостоен Нобелевской премии.
▍ Эксперимент Эвери, Маккарти и Маклеода
В дальнейшем появились научно обоснованные доказательства того, что за перенос генетической информации отвечает всё-таки ДНК, а не белок.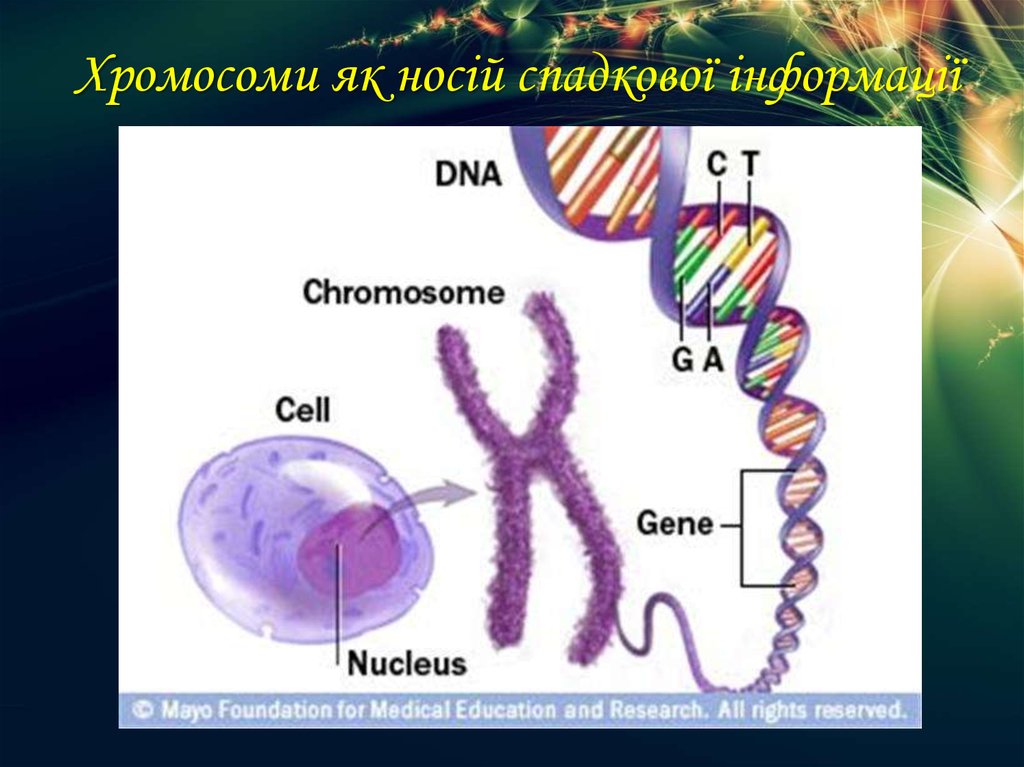 Это открытие принадлежит американским генетикам Освальду Эвери, Колину Маклеоду и Маклину Маккарти. Они продолжали исследования британского военного медика Фредерика Гриффита, которые он проводил ещё в 1928г. Исследование заключалось в проведении опытов со Streptococcus pneumoniae, который является возбудителем пневмонии.
Это открытие принадлежит американским генетикам Освальду Эвери, Колину Маклеоду и Маклину Маккарти. Они продолжали исследования британского военного медика Фредерика Гриффита, которые он проводил ещё в 1928г. Исследование заключалось в проведении опытов со Streptococcus pneumoniae, который является возбудителем пневмонии.
У Streptococcus pneumoniae есть два штамма — один образует шероховатые колонии, другой — гладкие. Как в будущем было выяснено, клетки «гладких» бактерий заключены в полисахаридную капсулу, которая обеспечивает им защиту от иммунной системы хозяина. Поэтому инъекция гладких бактерий убивает подопытную мышку, а животное, которому ввели «шероховатый» штамм, выздоравливает. При этом гладкие штаммы погибают при нагревании. Инъекция такого убитого штамма, соответственно, не вызывает гибели животного. Гриффит решил смешать живых безвредных «шероховатых» стрептококков с убитыми «гладкими».
Впоследствии он ввёл их мышам, животное умерло, а из его организма удалось выделить живых «гладких» стрептококков. Было такое впечатление, будто живые «гладкие» бактерии при контакте с мёртвым «шероховатыми» — становились вирулентными. Возможно, они позаимствовали у них какое-то вещество, которое способствовало защите их от иммунной системы хозяина и которое к тому же сумели передать новым поколениям бактерий.
Было такое впечатление, будто живые «гладкие» бактерии при контакте с мёртвым «шероховатыми» — становились вирулентными. Возможно, они позаимствовали у них какое-то вещество, которое способствовало защите их от иммунной системы хозяина и которое к тому же сумели передать новым поколениям бактерий.
Так вот, Эвери, Маклеод и Маккарти сумели определить, что это вещество — ДНК. Только при удалении ДНК из экстракта «гладких» бактерий, его смешивание с безвредными «шероховатыми» не делала их вирулентными, инфицированные мыши не погибли. Во всех остальных случаях, когда экстракт очищали от других веществ, но не от ДНК, эффект был тот же, что и при смешивании с целыми мёртвыми бактериями мыши погибали, из них можно было выделить живой патогенный штамм.
Опыт Эвери — Маклеода — Маккарти
Эксперимент Херши — Чейз
Ещё одно подтверждение того, что веществом наследственности, является именно ДНК, получили американские генетики Альфред Херши и Марта Чейз. За эти эксперименты Херши вручили Нобелевскую премию в области физиологии и медицины в 1969г. Марту Чейз на Нобелевскую премию не выдвинули. Дополнительно обидно, что в некоторых русских источниках встречается «эксперимент Херши — Чейза». Об исполнителе эксперимента и соавторе статьи многие не знают даже, что это женщина.
Марту Чейз на Нобелевскую премию не выдвинули. Дополнительно обидно, что в некоторых русских источниках встречается «эксперимент Херши — Чейза». Об исполнителе эксперимента и соавторе статьи многие не знают даже, что это женщина.
Для своих экспериментов Херши и Чейз выбрали бактериофаг Т4 — вирус бактерий, одни из самых простых объектов живой природы. Херши и Чейз показали, что фаги вводят в бактериальную клетку свою ДНК, а не белок. Для этого они использовали две разновидности фагов: одни имели в своём составе радиоактивную серу 35S, другие — радиоактивный фосфор 32P, который содержится только в ДНК. Когда фаги первого типа инфицировали бактерий, метка оставалась снаружи, в растворе. Но когда брали бактериофаги второго типа — меченый фосфор попадал внутрь клетки. Далее исследователи наблюдали, что новые фаги, которые выходили из инфицированной клетки, тоже были немного радиоактивными.
Схема эксперимента Херши — Чейз
Двойная спираль ДНК
Открытие Джеймсом Уотсоном и Фрэнсисом Криком структуры двойной спирали дезоксирибонуклеиновой кислоты (ДНК) в 1953 году стало важной вехой в истории науки и положило начало современной молекулярной биологии, которая в первую очередь занимается изучением того, как гены контролируют химические процессы в клетках. Их открытия вскоре позволили получить принципиально новые сведения о генетическом коде и синтезе белков.
Их открытия вскоре позволили получить принципиально новые сведения о генетическом коде и синтезе белков.
В 1970-х и 1980-х годах открытие помогло создать новые и мощные научные подходы, в частности, исследования рекомбинантной ДНК, генную инженерию, быстрое секвенирование генов и моноклональные антитела, которые являются основой сегодняшней многомиллиардной биотехнологической индустрии.
Рентгенограмма ДНК и модель её строения. Учёные, сделавшие открытие
Первая рентгенограмма ДНК была получена Флоренс Белл и Уильямом Эстбери ещё в 1938 году, которые описали соответствующую форму как «плотную последовательность сплюснутых или плоских нуклеотидов, стоящих перпендикулярно длинной оси молекулы, образуя относительно жёсткую структуру». Структура, по сути, представляла собой гребёнку.
Всё резко изменилось в 1951 году, когда Розалинда Франклин, которая работала над всё более точными картинами дифракции рентгеновских лучей, показала изображения ДНК в Королевском колледже в Лондоне. Когда Д. Уотсон и Ф. Крик начали изучать структуру ДНК, ситуация в науке складывалась следующим образом:
Когда Д. Уотсон и Ф. Крик начали изучать структуру ДНК, ситуация в науке складывалась следующим образом:
М. Уилкинс, много лет, работавший в Англии над разгадкой строения ДНК, накопил огромный фактический материал и был близок к правильному решению задачи. Р. Фрэнклин — кристаллограф, работавшая с ним вместе, сумела получить отлично выполненные рентгенограммы ДНК.
Первые учёные быстро построили структуру ДНК, которая имела форму спирали, но с тремя нитями, туго скрученными вместе и торчащими основаниями. В последующем стало ясно, что такая модель неверна. В 1953 году Крик и Уотсон получили новые данные, собранные Розалинд Франклин, через молекулярного биолога Макса Перутца. Уотсон, в очередной раз неверно истолковав данные, попытался построить нить, образующую половину двойной спирали, с винтом 18°, тогда как данные явно подразумевали, что винт должен быть 36°. Благодаря комментариям тогдашнего аспиранта — Джерри Донохью Фрэнсис начал строить модель с винтом 36°, подгоняя основания между двумя витками спирали. Уотсон в своей предыдущей попытке обнаружил, что пары оснований AT и GC имеют одинаковую форму. Из этого Крик сделал вывод, что цепи должны быть антипараллельными. Так и «родилась» современная форма ДНК.
Уотсон в своей предыдущей попытке обнаружил, что пары оснований AT и GC имеют одинаковую форму. Из этого Крик сделал вывод, что цепи должны быть антипараллельными. Так и «родилась» современная форма ДНК.
И вот в 1953 г. в журнал «Nature» вышла статья, насчитывающая всего 900 слов. В ней были представлены окончательные результаты исследований. Уотсон и Крик выдвинули предположение, что ДНК состоит из двух нитей, соединённых друг с другом азотистыми основаниями и закрученных одна вокруг другой. За это открытие учёные были удостоены Нобелевской премии в 1962г. Нобелевской премией был награждён и М. Уилкинс.
В 50 — 60-х годах Фрэнсис Крик вместе со своими сотрудниками открыли основные свойства генетического кода. Ими было доказано, что код триплетный, т.е. одной аминокислоте соответствует последовательность из трёх нуклеотидов. К тому моменту было известно, что в состав белков входит 20 типов аминокислот. В то же время было подсчитано, что всего существует 43 = 64 различных кодона. Также было установлено, что не каждому кодону соответствует аминокислота. Но таких «бессмысленных», кодонов очень немного. Они выполняют специальную функцию — служат стоп-сигналами, которые обозначают конец белковой цепи. В то же время был открыт и тот факт, что аминокислоте могут соответствовать несколько триплетов — код вырожденный, как говорят математики. Помимо этого, стало известно, что один нуклеотид не может входить одновременно в два триплета. Это называется неперекрываемостью.
Также было установлено, что не каждому кодону соответствует аминокислота. Но таких «бессмысленных», кодонов очень немного. Они выполняют специальную функцию — служат стоп-сигналами, которые обозначают конец белковой цепи. В то же время был открыт и тот факт, что аминокислоте могут соответствовать несколько триплетов — код вырожденный, как говорят математики. Помимо этого, стало известно, что один нуклеотид не может входить одновременно в два триплета. Это называется неперекрываемостью.
Данные открытия были сделаны благодаря методике разработанной американским биохимиком и генетиком из Национального института здравоохранения Маршаллом Ниренбергом и его немецким постдоком — Генрихом Маттеи. Если белковые последовательности к этому времени уже умели успешно расшифровывать, то ни последовательности ДНК, ни последовательности РНК — читать не умели. Поэтому пришлось пойти по иному пути. Учёные предположили, что если клетки «знают» генетический код, то, нужно предложить им распознавать разные последовательности нуклеотидов. Главное, чтобы было точно известно, что это за последовательности. К этому времени биохимики, как раз научились синтезировать кое-какие искусственные РНК. Например, Ниренберг и Маттеи использовали неживые клетки, а клеточные экстракты, которые сохраняли способность синтезировать белок на РНК. Очень важно, они были способны синтезировать белок по внесённой извне РНК. Такие экстракты назвали бесклеточной системой. Собственно, для своих опытов они использовали экстракт из кишечной палочки. Им удалось определить, что кодону УУУ отвечает аминокислота фенилаланин.
Главное, чтобы было точно известно, что это за последовательности. К этому времени биохимики, как раз научились синтезировать кое-какие искусственные РНК. Например, Ниренберг и Маттеи использовали неживые клетки, а клеточные экстракты, которые сохраняли способность синтезировать белок на РНК. Очень важно, они были способны синтезировать белок по внесённой извне РНК. Такие экстракты назвали бесклеточной системой. Собственно, для своих опытов они использовали экстракт из кишечной палочки. Им удалось определить, что кодону УУУ отвечает аминокислота фенилаланин.
О своём открытии Ниренберг сообщил на Международном биохимическом конгрессе в Москве в 1961г. Это было сенсацией в мире науки. Очень быстро удалось сделать подобный перевод для многих аминокислот. Однако определение последовательности нуклеотидов на тот момент было ещё весьма трудным занятием. Окончательно проблема была решена, когда на помощь биохимикам пришли химики-синтетики. Главный вклад внёс Хар Гобинд Корана.
Учёные, расшифровавшие генетический код
К 1967 году расшифровка генетического кода была окончательно завершена. Биологам стало очевидно, что ДНК в ядре клетки — это своеобразная «библиотека», в которой книги не выдают на дом, но позволяют снимать копии и забирать с собой. Копии книг — это матричные РНК.
Биологам стало очевидно, что ДНК в ядре клетки — это своеобразная «библиотека», в которой книги не выдают на дом, но позволяют снимать копии и забирать с собой. Копии книг — это матричные РНК.
В последующем биологами будет выяснено, что всё же небольшое отклонение от стандартного генетического кода есть у некоторых инфузорий. У них один или даже два стоп-кодона стандартного генетического кода могут кодировать аминокислоту глутамин. Таким образом, учёные пришли к выводу, что у некоторых организмов можно сделать небольшое искусственное изменение генетического кода.
Далее в науке предстояло не менее важное открытие структуры гена. Было установлено, что впереди каждого гена на молекуле ДНК расположена последовательность, которая регулирует его активность: «включение — выключение», интенсивность, место и время работы. Эту регуляторную последовательность называли промотором. Кодирующая область гена начинается с триплета нуклеотидов АТГ. Это место начала считывания информации с мРНК.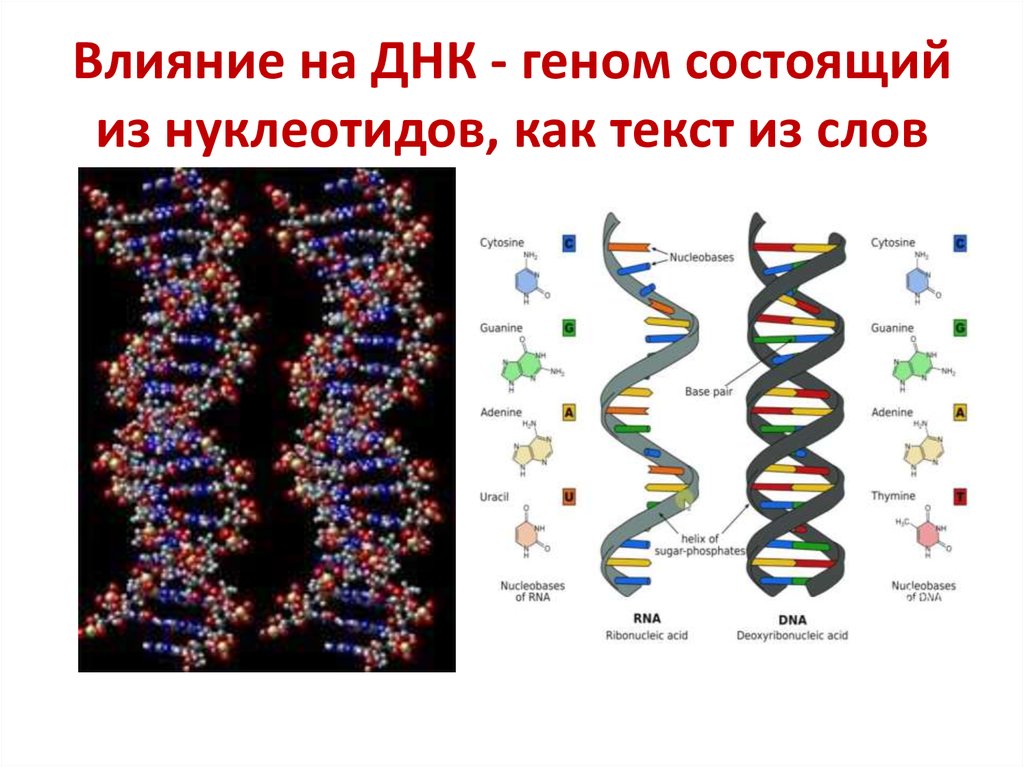 Заканчивается кодирующая область так называемым стоп-кодоном (ТАГ, или ТАА, или ТГА), указывающий на то место, где должна закончиться трансляция. Кодирующую область называют экзоном. У высших организмов, а также у многих прокариот кодирующую область гена могут прерывать одним или несколько интронов — участков ДНК, которые не несут генетической информации о последовательности аминокислот закодированного белка.
Заканчивается кодирующая область так называемым стоп-кодоном (ТАГ, или ТАА, или ТГА), указывающий на то место, где должна закончиться трансляция. Кодирующую область называют экзоном. У высших организмов, а также у многих прокариот кодирующую область гена могут прерывать одним или несколько интронов — участков ДНК, которые не несут генетической информации о последовательности аминокислот закодированного белка.
Схема строения гена эукариот. Промотор, энхансер, сайленсер — регуляторные последовательности. Кодирующая последовательность гена включает экзоны и интроны
Информация, записанная на мРНК с интронов, удаляется в ходе «созревания» (посттранскрипционного преобразования) молекулы мРНК. Терминальные последовательности гена включают кодоны, кодирующие место отсоединения РНК-полимеразы от молекулы ДНК и место присоединения так называемого поли-А хвоста молекулы мРНК (состоящего из остатков аденина).
Дальнейшее развитие изучения ДНК
Все эти открытия привели к тому, что возрос интерес к ДНК. Можно сказать, что в биологии начался бум открытий, связанных с этой молекулой. Очень важным этапом развития в молекулярной генетике стало открытие методов секвенирования (от англ. Sequence. В переводе дословно означает «определение последовательности»).
Можно сказать, что в биологии начался бум открытий, связанных с этой молекулой. Очень важным этапом развития в молекулярной генетике стало открытие методов секвенирования (от англ. Sequence. В переводе дословно означает «определение последовательности»).
Эра секвенирования геномов началась после изобретения метода ПЦР. Данный метод позволил получать неограниченное количество копий выбранного исследователем участка ДНК.
Открытие первого наиболее работоспособного метода секвенирования принадлежит английскому биохимику Фредерику Сенгеру (1918-2013). За это открытие он был удостоен Нобелевские премии по химии.
Фредерик Сенгер
Сенгеру принадлежит разработка секвенирования методом терминаторов. В научной литературе иногда его называют методом обрыва цепи, или дидезоксиметодом. В последующем этот инструмент назовут в честь учёного «Методом по Сенгеру» (хотя сейчас этот метод является отчасти устаревшим).
С развитием инструментария секвенирования и ПЦР стало возможным появление методов ДНК-дактилоскопии — системы научных методов биологической идентификации индивидуумов, которая основана на уникальности последовательности нуклеотидов ДНК каждого живого существа (исключением являются однояйцевые близнецы), открытие которых принадлежит Сэру Алеку Джеффрису.
Сэр Алек Джеффрис
В свою очередь, развитие методов секвенирования, ПЦР и ДНК-дактилоскопии привели к скачку фармакологии и появления таких наук, как фармакогеномика — клинической и научной дисциплины, которая основана на корреляции фенотипа, генотипа и/или кариотипа. В этой науке используется генетическая информация, которая предназначена для предсказания лекарственной эффективности и токсичности, а также для выявления лиц, чувствительных или нечувствительных к препаратам.
При изучении ДНК нельзя забывать про вопросы эволюционной биологии. Генетика, в том числе и молекулярная, неизбежно повлияла и на процесс развития эволюционных представлений. Главным образом молекулярная генетика повлияла на вопросы, которые касаются происхождения видов в природе.Генетические программы в ходе эволюции не возникают заново, а редуцируются специализированным матричным способом.
В процессе эволюционного развития видов генетические программы развития изменяются — не направлено. Приспособительными, полезными эти изменения становятся случайным образом. Доказано, что отбор случайных изменений не только основа эволюции жизни, но и основная причина её становления, потому что без мутаций отбор не действует. Это уже стало аксиомой основанной на принципах статистической физики и принципе неопределённости.
Приспособительными, полезными эти изменения становятся случайным образом. Доказано, что отбор случайных изменений не только основа эволюции жизни, но и основная причина её становления, потому что без мутаций отбор не действует. Это уже стало аксиомой основанной на принципах статистической физики и принципе неопределённости.
Генетика также доказала, что в ходе эволюции происходит процесс многократного увеличения силы случайных генетических изменений. Это делает возможным укрепление процесса влияния внешней среды на организм. В связи с этим эволюционный процесс зачастую непредсказуемый и его трудно просчитать.
При изучении взаимодействия генетики и эволюционной биологии невозможно не упомянуть о фундаментальном биологическом труде всемирно известного английского биолога Ричарда Докинза, который носит название «Эгоистичный ген». Главная идея работы состоит в обосновании геноцентричного взгляда на эволюцию. Эволюция в книге рассматривается прежде всего как эволюция генов. Учёный считает, что естественный отбор на уровне особей или популяций почти никогда не может одержать верх над естественным отбором на уровне генов. Исходя из этого, Докинз утверждает, что эволюция по Дарвину происходит на уровне генов, но никак не особей или видов. В науке это получило название теории эгоистичного гена.
Исходя из этого, Докинз утверждает, что эволюция по Дарвину происходит на уровне генов, но никак не особей или видов. В науке это получило название теории эгоистичного гена.
Докинз называет гены репликаторами, а организмы — машинами для выживания.
Заключение
Изучение ДНК в науке имеет долгий путь. Всё началось с открытия химической природы ДНК. В дальнейшем науке удалось открыть генетический код и двойную спираль. Всё это способствовало появлению ДНК-дактилоскопии и технологий рекомбинантной ДНК. Что смогло продвинуть вперёд развитие таких областей, как криминалистика, персонализированная медицина и генная инженерия. Но это ещё не конец пути. Учёными уже сделаны первые шаги в создании ДНК-чипов, которые используются в биологии и медицине и при создании…
вышек 5G!
Разумеется, это шутка
На этом исследователи не останавливаются и проводят исследования по созданию ДНК- компьютеров. В целом, можно сказать, что изучение структуры гена и генома смогут дать человечеству ещё множество открытий. Эти открытия будут способны стать основой прорывных технологий, которые послужат на благо человечества.
В целом, можно сказать, что изучение структуры гена и генома смогут дать человечеству ещё множество открытий. Эти открытия будут способны стать основой прорывных технологий, которые послужат на благо человечества.
Список литературы
- Билич Г.Л., Крыжановский В.А. Биология для поступающих в вузы / Г.Л. Билич, В.А. Крыжановский. — 33е изд., испр. и доп. — М.: Издательство Оникс, 2008. — 1088 с.
- Ермишин, А. П. Генетически модифицированные организмы и биобезопасность / А. П. Ермишин. — Минск: Беларус. навука, 2013.-171 с.
- Клещенко Е. В. ДНК и её человек. Краткая история ДНК-идентификации / Е. В. Клещенко. — Издательство Альпина нон-фикшн, 2019. — 314 с.
- Медицинская биология и общая генетика: учебник / Р. Г. Заяц [и др.]. — 2-е изд. испр. — Минск: Издательство Выш. шк., 2012.- 496 с.
- Павлович, С. А. Микробиология с вирусологией и иммунологией: учеб.
 пособие / С. А. Павлович. — 33е изд., испр. — Минск: Издательство Вышэйшая школа, 2013. — 799 с.
пособие / С. А. Павлович. — 33е изд., испр. — Минск: Издательство Вышэйшая школа, 2013. — 799 с.
- Панчин А. Ю. Сумма биотехнологии. Руководство по борьбе с мифами о генетической модификации растений, животных и людей / А. Ю. Панчин. — Издательство Corpus (АСТ), 2015. — 440 с.
- Ричард Докинз Эгоистичный ген./Р.Докинз, Москва Издательство Corpus, 2018. — 512 с.
- Румянцев Е. Ф. Закономерные чудеса / Е. Ф. Румянцев. — Москва: Издательство Молодая гвардия, 1976.- 191 с.
- Савченко В. К. Ценогенетика: генетика биотических сообществ / В. К. Савченко; Национальная академия наук Беларуси, Отделение биологических наук. — Минск Издательство Беларуская навука, 2010. — 270 с.
- Самая главная молекула: От структуры ДНК к биомедицине XXI века / Максим Франк-Каменецкий; — М.: Издательство Альпина нон-фикшн, 2017. — 336 с. — (Серия «Библиотека ПостНауки»).
- Стома И.
 О., Микробном человека / И.О. Стома, И.А. Карпов; Белорусский государственный медицинский университет, Минский научно-практический центр хирургии, трансплантологии и гематологии. — Минск: Издательство Доктор Дизайн, 2018. — 122 с.
О., Микробном человека / И.О. Стома, И.А. Карпов; Белорусский государственный медицинский университет, Минский научно-практический центр хирургии, трансплантологии и гематологии. — Минск: Издательство Доктор Дизайн, 2018. — 122 с.
- Что такое жизнь?: [сборник] /Эрвин Шрёдингер; [пер. с англ. К.Егоровой]. — Москва: Издательство АСТ, 2018. — 288 с. — (Эксклюзивная классика).
- Щипков В. П., Кривошеина Г. Н., Общая и медицинская генетика. В. П./ Щипков, Г. Н. Кривошеина. М.: Издательство Академия, 2003. 256c.
- The discovery of DNA
- A Physicist’s Quest in Biology: Max Delbrück and «Complementarity»
- The Discovery of the Double Helix, 1951-1953
Генетика синдромов, ассоциированных с мутацией гена FMR1
Геном человека — вся совокупность наследственного материала, заключенного в клетке человека. Геном состоит из 23 пар хромосом, находящихся в ядре, а также митохондриальной ДНК. Хромосома представляет собой молекулу ДНК – макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов.
Хромосома представляет собой молекулу ДНК – макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов.
Информация, содержащаяся в ДНК, определяет то, какими свойствами будет обладать организм. Например, многие наши внешние особенности, такие как цвет глаз, кожи и волос, «записаны» в нашем геноме.
Как это происходит? Дело в том, что большую роль в развитии и функционировании нашего организма играют белки. Это молекулы, которые представляют собой цепочки аминокислот, соединенных вместе пептидной связью. Комбинации 20 стандартных аминокислот позволяют создать большое разнообразие белков, обладающих разными свойствами. Именно эти свойства определяют то, как будет строиться и функционировать наш организм.
Ген – это участок ДНК, кодирующий определенный белок. При мутации (изменении) гена возникает изменение структуры или количества белка, которое в свою очередь приводит к изменениям на уровне отдельной ткани, органа и целого организма.
Каждый ген содержит «схему» строения белка. Эта информация содержится в так называемой структурной части гена (на схеме обозначена зеленым). Но помимо этого ген несет и указания на то, как и когда следует начинать и заканчивать изготовление данного белка. Эта информация образует регуляторную часть гена (на схеме отмечена синим цветом).
Так, перед структурной частью гена находится промотор, который влияет на то, будет ли в клетке создаваться данный белок. Это позволяет клеткам производить именно те белки, которые необходимы им сейчас, и останавливать синтез ненужных в данный момент или данной клетке белков. После структурной части расположен терминатор транскрипции, дающий сигнал о завершении транскрипции гена.
Среди 23 пар хромосом человека выделяют одну пару половых хромосом (остальные 22 пары хромосом называют аутосомами). Женский организм обычно имеет в своих клетках две половые хромосомы Х (ХХ), мужской – хромосомы Х и У (ХУ). Девочка наследует по одной хромосоме Х от обоих родителей, таким образом, ее набор половых хромосом – ХХ, где одна хромосома Х унаследована от матери, а вторая – от отца. Мальчик наследует от матери хромосому Х, а от отца – хромосому У.
Мальчик наследует от матери хромосому Х, а от отца – хромосому У.
Организм, в клетках которого содержится две хромосомы Х, производил бы вдвое больше белков, гены которых лежат в этих хромосомах, что могло бы приводить к серьезным аномалиям. Для того чтобы этого не происходило, существует процесс Х-инактивации. Это значит, что в каждой клетке женского организма одна из Х-хромосом остается активной, другая же инактивируется и не служит для производства белков. Обычно выбор хромосомы, которая будет инактивирована, случаен. Таким образом, примерно в половине клеток организма инактивируется одна хромосома X, например, материнского происхождения, а в другой половине – другая, отцовского происхождения. Это случай равной Х-инактивации.
Часто при генетических мутациях в хромосоме Х наблюдается неравная Х-инактивация. В таком случае тяжесть заболевания может определяться степенью смещения от равной инактивации хромосомы Х, в которой имеется мутация. Если таких активных хромосом с мутацией меньше 20%, то заболевание будет протекать легче, если их больше 80% — тяжелее.
В организме, содержащем только одну хромосому Х, такой инактивации не происходит.
FMR1 (fragile X mental retardation 1) – ген, кодирующий белок fragile X mental retardation protein (FMRP). Этот белок является важным для нормативного когнитивного развития, а так же женской репродуктивной функции. Ген FMR1 расположен на длинном плече хромосомы Х (одна из половых хромосом).
В промоторе гена FMR1 находится некоторое число тринуклеотидных повторов CGG (цитозин-гуанин-гуанин). У здоровых людей число этих повторов варьирует от 7 до 60. При возрастании числа повторов от 60 до 200 возникает состояние премутации FraXA, а количество повторов более 200 приводит к полной мутации.
Количество повторов CGG увеличивается в процессе образования половых клеток у женщин (но не у мужчин). Таким образом, женщина, имеющая премутацию по данному гену, может передать своему ребенку полную мутацию.
Полная мутация
Большое количество повторов CGG (более 200) сопровождается аномальным метилированием (присоединением метильных групп СН3) промотора данного гена, что приводит к невозможности синтеза соответствующего белка FMRP. Это состояние приводит к синдрому умственной отсталости, сцепленной с ломкой хромосомой Х (синдром Мартина-Белл).
Это состояние приводит к синдрому умственной отсталости, сцепленной с ломкой хромосомой Х (синдром Мартина-Белл).
Проявления данного синдрома обычно являются более тяжелыми у мальчиков. Организм, в клетках которого содержится только одна хромосома Х, не может производить белок FMRP, что и приводит к появлению соответствующих симптомов.
У девочек проявления могут варьироваться в зависимости от процесса Х-инактивации.
Премутация
Наличие в промоторе гена FMR1 количества повторов от 60 до 200 характеризуется состоянием премутации, которое может проявляться в виде синдромов FXPOI (fragile X-associated primary ovarian insufficiency) и FXTAS(fragile X tremor/ataxia).
Ссылки:
Синдромальные формы аутизма
Наследование
Диагностика
Синдром Мартина-Белл
Синдромы премутации гена FMR1
Гены: словарь терминов
Подтверждаю
Подробнее
891
07 Ноября
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Аллели – (от греч. allelon друг друга, взаимно) различные формы одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных (парных) хромосом, контролирующие один и тот же белок. Все гены соматических клеток, за исключением генов, расположенных в половых хромосомах, представлены двумя аллелями, один из которых унаследован от отца, а другой – от матери. Различия между аллелями обусловлены мутациями.
Все гены соматических клеток, за исключением генов, расположенных в половых хромосомах, представлены двумя аллелями, один из которых унаследован от отца, а другой – от матери. Различия между аллелями обусловлены мутациями.
Аутосомно-доминантный тип наследования – мутантный аллель (вариант) доминирует над нормальным аллелем (вариантом), т.е. проявляется как в гомозиготном, так и в гетерозиготном состоянии; патологическая наследственность прослеживается в родословной «по вертикали»; по крайней мере, один из родителей имеет проявление данной мутации. При этом мутантный ген расположен в аутосоме (неполовой хромосоме) и наследование не сцеплено с полом.
Аутосомно-рецессивный тип наследования – нормальный аллель (вариант) подавляет проявление мутантного аллеля (варианта), т.е. мутация может проявиться, только находясь в гомозиготном состоянии. При этом мутантный ген расположен в аутосоме (неполовой хромосоме) и наследование не сцеплено с полом.
Ген – элементарная единица наследственности, наименьший неделимый элемент наследственного материала, который может быть передан от родителей потомству как целое и который определяет признаки, свойства или физиологическую функцию организма. На молекулярном уровне — это участок молекулы ДНК, кодирующий первичную структуру белков и РНК.
На молекулярном уровне — это участок молекулы ДНК, кодирующий первичную структуру белков и РНК.
Генетический вариант полиморфизма – в широком смысле аналогичен понятию аллеля; здесь, в узком смысле – одна из двух разновидностей гена, различающихся по одному генетическому полиморфизму. Генетические варианты полиморфизма обычно отличаются аминокислотной последовательностью белкового продукта гена или уровнем экспрессии гена.
Генный полиморфизм, полиморфизм (здесь, в узком смысле) – структурное различие альтернативных вариантов гена (обычно нормального и мутантного). Возникновение вариантов гена обусловлено мутациями. Применительно к понятию «генный полиморфизм» обычно рассматриваются нейтральные мутации, не приводящие к заметным нарушениям функции гена, тогда как «мутациями» обычно называют изменения в гене, приводящие к выраженному нарушению работы гена.
Генотип – (здесь, в узком смысле) сочетание генетических вариантов (аллелей), расположенных на гомологичных хромосомах.
Гетерозиготный – содержащий разные аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Гомозиготный – содержащий одинаковые аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Гомологичные хромосомы – парные хромосомы из диплоидного набора, одинаковые по форме, размерам и набору генов.
Делеция – утрата в результате мутации сегмента ДНК размером от одного нуклеотида до субхромосомного фрагмента, включающего несколько генов. В случае генных полиморфизмов рассматриваются делеции, ограниченные одним геном.
Диплоидный набор – набор хромосом в соматических клетках организма, который содержит два гомологичных набора хромосом, из которых один передается от одного родителя, а второй — от другого.
Доминантный аллель – аллель, проявляющийся в фенотипе гетерозиготных особей.
Инсерция – вставка сегмента ДНК размерами от одного нуклеотида до субхромосомного фрагмента, включающего несколько генов. В случае генных полиморфизмов рассматриваются инсерции, ограниченные одним геном.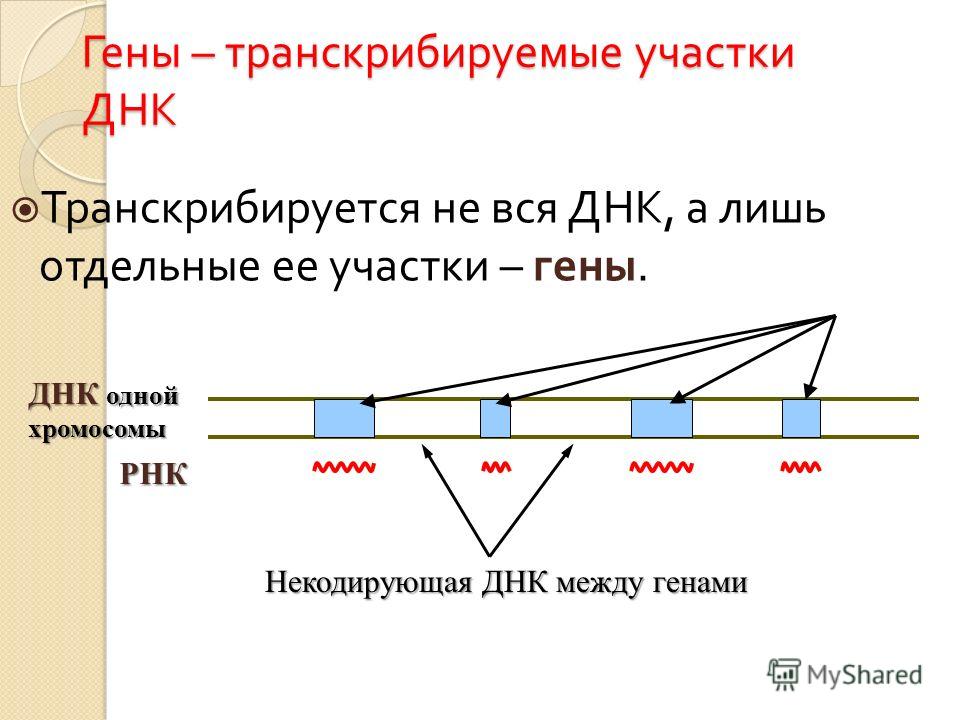
Интрон – область гена, разделяющая экзоны и не несущая информации об аминокислотной последовательности белкового продукта.
Миссенс-мутация — мутация, приводящая к подстановке несоответствующей аминокислоты в полипептидную цепь.
Мультифакториальные заболевания – заболевания, вызываемые взаимодействием множества наследственных и внешних факторов, например, ишемическая болезнь сердца, инфаркт миокарда (ИМ), инсульт, некоторые формы рака, психические заболевания и др.
Мутантный вариант полиморфизма – вариант полиморфизма, возникший вследствие мутации из своего предшественника – нормального варианта.
Мутация – изменение нуклеотидной последовательности ДНК. Чаще всего мутации представляют собой однонуклеотидные замены – миссенс-мутации. Влияние мутации на функцию гена может варьировать от ее полного нарушения до незначительного влияния или отсутствия влияния.
Нормальный вариант полиморфизма – наиболее распространенный в популяции вариант полиморфизма, который является предшественником других вариантов, возникающих вследствие мутаций.
Нуклеотид – структурная единица нуклеиновых кислот. В состав ДНК входят 4 нуклеотида: аденин – А, тимин – Т, гуанин – G, цитозин – С.
Пенетрантность – количественный показатель фенотипической изменчивости проявления гена. Измеряется (обычно в %) отношением числа особей, у которых данный ген проявился в фенотипе, к общему числу особей, в генотипе которых этот ген присутствует в необходимом для его проявления состоянии (гомозиготном – в случае рецессивных генов или гетерозиготном – в случае доминантных генов). Проявление гена у 100% особей с соответствующим генотипом называется полной пенетрантностью, в остальных случаях – неполной пенетрантностью. Неполная пенетрантность свойственна проявлению генов, связанных с мультифакториальными заболеваниями: болезнь развивается только у части лиц, в генотипе которых присутствует аномальный ген; у остальных же наследственное предрасположение к болезни остаётся нереализованным.
Полиморфизм гена – многообразие нуклеотидных последовательностей гена, в том числе его аллельных форм.
Прогностический – понятие, характеризующее заключение о предстоящем развитии и исходе, основанное на специальном исследовании.
Промотор – участок молекулы ДНК, к которому присоединяются молекулы РНК-полимеразы, что сопровождается инициацией транскрипции соответствующих генов; как правило, промотор расположен на операторном конце оперона; каждый ген (или оперон) имеет свой промотор, контролирующий его транскрипцию.
Рецессивный аллель – аллель, не проявляющийся в фенотипе гетерозиготных особей.
Фенотип – особенности строения и жизнедеятельности организма, обусловленные взаимодействием его генотипа с условиями среды.
Хромосома – составной элемент клеточного ядра, являющийся носителем генов. В основе хромосомы лежит линейная молекула ДНК
Экзон – фрагмент гена, кодирующий аминокислотную последовательность белкового продукта данного гена.
Экспрессия гена – перенос генетической информации от ДНК через РНК к полипептидам и белкам в определенных типах клеток организма.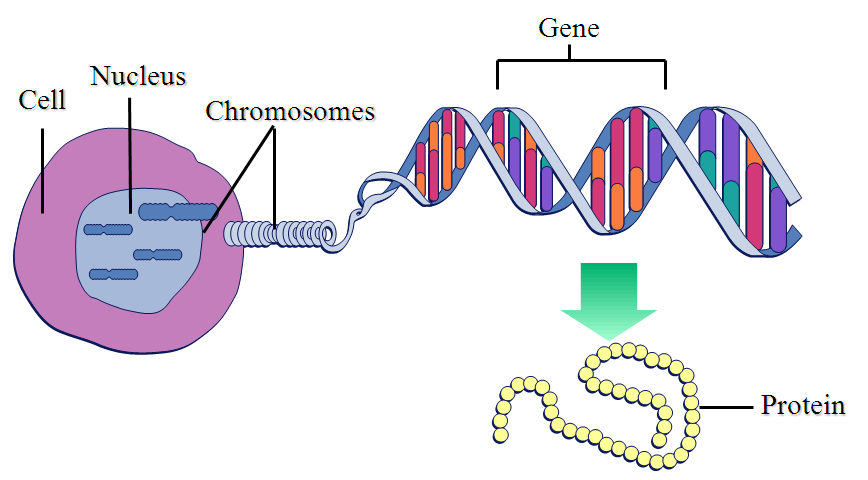
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Рекомендации
Врач-инфекционист: острая фаза пандемии прошла, но вирус никуда не делся
13445
16 Марта
Заметки инфекциониста
13247
08 Октября
Заметки инфекциониста
17828
12 Июля
Показать еще
На мобильном количество бактерий в 5 раз выше, чем на сиденье унитаза или на подошве обуви
Корпуса мобильных телефонов оказались усеяны плотным слоем бактерий, среди которых присутствовал даже золотистый стафилококк, который переносят на себе до 20% населения Земли. Но если одним люди его могут не бояться, то у граждан, например, с ослабленным иммунитетом он может вызвать всё что угодно — от лёгкого кожного заболевания до менингита…
Но если одним люди его могут не бояться, то у граждан, например, с ослабленным иммунитетом он может вызвать всё что угодно — от лёгкого кожного заболевания до менингита…
Подробнее
От «Книги мертвых» до ISO
Нередко «изобретение» стандартов качества приписывают ученым XX века. Однако, если бы дело обстояло именно так, то, возможно, многие шедевры и исторические артефакты древних цивилизаций просто не сохранились бы до наших дней. Начало долгого пути к хорошо нам известному ISO было положено еще в древнем Египте.
Подробнее
Беспроводные устройства приводят к депрессии и бесплодию
Ежегодно бесплодными становятся около двух процентов мужчин на планете. И большинство из них заядлые поклонники разнообразных гаджетов: компьютеров, мобильных телефонов и wi-fi. Об этом заявила исследователь Сальгренской академии в Гетеборге Сара Томе.
Подробнее
Остеопороз и его диагностика
Кость – это орган опорной системы, и у здорового человека в течение десяти лет она полностью обновляется благодаря процессу ремоделирования. При нарушении этого процесса развивается остеопороз (ОП), по данным ВОЗ, занимающий ведущее место в структуре заболеваемости и смертности населения после сердечно-сосудистых, онкологических заболеваний и сахарного диабета.
Подробнее
Изобретён моментальный анализатор крови
Дешёвое портативное устройство для анализа крови под названием mChip оказалось столь же точным, что и дорогие больничные тесты на выявление ВИЧ, сифилиса и других инфекционных заболеваний, пишет The Telegraph.
Подробнее
Подпишитесь на наши рассылки
Введите e-mail
Даю согласие на
обработку персональных данных
Подписаться
Гены и хромосомы – основы
Гены представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК), которые содержат код определенного белка, функционирующего в одном или нескольких типах клеток организма. Хромосомы — это структуры внутри клеток, которые содержат гены человека.
Хромосомы — это структуры внутри клеток, которые содержат гены человека.
Гены содержатся в хромосомах, находящихся в ядре клетки.
Хромосома содержит от сотен до тысяч генов.
Каждая нормальная клетка человека содержит 23 пары хромосом, всего 46 хромосом.
Признак – это любая определяемая генами характеристика, которая часто определяется более чем одним геном.
Некоторые признаки обусловлены мутировавшими генами, которые передаются по наследству или являются результатом мутации нового гена.
Белки, вероятно, являются самым важным классом материалов в организме. Белки — это не просто строительные блоки для мышц, соединительных тканей, кожи и других структур. Они также необходимы для производства ферментов. Ферменты представляют собой сложные белки, которые контролируют и осуществляют почти все химические процессы и реакции в организме. Организм вырабатывает тысячи различных ферментов. Таким образом, вся структура и функции организма регулируются типами и количествами белков, синтезируемых организмом. Синтез белка контролируется генами, содержащимися в хромосомах.
Таким образом, вся структура и функции организма регулируются типами и количествами белков, синтезируемых организмом. Синтез белка контролируется генами, содержащимися в хромосомах.
Генотип (или геном) — это уникальная комбинация генов или генетический состав человека. Таким образом, генотип представляет собой полный набор инструкций о том, как тело этого человека синтезирует белки и, следовательно, как это тело должно быть построено и функционировать.
Фенотип Фактическая структура и функция тела человека. Фенотип — это то, как генотип проявляется у человека — не все инструкции генотипа могут выполняться (или выражаться). Экспрессия гена определяется не только генотипом, но и окружающей средой (включая болезни и диету) и другими факторами, некоторые из которых неизвестны.
Кариотип — это изображение полного набора хромосом в клетках человека.
У человека от 20 000 до 23 000 генов.
Гены состоят из дезоксирибонуклеиновой кислоты (ДНК). ДНК содержит код или план, используемый для синтеза белка. Гены различаются по размеру в зависимости от размеров белков, которые они кодируют. Каждая молекула ДНК представляет собой длинную двойную спираль, напоминающую винтовую лестницу, содержащую миллионы ступенек. Ступени лестницы состоят из пар четырех типов молекул, называемых основаниями (нуклеотидами). На каждом этапе основание аденина (A) соединяется с основанием тимина (T) или основание гуанина (G) соединяется с основанием цитозина (C). Каждая чрезвычайно длинная молекула ДНК закручена внутри одной из хромосом. Хромосомы Гены представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК), которые содержат код определенного белка, функционирующего в одном или нескольких типах клеток организма. Хромосомы — это структуры внутри клеток… читать дальше.
ДНК содержит код или план, используемый для синтеза белка. Гены различаются по размеру в зависимости от размеров белков, которые они кодируют. Каждая молекула ДНК представляет собой длинную двойную спираль, напоминающую винтовую лестницу, содержащую миллионы ступенек. Ступени лестницы состоят из пар четырех типов молекул, называемых основаниями (нуклеотидами). На каждом этапе основание аденина (A) соединяется с основанием тимина (T) или основание гуанина (G) соединяется с основанием цитозина (C). Каждая чрезвычайно длинная молекула ДНК закручена внутри одной из хромосом. Хромосомы Гены представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК), которые содержат код определенного белка, функционирующего в одном или нескольких типах клеток организма. Хромосомы — это структуры внутри клеток… читать дальше.
Структура ДНК
ДНК (дезоксирибонуклеиновая кислота) представляет собой генетический материал клетки, содержащийся в хромосомах внутри клеточного ядра и митохондрий. За исключением некоторых клеток (например, сперматозоидов, яйцеклеток и эритроцитов), ядро клетки содержит 23 пары хромосом. Хромосома содержит множество генов. Ген — это сегмент ДНК, который обеспечивает код для построения белка. Молекула ДНК представляет собой длинную закрученную двойную спираль, напоминающую винтовую лестницу. В нем две нити, состоящие из молекул сахара (дезоксирибозы) и фосфата, соединены парами из четырех молекул, называемых основаниями, которые образуют ступени лестницы. На этапах аденин соединяется с тимином, а гуанин соединяется с цитозином. Каждая пара оснований удерживается вместе водородной связью. Ген состоит из последовательности оснований. Последовательности из трех оснований кодируют аминокислоту (аминокислоты являются строительными блоками белков) или другую информацию. |
Белки состоят из длинной цепи аминокислот, связанных друг с другом. Существует 20 различных аминокислот, которые могут использоваться в синтезе белка: некоторые должны поступать с пищей (незаменимые аминокислоты), а некоторые вырабатываются ферментами в организме. По мере того, как цепочка аминокислот собирается вместе, она складывается, создавая сложную трехмерную структуру. Именно форма складчатой структуры определяет ее функцию в организме. Поскольку укладка определяется точной последовательностью аминокислот, каждая отдельная последовательность приводит к разным белкам. Некоторые белки (например, гемоглобин) содержат несколько различных свернутых цепей. Инструкции по синтезу белков закодированы в ДНК.
По мере того, как цепочка аминокислот собирается вместе, она складывается, создавая сложную трехмерную структуру. Именно форма складчатой структуры определяет ее функцию в организме. Поскольку укладка определяется точной последовательностью аминокислот, каждая отдельная последовательность приводит к разным белкам. Некоторые белки (например, гемоглобин) содержат несколько различных свернутых цепей. Инструкции по синтезу белков закодированы в ДНК.
Информация закодирована в ДНК последовательностью расположения оснований (A, T, G и C). Код написан триплетами. То есть базы располагаются группами по три. Конкретные последовательности из трех оснований в ДНК кодируют определенные инструкции, такие как добавление одной аминокислоты в цепь. Например, GCT (гуанин, цитозин, тимин) кодирует добавление аминокислоты аланина, а GTT (гуанин, тимин, тимин) кодирует добавление аминокислоты валина. Таким образом, последовательность аминокислот в белке определяется порядком триплетных пар оснований в гене этого белка в молекуле ДНК. Процесс превращения закодированной генетической информации в белок включает транскрипцию и трансляцию.
Процесс превращения закодированной генетической информации в белок включает транскрипцию и трансляцию.
Транскрипция — это процесс, при котором информация, закодированная в ДНК, переносится (транскрибируется) на рибонуклеиновую кислоту (РНК). РНК представляет собой длинную цепь оснований, как и цепь ДНК, за исключением того, что основание урацил (U) заменяет основание тимин (T). Таким образом, РНК, как и ДНК, содержит информацию, закодированную триплетом.
При инициации транскрипции часть двойной спирали ДНК открывается и раскручивается. Одна из размотанных цепей ДНК действует как матрица, против которой формируется комплементарная нить РНК. Комплементарная цепь РНК называется матричной РНК (мРНК). мРНК отделяется от ДНК, покидает ядро и перемещается в цитоплазму клетки (часть клетки вне ядра — см. рисунок). Там мРНК присоединяется к рибосоме, крошечной структуре в клетке, где происходит синтез белка.
С переводом , код мРНК (из ДНК) сообщает рибосоме порядок и тип аминокислот, которые нужно связать вместе. Аминокислоты доставляются к рибосоме гораздо меньшим типом РНК, называемым транспортной РНК (тРНК). Каждая молекула тРНК приносит одну аминокислоту для включения в растущую цепь белка, которая сворачивается в сложную трехмерную структуру под влиянием близлежащих молекул, называемых молекулами-шаперонами.
Аминокислоты доставляются к рибосоме гораздо меньшим типом РНК, называемым транспортной РНК (тРНК). Каждая молекула тРНК приносит одну аминокислоту для включения в растущую цепь белка, которая сворачивается в сложную трехмерную структуру под влиянием близлежащих молекул, называемых молекулами-шаперонами.
В организме человека существует много типов клеток, таких как клетки сердца, клетки печени и мышечные клетки. Эти клетки выглядят и действуют по-разному и производят очень разные химические вещества. Однако каждая клетка является потомком одной оплодотворенной яйцеклетки и поэтому содержит практически одинаковую ДНК. Клетки приобретают очень разный внешний вид и функции, потому что разные гены экспрессируются в разных клетках (и в разное время в одной и той же клетке). Информация о том, когда ген должен экспрессироваться, также закодирована в ДНК. Экспрессия генов зависит от типа ткани, возраста человека, наличия специфических химических сигналов и множества других факторов и механизмов. Знание этих других факторов и механизмов, контролирующих экспрессию генов, быстро растет, но многие из этих факторов и механизмов все еще плохо изучены.
Знание этих других факторов и механизмов, контролирующих экспрессию генов, быстро растет, но многие из этих факторов и механизмов все еще плохо изучены.
Механизмы, с помощью которых гены контролируют друг друга, очень сложны. Гены имеют химические маркеры, указывающие, где должна начинаться и заканчиваться транскрипция. Различные химические вещества (например, гистоны) внутри и вокруг ДНК блокируют или разрешают транскрипцию. Кроме того, цепь РНК, называемая антисмысловой РНК, может соединяться с комплементарной цепью мРНК и блокировать трансляцию.
Клетки размножаются делением надвое. Поскольку каждой новой клетке требуется полный набор молекул ДНК, молекулы ДНК в исходной клетке должны воспроизводить (реплицировать) себя во время клеточного деления. Репликация происходит аналогично транскрипции, за исключением того, что вся двухцепочечная молекула ДНК раскручивается и разделяется на две части. После расщепления основания на каждой цепи связываются с комплементарными основаниями (А с Т и G с С), плавающими поблизости. Когда этот процесс завершен, существуют две идентичные двухцепочечные молекулы ДНК.
Когда этот процесс завершен, существуют две идентичные двухцепочечные молекулы ДНК.
Чтобы предотвратить ошибки во время репликации, в ячейках предусмотрена функция «вычитки», помогающая убедиться, что основания спарены правильно. Существуют также химические механизмы для восстановления ДНК, которая не была скопирована должным образом. Однако из-за того, что в процесс синтеза белка вовлечены миллиарды пар оснований, а также из-за его сложности, могут возникать ошибки. Такие ошибки могут возникать по многим причинам (включая воздействие радиации, лекарств или вирусов) или без видимой причины. Незначительные вариации в ДНК очень распространены и встречаются у большинства людей. Большинство вариаций не влияют на последующие копии гена. Ошибки, которые дублируются в последующих копиях, называются мутациями.
Наследственные мутации — это мутации, которые могут передаваться потомству. Мутации могут передаваться по наследству только тогда, когда они затрагивают половые клетки (сперматозоид или яйцеклетку). Мутации, не затрагивающие половые клетки, влияют на потомков мутировавшей клетки (например, превращаясь в рак), но не передаются потомству.
Мутации, не затрагивающие половые клетки, влияют на потомков мутировавшей клетки (например, превращаясь в рак), но не передаются потомству.
Мутации могут быть уникальными для отдельного человека или семьи, и большинство вредных мутаций встречаются редко. Мутации, которые становятся настолько распространенными, что затрагивают более 1% популяции, называются полиморфизмами (например, группы крови человека А, В, АВ и О). Большинство полиморфизмов практически не влияют на фенотип ( фактическое строение и функции организма человека).
Мутации могут затрагивать маленькие или большие сегменты ДНК. В зависимости от размера и локализации мутация может не иметь явного эффекта или может изменить последовательность аминокислот в белке или уменьшить количество продуцируемого белка. Если белок имеет другую аминокислотную последовательность, он может функционировать иначе или вообще не функционировать. Отсутствующий или нефункционирующий белок часто вреден или смертелен. Например, при фенилкетонурии Фенилкетонурия (ФКУ) Фенилкетонурия представляет собой нарушение метаболизма аминокислот, возникающее у младенцев, рожденных без способности нормально расщеплять аминокислоту, называемую фенилаланином. Фенилаланин, который токсичен… читать далее , мутация приводит к дефициту или отсутствию фермента фенилаланингидроксилазы. Этот дефицит позволяет аминокислоте фенилаланину (всасываемой из пищи) накапливаться в организме, что в конечном итоге вызывает тяжелую умственную отсталость. В редких случаях мутация вносит полезное изменение. Например, в случае гена серповидноклеточной анемии, когда человек наследует две копии аномального гена, у него разовьется серповидноклеточная анемия. в эритроцитах) характеризуется наличием серповидных (полумесяцев) эритроцитов и хроническим… читать далее . Однако, когда человек наследует только одну копию гена серповидноклеточной анемии (называемую носителем), у него развивается некоторая защита от малярии. Малярия Малярия — это заражение эритроцитов одним из пяти видов из 9.0031 Плазмодий, простейшее. Малярия вызывает лихорадку, озноб, потливость, общее недомогание (недомогание), а иногда… читать далее (заражение крови). Хотя защита от малярии может помочь выжить носителю, серповидно-клеточная анемия (у человека с двумя копиями гена) вызывает симптомы и осложнения, которые могут сократить продолжительность жизни.
Фенилаланин, который токсичен… читать далее , мутация приводит к дефициту или отсутствию фермента фенилаланингидроксилазы. Этот дефицит позволяет аминокислоте фенилаланину (всасываемой из пищи) накапливаться в организме, что в конечном итоге вызывает тяжелую умственную отсталость. В редких случаях мутация вносит полезное изменение. Например, в случае гена серповидноклеточной анемии, когда человек наследует две копии аномального гена, у него разовьется серповидноклеточная анемия. в эритроцитах) характеризуется наличием серповидных (полумесяцев) эритроцитов и хроническим… читать далее . Однако, когда человек наследует только одну копию гена серповидноклеточной анемии (называемую носителем), у него развивается некоторая защита от малярии. Малярия Малярия — это заражение эритроцитов одним из пяти видов из 9.0031 Плазмодий, простейшее. Малярия вызывает лихорадку, озноб, потливость, общее недомогание (недомогание), а иногда… читать далее (заражение крови). Хотя защита от малярии может помочь выжить носителю, серповидно-клеточная анемия (у человека с двумя копиями гена) вызывает симптомы и осложнения, которые могут сократить продолжительность жизни.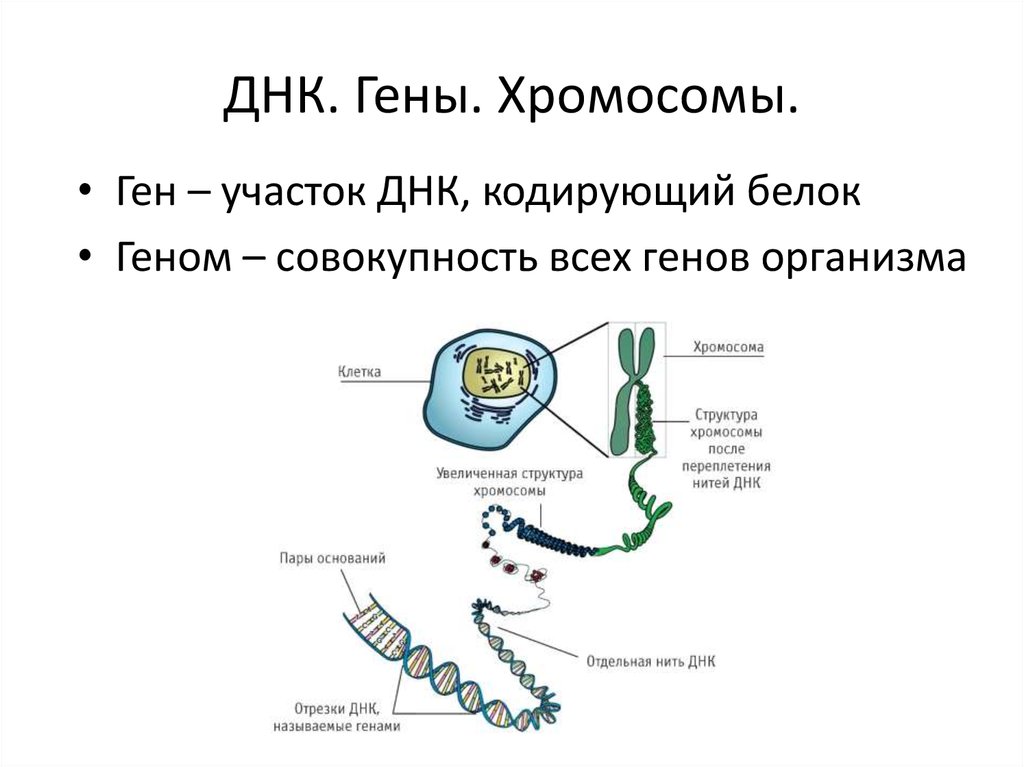
Естественный отбор относится к концепции, согласно которой мутации, ухудшающие выживаемость в данной среде, с меньшей вероятностью передаются потомству (и, таким образом, становятся менее распространенными в популяции), в то время как мутации, улучшающие выживаемость, постепенно становятся более распространенными. Таким образом, полезные мутации, хотя изначально редкие, со временем становятся обычным явлением. Медленные изменения, которые происходят с течением времени, вызванные мутациями и естественным отбором в скрещивающейся популяции, в совокупности называются эволюция.
Знаете ли вы…
Хромосома состоит из очень длинной нити ДНК и содержит множество генов Гены Гены представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК), которые содержат код определенного белка, функционирующего в одном или нескольких типы клеток в организме. Хромосомы — это структуры внутри клеток… читать дальше (от сотен до тысяч). Гены на каждой хромосоме расположены в определенной последовательности, и каждый ген имеет определенное место на хромосоме (называемое его локусом). Помимо ДНК, хромосомы содержат другие химические компоненты, влияющие на функцию генов.
Помимо ДНК, хромосомы содержат другие химические компоненты, влияющие на функцию генов.
За исключением некоторых клеток (например, сперматозоидов и яйцеклеток или эритроцитов), ядро каждой нормальной человеческой клетки содержит 23 пары хромосом, всего 46 хромосом. В норме каждая пара состоит из одной хромосомы от матери и одной от отца.
Имеется 22 пары неполовых (аутосомных) хромосом и одна пара половых хромосом. Парные неполовые хромосомы для практических целей идентичны по размеру, форме, положению и количеству генов. Поскольку каждый член пары неполовых хромосом содержит по одному соответствующему гену, существует в некотором смысле резервная копия генов на этих хромосомах.
23-я пара — половые хромосомы (X и Y).
Пара половых хромосом определяет, станет ли плод мужчиной или женщиной. У мужчин есть одна Х- и одна Y-хромосома. X у мужчин происходит от его матери, а Y — от отца. Женщины имеют две Х-хромосомы, одну от матери и одну от отца. В некотором смысле половые хромосомы функционируют иначе, чем неполовые хромосомы.
Меньшая Y-хромосома несет гены, определяющие мужской пол, а также несколько других генов. Х-хромосома содержит гораздо больше генов, чем Y-хромосома, многие из которых выполняют функции помимо определения пола и не имеют аналога в Y-хромосоме. У мужчин из-за отсутствия второй Х-хромосомы эти дополнительные гены на Х-хромосоме не являются парными, и практически все они экспрессируются. Гены на Х-хромосоме называются сцепленными с полом или Х-сцепленными генами.
В норме в неполовых хромосомах гены обеих пар хромосом способны к полной экспрессии. Однако у самок большинство генов на одной из двух Х-хромосом отключаются в результате процесса, называемого инактивацией Х (за исключением яйцеклеток в яичниках). Инактивация X происходит в начале жизни плода. В одних клетках Х от отца становится неактивным, а в других клетках становится неактивным Х от матери. Таким образом, одна клетка может иметь ген матери человека, а другая клетка — ген отца человека. Из-за инактивации Х отсутствие одной Х-хромосомы обычно приводит к относительно незначительным аномалиям (таким как синдром Тернера Синдром Тернера Синдром Тернера — это аномалия половой хромосомы, при которой девочки рождаются с частично или полностью отсутствующей одной из двух Х-хромосом). Синдром Тернера вызвано удалением части… читать далее ). Таким образом, отсутствие Х-хромосомы гораздо менее вредно, чем отсутствие неполовой хромосомы ( Обзор аномалий половых хромосом Обзор аномалий половых хромосом Аномалии половых хромосом могут быть вызваны полными или частичными делециями или дупликациями половых хромосом. Хромосомы представляют собой структуры внутри клеток, которые содержат ДНК и множество генов.Ген — это… читать дальше ).
Синдром Тернера вызвано удалением части… читать далее ). Таким образом, отсутствие Х-хромосомы гораздо менее вредно, чем отсутствие неполовой хромосомы ( Обзор аномалий половых хромосом Обзор аномалий половых хромосом Аномалии половых хромосом могут быть вызваны полными или частичными делециями или дупликациями половых хромосом. Хромосомы представляют собой структуры внутри клеток, которые содержат ДНК и множество генов.Ген — это… читать дальше ).
Если у женщины заболевание, при котором у нее имеется более двух Х-хромосом, дополнительные хромосомы, как правило, неактивны. Таким образом, наличие одной или нескольких дополнительных Х-хромосом вызывает гораздо меньше аномалий развития, чем наличие одной или нескольких дополнительных неполовых хромосом. Например, женщины с тремя Х-хромосомами (синдром тройной Х-хромосомы Трисомия Х Трисомия Х — распространенная аномалия половых хромосом, при которой девочки рождаются с тремя Х-хромосомами (XXX). Хромосомы представляют собой структуры внутри клеток, которые содержат ДНК и множество генов. Гены содержат. .. читать дальше ) часто физически и психически нормальны. Мужчины, имеющие более одной Y-хромосомы ( Главная страница. См. Синдром XYY Синдром XYY Синдром XYY — это аномалия половых хромосом, при которой мальчики рождаются с двумя Y-хромосомами и одной X-хромосомой. Хромосомы представляют собой структуры внутри клеток, которые содержат ДНК и множество генов. Гены … читать дальше ) могут иметь физические и психические отклонения.
Гены содержат. .. читать дальше ) часто физически и психически нормальны. Мужчины, имеющие более одной Y-хромосомы ( Главная страница. См. Синдром XYY Синдром XYY Синдром XYY — это аномалия половых хромосом, при которой мальчики рождаются с двумя Y-хромосомами и одной X-хромосомой. Хромосомы представляют собой структуры внутри клеток, которые содержат ДНК и множество генов. Гены … читать дальше ) могут иметь физические и психические отклонения.
Существует несколько типов хромосомных аномалий Обзор хромосомных и генных нарушений Хромосомы представляют собой структуры внутри клеток, которые содержат гены человека. Ген представляет собой сегмент дезоксирибонуклеиновой кислоты (ДНК) и содержит код определенного белка, функционирующего в одном… читать далее . У человека может быть аномальное количество хромосом или аномальные области на одной или нескольких хромосомах. Многие такие аномалии можно диагностировать до рождения (см. Тестирование на хромосомные и генные аномалии Тестирование на хромосомные и генные аномалии Хромосомы — это структуры внутри клеток, содержащие гены человека.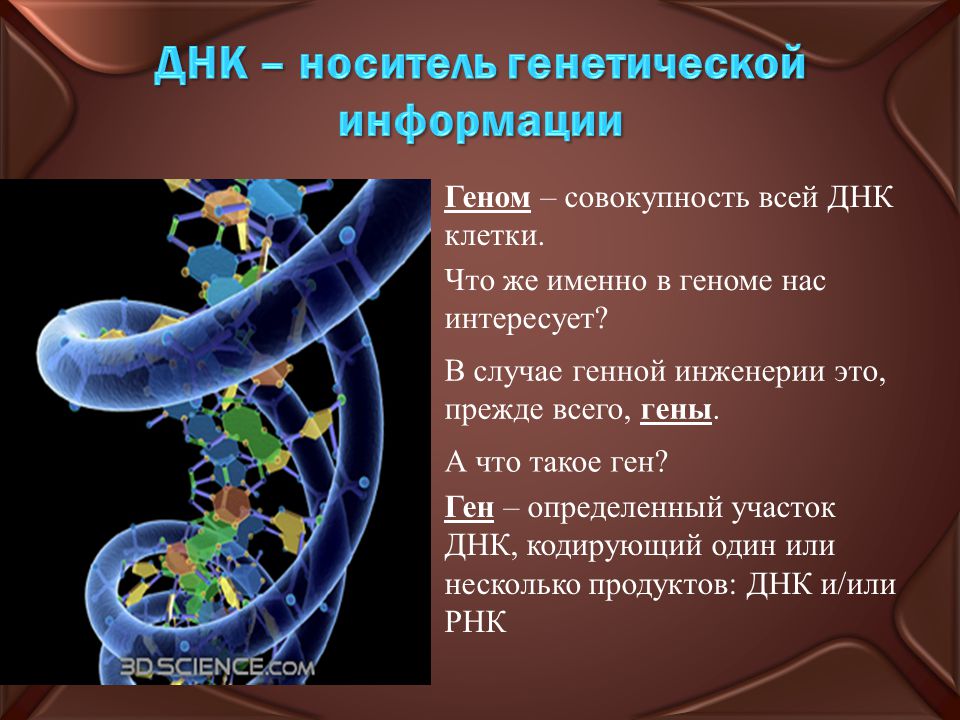 Ген — это сегмент дезоксирибонуклеиновой кислоты (ДНК), содержащий код специфический белок, функционирующий в одном… читать далее ).
Ген — это сегмент дезоксирибонуклеиновой кислоты (ДНК), содержащий код специфический белок, функционирующий в одном… читать далее ).
Аномальное число неполовых хромосом обычно приводит к серьезным аномалиям. Например, получение лишней неполовой хромосомы может быть смертельным для плода или привести к аномалиям, таким как синдром Дауна. Синдром Дауна (трисомия 21) Синдром Дауна — это хромосомное нарушение, вызванное дополнительной 21-й хромосомой, которое приводит к умственной отсталости и физическим отклонениям. Синдром Дауна вызывается дополнительной хромосомой 21… читать далее , которая обычно является результатом наличия у человека трех копий хромосомы 21. Отсутствие неполовой хромосомы фатально для плода.
Большие области на хромосоме могут быть аномальными, обычно из-за того, что целый участок был исключен (так называемая делеция) или ошибочно помещен в другую хромосому (так называемая транслокация). Например, хронический миелогенный лейкоз Хронический миелоидный лейкоз (ХМЛ) Хронический миелоидный лейкоз — это медленно прогрессирующее заболевание, при котором клетки, которые в норме превращаются в типы лейкоцитов, называемые нейтрофилами, базофилами, эозинофилами и моноцитами.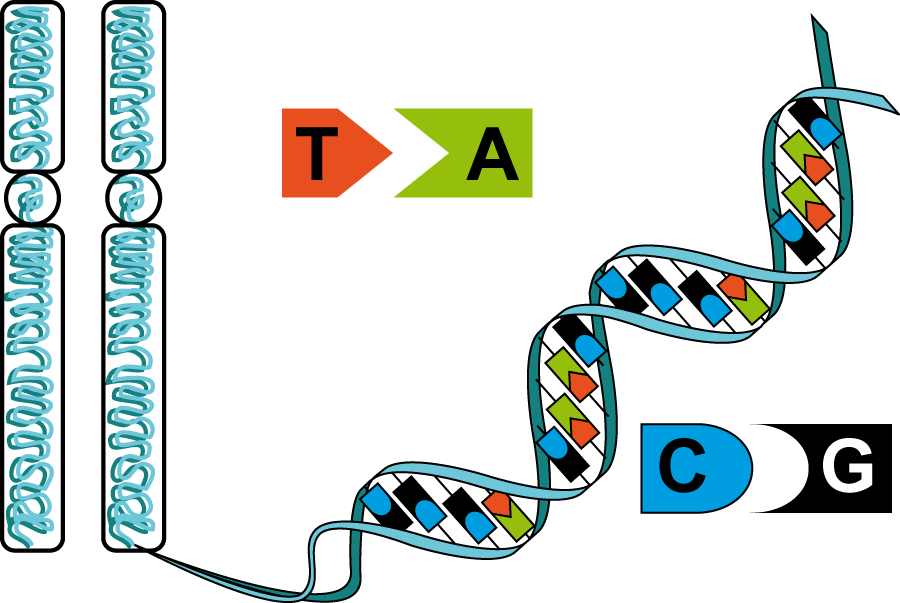 .. иногда в результате транслокации части хромосомы 9на хромосоме 22. Эта аномалия может передаваться по наследству или быть результатом новой мутации. Гены мутаций представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК), которые содержат код определенного белка, функционирующего в одном или нескольких типах клеток организма. Хромосомы — это структуры внутри клеток… читать дальше.
.. иногда в результате транслокации части хромосомы 9на хромосоме 22. Эта аномалия может передаваться по наследству или быть результатом новой мутации. Гены мутаций представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК), которые содержат код определенного белка, функционирующего в одном или нескольких типах клеток организма. Хромосомы — это структуры внутри клеток… читать дальше.
— это крошечные структуры внутри клеток, которые синтезируют молекулы, используемые для производства энергии. В отличие от других структур внутри клеток, каждая митохондрия содержит свою кольцевую хромосому. Эта хромосома содержит ДНК (митохондриальную ДНК), которая кодирует некоторые, но не все белки, составляющие эту митохондрию. Митохондриальная ДНК обычно происходит только от матери человека, потому что, как правило, при оплодотворении яйцеклетки только митохондрии из яйца становятся частью развивающегося эмбриона. Митохондрии из сперматозоидов обычно не становятся частью развивающегося зародыша.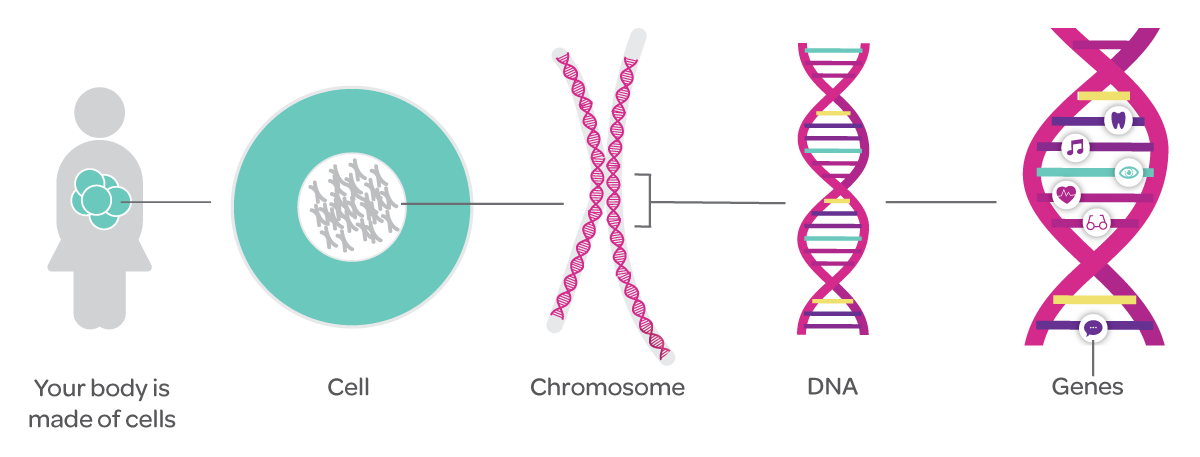
Признак – это любая определяемая геном характеристика. Многие признаки определяются функцией более чем одного гена. Например, рост человека, скорее всего, определяется многими генами, включая те, которые влияют на рост, аппетит, мышечную массу и уровень активности. Однако некоторые признаки определяются функцией одного гена.
Изменение некоторых признаков, таких как цвет глаз или группа крови, считается нормальным. Другие вариации, такие как альбинизм Альбинизм Альбинизм – это редкое наследственное заболевание, при котором мало или совсем не образуется пигмента меланина кожи. Поражаются кожа, волосы и глаза, а иногда и только глаза. Как правило, волосы… читать далее , Синдром Марфана Синдром Марфана Синдром Марфана – редкое наследственное заболевание соединительной ткани, приводящее к аномалиям глаз, костей, сердца, кровеносных сосудов, легких и центральной нервной системы. Этот синдром обусловлен… читать далее и болезнь Гентингтона Болезнь Гентингтона Болезнь Гентингтона — наследственное заболевание, которое начинается с периодических непроизвольных подергиваний или спазмов, затем прогрессирует в более выраженные непроизвольные движения (хорея и атетоз), психические. .. читать далее , наносят вред структуре или функции тела и считаются расстройствами. Однако не все такие генные аномалии одинаково опасны. Например, одна копия гена серповидноклеточной анемии может обеспечить защиту от малярии, а две копии гена вызывают серповидноклеточную анемию.
.. читать далее , наносят вред структуре или функции тела и считаются расстройствами. Однако не все такие генные аномалии одинаково опасны. Например, одна копия гена серповидноклеточной анемии может обеспечить защиту от малярии, а две копии гена вызывают серповидноклеточную анемию.
Знаете ли вы…
Генетическое заболевание — это вредная черта, вызванная аномальным геном. Аномальный ген может передаваться по наследству или возникать спонтанно в результате новой мутации. Генные аномалии довольно распространены. Каждый человек несет в среднем от 100 до 400 аномальных генов (разных у разных людей). Однако в большинстве случаев соответствующий ген на другой хромосоме в паре является нормальным и предотвращает любые вредные воздействия. В общей популяции вероятность наличия у человека двух копий одного и того же аномального гена (и, следовательно, расстройства) очень мала. Однако у детей, являющихся потомками близких кровных родственников, шансы выше. Шансы также выше среди детей родителей, вступивших в брак с изолированным населением, таким как амиши или меннониты.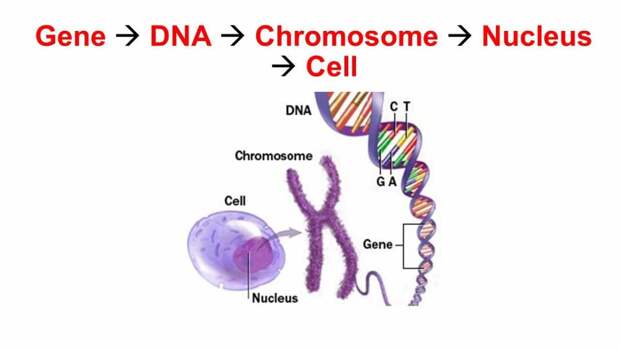
Гены, ДНК и рак | Cancer Research UK
Эта страница посвящена изменениям в генах и ДНК, которые могут привести к раку. Имеется информация о
ДНК и генах
Как дефектные гены приводят к раку
Гены, стимулирующие размножение клеток (онкогены)
Гены, останавливающие размножение клеток (гены-супрессоры опухолей)
Гены, восстанавливающие другие поврежденные гены (гены репарации ДНК)
Гены, которые предписывают клетке умереть (гены самоуничтожения)
Дополнительная информация
ДНК и гены
Почти в каждой клетке вашего тела есть структура, называемая ядром. Это центр управления ячейкой. Внутри ядра находятся 23 пары хромосом. Это длинные нити ДНК.
ДНК означает дезоксирибонуклеиновую кислоту (произносится как ди-окси-рай-боу-ню-гли-ик кислота). Каждая нить ДНК выглядит как скрученная лестница. Ученые называют это двойной спиралью.
Каждая клетка содержит более 2 метров ДНК. Но очень туго закручена, так что все влезает. ДНК похожа на код, содержащий все инструкции, которые сообщают клетке, что делать. Он состоит из генов. Всего у человека около 25 000 генов.
ДНК похожа на код, содержащий все инструкции, которые сообщают клетке, что делать. Он состоит из генов. Всего у человека около 25 000 генов.
Вы унаследовали половину ДНК от матери и половину от отца. Итак, у вас есть 2 копии каждого гена.
Ваши гены несут всю информацию, которая делает вас вами. Например, они говорят вашему телу, чтобы у него были светлые волосы, смуглая кожа или зеленые глаза. И они сообщают вашим ячейкам:
- какой ячейке быть
- как себя вести
- когда выращивать и размножать
- когда умереть
Некоторые гены контролируют скорость роста и деления каждой клетки.
Как дефектные гены приводят к раку
Наши гены улавливают ошибки, возникающие при делении клеток. Эти ошибки (или ошибки) называются мутациями. Мутации могут происходить на протяжении всей нашей жизни, во время естественных процессов в наших клетках. Или они могут произойти из-за других факторов, таких как:
- табачный дым
- высокоэнергетическое (ионизирующее) излучение, такое как рентгеновские лучи
- ультрафиолетовое излучение солнца
- некоторые вещества в пищевых продуктах
- химических веществ в окружающей среде
Иногда люди наследуют определенные дефектные гены от своих родителей. Это может повысить риск развития рака.
Это может повысить риск развития рака.
Обычно клетки восстанавливают ошибки в своих генах. Когда повреждение очень сильное, вместо этого клетка может самоуничтожиться. Или иммунная система может распознать их как ненормальные и убить. Это помогает защитить нас от рака.
Иногда мутации в важных генах приводят к тому, что клетка перестает понимать инструкции. Клетка может начать бесконтрольно размножаться. Он не восстанавливает себя должным образом и не умирает, когда должен. Это может привести к раку.
Существует 4 основных типа генов, участвующих в делении клеток. Большинство опухолей имеют дефектные копии более чем одного из этих типов. Вы можете прочитать больше о 4 типах ниже.
Гены, стимулирующие размножение клеток (онкогены)
Онкогены — это гены, которые в нормальных условиях заставляют клетки размножаться и делиться. У взрослых такое случается нечасто.
Мы можем думать об онкогенах как о педали акселератора в автомобиле. Когда они становятся активными, они ускоряют скорость роста клетки. Когда человек повреждается, это похоже на то, как педаль акселератора застревает. Эта клетка и все клетки, которые вырастают из нее, постоянно получают указание делиться. Так развивается рак.
Когда человек повреждается, это похоже на то, как педаль акселератора застревает. Эта клетка и все клетки, которые вырастают из нее, постоянно получают указание делиться. Так развивается рак.
Гены, останавливающие размножение клеток (гены-супрессоры опухолей)
Обычно клетки восстанавливают дефекты в своих генах. Когда повреждение очень серьезное, гены-супрессоры опухоли могут остановить рост и деление клеток.
Мутации в генах-супрессорах опухолей означают, что клетка больше не понимает команду прекратить рост. Затем клетка может начать бесконтрольно размножаться. Это может привести к раку.
Наиболее известным геном-супрессором опухоли является p53. Исследователям известно, что ген p53 поврежден или отсутствует при большинстве видов рака.
Гены, которые восстанавливают другие поврежденные гены (гены восстановления ДНК)
ДНК в каждой клетке нашего тела постоянно находится под угрозой повреждения. Но клетки содержат множество различных белков, задачей которых является восстановление поврежденной ДНК. Благодаря этим белкам большинство повреждений ДНК восстанавливаются сразу.
Благодаря этим белкам большинство повреждений ДНК восстанавливаются сразу.
Но если повреждение ДНК происходит с геном, который вырабатывает белок восстановления ДНК, у клетки снижается способность к самовосстановлению. Таким образом, ошибки со временем будут накапливаться в других генах и приведут к формированию рака.
Ученые обнаружили поврежденные гены репарации ДНК при некоторых видах рака, включая рак кишечника.
Гены, которые предписывают клетке умереть (гены самоуничтожения)
Некоторые гены приказывают клетке самоуничтожаться, если она стала слишком старой или поврежденной. Это называется апоптозом или запрограммированной гибелью клеток. Это очень сложный и важный процесс. Клетки обычно умирают всякий раз, когда что-то идет не так, чтобы предотвратить образование рака.
Существует множество различных генов и белков, участвующих в апоптозе. Если эти гены повреждены, неисправная клетка может выжить, а не умереть, и она становится раковой.
Информация по теме
Вы можете прочитать о наследственных генах, повышающих риск развития рака.
Генетическое тестирование | CDC
Генетическое тестирование направлено на поиск изменений в вашей ДНК, которые могут дать информацию о вашем медицинском обслуживании. Поговорите со своим врачом о том, подходит ли вам генетическое тестирование.
Что такое генетическое тестирование?
Генетическое тестирование ищет изменения, иногда называемые мутациями или вариантами, в вашей ДНК. Генетическое тестирование полезно во многих областях медицины и может изменить медицинское обслуживание, которое получаете вы или член вашей семьи. Например, генетическое тестирование может предоставить диагноз генетического состояния, такого как Fragile X, или информацию о риске развития рака. Существует множество различных видов генетических тестов. Генетические тесты проводятся с использованием образца крови или слюны, и результаты обычно готовы через несколько недель. Поскольку у нас общая ДНК с членами нашей семьи, если у вас обнаружится генетическое изменение, у членов вашей семьи может быть такое же изменение. Генетическое консультирование до и после генетического тестирования может помочь убедиться, что вы являетесь подходящим человеком в вашей семье для прохождения генетического теста, что вы проходите правильный генетический тест и что вы понимаете свои результаты.
Генетическое консультирование до и после генетического тестирования может помочь убедиться, что вы являетесь подходящим человеком в вашей семье для прохождения генетического теста, что вы проходите правильный генетический тест и что вы понимаете свои результаты.
Причины для генетического тестирования
- Чтобы узнать, есть ли у вас генетическое заболевание, которое встречается в вашей семье, до того, как у вас появятся симптомы
- Чтобы узнать о вероятности того, что текущая или будущая беременность будет иметь генетическое заболевание
- Для диагностики генетического заболевания, если у вас или вашего ребенка есть симптомы
- Чтобы понять и составить план профилактики или лечения рака
Узнав больше о генетическом тестировании, вы можете решить, что оно вам не подходит. Некоторые причины могут заключаться в том, что это не относится к вам или не изменит ваше медицинское обслуживание, это слишком дорого, а результаты могут вызвать у вас беспокойство или тревогу.
Типы генетических тестов
Клинические генетические тесты отличаются от генетических тестов для потребителей (DTC), которые могут дать некоторую информацию о медицинских и немедицинских признаках. Клинические генетические тесты назначаются вашим врачом по конкретной медицинской причине. Тесты DTC обычно покупают здоровые люди, которые заинтересованы в том, чтобы узнать больше о таких признаках, как происхождение, реакция на лекарства или риск развития определенных сложных состояний. Результаты теста DTC можно использовать для принятия решений о выборе образа жизни или для обсуждения вопросов с врачом. Тем не менее, тесты DTC не могут точно определить, заболеете ли вы или нет, и не должны использоваться отдельно для принятия решений о вашем лечении или медицинском обслуживании.
Существует множество различных видов генетических тестов. Не существует единого генетического теста, который мог бы выявить все генетические состояния. Подход к генетическому тестированию индивидуален в зависимости от вашей медицинской и семейной истории, а также от того, на какое заболевание вас проверяют.
Одноместный ген тестирование . Тесты с одним геном ищут изменения только в одном гене. Тестирование одного гена проводится, когда ваш врач считает, что у вас или вашего ребенка есть симптомы определенного состояния или синдрома. Некоторыми примерами этого являются мышечная дистрофия Дюшена или серповидно-клеточная анемия. Тестирование одного гена также используется, когда в семье есть известная генетическая мутация.
Проверка панели . Панельный генетический тест ищет изменения во многих генах в одном тесте. Панели генетического тестирования обычно сгруппированы по категориям, основанным на различных медицинских проблемах. Некоторыми примерами генетических панельных тестов являются низкий мышечный тонус, низкий рост или эпилепсия. Панельные генетические тесты также могут быть сгруппированы по генам, все из которых связаны с повышенным риском развития определенных видов рака, таких как рак молочной железы или колоректальный рак (ободочной кишки).
Крупномасштабное генетическое или геномное тестирование . Есть два разных вида крупномасштабных генетических тестов.
- При секвенировании экзома исследуются все гены в ДНК (полный экзом) или только гены, связанные с заболеваниями (клинический экзом).
- Секвенирование генома — крупнейший генетический тест, в ходе которого исследуется вся ДНК человека, а не только гены.
Секвенирование экзома и генома назначается врачами людям со сложным анамнезом. Широкомасштабное геномное тестирование также используется в исследованиях, чтобы узнать больше о генетических причинах состояний. Крупномасштабные генетические тесты могут иметь результаты, не связанные с тем, почему тест был заказан в первую очередь (вторичные результаты). Примерами вторичных результатов являются гены, связанные с предрасположенностью к раку или редким сердечным заболеваниям, когда вы искали генетический диагноз, объясняющий отклонения в развитии ребенка.
Тестирование на наличие изменений, отличных от генных
- Хромосомы .
 ДНК упакована в структуры, называемые хромосомами. Некоторые тесты ищут изменения в хромосомах, а не в генах. Примерами таких тестов являются кариотип и хромосомные микрочипы.
ДНК упакована в структуры, называемые хромосомами. Некоторые тесты ищут изменения в хромосомах, а не в генах. Примерами таких тестов являются кариотип и хромосомные микрочипы. - Экспрессия генов. Гены экспрессируются или включаются на разных уровнях в разных типах клеток. Тесты экспрессии генов сравнивают эти уровни между нормальными клетками и больными клетками, потому что знание различий может дать важную информацию для лечения заболевания. Например, эти тесты можно использовать для руководства химиотерапевтическим лечением рака молочной железы.
Типы результатов генетического теста
- Положительный результат — тест обнаружил генетическое изменение, которое, как известно, вызывает заболевание.
- Отрицательный результат – тест не обнаружил генетического изменения, вызывающего заболевание. Иногда отрицательный результат возникает, когда был назначен неправильный тест или нет генетической причины симптомов у этого человека.
 «Истинно отрицательный» — это когда в семье есть известные генетические изменения, и тестируемый человек не унаследовал их. Если результаты вашего теста отрицательные и в вашей семье нет известных генетических изменений, отрицательный результат теста может не дать вам определенного ответа. Это потому, что вы, возможно, не были проверены на генетические изменения, которые происходят в вашей семье.
«Истинно отрицательный» — это когда в семье есть известные генетические изменения, и тестируемый человек не унаследовал их. Если результаты вашего теста отрицательные и в вашей семье нет известных генетических изменений, отрицательный результат теста может не дать вам определенного ответа. Это потому, что вы, возможно, не были проверены на генетические изменения, которые происходят в вашей семье. - Неопределенный – вариант неизвестного или неопределенного значения означает, что недостаточно информации об этом генетическом изменении, чтобы определить, является ли оно доброкачественным (нормальным) или патогенным (вызывающим заболевание).
Генетическое тестирование можно представить так, будто вы задаете ДНК вопрос. Иногда мы не находим ответа, потому что задаем не тот вопрос или у науки просто еще нет ответа.
Дальнейшие действия
Если у вас есть генетическое заболевание в семейном анамнезе, симптомы генетического заболевания или вы хотите узнать о вероятности наличия генетического заболевания, поговорите со своим врачом о том, подходит ли вам генетическое тестирование. .
.
- Найдите консультанта-генетика в вашем районе через Национальное общество консультантов-генетиков
- Найдите медицинского генетика (врача-генетика) в вашем районе через Американский колледж медицинской генетики и геномики
Генетика рака | Cancer.Net
Одобрено редакционным советом Cancer.Net, 03/2018
Гены находятся в ДНК каждой клетки вашего тела. Они контролируют функционирование клетки, в том числе:
По оценкам исследователей, каждая клетка содержит 30 000 различных генов. Внутри каждой клетки гены расположены на хромосомах.
О хромосомах
Хромосомы представляют собой нитевидные структуры в клетках, содержащие гены. Имеется 46 хромосом, расположенных в 2 набора по 23.
Вы наследуете один набор от матери и один от отца. Одна хромосома в каждом наборе определяет, мужчина вы или женщина. Остальные 22 пары хромосом определяют другие физические характеристики. Эти пары хромосом называются аутосомами.
Как работают гены
Гены контролируют работу ваших клеток, производя белки. Белки имеют определенные функции и действуют как мессенджеры для клетки.
Каждый ген должен иметь правильные инструкции для создания своего белка. Это позволяет белку выполнять правильную функцию для клетки.
Все виды рака начинаются, когда один или несколько генов в клетке мутируют. Мутация – это изменение. Он создает аномальный белок. Или это может предотвратить образование белка.
Аномальный белок предоставляет другую информацию, чем нормальный белок. Это может привести к бесконтрольному размножению клеток и стать раковыми.
О генетических мутациях
Существует 2 основных типа генетических мутаций:
Приобретенные мутации. Это наиболее частая причина рака. Они возникают из-за повреждения генов в той или иной клетке в течение жизни человека. Например, это может быть клетка молочной железы или клетка толстой кишки, которая затем многократно делится и образует опухоль. Опухоль представляет собой аномальное образование. Рак, который возникает из-за приобретенных мутаций, называется спорадическим раком. Приобретенные мутации не обнаруживаются в каждой клетке организма и не передаются от родителей к детям.
Опухоль представляет собой аномальное образование. Рак, который возникает из-за приобретенных мутаций, называется спорадическим раком. Приобретенные мутации не обнаруживаются в каждой клетке организма и не передаются от родителей к детям.
Факторы, вызывающие эти мутации, включают:
Вирусы
Возраст
Мутации зародышевой линии. Они менее распространены. Мутация зародышевой линии происходит в сперматозоиде или яйцеклетке. Он переходит непосредственно от родителя к ребенку во время зачатия. Когда эмбрион превращается в ребенка, мутация исходного сперматозоида или яйцеклетки копируется в каждую клетку тела. Поскольку мутация затрагивает репродуктивные клетки, она может передаваться из поколения в поколение.
Рак, вызванный мутациями зародышевой линии, называется наследственным раком. На его долю приходится от 5% до 20% всех видов рака.
Мутации и рак
Мутации происходят часто. Мутация может быть полезной, вредной или нейтральной. Это зависит от того, где в гене происходит изменение. Как правило, организм корректирует большинство мутаций.
Мутация может быть полезной, вредной или нейтральной. Это зависит от того, где в гене происходит изменение. Как правило, организм корректирует большинство мутаций.
Одна мутация, скорее всего, не вызовет рак. Обычно рак возникает в результате множественных мутаций в течение жизни. Вот почему рак чаще возникает у пожилых людей. У них было больше возможностей для накопления мутаций.
Типы генов, связанных с раком
Многие гены, которые способствуют развитию рака, делятся на широкие категории:
Гены-супрессоры опухолей. Это защитные гены. Обычно они ограничивают рост клеток:
Мониторинг скорости деления клеток на новые клетки
Восстановление несовпадающей ДНК
Управление смертью клетки
При мутации гена-супрессора опухоли клетки растут бесконтрольно. И они могут в конечном итоге сформировать опухоль.
Примеры генов-супрессоров опухолей включают BRCA1 , BRCA2 и p53 или TP53 .
Мутации зародышевой линии в генах BRCA1 или BRCA2 повышают риск развития наследственного рака молочной железы или яичников у женщин и риск развития наследственного рака предстательной железы или молочной железы у мужчин. Они также увеличивают риск рака поджелудочной железы и меланомы у женщин и мужчин.
Наиболее часто мутирующий ген у больных раком — p53 или TP53 . Более 50% случаев рака связаны с отсутствием или повреждением гена p53 . Большинство генных мутаций р53 являются приобретенными. Мутации зародышевой линии p53 встречаются редко, но пациенты, которые их несут, подвергаются более высокому риску развития многих различных типов рака.
Онкогены. Они превращают здоровую клетку в раковую. Известно, что мутации в этих генах не передаются по наследству.
Два распространенных онкогена:
HER2, специализированный белок, контролирующий рост и распространение рака. Встречается в некоторых раковых клетках.
 Например, клетки рака молочной железы и яичников.
Например, клетки рака молочной железы и яичников.Семейство генов RAS , которое создает белки, участвующие в путях клеточной коммуникации, росте и гибели клеток.
Гены репарации ДНК. Исправлены ошибки, допущенные при копировании ДНК. Многие из них функционируют как гены-супрессоры опухолей. BRCA1 , BRCA2 и p53 являются генами репарации ДНК.
Если у человека есть ошибка в гене репарации ДНК, ошибки остаются неисправленными. Затем ошибки становятся мутациями. Эти мутации могут в конечном итоге привести к раку, особенно мутации в генах-супрессорах опухолей или онкогенах.
Мутации в генах репарации ДНК могут передаваться по наследству или приобретаться. Синдром Линча является примером наследственного типа. Мутации BRCA1 , BRCA2 и p53 и связанные с ними синдромы также наследуются.
Проблемы в понимании генетики рака
Исследователи многое узнали о том, как работают гены рака. Но многие виды рака не связаны с конкретным геном. Рак, вероятно, связан с множественными генными мутациями. Более того, некоторые данные свидетельствуют о том, что гены взаимодействуют с окружающей средой. Это еще больше усложняет наше понимание роли генов в развитии рака.
Но многие виды рака не связаны с конкретным геном. Рак, вероятно, связан с множественными генными мутациями. Более того, некоторые данные свидетельствуют о том, что гены взаимодействуют с окружающей средой. Это еще больше усложняет наше понимание роли генов в развитии рака.
Исследователи продолжают изучать влияние генетических изменений на развитие рака. Эти знания привели к улучшению лечения рака, включая раннее выявление, снижение риска, использование таргетной терапии и выживаемость.
Дальнейшее изучение генетики рака может помочь врачам найти лучшие способы:
Связанные ресурсы
Генетическое тестирование на риск рака
Понимание риска рака
Наследственные синдромы, связанные с раком
Что такое персонализированная медицина рака?
Как геномное тестирование дало мне чувство контроля над метастатическим раком молочной железы
Дополнительная информация
Национальный институт рака (NCI): Генетика рака
NCI: Как генетические изменения приводят к раку (инфографика)
Генетическое влияние на метилирование ДНК: результаты исследований и перспективы на будущее | Геномная биология
Hotchkiss RD.
 Количественное разделение пуринов, пиримидинов и нуклеозидов методом бумажной хроматографии. Дж. Биол. Хим. 1948 год; 175 (1): 315–32.
Количественное разделение пуринов, пиримидинов и нуклеозидов методом бумажной хроматографии. Дж. Биол. Хим. 1948 год; 175 (1): 315–32.КАС
пабмед
СтатьяGoogle ученый
Bourc’his D. Dnmt3L и установление материнских геномных импринтов. Наука. 2001 г.; 294 (5551): 2536–9.
ПабМед
СтатьяGoogle ученый
Сонг Дж., Речкоблит О., Бестор Т.Х., Патель Д.Дж. Структура комплекса DNMT1-ДНК показывает роль аутоингибирования в поддержании метилирования ДНК. Наука. 2011 г.; 331 (6020): 1036–40.
КАС
пабмед
СтатьяGoogle ученый
Первякова Н., Касела С., Моррис А.П., Калс М., Метспалу А., Линдгрен С.М., Салуметс А., Мяги Р. Импринтированные гены и контрольные области импринтинга показывают преобладающее промежуточное метилирование во взрослых соматических тканях.
 Эпигеномика. 2016; 8(6):789–99.
Эпигеномика. 2016; 8(6):789–99.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
ван Эйк К.Р., де Йонг С., Бокс М.П.М., Лангевельд Т., Колас Ф., Велдинк Дж.Х., де Ковел К.Ф. . Генетический анализ уровней метилирования ДНК и экспрессии генов в цельной крови здоровых людей. Геномика BMC. 2012 г.; 13(1):636.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Маунакеа А.К., Нагараджан Р.П., Биленки М., Баллинджер Т.Дж., Д’Суза С., Фаус С.Д., Джонсон Б.Е., Хонг С., Нильсен С., Чжао И., Турецки Г., Делани А., Вархол Р., Тиссен Н., Щорс К. , Heine VM, Rowitch DH, Xing X, Fiore C, Schillebeeckx M, Jones SJM, Haussler D, Marra MA, Hirst M, Wang T, Costello JF. Законсервированная роль внутригенного метилирования ДНК в регуляции альтернативных промоторов. Природа. 2010 г.; 466 (7303): 253–7.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Sharp AJ, Stathaki E, Migliavacca E, Brahmachary M, Montgomery SB, Dupre Y, Antonarakis SE.
 Профили метилирования ДНК активных и неактивных Х-хромосом человека. Геном Res. 2011 г.; 21 (10): 1592–600.
Профили метилирования ДНК активных и неактивных Х-хромосом человека. Геном Res. 2011 г.; 21 (10): 1592–600.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Vilain A, Bernardino J, Gerbault-Seureau M, Vogt N, Niveleau A, Lefrançois D, Malfoy B, Dutrillaux B. Метилирование ДНК и нестабильность хромосом в лимфобластоидных клеточных линиях. Цитогенет Геном Res. 2000 г.; 90(1-2):93–101.
КАС
СтатьяGoogle ученый
Бибикова М., Ле Дж., Барнс Б., Сэдиния-Мельник С., Чжоу Л., Шен Р., Гундерсон К.Л. Полногеномный анализ метилирования ДНК с использованием анализа Infinium Ⓡ . Эпигеномика. 2009 г.; 1(1):177–200.
КАС
пабмед
СтатьяGoogle ученый
Сандовал Дж., Хейн Х., Моран С., Серра-Мусач Дж., Пуджана М.А.
 , Бибикова М., Эстеллер М. Проверка микрочипа метилирования ДНК для 450 000 сайтов CpG в геноме человека. Эпигенетика. 2011 г.; 6(6):692–702.
, Бибикова М., Эстеллер М. Проверка микрочипа метилирования ДНК для 450 000 сайтов CpG в геноме человека. Эпигенетика. 2011 г.; 6(6):692–702.КАС
пабмед
СтатьяGoogle ученый
Моран С., Аррибас С., Эстеллер М. Проверка микроматрицы метилирования ДНК для 850 000 сайтов CpG генома человека, обогащенных энхансерными последовательностями. Эпигеномика. 2016; 8(3):389–99.
КАС
пабмед
СтатьяGoogle ученый
Хорстхемке Б. Критический взгляд на трансгенерационное эпигенетическое наследование у людей. Нац коммун. 2018; 9(1): 1–4.
КАС
СтатьяGoogle ученый
Сликер Р.С., Руст М.С., ван Иперен Л., Сучиман Х.Д., Тоби Э.В., Карлотти Ф., де Конинг Э.Дж.П., Слэгбум Ч.Е., Хейманс Б.Т., Чува де Соуза Лопес С.М. Ландшафты метилирования ДНК развития плода человека.
 Генетика PLoS. 2015 г.; 11(10):1005583.
Генетика PLoS. 2015 г.; 11(10):1005583.Артикул
КАСGoogle ученый
Смит З.Д., Чан М.М., Хамм К.С., Карник Р., Мехубад С., Регев А., Эгган К., Мейснер А. Динамика метилирования ДНК преимплантационного эмбриона человека. Природа. 2014; 511 (7511): 611–5.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Guo H, Zhu P, Yan L, Li R, Hu B, Lian Y, Yan J, Ren X, Lin S, Li J, Jin X, Shi X, Liu P, Wang X, Wang W, Wei Y, Li X, Guo F, Wu X, Fan X, Yong J, Wen L, Xie SX, Tang F, Qiao J. Ландшафт метилирования ДНК ранних эмбрионов человека. Природа. 2014; 511 (7511): 606–10.
КАС
пабмед
СтатьяGoogle ученый
Ziller MJ, Gu H, Müller F, Donaghey J, Tsai LTY, Kohlbacher O, De Jager PL, Rosen ED, Bennett DA, Bernstein BE, Gnirke A, Meissner A.
 Диаграмма динамического ландшафта метилирования ДНК человека геном. Природа. 2013; 500 (7463): 477–81.
Диаграмма динамического ландшафта метилирования ДНК человека геном. Природа. 2013; 500 (7463): 477–81.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Christensen BC, Houseman EA, Marsit CJ, Zheng S, Wrensch MR, Wiemels JL, Nelson HH, Karagas MR, Padbury JF, Bueno R, Sugarbaker DJ, Yeh R-F, Wiencke JK, Kelsey KT. Старение и воздействие окружающей среды изменяют тканеспецифичное метилирование ДНК в зависимости от контекста CpG-островков. Генетика PLoS. 2009 г.; 5(8):1000602.
Артикул
КАСGoogle ученый
Цай П.-К., Гластонбери К.А., Элиот М.Н., Боллепалли С., Йет И., Кастильо-Фернандес Дж.Э., Карнеро-Монторо Э., Хардиман Т., Мартин Т.К., Викерс А., Мангино М., Уорд К., Пиетиляйнен К.Х., Делоукас П., Спектор Т.Д., Виньуэла А., Лукс Э.Б., Олликайнен М., Келси К.Т., Смолл К.С., Белл Д.Т. Курение вызывает скоординированное метилирование ДНК и изменения экспрессии генов в жировой ткани с последствиями для метаболического здоровья.
 Клин Эпигенетика. 2018; 10(1):126.
Клин Эпигенетика. 2018; 10(1):126.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Махна Д., Пури С., Шарма С. Признаки метилирования ДНК: биомаркеры злоупотребления наркотиками и алкоголем. Mutat Res Rev Mutat Res. 2018; 777:19–28.
КАС
Статья
пабмедGoogle ученый
Мартин Э.М., Фрай Р.С. Влияние окружающей среды на эпигеном: метилирование ДНК, связанное с воздействием, в человеческих популяциях. Анну Рев Общественное здравоохранение. 2018; 39(1): 309–33.
ПабМед
СтатьяGoogle ученый
Санчес-Мут Дж.В., Хейн Х., Видаль Э., Моран С., Сайолс С., Дельгадо-Моралес Р., Шульц М.Д., Ансолеага Б., Гарсия-Эспарсия П., Понс-Эспиналь М., де Лагран М.М., Допазо Дж., Рабано А., Авила Дж., Дирсен М., Лотт И., Феррер И.
 , Экер Дж. Р., Эстеллер М. Метиломы ДНК человека при нейродегенеративных заболеваниях демонстрируют общие эпигеномные паттерны. Трансл Психиатрия. 2016; 6(1):718.
, Экер Дж. Р., Эстеллер М. Метиломы ДНК человека при нейродегенеративных заболеваниях демонстрируют общие эпигеномные паттерны. Трансл Психиатрия. 2016; 6(1):718.Артикул
КАСGoogle ученый
Лю Ю., Арье М.Дж., Падюков Л., Фаллин М.Д., Хессельберг Э., Рунарссон А., Рейниус Л., Асеведо Н., Тауб М., Роннингер М., Щетинский К., Шейниус А., Кере Дж., Альфредссон Л., Клареског Л., Экстрем Т.Дж., Файнберг А.П. Данные эпигеномной ассоциации предполагают, что метилирование ДНК является посредником генетического риска при ревматоидном артрите. Нац биотехнолог. 2013; 31(2):142–147.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Ким М., Лонг Т.И., Аракава К., Ван Р., Ю. М.С., Лэрд П.В. Метилирование ДНК как биомаркер риска сердечно-сосудистых заболеваний. ПЛОС ОДИН. 2010 г.; 5(3):9692.
Артикул
КАСGoogle ученый
Галлахер М.
 Д., Чен-Плоткин А.С. Эпоха после GWAS: от ассоциации к функции. Am J Hum Genet. 2018; 102 (5): 717–30.
Д., Чен-Плоткин А.С. Эпоха после GWAS: от ассоциации к функции. Am J Hum Genet. 2018; 102 (5): 717–30.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Vandiedonck C. Генетическая ассоциация молекулярных признаков: помощь в выявлении причинных вариантов сложных заболеваний. Клин Жене. 2018; 93 (3): 520–32.
КАС
пабмед
СтатьяGoogle ученый
До К., Ширер А., Судзуки М., Терри М.Б., Гелернтер Дж., Грелли Дж.М., Тыко Б. Генетико-эпигенетические взаимодействия в цис-цис: основное внимание в эпоху после GWAS. Геном биол. 2017; 18(1):1–22.
Артикул
КАСGoogle ученый
Треротола М., Релли В., Симеоне П., Альберти С. Эпигенетическое наследование и отсутствие наследуемости. Гум Геномика. 2015 г.; 9(1):17.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Visscher PM, Hill WG, Wray NR.
 Наследуемость в эпоху геномики – концепции и заблуждения. Нат Рев Жене. 2008 г.; 9(4):255–66.
Наследуемость в эпоху геномики – концепции и заблуждения. Нат Рев Жене. 2008 г.; 9(4):255–66.КАС
пабмед
СтатьяGoogle ученый
Verweij KJ, Mosing MA, Zietsch BP, Medland SE. Оценка наследуемости по исследованиям близнецов. В: Статистическая генетика человека. Спрингер: 2012. с. 151–70.
ван Донген Дж., Нивард М.Г., Виллемсен Г., Хоттенга Дж.-Дж., Хелмер К., Долан К.В., Эли Э.А., Дэвис Г.Э., ван Итерсон М., Бриз К.Э., Бек С., Сучиман Х.Е., Янсен Р., ван Мерс Д.Б., Хейманс BT, Slagboom PE, Boomsma DI. Генетические и экологические влияния взаимодействуют с возрастом и полом в формировании человеческого метилома. Нац коммун. 2016; 7(1):11115.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Грундберг Э., Медури Э., Сэндлинг Дж.К., Хедман О.К., Кейлдсон С., Буил А.
 , Буше С., Юань В., Нисбет Дж., Сековска М., Уилк А., Барретт А., Смолл К.С., Ге Б., Карон М., Шин С-Ю, Латроп М., Дермицакис Э.Т., Маккарти М.И., Спектор Т.Д., Белл Дж.Т., Делоукас П., Ахмади К.Р., Айнали С., Барретт А., Батай В., Белл Дж.Т., Буил А., Делоукас П., Дермицакис Э.Т., Димас А.С., Дурбин Р., Гласс Д., Грундберг Э., Хассанали Н., Хедман О.К., Ингл С., Ноулз Д., Крестьянинова М., Линдгрен К.М., Лоу К.Е., Маккарти М.И., Медури Э., ди Мелио П., Мин Дж.Л., Монтгомери С.Б., Нестле Ф.О., Ника А.С., Нисбет Дж., О’Рахилли С., Партс Л., Поттер С., Сэндлинг Дж., Сековска М., Шин С.Ю., Смолл К.С., Соранцо Н., Спектор Т.Д., Сурдулеску Г., Трэверс М.Е., Цапруни Л., Цока С., Уилк А., Ян Т.П., Зондерван КТ. Общий анализ вариаций метилирования ДНК в жировой ткани близнецов выявляет связи с вариантами, связанными с заболеванием, в дистальных регуляторных элементах. Am J Hum Genet. 2013; 93(5):876–90.
, Буше С., Юань В., Нисбет Дж., Сековска М., Уилк А., Барретт А., Смолл К.С., Ге Б., Карон М., Шин С-Ю, Латроп М., Дермицакис Э.Т., Маккарти М.И., Спектор Т.Д., Белл Дж.Т., Делоукас П., Ахмади К.Р., Айнали С., Барретт А., Батай В., Белл Дж.Т., Буил А., Делоукас П., Дермицакис Э.Т., Димас А.С., Дурбин Р., Гласс Д., Грундберг Э., Хассанали Н., Хедман О.К., Ингл С., Ноулз Д., Крестьянинова М., Линдгрен К.М., Лоу К.Е., Маккарти М.И., Медури Э., ди Мелио П., Мин Дж.Л., Монтгомери С.Б., Нестле Ф.О., Ника А.С., Нисбет Дж., О’Рахилли С., Партс Л., Поттер С., Сэндлинг Дж., Сековска М., Шин С.Ю., Смолл К.С., Соранцо Н., Спектор Т.Д., Сурдулеску Г., Трэверс М.Е., Цапруни Л., Цока С., Уилк А., Ян Т.П., Зондерван КТ. Общий анализ вариаций метилирования ДНК в жировой ткани близнецов выявляет связи с вариантами, связанными с заболеванием, в дистальных регуляторных элементах. Am J Hum Genet. 2013; 93(5):876–90.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Белл Дж.
 Т., Цай П.С., Ян Т.П., Пидсли Р., Нисбет Дж., Гласс Д., Мангино М., Чжай Г., Чжан Ф., Вальдес А., Шин С.И., Демпстер Э.Л., Мюррей Р.М., Грундберг Э., Хедман А.К., Ника A, Смолл К.С., Дермицакис Э.Т., Маккарти М.И., Милл Дж., Спектор Т.Д., Делукас П. Сканирование всего эпигенома выявляет дифференциально метилированные области для возрастных и связанных с возрастом фенотипов в здоровой стареющей популяции. Генетика PLoS. 2012 г.; 8(4):1002629.
Т., Цай П.С., Ян Т.П., Пидсли Р., Нисбет Дж., Гласс Д., Мангино М., Чжай Г., Чжан Ф., Вальдес А., Шин С.И., Демпстер Э.Л., Мюррей Р.М., Грундберг Э., Хедман А.К., Ника A, Смолл К.С., Дермицакис Э.Т., Маккарти М.И., Милл Дж., Спектор Т.Д., Делукас П. Сканирование всего эпигенома выявляет дифференциально метилированные области для возрастных и связанных с возрастом фенотипов в здоровой стареющей популяции. Генетика PLoS. 2012 г.; 8(4):1002629.Артикул
КАСGoogle ученый
Макрей А.Ф., Пауэлл Дж.Е., Хендерс А.К., Боудлер Л., Хемани Г., Шах С., Пейнтер Д.Н., Мартин Н.Г., Вишер П.М., Монтгомери Г.В. Вклад генетической изменчивости в трансгенерационное наследование метилирования ДНК. Геном биол. 2014; 15(5):73.
Артикул
КАСGoogle ученый
Nustad HE, Page CM, Reiner AH, Zucknick M, LeBlanc M. Байесовский смешанный подход к моделированию для оценки наследуемости.
 Труды БМК. 2018; 12 (С9):31.
Труды БМК. 2018; 12 (С9):31.ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Хуан Т., Джоханес Р., Сонг С., Пэн Ф., Го И., Мендельсон М., Яо С., Лю С., Ма Дж., Ричард М., Ага Г., Гуан В., Алмли Л.М., Конни К.Н., Киф Дж., Хван SJ, Johnson AD, Fornage M, Liang L, Levy D. Полногеномная идентификация QTL метилирования ДНК в цельной крови выявляет пути сердечно-сосудистых заболеваний. Нац коммун. 2019; 10(1):1–14.
КАС
СтатьяGoogle ученый
День К., Уэйт Л.Л., Алонсо А., Ирвин М.Р., Чжи Д., Тибо К.С., Аслибекян С., Идальго Б., Борецки И.Б., Ордовас Дж.М., Арнетт Д.К., Тивари Х.К., Абшер Д.М. Наследуемое метилирование ДНК в клетках CD4+ среди сложных семейств проявляет генетические и негенетические эффекты. ПЛОС ОДИН. 2016; 11(10):0165488.
Артикул
КАСGoogle ученый
Гонт Т.
 Р., Шихаб Х.А., Хемани Г., Мин Дж.Л., Вудворд Г., Литтлтон О., Чжэн Дж., Дуггирала А., Макардл В.Л., Хо К., Ринг С.М., Эванс Д.М., Дэйви Смит Г., Релтон К.Л. Систематическая идентификация генетических влияний на метилирование на протяжении всей жизни человека. Геном биол. 2016; 17(1):1–14.
Р., Шихаб Х.А., Хемани Г., Мин Дж.Л., Вудворд Г., Литтлтон О., Чжэн Дж., Дуггирала А., Макардл В.Л., Хо К., Ринг С.М., Эванс Д.М., Дэйви Смит Г., Релтон К.Л. Систематическая идентификация генетических влияний на метилирование на протяжении всей жизни человека. Геном биол. 2016; 17(1):1–14.Артикул
КАСGoogle ученый
Hannon E, Gorrie-Stone TJ, Smart MC, Burrage J, Hughes A, Bao Y, Kumari M, Schalkwyk LC, Mill J. Использование локусов количественных признаков метилирования ДНК для характеристики взаимосвязи между метиломной вариацией, геномом выразительность и сложные черты. Am J Hum Genet. 2018; 103 (5): 654–65.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
ван Донген Дж., Эли Э.А., Янсен Р., ван Бейстервельдт С.Э.М., Виллемсен Г., Хоттенга Дж.Дж., Каллсен Н.А., Пейтон С.А., Бриз С.Е., Клуфт С.
 , Хейманс Б.Т., Бартельс М., Дэвис Г.Э., Бумсма Д.И. Полногеномный анализ метилирования ДНК в буккальных клетках: исследование монозиготных близнецов и mQTL. Эпигенетика Хроматин. 2018; 11(1):54.
, Хейманс Б.Т., Бартельс М., Дэвис Г.Э., Бумсма Д.И. Полногеномный анализ метилирования ДНК в буккальных клетках: исследование монозиготных близнецов и mQTL. Эпигенетика Хроматин. 2018; 11(1):54.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Ракян В.К., Чонг С., Чамп М.Е., Катберт П.С., Морган Х.Д., Луу К.В.К., Уайтлоу Э. Трансгенерационное наследование эпигенетических состояний мышиного аллеля AxinFu происходит после материнской и отцовской передачи. Proc Natl Acad Sci. 2003 г.; 100(5):2538–43.
КАС
пабмед
Статья
ПабМед ЦентральныйGoogle ученый
Рэдфорд Э.Дж., Ито М., Ши Х., Кориш Дж.А., Ямазава К., Исганайтис Э., Зайзенбергер С., Хор Т.А., Рейк В., Эркек С., Питерс AHFM, Патти М.-Э., Фергюсон-Смит А.С. Внутриутробное недоедание нарушает метилом взрослых сперматозоидов и межпоколенческий метаболизм.
 Наука. 2014; 345(6198):1255903.
Наука. 2014; 345(6198):1255903.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Zaghlool SB, Al-Shafai M, Al Muftah WA, Kumar P, Gieger C, Waldenberger M, Falchi M, Suhre K. Менделевское наследование тримодальных сайтов метилирования CpG предполагает дистальные цис-действующие генетические эффекты. Клин Эпигенетика. 2016; 8(1):124.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Хейманс Б.Т., Кремер Д., Тоби Э.В., Бумсма Д.И., Слэгбум Ч.Е. В вариациях метилирования ДНК IGF2/h29 человека преобладают наследственные, а не возрастные экологические и стохастические факторы.место. Хум Мол Жене. 2007 г.; 16(5):547–54.
КАС
пабмед
СтатьяGoogle ученый
Керкель К., Спадола А., Юань Э., Косек Дж., Цзян Л.
 , Ход Э., Ли К., Мурти В.В., Шупф Н., Вилен Э. и др. Геномные исследования с помощью чувствительного к метилированию анализа SNP выявляют зависимое от последовательности аллель-специфическое метилирование ДНК. Нат Жене. 2008 г.; 40(7):904.
, Ход Э., Ли К., Мурти В.В., Шупф Н., Вилен Э. и др. Геномные исследования с помощью чувствительного к метилированию анализа SNP выявляют зависимое от последовательности аллель-специфическое метилирование ДНК. Нат Жене. 2008 г.; 40(7):904.КАС
пабмед
СтатьяGoogle ученый
Бокс М.П., Деркс Э.М., Вайзенбергер Д.Дж., Стренгман Э., Янсон Э., Соммер И.Е., Кан Р.С., Опхофф Р.А. Связь метилирования ДНК с возрастом, полом и генотипом у близнецов и здоровых контролей. ПЛОС ОДИН. 2009 г.; 4(8):6767.
Артикул
КАСGoogle ученый
Schalkwyk LC, Meaburn EL, Smith R, Dempster EL, Jeffries AR, Davies MN, Plomin R, Mill J. Аллельное искажение метилирования ДНК широко распространено в геноме. Am J Hum Genet. 2010 г.; 86(2):196–212.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Гиббс Дж.
 Р., ван дер Бруг М.П., Эрнандес Д.Г., Трейнор Б.Дж., Ноллс М.А., Лай С.Л., Арепалли С., Диллман А., Рафферти И.П., Тронкосо Дж., Джонсон Р., Зилке Х.Р., Ферруччи Л., Лонго Д.Л., Куксон М.Р. , Синглтон АБ. Существует множество локусов количественных признаков для метилирования ДНК и экспрессии генов в человеческом мозге. Генетика PLoS. 2010 г.; 6(5):1000952.
Р., ван дер Бруг М.П., Эрнандес Д.Г., Трейнор Б.Дж., Ноллс М.А., Лай С.Л., Арепалли С., Диллман А., Рафферти И.П., Тронкосо Дж., Джонсон Р., Зилке Х.Р., Ферруччи Л., Лонго Д.Л., Куксон М.Р. , Синглтон АБ. Существует множество локусов количественных признаков для метилирования ДНК и экспрессии генов в человеческом мозге. Генетика PLoS. 2010 г.; 6(5):1000952.Артикул
КАСGoogle ученый
Zhang D, Cheng L, Badner JA, Chen C, Chen Q, Luo W, Craig DW, Redman M, Gershon ES, Liu C. Генетический контроль индивидуальных различий в геноспецифическом метилировании в человеческом мозге. Am J Hum Genet. 2010 г.; 86 (3): 411–9.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Белл Дж.Т., Пай А.А., Пикрелл Дж.К., Гаффни Д.Дж., Пике-Реги Р., Дегнер Дж.Ф., Гилад И., Притчард Дж.К. Паттерны метилирования ДНК связаны с генетическими изменениями и изменениями экспрессии генов в клеточных линиях HapMap.
 Геном биол. 2011 г.; 12(1):10.
Геном биол. 2011 г.; 12(1):10.Артикул
КАСGoogle ученый
Мин Дж.Л., Хемани Г., Хэннон Э., Деккерс К.Ф., Кастильо-Фернандес Дж., Луйк Р., Карнеро-Монторо Э., Лоусон Д.Дж., Берроуз К., Судерман М., Бретерик А.Д., Ричардсон Т.Г., Клагхаммер Дж., Иотчкова В., Шарп Г., Хлейфат А.А., Шатунов А., Якоангели А., МакАрдл В.Л., Хо К.М., Кумар А., Сёдерхалл К., Сориано-Таррага К., Гиралт-Штайнхауэр Э., Казми Н., Мейсон Д., Макрей А.Ф., Коркоран Д.Л., Сагден К., Касела С., Кардона А., Дэй Ф.Р., Куглиари Г., Виберти К., Гуаррера С., Лерро М., Гупта Р., Боллепалли С., Мандавия П., Зенг Ю., Кларк Т.К., Уокер Р.М., Шмолл В., Чамара Д., Руис-Аренас С., Резван FI, Marioni RE, Lin T, Awaloff Y, Germain M, Aïssi D, Zwamborn R, van Eijk K, Dekker A, van Dongen J, Hottenga JJ, Willemsen G, Xu CJ, Barturen G, Català-Moll F, Kerick M , Ван С., Мелтон П., Эллиотт Х.Р., Шин Дж., Бернард М., Йет И, Смарт М., Горри-Стоун Т.
 , Шоу С., Чалаби А.А., Ринг С.М., Першаген Г., Мелен Э., Хименес-Конде Д., Рокер Д., Лоулор Д.А., Райт Дж., Мартин Н.Г., Монтгомери Г.В., Моффит Т.Е., Поултон Р., Эско Т., Милани Л., Метспалу А. , Перри Дж.Р.Б., Онг К.К., Уэрхэм Н.Дж., Матулло Г., Сакердот К., Каспи А., Арсено Л., Ганьон Ф., Олликайнен М., Каприо Дж., Феликс Д.Ф., Риваденейра Ф., Тимейер Х., ван Эйзендорн М.Х., Уиттерлинден А.Г., Джаддо ВВВ, Хейли С., Макинтош А.М., Эванс К.Л., Мюррей А., Райкконен К., Лахти Дж., Нор Э.А., Соренсен Т.И.А., Хансен Т., Морген К.С., Биндер Э.Б., Лукаэ С., Гонсалес Дж.Р., Бустаманте М., Суньер Дж., Холлоуэй Дж.В., Кармаус В. , Zhang H, Deary IJ, Wray NR, Starr JM, Beekman M, van Heemst D, Slagboom PE, Morange PE, Trégouët DA, Veldink JH, Davies GE, de Geus EJC, Boomsma DI, Vonk JM, Brunekreef B, Koppelman GH , Аларкон-Рикельме М.Э., Хуанг Р.С., Пеннелл С., Ван Мерс Дж., Икрам М.А., Хьюз А.Д., Тиллин Т., Чатурведи Н., Паусова З., Паус Т., Спектор Т.Д., Кумари М., Шалквик Л.С., Вишер П.М., Смит Г.
, Шоу С., Чалаби А.А., Ринг С.М., Першаген Г., Мелен Э., Хименес-Конде Д., Рокер Д., Лоулор Д.А., Райт Дж., Мартин Н.Г., Монтгомери Г.В., Моффит Т.Е., Поултон Р., Эско Т., Милани Л., Метспалу А. , Перри Дж.Р.Б., Онг К.К., Уэрхэм Н.Дж., Матулло Г., Сакердот К., Каспи А., Арсено Л., Ганьон Ф., Олликайнен М., Каприо Дж., Феликс Д.Ф., Риваденейра Ф., Тимейер Х., ван Эйзендорн М.Х., Уиттерлинден А.Г., Джаддо ВВВ, Хейли С., Макинтош А.М., Эванс К.Л., Мюррей А., Райкконен К., Лахти Дж., Нор Э.А., Соренсен Т.И.А., Хансен Т., Морген К.С., Биндер Э.Б., Лукаэ С., Гонсалес Дж.Р., Бустаманте М., Суньер Дж., Холлоуэй Дж.В., Кармаус В. , Zhang H, Deary IJ, Wray NR, Starr JM, Beekman M, van Heemst D, Slagboom PE, Morange PE, Trégouët DA, Veldink JH, Davies GE, de Geus EJC, Boomsma DI, Vonk JM, Brunekreef B, Koppelman GH , Аларкон-Рикельме М.Э., Хуанг Р.С., Пеннелл С., Ван Мерс Дж., Икрам М.А., Хьюз А.Д., Тиллин Т., Чатурведи Н., Паусова З., Паус Т., Спектор Т.Д., Кумари М., Шалквик Л.С., Вишер П.М., Смит Г. Д., Бок С., Гонт Т.Р., Белл Дж.Т., Хейманс Б.Т., Милл Дж., Релтон С.Л. Геномные и феномические идеи из атласа генетических эффектов метилирования ДНК. Нат Жене: 1–30. (под давлением).
Д., Бок С., Гонт Т.Р., Белл Дж.Т., Хейманс Б.Т., Милл Дж., Релтон С.Л. Геномные и феномические идеи из атласа генетических эффектов метилирования ДНК. Нат Жене: 1–30. (под давлением).Бондер М.Дж., Луйк Р., Жернакова Д.В., Моэд М., Дилен П., Вермаат М., Ван Итерсон М., Ван Дейк Ф., Ван Гален М., Бот Дж., Сликер Р.С., Джамаи П.М., Вербист М., Сучиман Х.Д., Веркерк М., Ван Дер Брегген Р., Ван Рой Дж., Лакенберг Н., Ариндрарто В., Килбаса С.М., Йонкерс И., Вант Хоф П., Ноорен И., Бикман М., Дилен Дж., Ван Хемст Д., Жернакова А., Тигчелаар Э.Ф., Свертц М.А. , Хофман А., Уиттерлинден А.Г., Пул Р., Ван Донген Дж., Хоттенга Дж.Дж., Стехаувер ЦДА, Ван Дер Каллен К.Дж.Х., Шалквийк К.Г., Ван Ден Берг Л.Х., Ван Цвет Э.В., Мей Х., Ли И., Лемир М., Хадсон Т.Дж., Слэгбум PE, Wijmenga C, Veldink JH, Van Greevenbroek MMJ, Van Duijn CM, Boomsma DI, Isaacs A, Jansen R, Van Meurs JBJ, Hoen’t PAC, Franke L, Heijmans BT. Варианты заболевания изменяют уровни транскрипционных факторов и метилирование их сайтов связывания.
 Нат Жене. 2017; 49(1): 131–8.
Нат Жене. 2017; 49(1): 131–8.КАС
пабмед
СтатьяGoogle ученый
Макклей Д.Л., Шабалин А.А., Дозморов М.Г., Адкинс Д.Е., Кумар Г., Нерелла С., Кларк С.Л., Берген С.Е., Халтман С.М., Магнуссон П.К.Е., Салливан П.Ф., Аберг К.А., ван ден Оорд EJCG. Анализ QTL высокой плотности метилирования в крови человека с помощью секвенирования нового поколения фракции метилированной геномной ДНК. Геном биол. 2015 г.; 16(1):291.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Макрей А.Ф., Мариони Р.Е., Шах С., Ян Дж., Пауэлл Дж.Е., Харрис С.Е., Гибсон Дж., Хендерс А.К., Боудлер Л., Пейнтер Дж.Н., Мерфи Л., Мартин Н.Г., Старр Дж.М., Рэй Н.Р., Дири И.Дж., Висшер Премьер-министр, Монтгомери Г.В. Идентификация 55 000 реплицированных QTL метилирования ДНК. Научный представитель 2018 г.; 8(1):1–9.
КАС
СтатьяGoogle ученый
Кулкарни Х.
 , Кос М.З., Нири Дж., Дайер Т.Д., Кент Дж.В., Геринг Х.Х.Х., Коул С.А., Комуззи А.Г., Алмаси Л., Махани М.С., Курран Дж.Е., Блангеро Дж., Карлесс М.А. Новые эпигенетические детерминанты диабета 2 типа в мексиканско-американских семьях. Хум Мол Жене. 2015 г.; 24 (18): 5330–44.
, Кос М.З., Нири Дж., Дайер Т.Д., Кент Дж.В., Геринг Х.Х.Х., Коул С.А., Комуззи А.Г., Алмаси Л., Махани М.С., Курран Дж.Е., Блангеро Дж., Карлесс М.А. Новые эпигенетические детерминанты диабета 2 типа в мексиканско-американских семьях. Хум Мол Жене. 2015 г.; 24 (18): 5330–44.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Лемир М., Заиди Ш.Э., Бан М., Ге Б., Айсси Д., Жермен М., Кассам И., Ван М., Занке Б.В., Ганьон Ф., Мранж П.Е., Трегуэ Д.А., Уэллс П.С., Сосер С., Галлинджер С., Пастинен Т., Хадсон Т.Дж. Эпигенетическая регуляция дальнего действия обеспечивается генетической изменчивостью, локализованной в тысячах независимых локусов. Нац коммун. 2015 г.; 6(1):6326.
КАС
пабмед
СтатьяGoogle ученый
Ши Дж., Марконетт К.Н., Дуан Дж., Хайленд П.Л., Ли П., Ван З., Уилер В., Чжоу Б., Кампан М.
 , Ли Д.С., Хуан Дж., Чжоу В., Триче Т., Амундадотир Л., Уорнер А., Хатчинсон A, Chen P-H, Chung BSI, Pesatori AC, Consonni D, Bertazzi P.A.l., Bergen AW, Freedman M, Siegmund KD, Berman BP, Borok Z, Chatterjee N, Tucker MA, Caporaso NE, Chanock SJ, Laird-Offringa IA , Ланди МТ. Характеристика генетической основы разнообразия метилома в гистологически нормальной ткани легких человека. Нац коммун. 2014; 5(1):3365.
, Ли Д.С., Хуан Дж., Чжоу В., Триче Т., Амундадотир Л., Уорнер А., Хатчинсон A, Chen P-H, Chung BSI, Pesatori AC, Consonni D, Bertazzi P.A.l., Bergen AW, Freedman M, Siegmund KD, Berman BP, Borok Z, Chatterjee N, Tucker MA, Caporaso NE, Chanock SJ, Laird-Offringa IA , Ланди МТ. Характеристика генетической основы разнообразия метилома в гистологически нормальной ткани легких человека. Нац коммун. 2014; 5(1):3365.ПабМед
Статья
КАСGoogle ученый
Ng B, White CC, Klein HU, Sieberts SK, McCabe C, Patrick E, Xu J, Yu L, Gaiteri C, Bennett DA, Mostafavi S, De Jager PL. Карта xQTL объединяет генетическую архитектуру транскриптома и эпигенома человеческого мозга. Нат Нейроски. 2017; 20(10):1418.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Вагнер Дж. Р., Буше С., Ге Б., Кван Т., Пастинен Т., Бланшетт М.
 Связь между метилированием ДНК, генетическими и экспрессионными межиндивидуальными вариациями в нетрансформированных фибробластах человека. Геном биол. 2014; 15(2):37.
Связь между метилированием ДНК, генетическими и экспрессионными межиндивидуальными вариациями в нетрансформированных фибробластах человека. Геном биол. 2014; 15(2):37.Артикул
Google ученый
Гутьеррес-Арселус М., Лаппалайнен Т., Монтгомери С.Б., Буил А., Онген Х., Юровский А., Бриуа Дж., Гигер Т., Романо Л., Планшон А., Фальконне Э., Бильсер Д., Ганьебин М., Падиоло И., Борель С. , Letourneau A, Makrythanasis P, Guipponi M, Gehrig C, Antonarakis SE, Dermitzakis ET. Пассивное и активное метилирование ДНК и взаимодействие с генетическими вариациями в регуляции генов. электронная жизнь. 2013; 2:e00523.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Husquin LT, Rotival M, Fagny M, Quach H, Zidane N, McEwen LM, MacIsaac JL, Kobor MS, Aschard H, Patin E, Quintana-Murci L. Изучение генетической основы человеческих популяционных различий в метилировании ДНК и их причинное влияние на регуляцию иммунных генов.
 Геном биол. 2018; 19(1):222.
Геном биол. 2018; 19(1):222.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Heyn H, Sayols S, Moutinho C, Vidal E, Sanchez-Mut JV, Stefansson OA, Nadal E, Moran S, Eyfjord JE, Gonzalez-Suarez E, Pujana MA, Esteller M. Количественный признак связи метилирования ДНК локусов к риску развития рака у человека. Представитель Cell 2014; 7 (2): 331–38.
КАС
пабмед
СтатьяGoogle ученый
Цзэн Ю., Амадор С., Ся С., Мариони Р., Спроул Д., Уокер Р.М., Моррис С.В., Бретерик А., Канела-Ксандри О., Бутин Т.С., Кларк Д.В., Кэмпбелл А., Роулик К., Хейуорд С., Надь Р. , Тенеса А., Портеус Д.Дж., Уилсон Дж.Ф., Дири И.Дж., Эванс К.Л., Макинтош А.М., Наварро П., Хейли К.С. Генетические эффекты родительского происхождения на метилирование у людей распространены и влияют на изменчивость сложных признаков. Нац коммун.
 2019; 10(1):1383.
2019; 10(1):1383.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Се С., Люн Ю.К., Чен А., Лонг Д.С., Хойо С., Хо С.М. Значения дифференциального метилирования в дифференциальном анализе метилирования. Биоинформатика. 2019; 35 (7): 1094–1097.
КАС
пабмед
СтатьяGoogle ученый
Du P, Zhang X, Huang C-C, Jafari N, Kibbe WA, Hou L, Lin SM. Сравнение методов бета-значения и М-значения для количественной оценки уровней метилирования с помощью анализа микрочипов. Биоинформатика BMC. 2010 г.; 11(1):587.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Ченг В.А., Шао Х, Морин А, Сиру В, Кван Т, Ге Б, Аисси Д, Чен Л, Васкес Л, Аллум Ф, Генар Ф, Бузигон Э, Саймон М-М, Булье Э, Реденсек А, Ватт С., Датта А.
 , Кларк Л., Фличек П., Мид Д., Пол Д.С., Бек С., Бурк Г., Латроп М., Черноф А., Фоль М.-К., Деменаис Ф., Пин И., Даунс К., Стунненберг Х.Г., Соранцо Н., Пастинен Т., Грундберг Э. Функциональная вариация аллельных метиломов подчеркивает сильный генетический вклад и выявляет новые эпигенетические изменения в эпигеноме человека. Геном биол. 2017; 18(1):50.
, Кларк Л., Фличек П., Мид Д., Пол Д.С., Бек С., Бурк Г., Латроп М., Черноф А., Фоль М.-К., Деменаис Ф., Пин И., Даунс К., Стунненберг Х.Г., Соранцо Н., Пастинен Т., Грундберг Э. Функциональная вариация аллельных метиломов подчеркивает сильный генетический вклад и выявляет новые эпигенетические изменения в эпигеноме человека. Геном биол. 2017; 18(1):50.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Белл К.Г., Гао Ф., Юань В., Роос Л., Актон Р.Дж., Ся И., Белл Дж., Уорд К., Мангино М., Хиси П.Г., Ван Дж., Спектор Т.Д. Облигатная и благоприятная аллельная изменчивость метилома ДНК в пределах общих локусов, связанных с заболеванием. Нац коммун. 2018; 9(1):8.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Банович Н.Е., Лан Х., МакВикер Г., ван де Гейн Б., Дегнер Дж.Ф., Блишак Дж.Д., Ру Дж.
 , Причард Дж.К., Гилад Ю. QTL метилирования связаны с координированными изменениями в связывании факторов транскрипции, модификациями гистонов и уровни экспрессии. Генетика PLoS. 2014; 10(9):1004663.
, Причард Дж.К., Гилад Ю. QTL метилирования связаны с координированными изменениями в связывании факторов транскрипции, модификациями гистонов и уровни экспрессии. Генетика PLoS. 2014; 10(9):1004663.Артикул
КАСGoogle ученый
Бентон М.С., Леа Р.А., Макартни-Коксон Д., Сазерленд Х.Г., Уайт Н., Кеннеди Д., Менгерсен К., Хаупт Л.М., Гриффитс Л.Р. Полногеномное аллель-специфическое метилирование обогащено регуляторными областями генов в родословной нескольких поколений от изолята с острова Норфолк. Эпигенетика Хроматин. 2019; 12(1):60.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Онучич В., Лурье Э., Карреро И., Павличек П., Патель Р.Ю., Розовский Дж., Галеев Т., Хуан З., Альтшулер Р.С., Чжан З., Харрис Р.А., Коарфа С., Эшмор Л., Бертол Дж.В., Фахури В.Д., Ю Ф., Келлис М., Герштейн М., Милосавлевич А.
 Аллель-специфические карты эпигенома выявляют зависящее от последовательности стохастическое переключение в регуляторных локусах. Наука. 2018; 361 (6409): 3146.
Аллель-специфические карты эпигенома выявляют зависящее от последовательности стохастическое переключение в регуляторных локусах. Наука. 2018; 361 (6409): 3146.Артикул
КАСGoogle ученый
Do C, Lang CF, Lin J, Darbary H, Krupska I, Gaba A, Petukhova L, Vonsattel J-P, Gallagher MP, Goland RS, et al. Механизмы и ассоциации заболеваний гаплотип-зависимого аллель-специфического метилирования ДНК. Am J Hum Genet. 2016; 98(5):934–55.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Hannon E, Spiers H, Viana J, Pidsley R, Burrage J, Murphy TM, Troakes C, Turecki G, O’Donovan MC, Schalkwyk LC, Bray NJ, Mill J. QTL метилирования в развивающемся мозге и их обогащение локусов риска шизофрении. Нат Нейроски. 2016; 19(1): 48–54.
КАС
пабмед
СтатьяGoogle ученый
Gong J, Wan H, Mei S, Ruan H, Zhang Z, Liu C, Guo A-Y, Diao L, Miao X, Han L.
 Pancan-meQTL: база данных для систематической оценки влияния генетических вариантов на метилирование при раке человека. Нуклеиновые Кислоты Res. 2019; 47 (Д1): 1066–72.
Pancan-meQTL: база данных для систематической оценки влияния генетических вариантов на метилирование при раке человека. Нуклеиновые Кислоты Res. 2019; 47 (Д1): 1066–72.Артикул
КАСGoogle ученый
Lin D, Chen J, Perrone-Bizzozero N, Bustillo JR, Du Y, Calhoun VD, Liu J. Характеристика кросс-тканевых генетико-эпигенетических эффектов и их паттернов при шизофрении. Геном Мед. 2018; 10(1):13.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Лонг Х.К., Симс Д., Хегер А., Блэкледж Н.П., Каттер С., Райт М.Л., Грюцнер Ф., Одом Д.Т., Пациент Р., Понтинг С.П., Клозе Р.Дж. Эпигенетическая консервация регуляторных элементов генов, выявленная с помощью профилирования неметилированной ДНК у семи позвоночных. электронная жизнь. 2013; 2:e00348.
ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Wang M, Zhang K, Ngo V, Liu C, Fan S, Whitaker JW, Chen Y, Ai R, Chen Z, Wang J, Zheng L, Wang W.
 Идентификация мотивов ДНК, которые регулируют метилирование ДНК. Нуклеиновые Кислоты Res. 2019; 47 (13): 6753–68.
Идентификация мотивов ДНК, которые регулируют метилирование ДНК. Нуклеиновые Кислоты Res. 2019; 47 (13): 6753–68.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Волков П., Олссон А.Х., Гиллберг Л., Йоргенсен С.В., Бронс С., Эрикссон К.Ф., Груп Л., Янссон П.А., Нильссон Э., Ронн Т., Вааг А., Линг С. Полногеномный анализ mQTL в жировой ткани человека идентифицирует генетические варианты, связанные с метилированием ДНК, экспрессией генов и метаболическими признаками. ПЛОС ОДИН. 2016; 11(6):0157776.
Артикул
КАСGoogle ученый
Шин Дж., Бурдон С., Бернар М., Уилсон М.Д., Райшл Э., Вальденбергер М., Руджери Б., Шуманн Г., Десривьер С., Лиманс А., Абрахамович М., Леонард Г., Рише Л., Бушар Л., Годе Д., Паус Т., Паусова З. Многоуровневый генетический контроль метилирования ДНК и экспрессии генов: очаг рассеянного склероза у здоровых людей.
 Хум Мол Жене. 2015 г.; 24 (20): 5733–45.
Хум Мол Жене. 2015 г.; 24 (20): 5733–45.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Чен Л., Ге Б., Казале Ф.П., Васкес Л., Кван Т., Гарридо-Мартин Д., Ватт С., Ян Ю., Кунду К., Экер С., Датта А., Ричардсон Д., Берден Ф., Мид Д., Манн А.Л. , Фернандес Дж.М., Роулстон С., Уайлдер С.П., Фэрроу С., Шао Х, Ламбурн Дж.Дж., Реденсек А., Альберс К.А., Амстиславский В., Эшфорд С., Беренсен К., Бомба Л., Бурк Г., Буджолд Д., Буше С., Кэрон М., Чен S-HH, Cheung W, Delaneau O, Dermitzakis ET, Elding H, Colgiu I, Bagger FO, Flicek P, Habibi E, Iotchkova V, Janssen-Megens E, Kim B, Lehrach H, Lowy E, Mandoli A, Matarese F , Маурано М.Т., Моррис Дж.А., Панкальди В., Пурфарзад Ф., Ренстром К., Рендон А., Риш Т., Шарифи Н., Саймон М-М.М., Султан М., Валенсия А., Уолтер К., Ван С-Й.Ю., Фронтини М., Антонаракис С.Е., Кларк Л., Яспо М-Л.Л., Бек С., Гиго Р., Рико Д., Мартенс Дж.Х.А., Оувеханд В.Х., Куиджперс Т.
 В., Пол Д.С., Стунненберг Х.Г., Стегле О., Даунс К., Пастинен Т., Соранцо Н. Генетические факторы эпигенеза и транскрипции изменение иммунных клеток человека. Клетка. 2016; 167(5):1398–141.
В., Пол Д.С., Стунненберг Х.Г., Стегле О., Даунс К., Пастинен Т., Соранцо Н. Генетические факторы эпигенеза и транскрипции изменение иммунных клеток человека. Клетка. 2016; 167(5):1398–141.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Шульц Х., Рупперт А.-К., Хермс С., Вольф С., Мирза-Шрайбер Н., Стегле О., Чамара Д., Форстнер А.Дж., Сивалингам С., Шох С., Мёбус С., Пютц Б., Хиллмер А., Фрикер Н., Ваттер Х. , Müller-Myhsok B, Nöthen MM, Becker AJ, Hoffmann P, Sander T, Cichon S. Полногеномное картирование генетических детерминант, влияющих на метилирование ДНК и экспрессию генов в гиппокампе человека. Нац коммун. 2017; 8(1):1511.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Джаффе А.Е., Гао Ю., Дип-Собослай А., Тао Р., Хайд Т.М., Вайнбергер Д.Р., Клейнман Дж.Е. Картирование метилирования ДНК в развитии, генотипе и шизофрении в лобной коре человека.
 Нат Нейроски. 2016; 19(1):40–7.
Нат Нейроски. 2016; 19(1):40–7.КАС
пабмед
СтатьяGoogle ученый
Хэтчер С., Релтон К.Л., Гонт Т.Р., Ричардсон Т.Г. Использование молекулярных данных, полученных из коры головного мозга, для выяснения эпигенетических и транскриптомных факторов сложных признаков и заболеваний. Трансл Психиатрия. 2019; 9(1):105.
ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Морроу Д.Д., Гласс К., Чо М.Х., Херш К.П., Пинто-Плата В., Челли Б., Маркетти Н., Крайнер Г., Буэно Р., Вашко Г., Чой АМКК, Квакенбуш Дж., Сильверман Э.К., ДеМео Д.Л. Локусы количественных признаков метилирования ДНК легких человека локализуются совместно с локусами ассоциации хронического обструктивного заболевания легких в масштабах всего генома. Am J Respir Crit Care Med. 2018; 197 (10): 1275–84.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Тейлор Д.
 Л., Джексон А.У., Нарису Н., Хемани Г., Эрдос М.Р., Чайнс П.С., Свифт А., Идол Дж., Дидион Дж.П., Уэлч Р.П., Киннунен Л., Сарамиес Дж., Лакка Т.А., Лааксо М., Туомилехто Дж., Паркер SCJJ, Койстинен Х.А., Дэйви Смит Г., Бонке М., Скотт Л.Дж., Бирни Э., Коллинз Ф.С. Интегративный анализ экспрессии генов, метилирования ДНК, физиологических признаков и генетической изменчивости скелетных мышц человека. Proc Natl Acad Sci. 2019; 116 (22): 10883–8.
Л., Джексон А.У., Нарису Н., Хемани Г., Эрдос М.Р., Чайнс П.С., Свифт А., Идол Дж., Дидион Дж.П., Уэлч Р.П., Киннунен Л., Сарамиес Дж., Лакка Т.А., Лааксо М., Туомилехто Дж., Паркер SCJJ, Койстинен Х.А., Дэйви Смит Г., Бонке М., Скотт Л.Дж., Бирни Э., Коллинз Ф.С. Интегративный анализ экспрессии генов, метилирования ДНК, физиологических признаков и генетической изменчивости скелетных мышц человека. Proc Natl Acad Sci. 2019; 116 (22): 10883–8.КАС
пабмед
Статья
ПабМед ЦентральныйGoogle ученый
Ци Т., Ву И., Цзэн Дж., Чжан Ф., Сюэ А., Цзян Л., Чжу З., Кемпер К., Йенго Л., Чжэн З. и др. Идентификация генов-мишеней для признаков, связанных с мозгом, с использованием транскриптомных и метиломных данных из крови. Нац коммун. 2018; 9(1):2282.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Эндрюс С.
 В., Эллис С.Э., Бакульский К.М., Шеппард Б., Кроен Л.А., Герц-Пиччиотто И., Ньюшаффер С.Дж., Фейнберг А.П., Аркинг Д.Э., Лэдд-Акоста С., Фаллин М.Д. Межтканная интеграция генетических и эпигенетических данных дает представление о расстройствах аутистического спектра. Нац коммун. 2017; 8(1):1011.
В., Эллис С.Э., Бакульский К.М., Шеппард Б., Кроен Л.А., Герц-Пиччиотто И., Ньюшаффер С.Дж., Фейнберг А.П., Аркинг Д.Э., Лэдд-Акоста С., Фаллин М.Д. Межтканная интеграция генетических и эпигенетических данных дает представление о расстройствах аутистического спектра. Нац коммун. 2017; 8(1):1011.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Смит А.К., Килару В., Кочак М., Алмли Л.М., Мерсер К.Б., Ресслер К.Дж., Тылавский Ф.А., Коннили К.Н. Локусы количественных признаков метилирования (meQTL) постоянно обнаруживаются в зависимости от происхождения, стадии развития и типа ткани. Геномика BMC. 2014; 15(1):145.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Лесли Р., О’Доннелл С.Дж., Джонсон А.Д. GRASP: анализ результатов генотип-фенотип на основе 1390 полногеномных ассоциативных исследований и соответствующей базы данных открытого доступа.
 Биоинформатика. 2014; 30 (12): 185–94.
Биоинформатика. 2014; 30 (12): 185–94.Артикул
КАСGoogle ученый
Эйхер Дж.Д., Ландовски С., Стэкхаус Б., Слоан А., Чен В., Дженсен Н., Лиен Дж.-П., Лесли Р., Джонсон А.Д. ГРАСП v2. 0: обновление общегеномного репозитория ассоциаций между SNP и фенотипами. Нуклеиновые Кислоты Res. 2014; 43(Д1):799–804.
Артикул
КАСGoogle ученый
Релтон С.Л., Гаунт Т., Макардл В., Хо К., Дуггирала А., Шихаб Х., Вудворд Г., Литтлтон О., Эванс Д.М., Рейк В. и др. Профиль ресурса данных: доступный ресурс для комплексных эпигеномных исследований (ОВЕН). Int J Эпидемиол. 2015 г.; 44(4):1181–90.
ПабМед
СтатьяGoogle ученый
Ding W, Chen J, Feng G, Chen G, Wu J, Guo Y, Ni X, Shi T. DNMIVD: база данных интерактивной визуализации метилирования ДНК.
 Нуклеиновые Кислоты Res. 2020; 48 (Д1): 856–62.
Нуклеиновые Кислоты Res. 2020; 48 (Д1): 856–62.Артикул
КАСGoogle ученый
Чжэн З., Хуан Д., Ван Дж., Чжао К., Чжоу И., Го З., Чжай С., Сюй Х., Цуй Х., Яо Х., Ван З., Йи С., Чжан С., Шам ПК, Ли М.Дж. QTLbase: интегративный ресурс для локусов количественных признаков во многих молекулярных фенотипах человека. Нуклеиновые Кислоты Res. 2020; 48 (Д1): 983–91.
Артикул
КАСGoogle ученый
У И, Цзэн Дж, Чжан Ф, Чжу З, Ци Т, Чжэн З, Ллойд-Джонс Л.Р., Мариони Р.Э., Мартин Н.Г., Монтгомери Г.В., Дири И.Дж., Рэй Н.Р., Виссчер П.М., Макрей А.Ф., Ян Дж. Интегративный анализ сводных данных по омикам выявляет предполагаемые механизмы, лежащие в основе сложных признаков. Нац коммун. 2018; 9(1): 1–14.
Артикул
КАСGoogle ученый
Пирс Б.
 Л., Тонг Л., Аргос М., Деманелис К., Жасмин Ф., Ракибуз-Заман М., Сарвар Г., Ислам М.Т., Шахриар Х., Ислам Т., Рахман М., Юнус М., Кибрия М.Г., Чен Л.С., Ахсан Х. Совместно встречающиеся QTL экспрессии и метилирования позволяют обнаруживать общие причинно-следственные варианты и общие биологические механизмы. Нац коммун. 2018; 9(1):804.
Л., Тонг Л., Аргос М., Деманелис К., Жасмин Ф., Ракибуз-Заман М., Сарвар Г., Ислам М.Т., Шахриар Х., Ислам Т., Рахман М., Юнус М., Кибрия М.Г., Чен Л.С., Ахсан Х. Совместно встречающиеся QTL экспрессии и метилирования позволяют обнаруживать общие причинно-следственные варианты и общие биологические механизмы. Нац коммун. 2018; 9(1):804.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Пай А.А., Притчард Дж.К., Гилад Ю. Генетическая и механистическая основа вариаций в регуляции генов. Генетика PLoS. 2015 г.; 11(1):1004857.
Артикул
КАСGoogle ученый
Liu F, Wu D, Wang X. Роль CTCF в конформации и функциях хромосом. Semin Cell Dev Biol. 2019; 90:168–73.
КАС
пабмед
СтатьяGoogle ученый
Stadler MB, Murr R, Burger L, Ivanek R, Lienert F, Schöler A, van Nimwegen E, Wirbelauer C, Oakeley EJ, Gaidatzis D, Tiwari VK, Schübeler D.
 ДНК-связывающие факторы формируют метилом мыши в дистальном отделе регулирующие регионы. Природа. 2011 г.; 480 (7378): 490–5.
ДНК-связывающие факторы формируют метилом мыши в дистальном отделе регулирующие регионы. Природа. 2011 г.; 480 (7378): 490–5.КАС
пабмед
СтатьяGoogle ученый
Quon G, Lippert C, Heckerman D, Listgarten J. Модели наследуемости метилирования в полногеномном анализе четырех областей мозга. Нуклеиновые Кислоты Res. 2013; 41(4):2095–104.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Томас Р., Трапани Д., Гудьер-Саит Л., Томкова М., Фернандес-Розадилья С., Сахнане Н., Вулли С., Дэвис Х., Чегвидден Л., Криаучионис С., Моган Т., Лидхэм С., Паллес С., Фурлан Д., Tomlinson I, Lewis A. Полиморфный вариант rs1800734 влияет на приобретение метилирования и аллель-специфическое связывание TFAP4 в промоторе MLh2, что приводит к дифференциальной экспрессии мРНК. Научный представитель 2019 г.; 9(1):13463.

ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Xue A, Wu Y, Zhu Z, Zhang F, Kemper KE, Zheng Z, Yengo L, Lloyd-Jones LR, Sidorenko J, Wu Y, McRae AF, Visscher PM, Zeng J, Yang J. Геном- широкий ассоциативный анализ выявил 143 варианта риска и предполагаемые механизмы регуляции диабета 2 типа. Нац коммун. 2018; 9(1):2941.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Рао ССП, Хантли М.Х., Дюран Н.К., Стаменова Е.К., Бочков И.Д., Робинсон Дж.Т., Санборн А.Л., Махол И., Омер А.Д., Ландер Э.С., Эйден Э.Л. Трехмерная карта генома человека с разрешением в тысячи пар оснований раскрывает принципы образования петель хроматина. Клетка. 2014; 159 (7): 1665–80.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Раджавелу А.
 , Лунгу К., Эмперле М., Дукатц М., Брем А., Броше Дж., Ханельт И., Парса Э., Шифферс С., Карник Р., Мейснер А., Карелл Т., Рэтет П., Юрковска Р.З., Елч А. Хроматин -зависимая аллостерическая регуляция активности DNMT3A с помощью MeCP2. Нуклеиновые Кислоты Res. 2018; 46(17):9044–56.
, Лунгу К., Эмперле М., Дукатц М., Брем А., Броше Дж., Ханельт И., Парса Э., Шифферс С., Карник Р., Мейснер А., Карелл Т., Рэтет П., Юрковска Р.З., Елч А. Хроматин -зависимая аллостерическая регуляция активности DNMT3A с помощью MeCP2. Нуклеиновые Кислоты Res. 2018; 46(17):9044–56.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Франклин Д. Мутация P152R в MeCP2 может вызвать потерю селективности связывания ДНК. Междисциплинарные науки Comput Life Sci. 2019; 11(1):10–20.
КАС
СтатьяGoogle ученый
Zhu H, Wang G, Qian J. Факторы транскрипции как считыватели и эффекторы метилирования ДНК. Нат Рев Жене. 2016; 17(9): 551–65.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Relton CL, Davey Smith G.
 Менделевская рандомизация: применение и ограничения в эпигенетических исследованиях. Эпигеномика. 2015 г.; 7(8):1239–43.
Менделевская рандомизация: применение и ограничения в эпигенетических исследованиях. Эпигеномика. 2015 г.; 7(8):1239–43.КАС
пабмед
СтатьяGoogle ученый
Санчес-Мут Дж.В., Хейн Х., Сильва Б.А., Диксо Л., Гарсия-Эспарсия П., Видаль Э., Сайолс С., Глаузер Л., Монтеагудо-Санчес А., Перес-Тур Дж., Феррер И., Монк Д., Шнайдер Б. , Esteller M, Gräff J. PM20D1 представляет собой локус количественного признака, связанный с болезнью Альцгеймера. Нат Мед. 2018; 24(5):598–603.
КАС
пабмед
СтатьяGoogle ученый
Rice SJ, Tselepi M, Sorial AK, Aubourg G, Shepherd C, Almarza D, Skelton AJ, Pangou I, Deehan D, Reynard LN, Loughlin J. Приоритизация PLEC и GRINA как генов риска остеоартрита посредством идентификации и характеристика новых локусов количественных признаков метилирования. Ревмирующий артрит. 2019; 71 (8): 1285–96.

КАС
СтатьяGoogle ученый
Pihlstrøm L, Berge V, Rengmark A, Toft M. Болезнь Паркинсона коррелирует с метилированием промотора в гене α -синуклеина. Мов Беспорядок. 2015 г.; 30(4):577–80.
ПабМед
Статья
КАСGoogle ученый
Кулар Л., Лю Ю., Рурманн С., Железнякова Г., Марабита Ф., Гомес-Кабреро Д., Джеймс Т., Юинг Э., Линден М., Гурникевич Б., Айнебанд С., Стрид П., Линк Дж., Андлауэр TFM, Гаспери С. , Wiendl H, Zipp F, Gold R, Tackenberg B, Weber F, Hemmer B, Strauch K, Heilmann-Heimbach S, Rawal R, Schminke U, Schmidt CO, Kacprowski T, Franke A, Laudes M, Dilthey AT, Celius EG , Сондергаард Х.Б., Тегнер Дж., Харбо Х.Ф., Отурай А.Б., Олафссон С., Эггертссон Х.П., Халлдорссон Б.В., Хьялтасон Х., Олафссон Э., Йонсдоттир И., Стефанссон К., Олссон Т., Пиль Ф., Экстрем Т.Дж., Кокум И., Фейнберг А.П.
 , Ягодич М. Метилирование ДНК как медиатор HLA-DRB1*15:01 и защитный вариант при рассеянном склерозе. Нац коммун. 2018; 9(1):2397.
, Ягодич М. Метилирование ДНК как медиатор HLA-DRB1*15:01 и защитный вариант при рассеянном склерозе. Нац коммун. 2018; 9(1):2397.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Иззи Б., Пистони М., Кладтс К., Аккор П., Ламбрехтс Д., Верфайи К., Верхам П., Фресон К., Хойлартс М.Ф. Аллель-специфическое метилирование ДНК усиливает активность энхансера PEAR1. Кровь. 2016; 128(7):1003–12.
КАС
пабмед
СтатьяGoogle ученый
He Z, Zhang R, Jiang F, Zhang H, Zhao A, Xu B, Jin L, Wang T, Jia W, Jia W, Hu C. Генетические полиморфизмы FADS1-FADS2 связаны с метаболизмом жирных кислот посредством изменений в метилировании ДНК и экспрессии генов. Клин Эпигенетика. 2018; 10(1):113.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Jiao C, Zhang C, Dai R, Xia Y, Wang K, Giase G, Chen C, Liu C.
 Позиционные эффекты, выявленные в массиве метилирования Illumina, и их влияние на анализ. Эпигеномика. 2018; 10(5):643–59.
Позиционные эффекты, выявленные в массиве метилирования Illumina, и их влияние на анализ. Эпигеномика. 2018; 10(5):643–59.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Дедервардер С., Дефранс М., Калонн Э., Денис Х., Сотириу С., Фукс Ф. Оценка технологии метилирования 450k инфиниума. Эпигеномика. 2011 г.; 3(6):771–84.
КАС
пабмед
СтатьяGoogle ученый
Сюй З., Ниу Л., Ли Л., Тейлор Дж. А. ENmix: новый метод коррекции фона для Illumina HumanMethylation450 BeadChip. Нуклеиновые Кислоты Res. 2016; 44(3):20.
Артикул
КАСGoogle ученый
Арие М.Дж., Джаффе А.Е., Коррада-Браво Х., Лэдд-Акоста С., Фейнберг А.П., Хансен К.Д., Иризарри Р.А. Minfi: гибкий и всеобъемлющий пакет Bioconductor для анализа микрочипов метилирования ДНК Infinium.
 Биоинформатика. 2014; 30 (10): 1363–9.
Биоинформатика. 2014; 30 (10): 1363–9.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Pidsley R, Y Wong CC, Volta M, Lunnon K, Mill J, Schalkwyk LC. Основанный на данных подход к предварительной обработке данных массива метилирования Illumina 450K. Геномика BMC. 2013; 14(1):1–10.
Артикул
КАСGoogle ученый
Лук-порей Дж.Т., Джонсон В.Е., Паркер Х.С., Джаффе А.Е., Стори Д.Д. Пакет sva для удаления пакетных эффектов и других нежелательных изменений в высокопроизводительных экспериментах. Биоинформатика. 2012 г.; 28(6):882–3.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Wang Z, Wu X, Wang Y. Система для анализа данных о метилировании ДНК, полученных с помощью Illumina Infinium HumanMethylation450 BeadChip.
 Биоинформатика BMC. 2018; 19(С5):115.
Биоинформатика BMC. 2018; 19(С5):115.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Wu MC, Kuan PF. Протоколы метилирования ДНК В: Tost J, редактор. Нью-Йорк, штат Нью-Йорк: Humana Press: 2018. с. 303–30. Глава. 16.
Лю Дж., Зигмунд К.Д. Оценка методов обработки данных HumanMethylation450 BeadChip. Геномика BMC. 2016; 17(1):469.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Heiss JA, Just AC. Улучшенная фильтрация данных микрочипов метилирования ДНК путем обнаружения значений p и их влияния на последующие анализы. Клин Эпигенетика. 2019; 11(1):15.
ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Zhou W, Laird PW, Shen H. Всесторонняя характеристика, аннотация и инновационное использование зондов Infinium для метилирования ДНК BeadChip.
 Нуклеиновые Кислоты Res. 2016; 45(4):967.
Нуклеиновые Кислоты Res. 2016; 45(4):967.Артикул
КАСGoogle ученый
Лог М.В., Смит А.К., Вольф Э.Дж., Маниатес Х., Стоун А., Шичман С.А., МакГлинчи Р.Э., Милберг В., Миллер М.В. Корреляция уровней метилирования, измеренная с помощью Illumina 450K и EPIC BeadChips в образцах крови. Эпигеномика. 2017; 9(11): 1363–71.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Пидсли Р., Зотенко Э., Питерс Т.Дж., Лоуренс М.Г., Рисбриджер Г.П., Моллой П., Ван Джик С., Мюльхауслер Б., Стирзакер С., Кларк С.Дж. Критическая оценка микроматрицы Illumina MethylationEPIC BeadChip для профилирования метилирования ДНК всего генома. Геном биол. 2016; 17(1):208.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Чжоу Л.
 , Нг Х.К., Драутц-Мозес Д.И., Шустер С.К., Бек С., Ким С., Чамберс Дж.К., Ло М. Систематическая оценка методов подготовки библиотек и платформ секвенирования для высокопроизводительного бисульфитного секвенирования всего генома. Научный представитель 2019; 9(1):10383.
, Нг Х.К., Драутц-Мозес Д.И., Шустер С.К., Бек С., Ким С., Чамберс Дж.К., Ло М. Систематическая оценка методов подготовки библиотек и платформ секвенирования для высокопроизводительного бисульфитного секвенирования всего генома. Научный представитель 2019; 9(1):10383.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Олова Н., Крюгер Ф., Эндрюс С., Оксли Д., Берренс Р.В., Бранко М.Р., Рейк В. Сравнение стратегий подготовки библиотеки бисульфитного секвенирования всего генома позволяет выявить источники ошибок, влияющих на данные о метилировании ДНК. Геном биол. 2018; 19(1):33.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Консорциум эпигеномного картографирования дорожной карты NIH. Стандарты и рекомендации по бисульфитному секвенированию всего генома. 2011. http://www.roadmapepigenomics.
 org/files/protocols/data/dna-methylation. MethylC-SeqStandards_FINAL.pdf. По состоянию на 21 сентября 2020 г.
org/files/protocols/data/dna-methylation. MethylC-SeqStandards_FINAL.pdf. По состоянию на 21 сентября 2020 г.Либертини Э., Хит С.К., Хамуди Р.А., Гут М., Циллер М.Дж., Эрреро Дж., Чиз А., Руотти В., Стунненберг Х.Г., Фронтини М., Оувеханд В.Х., Мейснер А., Гут И.Г., Бек С. , Анализ насыщения данных бисульфитного секвенирования всего генома. Нац биотехнолог. 2016; 34(7):691–3.
КАС
пабмед
СтатьяGoogle ученый
Ziller MJ, Hansen KD, Meissner A, Aryee MJ. Рекомендации по охвату анализа метилирования с помощью бисульфитного секвенирования всего генома. Нат Методы. 2015 г.; 12(3):230–2.
КАС
пабмед
СтатьяGoogle ученый
Мэнселл Г., Горри-Стоун Т.Дж., Бао И., Кумари М., Шалквик Л.С., Милл Дж., Хэннон Э. Руководство по исследованиям метилирования ДНК: статистические данные массива Illumina EPIC.
 Геномика BMC. 2019; 20(1):1–15.
Геномика BMC. 2019; 20(1):1–15.Артикул
Google ученый
Westfall PH, Young SS, et al, Vol. 279. Множественное тестирование на основе повторной выборки: примеры и методы для P — корректировка значения: John Wiley & Sons; 1993.
Благородный В.С. Как работает коррекция множественного тестирования? Nat Biotechnol. 2009 г.; 27 (12): 1135–1137.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Делано О., Онген Х., Браун А.А., Форт А., Панусис Н.И., Дермицакис Э.Т. Полный набор инструментов для обнаружения и анализа молекулярных QTL. Нац коммун. 2017; 8:1–7.
Артикул
КАСGoogle ученый
Онген Х., Буил А., Браун А.А., Дермицакис Э.Т., Делано О. Быстрый и эффективный картограф QTL для тысяч молекулярных фенотипов.
 Биоинформатика. 2016; 32 (10): 1479–85.
Биоинформатика. 2016; 32 (10): 1479–85.КАС
пабмед
СтатьяGoogle ученый
Westra H-J, Peters MJ, Esko T, Yaghootkar H, Schurmann C, Kettunen J, Christiansen MW, Fairfax BP, Schramm K, Powell JE, et al. Систематическая идентификация транс-eQTL как предполагаемых факторов известных ассоциаций заболеваний. Нат Жене. 2013; 45(10):1238.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Ферманн Р.С., Янсен Р.С., Велдинк Дж.Х., Вестра Х.Дж., Арендс Д., Бондер М.Дж., Фу Дж., Дилен П., Гроен Х.Дж., Смолонска А. и др. Trans-eQTL показывают, что независимые генетические варианты, связанные со сложным фенотипом, сходятся на промежуточных генах, при этом главную роль играет HLA. Генетика PLoS. 2011 г.; 7(8):1002197.
Артикул
КАСGoogle ученый
Cox JW, Patel D, Chung J, Zhu C, Lent S, Fisher V, Pitsillides A, Farrer L, Zhang X.
 Эффективный аналитический подход к полногеномной идентификации локусов количественных признаков метилирования в ответ на лечение фенофибратом. Труды БМК. 2018; 12(С9):44.
Эффективный аналитический подход к полногеномной идентификации локусов количественных признаков метилирования в ответ на лечение фенофибратом. Труды БМК. 2018; 12(С9):44.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Affinito O, Palumbo D, Fierro A, Cuomo M, De Riso G, Monticelli A, Miele G, Chiariotti L, Cocozza S. Расстояние между нуклеотидами влияет на совместное метилирование между соседними сайтами CpG. Геномика. 2020; 112(1):144–50.
КАС
пабмед
СтатьяGoogle ученый
Wen X. Молекулярное обнаружение QTL, включающее геномные аннотации с использованием байесовского контроля частоты ложных открытий. Энн Appl Стат. 2016; 10 (3): 1619–38.
Артикул
Google ученый
Sul JH, Raj T, de Jong S, de Bakker PIW, Raychaudhuri S, Ophoff RA, Stranger BE, Eskin E, Han B.
 Точная и быстрая коррекция множественного тестирования в исследованиях eQTL. Am J Hum Genet. 2015 г.; 96(6):857–68.
Точная и быстрая коррекция множественного тестирования в исследованиях eQTL. Am J Hum Genet. 2015 г.; 96(6):857–68.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Повысил Г., Петровский С., Хостик Дж., Аггарвал В., Аллен А.С., Гольдштейн Д.Б. Коллапс-анализ редких вариантов сложных признаков: рекомендации и приложения. Нат Рев Жене. 2019; 20 (12): 747–59.
КАС
пабмед
СтатьяGoogle ученый
Т.Г. , Тимпсон, штат Нью-Джерси, Гонт, ТР. Анализ локусов количественных признаков коллапса метилирования на предмет низкой частоты и редких вариантов. Хум Мол Жене. 2016; 25 (19): 4339–49.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Ли С., Вонг Э.М., Буй М., Нгуен Т.Л., Джу Дж.Х.Э., Стоун Дж., Дайт Г.С., Джайлз Г.Г., Саффери Р., Саути М.
 С., Хоппер Д.Л. Причинное влияние курения на метилирование ДНК в периферической крови: исследование близнецов и семей. Клин Эпигенетика. 2018; 10(1):1–12.
С., Хоппер Д.Л. Причинное влияние курения на метилирование ДНК в периферической крови: исследование близнецов и семей. Клин Эпигенетика. 2018; 10(1):1–12.Артикул
КАСGoogle ученый
Джоханес Р., Джаст А.С., Мариони Р.Э., Пиллинг Л.С., Рейнольдс Л.М., Мандавия П.Р., Гуан В., Сюй Т., Элкс К.Э., Аслибекян С., Морено-Масиас Х., Смит Дж.А., Броди Дж.А., Дингра Р., Юсефи П. , Панков Дж.С., Кунце С., Шах С.Х., Макрей А.Ф., Ломан К., Ша Дж., Абшер Д.М., Ферруччи Л., Чжао В., Демерат Э.В., Бресслер Дж., Гроув М.Л., Хуан Т., Лю С., Мендельсон М.М., Яо С., Киль DP, Peters A, Wang-Sattler R, Visscher PM, Wray NR, Starr JM, Ding J, Rodriguez CJ, Wareham NJ, Irvin MR, Zhi D, Barrdahl M, Vineis P, Ambatipudi S, Uitterlinden AG, Hofman A, Schwartz J, Colicino E, Hou L, Vokonas PS, Hernandez DG, Singleton AB, Bandinelli S, Turner ST, Ware EB, Smith AK, Klengel T, Binder EB, Psaty BM, Taylor KD, Gharib SA, Swenson BR, Liang L, ДеМео Д.
 Л., О’Коннор Г.Т., Герцег З., Ресслер К.Дж., Конни К.Н., Сотоодехния Н., Кардия С.Л.Р., Мельцер Д., Баккарелли А.А., ван Мёрс Дж.Б.Дж., Ромье И., Арнетт Д.К., Онг К.К., Лю И., Вальденбергер М., Дири И.Дж. , Форнейдж М., Леви Д., Лондон С.Дж. Эпигенетические признаки курения сигарет. Circ Cardiovasc Genet. 2016; 9(5): 436–47.
Л., О’Коннор Г.Т., Герцег З., Ресслер К.Дж., Конни К.Н., Сотоодехния Н., Кардия С.Л.Р., Мельцер Д., Баккарелли А.А., ван Мёрс Дж.Б.Дж., Ромье И., Арнетт Д.К., Онг К.К., Лю И., Вальденбергер М., Дири И.Дж. , Форнейдж М., Леви Д., Лондон С.Дж. Эпигенетические признаки курения сигарет. Circ Cardiovasc Genet. 2016; 9(5): 436–47.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Эрзурумлуоглу А.М., Лю М., Джексон В.Е., Барнс Д.Р., Датта Г., Мельбурн К.А., Янг Р., Батини С., Сурендран П., Цзян Т., Аднан С.Д., Афак С., Агравал А., Альтмайер Э., Антониу А.С., Ассельбергс FW, Baumbach C, Bierut L, Bertelsen S, Boehnke M, Bots ML, Brazel DM, Chambers JC, Chang-Claude J, Chen C, Corley J, Chou YL, David SP, de Boer RA, de Leeuw CA, Dennis JG , Доминичак А.Ф., Даннинг А.М., Истон Д.Ф., Итон С., Эллиотт П., Эванжелу Э., Фол Дж. Д., Фороуд Т., Гоат А., Гонг Дж., Грейб Х.Дж., Хесслер Дж., Хайман С., Холлманс Г.
 , Хаммершлаг А.Р., Харрис С.Е., Хаттерсли А., Хит А., Хсу С., Яконо В.Г., Канони С., Капур М., Каприо Дж., Кардия С.Л., Карпе Ф., Контто Дж., Кунер Дж.С., Куперберг С., Кууласмаа К., Лааксо М., Лай Д., Лангенберг С., Ле Н., Леттре Г., Лукола А., Луан Дж., Мэдден П.А.Ф., Мангино М., Мариони Р.Е., Марули Э., Мартен Дж., Мартин Н.Г., МакГью М., Михайлиду К., Михайлов Э., Моайери А., Мойтри М., Мюллер-Нурасиид М., Нахид А., Наук М., Невилл М.Дж., Нильсен С.Ф., Норт К., Перола М., Фараон PDP, Пистис Г., Полдерман Т. J, Posthuma D, Poulter N, Qaiser B, Rasheed A, Reiner A, Renström F, Rice J, Rohde R, Rolandsson O, Samani NJ, Samuel M, Schlessinger D, Scholte SH, Scott RA, Sever P, Shao Y, Shrine N, Smith JA, Starr JM, Stirrups K, Stram D, Stringham HM, Tachmazidou I, Tardif JC, Thompson DJ, Tindle HA, Tragante V, Trompet S, Turcot V, Tyrrell J, Vaartjes I, van der Leij AR, Ван дер Меер П., Варга Т.В., Вервей Н., Вёльцке Х., Уэрхэм Н.Дж., Уоррен Х.Р., Вейр Д.Р., Вайс С., Уэзерилл Л., Ягхуткар Х.
, Хаммершлаг А.Р., Харрис С.Е., Хаттерсли А., Хит А., Хсу С., Яконо В.Г., Канони С., Капур М., Каприо Дж., Кардия С.Л., Карпе Ф., Контто Дж., Кунер Дж.С., Куперберг С., Кууласмаа К., Лааксо М., Лай Д., Лангенберг С., Ле Н., Леттре Г., Лукола А., Луан Дж., Мэдден П.А.Ф., Мангино М., Мариони Р.Е., Марули Э., Мартен Дж., Мартин Н.Г., МакГью М., Михайлиду К., Михайлов Э., Моайери А., Мойтри М., Мюллер-Нурасиид М., Нахид А., Наук М., Невилл М.Дж., Нильсен С.Ф., Норт К., Перола М., Фараон PDP, Пистис Г., Полдерман Т. J, Posthuma D, Poulter N, Qaiser B, Rasheed A, Reiner A, Renström F, Rice J, Rohde R, Rolandsson O, Samani NJ, Samuel M, Schlessinger D, Scholte SH, Scott RA, Sever P, Shao Y, Shrine N, Smith JA, Starr JM, Stirrups K, Stram D, Stringham HM, Tachmazidou I, Tardif JC, Thompson DJ, Tindle HA, Tragante V, Trompet S, Turcot V, Tyrrell J, Vaartjes I, van der Leij AR, Ван дер Меер П., Варга Т.В., Вервей Н., Вёльцке Х., Уэрхэм Н.Дж., Уоррен Х.Р., Вейр Д.Р., Вайс С., Уэзерилл Л., Ягхуткар Х. , Явас Э., Цзян И., Чен Ф., Чжан Х., Чжан В., Чжао В., Чжао В., Чжоу К., Амуэль П., Бланкенберг С., Колфилд М.Дж., Чоудхури Р., Кукка Ф., Дири И.Дж., Делокас П., Ди Ангелантонио Э., Феррарио М., Ферьер Дж., Франкс П.В., Фрайлинг Т.М., Фроссар П., Холл И.П., Хейворд К., Янссон Дж.Х., Юкема Дж.В., Ки Ф., Мэннистё С., Метспалу А., Манро П.Б., Нордестгаард Б.Г., Палмер К.Н.А., Саломаа В., Саттар Н., Спектор Т., Страхан Д.П., ван дер Харст П., Зеггини Э., Салехин Д., Баттерворт AS, Wain LV, Abecasis GR, Danesh J, Tobin MD, Vrieze S, Liu DJ, Howson JMM. Метаанализ до 622 409человек идентифицирует 40 новых генетических локусов, связанных с курением. Мол Психиатрия. 2019; 25 (10): 2392–409.
, Явас Э., Цзян И., Чен Ф., Чжан Х., Чжан В., Чжао В., Чжао В., Чжоу К., Амуэль П., Бланкенберг С., Колфилд М.Дж., Чоудхури Р., Кукка Ф., Дири И.Дж., Делокас П., Ди Ангелантонио Э., Феррарио М., Ферьер Дж., Франкс П.В., Фрайлинг Т.М., Фроссар П., Холл И.П., Хейворд К., Янссон Дж.Х., Юкема Дж.В., Ки Ф., Мэннистё С., Метспалу А., Манро П.Б., Нордестгаард Б.Г., Палмер К.Н.А., Саломаа В., Саттар Н., Спектор Т., Страхан Д.П., ван дер Харст П., Зеггини Э., Салехин Д., Баттерворт AS, Wain LV, Abecasis GR, Danesh J, Tobin MD, Vrieze S, Liu DJ, Howson JMM. Метаанализ до 622 409человек идентифицирует 40 новых генетических локусов, связанных с курением. Мол Психиатрия. 2019; 25 (10): 2392–409.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Hancock DB, Markunas CA, Bierut LJ, Johnson EO. Генетика зависимости человека: новые идеи и направления в будущее. Curr Psychiatr Rep. 2018; 20(2):8.
Артикул
Google ученый
Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, MacIsaac JL, Mah SM, McEwen LM, Saw SM, Godfrey KM, Chong Y-S, Kwek K, Kwoh C-K, Soh SE, Chong MFF, Бартон С.
 , Карнани Н., Чонг С.И., Бушдорф Дж.П., Станкель В., Кобор М.С., Мини М.Дж., Глюкман П.Д., Холбрук Д.Д. Влияние генотипа и внутриутробной среды на межиндивидуальную изменчивость метиломов ДНК новорожденных. Геном Res. 2014; 24(7):1064–74.
, Карнани Н., Чонг С.И., Бушдорф Дж.П., Станкель В., Кобор М.С., Мини М.Дж., Глюкман П.Д., Холбрук Д.Д. Влияние генотипа и внутриутробной среды на межиндивидуальную изменчивость метиломов ДНК новорожденных. Геном Res. 2014; 24(7):1064–74.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Фрейзер Х.Б., Лам Л.Л., Нойманн С.М., Кобор М.С. Популяционная специфичность метилирования ДНК человека. Геном биол. 2012 г.; 13(2):8.
Артикул
КАСGoogle ученый
Мэн В., Чжу З., Цзян Х., Ту К.Л., Уэбе С., Ягодич М., Кокум И., Мурад С., Ферруччи Л., Альфредссон Л., Цзоу Х., Клареског Л., Фейнберг А.П., Экстрем Т.Дж., Падюков Л., Лю Y. Метилирование ДНК опосредует взаимодействие генотипа и курения в развитии ревматоидного артрита, положительного к антителам к цитруллиновому пептиду. Артрит Res Ther. 2017; 19(1): 1–10.

Артикул
КАСGoogle ученый
Кленгел Т., Мехта Д., Анакер С., Рекс-Хаффнер М., Прюсснер Дж. К., Парианте К. М., Пейс Т.В. , Биндер Э.Б. Аллель-специфическое деметилирование ДНК FKBP5 опосредует взаимодействие генов и детской травмы. Нат Нейроски. 2013; 16(1):33–41.
КАС
пабмед
СтатьяGoogle ученый
Palma-Gudiel H, Fañanás L. Интегративный обзор метилирования гена переносчика серотонина и его диалога с факторами риска окружающей среды, психопатологией и 5-HTTLPR. Neurosci Biobehav Rev. 2017; 72:190–209.
КАС
пабмед
СтатьяGoogle ученый
Макаллистер К., Механик Л.Э., Амос С., Асчард Х., Блэр И.А., Чаттерджи Н., Конти Д., Гаудерман В.Дж., Хсу Л., Хаттер С.М., Янковска М.М., Керр Дж., Крафт П., Монтгомери С.Б., Мукерджи Б.
 , Папаниколау GJ, Patel CJ, Ritchie MD, Ritz BR, Thomas DC, Wei P, Witte JS. Современные проблемы и новые возможности для изучения взаимодействия генов и окружающей среды при сложных заболеваниях. Am J Эпидемиол. 2017; 186 (7): 753–61.
, Папаниколау GJ, Patel CJ, Ritchie MD, Ritz BR, Thomas DC, Wei P, Witte JS. Современные проблемы и новые возможности для изучения взаимодействия генов и окружающей среды при сложных заболеваниях. Am J Эпидемиол. 2017; 186 (7): 753–61.ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Rönnegård L, Valdar W. Последние разработки в области статистических методов обнаружения генетических локусов, влияющих на фенотипическую изменчивость. Генетика БМК. 2012 г.; 13(1):63.
ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Думитраску Б., Дарнелл Г., Эйролес Дж., Энгельхардт Б.Э. Статистические тесты для обнаружения эффектов дисперсии в исследованиях количественных признаков. Биоинформатика. 2019; 35(2):200–10.
КАС
пабмед
СтатьяGoogle ученый
Conley D, Johnson R, Domingue B, Dawes C, Boardman J, Siegal M.
 Родственный метод идентификации vQTL. ПЛОС ОДИН. 2018; 13(4):0194541.
Родственный метод идентификации vQTL. ПЛОС ОДИН. 2018; 13(4):0194541.Артикул
КАСGoogle ученый
Wang H, Zhang F, Zeng J, Wu Y, Kemper KE, Xue A, Zhang M, Powell JE, Goddard ME, Wray NR, Visscher PM, McRae AF, Yang J. Предполагаемые взаимодействия генотипа и окружающей среды от генетических эффектов на фенотипическую изменчивость в британском биобанке. Научная реклама 2019; 5:3538.
Артикул
Google ученый
Браун А.А., Буил А., Виньуэла А., Лаппалайнен Т., Чжэн Х.Ф., Ричардс Дж.Б., Смолл К.С., Спектор Т.Д., Дермицакис Э.Т., Дурбин Р. Генетические взаимодействия, влияющие на экспрессию генов человека, выявленные с помощью картирования ассоциативных различий. электронная жизнь. 2014; 3:e01381.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Эк В.
 Е., Раск-Андерсен М., Карлссон Т., Энрот С., Гилленстен У., Йоханссон О. Генетические варианты, влияющие на гетерогенность фенотипической изменчивости. Хум Мол Жене. 2018; 27(5):799–810.
Е., Раск-Андерсен М., Карлссон Т., Энрот С., Гилленстен У., Йоханссон О. Генетические варианты, влияющие на гетерогенность фенотипической изменчивости. Хум Мол Жене. 2018; 27(5):799–810.КАС
пабмед
СтатьяGoogle ученый
Лаппалайнен Т., Грелли Дж.М. Ассоциирование клеточных эпигенетических моделей с фенотипами человека. Нат Рев Жене. 2017; 18(7):441–51.
КАС
пабмед
СтатьяGoogle ученый
Бирни Э., Смит Г.Д., Грелли Дж.М. Эпигеномные ассоциативные исследования и интерпретация омики болезней. Генетика PLoS. 2016; 12(6):1006105.
Артикул
КАСGoogle ученый
Краузе С., Зиверт Х., Гайслер С., Грохс М., Эль Гаммаль А.Т., Вольтер С., Олей О., Килперт Ф., Кремер У.М., Кастен М., Кляйн С., Брабант Г.Е., Манн О., Ленерт Х.
 , Киршнер Х. Критическая оценка маркеров метилирования ДНК ABCG1 и SREBF1 для стратификации диабета 2 типа. Эпигеномика. 2019; 11(8):885–97.
, Киршнер Х. Критическая оценка маркеров метилирования ДНК ABCG1 и SREBF1 для стратификации диабета 2 типа. Эпигеномика. 2019; 11(8):885–97.КАС
пабмед
СтатьяGoogle ученый
Smith GD, Lawlor DA, Harbord R, Timpson N, Day I, Ebrahim S. Кластерные среды и рандомизированные гены: фундаментальное различие между традиционной и генетической эпидемиологией. ПЛОС Мед. 2007 г.; 4(12):352.
Артикул
КАСGoogle ученый
Yu F, Qiu C, Xu C, Tian Q, Zhao LJ, Wu L, Deng HW, Shen H. Менделевская рандомизация идентифицирует сайты метилирования CpG с опосредованными эффектами для генетического влияния на BMD в моноцитах периферической крови. Фронт Жене. 2020; 11:1–14.
КАС
СтатьяGoogle ученый
Battram T, Richmond RC, Baglietto L, Haycock PC, Perduca V, Bojesen SE, Gaunt TR, Hemani G, Guida F, Carreras-Torres R, Hung R, Amos CI, Freeman JR, Sandanger TM, Nøst TH , Нордестгард Б.
 Г., Тешендорф А.Е., Полидоро С., Винейс П., Севери Г., Ходж А.М., Джайлз Г.Г., Гранквист К., Йоханссон М.Б., Йоханссон М., Дэйви Смит Г., Релтон С.Л. Оценка причинно-следственной связи метилирования ДНК с риском рака легких. Int J Эпидемиол. 2019; 48 (5): 1493–504.
Г., Тешендорф А.Е., Полидоро С., Винейс П., Севери Г., Ходж А.М., Джайлз Г.Г., Гранквист К., Йоханссон М.Б., Йоханссон М., Дэйви Смит Г., Релтон С.Л. Оценка причинно-следственной связи метилирования ДНК с риском рака легких. Int J Эпидемиол. 2019; 48 (5): 1493–504.ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Ахсан М., Эк В.Е., Раск-Андерсен М., Карлссон Т., Линд-Томсен А., Энрот С., Гилленстен У., Йоханссон О. Относительный вклад метилирования ДНК и генетических вариантов в белковые биомаркеры заболеваний человека. Генетика PLoS. 2017; 13(9):1007005.
Артикул
КАСGoogle ученый
Ричард М.А., Хуан Т., Лигхарт С., Гондалия Р., Джун М.А., Броди Дж.А., Ирвин М.Р., Мариони Р., Шен Дж., Цай П.С., Монтассер М.Е., Цзя И., Сайм С., Сальфати Э.Л., Бурвинкль Э., Гуан В., Мосли TH, Bressler J, Morrison AC, Liu C, Mendelson MM, Uitterlinden AG, van Meurs JB, Franco OH, Zhang G, Li Y, Stewart JD, Bis JC, Psaty BM, Chen Y-DI, Kardia SLR, Zhao W, Тернер С.
 Т., Абшер Д., Аслибекян С., Старр Дж.М., Макрей А.Ф., Хоу Л., Джаст А.С., Шварц Д.Д., Воконас П.С., Менни С., Спектор Т.Д., Шулдинер А., Дамкотт К.М., Роттер Д.И., Палмас В., Лю Ю., Паус Т. , Хорват С., О’Коннелл Дж. Р., Го Х, Паусова З., Ассимс Т. Л., Сотуодехния Н., Смит Дж. А., Арнетт Д. К., Дири И. Дж., Баккарелли А. А., Белл Дж. Т., Уитсел Э., Деган А., Леви Д., Форнейдж М., Хейманс Б. Т. , ‘t Hoen PAC, van Meurs J, Isaacs A, Jansen R, Franke L, Boomsma DI, Pool R, van Dongen J, Hottenga JJ, van Greevenbroek MMJ, Stehouwer CDA, van der Kallen CJH, Schalkwijk CG, Wijmenga C, Жернакова А., Тигчелаар Э.Ф., Слэгбум П.Е., Бикман М., Дилен Дж., ван Хемст Д., Велдинк Дж.Х., ван ден Берг Л.Х., ван Д. uijn CM, Hofman A, Uitterlinden AG, Jhamai PM, Verbiest M,suchman HED, Verkerk M, van der Breggen R, van Rooij J, Lakenberg N, Mei H, van Iterson M, van Galen M, Bot J, van ‘t Хоф П., Дилен П., Ноорен И., Моэд М., Вермаат М., Жернакова Д.В., Луйк Р., Бондер М.Дж., ван Дейк Ф., Ариндрарто В., Килбаса С.
Т., Абшер Д., Аслибекян С., Старр Дж.М., Макрей А.Ф., Хоу Л., Джаст А.С., Шварц Д.Д., Воконас П.С., Менни С., Спектор Т.Д., Шулдинер А., Дамкотт К.М., Роттер Д.И., Палмас В., Лю Ю., Паус Т. , Хорват С., О’Коннелл Дж. Р., Го Х, Паусова З., Ассимс Т. Л., Сотуодехния Н., Смит Дж. А., Арнетт Д. К., Дири И. Дж., Баккарелли А. А., Белл Дж. Т., Уитсел Э., Деган А., Леви Д., Форнейдж М., Хейманс Б. Т. , ‘t Hoen PAC, van Meurs J, Isaacs A, Jansen R, Franke L, Boomsma DI, Pool R, van Dongen J, Hottenga JJ, van Greevenbroek MMJ, Stehouwer CDA, van der Kallen CJH, Schalkwijk CG, Wijmenga C, Жернакова А., Тигчелаар Э.Ф., Слэгбум П.Е., Бикман М., Дилен Дж., ван Хемст Д., Велдинк Дж.Х., ван ден Берг Л.Х., ван Д. uijn CM, Hofman A, Uitterlinden AG, Jhamai PM, Verbiest M,suchman HED, Verkerk M, van der Breggen R, van Rooij J, Lakenberg N, Mei H, van Iterson M, van Galen M, Bot J, van ‘t Хоф П., Дилен П., Ноорен И., Моэд М., Вермаат М., Жернакова Д.В., Луйк Р., Бондер М.Дж., ван Дейк Ф., Ариндрарто В., Килбаса С. М., Сверц М.А., ван Цвет Э.В. Анализ метилирования ДНК идентифицирует локусы для регуляции кровяного давления. Am J Hum Genet. 2017; 101 (6): 888–902.
М., Сверц М.А., ван Цвет Э.В. Анализ метилирования ДНК идентифицирует локусы для регуляции кровяного давления. Am J Hum Genet. 2017; 101 (6): 888–902.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Валь С., Дронг А., Лене Б., Ло М., Скотт В.Р., Кунце С., Цай П.-С., Рид Дж.С., Чжан В., Ян И, Тан С., Фиорито Г., Франке Л., Гуаррера С., Касела С., Крибель J, Richmond RC, Adamo M, Afzal U, Ala-Korpela M, Albetti B, Ammerpohl O, Apperley JF, Beekman M, Bertazzi PA, Black SL, Blancher C, Bonder MJ, Brosch M, Carstensen-Kirberg M, de Craen AJM, де Лузиньян С., Дехган А., Элькалави М., Фишер К., Франко О.Х., Гаунт Т.Р., Хампе Дж., Хашеми М., Исаакс А., Дженкинсон А., Джха С., Като Н., Крог В., Лаффан М., Мейзингер С., Мейтингер Т. , Мок З.Ю., Мотта В., Нг Х.К., Николакопулоу З., Нтелиопулос Г., Панико С., Первьякова Н., Прокиш Х., Ратманн В., Роден М., Рота Ф., Розарио М.А., Сандлинг Дж.К., Шафмайер С.
 , Шрамм К., Зиберт Р., Слэгбум PE, Soininen P, Stolk L, Strauch K, Tai E-S, Tarantini L, Thorand B, Tigchelaar EF, Tumino R, Uitterlinden AG, van Duijn C, van Meurs JBJ, Vineis P, Wickremasinghe AR, Wijmenga C, Yang TP, Yuan В., Жернакова А., Баттерхэм Р.Л., Смит Г.Д., Делоукас П., Хейманс Б.Т., Гердер С., Хофман А., Линдгрен К.М., Милани Л., ван дер Харст П., Петерс А., Иллиг Т., Релтон К.Л., Вальденбергер М., Ярвелин М.Р., Боллати В., Сун Р., Спектор Т.Д., Скотт Дж., Маккарти М.И., Эллиотт П., Белл Дж.Т., Матулло Г., Гигер С., Кунер Дж. С., Граллерт Х., Чемберс Дж. К. Эпигеномное исследование ассоциации индекса массы тела и неблагоприятных последствий ожирения. Природа. 2017; 541 (7635): 81–6.
, Шрамм К., Зиберт Р., Слэгбум PE, Soininen P, Stolk L, Strauch K, Tai E-S, Tarantini L, Thorand B, Tigchelaar EF, Tumino R, Uitterlinden AG, van Duijn C, van Meurs JBJ, Vineis P, Wickremasinghe AR, Wijmenga C, Yang TP, Yuan В., Жернакова А., Баттерхэм Р.Л., Смит Г.Д., Делоукас П., Хейманс Б.Т., Гердер С., Хофман А., Линдгрен К.М., Милани Л., ван дер Харст П., Петерс А., Иллиг Т., Релтон К.Л., Вальденбергер М., Ярвелин М.Р., Боллати В., Сун Р., Спектор Т.Д., Скотт Дж., Маккарти М.И., Эллиотт П., Белл Дж.Т., Матулло Г., Гигер С., Кунер Дж. С., Граллерт Х., Чемберс Дж. К. Эпигеномное исследование ассоциации индекса массы тела и неблагоприятных последствий ожирения. Природа. 2017; 541 (7635): 81–6.КАС
пабмед
СтатьяGoogle ученый
Мендельсон М.М., Мариони Р.Э., Джоханес Р., Лю К., Хедман А.К., Аслибекян С., Демерат Э.В., Гуан В., Чжи Д., Яо К., Хуан Т., Виллингер К., Чен Б., Курчесн П., Мултауп М.
 , Ирвин MR, Cohain A, Schadt EE, Grove ML, Bressler J, North K, Sundström J, Gustafsson S, Shah S, McRae AF, Harris SE, Gibson J, Redmond P, Corley J, Murphy L, Starr JM, Kleinbrink E, Липович Л., Вишер П.М., Рэй Н.Р., Краусс Р.М., Фаллин Д., Файнберг А., Абшер Д.М., Форнейдж М., Панков Дж.С., Линд Л., Фокс С., Ингельссон Э., Арнетт Д.К., Бурвинкль Э., Лян Л., Леви Д., Дири И.Дж. . Ассоциация индекса массы тела с метилированием ДНК и экспрессией генов в клетках крови и отношения к кардиометаболическим заболеваниям: метод менделевской рандомизации. ПЛОС Мед. 2017; 14(1):1002215.
, Ирвин MR, Cohain A, Schadt EE, Grove ML, Bressler J, North K, Sundström J, Gustafsson S, Shah S, McRae AF, Harris SE, Gibson J, Redmond P, Corley J, Murphy L, Starr JM, Kleinbrink E, Липович Л., Вишер П.М., Рэй Н.Р., Краусс Р.М., Фаллин Д., Файнберг А., Абшер Д.М., Форнейдж М., Панков Дж.С., Линд Л., Фокс С., Ингельссон Э., Арнетт Д.К., Бурвинкль Э., Лян Л., Леви Д., Дири И.Дж. . Ассоциация индекса массы тела с метилированием ДНК и экспрессией генов в клетках крови и отношения к кардиометаболическим заболеваниям: метод менделевской рандомизации. ПЛОС Мед. 2017; 14(1):1002215.Артикул
Google ученый
Деккерс К.Ф., ван Итерсон М., Сликер Р.С., Моэд М.Х., Бондер М.Дж., ван Гален М., Мей Х., Жернакова Д.В., ван ден Берг Л.Х., Дилен Дж., ван Донген Дж., ван Хемст Д., Хофман А., Хоттенга JJ, ван дер Каллен CJH, Schalkwijk CG, Stehouwer CDA, Tigchelaar EF, Uitterlinden AG, Willemsen G, Zhernakova A, Franke L, ‘t Hoen PAC, Jansen R, van Meurs J, Boomsma DI, van Duijn CM, van Greevenbroek MMJ , Велдинк Дж.
 Х., Вийменга С., ван Цвет Э. В., Слэгбум П. Е., Юкема Дж. В., Хейманс Б. Т. Липиды крови влияют на метилирование ДНК в циркулирующих клетках. Геном биол. 2016; 17(1):138.
Х., Вийменга С., ван Цвет Э. В., Слэгбум П. Е., Юкема Дж. В., Хейманс Б. Т. Липиды крови влияют на метилирование ДНК в циркулирующих клетках. Геном биол. 2016; 17(1):138.ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Цапруни Л.Г., Ян Т.П., Белл Дж., Дик К.Дж., Канони С., Нисбет Дж., Виньуэла А., Грундберг Э., Нельсон С.П., Медури Э., Буйл А., Камбиен Ф., Хенгстенберг С., Эрдманн Дж., Шункерт Х., Гудолл AH, Ouwehand WH, Dermitzakis E, Spector TD, Samani NJ, Deloukas P. Курение сигарет снижает уровень метилирования ДНК в нескольких геномных локусах, но эффект частично обратим при прекращении курения. Эпигенетика. 2014; 9(10): 1382–96.
ПабМед
ПабМед Центральный
СтатьяGoogle ученый
Бурра П., Лу К., Яблонка Э. Почему отсутствующая наследственность не может быть в ДНК. Биоэссе. 2017; 39(7):1–2.

Артикул
Google ученый
Hannon E, Schendel D, Ladd-Acosta C, Grove J, Hansen CS, Andrews SV, Hougaard DM, Bresnahan M, Mors O, Hollegaard MV, Bækvad-Hansen M, Hornig M, Mortensen PB, Børglum AD, Верге Т., Педерсен М.Г., Нордентофт М., Буксбаум Дж., Даниэле Фаллин М., Бибьерг-Граухольм Дж., Рейхенберг А., Милл Дж. Повышенное полигенное бремя аутизма связано с дифференциальным метилированием ДНК при рождении. Геном Мед. 2018; 10(1):19.
ПабМед
ПабМед Центральный
Статья
КАСGoogle ученый
Richardson TG, Haycock PC, Zheng J, Timpson NJ, Gaunt TR, Davey Smith G, Relton CL, Hemani G. Структура систематической менделевской рандомизации разъясняет сотни сайтов CpG, которые могут опосредовать влияние генетических вариантов на заболевание. Хум Мол Жене. 2018; 27(18):3293–304.
КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Ли Й.
 И., ван де Гейн Б., Радж А., Ноулз Д.А., Петти А.А., Голан Д., Гилад Й., Притчард Дж.К. Сплайсинг РНК является основным связующим звеном между генетической изменчивостью и заболеванием. Наука. 2016; 352 (6285): 600–4.
И., ван де Гейн Б., Радж А., Ноулз Д.А., Петти А.А., Голан Д., Гилад Й., Притчард Дж.К. Сплайсинг РНК является основным связующим звеном между генетической изменчивостью и заболеванием. Наука. 2016; 352 (6285): 600–4.КАС
пабмед
ПабМед Центральный
СтатьяGoogle ученый
Гамазон Э.Р., Баднер Дж.А., Ченг Л., Чжан С., Чжан Д., Кокс Н.Дж., Гершон Э.С., Келсо Дж.Р., Гринвуд Т.А., Нивергельт С.М., Чен С., МакКинни Р., Шиллинг П.Д., Шорк Н.Дж., Смит Э.Н., Блосс CS, Nurnberger JI, Edenberg HJ, Foroud T, Koller DL, Scheftner WA, Coryell W, Rice J, Lawson WB, Nwulia EA, Hipolito M, Byerley W, McMahon FJ, Schulze TG, Berrettini WH, Potash JB, Zandi PP, Mahon PB, McInnis MG, Zöllner S, Zhang P, Craig DW, Szelinger S, Barrett TB, Liu C. Обогащение SNP экспрессии цис-регуляторных генов и метилирование локусов количественных признаков среди вариантов предрасположенности к биполярному расстройству. Мол Психиатрия.
 2013; 18(3):340–6.
2013; 18(3):340–6.КАС
пабмед
СтатьяGoogle ученый
Никодимус-Джонсон Дж., Майерс Р.А., Сакабе Н.Дж., Собрейра Д.Р., Хогарт Д.К., Наурекас Э.Т., Сперлинг А.И., Солуэй Дж., Уайт С.Р., Нобрега М.А., Николае Д.Л., Гилад И., Обер С. Метилирование ДНК в клетках легких связано с эндотипами астмы и генетическим риском. Взгляд JCI. 2016; 1(20):1–15.
Артикул
Google ученый
Delahaye F, Do C, Kong Y, Ashkar R, Salas M, Tycko B, Wapner R, Hughes F. Влияние генетических вариантов на регуляторный ландшафт плаценты. Генетика PLoS. 2018; 14(11):1007785.
Артикул
КАСGoogle ученый
Загрузить ссылки
Ученые разработали синтетическую ДНК для изучения генов «архитекторов»
Исследователи из Нью-Йоркского университета создали искусственные Hox гены, которые планируют и направляют клетки для развития тканей или органов, используя новую синтетическую ДНК технологии и геномной инженерии в стволовых клетках.
Их выводы, опубликованные в Science , подтвердите, как кластеры генов Hox помогают клеткам узнавать и запоминать, где они находятся в организме.
Hox гены как архитекторы тела
Почти все животные — от людей до птиц и рыб — имеют передне-заднюю ось или линию, проходящую от головы к хвосту. Во время развития гены Hox действуют как архитекторы, определяя план движения клеток вдоль оси, а также из каких частей тела они состоят. Гены Hox гарантируют, что органы и ткани развиваются в правильном месте, формируя грудную клетку или размещая крылья в правильных анатомических положениях.
Если гены Hox выходят из строя из-за неправильной регуляции или мутации, клетки могут теряться, что играет роль в некоторых видах рака, врожденных дефектах и выкидышах.
«Я не думаю, что мы можем понять развитие или болезнь, не понимая генов Hox », — сказал Эстебан Маццони, доцент биологии Нью-Йоркского университета и соавтор исследования.
Несмотря на их важность для развития, гены Hox сложны для изучения. Они плотно организованы в кластеры, всего Hox генов в участке ДНК, где они обнаружены, и никаких других генов, окружающих их (учёные называют это «генной пустыней»). И хотя многие части генома содержат повторяющиеся элементы, в кластерах Hox таких повторов нет. Эти факторы делают их уникальными, но их трудно изучать с помощью обычного редактирования генов, не затрагивая соседние гены Hox .
Начать заново с синтетической ДНК
Могут ли ученые создать искусственную Hox генов, чтобы лучше их изучить, а не полагаться на редактирование генов?
«Мы очень хорошо умеем читать геном или секвенировать ДНК. А благодаря CRISPR мы можем вносить небольшие правки в геном. Но мы все еще не умеем писать с нуля», — объяснил Маццони. «Написание или создание новых фрагментов генома может помочь нам проверить достаточность — в данном случае выяснить, какая наименьшая единица генома необходима клетке, чтобы знать, где она находится в организме».
Маццони объединился с Джефом Бёке, директором Института системной генетики Медицинской школы Гроссмана Нью-Йоркского университета, который известен своей работой по синтезу синтетического генома дрожжей. Лаборатория Боке стремилась перенести эту технологию на клетки млекопитающих.
Аспирант Сударшан Пинглей в лаборатории Бёке изготовил длинные нити синтетической ДНК, скопировав ДНК из генов Hox крыс. Затем исследователи доставили ДНК в точное место внутри плюрипотентных стволовых клеток мышей. Использование разных видов позволило исследователям отличить синтетическую ДНК крысы от естественных клеток мышей.
«Доктор. Ричард Фейнман однажды сказал: «То, что я не могу создать, я не понимаю». Теперь мы на гигантский шаг приблизились к пониманию 9.0031 Hox », — сказал Бёке, который также является профессором биохимии и молекулярной фармакологии в Нью-Йоркском университете имени Гроссмана и соавтором исследования.
Изучение кластеров Hox
Используя искусственную ДНК Hox в стволовых клетках мыши, исследователи теперь могут изучить, как гены Hox помогают клеткам узнавать и запоминать, где они находятся. У млекопитающих кластеры Hox окружены регуляторными областями, которые контролируют, как Hox гена активированы. Было неизвестно, нужен ли кластер сам по себе или кластер плюс другие элементы, чтобы клетки научились и запоминали, где они находятся.
У млекопитающих кластеры Hox окружены регуляторными областями, которые контролируют, как Hox гена активированы. Было неизвестно, нужен ли кластер сам по себе или кластер плюс другие элементы, чтобы клетки научились и запоминали, где они находятся.
Исследователи обнаружили, что только эти кластеры с высокой плотностью генов содержат всю информацию, необходимую клеткам для декодирования позиционного сигнала и его запоминания. Это говорит о том, что компактная природа кластеров Hox помогает клеткам узнать свое местоположение, подтверждая давнюю гипотезу о генах Hox , которую ранее было трудно проверить.
Создание синтетической ДНК и искусственных генов Hox прокладывает путь для будущих исследований развития животных и болезней человека.
«Разные виды имеют разные структуры и формы, многое из которых зависит от того, как экспрессируются кластеры Hox . Например, змея представляет собой длинную грудную клетку без конечностей, а конек не имеет грудной клетки и представляет собой только конечности.


 С этого кодона начинается синтез молекулы белка. Таким образом, во время синтеза белка, первой аминокислотой в последовательности всегда будет метионин.
С этого кодона начинается синтез молекулы белка. Таким образом, во время синтеза белка, первой аминокислотой в последовательности всегда будет метионин. 29. Хромосома до и после дупликации
29. Хромосома до и после дупликации )
) Нет, тут нужна совершенно иная идея. Тут действительно таится загадка. Великая загадка. Возможно, новый закон природы. Сейчас главный вопрос — как к этому подступиться экспериментально».
Нет, тут нужна совершенно иная идея. Тут действительно таится загадка. Великая загадка. Возможно, новый закон природы. Сейчас главный вопрос — как к этому подступиться экспериментально». Дж. Мюллер обнаружил, что ионизирующие излучения вызывают мутации, и работа берлинской группы очень ясно показала, что эти мутации вызываются либо отдельными парами ионов, либо их небольшими кластерами. Обсуждение этих открытий в нашей небольшой группе укрепило представление о том, что гены обладают своего рода стабильностью, аналогичной стабильности химических молекул. Оглядываясь назад, на наши нынешние знания, можно было бы счесть это тривиальным утверждением: чем ещё могут быть гены, как не молекулами? Однако в середине тридцатых годов это не было тривиальным утверждением. Гены в то время были алгебраическими единицами комбинаторной науки генетики, и было совсем неясно, что эти единицы были молекулами, поддающимися анализу с точки зрения структурной химии. Они могли оказаться субмикроскопическими стационарными системами, Кэрнс и др. 1966 ).
Дж. Мюллер обнаружил, что ионизирующие излучения вызывают мутации, и работа берлинской группы очень ясно показала, что эти мутации вызываются либо отдельными парами ионов, либо их небольшими кластерами. Обсуждение этих открытий в нашей небольшой группе укрепило представление о том, что гены обладают своего рода стабильностью, аналогичной стабильности химических молекул. Оглядываясь назад, на наши нынешние знания, можно было бы счесть это тривиальным утверждением: чем ещё могут быть гены, как не молекулами? Однако в середине тридцатых годов это не было тривиальным утверждением. Гены в то время были алгебраическими единицами комбинаторной науки генетики, и было совсем неясно, что эти единицы были молекулами, поддающимися анализу с точки зрения структурной химии. Они могли оказаться субмикроскопическими стационарными системами, Кэрнс и др. 1966 ).
 пособие / С. А. Павлович. — 33е изд., испр. — Минск: Издательство Вышэйшая школа, 2013. — 799 с.
пособие / С. А. Павлович. — 33е изд., испр. — Минск: Издательство Вышэйшая школа, 2013. — 799 с.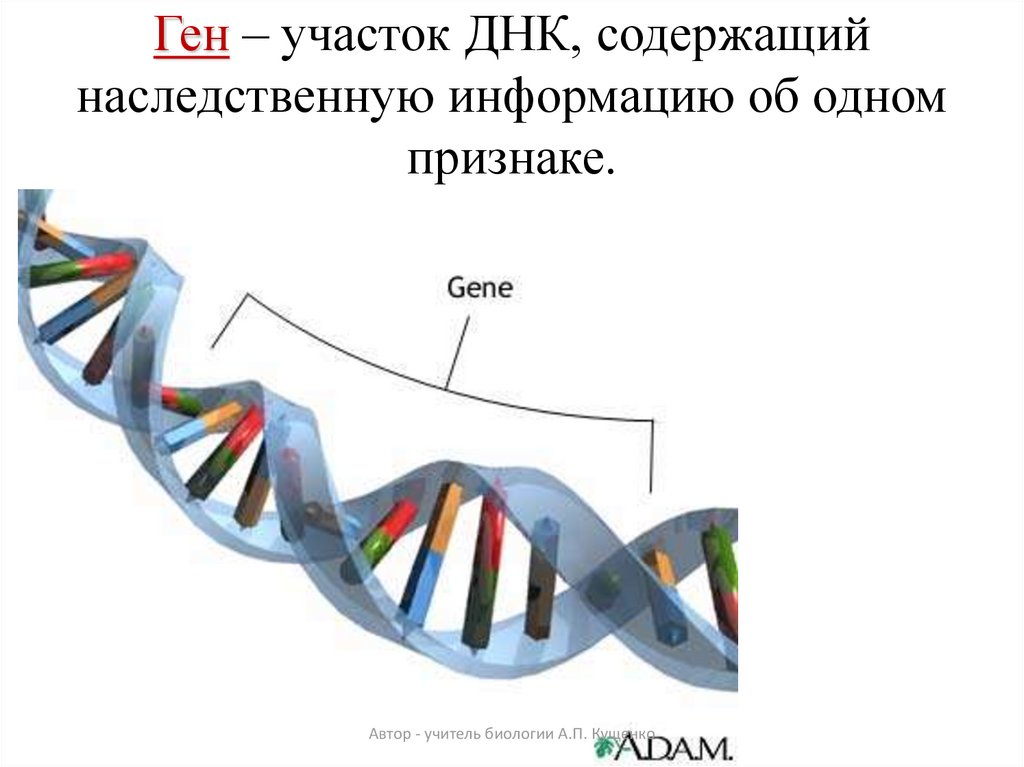 О., Микробном человека / И.О. Стома, И.А. Карпов; Белорусский государственный медицинский университет, Минский научно-практический центр хирургии, трансплантологии и гематологии. — Минск: Издательство Доктор Дизайн, 2018. — 122 с.
О., Микробном человека / И.О. Стома, И.А. Карпов; Белорусский государственный медицинский университет, Минский научно-практический центр хирургии, трансплантологии и гематологии. — Минск: Издательство Доктор Дизайн, 2018. — 122 с.