Содержание
Хиральные молекулы
Стереоизомеры, их виды
Определение 1
Стереоизомеры – это вещества, в молекулах которых атомы связаны между собой одинаково, но расположение их в пространстве различно.
Стереоизомеры подразделяют на:
- Энантиомеры (оптические изомеры). Имеют одинаковые физико – химические свойства (плотность, температуру кипения и плавления, растворимость, спектральные свойства) в ахиральном окружении, но различную оптическую активность.
- Диастеромеры – это соединения, которые могут содержать два и более хиральных центра.
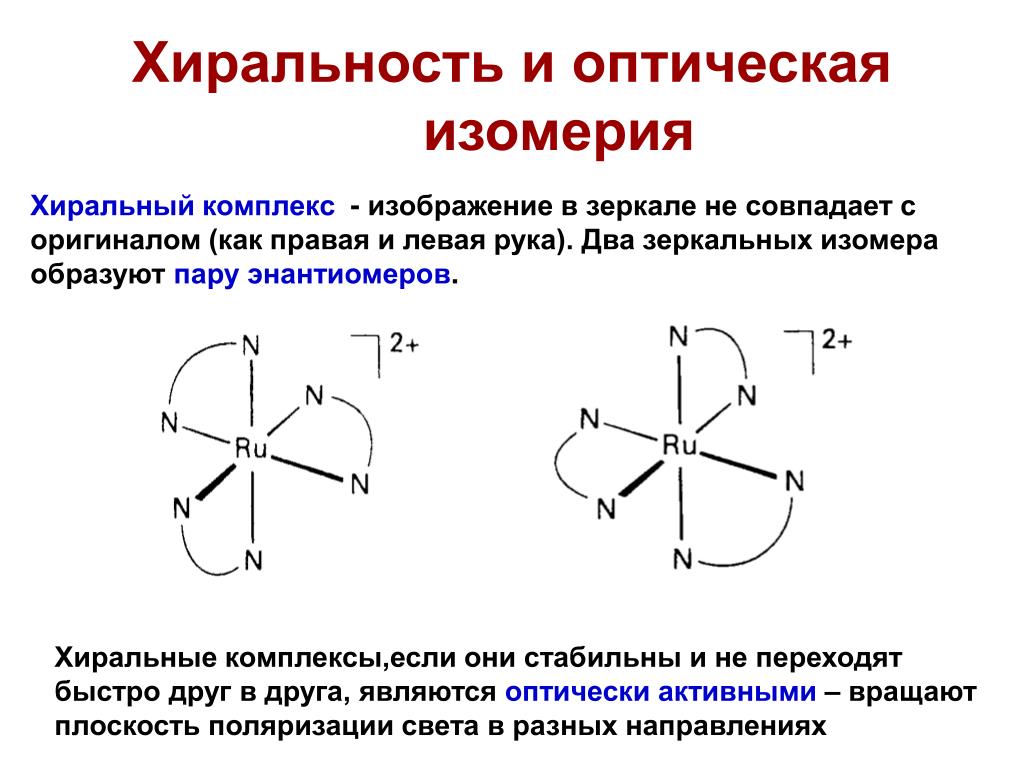
Под хиральностью понимают способность объекта не соответствовать своему зеркальному отражению. То есть, молекулы, не обладающие зеркально – поворотной симметрией, являются хиральными.
Определение 2
Прохиральная молекула – это молекула, которая может быть превращена в хиральную единственным изменением любого ее фрагмента.
В хиральных и прохиральных молекулах некоторые группы ядер, на первый взгляд химически эквивалентные, являются магнитно неэквивалентными, что подтверждают спектры ядерного магнитного резонанса. Это явление называется диастереотопией ядер, может наблюдаться по спектрам ядерного магнитного резонанса при наличии в одной молекуле прохирального и хирального фрагментов.
Это явление называется диастереотопией ядер, может наблюдаться по спектрам ядерного магнитного резонанса при наличии в одной молекуле прохирального и хирального фрагментов.
Например, в прохиральной молекуле две группы OPF2 являются эквивалентными, но в каждой группе атомов $PF_2$ атомы фтора неэквивалентны.
Это проявляется в константе спин – спинового взаимодействия 2/$FF$.
Если молекула оптически активная, то неэквивалентность ядер Х в тетраэдрических группах –$MX_2Y$ (например, -$CH_2R$, -$SiH_2R$ и др.) или пирамидальных группах –$MX_2$ (например, -$PF_2$, -$NH_2$ и др.) не зависит от высоты барьера внутреннего вращения этих групп. При вращении плоских групп –$MX_2$ и тетраэдрических –$MX_3$ потенциальный барьер очень низок, в результате чего ядра $X$ становятся эквивалентными.
Построение названий хиральных молекул
Современная система построения названий для хиральных молекул предложена Ингольдом, Каном и Прелогом. Согласно этой системе, для всех возможных групп $A$, $B$, $C$, $D$ при асимметричном атоме углерода выясняется порядок старшинства.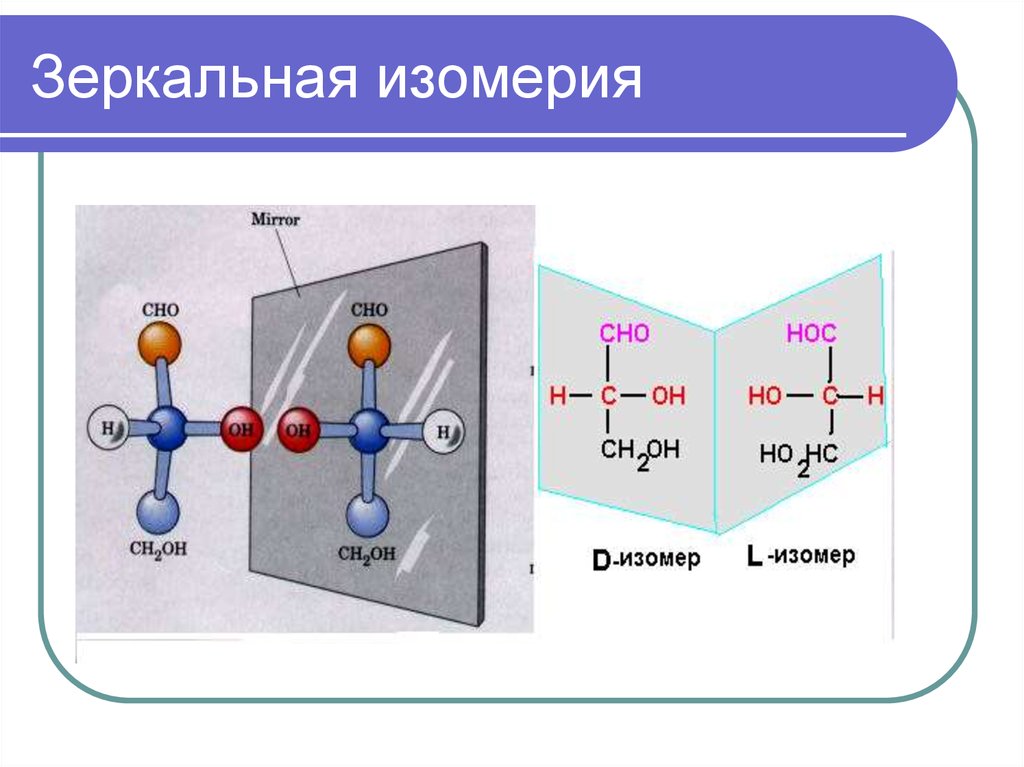 Чем больше атомный номер, тем он старше:
Чем больше атомный номер, тем он старше:
$H$
Если атомы одинаковые, то сравнивают второе окружение:
$CH_3$
Предположим, что группы расположены по уменьшению старшинства: $A → B → C → D$. Развернем молекулу таким образом, чтобы младший заместитель $D$ был направлен за плоскость рисунка, от нас. Тогда понижение старшинства в остальных группах может происходить либо по часовой, либо против часовой стрелки.
Замечание 1
Если понижение старшинства происходит по часовой стрелке при обозначении изомера используют символ $R$ (правый), если против часовой стрелки – $S$ (левый). Понятия «левый» и «правый» не отражают реального направления вращения линейно поляризованного света.
Эмиль Фишер предложил $DL$ –номенклатуру, согласно которой правовращающийся энантиомер обозначается буквой $D$, а левовращающийся – $L$. Эта номенклатура широко используется для обозначения аминокислот и углеводов.
Стереоспецифичность физиологической активности оптических изомеров
Оптические изомеры проявляют разную физиологическую активность.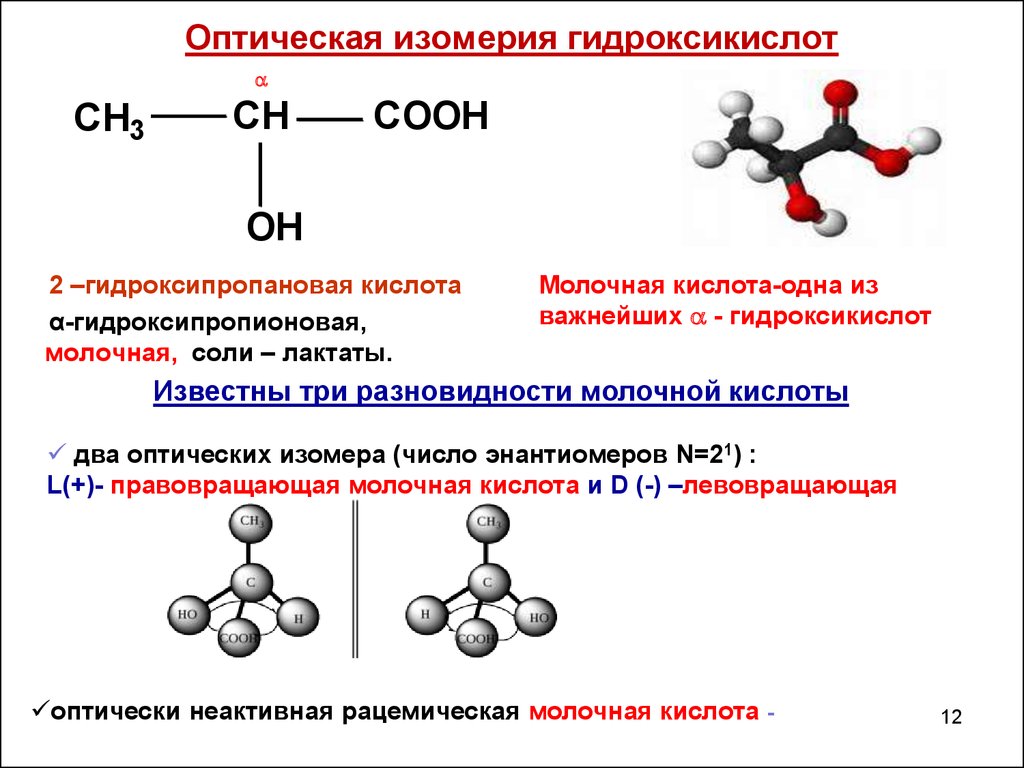 n$). Но только один ($R,R$)-изомер – хлоромицетин — проявляет свойства антибиотика
n$). Но только один ($R,R$)-изомер – хлоромицетин — проявляет свойства антибиотика
Получение чистых оптических изомеров является важной химико – технологической проблемой.
Пути получения чистых энантиомеров:
- Выделение из природного сырья. Все природные углеводы относятся к $D$-ряду, а природные аминокислоты – к $L$-ряду. Возможно использовать эти изомеры в химических реакциях, не затрагивающих центры оптической изомерии. Таким способом можно получить узкий круг веществ.
Выделение необходимого изомера из рацемической смеси при помощи оптически активного реагента.
Пример 1
Необходимо разделить смесь изомеров 1-фенилэтиламина. Вначале получают соли фенилэтиламина с природной винной кислотой (с ($R,R$)-изомером). Соли ($R,R,R$) и ($S,R,R$) являются диастереомерами и обладают разными физико – химическими свойствами. Их разделяют перекристаллизацией из этилового спирта.
Асимметрический синтез. Этот путь является самым перспективным.
 Необходимо, чтобы молекула имела один хиральный центр. Если во время реакции возникает второй центр, то переходные состояния будут диастереомерами, обладающими разной энергией. Если разность их энергий достигнет 10 кДж/моль, то доля определенного изомера (стереоселективность) достигнет 98%.
Необходимо, чтобы молекула имела один хиральный центр. Если во время реакции возникает второй центр, то переходные состояния будут диастереомерами, обладающими разной энергией. Если разность их энергий достигнет 10 кДж/моль, то доля определенного изомера (стереоселективность) достигнет 98%.
Хиральность в живой и неживой природе
Илья Леенсон,
канд. хим. наук, ст. науч. сотр. химического факультета МГУ
«Троицкий вариант» №24(218), 6 декабря 2016 года
Хиральность — несовместимость объекта со своим зеркальным отражением любой комбинацией вращений и перемещений в трехмерном пространстве. Речь идет только об идеальном плоском зеркале. В нем правша превращается в левшу и наоборот.
Хиральность типична для растений и животных, и сам термин происходит от греч. χείρ — рука.
Есть правые и левые ракушки и даже правые и левые клювы у клестов (рис. 1).
«Зеркальность» распространена и в неживой природе (рис. 2).
В последнее время стали модны «хиральные», т. е. зеркальные часы (обратите внимание на надпись на циферблате) (рис. 3).
е. зеркальные часы (обратите внимание на надпись на циферблате) (рис. 3).
И даже в лингвистике есть место хиральности! Это палиндромы: слова и предложения-перевертыши, например: Я УДАРЮ ДЯДЮ, ТЁТЮ РАДУЯ, Я УДАРЮ ТЁТЮ, ДЯДЮ РАДУЯ или ЛЕЕНСОН — УДАВ, НО ОН В АДУ НОС НЕ ЕЛ!
Очень важна хиральность для химиков и фармацевтов. Химия занимается объектами в наномасштабе (модное слово «нано» происходит от греч. νάννος — карлик). Хиральности в химии посвящена монография, на обложке которой (на фото справа) — хиральные колонны и две хиральные молекулы гексагелицена (от helix — спираль).
А важность хиральности для медицины символизирует обложка июньского номера американского журнала Journal of Chemical Education за 1996 год (рис. 4). На боку добродушно виляющего хвостом пса изображена структурная формула пеницилламина. Пес смотрит в зеркало, а оттуда на него глядит страшный зверь с оскаленной клыкастой пастью, горящими огнем глазами и вставшей дыбом шерстью. На боку зверя изображена та же самая структурная формула в виде зеркального отображения первой. Название опубликованной в этом номере статьи о лекарственных хиральных средствах было не менее красноречивым: «Когда молекулы лекарств смотрятся в зеркало». Почему же «зеркальное отражение» так драматически изменяет облик молекулы? И как узнали, что две молекулы являются «зеркальными антиподами»?
На боку зверя изображена та же самая структурная формула в виде зеркального отображения первой. Название опубликованной в этом номере статьи о лекарственных хиральных средствах было не менее красноречивым: «Когда молекулы лекарств смотрятся в зеркало». Почему же «зеркальное отражение» так драматически изменяет облик молекулы? И как узнали, что две молекулы являются «зеркальными антиподами»?
Поляризация света и оптическая активность
Со времен Ньютона в науке шли споры о том, представляет ли свет собой волны или частицы. Ньютон полагал, что свет состоит из частиц с двумя полюсами — «северным» и «южным». Французский физик Этьен Луи Малюс, ввел понятие о поляризованном свете, с одним направлением «полюсов». Теория Малюса не подтвердилась, однако название осталось.
В 1816 году французский физик Огюстен Жан Френель высказал необычную для того времени идею о том, что световые волны — поперечные, как волны на поверхности воды.
Френель объяснил и явление поляризации света: в обычном свете колебания происходят хаотично, во всех направлениях, перпендикулярных направлению луча. Но, пройдя через некоторые кристаллы, например исландского шпата или турмалина, свет приобретает особые свойства: волны в нем колеблются только в одной плоскости. Образно говоря, луч такого света подобен шерстяной нитке, которую продернули через узкую щель между двумя острыми лезвиями бритвы. Если второй такой же кристалл поставить перпендикулярно первому, поляризованный свет через него не пройдет.
Но, пройдя через некоторые кристаллы, например исландского шпата или турмалина, свет приобретает особые свойства: волны в нем колеблются только в одной плоскости. Образно говоря, луч такого света подобен шерстяной нитке, которую продернули через узкую щель между двумя острыми лезвиями бритвы. Если второй такой же кристалл поставить перпендикулярно первому, поляризованный свет через него не пройдет.
Отличить обычный свет от поляризованного можно с помощью оптических приборов — поляриметров; ими пользуются, например, фотографы: поляризационные фильтры помогают избавиться от бликов на фотографии, которые возникают при отражении света от поверхности воды.
Оказалось, что при прохождении поляризованного света через некоторые вещества плоскость поляризации поворачивается. Впервые это явление обнаружил в 1811 году французский физик Франсуа Доминик Араго у кристаллов кварца. Это связано со строением кристалла. Природные кристаллы кварца асимметричны, причем они бывают двух типов, которые отличаются по своей форме, как предмет от своего зеркального изображения (рис. 5). Эти кристаллы вращают плоскость поляризации света в противоположных направлениях; их назвали право- и левовращающими.
5). Эти кристаллы вращают плоскость поляризации света в противоположных направлениях; их назвали право- и левовращающими.
В 1815 году французский физик Жан Батист Био и немецкий физик Томас Иоганн Зеебек выяснили, что некоторые органические вещества, например сахар и скипидар, также обладают способностью вращать плоскость поляризации, причем не только в кристаллическом, но и в жидком, растворенном и даже газообразном состояниях. Оказалось, что каждый «цветовой луч» белого света поворачивается на разный угол. Сильнее всего поворачивается плоскость поляризации для фиолетовых лучей, меньше всего — для красных. Поэтому бесцветное вещество в поляризованном свете может стать окрашенным.
Как и в случае кристаллов, некоторые химические соединения могли существовать в виде как право-, так и левовращающих разновидностей. Однако оставалось неясным, с каким свойством молекул связано это явление: самый тщательный химический анализ не мог обнаружить между ними никаких различий! Такие разновидности веществ назвали оптическими изомерами, а сами соединения — оптически активными. Оказалось, что у оптически активных веществ есть и третий тип изомеров — оптически неактивные. Это обнаружил в 1830 году знаменитый шведский химик Йёнс Якоб Берцелиус: виноградная кислота С4Н6О6 оптически неактивна, а винная кислота точно такого же состава обладает в растворе правым вращением. Но никто не знал, существует ли не встречающаяся в природе «левая» винная кислота — антипод правовращающей.
Оказалось, что у оптически активных веществ есть и третий тип изомеров — оптически неактивные. Это обнаружил в 1830 году знаменитый шведский химик Йёнс Якоб Берцелиус: виноградная кислота С4Н6О6 оптически неактивна, а винная кислота точно такого же состава обладает в растворе правым вращением. Но никто не знал, существует ли не встречающаяся в природе «левая» винная кислота — антипод правовращающей.
Открытие Пастера
Оптическую активность кристаллов физики связывали с их асимметричностью; полностью симметричные кристаллы, например кубические кристаллы поваренной соли, оптически неактивны. Причина же оптической активности молекул долгое время оставалась совершенно загадочной. Первое открытие, проливавшее свет на это явление, сделал в 1848 году никому тогда не известный французский ученый Луи Пастер. Еще в студенческие годы он заинтересовался химией и кристаллографией, работая под руководством вышеупомянутого Жана Батиста Био и видного французского химика-органика Жана Батиста Дюма. После окончания Высшей нормальной школы в Париже молодой (ему было всего 26 лет) Пастер работал лаборантом у Антуана Балара. Балар был уже известным химиком, который за 22 года до этого прославился открытием нового элемента — брома. Своему ассистенту он дал тему по кристаллографии, не предполагая, что это приведет к выдающемуся открытию.
После окончания Высшей нормальной школы в Париже молодой (ему было всего 26 лет) Пастер работал лаборантом у Антуана Балара. Балар был уже известным химиком, который за 22 года до этого прославился открытием нового элемента — брома. Своему ассистенту он дал тему по кристаллографии, не предполагая, что это приведет к выдающемуся открытию.
В ходе исследования Пастер приготовил раствор натриево-аммониевой соли оптически неактивной виноградной кислоты и медленным выпариванием воды получил красивые призматические кристаллы этой соли. Кристаллы эти, в отличие от кристаллов виноградной кислоты, оказались асимметричными. У части кристалликов одна характерная грань находилась справа, а у других — слева, причем по форме два типа кристаллов были как бы зеркальным отражением друг друга.
Тех и других кристаллов получилось поровну. Зная, что в подобных случаях кристаллы кварца вращают в разные стороны, Пастер решил проверить, не будет ли наблюдаться это явление и на полученной им соли. Вооружившись увеличительным стеклом и пинцетом, Пастер аккуратно разделил кристаллы на две кучки. Их растворы, как и следовало ожидать, обладали противоположным оптическим вращением, а смесь растворов была оптически неактивной (правая и левая поляризации взаимно компенсировались). Пастер на этом не остановился. Из каждого из двух растворов с помощью сильной серной кислоты он вытеснил более слабую органическую кислоту. Можно было предположить, что в обоих случаях получится исходная виноградная кислота, которая оптически неактивна. Однако оказалось, что из одного раствора образовалась вовсе не виноградная, а известная правовращающая винная кислота, а из другого раствора получилась тоже винная кислота, но вращающая влево! Эти кислоты получили название d-винной (от лат. dexter — правый) и l-винной (от лат. laevus — левый). В дальнейшем направление оптического вращения стали обозначать знаками (+) и (–), а абсолютную конфигурацию молекулы в пространстве — буквами R и S. Итак, неактивная виноградная кислота оказалась смесью равных количеств известной «правой» винной кислоты и ранее неизвестной «левой».
Их растворы, как и следовало ожидать, обладали противоположным оптическим вращением, а смесь растворов была оптически неактивной (правая и левая поляризации взаимно компенсировались). Пастер на этом не остановился. Из каждого из двух растворов с помощью сильной серной кислоты он вытеснил более слабую органическую кислоту. Можно было предположить, что в обоих случаях получится исходная виноградная кислота, которая оптически неактивна. Однако оказалось, что из одного раствора образовалась вовсе не виноградная, а известная правовращающая винная кислота, а из другого раствора получилась тоже винная кислота, но вращающая влево! Эти кислоты получили название d-винной (от лат. dexter — правый) и l-винной (от лат. laevus — левый). В дальнейшем направление оптического вращения стали обозначать знаками (+) и (–), а абсолютную конфигурацию молекулы в пространстве — буквами R и S. Итак, неактивная виноградная кислота оказалась смесью равных количеств известной «правой» винной кислоты и ранее неизвестной «левой». Именно поэтому равная смесь их молекул в кристалле или в растворе не обладает оптической активностью. Для такой смеси стали применять название «рацемат», от лат. racemus — виноград. Два антипода, дающие при смешении в равных количествах оптически неактивную смесь, получили название энантиомеров (от греч. έναντίος — противоположный).
Именно поэтому равная смесь их молекул в кристалле или в растворе не обладает оптической активностью. Для такой смеси стали применять название «рацемат», от лат. racemus — виноград. Два антипода, дающие при смешении в равных количествах оптически неактивную смесь, получили название энантиомеров (от греч. έναντίος — противоположный).
Поняв значение своего эксперимента, Пастер выбежал из лаборатории и, встретив лаборанта физического кабинета, бросился к нему и воскликнул: «Я только что сделал великое открытие!» Кстати, Пастеру очень повезло с веществом: в дальнейшем химики обнаружили всего несколько подобных случаев кристаллизации при определенной температуре смеси оптически различных кристалликов, достаточно крупных, чтобы их можно было под лупой разделить пинцетом.
Пастер открыл еще два метода разделения рацемата на два антипода. Биохимический метод основан на избирательной способности некоторых микроорганизмов усваивать только один из изомеров. Во время посещения Германии один из аптекарей дал ему давно стоявшую склянку с виноградной кислотой, в которой завелась зеленая плесень. В своей лаборатории Пастер обнаружил, что бывшая когда-то неактивной кислота стала левовращающей. Оказалась, что зеленый плесневой грибок Penicillum glaucum «поедает» только правый изомер, оставляя левый без изменения. Такое же действие оказывает эта плесень на рацемат миндальной кислоты, только в данном случае она «поедает» левовращающий изомер, не трогая правовращающий.
В своей лаборатории Пастер обнаружил, что бывшая когда-то неактивной кислота стала левовращающей. Оказалась, что зеленый плесневой грибок Penicillum glaucum «поедает» только правый изомер, оставляя левый без изменения. Такое же действие оказывает эта плесень на рацемат миндальной кислоты, только в данном случае она «поедает» левовращающий изомер, не трогая правовращающий.
Третий способ разделения рацематов был чисто химическим. Для него нужно было иметь оптически активное вещество, которое при взаимодействии с рацемической смесью по-разному связывалось бы к каждым из энантиомеров. В результате два вещества в смеси не будут антиподами (энантиомерами) и их можно будет разделить как два разных вещества. Это можно пояснить такой моделью на плоскости. Возьмем смесь двух антиподов — Я и R. Их химические свойства одинаковые. Внесем в смесь несимметричный (хиральный) компонент, например Z, который может реагировать с каким-либо участком в этих энантиомерах. Получим два вещества: ЯZ и ZR (или ЯZ и RZ). Эти структуры не являются зеркально симметричными, поэтому такие вещества будут чисто физически различаться (температурой плавления, растворимостью, еще чем-нибудь) и их можно разделить.
Эти структуры не являются зеркально симметричными, поэтому такие вещества будут чисто физически различаться (температурой плавления, растворимостью, еще чем-нибудь) и их можно разделить.
Пастер сделал еще много открытий, в числе которых прививки против сибирской язвы и бешенства, ввел методы асептики и антисептики.
Исследование Пастера, доказывающее возможность «расщепления» оптически неактивного соединения на антиподы — энантиомеры, первоначально вызвало у многих химиков недоверие, однако, как и последующие его работы, привлекло самое пристальное внимание ученых. Вскоре французский химик Жозеф Ашиль Ле Бель с помощью третьего пастеровского метода расщепил несколько спиртов на оптически активные антиподы. Немецкий химик Иоганн Вислиценус установил, что существуют две молочные кислоты: оптически неактивная, образующаяся в скисшем молоке (молочная кислота брожения), и правовращающая, которая появляется в работающей мышце (мясомолочная кислота). Подобных примеров становилось всё больше, и требовалась теория, объясняющая, чем же отличаются друг от друга молекулы антиподов.
Теория Вант-Гоффа
Такую теорию создал молодой голландский ученый Якоб Хендрик Вант-Гофф, который в 1901 году получил первую в истории Нобелевскую премию по химии. Согласно его теории, молекулы, как и кристаллы, могут быть хиральными — «правыми» и «левыми», являясь зеркальным отражением друг друга. Простейший пример — молекулы, в которых имеется так называемый асимметрический атом углерода, окруженный четырьмя разными группами. Это можно продемонстрировать на примере простейшей аминокислоты аланина. Две изображенные молекулы невозможно совместить в пространстве никакими поворотами (рис. 6, вверху).
Многие ученые отнеслись к теории Вант-Гоффа недоверчиво. А известный немецкий химик-органик, выдающийся экспериментатор, профессор Лейпцигского университета Адольф Кольбе разразился резкой до неприличия статьей в Journal für praktische Chemie с ехидным названием «Zeiche der Zeit» («Приметы времени»). Он сравнивал теорию Вант-Гоффа с «отбросами человеческого ума», с «кокоткой, наряженной в модные одежды и покрывшей лицо белилами и румянами, чтобы попасть в порядочное общество, в котором для нее нет места».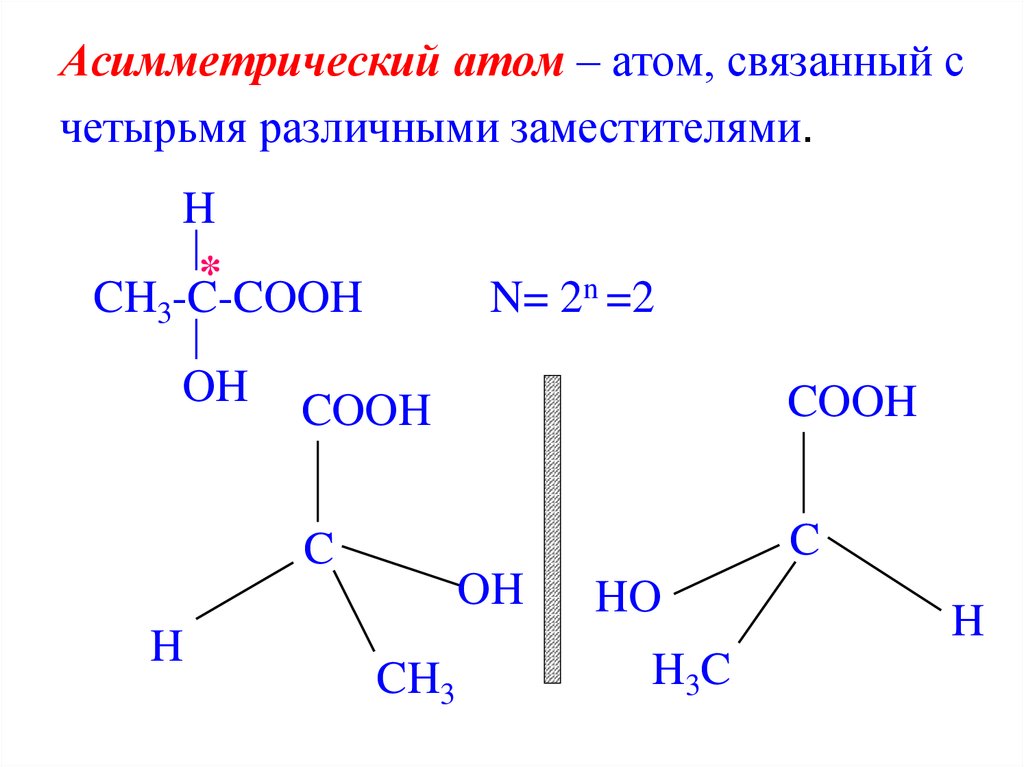 Кольбе писал, что «некоему доктору Вант-Гоффу, занимающему должность в Утрехтском ветеринарном училище, очевидно, не по вкусу точные химические исследования. Он счел более приятным сесть на Пегаса (вероятно, взятого напрокат из ветеринарного училища) и поведать миру то, что узрел с химического Парнаса… Настоящих исследователей поражает, как почти неизвестные химики берутся так уверенно судить о высочайшей проблеме химии — вопросе о пространственном положении атомов, который, пожалуй, никогда не будет решен… Такой подход к научным вопросам недалек от веры в ведьм и духов. А таких химиков следовало бы исключить из рядов настоящих ученых и причислить к лагерю натурфилософов, совсем немногим отличающихся от спиритов».
Кольбе писал, что «некоему доктору Вант-Гоффу, занимающему должность в Утрехтском ветеринарном училище, очевидно, не по вкусу точные химические исследования. Он счел более приятным сесть на Пегаса (вероятно, взятого напрокат из ветеринарного училища) и поведать миру то, что узрел с химического Парнаса… Настоящих исследователей поражает, как почти неизвестные химики берутся так уверенно судить о высочайшей проблеме химии — вопросе о пространственном положении атомов, который, пожалуй, никогда не будет решен… Такой подход к научным вопросам недалек от веры в ведьм и духов. А таких химиков следовало бы исключить из рядов настоящих ученых и причислить к лагерю натурфилософов, совсем немногим отличающихся от спиритов».
Со временем теория Вант-Гоффа получила полное признание. Каждый химик знает, что, если в смеси поровну «правых» и «левых» молекул, вещество в целом будет оптически неактивным. Именно такие вещества и получаются в колбе в результате обычного химического синтеза. И только в живых организмах, при участии асимметричных агентов, например ферментов, образуются асимметричные соединения. Так, в природе преобладают аминокислоты и сахара́ только одной конфигурации, а образование их антиподов подавлено. В некоторых случаях разные энантиомеры можно различить и без всяких приборов — когда они по-разному взаимодействуют с асимметрическими рецепторами в нашем организме. Яркий пример — аминокислота лейцин: ее правовращающий изомер сладкий, а левовращающий — горький.
И только в живых организмах, при участии асимметричных агентов, например ферментов, образуются асимметричные соединения. Так, в природе преобладают аминокислоты и сахара́ только одной конфигурации, а образование их антиподов подавлено. В некоторых случаях разные энантиомеры можно различить и без всяких приборов — когда они по-разному взаимодействуют с асимметрическими рецепторами в нашем организме. Яркий пример — аминокислота лейцин: ее правовращающий изомер сладкий, а левовращающий — горький.
Конечно, тут же возникает вопрос о том, как же появились на Земле первые оптически активные химические соединения, например та же природная правовращающая винная кислота, или как возникли «асимметричные» микроорганизмы, питающиеся только одним из энантиомеров. Ведь в отсутствие человека некому было осуществлять направленный синтез оптически активных веществ, некому было разделять кристаллы на правые и левые! Однако подобные вопросы оказались настолько сложными, что однозначного ответа на них нет и поныне. Ученые сходятся лишь в том, что существуют асимметричные неорганические или физические агенты (асимметричные катализаторы, поляризованный солнечный свет, поляризованное магнитное поле), которые могли дать начальный толчок асимметрическому синтезу органических веществ. Похожее явление мы наблюдаем и в случае асимметрии «вещество — антивещество», поскольку все космические тела состоят только из вещества, а отбор произошел на самых ранних стадиях образования Вселенной.
Ученые сходятся лишь в том, что существуют асимметричные неорганические или физические агенты (асимметричные катализаторы, поляризованный солнечный свет, поляризованное магнитное поле), которые могли дать начальный толчок асимметрическому синтезу органических веществ. Похожее явление мы наблюдаем и в случае асимметрии «вещество — антивещество», поскольку все космические тела состоят только из вещества, а отбор произошел на самых ранних стадиях образования Вселенной.
Хиральные лекарства
Химики часто относятся к энантиомерам как к одному соединению, поскольку их химические свойства идентичны. Однако их биологическая активность может быть совершенно различной. Человек — существо хиральное. И это относится не только к его внешнему виду. «Правые» и «левые» лекарства, взаимодействуя с хиральными молекулами в организме, например с ферментами, могут действовать по-разному. «Правильное» лекарство подходит к своему рецептору как ключ к замку и запускает желаемую биохимическую реакцию. Действие же «неправильного» антипода можно уподобить попытке пожать правой рукой левую руку своего гостя. Необходимость в оптически чистых энантиомерах объясняется также тем, что часто только один из них обладает требуемым терапевтическим эффектом, тогда как второй антипод может в лучшем случае быть бесполезным, а в худшем — вызвать нежелательные побочные эффекты или даже быть токсичным. Это стало очевидным после нашумевшей трагической истории с талидомидом — лекарственным средством, которое назначали в 1960-е годы беременным женщинам как эффективное снотворное и успокаивающее. Однако со временем проявилось его побочное тератогенное (от греч. τέρας — чудовище) действие, и на свет появилась масса младенцев с врожденными уродствами. Лишь в конце 1980-х годов выяснилось, что причиной несчастий был только один из энантиомеров талидомида — правовращающий — и только левовращающий изомер является мощным транквилизатором (рис. 6, внизу). К сожалению, такое различие в действии лекарственных форм раньше не было известно, поэтому продаваемый талидомид был рацемической смесью обоих антиподов.
Действие же «неправильного» антипода можно уподобить попытке пожать правой рукой левую руку своего гостя. Необходимость в оптически чистых энантиомерах объясняется также тем, что часто только один из них обладает требуемым терапевтическим эффектом, тогда как второй антипод может в лучшем случае быть бесполезным, а в худшем — вызвать нежелательные побочные эффекты или даже быть токсичным. Это стало очевидным после нашумевшей трагической истории с талидомидом — лекарственным средством, которое назначали в 1960-е годы беременным женщинам как эффективное снотворное и успокаивающее. Однако со временем проявилось его побочное тератогенное (от греч. τέρας — чудовище) действие, и на свет появилась масса младенцев с врожденными уродствами. Лишь в конце 1980-х годов выяснилось, что причиной несчастий был только один из энантиомеров талидомида — правовращающий — и только левовращающий изомер является мощным транквилизатором (рис. 6, внизу). К сожалению, такое различие в действии лекарственных форм раньше не было известно, поэтому продаваемый талидомид был рацемической смесью обоих антиподов. Они отличаются взаимным расположением в пространстве двух фрагментов молекулы.
Они отличаются взаимным расположением в пространстве двух фрагментов молекулы.
Еще один пример. Пеницилламин, структура которого была нарисована на собаке и волке на обложке журнала, — довольно простое производное аминокислоты цистеина. Это вещество применяют при острых и хронических отравлениях медью, ртутью, свинцом, другими тяжелыми металлами, так как оно обладает способностью давать прочные комплексы с ионами этих металлов; образующиеся комплексы удаляются почками. Применяют пеницилламин также при различных формах ревматоидного артрита, в ряде других случаев. При этом применяют только «левую» форму препарата, так как «правая» токсична и может привести к слепоте.
Бывает и так, что каждый энантиомер обладает своим специфическим действием. Так, левовращающий S-тироксин (лекарственный препарат левотроид) — это природный гормон щитовидной железы. А правовращающий R-тироксин (декстроид) понижает содержание холестерина в крови. Некоторые производители придумывают для подобных случаев торговые названия-палиндромы, например, darvon и novrad для синтетического наркотического анальгетика и препарата от кашля соответственно.
В настоящее время многие лекарственные средства выпускаются в виде оптически чистых соединений. Их получают тремя методами: разделением рацемических смесей, модификацией природных оптически активных соединений и прямым синтезом. Последний также требует хиральных источников, поскольку любые другие традиционные методы синтеза дают рацемат. Это, кстати, одна из причин очень высокой стоимости некоторых лекарств, поскольку направленный синтез только одного из них — сложная задача. Поэтому не удивительно, что из множества синтетических хиральных препаратов, выпускаемых во всем мире, лишь небольшая часть является оптически чистой, остальные — рацематы.
О хиральности молекул см. также:
Глава Происхождение хиральной чистоты из книги Михаила Никитина «Происхождение жизни».
почему «зеркальные» молекулы действуют так по-разному и как это используют в фармакологии — Нож
Вы когда-нибудь, смотря в зеркало, задумывались о том, что было бы, если бы вас реального и вас из зеркала совместить и сравнить? Вроде бы вы оба были бы одинаковы — две руки, две ноги… но отраженные по горизонтали. Например, родинка на левом бедре у вас реального — переместилась бы на правое у вас зеркального.
Например, родинка на левом бедре у вас реального — переместилась бы на правое у вас зеркального.
Ситуация чисто гипотетическая, да и смахивает на описание какого-то бэд-трипа. Но в мире химии вышеописанная фантасмагория встречается сплошь и рядом, при этом имея достаточно важное значение для свойств химических соединений.
Что такое «зеркальные» вещества
«Зеркальные» вещества называются оптическими изомерами. Термин, кстати, не самый удачный, так как он описывает лишь вращение поляризации света при его прохождении через растворы различных оптических изомеров одного и того же вещества. Более широко используемый термин — энантиомеры. Это понятие лучше всего проиллюстрировать картинкой из «Википедии»:
Источник
В химии соединение принимает лишь одну конфигурацию — энергетически выгодную, которая обусловлена взаимодействием электронных оболочек атомов. В данном случае трехгранная пирамида (тетраэдр) является такой выгодной конфигурацией взаимного расположения атомов, связанных с центральным атомом углерода.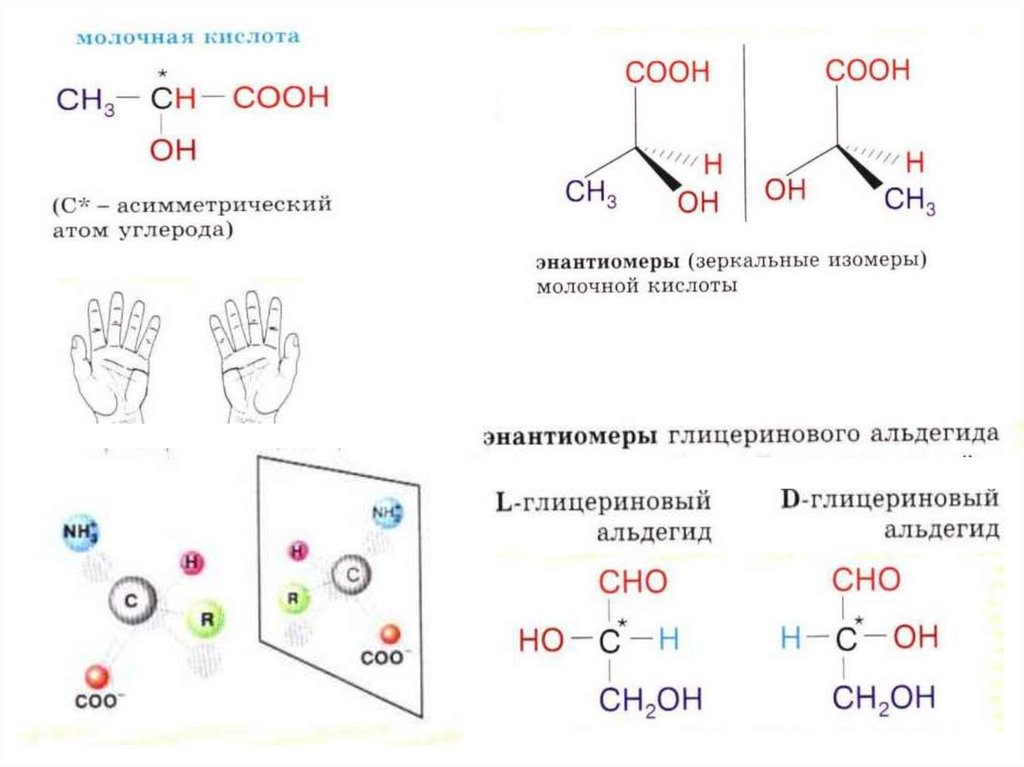 И расположение ее «углов» может быть либо как на левой руке, либо как на правой, причем эти «отражения» невозможно совместить, как бы вы их ни крутили. Кстати, химики особо не задумываются и так и называют оптические изомеры — левовращающие (L-изомеры) и правовращающие (D-изомеры).
И расположение ее «углов» может быть либо как на левой руке, либо как на правой, причем эти «отражения» невозможно совместить, как бы вы их ни крутили. Кстати, химики особо не задумываются и так и называют оптические изомеры — левовращающие (L-изомеры) и правовращающие (D-изомеры).
Может показаться, что это очередная муть из области физхимии и ее трехэтажных уравнений, но отнюдь: каким-то чудом (на самом деле термодинамикой) получилось так, что мы все состоим из аминокислот, имеющих L-конформацию и углеводов, имеющих D-конформацию!
Из этого правила, конечно же, есть исключения: в природе встречаются D-аминокислоты, но их мало, у них весьма специфические свойства (например, регуляция метаболизма у некоторых бактерий), и они не включаются в состав белков.
В знаменитом эксперименте Миллера — Юри, воспроизводящем условия древней Земли и так называемого этапа абиогенеза — образования органических соединений из неорганики, на выходе получалась равная смесь L- и D-аминокислот.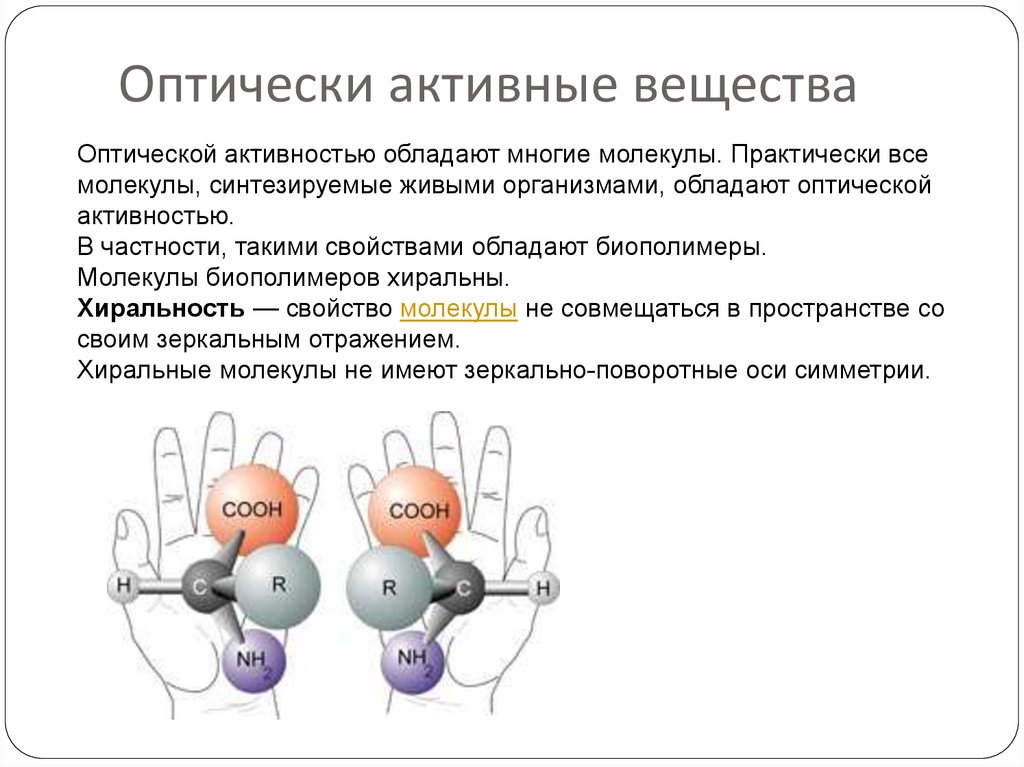 Существует несколько гипотез, объясняющих преобладание L-форм (например, что излучение «молодого» Солнца было частично поляризовано и поглощалось D-аминокислотами с последующим их разрушением), но на данный момент они мало продвинулись в объяснении того, почему ранние протоорганизмы всё-таки «выбрали» L-аминокислоты для самовоспроизведения.
Существует несколько гипотез, объясняющих преобладание L-форм (например, что излучение «молодого» Солнца было частично поляризовано и поглощалось D-аминокислотами с последующим их разрушением), но на данный момент они мало продвинулись в объяснении того, почему ранние протоорганизмы всё-таки «выбрали» L-аминокислоты для самовоспроизведения.
Однако все ученые сходятся на одном: явление «гомохиральности», то есть использования исключительно L- либо D-аминокислот, — одно из ключевых пунктов в стабильности белковых молекул.
Интересно, что наш организм не способен усваивать D-аминокислоты и L-углеводы. Этот милый факт привел ученых-биохимиков к весьма садистскому мысленному эксперименту, известному как «зеркальный мир». Представьте, что вы оказались на планете, идентичной Земле, но где хиральность аминокислот и углеводов перевернута. Вы умрете от голода (и, возможно, отравления) даже при обилии легкоусвояемой пищи.
Братья-амфетамины: с приходом и без
Давайте немножечко поднимемся над глубинами биохимии и рассмотрим, как хиральность влияет на нашу повседневную жизнь.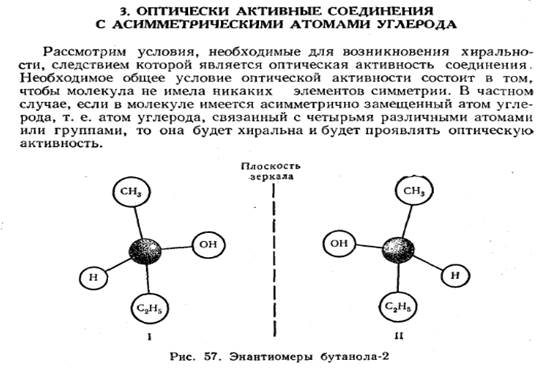 Для примера возьмем такой известный лекарственный препарат, как амфетамин. Гусары, молчать! В США он одобрен FDA (Food and Drugs Administration, ведомство в США занимающееся безопасностью лекарственных препаратов, на данный момент считается наиболее авторитетным в вопросах допуска лекарств на рынок и в доклинических испытаниях) для лечения нарколепсии под маркой Adderall.
Для примера возьмем такой известный лекарственный препарат, как амфетамин. Гусары, молчать! В США он одобрен FDA (Food and Drugs Administration, ведомство в США занимающееся безопасностью лекарственных препаратов, на данный момент считается наиболее авторитетным в вопросах допуска лекарств на рынок и в доклинических испытаниях) для лечения нарколепсии под маркой Adderall.
Он имеет два энантиомера — L-амфетамин (левоамфетамин) и D-амфетамин (декстроамфетамин, или декседрин).
Как видите, они отличаются с химической точки зрения лишь расположением метильной группы (-Ch4) относительно плоскости молекулы. Источник
При классических методиках синтеза, которые я, пожалуй, здесь приводить не буду, на выходе мы получаем так называемый рацемат — смесь L- и D-энантиомеров в примерно равных пропорциях. Также существуют методики «стереоселективного» синтеза, позволяющие получать избирательно один из энантиомеров.
Что же касается биологических свойств левоамфетамина и декседрина, то различия в них довольно значительны — левоамфетамин с трудом преодолевает ГЭБ (гемато-энцефалический барьер, систему специализированных клеток и белков, «фильтрующих» поступающие в ткани мозга химические вещества) и оказывает в основном периферические эффекты — повышение давления, учащение пульса.
В то время как D-энантиомер оказывает в основном эффекты именно на ЦНС: он более чем в четыре раза эффективнее участвует в высвобождении дофамина, чем L-изомер.
Почему же так происходит? Одно из основных правил биохимии — субстрат должен подходить к ферменту как ключ к замку. Это же правило справедливо и для фармакологии: лекарственное вещество должно иметь структурное сродство к своей мишени.
Если вы посмотрите внимательно на объемную структуру различных энантиомеров амфетамина, то увидите разницу в расположении атомов в пространстве (синий атом — атом азота). А это — ключевой момент при связывании с белками, например с тем же дофаминовым транспортером (DAT). Источник
Поскольку «сайт связывания» белка-мишени распознает не структуру молекулы целиком, а лишь расположение отдельных атомов, и исходя из этого белковая молекула либо останавливает свою работу, либо активируется, то небольшая разница в пространственном положении одного-двух атомов может играть огромную роль.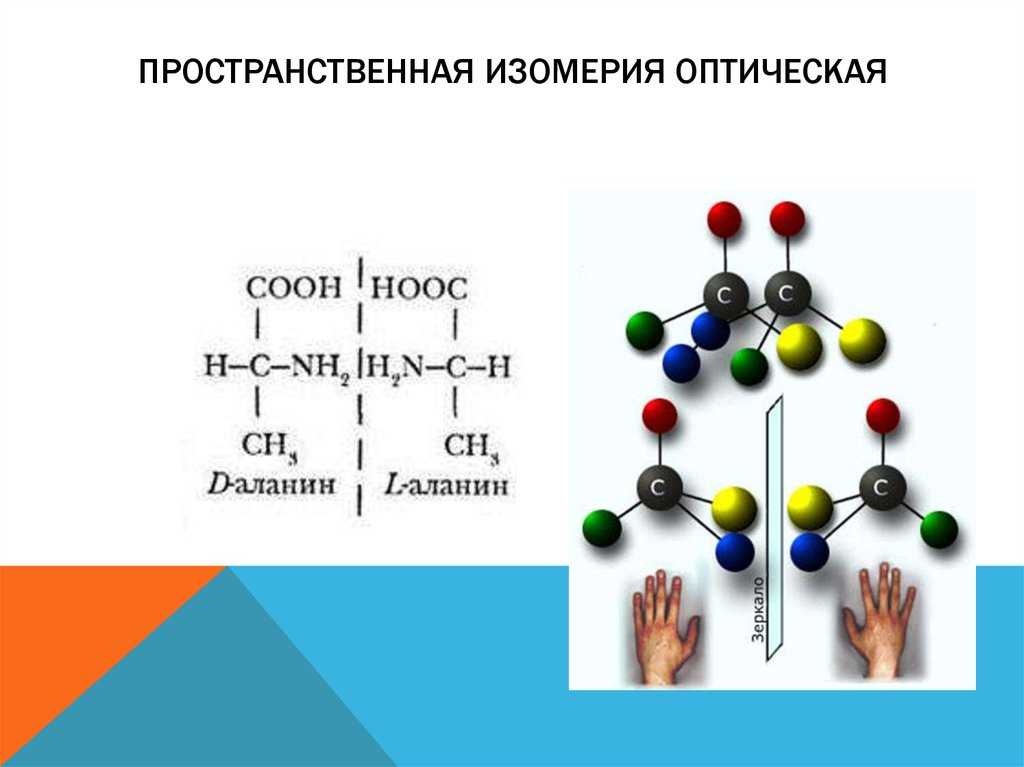
Fun fact: декседрин применялся в космической медицине и при полетах американских астронавтов. Видите ли в чем дело — играть с давлением и гемодинамикой в условиях невесомости, при активном перераспределении жидкостей в организме, довольно опасно. Но нужно же чем-то держать астронавтов в тонусе?
Вот состав аптечки астронавта — как вы можете видеть в графах Stowed/Used («Вложено»/«Использовано»), покорители Луны любили смешивать декседрин со скополамином. Источник
Как сообщается, эта смесь крайне эффективно помогала при тошноте. Также существовал регламент, по которому астронавты были обязаны принимать 10 мг декседрина при спуске с орбиты.
Безопасный транквилизатор с нюансом
В истории и фармакологии применения различных энантиомеров, помимо веселого покорения Луны под амфетамином, были также и весьма темные страницы, например талидомид.
Известно, что во время беременности женщина становится «условно вменяемой» (как в шутку говорили советские гинекологи) из-за прямо-таки 10-балльного гормонального шторма, который проявлялся в виде бессонницы, тошноты, беспокойства и странных вкусовых предпочтений вроде требования сделать бутерброд с вареньем и ветчиной в час ночи. В конце 1950-х врачи обратили внимание на набирающий популярность талидомид — безопасный транквилизатор без серьезных побочных эффектов.
В конце 1950-х врачи обратили внимание на набирающий популярность талидомид — безопасный транквилизатор без серьезных побочных эффектов.
Да, он действительно снимал тревожность и странные поведенческие отклонения, но вот в чем цимус — до этого он никогда не использовался при беременности, даже у крыс.
Буквально через 2–3 года после введения его в практику врачи были удивлены рождением огромного количества детей с самыми различными уродствами: у кого-то не было ног, у кого-то рук, а кто-то вообще без мозга родился (в буквальном смысле). Они начали поднимать истории назначения препаратов при беременности и нашли там талидомид.
Естественно, его использование было сразу прекращено и началось многолетнее расследование того, как его вообще допустили на рынок. Я не буду утомлять читателя перипетиями судебных процессов, но перейду к сути.
При синтезе, который не был стереоселективным, получалось два энантиомера — D- и L-. Один из них был действительно хорошим и годным транквилизатором без побочных эффектов, другой — тератогеном, то есть вызывающим врожденные уродства.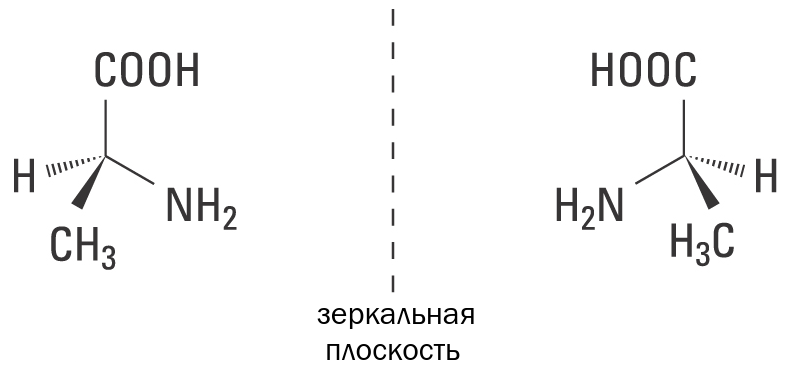
В англоязычной литературе иногда используются обозначения R-энантиомер для D-формы и S-энантиомер для L-формы. Это лишь небольшие номенклатурные различия, обозначающие абсолютные и относительные конфигурации. Источник
Суть токсического действия талидомида (злого брата-энантиомера) заключалась в том, что он подобно иприту встраивался в ДНК. Хотя это лишь один из множества обнаруженных механизмов ядовитого действия, но в ситуации, когда у вас присутствует растущая не по дням, а по часам масса постоянно делящихся клеток, именно это оказывается критичным.
Череда трагических событий и инвалидностей, вызванных этим препаратом, названа талидомидной трагедией. Самое интересное, что компания-производитель совсем не разорилась на выплатах пострадавшим, более того — Grünenthal до сих пор прекрасно здравствует и процветает, занимаясь производством опиоидного анальгетика трамадола.
Ну и иногда еще отстегивает с барского плеча жалкие 50 млн евро различным организациям инвалидов.
Еще, конечно же, наша «любимая» FDA ввела несколько дополнительных обязательных тестов на тератогенность, чье проведение до талидомидной трагедии оставалось лишь на совести фармкомпаний.
Кетамин: галлюциноген, антидепрессант или снотворное?
Помимо этого, существует еще масса случаев, когда расположение одного-двух атомов в молекуле оказывалось критичным, например, при синтезе циталопрама и эсциталопрама (L-изомера).
Второй отличается от первого большей аффинностью (селективностью) к серотониновому транспортеру, закачивающему серотонин обратно в нейрон после выброса. При заблокированном транспортере время нахождения серотонина в межсинаптическом пространстве возрастает, соответственно, возрастают и антидепрессивные эффекты лекарственного препарата.
Из других перспективных антидепрессантов можно упомянуть кетамин, который до этого применялся исключительно для общего наркоза. Он также существует в виде двух оптических изомеров — аркетамин (R-кетамин) и эскетамин (S-кетамин).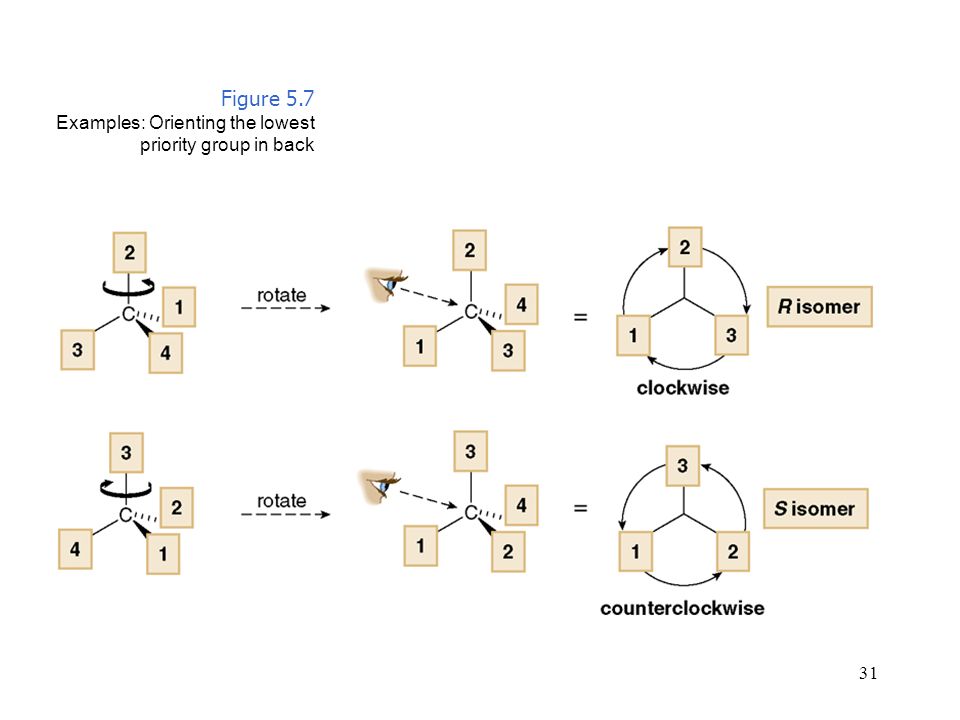 Долгое время врачи и фармакологи не обращали внимания на различия между рацематом и моноприменением отдельных форм, но сейчас, когда это вещество активно исследуется в качестве антидепрессанта и для лечения различного рода тревожных расстройств, этим различиям стали уделять больше внимания.
Долгое время врачи и фармакологи не обращали внимания на различия между рацематом и моноприменением отдельных форм, но сейчас, когда это вещество активно исследуется в качестве антидепрессанта и для лечения различного рода тревожных расстройств, этим различиям стали уделять больше внимания.
Источник
Аркетамин более чем в 4 раза менее активен, чем эскетамин, относительно NMDA-рецепторов, чья блокада и является причиной феерических галлюцинаций.
В свою очередь R-изомер имеет два уникальных свойства: активация AMPA-рецепторов (рецепторы, активируемые в обычных условиях глутаматом и участвующие в формировании так называемой долговременной потенциации — одной из биологических основ процесса запоминания) и образование уникального метаболита, характерного только для аркетамина — (2R,6R)-HNK. Этот метаболит, называемый по-простому гидроксиноркетамин, а точнее, его R-стереоизомер, является умеренно сильным психостимулятором и хорошим антидепрессантом.
Стоит также упомянуть его брата-близнеца — эскетамин. Он является более потентным NMDA-антагонистом и ингибитором обратного захвата дофамина. Вы скажете, что это хорошо — насчет дофамина, — и будете не правы. Когда этого нейромедиатора очень много, то человек начинает, мягко говоря, чувствовать себя не в этой реальности. Как пример можно привести белую горячку — по своему механизму это патологическое состояние частично напоминает эффекты от введения чистого эскетамина.
Однако если пациенту будет введено очень много эскетамина, то он впадет в весьма мягкий (с точки зрения переносимости) наркоз, после выхода из которого у человека практически полностью будет отсутствовать постнаркозное возбуждение, которое довольно часто наблюдается при использовании «классического» рацемического кетамина.
И это — лишь крупица всех возможных примеров разницы между биологической активностью оптических изомеров лекарственных веществ. В настоящее время ведется множество клинических испытаний, которые должны выявить эти самые клинически значимые различия в активности у веществ, которые до этого использовались лишь в виде рацемических смесей.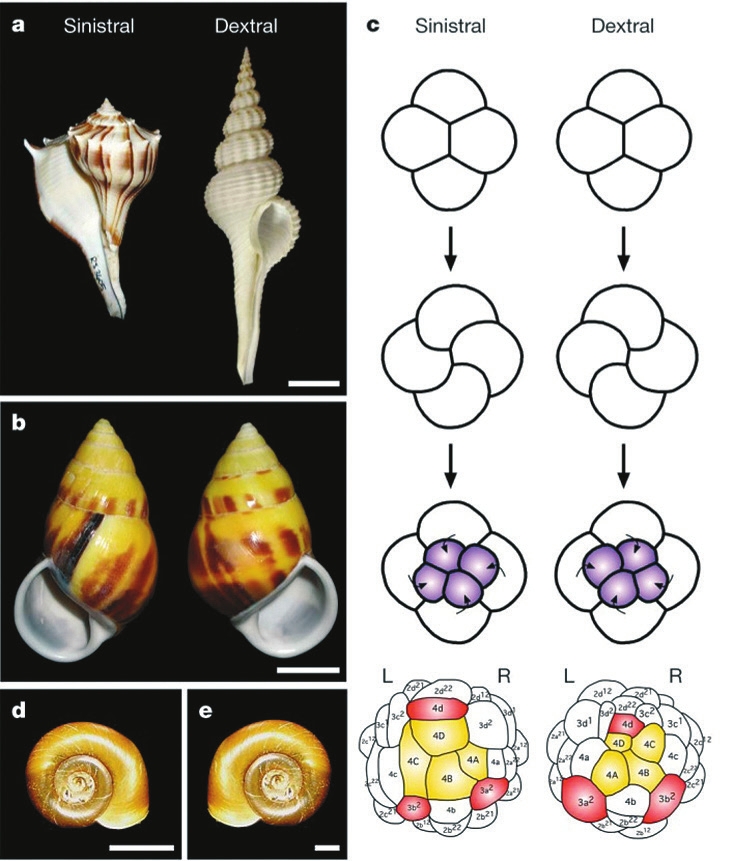
Причем эти различия по своей силе могут быть как ничтожны (с пациентом ничего угрожающего не случится, если он употребит циталопрам вместо эсциталопрама), так и весьма важны, как в случае с талидомидом.
5.1: Хиральные молекулы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 32358
Цели
После завершения этого раздела вы сможете
- используют молекулярные модели, чтобы показать, что только тетраэдрический атом углерода удовлетворительно объясняет отсутствие изомерии в молекулах типа CH 2 XY и наличие оптической изомерии в молекулах типа CHXYZ.
- определяют, являются ли две по-разному ориентированные структуры из клиновидных и пунктирных линий идентичными или представляют собой пару энантиомеров.

Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
- энантиомер
Учебные заметки
Стереоизомеры — это изомеры, которые различаются пространственным расположением атомов, а не порядком соединения атомов. Один из наиболее интересных типов изомеров — стереоизомер зеркального отображения, представляющий собой несовместимый набор двух молекул, являющихся зеркальным отражением друг друга. Существование этих молекул определяется концепцией, известной как хиральность . Слово «хиральный» произошло от греческого слова «рука», потому что наши руки — хороший пример хиральности, поскольку они являются не накладываемыми друг на друга зеркальными отражениями.
Хиральные молекулы
Термин хиральный , от греческого слова «рука», относится ко всему, что не может быть наложено на свое собственное зеркальное отражение. Некоторые органические молекулы являются хиральными, что означает, что они не накладываются на свое зеркальное отражение. Хиральные молекулы содержат один или несколько хиральных центров , которые почти всегда представляют собой тетраэдрические ( sp 3 -гибридизированные) атомы углерода с четырьмя различными заместителями. Рассмотрим молекулу А ниже: тетраэдрический углерод с четырьмя разными заместителями, обозначенными шариками четырех разных цветов.
Хиральные молекулы содержат один или несколько хиральных центров , которые почти всегда представляют собой тетраэдрические ( sp 3 -гибридизированные) атомы углерода с четырьмя различными заместителями. Рассмотрим молекулу А ниже: тетраэдрический углерод с четырьмя разными заместителями, обозначенными шариками четырех разных цветов.
Зеркальное отражение А, которое мы будем называть Б, нарисовано в правой части рисунка, а воображаемое зеркало находится посередине. Обратите внимание, что каждая точка на A совпадает с той же точкой на B в зеркале: другими словами, если бы A посмотрела в зеркало, она увидела бы, что B смотрит назад.
Теперь, если мы перевернем соединение A и попытаемся наложить его точку за точкой на соединение B, мы обнаружим, что не можем этого сделать: если мы наложим любые два цветных шара, то два других сместятся.
A не накладывается на свое зеркальное отображение (B), поэтому по определению A является хиральной молекулой. Отсюда следует, что B также не накладывается на своего зеркального отображения (A) и, следовательно, также является хиральной молекулой.
Отсюда следует, что B также не накладывается на своего зеркального отображения (A) и, следовательно, также является хиральной молекулой.
A и B называются стереоизомерами или оптическими изомерами : молекулы с одинаковой молекулярной формулой и одинаковым расположением связей, но различным расположением атомов в пространстве . Энантиомеры представляют собой пары стереоизомеров, которые являются зеркальным отображением друг друга: таким образом, А и В являются энантиомерами. Должно быть самоочевидно, что хиральная молекула всегда будет иметь одну (и только один) энантиомер: энантиомеры идут парами. Энантиомеры имеют одинаковые физические свойства (температура плавления, температура кипения, плотность и т. д.). Однако энантиомеры различаются по тому, как они взаимодействуют с поляризованным светом (мы скоро узнаем об этом больше), и они также могут совершенно по-разному взаимодействовать с другими хиральными молекулами, например с белками.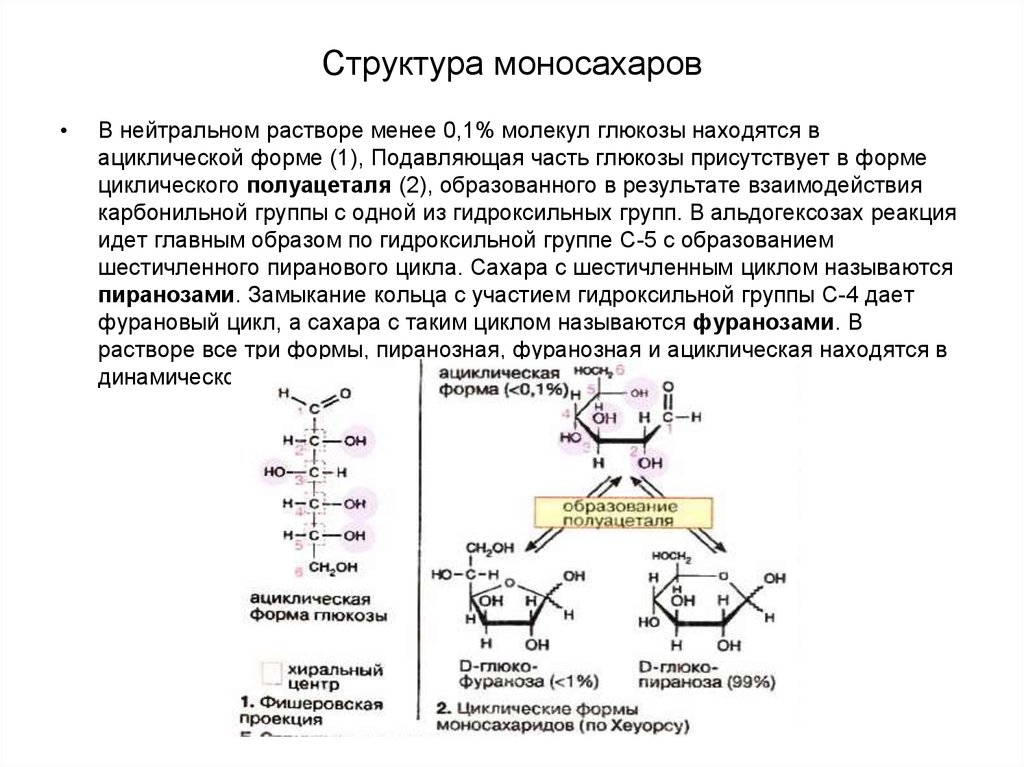 Мы начнем исследовать эту последнюю идею позже в этой главе и увидим множество примеров в оставшейся части нашего изучения биологической органической химии.
Мы начнем исследовать эту последнюю идею позже в этой главе и увидим множество примеров в оставшейся части нашего изучения биологической органической химии.
Множество синонимов хирального углерода
Имейте в виду — все следующие термины могут использоваться для описания хирального углерода.
хиральный углерод = асимметричный углерод = оптически активный углерод = стереоуглерод = стереоцентр = хиральный центр
Давайте применим наше обсуждение хиральности к реальным молекулам.
Рассмотрим 2-бутанол, изображенный в двух измерениях ниже.
Углерод №2 является хиральным центром: он sp 3 -гибридизированный и тетраэдрический (хотя выше он не изображен таким образом), и четыре заместителя, присоединенные к нему, различны: водород (H ), метил (-CH 3 ), этильную группу (-CH 2 CH 3 ) и гидроксильную (ОН) группу. Если связь С 2 2-бутанола изобразить в трех измерениях и эту структуру назвать А. Тогда зеркальное отображение А можно нарисовать, чтобы сформировать структуру В.
Тогда зеркальное отображение А можно нарисовать, чтобы сформировать структуру В.
Когда мы пытаемся наложить А на В, мы обнаруживаем, что не можем этого сделать. Поскольку структуры A и B не накладываются друг на друга в своем зеркальном отображении, они обе являются хиральными молекулами. Поскольку А и В различаются только расположением атомов в пространстве, они являются стереоизомерами. Поскольку А и В являются зеркальными отображениями друг друга, они также являются энантиомерами. При взгляде на упрощенные линейные структуры становится ясно, что существует два различных способа рисования 2-бутанола, которые отличаются только своим пространственным расположением вокруг хирального углерода.
Трехмерные структуры двух энантиомеров 2-бутанола
Для сравнения, 2-пропанол является ахиральной молекулой, поскольку в нем отсутствует хиральный углерод. Углерод № 2 связан с двумя идентичными заместителями (метальными группами), поэтому он не является хиральным углеродом. Ахиральность означает, что 2-пропанол должен накладываться на его зеркальное отображение, как показано на рисунке ниже. Более подробное объяснение того, почему 2-пропанол является ахиральным, будет дано в следующем разделе.
Ахиральность означает, что 2-пропанол должен накладываться на его зеркальное отображение, как показано на рисунке ниже. Более подробное объяснение того, почему 2-пропанол является ахиральным, будет дано в следующем разделе.
2-пропанол является ахиральным:
Стереоизомеры
Стереоизомеры определяются как молекулы с одинаковыми связями, но различным расположением атомов в пространстве. Важно отметить, что существует два типа стереоизомеров: геометрические и оптические.
Оптические изомеры представляют собой молекулы, структуры которых являются зеркальными отображениями, но не могут быть наложены друг на друга в любой ориентации. Оптические изомеры имеют идентичные физические свойства, хотя их химические свойства могут различаться в асимметричных средах. Молекулы, которые не накладываются друг на друга, называются хиральными. 25.7.1a» роль=»презентация» tabindex=»0″>
Геометрические изомеры различаются относительным положением(ями) заместителей в жесткой молекуле. Простое вращение вокруг σ-связи C–C в алкене, например, не может происходить из-за наличия π-связи. Таким образом, заместители жестко привязаны к определенному пространственному расположению. Таким образом, кратная углерод-углеродная связь или, в некоторых случаях, кольцо предотвращает легкое превращение одного геометрического изомера в другой. Члены изомерной пары идентифицируются как цис- или транс-, и взаимопревращение между двумя формами требует разрыва и восстановления одной или нескольких связей. Поскольку их структурные различия приводят к тому, что они имеют разные физические и химические свойства, цис- и транс-изомеры на самом деле являются двумя разными химическими соединениями. Меры имеют одинаковую связь, но разное расположение атомов в пространстве. Более подробно геометрические изомеры будут обсуждаться в Разделы 7.4 и 7.5 .
Простое вращение вокруг σ-связи C–C в алкене, например, не может происходить из-за наличия π-связи. Таким образом, заместители жестко привязаны к определенному пространственному расположению. Таким образом, кратная углерод-углеродная связь или, в некоторых случаях, кольцо предотвращает легкое превращение одного геометрического изомера в другой. Члены изомерной пары идентифицируются как цис- или транс-, и взаимопревращение между двумя формами требует разрыва и восстановления одной или нескольких связей. Поскольку их структурные различия приводят к тому, что они имеют разные физические и химические свойства, цис- и транс-изомеры на самом деле являются двумя разными химическими соединениями. Меры имеют одинаковую связь, но разное расположение атомов в пространстве. Более подробно геометрические изомеры будут обсуждаться в Разделы 7.4 и 7.5 .
Упражнение \(\PageIndex{1}\)
Определите следующие молекулы как хиральные или ахиральные.
- Ответить
а) хиральный (4 разные группы от С)
b) ахиральный (2 идентичных -CH 3 заместителя вне центральной C)
c) ахиральный (2 идентичных -CH 2 CH 3 заместителей вне центральной C)
г) ахиральный (2 идентичных СН 3 заместители, не содержащие углерода 2)
e) хиральный (4 разные группы углерода 2)
f) ахиральный (2 идентичных CH 3 заместителя вне центрального C)
Упражнение \(\PageIndex{2}\)
Определите, являются ли следующие наборы соединений в каждой группе энантиомерами или одним и тем же соединением.
- Ответить
а) энантиомеры – несовместимые зеркальные изображения
б) то же соединение – при вращении молекулы справа она идентична молекуле слева
в) энантиомеры – не накладывающиеся зеркальные изображения
г) энантиомеры – не накладывающиеся друг на друга зеркальные изображения
Цели
После завершения этого раздела вы сможете
- определить, является ли соединение хиральным, учитывая его структуру Келюле, конденсированную или сокращенную структуру, с помощью молекулярных моделей или без них.
- обозначают хиральные центры (атомы углерода) в данной Келюле, конденсированной или сокращенной структуре.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте ключевые термины ниже.
- ахиральный
- хиральный
- хиральный (стереогенный) центр
- плоскость симметрии
Симметрия и хиральность
Молекулы, которые не накладываются друг на друга, называются хиральными (произносится как «ky-ral» от греческого cheir, что означает «рука»). Примерами некоторых знакомых хиральных объектов являются ваши руки. Ваши левая и правая руки — несовместимые зеркальные отображения. (Попробуйте надеть правый ботинок на левую ногу — это просто не работает.) Ахиральный объект — это объект, который можно наложить на свое зеркальное отражение, как показано наложенными колбами 25.7.1b на рисунке ниже. 25.7.1б.
Примерами некоторых знакомых хиральных объектов являются ваши руки. Ваши левая и правая руки — несовместимые зеркальные отображения. (Попробуйте надеть правый ботинок на левую ногу — это просто не работает.) Ахиральный объект — это объект, который можно наложить на свое зеркальное отражение, как показано наложенными колбами 25.7.1b на рисунке ниже. 25.7.1б.
Важный вопрос: почему один хиральный, а другой нет? Ответ заключается в том, что у колбы есть плоскость симметрии, а у вашей руки — нет. Плоскость симметрии — это плоскость или линия, проходящая через объект, которая делит объект на две половины, являющиеся зеркальным отражением друг друга. Глядя на колбу, посередине можно провести линию, которая разделяет ее на две зеркальные половины. Однако аналогичная линия посередине руки разделяет ее на две незеркальные половины. Эту идею можно использовать для предсказания хиральности. Если объект или молекула имеют плоскость симметрии, они ахиральны. Если у него нет плоскости симметрии, он хиральный.
Симметрию можно использовать для объяснения того, почему углерод, связанный с четырьмя различными заместителями, является хиральным. Когда углерод связан менее чем с четырьмя различными заместителями, он будет иметь плоскость симметрии, делающую его ахиральным. Атом углерода, который связан с четырьмя различными заместителями, теряет всю симметрию, и его часто называют асимметричным углеродом. Отсутствие плоскости симметрии делает углерод хиральным. Наличие одного хирального атома углерода достаточно, чтобы сделать молекулу хиральной, и современная терминология относится к таким группировкам, как хиральные центры или стереоцентры.
Пример показан в молекуле бромхлорфторметана, показанной в части (a) рисунка ниже. Этот углерод связан с четырьмя различными заместителями, что делает его хиральным. который часто обозначается звездочкой на структурных чертежах. Если атом брома заменить другим атомом хлора, чтобы получить дихлорфторметан, как показано в части (b) ниже, молекула и ее зеркальное отражение теперь могут быть наложены друг на друга простым вращением.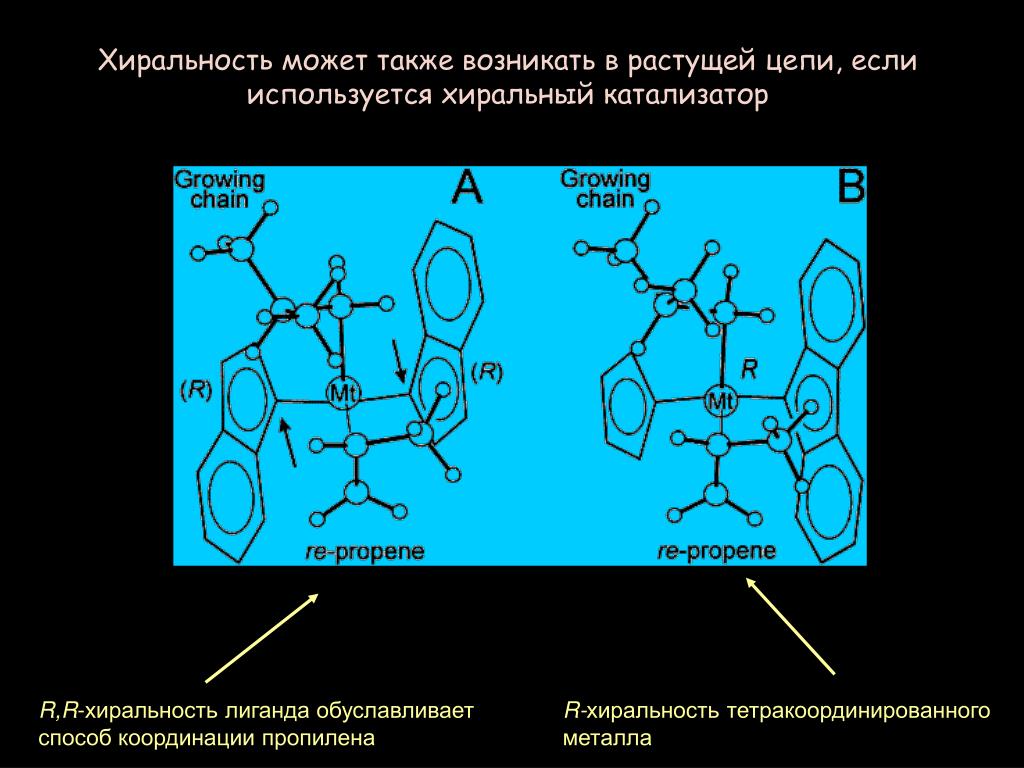 Таким образом, углерод больше не является хиральным центром. Для сравнения, у бромхлорфторметана отсутствует плоскость симметрии, а у дихлорфторметана плоскость симметрии есть.
Таким образом, углерод больше не является хиральным центром. Для сравнения, у бромхлорфторметана отсутствует плоскость симметрии, а у дихлорфторметана плоскость симметрии есть.
Идентификация хиральных атомов углерода
Идентификация хиральных атомов углерода в молекуле является важным навыком для химиков-органиков. Присутствие хирального углерода дает возможность молекуле иметь несколько стереоизомеров. Большинство хиральных центров, которые мы будем обсуждать в этой главе, представляют собой асимметричные атомы углерода, но следует признать, что другие тетраэдрические или пирамидальные атомы могут стать хиральными центрами при соответствующей замене. Кроме того, когда в молекулярной структуре присутствует более одного хирального центра, необходимо тщательно проанализировать их взаимосвязь, прежде чем сделать вывод о том, что конкретная молекулярная конфигурация является хиральной или ахиральной. Этот аспект стереоизомерии будет рассмотрен позже.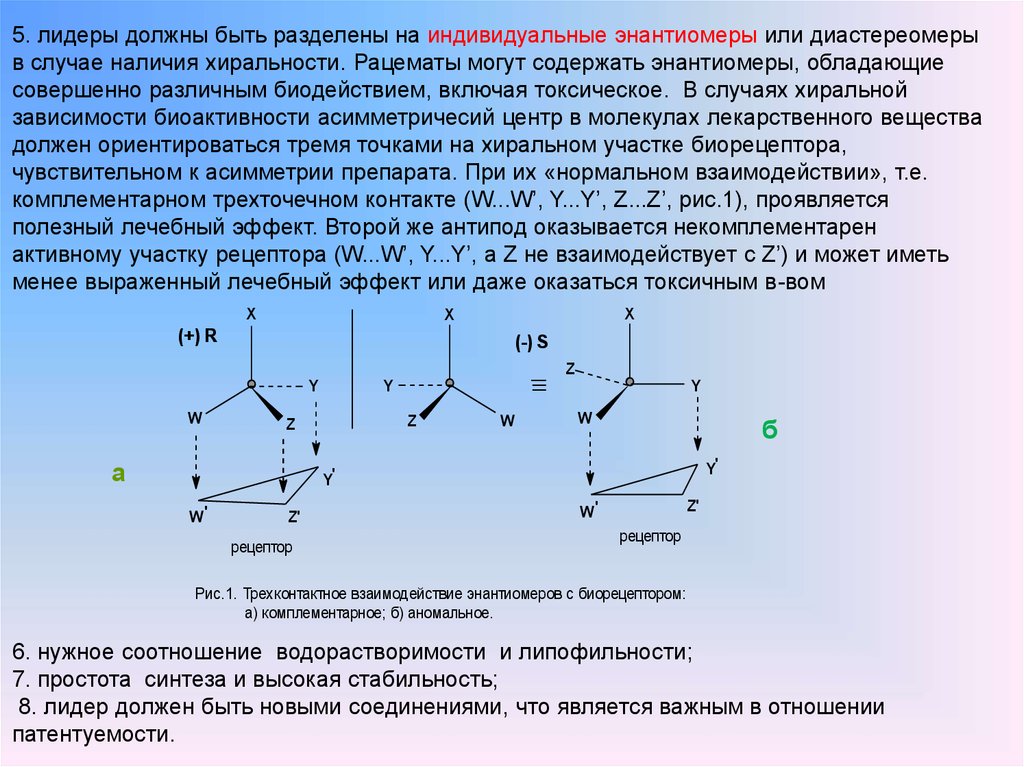 Поскольку углерод требует четырех различных заместителей, чтобы стать асимметричным, можно сказать, за немногими исключениями, что sp 2 и sp гибридизованные атомы углерода, участвующие в кратных связях, являются ахиральными. Кроме того, любой углерод с более чем одним водородом, такой как группа -CH 3 или -CH 2 -, также является ахиральным.
Поскольку углерод требует четырех различных заместителей, чтобы стать асимметричным, можно сказать, за немногими исключениями, что sp 2 и sp гибридизованные атомы углерода, участвующие в кратных связях, являются ахиральными. Кроме того, любой углерод с более чем одним водородом, такой как группа -CH 3 или -CH 2 -, также является ахиральным.
Поиск плоскостей симметрии в молекуле полезен, но на практике часто сложен. Это трудно проиллюстрировать на двухмерной странице, но если вы построите модели этих ахиральных молекул, вы увидите, что в каждом случае существует по крайней мере одна плоскость симметрии , где одна сторона плоскости является зеркальным отражением другого. В большинстве случаев самый простой способ определить, является ли молекула хиральной или ахиральной, — это найти один или несколько стереоцентров — за несколькими редкими исключениями общее правило состоит в том, что молекулы, имеющие хотя бы один стереоцентр, являются хиральными, а молекулы без стереоцентров являются ахиральными.
Часто бывает трудно определить, связан ли углерод с четырьмя совершенно разными заместителями. Помните, что даже малейшее различие делает заместитель уникальным. Часто эти различия могут быть далеки от самого хирального углерода. Может потребоваться тщательное рассмотрение и часто построение молекулярных моделей. Хороший пример показан ниже. Может показаться, что молекула ахиральна, однако, если посмотреть на группы, непосредственно присоединенные к возможному хиральному углероду, становится ясно, что все они разные. Две алкильные группы отличаются одним -CH 2 — группа, которой достаточно, чтобы считать их разными.
Пример \(\PageIndex{1}\)
Предскажите, будет ли следующая молекула хиральной или ахиральной:
- Ответ
Ахирал. При определении хиральности молекулы лучше всего начать с определения местоположения любых хиральных атомов углерода. Очевидным кандидатом является кольцевой углерод, присоединенный к метильному заместителю.
 Тогда возникает вопрос: делает ли кольцо в виде двух разных заместителей хиральным замещенный углерод кольца? При такой неопределенности полезно попытаться идентифицировать любые плоскости симметрии в молекуле. Эта молекула имеет плоскость симметрии, что делает молекулу ахиральной. Плоскость симметрии было бы легче увидеть, если бы молекула рассматривалась сверху. Как правило, монозамещенные циклоалканы имеют одинаковую плоскость симметрии, что делает их все ахиральными.
Тогда возникает вопрос: делает ли кольцо в виде двух разных заместителей хиральным замещенный углерод кольца? При такой неопределенности полезно попытаться идентифицировать любые плоскости симметрии в молекуле. Эта молекула имеет плоскость симметрии, что делает молекулу ахиральной. Плоскость симметрии было бы легче увидеть, если бы молекула рассматривалась сверху. Как правило, монозамещенные циклоалканы имеют одинаковую плоскость симметрии, что делает их все ахиральными.
Упражнение 5.2.1
Определите, является ли каждая из следующих молекул хиральной или ахиральной. Для хиральных молекул указывают любые хиральные атомы углерода.
- Ответить
Пояснение
Структуры F и G ахиральны. Первый имеет плоскость симметрии, проходящую через атом хлора и делящую пополам противоположную углерод-углеродную связь. Подобная структура соединения Е не имеет такой плоскости симметрии, а углерод, связанный с хлором, является хиральным центром (два сегмента кольца, соединяющие этот углерод, не идентичны).
 Структура G по существу плоская. Все атомы углерода, кроме метильной группы, равны 9.0056 sp 2 гибридизированы и поэтому имеют тригонально-плоскую конфигурацию. Соединения C, D и H имеют более одного хирального центра и также являются хиральными.
Структура G по существу плоская. Все атомы углерода, кроме метильной группы, равны 9.0056 sp 2 гибридизированы и поэтому имеют тригонально-плоскую конфигурацию. Соединения C, D и H имеют более одного хирального центра и также являются хиральными.
Примечание
В 1960-х годах в Западной Европе для облегчения утренней тошноты беременным женщинам широко прописывали препарат под названием талидомид.
Талидомид ранее использовался в других странах в качестве антидепрессанта и считался безопасным и эффективным для обеих целей. Препарат не был одобрен для использования в США. Однако вскоре врачи поняли, что что-то пошло не так: многие дети, рожденные женщинами, принимавшими талидомид во время беременности, страдали тяжелыми врожденными дефектами.
Позднее исследователи поняли, что проблема заключалась в том, что талидомид поставлялся в виде смеси двух разных изомерных форм.
Один из изомеров является эффективным лекарством, другой вызывает побочные эффекты.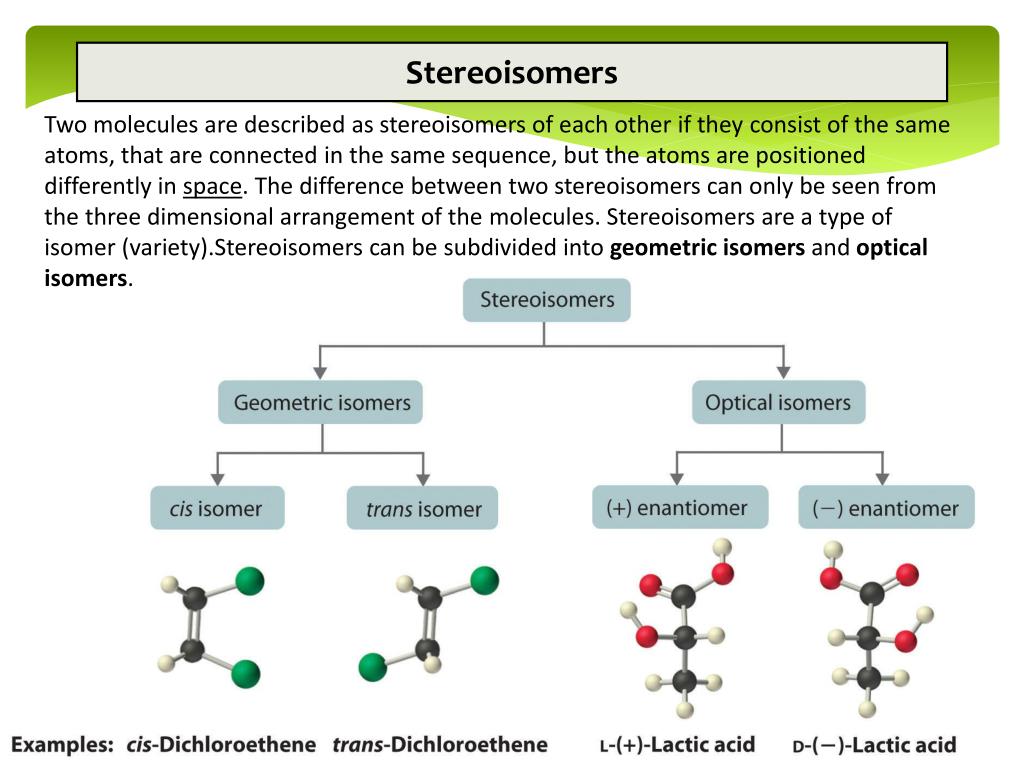 Обе изомерные формы имеют одинаковую молекулярную формулу и одинаковую связь между атомами, поэтому они не являются конституционными изомерами. Они отличаются расположением в трехмерном пространстве около одного тетраэдра, sp 3 -гибридизированного углерода. Эти две формы талидомида стереоизомеры . Если вы сделаете модели двух стереоизомеров талидомида, вы увидите, что они тоже являются зеркальными отображениями и не могут быть наложены друг на друга.
Обе изомерные формы имеют одинаковую молекулярную формулу и одинаковую связь между атомами, поэтому они не являются конституционными изомерами. Они отличаются расположением в трехмерном пространстве около одного тетраэдра, sp 3 -гибридизированного углерода. Эти две формы талидомида стереоизомеры . Если вы сделаете модели двух стереоизомеров талидомида, вы увидите, что они тоже являются зеркальными отображениями и не могут быть наложены друг на друга.
Напомним, талидомид никогда не был одобрен для использования в Соединенных Штатах. Во многом это произошло благодаря усилиям доктора Фрэнсис Келси, специалиста по контролю за продуктами и лекарствами, которая, рискуя своей карьерой, заблокировала его одобрение из-за своей обеспокоенности по поводу отсутствия адекватных исследований безопасности, особенно в отношении способности препарата. попасть в кровоток развивающегося плода. К сожалению, в то время клинические испытания новых лекарств включали широкое и нерегулируемое распространение среди врачей и их пациентов по всей стране, поэтому семьи в США не были избавлены от нанесенного ущерба.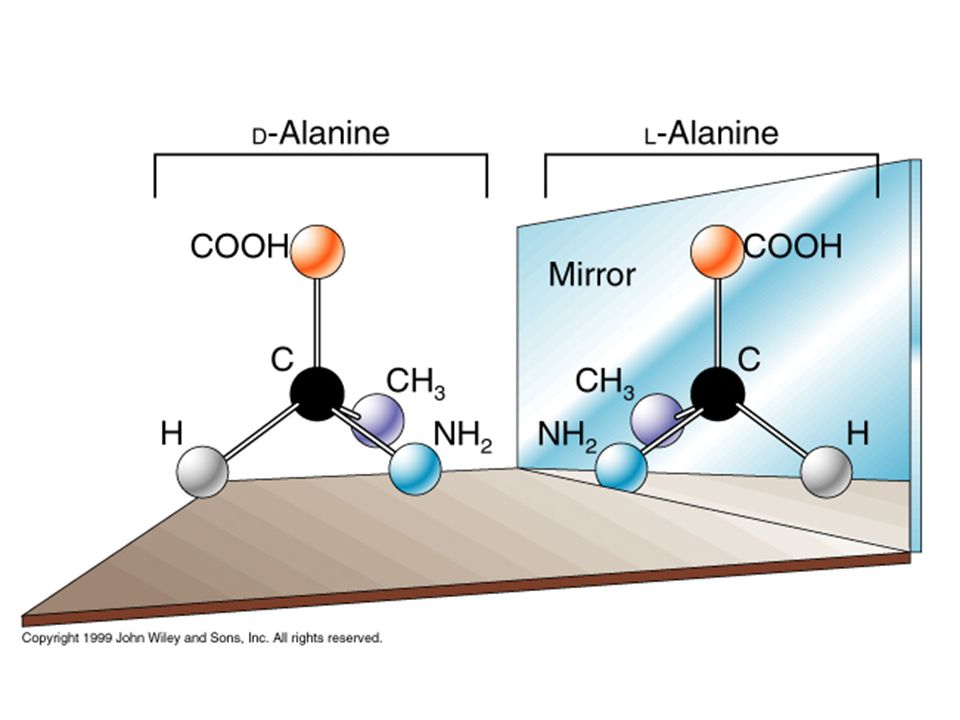
Совсем недавно близкое производное талидомида стало законным для повторного назначения в Соединенных Штатах, со строгими мерами безопасности, для лечения формы рака крови, называемой множественной миеломой. В Бразилии талидомид используется для лечения проказы, но, несмотря на меры безопасности, дети все еще рождаются с дефектами, связанными с талидомидом.
Пример 5.2.2
Обозначьте указанные ниже молекулы как хиральные или ахиральные и найдите все стереоцентры.
- Ответить
Упражнение 5.2.2
1) Для следующих соединений пометьте звездочкой (*) каждый хиральный центр, если он есть.
2) Объясните, почему следующее соединение является хиральным.
3) Определите, какой из следующих объектов является хиральным.
а) Перчатка.
б) Гвоздь.
c) Пара солнцезащитных очков.
г) Написанное слово «Хирал».
4) Поставьте «*» рядом со всеми хриальными атомами углерода в следующих молекулах.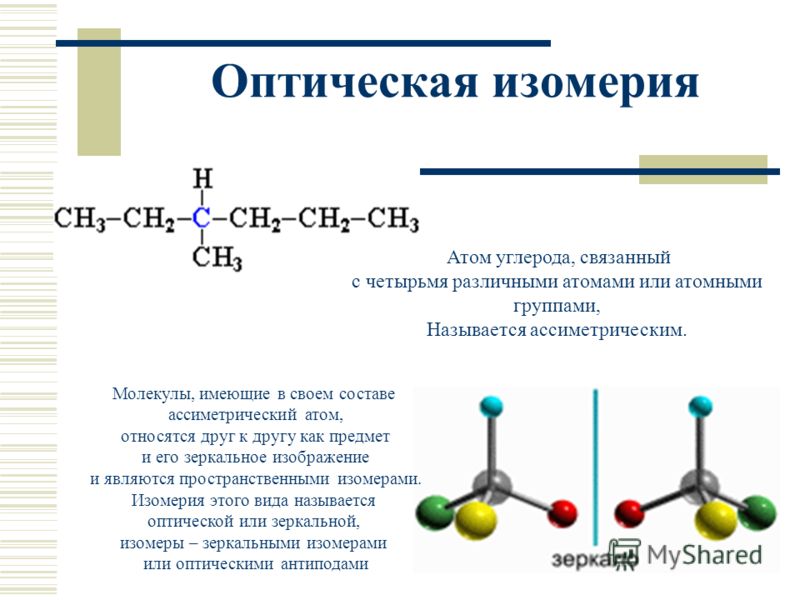
а)
Эритроза, четырехуглеродный сахар.
б) Изофлуран, анестетик. Ярко-зеленый = хлор, бледно-зеленый = фтор.
- Ответить
1)
2) Хотя молекула не содержит хирального углерода, она является хиральной, так как не накладывается на свое зеркальное отражение из-за своей закрученной природы (закрученность возникает из-за структуры двойных связей, которые должны находиться в положении 9под углом 0° друг к другу, что препятствует тому, чтобы молекула была плоской).
3)
а) Как руки хиральны, так и перчатка должна быть хиральна.
б) Гвоздь имеет плоскость симметрии, которая идет вниз посередине, что делает его ахиральным.
c) Пара солнцезащитных очков имеет плоскость симметрии, которая проходит через нос, что делает его ахиральным.
г) Большинство написанных слов хиральны. Посмотрите в зеркало, чтобы убедиться в этом.

4
а)
б)
Упражнение 5.2.3
Обведите все углеродные стереоцентры в молекулах ниже.
- Ответить
Упражнение 5.2.4
Обведите все углеродные стереоцентры в молекулах ниже.
- Ответить
Вот еще несколько примеров хиральных молекул, которые существуют в виде пар энантиомеров. В каждом из этих примеров имеется единственный стереоцентр, указанный стрелкой. (Многие молекулы имеют более одного стереоцентра, но до этого мы доберемся чуть позже!)
Вот несколько примеров молекул, которые являются ахиральными ( не хиральными). Обратите внимание, что ни одна из этих молекул не имеет стереоцентра.
Это трудно проиллюстрировать на двумерной странице, но если вы построите модели этих ахиральных молекул, вы увидите, что в каждом случае существует по крайней мере одна плоскость симметрии , где одна сторона плоскости является зеркальным отражением другого. Хиральность концептуально связана с идеей асимметрии, и любая молекула, имеющая плоскость симметрии, не может быть хиральной . Однако при поиске плоскости симметрии мы должны учитывать все возможные конформации, которые может принять молекула. Даже очень простая молекула, такая как этан, например, асимметрична во многих своих бесчисленных потенциальных конформациях, но она имеет очевидную симметрию как в затененной, так и в шахматной конформациях, и по этой причине она ахиральна.
Хиральность концептуально связана с идеей асимметрии, и любая молекула, имеющая плоскость симметрии, не может быть хиральной . Однако при поиске плоскости симметрии мы должны учитывать все возможные конформации, которые может принять молекула. Даже очень простая молекула, такая как этан, например, асимметрична во многих своих бесчисленных потенциальных конформациях, но она имеет очевидную симметрию как в затененной, так и в шахматной конформациях, и по этой причине она ахиральна.
Поиск плоскостей симметрии в молекуле полезен, но на практике часто сложен. В большинстве случаев самый простой способ определить, является ли молекула хиральной или ахиральной, — это найти один или несколько стереоцентров. За несколькими редкими исключениями (см. раздел 3.7B) общее правило состоит в том, что молекулы, имеющие хотя бы один стереоцентр, являются хиральными. , а молекулы без стереоцентров ахиральны. Углеродные стереоцентры также довольно часто называют хиральные атомы углерода .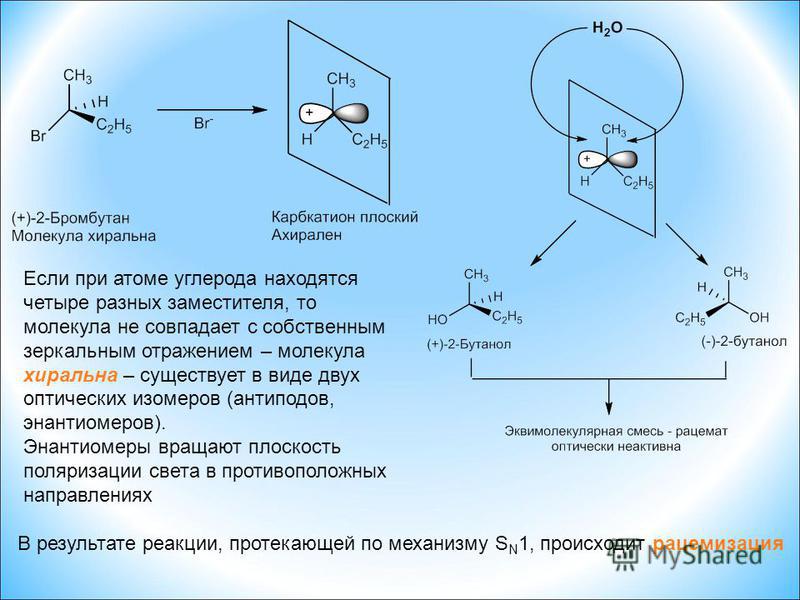
При оценке молекулы на предмет хиральности важно понимать, что вопрос о том, используется ли штриховая/закрашенная линия клина, не имеет значения. Хиральные молекулы иногда рисуют без использования клиньев (хотя, очевидно, это означает, что стереохимическая информация опускается). И наоборот, клинья можно использовать для атомов углерода, не являющихся стереоцентрами — посмотрите, например, на рисунки глицина и цитрата на рисунке выше. Просто потому, что вы видите пунктирные и сплошные клинья в структуре, не следует автоматически предполагать, что вы смотрите на стереоцентр.
Другие элементы помимо углерода могут быть стереоцентрами. Фосфорный центр иона фосфата и органических эфиров фосфорной кислоты, например, имеет тетраэдрическую форму и, таким образом, потенциально является стереоцентром.
В главе 10 мы увидим, как исследователи для изучения стереохимии реакций в фосфатном центре включали серу и/или 17 O и 18 O изотопы кислорода («нормальный» изотоп 16 O) для создания хиральных фосфатных групп.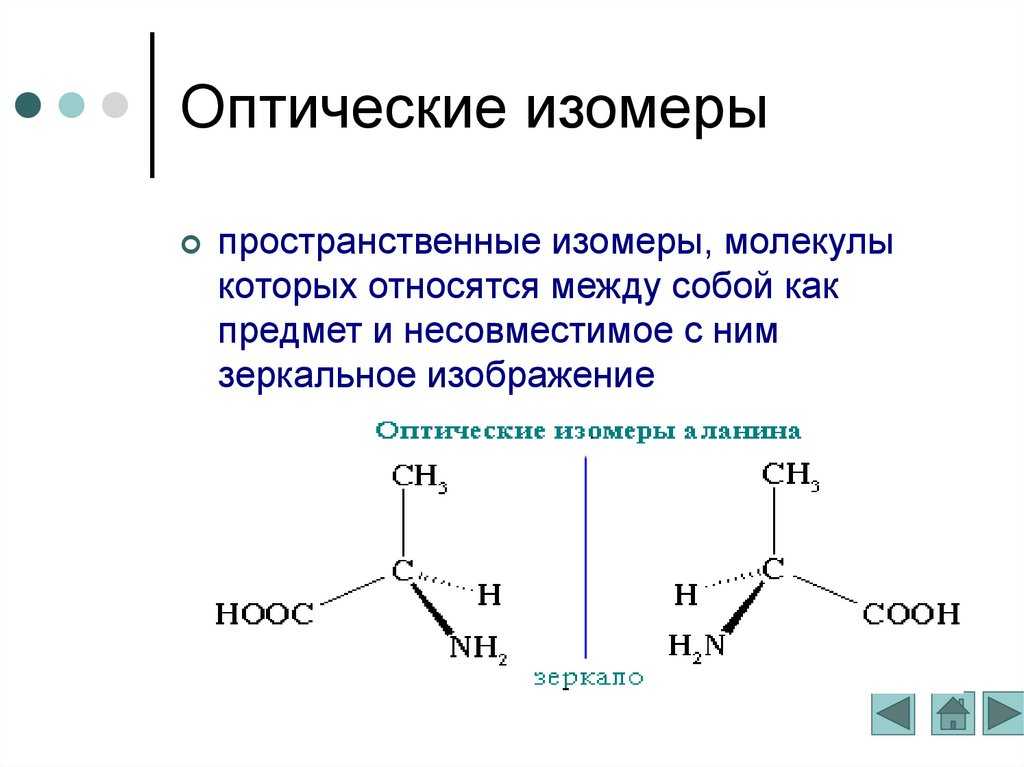 Триэфиры фосфатов являются хиральными, если три группы заместителей различны.
Триэфиры фосфатов являются хиральными, если три группы заместителей различны.
Асимметричные четвертичные аммониевые группы также являются хиральными. Однако амины не являются хиральными, поскольку они быстро инвертируются или выворачиваются «наизнанку» при комнатной температуре.
Упражнение 5.2.5
Обозначьте указанные ниже молекулы как хиральные или ахиральные и обведите все стереоцентры.
a) фумарат (промежуточный продукт цикла лимонной кислоты)
b) малат (промежуточный продукт цикла лимонной кислоты)
b) малат (промежуточный продукт цикла лимонной кислоты)
- Ответить
а) ахиральный (без стереоцентров)
б) хиральный
в) хиральный
Упражнение 5.2.6
Обозначьте указанные ниже молекулы как хиральные или ахиральные и обведите все стереоцентры. 1960 лет)
- Ответить
а) ахиральный (без стереоцентров)
б) ахиральные (без стереоцентров)
в) хиральный
Упражнение 5.
 2.7
2.7
Изобразите оба энантиомера следующих хиральных аминокислот.
а) Цистеин
б) Пролин
- Ответ
Упражнение 5.2.8
Нарисуйте оба энантиомера следующих соединений с данными названиями.
а) 2-бромбутан
б) 2,3-диметил-3-пентанол
- Ответ
Упражнение 5.2.9
Какие из следующих частей тела являются хиральными?
а) Руки б) Глаза в) Ноги г) Уши
- Ответ
а) хиральный, поскольку зеркальные изображения не могут быть наложены друг на друга (вспомните пример в начале раздела)
б) Глаза-ахиральные, поскольку зеркальные изображения накладываются друг на друга
c) Ноги хиральны, поскольку зеркальные изображения не могут быть наложены друг на друга (Ваша правая нога помещается в левый ботинок?)
г) ушной хиральный, поскольку зеркальные изображения не могут быть наложены друг на друга
Упражнение 5.
 2.10
2.10
Обведите хиральные центры в следующих соединениях.
- Ответить
Упражнение 5.2.11
Определите хиральные центры в следующих соединениях.
- Ответить
5.1: Chiral Molecules распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги

Хиральные молекулы и спин электрона
Либ, Э. Х. Стабильность материи: от атомов до звезд. Бык. Являюсь. Мат. соц. 22 , 1–49 (1990).
Google ученый
Дженкс В. С. и Турро Н. Дж. Перенос поляризации электронного спина между радикалами. Дж. Ам. хим. соц. 112 , 9009–9011 (1990).
КАС
Google ученый
Турро Н. Дж., Худяков И. В. Однофазный перенос первичной электронной спиновой поляризации в реакциях спинового захвата. Хим. физ. лат. 193 , 546–552 (1992).
КАС
Google ученый
Шайк, С., Чен, Х. и Джанарданан, Д. Повышенная обменная реактивность при активации связей металл-оксоферментами и синтетическими реагентами.
 Нац. хим. 3 , 19–27 (2011).
Нац. хим. 3 , 19–27 (2011).КАС
пабмедGoogle ученый
Naaman, R. & Waldeck, DH. Хирально-индуцированный эффект спиновой селективности. J. Phys. хим. лат. 3 , 2178–2187 (2012).
КАС
пабмедGoogle ученый
Нааман, Р. и Вальдек, Д. Х. Спинтроника и хиральность: спиновая селективность при переносе электронов через хиральные молекулы. Анна. Преподобный физ. хим. 66 , 263–281 (2015).
КАС
Google ученый
Се, З. и др. Спин-специфическая электронная проводимость через олигомеры ДНК. Нано Летт. 11 , 4652–4655 (2011).
КАС
пабмедGoogle ученый
Кармели И., Скакалова В., Нааман Р.
 и Вагер З. Намагничивание хиральных монослоев полипептида: возможный источник магнетизма в некоторых биологических мембранах. Анжю. хим. Междунар. Эд. 41 , 761–764 (2002).
и Вагер З. Намагничивание хиральных монослоев полипептида: возможный источник магнетизма в некоторых биологических мембранах. Анжю. хим. Междунар. Эд. 41 , 761–764 (2002).КАС
Google ученый
Кеттнер, М. и др. Спиновая фильтрация при транспорте электронов через хиральные олигопептиды. J. Phys. хим. C 119 , 14542–14547 (2015).
КАС
Google ученый
Цванг, Т.Дж., Хюрлиманн, С., Хилл, М.Г. и Бартон, Дж.К. Зависимая от спирали спиновая фильтрация через дуплекс ДНК. Дж. Ам. хим. соц. 138 , 15551–15554 (2016).
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Кеттнер, М. и др. Зависимая от хиральности фильтрация электронных спинов молекулярными монослоями гелиценов. J. Phys.
 хим. лат. 9 , 2025–2030 (2018).
хим. лат. 9 , 2025–2030 (2018).КАС
пабмедGoogle ученый
Экштайн-Леви, М. и др. Холодовая денатурация вызывает инверсию диполя и перенос спина в монослоях хиральных пептидов. Нац. коммун. 7 , 10744 (2016).
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Абендрот, Дж. М. и др. Анализ спиновой селективности в ДНК-опосредованном переносе заряда с помощью флуоресцентной микроскопии. ACS Nano 11 , 7516–7526 (2017).
КАС
пабмедGoogle ученый
Дор, О. Б., Йочелис, С., Олдаг, Х. и Палтиель, Ю. Исследование оптической хирально-индуцированной спиновой селективности XMCD. Chimia 72 , 379–383 (2018).
КАС
пабмедGoogle ученый
«>Хе Х., Чжоу Ю., Вэнь Х., Шпильман А. А. и Рен К. Влияние спиновой поляризации на зону отчуждения воды. J. Phys. хим. B 122 , 8493–8502 (2018).
КАС
пабмедGoogle ученый
Банерджи-Гош, К. и др. Разделение энантиомеров по их энантиоспецифическому взаимодействию с ахиральными магнитными субстратами. Наука 360 , 1331–1334 (2018).
КАС
пабмедGoogle ученый
Дор, О. Б. и др. Перемагничивание в ферромагнетиках адсорбированными хиральными молекулами без тока и внешнего магнитного поля. Нац. коммун.
 8 , 14567 (2017).
8 , 14567 (2017).ПабМед
ПабМед ЦентральныйGoogle ученый
Уэртас-Эрнандо Д., Гвинея Ф. и Братаас А. Спин-орбитальная связь в изогнутом графене, фуллеренах, нанотрубках и крышках нанотрубок. Физ. Ред. B 74 , 155426 (2006).
Google ученый
Мин, Х. и др. Собственные и рашба спин-орбитальные взаимодействия в листах графена. Физ. Ред. B 74 , 165310 (2006 г.).
Google ученый
Куэммет Ф., Илани С., Ральф Д. и МакЮэн П. Связь спинового и орбитального движения электронов в углеродных нанотрубках. Природа 452 , 448–452 (2008).
КАС
пабмедGoogle ученый
Steele, G. A. et al. Большое спин-орбитальное взаимодействие в углеродных нанотрубках.
 Нац. коммун. 4 , 1573 (2013).
Нац. коммун. 4 , 1573 (2013).КАС
пабмедGoogle ученый
Берш, Б., Мирелес, Ф. и Медина, Э. Рашба, спин-орбитальное взаимодействие, усиленное плоскостными деформациями графена. Конденс. Материя физ. 20 , 13702 (2017).
Google ученый
Михаэли, К. и Нааман, Р. Происхождение спин-зависимого туннелирования через хиральные молекулы. Препринт в arXiv https://arxiv.org/abs/1512.03435v2 (2016 г.).
Медина, Э., Гонсалес-Аррага, Л.А., Финкельштейн-Шапиро, Д., Берче, Б. и Мухика, В. Континуальная модель хирально индуцированной спиновой селективности в спиральных молекулах. J. Chem. физ. 142 , 194308 (2015).
ПабМед
Google ученый
Корецунэ, Т.
 , Арита, Р. и Аоки, Х. Магнито-орбитальный эффект без спин-орбитальных взаимодействий в нецентросимметричной углеродной структуре на основе цеолита. Физ. Ред. B 86 , 125207 (2012 г.).
, Арита, Р. и Аоки, Х. Магнито-орбитальный эффект без спин-орбитальных взаимодействий в нецентросимметричной углеродной структуре на основе цеолита. Физ. Ред. B 86 , 125207 (2012 г.).Google ученый
Егане С., Ратнер М. А., Медина Э. и Мухика В. Хиральный перенос электронов: рассеяние через спиральные потенциалы. J. Chem. физ. 131 , 014707 (2009).
ПабМед
Google ученый
Медина Э., Лопес Ф., Ратнер М. А. и Мухика В. Хиральные молекулярные пленки как поляризаторы электронов и модуляторы поляризации. Еврофиз. лат. 99 , 17006 (2012).
Google ученый
Гутьеррес Р., Диас Э., Нааман Р. и Куниберти Г. Спин-селективный транспорт через спиральные молекулярные системы. Физ. Ред. B 85 , 081404 (2012).

Google ученый
Гутьеррес, Р. и др. Моделирование спинового переноса в спиральных полях: вывод эффективного низкоразмерного гамильтониана. J. Phys. хим. C 117 , 22276–22284 (2013).
КАС
Google ученый
Guo, AM & Sun, QF. Спин-селективный перенос электронов в двойной спирали ДНК. Физ. Преподобный Летт. 108 , 218102 (2012).
ПабМед
Google ученый
Guo, AM & Sun, QF. Спин-зависимый транспорт электронов в белковоподобных односпиральных молекулах. Проц. Натл акад. науч. США 111 , 11658–11662 (2014).
КАС
пабмедGoogle ученый
Еремко А. А., Локтев В. М. Спин-чувствительное прохождение электронов через винтовые потенциалы Phys.
 Ред. B 88 , 165409 (2013).
Ред. B 88 , 165409 (2013).Google ученый
Рай, Д. и Гальперин, М. Электрически управляемые спиновые токи в ДНК. J. Phys. хим. C 117 , 13730–13737 (2013).
КАС
Google ученый
Герстен Дж., Каасбьерг К. и Ницан А. Индуцированная спиновая фильтрация при передаче электронов через хиральные молекулярные слои, адсорбированные на металлах с сильным спин-орбитальным взаимодействием. J. Chem. физ. 139 , 114111 (2013).
ПабМед
Google ученый
Кузьмин С. Л. и Дулей В. В. Свойства специфических электронных спиральных состояний приводят к эффекту спиновой фильтрации в молекулах двухцепочечной ДНК. Физ. лат. А 378 , 1674–1650 (2014).
Google ученый
«>Маслюк В.В., Гутьеррес Р., Дианат А., Мухика В. и Куниберти Г. Повышенное магнитосопротивление в хиральных молекулярных соединениях. J. Phys. хим. лат. 9 , 5453–5459 (2018).
КАС
пабмедGoogle ученый
Михаэли К., Вараде В., Нааман Р. и Вальдек Д. Новый подход к спинтронике – спинтроника без магнитов. J. Phys. Конденс. Материя 29 , 103002 (2017).
ПабМед
Google ученый
Aragonès, A.C. et al. Измерение мощности спиновой поляризации одиночной хиральной молекулы.
 Малый 13 , 1602519 (2017).
Малый 13 , 1602519 (2017).Google ученый
Михаэли К., Бератан Д. Н., Вальдек Д. Х. и Нааман Р. Индуцированный напряжением когерентный перенос электронов на большие расстояния через органические молекулы. Проц. Натл акад. науч. США , в печати (2019).
Кумар, А. и др. Спиновая поляризация, индуцированная хиральностью, накладывает ограничения симметрии на биомолекулярные взаимодействия. Проц. Натл акад. науч. США 114 , 2474–2478 (2017).
КАС
пабмедGoogle ученый
Роушан, П. и др. Топологические поверхностные состояния, защищенные от обратного рассеяния киральной спиновой текстурой. Природа 460 , 1106–1109 (2009).
КАС
пабмедGoogle ученый
«>Кармели, И., Кумар, К.С., Хейфлер, О., Кармели, К. и Нааман, Р. Спиновая селективность в переносе электронов в фотосистеме I. Angew. Chemie 53 , 8953–8958 (2014).
КАС
Google ученый
Михаэли К., Кантор-Уриэль Н., Нааман Р. и Вальдек Д. Х. Спин электрона и молекулярная хиральность: как они связаны и как влияют на жизненные процессы? Хим. соц. 45 , 6478–6487 (2016).
КАС
пабмедGoogle ученый
Тассинари, Ф. и др. Скорость переноса заряда в олигопептидах зависит от хиральности. Доп. Мат. 30 , 1706423 (2018).
Google ученый
«>Кай, М., Такеда, К., Морита, Т. и Кимура, С. Зависимость от расстояния переноса электронов на большие расстояния через спиральные пептиды. Дж. Пепт. науч. 14 , 192–202 (2008).
КАС
пабмедGoogle ученый
Сек С., Толак А., Мисицка А., Палис Б. и Билевич Р. Асимметрия прохождения электронов через монослои спирального полиаланина, адсорбированные на золотых поверхностях. J. Phys. хим. B 109 , 18433–18438 (2005).
КАС
пабмедGoogle ученый
Деккер, Дж. П. и Ван Гронделл, Р. Разделение первичного заряда в фотосистеме II. Фотосинтез.
 Рез. 63 , 195–208 (2000).
Рез. 63 , 195–208 (2000).КАС
пабмедGoogle ученый
Дуань Х.-Г. и другие. Первичное разделение зарядов в реакционном центре Фотосистемы II, выявленное глобальным анализом двумерных электронных спектров. наук. Респ. 7 , 12347 (2017).
ПабМед
ПабМед ЦентральныйGoogle ученый
Пир, Н., Дуйовне, И., Йочелис, С. и Палтиель, Ю. Наноразмерное разделение зарядов с использованием хиральных молекул. ACS Photonics 2 , 1476–1481 (2015).
КАС
Google ученый
Кристенсен А.С., Кубар Т., Куи К. и Эльстнер М. Полуэмпирические квантово-механические методы нековалентных взаимодействий для химических и биохимических приложений. Хим. Ред. 116 , 5301–5337 (2016).
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
«>Стоун, А. Дж. Теория межмолекулярных сил (Oxford Univ. Press, 2013).
Салевич, К. Адаптированная к симметрии теория возмущений межмолекулярных сил. Wiley Interdiscip. Преп. Вычисл. Мол. науч. 2 , 187–374 (2012).
Google ученый
Уайт, Р. М. Квантовая теория магнетизма: магнитные свойства материалов 3-е изд., гл. 2.2.7 (Спрингер, 2007 г.).
Бехтольд Т., Рудный Е. В. и Корвинк Дж. Г. Динамическое электротермическое моделирование микросистем — обзор. Дж. Микромех. Микроангл. 15 , Р17–Р31 (2005 г.
 ).
).КАС
Google ученый
Джоши, В. К. Спинтроника: современный обзор новых электронных устройств. англ. науч. Технол. 19 , 1503–1513 (2016).
Google ученый
Фельзер К., Фехер Г. Х. (редакторы) Спинтроника от материалов к устройствам (Springer, 2013).
Bandyopadhyay, S. & Cahay, M. Спин электрона для классической обработки информации: краткий обзор логических устройств, вентилей и схем на основе спина. Нанотехнологии 20 , 412001 (2009).
ПабМед
Google ученый
Датта С. и Дас Б. Электронный аналог электрооптического модулятора. Заявл. физ. лат. 56 , 665 (1990).
КАС
Google ученый
«>[Авторы не указаны.] Память со спином [от редакции]. Нац. нанотехнологии. 10, 185 (2015).
Hickey, M.C. et al. Эффективность передачи крутящего момента, измеренная с использованием наномоста из пермаллоя. Заяв. физ. лат. 97 , 202505 (2010).
Google ученый
Санвито, С. Молекулярная спинтроника: рост науки о спин-терфейсах. Нац. физ. 6 , 562–564 (2010).
КАС
Google ученый
Чуа, Л. Мемристор: недостающий элемент схемы. IEEE Trans. Теория цепей 18 , 507–519 (1971).
Google ученый
«>Хирохата, А. и Таканаши, К. Будущие перспективы спинтронных устройств. J. Phys. Д 47 , 193001 (2014).
Google ученый
Дор, О. Б., Йочелис, С., Мэтью, С. П., Нааман, Р. и Палтиель, Ю. Магнитное запоминающее устройство на основе хирала без постоянного магнита. Нац. коммун. 4 , 2256 (2013).
ПабМед
ПабМед ЦентральныйGoogle ученый
Мэтью С.П., Мондал П.С., Моше Х., Мастай Ю. и Нааман Р. Немагнитный органический/неорганический спин-инжектор при комнатной температуре. Заяв. физ.
 лат. 105 , 242408 (2014).
лат. 105 , 242408 (2014).Google ученый
Коплвитц, Г. и др. Магнитно-спиновый мемристор на одной наночастице. Доп. Мат. 29 , 1606748 (2017).
Google ученый
Дор, О. Б., Морали, Н., Йочелис, С., Бачевски, Л. Т. и Палтиель, Ю. Локальное намагничивание, индуцированное светом, с использованием наноточек и хиральных молекул. Нано Летт. 14 , 6042 (2014).
ПабМед
Google ученый
Аль Бустами, Х. и др. Магнитно-спиновый мемристор на одной наночастице. Малый 14 , 1801249 (2018).
Google ученый
Лисяк Д. и Дрофеник М. Химическое замещение — альтернативная стратегия контроля размера частиц феррита бария.
 Кристалл. Рост Des. 12 , 5174–5179 (2012).
Кристалл. Рост Des. 12 , 5174–5179 (2012).КАС
Google ученый
Кармели И., Лейтус Г., Нааман Р., Райх С. и Вагер З. Магнетизм, вызванный организацией самособирающихся монослоев. J. Chem. физ. 118 , 10372 (2003 г.).
КАС
Google ученый
Эрнандо А., Креспо П. и Гарсия М. А. Происхождение орбитального ферромагнетизма и гигантской магнитной анизотропии на наноуровне. Физ. Преподобный Летт. 96 , 057206 (2006).
КАС
пабмедGoogle ученый
Креспо, П. и др. Постоянный магнетизм, магнитная анизотропия и гистерезис покрытых тиолом наночастиц золота. Физ. Преподобный Летт. 93 , 087204 (2004).
КАС
пабмедGoogle ученый
«>Бучаченко А.Л., Бердинский В.Л. Электронно-спиновый катализ. Хим. Ред. 102 , 603–612 (2002).
КАС
пабмедGoogle ученый
Сикорский Т., Меир З., Бен-Шломи Р., Акерман Н. и Озери Р. Атомно-ионная химия с контролируемым спином. Нац. коммун. 9 , 920 (2018).
ПабМед
ПабМед ЦентральныйGoogle ученый
Wolff, H.-J., Burher, D. & Steiner, U.E. Спиновая химия Ru(bpy), управляемая спин-орбитальным взаимодействием0029 3 2+ фотоокисление: обнаружение сильной вязкостной зависимости скорости обратного переноса электронов в клетке.
 Чистое приложение. хим. 67 , 167–174 (1995).
Чистое приложение. хим. 67 , 167–174 (1995).КАС
Google ученый
Chrétien, S. & Metiu, H. O 2 эволюция на чистой частично восстановленной поверхности рутила TiO 2 (110) и на той же поверхности, предварительно покрытой Au 1 и Au 2 : важность сохранения спина. J. Chem. физ. 129 , 74705 (2008 г.).
Google ученый
Торун, Э., Фанг, К.М., де Вийс, Г.А. и де Гроот, Р.А. Роль магнетизма в катализе: RuO 2 (110) поверхность. J. Phys. хим. C 117 , 6353–6357 (2013).
КАС
Google ученый
Мтанги В., Киран В., Фонтанези К. и Нааман Р. Роль поляризации электронного спина в расщеплении воды. J. Phys. хим. лат. 6 , 4916–4922 (2015).

КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Мтанги, В. и др. Управление спином электронов исключает образование перекиси водорода при расщеплении воды. Дж. Ам. хим. соц. 139 , 2794–2798 (2017).
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Тассинари, Ф. и др. Улучшенное производство водорода с помощью электродов на основе хирального проводящего полимера. J. Phys. хим. C 121 , 15777–15783 (2017).
КАС
Google ученый
Ghosh, K.B. et al. Контроль химической селективности в электрокатализе с хиральными электродами с покрытием CuO. J. Phys. хим. C 123 , 3024–3031 (2019).
КАС
Google ученый
«>Ши, X. и др. др. Понимание тенденций активности электрохимического окисления воды с образованием перекиси водорода. Нац. коммун. 8 , 701 (2017).
ПабМед
ПабМед ЦентральныйGoogle ученый
Чжан В., Банерджи-Гош К., Тассинари Ф. и Нааман Р. Улучшенное электрохимическое расщепление воды с помощью Fe 9, покрытого хиральными молекулами0029 3 O 4 наночастицы. ACS Energy Письмо. 3 , 2308–2313 (2018).
КАС
Google ученый
Ральф, Д. К. и Стайлз, М. Д. Моменты передачи вращения. Дж. Магн. Магн. Матер. 320 , 1190–1216 (2008).
КАС
Google ученый
«>Линдер Дж. и Робинсон Дж. В. А. Сверхпроводящая спинтроника. Нац. физ. 11 , 307–315 (2015).
КАС
Google ученый
Keizer, R. S. et al. Спиновый триплетный сверхток через полуметаллический ферромагнетик CrO 2 . Природа 439 , 825–827 (2006).
КАС
пабмедGoogle ученый
Анвар М.С., Чешка Ф., Хессельберт М., Порку М. и Аартс Дж. Сверхтоки дальнего действия через полуметаллический ферромагнитный CrO 2 . Физ. Ред. B 82 , 100501 (2011 г.
 ).
).Google ученый
Хайре, Т. С., Хасауна, М. А., Пратт, В. П. младший и Бирдж, Н. О. Наблюдение спин-триплетной сверхпроводимости в соединениях Джозефсона на основе кобальта. Физ. Преподобный Летт. 104 , 137002 (2010 г.).
ПабМед
Google ученый
Робинсон, Дж. В. А., Витт, Дж. Д. С. и Бламир, М. Г. Управляемая инжекция спин-триплетного сверхтока в сильный ферромагнетик. Наука 329 , 59–61 (2010).
КАС
пабмедGoogle ученый
Альмог, Б., Хакоэн-Гурги, С., Цукерник, А. и Дойчер, Г. Параметр дальнего нечетного триплетного порядка с равным спариванием спинов в диффузионных контактах Co/In. Физ. Ред. B 80 , 220512 (2009 г.).
Google ученый
«>Kalcheim, Y., Robinson, J., Eglimez, M., Blamire, M.G. & Millo, O. Доказательства анизотропного параметра порядка триплетного сверхпроводника, индуцированного в L 2/3 C 1/3 MnO 3 ферромагнетик вблизи Pr 1,85 Ce 0,15 CuO 4 сверхпроводник. Физ. Ред. B 85 , 104504 (2012 г.).
Google ученый
Kalcheim, Y. et al. Зависимость от магнитного поля индуцированной близостью триплетной сверхпроводимости на переходах ферромагнетик/сверхпроводник.
 Физ. Ред. B 89 , 180506 (2014).
Физ. Ред. B 89 , 180506 (2014).Google ученый
Kalcheim, Y., Millo, O., Di Bernardo, A., Pal, A. & Robinson, J. W. A. Обратный эффект близости в NbN-La 2/3 Ca 1/3 MnO 3 интерфейс сверхпроводник-ферромагнетик: свидетельство триплетного спаривания в сверхпроводнике. Физ. Ред. B 92 , 060501 (2015).
Google ученый
Ди Бернардо, А. и др. p -волновая сверхпроводимость в однослойном графене на легированном электронами оксидном сверхпроводнике. Нац. коммун. 8 , 14024 (2017).
ПабМед
ПабМед ЦентральныйGoogle ученый
Ди Бернардо, А. и др. Сигнатура магнитозависимых бесщелевых состояний с нечетной частотой на границах раздела сверхпроводник/ферромагнетик.
 Нац. коммун. 6 , 8053 (2015).
Нац. коммун. 6 , 8053 (2015).ПабМед
ПабМед ЦентральныйGoogle ученый
Гу, Ю., Халас, Г. Б., Робинсон, Дж. В. А. и Бламир, М. Г. Эффект большого сверхпроводящего спинового клапана и сверхмалое обменное расщепление в эпитаксиальных трехслойных слоях редкоземельных элементов и ниобия. Физ. Преподобный Летт. 115 , 06720 (2015).
Google ученый
Gu, Y. et al. Контролируемая магнитным состоянием критическая температура в эпитаксиальных бислоях Ho/Nb. АПЛ Матер. 2 , 046103 (2014).
Google ученый
Alpern, H. et al. Нетрадиционная сверхпроводимость в пленках Nb за счет адсорбированных хиральных молекул. New J. Phys. 18 , 113048 (2016).
Google ученый
«>Блум Б.П., Графф Б.М., Гош С., Бератан Д.Н. и Вальдек Д.Х. Хиральный контроль переноса электронов в сборках квантовых точек. Дж. Ам. хим. соц. 139 , 9038–9043 (2017).
КАС
пабмедGoogle ученый
Рави С., Совмия П. и Картикеян А. Магнитосопротивление и эффективность спиновой фильтрации ДНК-сэндвичевых ферромагнитных наноструктур. СПИН 3 , 1350003 (2013).
Google ученый
Матитьяху С., Утсуми Ю., Ахарони А., Энтин-Вольман О. и Бальсейро С.А. Спин-зависимый транспорт через хиральную молекулу при наличии спин-орбитального взаимодействия и неунитарных эффектов. Физ. Ред. B 93 , 075407 (2016).
Google ученый
Хасан, М. З. и Кейн, К. Л. Коллоквиум: топологические изоляторы. Ред. Мод. физ. 82 , 3045–3067 (2010).
КАС
Google ученый
Нонненмахер, М., О’Бойл, М.П. и Викрамасингх, Х.К. Силовая микроскопия зонда Кельвина. Заяв. физ. лат. 58 , 2921–2923 (1991).
Google ученый
Wagner, J.R. et al. Новые вычислительные методы для рационального открытия аллостерических наркотиков. Хим. Ред. 116 , 6370–6390 (2016 г.).
КАС
пабмед
ПабМед Центральный
Google ученый
Дери, Х. и Шам, Л. Дж. Теория извлечения спина и ее отношение к спинтронике. Физ. Преподобный Летт. 98 , 046602 (2007).
КАС
пабмед
Google ученый
Lequeux, S. et al. Магнитный синапс: многоуровневый мемристор спинового момента с перпендикулярной анизотропией. наук. Респ. 6 , 31510 (2016).
КАС
пабмед
ПабМед Центральный
Google ученый
Yamamoto, Y. et al. Прямое наблюдение ферромагнитной спиновой поляризации в наночастицах золота. Физ. Преподобный Летт. 93 , 116801 (2004 г.).
КАС
пабмед
Google ученый
Arakawa, H. Фотокатализ: наука и технология Ch. 14 (ред. Канеко, М., Окура, И.) 235 (Спрингер, 2002).
Йода, Х. и др. Высокоэффективная запись крутящего момента с передачей вращения на перпендикулярных магнитных туннельных переходах для MRAM высокой плотности. Курс. заявл. физ. 10 , e87–e89 (2010 г.).
Google ученый
Kalcheim, Y., Kirzhner, T., Koren, G. & Millo, O. Эффект близости дальнего действия в La 2/3 Ca 1/3 MnO 3 /(100)YBa 2 Cu 3 O 7−δ бислои ферромагнетик/сверхпроводник: свидетельство индуцированной триплетной сверхпроводимости в ферромагнетике. Физ. Ред. B 83 , 064510 (2011).
Google ученый
Сукеник Н. и др. Эффект близости через хиральные молекулы в устройствах на основе Nb-графена. Доп. Матер. Технол. 3 , 1700300 (2018).
Google ученый
Скачать ссылки
Молекулы: идентификация хиральных центров, мезосоединений и диастереомеров
Хиральные молекулы обычно содержат по крайней мере один атом углерода с четырьмя неидентичными заместителями. Такой атом углерода называется хиральным центром (или иногда стереогенным центром ), используя органический язык. Любая молекула, содержащая хиральный центр, будет хиральной, за исключением мезосоединения (см. ниже, как их идентифицировать).
Например, показанное здесь соединение содержит атом углерода с четырьмя неидентичными заместителями; этот атом углерода является хиральным центром, и сама молекула хиральна, потому что она не накладывается на свое зеркальное отображение.
Хиральный центр
Вы должны уметь быстро обнаруживать хиральные центры в молекулах. Все атомы углерода алкильной группы с прямой цепью (СН 3 или СН 2 единицы) будут а не хиральными центрами, потому что эти группы имеют две или более идентичных групп (атомов водорода), присоединенных к атомам углерода. Атомы углерода на двойных или тройных связях не будут хиральными центрами, потому что они не могут иметь связи с четырьмя разными группами.
Глядя на молекулу, ищите атомы углерода, замещенные четырьмя разными группами. Посмотрите, например, сможете ли вы определить два хиральных центра в молекуле, показанной здесь.
Молекула с двумя хиральными центрами
Поскольку группы CH 3 и CH 2 не могут быть хиральными центрами, эта молекула имеет только три атома углерода, которые могут быть хиральными центрами. Две крайние левые возможности, указанные на следующем рисунке, имеют четыре неидентичные группы и являются хиральными центрами, но крайняя правая имеет две идентичные метильные (CH 3 ) группы и поэтому не является хиральным центром.
Две крайние левые возможности, указанные на следующем рисунке, имеют четыре неидентичные группы и являются хиральными центрами, но крайняя правая имеет две идентичные метильные (CH 3 ) группы и поэтому не является хиральным центром.
Хиральные центры в длинной молекуле
Как идентифицировать молекулы как мезосоединения
Мезосоединение содержит плоскость симметрии и поэтому является ахиральным независимо от того, имеет ли молекула хиральный центр. Плоскость симметрии — это плоскость, которая разрезает молекулу пополам, образуя две половинки, являющиеся зеркальным отражением друг друга.
По определению, молекула, которая не накладывается на свое зеркальное отражение, является хиральной молекулой. Соединения, содержащие хиральные центры, обычно хиральны, тогда как молекулы, имеющие плоскости симметрии, ахиральны и имеют структуру, идентичную их зеркальному отображению.
Плоскость симметрии в мезосоединениях
Например, цис -1,2-дибромциклопентан (показан на первом рисунке) является мезо, поскольку плоскость разрезает молекулу на две половинки, являющиеся отражением друг друга. Однако транс -1,2-дибромциклопентан является хиральным, поскольку никакая плоскость не разделяет молекулу на две зеркально отраженные половины.
Однако транс -1,2-дибромциклопентан является хиральным, поскольку никакая плоскость не разделяет молекулу на две зеркально отраженные половины.
Теперь посмотрите на зеркальные отображения этих двух молекул на втором рисунке, чтобы убедиться в этом для себя.
Зеркальные изображения ахиральных (мезо) и хиральных молекул
Несмотря на то, что цис-соединение имеет два хиральных центра (обозначенных звездочками), молекула является ахиральной, поскольку зеркальное отражение идентично исходной молекуле (и, следовательно, накладывается на исходную молекулу). Молекулы с плоскостями симметрии всегда будут иметь накладываемые зеркальные изображения и будут ахиральными. С другой стороны, транс-стереоизомер не имеет плоскости симметрии и является хиральным.
В органической химии вам нужно уметь находить плоскости симметрии в молекулах, чтобы вы могли определить, будет ли молекула с хиральными центрами хиральной или мезо. Например, можете ли вы определить плоскости симметрии в каждом из мезосоединений, показанных на последнем рисунке?
Некоторые мезосоединения
Как определить диастереомеры молекулы
Когда в молекуле присутствует более одного хирального центра, у вас есть возможность иметь стереоизомеры, которые не являются зеркальными отображениями друг друга. Такие стереоизомеры, не являющиеся зеркальными отображениями, называются диастереомеров .
Такие стереоизомеры, не являющиеся зеркальными отображениями, называются диастереомеров .
Как правило, диастереомеры могут быть только в том случае, если молекула имеет два или более хиральных центра.
Максимальное количество возможных стереоизомеров, которые может иметь молекула, зависит от 2 n , где n — число хиральных центров в молекуле. Следовательно, молекула с пятью хиральными центрами может иметь до 2 5 или 32 возможных стереоизомера! По мере увеличения числа хиральных центров число возможных стереоизомеров этого соединения быстро увеличивается.
Например, показанная здесь молекула имеет два хиральных центра.
Молекула с двумя хиральными центрами
Поскольку эта молекула имеет два хиральных центра, она может иметь всего 2 2 или 4 возможных стереоизомера, из которых только один будет энантиомером исходной молекулы.

 Необходимо, чтобы молекула имела один хиральный центр. Если во время реакции возникает второй центр, то переходные состояния будут диастереомерами, обладающими разной энергией. Если разность их энергий достигнет 10 кДж/моль, то доля определенного изомера (стереоселективность) достигнет 98%.
Необходимо, чтобы молекула имела один хиральный центр. Если во время реакции возникает второй центр, то переходные состояния будут диастереомерами, обладающими разной энергией. Если разность их энергий достигнет 10 кДж/моль, то доля определенного изомера (стереоселективность) достигнет 98%.
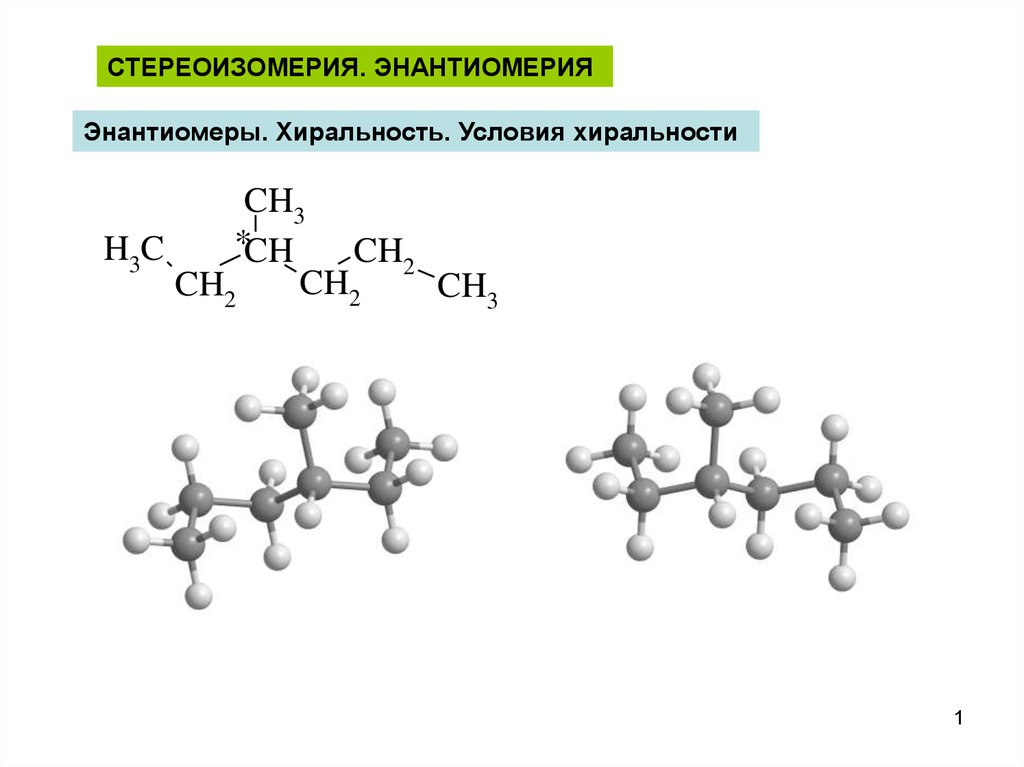 Тогда возникает вопрос: делает ли кольцо в виде двух разных заместителей хиральным замещенный углерод кольца? При такой неопределенности полезно попытаться идентифицировать любые плоскости симметрии в молекуле. Эта молекула имеет плоскость симметрии, что делает молекулу ахиральной. Плоскость симметрии было бы легче увидеть, если бы молекула рассматривалась сверху. Как правило, монозамещенные циклоалканы имеют одинаковую плоскость симметрии, что делает их все ахиральными.
Тогда возникает вопрос: делает ли кольцо в виде двух разных заместителей хиральным замещенный углерод кольца? При такой неопределенности полезно попытаться идентифицировать любые плоскости симметрии в молекуле. Эта молекула имеет плоскость симметрии, что делает молекулу ахиральной. Плоскость симметрии было бы легче увидеть, если бы молекула рассматривалась сверху. Как правило, монозамещенные циклоалканы имеют одинаковую плоскость симметрии, что делает их все ахиральными. Структура G по существу плоская. Все атомы углерода, кроме метильной группы, равны 9.0056 sp 2 гибридизированы и поэтому имеют тригонально-плоскую конфигурацию. Соединения C, D и H имеют более одного хирального центра и также являются хиральными.
Структура G по существу плоская. Все атомы углерода, кроме метильной группы, равны 9.0056 sp 2 гибридизированы и поэтому имеют тригонально-плоскую конфигурацию. Соединения C, D и H имеют более одного хирального центра и также являются хиральными.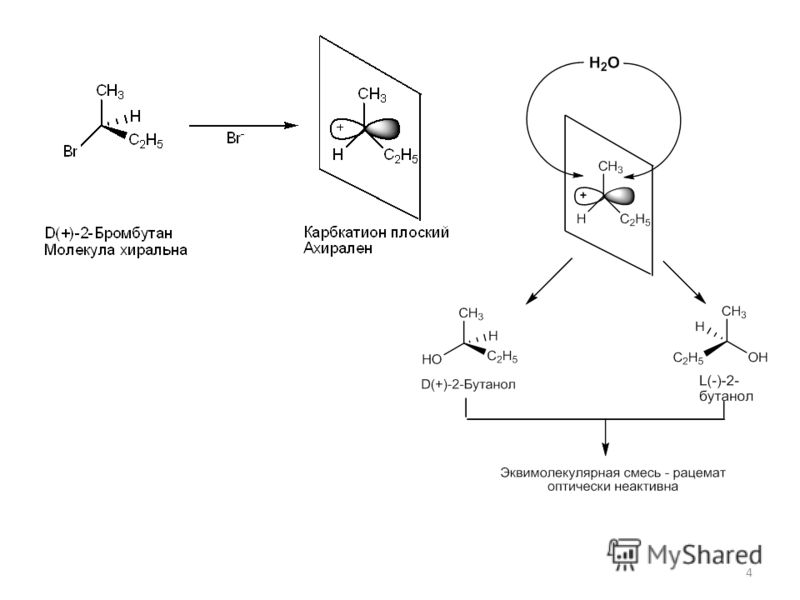

 Нац. хим. 3 , 19–27 (2011).
Нац. хим. 3 , 19–27 (2011). и Вагер З. Намагничивание хиральных монослоев полипептида: возможный источник магнетизма в некоторых биологических мембранах. Анжю. хим. Междунар. Эд. 41 , 761–764 (2002).
и Вагер З. Намагничивание хиральных монослоев полипептида: возможный источник магнетизма в некоторых биологических мембранах. Анжю. хим. Междунар. Эд. 41 , 761–764 (2002).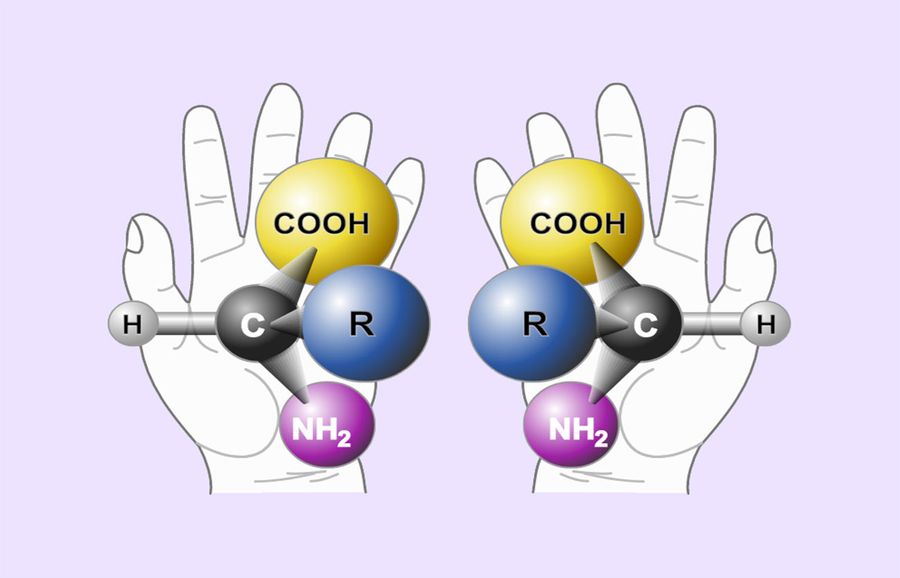 хим. лат. 9 , 2025–2030 (2018).
хим. лат. 9 , 2025–2030 (2018).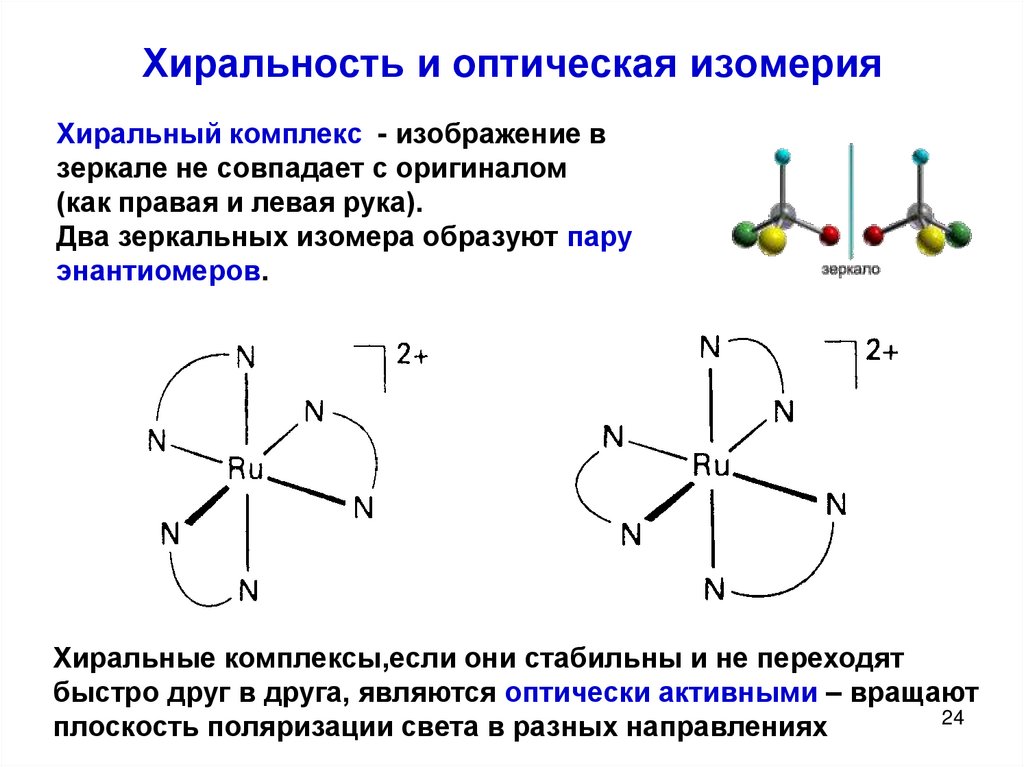 8 , 14567 (2017).
8 , 14567 (2017). Нац. коммун. 4 , 1573 (2013).
Нац. коммун. 4 , 1573 (2013).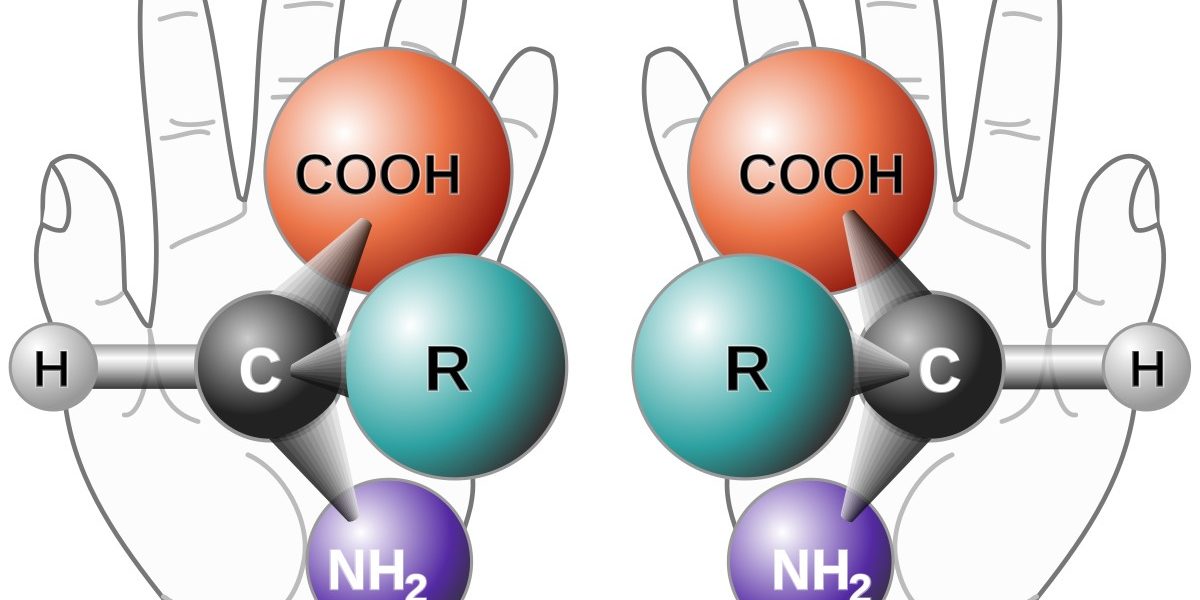 , Арита, Р. и Аоки, Х. Магнито-орбитальный эффект без спин-орбитальных взаимодействий в нецентросимметричной углеродной структуре на основе цеолита. Физ. Ред. B 86 , 125207 (2012 г.).
, Арита, Р. и Аоки, Х. Магнито-орбитальный эффект без спин-орбитальных взаимодействий в нецентросимметричной углеродной структуре на основе цеолита. Физ. Ред. B 86 , 125207 (2012 г.).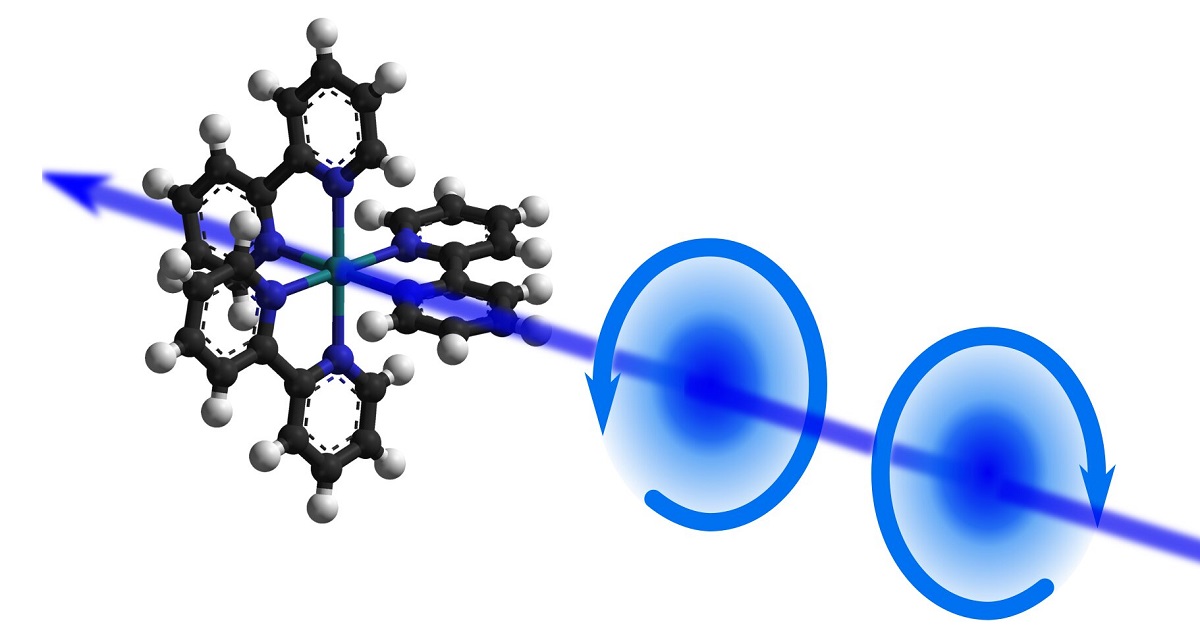
 Ред. B 88 , 165409 (2013).
Ред. B 88 , 165409 (2013).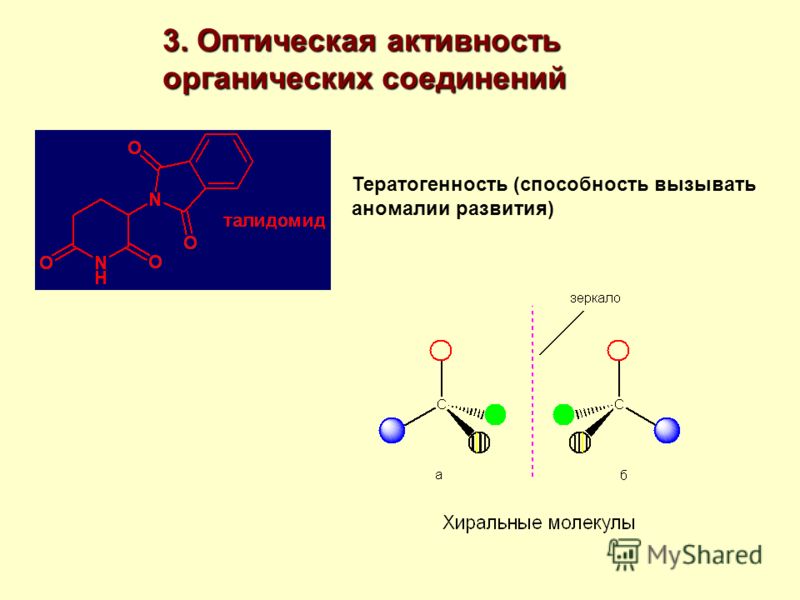 Малый 13 , 1602519 (2017).
Малый 13 , 1602519 (2017). Рез. 63 , 195–208 (2000).
Рез. 63 , 195–208 (2000). ).
).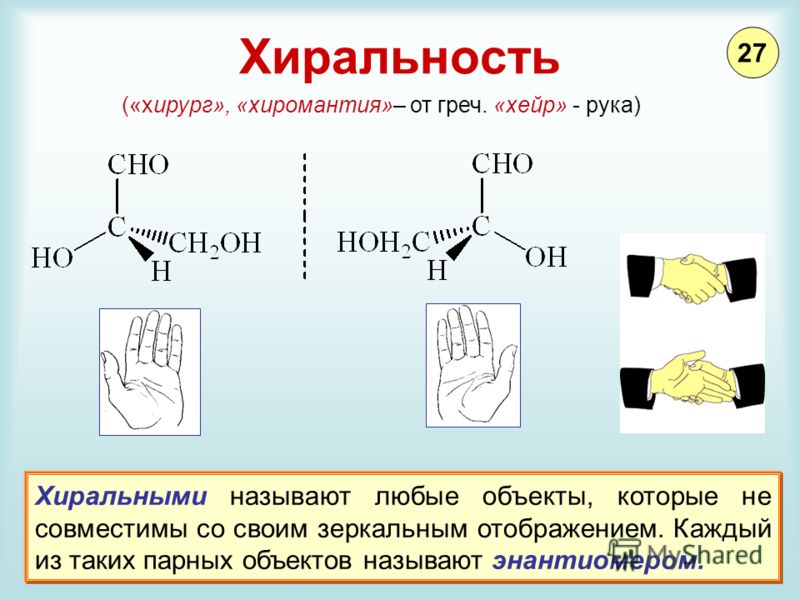 лат. 105 , 242408 (2014).
лат. 105 , 242408 (2014). Кристалл. Рост Des. 12 , 5174–5179 (2012).
Кристалл. Рост Des. 12 , 5174–5179 (2012).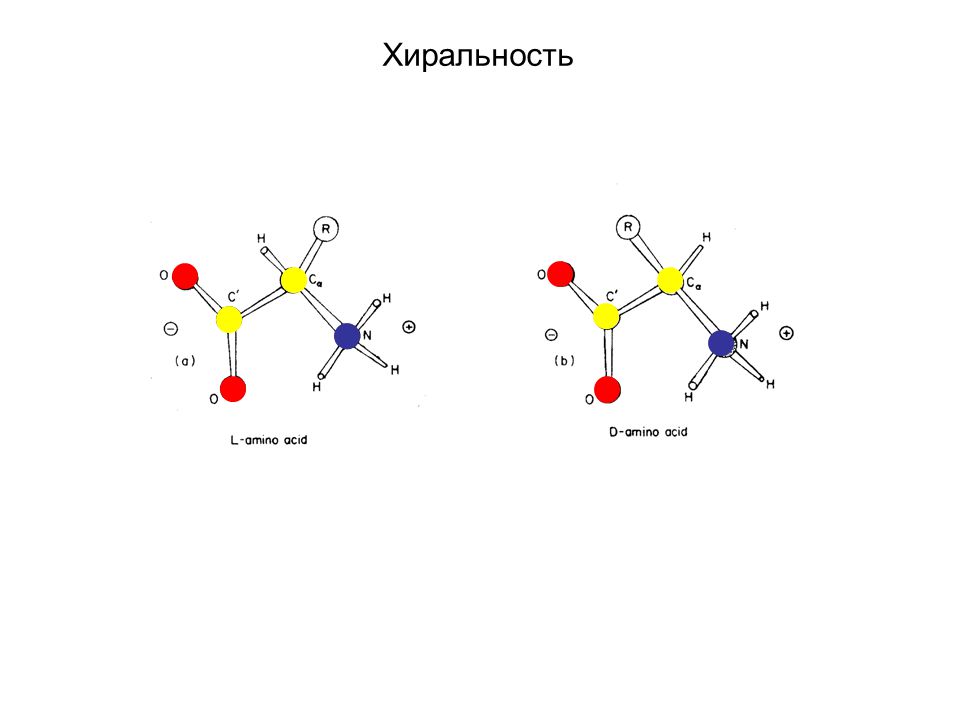 Чистое приложение. хим. 67 , 167–174 (1995).
Чистое приложение. хим. 67 , 167–174 (1995).