Содержание
Искусственное сердце – Наука – Коммерсантъ
5K
4 мин.
…
2 декабря 1982 года американский хирург Дейтон Кули в критической ситуации имплантировал искусственное сердце Jarvik 7 пациенту Барни Кларку. Пациент прожил с искусственным сердцем 112 дней, которые, как сказал один из участников операции, «дали больше знаний, чем предыдущие девять лет» жизни Барни Кларка. Примечательно, что Кларк, будучи верующим человеком, согласился на операцию не для продления жизни, а для помощи науке.
Фото: AP
В день пересадки Дейтон Кули работал под руководством другого знаменитого хирурга Майкла Эллиса Дебейки и даже не предупредил его о предстоящей операции, что привело к драматическим последствиям в их отношениях. Поведение Кули было признано неэтичным, и он был вынужден перейти на работу в другой госпиталь. Даже разработка искусственного сердца велась разными путями. Когда был создан Jarvik 2000 J весом 90 грамм, в клинике Дебейки использовали DeBakey Mikromed весом всего 53 грамма. Врачи помирились через сорок лет, когда Кули было 87 лет, а Дебейки – 99.
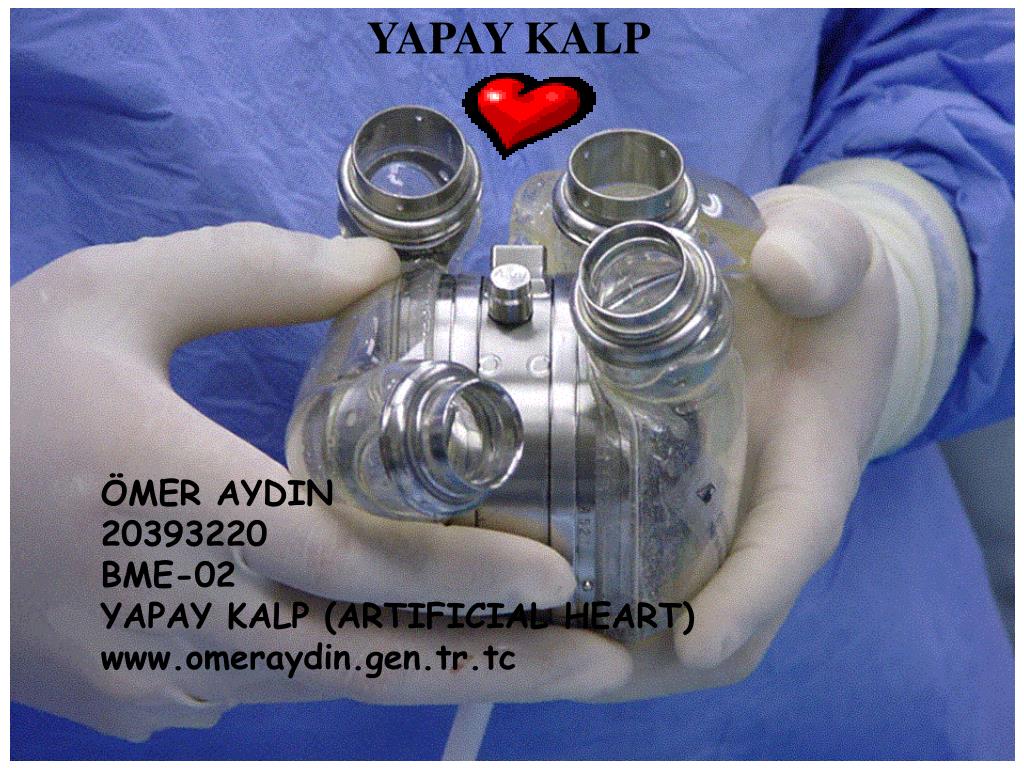
Искусственное сердце Jarvik 7, разработанное доктором Робертом Джарвиком в лаборатории знаменитого врача Виллема Йохана Колффа, было не первым (что понятно по цифре 7) и не единственным искусственным сердцем к тому времени. Но именно это устройство стало наиболее востребованным и применимым при операциях на сердце. В новых модификациях оно выпускается до настоящего времени фирмой SynCardia Systems.
Первое пересаженное сердце было искусственным: пластмассовый насос с моторчиком. Операцию по его пересадке провел в 1937 году выдающийся отечественный хирург и основоположник научной трансплантологии Владимир Петрович Демихов. Собака, которой была проведена операция, прожила с искусственным сердцем два часа. Человеку впервые было пересажено сердце в 1964 году американским хирургом Джеймсом Харди. Пациенту пересадили сердце шимпанзе. Больной прожил всего полтора часа: маленькое сердце шимпанзе не смогло обеспечить крупного мужчину. Первую пересадку сердца от человека человеку произвел в 1967 году в ЮАР Кристиан Бернард. Донором был женщина 25 лет, а реципиентом 55-летний мужчина. Пациент прожил 18 суток и умер от двусторонней пневмонии, поскольку пересадка чужих тканей требовала полного подавления собственного иммунитета. Кстати, до конца жизни Бернард считал своим учителем В. П. Демихова. В нашей стране первая пересадка сердца была проведена в 1987 году хирургом Валерием Ивановичем Шумаковым.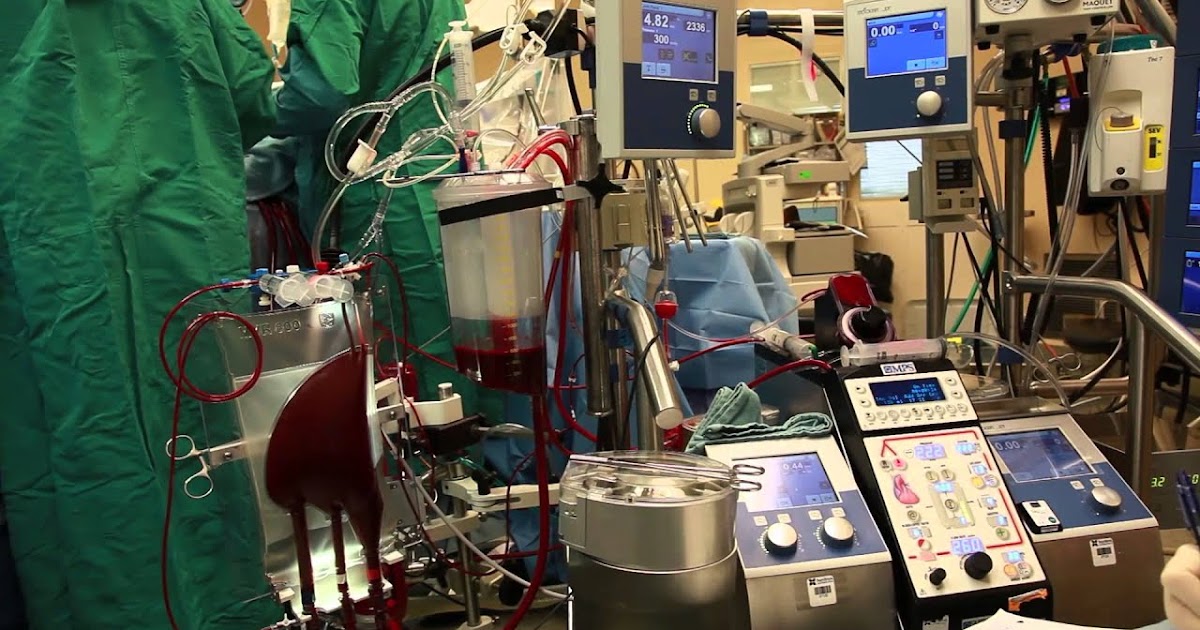
В настоящее время пересадка сердца стала рутинной операцией. В мире производится около 6000 пересадок сердца в год. Однако количество научных проблем по мере развития этого направления современной хирургии возрастает. Кроме того, остаются актуальными все возникшие при первых пересадках проблемы. Первый вопрос: искусственное или «натуральное»? Пересадка сердца от донора требует специального подбора, типирования, что может надолго задержать спасительную операцию, когда обратный отсчет идет даже не днями, а часами – больной может так и не дождаться подходящего донора. К несчастью, количество людей, ожидающих трансплантацию сердца во всем мире, значительно превышает возможности получения донорских сердец. Именно это поддерживает напряженную активность в разработке искусственного сердца.
Функция, которую выполняет человеческое сердце как насос, оказалась настолько значительной, что масса искусственного сердца превышает 6 килограмм. Источник питания и двигатель надо носить с собой в рюкзаке или катить за собой на тележке. Отчасти поэтому борьба идет за уменьшение размеров и создание таких внутренних поверхностей искусственного сердца, которые минимально способствуют образованию тромбов. В Новосибирском институте патологии кровообращения им. Мешалкина имплантируют искусственное сердце отечественной разработки. К настоящему времени имплантировано более 20 таких искусственных сердец.
Отчасти поэтому борьба идет за уменьшение размеров и создание таких внутренних поверхностей искусственного сердца, которые минимально способствуют образованию тромбов. В Новосибирском институте патологии кровообращения им. Мешалкина имплантируют искусственное сердце отечественной разработки. К настоящему времени имплантировано более 20 таких искусственных сердец.
Устройство с дисковым насосом уменьшает контакт крови с механическими поверхностями, тем самым минимизируя образование тромбов. Сам прибор по размерам меньше зарубежных аналогов, проще имплантируется и стоит в почти впятеро дешевле. Это устройство может в дальнейшем значительно потеснить иностранные аналоги, поскольку стоимость операции по пересадки сердца в США превышает 800 тысяч долларов. Однако все имплантируемые искусственные сердца имеют выход наружу, что является потенциальным источником инфекции и ограничивает сроки их применения.
Американская фирма AbioCor создала искусственное сердце, имплантируемое целиком: когда источник питания находится под кожей и может подзаряжаться снаружи. Пока это устройство находится в стадии испытаний. В любом случае, искусственное сердце – это этап на пути пересадки донорского сердца. 25-летний Сэм Ларкин живет с искусственным сердцем фирмы SynCardia уже семнадцать месяцев. Он может находиться вне дома и даже играет в баскетбол. Но это несравнимо с донорским сердцем, максимальная продолжительность жизни с которым в настоящее время составляет 33 года. Именно столько прожил Джон Маккаферти, которому пересадка была проведена в 1983 году. Пересаженное сердце тоже может стареть, болеть и приходить в негодность. Миллиардер Дэвид Рокфеллер сделал себе первую пересадку сердца в 1976 году. В этом году, ко дню его 101-летия, ему пересадили шестое по счету сердце.
Пока это устройство находится в стадии испытаний. В любом случае, искусственное сердце – это этап на пути пересадки донорского сердца. 25-летний Сэм Ларкин живет с искусственным сердцем фирмы SynCardia уже семнадцать месяцев. Он может находиться вне дома и даже играет в баскетбол. Но это несравнимо с донорским сердцем, максимальная продолжительность жизни с которым в настоящее время составляет 33 года. Именно столько прожил Джон Маккаферти, которому пересадка была проведена в 1983 году. Пересаженное сердце тоже может стареть, болеть и приходить в негодность. Миллиардер Дэвид Рокфеллер сделал себе первую пересадку сердца в 1976 году. В этом году, ко дню его 101-летия, ему пересадили шестое по счету сердце.
В Массачусетском госпитале ученые разработали совершенно новый способ получения донорских сердец. Сердце, которое не подошло для трансплантации, помещают в специальную среду, где удаляют практически все живые клетки, оставляя «каркас». Этот каркас заселяют клетками, взятыми у больного, и за две недели выращивают новое сердце. Такие пересадки уже сделаны на мышах.
Такие пересадки уже сделаны на мышах.
Еще одним путем получения нового сердца стали попытки напечатать его на 3D-принтере. Поскольку ткани сердца достаточно однородны, то напечатать его даже легче, чем другие органы. Предположительный срок реализации этого направления оценивается в десять лет. Достижения современной науки позволяют искать новые пути в области пересадки сердца.
Александр Свиридов, врач-кардиолог
как начиналось создание искусственного сердца — РТ на русском
В марте 1952 года врачам одной из американских клиник удалось поддерживать жизнь пациента при помощи искусственного сердца в течение почти полутора часов. С тех пор этот случай считается первым успешным применением подобного устройства для сохранения кровообращения у человека. Как учёные десятки лет пытались заменить человеческое сердце механизмом и с какими трудностями им пришлось столкнуться — в материале RT.
Гонка за кровотоком
В марте 1952 года в США врачи смогли поддерживать жизнь пациента при помощи искусственного сердца в течение почти полутора часов. В те времена в разных странах мира полным ходом шла работа над созданием аппарата, который позволил бы заменить человеческое сердце. Разные конструкции такого устройства испытывали едва ли не ежемесячно. Опыты над животными проходили успешно, и учёные всё чаще пытались задействовать аппараты при оперировании людей.
В те времена в разных странах мира полным ходом шла работа над созданием аппарата, который позволил бы заменить человеческое сердце. Разные конструкции такого устройства испытывали едва ли не ежемесячно. Опыты над животными проходили успешно, и учёные всё чаще пытались задействовать аппараты при оперировании людей.
О полноценной замене сердца тогда речь ещё не шла, однако исследователи были близки к созданию устройства, которое могло бы поддерживать кровообращение во время операций. В те времена их могли проводить только на закрытом сердце, что сильно сужало круг нарушений, которые хирурги могли исправить.
Одним из первых успехов в этой области можно считать работу российского экспериментатора Владимира Демихова. В 1937 году он заменил сердце собаки искусственным агрегатом. Ему удалось доказать, что по крайней мере несколько часов кровь по сосудам можно гонять таким образом. Позднее он и вовсе провёл успешную операцию по трансплантации донорского сердца псу, допустив возможность пересадки органа в организм человека.
Другой учёный, американский исследователь Джон Гиббон, из года в год проводил многочисленные эксперименты на животных, а затем при поддержке компании IBM начал испытывать свои аппараты на людях. Также над устройствами, которые работали по принципу насоса для перекачки жидкостей, трудились Клэренс Деннис, Чарльз Линдберг, Алексис Каррель и другие.
Необходимо было также научиться снабжать организм пациента кислородом, но объединить два устройства в одно было меньшей проблемой. Пациенты, возраст которых зачастую не превышал пяти лет, погибали во время операций. Джон Гиббон списывал это на человеческий фактор. Он был уверен, что техника работает исправно. Стоит отметить, что причиной летального исхода, как правило, становился неправильный диагноз.
Сенсация
8 марта 1952 года 41-летнему сталевару Питеру Дьюрингу из городка Бетхелем понадобилась операция на сердце. В распоряжении врачей из трёх больниц, которые поспешили ему на помощь, был прибор на основе перистальтического насоса, принцип которого разработал ещё в 1931 году американский кардиохирург Майкл Дебейки. Сам учёный к тому времени преподавал в Бэйлорском университете в Техасе, а аппарат местные врачи доработали сами.
Сам учёный к тому времени преподавал в Бэйлорском университете в Техасе, а аппарат местные врачи доработали сами.
Подключив пациента к насосу, девять врачей, пять медсестёр и два технических специалиста пытались найти причину ухудшения состояния мужчины. Аппарат установили так, чтобы он перегонял только часть крови — три литра в минуту вместо пяти. Медики надеялись обнаружить кровяной сгусток или другую преграду, мешавшую нормальной работе органа. Несмотря на то, что спасти Дьюринга не удалось, благодаря насосу он смог прожить ещё 80 минут.
Следующие несколько дней СМИ разносили новости об уникальной операции. «Врачи впервые успешно применили искусственное сердце во время операции, но пациент скончался», — говорилось в выходившей в штате Огайо газете The Coshocton Tribune. При этом отмечалось, что это был первый случай в стране, когда к аппарату подключили человека. Со ссылкой на представителей больницы та же газета сообщала, что чуть раньше местные учёные удачно испытали насос для кровообращения на собаке.
Наука пропитывает жизнь
До настоящей сенсации оставалось совсем недолго. Одним из первых успешных хирургических вмешательств на человеческом сердце при использовании аппарата искусственного кровообращения считают операцию с применением устройства американского хирурга Фостера Додрилла. Объединившись с инженерами компании General Motors, он разработал своё искусственное сердце. В июле 1952 года Додрилл успешно применил свой аппарат, напоминающий 12-цилиндровый двигатель, чтобы исправить порок сердца у 41-летнего Генри Опитека. Операция длилась 80 минут, 50 из которых пациент был подключён к аппарату. Опитек прожил ещё около 30 лет.
- Искусственное сердце, разработанное Додриллом.
- © gmheritagecenter.com
Чуть позже добился положительного результата и американский кардиохирург Джон Гиббон. Его первая по-настоящему удачная операция прошла в Медицинском колледже Джефферсона в Пенсильвании.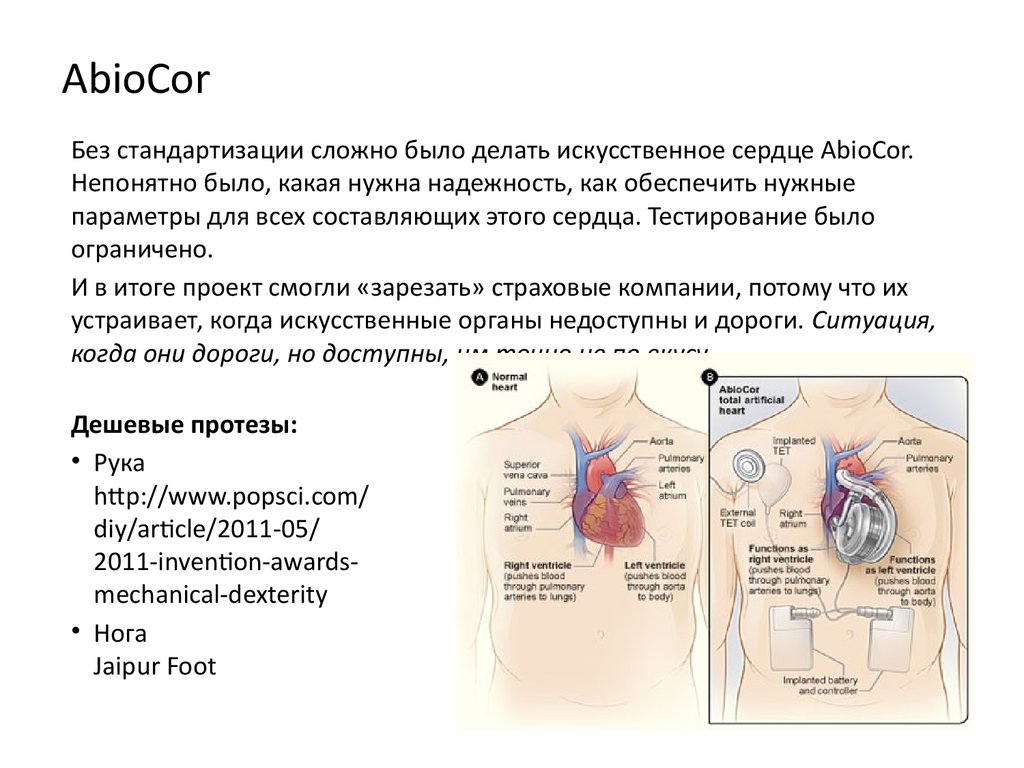 6 мая 1953 года у Гиббона получилось успешно прооперировать 18-летнюю девушку. Однако последующие операции были омрачены смертями пациентов от осложнений, в связи с чем учёный отказался от дальнейших испытаний созданного им искусственного сердца.
6 мая 1953 года у Гиббона получилось успешно прооперировать 18-летнюю девушку. Однако последующие операции были омрачены смертями пациентов от осложнений, в связи с чем учёный отказался от дальнейших испытаний созданного им искусственного сердца.
С тех пор учёные продолжали разработку аппаратов искусственного кровоснабжения и значительно продвинулись в этой области, хотя операции на открытом сердце по-прежнему считаются довольно опасными. Что же касается сенсации в пенсильванской больнице, быстро разошедшаяся новость не забылась со временем. Так, например, американский писатель Чарльз Уиллингем в своей книге «В моё время: век величайших изменений в истории человечества» (In My Time:the Greatest Century of Change in the History of Man) вспоминает, как 8 марта 1952 года услышал по телевизору о том, что на человеке впервые успешно испытали искусственное сердце.
«Я очень любил науку, — писал он. — И каждый день, куда ни гляну, я везде замечал, как она пропитывает нашу жизнь».
Robert Jarvik, MD на Jarvik-7
Robert Jarvik, MD широко известен как изобретатель первого успешного постоянного искусственного сердца, Jarvik 7.
В 1982 году первая имплантация Jarvik 7 пациенту Барни Кларку привлекли внимание средств массовой информации по всему миру. Чрезвычайная открытость этого медицинского эксперимента, организованного Университетом штата Юта, вызвала горячие общественные дебаты по всем аспектам медицинских исследований. Но когда врачи узнали, как добиться отличных клинических результатов у последующих пациентов с Jarvik 7, пресса и общественность в значительной степени потеряли интерес к этой теме. В результате устаревшие и ошибочные отчеты снова и снова появлялись в основных дискуссиях о Jarvik 7. Я встретился с доктором Ярвик, чтобы обсудить распространенные ошибки и ложные впечатления о первом постоянном искусственном сердце, устройстве, которое используется до сих пор и имеет самый высокий уровень успеха среди всех механических сердечных или вспомогательных устройств в мире.
Искусственные сердца в контексте
В сущности, существует два типа искусственных сердец: полностью искусственное сердце, которое имплантируется после удаления естественного сердца, и вспомогательное устройство для желудочков, которое имплантируется для поддержки естественного сердца, оставляя собственное сердце пациента на месте и все еще функционирует.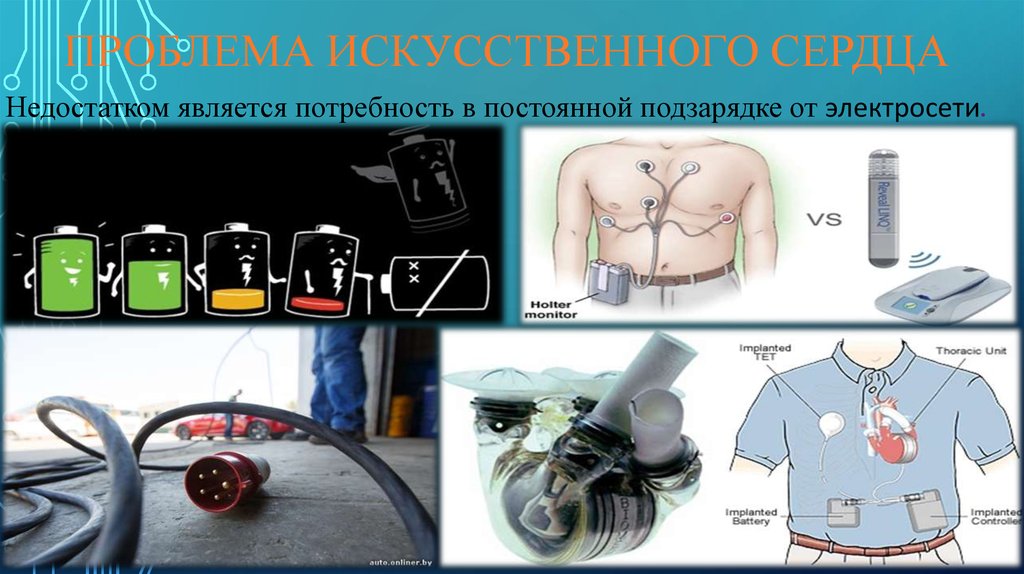
«Удаление сердца человека — одна из самых драматических хирургических операций, которые только можно себе представить», — говорит д-р Ярвик, который начал разработку крошечного вспомогательного желудочкового устройства Jarvik 2000 в 1988. «Неудивительно, что больше внимания общественности уделяется замене сердца, чем его помощи. Но подумайте над этим вопросом: если бы у вас была неисправная рука или нога, вы бы предпочли лучший из возможных протезов или устройство, которое позволило бы вам сохранить собственную руку или ногу?»
Вопрос риторический. Но хотя вспомогательные устройства для работы желудочков находят более широкое применение у пациентов, чем полностью искусственные сердца, эксперты рассматривают их как дополняющие друг друга методы лечения. Например, полное искусственное сердце требуется, когда вспомогательное устройство не подходит, например, в случаях бивентрикулярной недостаточности, когда обе стороны естественного сердца колеблются.
В 60-х и 70-х годах Национальные институты здравоохранения (NIH) разрабатывали механические сердца, но они были малоизвестны широкой публике. Затем, в 1967 году, Кристиан Бернар провел первую трансплантацию человеческого сердца, событие, вызвавшее интерес во всем мире: люди внезапно узнали о замене сердца как о способе лечения сердечной недостаточности. В 1969 году Дентон Кули провел первую имплантацию временного тотального искусственного сердца, и примитивное устройство поддерживало пациента в течение почти трех дней, пока по настоятельному призыву в прессе не был найден донор. После еще полутора десятилетий исследований, поддерживаемых NIH, сердце Jarvik 7 стало первым полностью искусственным сердцем, имплантированным в качестве постоянной замены безнадежно больному естественному сердцу.
Затем, в 1967 году, Кристиан Бернар провел первую трансплантацию человеческого сердца, событие, вызвавшее интерес во всем мире: люди внезапно узнали о замене сердца как о способе лечения сердечной недостаточности. В 1969 году Дентон Кули провел первую имплантацию временного тотального искусственного сердца, и примитивное устройство поддерживало пациента в течение почти трех дней, пока по настоятельному призыву в прессе не был найден донор. После еще полутора десятилетий исследований, поддерживаемых NIH, сердце Jarvik 7 стало первым полностью искусственным сердцем, имплантированным в качестве постоянной замены безнадежно больному естественному сердцу.
Первые пациенты Jarvik 7
2 декабря 1982 года в Университете штата Юта доктор медицинских наук Уильям ДеВриз имплантировал тотальный искусственный Jarvik 7 Барни Кларку, дантисту из Сиэтла, который вызвался пройти новаторскую процедуру, потому что хотел сделать вклад в медицинскую науку. Доктор Ярвик вспоминает, что перед операцией доктор Кларк сказал врачам, что не рассчитывает прожить с экспериментальным сердцем больше нескольких дней, но надеется, что то, что узнали врачи, когда-нибудь поможет спасти жизни других людей.
Доктор Ярвик, возглавлявший компанию по производству сердца Jarvik 7, договорился с администрацией университета не предоставлять никакой информации прессе напрямую: никаких пресс-релизов и никаких интервью. Вместо этого информация будет проходить через пресс-службу университета. Заявленная цель состояла в том, чтобы придерживаться самых высоких этических принципов и проводить это важное медицинское исследование открыто, без каких-либо усилий по влиянию или ограничению прессы. Желательна или ожидаема небольшая пресса. Университет провел брифинг перед исторической операцией, и посещаемость была умеренной.
«Новости о Барни Кларке ошеломили врачей, попав в заголовки газет по всему миру», — говорит д-р Ярвик. «Развился огромный общественный интерес, и сотни репортеров собрались в Солт-Лейк-Сити, чтобы осветить эту историю, а университет начал проводить для них ежедневные брифинги, которые не подвергались никакой цензуре. Сообщалось обо всех значимых с медицинской точки зрения событиях в послеоперационном периоде, как об успехах, так и о неудачах».

Инструктажи носили образовательный характер и содержали много медицинской информации, в том числе объяснения основ физиологии, интерпретации лабораторных анализов и рентгеновских снимков, а также длинные сессии вопросов и ответов. Были полностью описаны все осложнения, а также эффективность механического сердца для поддержания нормального кровотока доктора Кларка и поддержания его жизни.
«Огромный объем информации и чрезвычайная степень прозрачности создали нечто вроде медицинского эксперимента в аквариуме, — говорит доктор Ярвик. Университет Юты достиг своих исследовательских и образовательных целей, но освещение в прессе, казалось, оставило у его читателей необоснованные надежды и ожидания: многие начали верить, что искусственные сердца вскоре станут обычным явлением и почти решат проблему сердечных заболеваний. Пристальное внимание также привлекло критиков, которые, очевидно, ничего не знали о щедрых намерениях доктора Кларка и назвали его «человеческой морской свинкой».![]() Позже вдова доктора Кларка попыталась изменить это ложное впечатление, чтобы воздать своему мужу должное гуманитарное доверие, которого он заслуживал. Но миссис Кларк получила гораздо меньше прессы, чем критических комментариев, и ее миссия в конечном итоге провалилась. Прежде чем можно было провести еще один случай, доктор Де Врис, хирург, принял предложение присоединиться к исследовательской программе в больнице Humana в Луисвилле, штат Кентукки, и применил там свой опыт.
Позже вдова доктора Кларка попыталась изменить это ложное впечатление, чтобы воздать своему мужу должное гуманитарное доверие, которого он заслуживал. Но миссис Кларк получила гораздо меньше прессы, чем критических комментариев, и ее миссия в конечном итоге провалилась. Прежде чем можно было провести еще один случай, доктор Де Врис, хирург, принял предложение присоединиться к исследовательской программе в больнице Humana в Луисвилле, штат Кентукки, и применил там свой опыт.
Следующие несколько имплантаций сердца Jarvik 7, проведенные Humana — национальной сетью больниц — прошли так же, как и первые: с обнародованием обширной медицинской информации и политикой открытой прессы. Второй имплантат Jarvik 7 был установлен в 1985 году. Билл Шредер, пациент, поначалу чувствовал себя настолько хорошо, что, когда через неделю президент Рональд Рейган позвонил ему с пожеланиями выздоровления, он спросил президента, почему его чек социального обеспечения задержался. (Он был доставлен из рук в руки на следующий день. ) Г-н Шредер дал оптимистичные интервью журналистам и даже пошутил, что его шумная консоль привода «звучит как старомодная молотильная машина». Но всего через две недели после операции у него случился серьезный инсульт, из-за которого он не мог говорить. Позже г-н Шредер переехал из больницы и жил со своей женой в соседней квартире, которая была оснащена необходимым ему специальным оборудованием, включая воздушный компрессор и аварийный генератор. Во время путешествий он использовал портативную систему питания на сжатом воздухе, которая весила около пятнадцати фунтов. Во время своего пребывания на Jarvik 7 он посетил свой родной город в Индиане и проехал по Мейн-стрит на параде, посетил баскетбольный матч и порыбачил, но в ограниченном количестве: у него было много проблем со здоровьем, включая другие серьезные инсульты и инфекции. . В целом г-н Шредер прожил 620 дней с восстановленной сердечной функцией, но из-за осложнений.
) Г-н Шредер дал оптимистичные интервью журналистам и даже пошутил, что его шумная консоль привода «звучит как старомодная молотильная машина». Но всего через две недели после операции у него случился серьезный инсульт, из-за которого он не мог говорить. Позже г-н Шредер переехал из больницы и жил со своей женой в соседней квартире, которая была оснащена необходимым ему специальным оборудованием, включая воздушный компрессор и аварийный генератор. Во время путешествий он использовал портативную систему питания на сжатом воздухе, которая весила около пятнадцати фунтов. Во время своего пребывания на Jarvik 7 он посетил свой родной город в Индиане и проехал по Мейн-стрит на параде, посетил баскетбольный матч и порыбачил, но в ограниченном количестве: у него было много проблем со здоровьем, включая другие серьезные инсульты и инфекции. . В целом г-н Шредер прожил 620 дней с восстановленной сердечной функцией, но из-за осложнений.
Три других пациента получили сердце Jarvik 7 для постоянного использования в течение следующего года — еще два в Луисвилле и один в Швеции. Один пациент умер от кровотечения через неделю после операции; остальные прожили 10 месяцев и 14 месяцев. Как выяснилось, шведским пациентом был мужчина, обвиненный в уклонении от уплаты налогов, но после того, как ему удалили сердце, он был официально объявлен мертвым, поскольку по шведским законам человек считается мертвым, когда его или ее сердце перестало биться. Обвинения против него были официально сняты. В тот день, когда он получил эту новость, пациент был в восторге: он пошутил со своими врачами, что старая поговорка о том, что нет ничего определенного, кроме смерти и налогов, не соответствует действительности.
Один пациент умер от кровотечения через неделю после операции; остальные прожили 10 месяцев и 14 месяцев. Как выяснилось, шведским пациентом был мужчина, обвиненный в уклонении от уплаты налогов, но после того, как ему удалили сердце, он был официально объявлен мертвым, поскольку по шведским законам человек считается мертвым, когда его или ее сердце перестало биться. Обвинения против него были официально сняты. В тот день, когда он получил эту новость, пациент был в восторге: он пошутил со своими врачами, что старая поговорка о том, что нет ничего определенного, кроме смерти и налогов, не соответствует действительности.
The Jarvik 7 Сегодня
После первых пяти постоянных случаев сердце Jarvik 7 стало более широко использоваться в качестве временного тотального искусственного сердца, что позволяет пациентам переходить на трансплантацию. Шестой пациент прожил пять лет после того, как было найдено донорское сердце, а седьмой пациент прожил одиннадцать лет со своим донорским сердцем. Другому пациенту перенесли мост из сердца Jarvik 7 в человеческое сердце, что дало ему еще четырнадцать лет нормальной жизни. Пресса не знала об этих успехах или, возможно, считала эту тему устаревшей, что, по словам доктора Ярвика, «более чем устраивало» причастных к этому врачей. Но со временем пресса начала ошибочно сообщать, что использование сердца Jarvik 7 прекратилось после первых пяти. Позже это превратилось в ошибочное сообщение о том, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) запретило его использование. Еще позже это превратилось в ошибочное сообщение о том, что сердце Jarvik 7 было неудачным экспериментом: пресса начала верить в свои собственные ошибки.
Другому пациенту перенесли мост из сердца Jarvik 7 в человеческое сердце, что дало ему еще четырнадцать лет нормальной жизни. Пресса не знала об этих успехах или, возможно, считала эту тему устаревшей, что, по словам доктора Ярвика, «более чем устраивало» причастных к этому врачей. Но со временем пресса начала ошибочно сообщать, что использование сердца Jarvik 7 прекратилось после первых пяти. Позже это превратилось в ошибочное сообщение о том, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) запретило его использование. Еще позже это превратилось в ошибочное сообщение о том, что сердце Jarvik 7 было неудачным экспериментом: пресса начала верить в свои собственные ошибки.
С 1982 года более 350 пациентов использовали сердце Jarvik 7, и оно используется по сей день. Первые несколько пациентов жили в среднем 10 месяцев (когда ожидаемая продолжительность их жизни составляла всего несколько дней или недель). Частота осложнений была высокой. «Именно здесь пресса перестала проводить исследования и проверять факты и вместо этого начала публиковать ошибку за ошибкой за ошибкой», — отмечает д-р Ярвик.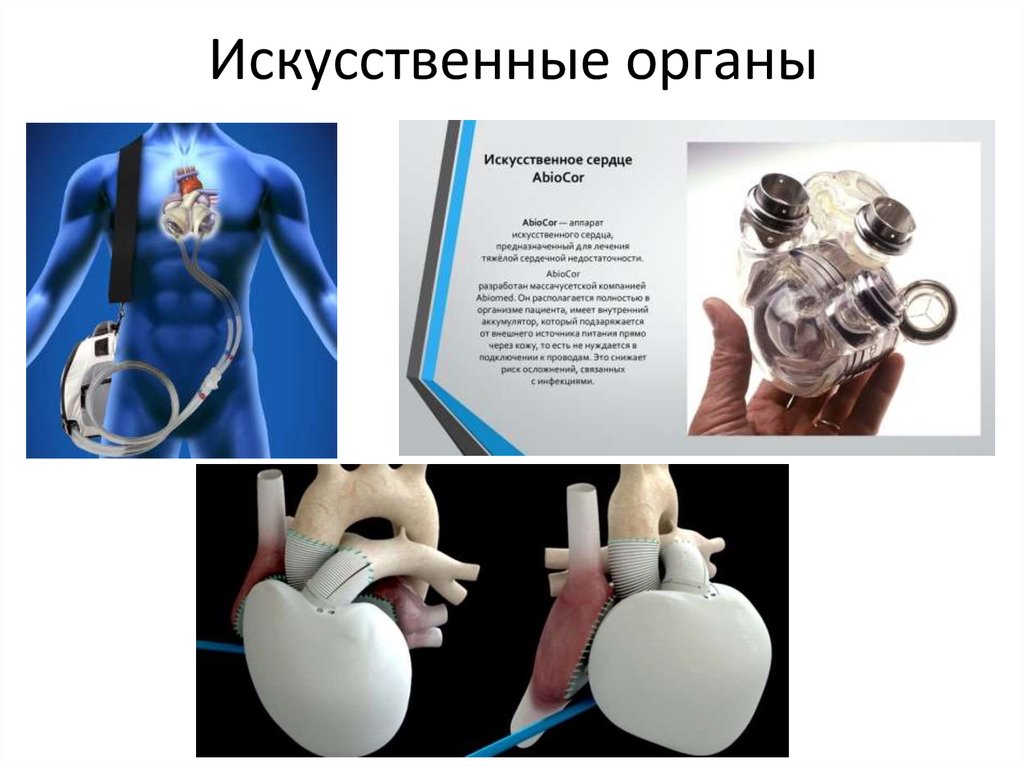 Все аспекты опыта, от роли государственного финансирования исследований до этики экспериментов на людях, обсуждались, но часто на основе дезинформации. Появились газетные и журнальные статьи с устаревшими и ошибочными описаниями. Были опубликованы книги с многочисленными ошибками. Тем временем врачи приобрели опыт работы с Jarvik 7 и научились более эффективно лечить своих пациентов и с меньшим количеством осложнений.
Все аспекты опыта, от роли государственного финансирования исследований до этики экспериментов на людях, обсуждались, но часто на основе дезинформации. Появились газетные и журнальные статьи с устаревшими и ошибочными описаниями. Были опубликованы книги с многочисленными ошибками. Тем временем врачи приобрели опыт работы с Jarvik 7 и научились более эффективно лечить своих пациентов и с меньшим количеством осложнений.
«Знающие врачи с изумлением наблюдали, как вопиющие ошибки появлялись в печати, а затем повторялись снова и снова, поскольку газеты и журналы копировали более ранние истории и друг друга и не тратили время на получение информации из первоисточников», — говорится в сообщении. Доктор Ярвик. «Мне очень редко звонили, чтобы проверить факты. Например, пресса неоднократно писала, что доктор Кларк умер от инсульта. На самом деле, у него никогда не было инсульта. Пресса снова и снова писала, что консоль, необходимая пациенту для питания сердца, была «размером с холодильник».
портфель.»
И это еще не все, говорит доктор Ярвик. «Пресса также писала, что сердце Jarvik 7 вызвало высокий уровень инсультов и инфекций. Пресса не заметила, что по мере того, как делалось больше случаев, эти показатели резко падали, но устройство оставалось тем же. Таким образом, само по себе устройство никогда не было причиной более ранних осложнений. Скорее, врачам нужно было научиться более эффективно управлять своими пациентами: в этом в первую очередь и заключается смысл таких исследований».
Возможно, самая вопиющая ошибка из всех — та, которая время от времени всплывает в обличительных выступлениях некоторых самопровозглашенных ученых мужей: сердце Джарвика 7 было неудачным экспериментом. Фактически, он достиг самого высокого уровня успеха среди всех типов искусственного сердца или вспомогательных устройств, которые когда-либо были разработаны. (Подробности см. ниже.) Сегодня сердце Jarvik 7 доступно примерно в десяти медицинских центрах в США, Канаде, Франции и Германии под названием тотальное искусственное сердце CardioWest. (Владелец несколько раз переходил из рук в руки, но конструкция устройства практически не изменилась.)
(Владелец несколько раз переходил из рук в руки, но конструкция устройства практически не изменилась.)
Сравнение Jarvik 7 с другими устройствами
В 1986 году д-р Ярвик был председателем и генеральным директором Symbion, Inc., публичной компании, производившей сердце Jarvik 7. Венчурная компания, которая финансировала Symbion, подала заявку на враждебное поглощение. Доктор Ярвик выступил против поглощения и подал жалобу в Комиссию по ценным бумагам и биржам, поскольку венчурная фирма имела доступ к конфиденциальной информации. Однако ему не удалось остановить это, и в результате он потерял свою позицию. Затем он основал Jarvik Heart, Inc. и начал работу в другом направлении, чтобы создать сердце Jarvik 2000, вспомогательное устройство для работы желудочков. Производство сердца Jarvik 7 продолжалось без него.
В 1990 году, после того как Jarvik 7 был использован у 198 пациентов, Symbion прекратила производство устройства, поскольку компания больше не соблюдала требования FDA по ведению документации и отчетности. В прессе ложно сообщалось, что FDA удалило Jarvik 7 с рынка, потому что у устройства был высокий процент отказов. На самом деле отказы Jarvik 7 случались крайне редко. Имплантированное сердце Jarvik 7 является более надежным и имеет меньше механических отказов, чем любое имплантированное искусственное сердце с положительным смещением (менее 2% отказов диафрагмы в исследовании FDA с участием 81 пациента). В качестве сравнения д-р Ярвик отмечает, что частота повторных операций по ремонту или замене устройства HeartMate составила более 75% в течение двух лет в крупном рандомизированном клиническом исследовании под названием REMATCH. Устройство Novacor имеет частоту повторных операций по замене или ремонту 16% в течение двух-трех лет на основе анализа историй болезни 1077 пациентов. Кроме того, почти во всех устройствах Novacor основной подшипник выходит из строя в течение трех-четырех лет, и его необходимо заменить новым устройством.
В прессе ложно сообщалось, что FDA удалило Jarvik 7 с рынка, потому что у устройства был высокий процент отказов. На самом деле отказы Jarvik 7 случались крайне редко. Имплантированное сердце Jarvik 7 является более надежным и имеет меньше механических отказов, чем любое имплантированное искусственное сердце с положительным смещением (менее 2% отказов диафрагмы в исследовании FDA с участием 81 пациента). В качестве сравнения д-р Ярвик отмечает, что частота повторных операций по ремонту или замене устройства HeartMate составила более 75% в течение двух лет в крупном рандомизированном клиническом исследовании под названием REMATCH. Устройство Novacor имеет частоту повторных операций по замене или ремонту 16% в течение двух-трех лет на основе анализа историй болезни 1077 пациентов. Кроме того, почти во всех устройствах Novacor основной подшипник выходит из строя в течение трех-четырех лет, и его необходимо заменить новым устройством.
Позже, в 1990 году, Symbion передала свои права Исследовательскому фонду MedForte, который в 1991 году в сотрудничестве с Университетским медицинским центром в Тусоне, штат Аризона, создал компанию CardioWest Technologies, Inc.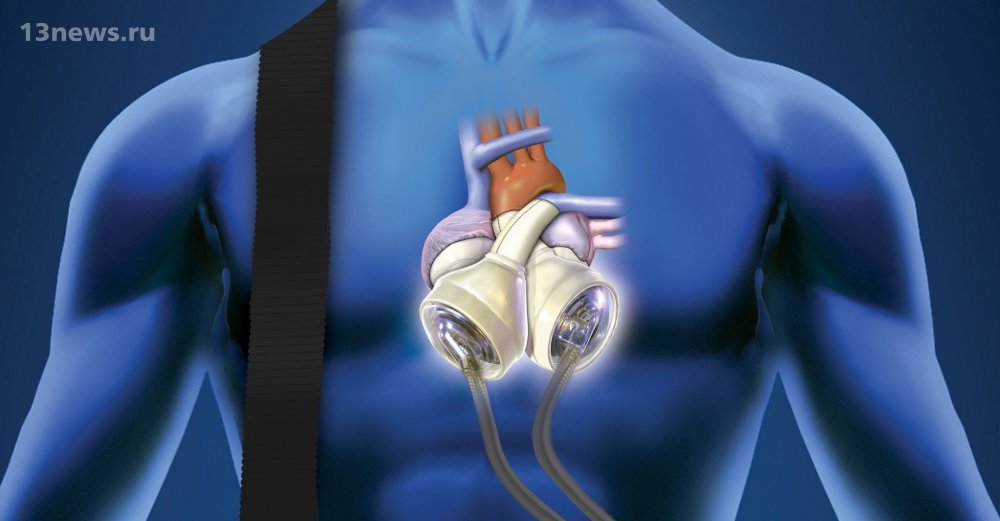 Затем сердце Jarvik 7 было переименовано в сердце CardioWest, и Symbion закрыл свои двери. Сердце CardioWest идентично сердцу Jarvik 7 небольшого размера, разработанному для женщин и мужчин меньшего роста в середине 1980-х годов. Устройство использует ту же конструкцию насоса для крови, те же клапаны Medtronic-Hall и ту же систему внешнего питания, что и оригинальное сердце Jarvik 7 небольшого размера. Единственными изменениями являются использование пневматических силовых труб меньшего диаметра, входящих в корпус, и современный портативный компьютер, заменяющий первоначально использовавшийся портативный компьютер Compaq.
Затем сердце Jarvik 7 было переименовано в сердце CardioWest, и Symbion закрыл свои двери. Сердце CardioWest идентично сердцу Jarvik 7 небольшого размера, разработанному для женщин и мужчин меньшего роста в середине 1980-х годов. Устройство использует ту же конструкцию насоса для крови, те же клапаны Medtronic-Hall и ту же систему внешнего питания, что и оригинальное сердце Jarvik 7 небольшого размера. Единственными изменениями являются использование пневматических силовых труб меньшего диаметра, входящих в корпус, и современный портативный компьютер, заменяющий первоначально использовавшийся портативный компьютер Compaq.
В 1993 году компания CardioWest Technologies получила разрешение на проведение клинических исследований сердца в качестве моста к трансплантации в пяти медицинских центрах США. Исследование показало, что сердце Jarvik 7 (CardioWest) безопасно и эффективно. Когда исследование было завершено в 2003 году, компания снова сменила владельца и название, на этот раз на SynCardia, Inc. , ее нынешний статус.
, ее нынешний статус.
Исследование FDA длилось десять лет и включало 95 пациентов. Он показал 79% успеха моста к трансплантации и отличную общую выживаемость, включая трансплантацию (70% через один год, 50% через пять лет и 45% через восемь лет). Таким образом, в исследовании, проведенном в США, Jarvik 7 (CardioWest) имеет лучший показатель успеха от моста до трансплантации, чем любое другое полностью искусственное сердце или любое другое вспомогательное устройство для желудочков, когда-либо разработанное. Уровень успеха в зарубежных странах ниже, но все же выше, чем у других устройств. 17 марта 2004 г. обзорная группа FDA рекомендовала предварительное одобрение на продажу (PMA) сердца для использования в качестве моста для трансплантации. 18 октября 2004 г. это одобрение было получено, что сделало Jarvik 7 первым полностью искусственным сердцем, получившим полное одобрение FDA для любых показаний к применению. «Далеко не провал, — говорит д-р Ярвик, — сердце [Jarvik 7] — это задокументированный успех».
Сравнение Jarvik 7 и тотальных искусственных сердец AbioCor
Единственным другим тотальным искусственным сердцем, доступным в настоящее время для использования у пациентов, является AbioCor, который был одобрен FDA для исследовательского использования у 15 пациентов. AbioCor был имплантирован 14 пациентам в течение трех лет после первого случая. Если бы исследование PMA с AbioCor было проведено с таким уровнем охвата (предполагая, что около 95 пациентов, как в клиническом испытании Jarvik 7 (CardioWest)), то исследование заняло бы 20 лет.
«Jarvik 7 по своей природе более надежен, чем AbioCor, из-за простоты компонентов Jarvik 7 и многослойной конструкции с низким напряжением наиболее важного компонента — гибкой диафрагмы», — говорит д-р Ярвик. «Jarvik 7 безотказно работал на стенде более шести лет, а один ранний прототип в Университете Юты непрерывно работал на стенде более десяти лет».
AbioCor, напротив, представляет собой очень сложное устройство с многочисленными имплантированными компонентами, которые могут выйти из строя.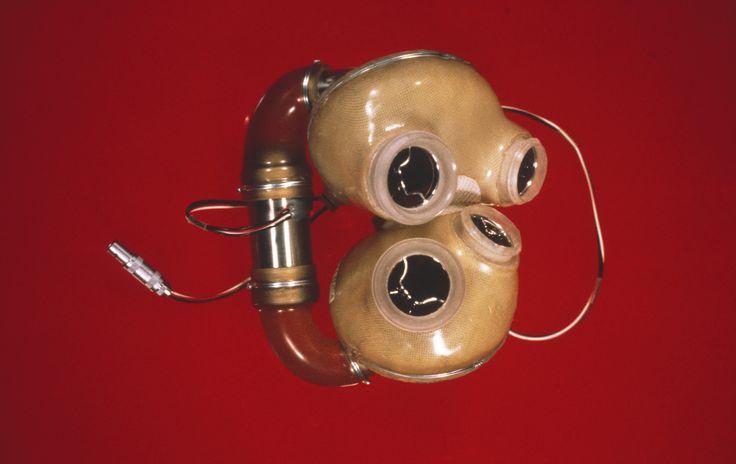 Фактически второе имплантированное сердце AbioCor имело две неисправности: первая потребовала повторной операции для замены имплантированной батареи, которая преждевременно ослабла; а второй связан с изношенной диафрагмой — одним из критических компонентов устройства — что привело к смерти пациента при выходе из строя.
Фактически второе имплантированное сердце AbioCor имело две неисправности: первая потребовала повторной операции для замены имплантированной батареи, которая преждевременно ослабла; а второй связан с изношенной диафрагмой — одним из критических компонентов устройства — что привело к смерти пациента при выходе из строя.
По словам доктора Ярвика, основным преимуществом сердца Jarvik 7 является его гемодинамическая эффективность в качестве спасательного устройства у пациентов, страдающих крайней сердечной недостаточностью и серьезными вторичными повреждениями других систем органов. Он обеспечивает более высокий кровоток, чем сердце AbioCor, при фактическом использовании пациентом (около 10 л/мин для Jarvik 7 по сравнению с примерно 7 л/мин для AbioCor). Более высокий поток полезен для восстановления функций почек, печени, легких и желудочно-кишечного тракта, которые серьезно нарушены в предсмертных состояниях. Более того, Jarvik 7 более эффективен у пациентов с полиорганной недостаточностью, чем любое вспомогательное устройство для левого желудочка.
Еще одним преимуществом Jarvik 7 является то, что он независимо регулирует работу правой и левой сторон сердца, обеспечивая оптимальное наполнение и выброс с каждой стороны. AbioCor, с другой стороны, попеременно накачивает правую и левую стороны, заполняя одну и опорожняя другую. Его конструкция не допускает независимого управления правой и левой сторонами и, следовательно, может нагнетать кровь в легкие под чрезмерно высоким давлением, нарушая функцию легких. «Почти всем пациентам AbioCor, которые пережили операцию, требуются респираторы в течение месяца или двух, — говорит д-р Ярвик, — тогда как пациенты с Jarvik 7 обычно снимают респиратор в течение нескольких дней».
Консоль основного привода, используемая для большинства пациентов с Jarvik 7, большая, но на самом деле она меньше, чем консоль, используемая более чем для тысячи пациентов с устройством Thoratec. Хотя основная консоль не подходит для действительно мобильного образа жизни и в настоящее время ограничена использованием в больницах, для Jarvik 7 была разработана небольшая портативная система питания с батарейным питанием, которая используется такими пациентами, как г-н Шредер, вне помещений. больница. С современной технологией литий-ионных аккумуляторов можно создать портативный блок питания весом около 8 фунтов, способный работать несколько часов без замены аккумулятора. Это будет такой же вес, как батарея AbioCor и электронные компоненты.
больница. С современной технологией литий-ионных аккумуляторов можно создать портативный блок питания весом около 8 фунтов, способный работать несколько часов без замены аккумулятора. Это будет такой же вес, как батарея AbioCor и электронные компоненты.
Существенным преимуществом AbioCor является то, что он намного тише, чем шумный Jarvik 7 с четырьмя механическими клапанами сердца. В AbioCor, напротив, используются бесшумные трехстворчатые пластиковые клапаны. Кроме того, две трубки, которые подают сжатый воздух для питания сердца Jarvik 7, являются потенциальным источником инфекции, особенно при длительном использовании (то есть 2-5 лет и более). При тщательном ведении они не представляли серьезной проблемы в клиническом исследовании Jarvik 7 (CardioWest): у 81 пациента было зарегистрировано 17 трансмиссивных инфекций, большинство из которых были поверхностными кожными инфекциями, которые лечили обычной сменой повязок.
AbioCor, однако, спроектирован так, что приводные механизмы не проникают сквозь кожу. Скорее, он использует радиочастотную передачу энергии от внешней катушки передатчика (размером примерно с коробку компакт-диска) на имплантированную катушку приемника. Хотя эта конструкция может предотвратить инфекции, связанные с прокалыванием кожи проводами, д-р Ярвик и другие отмечают ее серьезные недостатки:
Скорее, он использует радиочастотную передачу энергии от внешней катушки передатчика (размером примерно с коробку компакт-диска) на имплантированную катушку приемника. Хотя эта конструкция может предотвратить инфекции, связанные с прокалыванием кожи проводами, д-р Ярвик и другие отмечают ее серьезные недостатки:
- Она требует очень сложных, громоздких имплантируемых компонентов, которые значительно увеличивают травматичность операции по имплантации и сдавливают внутренние органы. В грудную клетку и брюшную полость пациента необходимо имплантировать почти пять фунтов оборудования, и это оборудование, как правило, очень сложно и дорого сделать надежным.
- Система чрескожной передачи энергии тратит впустую около 40% энергии внешней батареи, что требует от пациента носить с собой большую и тяжелую внешнюю батарею.
- Имплантированную батарею необходимо заменять раз в год или два, что требует серьезной операции, сопряженной со значительным риском кровотечения и инфицирования.
 Кроме того, внутренняя батарея позволяет AbioCor работать менее 30 минут. Это не батарея кардиостимулятора, которая работает годами.
Кроме того, внутренняя батарея позволяет AbioCor работать менее 30 минут. Это не батарея кардиостимулятора, которая работает годами.
«Еще одно преимущество сердца Jarvik 7, — добавляет д-р Ярвик, — заключается в том, что оно помещается более чем в 90% населения США, как мужчины, так и женщины. Напротив, AbioCor подходит менее чем для 10% населения и лишь для нескольких процентов американских женщин».
Таблица Сравнение первых клинических результатов Jarvik 7 с первыми клиническими результатами AbioCor
В приведенной ниже таблице данных сравниваются первые пациенты Jarvik 7 с исходными пациентами AbioCor. Он включает только первых семь пациентов, потому что на момент написания этой статьи данные о более поздних пациентах Jarvik 7 недоступны.
«Несмотря на все затраченные усилия и использование сложных современных технологий, AbioCor не добился лучших результатов, чем Jarvik 7 двадцать лет назад», — говорит д-р Ярвик. Он отмечает, что пациенты Jarvik 7 прожили дольше и с лучшим качеством жизни, чем пациенты AbioCor. Ни один пациент Jarvik 7 не умер во время операции, но умерли двое пациентов AbioCor. Ни один пациент Jarvik 7 не умер из-за отказа устройства, но два пациента AbioCor умерли в результате механических повреждений. У обоих устройств была серьезная проблема с инсультом у первых пациентов, которая значительно уменьшилась у более поздних пациентов Jarvik 7. «Абиомед» внес изменения в конструкцию, чтобы избежать инсультов, но они продолжали возникать у пациентов.
Ни один пациент Jarvik 7 не умер во время операции, но умерли двое пациентов AbioCor. Ни один пациент Jarvik 7 не умер из-за отказа устройства, но два пациента AbioCor умерли в результате механических повреждений. У обоих устройств была серьезная проблема с инсультом у первых пациентов, которая значительно уменьшилась у более поздних пациентов Jarvik 7. «Абиомед» внес изменения в конструкцию, чтобы избежать инсультов, но они продолжали возникать у пациентов.
«Не говоря уже о том, — добавляет д-р Ярвик, — что нынешние результаты с Jarvik 7 (CardioWest) намного лучше, чем первоначальные результаты много лет назад».
Изобретение искусственного сердца
Обзор
Во второй половине двадцатого века ишемическая болезнь сердца стала основной причиной смерти в богатых, промышленно развитых странах. При этом более половины смертей в США были вызваны сердечно-сосудистыми заболеваниями. Многие из этих смертей можно было бы предотвратить с помощью агрессивного лечения и хирургических процедур, включая операции по пересадке сердца. Однако нехватка донорских сердец вселила надежду на то, что полностью имплантируемое механическое устройство сможет преодолеть нехватку и избежать проблемы иммунологического отторжения, но ранние попытки имплантации постоянных искусственных сердец подверглись критике как преждевременные эксперименты на людях. Действительно, споры, вызванные экспериментальными имплантациями в 1960-е годы, возможно, затормозили разработку постоянной замены сердца. Вместо этого низкое качество жизни, обеспечиваемое искусственным сердцем, привело к попыткам разработать новое поколение вспомогательных устройств для левого желудочка.
Однако нехватка донорских сердец вселила надежду на то, что полностью имплантируемое механическое устройство сможет преодолеть нехватку и избежать проблемы иммунологического отторжения, но ранние попытки имплантации постоянных искусственных сердец подверглись критике как преждевременные эксперименты на людях. Действительно, споры, вызванные экспериментальными имплантациями в 1960-е годы, возможно, затормозили разработку постоянной замены сердца. Вместо этого низкое качество жизни, обеспечиваемое искусственным сердцем, привело к попыткам разработать новое поколение вспомогательных устройств для левого желудочка.
Предыстория
Человеческое сердце — замечательный орган, чуть больше кулака, который без отдыха бьется более 100 000 раз в день. Сердце среднего взрослого человека перекачивает более 4 300 галлонов (16 000 литров) крови в день через почти 100 000 миль (161 000 км) кровеносных сосудов. Представляя сердце просто как насос, Майкл Э. Дебейки, пионер кардиохирургии, которого называли «Техасским торнадо», предсказал, что механическое устройство может дублировать его основную функцию.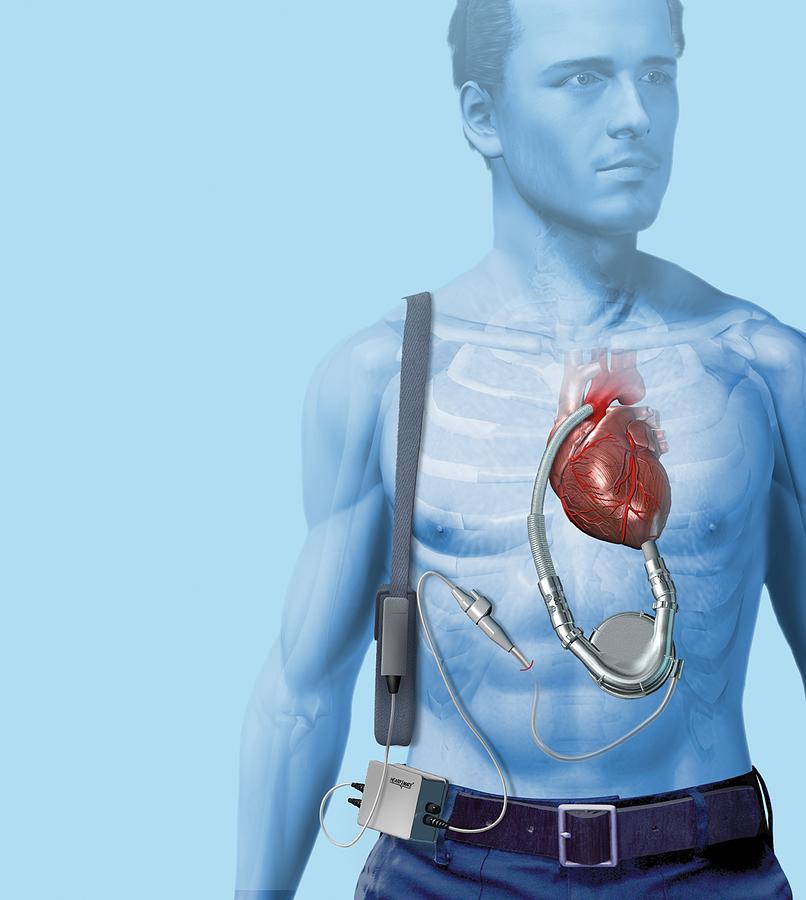 Искусственные сердца на самом деле датируются 19 годом.57, когда Виллем Колфф, изобретатель искусственной почки, и Тецузо Акуцу имплантировали экспериментальное сердце животным. Модель сердца Кольфа поддерживала жизнь собаки в течение 36 часов. Специалисты-кардиологи и ученые разработали четыре основных подхода к замене сердца: искусственное сердце, трансплантация донорского сердца, вспомогательные устройства, которые заменяют только часть естественного сердца, и замещающее сердце, разработанное с помощью методов тканевой инженерии в лаборатории, или сердце, выращенное в генетических условиях. измененные животные.
Искусственные сердца на самом деле датируются 19 годом.57, когда Виллем Колфф, изобретатель искусственной почки, и Тецузо Акуцу имплантировали экспериментальное сердце животным. Модель сердца Кольфа поддерживала жизнь собаки в течение 36 часов. Специалисты-кардиологи и ученые разработали четыре основных подхода к замене сердца: искусственное сердце, трансплантация донорского сердца, вспомогательные устройства, которые заменяют только часть естественного сердца, и замещающее сердце, разработанное с помощью методов тканевой инженерии в лаборатории, или сердце, выращенное в генетических условиях. измененные животные.
Идеальное искусственное сердце должно функционировать практически без обслуживания в течение многих лет в жаркой, влажной и агрессивной внутренней среде тела. Дизайн успешного искусственного сердца должен был преодолеть трудности, которые были обнаружены с тех пор, как первые такие устройства были испытаны в 1960-х годах: повреждение крови, вызванное контактом с искусственными материалами, отторжение замещающего сердца иммунной системой организма, трудности с предоставлением адекватных
питание насоса без подключения через кожу, миниатюризация насосов, достаточная для использования у детей и маленьких взрослых, и регулировка кровотока в ответ на физиологический стресс. Хотя искусственные сердца в разработке в течение 1990-е годы могут решить многие из этих проблем, эти устройства, вероятно, не станут практичными или рутинными в течение многих лет. Действительно, история искусственного сердца — это история спорных случаев.
Хотя искусственные сердца в разработке в течение 1990-е годы могут решить многие из этих проблем, эти устройства, вероятно, не станут практичными или рутинными в течение многих лет. Действительно, история искусственного сердца — это история спорных случаев.
Impact
Исследования, проведенные Институтом медицины в 1990-х годах, показали, что от 10 000 до 20 000 американцев в год могут быть кандидатами на тотальное искусственное сердце, а еще от 25 000 до 50 000 могут потребоваться вспомогательные устройства для левого желудочка. Сердечная недостаточность поражает около 5 миллионов американцев в год; кроме того, смертность от сердечной недостаточности увеличилась в три раза между 1974 и 1994. Различные формы искусственных насосов обеспечивают временные «мосты», поддерживая жизнь пациентов в ожидании трансплантации, но количество донорских сердец составляет всего около 2000 в год. Для многих пациентов вспомогательные насосы, также известные как вспомогательные устройства для левого желудочка (LVAD), могут быть более практичными, чем замена всего сердца.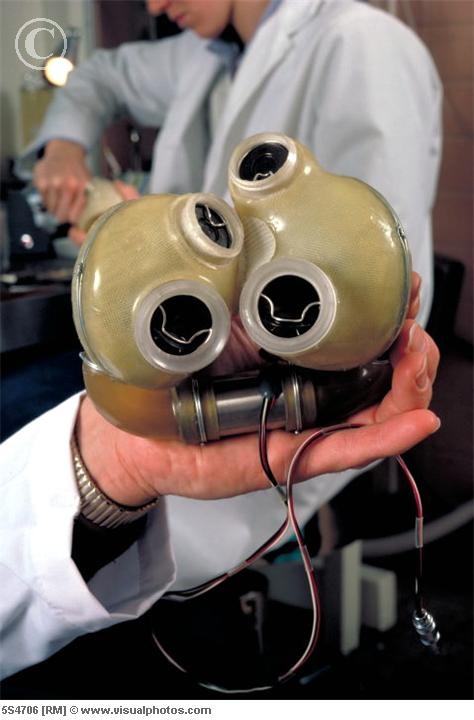 Дебейки начал работать над искусственным сердцем и связанными с ним устройствами в 1960 году. Он изобрел простой насос для крови, LVAD, который мог помогать сердцу, пока пациент ждал пересадки. В 1966 Дебейки провел первую имплантацию LVAD человеку.
Дебейки начал работать над искусственным сердцем и связанными с ним устройствами в 1960 году. Он изобрел простой насос для крови, LVAD, который мог помогать сердцу, пока пациент ждал пересадки. В 1966 Дебейки провел первую имплантацию LVAD человеку.
Одно из самых драматических событий в хирургии двадцатого века произошло в 1967 году, когда Кристиан Барнард (1922 г.р.), южноафриканский хирург, провел первую трансплантацию человеческого сердца. (Во многих случаях болезнь сердца может быть настолько серьезной, что пациент может не пережить ожидания донорского сердца.) Попытки использовать органы животных, такие как трансплантация Леонардом Бейли в 1984 году сердца бабуина новорожденному, который был идентифицирован как Бэби. Fae, закончился провалом. Поэтому дефицит донорских органов дал большой толчок развитию искусственного сердца.
4 апреля 1969 года Дентон А. Кули провел первую имплантацию искусственного сердца человеку, когда он использовал устройство, разработанное Доминго Лиотта, чтобы поддерживать жизнь Хаскелла Карпа.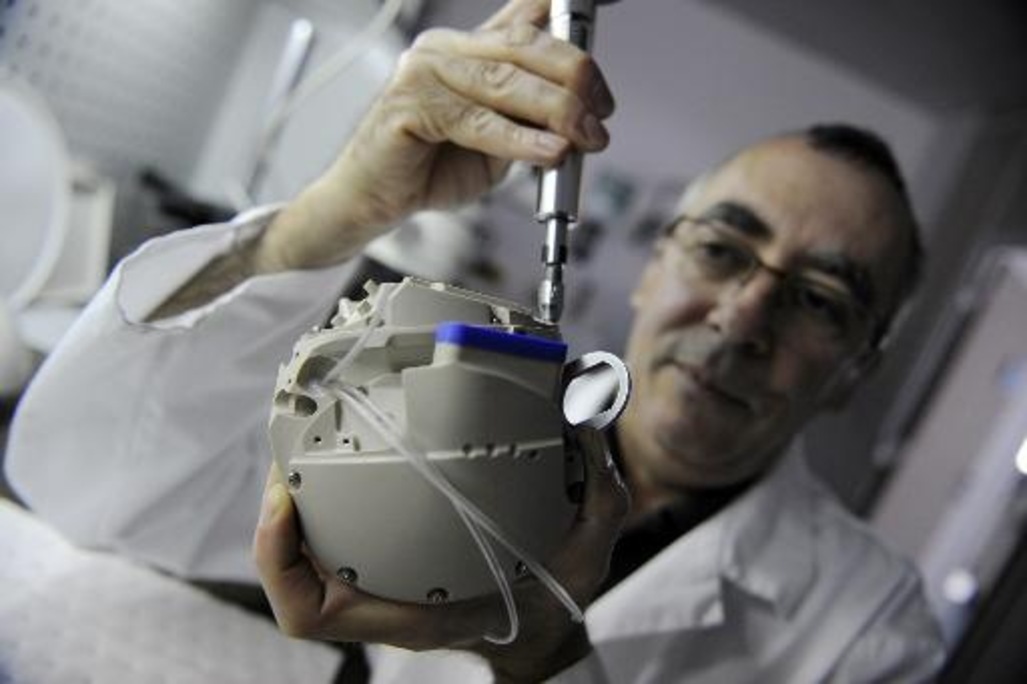 Карп был 47-летним пациентом с сердечной недостаточностью после операции по поводу аневризмы левого желудочка. Карп прожил с искусственным сердцем в груди 65 часов, но умер вскоре после пересадки сердца. Дебейки утверждал, что сердце, которое использовал Кули, было идентично тому, которое разрабатывалось в его лаборатории, и что Кули использовал его без разрешения. Поскольку устройство использовалось с ограниченным успехом у телят, Дебейки счел имплантацию человеку преждевременной и неразумной. Хотя Кули получил согласие на операцию от пациента, он не запрашивал разрешения у наблюдательного совета больницы или у федеральных агентств. Он и Лиотта думали, что разрешение не будет предоставлено и что они упустят прекрасную возможность провести эксперимент. Рабочие отношения между Кули и Дебейки были разрушены разногласиями вокруг операции Карпа.
Карп был 47-летним пациентом с сердечной недостаточностью после операции по поводу аневризмы левого желудочка. Карп прожил с искусственным сердцем в груди 65 часов, но умер вскоре после пересадки сердца. Дебейки утверждал, что сердце, которое использовал Кули, было идентично тому, которое разрабатывалось в его лаборатории, и что Кули использовал его без разрешения. Поскольку устройство использовалось с ограниченным успехом у телят, Дебейки счел имплантацию человеку преждевременной и неразумной. Хотя Кули получил согласие на операцию от пациента, он не запрашивал разрешения у наблюдательного совета больницы или у федеральных агентств. Он и Лиотта думали, что разрешение не будет предоставлено и что они упустят прекрасную возможность провести эксперимент. Рабочие отношения между Кули и Дебейки были разрушены разногласиями вокруг операции Карпа.
Затем вдова Карпа подала иск о неправомерной смерти Кули. Она утверждала, что она и ее муж не были полностью проинформированы о рисках экспериментальной процедуры. Судья закрыл дело, постановив, что пациент дал информированное согласие и что больница и хирурги тщательно проинформировали пациента о рисках процедуры и низкой вероятности полного выздоровления или выживания. Решение по этому делу расценивается как этапное в развитии и внедрении медицинских технологий.
Судья закрыл дело, постановив, что пациент дал информированное согласие и что больница и хирурги тщательно проинформировали пациента о рисках процедуры и низкой вероятности полного выздоровления или выживания. Решение по этому делу расценивается как этапное в развитии и внедрении медицинских технологий.
В 1981 году Кули провел еще одну неоднозначную операцию — имплантацию тотального искусственного сердца, разработанного Тецудзо Акуцу. 36-летний пациент находился на искусственном сердце в течение 55 часов, пока донорское сердце не стало доступным для трансплантации. Роберт Джарвик, врач и биомедицинский инженер, обратился к Дебейки с предложением протестировать аналогичное устройство, известное как Джарвик-7, но Дебейки отказался, потому что не думал, что устройство готово для использования человеком. Год спустя Уильям ДеВрис в сотрудничестве с Джарвиком имплантировал сердце Джарвика-7 в грудную клетку Барни Кларка, 61-летнего дантиста из Сиэтла, умирающего от сердечной недостаточности.
В отличие от случая с Карпом, в котором искусственное сердце было имплантировано в качестве моста к трансплантату, Де Врис и Ярвик намеревались использовать свое искусственное сердце в качестве постоянной замены больному сердцу. Кларк, проживший 112 дней на искусственном сердце, был отмечен членами команды имплантантов как «настоящий первооткрыватель», который понимал, что участвует в эксперименте, который вряд ли спасет ему жизнь, но который предоставит информацию, которая поможет ему. биомедицинские науки и другие пациенты.
В течение 1985 года было установлено пять подобных имплантатов. Дольше всего выжил Уильям Шредер, которого Ярвик-7 поддерживал в течение 620 дней. Зрелище низкого качества жизни и болезненных осложнений, перенесенных такими пациентами, как Кларк и Шредер, вызвало значительную общественную реакцию против искусственного сердца. Более того, многие врачи, ученые, специалисты по этике и политики пришли к выводу, что использование искусственного сердца преждевременно и что новое поколение искусственных сердец значительно улучшит жизнь пациентов только в следующем столетии. Проблемы, связанные с имплантируемыми искусственными сердцами, в конечном итоге привели к общему мнению, что вспомогательное устройство будет более практичным и полезным для пациентов. Первоначальная цель LVAD заключалась в том, чтобы поддерживать жизнь людей с терминальной сердечной недостаточностью до тех пор, пока не станет доступным донорское сердце. Таким образом, Jarvik-7 позже использовался у сотен пациентов в качестве моста к трансплантации.
Проблемы, связанные с имплантируемыми искусственными сердцами, в конечном итоге привели к общему мнению, что вспомогательное устройство будет более практичным и полезным для пациентов. Первоначальная цель LVAD заключалась в том, чтобы поддерживать жизнь людей с терминальной сердечной недостаточностью до тех пор, пока не станет доступным донорское сердце. Таким образом, Jarvik-7 позже использовался у сотен пациентов в качестве моста к трансплантации.
К началу 1990-х сложные LVAD регулярно использовались в больницах по всему миру. Однако многие из первых устройств были слишком большими для использования детьми и маленькими взрослыми. Таким образом, исследователи сосредоточились на разработке небольшого, но все же мощного LVAD. Дебейки и другим пришлось проводить некоторые из своих экспериментов и клинических испытаний в Европе, потому что правительственные правила в отношении клинических испытаний в Соединенных Штатах были более строгими. Инновационные решения проблемы создания более качественного насоса появились в результате сотрудничества между Дебейки и учеными Национального управления по аэронавтике и исследованию космического пространства (НАСА). (Это сотрудничество началось после операции, которую Дебейки провел над Дэвидом Соссье, инженером НАСА.
(Это сотрудничество началось после операции, которую Дебейки провел над Дэвидом Соссье, инженером НАСА.
Устройство DeBakey Ventricular Assist Device (VAD), миниатюрная помпа размером примерно в одну десятую по сравнению со старыми устройствами, наносило меньше повреждений клеткам крови, требовало менее восьми ватт энергии и могло заряжаться через кожу. Многие другие экспериментальные устройства также проходили испытания к 1998 году, когда 90-летний Дебейки отправился в Германию, чтобы лично наблюдать за первыми испытаниями своего VAD на людях. Всего шесть пациентов, первый, находившийся в критическом состоянии на момент операции, скончался через шесть недель. У второго было удалено устройство из-за образования тромба в механизме, но двое других пациентов смогли покинуть больницу с устройством на месте.
Новое поколение LVAD дает надежду многим пациентам из-за неожиданного явления, о котором сообщили несколько центров трансплантации сердца. Некоторые из пациентов, использующих LVADS в ожидании донорского сердца, действительно выздоравливали. По-видимому, полный покой левого желудочка, обеспечиваемый LVAD, в значительной степени реверсировал сердечную недостаточность, и увеличенные клетки сердца возвращались к нормальному размеру. Следовательно, LVAD также можно использовать в качестве «моста к восстановлению».
По-видимому, полный покой левого желудочка, обеспечиваемый LVAD, в значительной степени реверсировал сердечную недостаточность, и увеличенные клетки сердца возвращались к нормальному размеру. Следовательно, LVAD также можно использовать в качестве «моста к восстановлению».
Помимо трансплантации человеческого сердца и механических сердец, некоторые ученые считают, что ткани и органы животных или комбинации живых клеток с искусственными материалами в конечном итоге будут использоваться для помощи или замены больных сердец. В настоящее время ученые пытаются вырастить сердечную мышечную ткань, сердечные клапаны и кровеносные сосуды в лаборатории; этот подход известен как тканевая инженерия. Поскольку полное сердце редко выходит из строя, помощь многим пациентам с тканеинженерной сердечной мышцей может оказаться возможной. Кроме того, в области, называемой ксенотрансплантацией, ученые уже ищут способы изменить органы животных, чтобы они не были отвергнуты людьми-реципиентами. Противодействие со стороны зоозащитников и угроза ранее неизвестных вирусов сделали приматов менее желательными в качестве источников органов, но трансгенные свиньи могут в конечном итоге предоставить органы для людей. Другие ученые, однако, считают, что большая часть социального и индивидуального бремени сердечных заболеваний может быть предотвращена с помощью физических упражнений, изменения диеты и отказа от курения.
Другие ученые, однако, считают, что большая часть социального и индивидуального бремени сердечных заболеваний может быть предотвращена с помощью физических упражнений, изменения диеты и отказа от курения.
ЛОИС Н. МАГНЕР
Дополнительная литература
Книги
Специальная рабочая группа по замене сердца. Замена сердца: медицинские, этические, психологические и экономические последствия. Вашингтон, округ Колумбия: Типография правительства США, 1969.
Конрад, Питер и Рошель Керн, ред. Социология здоровья и болезней: критические перспективы. 4-е изд. Нью-Йорк: St. Martin’s Press, 1994.
Хогнесс, Джон Р., изд. Искусственное сердце: прототипы, политика и пациенты. Вашингтон, округ Колумбия: National Academy Press, 1991.
Колфф, Виллем. Искусственные органы. Нью-Йорк: Wiley, 1976.
Любек, Д., и Дж. П. Банкер. Искусственное сердце: затраты, риски и преимущества. Вашингтон, округ Колумбия: Управление по оценке технологий, 1982 г.


 портфель.»
портфель.»  Кроме того, внутренняя батарея позволяет AbioCor работать менее 30 минут. Это не батарея кардиостимулятора, которая работает годами.
Кроме того, внутренняя батарея позволяет AbioCor работать менее 30 минут. Это не батарея кардиостимулятора, которая работает годами.