Содержание
Изобретатель первого в мире искусственного сердца назвал причину его остановки
Медицина
Опубликовано:
Искусственное сердце «Кармат». (©Société Carmat)
Воскресная газета «Журнал дю диманш» опубликовала имя первого в мире пациента, пережившего операцию по пересадке искусственного сердца. Клод Дани был прооперирован 18 декабря 2013 года. Он прожил 74 дня.
Реклама
Газета также публикует интервью с Аленом Карпентье, хирургом, проводившем операцию. Он же является и разработчиком этого удивительного проекта искусственного сердца, который называется «Кармат» (Carmat).
Он же является и разработчиком этого удивительного проекта искусственного сердца, который называется «Кармат» (Carmat).
Ален Карпентье пытается анализировать причины смерти пациента. По его версии, в механизме произошло короткое замыкание. Почему при этом не сработали различные системы безопасности, еще предстоит выяснить, — говорит хирург.
Как передал после этого французский телеканал i-Tele, все дальнейшие клинические испытания искусственного сердца «Кармат» приостановлены до выяснения причин. Сразу после смерти первого пациента в начале марта было объявлено, что на подобную операцию во Франции согласились еще два человека.
В ноябре прошлого года инженеры «Кармат» заявляли, что планируют завершить все клинические испытания к концу 2014 года. После этого Европа должна была дать добро на коммерческое изготовление искусственного сердца.
«Кармат» является уникальным проектом, предназначенным для больных сердечной недостаточностью в последней стадии, продолжительность жизни которых очень короткая.
- Здравоохранение
- Медицина
- Наука
- Франция
Главное по теме
Франция
В Париже успешно осуществлена первая пересадка искусственного автономного сердца
Медицина
Во Франции провели первую операцию по вживлению искусственного сердца
Читайте также
06/10/2022
Мобилизация по-французски: правительство представило план экономии энергии
Нобелевская премия
06/10/2022
Нобелевскую премию по литературе получила французская писательница Анни Эрно
05/10/2022
Франция начнет выдавать визы российским оппозиционерам
Франция — Украина
04/10/2022
«Эта война стала геополитическим пробуждением»: французские депутаты обсудили положение в Украине
Планета и Мода
04/10/2022
Paris Fashion week: экология стала императивом
03/10/2022
Министра юстиции Франции решили отправить под суд по делу о конфликте интересов
Эмиграция
30/09/2022
Могут ли бегущие от мобилизации россияне рассчитывать на убежище во Франции?
29/09/2022
За повышение зарплат и против пенсионной реформы: во Франции проходят забастовки
28/09/2022
Военные преступления в Украине: во Франции создано специальное следственное подразделение
27/09/2022
Эмманюэль Макрон встретится с Джо Байденом 1 декабря в Вашингтоне
26/09/2022
В нормандском Кане обсудили будущее российской демократии
История
26/09/2022
«Последний адрес» во Франции: в Булони увековечили имя генерала Миллера
23/09/2022
Французские «зеленые» в Сенате выступили за прием россиян, бегущих от мобилизации
Как начиналось создание искусственного сердца
9 марта 2017
RT на русскомиещё 1
В марте 1952 года, в одной из американских больниц врачам впервые удалось поддерживать жизнь пациента при помощи «искусственного сердца» в течение почти полутора часов.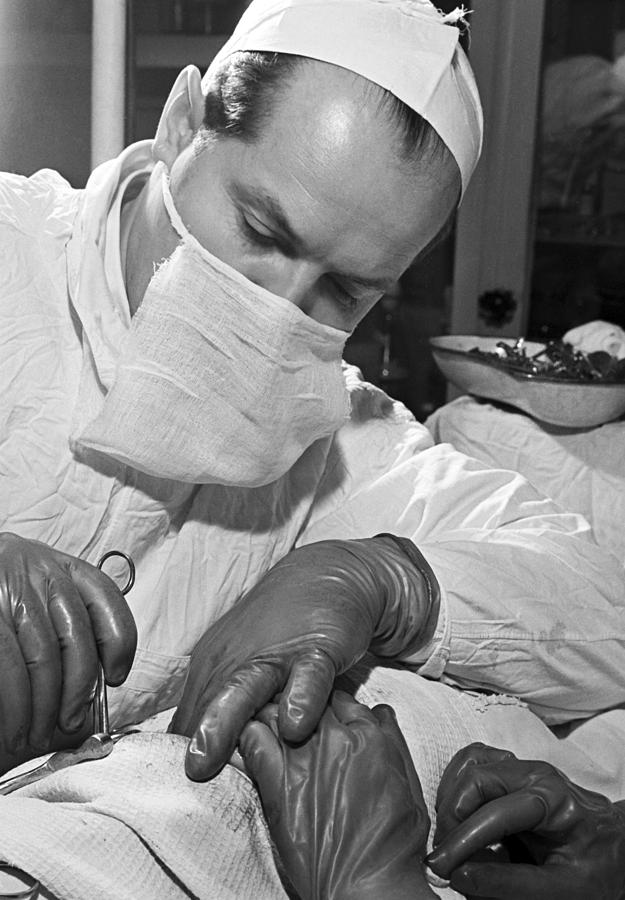 С тех пор этот случай упоминают как первое успешное использование подобного аппарата для поддержания кровообращения у человека. О том, как учёные десятки лет пытались заменить человеческое сердце механизмом и с какими трудностями им пришлось столкнуться, — в материале RT.
С тех пор этот случай упоминают как первое успешное использование подобного аппарата для поддержания кровообращения у человека. О том, как учёные десятки лет пытались заменить человеческое сердце механизмом и с какими трудностями им пришлось столкнуться, — в материале RT.
Фото: RT на русскомRT на русском
Гонка за кровотоком
Видео дня
В марте 1952 года в США врачи смогли поддерживать жизнь пациента при помощи искусственного сердца в течение почти полутора часов. В те времена в разных странах мира полным ходом шла работа над аппаратом, который позволил бы заменить человеческое сердце. Разные конструкции такого устройства испытывали едва ли не ежемесячно. Опыты над животными плавно подходили к концу, и учёные всё чаще пытались задействовать аппараты при оперировании людей.
О полноценной замене сердца тогда речь ещё не шла, однако исследователи вплотную подошли к изобретению устройства, которое могло бы поддерживать кровообращение во время операций. В те времена их могли проводить только на закрытом сердце, что сильно ограничивало число нарушений, которые хирурги могли исправить.
Одним из первых успехов можно считать работу российского экспериментатора Владимира Демихова. В 1937 году он заменил сердце собаки на искусственный агрегат. Ему удалось доказать, что по крайней мере несколько часов кровь по сосудам можно гонять таким образом. Позднее он и вовсе провёл успешную операцию по трансплантации донорского сердца псу, допустив возможность пересадки органа в организм человека.
Другой учёный, американский исследователь Джон Гиббон, из года в год проводил многочисленные эксперименты сначала на животных, а затем при поддержке компании IBM начал испытывать свои аппараты на людях. Также над устройствами, в основе которых лежал насос для перекачки жидкостей, работали Клэренс Деннис, Чарльз Линдберг, Алексис Каррель и другие.
Помимо перекачки крови нужно было снабжать организм пациента кислородом, но объединить два устройства в одно было меньшей проблемой. Пациенты, возраст которых зачастую не превышал пять лет, погибали во время операций. Джон Гиббон списывал это на человеческий фактор. Он был уверен, что техника работает исправно. Стоит отметить, что к фатальным последствиям для пациентов в ходе недолгих операций как правило приводил неправильный диагноз.
Он был уверен, что техника работает исправно. Стоит отметить, что к фатальным последствиям для пациентов в ходе недолгих операций как правило приводил неправильный диагноз.
Громкая сенсация
8 марта 1952 41-летнему сталевару Питеру Дьюрингу из городка Бетхелем понадобилась операция на сердце. В распоряжении врачей из трёх больниц, которые поспешили ему на помощь, был прибор на основе перистальтического насоса, принцип которого разработал ещё в 1931 году американский кардиохирург Майкл Дебейки. Сам учёный к тому времени преподавал в Бэйлорском университете в Техасе, а аппарат местные врачи доработали сами.
Подключив пациента к насосу, девять врачей, пять медсестёр и два технических специалиста пытались найти причины ухудшения состояния мужчины. Аппарат установили так, чтобы он перегонял только часть крови — три литра в минуту вместо пяти. Медики надеялись обнаружить кровяной сгусток или другую преграду, мешавшую нормальной работе органа. Несмотря на то, что спасти Дьюринга не удалось, благодаря насосу он смог прожить ещё 80 минут.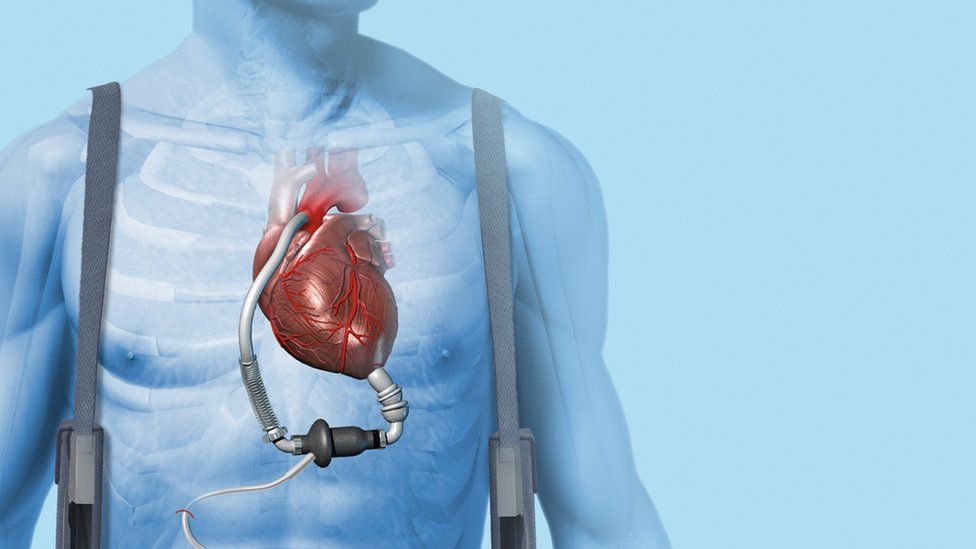
Следующие несколько дней СМИ друг за другом разносили новости об уникальной операции. «Врачи впервые успешно применили искусственное сердце во время операции, но пациент скончался», — говорилось в выходившей в штате Огайо газете The Coshocton Tribune. При этом отмечалось, что это был первый случай в стране, когда к аппарату подключили человека. Со ссылкой на представителей больницы та же газета сообщала, что чуть раньше местные учёные удачно испытали насос для кровообращения на собаке.
Наука пропитывает жизнь
До настоящей сенсации оставалось совсем недолго. Одной из первых успешных операций на человеческом сердце при использовании аппарата искусственного кровообращения считают опыт с устройством американского хирурга Фостера Додрилла. Объединившись с инженерами компании General Motors, он разработал своё искусственное сердце. В июле 1952 года Додрилл успешно применил свой аппарат, напоминающий 12-цилиндровый двигатель, чтобы исправить порок сердца у 41-летнего Генри Опитека. Процедура длилась 80 минут, 50 из которых больной был подключен к аппарату. После операции Опитек прожил ещё около 30 лет.
Процедура длилась 80 минут, 50 из которых больной был подключен к аппарату. После операции Опитек прожил ещё около 30 лет.
Искусственное сердце, разработанное Додриллом.
gmheritagecenter.com
Чуть позже добился положительного результата и американский кардиохирург Джон Гиббон. Его первая по-настоящему удачная операция прошла в Медицинском колледже Джефферсона в Пенсильвании. 6 мая 1953 года у Гиббона получилось успешно прооперировать 18-летнюю девушку. Однако последующие операции были омрачены смертями пациентов от осложнений, в связи с чем учёный отказался от дальнейших испытаний созданного им искусственного сердца.
С тех пор учёные продолжали разработку аппаратов искусственного кровоснабжения и значительно продвинулись в этой области, хотя операции на открытом сердце по-прежнему остаются довольно опасными. Что же касается сенсации в пенсильванской больнице, быстро разошедшаяся новость не забылась со временем. Так, например, американский писатель Чарльз Уиллингем в своей книге «В моё время: век величайших изменений в истории человечества» (In My Time:the Greatest Century of Change in the History of Man), вспоминает, как 8 марта 1952 года услышал по телевизору о том, что на человеке впервые успешно испытали искусственное сердце.
«Я очень любил науку, — писал он. — И каждый день, куда ни гляну, я везде замечал, как она пропитывает нашу жизнь».
Владимир Демихов,IBM,General Motors,
Каково это — жить с искусственным сердцем?
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Greg Funnell/ British Heart Foundation
Подпись к фото,
Джим Лински всегда носит с собой запасные батарейки, ведь от них в прямом смысле зависит его жизнь
50 лет назад знаменитый хирург Кристиан Барнард осуществил первую в мире успешную операцию по пересадке человеческого сердца. С тех пор такие операции стали обычным делом.
- 50 лет первой трансплантации сердца в мире
- Сердечные дела: на что будут способны кардиохирурги в будущем
Сейчас в Великобритании в очереди на пересадку сердца стоит около 300 человек, и многим из них в качестве временной меры — пока не нашлось донорское сердце — ставят механический насос.
Этот насос называется вспомогательным устройством левого желудочка сердца (LVAD) и помогает поддерживать ток крови в организме.
Для многих эта временная мера растягивается на годы, и все это время они вынуждены полагаться на LVAD, работающий от батарейки. Каково это, жить с таким искусственным сердцем?
Студенту Джиму Лински LVAD вживили в 2015 году, когда ему было всего 19. Считается, что он стал самым молодым жителем Великобритании, которому установили это устройство.
На второй неделе жизни Джим и его сестра-двойняшка Грейс заболели менингитом. Девочка перенесла это вирусное заболевание без последствий, а вот у ее брата было сильно повреждено сердце.
Сейчас Лински, как и большинство пациентов с LVAD, включен в список на трансплантацию, но не считается первоочередником.
«Мне ни разу не предлагали пересадку, — говорит он. — И это очень странно, если учесть, что в списке у меня не так много «конкурентов», у которых был бы тот же рост, вес и возраст».
Автор фото, Greg Funnell/ British Heart Foundation
Подпись к фото,
Джим Лински (на фото с сестрой и матерью) в детстве переболел менингитом, который дал осложнение на сердце
Лински продолжает учебу в университете Шеффилд Халлам и ведет независимый образ жизни вдали от дома.
Правда, он всегда носит с собой рюкзачок, провода от которого уходят прямо в тело.
Он хорошо понимает, как это выглядит со стороны, поэтому батарейки держит в кармане, а пульт управления — на поясе, чтобы все это не бросалось в глаза.
И еще он мечтает о том, чтобы вместе с друзьями ходить в спортзал или бассейн и не задумываться об этом.
Что такое вспомогательное устройство левого желудочка сердца?
Автор фото, Science Photo Library
- LVAD — это своего рода искусственный сердечный насос
- Устройством пользуются люди с тяжелой сердечной недостаточностью.
 Иногда его вживляют людям, ожидающим пересадки сердца
Иногда его вживляют людям, ожидающим пересадки сердца - Обычно левый желудочек, одна из четырех камер сердца, закачивает кровь в аорту и далее гонит ее по всему телу
- В случае тяжелой сердечной недостаточности сердце настолько ослаблено, что не справляется с этой работой
- Тогда устройство помогает сердцу восстановить нормальный ток крови
- Некоторым пациентам, ожидающим пересадки сердца, может понадобиться LVAD, если, по оценкам врачей, они не доживут до тех пор, пока не найдется подходящее донорское сердце
Источник: British Heart Foundation
Иногда он просыпается по ночам от жужжания устройства. Но когда Лински спит, батарейки подзаряжаются. На следующий день это дает им 8-10 часов работы.
«Особенно трудно принимать душ, потому что я не могу слишком сильно мочить ранку, — признается он. — Да и студенческий образ жизни поддерживать нелегко. Если в клубе что-нибудь прольешь на себя, приходится бежать домой. Страшно подумать, что будет, если тебя случайно толкнут или обольют. Так что жить с чем-то таким неестественным, особенно в свои лучшие молодые годы, очень непросто».
Страшно подумать, что будет, если тебя случайно толкнут или обольют. Так что жить с чем-то таким неестественным, особенно в свои лучшие молодые годы, очень непросто».
Автор фото, Calon Cardio
Подпись к фото,
Конструкция насосов постоянно совершенствуется
Когда три года назад Лински только имплантировали LVAD, он весил всего 44 килограмма. Сейчас он набрал вес.
«Я чувствую себя сейчас намного лучше, чем когда у меня еще не было насоса. Мой организм стал функционировать более стабильно. Но иногда все равно возникают невероятные сложности», — признается он.
В октябре старый насос отказал, и Лински пришлось вставлять новый LVAD в больнице. Свой 22-ой день рождения он провел в коме.
И хотя он благодарен врачам за насос, который не дает ему умереть, Лински говорит, что, если бы ему пересадили полноценное сердце, это избавило бы его от многих страхов и ограничений.
Конечная терапия
У нынешних насосов есть свои минусы. Помимо торчащих прямо из тела проводов и необходимости носить с собой батарейки, пациенты не застрахованы от таких осложнений, как инфекции и кровотечения.
Помимо торчащих прямо из тела проводов и необходимости носить с собой батарейки, пациенты не застрахованы от таких осложнений, как инфекции и кровотечения.
Кроме того, для некоторых людей, включая тех, кто, по мнению врачей, слишком слаб для трансплантации, LVAD является окончательным решением.
Подпись к фото,
Профессор Стивен Уэстаби установил искусственное сердце Питеру Хаутону, который попал в Книгу рекордов Гиннеса
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Одним из таких людей был психолог из Бирмингема Питер Хаутон. Он скончался в 2007 году, но успел попасть в Книгу рекордов Гиннеса как самый долгоживущий пациент с искусственным сердцем.
Хаутон активно работал, консультируя смертельно больных людей, когда у него самого начались проблемы с сердцем.
Когда через несколько лет он наконец попал на прием к кардиохирургу Стивену Уэстаби, Хаутон страдал от сильной одышки, у него была подагра, язвы по всему телу, и вообще, по его собственному признанию, «жить стало слишком больно».
Профессор Уэстаби счел, что для трансплантации Хаутон слишком болен и жить ему осталось считанные недели. Поэтому он предложил радикальную операцию по вживлению искусственного сердца. И Хаутон ухватился за этот шанс, который он потом называл лотерейным билетом.
В июне 2000 года ему вставили насос модели Jarvik. Хаутону пришлось носить с собой рюкзачок с батареями и контроллером. Кроме того, в черепе ему сделали миниатюрную розетку, провод от которой тянулся прямо к насосу.
С тех пор Питер Хаутон прожил еще семь лет, вместе с женой усыновил более 10 детей, совершил благотворительный поход протяженностью в 91 милю (почти 150 км) и посещал различные международные конференции, на которых неизменно выступал в поддержку LVAD.
Но его главная задача заключалась в том, чтобы сделать искусственное сердце «конечной терапией», после которой уже не требовалась бы трансплантация донорского органа.
Автор фото, PA
Подпись к фото,
В череп Питера Хаутона был вставлен металлический разъем, провод от которого тянулся прямо к насосу
Автор фото, PA
Подпись к фото,
Jarvik 2000. Устройство такого типа носил Питер Хаутон
Что касается Джима Лински, то ему пересадка сердца, конечно, обеспечила бы более высокое качество жизни. Однако в ближайшие полгода его не станут включать в список первоочередников, поскольку ему совсем недавно пересадили новейший LVAD и, чтобы он как следует прижился, должно пройти время.
«Честно говоря, с этим насосом я был бы рад не ложиться под нож хирурга еще 10 лет, а потом, быть может, и подумал бы о трансплантации, — говорит он. — Но если до этого мне вдруг предложат пересадку, я вряд ли откажусь от такой возможности».
Robert Jarvik, MD на Jarvik-7
Robert Jarvik, MD широко известен как изобретатель первого успешного постоянного искусственного сердца, Jarvik 7.
В 1982 году первая имплантация Jarvik 7 пациенту Барни Кларку привлекли внимание средств массовой информации по всему миру. Чрезвычайная открытость этого медицинского эксперимента, проведенного при содействии Университета штата Юта, вызвала горячие общественные дебаты по всем аспектам медицинских исследований. Но когда врачи узнали, как добиться отличных клинических результатов у последующих пациентов с Jarvik 7, пресса и общественность в значительной степени потеряли интерес к этой теме. В результате устаревшие и ошибочные отчеты снова и снова появлялись в основных дискуссиях о Jarvik 7. Я встретился с доктором Ярвик, чтобы обсудить распространенные ошибки и ложные впечатления о первом постоянном искусственном сердце, устройстве, которое используется до сих пор и имеет самый высокий уровень успеха среди всех механических сердечных или вспомогательных устройств в мире.
Искусственные сердца в контексте
По сути, существует два типа искусственных сердец: полное искусственное сердце, которое имплантируется после удаления естественного сердца, и вспомогательное устройство для желудочков, которое имплантируется для поддержки естественного сердца, оставляя собственное сердце пациента на месте и все еще функционирует.
«Удаление сердца человека — одна из самых драматических хирургических операций, которые только можно себе представить», — говорит д-р Ярвик, который начал разработку крошечного вспомогательного желудочкового устройства Jarvik 2000 в 1988. «Неудивительно, что больше внимания общественности уделяется замене сердца, чем его помощи. Но подумайте над этим вопросом: если бы у вас была неисправная рука или нога, вы бы предпочли лучший из возможных протезов или устройство, которое позволило бы вам сохранить собственную руку или ногу?»
Вопрос риторический. Но хотя вспомогательные устройства для работы желудочков находят более широкое применение у пациентов, чем полностью искусственные сердца, эксперты рассматривают их как дополняющие друг друга методы лечения.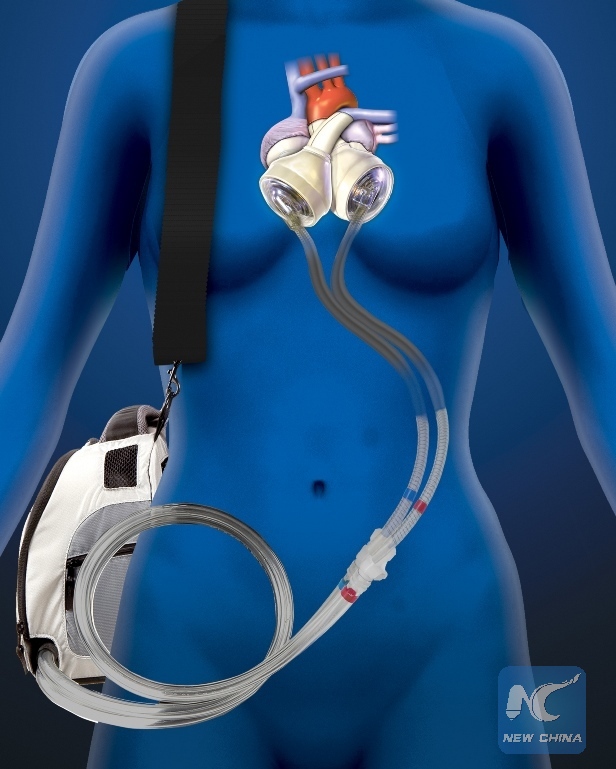 Например, полное искусственное сердце требуется, когда вспомогательное устройство не подходит, например, в случаях бивентрикулярной недостаточности, когда обе стороны естественного сердца колеблются.
Например, полное искусственное сердце требуется, когда вспомогательное устройство не подходит, например, в случаях бивентрикулярной недостаточности, когда обе стороны естественного сердца колеблются.
В 60-х и 70-х годах Национальные институты здравоохранения (NIH) разрабатывали механические сердца, но они были малоизвестны широкой публике. Затем, в 1967 году, Кристиан Бернар провел первую трансплантацию человеческого сердца, событие, вызвавшее интерес во всем мире: люди внезапно узнали о замене сердца как о способе лечения сердечной недостаточности. В 1969 году Дентон Кули провел первую имплантацию временного тотального искусственного сердца, и примитивное устройство поддерживало пациента в течение почти трех дней, пока по настоятельному призыву в прессе не был найден донор. Спустя еще полтора десятилетия исследований, поддерживаемых NIH, сердце Jarvik 7 стало первым полностью искусственным сердцем, имплантированным в качестве постоянной замены безнадежно больному естественному сердцу.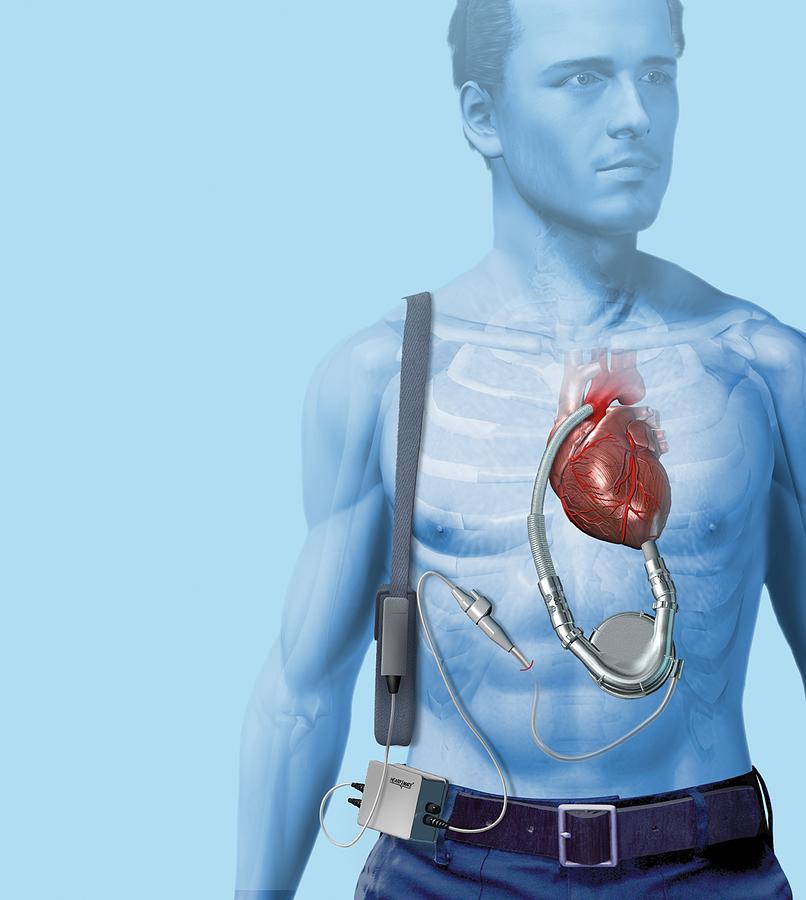
Первые пациенты Jarvik 7
2 декабря 1982 года в Университете штата Юта доктор медицинских наук Уильям ДеВриз имплантировал тотальный искусственный Jarvik 7 Барни Кларку, дантисту из Сиэтла, который вызвался пройти новаторскую процедуру, потому что хотел сделать вклад в медицинскую науку. Доктор Ярвик вспоминает, что перед операцией доктор Кларк сказал врачам, что не рассчитывает прожить с экспериментальным сердцем больше нескольких дней, но надеется, что то, что узнали врачи, когда-нибудь поможет спасти жизни других людей.
Доктор Ярвик, возглавлявший компанию по производству сердца Jarvik 7, договорился с администрацией университета не предоставлять никакой информации прессе напрямую: никаких пресс-релизов и никаких интервью. Вместо этого информация будет проходить через пресс-службу университета. Заявленная цель состояла в том, чтобы придерживаться самых высоких этических принципов и проводить это важное медицинское исследование открыто, без каких-либо усилий по влиянию или ограничению прессы. Желательна или ожидаема небольшая пресса. Университет провел брифинг перед исторической операцией, и посещаемость была умеренной.
Желательна или ожидаема небольшая пресса. Университет провел брифинг перед исторической операцией, и посещаемость была умеренной.
«Новости о Барни Кларке ошеломили врачей, попав в заголовки газет по всему миру», — говорит д-р Ярвик. «Развился огромный общественный интерес, и сотни репортеров собрались в Солт-Лейк-Сити, чтобы осветить эту историю, а университет начал проводить для них ежедневные брифинги, которые не подвергались никакой цензуре. Сообщалось обо всех значимых с медицинской точки зрения событиях в послеоперационном периоде, как об успехах, так и о неудачах».
Инструктажи носили образовательный характер и содержали много медицинской информации, в том числе объяснения основ физиологии, интерпретации лабораторных анализов и рентгеновских снимков, а также длинные сессии вопросов и ответов. Были полностью описаны все осложнения, а также эффективность механического сердца для поддержания нормального кровотока доктора Кларка и поддержания его жизни.
«Огромный объем информации и чрезвычайная степень прозрачности создали нечто вроде медицинского эксперимента в аквариуме, — говорит доктор Ярвик. Университет Юты достиг своих исследовательских и образовательных целей, но освещение в прессе, казалось, оставило у его читателей необоснованные надежды и ожидания: многие начали верить, что искусственные сердца скоро станут обычным явлением и почти решат проблему сердечных заболеваний. Пристальное внимание также привлекло критиков, которые, по-видимому, ничего не знали о щедрых намерениях доктора Кларка и назвали его «человеческой морской свинкой». Позже вдова доктора Кларка попыталась изменить это ложное впечатление, чтобы воздать своему мужу должное гуманитарное доверие, которого он заслуживал. Но миссис Кларк получила гораздо меньше прессы, чем критических комментариев, и ее миссия в конечном итоге провалилась. Прежде чем можно было провести еще один случай, доктор Де Вриз, хирург, принял предложение присоединиться к исследовательской программе в больнице Humana в Луисвилле, штат Кентукки, и поделился там своим опытом.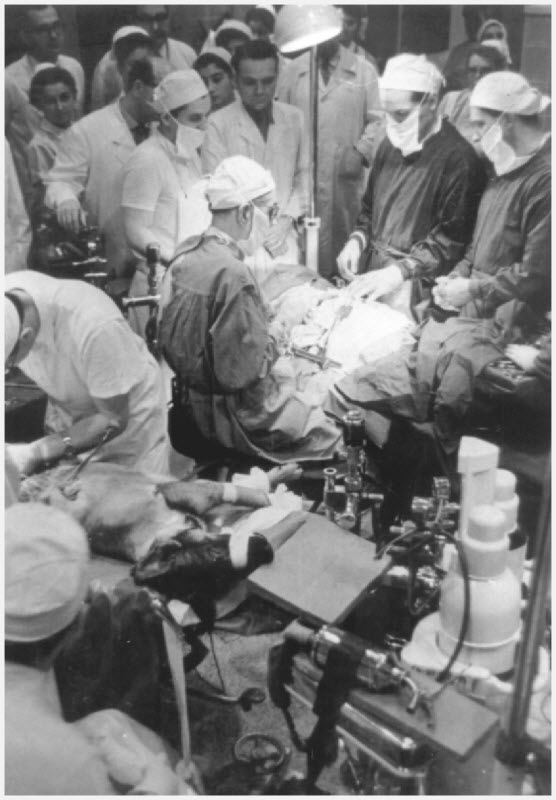
Следующие несколько имплантаций сердца Jarvik 7, проведенные Humana — национальной сетью больниц — прошли так же, как и первые: с обнародованием обширной медицинской информации и политикой открытой прессы. Второй имплантат Jarvik 7 был установлен в 1985 году. Билл Шредер, пациент, поначалу чувствовал себя настолько хорошо, что, когда через неделю президент Рональд Рейган позвонил ему с пожеланиями выздоровления, он спросил президента, почему его чек социального обеспечения задержался. (Он был доставлен из рук в руки на следующий день.) Г-н Шредер дал оптимистичные интервью журналистам и даже пошутил, что его шумная консоль привода «звучит как старомодная молотильная машина». Но всего через две недели после операции у него случился серьезный инсульт, из-за которого он не мог говорить. Позже г-н Шредер переехал из больницы и жил со своей женой в соседней квартире, которая была оснащена необходимым ему специальным оборудованием, включая воздушный компрессор и аварийный генератор. Во время путешествий он использовал портативную систему питания на сжатом воздухе, которая весила около пятнадцати фунтов. Во время своего пребывания на Jarvik 7 он посетил свой родной город в Индиане и проехал по Мейн-стрит на параде, посетил баскетбольный матч и порыбачил, но в ограниченном количестве: у него было много проблем со здоровьем, включая другие серьезные инсульты и инфекции. . В целом г-н Шредер прожил 620 дней с восстановленной сердечной функцией, но из-за осложнений.
Во время путешествий он использовал портативную систему питания на сжатом воздухе, которая весила около пятнадцати фунтов. Во время своего пребывания на Jarvik 7 он посетил свой родной город в Индиане и проехал по Мейн-стрит на параде, посетил баскетбольный матч и порыбачил, но в ограниченном количестве: у него было много проблем со здоровьем, включая другие серьезные инсульты и инфекции. . В целом г-н Шредер прожил 620 дней с восстановленной сердечной функцией, но из-за осложнений.
Три других пациента получили сердце Jarvik 7 для постоянного использования в течение следующего года — еще два в Луисвилле и один в Швеции. Один пациент умер от кровотечения через неделю после операции; остальные прожили 10 месяцев и 14 месяцев. Как выяснилось, шведским пациентом был мужчина, обвиненный в уклонении от уплаты налогов, но после того, как ему удалили сердце, он был официально объявлен мертвым, поскольку по шведским законам человек считается мертвым, когда его или ее сердце перестало биться. Обвинения против него были официально сняты. В тот день, когда он получил эту новость, пациент был в восторге: он пошутил со своими врачами, что старая поговорка о том, что нет ничего определенного, кроме смерти и налогов, не соответствует действительности.
Обвинения против него были официально сняты. В тот день, когда он получил эту новость, пациент был в восторге: он пошутил со своими врачами, что старая поговорка о том, что нет ничего определенного, кроме смерти и налогов, не соответствует действительности.
The Jarvik 7 Сегодня
После первых пяти постоянных случаев сердце Jarvik 7 стало более широко использоваться в качестве временного тотального искусственного сердца, что позволяет пациентам переходить на трансплантацию. Шестой пациент прожил пять лет после того, как было найдено донорское сердце, а седьмой пациент прожил одиннадцать лет со своим донорским сердцем. Другому пациенту перенесли мост из сердца Jarvik 7 в человеческое сердце, что дало ему еще четырнадцать лет нормальной жизни. Пресса не знала об этих успехах или, возможно, считала эту тему устаревшей, что, по словам доктора Ярвика, «более чем устраивало» причастных к этому врачей. Но со временем пресса начала ошибочно сообщать, что использование сердца Jarvik 7 прекратилось после первых пяти. Позже это превратилось в ошибочное сообщение о том, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) запретило его использование. Еще позже это превратилось в ошибочное сообщение о том, что сердце Jarvik 7 было неудачным экспериментом: пресса начала верить в свои собственные ошибки.
Позже это превратилось в ошибочное сообщение о том, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) запретило его использование. Еще позже это превратилось в ошибочное сообщение о том, что сердце Jarvik 7 было неудачным экспериментом: пресса начала верить в свои собственные ошибки.
С 1982 года более 350 пациентов использовали сердце Jarvik 7, и оно используется по сей день. Первые несколько пациентов жили в среднем 10 месяцев (когда ожидаемая продолжительность их жизни составляла всего несколько дней или недель). Частота осложнений была высокой. «Именно здесь пресса перестала проводить исследования и проверять факты и вместо этого начала публиковать ошибку за ошибкой за ошибкой», — отмечает д-р Ярвик. Все аспекты опыта, от роли государственного финансирования исследований до этики экспериментов на людях, обсуждались, но часто на основе дезинформации. Появились газетные и журнальные статьи с устаревшими и ошибочными описаниями. Были опубликованы книги с многочисленными ошибками. Тем временем врачи приобрели опыт работы с Jarvik 7 и научились более эффективно лечить своих пациентов и с меньшим количеством осложнений.
Тем временем врачи приобрели опыт работы с Jarvik 7 и научились более эффективно лечить своих пациентов и с меньшим количеством осложнений.
«Знающие врачи с изумлением наблюдали, как вопиющие ошибки появлялись в печати, а затем повторялись снова и снова, поскольку газеты и журналы копировали более ранние истории и друг друга и не тратили время на получение информации из первоисточников», — говорится в сообщении. Доктор Ярвик. «Мне очень редко звонили, чтобы проверить факты. Например, пресса неоднократно писала, что доктор Кларк умер от инсульта. На самом деле, у него никогда не было инсульта. Пресса снова и снова писала, что консоль, необходимая пациенту для питания сердца, была «размером с холодильник». портфель.»
И это еще не все, говорит доктор Ярвик. «Пресса также писала, что сердце Jarvik 7 вызвало высокий уровень инсультов и инфекций. Пресса не заметила, что по мере того, как делалось больше случаев, эти показатели резко падали, но устройство оставалось тем же.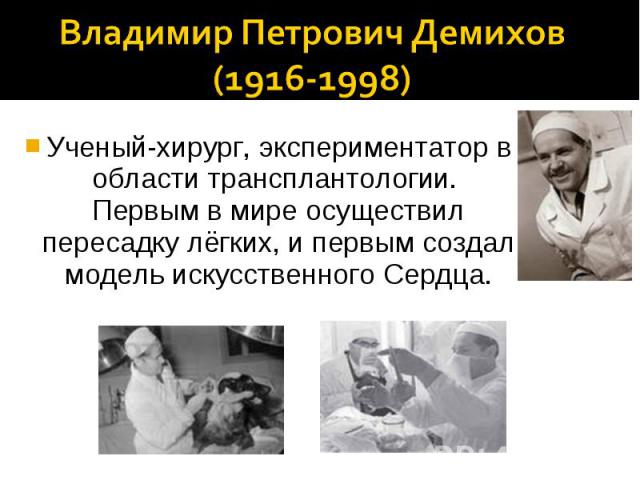 Таким образом, само по себе устройство никогда не было причиной более ранних осложнений. Скорее, врачам нужно было научиться более эффективно управлять своими пациентами: в этом в первую очередь и заключается смысл таких исследований».
Таким образом, само по себе устройство никогда не было причиной более ранних осложнений. Скорее, врачам нужно было научиться более эффективно управлять своими пациентами: в этом в первую очередь и заключается смысл таких исследований».
Возможно, самая вопиющая ошибка из всех — та, которая время от времени всплывает в обличительных выступлениях некоторых самопровозглашенных ученых мужей: сердце Джарвика 7 было неудачным экспериментом. Фактически, он достиг самого высокого уровня успеха среди всех типов искусственного сердца или вспомогательных устройств, которые когда-либо были разработаны. (Подробности см. ниже.) Сегодня сердце Jarvik 7 доступно примерно в десяти медицинских центрах в США, Канаде, Франции и Германии под названием тотальное искусственное сердце CardioWest. (Владелец несколько раз переходил из рук в руки, но конструкция устройства практически не изменилась.)
Сравнение Jarvik 7 с другими устройствами
В 1986 году д-р Ярвик был председателем и генеральным директором Symbion, Inc. , публичной компании, производившей сердце Jarvik 7. Венчурная компания, которая финансировала Symbion, подала заявку на враждебное поглощение. Доктор Ярвик выступил против поглощения и подал жалобу в Комиссию по ценным бумагам и биржам, поскольку венчурная фирма имела доступ к конфиденциальной информации. Однако ему не удалось остановить это, и в результате он потерял свою позицию. Затем он основал Jarvik Heart, Inc. и начал работу в другом направлении, чтобы создать сердце Jarvik 2000, вспомогательное устройство для работы желудочков. Производство сердца Jarvik 7 продолжалось без него.
, публичной компании, производившей сердце Jarvik 7. Венчурная компания, которая финансировала Symbion, подала заявку на враждебное поглощение. Доктор Ярвик выступил против поглощения и подал жалобу в Комиссию по ценным бумагам и биржам, поскольку венчурная фирма имела доступ к конфиденциальной информации. Однако ему не удалось остановить это, и в результате он потерял свою позицию. Затем он основал Jarvik Heart, Inc. и начал работу в другом направлении, чтобы создать сердце Jarvik 2000, вспомогательное устройство для работы желудочков. Производство сердца Jarvik 7 продолжалось без него.
В 1990 году, после того как Jarvik 7 был использован у 198 пациентов, Symbion прекратила производство устройства, поскольку компания больше не соблюдала требования FDA по ведению документации и отчетности. В прессе ложно сообщалось, что FDA удалило Jarvik 7 с рынка, потому что у устройства был высокий процент отказов. На самом деле отказы Jarvik 7 случались крайне редко. Имплантированное сердце Jarvik 7 является более надежным и имеет меньше механических отказов, чем любое имплантированное искусственное сердце с положительным смещением (менее 2% отказов диафрагмы в исследовании FDA с участием 81 пациента). В качестве сравнения д-р Ярвик отмечает, что частота повторных операций по ремонту или замене устройства HeartMate составила более 75% в течение двух лет в крупном рандомизированном клиническом исследовании под названием REMATCH. У устройства Novacor частота повторных операций по замене или ремонту составляет 16% в течение двух-трех лет на основе анализа историй болезни 1077 пациентов. Кроме того, почти во всех устройствах Novacor основной подшипник выходит из строя в течение трех-четырех лет, и его необходимо заменить новым устройством.
В качестве сравнения д-р Ярвик отмечает, что частота повторных операций по ремонту или замене устройства HeartMate составила более 75% в течение двух лет в крупном рандомизированном клиническом исследовании под названием REMATCH. У устройства Novacor частота повторных операций по замене или ремонту составляет 16% в течение двух-трех лет на основе анализа историй болезни 1077 пациентов. Кроме того, почти во всех устройствах Novacor основной подшипник выходит из строя в течение трех-четырех лет, и его необходимо заменить новым устройством.
Позднее, в 1990 году, Symbion передала свои права Исследовательскому фонду MedForte, который в 1991 году в сотрудничестве с Университетским медицинским центром в Тусоне, штат Аризона, создал компанию CardioWest Technologies, Inc. Затем сердце Jarvik 7 было переименовано в сердце CardioWest, и Symbion закрыл свои двери. Сердце CardioWest идентично сердцу Jarvik 7 небольшого размера, разработанному для женщин и мужчин меньшего роста в середине 1980-х годов.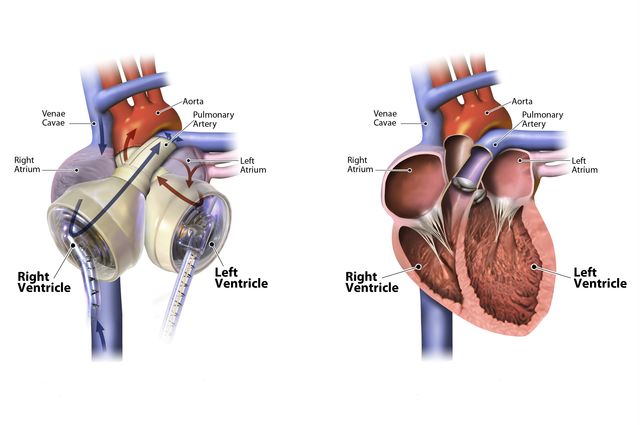 Устройство использует ту же конструкцию насоса для крови, те же клапаны Medtronic-Hall и ту же систему внешнего питания, что и оригинальное сердце Jarvik 7 небольшого размера. Единственными изменениями являются использование пневматических силовых труб меньшего диаметра, входящих в корпус, и современный портативный компьютер, заменяющий первоначально использовавшийся портативный компьютер Compaq.
Устройство использует ту же конструкцию насоса для крови, те же клапаны Medtronic-Hall и ту же систему внешнего питания, что и оригинальное сердце Jarvik 7 небольшого размера. Единственными изменениями являются использование пневматических силовых труб меньшего диаметра, входящих в корпус, и современный портативный компьютер, заменяющий первоначально использовавшийся портативный компьютер Compaq.
В 1993 году компания CardioWest Technologies получила разрешение на проведение клинических исследований сердца в качестве моста к трансплантации в пяти медицинских центрах США. Исследование показало, что сердце Jarvik 7 (CardioWest) безопасно и эффективно. Когда исследование было завершено в 2003 году, компания снова сменила владельца и название, на этот раз на SynCardia, Inc., ее нынешний статус.
Исследование FDA длилось десять лет и включало 95 пациентов. Он показал 79% успеха моста к трансплантации и отличную общую выживаемость, включая трансплантацию (70% через один год, 50% через пять лет и 45% через восемь лет).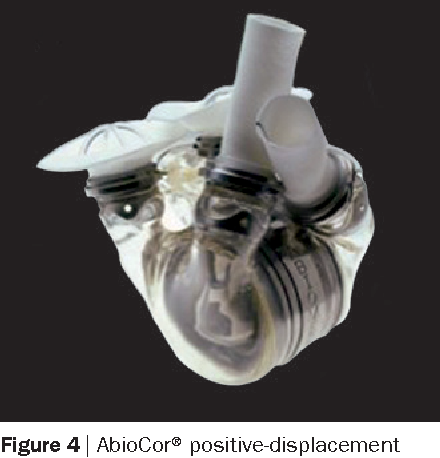 Таким образом, в исследовании, проведенном в США, Jarvik 7 (CardioWest) имеет более высокий показатель успеха от моста до трансплантации, чем любое другое полностью искусственное сердце или любое устройство поддержки желудочков, когда-либо разработанное. Уровень успеха в зарубежных странах ниже, но все же выше, чем у других устройств. 17 марта 2004 г. обзорная группа FDA рекомендовала предварительное одобрение на продажу (PMA) сердца для использования в качестве моста для трансплантации. 18 октября 2004 г. это одобрение было получено, что сделало Jarvik 7 первым полностью искусственным сердцем, получившим полное одобрение FDA для любых показаний к применению. «Далеко не провал, — говорит д-р Ярвик, — сердце [Jarvik 7] — это задокументированный успех».
Таким образом, в исследовании, проведенном в США, Jarvik 7 (CardioWest) имеет более высокий показатель успеха от моста до трансплантации, чем любое другое полностью искусственное сердце или любое устройство поддержки желудочков, когда-либо разработанное. Уровень успеха в зарубежных странах ниже, но все же выше, чем у других устройств. 17 марта 2004 г. обзорная группа FDA рекомендовала предварительное одобрение на продажу (PMA) сердца для использования в качестве моста для трансплантации. 18 октября 2004 г. это одобрение было получено, что сделало Jarvik 7 первым полностью искусственным сердцем, получившим полное одобрение FDA для любых показаний к применению. «Далеко не провал, — говорит д-р Ярвик, — сердце [Jarvik 7] — это задокументированный успех».
Сравнение Jarvik 7 и тотальных искусственных сердец AbioCor
Единственным другим тотальным искусственным сердцем, доступным в настоящее время для использования у пациентов, является AbioCor, который был одобрен FDA для исследовательского использования у 15 пациентов. AbioCor был имплантирован 14 пациентам в течение трех лет после первого случая. Если бы исследование PMA с AbioCor было проведено с таким уровнем охвата (предполагая, что около 95 пациентов, как в клиническом испытании Jarvik 7 (CardioWest)), то исследование заняло бы 20 лет.
AbioCor был имплантирован 14 пациентам в течение трех лет после первого случая. Если бы исследование PMA с AbioCor было проведено с таким уровнем охвата (предполагая, что около 95 пациентов, как в клиническом испытании Jarvik 7 (CardioWest)), то исследование заняло бы 20 лет.
«Jarvik 7 по своей природе более надежен, чем AbioCor, из-за простоты компонентов Jarvik 7 и многослойной конструкции с низким напряжением наиболее важного компонента — гибкой диафрагмы», — говорит д-р Ярвик. «Jarvik 7 безотказно работал на стенде более шести лет, а один ранний прототип в Университете Юты непрерывно работал на стенде более десяти лет».
AbioCor, напротив, представляет собой очень сложное устройство с многочисленными имплантированными компонентами, которые могут выйти из строя. Фактически второе имплантированное сердце AbioCor имело две неисправности: первая потребовала повторной операции для замены имплантированной батареи, которая преждевременно ослабла; а второй связан с изношенной диафрагмой — одним из критических компонентов устройства — что привело к смерти пациента при выходе из строя.
По словам доктора Ярвика, основным преимуществом сердца Jarvik 7 является его гемодинамическая эффективность в качестве спасательного устройства у пациентов, страдающих крайней сердечной недостаточностью и серьезными вторичными повреждениями других систем органов. Он обеспечивает более высокий кровоток, чем сердце AbioCor, при фактическом использовании пациентом (около 10 л/мин для Jarvik 7 по сравнению с примерно 7 л/мин для AbioCor). Более высокий поток полезен для восстановления функций почек, печени, легких и желудочно-кишечного тракта, которые серьезно нарушены в предсмертных состояниях. Более того, Jarvik 7 более эффективен у пациентов с полиорганной недостаточностью, чем любое вспомогательное устройство для левого желудочка.
Еще одним преимуществом Jarvik 7 является то, что он независимо регулирует работу правой и левой сторон сердца, обеспечивая оптимальное наполнение и выброс с каждой стороны. AbioCor, с другой стороны, попеременно накачивает правую и левую стороны, заполняя одну и опорожняя другую. Его конструкция не допускает независимого управления правой и левой сторонами и, следовательно, может нагнетать кровь в легкие под чрезмерно высоким давлением, нарушая функцию легких. «Почти всем пациентам AbioCor, которые пережили операцию, требуются респираторы в течение месяца или двух, — говорит д-р Ярвик, — тогда как пациенты с Jarvik 7 обычно снимают респиратор в течение нескольких дней».
Его конструкция не допускает независимого управления правой и левой сторонами и, следовательно, может нагнетать кровь в легкие под чрезмерно высоким давлением, нарушая функцию легких. «Почти всем пациентам AbioCor, которые пережили операцию, требуются респираторы в течение месяца или двух, — говорит д-р Ярвик, — тогда как пациенты с Jarvik 7 обычно снимают респиратор в течение нескольких дней».
Консоль основного привода, используемая для большинства пациентов с Jarvik 7, большая, но на самом деле она меньше, чем консоль, используемая более чем для тысячи пациентов с устройствами Thoratec. Хотя основная консоль не подходит для действительно мобильного образа жизни и в настоящее время ограничена использованием в больницах, для Jarvik 7 была разработана небольшая портативная система питания с батарейным питанием, которая используется пациентами, такими как г-н Шредер, вне помещений. больница. С современной технологией литий-ионных аккумуляторов можно создать портативный блок питания весом около 8 фунтов, способный работать несколько часов без замены аккумулятора. Это будет такой же вес, как батарея AbioCor и электронные компоненты.
Это будет такой же вес, как батарея AbioCor и электронные компоненты.
Существенным преимуществом AbioCor является то, что он намного тише, чем шумный Jarvik 7 с четырьмя механическими клапанами сердца. В AbioCor, напротив, используются бесшумные трехстворчатые пластиковые клапаны. Кроме того, две трубки, которые подают сжатый воздух для питания сердца Jarvik 7, являются потенциальным источником инфекции, особенно при длительном использовании (то есть 2-5 лет и более). При тщательном ведении они не представляли серьезной проблемы в клиническом исследовании Jarvik 7 (CardioWest): у 81 пациента было зарегистрировано 17 трансмиссивных инфекций, большинство из которых были поверхностными кожными инфекциями, которые лечили обычной сменой повязок.
AbioCor, однако, спроектирован так, что приводные механизмы не проникают сквозь кожу. Скорее, он использует радиочастотную передачу энергии от внешней катушки передатчика (размером примерно с коробку компакт-диска) на имплантированную катушку приемника. Хотя эта конструкция может предотвратить инфекции, связанные с прокалыванием кожи проводами, д-р Ярвик и другие отмечают ее серьезные недостатки:
Хотя эта конструкция может предотвратить инфекции, связанные с прокалыванием кожи проводами, д-р Ярвик и другие отмечают ее серьезные недостатки:
- Она требует очень сложных, громоздких имплантируемых компонентов, которые значительно увеличивают травматичность операции по имплантации и сдавливают внутренние органы. В грудную клетку и брюшную полость пациента необходимо имплантировать почти пять фунтов оборудования, и это оборудование, как правило, очень сложно и дорого сделать надежным.
- Система чрескожной передачи энергии тратит впустую около 40% энергии внешней батареи, что требует от пациента носить с собой большую и тяжелую внешнюю батарею.
- Имплантированную батарею необходимо заменять раз в год или два, что требует серьезной операции, сопряженной со значительным риском кровотечения и инфицирования. Кроме того, внутренняя батарея позволяет AbioCor работать менее 30 минут. Это не батарея кардиостимулятора, которая работает годами.
«Еще одно преимущество сердца Jarvik 7, — добавляет д-р Ярвик, — заключается в том, что оно помещается более чем в 90% населения США, как мужчины, так и женщины. Напротив, AbioCor подходит менее чем для 10% населения и лишь для нескольких процентов американских женщин».
Напротив, AbioCor подходит менее чем для 10% населения и лишь для нескольких процентов американских женщин».
Таблица Сравнение первых клинических результатов Jarvik 7 с первыми клиническими результатами AbioCor
В приведенной ниже таблице данных сравниваются первые пациенты Jarvik 7 с исходными пациентами AbioCor. Он включает только первых семь пациентов, потому что на момент написания этой статьи данные о более поздних пациентах Jarvik 7 недоступны.
«Несмотря на все затраченные усилия и использование сложных современных технологий, AbioCor не добился лучших результатов, чем Jarvik 7 двадцать лет назад», — говорит д-р Ярвик. Он отмечает, что пациенты Jarvik 7 прожили дольше и с лучшим качеством жизни, чем пациенты AbioCor. Ни один пациент Jarvik 7 не умер во время операции, но умерли двое пациентов AbioCor. Ни один пациент Jarvik 7 не умер из-за отказа устройства, но два пациента AbioCor умерли в результате механических повреждений. У обоих устройств была серьезная проблема с инсультом у первых пациентов, которая значительно уменьшилась у более поздних пациентов Jarvik 7. «Абиомед» внес изменения в конструкцию, чтобы избежать инсультов, но они продолжали возникать у пациентов.
«Абиомед» внес изменения в конструкцию, чтобы избежать инсультов, но они продолжали возникать у пациентов.
«Не говоря уже о том, — добавляет д-р Ярвик, — что нынешние результаты с Jarvik 7 (CardioWest) намного лучше, чем первоначальные результаты много лет назад».
Изобретателя искусственного сердца вдохновил его отец-сантехник
Я работаю отоларингологом более двух десятков лет. Мои пациенты говорят мне, что им нужен более естественный звук, больше удовольствия от музыки и, прежде всего, лучшее понимание речи, особенно в условиях фонового шума — так называемая
проблема коктейльной вечеринки. В течение 15 лет моя команда из Геттингенского университета в Германии сотрудничала с коллегами из Фрайбургского университета и других университетов, чтобы заново изобрести кохлеарный имплант поразительно нелогичным способом: с использованием света.
Мы понимаем, что современные кохлеарные импланты наталкиваются на жесткие ограничения техники и физиологии человека. Поэтому мы разрабатываем кохлеарный имплант нового типа, в котором используются излучатели света и генетически измененные клетки, реагирующие на свет. Используя точные лучи света вместо электрического тока для стимуляции кохлеарного нерва, мы ожидаем, что наши оптические кохлеарные имплантаты будут лучше воспроизводить полный спектральный характер звуков и лучше имитировать естественный слух. Мы стремимся начать клинические испытания в 2026 году, и, если все пойдет хорошо, мы можем получить одобрение регулирующих органов на наше устройство в начале следующего десятилетия. Тогда люди во всем мире могли начать слышать свет.
Поэтому мы разрабатываем кохлеарный имплант нового типа, в котором используются излучатели света и генетически измененные клетки, реагирующие на свет. Используя точные лучи света вместо электрического тока для стимуляции кохлеарного нерва, мы ожидаем, что наши оптические кохлеарные имплантаты будут лучше воспроизводить полный спектральный характер звуков и лучше имитировать естественный слух. Мы стремимся начать клинические испытания в 2026 году, и, если все пойдет хорошо, мы можем получить одобрение регулирующих органов на наше устройство в начале следующего десятилетия. Тогда люди во всем мире могли начать слышать свет.
На этих трехмерных микроскопических изображениях анатомии уха мыши видны оптические имплантаты [пунктирные линии], проходящие через сложную структуру нормальной улитки, которая содержит волосковые клетки; при глухоте эти клетки утрачиваются или повреждаются. Слева волосковые клетки [голубая спираль] соединяются с кохлеарными нервными клетками [синие нити и точки]. На среднем и правом изображениях костяной корпус улитки мыши окружает это тонкое устройство. Даниэль Кеппелер
На среднем и правом изображениях костяной корпус улитки мыши окружает это тонкое устройство. Даниэль Кеппелер
Как работают кохлеарные импланты
Немного
По данным Всемирной организации здравоохранения, 466 миллионов человек во всем мире страдают от инвалидизирующей потери слуха, требующей вмешательства. Потеря слуха в основном возникает в результате повреждения улитки, вызванного болезнью, шумом или возрастом, и до сих пор неизлечимо. Слух можно частично восстановить с помощью слуховых аппаратов, которые, по сути, передают усиленную версию звука оставшимся сенсорным волосковым клеткам улитки. Люди с глубокими нарушениями слуха получают больше пользы от кохлеарных имплантатов, которые, как упоминалось выше, пропускают дисфункциональные или потерянные волосковые клетки и непосредственно стимулируют кохлеарный, или слуховой, нерв.
В 2030-х годах люди во всем мире смогут начать слышать свет.
Сегодняшние кохлеарные имплантаты являются наиболее успешными нейропротезами на сегодняшний день. Первое устройство было одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 1980-х годах.
к 2019 году во всем мире было имплантировано почти 737 000 устройств. Тем не менее, они ограниченно используют нейроны, доступные для кодирования звука в улитке. Чтобы понять почему, сначала нужно понять, как работает естественный слух.
В функционирующем человеческом ухе звуковые волны направляются в слуховой проход и приводят в движение барабанную перепонку, которая, в свою очередь, вызывает вибрацию крошечных косточек в среднем ухе. Эти кости передают вибрации на улитку внутреннего уха, структуру в форме улитки размером с горошину. Внутри заполненной жидкостью улитки мембрана колеблется в ответ на звуковые вибрации, и эти рябь перемещают пучки сенсорных волосковых клеток, которые выступают с поверхности этой мембраны. Эти движения заставляют волосковые клетки высвобождать нейротрансмиттеры, которые вызывают электрический сигнал в нейронах кохлеарного нерва. Все эти электрические сигналы кодируют звук, и сигнал проходит по нерву в мозг. Независимо от того, какую звуковую частоту они кодируют, кохлеарные нейроны представляют интенсивность звука скоростью и синхронизацией своих электрических сигналов: частота срабатывания может достигать нескольких сотен герц, а синхронизация может достигать точности до миллисекунды.
Все эти электрические сигналы кодируют звук, и сигнал проходит по нерву в мозг. Независимо от того, какую звуковую частоту они кодируют, кохлеарные нейроны представляют интенсивность звука скоростью и синхронизацией своих электрических сигналов: частота срабатывания может достигать нескольких сотен герц, а синхронизация может достигать точности до миллисекунды.
Волосковые клетки в разных частях улитки реагируют на разные частоты звука: клетки в основании спиралевидной улитки обнаруживают высокие звуки частотой примерно до 20 кГц, а клетки в верхней части спирали — низкие. звучит примерно до 20 Гц. Эта частотная карта улитки также доступна на уровне нейронов, которые можно рассматривать как спиралевидный массив приемников. Кохлеарные имплантаты извлекают выгоду из этой структуры, стимулируя нейроны в основании улитки, чтобы создать восприятие высокого тона и так далее.
Коммерческий кохлеарный имплант сегодня имеет микрофон, процессор и передатчик, которые носят на голове, а также приемник и имплантированные электроды. Обычно он имеет от 12 до 24 электродов, которые вставляются в улитку для непосредственной стимуляции нерва в разных точках. Но солевой раствор внутри улитки является проводящим, поэтому ток от каждого электрода распространяется и вызывает широкую активацию нейронов по частотной карте улитки. Поскольку частотная избирательность электрической стимуляции ограничена, качество искусственного слуха также ограничено. Естественный процесс слуха, при котором волосковые клетки воздействуют на определенные точки улиткового нерва, можно представить себе как игру пальцами на пианино; кохлеарные импланты больше похожи на игру с кулаками. Хуже того, это большое перекрытие стимуляции ограничивает способ стимуляции слухового нерва, поскольку заставляет нас активировать только один электрод за раз.
Обычно он имеет от 12 до 24 электродов, которые вставляются в улитку для непосредственной стимуляции нерва в разных точках. Но солевой раствор внутри улитки является проводящим, поэтому ток от каждого электрода распространяется и вызывает широкую активацию нейронов по частотной карте улитки. Поскольку частотная избирательность электрической стимуляции ограничена, качество искусственного слуха также ограничено. Естественный процесс слуха, при котором волосковые клетки воздействуют на определенные точки улиткового нерва, можно представить себе как игру пальцами на пианино; кохлеарные импланты больше похожи на игру с кулаками. Хуже того, это большое перекрытие стимуляции ограничивает способ стимуляции слухового нерва, поскольку заставляет нас активировать только один электрод за раз.
Как работает оптогенетика
Идея лучшего способа возникла еще в 2005 году, когда я начал слышать о новой методике, впервые примененной в неврологии, под названием
оптогенетика. Немецкие исследователи одними из первых обнаружили в водорослях светочувствительные белки, регулирующие поток ионов через клеточную мембрану. Затем другие исследовательские группы начали экспериментировать, беря гены, кодирующие такие белки, и используя безвредный вирусный вектор для встраивания их в нейроны. В результате облучение этих генетически измененных нейронов могло заставить их открыть потенциалзависимые ионные каналы и, таким образом, сработать или активироваться, что позволило исследователям напрямую контролировать мозг и поведение живых животных. С тех пор оптогенетика стала важным инструментом в исследованиях в области неврологии, и клиницисты экспериментируют с медицинскими приложениями, включая восстановление зрения и кардиостимуляцию.
Немецкие исследователи одними из первых обнаружили в водорослях светочувствительные белки, регулирующие поток ионов через клеточную мембрану. Затем другие исследовательские группы начали экспериментировать, беря гены, кодирующие такие белки, и используя безвредный вирусный вектор для встраивания их в нейроны. В результате облучение этих генетически измененных нейронов могло заставить их открыть потенциалзависимые ионные каналы и, таким образом, сработать или активироваться, что позволило исследователям напрямую контролировать мозг и поведение живых животных. С тех пор оптогенетика стала важным инструментом в исследованиях в области неврологии, и клиницисты экспериментируют с медицинскими приложениями, включая восстановление зрения и кардиостимуляцию.
Меня давно интересовало, как кодируется звук и как это кодирование нарушается при нарушениях слуха. Мне пришло в голову, что стимуляция улиткового нерва светом вместо электричества могла бы обеспечить гораздо более точный контроль, потому что свет можно точно сфокусировать даже в солевой среде улитки.
Мы предлагаем новый тип имплантируемого медицинского устройства, который будет сочетаться с новым типом генной терапии.
Если бы мы использовали оптогенетику, чтобы сделать кохлеарные нервные клетки чувствительными к свету, мы могли бы точно поражать эти цели лучами низкоэнергетического света, чтобы производить гораздо более тонкие слуховые ощущения, чем с электрическим имплантатом. Теоретически мы могли бы иметь более чем в пять раз больше целей, разнесенных по всей улитке, возможно, 64 или 128. Звуковые стимулы можно было бы электронным способом разделить на множество дискретных частотных диапазонов, что дало бы пользователям гораздо более богатый опыт звука. Эта общая идея была подхвачена ранее
Клаус-Питер Рихтер из Северо-Западного университета, который предложил прямую стимуляцию слухового нерва высокоэнергетическим инфракрасным светом, хотя эта концепция не была подтверждена другими лабораториями.
Наша идея была захватывающей, но мы с коллегами увидели множество проблем. Мы предлагали новый тип имплантируемого медицинского устройства, которое будет сочетаться с новым типом генной терапии, оба из которых должны соответствовать самым высоким стандартам безопасности. Нам нужно определить лучший источник света для использования в оптогенетической системе и как передать его в нужные точки в улитке. Нам нужно было найти правильный светочувствительный белок для использования в клетках улитки, и мы должны были выяснить, как лучше всего доставить гены, кодирующие эти белки, в нужные части улитки.
Мы предлагали новый тип имплантируемого медицинского устройства, которое будет сочетаться с новым типом генной терапии, оба из которых должны соответствовать самым высоким стандартам безопасности. Нам нужно определить лучший источник света для использования в оптогенетической системе и как передать его в нужные точки в улитке. Нам нужно было найти правильный светочувствительный белок для использования в клетках улитки, и мы должны были выяснить, как лучше всего доставить гены, кодирующие эти белки, в нужные части улитки.
Но за эти годы мы добились большого прогресса. В 2015 году Европейский исследовательский совет выразил нам вотум доверия, когда
профинансировал наш проект OptoHear, а в 2019 году мы выделили компанию под названием OptoGenTech для работы над коммерциализацией нашего устройства.
Каналродопсины, микросветодиоды и волоконная оптика
Наши ранние эксперименты по проверке концепции на мышах исследовали как биологию, так и технологию, задействованную в нашей миссии. Поиск подходящего светочувствительного белка, или каналородопсина, оказался долгим процессом. Многие ранние попытки оптогенетики использовали
Поиск подходящего светочувствительного белка, или каналородопсина, оказался долгим процессом. Многие ранние попытки оптогенетики использовали
канал родопсин-2 (ChR2), который открывает ионный канал в ответ на синий свет. Мы использовали его в экспериментальном эксперименте на мышах, который продемонстрировал, что оптогенетическая стимуляция слухового пути обеспечивает лучшую частотную избирательность, чем электрическая стимуляция.
В нашем продолжающемся поиске лучшего канального родопсина для нашей цели мы попробовали вариант ChR2, названный
кальций-транслокирующий каналродопсин (CatCh) из лаборатории биофизики Института Макса Планка Эрнста Бамберга, одного из пионеров оптогенетики в мире. Мы доставили CatCh в кохлеарные нейроны монгольских песчанок, используя безвредный вирус в качестве вектора. Затем мы обучили песчанок реагировать на слуховой раздражитель, научив их избегать определенной области, когда они слышали звук. Затем мы оглушили песчанок, применив лекарство, убивающее волосковые клетки, и вставили крошечный оптический кохлеарный имплант, чтобы стимулировать чувствительные к свету нейроны улитки. Глухие животные реагировали на это световое раздражение так же, как и на слуховой раздражитель.
Глухие животные реагировали на это световое раздражение так же, как и на слуховой раздражитель.
Оптический кохлеарный имплант позволит людям различать голоса на оживленных собраниях и ценить тонкости любимых песен.
Однако использование CatCh имеет две проблемы: во-первых, требуется синий свет, связанный с
фототоксичность. Когда свет, особенно высокоэнергетический синий свет, падает прямо на клетки, которые обычно находятся в темноте внутри тела, эти клетки могут быть повреждены и в конечном итоге отмирают. Другая проблема с CatCh заключается в том, что он медленно перезагружается. При температуре тела, когда CatCh активируется светом, требуется около дюжины миллисекунд, чтобы закрыть канал и быть готовым к следующей активации. Такая медленная кинетика не поддерживает точное время активации нейронов, необходимое для кодирования звука, для которого может потребоваться более сотни импульсов в секунду. Многие говорили, что кинетика каналородопсинов делает наши поиски невозможными — даже если мы получим спектральное разрешение, мы потеряем временное разрешение. Но мы восприняли эти сомнения как сильную мотивацию для поиска более быстрых канальных родопсинов, которые реагируют на красный свет.
Но мы восприняли эти сомнения как сильную мотивацию для поиска более быстрых канальных родопсинов, которые реагируют на красный свет.
Мы были взволнованы, когда лидер в области оптогенетики,
Эдвард Бойден из Массачусетского технологического института открыл более быстродействующий канальный родопсин, который его команда назвала Хроносом. Хотя для активации по-прежнему требовался синий свет, Chronos был самым быстрым канальным родопсином на сегодняшний день: для закрытия при комнатной температуре требовалось около 3,6 миллисекунд. Более того, мы обнаружили, что он закрылся примерно за 1 мс при более высокой температуре тела. Однако потребовались некоторые дополнительные приемы, чтобы заставить Chronos работать в улитке: нам пришлось использовать мощные вирусные векторы и определенные генетические последовательности, чтобы улучшить доставку белка Chronos к клеточной мембране нейронов улитки. С помощью этих трюков как отдельные нейроны, так и популяция нейронов реагировали надежно и с хорошей временной точностью на оптическую стимуляцию с более высокой частотой, примерно до 250 Гц. Таким образом, Хронос позволил нам получить почти естественную частоту возбуждения нейронов, предполагая, что мы можем иметь как частотное, так и временное разрешение. Но нам все еще нужно было найти сверхбыстрый канальный родопсин, который работал бы с более длинноволновым светом.
Таким образом, Хронос позволил нам получить почти естественную частоту возбуждения нейронов, предполагая, что мы можем иметь как частотное, так и временное разрешение. Но нам все еще нужно было найти сверхбыстрый канальный родопсин, который работал бы с более длинноволновым светом.
Мы объединились с Бамбергом, чтобы принять вызов. Сотрудничество было нацелено на Chrimson, канальный родопсин, впервые описанный Бойденом, который лучше всего стимулируется оранжевым светом.
Первыми результатами наших инженерных экспериментов с Chrimson были быстрый Chrimson (f-Chrimson) и очень быстрый Chrimson (vf-Chrimson). Мы были рады обнаружить, что f-Chrimson позволяет кохлеарным нейронам надежно реагировать на красный свет при частоте стимуляции примерно 200 Гц. Vf-Chrimson еще быстрее, но хуже экспрессируется в клетках, чем f-Chrimson; до сих пор vf-Chrimson не продемонстрировал заметного преимущества перед f-Chrimson, когда речь идет о высокочастотной стимуляции кохлеарных нейронов.
..»> Эта гибкая матрица микро-светодиодов, изготовленная во Фрайбургском университете, намотана на стеклянный стержень диаметром 1 миллиметр. Массив показан с выключенными 144 диодами [слева] и работающими на 1 миллиампер [справа]. Фрайбургский университет/Frontiers
Мы также изучаем наши варианты имплантированного источника света, который будет запускать оптогенетические клетки. Имплантат должен быть достаточно маленьким, чтобы поместиться в ограниченном пространстве улитки, достаточно жестким для хирургического введения, но достаточно гибким, чтобы плавно повторять кривизну улитки. Его корпус должен быть биосовместимым, прозрачным и достаточно прочным, чтобы прослужить десятилетиями. Мои соавторы
Ульрих Шварц и Патрик Рутер, работавшие тогда во Фрайбургском университете, начали с разработки первых микросветоизлучающих диодов (микро-светодиодов) для оптических кохлеарных имплантов.
Мы нашли микро-светодиоды полезными, потому что это очень зрелая коммерческая технология с хорошей энергоэффективностью. Мы провели
Мы провели
несколько экспериментов с тонкопленочными микросветодиодами, изготовленными из микроволокна, и продемонстрировали, что мы можем оптогенетически стимулировать кохлеарный нерв в наших целевых диапазонах частот. Но у микросветодиодов есть недостатки. Во-первых, трудно установить гибкую, прозрачную и прочную герметичную изоляцию вокруг имплантированных микросветодиодов. Кроме того, микросветодиоды с наивысшей эффективностью излучают синий свет, что возвращает нас к проблеме фототоксичности. Вот почему мы также смотрим на другой путь вперед.
Вместо того, чтобы поместить сам полупроводниковый излучатель в улитку, альтернативный подход помещает источник света, такой как лазерный диод, дальше в герметичный титановый корпус. Затем оптические волокна доставляют свет в улитку и к светочувствительным нейронам. Оптические волокна должны быть биосовместимыми, прочными и достаточно гибкими, чтобы проходить через улитку, что может быть затруднительно при использовании обычных стеклянных волокон. В настоящее время ведутся интересные исследования гибких полимерных волокон, которые могут иметь лучшие механические характеристики, но пока что они не могут сравниться со стеклом по эффективности распространения света. Волоконно-оптический подход может иметь недостатки в эффективности, потому что мы потеряем некоторое количество света, когда он идет от лазерного диода к волокну, когда он проходит по волокну и когда он идет от волокна к улитке. Но подход кажется многообещающим, так как он гарантирует, что оптоэлектронные компоненты могут быть надежно запечатаны и, вероятно, облегчит вставку гибкой решетки волноводов.
В настоящее время ведутся интересные исследования гибких полимерных волокон, которые могут иметь лучшие механические характеристики, но пока что они не могут сравниться со стеклом по эффективности распространения света. Волоконно-оптический подход может иметь недостатки в эффективности, потому что мы потеряем некоторое количество света, когда он идет от лазерного диода к волокну, когда он проходит по волокну и когда он идет от волокна к улитке. Но подход кажется многообещающим, так как он гарантирует, что оптоэлектронные компоненты могут быть надежно запечатаны и, вероятно, облегчит вставку гибкой решетки волноводов.
Другая возможность конструкции оптических кохлеарных имплантов заключается в использовании лазерных диодов в качестве источника света и сопряжении их с оптическими волокнами, изготовленными из гибкого полимера. Лазерный диод можно было бы безопасно инкапсулировать вне улитки, что уменьшило бы опасения по поводу перегрева, в то время как массивы полимерных волноводов [изображения слева и справа] закручивались бы в улитку, чтобы доставлять свет к клеткам.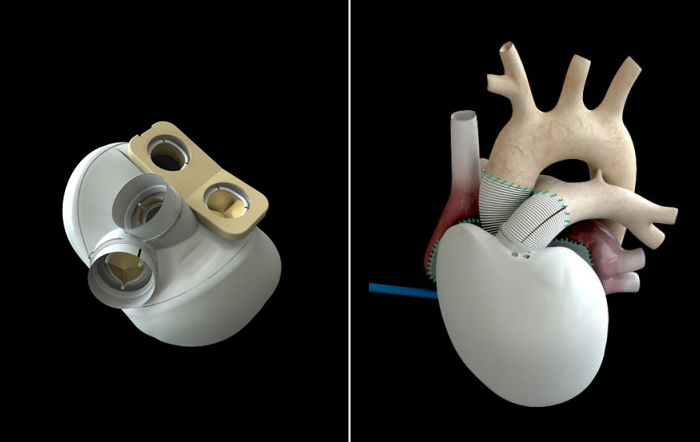 OptoGenTech
OptoGenTech
Путь к клиническим испытаниям
Поскольку мы рассматриваем возможность сборки этих компонентов в коммерческое медицинское устройство, мы сначала ищем части существующих кохлеарных имплантов, которые мы могли бы использовать. Аудиопроцессоры, которые работают с современными кохлеарными имплантами, можно адаптировать для наших целей; нам просто нужно разделить сигнал на большее количество каналов с меньшими частотными диапазонами. Внешний передатчик и имплантированный приемник также могут быть аналогичны существующим технологиям, что значительно облегчит наш путь регулирования. Но действительно новые части нашей системы — оптический стимулятор и генная терапия для доставки канальных родопсинов в улитку — потребуют тщательного изучения.
Операция по кохлеарной имплантации достаточно зрелая и обычно занимает максимум пару часов. Для простоты мы хотим, чтобы наша процедура была как можно ближе к существующим операциям. Но ключевая часть операции будет совсем другой: вместо того, чтобы вставлять электроды в улитку, хирурги сначала введут вирусные векторы, чтобы доставить гены каналородопсина в клетки улитки, а затем имплантируют в улитку излучатель света.
Но ключевая часть операции будет совсем другой: вместо того, чтобы вставлять электроды в улитку, хирурги сначала введут вирусные векторы, чтобы доставить гены каналородопсина в клетки улитки, а затем имплантируют в улитку излучатель света.
Поскольку оптогенетическая терапия только начинает проходить клинические испытания, все еще существует некоторая неопределенность в отношении того, как лучше всего заставить эту технику работать на людях. Мы все еще думаем, как заставить вирусный вектор доставлять необходимые гены в нужные нейроны улитки. Вирусный вектор, который мы использовали в экспериментах до сих пор,
Аденоассоциированный вирус — это безвредный вирус, который уже был одобрен для использования в нескольких генных терапиях, и мы используем некоторые генетические приемы и местное введение для целенаправленного воздействия на кохлеарные нейроны. Мы уже начали собирать данные о стабильности оптогенетически измененных клеток и о том, потребуются ли им повторные инъекции генов каналородопсина, чтобы оставаться чувствительными к свету.
Наша дорожная карта для клинических испытаний очень амбициозна. Сейчас мы работаем над завершением и заморозкой конструкции устройства, и у нас продолжаются доклинические исследования на животных, чтобы проверить фототоксичность и доказать эффективность основной идеи. Мы стремимся начать наше первое исследование на людях в 2026 году, в ходе которого мы найдем самую безопасную дозу для генной терапии. Мы надеемся начать крупное клиническое испытание фазы 3 в 2028 году для сбора данных, которые мы будем использовать при подаче устройства на одобрение регулирующих органов, которое мы можем выиграть в начале 2030-х годов.
Мы предвидим будущее, в котором лучи света смогут создавать богатые звуковые ландшафты для людей с глубокой потерей слуха или глухотой. Мы надеемся, что оптический кохлеарный имплант позволит им различать голоса на оживленном совещании, ценить тонкости своих любимых песен и воспринимать весь спектр звука — от трели птиц до гулких басовых нот. Мы думаем, что эта технология может осветить их слуховой мир.
Изобретатель искусственного сердца переключает внимание на устройства для помощи сердцу
Я работаю отоларингологом более двух десятков лет. Мои пациенты говорят мне, что им нужен более естественный звук, больше удовольствия от музыки и, прежде всего, лучшее понимание речи, особенно в условиях фонового шума — так называемая
проблема коктейльной вечеринки. В течение 15 лет моя команда из Геттингенского университета в Германии сотрудничала с коллегами из Фрайбургского университета и других университетов, чтобы заново изобрести кохлеарный имплант поразительно нелогичным способом: с использованием света.
Мы понимаем, что современные кохлеарные импланты наталкиваются на жесткие ограничения техники и физиологии человека. Поэтому мы разрабатываем кохлеарный имплант нового типа, в котором используются излучатели света и генетически измененные клетки, реагирующие на свет. Используя точные лучи света вместо электрического тока для стимуляции кохлеарного нерва, мы ожидаем, что наши оптические кохлеарные имплантаты будут лучше воспроизводить полный спектральный характер звуков и лучше имитировать естественный слух. Мы стремимся начать клинические испытания в 2026 году, и, если все пойдет хорошо, мы можем получить одобрение регулирующих органов на наше устройство в начале следующего десятилетия. Тогда люди во всем мире могли начать слышать свет.
Мы стремимся начать клинические испытания в 2026 году, и, если все пойдет хорошо, мы можем получить одобрение регулирующих органов на наше устройство в начале следующего десятилетия. Тогда люди во всем мире могли начать слышать свет.
На этих трехмерных микроскопических изображениях анатомии уха мыши видны оптические имплантаты [пунктирные линии], проходящие через сложную структуру нормальной улитки, которая содержит волосковые клетки; при глухоте эти клетки утрачиваются или повреждаются. Слева волосковые клетки [голубая спираль] соединяются с кохлеарными нервными клетками [синие нити и точки]. На среднем и правом изображениях костяной корпус улитки мыши окружает это тонкое устройство. Даниэль Кеппелер
Как работают кохлеарные импланты
Немного
По данным Всемирной организации здравоохранения, 466 миллионов человек во всем мире страдают от инвалидизирующей потери слуха, требующей вмешательства. Потеря слуха в основном возникает в результате повреждения улитки, вызванного болезнью, шумом или возрастом, и до сих пор неизлечимо. Слух можно частично восстановить с помощью слуховых аппаратов, которые, по сути, передают усиленную версию звука оставшимся сенсорным волосковым клеткам улитки. Люди с глубокими нарушениями слуха получают больше пользы от кохлеарных имплантатов, которые, как упоминалось выше, пропускают дисфункциональные или потерянные волосковые клетки и непосредственно стимулируют кохлеарный, или слуховой, нерв.
Потеря слуха в основном возникает в результате повреждения улитки, вызванного болезнью, шумом или возрастом, и до сих пор неизлечимо. Слух можно частично восстановить с помощью слуховых аппаратов, которые, по сути, передают усиленную версию звука оставшимся сенсорным волосковым клеткам улитки. Люди с глубокими нарушениями слуха получают больше пользы от кохлеарных имплантатов, которые, как упоминалось выше, пропускают дисфункциональные или потерянные волосковые клетки и непосредственно стимулируют кохлеарный, или слуховой, нерв.
В 2030-х годах люди во всем мире смогут начать слышать свет.
Сегодняшние кохлеарные имплантаты являются наиболее успешными нейропротезами на сегодняшний день. Первое устройство было одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 1980-х годах.
к 2019 году во всем мире было имплантировано почти 737 000 устройств. Тем не менее, они ограниченно используют нейроны, доступные для кодирования звука в улитке. Чтобы понять почему, сначала нужно понять, как работает естественный слух.
Чтобы понять почему, сначала нужно понять, как работает естественный слух.
В функционирующем человеческом ухе звуковые волны направляются в слуховой проход и приводят в движение барабанную перепонку, которая, в свою очередь, вызывает вибрацию крошечных косточек в среднем ухе. Эти кости передают вибрации на улитку внутреннего уха, структуру в форме улитки размером с горошину. Внутри заполненной жидкостью улитки мембрана колеблется в ответ на звуковые вибрации, и эти рябь перемещают пучки сенсорных волосковых клеток, которые выступают с поверхности этой мембраны. Эти движения заставляют волосковые клетки высвобождать нейротрансмиттеры, которые вызывают электрический сигнал в нейронах кохлеарного нерва. Все эти электрические сигналы кодируют звук, и сигнал проходит по нерву в мозг. Независимо от того, какую звуковую частоту они кодируют, кохлеарные нейроны представляют интенсивность звука скоростью и синхронизацией своих электрических сигналов: частота срабатывания может достигать нескольких сотен герц, а синхронизация может достигать точности до миллисекунды.
Волосковые клетки в разных частях улитки реагируют на разные частоты звука: клетки в основании спиралевидной улитки обнаруживают высокие звуки частотой примерно до 20 кГц, а клетки в верхней части спирали — низкие. звучит примерно до 20 Гц. Эта частотная карта улитки также доступна на уровне нейронов, которые можно рассматривать как спиралевидный массив приемников. Кохлеарные имплантаты извлекают выгоду из этой структуры, стимулируя нейроны в основании улитки, чтобы создать восприятие высокого тона и так далее.
Коммерческий кохлеарный имплант сегодня имеет микрофон, процессор и передатчик, которые носят на голове, а также приемник и имплантированные электроды. Обычно он имеет от 12 до 24 электродов, которые вставляются в улитку для непосредственной стимуляции нерва в разных точках. Но солевой раствор внутри улитки является проводящим, поэтому ток от каждого электрода распространяется и вызывает широкую активацию нейронов по частотной карте улитки. Поскольку частотная избирательность электрической стимуляции ограничена, качество искусственного слуха также ограничено. Естественный процесс слуха, при котором волосковые клетки воздействуют на определенные точки улиткового нерва, можно представить себе как игру пальцами на пианино; кохлеарные импланты больше похожи на игру с кулаками. Хуже того, это большое перекрытие стимуляции ограничивает способ стимуляции слухового нерва, поскольку заставляет нас активировать только один электрод за раз.
Естественный процесс слуха, при котором волосковые клетки воздействуют на определенные точки улиткового нерва, можно представить себе как игру пальцами на пианино; кохлеарные импланты больше похожи на игру с кулаками. Хуже того, это большое перекрытие стимуляции ограничивает способ стимуляции слухового нерва, поскольку заставляет нас активировать только один электрод за раз.
Как работает оптогенетика
Идея лучшего способа возникла еще в 2005 году, когда я начал слышать о новой методике, впервые примененной в неврологии, под названием
оптогенетика. Немецкие исследователи одними из первых обнаружили в водорослях светочувствительные белки, регулирующие поток ионов через клеточную мембрану. Затем другие исследовательские группы начали экспериментировать, беря гены, кодирующие такие белки, и используя безвредный вирусный вектор для встраивания их в нейроны. В результате облучение этих генетически измененных нейронов могло заставить их открыть потенциалзависимые ионные каналы и, таким образом, сработать или активироваться, что позволило исследователям напрямую контролировать мозг и поведение живых животных. С тех пор оптогенетика стала важным инструментом в исследованиях в области неврологии, и клиницисты экспериментируют с медицинскими приложениями, включая восстановление зрения и кардиостимуляцию.
С тех пор оптогенетика стала важным инструментом в исследованиях в области неврологии, и клиницисты экспериментируют с медицинскими приложениями, включая восстановление зрения и кардиостимуляцию.
Меня давно интересовало, как кодируется звук и как это кодирование нарушается при нарушениях слуха. Мне пришло в голову, что стимуляция улиткового нерва светом вместо электричества могла бы обеспечить гораздо более точный контроль, потому что свет можно точно сфокусировать даже в солевой среде улитки.
Мы предлагаем новый тип имплантируемого медицинского устройства, который будет сочетаться с новым типом генной терапии.
Если бы мы использовали оптогенетику, чтобы сделать кохлеарные нервные клетки чувствительными к свету, мы могли бы точно поражать эти цели лучами низкоэнергетического света, чтобы производить гораздо более тонкие слуховые ощущения, чем с электрическим имплантатом. Теоретически мы могли бы иметь более чем в пять раз больше целей, разнесенных по всей улитке, возможно, 64 или 128. Звуковые стимулы можно было бы электронным способом разделить на множество дискретных частотных диапазонов, что дало бы пользователям гораздо более богатый опыт звука. Эта общая идея была подхвачена ранее
Звуковые стимулы можно было бы электронным способом разделить на множество дискретных частотных диапазонов, что дало бы пользователям гораздо более богатый опыт звука. Эта общая идея была подхвачена ранее
Клаус-Питер Рихтер из Северо-Западного университета, который предложил прямую стимуляцию слухового нерва высокоэнергетическим инфракрасным светом, хотя эта концепция не была подтверждена другими лабораториями.
Наша идея была захватывающей, но мы с коллегами увидели множество проблем. Мы предлагали новый тип имплантируемого медицинского устройства, которое будет сочетаться с новым типом генной терапии, оба из которых должны соответствовать самым высоким стандартам безопасности. Нам нужно определить лучший источник света для использования в оптогенетической системе и как передать его в нужные точки в улитке. Нам нужно было найти правильный светочувствительный белок для использования в клетках улитки, и мы должны были выяснить, как лучше всего доставить гены, кодирующие эти белки, в нужные части улитки.
Но за эти годы мы добились большого прогресса. В 2015 году Европейский исследовательский совет выразил нам вотум доверия, когда
профинансировал наш проект OptoHear, а в 2019 году мы выделили компанию под названием OptoGenTech для работы над коммерциализацией нашего устройства.
Каналродопсины, микросветодиоды и волоконная оптика
Наши ранние эксперименты по проверке концепции на мышах исследовали как биологию, так и технологию, задействованную в нашей миссии. Поиск подходящего светочувствительного белка, или каналородопсина, оказался долгим процессом. Многие ранние попытки оптогенетики использовали
канал родопсин-2 (ChR2), который открывает ионный канал в ответ на синий свет. Мы использовали его в экспериментальном эксперименте на мышах, который продемонстрировал, что оптогенетическая стимуляция слухового пути обеспечивает лучшую частотную избирательность, чем электрическая стимуляция.
В нашем продолжающемся поиске лучшего канального родопсина для нашей цели мы попробовали вариант ChR2, названный
кальций-транслокирующий каналродопсин (CatCh) из лаборатории биофизики Института Макса Планка Эрнста Бамберга, одного из пионеров оптогенетики в мире. Мы доставили CatCh в кохлеарные нейроны монгольских песчанок, используя безвредный вирус в качестве вектора. Затем мы обучили песчанок реагировать на слуховой раздражитель, научив их избегать определенной области, когда они слышали звук. Затем мы оглушили песчанок, применив лекарство, убивающее волосковые клетки, и вставили крошечный оптический кохлеарный имплант, чтобы стимулировать чувствительные к свету нейроны улитки. Глухие животные реагировали на это световое раздражение так же, как и на слуховой раздражитель.
Мы доставили CatCh в кохлеарные нейроны монгольских песчанок, используя безвредный вирус в качестве вектора. Затем мы обучили песчанок реагировать на слуховой раздражитель, научив их избегать определенной области, когда они слышали звук. Затем мы оглушили песчанок, применив лекарство, убивающее волосковые клетки, и вставили крошечный оптический кохлеарный имплант, чтобы стимулировать чувствительные к свету нейроны улитки. Глухие животные реагировали на это световое раздражение так же, как и на слуховой раздражитель.
Оптический кохлеарный имплант позволит людям различать голоса на оживленных собраниях и ценить тонкости любимых песен.
Однако использование CatCh имеет две проблемы: во-первых, требуется синий свет, связанный с
фототоксичность. Когда свет, особенно высокоэнергетический синий свет, падает прямо на клетки, которые обычно находятся в темноте внутри тела, эти клетки могут быть повреждены и в конечном итоге отмирают. Другая проблема с CatCh заключается в том, что он медленно перезагружается.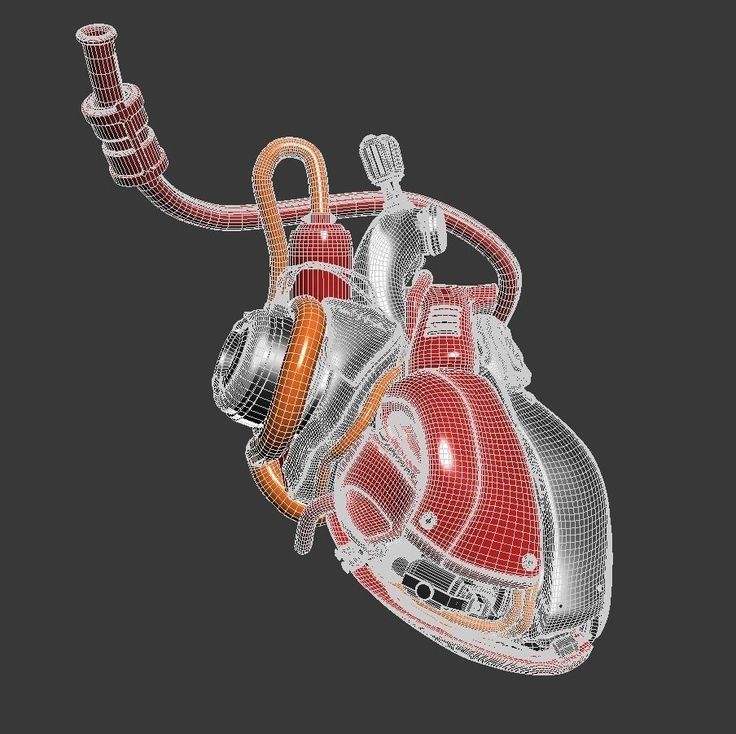 При температуре тела, когда CatCh активируется светом, требуется около дюжины миллисекунд, чтобы закрыть канал и быть готовым к следующей активации. Такая медленная кинетика не поддерживает точное время активации нейронов, необходимое для кодирования звука, для которого может потребоваться более сотни импульсов в секунду. Многие говорили, что кинетика каналородопсинов делает наши поиски невозможными — даже если мы получим спектральное разрешение, мы потеряем временное разрешение. Но мы восприняли эти сомнения как сильную мотивацию для поиска более быстрых канальных родопсинов, которые реагируют на красный свет.
При температуре тела, когда CatCh активируется светом, требуется около дюжины миллисекунд, чтобы закрыть канал и быть готовым к следующей активации. Такая медленная кинетика не поддерживает точное время активации нейронов, необходимое для кодирования звука, для которого может потребоваться более сотни импульсов в секунду. Многие говорили, что кинетика каналородопсинов делает наши поиски невозможными — даже если мы получим спектральное разрешение, мы потеряем временное разрешение. Но мы восприняли эти сомнения как сильную мотивацию для поиска более быстрых канальных родопсинов, которые реагируют на красный свет.
Мы были взволнованы, когда лидер в области оптогенетики,
Эдвард Бойден из Массачусетского технологического института открыл более быстродействующий канальный родопсин, который его команда назвала Хроносом. Хотя для активации по-прежнему требовался синий свет, Chronos был самым быстрым канальным родопсином на сегодняшний день: для закрытия при комнатной температуре требовалось около 3,6 миллисекунд.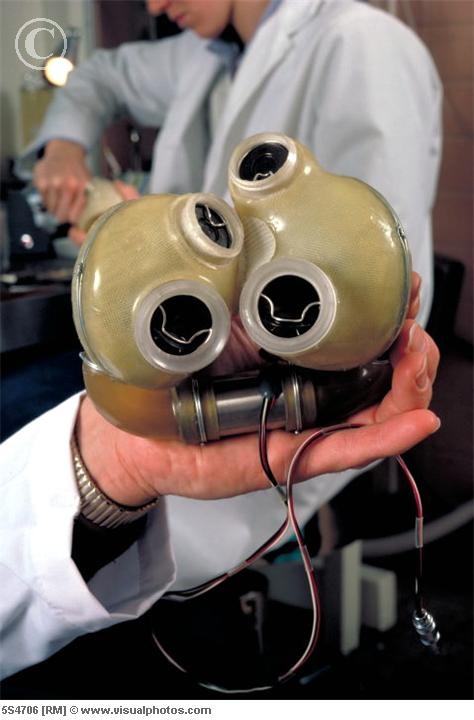 Более того, мы обнаружили, что он закрылся примерно за 1 мс при более высокой температуре тела. Однако потребовались некоторые дополнительные приемы, чтобы заставить Chronos работать в улитке: нам пришлось использовать мощные вирусные векторы и определенные генетические последовательности, чтобы улучшить доставку белка Chronos к клеточной мембране нейронов улитки. С помощью этих трюков как отдельные нейроны, так и популяция нейронов реагировали надежно и с хорошей временной точностью на оптическую стимуляцию с более высокой частотой, примерно до 250 Гц. Таким образом, Хронос позволил нам получить почти естественную частоту возбуждения нейронов, предполагая, что мы можем иметь как частотное, так и временное разрешение. Но нам все еще нужно было найти сверхбыстрый канальный родопсин, который работал бы с более длинноволновым светом.
Более того, мы обнаружили, что он закрылся примерно за 1 мс при более высокой температуре тела. Однако потребовались некоторые дополнительные приемы, чтобы заставить Chronos работать в улитке: нам пришлось использовать мощные вирусные векторы и определенные генетические последовательности, чтобы улучшить доставку белка Chronos к клеточной мембране нейронов улитки. С помощью этих трюков как отдельные нейроны, так и популяция нейронов реагировали надежно и с хорошей временной точностью на оптическую стимуляцию с более высокой частотой, примерно до 250 Гц. Таким образом, Хронос позволил нам получить почти естественную частоту возбуждения нейронов, предполагая, что мы можем иметь как частотное, так и временное разрешение. Но нам все еще нужно было найти сверхбыстрый канальный родопсин, который работал бы с более длинноволновым светом.
Мы объединились с Бамбергом, чтобы принять вызов. Сотрудничество было нацелено на Chrimson, канальный родопсин, впервые описанный Бойденом, который лучше всего стимулируется оранжевым светом.
Первыми результатами наших инженерных экспериментов с Chrimson были быстрый Chrimson (f-Chrimson) и очень быстрый Chrimson (vf-Chrimson). Мы были рады обнаружить, что f-Chrimson позволяет кохлеарным нейронам надежно реагировать на красный свет при частоте стимуляции примерно 200 Гц. Vf-Chrimson еще быстрее, но хуже экспрессируется в клетках, чем f-Chrimson; до сих пор vf-Chrimson не продемонстрировал заметного преимущества перед f-Chrimson, когда речь идет о высокочастотной стимуляции кохлеарных нейронов.
Эта гибкая матрица микро-светодиодов, изготовленная во Фрайбургском университете, намотана на стеклянный стержень диаметром 1 миллиметр. Массив показан с выключенными 144 диодами [слева] и работающими на 1 миллиампер [справа]. Фрайбургский университет/Frontiers
Мы также изучаем наши варианты имплантированного источника света, который будет запускать оптогенетические клетки. Имплантат должен быть достаточно маленьким, чтобы поместиться в ограниченном пространстве улитки, достаточно жестким для хирургического введения, но достаточно гибким, чтобы плавно повторять кривизну улитки. Его корпус должен быть биосовместимым, прозрачным и достаточно прочным, чтобы прослужить десятилетиями. Мои соавторы
Имплантат должен быть достаточно маленьким, чтобы поместиться в ограниченном пространстве улитки, достаточно жестким для хирургического введения, но достаточно гибким, чтобы плавно повторять кривизну улитки. Его корпус должен быть биосовместимым, прозрачным и достаточно прочным, чтобы прослужить десятилетиями. Мои соавторы
Ульрих Шварц и Патрик Рутер, работавшие тогда во Фрайбургском университете, начали с разработки первых микросветоизлучающих диодов (микро-светодиодов) для оптических кохлеарных имплантов.
Мы нашли микро-светодиоды полезными, потому что это очень зрелая коммерческая технология с хорошей энергоэффективностью. Мы провели
несколько экспериментов с тонкопленочными микросветодиодами, изготовленными из микроволокна, и продемонстрировали, что мы можем оптогенетически стимулировать кохлеарный нерв в наших целевых диапазонах частот. Но у микросветодиодов есть недостатки. Во-первых, трудно установить гибкую, прозрачную и прочную герметичную изоляцию вокруг имплантированных микросветодиодов.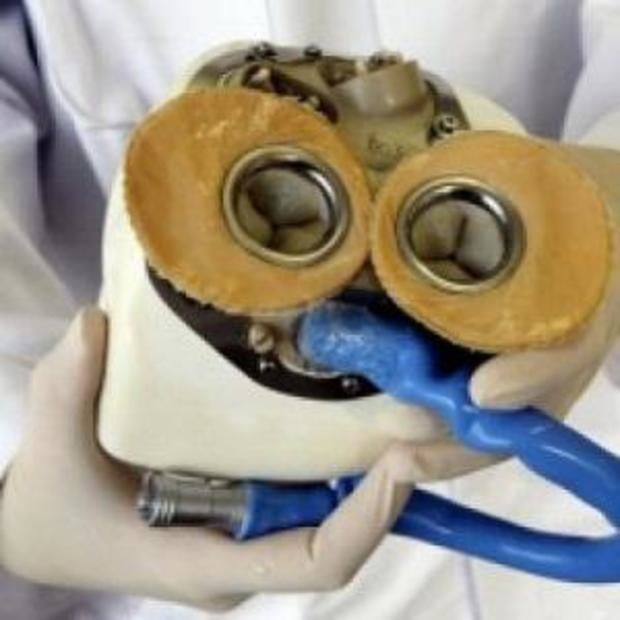 Кроме того, микросветодиоды с наивысшей эффективностью излучают синий свет, что возвращает нас к проблеме фототоксичности. Вот почему мы также смотрим на другой путь вперед.
Кроме того, микросветодиоды с наивысшей эффективностью излучают синий свет, что возвращает нас к проблеме фототоксичности. Вот почему мы также смотрим на другой путь вперед.
Вместо того, чтобы поместить сам полупроводниковый излучатель в улитку, альтернативный подход помещает источник света, такой как лазерный диод, дальше в герметичный титановый корпус. Затем оптические волокна доставляют свет в улитку и к светочувствительным нейронам. Оптические волокна должны быть биосовместимыми, прочными и достаточно гибкими, чтобы проходить через улитку, что может быть затруднительно при использовании обычных стеклянных волокон. В настоящее время ведутся интересные исследования гибких полимерных волокон, которые могут иметь лучшие механические характеристики, но пока что они не могут сравниться со стеклом по эффективности распространения света. Волоконно-оптический подход может иметь недостатки в эффективности, потому что мы потеряем некоторое количество света, когда он идет от лазерного диода к волокну, когда он проходит по волокну и когда он идет от волокна к улитке. Но подход кажется многообещающим, так как он гарантирует, что оптоэлектронные компоненты могут быть надежно запечатаны и, вероятно, облегчит вставку гибкой решетки волноводов.
Но подход кажется многообещающим, так как он гарантирует, что оптоэлектронные компоненты могут быть надежно запечатаны и, вероятно, облегчит вставку гибкой решетки волноводов.
Другая возможность конструкции оптических кохлеарных имплантов заключается в использовании лазерных диодов в качестве источника света и сопряжении их с оптическими волокнами, изготовленными из гибкого полимера. Лазерный диод можно было бы безопасно инкапсулировать вне улитки, что уменьшило бы опасения по поводу перегрева, в то время как массивы полимерных волноводов [изображения слева и справа] закручивались бы в улитку, чтобы доставлять свет к клеткам. OptoGenTech
Путь к клиническим испытаниям
Поскольку мы рассматриваем возможность сборки этих компонентов в коммерческое медицинское устройство, мы сначала ищем части существующих кохлеарных имплантов, которые мы могли бы использовать. Аудиопроцессоры, которые работают с современными кохлеарными имплантами, можно адаптировать для наших целей; нам просто нужно разделить сигнал на большее количество каналов с меньшими частотными диапазонами. Внешний передатчик и имплантированный приемник также могут быть аналогичны существующим технологиям, что значительно облегчит наш путь регулирования. Но действительно новые части нашей системы — оптический стимулятор и генная терапия для доставки канальных родопсинов в улитку — потребуют тщательного изучения.
Аудиопроцессоры, которые работают с современными кохлеарными имплантами, можно адаптировать для наших целей; нам просто нужно разделить сигнал на большее количество каналов с меньшими частотными диапазонами. Внешний передатчик и имплантированный приемник также могут быть аналогичны существующим технологиям, что значительно облегчит наш путь регулирования. Но действительно новые части нашей системы — оптический стимулятор и генная терапия для доставки канальных родопсинов в улитку — потребуют тщательного изучения.
Операция по кохлеарной имплантации достаточно зрелая и обычно занимает максимум пару часов. Для простоты мы хотим, чтобы наша процедура была как можно ближе к существующим операциям. Но ключевая часть операции будет совсем другой: вместо того, чтобы вставлять электроды в улитку, хирурги сначала введут вирусные векторы, чтобы доставить гены каналородопсина в клетки улитки, а затем имплантируют в улитку излучатель света.
Поскольку оптогенетическая терапия только начинает проходить клинические испытания, все еще существует некоторая неопределенность в отношении того, как лучше всего заставить эту технику работать на людях. Мы все еще думаем, как заставить вирусный вектор доставлять необходимые гены в нужные нейроны улитки. Вирусный вектор, который мы использовали в экспериментах до сих пор,
Мы все еще думаем, как заставить вирусный вектор доставлять необходимые гены в нужные нейроны улитки. Вирусный вектор, который мы использовали в экспериментах до сих пор,
Аденоассоциированный вирус — это безвредный вирус, который уже был одобрен для использования в нескольких генных терапиях, и мы используем некоторые генетические приемы и местное введение для целенаправленного воздействия на кохлеарные нейроны. Мы уже начали собирать данные о стабильности оптогенетически измененных клеток и о том, потребуются ли им повторные инъекции генов каналородопсина, чтобы оставаться чувствительными к свету.
Наша дорожная карта для клинических испытаний очень амбициозна. Сейчас мы работаем над завершением и заморозкой конструкции устройства, и у нас продолжаются доклинические исследования на животных, чтобы проверить фототоксичность и доказать эффективность основной идеи. Мы стремимся начать наше первое исследование на людях в 2026 году, в ходе которого мы найдем самую безопасную дозу для генной терапии.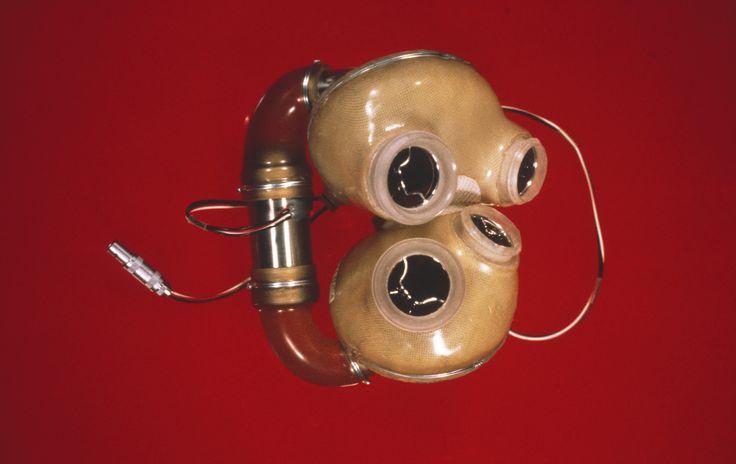

 Иногда его вживляют людям, ожидающим пересадки сердца
Иногда его вживляют людям, ожидающим пересадки сердца