Содержание
Получение водорода в домашних условиях
Библиографическое описание:
Шапилова, В. В. Получение водорода в домашних условиях / В. В. Шапилова, Г. И. Талапчук. — Текст : непосредственный // Юный ученый. — 2018. — № 1.1 (15.1). — С. 97-98. — URL: https://moluch.ru/young/archive/15/1180/ (дата обращения: 24.10.2022).
На Земле водород в чистом виде почти не встречается, и в повседневной жизни мы с ним не сталкиваемся. Но в соединениях — это второй по количеству атомов элемент в земной коре после кислорода. Все живые существа на Земле, включая нас с вами, примерно на 2/3 состоят из водорода.
Ключевые слова: водород, получение водорода.
Так что же такое водород? Каковы его свойства? Как его получают и применяют в земных условиях? Можно ли получить водород в домашних условиях, и как это делать лучше всего? На эти и другие вопросы мы постараемся ответить в ходе нашей научной работы.
Водород — это самый простой элемент в природе, состоящий из одного протона и вращающегося вокруг него электрона. Впервые получение водорода упоминается у английского учёного Роберта Бойля, который в 1671 году проводил реакцию между железными стружками и разбавленными кислотами. Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова. Официальное латинское название водорода «Hydrogenium».
В промышленности водород получают в основном из ископаемого топлива. В первую очередь это природный газ, метан, с которым большинство из нас может встретится на кухне, если вас есть газовая плита. Водород получают из лёгких фракций нефти. Третий по популярности источник водорода — это уголь.
Наиболее доступным для повторения в домашних условиях является разложение воды электрическим током (электролиз).
Для проведения нашего эксперимента мы взяли старую зарядку на 5 В 750мА и угольные электроды, извлечённые из обычных солевых батареек.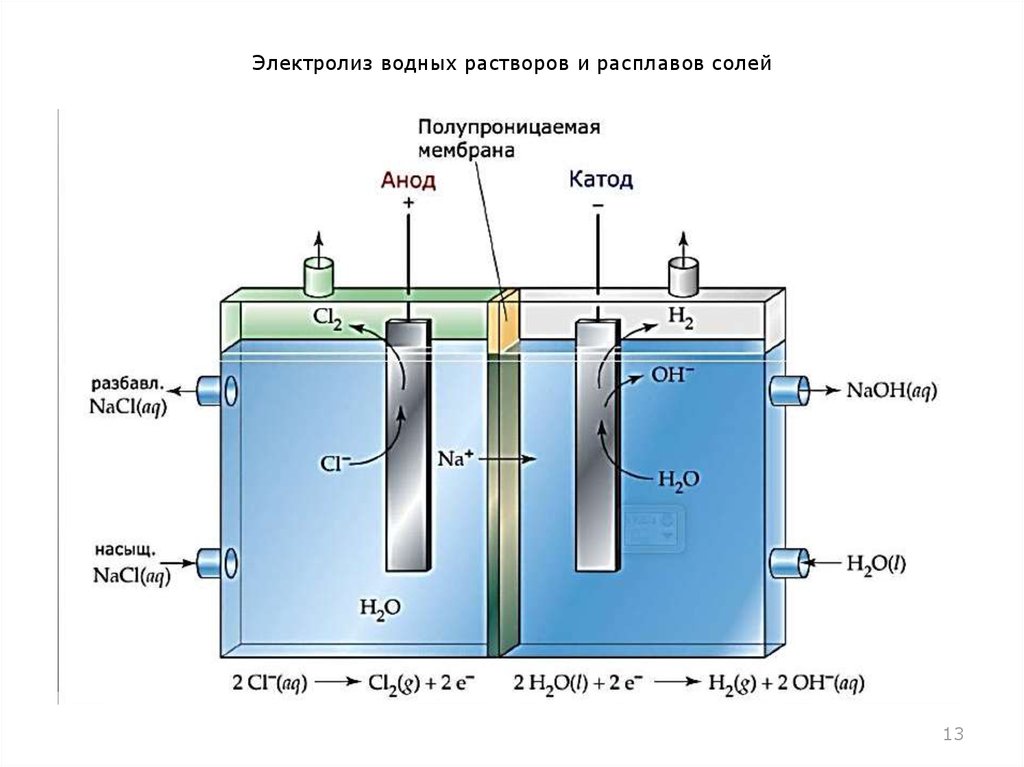 Для измерения протекающего тока использовался мультиметр.
Для измерения протекающего тока использовался мультиметр.
Для сбора и измерения получающихся газов, в бутылки налили воды, и закрепили их на основной ёмкости горлышком вниз, погрузив его при этом в электролит. Таким образом, чтобы воздух в бутылку попадать не смог. Всего в ёмкости и бутылках получилось около 1,5 литров воды. Как и ожидалось, с чистой водой, после подачи напряжения с зарядного устройства ничего не произошло. Мультиметр показывал почти нулевой ток. Но, когда в воду добавили две чайные ложки соды, электролиз пошёл бодрее, на обоих электродах начали появляться пузырьки газа, а мультиметр показал ток 15 мА. С таким маленьким током за сутки (24 часа) удалось собрать только 0,11 литра водорода (примерно полстакана). Во второй бутылке при этом собралось примерно в 2 раза меньше кислорода. Это означает, что в воде водорода в два раза больше, чем кислорода.
Наблюдение выделения водорода в результате взаимодействия металлов с разбавленными кислотами было самых первым в истории химии. И его относительно просто повторить в домашних условиях. Для этого нам понадобится металл, желательно поактивнее и кислота. В нашем эксперименте мы выбрали электролит для свинцовых аккумуляторов, который можно найти в ближайшем автомобильном магазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, использовали перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в пропорции 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки получилось примерно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
И его относительно просто повторить в домашних условиях. Для этого нам понадобится металл, желательно поактивнее и кислота. В нашем эксперименте мы выбрали электролит для свинцовых аккумуляторов, который можно найти в ближайшем автомобильном магазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, использовали перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в пропорции 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки получилось примерно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
Другой популярный метод — взаимодействие металлов с щелочами. Для эксперимента мы выбрали два варианта, которые были под рукой — кусочки провода и фольгу для запекания. Щёлочь (гидроксид натрия) можно найти в бытовых магазинах как средство для прочистки канализационных труб (КРОТ, например). Установку для получения использовали почти такую же, что и в опыте с кислотой и цинком. Раствор в обоих опытах был одинаковым: 20 мл щёлочи и 200 мл воды. В первом опыте использовали проволоку диаметром 1.5 мм, во втором — кусочки фольги. В обоих случаях масса алюминия была 1 г. В первом опыте удалось получить 1.2 л водорода, заняло это 34 часа. Во втором опыте фольга растворилась за 1 час 20 минут, выделив 1.4 л водорода. Из этих опытов можно сделать вывод, что скорость реакции сильно зависит от площади поверхности, на которой она происходит. В опыте с фольгой площадь поверхности была во много раз выше, чем в опыте с проволокой. Ещё большей скорости можно добиться, если взять алюминий в порошке. В этом случае соотношение площади поверхности к массе будет наибольшим.
Раствор в обоих опытах был одинаковым: 20 мл щёлочи и 200 мл воды. В первом опыте использовали проволоку диаметром 1.5 мм, во втором — кусочки фольги. В обоих случаях масса алюминия была 1 г. В первом опыте удалось получить 1.2 л водорода, заняло это 34 часа. Во втором опыте фольга растворилась за 1 час 20 минут, выделив 1.4 л водорода. Из этих опытов можно сделать вывод, что скорость реакции сильно зависит от площади поверхности, на которой она происходит. В опыте с фольгой площадь поверхности была во много раз выше, чем в опыте с проволокой. Ещё большей скорости можно добиться, если взять алюминий в порошке. В этом случае соотношение площади поверхности к массе будет наибольшим.
Таким образом, в экспериментах по получению водорода наиболее быстрым и доступным способом оказался вариант взаимодействия алюминиевой фольги со щёлочью. Но если необходимо получать водород регулярно и в больших количествах, то на первое место должен выйти электролиз, так как он не требует никаких расходных материалов кроме воды.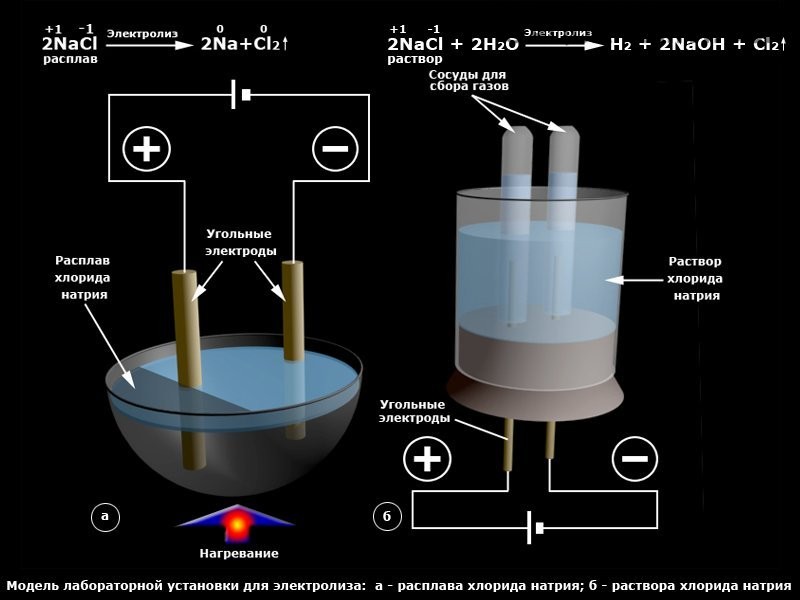 Правда для этого понадобится более серьёзная установка, чем зарядка от телефона и пара бутылок.
Правда для этого понадобится более серьёзная установка, чем зарядка от телефона и пара бутылок.
В ходе научной работы мы познакомились с самым распространённым, но таким редким в быту веществом, как водород. Научились получать его различными способами и выбрали наиболее удобный для осуществления в домашних условиях — воздействие средства для прочистки труб, содержащего щёлочь, на алюминиевую фольгу.
Так же мы на собственном опыте убедились, что водород — горючий и взрывоопасный газ, но им вполне можно наполнять воздушные шарики, чтобы они летали. Правда при этом стоит держать их подальше от открытого огня.
Основные термины (генерируются автоматически): водород, получение водорода, опыт, алюминиевая фольга, научная работа, литр водорода, площадь поверхности.
Из
опыта подготовки исследовательского проекта школьников по…
Известные технологии получения водорода из связанного состояния энергозатратные, дорогие и сложны в эксплуатации [4, с. 8]. Существует необходимость в поиске методов получения водорода из связанного состояния, лишенных перечисленных недостатков.
8]. Существует необходимость в поиске методов получения водорода из связанного состояния, лишенных перечисленных недостатков.
Водород — топливо будущего? | Статья в журнале…
Получение водорода методом электролиза неэффективно с энергетической точки зрения, количество затраченной на это энергии значительно превышает количество энергии, содержащейся в водороде. Процесс получения водорода из ископаемых видов топлива…
Исследование методов
получения водорода в соответствии…
Говоря о водороде как о экологически чистом топливе будущего, считается, что его производство не наносит вреда окружающей среде.
Настоящая работа направлена на исследование способов получения водорода в соответствии с принципами «зелёной химии».
Создание технологий
водородной энергетики | Статья в журнале…
Введение. Понятие — «водородная энергетика» сформировалось в середине 70-х г. XX столетия. Водородную энергетику можно определить, как научно техническое направление, охватывающее проблемы получения, хранения, транспортировки и использования водорода.
Краткий обзор опытно-конструкторских
работ по использованию…
При подаче водорода соответственно уменьшалось количество бензина в смеси. Как видно, добавка водорода при неизменной энергии
2. Трелин Ю. А. Исследование особенностей работы ДВС с искровым зажиганием при добавках водорода в бензовоздушную смесь: дисс…
К вопросу применения
водорода на двигателях внутреннего. ..
..
Первое практическое использование водорода в качестве добавки к топливу для авиационных ДВС относится к 1927г. В Советском Союзе работы по применению Н2 в качестве топлива для ДВС проводятся в секторе неоднородных средств АН СССР под руководством академика В.В…
Особенности топливных систем двигателей, работающих на…
Получение водорода разложением воды в многоступенчатых термохимических циклах на транспортных энергоустановках практически невозможно из-за высоких и различных на разных ступенях температур (до 450-9000С) и использования большого количества цветных металлов.
Технология очистки отходящих газов высокоамперных…
Технология улавливания фтористого водорода в системе сухой газоочистки основана на способности глинозема поглощать фтористый водород. В реакторе-адсорбере в режиме аэровзвеси, происходит процесс соединения фтористого водорода с оксидом алюминия [2]
Анализ условий самовоспламенения сжатого
водорода. Обзор
Обзор
Проведен обзор работ за последние 15 лет по проблеме водородной безопасности. Приведены условия, при которых происходит самовоспламенение струи водорода, истекающей под высоким давлением в воздух. Показано, что воспламенение водорода возможно даже при…
Расщепление воды с эффективностью 100%: полдела сделано / Хабр
alizar
Научно-популярное Энергия и элементы питания Нанотехнологии Химия
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Теги:
- вода
- электролиз
- восстановление
- водородное топливо
- солнечная энергия
- фотолиз
Хабы:
- Научно-популярное
- Энергия и элементы питания
- Нанотехнологии
- Химия
Всего голосов 26: ↑23 и ↓3 +20
Просмотры
68K
Комментарии
75
Анатолий Ализар
@alizar
автор, фрилансер
Telegram
Комментарии
Комментарии 75
Производство водорода: Электролиз | Департамент энергетики
Электролиз — многообещающий вариант безуглеродного производства водорода из возобновляемых и ядерных ресурсов. Электролиз — это процесс использования электричества для расщепления воды на водород и кислород. Эта реакция происходит в устройстве, называемом электролизером. Размер электролизеров может варьироваться от небольшого оборудования размером с прибор, которое хорошо подходит для мелкомасштабного распределенного производства водорода, до крупномасштабных центральных производственных объектов, которые могут быть напрямую связаны с возобновляемыми или другими формами энергии, не выделяющими парниковых газов. производство электроэнергии.
Электролиз — это процесс использования электричества для расщепления воды на водород и кислород. Эта реакция происходит в устройстве, называемом электролизером. Размер электролизеров может варьироваться от небольшого оборудования размером с прибор, которое хорошо подходит для мелкомасштабного распределенного производства водорода, до крупномасштабных центральных производственных объектов, которые могут быть напрямую связаны с возобновляемыми или другими формами энергии, не выделяющими парниковых газов. производство электроэнергии.
Как это работает?
Как и топливные элементы, электролизеры состоят из анода и катода, разделенных электролитом. Различные электролизеры работают по-разному, в основном из-за разного типа используемого электролита и ионных частиц, которые он проводит.
Электролизеры с мембраной из полимерного электролита
В электролизере с мембраной из полимерного электролита (ПЭМ) электролит представляет собой твердый специальный пластиковый материал.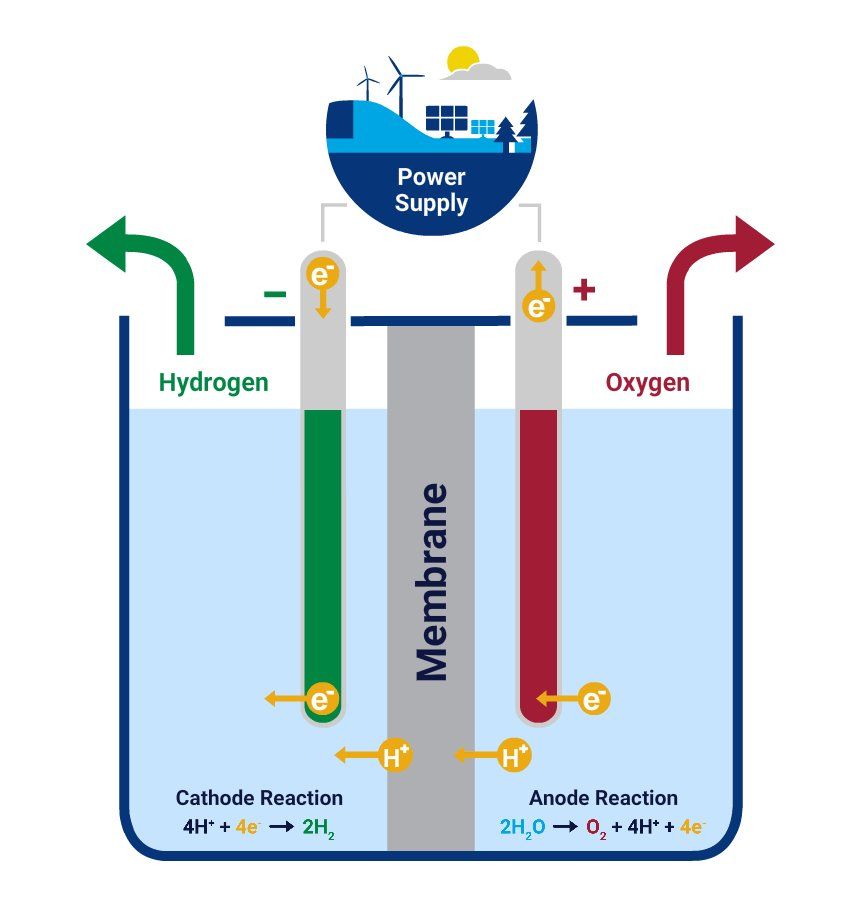
- Вода реагирует на аноде с образованием кислорода и положительно заряженных ионов водорода (протонов).
- Электроны проходят через внешнюю цепь, а ионы водорода избирательно перемещаются через ФЭУ к катоду.
- На катоде ионы водорода соединяются с электронами из внешней цепи, образуя газообразный водород. Анодная реакция: 2H 2 O → O 2 + 4H + + 4e — Катодная реакция: 4H + + 4e — → 2H 94 2 94
Щелочные электролизеры
Щелочные электролизеры работают за счет транспорта ионов гидроксида (OH —) через электролит от катода к аноду с образованием водорода на стороне катода. Электролизеры, в которых в качестве электролита используется жидкий щелочной раствор гидроксида натрия или калия, уже много лет имеются в продаже. Новые подходы с использованием твердых щелочных обменных мембран (AEM) в качестве электролита показывают многообещающие результаты в лабораторных масштабах.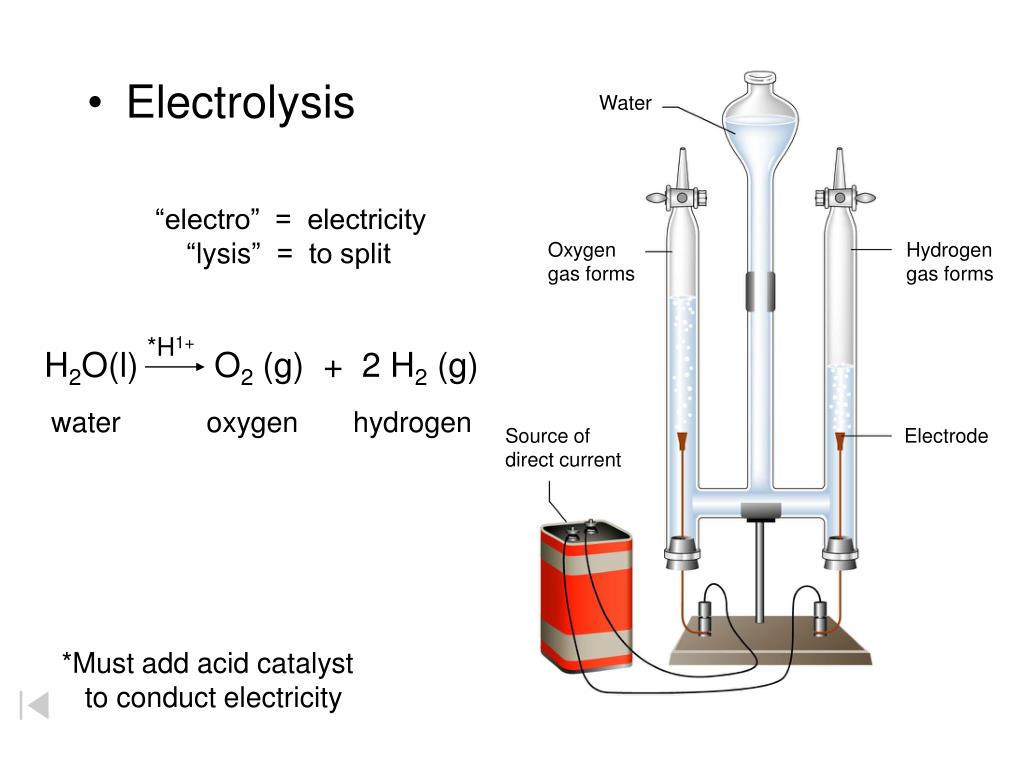
Электролизеры твердого оксида
Электролизеры твердого оксида, в которых в качестве электролита используется твердый керамический материал, избирательно проводящий отрицательно заряженные ионы кислорода (O 2-) при повышенных температурах генерируют водород несколько другим способом.
- Пар на катоде соединяется с электронами из внешней цепи с образованием газообразного водорода и отрицательно заряженных ионов кислорода.
- Ионы кислорода проходят через твердую керамическую мембрану и реагируют на аноде, образуя газообразный кислород и генерируя электроны для внешней цепи.
Твердооксидные электролизеры должны работать при температурах, достаточно высоких для нормального функционирования твердооксидных мембран (около 700–800 °C по сравнению с электролизерами на основе PEM, которые работают при 70–90°C и коммерческие щелочные электролизеры, которые обычно работают при температуре ниже 100°C). Усовершенствованные лабораторные твердооксидные электролизеры на основе протонпроводящих керамических электролитов демонстрируют перспективность снижения рабочей температуры до 500–600°C. Твердооксидные электролизеры могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), для уменьшения количества электроэнергии, необходимой для производства водорода из воды.
Твердооксидные электролизеры могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), для уменьшения количества электроэнергии, необходимой для производства водорода из воды.
Почему рассматривается этот путь?
Электролиз — это ведущий способ производства водорода для достижения цели Hydrogen Energy Earthshot по снижению стоимости чистого водорода на 80% до 1 доллара за 1 килограмм за 1 десятилетие («1 1 1»). Водород, полученный с помощью электролиза, может привести к нулевым выбросам парниковых газов, в зависимости от используемого источника электроэнергии. Источник необходимой электроэнергии, включая его стоимость и эффективность, а также выбросы в результате производства электроэнергии, необходимо учитывать при оценке преимуществ и экономической целесообразности производства водорода с помощью электролиза. Во многих регионах страны сегодняшняя электросеть не идеальна для обеспечения электроэнергией, необходимой для электролиза, из-за выбросов парниковых газов и количества необходимого топлива из-за низкой эффективности процесса производства электроэнергии. Производство водорода с помощью электролиза используется для возобновляемых источников (ветер, солнце, гидро, геотермальная энергия) и ядерной энергии. Эти пути производства водорода приводят к практически нулевым выбросам парниковых газов и загрязняющих веществ; тем не менее, стоимость производства должна быть значительно снижена, чтобы быть конкурентоспособным с более зрелыми способами, основанными на углероде, такими как риформинг природного газа.
Производство водорода с помощью электролиза используется для возобновляемых источников (ветер, солнце, гидро, геотермальная энергия) и ядерной энергии. Эти пути производства водорода приводят к практически нулевым выбросам парниковых газов и загрязняющих веществ; тем не менее, стоимость производства должна быть значительно снижена, чтобы быть конкурентоспособным с более зрелыми способами, основанными на углероде, такими как риформинг природного газа.
Потенциал для синергии с производством энергии из возобновляемых источников
Производство водорода посредством электролиза может предложить возможности для синергии с динамической и прерывистой выработкой энергии, что характерно для некоторых технологий возобновляемых источников энергии. Например, хотя стоимость энергии ветра продолжает снижаться, присущая ветру изменчивость является препятствием для эффективного использования энергии ветра. Водородное топливо и производство электроэнергии могут быть интегрированы в ветряную электростанцию, что позволит гибко переключать производство, чтобы наилучшим образом соответствовать доступности ресурсов с эксплуатационными потребностями системы и рыночными факторами. Кроме того, во времена избыточного производства электроэнергии ветряными электростанциями вместо того, чтобы сокращать электроэнергию, как это обычно делается, можно использовать эту избыточную электроэнергию для производства водорода путем электролиза.
Кроме того, во времена избыточного производства электроэнергии ветряными электростанциями вместо того, чтобы сокращать электроэнергию, как это обычно делается, можно использовать эту избыточную электроэнергию для производства водорода путем электролиза.
Важно отметить…
- Электроэнергия в настоящее время не является идеальным источником электроэнергии для электролиза, поскольку большая часть электроэнергии вырабатывается с использованием технологий, которые приводят к выбросам парниковых газов и являются энергоемкими. Выработка электроэнергии с использованием технологий возобновляемой или ядерной энергии, либо отдельно от сети, либо в качестве растущей части сети, является возможным вариантом преодоления этих ограничений для производства водорода с помощью электролиза.
- Министерство энергетики США и другие организации продолжают усилия по снижению стоимости производства электроэнергии на основе возобновляемых источников и развитию более эффективного производства электроэнергии на основе ископаемого топлива с улавливанием, утилизацией и хранением углерода.
 Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире.
Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире.
Исследования сосредоточены на преодолении проблем
- Достижение целевого показателя стоимости чистого водорода Hydrogen Shot в размере 1 доллара США за кг H 2 к 2030 г. (и промежуточная цель 2 долл. США/кг H 2 к 2025 г.) за счет лучшего понимания компромиссов между производительностью, стоимостью и долговечностью электролизных систем при прогнозируемых будущих динамических режимах работы с использованием CO 2 — без электричества .
- Снижение капитальных затрат электролизера и баланса системы.
- Повышение энергоэффективности преобразования электроэнергии в водород в широком диапазоне условий эксплуатации.
- Углубление понимания процессов деградации элементов и батарей электролизера и разработка стратегий смягчения последствий для увеличения срока службы.
Химия для детей — Как разделить воду на водород и кислород с помощью электролиза
Нам всем говорили, что вода состоит из водорода и кислорода. Но как мы действительно знаем это? Неужели это влажное вещество, утоляющее жажду и охлаждающее тело в жаркие летние дни, действительно состоит из двух частей?0098 газы ?
Но как мы действительно знаем это? Неужели это влажное вещество, утоляющее жажду и охлаждающее тело в жаркие летние дни, действительно состоит из двух частей?0098 газы ?
Мы пытались разделить воду на кислород и водород с помощью электролиза. Нам удалось это сделать после серии экспериментов, которые оставили у нас еще больше вопросов, чем до того, как мы начали. Что не обязательно плохо — любопытство — отличное состояние обучения! (См. таинственный случай отсутствия кислорода, ниже.)
Вы можете воспользоваться нашими ошибками и провести электролиз быстрым способом. Вот как можно разделить воду на водород и кислород с помощью электролиза. Потом я расскажу вам о том, что мы сделали сначала, что произвело совсем другой газ.
Как разделить воду на водород и кислород
Что вам понадобится
- стеклянная или пластиковая ванна
- 2 резинки
- 2 пробирки (по возможности с крышками)
- двууглекислая сода (1 ст.
 л.)
л.) - графитовые грифели
- вода
- (мы использовали 6В, примерно как эта)
- 2 пары зажимов типа «крокодил»
- водонепроницаемая лента
Батарейка
Аппарат для электролиза
Чем вы занимаетесь
Подробные инструкции по установке смотрите в этом видео – расположение эластичных лент идеально удерживает пробирки на месте.
Если вы не можете посмотреть видео, вот его суть: Подсоедините один конец каждого зажима-крокодила к кусочку графита, а другой к батарее. Прикрепите концы графита ко дну ванны так, чтобы графит торчал вверх, и поместите перевернутую пробирку на каждый кусок графита (удерживаемый эластичными лентами). Растворите бикарбонат соды в воде и наполните ванну. Наконец, выньте каждую пробирку, наполните ее водой и осторожно поставьте на графит. Любые газы, собранные во время электролиза, заменят воду в трубках, поэтому убедитесь, что нет пузырьков воздуха.
Что происходит
На каждом электроде быстро начинают образовываться пузырьки газа.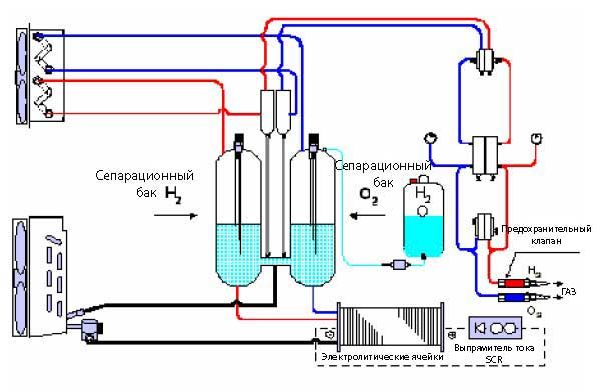 На отрицательном электроде (катоде) собирается больше газа, чем на положительном (аноде).
На отрицательном электроде (катоде) собирается больше газа, чем на положительном (аноде).
Как проверить ваши газы
Когда вы соберете достаточное количество газа на каждом электроде, осторожно закройте пробирки крышками (пока они находятся под водой).
Для проверки на водород
Мы предположили, что газ на нашем (отрицательном) катоде был (положительно заряженным) водородом. Водород взрывоопасен. В таких количествах он не разрушит ваш дом, но будет издавать прохладный хлопающий звук в присутствии зажженной щепки. Вы можете услышать это в видео ниже.
Для проверки на кислород
Мы проверяем на кислород с помощью светящейся шины.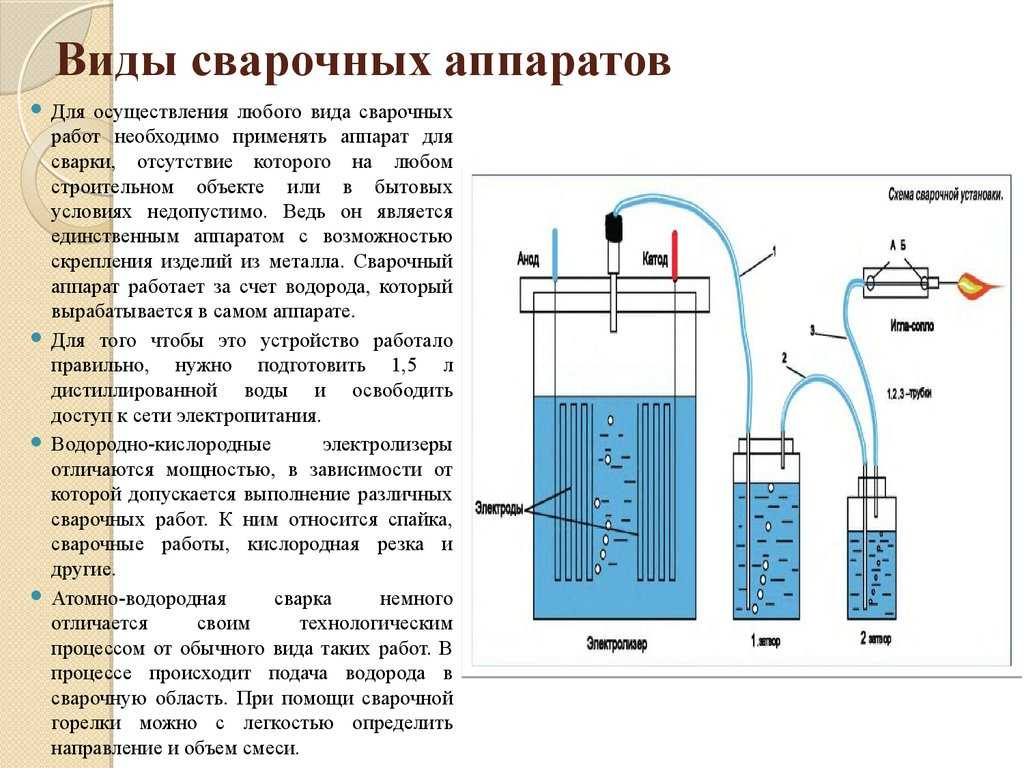 Если кислорода достаточно, шина воспламеняется. Газ, который мы собрали на нашем аноде, дал кратковременное свечение, которое подтвердило, что это кислород, но после возбуждения от взрыва водорода мы были немного разочарованы. Позже мы произвели намного больше кислорода, используя другой метод — см. ниже видео о нашей повторно зажженной шине.
Если кислорода достаточно, шина воспламеняется. Газ, который мы собрали на нашем аноде, дал кратковременное свечение, которое подтвердило, что это кислород, но после возбуждения от взрыва водорода мы были немного разочарованы. Позже мы произвели намного больше кислорода, используя другой метод — см. ниже видео о нашей повторно зажженной шине.
Как работает электролиз?
Вода представляет собой ковалентную молекулу (h30), удерживаемую общими электронами в ковалентных связях.
Во время электролиза молекулы восстанавливаются на катоде до газообразного водорода и окисляются на аноде до газообразного кислорода.
Чистая вода не проводит электричество, поэтому нам нужно добавить электролит, например двууглекислую соду. (Вы не поверите, сколько веб-сайтов советуют использовать соль. Мы попробовали и получили совершенно другой газ. Подробнее об этом позже.)
Производится вдвое больше водорода, чем кислорода, что отражает молекулярный состав вода.
Credit – J Squish
Вот довольно простое объяснение электролиза воды.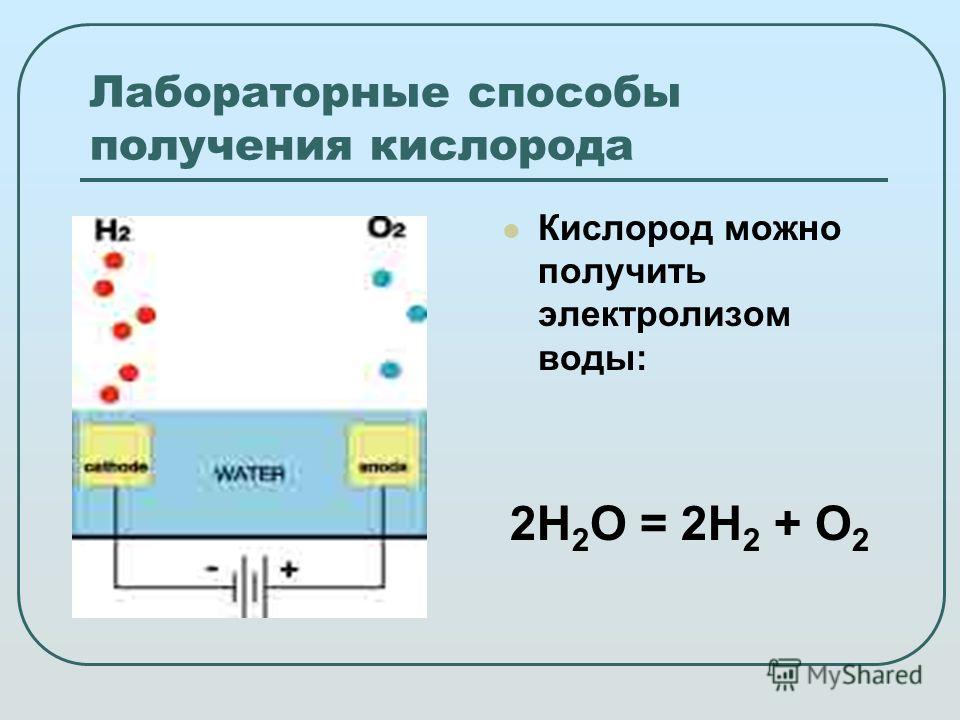
Если вам нужно более подробное объяснение, см. Википедию.
{Большое спасибо, Сара, за то, что указали на мое прежнее недоразумение и сделали этот пост более точным!}
Таинственный случай отсутствия кислорода
(Или что происходит, когда вы используете соль в качестве электролита.)
Прежде чем мы успешно разделили воду на водород и кислород, используя описанный выше метод, мы пытались добавить соль, чтобы помочь нашей воде проводить электричество. И не только щепотку соли. Я решил, что если немного соли немного поможет, то много соли будет еще лучше. (В конце концов, это работает для кристаллов.)
Мы проводим наш электролиз, используя тот же аппарат, что и выше, но на этот раз с насыщенным раствором соли. И вот мы сидели, жадно выискивая наши пузыри водорода и кислорода.
Что случилось? Ну, много на нашем катоде. Газ быстро начал заполнять пробирку. Мы протестировали его и обнаружили, что это водород. А на положительном электроде? Ни единого пузырька газа! Что случилось с кислородом из наших молекул воды?
Ночью я провел небольшое исследование.
Похоже, что во время электролиза раствора хлорида натрия (соли) хлорид натрия распадается на положительном электроде с образованием газообразного хлора и раствора гидроксида натрия. (Нажмите на ссылку, чтобы получить более подробное объяснение.) Хлор легко растворяется в воде, поэтому не будет собираться в виде газа, пока раствор не станет насыщенным и не сможет больше поглощать хлор.
Итак, если наш положительный электрод был занят притяжением хлора, а на катоде собирался водород… что случилось с кислородом? Или в натрий из нашего хлорида натрия (NaCl), если уж на то пошло? По словам химиков, натрий и кислород объединяются, образуя раствор гидроксида натрия. Требовалось дальнейшее расследование.
Мы оставили наш аппарат настроенным — отключенным от батареи — на ночь. Мы решили изучить его на наличие зацепок.
Дальнейшие исследования
Какие изменения произошли в результате электролиза?
Наш солевой раствор приобрел коричневатый цвет.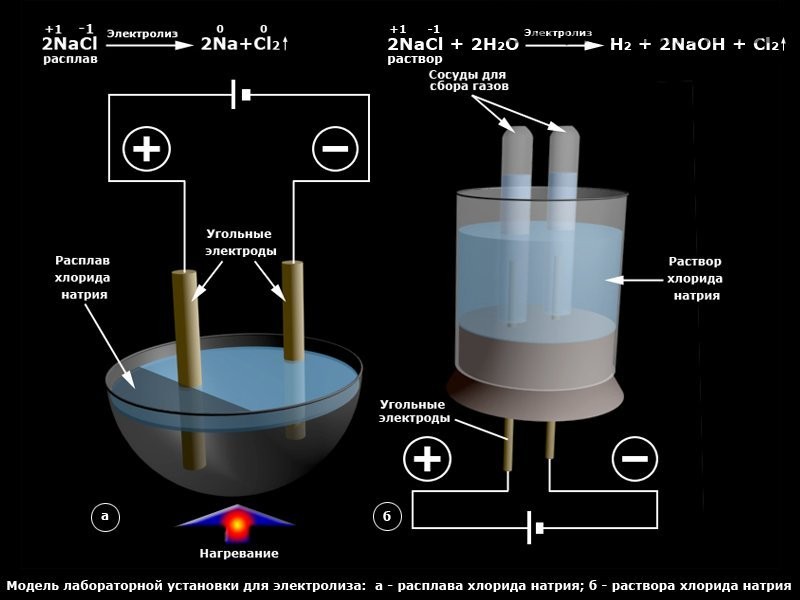 Был ли это растворенный хлор? Сломанный графит? Проржавел зажим-крокодил (который был прикреплен к аноду)?
Был ли это растворенный хлор? Сломанный графит? Проржавел зажим-крокодил (который был прикреплен к аноду)?
Изменения в результате электролиза
Фильтрация раствора .
Часть нашего положительного электрода (анода) сломалась, оставив в растворе черные частицы. Мы используем графит в электролизе, потому что это инертный (нереакционноспособный) металл, но, возможно, большое количество произведенного нами хлора вызвало его реакцию? Мы отфильтровали коричневый раствор, чтобы увидеть, остались ли какие-либо нерастворимые частицы. Они этого не сделали. Но мы заметили несколько белых пятен на фильтровальной бумаге — должно быть, хлор, образующийся на нашем положительном электроде, обесцветил бумагу!
Отбеленная фильтровальная бумагаПосле электролиза наш раствор был слегка кислым
Тестирование рН раствора
Мы предположили, что раствор будет слегка щелочным из-за гидроксида натрия. Но когда мы проверили его, мы обнаружили обратное. Он был слегка кислым — как хлор. Мы предположили, что это означает, что раствор должен содержать больше хлора, чем гидроксида.
Мы предположили, что это означает, что раствор должен содержать больше хлора, чем гидроксида.
Еще больше удовольствия от кислорода
Здесь я немного отклоняюсь от темы, но обещал рассказать, как мы создали достаточное количество кислорода, чтобы успешно протестировать его. Идея пришла к нам после перехода к 9 0098 Магия кислорода Шоу в Королевском институте. Я хотел бы поделиться с вами одной из демонстраций, которые мы там видели.
Ведущие спросили, могут ли они одолжить у меня купюру в 10 фунтов, а потом подожгли ее! Вот видео моих пылающих денег.
Невредимая банкнота номиналом 10 фунтов стерлингов
Магия кислорода Ученые также продемонстрировали, как сделать «зубную пасту для слонов», расщепляя перекись водорода.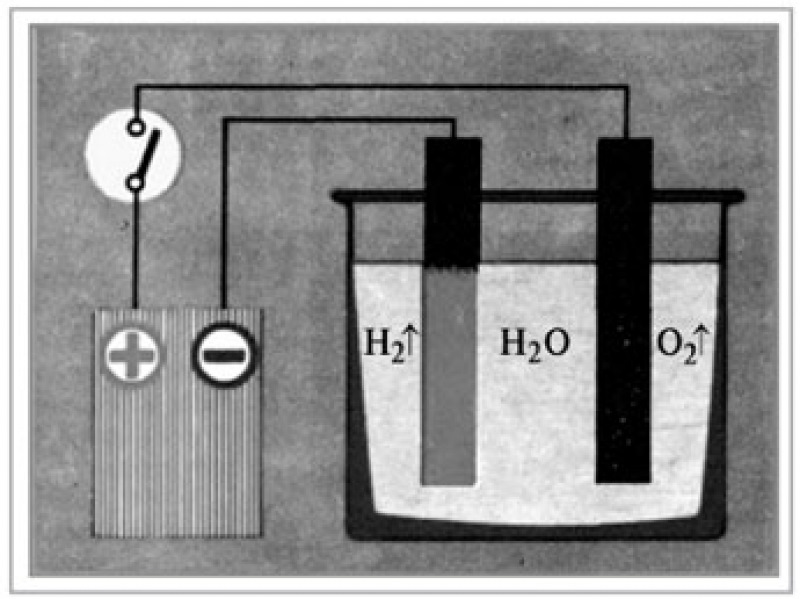 Мы вспомнили, как когда-то сами делали зубную пасту для слонов. Когда мы вернулись домой, мы решили снова сделать зубную пасту для слонов и использовать светящуюся шину для проверки на кислород.
Мы вспомнили, как когда-то сами делали зубную пасту для слонов. Когда мы вернулись домой, мы решили снова сделать зубную пасту для слонов и использовать светящуюся шину для проверки на кислород.
Изготовление зубной пасты для слонов
Когда вы помещаете светящуюся шину в кислород, она снова загорается.
Почему это мой любимый способ заниматься наукой на дому
Как вы понимаете, это не была демонстрация науки на дому, когда мама точно знает, что произойдет и почему.

 Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире.
Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире. л.)
л.)