Как получить водород в домашних условиях. Как воду разложить на водород и кислород в домашних условиях
Получение водорода в домашних условиях

В данной статье описаны наиболее популярные способы получения дешевого водорода в домашних условиях.
Способ 1. Водород из алюминия и щелочи.
Используемый раствор щелочи – едкого кали (гидроксид калия), либо едкого натра (гидроксид натрия, продается в магазинах, как средство очистки труб «Крот»). Выделяемый водород более чистый, чем при реакции кислот с активными металлами.
Насыпаем в колбу небольшое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся.Дождавшись пока реакция будет происходить более активно, аккуратно добавим еще 10г. щелочи и несколько кусочком алюминия. Так мы значительно усилим процесс.Закупориваем колбу, пробиркой с трубкой ведущей сосуд для сбора газа. Ждем примерно 3 -5 мин., пока водород вытеснит воздух из сосуда.
Как образуется водород? Оксидная пленка, которая покрывающая поверхность алюминия, при контакте с щелочью разрушается. Так как алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑
Способ 2. Водород из алюминия, сульфата меди и пищевой соли.
В колбу насыпаем немного сульфата меди (медный купорос, продается в любом магазине для сада), и соли (соли чуть больше). Добавляем воду и перемешиваем до полного растворения. Раствор должен, окрасится в зеленый цвет, если этого не произошло, добавьте еще небольшое количество соли.Колбу необходимо поставить в чашку наполненной холодной водой, т.к. при реакции, будет выделятся большое количество тепла.Добавляем в раствор несколько кусочков алюминия. Начнется реакция.
Как происходит выделение водорода? В процессе образуется хлорид меди, смывающий оксидную пленку с метала. Одновременно с восстановлением меди происходит образование газа.
Способ 3. Водород из цинка и соляной кислоты.
Помещаем в пробирку кусочки цинка и заливаем их соляной кислотой.Являясь активным металлом цинк, взаимодействуя с кислотой, вытесняет из нее водород.
Zn + 2HCl → ZnCl2 + h3↑
Способ 4. Производство водорода электролизом.
Пропускаем через раствор воды и проваренной соли электрический ток (12В). При реакции, будет выделятся водород (на аноде) и кислород (на катоде).
При получении водорода и последующих экспериментах, соблюдайте технику безопасности.
all-he.ru
Расщепление воды на водород и кислород | Водопровод
 » Водопровод
» Водопровод
Банк идей cегодня идей в Базе - 751
Расщепить воду на водород и кислород
Дата публикации: 06.07.
Водород как источник энергии привлекает своей экологической безопасностью. Ведь при его сжигании образуются только водяной пар. На Земле, запасы водорода в связанном состоянии в виде воды неисчерпаемы. Добыть водород из воды можно при помощи хорошо известного химического эффекта, называемого электролиз. Электрический ток разлагает воду на водород и кислород. Однако чтобы получать водород таким способом в промышленных масштабах, необходимо затратить огромное количество электроэнергии. А как можно в промышленных масштабах расщеплять воду на водород и кислород без использования электрического тока?
. Вспомним о хорошо известном биологическом эффекте биосинтеза, когда растения, без ничего , используя бесплатные ресурсы (солнечный свет, воду и углекислый газ) выделяют в окружающую среду кислород. Причём, этот кислород получается в результате расщепления воды. Может, можно подыскать подходящий биологический эффект, позволяющий расщеплять воду на водород и кислород, используя в качестве источника энергии солнечный свет?
Оказывается, что для расщепления молекул воды на водород и кислород можно использовать фотоэлектрохимический эффект. Фотоэлектрохимическая ячейка включает в себя погруженный в воду электрод, созданный на основе наночастиц природного материала гематита (разновидность оксида железа), покрытых сетью из зелёного белкового пигмента фикоцианина, содержащегося в сине-зелёных водораслях (рис.1).

Рис.1. Фрагмент фотоэлектрохимического электрода под электронным микроскопом. Красный фон - наночастицы гематита, зелёные нити - фикоцианин.
При облучении погруженного в воду поверхности этого электрода солнечным светом, электрод вырабатывает электрический ток, а электрический ток разлагает молекулы воды на водород и кислород. Полученный белковый комплекс на поверхности пластины оказался довольно стойким и не разрушался при контакте с оксидом железа в щелочной среде, на ярком свете.
Эта разработка представляет несомненный интерес в качестве возможного способа производства водородного топлива. Осталось выяснить, как наладить массовое производство этих электродов и как они будут работать в реальных условиях эксплуатации.
Ученые расщепили воду на водород и кислород, используя обычную батарейку

Ученые из Стэнфордского университета разработали необычное устройство, которое использует обычную 1,5-вольтовую батарейку, для расщепления воды на водород и кислород при комнатной температуре. Их разработка может являться дешевым и удобным способом для производства горючего для водородных автомобилей .
Расщепитель воды производится из относительно дешевых металлов, никеля и железа, через которые пропускается ток от обычной батарейки типа ААА, сообщает ресурс Gizmag.
«Нам впервые удалось расщепить воду при низком напряжении, используя недорогие металлы. Это очень важно, ведь ранее для подобных целей использовались дорогие металлы, такие как платина или иридий», говорит ведущий исследователь Hongjie Dai.
Технология имеет огромный потенциал в качестве источника питания для водородных двигателей, которые уже давно пророчат на смену бензиновым. В отличие от бензиновых двигателей, которые производят много вредных выбросов в атмосферу, в качестве побочного продукта у водородных агрегатов является вода.
Ранее водородные двигатели критиковали за их высокую стоимость, отсутствие развитой инфраструктуры и низкую энергоэффективность. Однако, по мнению исследователей из Стэнфордского университета, их изобретение может значительно исправить большинство этих недостатков.
«На протяжении многих лет ученые пытались сделать недорогие электрокатализаторы с высокой эффективностью и длительным сроком службы. Когда мы обнаружили, что никель является столь же эффективным, как и платина, это стало для нас неожиданностью», объясняет Hongjie Dai.
Катализатор из никеля и оксида никеля требует для расщепления воды значительно меньшее напряжение, по сравнению с чистым никелем или чистым оксидом никеля. Однако, как сообщают создатели, данная технология еще довольно «сырая» и не совсем готова для коммерческого использования.
В будущем ученые планируют разработать катализатор, работающий от солнечной энергии вместо батарейки. Ведь исследователи полагают, что их изобретение может существенно повлиять на производство водородных автомобилей. Кстати, напомним, что компания Toyota, планирует в следующем году представить автомобиль с двигателем, работающем на водороде .
Каким образом можно воду расщепить на водород и кислород?
kudec Гуру (4476) 6 лет назад
А в чем проблема, в малых количествах можно и два любых электрода (проводок, пластинка) вставить в воду и дать постоянное напряжение порядка 10-20 вольт.
Marat Просветленный (25772) 6 лет назад
Это просто.
1) Нетрудно показать, что равновесие 2h3O = 2h3 + O2 сместится в прямом направлении при температуре порядка +2000С. Недостатком термического способа является большая энергоёмкость и наличие других равновесий (с участием, например пероксида водорода).
2) Химический способ. Вода может быть как окислителем, так и восстановителем. Из воды можно выделить кислород, окислив её свободным фтором: F2 + h3O = O2 + HF. С другой строны, активный щелочной металл запросто вытеснит из воды водород: Na + h3O = h3 + NaOH (данные реакции идут при нормальных условиях).
3) Облучение паров воды лазером с использованием фемтохимических методов. Существует множество различных путей реакции с участием взаимодействующих молекул h3O. Задавая последовательность лазерных импульсов в определённой последовательности и в определённом частотном диапазоне, можно заставить систему дать в конечном итоге именно h3 и O2. Здесь положение усугубляется спиновым запретом процессов элементарного акта, но и его можно снять.
4) Электролиз жидкой воды: пропускание тока через ячейку, заполненную водой (водным раствором). Тогда на аноде будет выделяться кислород, а на катоде - водород. Легко показать, что минимальное напряжение, необходимое для этого, составляет порядка 2.2 вольт (в реальности, разумеется, больше - из-за омических потерь в водном растворе). Этот способ разложения воды на простые вещества является, пожалуй, наиболее доступным.
Источники: http://www.trizland.ru/ideas/2441, http://hi-news.ru/technology/uchenye-rasshhepili-vodu-na-vodorod-i-kislorod-ispolzuya-obychnuyu-batarejku.html, http://otvet.mail.ru/question/28926714
restart24.ru
Как получить водород в домашних условиях | В домашних условиях
 » В домашних условиях
» В домашних условиях
Как получить водород?
Производство водорода – одна из главных образующих цепочек водородной энергетики. Водород в чистом виде, практически не встречается в природе, поэтому он должен извлекаться из других химических веществ различными методами и способами.
Как получить водород: методы
- Паровая конверсия метана и природного газа: водяной пар при высокой температуре (700 – 1000 градусов Цельсия) смешивается с метаном под давлением, в присутствии катализирующего вещества.
- Газификация угля: один из старейших способов получения водорода. Без доступа воздуха, при температуре 800 – 1300 градусов Цельсия нагревают уголь вместе с водяным паром, при этом из воды уголь вытесняет кислород. На выходе получается углекислый газ и водород.
- Электролиз воды. очень простой способ получения водорода. В емкость наливается раствор соды, в который помещается 2 электрических элемента, один соответствует минусу – катод, другой плюсу – анод. В данный раствор подается электричество, которое разлаживает воду на составляющие – водород выделяется на катоде, а кислород на аноде.
- Пиролиз: разложение воды на водород и кислород без доступа воздуха и при высокой температуре.
- Частичное окисление: сплав металлов алюминия и галлия формируют в специальные брикеты, которые помещают в емкость с водой, в результате химической реакции образуется водород и окись алюминия. Галлий используется в сплаве для предотвращения окисления алюминия.
- Биотехнологии: еще в 20 веке было обнаружено, что если водорослям хламидомонадам не будет хватать кислорода и серы в процессе жизнедеятельности, то они бурно начнут выделять водород.
- Глубинный газ планеты: в недрах земли водород может находится в чистом газообразном виде, но его выработка оттуда не целесообразна.
Как из воды получить водород
Наиболее простым способом получения водорода из воды является электролиз. Электролиз — химический процесс, при котором раствор электролита, под воздействием электрического тока, разделяется на составные части, то есть в нашем случае вода разделяется на водород и кислород. Для этого используется раствор соды в воде и два элемента – катод и анод, на которых и будут выделятся газы. На элементы подается напряжение, на аноде выделяется кислород, а на катоде водород.
Как получить водород в домашних условиях
Реактивы используются довольно простые – купорос (медный), поваренная соль, алюминий и вода. Алюминий можно взять из под пивных банок, но прежде, его нужно обжечь, чтобы избавится от пластиковой пленки, которая мешает реакции.
Потом отдельно готовится раствор купороса, и раствор соли, раствор купороса голубого цвета, смешивается с раствором соли, в итоге получается раствор зеленого цвета. Затем в этот зеленый раствор бросаем кусочек алюминиевой фольги, вокруг него появляются пузырьки – это водород. Также замечаем, что фольга покрылась красным налетом, это алюминий вытеснил медь из раствора. Для того, чтобы собрать водород для личных целей, используйте бутылку с пробкой, в которую заранее вставлена не широкая трубка, через которую и будет выходить газ.
А теперь, внимание! Меры предосторожности. Поскольку водород взрывоопасный газ, опыты с ним нужно проводить на улице, а во-вторых реакция получения водорода проходит с большим выделением тепла, раствор может разбрызгиваться и вас попросту обжечь.
Как получить перекись водорода
- В лаборатории перекись водорода получают с помощью реакции: ВаО2 + Н2 SО4 = BaSO4 + h3 O2 .
- В промышленных масштабах ее получают с помощью электролиза серной кислоты, в процессе которого образуется надсерная кислота, которую, в итоге, разлаживают на серную кислоту и перекись водорода.
- Как получают водород в лаборатории еще: часто водород в лаборатории получают взаимодействием цинка и соляной кислоты: Zn + 2HCl = h3 + ZnCl2 .
Надеюсь, с этой статьи вы вынесли ту информацию, которая вам была необходима, и еще раз предупреждаю – будьте осторожны с любыми опытами и экспериментами с водородом!
Как быстро и легко получить водород в домашних условиях
- Кое что из школьного курса химии.
- Позвонил знакомый,и попросил меня изготовить или дать реальный рецепт химической реакции,позволяющей легко и безопасно получить водород в домашних условиях.
Не зная истинных целей применения водорода, я придумал,вернее вспомнил из школьного урока химии ,реакцию получения водорода ,достаточного для того, чтобы надуть несколько детских воздушных шариков Заранее хочу предупредить - делать это нужно на открытом воздухе и помнить что водород - очень опасный газ. Даже с несколькими литрами, оказавшимися в резиновой оболочке нужно обращаться очень осторожно. А в помещении с ним возиться не стоит, так как он легче воздуха и, улетев в достаточном количестве, стремится образовать под потолком слой гремучего газа.
Учтя эти меры предосторожности, приступаем. Реактивы самые простые, доступные и относительно безвредные - медный купорос из хозяйственного магазина, поваренная соль, алюминий и вода. Алюминий я взял из использованных пивных банок. Правда, их пришлось обжечь чтобы избавиться от пластиковой плёнки, которая не даёт алюминию реагировать с содержимым банки. Первый эффектный фокус можно посмотреть, если отдельно приготовить раствор медного купороса (голубой) и раствор поваренной соли (бесцветный). Сливаем в одну банку - раствор стал зелёным. Если теперь в него бросить кусочек алюминевой фольги, увидим как раствор вокруг него вспенивается - это выделяется водород, а сам кусочек фольги покрывается красным налётом - алюминий вытеснил из раствора медь. Кроме того, алюминий окислился - появилась белая взвесь. Ещё одно предупреждение - процесс экзотермический. Иначе говоря, идёт с выделением тепла. Т.е. раствор с течением времени разогревается. А если учесть то, что скорость этой реакции увеличивается с ростом температуры, очень легко получить реакцию идущую вразнос . Как у меня и вышло. Первый результат - гейзер, который стоя на улице, плевался бурым кипятком. Но вот концентрация подобрана, подобрана начальная температура и можно видеть результат:
Берете бутылку из под шампанского и закрываете пробкой с заранее вставленой в неё трубкой диаметром 5-8мм.С трубки выходит водород,которым вы можете надуть красивые воздушные шары,а потом ,гуляя с ребенком вместе с ним отпустите их в небо.Поверте:-восторг и смех вашего ребенка стоит этих несложных действий.
Новая дешевая технология получения водорода в домашних условиях

Водородные топливные элементы могут стать еще одной альтернативой традиционным аккумуляторным батареям, используемым в электрических автомобилях. Уже существуют прототипы авто, которые работают на водороде. Но сложность получения этого вещества в домашних условиях пока тормозит развитие этого экологически чистого источника энергии.
Подвинуть прогресс в этом направлении смогли ученые из Стэндфордского университета. Они создали портативный электронный сплиттер, который расщепляет воду на кислород и водород, получая питание всего от одной 1,5-вольтовой батарейки. Сплиттер состоит из никелевого и железного электродов. Он эффективно функционирует даже при комнатной температуре.
Новая технология уникальна тем, что в процессе выработки водорода не участвуют дорогие материалы, как это происходит в промышленных расщепителях воды. К тому же устройство использует крайне мало электрической энергии.
Катализатор на основе никеля и железа был изобретен аспирантом Стэндфордского университета Мин Гуном. Следующим шагом в исследовании будет использование вместо батарейки солнечного фотоэлемента. Это еще больше удешевит добычу водорода.
Первые разработки автомобилей на топливных элементах начались еще в 60-х годах прошлого столетия. Но это в основном были лишь прототипы. Однако уже в следующем году такие автопроизводители как Toyota, Honda и Hyundai планируют запустить в производство серийные модели автомобилей на водородных топливных элементах. И разработка ученых из Стэнфорда им как раз на руку.
Источники: http://elhow.ru/ucheba/himija/himicheskie-reakcii/kak-poluchit-vodorod, http://blog.i.ua/user/669719/377589/, http://scsiexplorer.com.ua/index.php/novie-razrabotki/energetika/1589-novaja-deshevaja-tehnologija-poluchenija-vodoroda-v-domashnih-uslovijah.html
Комментариев пока нет!restart24.ru
Разложение воды на водород и кислород
Существуют различные способы получения водорода и кислорода, которые условно можно разделить на промышленные и лабораторные.Один из наиболее простых и популярных методов получения и кислорода, и водорода – разложение воды на водород и кислород. Уравнение данной химической реакции имеет вид:
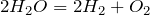 .
.
Учитывая, что разложению подверглось 100 г воды, рассчитаем её количество вещества:
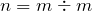 ;
;
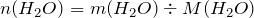 ;
;
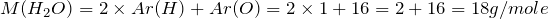 ;
;
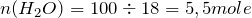 .
.
Согласно уравнению реакции, вода, водород и кислород находятся в следующих мольных соотношениях:
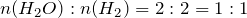 ;
;
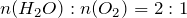 .
.
Это означает, что количество вещества продуктов реакции будет равно:
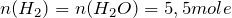 ;
;
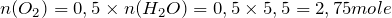 .
.
Тогда, объемы выделившихся в ходе реакции разложения воды газов будут равняться:
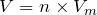 ;
; ;
;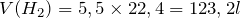 .
.
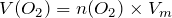 ;
;
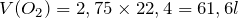 .
.
ru.solverbook.com
Обычная батарейка расщепляет воду на кислород и водород!
В отличие от традиционного топлива, которое выделяет вредные выхлопные газы, загрязняющие атмосферу и приводящие к изменению климатических условий, водородное топливо абсолютно безвредно для окружающей среды.
Почему все транспортные средства не используют водород в качестве топлива?

До сих пор экологически чистый процесс получения водорода требовал большого количества драгоценных металлов, что значительно повышает стоимость водородного топлива, особенно в сравнении с традиционным.
Путем химического взаимодействия атомов водорода с атомами кислорода, находящегося в воздухе, водородное топливо вырабатывает достаточно энергии для двигателя автомобиля, а «выхлопами» такого мотора становится чистая вода. Однако сегодня практически каждый «чистый» двигатель, который работает на водородном топливе, использует водород, полученный с помощью природного газа – процесс, экологическая чистота которого находится под сомнением.
Как получить «чистый» водород?
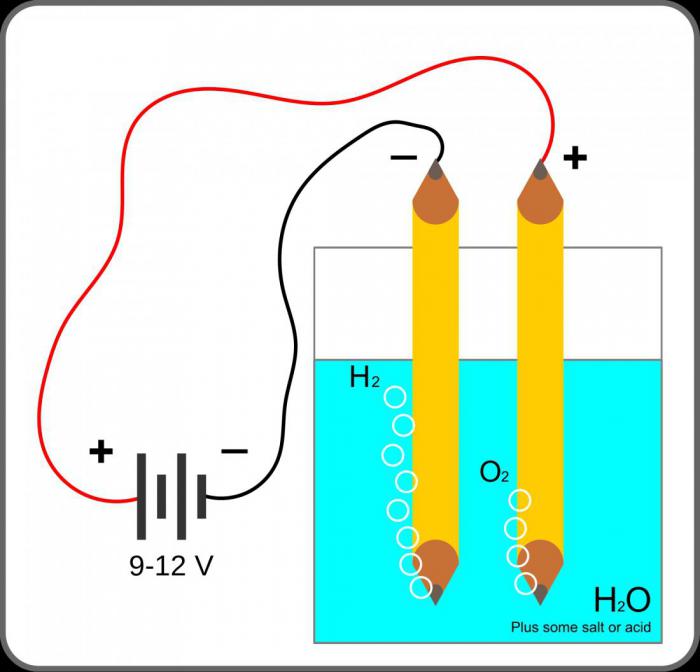
С помощью электрических потоков воду можно разделить на атомы кислорода и водорода. Этот процесс требует большого количества дорогих металлов, таких как платина или иридий, – они хорошо проводят электричество и не портятся, находясь в воде долгое время.

Процесс расщепления молекулы воды на атомы водорода и кислорода называется электролизом и проходит следующим образом: два электрода опускаются в воду, по ним проводится ток, под действием которого атомы водорода стремятся к отрицательно заряженному катоду, а атомы кислорода к положительно заряженному аноду.
Новый прорыв

Ученые из Стэндфордского университета провели уникальный эксперимент, в результате которого совершили процесс электролиза с помощью стандартных никелевых электродов под рекордно низким напряжением - обычная батарейка в 1.5 Вольт.
По данным ученых, конструкция электродов из никеля и его оксида позволила процессу успешно завершиться под таким низким напряжением. До этого никому не удавалось совершить подобное. Новая технология в промышленных масштабах поможет производителям водородного топлива значительно сэкономить на электричестве и проводниках. Сейчас ученые работают над тем, как увеличить продолжительность работы никелевых проводников в воде.
fb.ru
Как отделить кислород от водорода
Для этого нужен более сложный прибор — электролизер, который состоит из широкой загнутой трубки, наполненной раствором щелочи, в которую погружены два электрода из никеля.
Кислород будет выделяться в правом колене электролизера, куда подключен положительный полюс источника тока, а водород — в левом.
Это обычный тип электролизера, которым пользуются в лабораториях для получения небольших количеств чистого кислорода.
В больших количествах кислород получают в электролитических ваннах разнообразных типов.
Войдем в один из электрохимических заводов по производству кислорода и водорода. В огромных светлых залах-цехах строгими рядами стоят аппараты, к которым по медным шинам подводится постоянный ток. Это электролитические ванны. В них из воды можно получить кислород и водород.
Электролитическая ванна — сосуд, в котором параллельно друг другу расположены электроды. Сосуд наполняют раствором — электролитом. Число электродов в каждой ванне зависит от размера сосуда и от расстояния между электродами. По схеме включения электродов в электрическую цепь ванны делятся на однополярные (монополярные) и двухполярные (биполярные).
В монополярной ванне половина всех электродов подключается к положительному полюсу источника тока, а вторая половина — к отрицательному полюсу.
В такой ванне каждый электрод служит или анодом, или катодом, и на обеих сторонах его идет один и тот же процесс.
В биполярной ванне источник тока подключается только к крайним электродам, один из которых служит анодом, а другой — катодом. С анода ток поступает в электролит, через который он переносится ионами к близлежащему электроду и заряжает его отрицательно.
Проходя через электрод, ток снова входит в электролит, заряжая обратную сторону этого электрода положительно. Таким образом, проходя от одного электрода к другому, ток доходит до катода.
В биполярной ванне только анод и катод работают как монополярные электроды. Все же остальные электроды, расположенные между ними, являются с одной стороны катодами (—), а с другой стороны — анодами (+).
При прохождении электрического тока через ванну между электродами выделяются кислород и водород. Эти газы нужно отделить друг от друга и направить каждый по своему трубопроводу.
Существуют два способа отделения кислорода от водорода в электролитической ванне.
Первый из них заключается в том, что электроды отгораживаются друг от друга металлическими колоколами. Образующиеся на электродах газы поднимаются в виде пузырьков кверху и попадают каждый в свой колокол, откуда через верхний отвод направляются в трубопроводы.
Этим способом кислород легко отделить от водорода. Однако такое разделение приводит к излишним, непроизводительным затратам электроэнергии, так как электроды приходится ставить на большом расстоянии друг от друга.
Другой способ разделения кислорода и водорода при электролизе заключается в том, что между электродами ставится перегородка — диафрагма, которая является непроницаемой для пузырьков газа, но хорошо пропускает электрический ток. Диафрагма может быть сделана из плотно сотканной асбестовой ткани толщиной 1,5—2 миллиметра. Эту ткань натягивают между двумя стенками сосуда, создавая тем самым изолированные друг от друга катодные и анодные пространства.
Водород из всех катодных и кислород из всех анодных пространств поступают в сборные трубы. Оттуда по трубопроводам каждый газ направляется в отдельное помещение. В этих помещениях под давлением 150 атмосфер полученными газами наполняют стальные баллоны. Баллоны направляют во все уголки нашей страны. Кислород и водород находят широкое применение в различных областях народного хозяйства.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Как получить водород?
Производство водорода – одна из главных образующих цепочек водородной энергетики. Водород в чистом виде, практически не встречается в природе, поэтому он должен извлекаться из других химических веществ различными методами и способами.
Как получить водород: методы
- Паровая конверсия метана и природного газа: водяной пар при высокой температуре (700 – 1000 градусов Цельсия) смешивается с метаном под давлением, в присутствии катализирующего вещества.
- Газификация угля: один из старейших способов получения водорода. Без доступа воздуха, при температуре 800 – 1300 градусов Цельсия нагревают уголь вместе с водяным паром, при этом из воды уголь вытесняет кислород. На выходе получается углекислый газ и водород.
- Электролиз воды.: очень простой способ получения водорода. В емкость наливается раствор соды, в который помещается 2 электрических элемента, один соответствует минусу – катод, другой плюсу – анод. В данный раствор подается электричество, которое разлаживает воду на составляющие – водород выделяется на катоде, а кислород на аноде.
- Пиролиз: разложение воды на водород и кислород без доступа воздуха и при высокой температуре.
- Частичное окисление: сплав металлов алюминия и галлия формируют в специальные брикеты, которые помещают в емкость с водой, в результате химической реакции образуется водород и окись алюминия. Галлий используется в сплаве для предотвращения окисления алюминия.
- Биотехнологии: еще в 20 веке было обнаружено, что если водорослям хламидомонадам не будет хватать кислорода и серы в процессе жизнедеятельности, то они бурно начнут выделять водород.
- Глубинный газ планеты: в недрах земли водород может находится в чистом газообразном виде, но его выработка оттуда не целесообразна.
Как из воды получить водород
Наиболее простым способом получения водорода из воды является электролиз. Электролиз — химический процесс, при котором раствор электролита, под воздействием электрического тока, разделяется
elhow.ru
- Пересадка головы операция

- Необычные механизмы

- Альфа центавра на карте звездного неба

- Новый htc смартфон

- Что творится в космосе

- Необычные технологии

- Индийские смартфоны

- Андроид как устроен

- Как работает экзоскелет

- Самый лучший институт в галактике

- Умные дороги






