Содержание
Что такое атом?
Физики из Корнеллского университета в США получили фотографии отдельных атомов с рекордным разрешением — меньше половины ангстрема (0,39 Å). Предыдущий рекорд разрешения больше вдвое — 0,98 Å.
Men Today
Теги:
Нетленка
Физика
фотография
Магнитное поле
Electron
Электронные микроскопы, позволяющие делать снимки отдельных атомов, существуют уже полвека. Длина волны видимого света больше диаметра среднего атома, поэтому увидеть атом с помощью даже самого мощного светового микроскопа нельзя. Длина волны электрона гораздо меньше, и электронные микроскопы, позволяющие делать снимки отдельных атомов, существуют уже полвека.
Аналогом линз, фокусирующих изображение, в электронных микроскопах выступает магнитное поле, но его колебания служат источником искажений; эти искажения поддаются корректировке дополнительными устройствами управления колебаниями напряженности магнитного поля, но с ними сложность конструкции микроскопа возрастает.
В прошлом году физики из Корнеллского университета предложили устройство electron microscope pixel array detector (EMPAD), заменяющее сложную систему генераторов, фокусирующих входящие электроны. Устройство представляет собой матрицу — 128х128 пикселей, чувствительных к отдельным электронам. Каждый пиксель регистрирует угол отражения электрона; зная его, ученые при помощи техники птайкографии реконструируют характеристики электронов, включая координаты точки, откуда он был выпущен.
Затем ученые закрепили на подвижной балке лист двумерного материала — сульфида молибдена MoS2, и выпустили пучки электронов, поворачивая балку под разными углами к источнику электронов. С помощью EMPAD и птайкографии ученые определили расстояния между отдельными атомами молибдена и получили изображение с рекордным разрешением — 0,39 Å. «В сущности мы создали самую маленькую в мире линейку», — поясняет Сол Грюнер (Sol Gruner), один из авторов эксперимента. На снимке ниже видны атомы серы и место, где одного такого атома не хватает (указано стрелочкой).
На снимке ниже видны атомы серы и место, где одного такого атома не хватает (указано стрелочкой).
Кроме рекордного разрешения у этого метода есть еще одно преимущество: он требует относительно низкой энергии электронов. Самые мощные из современных электронных микроскопов используют пучки электронов с энергией до 300кЭв и тоже дают субангстемное неплохое разрешение — до 0,5 Å, но электроны такой высокой энергии годятся только для исследования очень прочных материалов. Двумерные материалы и биомолекулы разрушаются под действием таких высокоэнергетических частиц, поэтому возможность использовать электроны на порядок меньшей энергии (80 кЭв в эксперименте физиков из Корнелльского университета) очень ценно.
Описание эксперимента опубликовано в журнале Nature.
«Вещество на 99% состоит из пустоты» / Хабр
При обсуждении строения атома и вещества часто можно прочитать, что вещество на 99. 99…% состоит из пустоты, с разными версиями количества девяток. Как мы сейчас увидим, это утверждение имеет весьма шаткие основания, а попытки оценить долю пустоты в веществе могут с одинаковым успехом дать любое число от 0 до 100%. Последовательное же рассмотрение вопроса в рамках квантовой механики показывает, что от пустоты вещество отличается довольно сильно.
99…% состоит из пустоты, с разными версиями количества девяток. Как мы сейчас увидим, это утверждение имеет весьма шаткие основания, а попытки оценить долю пустоты в веществе могут с одинаковым успехом дать любое число от 0 до 100%. Последовательное же рассмотрение вопроса в рамках квантовой механики показывает, что от пустоты вещество отличается довольно сильно.
Традиционная линия рассуждений(*) выглядит так: в атоме, имеющем размер около одного ангстрема (10–10 метра), электроны вращаются вокруг ядра, размер которого в 100 000 раз меньше (около 10–15 метра). Размер самого электрона равен нулю, это точечная частица(**), поэтому атом оказывается практически пустым: в нем «непустое» лишь ядро. Чтобы получить долю объема атома, занимаемого ядром, нужно возвести в куб отношение их размеров. Получаем, что ядро занимает 10–15 объема атома, остальную долю объема — это 99.99…% с 13 девятками после запятой — занимает пустота.
Если атом растянуть до размеров футбольного поля, то ядро будет величиной с маковое зернышко.
Что не так в этих рассуждениях? Давайте продолжим ту же логику, рассматривая уже не атом, а его ядро. Мы считали атомное ядро непустым, но ведь оно состоит из протонов и нейтронов, которые, в свою очередь, состоят из фундаментальных частиц — кварков и глюонов(***). По современным представлениям, кварки и глюоны тоже являются точечными частицами, как и электрон. Следуя такой же линии рассуждений, как и в случае атома, получим, что ядро — тоже пустота, в которой летают частицы нулевых размеров. Итог: вещество ровно на 100% состоит из пустоты. Эта линия рассуждений завела нас в никуда.
Квантовая механика говорит нам, что электрон в атоме является не маленьким шариком, летающим по орбите вокруг ядра, а размазан по пространству в виде вероятностного облака, называемого орбиталью. Плотность этого облака, или просто электронная плотность , зависит от координаты
..jpg) Эта зависимость своя для каждой орбитали, тем не менее, есть общая закономерность: заметно отлична от нуля в области пространства размерами порядка ангстрема, а на больших расстояниях от ядра экспоненциально убывает.
Эта зависимость своя для каждой орбитали, тем не менее, есть общая закономерность: заметно отлична от нуля в области пространства размерами порядка ангстрема, а на больших расстояниях от ядра экспоненциально убывает.
Типичное поведение электронной плотности в атоме для разных электронных орбиталей. Источник.
Отсюда берется характерный размер атома в один ангстрем, использованный выше при сравнении размеров атома и ядра. Какой же количественный ответ на вопрос о доле пустоты в веществе может дать нам квантовая механика? Для этого нужно оценить суммарный объем, занимаемый электронными орбиталями всех атомов. А для этого, в свою очередь, следует провести четкую границу между атомом и окружающей его пустотой. Но как это сделать? Формально электронная плотность , хоть и стремится к нулю при удалении от ядра, никогда в ноль не обращается, поэтому каждая атомная орбиталь заполняет если не всю Вселенную, то, как минимум, весь объем рассматриваемого куска вещества. В этом случае получается, что пустоты в веществе нет — в любой точке есть отличная от нуля вероятность найти электрон.
В этом случае получается, что пустоты в веществе нет — в любой точке есть отличная от нуля вероятность найти электрон.
Можно определить границу атома как место, где электронная плотность достигает 1/2 от максимальной. Или 1/15 — такая граница будет отстоять дальше от ядра. Или как поверхность, внутри которой содержится 1/2 всей суммарной электронной плотности. Можно ухватить и больше объема, проведя поверхность, внутрь которой попадает, например, 9/10 всей плотности.
Плотность электронного облака для орбитали в атоме водорода (показана белым цветом) и разные варианты проведения условной границы атома.
Как видим, по-разному проводя условные границы атомов, можно получать разные величины занимаемого ими объема. Поэтому и для доли пустоты в веществе можно получить любой ответ от 0 до 100%. Например, в этом видео доля пустоты оценивается как 90%. Почему именно 90, а не 80 или 95? Видимо, автор взял какой-то «стандартный» размер атома в районе одного ангстрема.
Хотя для точного определения границ атома поверхности равной электронной плотности и не годятся, они удобны, когда нужно наглядно изобразить структуру вещества на микроуровне. По форме этих поверхностей можно судить о структуре молекулярных орбиталей и химических связей.
Пример поверхности (она зеленая и полупрозрачная), на которой электронная плотность в кристалле принимает постоянное значение. Источник.
А так выглядят поверхности постоянной плотности в некоторых белках. Источник.
Даже если вещество от пустоты нельзя четко отделить, можно ли хотя бы ответить на вопрос, чем вообще, с точки зрения квантовой теории, вещество отличается от пустого пространства? Для ответа обратимся к квантовой теории поля, изучающей системы многих частиц и вакуум. В этой теории любое состояние системы (точнее, квантованного поля), в которой может находиться 0, 1, 2 и т.д. частиц, характеризуется вектором, длина которого равна единице.
частиц, характеризуется вектором, длина которого равна единице.
Подробнее
Каждый вектор можно задать его проекциями на координатные оси, число которых равно размерности пространства : . Квантовые системы описываются векторами в бесконечномерном пространстве, то есть такими векторами, число проекций которого бесконечно: . Сами же проекции в квантовой механике являются комплексными числами, это обстоятельство важно при описании явлений интерференции.
Если в системе нет ни одной частицы (пустота), ее состояние называют вакуумом, и соответствующий вектор принято обозначать как . Атом с одним электроном на любой орбитали — это состояние системы с одной частицей, вектор которого можно обозначить как . Насколько отличаются эти два состояния друг от друга? Существуют разные способы описания «расстояния» между векторами, наиболее простой и часто используемый(****) — посчитать длину разности векторов . Можно показать, что векторы и взаимно перпендикулярны, это обычная ситуация для существенно отличающихся друг от друга квантовых состояний. Выходит, что, с точки зрения квантовой теории поля, «расстояние» между пустотой и электроном, находящимся на атомной орбитали, равно .
Можно показать, что векторы и взаимно перпендикулярны, это обычная ситуация для существенно отличающихся друг от друга квантовых состояний. Выходит, что, с точки зрения квантовой теории поля, «расстояние» между пустотой и электроном, находящимся на атомной орбитали, равно .
Два взаимно перпендикулярных вектора состояния — вакуум и один электрон на атомной орбитали, — и расстояние между ними.
Получаемый ответ — что вещество всегда радикально отличается от пустоты, даже если содержит одну частицу на кубический километр, — не очень удовлетворителен, потому что из него начисто выпадает распределение вещества в пространстве. Можно ли ввести меру отличия вещества от пустоты, показывающую, насколько сильно они отличаются не в целом, а локально, в каждой точке ? Да, такую меру найти можно, и ей является не что иное как электронная плотность . Там, где электронная плотность спадает до предельно малых значений, отличие вещества от пустоты также становится несущественным.
Пара формул
Это можно понять, если учесть, что квадрат расстояния представляется в виде:
где — волновая функция многоэлектронной системы, — число электронов. Как видим, квадрат расстояния складывается из двух частей: одна из них равна единице, другая набегает за счет интеграла от электронной плотности по пространству.
Линии равных электронных плотностей в кристалле Na2GeS3. Чем дальше от атомных ядер, тем ниже плотность, и тем ближе пустота. Источник.
Итак, мы видим, что:
- Если рассуждать в духе «в атоме непустым является лишь ядро», то придется признать, что вещество — ровно на 100% пустота, потому что ядро — это такой же пустой «атом», только состоящий из других частиц.
- В квантовой механике электронные оболочки атомов размазаны в пространстве, и невозможно точно сказать, где кончается атом и начинается окружающее его пустое пространство.
 Как следствие, нельзя и точно сказать, какова доля пустоты в веществе — с одинаковым успехом можно взять любое число от 0 до 100%.
Как следствие, нельзя и точно сказать, какова доля пустоты в веществе — с одинаковым успехом можно взять любое число от 0 до 100%. - С точки зрения квантовой теории поля, вещество даже с одним электроном существенно отличается от вакуума — эти два квантовых состояния представляются взаимно перпендикулярными векторами, расстояние между которыми равно .
- Однако можно, в каком-то смысле, ввести меру отличия вещества от вакуума не в целом, а локально, в каждой точке пространства. Этой мерой является электронная плотность . К сожалению, электронная плотность — размерная величина, она имеет размерность м–3, и поэтому не дает нам ответа на вопрос «на сколько процентов вещество вот в этой точке отличается от пустоты». С ее помощью можно лишь судить о том, где вещество сильнее отличается от пустоты, а где слабее. Вблизи центров атомов максимальна, там вещество отличается от пустоты сильнее всего, а на больших расстояниях от атомов она очень быстро убывает, и отличие вещества от пустоты становится несущественным.

(*)Вот примеры такого рода рассуждений, в которых, впрочем, соотношение размеров атома и ядра иногда преувеличивают в миллионы раз:
• www.popmech.ru/science/10566-zhizn-v-pustote-kvantovoe-osoznanie
• www.yaplakal.com/forum7/topic1503279.html
• pikabu.ru/story/tyi_nichto_561687
• thequestion.ru/questions/10102/atom-sostoit-iz-pustoty-vsyo-materialnoe-sostoit-iz-atomov-kak-materialnoe-mozhet-sostoyat-iz-pustoty
(**)По крайней мере, эксперименты на Большом электрон-позитронном коллайдере показали, что размер электрона не превышает 10–19 м. Более поздние сверхточные измерения магнитного момента электрона дали верхнюю оценку размера электрона, равную 10–20 м. Эти оценки показывают, что электрон, как минимум, в десятки тысяч раз меньше ядра.
(***)Интересный факт: три кварка, из которых состоит протон, дают лишь менее 2% его массы. Остальная часть массы — это виртуальные частицы (кварки и глюоны), возникающие в результате взаимодействия трех исходных кварков. Этих частиц так много, что они образуют целое «море», и поэтому называются «морскими» кварками и глюонами.
Этих частиц так много, что они образуют целое «море», и поэтому называются «морскими» кварками и глюонами.
(****)В случае двух чистых квантовых состояний и такие меры расстояния между ними, как метрика Гильберта-Шмидта и метрика Фубини-Штуди, сводятся именно к длине вектора .
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д. Филлипс
- Похожие темы:
- субатомная частица
радиоактивность
изотоп
атомизм
периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метра.
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов. Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.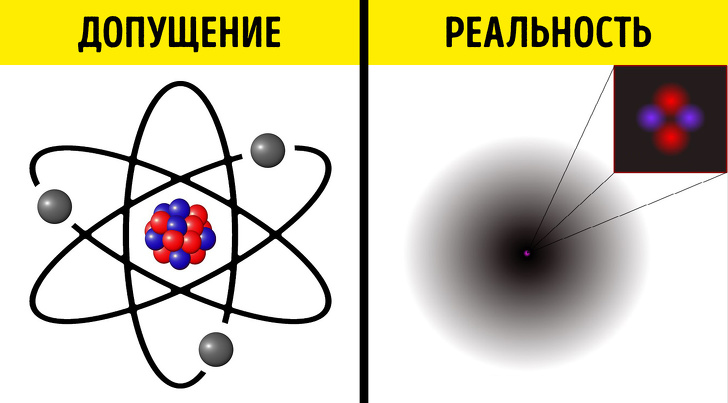 Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье
Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомные частицы.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Откуда ученые знают, как выглядит атом, чтобы создать его модель? Откуда они знают, что каждая молекула на научных диаграммах имеет определенные протоны, нейтроны и в каком порядке, если атом нельзя увидеть? Как ты можешь это доказать?
На ваши вопросы нет простого ответа.
 Здесь нет
Здесь нет
«атомный микроскоп», который позволил бы заглянуть внутрь атома и сказать:
«Ага! Здесь 7 синих протонов, 6 зеленых нейтронов и 7 красных электронов».
Способ, которым была разработана структура атома, состоял из длинной серии
эксперименты. Каждый из них был разработан для рассмотрения определенного аспекта
атом. Когда-то считалось, что атом представляет собой твердый шар положительного заряда.
заряд с внедренными в него электронами. Потом в 1909, Эрнест Резерфорд сделал
эксперимент, который показал, что эта картина была неправильной и что
Положительный заряд был сосредоточен в центре атома и занимал очень
небольшой объем по сравнению со всем атомом.
До открытия нейтрона в 1932 году считалось, что ядро
в нем и протоны, и электроны. Число протонов было выбрано таким, чтобы получить
правильный атомный вес и число электронов были выбраны, чтобы получить
правильный ядерный заряд. Оказалось, что эта модель не дала
предсказания, совпадающие с экспериментом. Открытие нейтронного свинца
к пересмотру модели, ведущей к текущей.
В современной модели количество электронов в атоме определяется
гамма- и рентгеновская спектроскопия. Количество протонов в атоме выбирают
чтобы уравновесить заряд электронов в атоме. Количество нейтронов
в атоме выбирается таким образом, чтобы дать правильный атомный вес элемента в
вопрос. Для подтверждения модели было проведено множество дополнительных экспериментов.
как окончательно разработано, и до сих пор полученные результаты таковы, как можно было бы
ожидать от модели. Это согласие между экспериментальными результатами и
предсказания, основанные на модели, — это то, что называется доказательством.
Представлено Эшли (Даллас, Техас, США)
(26 сентября 1997 г.)
Вас также может заинтересовать:
Атомы состоят из массивного центрального ядра, окруженного роем быстро движущихся электронов. Ядро состоит из протонов и, в большинстве случаев, нейтронов. Почти вся масса (более 99%)…more
Это зависит от того, о каком типе движения вы спрашиваете.

 Как следствие, нельзя и точно сказать, какова доля пустоты в веществе — с одинаковым успехом можно взять любое число от 0 до 100%.
Как следствие, нельзя и точно сказать, какова доля пустоты в веществе — с одинаковым успехом можно взять любое число от 0 до 100%.