Ученые впервые засняли на видео трансляцию РНК
4308
Добавить в закладки
Ученые из государственного университета Колорадо (США), под
руководством ассистента-профессора кафедры биохимии и
молекулярной биологии Тима Стасевича (Tim Stasevich) и
ассистента-исследователя Тацуи Морисаки (Tatsuya Morisaki)
впервые смогли заснять на видео трансляцию РНК, т. е. синтез
белка в рибосоме. Об этом прорывном достижении рассказывает
пресс-релиз университета Колорадо.
В основе успеха ученых из Колорадо лежат два компонента.
Во-первых, это уникальный микроскоп, разработанный Морисаки.
Ученые назвали его Fixie – от названия типа велосипеда, который
имеет только одну фиксированную передачу. «Фикси» не имеет
движущихся частей, зато имеет две высокочувствительные камеры,
которые позволяет вести съемку нанообъектов в реальном времени и
в разных цветах.
Во-вторых, это как раз новый метод окрашивания. Все
Все
существовавшие до сих пор методы были слишком «медленными», чтобы
зафиксировать самые ранние стадии синтеза белка. Стасевич с
коллегами обошли это затруднение следующим образом: они заставили
экспериментальную клетку вырабатывать простой флюоресцентный
фрагмент-антитело — своеобразный «ключ» к «замку», в качестве
которого выступали определенные рецепторные участки самого белка.
Как только синтез белка начинался, «ключ» подходил к «замку» и
белок окрашивался в ярко-зеленый цвет. При этом белок оставался
присоединенным к РНК, и ученые могли пронаблюдать — и заснять —
все стадии процесса.
Варьируя биохимические метки, авторы исследования смогли
заставить разные белки окрашиваться в разные цвета, чтобы можно
было наблюдать за их синтезом.
Попутно ученые сделали еще несколько интересных открытий. В
частности, выяснили, что удлинение молекулы белка происходит со
скоростью 10 аминокислот в секунду. Далее, они показали, что
полисомы — цепочки рибосом — имеют скорее округлую, чем
удлиненную форму. Наконец, им удалось выяснить, что полисомы
Наконец, им удалось выяснить, что полисомы
иногда взаимодействуют друг с другом, даже кодируя совершенно
разные белки.
Возможность заснять на видео процесс синтеза белков в РНК имеет
огромное научное значение, как теоретическое, так и прикладное. С
одной стороны, он позволяет лучше понять генную машинерию клетки.
С другой, таким образом можно изучать причины развития многих
опасных болезней, которые начинаются как раз с синтеза «не тех»
белков. В том числе это происходит под воздействием вирусов — и
теперь можно будет рассмотреть, как именно, отмечает Стасевич.
Напомним, что процессу трансляции РНК и синтеза белка в рибосомах
предшествует процесс транскрипции, когда информация с ДНК,
находящейся в ядре клетки, переписывается на РНК.
Отметим также, что это не первый случай за последнее время, когда
сложный микроскопический биологический процесс удалось наглядно
запечатлеть на видео. В прошлом году так удалось
заснять работу нервной системы дрозофилы.

микроскоп fixie
синтез белка
трансляция рнк
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Ученые МФТИ приблизились к разрешению главной проблемы крионики
12:30 / Физика
На VIII Всероссийскую премию «За верность науке» подано более тысячи заявок
11:22 / Наука и общество
Как думает компьютер? Развитие искусственного интеллекта от простого алгоритма к нейросетям
10:30 / Информационные технологии, История, Математика, Наука и общество
XXIV Всероссийская агропромышленная выставка «Золотая осень»
20:30 / Наука и общество, Науки о земле
Московский зоопарк на Фестивале НАУКА 0+
19:10 / «Мамин навигатор»
Фестиваль науки
19:05 / «Мамин навигатор»
День зубра
19:00 / «Мамин навигатор»
Физики обесцветили искусственный алмаз при помощи света
18:30 / Физика
Более 9 тысяч заявок подано на участие в третьем сезоне конкурса «Лига Лекторов» Российского общества «Знание»
18:00 / Наука и общество
В ДВФУ запустили интеллектуальную систему для мониторинга окружающей среды
17:30 / Экология
Памяти великого ученого. Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
Смотреть все
Как отличить ДНК преступника от ДНК человека, который просто проходил мимо
Книга «ДНК и ее человек» Елены Клещенко вошла в финал премии «Просветитель». Bookmate Journal публикует отрывок из этой новинки, вышедшей в издательстве «Альпина нон-фикшн», — главу про убийц и улики.
Читайте на Букмейте
Читать
Несуществующая убийца и улики против невиновных
Как отличить ДНК преступника от ДНК человека, который просто проходил мимо? Причем даже необязательно мимо места преступления. В 2004 г. в Австралии за убийцу приняли женщину, которая на самом деле была жертвой: ее одежда исследовалась в той же лаборатории, что и улики с места убийства. Было и еще несколько подобных случаев.
Вот самый жуткий — леденящая кровь история о Фантоме из Хайльбронна, или Женщине без лица. Ее ДНК нашли на месте примерно 40 преступлений, в том числе шести убийств, совершенных в 1993–2009 гг. в Австрии, Франции и Германии. Не было никаких сомнений, что эта ДНК принадлежит женщине, анализ мтДНК показал, что она родилась где-то в Восточной Европе, возможно, в России.
В апреле 2007 г. кто-то смертельно ранил 22-летнюю женщину-полицейского в австрийском городе Хайльбронне. Ее напарник тоже был ранен и впал в кому, убийцу впоследствии не мог вспомнить. У обоих полицейских украли оружие и наручники, но удалось получить образец ДНК преступника.
Ту же ДНК обнаружили на чашке в доме убитой пожилой женщины, на кухонном столе в доме убитого мужчины, на шприце с героином, найденном в лесу, в местах дерзких ограблений и угонов машин… Везде побывала незнакомка из Восточной Европы. Кошмарная какая-то баба, прямо киллер Наташа из Марвел-комиксов!
Подвиги Фантома из Хайльбронна развлекали читателей новостей два года. В 2009 г. случился казус: во Франции при установлении личности беженца, обгоревший труп которого был найден в 2002 г., ДНК-анализ показал, что он и был Женщиной без лица. То есть по всем остальным показателям мужчина, а по ДНК, которую взяли с отпечатков пальцев, приложенных к просьбе о предоставлении убежища, — женщина… Тут детективы насторожились, версию о смене пола отмели как слишком кинематографичную и задались вопросом: все ли в порядке в лаборатории?.. Коротко говоря, демоническая женщина-убийца оказалась работницей одной баварской фабрики — укладчицей ватных палочек, которые использовали криминалисты. Палочки назывались стерильными, таковыми и были, но стерильность — это, по определению, отсутствие живых бактерий, а не отсутствие ДНК. Я предупреждала: страшная история. Надо же было так скомпрометировать наш любимый метод. Но теперь-то криминалисты знают про эти грабли, и к материалам для работы, и к месту работы предъявляют особые требования.
В 2009 г. случился казус: во Франции при установлении личности беженца, обгоревший труп которого был найден в 2002 г., ДНК-анализ показал, что он и был Женщиной без лица. То есть по всем остальным показателям мужчина, а по ДНК, которую взяли с отпечатков пальцев, приложенных к просьбе о предоставлении убежища, — женщина… Тут детективы насторожились, версию о смене пола отмели как слишком кинематографичную и задались вопросом: все ли в порядке в лаборатории?.. Коротко говоря, демоническая женщина-убийца оказалась работницей одной баварской фабрики — укладчицей ватных палочек, которые использовали криминалисты. Палочки назывались стерильными, таковыми и были, но стерильность — это, по определению, отсутствие живых бактерий, а не отсутствие ДНК. Я предупреждала: страшная история. Надо же было так скомпрометировать наш любимый метод. Но теперь-то криминалисты знают про эти грабли, и к материалам для работы, и к месту работы предъявляют особые требования.
Однако мы не можем установить идеальный порядок на месте преступления, и очень трудно гарантировать, что посторонняя ДНК не попадет куда не надо. Любопытный эксперимент провели в 2015 г. аспиранты университета Индианаполиса Синтия Кейл и Мэдисон Эрл под руководством профессора Кристы Латэм.
Любопытный эксперимент провели в 2015 г. аспиранты университета Индианаполиса Синтия Кейл и Мэдисон Эрл под руководством профессора Кристы Латэм.
Пары добровольцев держались за руки в течение двух минут, после этого каждый брал в руку нож, а затем с рукояток ножей брали пробы ДНК. И что бы вы думали: в 85% случаев удалось получить ДНК-профили обоих, в 5% случаев тот, кто ножа не касался, был определен как основной или даже единственный источник ДНК!
Кто-то может сказать, что дизайн этой работы неестествен, что люди редко держатся за руки в течение двух минут, а потом берутся за ножи. Но реальность подносит и не такие сюрпризы.
В Калифорнии в 2013 г. некоего Лукиса Андерсона арестовали по обвинению в убийстве — его ДНК была обнаружена под ногтями жертвы. Правда, именно в момент убийства Андерсон попал в больницу, что похоже на алиби, но ведь ДНК… Потом оказалось, что те же самые врачи «скорой», которые отвозили в больницу Андерсона, потом выехали на убийство, и вместе с ними поехали следовые количества ДНК Андерсона. Человек провел в тюрьме несколько месяцев.
Человек провел в тюрьме несколько месяцев.
Активно обсуждалось в среде криминалистов дело Шона Хоя, подозреваемого по делу о теракте 15 августа 1998 г. в городе Ома (Северная Ирландия). Самый страшный теракт за всю историю конфликта между британскими властями и местными радикальными организациями. В этот день должно было состояться карнавальное шествие, но за час до него на главной улице города взорвался автомобиль, начиненный 220 кг взрывчатки. Погибли 29 человек — протестанты, католики, дети и взрослые, беременная близнецами женщина, два туриста из Испании. Ранения получили более 200 человек. Ответственность за теракт взяла на себя так называемся Подлинная Ирландская республиканская армия, отделившаяся от ИРА, когда та согласилась на мирные переговоры. Мужчина, который в тот же день позвонил в региональную телекомпанию Ulster TV и сообщил о бомбе, тоже представился активистом этой организации. Полицейские после звонка оттеснили людей на ближайшую улицу, но всех эвакуировать не успели.
Обвинения по этому делу предъявили нескольким гражданам, но нас интересует только электрик Шон Хой, племянник одного из людей, обвиненных ранее. Следовые количества его ДНК обнаружили на фрагментах бомбы. Он был обвинен в мае 2005 г. и в декабре 2007-го полностью оправдан. При этом критике подверглась работа экспертов. Использовался так называемый метод получения ДНК-профилей по низкокопийной ДНК (LCN — low copy number), который британские криминалисты применяют с 1999 г. Он основан на амплификации с помощью ПЦР генетического материала единичных клеток, и с его помощью раскрыли множество преступлений. В том же декабре 2007 г. использование этого метода даже приостановили — решили разобраться, не в технологии ли причина, но менее через месяц решили, что точно не в ней. Причиной ложного обвинения был назван «преднамеренный и расчетливый обман» со стороны полиции. Некоторые вещественные доказательства были помечены неправильно, некоторые свидетели полиции лгали по поводу того, как собирались улики, со всеми ли предосторожностями. Понятно стремление кого-нибудь наказать после гибели невинных людей, но правосудие прежде всего. То есть виновным в ошибке оказался не метод, а человеческий фактор. А в деле о взрыве в Ома и спустя 20 лет остается много неясного.
Понятно стремление кого-нибудь наказать после гибели невинных людей, но правосудие прежде всего. То есть виновным в ошибке оказался не метод, а человеческий фактор. А в деле о взрыве в Ома и спустя 20 лет остается много неясного.
Как ни надежно ДНК-профилирование, необходимо помнить, что генетический материал обвиняемого по случайности или злому умыслу может оказаться на месте преступления даже в том случае, если самого человека там не было. Не следует считать ДНК-анализ магическим артефактом, который освобождает детективов и присяжных заседателей от обязанности думать.
А вот совсем экзотическая ситуация: ни чьей-либо злой воли, ни случайности, а ДНК-анализ указывает на невиновного. В мире появляется все больше людей, которые перенесли трансплантацию костного мозга, например, после химиотерапии. Костный мозг — кроветворный орган, поэтому в крови такого человека будут клетки с ДНК-профилем донора. Более того, такие клетки могут появиться и в слизистой оболочке щеки, откуда часто берут образцы ДНК, и по некоторым данным, даже в волосяных фолликулах. Насчет спермы неясность: кажется, она все-таки сохраняет ДНК-профиль реципиента. Но вот анализ крови точно даст ошибку. Хорошо, что хотя бы переливание крови такого эффекта не дает: следы ДНК другого человека еще какое-то время видно (если знать, что искать, и использовать специфические маркеры), но основная ДНК все же принадлежит реципиенту, а не донору.
Насчет спермы неясность: кажется, она все-таки сохраняет ДНК-профиль реципиента. Но вот анализ крови точно даст ошибку. Хорошо, что хотя бы переливание крови такого эффекта не дает: следы ДНК другого человека еще какое-то время видно (если знать, что искать, и использовать специфические маркеры), но основная ДНК все же принадлежит реципиенту, а не донору.
Значит, к списку обязательных вопросов, которые должны быть заданы при написании экспертного заключения, прибавляется еще один: не был ли подозреваемый донором костного мозга, а если был, то кто реципиент?
Читайте эту и другие книги на полке премии «Просветитель» на Букмейте.
12 методов в картинках: микроскопия
Один из старейших научных приборов — микроскоп — появился практически одновременно с наукой в ее современном виде. Этот канонический инструмент биолога более 400 лет был важнейшим средством для познания живого, и дал львиную долю наших знаний об устройстве жизни. Все это время эволюция микроскопа продолжалась, расширяя возможности увидеть неразличимое глазом.
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
История микроскопии
На пороге микромира
Собирающие (увеличивающие) линзы были известны с XI века, и очки распространились по Европе уже в XIV веке. Традиционно изобретение первого составного микроскопа приписывают отцу и сыну — Хансу и Захарию Янсенам в 1595 году (рис. 1). Этот первый микроскоп мог увеличивать изображение всего в 3–9 раз. Есть версия, что первый микроскоп создал Корнелиус Дреббель. Среди изобретателей первых микроскопов был и Галилей, создавший свой микроскоп в 1609 году. Так или иначе, ни один из изобретателей не оставил подробных описаний микромира. Микроскопия как наука началась с Роберта Гука, который в 1665 году издал Micrographia — книгу, в которой подробно описывались устройство микроскопа, основы оптики и первые наблюдения за биологическими объектами, иллюстрированные подробными рисунками [1]. Микроскоп Гука (рис. 2) состоял из трех линз и источника света — эта основа сохраняется и в современной микроскопии. Однако достичь больших увеличений удалось с помощью более простой конструкции — Антони ван Левенгук использовал, казалось бы, примитивный микроскоп всего с одной линзой (рис. 2). Однако благодаря высочайшему качеству этой линзы ему удалось достичь 200-кратного увеличения и описать клетки простейших и даже крупные бактерии. Использование всего одной линзы не создавало оптических аберраций, которые только множились при конструировании более сложной оптической системы.
Микроскоп Гука (рис. 2) состоял из трех линз и источника света — эта основа сохраняется и в современной микроскопии. Однако достичь больших увеличений удалось с помощью более простой конструкции — Антони ван Левенгук использовал, казалось бы, примитивный микроскоп всего с одной линзой (рис. 2). Однако благодаря высочайшему качеству этой линзы ему удалось достичь 200-кратного увеличения и описать клетки простейших и даже крупные бактерии. Использование всего одной линзы не создавало оптических аберраций, которые только множились при конструировании более сложной оптической системы.
Генеральный партнер цикла «12 методов» — компания «Диаэм»
«Диаэм» — крупнейшая российская компания, специализирующаяся на поставке оборудования и реагентов ведущих мировых производителей в области микроскопии: от микроскопов начального уровня до исследовательских, конфокальных и мультифотонных систем, а также автоматизированных биоимиджинговых систем, способных поддерживать жизнеспособность клеток при постановке длительных экспериментов.
Материал предоставлен партнёром — компанией «Диаэм»
Рисунок 1. Микроскопия: этапы большого пути. 1590 г. — Захарий и Ханс Янсены создают первый микроскоп. 1665 г. — первое издание книги Роберта Гука Micrographia: описание и иллюстрации первых микроскопических исследований. 1674 г. — Антони ван Левенгук с помощью своего микроскопа описывает инфузории, а в дальнейшем — бактерии, сперматозоиды, вакуоли внутри клетки и т.п. 1858 г. — Йозеф фон Герлах разрабатывает окрашивание кармином — одной из первых гистологических красок. 1878 г. — Эрнст Аббе выводит формулу Аббе, позволяющую вычислить максимальное разрешение, исходя из длины волны. 1911 г. — Оскар Хеймштадт изобретает первый флуоресцентный микроскоп. 1929 г. — Филипп Эллингер и Август Хирт конструируют эпифлуоресцентный микроскоп, в котором эффективно отфильтровывалось излучение от источника света. 1932 г. — Фриц Цернике изобретает фазовый контраст, позволяя рассматривать живые неокрашенные объекты с большим контрастом. 1933 г. — Эрнст Руска совместно с Максом Кноллем создает первый электронный микроскоп. В 1939 году с его помощью выпустили первый коммерческий электронный микроскоп. 1934 г. — Джон Маррак получает первый конъюгат антитела с красителем. Первое практическое использование Альбертом Кунсом, усовершенствовавшим технику конъюгацией с флуоресцентной меткой. 1942 г. — Эрнст Руска создает сканирующий электронный микроскоп. 1962 г. — первое описание GFP Осамой Симомурой. 1967 г. — первое использование конфокальной микроскопии Моймиром Петраном, Дэвидом Эггером и Робертом Галамбосом. 1969 и 1971 гг. — первое описание конфокальной лазерной микроскопии. 1981 г. — Герд Бинниг и Генрих Рорер создают первый сканирующий туннельный микроскоп. 1986 г.
1932 г. — Фриц Цернике изобретает фазовый контраст, позволяя рассматривать живые неокрашенные объекты с большим контрастом. 1933 г. — Эрнст Руска совместно с Максом Кноллем создает первый электронный микроскоп. В 1939 году с его помощью выпустили первый коммерческий электронный микроскоп. 1934 г. — Джон Маррак получает первый конъюгат антитела с красителем. Первое практическое использование Альбертом Кунсом, усовершенствовавшим технику конъюгацией с флуоресцентной меткой. 1942 г. — Эрнст Руска создает сканирующий электронный микроскоп. 1962 г. — первое описание GFP Осамой Симомурой. 1967 г. — первое использование конфокальной микроскопии Моймиром Петраном, Дэвидом Эггером и Робертом Галамбосом. 1969 и 1971 гг. — первое описание конфокальной лазерной микроскопии. 1981 г. — Герд Бинниг и Генрих Рорер создают первый сканирующий туннельный микроскоп. 1986 г. — Герд Бинниг, Келвин Куэйт и Кристофер Гербер изобретают атомно-силовую микроскопию. 1990 г. — Винфрид Денки и Джеймс Стиклер разрабатывают первый двухфотонный микроскоп. 1994 г. — Штефан Хелл: суперразрешающая электронная микроскопия на основе подавления спонтанного испускания (STED). 2006 г. — изобретение PALM/STROM-микроскопии. Чтобы увидеть рисунок в полном размере, нажмите на него.
— Герд Бинниг, Келвин Куэйт и Кристофер Гербер изобретают атомно-силовую микроскопию. 1990 г. — Винфрид Денки и Джеймс Стиклер разрабатывают первый двухфотонный микроскоп. 1994 г. — Штефан Хелл: суперразрешающая электронная микроскопия на основе подавления спонтанного испускания (STED). 2006 г. — изобретение PALM/STROM-микроскопии. Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Рисунок 2а. Первые «ласточки». Микроскоп Гука (реконструкция).
сайт blog.sciencemuseum.org.uk
Рисунок 2б. Первые «ласточки». Микроскоп Левенгука.
сайт www.history-of-the-microscope.org
Улучшение оптики и преодоление аберраций
Оптические артефакты — аберрации — не позволяли рассматривать мелкие объекты, даже когда удавалось достичь больших увеличений. В XVIII веке некоторые мастера-оптики смогли устранить хроматические и сферические аберрации с помощью сложных оптических систем, состоящих из собирающей и рассеивающей линз из разного типа стекол с разными показателями преломления. Ахроматические линзы (то есть линзы, устраняющие хроматические аберрации) изобрел Честер Мур Халл в 1733 году. Первые ахроматические объективы для микроскопов создал Бенджамин Мартин (около 1775 г.) и значительно улучшил Йозеф Фраунгофер. Отец известного хирурга и отца антисептики Джозефа Листера — Джозеф Джексон Листер — обнаружил, что сочетание нескольких ахроматических линз позволяет исправить не только хроматические, но и сферические аберрации (1826 г.). Правда, несмотря на совершенство оптики, повышать увеличение до бесконечности нельзя: причиной тому дифракционный предел, о котором пойдет речь ниже.
Ахроматические линзы (то есть линзы, устраняющие хроматические аберрации) изобрел Честер Мур Халл в 1733 году. Первые ахроматические объективы для микроскопов создал Бенджамин Мартин (около 1775 г.) и значительно улучшил Йозеф Фраунгофер. Отец известного хирурга и отца антисептики Джозефа Листера — Джозеф Джексон Листер — обнаружил, что сочетание нескольких ахроматических линз позволяет исправить не только хроматические, но и сферические аберрации (1826 г.). Правда, несмотря на совершенство оптики, повышать увеличение до бесконечности нельзя: причиной тому дифракционный предел, о котором пойдет речь ниже.
Гистология
Рисунок 3. Гистология — дело тонкое: микротом нарезает препарат на слои, прозрачные для микроскопа.
рисунок Ольги Пташник
Развитие оптики в XVIII веке позволяло исследовать микромир на больших увеличениях, однако исследование тканей и клеток было сопряжено со множеством трудностей — они же в основном не окрашены, малоконтрастны и быстро умирают вне организма. Очередной прорыв в микроскопии пришел со стороны химии. В XIX веке открыли огромное количество красителей, и биологи пробовали окрашивать ими объекты своих исследований. Одновременно изобрели микротом (рис. 3) — прибор для нарезания тонких срезов тканей определенной толщины. Для стабилизации структуры ткани выдерживали в растворах фиксаторов (например, формалина), после чего препараты хранились долгое время. Для удобства нарезания заформалиненные куски органов заключали в парафин, блоки которого удобно резать.
Очередной прорыв в микроскопии пришел со стороны химии. В XIX веке открыли огромное количество красителей, и биологи пробовали окрашивать ими объекты своих исследований. Одновременно изобрели микротом (рис. 3) — прибор для нарезания тонких срезов тканей определенной толщины. Для стабилизации структуры ткани выдерживали в растворах фиксаторов (например, формалина), после чего препараты хранились долгое время. Для удобства нарезания заформалиненные куски органов заключали в парафин, блоки которого удобно резать.
Ряд классических гистологических красителей, изобретенных в 19-м веке и начале 20-го, используется до сих пор: фиолетовый гематоксилин окрашивает ядра, розовый эозин — цитоплазму клеток, краситель Перлса — двухвалентное железо, реактив Шиффа — полисахариды, краситель Судан III выявляет жиры техникой Дадди, а нитрат серебра — клетки Пуркинье на срезах мозга по методу Рамон-и-Кахаля. Изобретение различных техник позволило описать тонкие структуры каждого органа, выявить входящие в них ткани и даже рассмотреть структуру клеток — ядро (с митотическими хромосомами), ядрышки и митохондрии. Микроскопические исследования того времени, хотя и были в большей степени описательными, сформировали базовые теории клеточной биологии, нейробиологии и иммунологии [2].
Микроскопические исследования того времени, хотя и были в большей степени описательными, сформировали базовые теории клеточной биологии, нейробиологии и иммунологии [2].
Математический аппарат
Дальнейшие улучшения в оптике сопровождались разработкой математического аппарата для ее описания. Джордж Биддель Эйри описал диск Эйри — дифракционный рисунок, образующийся в идеальной оптической линзе с круговой апертурой. Дифракция света ограничивает минимально возможное разрешение между двумя источниками света, и, соответственно, разрешение в оптической системе (то есть минимальное расстояние, на котором оптика микроскопа может различить раздельно две близко расположенные точки). Эрнст Аббе предложил формулу дифракционного предела в 1873 году [3]. Формула определяет предельное разрешение как:
r = λ/2NA,
где λ — длина волны источника света (от 390 до 700 нм), а NA — числовая апертура объектива, определяемая как:
NA = n×sin(θ),
где n — индекс преломления среды между объективом и препаратом, а θ — апертурный угол между крайними лучами конического светового пучка, попадающего в объектив.
Из формулы видно, что разрешение тем выше (то есть значение r меньше), чем меньше длина волны (синий свет предпочтителен красному) и чем больше числовая апертура и индекс преломления среды. Поэтому для увеличения разрешения микроскопа используют масляные объективы, когда между препаратом и объективом добавляется иммерсионное масло с высоким показателем преломления. Более строгим является критерий Рэлея, в котором предел разрешения определяется как:
R=0,61×λ/NA
Разница с пределом Аббе вызвана отличием в том, как два оптика определяли разрешение между двумя точками (критерий Рэлея строже).
Устройство микроскопа
Рисунок 4. Под увеличительным стеклом: принципиальное устройство микроскопа. Оптический микроскоп создает огромные увеличения с помощью увеличивающих линз объектива и окуляра. Промежуточные линзы устраняют аберрации, а яркий источник света позволяет рассмотреть препарат даже при больших увеличениях.
рисунок Ольги Пташник
Принципиальное устройство светового микроскопа мало менялось со времен Аббе, и основные улучшения касались уменьшения аберраций за счет усложнения состава и количества линз. Оптический микроскоп состоит из источника света, объектива и окуляров. Препарат, освещенный светом лампы, должен находиться немного дальше фокуса объектива, что создает увеличенное изображение, которое усиливается и проецируется линзой окуляра и хрусталиком глаза на сетчатку (или на матрицу камеры). В микроскопах с «бесконечной» оптикой (не ограниченной определенной длиной тубуса) препарат находится в фокусе объектива, и для построения промежуточного изображения необходима дополнительная тубулярная линза. В современных микроскопах каждый из этих компонентов включает в себя большое количество сложных линз для коррекции хроматических и сферических аберраций, а также диафрагмы, позволяющие регулировать размер поля зрения и интенсивность света. Исследовательские микроскопы оснащены несколькими объективами с разным увеличением (от 2,5—4× до 100×), которые имеют одинаковую фокусную длину и могут свободно меняться с помощью револьверной насадки. Таким образом можно найти интересный участок препарата, используя небольшое увеличение, позволяющее рассмотреть широкое поле зрение, и затем разглядеть подробности, сменив объектив на более мощный.
Оптический микроскоп состоит из источника света, объектива и окуляров. Препарат, освещенный светом лампы, должен находиться немного дальше фокуса объектива, что создает увеличенное изображение, которое усиливается и проецируется линзой окуляра и хрусталиком глаза на сетчатку (или на матрицу камеры). В микроскопах с «бесконечной» оптикой (не ограниченной определенной длиной тубуса) препарат находится в фокусе объектива, и для построения промежуточного изображения необходима дополнительная тубулярная линза. В современных микроскопах каждый из этих компонентов включает в себя большое количество сложных линз для коррекции хроматических и сферических аберраций, а также диафрагмы, позволяющие регулировать размер поля зрения и интенсивность света. Исследовательские микроскопы оснащены несколькими объективами с разным увеличением (от 2,5—4× до 100×), которые имеют одинаковую фокусную длину и могут свободно меняться с помощью револьверной насадки. Таким образом можно найти интересный участок препарата, используя небольшое увеличение, позволяющее рассмотреть широкое поле зрение, и затем разглядеть подробности, сменив объектив на более мощный.
Рисунок 5а. Микроскопические изображения окрашенных срезов тканей. Эластичный хрящ уха (окраска: гематоксилин-эозин).
сайт www.flickr.com
Рисунок 5б. Микроскопические изображения окрашенных срезов тканей. Срез придатка яичка (окраска: гематоксилин-эозин).
микроскоп AmScope M500C-LED на Amazon
Рисунок 5в. Микроскопические изображения окрашенных срезов тканей. Толстая кишка крысы (пентахромная окраска по Мовату).
сайт ru.pinterest.com
Линза окуляра дополнительно увеличивают промежуточное изображение в 10–25 раз, создавая огромные увеличения. Световая микроскопия позволяет хорошо рассмотреть тонкие препараты (например, срезы ткани или клетки, растущие на стекле), окрашенные цветными красителями (например, антителами с цветной меткой или гистологическими красителями) (рис. 5). Окраска препарата требует его химической фиксации, что не подходит для наблюдения за живыми объектами, а поэтому в большинстве современных микроскопов вводят дополнительные элементы, позволяющие наблюдать микроскопические объекты без фиксации — с помощью методов фазового контраста и его модификаций.
Фазовый контраст, видеомикроскопия и клеточные культуры
В то время как световая микроскопия подошла к своему физическому пределу, возникло два новых типа микроскопии, значительно расширяющих возможности метода. Одной из таких модификаций стал фазовый контраст.
Статичность классической гистологии не позволяла наблюдать процессы, происходящие в клетках, в реальном времени. Уже в 19 веке начались первые попытки наблюдать за тканями вне организма. Используя растворы соли и кровь или сыворотку животных, исследователи могли некоторое время поддерживать ткани в живом состоянии вне организма. В 1907 году Росс Гаррисон наблюдал развитие нервных волокон в течение недели. Использование асептических условий, протеолитических ферментов и культуральных сред позволяло выращивать отдельные клетки в течение долгого времени, проводить с ними эксперименты и, конечно, наблюдать с помощью микроскопа. В том же 1907 году Джулиус Риес снял первый микроскопический фильм — развитие эмбриона морского ежа (рис. 6) [4]. В 1913 и 1914 годах Жан Командон и Жустин Жолли снимали деление клеток в клеточной культуре. Изобретение фазового контраста Фрицем Цернике в 1941 году позволило наблюдать неокрашенные биологические объекты — прежде всего живые клетки в культуре. Фазовый контраст и его вариация — дифференциальная интерференционно-контрастная микроскопия (оптика Номарского) — стали основой как для рутинного наблюдения за клеточной культурой, так и для изучения клеточной подвижности и динамики движения органелл.
6) [4]. В 1913 и 1914 годах Жан Командон и Жустин Жолли снимали деление клеток в клеточной культуре. Изобретение фазового контраста Фрицем Цернике в 1941 году позволило наблюдать неокрашенные биологические объекты — прежде всего живые клетки в культуре. Фазовый контраст и его вариация — дифференциальная интерференционно-контрастная микроскопия (оптика Номарского) — стали основой как для рутинного наблюдения за клеточной культурой, так и для изучения клеточной подвижности и динамики движения органелл.
Рисунок 6. Снято! Раскадровка первого микроскопического фильма: развитие эмбриона морского ежа.
Рисунок 7. Фазовый контраст — микроскопия контрастов. Использование интерференции позволяет увеличить контрастность и изучать неокрашенные препараты. Свет, не провзаимодействовавший с препаратом, попадает на фазовую пластинку, которая смещает его на +1/4 длины волны, в то время как биологические объекты рассеивают свет так, что он не попадает на фазовую пластинку, и смещают его фазу на −1/4 длины волны. Получающаяся разница в 1/2 длины волны в тех местах, где свет проходит через препарат, приводит к тому, что в этих местах волны прямого и дифрагированного света взаимно гасят друг друга, создавая темные, контрастные области на изображении.
Получающаяся разница в 1/2 длины волны в тех местах, где свет проходит через препарат, приводит к тому, что в этих местах волны прямого и дифрагированного света взаимно гасят друг друга, создавая темные, контрастные области на изображении.
рисунок Ольги Пташник
Фазовый контраст основан на интерференции волн света — две световых волны, фазы колебаний которых совпадают, усиливаются, в то время как при отличии фазы на 1/2 длины волны происходит полное гашение. Проходя через материал с большим индексом отражения, свет замедляется, что приводит к смещению его фазы. Это и используется в методе фазового контраста для увеличения контрастности изображения (рис. 7). В оптический путь световой микроскопии вводятся два дополнительных элемента — обычный объектив заменяется на объектив с фазовой пластинкой, а в конденсор осветителя добавляется кольцевая диафрагма, в которой свет может пройти только через тонкое кольцо.
Кольцевая диафрагма блокирует бóльшую часть света, оставляя только полый конус света, сконцентрированный конденсором на препарате. Свет, не рассеянный и отраженный препаратом, точно попадает на фазовую пластинку объектива — напыленное полупрозрачное кольцо, которое смещает фазу света на +1/4 длины волны. Свет же, прошедший через биологические объекты, рассеивается и отражается, отклоняясь от оптического пути и не попадая на фазовое кольцо объектива. К тому же биологические объекты сами меняют фазу света за счет разницы в индексе отражения и толщины препарата, чаще всего приблизительно на −1/4 длины волны. Таким образом, между рассеянным препаратом светом и светом, не провзаимодействовавшим с препаратом, создается разница фаз в 1/2 длины волны. Рассеянный свет от препарата и свет, попавший на фазовую пластинку, снова совмещаются, приводя к ослабляющей интерференции, и, соответственно, затемнению мест препарата, отличающихся по толщине и индексу отражения.
Свет, не рассеянный и отраженный препаратом, точно попадает на фазовую пластинку объектива — напыленное полупрозрачное кольцо, которое смещает фазу света на +1/4 длины волны. Свет же, прошедший через биологические объекты, рассеивается и отражается, отклоняясь от оптического пути и не попадая на фазовое кольцо объектива. К тому же биологические объекты сами меняют фазу света за счет разницы в индексе отражения и толщины препарата, чаще всего приблизительно на −1/4 длины волны. Таким образом, между рассеянным препаратом светом и светом, не провзаимодействовавшим с препаратом, создается разница фаз в 1/2 длины волны. Рассеянный свет от препарата и свет, попавший на фазовую пластинку, снова совмещаются, приводя к ослабляющей интерференции, и, соответственно, затемнению мест препарата, отличающихся по толщине и индексу отражения.
Флуоресцентный микроскоп и иммунофлуоресценция
В 1911 году Оскар Хеймштадт разработал первый флуоресцентный микроскоп, в котором мощный источник света возбуждал свечение во флуоресцентных веществах. В 1929 году его конструкцию значительно улучшили Филипп Эллингер и Август Хирт, которые создали микроскоп, где с помощью светофильтров эффективно отсекался возбуждающий свет, что позволяло рассмотреть даже слабую флуоресценцию [5]. В это время биохимики и генетики уже начинали исследовать отдельные белки и гены, но в микроскопии не было инструмента, который бы позволил точно пометить отдельный белок. Таким инструментом удивительным образом оказались антитела — белки, которые иммунная система использует для выявления и нейтрализации возбудителей [6]. Джон Маррак одним из первых связал антибактериальное антитело с красителем (R-солью) и окрасил им бактериальный препарат. Изобретение флуоресцентного микроскопа и связывание антител с яркими флуоресцентными красителями позволило получать ярко окрашенные препараты. Меченые антитела помогали окрасить не только возбудителей болезней — иммунизируя животных с помощью различных белков, стало возможным получать антитела для выявления местоположения и количества этих белков внутри клеток и тканей (рис.
В 1929 году его конструкцию значительно улучшили Филипп Эллингер и Август Хирт, которые создали микроскоп, где с помощью светофильтров эффективно отсекался возбуждающий свет, что позволяло рассмотреть даже слабую флуоресценцию [5]. В это время биохимики и генетики уже начинали исследовать отдельные белки и гены, но в микроскопии не было инструмента, который бы позволил точно пометить отдельный белок. Таким инструментом удивительным образом оказались антитела — белки, которые иммунная система использует для выявления и нейтрализации возбудителей [6]. Джон Маррак одним из первых связал антибактериальное антитело с красителем (R-солью) и окрасил им бактериальный препарат. Изобретение флуоресцентного микроскопа и связывание антител с яркими флуоресцентными красителями позволило получать ярко окрашенные препараты. Меченые антитела помогали окрасить не только возбудителей болезней — иммунизируя животных с помощью различных белков, стало возможным получать антитела для выявления местоположения и количества этих белков внутри клеток и тканей (рис. 8) [7].
8) [7].
Рисунок 8а. Возможности флуоресцентной микроскопии. Клетки остеосаркомы человека (окраска на митохондрии, ДНК и актин).
сайт www.nikonsmallworld.com
Рисунок 8б. Возможности флуоресцентной микроскопии. Клетки бычьего эндотелия BPAEC (окраска на митохондрии, ДНК и актин).
сайт www.thorlabs.com
Рисунок 8в. Возможности флуоресцентной микроскопии. Стадии митоза (синий — ДНК, зеленый — веретено деления, красный — центромеры).
сайт wellcomeimages.org
Для того чтобы наблюдать за белками вживую, требовалось найти способ прикрепить к ним светящуюся молекулу — флуорофор. Первым таким флоурофором оказался знаменитый зеленый флуоресцентный белок (GFP). Впервые GFP выделил из медузы Aequorea victoria Осаму Симомура в 1962 году [8]. Затем зеленый флуоресцентный белок с помощью генетической инженерии научились вставлять в клетки и включать в состав белков-химер, где его «сшивали» с изучаемым белком (рис.![]() 9). Помимо этого довольно быстро обнаружили белки всех цветов спектра [9], а их свойства усовершенствовали для лучшей флуоресценции и стабильности. За флуоресцентные и генетические технологии, связанные с GPF, в 2008 году вручена Нобелевская премия [10]. Сегодня есть флуоресцентные белки, которые светятся в присутствии определенных молекул (кальция [11], АТФ, глюкозы, глутамата и т.п.), начинают флуоресцировать при связывании двух белков друг с другом, активации определенных клеточных процессов (например, клеточной гибели) или изменении активности транскрипционных факторов.
9). Помимо этого довольно быстро обнаружили белки всех цветов спектра [9], а их свойства усовершенствовали для лучшей флуоресценции и стабильности. За флуоресцентные и генетические технологии, связанные с GPF, в 2008 году вручена Нобелевская премия [10]. Сегодня есть флуоресцентные белки, которые светятся в присутствии определенных молекул (кальция [11], АТФ, глюкозы, глутамата и т.п.), начинают флуоресцировать при связывании двух белков друг с другом, активации определенных клеточных процессов (например, клеточной гибели) или изменении активности транскрипционных факторов.
Рисунок 9. «Да будет свет»: флуоресцентные белки помогают наблюдать процессы в живых клетках. С помощью генетической инженерии ген GFP совмещается с геном белка, за которым мы хотим «установить слежку», и получившийся химерный ген кодирует белок, помеченный с помощью GFP. С помощью этого подхода можно пометить клетки, экспрессирующие нужные нам гены, или наблюдать за биохимическими реакциями и взаимодействиями белков. Чтобы увидеть рисунок в полном размере, нажмите на него.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Система визуализации ZOE от компании «Диаэм»
Система визуализации ZOE производства Bio-Rad — это настольный компактный флуоресцентный микроскоп для рутинного мониторинга клеточных культур с возможностью детекции флуоресцентных меток! Незаменим в любой лаборатории, где необходимо регулярно наблюдать культуры клеток, очень прост в управлении и не требует регулярной настройки оптики.
Материал предоставлен партнёром — компанией «Диаэм»
Рисунок 10. Флуоресцентный микроскоп: лабиринт отражений. Дихроичное зеркало и объектив фокусируют возбуждающий свет на препарате и направляют флуоресцентный свет к окуляру по другому оптическому пути.
рисунок Ольги Пташник
Флуоресцентная микроскопия позволяет получать красочные изображения, светящиеся собственным светом, и в то же время за счет использования светофильтров рассматривать свечение разных цветов отдельно. Так можно изучать распределение нескольких меток, например антител к разным белкам, каждое из которых окрашено своим флуоресцентным красителем. В основе метода лежит Стоксов сдвиг: при возбуждении электрона во флуоресцентном красителе (флуорофоре) источником света, испускаемый фотон обладает большей длиной волны за счет потери части колебательной энергии, что позволяет отфильтровать яркий свет, которым освещают образец для возбуждения, и наблюдать только свет от флуоресцентной метки (рис. 10).
Так можно изучать распределение нескольких меток, например антител к разным белкам, каждое из которых окрашено своим флуоресцентным красителем. В основе метода лежит Стоксов сдвиг: при возбуждении электрона во флуоресцентном красителе (флуорофоре) источником света, испускаемый фотон обладает большей длиной волны за счет потери части колебательной энергии, что позволяет отфильтровать яркий свет, которым освещают образец для возбуждения, и наблюдать только свет от флуоресцентной метки (рис. 10).
Источник света во флуоресцентном микроскопе — яркая лампа (ртутная или галогеновая). Свет от лампы проходит через светофильтр, который оставляет оптимальные для возбуждения флуоресцентной метки длины волн. Прошедший через светофильтр свет отражается дихроичным зеркалом и фокусируется объективом на образце, возбуждая флуоресценцию метки. Такая схема микроскопа, в которой возбуждающий свет фокусируется не конденсором, а самим объективом, называется эпифлуоресцентной, и позволяет значительно уменьшить фоновую засветку от лампы. Флуоресцентный свет от препарата через объектив вновь попадает на дихроичное зеркало, которое уже прозрачно для смещенной длины волны света от флуоресцентной метки, и на второй светофильтр, который дополнительно отсекает фоновый свет от лампы. Микроскоп содержит несколько комплектов светофильтров и зеркал, которые можно быстро сменить в зависимости от метки, что позволяет снимать даже микроскопические фильмы с несколькими флуоресцентными метками одновременно.
Флуоресцентный свет от препарата через объектив вновь попадает на дихроичное зеркало, которое уже прозрачно для смещенной длины волны света от флуоресцентной метки, и на второй светофильтр, который дополнительно отсекает фоновый свет от лампы. Микроскоп содержит несколько комплектов светофильтров и зеркал, которые можно быстро сменить в зависимости от метки, что позволяет снимать даже микроскопические фильмы с несколькими флуоресцентными метками одновременно.
Узнай больше
- Протокол иммуногистохимической обработки парафиновых срезов
- Техника многоцветного иммуннофлуоресцентного окрашивания гистологических и цитологических препаратов
- Реагенты для ИГХ (справочник)
Материал предоставлен партнёром — компанией «Диаэм»
Современные микроскопы позволяют изучать препарат всеми вышеописанными методами, быстро заменяя или совмещая компоненты оптического пути, например, фазового контраста и флуоресценции. Быстрое последовательное переключение между флуоресценцией и фазовым контрастом (например, за счет автоматического открытия диафрагмы) позволяет получить обоими методами фотографии одного и того же участка препарата, которые затем можно совместить для получения суммарного изображения. Такой микроскоп дает максимум информации на одном и том же препарате за небольшое время.
Такой микроскоп дает максимум информации на одном и том же препарате за небольшое время.
Реагенты для флуоресцентной микроскопии от компании Abcam:
- Широкий выбор первичных и вторичных антител.
- Флуоресцентные красители и наборы для конъюгации антител.
- Красители и наборы для ИЦХ- и ИГХ-окраски препаратов тканей и клеток.
- Срок поставки — 2 недели!
Материал предоставлен партнёром — компанией «Диаэм»
Конфокальная микроскопия
Качество флуоресцентной микроскопии было ограничено из-за возбуждения флуоресценции вне оптического фокуса. Конфокальная микроскопия позволила рассматривать флуоресценцию только в фокусе объектива, и реконструировать трехмерные изображения из послойно снятых фокусных планов. Для этого используют точечный источник света, сканирующий образец, и точечную диафрагму, отсекающую свет вне оптического фокуса [12]. Первую такую конструкцию запатентовал Марвин Мински в 1961 году. Однако первый работающий микроскоп сконструировал в Чехословакии Моймир Петран (рис. 11), который в 1967 году вместе с Дэвидом Эггером и Робертом Галамбосом впервые применил его для изучения биологических образцов. В 1980-х годах в качестве источника света начали применять лазер, и конфокальная микроскопия быстро стала альтернативой обычному флуоресцентному микроскопу.
11), который в 1967 году вместе с Дэвидом Эггером и Робертом Галамбосом впервые применил его для изучения биологических образцов. В 1980-х годах в качестве источника света начали применять лазер, и конфокальная микроскопия быстро стала альтернативой обычному флуоресцентному микроскопу.
Рисунок 11. Моймир Петран. Чехословацкий ученый с коллегами создал первый работающий конфокальный микроскоп.
сайт vyznamneosobnosti.cz
Рисунок 12. Конфокальная микроскопия: через замочную скважину. В конфокальной микроскопии свечение возбуждается лазером, ограниченным точечной диафрагмой. Вторая диафрагма, помещенная после дихроичного зеркала и светофильтра эмиссии в плоскости фокуса объектива (конфокальной плоскости), отсекает свет, находящийся не в фокусе объектива. Передвижение луча лазера по препарату достигается двумя зеркалами, контролируемыми точными гальванометрическими двигателями. Переход между оптическими плоскостями (ось Z) осуществляется с помощью движения объектива вверх или вниз. Чтобы увидеть рисунок в полном размере, нажмите на него.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Лазерная сканирующая конфокальная микроскопия является модификацией флуоресцентной микроскопии, улучшающей качество изображения и позволяющей строить трехмерные реконструкции препарата, а также в некоторых модификациях манипулировать биологическими объектами с помощью лазера. В конфокальной микроскопии, в отличие от флуоресцентной, свечение возбуждается не во всём препарате, а точечно. Перемещение лазера сканирует препарат, подобно тому, как распечатывает изображение принтер.
Соответственно, по сравнению с флуоресцентной микроскопией, в конфокальном варианте появляется несколько новых компонентов (рис. 12): прежде всего это две точечные диафрагмы, отсекающие свет, который находится вне фокуса объектива. Возбуждение света происходит с помощью лазера, сканирующего препарат, а регистрация — чувствительным фотоумножителем. Конфокальный микроскоп позволяет получать тонкие оптические срезы, и так как флуоресценция от препарата вне фокуса не попадает на детектор, то им можно снимать объемные объекты — например, стадии эмбрионального развития (рис. 13). Так как интенсивность лазера можно регулировать, а точечная диафрагма концентрирует свечение в одной точке, конфокальный микроскоп позволяет использовать лазер для точного воздействия на объект исследования. Например, лазером можно выжечь свечение флуоресцентного белка в части клетки и замерить скорость его восстановления в этой области, то есть скорость, с которой происходит диффузия белка. Этот метод называется FRAP (Fluorescence recovery after photobleaching). С помощью лазера можно повреждать клетку или только ее ядро, или активировать светочувствительные белки, запуская различные клеточные процессы.
13). Так как интенсивность лазера можно регулировать, а точечная диафрагма концентрирует свечение в одной точке, конфокальный микроскоп позволяет использовать лазер для точного воздействия на объект исследования. Например, лазером можно выжечь свечение флуоресцентного белка в части клетки и замерить скорость его восстановления в этой области, то есть скорость, с которой происходит диффузия белка. Этот метод называется FRAP (Fluorescence recovery after photobleaching). С помощью лазера можно повреждать клетку или только ее ядро, или активировать светочувствительные белки, запуская различные клеточные процессы.
Узнай больше
Видеолекции:
- «Принципы и практические советы по конфокальной микроскопии»
- «Использование флуоресцентной микроскопии в изучении каспазной активности»
Материал предоставлен партнёром — компанией «Диаэм»
Двухфотонная (мультифотонная) микроскопия является модификацией конфокальной микроскопии, позволяющей отказаться от точечных апертур [13]. Возбуждение в таком микроскопе происходит за счет возбуждения флуорофора одновременным попаданием двух фотонов неоптимальной длины волны от мощного лазера. Вероятность такого события падает с квадратом расстояния, поэтому эффективное возбуждение происходит только в месте фокусировки лазера.
Возбуждение в таком микроскопе происходит за счет возбуждения флуорофора одновременным попаданием двух фотонов неоптимальной длины волны от мощного лазера. Вероятность такого события падает с квадратом расстояния, поэтому эффективное возбуждение происходит только в месте фокусировки лазера.
Рисунок 13а. Конфокальная микроскопия: не только срезы, но и сравнительно крупные объекты. Периферийные нервы в зародыше мыши.
сайт www.nikonsmallworld.com
Рисунок 13б. Конфокальная микроскопия: не только срезы, но и сравнительно крупные объекты. Гиппокампальные нейроны на срезе мозга крысы.
сайт www.olympusbioscapes.com
Рисунок 13в. Конфокальная микроскопия: не только срезы, но и сравнительно крупные объекты. Окраска мышиной сетчатки на маркер астроцитов (красный — GFAP) и кровеносные сосуды (зеленый — коллаген IV).
сайт webvision.med.utah.edu
Система визуализации EVOS FL Auto 2 от компании «Диаэм»
Устали проводить много времени, получая и анализируя изображения клеток? Выберите другой путь. Система визуализации EVOS FL Auto 2 (производство Thermo Fisher Scientific) — передовое решение для работы с живыми клетками, получения изображений при разных фокусных расстояниях (Z-stacking) и сшивки изображений, обладающее функцией поддержания жизнеспособности клеточных культур для изучения процессов в динамике.
Система визуализации EVOS FL Auto 2 (производство Thermo Fisher Scientific) — передовое решение для работы с живыми клетками, получения изображений при разных фокусных расстояниях (Z-stacking) и сшивки изображений, обладающее функцией поддержания жизнеспособности клеточных культур для изучения процессов в динамике.
Материал предоставлен партнёром — компанией «Диаэм»
Электронная микроскопия
Дифракционный предел больше ста лет ограничивал оптическую микроскопию, пока не появились идеи, как его преодолеть. В 1930-х годах создали новую технику, позволяющую рассмотреть внутриклеточные структуры максимально близко: электронную микроскопию. Ее идея состоит в использовании электронов в качестве средства «освещения». Длина волны у электрона на 5 порядков (в 100 000 раз) меньше, чем у фотона, что дает разрешение до 50 пикометров! Электронная микроскопия позволяет рассматривать вирусы и структуру белковых комплексов.
В принципе, устройство электронного микроскопа очень похоже на микроскоп оптический. В качестве источника электронов (осветителя в обычном микроскопе) используется электронная пушка, в которой поток электронов от источника (например, вольфрамовой нити) фокусируется с помощью цилиндрического электрода (цилиндра Венельта). В качестве линз используют электромагнитные катушки, работающие как магнитные линзы. Для того чтобы электроны не задерживались молекулами воздуха, внутри микроскопа создают вакуум.
В качестве источника электронов (осветителя в обычном микроскопе) используется электронная пушка, в которой поток электронов от источника (например, вольфрамовой нити) фокусируется с помощью цилиндрического электрода (цилиндра Венельта). В качестве линз используют электромагнитные катушки, работающие как магнитные линзы. Для того чтобы электроны не задерживались молекулами воздуха, внутри микроскопа создают вакуум.
Рисунок 14. Принцип работы трансмиссионного электронного микроскопа. Электроны от пушки фокусируются магнитными линзами и, проходя через сверхтонкий образец, попадают на флуоресцентный экран.
рисунок Ольги Пташник
Рисунок 15. Сканирующий электронный микроскоп позволяет изучать поверхность препарата за счет многих видов отраженного излучения.
рисунок Ольги Пташник
В трансмиссионной электронной микроскопии (рис. 14) изучают очень тонкие срезы клеток: препараты вирусов и тому подобные неплотные образцы. Часть электронов рассеивается или поглощается образцом, в то время как прошедшие через образец электроны попадают на флуоресцентный экран, создавая «тень» от образца — где более плотные части образца будут более темными на изображении. Трансмиссионная электронная микроскопия требует предварительной фиксации и обезвоживания препарата, а также его очень тонкой нарезки, и часто для увеличения контрастности препарат необходимо окрасить соединениями тяжелых металлов. Все эти процедуры не дают возможности наблюдать живую клетку и часто искажают изображение препарата. К тому же подготовка препаратов крайне трудоемка по сравнению с оптической микроскопией.
Трансмиссионная электронная микроскопия требует предварительной фиксации и обезвоживания препарата, а также его очень тонкой нарезки, и часто для увеличения контрастности препарат необходимо окрасить соединениями тяжелых металлов. Все эти процедуры не дают возможности наблюдать живую клетку и часто искажают изображение препарата. К тому же подготовка препаратов крайне трудоемка по сравнению с оптической микроскопией.
Электронная микроскопия позволяет метить молекулы с помощью антител, используя металлические метки (например, коллоидное золото) вместо флуорофоров, однако количество меток, которое можно использовать, ограничено по сравнению с флуоресцентной микроскопией. Несмотря на то, что именно трансмиссионная электронная микроскопия позволила нам рассмотреть структуру органелл внутри клетки, ее ограничения и дороговизна не позволяют этому методу войти в широкий лабораторный обиход.
Используя пучок электронов, образец можно «сканировать» поточечно (рис. 15), как в конфокальной микроскопии. Такой метод называется сканирующей электронной микроскопией, и в ней обычно регистрируются вторичные электроны, испускаемые образцом при попадании электронного пучка, и электроны, отраженные образцом. Метод сканирующей электронной микроскопии обычно используют для изучения поверхности образца, хотя вариант сканирующей трансмиссионной электронной микроскопии позволяет изучать тонкие срезы.
Такой метод называется сканирующей электронной микроскопией, и в ней обычно регистрируются вторичные электроны, испускаемые образцом при попадании электронного пучка, и электроны, отраженные образцом. Метод сканирующей электронной микроскопии обычно используют для изучения поверхности образца, хотя вариант сканирующей трансмиссионной электронной микроскопии позволяет изучать тонкие срезы.
Именно сканирующая электронная микроскопия дает потрясающие объемные изображения клеток, бактерий, кристаллов, белковых матриксов и многих других объектов (рис. 16).
Рисунок 16а. Трансмисионная электронная микроскопия. Структура цитоскелета около ведущего края фибробласта.
сайт http://www.tousimis.com
Рисунок 16б. Сканирующая электронная микроскопия. Макрофаги и эндотелиоциты.
сайт http://www.tousimis.com
Рисунок 16в. Сканирующая электронная микроскопия. Фрагмент глаза дрозофилы.
сайт http://www.tousimis. com
com
Рисунок 16г. Сканирующая электронная микроскопия. Апоптотическая клетка.
сайт www.anatomybox.com
Методы суперразрешения
Электронная микроскопия продвинула исследования далеко за предел разрешения оптической микроскопии, однако она не позволяет смотреть на живые объекты и использовать разноцветные метки или красители. Возможно ли преодолеть дифракционный предел в оптической микроскопии? Методы, преодолевающие предел Аббе, называются методами суперразрешения. Мы подробно остановимся на двух таких методах, за которые присудили Нобелевскую премию по химии 2014 года [14].
В 1990-х исследователи начали разрабатывать методы для преодоления дифракционного предела Аббэ. Центральную роль в разработке этих методов играл Штефан Хелль, который разработал STED-микроскопию [14–16]. В методике STED возбуждение флуорофора происходит с помощью двух лазеров — один возбуждает флуоресценцию в точке фокуса, в то время как другой тушит ее вокруг этой точки за счет смещения флуоресценции в более красную область. За достижением Хелля последовало изобретение других суперразрешающих методов — PALM/STORM, GSDIM и других.
За достижением Хелля последовало изобретение других суперразрешающих методов — PALM/STORM, GSDIM и других.
Штефан Хелль одним из первых понял, что возможно преодолеть дифракционный предел, используя свойства самих флуорофоров. Идея Хелля состояла в том, что не обязательно ограничивать дифракцию света, который стимулирует флуоресценцию, если можно «запретить» флуоресцировать молекулам вне самого центра фокуса. Для этого он придумал использовать принцип стимулирования испускания: в нем флуорофор в возбужденном состоянии переводится в невозбужденное состояние вторым лазером. За счет использования «более красной» длины волны испускаемый при стимулированном переходе фотон имеет большую длину волны (такую же, как и лазер) и не регистрируется детектором.
Как же можно увидеть изображение, если мы подавили флуоресценцию во всем образце? Дело в форме луча света второго лазера — проходя через специальную фазовую пластинку, он приобретает форму кольца, и интенсивности подавляющего лазера в узкой центральной точке не хватает для подавления флуоресценции. Таким образом, флуоресценция возбуждается только в узкой фокусной точке, которая по размерам гораздо меньше предела дифракции. STED-микроскопия (рис. 17 и 18) позволяет получать изображения с разрешением меньше 20 нм в поперечном направлении, и около 40–50 нм в продольном направлении.
Таким образом, флуоресценция возбуждается только в узкой фокусной точке, которая по размерам гораздо меньше предела дифракции. STED-микроскопия (рис. 17 и 18) позволяет получать изображения с разрешением меньше 20 нм в поперечном направлении, и около 40–50 нм в продольном направлении.
Рисунок 17. Принцип микроскопии суперразрешения. Для STED-микроскопии необходимы два лазера: флуоресценция возбуждается первым зеленым лучом, а второй, красный, лазер подавляет флуоресценцию за счет стимуляции испускания. Из-за фазовой пластинки в середине пути второй лазер имеет форму кольца, поэтому в центре его мощности не хватает для подавления флуоресценции. Таким образом флуоресценция возбуждается только в центре — в узкой фокусной точке, куда попадает свет только от первого лазера и которая по размерам гораздо меньше предела дифракции. Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Ольги Пташник
Рисунок 18а. Преимущества микроскопии суперразрешения. а — Ядерная пора («обычная» конфокальная микроскопия vs. STED). б — Цитоскелет («обычная» конфокальная микроскопия vs. STED).
а — Ядерная пора («обычная» конфокальная микроскопия vs. STED). б — Цитоскелет («обычная» конфокальная микроскопия vs. STED).
сайты www.photonics.com и www.picoquant.com
Рисунок 18б. Преимущества микроскопии суперразрешения. STORM-микроскопия.
сайт www.nikoninstruments.com
Другим подходом стало ограничение флуоресценции флуорофоров по времени. В PALM/STORM/FPALM-микроскопии используют специальные флуорофоры (флуоресцентные белки или синтетические флуорофоры), которые могут переключаться между возбужденным и невозбужденным состоянием (см. видео) [17], [18]. Низкочастотный возбуждающий лазер возбуждает лишь часть молекул, так чтобы статистически возбужденные молекулы были разделены расстоянием больше дифракционного предела. Высокочувствительная камера регистрирует флуоресценцию от этих молекул, позволяя точно определить их положение по испускаемым фотонам. Второй лазер подавляет флуоресценцию и возвращает молекулы обратно в невозбужденное состояние. После многократного повторения этого цикла (в каждом цикле случайно возбуждаются разные молекулы флуорофора), компьютер составляет цельную картину из изображений, снятых в отдельных циклах.
После многократного повторения этого цикла (в каждом цикле случайно возбуждаются разные молекулы флуорофора), компьютер составляет цельную картину из изображений, снятых в отдельных циклах.
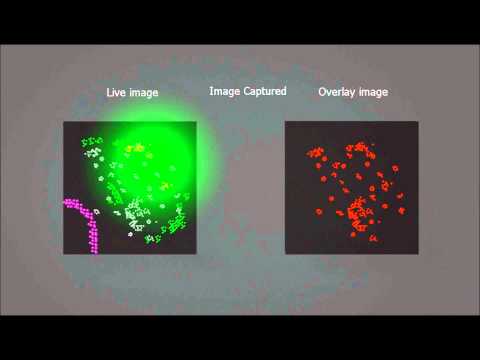
Видео. PALM-микроскопия
STED и PALM/STORM являются наиболее распространенными видами суперразрешающей микроскопии, однако существует множество методов на их основе или использующих сходные принципы: SIM, GSD, SSIM, dSTROM и другие — оптическая микроскопия продолжает развиваться, расширяя границы нашего познания о микромире.
Применение в биомедицине
Даже обычные световые микроскопы до сих пор активно используют для постановки диагнозов в медицине. Опухоли, воспалительные процессы, отложения железа или кальция, замещения нормальной ткани соединительной и многое, многое другое рутинно проверяется на препаратах, полученных с помощью биопсии, постоперационно или во время вскрытия. Широкое применение антител проникло и в рутинную диагностику — срезы окрашивают антителами к клеточным маркерам или возбудителям болезней, которые позволяют уточнить или подтвердить диагноз и лучше подобрать лечение. Особенно широкое применение световая микроскопия и иммуногистохимия нашла в онкологии, где присутствие специфических белков определяет применяемую химиотерапию (например, применение герцептина для опухолей с белком HER2 при раке молочной железы). Микроскопия необходима не только для постановки диагнозов, но и в процессе лечения: хирурги применяют микроскопы при операциях, требующих тонкого вмешательства, — в офтальмологии, нейрохирургии, сосудистой хирургии и многих других (рис. 19).
Широкое применение антител проникло и в рутинную диагностику — срезы окрашивают антителами к клеточным маркерам или возбудителям болезней, которые позволяют уточнить или подтвердить диагноз и лучше подобрать лечение. Особенно широкое применение световая микроскопия и иммуногистохимия нашла в онкологии, где присутствие специфических белков определяет применяемую химиотерапию (например, применение герцептина для опухолей с белком HER2 при раке молочной железы). Микроскопия необходима не только для постановки диагнозов, но и в процессе лечения: хирурги применяют микроскопы при операциях, требующих тонкого вмешательства, — в офтальмологии, нейрохирургии, сосудистой хирургии и многих других (рис. 19).
Рисунок 19а. Многообразие микроскопов в медицине. Хирургический микроскоп.
сайт redstarvietnam.com
Рисунок 19б. Многообразие микроскопов в медицине. Микроскопическая платформа для высококонтентного скрининга.
сайт www.perkinelmer.com
Рисунок 19в. Многообразие микроскопов в медицине. Бумажный микроскоп.
Многообразие микроскопов в медицине. Бумажный микроскоп.
сайт www.mccrone.com
Флуоресцентные микроскопы за счет развития флуоресцентных проб и белков позволяют «рассматривать» биохимические процессы в реальном времени. Флуоресцентные белки помогают увидеть увеличение внутриклеточной концентрации кальция и магния, концентрации важных метаболитов (NADH+, лактата, глутамата и многих других), изменения pH, потенциалов действия, развитие важнейших клеточных процессов —прохождение клетки по клеточному циклу, программируемую клеточную гибель, активацию сигнальных каскадов и много другого.
Огромные возможности микроскопии, естественно, нашли применение в разработке новых лекарств, в том числе и для скрининга огромных библиотек химических веществ, антисмысловых РНК, антител и т.п. Микроскопия позволяет идентифицировать комплексные фенотипы, не ограничиваясь, как в биохимических скринингах, лишь одной мишенью. Микроскопы для высококонтентного анализа (high-content screening/analysis) потеряли свои канонические окуляры и открытые объективы — эти приборы выглядят как закрытые ящики, подключенные к компьютеру, однако могут снимать тысячи экспериментальных точек в день (особенно если они интегрированы с роботами для автоматической подачи образцов). Результаты таких анализов также не обрабатываются вручную, а анализируются компьютером по заранее заданным исследователем правилам. Компьютерный анализ применяется все шире, и, безусловно, скоро распространится и на рутинные научные исследования, и на постановку диагнозов. Последнее преимущество позволяет уменьшить субъективность диагноста: если раньше диагноз выставляли лишь с помощью взгляда патолога, то сейчас возможно применять программы для анализа, которые не будут зависеть от неопытности или ошибок врача. Оцифровка микроскопических изображений позволит анализировать их массивы с помощью машинного обучения, и в особо сложных случаях получать консультации врачей из любой точки мира.
Результаты таких анализов также не обрабатываются вручную, а анализируются компьютером по заранее заданным исследователем правилам. Компьютерный анализ применяется все шире, и, безусловно, скоро распространится и на рутинные научные исследования, и на постановку диагнозов. Последнее преимущество позволяет уменьшить субъективность диагноста: если раньше диагноз выставляли лишь с помощью взгляда патолога, то сейчас возможно применять программы для анализа, которые не будут зависеть от неопытности или ошибок врача. Оцифровка микроскопических изображений позволит анализировать их массивы с помощью машинного обучения, и в особо сложных случаях получать консультации врачей из любой точки мира.
Развитие биологии все время демонстрировало сложность и неоднородность устройства биологических объектов — от клетки к органу в целом. Микроскоп позволяет сохранить часть этой сложности, рассматривая клетки и ткани как комплексные системы, а не просто множество реакций в пробирке. И потому этому старейшему биологическому инструменту можно спокойно предсказать еще долгие годы жизни.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет сентябрь.
- H. Gest. (2004). The discovery of microorganisms by Robert Hooke and Antoni van Leeuwenhoek, Fellows of The Royal Society. Notes and Records of the Royal Society. 58, 187-201;
- Giuseppe Musumeci. (2014). Past, present and future: overview on histology and histopathology. J Histol Histopathol. 1, 5;
- Abbe E. (1883). XV. The relation of aperture and power in the microscope. J. R. Microsc. Soc. 3, 790–812;
- Hannah Landecker. (2009). Seeing things: from microcinematography to live cell imaging. Nat Meth. 6, 707-709;
- Rusk N. (2009). The fluorescence microscope. Nat. Methods;
- Иммунитет: борьба с чужими и… своими;
- Моноклональные антитела;
- Osamu Shimomura, Frank H.
 Johnson, Yo Saiga. (1962). Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan,Aequorea. J. Cell. Comp. Physiol.. 59, 223-239;
Johnson, Yo Saiga. (1962). Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan,Aequorea. J. Cell. Comp. Physiol.. 59, 223-239; - Флуоресцентные белки: разнообразнее, чем вы думали!;
- Флуоресцирующая Нобелевская премия по химии;
- Miyawaki A., Llopis J., Heim R., McCaffery J.M., Adams J.A., Ikura M. et al. (1997). Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388, 882–887;
- Sheppard C.J.R. and Wilson T. (1981). The theory of the direct-view confocal microscope. J. Microsc. 124, 107–117;
- W Denk, J. Strickler, W. Webb. (1990). Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Stefan W.
 Hell, Jan Wichmann. (1994). Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.. 19, 780;
Hell, Jan Wichmann. (1994). Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.. 19, 780; - Флуоресцентные репортеры и их молекулярные репортажи;
- E. Betzig, G. H. Patterson, R. Sougrat, O. W. Lindwasser, S. Olenych, et. al.. (2006). Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313, 1642-1645.
Вы не сможете увидеть ДНК, если не посмотрите как следует | Стивен Карри | Наука
Мы знаем, как выглядит ДНК, и изучаем ее уже почти 60 лет. Так почему же о новом анализе структуры ДНК так мало сообщалось?
Я не злой человек, но новый анализ структуры ДНК с помощью электронной микроскопии вчера меня рассердил. Это не было виной ученых, участвовавших в исследовании, но небрежность, с которой сообщалось о результатах, заставило меня понервничать.
Структура ДНК была впервые определена почти 60 лет назад благодаря знаменитому анализу Уотсоном и Криком картин рассеяния, записанных Морисом Уилкинсом и Розалинд Франклин, когда они направляли рентгеновские лучи на узкие волокна вещества. У нас было много времени, чтобы уточнить и переварить этот результат, поэтому я был удивлен, наткнувшись на столько неточной информации в интернет-дайджестах о новом открытии, о котором сообщила в журнале Nano Letters итальянская группа под руководством Энцо ди Фабрицио.
Веб-сайт io9.com озаглавил статью Джорджа Дворски «Ученые впервые сделали снимок двойной спирали ДНК». Нет, не было. В сопроводительной статье факт перемежался с вымыслом, прежде чем, наконец, был сделан вывод о том, что новый метод визуализации позволит нам увидеть, «как он взаимодействует с белками и РНК». Нет, не будет.
Через минуту я объясню почему, но сначала давайте взглянем на статью New Scientist в той же статье. Это был более взвешенный и более точный отчет о новом результате, но статья началась неудачно. В статье Роланда Писа утверждалось, что «электронный микроскоп запечатлел знаменитую двойную спираль Уотсона-Крика во всей ее красе». Но это явно не так. Прилагаемое изображение было нечетким и не показывало двойную спираль, похожую на описанную Уотсоном и Криком.
В статье Роланда Писа утверждалось, что «электронный микроскоп запечатлел знаменитую двойную спираль Уотсона-Крика во всей ее красе». Но это явно не так. Прилагаемое изображение было нечетким и не показывало двойную спираль, похожую на описанную Уотсоном и Криком.
Модель и электронная микрофотография волокна ДНК (опубликовано в Nano Letters)
Пиз последовал за этим с тем же необоснованным утверждением, что новый метод позволит исследователям увидеть, как другие биомолекулы взаимодействуют с ДНК. Я не уверен, откуда взялось это утверждение, потому что его нет в газете. Возможно, неудачный пресс-релиз?
Наконец-то Алекс Уайлд написал об этой статье в журнале Scientific American. В его посте, рискованно озаглавленном «Как на самом деле выглядит ДНК», утверждалось, что в статье сообщается о «первом в истории микроскопическом изображении изолированной молекулы ДНК». Если бы он взял на себя нанопроблему и набрал «электронную микрофотографию ДНК» в поиске Google, он бы увидел, что существует множество более ранних микроскопических изображений ДНК. Если бы он более внимательно посмотрел на реферат статьи — в данном случае услужливо проиллюстрированный (см. выше), — он бы увидел, что образец на самом деле представляет собой пучок молекул ДНК, а не изолированный. Шиш.
Если бы он более внимательно посмотрел на реферат статьи — в данном случае услужливо проиллюстрированный (см. выше), — он бы увидел, что образец на самом деле представляет собой пучок молекул ДНК, а не изолированный. Шиш.
Зачем поднимать из-за этого шум? Хорошо, отчасти потому, что я использую рентгеновскую кристаллографию, а не электронную микроскопию, чтобы изучить структуры интересных биологических молекул в своих исследованиях, и преувеличенные заявления, сделанные научными писателями в пользу электронной микроскопии, раздражали меня до мурашек. Вы знаете, мы, ученые, территориально разделены.
Я не должен так волноваться, потому что проблема во многом связана с соблазнительной силой образа, над чем я раньше ломал голову. Все три автора сосредоточились на том факте, что новая газета сообщила о картине, которую вы можете видеть; напротив, хотя рентгеновский метод дает гораздо более высокий уровень детализации, его результаты получаются косвенно посредством математического анализа того, как молекулы рассеивают рентгеновский луч. Дворский, Пиз и Уайлд, возможно, не полностью осознали, что косвенность рентгеновской кристаллографии никоим образом не снижает качество получаемой информации — по общему признанию, не то, что я ожидал бы знать от неспециалиста, — но привлекательность изображения, тем не менее, кажется чтобы притупить их зрение. Что меня разочаровало, так это то, что, несмотря на то, что им подали изображение, они не рассмотрели его должным образом, и это позволило закрасться ошибкам.
Дворский, Пиз и Уайлд, возможно, не полностью осознали, что косвенность рентгеновской кристаллографии никоим образом не снижает качество получаемой информации — по общему признанию, не то, что я ожидал бы знать от неспециалиста, — но привлекательность изображения, тем не менее, кажется чтобы притупить их зрение. Что меня разочаровало, так это то, что, несмотря на то, что им подали изображение, они не рассмотрели его должным образом, и это позволило закрасться ошибкам.
На самом деле новым в статье является то, что авторы смогли получить высококонтрастное изображение волокна ДНК (состоящего из пучка двойных спиралей ДНК) с помощью электронной микроскопии. Они сделали это, высушив каплю ДНК, растворенную в воде, над слоем кремния, который был микрофабрикирован так, чтобы на его поверхности располагался массив крошечных столбиков. Когда вода испарилась, нити ДНК остались растянутыми между столбами. Потому что они приостановлены выше на кремниевой основе удалось получить хорошее изображение нитей ДНК (контраст хуже, если ДНК лежит на твердой поверхности). Приятно, что авторы отмечают, что их подготовка образцов аналогична методу, использованному Уилкинсом, но они получили волокна примерно в тысячу раз тоньше, чем он смог получить.
Приятно, что авторы отмечают, что их подготовка образцов аналогична методу, использованному Уилкинсом, но они получили волокна примерно в тысячу раз тоньше, чем он смог получить.
И что они видят? В изображении определенно есть тонкая структура. Существуют повторяющиеся особенности размера, ожидаемые для спиральной структуры ДНК. Но итальянским исследователям было ясно и должно быть ясно любому, кто смотрит на картинку в их онлайн-реферате, что изображение представляет собой не одну молекулу ДНК, а их связку. Ди Фабрицио и его коллеги смоделировали структуру как группу из семи параллельных двойных спиралей ДНК, поскольку в результате получается структура такой же толщины, как и изображенное волокно.
Однако верна ли их модель? Если вы посмотрите на вставку на рисунке, вы увидите, что углубления на нижней стороне намного глубже, чем на модели ДНК (средняя панель). Возможно, это артефакт того, как электронные микроскопы создают изображения. Я не знаю, потому что я не эксперт, и авторы не комментируют несоответствие.
Связанный характер образцов ДНК, подготовленных для этих экспериментов, также помогает объяснить, почему метод микроскопии будет непригоден для анализа взаимодействий белковых молекул с ДНК, вопреки утверждениям Дворского и Писа. Пучки ДНК не встречаются в природе; в живых клетках, когда ДНК манипулируют белками — для копирования или использования для создания инструкций для клеточных процессов — двойная спираль должна быть разделена на отдельные нити, чтобы можно было прочитать генетический код. Мы вряд ли сможем исследовать эти процессы, используя образцы, состоящие из плотно упакованных пучков двойных спиралей ДНК.
Даже если с помощью электронной микроскопии можно выделить и визуализировать одну цепь ДНК, тот факт, что метод основан на значительной степени высушивания образца, делает его непригодным для анализа любых связанных белков, поскольку эти молекулы критически зависят от погружения в воду для работы. правильно.
Все это говорит вам о том, что Природа — сука, которая любит усложнять жизнь ученым. Честная игра для итальянцев, которые усовершенствовали методы подготовки волокон ДНК до нового уровня, но еще неизвестно, откроет ли их метод какую-либо интересную новую биологию. Я бы пока не стал на это ставить. У ученых есть еще работа, и у научных писателей тоже.
Честная игра для итальянцев, которые усовершенствовали методы подготовки волокон ДНК до нового уровня, но еще неизвестно, откроет ли их метод какую-либо интересную новую биологию. Я бы пока не стал на это ставить. У ученых есть еще работа, и у научных писателей тоже.
Обновление от 12.07.2012 09:30 — Читателям может быть интересно узнать, что в ответ на эту статью Джордж Дворски из io9.com и Алекс Уайлд из Scientific American Blogs обновили свои статьи, добавив разъяснения и исправления. в то время как Роланд Пиз любезно написал мне, чтобы объяснить свое отношение к статье (см. комментарий ниже).
Мы отключили комментарии на этой старой версии сайта. Чтобы прокомментировать кроссворды, пожалуйста
переключитесь на новую версию, чтобы прокомментировать.
Подробнее…
TOP 9 как выглядит ДНК под микроскопом САМОЕ ЛУЧШЕЕ и НОВОЕ
Вы задаетесь вопросом как выглядит ДНК под микроскопом но в настоящее время нет ответа, поэтому позвольте kienthuctudonghoa. com обобщить и перечислить топ статей с вопросом. ответьте на вопрос как выглядит днк под микроскопом, что поможет вам получить максимально точный ответ. Следующая статья призвана помочь вам сделать более правильный выбор и получить больше полезной информации
com обобщить и перечислить топ статей с вопросом. ответьте на вопрос как выглядит днк под микроскопом, что поможет вам получить максимально точный ответ. Следующая статья призвана помочь вам сделать более правильный выбор и получить больше полезной информации
Mục lục
- 1 1. ДНК под микроскопом – электронная и атомно-силовая микроскопия
- 2 2. Как выглядит ДНК? Спустя 66 лет мы все еще учимся.
- 3 3. Я исследовал свою ДНК под микроскопом, и вы тоже можете… – YouTube
- 4 4. ДНК выглядит не так, как вы думаете! – YouTube
- 5 5. Впервые изображение ДНК с помощью электронного микроскопа | New Scientist
- 6 6. Можно ли увидеть ДНК под микроскопом? — Нью-Йорк Таймс
- 7 7. Новый «ДНК-микроскоп» позволяет заглянуть глубоко внутрь живых клеток – STAT
- 8 8.Как на самом деле выглядит ДНК – The Atlantic
- 9 9.Первый непосредственный снимок ДНК | Live Science
1.DNA под микроскопом — Электронная и атомная микроскопия
- Автор: www.
 microscopemaster.com
microscopemaster.com - .
- Высшая оценка: 3
- Низкий рейтинг: 2
- Сводка: Учитывая, что молекулы ДНК находятся внутри клеток, они слишком малы, чтобы их можно было увидеть невооруженным глазом. Хотя можно увидеть ядро (содержащее …
Подробнее
2. Как выглядит ДНК? Спустя 66 лет мы все еще узнаем больше.
- Автор: www.forbes.com
- Дата публикации: 23 вчера
- Рейтинг: 3(211 отзывов)
- Высокий рейтинг: 5
- Низкий рейтинг: 1
- РЕЗЮМЕ:
СМОТРИ
3.I Поместите мою ДНК под микроскоп, и вы тоже можете… – YouTube
99999. : www.youtube.com
9.
9.
9.
.
.0044
Подробнее
4. ДНК выглядит не так, как вы думаете! — YouTube
- Автор: www.youtube.com
- Дата поста: 12 вчера
- .
- Резюме:
Подробнее
5.ДНК впервые получена с помощью электронного микроскопа | Новый ученый
- Author: www.newscientist.com
- Post date: 9 yesterday
- Rating: 5(1427 reviews)
- Highest rating: 3
- Low rated: 1
- Резюме:
Подробнее
6. Можно ли увидеть ДНК под микроскопом? – The New York Times
- Автор: www.nytimes.
 com
com - Дата публикации: 13 вчера
- Рейтинг: 5 (1246 обзоров)
- Высокий рейтинг: 5
- Низкий рейтинг: 2
- . Внутренние живые ячейки — STAT
- Автор: www.statnews.com
- Пост Дата: 28 Вчера
- Рейтинг: 2 (388 Обзоры)
- Высокий рейтинг: 44 3
- :0060 Низкий рейтинг: 2
- Сводка:
См. Подробности
8. Какую ДНК на самом деле выглядит — Atlantic
- Автор: WWW.THEAT.com
- Рейтинг: 2 (480 обзоров)
- Высокий рейтинг: 3
- Низкий рейтинг: 1
- Сводная норму
060 . Вчера
- Author: www.livescience.com
- Post date: 10 yesterday
- Rating: 4(1507 reviews)
- Highest rating: 4
- Low rated: 2
- Резюме:
- • Возьмите пластиковый стаканчик. …
- • Наполните градуированный цилиндр 100 мл воды.
 …
… - • Возьмите пластиковую ложку. …
- • Добавьте в чашку 1 порцию мыла. …
- • Добавьте в чашку 1/8 чайной ложки размягчителя мяса. …
- • Добавьте в чашку 1 чайную ложку пищевой соды. …
- • Прекратите перемешивать и выбросьте ложку. …
- •
- Что можно увидеть в микроскоп с увеличением 2500x?
- Клетки бактерий.
- Нематоды.
- Грибок ногтей.
- Клетки грибов.
- Водяной жук.
- Старые подошвенные бородавки.
- Раковая клетка.
. СМОТРИ
99999999999999999999999. Живая наука
Живая наука
См. подробности
Информация, представленная выше о вопросе как выглядит ДНК под микроскопом , безусловно, помогла вам получить желаемый ответ, пожалуйста, поделитесь этой статьей со всеми. так что каждый может знать эту полезную информацию. Желаю тебе хорошего дня!
Top EN —
What Does Dna Look Like Under A Microscope
от администратора
Содержание
Как выглядит ДНК под микроскопом?
A. Дезоксирибонуклеиновая кислота, экстрагированная из клеток, по разным описаниям выглядит как нити слизи вялая тонкая белая лапша или сеть нежных вялых волокон. Под микроскопом можно увидеть знакомую двойную спираль молекулы ДНК. Дезоксирибонуклеиновую кислоту, экстрагированную из клеток, по-разному описывают как похожую на нити слизи вялую тонкую белую лапшу или сеть тонких вялых волокон. Под микроскопом знакомая двойная спираль
Дезоксирибонуклеиновая кислота, экстрагированная из клеток, по разным описаниям выглядит как нити слизи вялая тонкая белая лапша или сеть нежных вялых волокон. Под микроскопом можно увидеть знакомую двойную спираль молекулы ДНК. Дезоксирибонуклеиновую кислоту, экстрагированную из клеток, по-разному описывают как похожую на нити слизи вялую тонкую белую лапшу или сеть тонких вялых волокон. Под микроскопом знакомая двойная спираль
двойная спираль
имеет ширину 23,7 Å и простирается на 34 Å на 10 п.н. последовательности. Двойная спираль делает один полный оборот вокруг своей оси через каждые 10,4–10,5 пар оснований в растворе.
Как выглядит реальная ДНК?

Можно ли увидеть ДНК под обычным микроскопом?
Учитывая, что молекулы ДНК находятся внутри клеток, они слишком малы, чтобы их можно было увидеть невооруженным глазом. … В то время как ядро (содержащее ДНК) можно увидеть с помощью светового микроскопа , нити/нити ДНК можно рассматривать только с помощью микроскопов с более высоким разрешением .
… В то время как ядро (содержащее ДНК) можно увидеть с помощью светового микроскопа , нити/нити ДНК можно рассматривать только с помощью микроскопов с более высоким разрешением .
Как бы вы описали, как выглядит ДНК?
Двойная спираль выглядит как закрученная лестница — ступени лестницы состоят из пар азотистых оснований (пар оснований), а стороны лестницы состоят из чередующихся молекул сахара и фосфатных групп. Молекулы ДНК имеют длину от сотен тысяч до миллионов пар оснований.
В какой микроскоп можно увидеть ДНК?
Электронные микроскопы
Электронные микроскопы также могут видеть ДНК в клетках, а секвенаторы ДНК могут определять A, T, C и G (нуклеотиды), из которых она состоит. 20 июня 2019 г.
Как можно увидеть ДНК без микроскопа?
Вы можете легко увидеть ДНК, выполнив следующие действия.
Откуда мы знаем, что ДНК настоящая?
Мы знаем, что ДНК существует в этой двойной спирали , потому что это единственная форма, которая может объяснить формируемые ею рентгеновские дифракционные картины. Мы знаем это не только по снимку Розалинды Франклин, но и по многим другим снимкам, сделанным на протяжении многих лет многими другими учеными. … Еще одна знакомая форма ДНК — это хромосома.
Как проверить ДНК дома?
Медленно налить холодный изопропиловый спирт в маленькое прозрачное стекло, пока оно не наполнится почти полностью. Наливайте спирт максимально осторожно, стараясь не потревожить смесь, которая уже находится в маленьком прозрачном стакане. Обратите внимание на белую тягучую пенистую смесь в стакане — это ваша ДНК!
Обратите внимание на белую тягучую пенистую смесь в стакане — это ваша ДНК!
Можно ли увидеть эритроцит в световой микроскоп?
Световая микроскопия страдает малой глубиной резкости при высоком разрешении, что видно на изображении эритроцитов, полученном с помощью светового микроскопа.
Насколько мала ДНК?
Нить ДНК представляет собой длинную тонкую молекулу, в среднем около двух нанометров (или двух миллиардных долей метра) в ширину. Он настолько тонкий, что человеческий волос примерно в 40 000 раз шире.
Есть фотографии ДНК?
Впервые человека сделали прямые фотографии ДНК . Discovery News сообщает, что Энцо ди Фабрицио, исследователь из Университета Генуи в Италии, разработал метод, который протягивает нити ДНК между двумя крошечными силиконовыми столбиками, а затем фотографирует их с помощью электронного микроскопа.
Как вы описываете структуру ДНК?
Нуклеотиды расположены в виде двух длинных нитей, образующих спираль, называемую двойной спиралью. Структура двойной спирали чем-то напоминает лестницу, где пары оснований образуют ступени лестницы, а молекулы сахара и фосфата образуют вертикальные боковые части лестницы.
Структура двойной спирали чем-то напоминает лестницу, где пары оснований образуют ступени лестницы, а молекулы сахара и фосфата образуют вертикальные боковые части лестницы.
Имеет ли ДНК какой-либо цвет?
На самом базовом уровне вся ДНК состоит из ряда более мелких молекул, называемых нуклеотидами. … Рисунок 2: Четыре азотистых основания, из которых состоят нуклеотиды ДНК, показаны на яркие цвета : аденин (А зеленый) тимин (Т красный) цитозин (С оранжевый) и гуанин (Г синий).
Можно ли увидеть хромосомы в световой микроскоп?
Во время профазы хромосомы в ядре клетки уплотняются до такой степени, что их можно рассмотреть с помощью светового микроскопа.
Как выглядит атом под микроскопом?

Как выглядит ДНК для человеческого глаза?
A. Дезоксирибонуклеиновая кислота, экстрагированная из клеток, по разным описаниям выглядит как нити слизи вялая тонкая белая лапша или сеть нежных вялых волокон. Под микроскопом можно увидеть знакомую двойную спираль молекулы ДНК.
Дезоксирибонуклеиновая кислота, экстрагированная из клеток, по разным описаниям выглядит как нити слизи вялая тонкая белая лапша или сеть нежных вялых волокон. Под микроскопом можно увидеть знакомую двойную спираль молекулы ДНК.
Можно ли физически увидеть ДНК?
Многие люди полагают, что из-за того, что ДНК настолько мала, мы не можем увидеть ее без мощных микроскопов. Но на самом деле ДНК можно легко увидеть невооруженным глазом, если собрать ее из тысяч клеток .
Растворяется ли ДНК в спирте?
ДНК растворима в воде . Это означает, что он может растворяться в воде. Однако он не растворяется в присутствии спирта и соли. Лаборанты могут добавить этанол или изопропиловый спирт (медицинский спирт), чтобы ДНК сгустилась и образовала видимый белый осадок.
Есть ли ДНК в вашей еде?
Да в вашей пище есть ДНК . Мы знаем это, потому что люди могут есть только другие виды живых существ, такие как рыба, фрукты, бобы и свинина.
Была ли сфотографирована ДНК?
Фото 51 представляет собой рентгеновское дифракционное изображение паракристаллического геля, состоящего из волокон ДНК, сделанное Рэймондом Гослингом, аспирантом, работавшим под руководством Розалинд Франклин в мае 1952 года в Королевском колледже Лондона во время работы в группе сэра Джона Рэндалла.
Почему ДНК представляет собой двойную спираль?
Двойник происходит из того факта, что спираль состоит из двух длинных нитей ДНК, которые переплетаются, что-то вроде скрученной лестницы . Каждая нить ДНК (или сторона лестницы) представляет собой длинную линейную молекулу, состоящую из остова из сахаров и фосфатных групп. С каждым сахаром связано азотистое основание.
Как ДНК делает копию самой себя?
Репликация ДНК — это процесс, посредством которого ДНК создает свою копию во время клеточного деления. … Разделение двух одиночных нитей ДНК создает форму «Y», называемую «вилкой» репликации. Две разделенные нити будут действовать как шаблоны для создания новых цепей ДНК.
Две разделенные нити будут действовать как шаблоны для создания новых цепей ДНК.
Как выделить ДНК из крови в домашних условиях?

Из каких продуктов можно извлечь ДНК?
В этой лаборатории особенно хорошо работают такие продукты, как клубника, бананы, киви, малина и лук. ДНК можно выделить и извлечь из других пищевых продуктов, таких как мясо другие продукты и даже переработанные пищевые продукты, такие как кукурузные чипсы и крекеры.
Как тайно провести ДНК-тест?
Чтобы пройти секретный ДНК-тест на отцовство, вам необходимо предоставить образец от каждого человека, обычно мазок изо рта для отца и отдельный образец для ребенка, хотя допустимо любое количество отдельных образцов от кого угодно. Б/у Пластыри Тампоны Гигиенические салфетки кровяные салфетки Марля.
Какое увеличение нужно, чтобы увидеть сперму?
Вы можете просматривать сперму 400-кратное увеличение . Вам НЕ нужен микроскоп, который рекламирует что-либо выше 1000x, это просто пустое увеличение и в нем нет необходимости. Для исследования спермы под микроскопом вам понадобятся покровные стекла и биологический микроскоп.
Можно ли смотреть кровь под микроскопом?
Предыстория: Человеческая кровь невооруженным глазом кажется красной жидкостью, но под микроскопом мы можем увидеть, что она содержит четыре различных элемента: плазму. … лейкоциты .
Что можно увидеть при увеличении в 2500 раз?
Как далеко простирается человеческая ДНК?
Это позволяет 3 миллиардам пар оснований в каждой клетке поместиться на пространстве шириной всего 6 микрон. Если бы вы растянули ДНК в одной клетке до конца, получилось бы около 2 м в длину и вся ДНК во всех ваших клетках, вместе взятых, будет примерно в два раза больше диаметра Солнечной системы.
Если бы вы растянули ДНК в одной клетке до конца, получилось бы около 2 м в длину и вся ДНК во всех ваших клетках, вместе взятых, будет примерно в два раза больше диаметра Солнечной системы.
Сколько ДНК у человека?
Таким образом, диплоидный геном человека состоит из 46 молекул ДНК 24 различных типов . Поскольку хромосомы человека существуют почти идентичными парами, необходимо секвенировать только 3 миллиарда пар нуклеотидов (гаплоидный геном), чтобы получить полную информацию о репрезентативном геноме человека.
Сколько ДНК у нас общего с бананами?
Удивительно, но даже бананы по-прежнему имеют около 60% той же ДНК, что и люди!
Есть фото атома?
Фотография Дэвида Надлингера под названием «Один атом в ионной ловушке» стала победителем конкурса научной фотографии Совета по исследованиям в области инженерных и физических наук. На фотографии изображен одиночный атом стронция , встроенный в сильное электрическое поле, облучаемое лазерами, которые заставляют его излучать свет.

 Johnson, Yo Saiga. (1962). Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan,Aequorea. J. Cell. Comp. Physiol.. 59, 223-239;
Johnson, Yo Saiga. (1962). Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan,Aequorea. J. Cell. Comp. Physiol.. 59, 223-239; Hell, Jan Wichmann. (1994). Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.. 19, 780;
Hell, Jan Wichmann. (1994). Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.. 19, 780; microscopemaster.com
microscopemaster.com com
com …
…