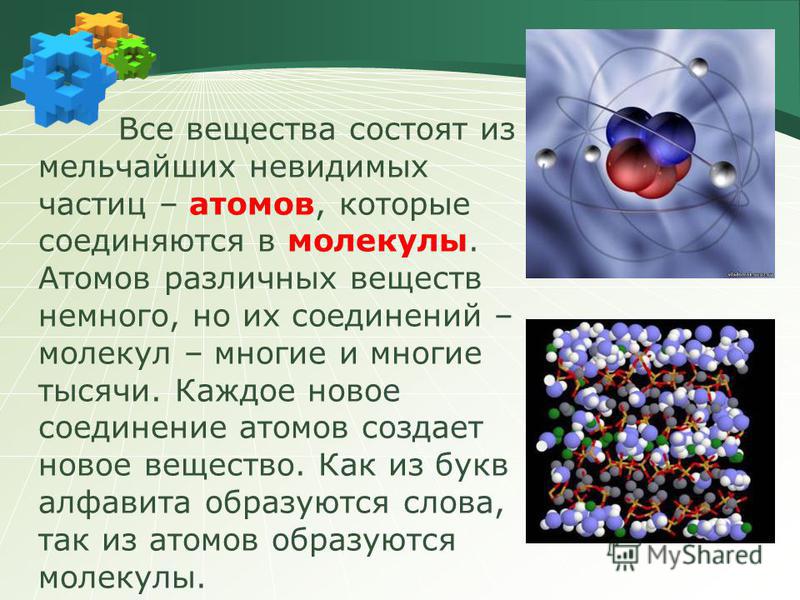
Атомная физика
Для простоты ограничимся рассмотрением простейших двухатомных молекул. Силы, удерживающие атомы в молекуле, вызваны взаимодействием внешних электронов, а электроны внутренних оболочек при объединении атомов в молекулы остаются в прежних состояниях. Различают два вида связи между атомами в молекуле: ионную (гетерополярную) и ковалентную (гомеополярную).
Ионная связь. Этот вид химической связи обусловлен переносом валентных электронов с одного атома на другой и кулоновским притяжением образовавшихся ионов. Иными словами, ионная связь осуществляется в том случае, когда электроны в молекуле можно разделить на две группы, каждая из которых все время находится около одного из ядер.
Электроны разделяются так, что около одного из ядер образуется избыток электронов, а около другого — их недостаток, то есть молекулу можно представить как образование, состоящее из отрицательного и положительного ионов, притягивающихся друг к другу (например, молекула состоит из ионов и ).
Для описания ионных молекул еще до создания квантовой механики с успехом применялись полуэмпирические способы расчета энергии связи, основанные на классической электростатике. Пусть, например, мы имеем дело с молекулами типа , и т. п. В начальном состоянии имеем два нейтральных атома, например и , разнесенные на бесконечно большое расстояние. Попытаемся мысленно построить из них молекулу. Затрачивая энергию , численно равную потенциалу ионизации щелочного металла, мы отрываем электрон от металла и переносим его на галоген. При присоединении электрона к последнему выделится энергия (сродство галогена к электрону), так что энерговыделение на этом этапе составляет . Далее сближаем образованные нами ионы до равновесного расстояния (размер молекулы). При этом выделится дополнительная энергия кулоновского взаимодействия . Полная выделившаяся энергия и есть энергия связи получившейся молекулы: именно ее надо затратить, чтобы разорвать молекулу на составные части:
|
|
|
(8.
|
Учитывая, что кулоновская энергия равна
находим отсюда выражение для равновесного расстояния:
|
|
|
(8.2)
|
Применим полученную формулу для оценки размера молекулы . Берем экспериментальные данные: так что кулоновская энергия будет
Отсюда легко находим размер молекулы
|
|
.
|
(8.3)
|
Получившаяся величина примерно в пять раз превышает радиус Бора и дает вполне приемлемую оценку размера молекулы. Отметим, что для равновесного межъядерного расстояния в молекуле эксперимент дает .
Отметим, что для равновесного межъядерного расстояния в молекуле эксперимент дает .
Оценим также размер молекулы другого соединения — , для которого и . Чтобы не повторять аналогичных выкладок, используем уже полученный результат. Имеем в этом случае:
что в
раза больше кулоновской энергии для молекулы . Соответственно, размер молекулы будет в такое же число раз меньшим:
(эксперимент для равновесного межъядерного расстояния дает значение ).
Отчуждение электрона одним ионом у другого (ионная связь) встречается в большинстве неорганических соединений, особенно в молекулах, состоящих из атомов далеких групп. Кроме соединений щелочных металлов и галогенов можно привести и другие примеры. Однако изложенные классические соображения не дают возможности вычислить независимо энергию связи молекулы (или ее размер). Само возникновение равновесного расстояния остается вне пределов компетенции такой теории.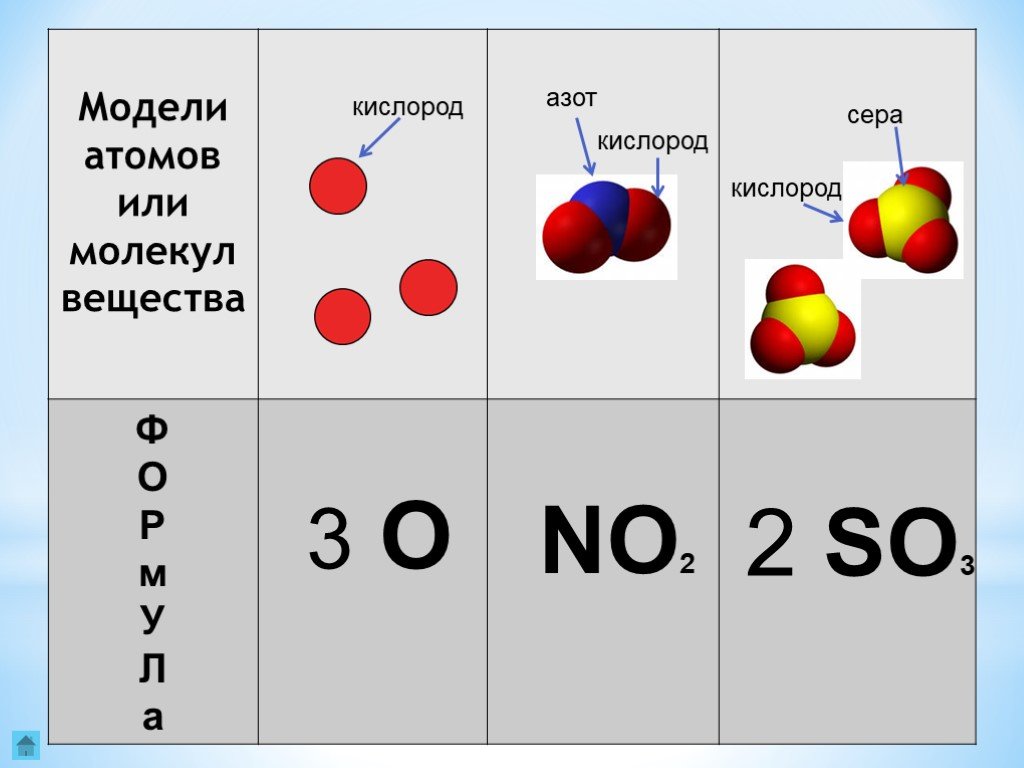 Силы электростатического притяжения между ионами должны уравновешиваться в равновесном состоянии какими-то силами отталкивания. Природа этих сил довольно сложна и связана с перекрытием электронных оболочек ионов. При сближении атомов оболочки начинают сильно деформироваться, что препятствует дальнейшему сближению. Величина — это равновесное расстояние между ионами, на котором силы электрического притяжения уравновешиваются квантово-механическим отталкиванием атомов на близких расстояниях.
Силы электростатического притяжения между ионами должны уравновешиваться в равновесном состоянии какими-то силами отталкивания. Природа этих сил довольно сложна и связана с перекрытием электронных оболочек ионов. При сближении атомов оболочки начинают сильно деформироваться, что препятствует дальнейшему сближению. Величина — это равновесное расстояние между ионами, на котором силы электрического притяжения уравновешиваются квантово-механическим отталкиванием атомов на близких расстояниях.
Ковалентная связь. Второй вид связи наблюдается в молекулах, где электроны, осуществляющие связь, значительную часть времени проводят в пространстве между атомами и в какой-то мере являются «общими» для обоих ядер. Гомеополярная (ковалентная) связь характерна для большинства молекул с двумя одинаковыми атомами ( и т. д.). Гомеополярная связь не поддается классическому описанию, требует квантового рассмотрения.
Рассмотрим простейшую гомеополярную молекулу — молекулу водорода. Впервые это было сделано в 1927 г. В. Гайтлером и Ф. Лондоном. Мы ограничимся принципиальным анализом, опуская проведение расчетов, так как нашей задачей является уяснение физической природы ковалентной (гомеополярной) связи. Схема взаимодействий в такой молекуле, состоящей из двух протонов (ядер атома водорода) А и В и двух электронов 1 и 2, показана на рис. 8.1.
Впервые это было сделано в 1927 г. В. Гайтлером и Ф. Лондоном. Мы ограничимся принципиальным анализом, опуская проведение расчетов, так как нашей задачей является уяснение физической природы ковалентной (гомеополярной) связи. Схема взаимодействий в такой молекуле, состоящей из двух протонов (ядер атома водорода) А и В и двух электронов 1 и 2, показана на рис. 8.1.
Рис. 8.1. Схема взаимодействия в молекуле водорода
Уравнение Шредингера для системы имеет вид
|
|
|
(8.4)
|
где через и обозначены радиус-векторы первого и второго электронов, а — гамильтониан системы:
|
|
|
(8.
|
Гамильтониан содержит оператор кинетической энергии электрона 1 и потенциальную энергию того же электрона в кулоновском поле ядра А. Аналогичную структуру имеет гамильтониан . Оператор U описывает четыре взаимодействия: электрона 1 с ядром В, электрона 2 с ядром А, электронов между собой и ядер — также между собой. Ядра имеют массу, примерно в 2 000 раз превышающую массу электрона, поэтому они движутся гораздо медленнее электронов, и в первом приближении их можно считать неподвижными (такое приближение называется адиабатическим). Поэтому волновая функция
рассматривается как функция координат только электронов, а расстояние R между ядрами, важное в проблеме ковалентной связи, входит в волновую функцию как параметр. Получающиеся из уравнения Шредингера собственные значения энергии будут тогда зависеть от расстояния R, то есть
причем в случаях параллельной и антипараллельной ориентации спинов электронов характер этой зависимости оказывается различным.
Полная волновая функция зависит не только от пространственных координат электронов, но и от их спинов. Вследствие принципа Паули (согласно которому данный набор квантовых чисел может иметь лишь одна частица), такая полная волновая функция должна быть антисимметричной относительно перестановки электронов. Поскольку спиновое состояние не зависит от орбитального, пространственные и спиновые переменные разделяются, и полную волновую функцию электронов в молекуле водорода можно представить в виде произведения координатной и спиновой функций:
|
|
|
(8.6)
|
Из принципа Паули следуют свойства волновых функций:
|
Симметричная спиновая волновая функция соответствует параллельному расположению векторов спинов электронов, то есть суммарному спину электронов S = 1. Такое состояние называется триплетным по числу (2S + 1) = 3 возможных проекций суммарного спина. Во втором же случае антисимметричная спиновая функция связана с противоположно ориентированными спинами, дающими в сумме S = 0, и, следовательно, возможно только одно значение проекции полного спина, и состояние называется синглетным.
Взаимодействие между нейтральными атомами, когда расстояние между ядрами R много больше характерных размеров электронных оболочек, то есть радиуса Бора
практически отсутствует, а энергия системы равна удвоенной энергии связи атома водорода , где
При уменьшении R до нуля эта энергия будет бесконечно возрастать из-за кулоновского отталкивания ядер.
Результаты расчетов можно описать следующим образом. Если спины электронов параллельны, то при сближении атомов водорода энергия системы монотонно увеличивается, никакого связанного состояния не возникает (кривая на рис. 8.2).
Рис. 8.2. Зависимость энергии Е молекулы водорода от расстояния R между атомами:
на больших расстояниях существуют два нейтральных атома водорода с общей энергией ;
кривая Е– соответствует триплетному состоянию электронов и проходит выше асимптотического значения
— связанного состояния молекулы в этом случае не существует; кривая соответствует синглетному
состоянию электронов, она имеет минимум при (конечный размер молекулы),
расстояние которого от асимптотического значения и есть энергия связи молекулы водорода
В этом случае предоставленные самим себе два атома вновь разойдутся, стремясь к состоянию с наименьшей возможной энергией.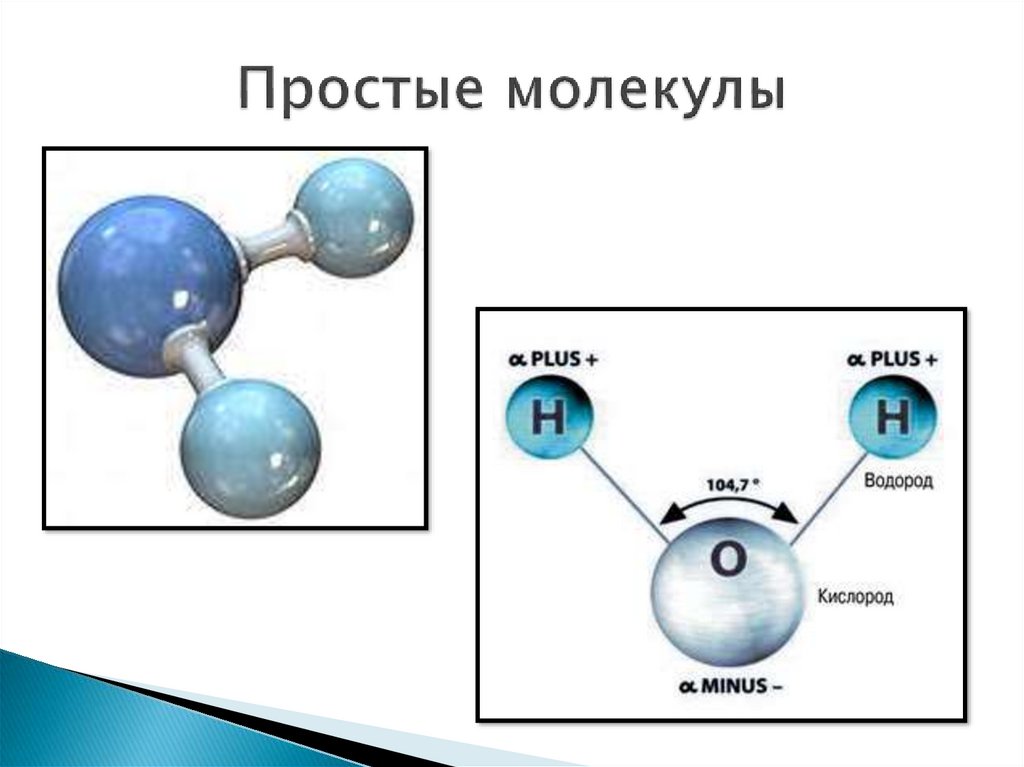 Условие существования связанного состояния — наличие минимума энергии системы при некотором значении — выполняется только при синглетном состоянии электронов, когда их спины антипараллельны (кривая на рис. 8.2).
Условие существования связанного состояния — наличие минимума энергии системы при некотором значении — выполняется только при синглетном состоянии электронов, когда их спины антипараллельны (кривая на рис. 8.2).
Понять такое поведение энергии можно на качественном уровне, если рассмотреть два водородных атома, находящихся на большом расстоянии
друг от друга. Тогда оператором взаимодействия U в гамильтониане (8.5) можно пренебречь, и мы имеем два независимых атома, описываемых суммой гамильтонианов и . Решения соответствующего каждому из них уравнения Шредингера мы уже знаем. Введем обозначения для получающихся волновых функций: и . Тогда решение для суммы гамильтонианов будет представляться в виде произведения волновых функций
а энергия — в виде суммы энергий, то есть будет равна . Физический смысл произведения волновых функций очевиден: электрон 1 находится в поле ядра А1, а электрон 2 — в поле ядра В2. Но электроны неразличимы, и эта физическая ситуация ничем не отличается от случая, когда электрон 2 находится в поле ядра 1А, а электрон 1 — в поле ядра В2. Этому соответствует иное произведение волновых функций:
Но электроны неразличимы, и эта физическая ситуация ничем не отличается от случая, когда электрон 2 находится в поле ядра 1А, а электрон 1 — в поле ядра В2. Этому соответствует иное произведение волновых функций:
которое тоже является решением уравнения Шредингера с той же энергией . Согласно принципу суперпозиции, решением с этой же энергией будет и любая линейная комбинация указанных произведений. Поскольку принцип Паули требует, чтобы полная волновая функция была либо симметрична, либо антисимметрична по пространственным координатам электрона, она должна иметь вид
|
|
|
(8.7)
|
где — вычисляемые нормировочные коэффициенты, обеспечивающие равенство единице полной вероятности:
Подставляя сюда выражения (8. 7) и учитывая, что и уже нормированы на единицу, получаем
7) и учитывая, что и уже нормированы на единицу, получаем
|
|
|
(8.8)
|
откуда
|
|
|
(8.9)
|
Величина Р, называемая интегралом перекрытия, равна
|
|
|
(8.
|
Она характеризует степень перекрытия волновых функций и , то есть степень независимости пространственного распределения электронов друг от друга, и играет важную роль в теоретических расчетах свойств молекул.
Если учесть теперь оператор взаимодействия U, то в зависимости от симметрии волновой функции получатся поправки к энергии разных знаков. В случае антисимметричного состояния (полный спин электронов S = 1) поправка получается положительной (отталкивание атомов), и связанного состояния не возникает. В случае же симметричного состояния (полный спин электронов S = 0) поправка для больших R отрицательна (притяжение атомов), что приводит к образованию молекулы водорода.
Осмыслить такое поведение поправки к энергии помогает график волновой функции. Ось z направим по линии, соединяющей ядра атомов водорода, а начало отсчета выберем в средней точке между ядрами, так что координаты ядра А равны (0, 0, –R/2), а ядра В — (0, 0, R/2). Для простоты рассмотрим волновые функции на этой оси, причем для случая симметричного расположения электронов относительно начала отсчета:
Для простоты рассмотрим волновые функции на этой оси, причем для случая симметричного расположения электронов относительно начала отсчета:
Тогда
|
|
|
(8.11)
|
Графики этих функций представлены на рис. 8.3.
Рис. 8.3. Волновые функции электронов в молекуле водорода на оси, соединяющей ядра атомов,
для синглетного и триплетного состояний
Мы видим, что в обоих случаях существует наибольшая вероятность найти электроны вблизи ядер — волновые функции имеют экстремумы в точках
Однако при сближении атомов в пространстве между ядрами происходит перераспределение плотности электронов, поведение которой различается в зависимости от типа симметрии пространственной части волновой функции — или .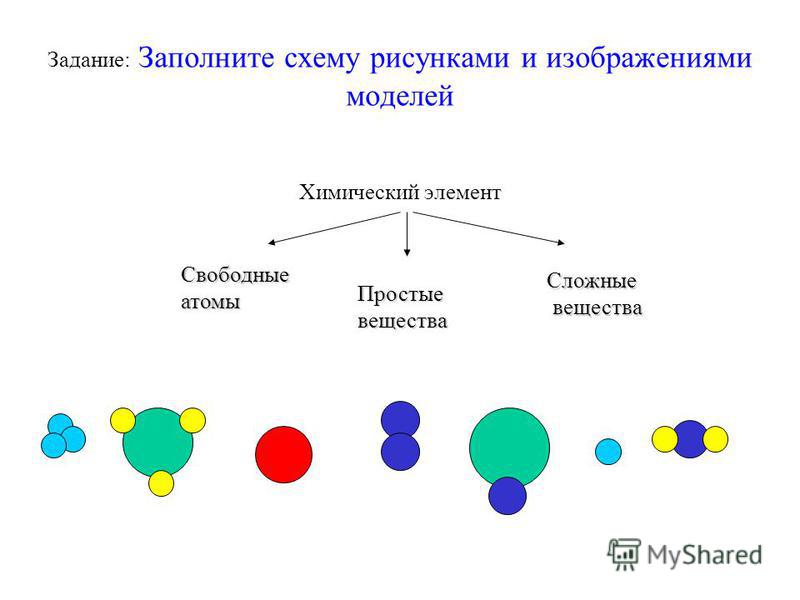 В состоянии электроны часть времени проводят в области между протонами (волновая функция в этой области заметно отлична от нуля). В центре между атомами получается электронное облачко, притягивающее к себе протоны — возникает стягивающее действие и образуется молекула. В состоянии же плотность электронов между протонами уменьшается (волновая функция проходит через нуль), отталкивание протонов не экранируется, что и приводит к увеличению энергии системы в этом состоянии (см. рис. 8.2). Положение минимума, таким образом, определяется из решения уравнения Шредингера с учетом потенциальной энергии электрического взаимодействия электронов и протонов в молекуле.
В состоянии электроны часть времени проводят в области между протонами (волновая функция в этой области заметно отлична от нуля). В центре между атомами получается электронное облачко, притягивающее к себе протоны — возникает стягивающее действие и образуется молекула. В состоянии же плотность электронов между протонами уменьшается (волновая функция проходит через нуль), отталкивание протонов не экранируется, что и приводит к увеличению энергии системы в этом состоянии (см. рис. 8.2). Положение минимума, таким образом, определяется из решения уравнения Шредингера с учетом потенциальной энергии электрического взаимодействия электронов и протонов в молекуле.
Численные результаты , для кривой , полученные в таком подходе, следует сравнить с экспериментальными данными: , . Разница в энергии связи составляет 31 %, в размере молекулы — 17 %.
Комбинации различных типов связи. Мы познакомились с двумя типами связи — ионной и ковалентной.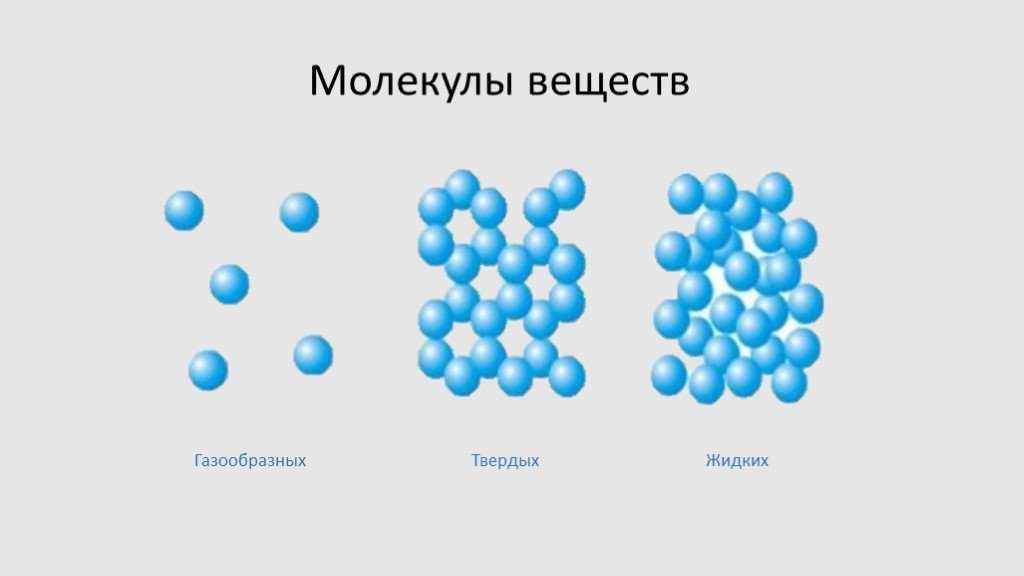 В первой основную роль играет «перескок» электронов от одного атома к другому, во второй — дополнительные силы притяжения между атомами, порождаемые парой электронов с противоположными спинами. На самом деле оказывается, что такое резкое разделение не есть внутреннее свойство системы, но, скорее, недостаток наших методов расчета. Так, для улучшения согласия с экспериментом использованное приближение Гайтлера — Лондона может быть уточнено. Именно, ранее исходным моментом были волновые функции электронов — электрона 1 в поле ядра А и электрона 2 — в поле ядра В. Но электрон 1 также находится и в поле ядра В, а электрон 2 — в поле ядра А. Эти взаимодействия были учтены в поправочных членах, входящих в оператор U. Можно, однако, попытаться включить эти взаимодействия в рассмотрение с самого начала. Для этого представим волновую функцию первого электрона в виде
В первой основную роль играет «перескок» электронов от одного атома к другому, во второй — дополнительные силы притяжения между атомами, порождаемые парой электронов с противоположными спинами. На самом деле оказывается, что такое резкое разделение не есть внутреннее свойство системы, но, скорее, недостаток наших методов расчета. Так, для улучшения согласия с экспериментом использованное приближение Гайтлера — Лондона может быть уточнено. Именно, ранее исходным моментом были волновые функции электронов — электрона 1 в поле ядра А и электрона 2 — в поле ядра В. Но электрон 1 также находится и в поле ядра В, а электрон 2 — в поле ядра А. Эти взаимодействия были учтены в поправочных членах, входящих в оператор U. Можно, однако, попытаться включить эти взаимодействия в рассмотрение с самого начала. Для этого представим волновую функцию первого электрона в виде
где c, d — некие численные коэффициенты.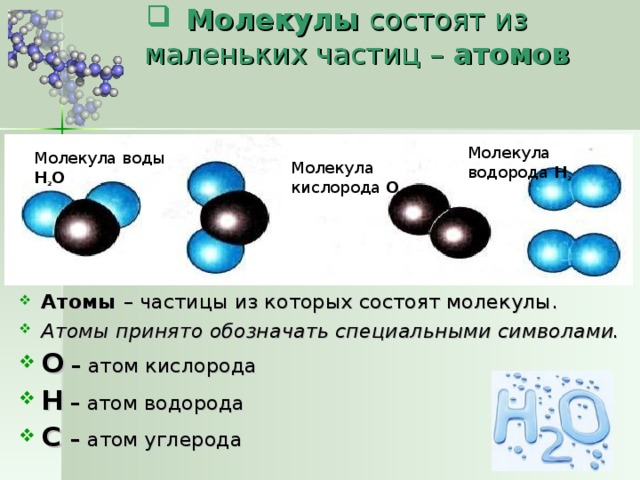 Они не являются независимыми: условие нормировки волновой функции y1 приводит к связи между ними
Они не являются независимыми: условие нормировки волновой функции y1 приводит к связи между ними
|
|
|
(8.12)
|
где P — тот же интеграл перекрытия (8.10). Аналогичный вид имеет и волновая функция второго электрона:
Волновую функцию синглетного двухэлектронного состояния строим как произведение
|
|
|
(8.13)
|
Мы видим, что здесь содержится волновая функция Гайтлера–Лондона — это последнее слагаемое в (8.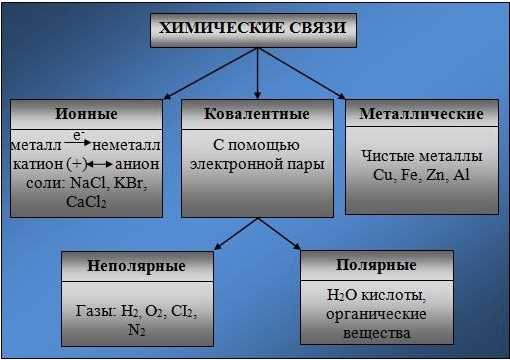 13). Однако в приведенных формулах содержится и описание другого случая: это слагаемые
13). Однако в приведенных формулах содержится и описание другого случая: это слагаемые
Физический смысл первого из них достаточно очевиден: оба электрона сосредоточены вокруг ядра А, образуя ион водорода Н –, в то время как ядро В, лишившееся электрона, образует ион Н +. Мы видим, что этот случай описывает ионную связь. Второе слагаемое описывает аналогичную ситуацию, только ядра A и В меняются ролями. Для симметричной молекулы при обмене ядер местами ничего не меняется, откуда следует равенство коэффициентов
Таким образом, волновая функция (8.13) описывает некую комбинацию ионной и ковалентной связи, причем относительные веса этих двух типов связи одинаковы. Физически это, однако, не так, поскольку мы уже убедились, что метод Гайтлера–Лондона дает неплохое описание молекулы водорода. Но мы нащупали путь. Ясно, что недостаток метода Гайтлера–Лондона заключается в пренебрежении ионными членами, а недостаток только что изложенного подхода (его называют методом молекулярных орбит) — в переоценке влияния этих членов.
Можно принять оба этих метода как два различных исходных приближения, и естественным обобщением может стать улучшение численных значений коэффициентов в волновой функции, определяющих статистический вес ионной и ковалентной связей. Представим, например, симметричную волновую функцию как суперпозицию отдельных двухэлектронных состояний с произвольными коэффициентами :
|
|
|
(8.14)
|
При использовании такой волновой функции согласие с экспериментом заметно улучшается. В реальных расчетах коэффициенты определяются из условия минимума средней энергии, и их численные значения получаются автоматически, в зависимости от свойств системы. Если окажется, что численное значение одного из них намного превосходит по абсолютной величине два других, то можно говорить о преобладании связи определенного типа.
Так, если
то это будет ионная связь (электрон «перепрыгнул» с ядра В на ядро А).
Если
то это случай ионной связи (электрон перешел с ядра А на ядро В).
Если же, наконец,
то мы имеем дело с ковалентной связью.
Этот подход применим как к молекулам из двух разных атомов, так и к соединениям одинаковых атомов, и позволяет учесть вклад ковалентного соединения в ионных молекулах и вклад ионной связи — в ковалентных молекулах. В применении к симметричным молекулам должно выполняться равенство
но третий коэффициент остается независимым, в отличие от метода молекулярных орбит. Сравнение экспериментов с расчетами по волновой функции (8.14) показало, что доля ионной связи в ковалентной молекуле атома водорода равна 20 %.
Химическая связь — основные виды, типы и характеристики
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики.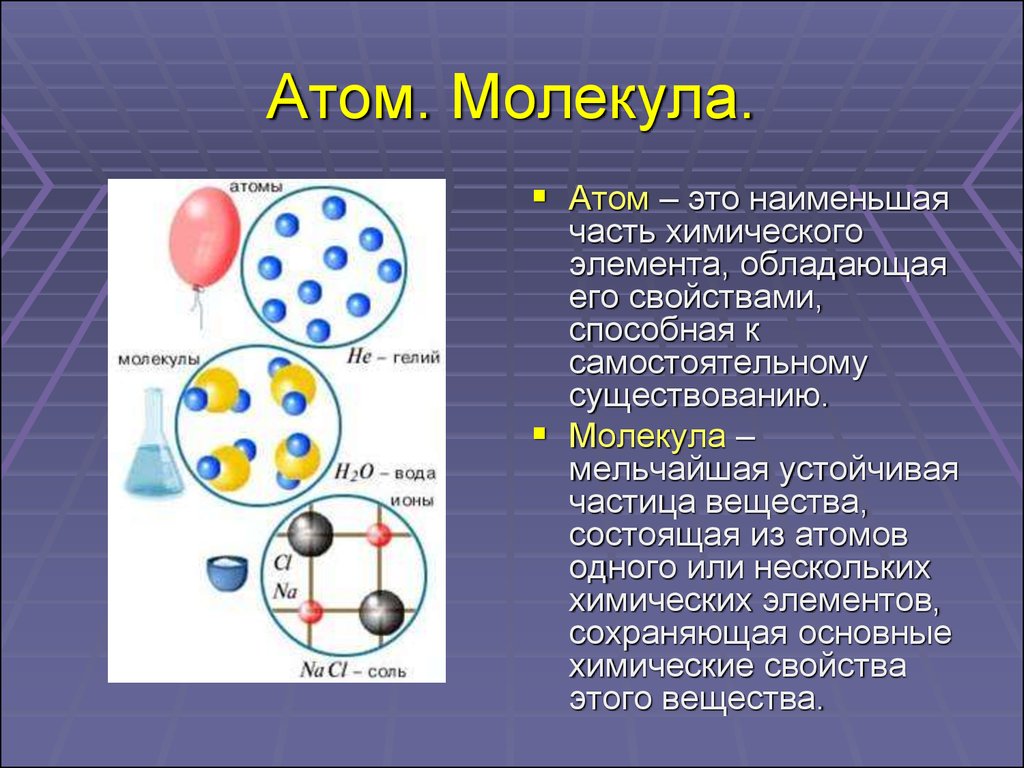 Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии.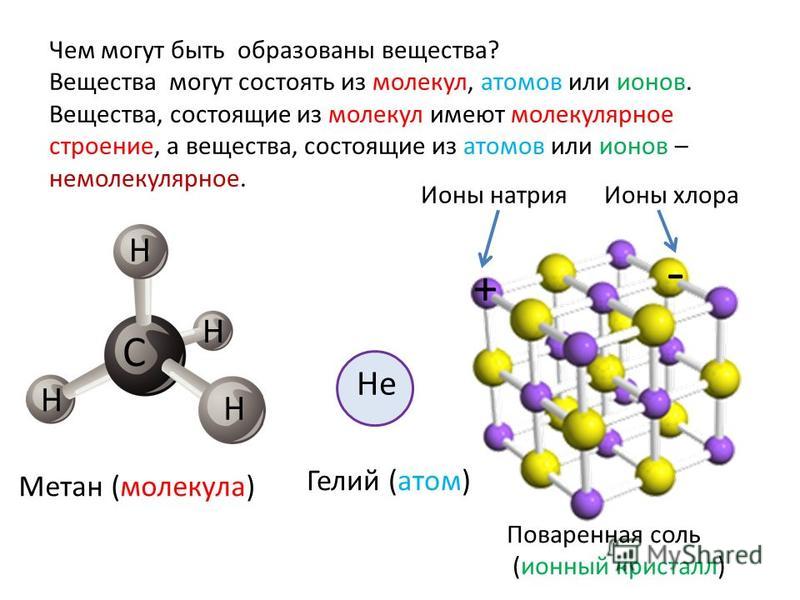 Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
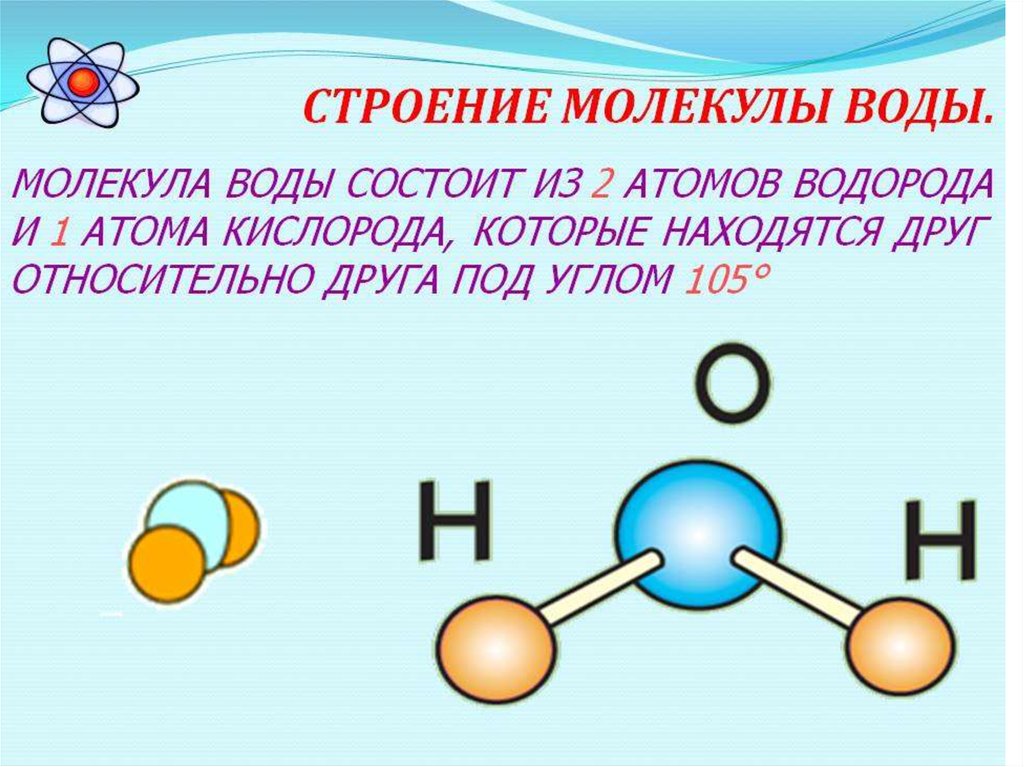
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.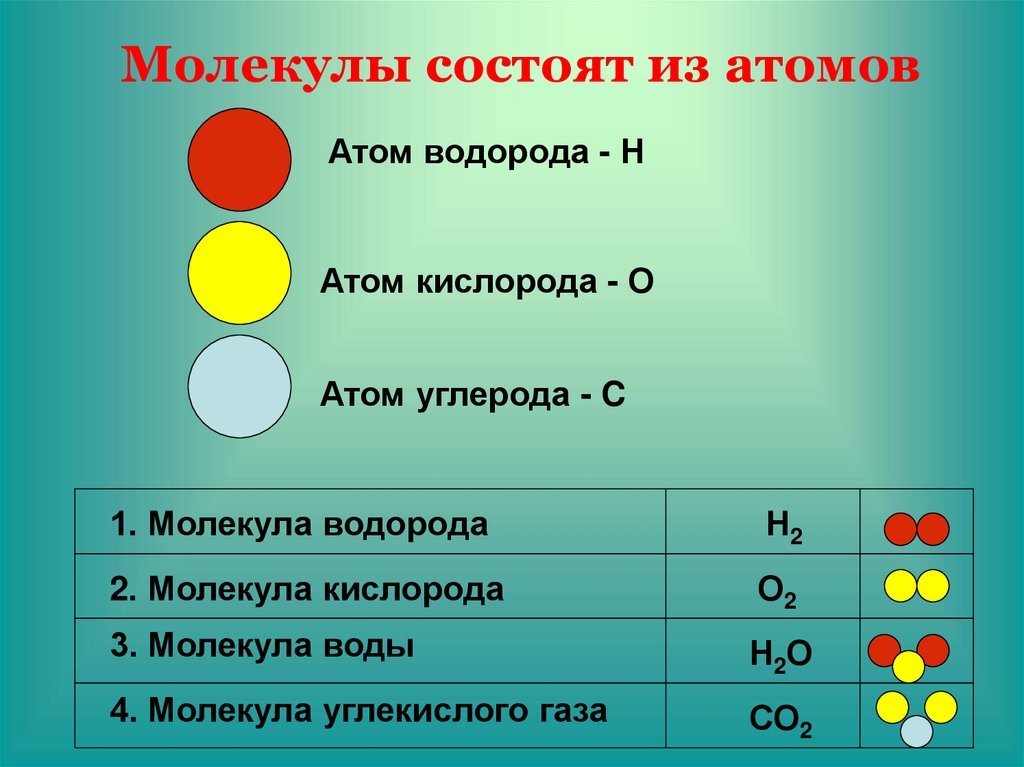
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.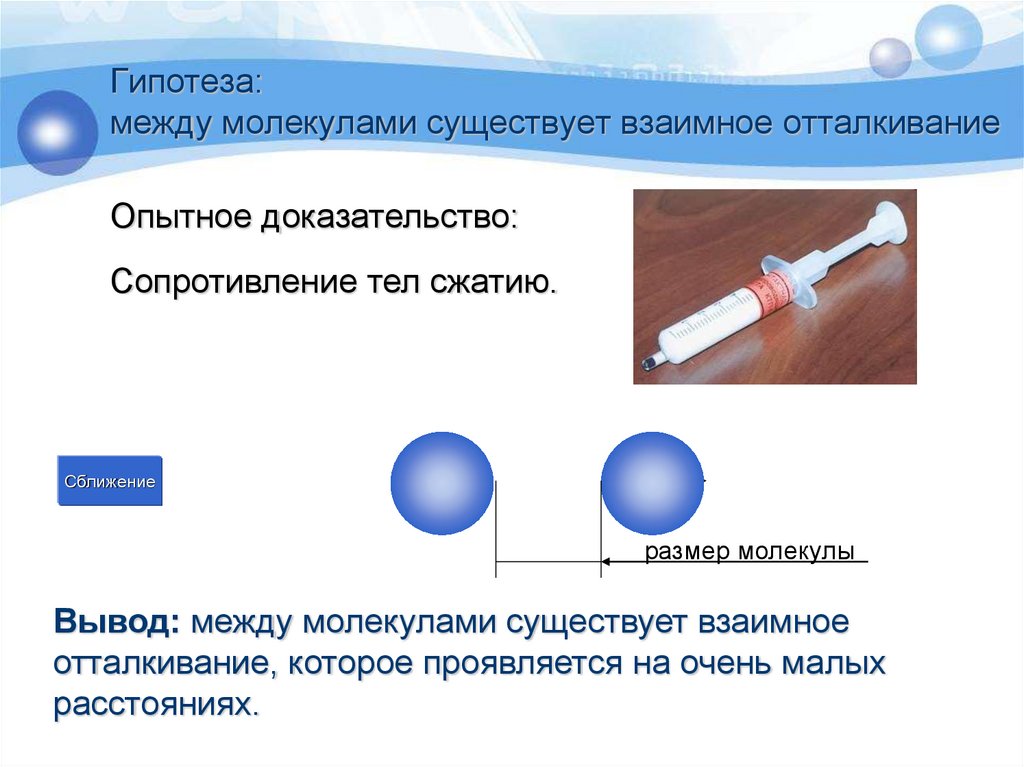
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь | Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества.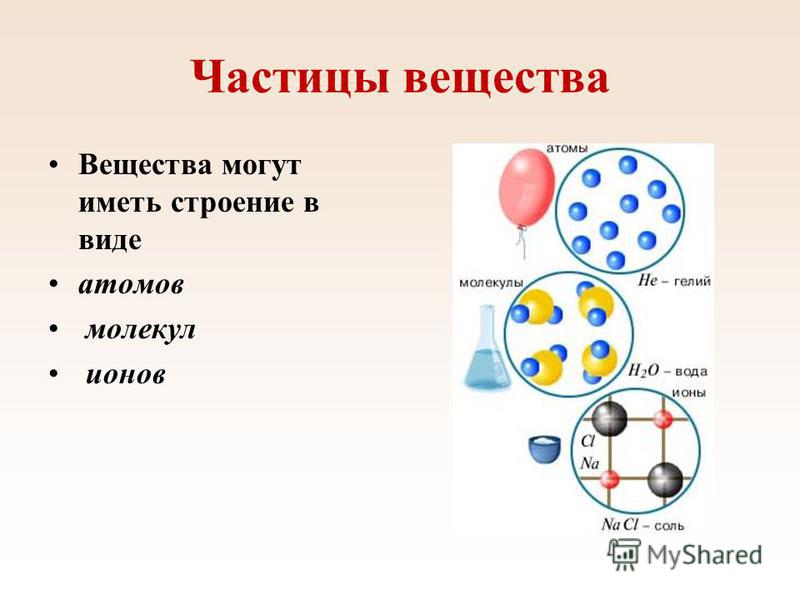 |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Таблица ниже описывает кратко химические связи и строение вещества.
Molecules and Chemical Nomenclature – Introductory Chemistry – 1st Canadian Edition
Глава 3. Атомы, молекулы и ионы
- Определить молекулу .
- Назовите простые молекулы по их формулам.
- Определите формулу молекулы по ее названию.
Есть много веществ, которые существуют в виде двух или более атомов, связанных вместе настолько прочно, что ведут себя как одна частица. Эти многоатомные комбинации называются молекулами. Молекула – это наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества. В некоторых отношениях молекула похожа на атом. Однако молекула состоит из более чем одного атома.
Некоторые элементы существуют в природе в виде молекул. Например, водород и кислород существуют в виде двухатомных молекул. Другие элементы также существуют в природе в виде двухатомных молекул (см. список «Элементы, существующие в виде двухатомных молекул»). Как и в случае любой молекулы, эти элементы помечены молекулярной формулой, формальным списком того, что и сколько атомов входит в молекулу. (Иногда используется только слово формула , и ее значение выводится из контекста.) Например, молекулярная формула элементарного водорода H 2 , где Н является символом водорода, а нижний индекс 2 означает, что в молекуле есть два атома этого элемента. Аналогичные формулы имеют и другие двухатомные элементы: O 2 , N 2 и так далее. Другие элементы существуют в виде молекул — например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем считать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле присутствует только один атом, если справа от символа элемента нет числового нижнего индекса.
Как и в случае любой молекулы, эти элементы помечены молекулярной формулой, формальным списком того, что и сколько атомов входит в молекулу. (Иногда используется только слово формула , и ее значение выводится из контекста.) Например, молекулярная формула элементарного водорода H 2 , где Н является символом водорода, а нижний индекс 2 означает, что в молекуле есть два атома этого элемента. Аналогичные формулы имеют и другие двухатомные элементы: O 2 , N 2 и так далее. Другие элементы существуют в виде молекул — например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем считать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле присутствует только один атом, если справа от символа элемента нет числового нижнего индекса.
Ниже приведен список элементов, которые существуют в виде двухатомных молекул:
- водород
- кислород
- азот
- фтор
- хлор
- бром
- йод
Рисунок 3. 3 «Молекулярное искусство молекул S 8 и P 4 ». Если каждый зеленый шарик представляет атом серы, то диаграмма слева представляет молекулу S 8 . Молекула справа показывает, что существует одна форма элементарного фосфора в виде четырехатомной молекулы.
3 «Молекулярное искусство молекул S 8 и P 4 ». Если каждый зеленый шарик представляет атом серы, то диаграмма слева представляет молекулу S 8 . Молекула справа показывает, что существует одна форма элементарного фосфора в виде четырехатомной молекулы.
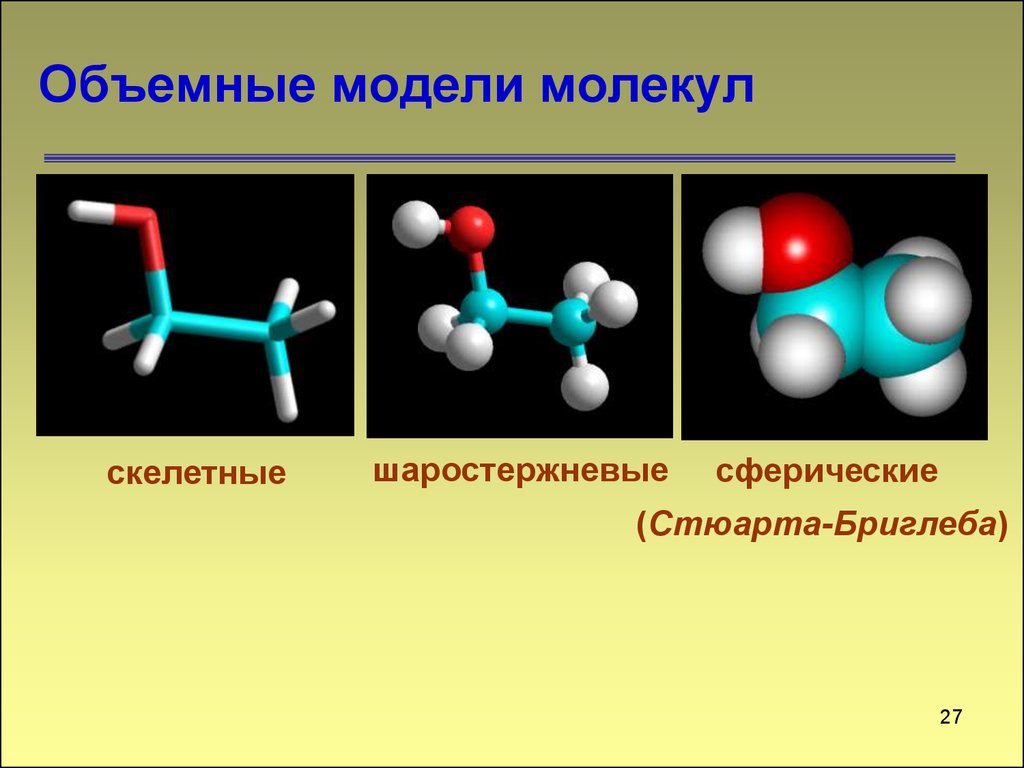
На рис. 3.3 «Молекулярное искусство S» показаны два примера того, как мы будем представлять молекулы в этом тексте. Атом представлен маленьким шариком или сферой, что обычно указывает, где в молекуле находится ядро. Цилиндрическая линия, соединяющая шары, представляет собой связь между атомами, которые делают этот набор атомов молекулой. Это соединение называется химической связью. В главе 9 «Химические связи» мы исследуем происхождение химических связей. В этой книге вы встретите и другие примеры такого представления молекул в виде «шара и цилиндра».
Многие соединения существуют в виде молекул. В частности, когда неметаллы соединяются с другими неметаллами, соединение обычно существует в виде молекул. (Соединения между металлом и неметаллом различны и рассматриваются в разделе «Ионы и ионные соединения».) Более того, в некоторых случаях существует множество различных типов молекул, которые могут образовываться между любыми данными элементами, причем все разные молекулы имеют разные химические и физические свойства. Как мы их различаем?
(Соединения между металлом и неметаллом различны и рассматриваются в разделе «Ионы и ионные соединения».) Более того, в некоторых случаях существует множество различных типов молекул, которые могут образовываться между любыми данными элементами, причем все разные молекулы имеют разные химические и физические свойства. Как мы их различаем?
Ответом является очень специфическая система наименования соединений, называемая химической номенклатурой. Следуя правилам номенклатуры, каждое соединение имеет свое собственное уникальное имя, и каждое название относится к одному и только одному соединению. Здесь мы начнем с относительно простых молекул, содержащих только два элемента, так называемых бинарные соединения :
- Определите элементы в молекуле по ее формуле. Вот почему вам необходимо знать названия и символы элементов в Таблице 3.8 «Названия и символы общих элементов».
- Начинайте имя с имени первого элемента. Если в молекулярной формуле имеется более одного атома этого элемента, используйте числовой префикс для обозначения количества атомов, как указано в Таблице 3.
 6 «Числовые префиксы, используемые при наименовании молекулярных соединений». Не используйте префикс моно-, если имеется только один атом первого элемента.
6 «Числовые префиксы, используемые при наименовании молекулярных соединений». Не используйте префикс моно-, если имеется только один атом первого элемента.
Таблица 3.6 Числовые префиксы, используемые в названиях молекулярных соединений Количество атомов элемента Префикс 1 моно- 2 ди- 3 три- 4 тетра- 5 пента- 6 гекса- 7 гепта- 8 окта- 9 нон- 10 дека- Назовите второй элемент, используя три части:
- числовой префикс, указывающий количество атомов второго элемента, плюс
- основа имени элемента (например, ох для кислорода, хлор для хлора и т.
 д.), плюс
д.), плюс - суффикс – ide .
- Соедините два слова, оставив между ними пробел.
Давайте посмотрим, как эти шаги работают для молекулы с молекулярной формулой SO 2 , которая имеет один атом серы и два атома кислорода — это завершает шаг 1. Согласно шагу 2, мы начинаем с названия первого элемента —сера. Помните, мы не используем моно-.префикс для первого элемента. Теперь для шага 3 мы комбинируем числовой префикс ди- (см. Таблицу 3.6 «Числовые префиксы, используемые в названиях молекулярных соединений») с основой ox- и суффиксом -ide , чтобы получить диоксид . Объединив эти два слова, мы получили уникальное название этого соединения — двуокись серы.
К чему все эти проблемы? Существует еще одно распространенное соединение, состоящее из серы и кислорода, молекулярная формула которого SO 3 , поэтому соединения необходимо различать. ТАК 3 содержит три атома кислорода, поэтому это другое соединение с другими химическими и физическими свойствами.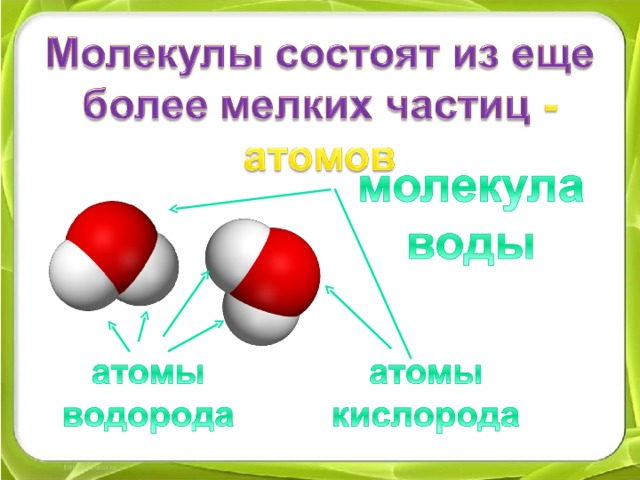 Система химической номенклатуры разработана таким образом, чтобы присвоило этому соединению собственное уникальное название . Название его, если пройти все этапы, триоксид серы. Разные соединения имеют разные названия.
Система химической номенклатуры разработана таким образом, чтобы присвоило этому соединению собственное уникальное название . Название его, если пройти все этапы, триоксид серы. Разные соединения имеют разные названия.
В некоторых случаях, когда префикс заканчивается на a или o , а имя элемента начинается с o , мы опускаем a или o в префиксе. Таким образом, мы видим монооксид или пентаоксид , а не монооксид или пентаоксид в названиях молекул.
Отличительной чертой этой системы является то, что она работает в обоих направлениях. По названию соединения можно определить его молекулярную формулу. Просто перечислите символы элемента с числовым нижним индексом, если имеется более одного атома этого элемента, в порядке имени (мы не используем нижний индекс 1, если присутствует только один атом элемента; 1 подразумевается) . От имени трихлорид азота , вы сможете получить NCl 3 в качестве формулы для этой молекулы.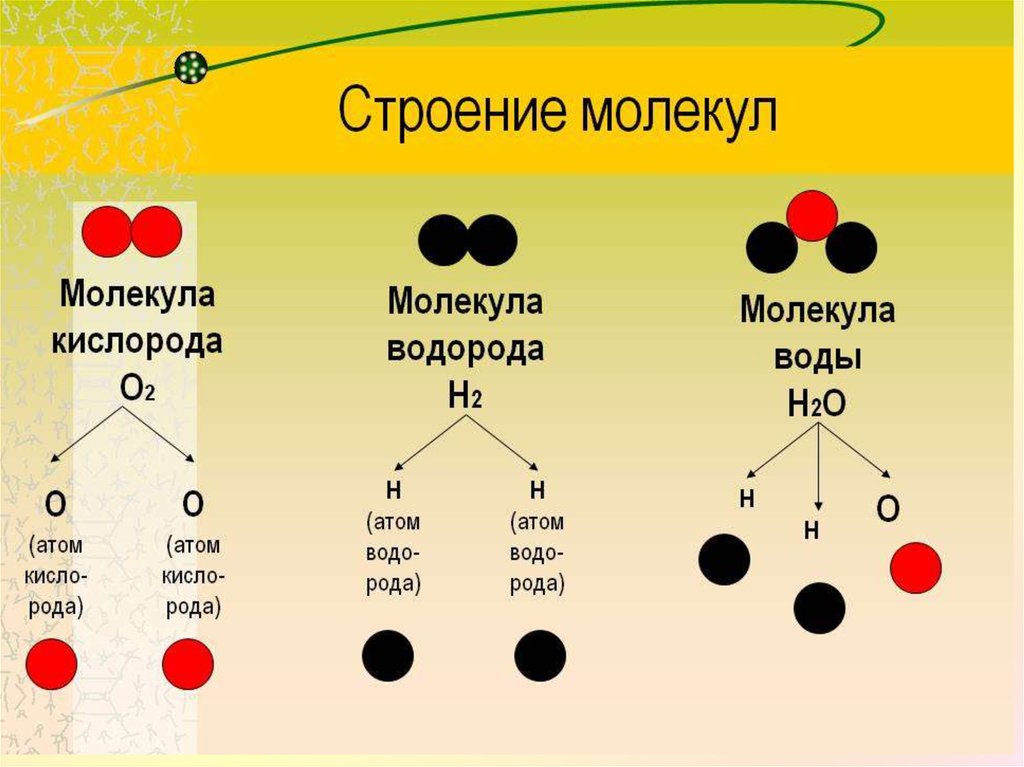 Из названия пятиокись дифосфора можно получить формулу P 2 O 5 (обратите внимание на числовой префикс перед первым элементом, указывающий на то, что в формуле присутствует более одного атома фосфора).
Из названия пятиокись дифосфора можно получить формулу P 2 O 5 (обратите внимание на числовой префикс перед первым элементом, указывающий на то, что в формуле присутствует более одного атома фосфора).
Назовите каждую молекулу.
- ПФ 3
- СО
- Се 2 Бр 2
Растворы
- Молекула с одним атомом фосфора и тремя атомами фтора называется трифторидом фосфора.
- Соединение с одним атомом углерода и одним атомом кислорода правильно называется монооксидом углерода, а не монооксидом углерода.
- Есть два атома каждого элемента, селена и брома. По правилам имя собственное здесь диселения дибромид.
Назовите каждую молекулу.
- СФ 4
- П 2 С 5
Ответы
- тетрафторид серы
- пентасульфид дифосфора
Назовите формулу каждой молекулы.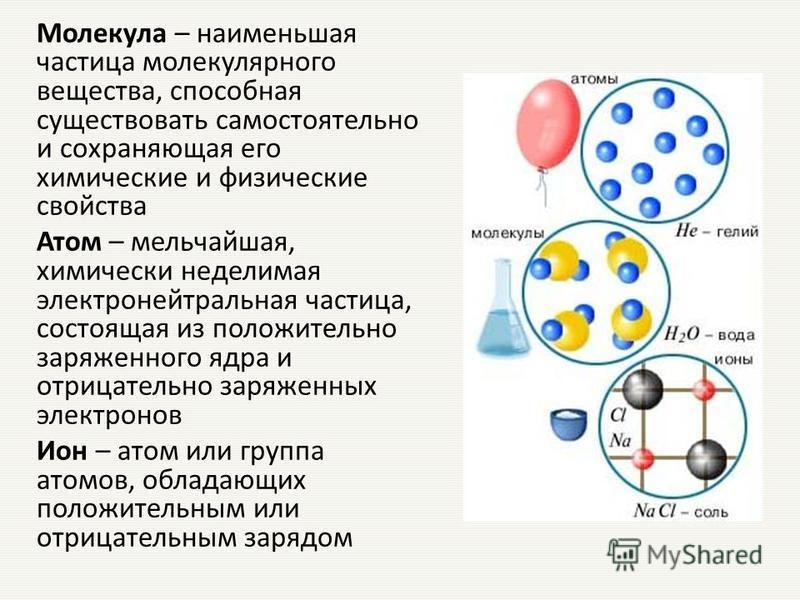
- четыреххлористый углерод
- диоксид кремния
- тетранитрид трикремния
Растворы
- Название четыреххлористый углерод подразумевает один атом углерода и четыре атома хлора, поэтому формула CCl 4 .
- Название диоксид кремния подразумевает один атом кремния и два атома кислорода, поэтому формула SiO 2 .
- У нас есть имя с числовыми префиксами в обоих элементах. Три- означает три, а тетра- означает четыре, поэтому формула этого соединения Si 3 N 4 .
Назовите формулу каждой молекулы.
- дифторид серы
- пентабромид йода
Ответы
- S 2 F 2
- ИБр 5
Некоторые простые молекулы имеют общие названия, которые мы используем как часть формальной системы химической номенклатуры. Например, Н 2 О дается название вода , а не моноокись дигидрогена . NH 3 называется аммиак , а CH 4 называется метан . Время от времени мы будем видеть другие молекулы, имеющие общие названия; мы будем указывать на них по мере их возникновения.
NH 3 называется аммиак , а CH 4 называется метан . Время от времени мы будем видеть другие молекулы, имеющие общие названия; мы будем указывать на них по мере их возникновения.
- Молекулы — это группы атомов, которые ведут себя как единое целое.
- Некоторые элементы существуют в виде молекул: водород, кислород, сера и так далее.
- Существуют правила, которые могут выражать уникальное имя для любой заданной молекулы и уникальную формулу для любого заданного имени.
- Какие из этих формул представляют собой молекулы? Укажите, сколько атомов содержится в каждой молекуле.
- Fe
- PCl 3
- Р 4
- Ар
- Какие из этих формул представляют собой молекулы? Укажите, сколько атомов содержится в каждой молекуле.
- I 2
- Он
- Н 2 О
- Ал
- В чем разница между CO и Co?
- В чем разница между H 2 O и H 2 O 2 (перекись водорода)?
- Приведите соответствующую формулу для каждого двухатомного элемента.

- В 1986 году, когда комета Галлея в последний раз прошла мимо Земли, астрономы обнаружили в своих телескопах присутствие S 2 . Почему серу не считают двухатомным элементом?
- Какая основа слова фтор используется в названиях молекул? CF 4 является одним из примеров.
- Какая основа селена используется в названиях молекул? SiSe 2 является примером.
- Дайте правильное название каждой молекуле.
- ПФ 3
- TeCl 2
- Н 2 О 3
- Дайте правильное название каждой молекуле.
- №
- КС 2
- Как 2 О 3
- Дайте правильное название каждой молекуле.
- XEF 2
- О 2 Ж 2
- СФ 6
- Дайте правильное название каждой молекуле.

- Р 4 О 10
- Б 2 О 3
- П 2 С 3
- Дайте правильное название каждой молекуле.
- Н 2 О
- Н 2 О 4
- Н 2 О 5
- Дайте правильное название каждой молекуле.
- СеО 2
- Класс 2 О
- XEF 6
- Дайте правильную формулу для каждого имени.
- пятиокись азота
- трикарбид тетрабора
- пентахлорид фосфора
- Дайте правильную формулу для каждого имени.
- трийодид азота
- трисульфид димышьяка
- трихлорид йода
- Дайте правильную формулу для каждого имени.
- дихлорид кислорода
- диазот трисульфид
- тетрафторид ксенона
- Дайте правильную формулу для каждого имени.

- диоксид хлора
- дибромид селена
- триоксид диазота
- Дайте правильную формулу для каждого имени.
- трифторид йода
- триоксид ксенона
- декафторид дисеры
- Дайте правильную формулу для каждого имени.
- германия двуокись
- сероуглерод
- диселения дибромид
- не молекула
- молекула; всего четыре атома
- молекула; всего четыре атома
- не молекула
- CO представляет собой соединение углерода и кислорода; Co — элемент кобальт.
- H 2 , O 2 , N 2 , F 2 , Cl 2 , Бр 2 , И 2
- фтор-
- трифторид фосфора
- дихлорид теллура
- триоксид диазота
- дифторид ксенона
- дифторид кислорода
- гексафторид серы
- монооксид диазота
- тетраоксид диазота
- пятиокись азота
- Н 2 О 5
- Б 4 С 3
- PCl 5
- О 2 Класс 2
- Н 2 С 3
- XEF 4
- ЕСЛИ 3
- ХеО 3
- С 2 Ж 10
Атрибуция СМИ
Рисунок 3. 3
3
- «Молекулярное искусство молекул S 8 и P 4 » Дэвида У. Болла © CC BY-NC-SA (Attribution NonCommercial ShareAlike)
Молекулы и химическая номенклатура | Введение в химию – 1-е канадское издание
Цели обучения
- Дать определение молекуле .
- Назовите простые молекулы по их формулам.
- Определите формулу молекулы по ее названию.
Есть много веществ, которые существуют в виде двух или более атомов, соединенных вместе настолько прочно, что ведут себя как одна частица. Эти многоатомные комбинации называются молекулами. Молекула – это наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества. В некоторых отношениях молекула похожа на атом. Однако молекула состоит из более чем одного атома.
Некоторые элементы существуют в природе в виде молекул. Например, водород и кислород существуют в виде двухатомных молекул. Другие элементы также существуют в природе в виде двухатомных молекул (см.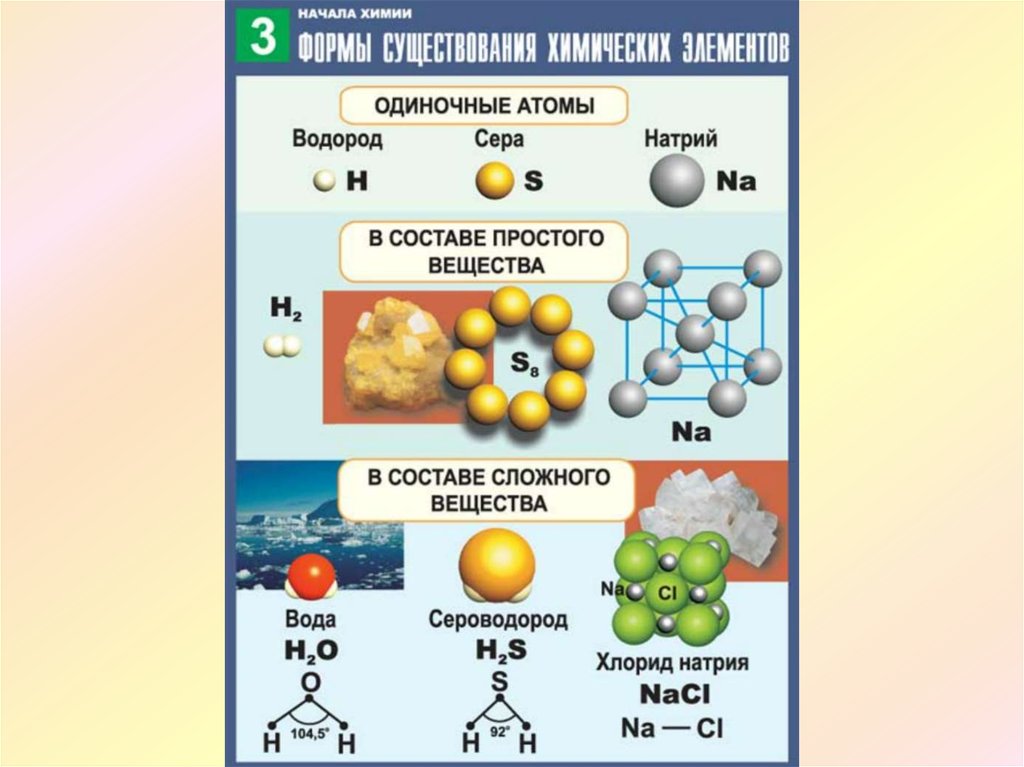 Таблицу 3.3 «Элементы, существующие в виде двухатомных молекул»). Как и в случае любой молекулы, эти элементы помечены молекулярной формулой, формальным списком того, что и сколько атомов входит в молекулу. (Иногда только слово используется формула , и ее значение выводится из контекста.) Например, молекулярная формула элементарного водорода H 2 , где H является символом водорода, а нижний индекс 2 означает, что существует два атома этого атома. элемент в молекуле. Аналогичные формулы имеют и другие двухатомные элементы: O 2 , N 2 и так далее. Другие элементы существуют в виде молекул, например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем считать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле присутствует только один атом, если справа от символа элемента нет числового нижнего индекса.
Таблицу 3.3 «Элементы, существующие в виде двухатомных молекул»). Как и в случае любой молекулы, эти элементы помечены молекулярной формулой, формальным списком того, что и сколько атомов входит в молекулу. (Иногда только слово используется формула , и ее значение выводится из контекста.) Например, молекулярная формула элементарного водорода H 2 , где H является символом водорода, а нижний индекс 2 означает, что существует два атома этого атома. элемент в молекуле. Аналогичные формулы имеют и другие двухатомные элементы: O 2 , N 2 и так далее. Другие элементы существуют в виде молекул, например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем считать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле присутствует только один атом, если справа от символа элемента нет числового нижнего индекса.
Таблица 3.3 Элементы, существующие в виде двухатомных молекул
| Водород |
| Кислород |
| Азот |
| Фтор |
| Хлор |
| Бром |
| Йод |
Рисунок 3.3 Молекулярное изображение молекул S 8 и P 4
Если каждый зеленый шарик представляет атом серы, то диаграмма слева представляет молекулу S 8 . Молекула справа показывает, что существует одна форма элементарного фосфора в виде четырехатомной молекулы.
На рис. 3.3 «Молекулярное искусство S» показаны два примера того, как мы будем представлять молекулы в этом тексте. Атом представлен маленьким шариком или сферой, что обычно указывает, где в молекуле находится ядро. Цилиндрическая линия, соединяющая шары, представляет собой связь между атомами, которые делают этот набор атомов молекулой. Это соединение называется химической связью. В главе 9«Химические связи», мы будем исследовать происхождение химических связей. В этой книге вы встретите и другие примеры такого представления молекул в виде «шара и цилиндра».
В главе 9«Химические связи», мы будем исследовать происхождение химических связей. В этой книге вы встретите и другие примеры такого представления молекул в виде «шара и цилиндра».
Многие соединения существуют в виде молекул. В частности, когда неметаллы соединяются с другими неметаллами, соединение обычно существует в виде молекул. (Соединения между металлом и неметаллом различны и будут рассмотрены в разделе 3.4 «Ионы и ионные соединения».) молекулы с различными химическими и физическими свойствами. Как мы их различаем?
Ответом является очень специфическая система наименования соединений, называемая химической номенклатурой. Следуя правилам номенклатуры, каждое соединение имеет свое собственное уникальное имя, и каждое название относится к одному и только одному соединению. Здесь мы начнем с относительно простых молекул, содержащих только два элемента, так называемых бинарных соединений :
- Определите элементы в молекуле по ее формуле. Вот почему вам необходимо знать названия и символы элементов в Таблице 3.
 2 «Названия и символы общих элементов».
2 «Названия и символы общих элементов». Начинайте имя с имени первого элемента. Если в молекулярной формуле имеется более одного атома этого элемента, используйте числовой префикс для обозначения количества атомов, как указано в Таблице 3.4 «Цифровые префиксы, используемые при наименовании молекулярных соединений». Не используйте префикс моно-, если имеется только один атом первого элемента.
Таблица 3.4 Числовые префиксы, используемые в названиях молекулярных соединений
Число атомов элемента Префикс 1 моно- 2 ди- 3 три- 4 тетра- 5 пента- 6 гекса- 7 гепта- 8 окта- 9 нон- 10 дека- Назовите второй элемент, используя три части:
- числовой префикс, указывающий количество атомов второго элемента, плюс
- основа названия элемента (например, ox для кислорода, chlor для хлора и т.
 д.), плюс
д.), плюс - суффикс -ide .
- Соедините два слова, оставив между ними пробел.
Давайте посмотрим, как эти шаги работают для молекулы, молекулярная формула которой SO 2 , который имеет один атом серы и два атома кислорода — это завершает шаг 1. Согласно шагу 2 мы начинаем с названия первого элемента — сера. Помните, мы не используем префикс mono- для первого элемента. Теперь для шага 3 мы объединяем числовой префикс ди- (см. Таблицу 3.4 «Числовые префиксы, используемые в названиях молекулярных соединений») с основой ox- и суффиксом -ide , чтобы получить диоксид . Объединив эти два слова, мы получили уникальное название этого соединения — двуокись серы.
К чему все эти проблемы? Существует еще одно распространенное соединение, состоящее из серы и кислорода, молекулярная формула которого SO 3 , поэтому соединения необходимо различать. SO 3 содержит три атома кислорода, поэтому это другое соединение с другими химическими и физическими свойствами.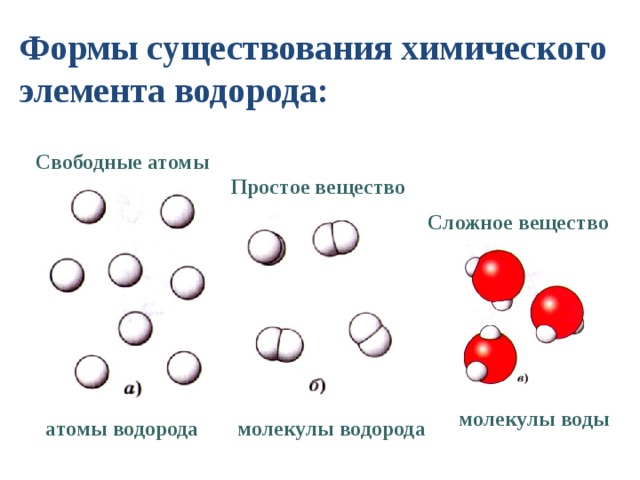 Система химической номенклатуры разработана таким образом, чтобы присвоило этому соединению собственное уникальное название . Название его, если пройти все этапы, триоксид серы. Разные соединения имеют разные названия.
Система химической номенклатуры разработана таким образом, чтобы присвоило этому соединению собственное уникальное название . Название его, если пройти все этапы, триоксид серы. Разные соединения имеют разные названия.
В некоторых случаях, когда префикс заканчивается на на или на , а имя элемента начинается на на , мы опускаем на или на в префиксе. Таким образом, мы видим монооксид или пентаоксид , а не монооксид или пентаоксид в названиях молекул.
Отличительной чертой этой системы является то, что она работает в обоих направлениях. По названию соединения можно определить его молекулярную формулу. Просто перечислите символы элемента с числовым нижним индексом, если имеется более одного атома этого элемента, в порядке имени (мы не используем нижний индекс 1, если присутствует только один атом элемента; 1 подразумевается) . От имени трихлорид азота , вы сможете получить NCl 3 в качестве формулы для этой молекулы.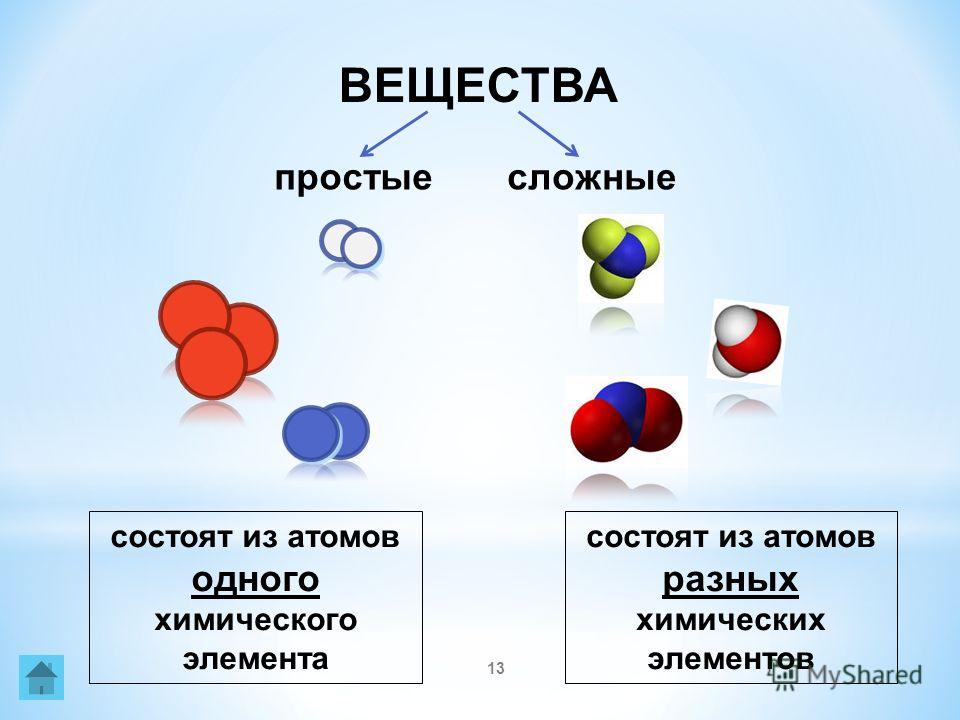 Из названия пятиокись дифосфора можно получить формулу P 2 O 5 (обратите внимание на числовой префикс перед первым элементом, указывающий на то, что в формуле присутствует более одного атома фосфора).
Из названия пятиокись дифосфора можно получить формулу P 2 O 5 (обратите внимание на числовой префикс перед первым элементом, указывающий на то, что в формуле присутствует более одного атома фосфора).
Пример 3
Назовите каждую молекулу.
- ПФ 3
- СО
- Се 2 Бр 2
Раствор
- Молекула с одним атомом фосфора и тремя атомами фтора называется трифторидом фосфора.
- Соединение с одним атомом углерода и одним атомом кислорода правильно называется монооксидом углерода, а не монооксидом углерода.
- Есть два атома каждого элемента, селена и брома. По правилам имя собственное здесь диселения дибромид .
Проверь себя
Назовите каждую молекулу.
- СФ 4
- П 2 С 5
Ответы
- тетрафторид серы
- пентасульфид дифосфора
Пример 4
Приведите формулу каждой молекулы.
- четыреххлористый углерод
- диоксид кремния
- тетранитрид трикремния
Раствор
- Наименование Четыреххлористый углерод подразумевает один атом углерода и четыре атома хлора, поэтому формула CCl 4 .
- Название диоксид кремния подразумевает один атом кремния и два атома кислорода, поэтому формула SiO 2 .
- У нас есть имя с числовыми префиксами в обоих элементах. Три- означает три, а тетра- означает четыре, поэтому формула этого соединения Si 3 N 4 .
Проверь себя
Назовите формулу каждой молекулы.
- дифторид серы
- пентабромид йода
Ответы
- S 2 F 2
- ИБр 5
Некоторые простые молекулы имеют общие названия, которые мы используем как часть формальной системы химической номенклатуры. Например, H 2 O получает название вода , а не монооксид дигидрогена . NH 3 называется аммиак , а CH 4 называется метан . Время от времени мы будем видеть другие молекулы, имеющие общие названия; мы будем указывать на них по мере их возникновения.
Например, H 2 O получает название вода , а не монооксид дигидрогена . NH 3 называется аммиак , а CH 4 называется метан . Время от времени мы будем видеть другие молекулы, имеющие общие названия; мы будем указывать на них по мере их возникновения.
Ключевые выводы
- Молекулы — это группы атомов, которые ведут себя как единое целое.
- Некоторые элементы существуют в виде молекул: водород, кислород, сера и так далее.
- Существуют правила, которые могут выражать уникальное имя для любой заданной молекулы и уникальную формулу для любого заданного имени.
Упражнения
Какие из этих формул представляют собой молекулы? Укажите, сколько атомов содержится в каждой молекуле.
a) Fe
b) PCl 3
c) P 4
d) Ar
2 из этих формул. Укажите, сколько атомов содержится в каждой молекуле.
a) I 2
b) He
c) H 2 O
d) Al
3. В чем разница между CO и Co?
4. В чем разница между H 2 O и H 2 O 2 (перекись водорода)?
5. Приведите соответствующую формулу для каждого двухатомного элемента.
6. В 1986 году, когда комета Галлея в последний раз прошла мимо Земли, астрономы обнаружили в своих телескопах присутствие S 2 . Почему серу не считают двухатомным элементом?
7. Какая основа слова фтор используется в названиях молекул? CF 4 является одним из примеров.
8. Какая основа слова селен используется в названиях молекул? Например, SiSe 2 .
9. Дайте правильное название каждой молекуле.
A) PF 3
B) TECL 2
C) N 2 O 3
10. Дайте правильное название для каждой молекулы.
a) NO
b) CS 2
c) As 2 O 3
11. Дайте имя собственное для каждой молекулы.
A) XEF 2
B) O 2 F 2
C) SF 6
12. Дайте правильное название для каждой молекулы.
а) П 4 О 10
б) В 2 О 3
в) П 2 S 3
13. Дайте правильное название каждой молекуле.
A) N 2 O
B) N 2 O 4
C) N 2 O 5
14. Дайте правильное название для каждой молекулы. 15.
а) пятиокись азота
b) трикарбид тетрабора
c) пятихлористый фосфор
16. Укажите правильную формулу для каждого названия.
а) трийодид азота
б) трисульфид димышьяка
в) трихлорид йода
17. Приведите соответствующую формулу для каждого названия.
Приведите соответствующую формулу для каждого названия.
а) дихлорид кислорода
б) трисульфид диазота
в) тетрафторид ксенона
18. Приведите соответствующую формулу для каждого названия.
а) диоксид хлора
б) дибромид селена
в) триоксид азота
19. Приведите соответствующую формулу для каждого названия.
а) трифторид йода
б) триоксид ксенона
в) декафторид дисеры
20. Приведите соответствующую формулу для каждого названия.
а) германия двуокись
б) сероуглерод
в) диселена дибромид
Ответы
1.
а) не молекула
б) молекула; всего четыре атома
c) молекула; всего четыре атома
d) не является молекулой
3.
CO представляет собой соединение углерода и кислорода; Co — элемент кобальт.
5.
H 2 , O 2 , N 2 , F 2 , CL 2 , BR 2 , I 2 7713771951595159515951595515151515151515151515151515151515151515151515151515151515151515151371515157151518715151518715151518715151518715151515151515137113771951519219813771377179тели .

 1)
1) 5)
5)
 10)
10)


 6 «Числовые префиксы, используемые при наименовании молекулярных соединений». Не используйте префикс моно-, если имеется только один атом первого элемента.
6 «Числовые префиксы, используемые при наименовании молекулярных соединений». Не используйте префикс моно-, если имеется только один атом первого элемента.  д.), плюс
д.), плюс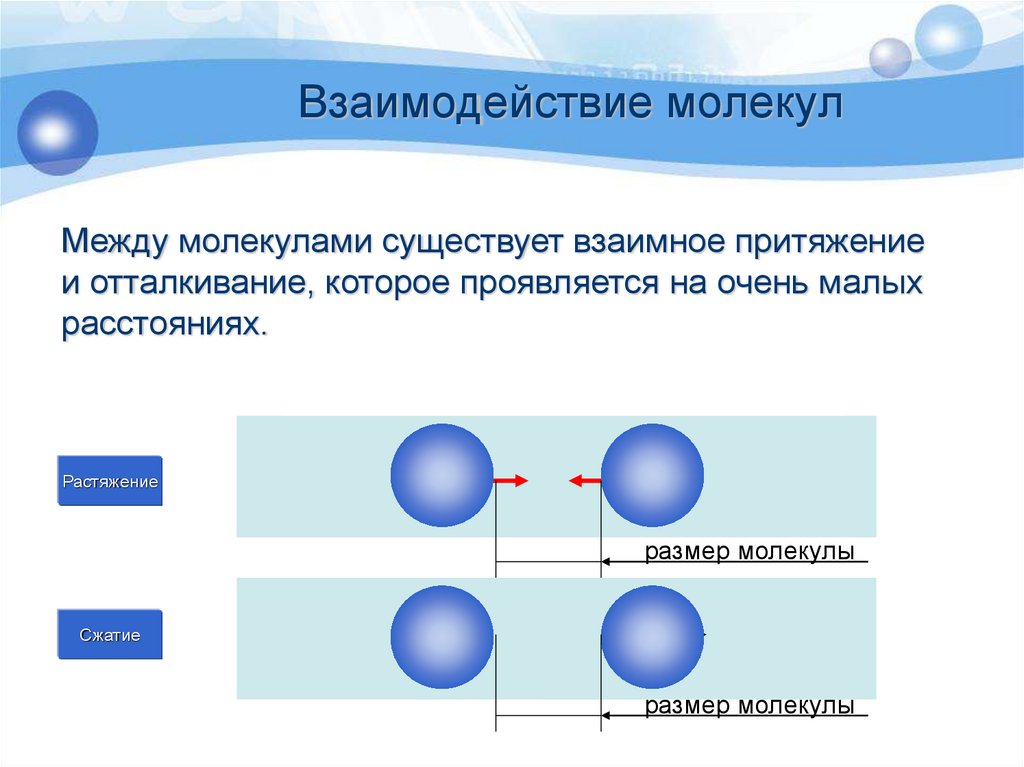

 2 «Названия и символы общих элементов».
2 «Названия и символы общих элементов». д.), плюс
д.), плюс