Содержание
Углерод: формула, химические свойства, характеристики
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).

Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
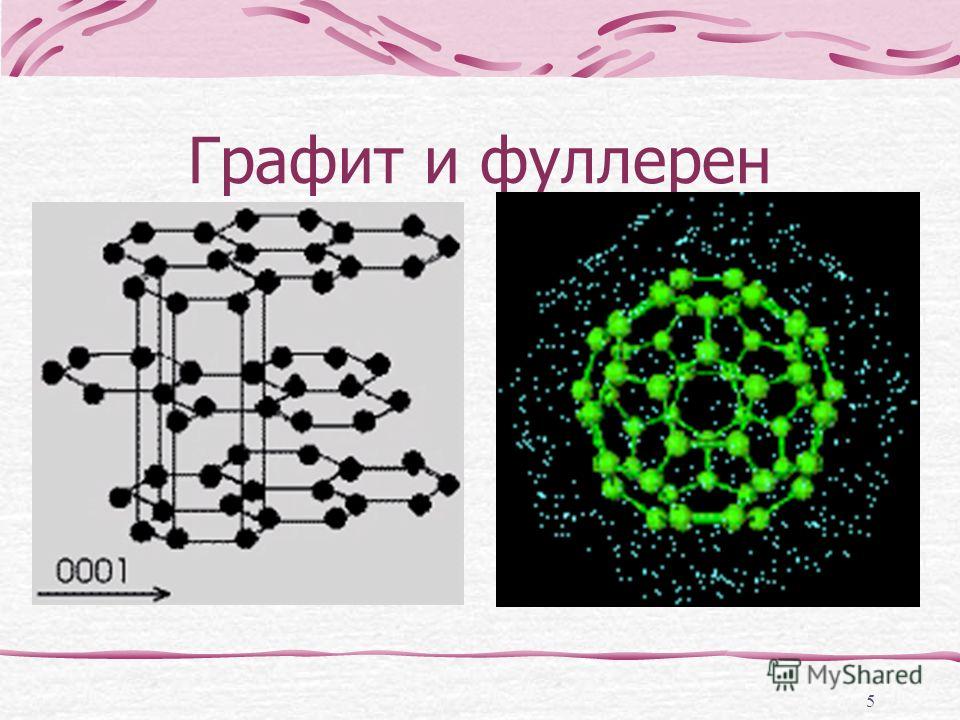
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
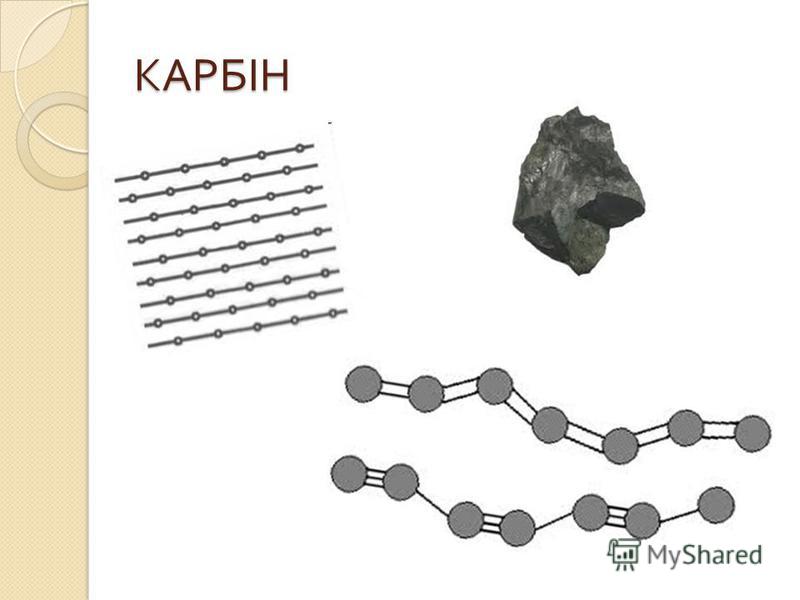
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.

Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Карбин формула.
 Α-карбин и β-карбин. Карбин в медицине
Α-карбин и β-карбин. Карбин в медицине
Кумулированной =С=С=С=С= связью. Может быть линейным или образовывать циклические структуры.
Энциклопедичный YouTube
Субтитры
Физические свойства
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода , уложенных параллельно друг другу. Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полииновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками Ю.П.Кудрявцевым, А.М.Сладковым,В.И.Касаточкиным и В. В. Коршаком в начале 60-х гг в Академии наук СССР (ИНЭОС) . Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах .
Предыстория открытия
Вопрос о возможности существования форм углерода с sp-гибридизацией атомов неоднократно рассматривался теоретически. Ещё в 1885 году немецкий химик Адольф Байер пытался синтезировать цепочечный углерод из производных ацетилена ступенчатым методом. Однако попытка Байера получить полиин
(соединение, содержащие в молекуле не менее трех изолированных или сопряженных связей С≡С) оказалась неудачной, он получил углеводород , состоящий из четырех молекул ацетилена, соединенных в цепочку, и оказавшийся чрезвычайно неустойчивым. Неустойчивость низших полиинов послужила Байеру основанием для создания теории напряжения, в которой он постулировал невозможность получения цепочечного углерода. Авторитет ученого охладил интерес исследователей к синтезу полиинов, и работы в этом направлении надолго прекратились.
Одномерная (линейная) форма углерода долгое время оставалась недостающим звеном в аллотропии углерода. Важным стимулом для возобновления работ в этой области явилось открытие в 1930-е годы представителей полиацетиленового ряда в природе. В некоторых растениях и низших грибах были обнаружены соединения полиинового ряда, содержащие до пяти сопряженных ацетиленовых группировок. Одними из первых, кто решился бросить вызов авторитету предшественников, стали химики лаборатории высокомолекулярных соединений ИНЭОС Алексей Михайлович Сладков, Юрий Павлович Кудрявцев . Проведённая ими работа привела к открытию новой линейной аллотропной формы углерода.
В некоторых растениях и низших грибах были обнаружены соединения полиинового ряда, содержащие до пяти сопряженных ацетиленовых группировок. Одними из первых, кто решился бросить вызов авторитету предшественников, стали химики лаборатории высокомолекулярных соединений ИНЭОС Алексей Михайлович Сладков, Юрий Павлович Кудрявцев . Проведённая ими работа привела к открытию новой линейной аллотропной формы углерода.
В 1959–1960 годах в лаборатории высокомолекулярных соединений ИНЭОС, возглавляемой академиком Коршаком, проводились систематические исследования реакции окислительного сочетания диацетиленовых соединений. Было установлено, что в присутствии солей двухвалентной меди эта реакция может быть проведена с любыми диацетиленовыми соединениями с образованием полимеров , элементарное звено которых сохраняет углеродный скелет исходного диацетилена. При этом сначала образуются полимерные полиацетилениды Cu(I). Этот вариант реакции окислительного сочетания был назван окислительной дегидрополиконденсацией. Ученые предположили, что в качестве мономера для такой поликонденсации можно взять и ацетилен. Действительно, при пропускании ацетилена в водно-аммиачный раствор соли Cu(II) быстро выпадал черный осадок. Именно этот путь привёл А.М.Сладкова, Ю.П.Кудрявцева, В.В.Коршака, и В.И.Касаточкина к открытию линейной формы углерода, назвали «карбин
Ученые предположили, что в качестве мономера для такой поликонденсации можно взять и ацетилен. Действительно, при пропускании ацетилена в водно-аммиачный раствор соли Cu(II) быстро выпадал черный осадок. Именно этот путь привёл А.М.Сладкова, Ю.П.Кудрявцева, В.В.Коршака, и В.И.Касаточкина к открытию линейной формы углерода, назвали «карбин
».
По словам первооткрывателей карбина, самым сложным для них было определить, какими же связями соединены в цепочку углеродные атомы. Это могли быть чередующиеся одинарные и тройные связи (–С≡С–С≡С–), только двойные связи (=С=С=С=С=), или и те, и другие одновременно. Лишь через несколько лет удалось доказать, что в полученном карбине двойных связей нет. Подтверждением полиинового строения цепочек послужило образование щавелевой кислоты при озонировании карбина.
Однако теория допускала существование и углеродного линейного полимера только с двойными связями, который и был получен в 1968 году В.П.Непочатых: встречный синтез (восстановлением полимерного гликоля) привёл к образованию линейного полимера углерода с кумуленовыми связями, который назвали поликумуленом.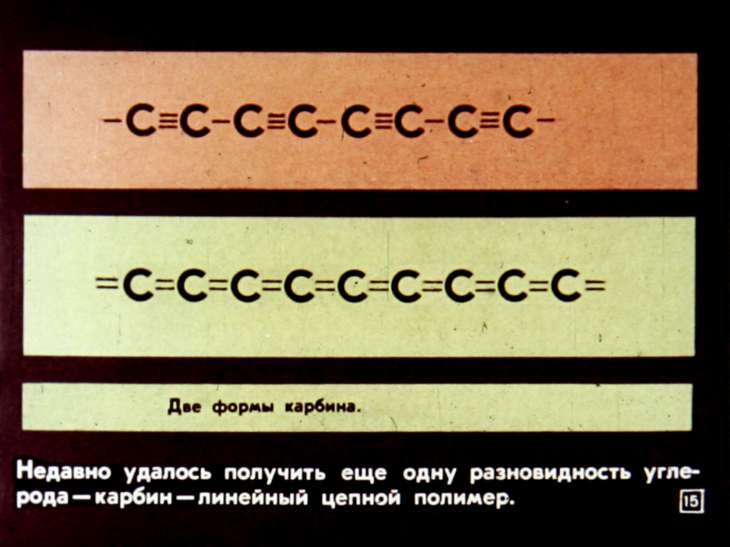 Доказательством наличия двойных связей в полученном веществе стал тот факт, что при озонировании поликумулена получается только диоксид углерода .
Доказательством наличия двойных связей в полученном веществе стал тот факт, что при озонировании поликумулена получается только диоксид углерода .
Итак, были получены две формы линейного углерода: полииновая (–С≡С–) n , или α-карбин, и поликумуленовая (=С=С=) n , или β-карбин. Авторами открытия было проведено детальное исследование структуры карбина различными методами, изучены его термодинамические и электрофизические свойства.
Известно несколько сообщений о находках карбиносодержащих углеродных веществ, сделанных А.Г.Виттакером в цейлонском графите и графите различных штатов США, В.И.Касаточкиным в природном алмазе, Ф.Дж.Рейтингером в графите Шри-Ланки, Г.В.Вдовыкиным в метеорите.
Детальные способы получения, физические и химические свойства карбина и его применения описаны в ряде работ Ю.П.Кудрявцева, С.Е.Евсюкова, М.Б.Гусевой,В.П.Бабаева, Т.Г.Шумиловой .
Структура карбина
По мнению некоторых исследователей, однозначных и строгих доказательств индивидуальности карбина и его строения до сих пор не получено, другие же авторы, наоборот, считают, что такие доказательства имеются. Дискуссия по поводу существования карбина во многом обусловлена тем, что диагностика его имеет ряд технических сложностей, поскольку при использовании высокоэнергетических методов возможен переход карбина в другие формы углерода. К тому же представления о структуре карбина долгое время отличались несовершенством. Авторы открытия карбина предложили модель его кристаллической структуры в виде совокупности цепочек кумуленового или полиинового типа, упакованных в кристаллы за счет вандерваальсовых сил . Цепочки полагались прямолинейными, поскольку каждый атом углерода находится в состоянии sp-гибридизации.
Дискуссия по поводу существования карбина во многом обусловлена тем, что диагностика его имеет ряд технических сложностей, поскольку при использовании высокоэнергетических методов возможен переход карбина в другие формы углерода. К тому же представления о структуре карбина долгое время отличались несовершенством. Авторы открытия карбина предложили модель его кристаллической структуры в виде совокупности цепочек кумуленового или полиинового типа, упакованных в кристаллы за счет вандерваальсовых сил . Цепочки полагались прямолинейными, поскольку каждый атом углерода находится в состоянии sp-гибридизации.
Действительно, к настоящему времени установлено, что структуру карбина образуют атомы углерода, собранные в цепочки двойными связями (β-карбин) или чередующимися одинарными и тройными связями (α-карбин). Полимерные цепочки имеют химически активные концы (т. е. несут локализованный отрицательный заряд) и изгибы с цепочечными вакансиями, в местах которых цепочки соединяются между собой за счет перекрывания π-орбиталей атомов углерода.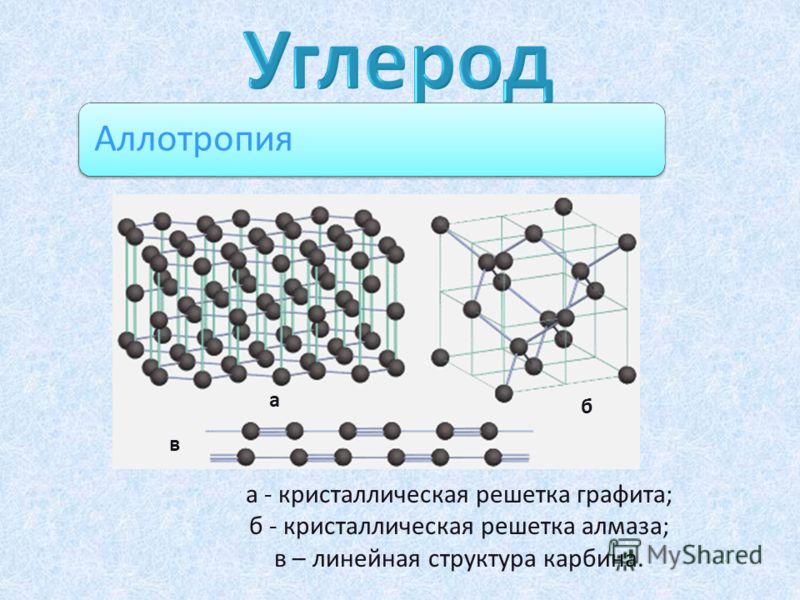 Важное значение для образования сшивок имеет присутствие таких примесей металлов, как железо , калий . Убедительное свидетельство наличия зигзагов в линейной углеродной цепочке было получено в теоретической работе Коршака: результаты его расчета хорошо согласуются с ИК-спектром карбина.
Важное значение для образования сшивок имеет присутствие таких примесей металлов, как железо , калий . Убедительное свидетельство наличия зигзагов в линейной углеродной цепочке было получено в теоретической работе Коршака: результаты его расчета хорошо согласуются с ИК-спектром карбина.
На основании результатов дальнейших исследований структуры кристаллического карбина была предложена модель его элементарной ячейки. Согласно этой модели элементарная ячейка карбина составлена параллельными цепочками углерода, имеющими зигзаги, благодаря которым ячейка оказывается двуслойной. Толщину одного слоя составляет цепочка из шести атомов углерода. В нижнем слое цепочки плотно упакованы и расположены в центре и по углам гексагона , тогда как в верхнем слое центральная цепочка отсутствует, а в образовавшейся вакансии могут располагаться атомы примеси. Возможно, что они являются катализаторами кристаллизации карбина. Такая модель дает ключ к раскрытию феномена карбина и объясняет, в какой конфигурации может стабилизироваться в общем случае неустойчивая совокупность линейных цепочек углерода.
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Изотопы углерода
Природный углерод состоит из двух стабильных изотопов — 12 С (98,93 %) и 13 С (1,07 %) и одного радиоактивного изотопа 14 С (β-излучатель, Т ½ = 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14 N (n, p) 14 C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14 С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
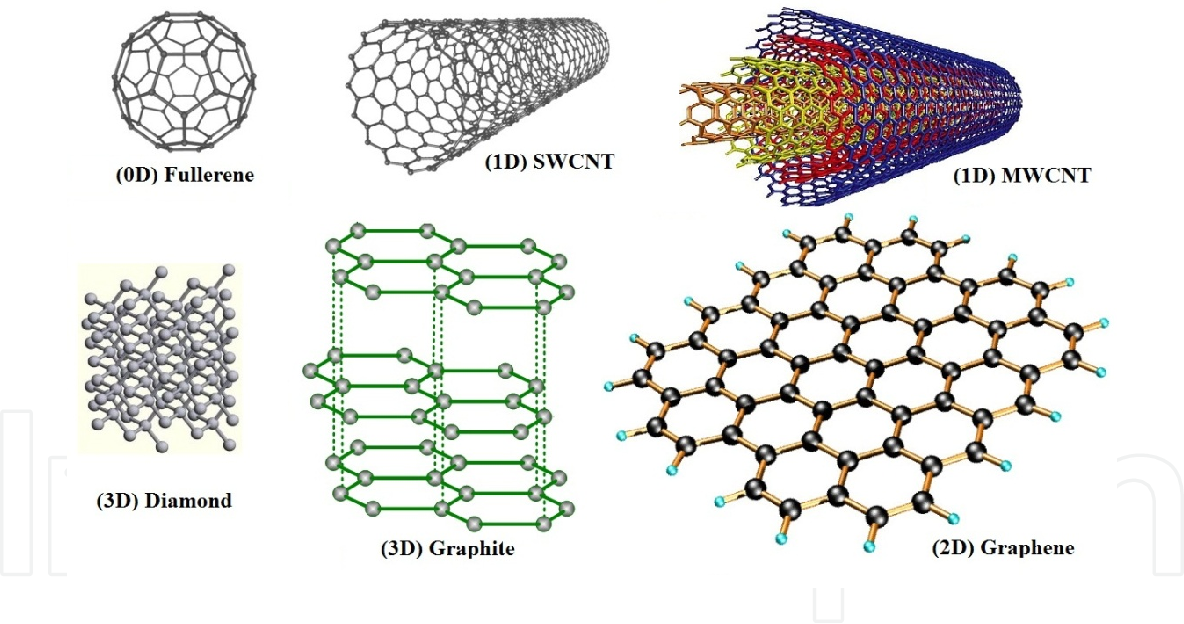
Аллотропные модификации углерода
Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит, d: фуллерен — бакибол C 60 , e: фуллерен C 540 , f: фуллерен C 70, g: аморфный углерод, h: углеродная нанотрубка
Кристаллический углерод
· Алмаз, Графен, Графит, Карбин, Лонсдейлит, Наноалмаз, Фуллерены, Фуллерит, Углеродное волокно, Углеродные нановолокна, Углеродные нанотрубки
Аморфный углерод
· Активированный уголь, Древесный уголь, Ископаемый уголь: антрацит, Кокс каменноугольный, нефтяной, Стеклоуглерод, Техуглерод, Сажа, Углеродная нанопена
На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Кластерные формы
· Астралены
· Диуглерод
Структура
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
· тетраэдрическая, образуется при смешении одного s- и трех p-электронов (sp 3 -гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
· тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp 2 -гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами.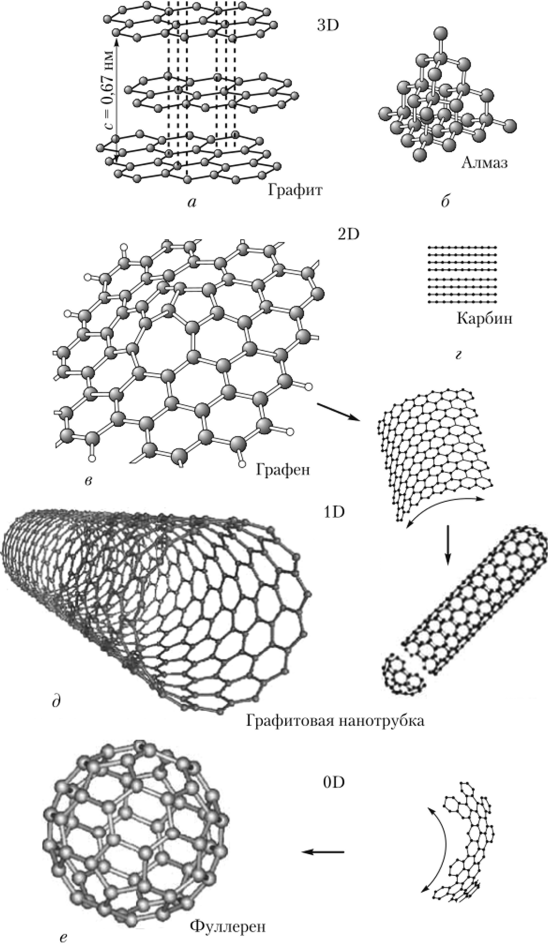 Такая геометрия углерода характерна для графита, фенола и др.
Такая геометрия углерода характерна для графита, фенола и др.
· дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формыметастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. ΔН 0 перехода — 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3 780 K. Жидкий углерод существует только при определенном внешнем давлении. Тройные точки: графит-жидкость-пар Т = 4130 K, р = 10,7 МПа. Прямой переход графита в алмаз происходит при 3000 K и давлении 11-12 ГПа.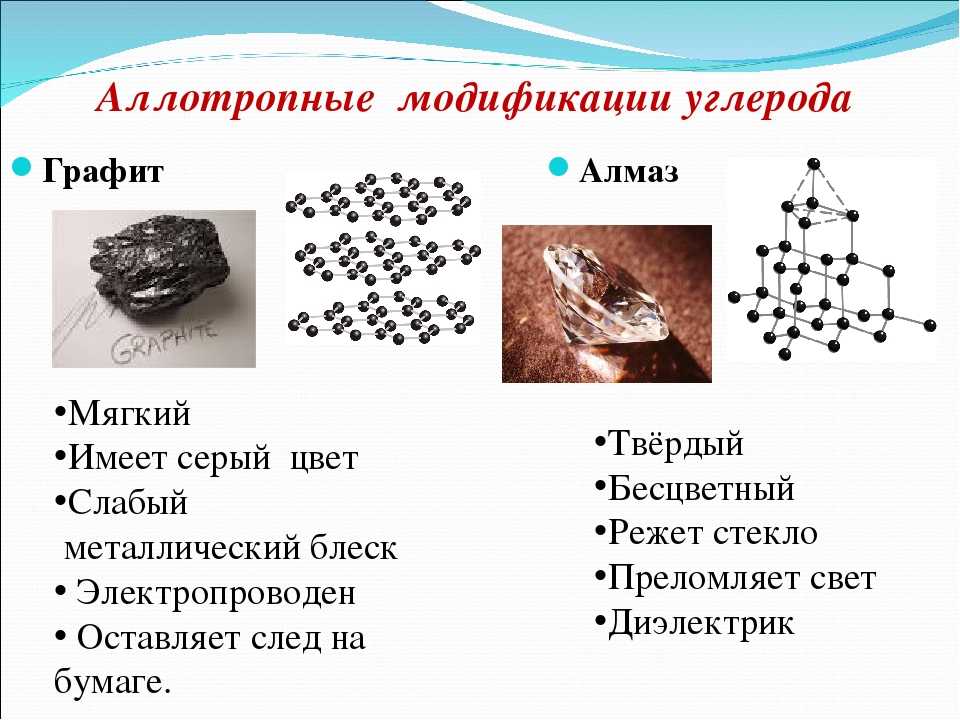
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (-C≡C-), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68-3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl 4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР . Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР . Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Свойства
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода , уложенных параллельно друг другу. Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полииновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком , А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в Академии наук СССР (ИНЭОС) . Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах .
в Академии наук СССР (ИНЭОС) . Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах .
Предыстория открытия
Вопрос о возможности существования форм углерода с sp-гибридизацией атомов неоднократно рассматривался теоретически. Ещё в 1885 году немецкий химик Адольф Байер пытался синтезировать цепочечный углерод из производных ацетилена ступенчатым методом. Однако попытка Байера получить полиин
(соединение, содержащие в молекуле не менее трех изолированных или сопряженных связей С≡С) оказалась неудачной, он получил углеводород , состоящий из четырех молекул ацетилена, соединенных в цепочку, и оказавшийся чрезвычайно неустойчивым. Неустойчивость низших полиинов послужила Байеру основанием для создания теории напряжения, в которой он постулировал невозможность получения цепочечного углерода. Авторитет ученого охладил интерес исследователей к синтезу полиинов, и работы в этом направлении надолго прекратились.
Одномерная (линейная) форма углерода долгое время оставалась недостающим звеном в аллотропии углерода. Важным стимулом для возобновления работ в этой области явилось открытие в 1930-е годы представителей полиацетиленового ряда в природе. В некоторых растениях и низших грибах были обнаружены соединения полиинового ряда, содержащие до пяти сопряженных ацетиленовых группировок. Одними из первых, кто решился бросить вызов авторитету предшественников, стали заведующий лабораторией высокомолекулярных соединений ИНЭОС Василий Владимирович Коршак и Алексей Михайлович Сладков. Проведённая ими работа привела к открытию новой линейной аллотропной формы углерода.
В 1959–1960 годах в лаборатории высокомолекулярных соединений ИНЭОС, возглавляемой академиком Коршаком, проводились систематические исследования реакции окислительного сочетания диацетиленовых соединений. Было установлено, что в присутствии солей двухвалентной меди эта реакция может быть проведена с любыми диацетиленовыми соединениями с образованием полимеров , элементарное звено которых сохраняет углеродный скелет исходного диацетилена. При этом сначала образуются полимерные полиацетилениды Cu(I). Этот вариант реакции окислительного сочетания был назван окислительной дегидрополиконденсацией. Ученые предположили, что в качестве мономера для такой поликонденсации можно взять и ацетилен. Действительно, при пропускании ацетилена в водно-аммиачный раствор соли Cu(II) быстро выпадал черный осадок. Именно этот путь привёл А.М.Сладкова, В.В.Коршака, В.И.Касаточкина и Ю.П.Кудрявцева к открытию линейной формы углерода, которую они, по предложению Сладкова, назвали «карбин
При этом сначала образуются полимерные полиацетилениды Cu(I). Этот вариант реакции окислительного сочетания был назван окислительной дегидрополиконденсацией. Ученые предположили, что в качестве мономера для такой поликонденсации можно взять и ацетилен. Действительно, при пропускании ацетилена в водно-аммиачный раствор соли Cu(II) быстро выпадал черный осадок. Именно этот путь привёл А.М.Сладкова, В.В.Коршака, В.И.Касаточкина и Ю.П.Кудрявцева к открытию линейной формы углерода, которую они, по предложению Сладкова, назвали «карбин
».
По словам первооткрывателей карбина, самым сложным для них было определить, какими же связями соединены в цепочку углеродные атомы. Это могли быть чередующиеся одинарные и тройные связи (–С≡С–С≡С–), только двойные связи (=С=С=С=С=), или и те, и другие одновременно. Лишь через несколько лет удалось доказать, что в полученном карбине двойных связей нет. Подтверждением полиинового строения цепочек послужило образование щавелевой кислоты при озонировании карбина.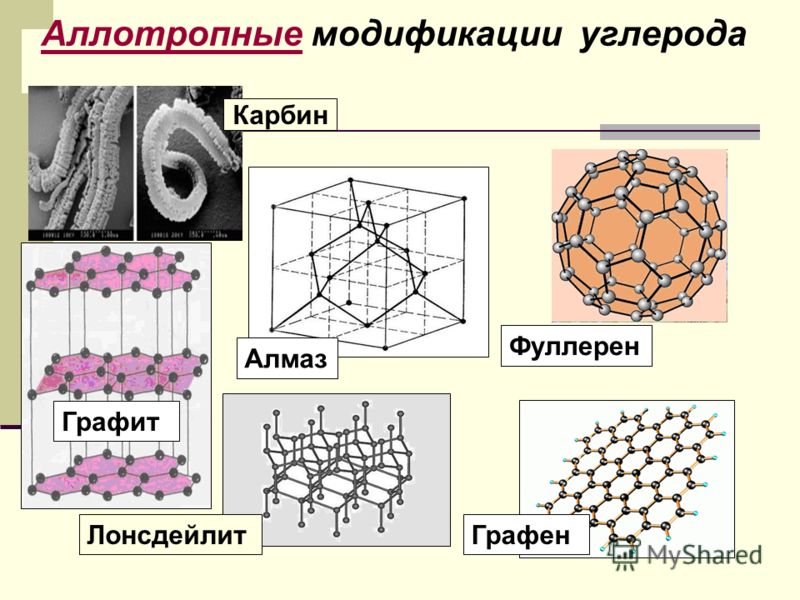
Однако теория допускала существование и углеродного линейного полимера только с двойными связями, который и был получен в 1968 году аспиранткой Сладкова В.П.Непочатых: встречный синтез (восстановлением полимерного гликоля) привёл к образованию линейного полимера углерода с кумуленовыми связями, который назвали поликумуленом. Доказательством наличия двойных связей в полученном веществе стал тот факт, что при озонировании поликумулена получается только диоксид углерода .
Итак, были получены две формы линейного углерода: полииновая (–С≡С–) n , или α-карбин, и поликумуленовая (=С=С=) n , или β-карбин. Авторами открытия было проведено детальное исследование структуры карбина различными методами, изучены его термодинамические и электрофизические свойства.
Структура на карбина
По мнению некоторых исследователей, однозначных и строгих доказательств индивидуальности карбина и его строения до сих пор не получено, другие же авторы, наоборот, считают, что такие доказательства имеются. Дискуссия по поводу существования карбина во многом обусловлена тем, что диагностика его имеет ряд технических сложностей, поскольку при использовании высокоэнергетических методов возможен переход карбина в другие формы углерода. К тому же представления о структуре карбина долгое время отличались несовершенством. Авторы открытия карбина предложили модель его кристаллической структуры в виде совокупности цепочек кумуленового или полиинового типа, упакованных в кристаллы за счет вандерваальсовых сил . Цепочки полагались прямолинейными, поскольку каждый атом углерода находится в состоянии sp-гибридизации.
Дискуссия по поводу существования карбина во многом обусловлена тем, что диагностика его имеет ряд технических сложностей, поскольку при использовании высокоэнергетических методов возможен переход карбина в другие формы углерода. К тому же представления о структуре карбина долгое время отличались несовершенством. Авторы открытия карбина предложили модель его кристаллической структуры в виде совокупности цепочек кумуленового или полиинового типа, упакованных в кристаллы за счет вандерваальсовых сил . Цепочки полагались прямолинейными, поскольку каждый атом углерода находится в состоянии sp-гибридизации.
Действительно, к настоящему времени установлено, что структуру карбина образуют атомы углерода, собранные в цепочки двойными связями (β-карбин) или чередующимися одинарными и тройными связями (α-карбин). Полимерные цепочки имеют химически активные концы (т. е. несут локализованный отрицательный заряд) и изгибы с цепочечными вакансиями, в местах которых цепочки соединяются между собой за счет перекрывания π-орбиталей атомов углерода. Важное значение для образования сшивок имеет присутствие таких примесей металлов, как железо , калий . Убедительное свидетельство наличия зигзагов в линейной углеродной цепочке было получено в теоретической работе Коршака: результаты его расчета хорошо согласуются с ИК-спектром карбина.
Важное значение для образования сшивок имеет присутствие таких примесей металлов, как железо , калий . Убедительное свидетельство наличия зигзагов в линейной углеродной цепочке было получено в теоретической работе Коршака: результаты его расчета хорошо согласуются с ИК-спектром карбина.
На основании результатов дальнейших исследований структуры кристаллического карбина была предложена модель его элементарной ячейки. Согласно этой модели элементарная ячейка карбина составлена параллельными цепочками углерода, имеющими зигзаги, благодаря которым ячейка оказывается двуслойной. Толщину одного слоя составляет цепочка из шести атомов углерода. В нижнем слое цепочки плотно упакованы и расположены в центре и по углам гексагона , тогда как в верхнем слое центральная цепочка отсутствует, а в образовавшейся вакансии могут располагаться атомы примеси. Возможно, что они являются катализаторами кристаллизации карбина. Такая модель дает ключ к раскрытию феномена карбина и объясняет, в какой конфигурации может стабилизироваться в общем случае неустойчивая совокупность линейных цепочек углерода.
См. также
Ссылки
- * В.І. Саранчук, В. В. Ошовський, Г. О. Власов. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2003. −204 с.
- Углерод Алексея Сладкова — история открытия карбина
- Сладков А. М., Кудрявцев Ю. П. Алмаз, графит, карбин — аллотропные формы углерода // Природа. 1969.№ 5. С.37-44.
Примечания
Wikimedia Foundation
.
2010
.
Синонимы
:
«Карбин» — это материал, созданный из атомов углерода, которые определённым путём собрали в цепочку. Созданная в лаборатории новая форма углерода – «Карбин», который можно было бы пощупать руками, учёные долго не признавали. Пока не обнаружили его в природе.
Учёные впервые обнаружили «Карбин» в кусочках некоторых метеоритов, только после этого он был признан как существующий материал.
После длительных экспериментов «Карбин» синтезировали в лаборатории, но это было такое мизерное количество, что основные свойства пришлось определять математическим методом.
Рассчитали, что прочность «Карбина» почти в 2 раза выше прочности «Графена» и выяснили, что молекулы «Карбина» не растягиваются, но при этом не теряют гибкости. Это химически неактивный материал. Добавляя молекулы определённых веществ к «Карбину» можно получать материалы совершенно с разными свойствами.
В данное время физические и химические свойства «Карбина» уже хорошо изучены. Начинается создание материалов с применением «Карбина» в промышленных объёмах, прочность которых в два раза прочнее «Графена». Эти материалы обладают хорошей адгезией и химически неактивны.
«Карбин» как и «Графен» имеет толщину в 1 атом. Это означает, что площадь поверхности по отношению к массе очень велика. А значит, его можно использовать при изготовлении аккумуляторных батарей и супперконденсаторов.
Кроме того, «Карбин» обладает целым рядом других свойств, позволяющих использовать его в электронике и медицине.
На основе электронных свойств учёные строят датчики газа, света и наличия жизни.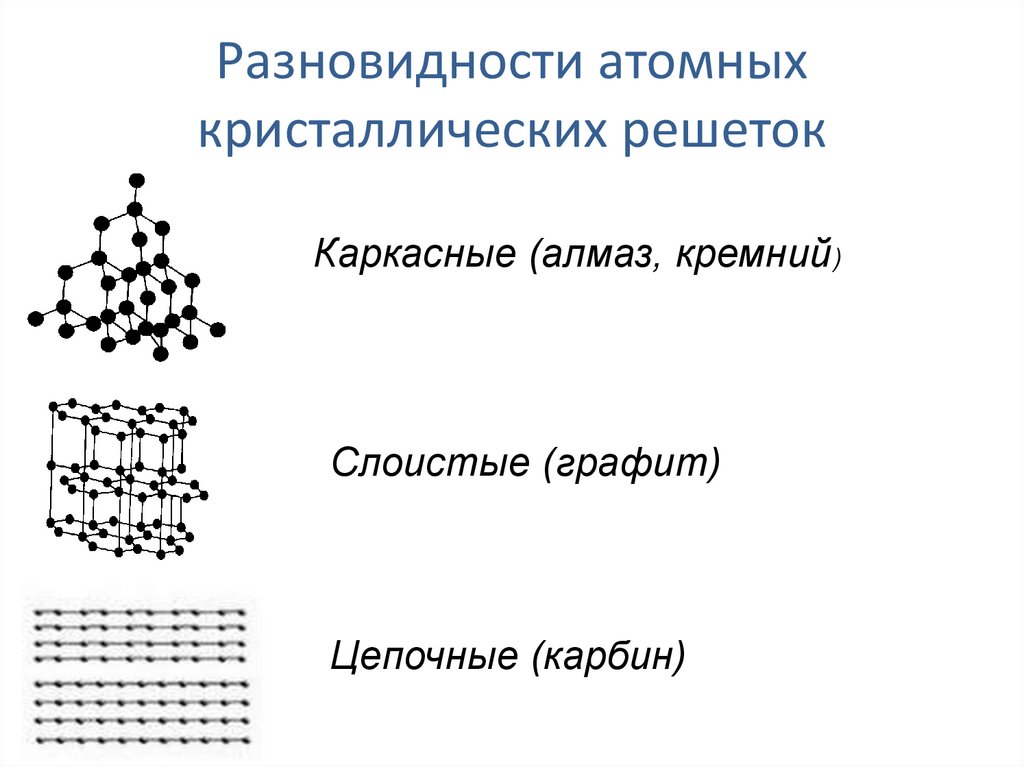 Институт продвинутых технологий Samsung работает над созданием гибкого дисплея, транзисторов и устройств хранения данных.
Институт продвинутых технологий Samsung работает над созданием гибкого дисплея, транзисторов и устройств хранения данных.
«Карбин» обладает высокой биологической совместимостью, поэтому его широко стали применять в медицине. С использованием «Карбина» были созданы протезы сосудов, шовные нити, покрытия для трущихся суставов. Его уже применяют в офтальмологии, урологии и стоматологии.
»
· Применение
· Токсическое действие
· Близкие статьи
· Комментарии
· Примечания
· Литература
· Официальный сайт
·
Схемы строения различных модификаций углерода
a
: алмаз, b
: графит, c
: лонсдейлит
d
: фуллерен — бакибол C 60 , e
: фуллерен C 540 , f
: фуллерен C 70
g
: аморфный углерод, h
: углеродная нанотрубка
Подробнее: Аллотропия углерода
Кристаллический углерод
- алмаз
- Графен
- графит
- Карбин
- лонсдейлит
- Наноалмаз
- Фуллерены
- Фуллерит
- Углеродное волокно
- Углеродные нановолокна
- Углеродные нанотрубки
Аморфный углерод
- Активированный уголь
- Древесный уголь
- Ископаемый уголь: антрацит и др.

- Кокс каменноугольный, нефтяной и др.
- Стеклоуглерод
- Техуглерод
- Углеродная нанопена
На практике, обычно, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Кластерные формы
- Астралены
- Диуглерод
- Углеродные наноконусы
Структура
Электронные орбитали атома углерода могут иметь различную геометрию, исходя из степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
- тетраэдрическая, образуется при смешении одного s- и трёх p-электронов (sp 3 -гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными -связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, к примеру, в метане и других углеводородах.

- тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp 2 -гибридизация). Атом углерода имеет три равноценные -связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости -связей, используется для образования -связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
- дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). Помимо этого два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают -связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — Карбин.
В 2010 году сотрудиники университета Ноттингема Стивен Лиддл и коллеги получили соединение (мономерный дилитио метандий), в котором четыре связи атома углерода находятся в одной плоскости. Ранее возможность «плоского углерода» была предсказана Паулем фон Шлейером для вещества , но оно не было синтезировано.
Графит и алмаз
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и прочие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. Н 0 перехода — 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3 780 K. Жидкий углерод существует только при определенном внешнем давлении. Тройные точки: графит-жидкость-пар Т = 4130 K, р
= 10,7 МПа. Прямой переход графита в алмаз происходит при 3000 K и давлении 11-12 ГПа.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15-20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решёткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р6 3 /mmc
), плотность 3,51 г/см, то есть такая же, как у алмаза.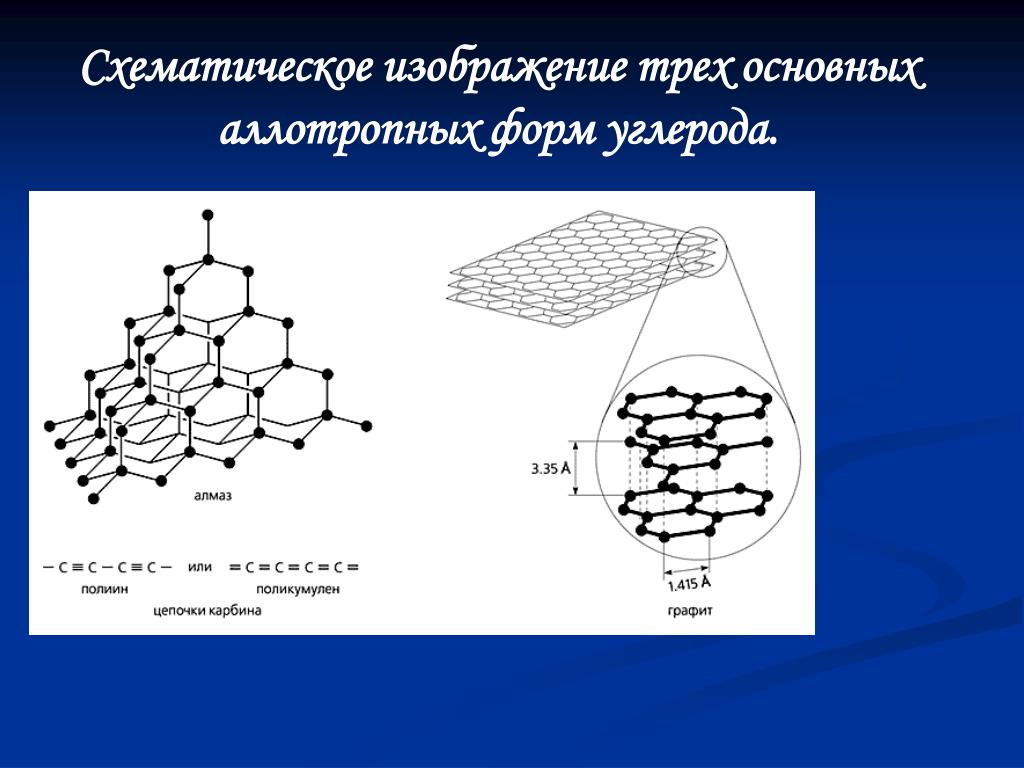 Лонсдейлит найден также в метеоритах.
Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е гг. в СССР было найдено, что в условиях динамической нагрузки углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). Сегодня всё чаще используется термин «наноалмазы». Размер частиц в таких материалах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ с значительным отрицательным кислородным балансом, к примеру смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется Карбин. Цепи имеют либо полиеновое строение (-CC-), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68-3,30 г/см). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl 4 в низкотемпературной плазме.
Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68-3,30 г/см). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl 4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Фуллерены и Углеродные нанотрубки
Углерод известен также в виде кластерных частиц С 60 , С 70 , C 80 , C 90 , C 100 и подобных (Фуллерены), и кроме этого графенов, нанотрубок и сложных структур — астраленов.
Аморфный углерод (строение)
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, Техуглерод, Сажа, активный уголь.
Графен
Подробнее: Графен
Графен (англ. graphene) — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp связей в гексагональную двумерную кристаллическую решётку.
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат.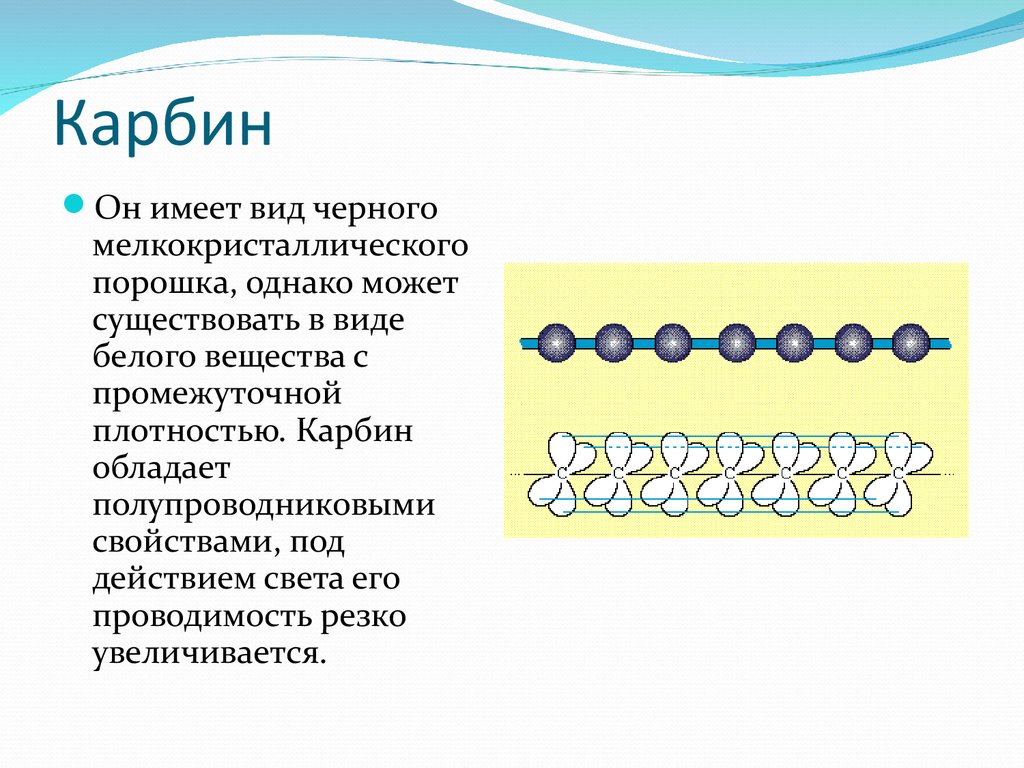 би – два) или двухэлементными.
би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.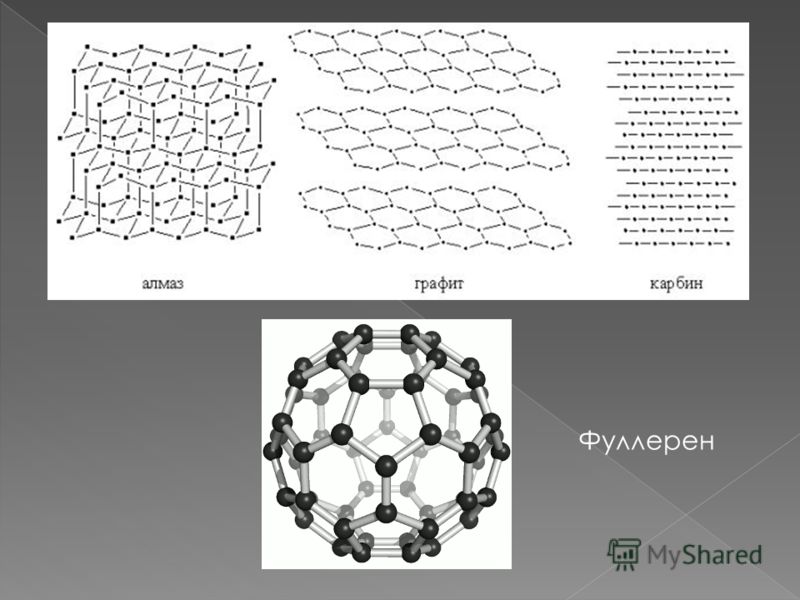
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.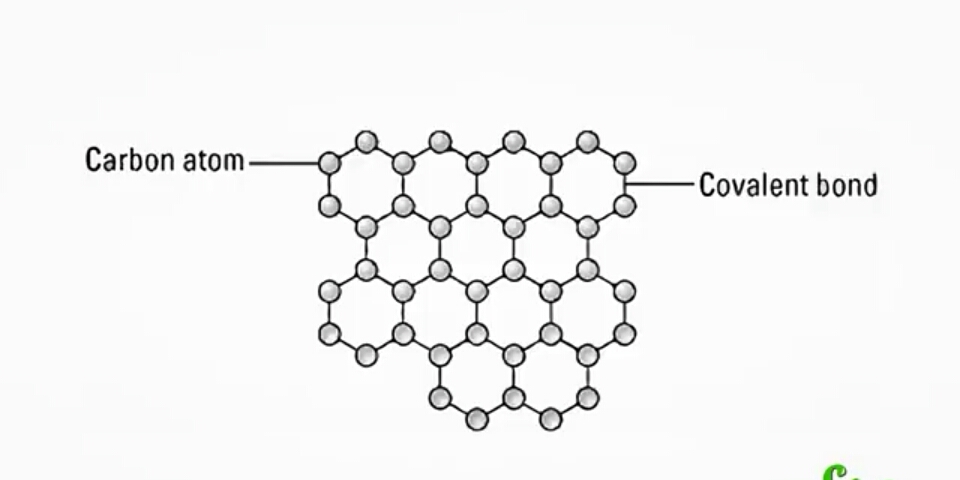
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
карбен | химия | Британика
карбен
См. все материалы
- Связанные темы:
- Карбен Шрока
карбен Фишера
См. всю связанную информацию →
карбен , любой член класса высокореактивных молекул, содержащих двухвалентные атомы углерода, то есть атомы углерода, которые используют только две из четырех связей, которые они способны образовывать с другими атомами. Встречаясь обычно как переходные промежуточные соединения во время химических реакций, они важны главным образом тем, что они раскрывают информацию о химических реакциях и молекулярной структуре. Кроме того, некоторые химические соединения, особенно те, молекулы которых содержат атомы углерода, расположенные в виде малых колец, лучше всего получать с использованием карбенов.
Кроме того, некоторые химические соединения, особенно те, молекулы которых содержат атомы углерода, расположенные в виде малых колец, лучше всего получать с использованием карбенов.
Согласно электронной теории связи, связи между атомами образуются путем совместного использования электронов. Таким образом, с точки зрения этой теории карбен представляет собой соединение, в котором только два из четырех валентных или связывающих электронов атома углерода фактически связаны с другими атомами. Напротив, в соединениях с множественными связями, таких как цианистый водород, все четыре валентных электрона атомов участвуют в связях с другими атомами. Поскольку в молекулах карбенов нет избытка или недостатка электронов, они электрически нейтральны (неионогенны).
Ранние исследования.
Из-за большой реакционной способности карбенов они обычно имеют очень короткое время жизни, и поэтому неудивительно, что однозначные и прямые экспериментальные доказательства их существования получены лишь недавно. Однако соединения двухвалентного углерода были постулированы еще в 1876 году, когда было высказано предположение, что дихлоркарбен, Cl-C-Cl, является промежуточным продуктом в катализируемом основанием гидролизе (разложении, вызванном водой) хлороформа (HCl 3 ). К концу 19 века была разработана обширная теория, которая постулировала соединения двухвалентного углерода в качестве промежуточных продуктов во многих реакциях. Однако более поздние работы опровергли многие из этих постулатов, и в результате карбены больше не выдвигались в качестве гипотетических промежуточных продуктов реакции. Химия карбенов возродилась в 1950-х годах после того, как недвусмысленные доказательства продемонстрировали их существование, а исследования несколькими методами дали подробную информацию об их структурах.
Однако соединения двухвалентного углерода были постулированы еще в 1876 году, когда было высказано предположение, что дихлоркарбен, Cl-C-Cl, является промежуточным продуктом в катализируемом основанием гидролизе (разложении, вызванном водой) хлороформа (HCl 3 ). К концу 19 века была разработана обширная теория, которая постулировала соединения двухвалентного углерода в качестве промежуточных продуктов во многих реакциях. Однако более поздние работы опровергли многие из этих постулатов, и в результате карбены больше не выдвигались в качестве гипотетических промежуточных продуктов реакции. Химия карбенов возродилась в 1950-х годах после того, как недвусмысленные доказательства продемонстрировали их существование, а исследования несколькими методами дали подробную информацию об их структурах.
Теория химической связи предсказывает две принципиально разные электронные конфигурации для карбенов, каждая из которых может соответствовать основному состоянию молекул (состоянию с меньшим содержанием энергии) в зависимости только от природы атомов и групп, присоединенных к двухвалентному атом углерода.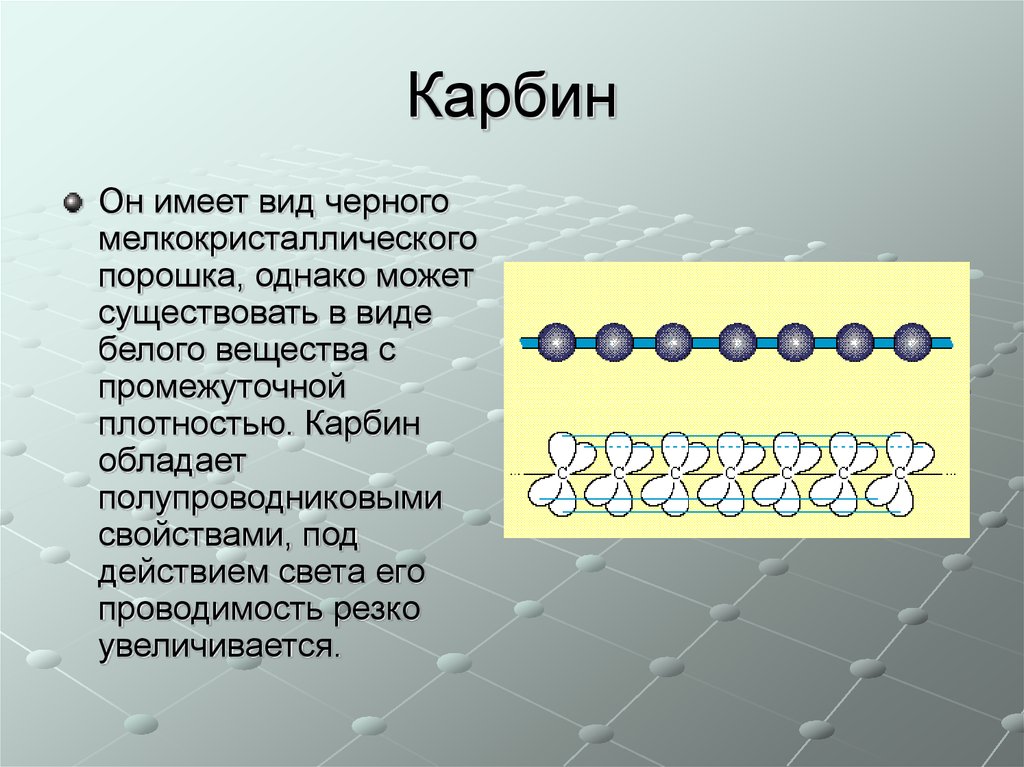 Эта двойственность возникает из-за того, что две связи карбена используют только две из четырех валентных орбиталей углерода — орбитали представляют собой области, занятые различными электронами в атоме. Две валентные орбитали атома углерода, не используемые для связывания, могут принять два несвязывающих электрона. В общем случае на каждой орбитали могут разместиться два электрона, если их спины спарены, то есть если угловые моменты имеют противоположный знак. Таким образом, есть два возможных распределения несвязывающих электронов: они могут находиться на одной орбитали и иметь спаренные (противоположные) спины или они могут быть разделены между двумя доступными орбиталями и иметь параллельные спины. Вещества с электронами, имеющими параллельные (или неспаренные) спины, проявляют магнитный эффект (момент). В магнитном поле этот момент может быть параллельным, перпендикулярным или антипараллельным (параллельным, но действующим в обратном направлении) направлению поля; эти три возможных выравнивания соответствуют трем формам несколько отличающейся энергии, и в результате вещества с неспаренными электронами могут существовать во всех трех формах и, как говорят, находятся в триплетном состоянии.
Эта двойственность возникает из-за того, что две связи карбена используют только две из четырех валентных орбиталей углерода — орбитали представляют собой области, занятые различными электронами в атоме. Две валентные орбитали атома углерода, не используемые для связывания, могут принять два несвязывающих электрона. В общем случае на каждой орбитали могут разместиться два электрона, если их спины спарены, то есть если угловые моменты имеют противоположный знак. Таким образом, есть два возможных распределения несвязывающих электронов: они могут находиться на одной орбитали и иметь спаренные (противоположные) спины или они могут быть разделены между двумя доступными орбиталями и иметь параллельные спины. Вещества с электронами, имеющими параллельные (или неспаренные) спины, проявляют магнитный эффект (момент). В магнитном поле этот момент может быть параллельным, перпендикулярным или антипараллельным (параллельным, но действующим в обратном направлении) направлению поля; эти три возможных выравнивания соответствуют трем формам несколько отличающейся энергии, и в результате вещества с неспаренными электронами могут существовать во всех трех формах и, как говорят, находятся в триплетном состоянии. Напротив, вещества, в которых все электроны спарены, не имеют суммарного магнитного момента и называются синглетными состояниями. В принципе, карбены могут существовать как в синглетном, так и в триплетном состоянии (в зависимости от того, находятся ли электроны на одной или разных орбиталях соответственно).
Напротив, вещества, в которых все электроны спарены, не имеют суммарного магнитного момента и называются синглетными состояниями. В принципе, карбены могут существовать как в синглетном, так и в триплетном состоянии (в зависимости от того, находятся ли электроны на одной или разных орбиталях соответственно).
В большинстве органических соединений (соединений углерода) синглетное состояние более стабильно, чем триплетное, и нормальное или основное состояние молекулы имеет эту форму. В этих соединениях триплеты встречаются только в возбужденных или высокоэнергетических состояниях. С другой стороны, в карбенах из-за двух несвязывающих электронов и двух вакантных орбиталей теоретически ожидается, что триплетное состояние должно быть сравнимо по стабильности с синглетным состоянием и фактически может быть основным состоянием.
Теоретические соображения также предполагают, что атом углерода карбена и два атома, присоединенные к нему, расположены в виде буквы «V», а не линейно, то есть связи от атома углерода к двум атомам-заместителям расположены в угол, меньший 180°, как в триплетном, так и в синглетном состояниях. Однако предсказано, что валентный угол для синглетного состояния будет больше, чем для триплетного состояния. Эти предсказания полностью подтверждаются экспериментами. Метод, называемый спектроскопией электронного магнитного резонанса, показал, что простейший карбен, метилен, имеет триплетное основное состояние, в котором угол между углерод-водородными связями равен 136 °. Синглетное состояние метилена, которое может быть получено в особых условиях, изучено другим методом — оптической спектроскопией, и определен его валентный угол, равный 104°. Структуры и конфигурации несвязывающих электронов триплетного и синглетного состояний метилена показаны как A и B на прилагаемом рисунке; петли представляют собой орбитали, не используемые для связывания, а спаривание и неспаривание электронных спинов обозначены антипараллельными и параллельными стрелками соответственно. Это схематическое изображение орбиты показывает как несвязывающие орбитали, занятые в A (триплетное состояние), так и пустую орбиталь в B (синглет).
Однако предсказано, что валентный угол для синглетного состояния будет больше, чем для триплетного состояния. Эти предсказания полностью подтверждаются экспериментами. Метод, называемый спектроскопией электронного магнитного резонанса, показал, что простейший карбен, метилен, имеет триплетное основное состояние, в котором угол между углерод-водородными связями равен 136 °. Синглетное состояние метилена, которое может быть получено в особых условиях, изучено другим методом — оптической спектроскопией, и определен его валентный угол, равный 104°. Структуры и конфигурации несвязывающих электронов триплетного и синглетного состояний метилена показаны как A и B на прилагаемом рисунке; петли представляют собой орбитали, не используемые для связывания, а спаривание и неспаривание электронных спинов обозначены антипараллельными и параллельными стрелками соответственно. Это схематическое изображение орбиты показывает как несвязывающие орбитали, занятые в A (триплетное состояние), так и пустую орбиталь в B (синглет).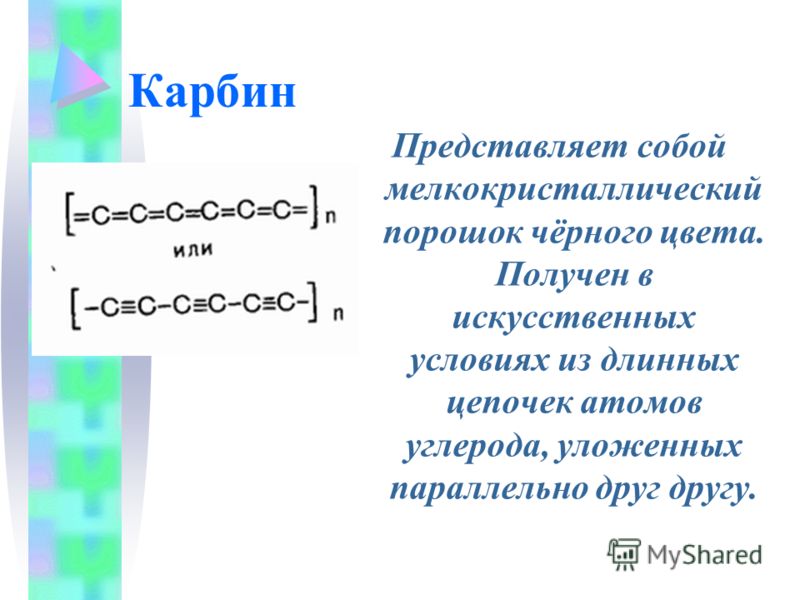
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Структурные особенности, определяющие, соответствует ли синглетное или триплетное состояние низкоэнергетической форме молекулы карбена, можно резюмировать следующим правилом: за немногими исключениями карбены имеют только атомы углерода или водорода, присоединенные к двухвалентной ( карбен) атом углерода имеет триплетное основное состояние, тогда как те, у которых есть заместители азота, кислорода и галогена, имеют синглетное основное состояние. Примерами триплетных карбенов являются метилен (H―C―H), фенилметилен (C 6 H 5 ―C―H), дифенилметилен (C 6 H 5 ―C―C 6 H 5 ) и пропаргилен (HC≡C―C―H). Карбены с известным синглетным основным состоянием представляют собой метоксиметилен (CH 3 O―C―H), хлорметилен (Cl―C―H) и фенилхлорметилен (C 6 H 5 ―C―Cl).
Оружейное дело: можно ли улучшить карабин М-1?
Приклад и планка установлены, древесина немного демонстрирует свою текстуру.
Несмотря на то, что карабин М-1 подвергается критике за недостаточное останавливающее действие и неточность, у него много достоинств, и да, его можно даже улучшить.
Мой давний фаворит, старый М-1 нравится и многим другим. За исключением авторов оружия, которые, кажется, ненавидят это. Эта ненависть вызвана, на мой взгляд, неразвитостью современных боеприпасов и, думаю, долей снобизма. Долгое время карабин поносили за отсутствие убойной силы, неточность и антропоморфное отсутствие мелких круглых штук.
Меня это всегда раздражало, потому что, будучи невысоким полуазиатским ребенком в ХОЛОДНЫХ болотах Висконсина, лучшего оленьего ружья не найти. Итак, я обменял коллекционный винчестер моего дяди на свой несколько потрепанный CMP Inland. Конечно, вскоре после проклятия оружейника желание оживить его стало слишком велико.
На изображении задней четверти показана вся сборка, направляющая, ложа и точка.
Вы испортили исторический памятник?
Так что же можно сделать? Я не хотел «спортивной» или «разделки», которой подверглись многие из этих винтовок, но я хотел, чтобы она была лучше, чем была. Этот карабин томился на каком-то сыром складе лингвини в Италии последние 40 или 50 лет, и приклад выглядел так, с большим количеством смазки и масла. Поверхность была занозой и в целом шероховатой. Решением этой проблемы стал новый приклад, который я заказал в Fulton Armory в Мэриленде.
Этот карабин томился на каком-то сыром складе лингвини в Италии последние 40 или 50 лет, и приклад выглядел так, с большим количеством смазки и масла. Поверхность была занозой и в целом шероховатой. Решением этой проблемы стал новый приклад, который я заказал в Fulton Armory в Мэриленде.
Это была совершенно новая ложа из грецкого ореха, вырезанная с высокой точностью. Была только одна вещь, которая не подходила идеально, и этого не следовало ожидать. Дерево, окружающее затыльник в задней части ствольной коробки, стояло довольно гордо, но этого и следовало ожидать. Во всех остальных областях приклад и цевье подходили идеально, и это было, одним словом, супер. Его также не нужно было подготавливать, так как он уже был полностью отформован и отшлифован. Я был очень доволен этим запасом и настоятельно рекомендую его для замены или обновления.
Аккуратному. Ссылка на книгу Джерри Кунхаузена «Газовые карабины калибра .30 США: руководство по ремонту» уже оказалась полезной для проверки функционирования и безопасности винтовки..png) Теперь небольшой уточняющий раздел сзади был использован, чтобы дать этому скромному обозревателю подсказку. Также упоминался веб-сайт Гражданской программы меткой стрельбы (www.thecmp.org), на котором размещена ссылка на карабины M-1 с высокой точностью.
Теперь небольшой уточняющий раздел сзади был использован, чтобы дать этому скромному обозревателю подсказку. Также упоминался веб-сайт Гражданской программы меткой стрельбы (www.thecmp.org), на котором размещена ссылка на карабины M-1 с высокой точностью.
Между ними было небольшое различие в импорте, и они сказали, в двух словах, что затыльник должен быть надежно закреплен, как и место под стволом в передней части приклада. Клинт Макки из Fulton Armory тоже был источником информации.
Начало работы
Окрашивание по формуле Вандерхаве позволило автору (по его скромному мнению) проделать превосходную работу, воспроизведя красноватый цвет оригинального орехового дерева.
Используя вертикальную фрезу, я удалил древесину из-под откидной пластины и вокруг нее, оставив очень небольшую полку вокруг края области отверстия для винта для определения местоположения. Чтобы сделать трубку для винта затыльника (чтобы никакая подкладка не соприкасалась с ней), я разрезал и развернул скрученную алюминиевую ручку одной из кислотных щеток из комплекта подкладки Brownells, затем снова намотал ее вокруг винта затыльника и затем обрезать по размеру.
Затем я вставил получившуюся трубку в отверстие в ложе, а затем нанес вокруг нее постельный состав. (Бьюсь об заклад, Браунеллс этого не предвидел). Откидная пластина, тщательно покрытая антиадгезивом, затем втаптывалась в подстилку и устанавливалась на оставшуюся маленькую полку локатора. Конечно, компаунд продолжал сочиться, и приклад вокруг затыльника нуждался в некоторой очистке.
Затем я вставил затвор в ложу, чтобы убедиться, что пластина отдачи правильно выровнена по прямой, и затянула винт. После того, как компаунд достаточно застыл, затвор, а затем откатную пластину удаляли, чтобы дать компаунду окончательно затвердеть.
Затем я выкопал небольшой канал сразу за тем местом, где внутренние пальцы ленты ствола охватывают ствол в передней части ложи. В руководстве Kuhnhausen указано, что под этими пальцами следует размещать переднюю подкладку, но я не хотел возиться с этим, поэтому поместил эту подкладку сразу за ними. Я полагал, что поскольку колодка была примерно на том же месте, ее функция заключалась в обеспечении надежной базы для ствола, то она должна работать так же хорошо, как и смещение на полдюйма.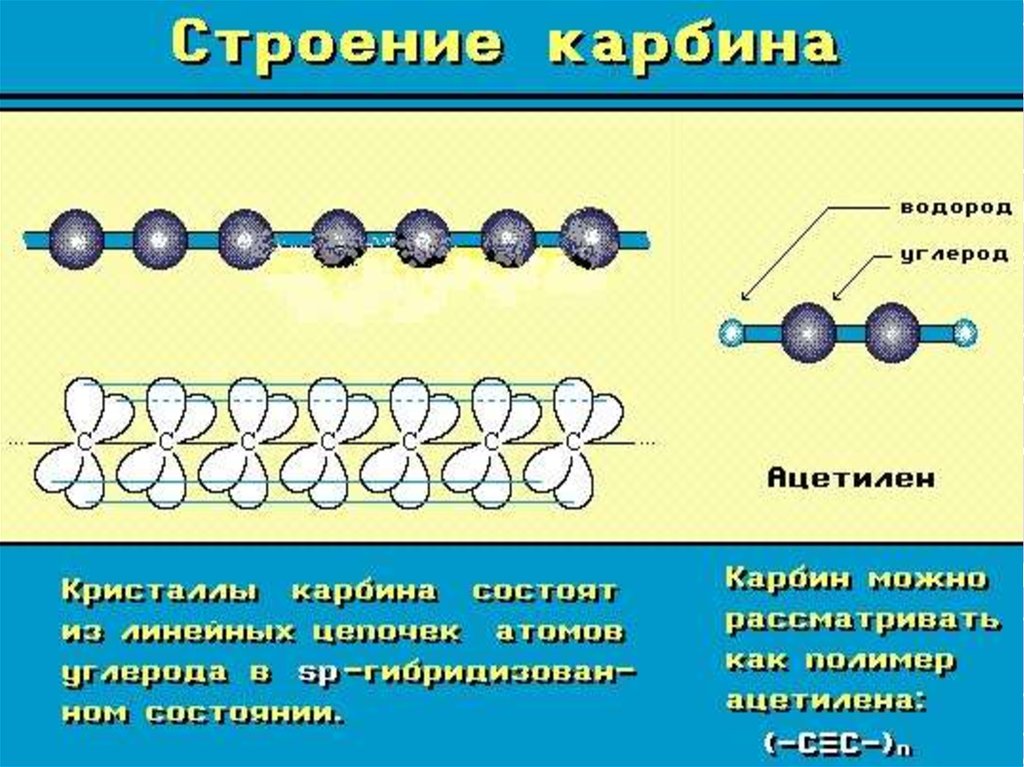
Затем нужно было модифицировать, если необходимо, пластину отдачи, чтобы ствол располагался немного выше цевья, что вызывало небольшое постоянное натяжение ствола при установке ленты ствола. К счастью, там изначально было около 1/8 дюйма поплавка, поэтому я решил оставить это как есть и не пытаться добавить больше.
Последним этапом было окрашивание подвоя с помощью формулы XIII Вандерхейва от Brownells. Этот материал должен дублировать темный, слегка красноватый цвет старых прикладов времен Второй мировой войны. Я немного разбавил его спиртом и использовал старый, но все еще белый носок, чтобы нанести его на дерево.
Я натер довольно разбавленным слоем, чтобы он действовал как герметик, и менее разбавленным слоем, чтобы действительно испачкать приклад и цевье. После этого было нанесено два хороших слоя тунгового масла, и приклад выдержал несколько дней, прежде чем я использовал наждачную бумагу с зернистостью 1000, чтобы слегка убрать блеск с верхнего слоя тунгового масла.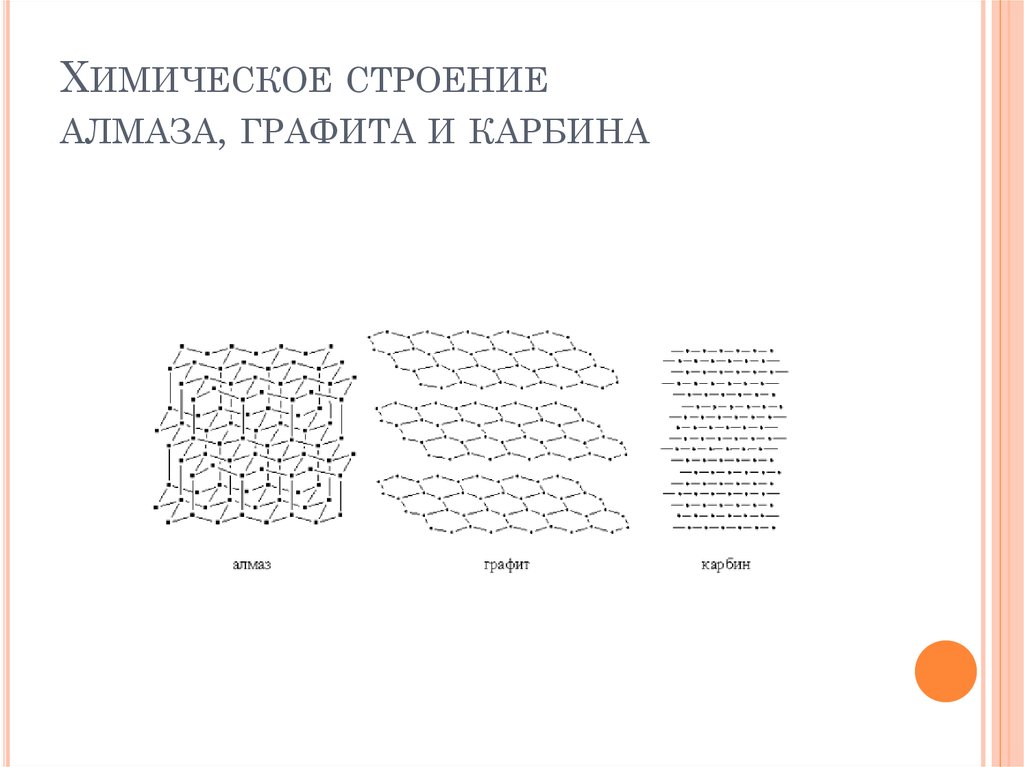 И вот, он выглядел чертовски хорошо, с легким красноватым оттенком и чуть-чуть светлее, чем промасленный приклад, в котором поставлялся карабин.0003 Слева новый приклад, справа старый, видна подкладка и отделка поста.
И вот, он выглядел чертовски хорошо, с легким красноватым оттенком и чуть-чуть светлее, чем промасленный приклад, в котором поставлялся карабин.0003 Слева новый приклад, справа старый, видна подкладка и отделка поста.
Последней частью модернизации снаряжения стало добавление поручня разведчика, который заменяет цевье. Этот рельс был изготовлен Ultimak и получен от Brownells.
Эта удобная планка заменяет цевье алюминиевым профилем, увенчанным планкой Пикатинни. Сюда можно добавить все, что угодно, например, прицел с увеличенным выносом зрачка в стиле скаута, но я просто поставил дешевый маленький прицел с микрокрасной точкой. Следует отметить, что установка чего-либо на эту планку выведет из строя прицельные приспособления, и что-либо, помещенное туда, может сильно нагреться из-за передачи тепла от ствола. Потом было на полигоне.
Отчет о дальности стрельбы
Я провел тестовые стрельбы группами до обновления и с моими слабыми способностями получил примерно 3-дюймовые группы на 50 ярдах, стреляя группами по 10 патронов. Не пять. Не три. Любой, кто закладывает группы из пяти выстрелов и называет их репрезентативными, рассказывает рыбные байки. Любой, кто использует группы из трех выстрелов или лучше всего три из пяти, начисто лжет вам, вытягивая фабрикации из определенной задней трещины. Чем больше выстрелов, тем лучше, и 10 или более выстрелов немного откроются от 5 выстрелов, поэтому авторы и производители оружия любят использовать группы из пяти выстрелов, но это просто недопустимое научное представление.
Не пять. Не три. Любой, кто закладывает группы из пяти выстрелов и называет их репрезентативными, рассказывает рыбные байки. Любой, кто использует группы из трех выстрелов или лучше всего три из пяти, начисто лжет вам, вытягивая фабрикации из определенной задней трещины. Чем больше выстрелов, тем лучше, и 10 или более выстрелов немного откроются от 5 выстрелов, поэтому авторы и производители оружия любят использовать группы из пяти выстрелов, но это просто недопустимое научное представление.
Группа из 10 выстрелов немного лучше, но разница между 10 и 20 выстрелами почти всегда намного меньше, чем разница между пятью и 10 выстрелами. девять выстрелов из 10 в 1-дюймовую рваную дыру, а десятый еще на дюйм, «летающий», если хотите. Тем не менее, 2-дюймовая группа из 10 выстрелов намного лучше, чем 3-дюймовая группа из 10 выстрелов.
Все группы после обновления выстрелили хотя бы немного меньше, чем до обновления. Были использованы перезарядки от Wisconsin Cartridge Corporation и заводского Remington UMC, причем UMC получил лучшие группы. Между прочим, я также зарядил несколько 100-грановых пуль Barnes X (больше не доступны), и они стреляли довольно паршиво. Шестидюймовая группа. Я очень надеюсь, что это была плохая техника перезарядки.
Между прочим, я также зарядил несколько 100-грановых пуль Barnes X (больше не доступны), и они стреляли довольно паршиво. Шестидюймовая группа. Я очень надеюсь, что это была плохая техника перезарядки.
Эта статья появилась в выпуске Gun Digest the Magazine от 14 февраля 2011 года.
СЛЕДУЮЩИЙ ШАГ: Загрузите набор
Free Storm Tactical Printable Target Pack. стрельба из винтовки и пистолета. Сетки мишеней и размеры яблочка указаны в МОА. Идеально подходит для дальней стрельбы!
Подпишитесь на информационный бюллетень Gun Digest по электронной почте, и мы сразу же отправим вам комплект мишеней для печати на дому. Просто введите свой адрес электронной почты ниже.
Быстрые советы по горизонтали и высоте для полицейских снайперов
Меткий стрелок должен иметь базовые знания по высоте и горизонтали, закрепленные в памяти, и есть несколько простых вспомогательных средств для запоминания.
Ранее я обсуждал способ упростить некоторые аспекты внешней баллистики, необходимые полицейским снайперам. Слишком часто мы настолько увлекаемся научными мелочами, что процесс становится более сложным, чем это необходимо для реального мира.
Большинство снайперов разработали личную карту дальности стрельбы, основанную на подробном журнале регистрации каждого выстрела из их винтовки. Некоторые идут еще дальше и используют баллистическое «приложение» на своем смартфоне, чтобы рассчитывать свои выстрелы с поистине хирургической точностью. Такая точность — это хорошо, если вы по-прежнему сохраняете навыки, необходимые для выстрела без бортового журнала, карты стрельбища или приложения для смартфона.
Поскольку любая полицейская операция может стать жертвой Закона сержанта Мерфи, снайперы правоохранительных органов должны быть в состоянии доставить товар, даже если их карточка дальности теряется во время ползания на позицию, а батарея их смартфона садится. Снайпер должен иметь базовые знания о высоте и горизонтали, закрепленные в памяти, и некоторые вспомогательные средства памяти «KISS» могут помочь.
Для «стандартной» полицейской снайперской винтовки/заряда, патрона .308 Winchester, выпускающего 168-гранную пулю Open Tip Match (OTM) со скоростью около 2650 футов в секунду*, есть несколько очень простых приемов, которые позволят вам чтобы отработать поправки, необходимые для выстрелов в тело на расстоянии до 600 ярдов (значительно за пределами обычной дальности действия полиции).
Оценка высоты
Необходимые корректировки траектории очень легко запомнить. Предполагая пристрелку на 100 ярдов, ваши поправки для дальностей до 600 ярдов будут следующими: 2 – 3 – 3 – 4 – 4.
Добавление 2 угловых минут (MOA) угла места поместит вас на 200 ярдов. Добавление еще 3 МОА (всего 5 МОА регулировки высоты) даст вам 300 ярдов.
Используя мою простую таблицу для запоминания, общее изменение высоты, необходимое для дистанций от 200 до 600 ярдов, равно 2/5/8/12/16 МОА. Проверьте это с помощью своего личного журнала или баллистической программы, и вы увидите, что значения находятся в пределах ½ МОА, а в некоторых случаях и в пределах ¼ МОА (достаточно хорошо для выстрелов в тело). Для промежуточных расстояний разделите разницу между значениями в сотнях ярдов.
Для промежуточных расстояний разделите разницу между значениями в сотнях ярдов.
Если вы работаете на большой высоте, скажем, на высоте более 3000 футов над уровнем моря, ваши пули будут падать меньше, и вам потребуется меньше поправок.
Range Minus One, парусность Formula
Мой друг Джефф Хоффман, глава компании Black Hills Ammunition и до сих пор действующий офицер запаса/снайпер, разработал аналогичное эмпирическое правило для калибра .308 Winchester 168/175 гран OTM. Подводя итог его полной статьи по этой теме здесь, ваши поправки на ветер для полноценного ветра со скоростью 10 миль в час рассчитываются с использованием формулы «Диапазон минус один».
Например, для выстрела на 200 ярдов при полномасштабном ветре 10 миль в час (90 градусов влево/вправо) необходимая поправка составляет 1 МОА. Два (сотни ярдов) минус один = поправка на 1 МОА.
Для выстрела на 300 ярдов потребуется поправка на 2 МОА (3-1=2).
Опять же, эта формула дает допуски на попадание в тело, но точность составляет ½ МОА на очень больших дистанциях для полицейских. Различные направления ветра изменят это значение на доли, которые вы уже должны знать: ветер с половинным значением нуждается в половинной коррекции.
Различные направления ветра изменят это значение на доли, которые вы уже должны знать: ветер с половинным значением нуждается в половинной коррекции.
Формула морской парусности
Альтернативная формула парусности, которую я использовал в течение многих лет, меня научили как «морскую формулу». Используя морскую формулу, вы должны предварительно рассчитать «коэффициент» ветра для данной нагрузки.
Я дам вам коэффициент ветра для стандартной нагрузки 168 OTM: 12. Формула выглядит так: умножьте сотни ярдов на скорость ветра в милях в час, затем разделите это значение на коэффициент ветра (12 для нашего 168-граммового груза). нагрузка). Результатом формулы является значение МОА, необходимое для поправки на ветер.
Таким образом, выстрел на 300 ярдов при полном ветре со скоростью 10 миль в час выглядит следующим образом: 3×10=30 … 30/12=2,5 МОА коррекции.
Хотя это требует немного больше умственной гимнастики, я считаю, что эта формула немного более точна, чем формула Джеффа Хоффмана «Диапазон минус один». Еще одним преимуществом является то, что вы можете рассчитать коэффициент парусности по морской формуле для других нагрузок. Например, мое ружье для охоты на оленя на дальние дистанции, которое обеспечивает большую скорость с более эффективной пулей, имеет коэффициент ветра 20.
Еще одним преимуществом является то, что вы можете рассчитать коэффициент парусности по морской формуле для других нагрузок. Например, мое ружье для охоты на оленя на дальние дистанции, которое обеспечивает большую скорость с более эффективной пулей, имеет коэффициент ветра 20.
Запомнив эти простые эмпирические правила высоты и горизонтальности, вы будете готовы к наихудшему сценарию, когда все ваши тщательно подготовленные записи или высокотехнологичные инструменты будут недоступны.
* Общие значения также «достаточно близки» для американского патрона M118LR калибра 7,62 мм НАТО с OTM 175 гран.
Об авторе
Дик Фэйрбёрн имеет более чем 40-летний опыт работы в правоохранительных органах Иллинойса и Вайоминга, патрулирования, расследований и выполнения административных задач. Дик также был начальником отдела учебного подразделения огнестрельного оружия крупной академии и программы обучения критическим инцидентам. У него есть B.