Содержание
Свечение одного атома • Игорь Иванов • Научная картинка дня на «Элементах» • Физика
Этот снимок, победивший в конкурсе научных фотографий EPSRC competition и обошедший мировые СМИ, — настоящий привет из микромира в мир макроскопический, человеческий. Присмотритесь: в самом центре установки, в зазоре между двумя электродами, светится маленькая точка. Это — один-единственный атом, а точнее, ион, стронция. Пойманный в ионную ловушку Пауля и облучаемый лазерным светом, ион поглощает лазерные фотоны, возбуждается, переизлучает их — и в результате светится сам. Как оказалось, это флуоресцентное свечение отдельного иона не такое уж и слабенькое. Для того, чтобы его уловить, вовсе не требуется прибегать к сверхсложным приборам. Давид Надлингер (David Nadlinger), аспирант Оксфордского университета, сфотографировал этот сияющий осколок микромира на обычную зеркальную камеру Canon 5D Mark II DSLR с объективом Canon EF 50mm f/1.8.
Здесь уместно сделать маленькое техническое пояснение. Еще со школы все знают, что слишком маленькие объекты нельзя разглядеть даже в сверхсильный оптический микроскоп. Это так называемый дифракционный предел. Возникает он потому, что сам свет имеет длину волны около половины микрометра, и все, что мельче этого размера, неконтролируемо размывается в фокусе микроскопа. Но обратите внимание: это ограничение касается лишь разделения нескольких светящихся (или освещенных внешним светом) объектов на отдельные источники света. Дифракционный предел совершенно не мешает нам видеть свечение одного-единственного объекта, каким бы мелким он ни был!
Еще со школы все знают, что слишком маленькие объекты нельзя разглядеть даже в сверхсильный оптический микроскоп. Это так называемый дифракционный предел. Возникает он потому, что сам свет имеет длину волны около половины микрометра, и все, что мельче этого размера, неконтролируемо размывается в фокусе микроскопа. Но обратите внимание: это ограничение касается лишь разделения нескольких светящихся (или освещенных внешним светом) объектов на отдельные источники света. Дифракционный предел совершенно не мешает нам видеть свечение одного-единственного объекта, каким бы мелким он ни был!
Конечно, для самих ученых в этой фотографии нет ничего необычного. Манипулировать отдельными атомами и ионами, а также их внутренним состоянием, физики научились десятилетия назад, и первооткрыватели экспериментальных методик получили даже свои Нобелевские премии (см., например, вторую половину нашей новости Нобелевская премия по физике — 2012). В современных исследованиях физики умудряются даже подвешивать в вакууме ровные цепочки отдельных атомов и, словно по мановению волшебной палочки, включать и выключать их свечение.
Например, на комбинированном изображении, полученном недавно в лаборатории Trapped Ion Quantum Information в Университете Мэриленда, показана цепочка из 53 отдельных ионов, висящих в ионной ловушке и запечатленных в разные моменты времени. Эти 53 иона выступали в роли квантового симулятора, и каждый ряд на этом изображении — это отдельный снимок, отражающий очередной этап его эволюции. Но если для получения этих изображений использовался специальный инструментарий современной атомной физики, то исходная фотография — это «любительский» снимок, это лазейка в микромир, доступная каждому из нас, и именно этим она так завораживает.
Справедливости ради надо сказать, что, при всей своей визуальной привлекательности, это все же далеко не первый пример, когда человек видел свечение отдельных частиц микромира. В 1960-е годы, когда физики разрабатывали первые коллайдеры, они поштучно запускали электроны в накопительные кольца и сквозь наблюдательное окошко невооруженным глазом (!) видели голубоватое синхротронное свечение от небольшого числа электронов. На рисунке ниже приведены показания фотодатчика, следившего за синхротронным свечением в итальянском накопительном кольце AdA во время его запуска в феврале 1961 года. Ступеньки на этом графике — это как раз отдельные электроны, влетавшие в ускорительное кольцо и выбывавшие из него. Видно, что отдельные электроны светятся вполне уверенно.
На рисунке ниже приведены показания фотодатчика, следившего за синхротронным свечением в итальянском накопительном кольце AdA во время его запуска в феврале 1961 года. Ступеньки на этом графике — это как раз отдельные электроны, влетавшие в ускорительное кольцо и выбывавшие из него. Видно, что отдельные электроны светятся вполне уверенно.
Между прочим, свечение отдельных электронов может в ближайшем будущем стать основой прорывного метода по измерению массы других сверхлегких частиц — нейтрино. Мы писали три года назад про первые шаги нового эксперимента Project 8, в котором наблюдалось уже не оптическое, а радиосвечение от одного нерелятивистского электрона во внешнем магнитном поле. Так что свет от отдельных частиц микромира — это не только красиво, но и реально полезный инструмент исследования.
Фото © David Nadlinger с сайта epsrc.ac.uk.
Игорь Иванов
Уравнения химических реакций: свойства, коэффициенты и схемы
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях.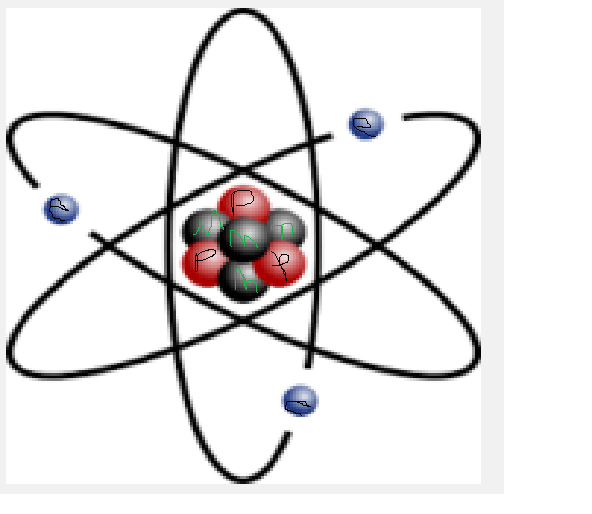 В результате одни вещества превращаются в другие.
В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
- Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные.
 Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
- Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества.
 В такой реакции обязательно образуется вода, газ или осадок.
В такой реакции обязательно образуется вода, газ или осадок.
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Эта фотография одного захваченного атома просто захватывает дух: ScienceAlert
(Дэвид Надлингер/Оксфордский университет)
В самом центре изображения выше находится нечто невероятное — одиночный положительно заряженный атом стронция, подвешенный в движении электрическими полями.
Мало того, что это невероятно редкое зрелище, так еще трудно уложить в голове тот факт, что эта крошечная точка синего света является строительным блоком материи.
Крошечные частицы энергии, подобные этой, находятся в центре множества вещей вокруг нас, и мысль о том, что мы можем см. это заставляет наши сердца болеть.
Если вам не удается рассмотреть изображение достаточно близко, чтобы понять, о чем мы говорим, команда Gizmodo сделала для вас работу с масштабированием.
Просто посмотрите на это:
(Дэвид Надлингер/Оксфордский университет)
Изображение было сделано физиком Дэвидом Надлингером из Оксфордского университета, и оно было удостоено общей премии в области инженерных и физических наук Великобритании. Совет фотоконкурса.
Чтобы дать вам некоторое представление о размере этой установки, атом удерживается на месте электрическими полями, исходящими от этих двух металлических игл по обе стороны от него.
Расстояние между ними составляет около 2 миллиметров (0,08 дюйма).
Атом освещается сине-фиолетовым лазером. Энергия лазера заставляет атом испускать фотоны, которые Надлингер мог запечатлеть на камеру, используя длительную выдержку.
Все это находится внутри камеры сверхвысокого вакуума и резко охлаждается, чтобы атом оставался неподвижным. Надлингер сделал это фото через окно вакуумной камеры.
«Идея увидеть отдельный атом невооруженным глазом показалась мне удивительно прямым и интуитивным мостом между крохотным квантовым миром и нашей макроскопической реальностью», — объясняет он.
«Подсчеты на обратной стороне конверта показали, что цифры на моей стороне, и когда я отправился в лабораторию с камерой и штативами одним тихим воскресным днем, я был вознагражден этой конкретной фотографией маленького, бледного синяя точка».
Эти типы атомных ионов, охлаждаемых лазером, не только позволяют исследователям изучать и использовать свойства квантового мира, они также могут быть использованы для создания атомных часов и будущих квантовых компьютеров.
Вы можете увидеть некоторые другие изображения-победители ниже:
«Поиск имитированных обломков топлива на Фукусиме с помощью ТНПА AVEXIS TM», Саймон Уотсон, Манчестерский университет
(Саймон Уотсон/Манчестерский университет)
«Далеко-далеко на кухне…» (Схемы нестабильности жидкости на поверхности мыльного пузыря) Ли Шен, Имперский колледж Лондона
(Ли Чен, Имперский колледж Лондона)
«Биоразлагаемые микромиски могут помочь в борьбе с раком толстой кишки» Тайо Сандерс II, Оксфордский университет
(Тайо Сандерс II, Оксфордский университет)
«Строительные блоки для светлого будущего», Сэм Кэтчпол-Смит, Ноттингемский университет
(Сэм Кэтчпол-Смит, Ноттингемский университет)
Просмотреть все победители здесь.
Как студент сфотографировал отдельный атом купленным в магазине фотоаппаратом
Одиночный атом стронция плавает между двумя электродами.
(Изображение предоставлено Дэвидом Надлингером/Оксфордский университет)
Присмотритесь, и вы увидите это: бледный фиолетовый пиксель, висящий в черном поле между двумя цилиндрическими иглами. машина с ионной ловушкой в Оксфордском университете.
Это мало. Очень маленький. Размер каждого атома составляет примерно 0,25 нанометра (или миллиардных долей метра); миллиарды атомов удобно поместились бы внутри одной эритроцита.
Как сфотографировать что-то такое, казалось бы, бесконечно маленькое? Один фотограф, Дэвид Надлингер, использовал стандартную цифровую камеру, но ему помогли настроить снимок благодаря лаборатории квантовых вычислений с ионной ловушкой в Оксфорде, где он работает над своей докторской диссертацией. 12 февраля Надлингер занял первое место в национальном конкурсе научной фотографии, организованном Исследовательским советом по инженерным и физическим наукам, за эту редкую фотографию одиночного освещенного атома.
«Я думаю, что эта фотография особенно интересна людям тем, что вы можете видеть окружающее ее оборудование», — сказал Надлингер в интервью Live Science. «И я думаю, что люди также удивлены тем, насколько большим здесь выглядит атом… Я надеюсь, что этой фотографией я не отменяю 100 лет научного образования — атомы на самом деле невероятно малы!»
«И я думаю, что люди также удивлены тем, насколько большим здесь выглядит атом… Я надеюсь, что этой фотографией я не отменяю 100 лет научного образования — атомы на самом деле невероятно малы!»
Для ясности, сказал Надлингер, пурпурное пятнышко в центре этой фотографии не соответствует истинному размеру самого атома стронция; это свет от множества окружающих лазеров, переизлучаемых атомом. Когда стронций купается в синем свете определенной длины волны, он создает свечение, в сотни раз превышающее радиус самого атома (который составляет около четверти нанометра или 2,5×10 на -7 метров, сказал Надлингер). Это свечение было бы едва заметно невооруженным глазом, но становится очевидным при небольшом манипулировании камерой.
Посмотрите внимательно: эта фиолетовая точка — это свет, испускаемый одним атомом стронция. (Изображение предоставлено Дэвидом Надлинджером/Оксфордский университет)
«Видимый размер, который вы видите на картинке, — это то, что мы называем оптической аберрацией», — сказал Надлингер. «Объектив, через который мы его видим, не идеален — он также немного не в фокусе и слегка переэкспонирован. Это можно сравнить со взглядом на звезды в ночном небе, которые кажутся яркими, но на самом деле намного меньше, чем размер они кажутся такими только потому, что нашим глазам (или камере) не хватает разрешения, чтобы их обработать».
«Объектив, через который мы его видим, не идеален — он также немного не в фокусе и слегка переэкспонирован. Это можно сравнить со взглядом на звезды в ночном небе, которые кажутся яркими, но на самом деле намного меньше, чем размер они кажутся такими только потому, что нашим глазам (или камере) не хватает разрешения, чтобы их обработать».
Итак, увидеть один атом невооруженным глазом невозможно. Однако ловушка в лаборатории немного более выполнима.
Чтобы сделать отдельный атом пригодным для камеры, исследователям сначала нужно превратить его в ион: атом с неравным количеством протонов и электронов, что придает ему положительный или отрицательный суммарный заряд. «Мы можем улавливать только заряженные частицы», — сказал Надлингер. «Итак, мы берем поток нейтральных атомов стронция, которые исходят из печи, и направляем на них лазеры, чтобы избирательно их фотоионизировать. Таким образом, мы можем создавать отдельные ионы».
При помещении в устройство с ионной ловушкой отдельные атомы удерживаются на месте четырьмя электродами в форме лезвий, подобными тем, что видны над и под стронциевым пятнышком на фотографии Надлингера (два дополнительных электрода не видны). Эти электроды создают ток, удерживающий атом на вертикальной оси; два игольчатых цилиндра по обе стороны от атома удерживают его в горизонтальном положении.
Эти электроды создают ток, удерживающий атом на вертикальной оси; два игольчатых цилиндра по обе стороны от атома удерживают его в горизонтальном положении.
Когда токи от этих электродов взаимодействуют, они создают так называемый вращающийся седловой потенциал. «В Интернете можно увидеть видеоролики, где люди буквально берут седло, поворачивают его и кладут на него шарик; из-за вращения шарик фактически остается в центре седла. Вот что делают эти электроды, чтобы удерживать ион». — сказал Надлингер.
Как только атом оказывается в замкнутом пространстве, на атом попадает множество лазеров, которые рассеивают свет во всех направлениях; на фотографии Надлингера вы можете увидеть следы синего лазера по всему фону. Используя эту систему, исследователи потенциально могут улавливать цепочки из сотен ионов между маленькими электродами, что приводит к потрясающим изображениям.
«На нашем веб-сайте есть изображение девяти ионов, пойманных в цепочку», — сказал Надлингер.

 Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду: В такой реакции обязательно образуется вода, газ или осадок.
В такой реакции обязательно образуется вода, газ или осадок.