Совершен прорыв на пути к созданию перезаряжаемой литий-кислородной батареи. Кислород литий
Литий с кислородом - Справочник химика 21
Для натрия образование перекисных соединений более характерно, чем ДJ я лития. Так, взаимодействуя с кислородом, он (в отличие от лития I образует не оксид, а пероксид [c.489]
Воспламеняющиеся реактивы — пероксиды натрия, калия, лития, магния, стронция, бария, цинка, а также пероксид водорода, азотная кислота и ее соли, соли кислот азотистой, хлористой, хлорноватой, йодной, йодноватой, хлорная кислота и ее соли, соли надборной, надсерной и марганцевой кислот, хромовый ангидрид и соли хромовых кислот. Все эти соединения негорючи, но, разлагаясь, они выделяют кислород, способствующий горению других веществ, а следовательно, интенсивному развитию пожара. Не менее важной особенностью этих веществ является их способность не только воспламеняться, но и взрываться в смеси с другими веществами. [c.38]
Данные таблицы I свидетельствуют, что в полученных формо-литах кислород имеет ацетальную и метилольную формы. [c.343]
Последовательные реакции в зависимости от условий можно использовать для определения лития, кислорода и азота. Облучение в течение 25 сек уже приводит к активности насыщения для изотопа а измерения в течение такого же времени позволяют зарегистрировать 98% всех нейтронов. Естественно, что задержка после облучения должна быть минимальной и точно фиксированной. [c.296]
Хотя, согласно литературным данным [3], связь литий — кислород должна иметь частично донорно-акценторный характер, для некоторых комплексов Ь1+...(0Н2) ...Х координационную связь лития с кислородом кристаллизационной воды с хорошим приближением можно рассматривать как ионно-дипольную (потенциал ионизации молекул воды более чем в [c.279]
Образование твердых растворов и соединений между твердым и жидким металлом происходит в результате протекания диффузионных процессов в твердой фазе — атомной и реактивной диффузии — и является весьма нежелательным явлением, так как образующийся слой твердого раствора или интерметаллического соединения обычно бывает хрупким, что снижает пластичность всего изделия. Возможны также частные случаи химического взаимодействия жидкометаллической среды с компонентами твердого металла взаимодействие щелочных металлов с растворенным в твердых металлах кислородом, лития — с углеродом, серой и [c.144]
При других партнерах по реакции и условиях ее протекания ряд изменения химической активности простых веществ может быть иным. Так, из щелочных металлов по отношению к фтору (а также кислороду) наиболее активен литий [c.237]
Перхлорат лития и нитрат лития отличаются исключительно выгодными характеристиками по сравнению другими неорганическими окислителями, прежде всего из-за высокого содержания кислорода — в перхлорате лития кислорода 60,1%, в нитрате лития — 69,5%, в то время, как в перхлорате аммония, который применяется в большинстве высококачественных типов твердого ракетного горючего, содержание кислорода составляет только 54,4%. Кроме того, перхлорат и нитрат лития обладают более высокой плотностью, вполне удовлетворительны в отношении показателей токсичности и коррозионного действия, они также весьма стабильны, если защищены от воздействия воды. Пер хлорат и нитрат лития легко растворяются в спирте (в метаноле, например, растворяется 65% перхлората лития), что позволяет использовать их в производстве горючего с высоким содержанием энергии, большой плотностфю и высоким содержанием кислорода для жидкостных ракетных двигателей. По совокупности свойств эти соединения являются весьма перспективными окислителями для производства сложных типов ракетного горючего, а так- [c.20]Константа скорости образования комплекса К увеличивается по мере добавления металлов и зависит от природы металла. Максимальное влияние на величину К оказывают концентрации металлов — примерно до 0,3—0,4 вес. % При больших концентрациях металлов константа скорости образования углерод-кислород-ного комплекса изменяется незначительно (см. рис. 73). Наиболее резко эта константа изменяется у образцов с добавками хрома при содержании его в катализаторе от 0,1 до 0,8% К становится в 3 раза больше, чем для исходного. Среди щелочных и щелочноземельных металлов сильнее всего на константу образования комплекса влияет литий. В присутствии 1,3 вес. % этого металла она возрастает в 2,5 раза. Константа скорости К2 разложения комплекса не зависит от содержания металла в катализаторе и определяется только его природой (см. рис. 74). Большая часть исследованных металлов уменьшает константу скорости К2 разложения комплекса. Так, наименьшая величина константы скорости разложения комплекса наблюдается на образцах, содержащих хром. В этом случае К2 в 2,4 раза меньше константы скорости разложения исходного катализатора (см. рис. 74). Среди щелочных металлов эта константа наиболее резко уменьшается при добавлении лития (в 1,2 раза). Щелочноземельные металлы практически не влияют на коНстанту разложения кислородного комплекса. [c.169]
Среди щелочных металлов эта константа наиболее резко уменьшается при добавлении лития (в 1,2 раза). Щелочноземельные металлы практически не влияют на константу разложения кислород-углеродного комплекса. [c.35]
Кислород Кобальт Кремний Криптон Ксенон. Кюрий. Лантан. Литий. Лютеций Магний. Марганец Медь. . . Менделевий Молибден Мышьяк Натрий. Неодим Неон. . Нептуний Никель. Ниобий Нобелий Олово. Осмий. Палладий Платина Плутоний Полоний. Празеодим Прометий Протактиний Радий Радон Рений [c.19]
Вместе с тем необходимо подчеркнуть, что энергетически выгодное распаривание электронов происходит лишь в пределах одного энергетического уровня. Поэтому получение, например, четырехвалентного кислорода, трехвалентного лития, двухвалентного гелия практически невозможно, так как затрата энергии при переходах [c.43]
Помимо литья металлов, требующего полного расплавления и композиционного формирования расплава, имеется большое число операций термической обработки, в результате которых осуществляется молекулярная переориентация и перестройка кристаллической структуры металлов и сплавов. Для достижения такой перестройки необходимо обеспечить, как правило, нагрев металлической детали до температуры, при которой подвижность электронов и атомов в металле станет достаточной для перехода в новое состояние при заданной скорости. Однако при этом нельзя превышать температуры плавления. При выборе температуры необходимо учитывать вид термообработки. Соответствующие ему реакции взаимодействия между компонентами газовой фазы и металлом должны проходить при отсутствии окисления поверхности металла. Иными словами, нагрев металлического изделия должен осуществляться в атмосфере, свободной от кислорода. Если необходимая кристаллическая структура неустойчива при комнатной температуре, ее необходимо зафиксировать при повышенной температуре, т.е. охладить или закалить металлическую деталь с такой скоростью, при которой в дальнейшем не произойдет перестройки молекул. [c.316]
Бруэр и Маргрейв [928] отметили, что система литий — кислород вблизи состава, соответствующего LI2O, имеет небольшую область гомогенности, что может внести погрешность в расчеты тепловых эффектов равновесий, включающих конденсированную фазу LijO. В работе Берковича и др. [758] приведены значения давлений паров LI2O, LiO и О при 1400° К. Эти данные позволяют рассчитать тепловой эффект реакции [c.882]
Система железо — литий — кислород. О характере фазовых равновесий в системе Ы—Ре—О можно судить на основе диаграммы, построенной Глейзером [49] (рис. 32). Из этой диаграммы и данных [50—53] следует, что в системе Ре——О возможно об- [c.95]
Необходимо отметить, что Мак-Гоуен и Форд [282] изучали кинетику полимеризации этилена на каталитической системе бутиллитий— четыреххлористый титан при 30°. Компоненты катализатора вводили в реакцию в отсутствие этилена. Во всех случаях использовали молярное соотношение компонентов 4 1. Поскольку другие соотношения не были исследованы, определить оптимум каталитической активпости невозможно. Однако при соотношении 4 1 полимеризация происходила. При введении в систему вместе с этиленом кислорода скорость полимеризации вначале не изменялась, но затем процесс полностью прекращался. Авторы объяснили это явление связыванием алкила лития кислородом. Однако [c.127]
Из других элементов второго периода периодической системы бор и бериллий образуют расщепляемые на антиподы соединения, в которых центральный атом является четырехлигандным (т. е. связан с четырьмя атомами или группами от латинского слова ligare — связывать). Четырехлигандные соединения остальных элементов второго периода — лития, кислорода, фтора и неона — неизвестны. [c.64]
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием LigN. При активации молекул N2 (нагре-ваниш, действием электроразряда или ионизирующих излучений) азот )бычно выступает как окислитель и лишь при взаимодействии с фтором и кислородом — как восстановитель. [c.345]
Литий ВЫСОКО химически ак1ивен. С кислородом и азотом взаимо-лейс1вует уже при обычных условиях, поэтому на воздухе тотчас окисляется, образуя темно-серый налет продуктов взаимодействия (Ь[гО, LijN) При температуре выше 200°С загорается. В атмосфере фтора и хлора, а также в парах брома и иода самовоспламеняется при обычных условиях. При нагревании непосредственно соединяется с серой, углем, водородом и другими неметаллами. Будучи накален, горит в Og. [c.486]
Литий — одновалентный металл, энергично разлагающий воду с образованием щелочи. За литием идет бериллий — тоже металл, но двухвалентный, медленно разлагающий воду при обычной температуре. После бериллия стоит бор — трехвалентный элемент со слабо выраженными неметаллическими свойствами, проявляющий однако 1и которые свойства металла. Следующее место в ряду занимает углерод — четырсхвалентный неметалл. Далее идут азот — элемент с довольно ])езко выраженными свойствами неметалла кислород — типичный неметалл наконец, седьмой элемент с1)тор — самый активный из неметаллов, принадлежащий к группе галогенов. [c.48]
Все щелочные металлы энергично соеднняююя с кислородом. Рубидий и цезпй самовоспламеняются иа воздухе литий, натрий и калий загораются при небольшом нагревании. Характерно, что только литий, сгорая, образует нормальный оксид Ь(20, остальные же щелочные металлы превращаются в пероксидйые соединения ЫазОг. КОа, РЬОз, СзОа. [c.563]
Щелочные металлы и их соединения широко используются технике. Литий применяется в ядерной энергетике. В частности, изотоп Li служит промышленным источником для производства трития, а изотоп Li используется как теплоноситель в урановых реакторах. Благодаря способности лития легко соединяться с водородом, азотом, кислородом, серой, ои применяется в металлургии для удаления следов этнх элементов из металлов и сплавов. LiF и Li l входят в состав флюсов, используемых при ]]лавке металлов и сварке магння и алюминия. Используется лтий и его соединения и в качестве топлива для ракет. Смазки, содержащие соединения лития, сохраняют свои с1юйства при температурах от —60 до - -150°С. Гидроксид лития входит в состав электролита щелочных аккумуляторов (см. 244), благодаря чему в 2—3 раза возрастает срок их службы. Применяется литий также в керамической, стекольной и других отраслях химической промышленности. Вообще, по значимости в современной технике этот металл является одним из важнейших редких элементов. [c.564]
Кислород и щелочи могут выде.лить этил- й бензоил-меркаптаны. Один, сам но себе, докторский раствор действия не оказывает. [c.204]
Кислотно-основной характер системы определяется типом заместителей и электроноакцепторные группы усиливают кислотность соли или основность соответствующего илида. В этих случаях для отрыва а-протона пригодны слабые основания, например карбонат калия. В более общем случае, когда заместителей, сильно повышающих кислотность, мало или они отсутствуют, используют, как правило, сильные щелочи литий-органические соединения, амид натрия в жидком аммиаке, ал-ко сиды щелочных металлов в гидроксильных растворителях или в диметилсульфоксиде либо димсильный анион в ДМСО. Стабилизованные (наличием групп Р = СООР, СМ и др.) илиды можно выделить. В то же время хорошо известно, что обычные фосфониевые илиды чувствительны и к воде, и к кислороду, поэтому стандартная методика требует применения тщательно высушенных растворителей и инертной атмосферы. Под действием воды происходит необратимый распад с образованием ал-килдифенилфосфина и бензола. На воздухе протекают следующие реакции [c.251]
Элементорганические анионы, не имеющие связанных с металлами атомов кислорода, серы или азота, называют подобно радикалам, но окончание ио заменяют на ат , например ЫСи(СНз)2 диметилкупрат лития [(СвН5)зРЬ] трифенил- [c.194]
Реакционная способность углерода сильно зависит от его структуры и чистотьр), т. е. наличия в составе его примесей. Например, исследования реакционной способности углерода показали значительное действие карбонатов натрия, калия, лития и солей железа на температуру его воспламенения [61, 63]. В этой связи при изучении кинетики процесса взаимодействия углерода с кислородом применяют графит или древесный уголь, либо другие искусственно приготовленные беззольные угли [62, 64]. Некоторые исследователи используют хорошо подготовленный беззольный и не содержащий летучих соединений уголь с вы- [c.21]
Детали из алюминия и его сплавов сваривают в газовом пламени без избытка кислорода или же ручной электродуговой сваркой постоянным током обратной полярности. Химический состав электродов должен соответствовать составу основного металла. При сварке применяют флюс АФ-44 (28% хлорида натрия, 50% хлорида калия, 14% хлорида лития и 8% фторида натрия). ГОСТ 78711—75 предусматривает сварочную проволоку из алюминия н алюминиевых сплавов. ГОСТ 14806—80 указывает основные типы и конструктивные элементы соединений при электродуговой сварке алюминия и алюм иниевых сплавов. [c.266]
При крупномасштабном производстве алюминиевого литья алюминий весьма часто переплавляют в мелких отражательных печах, куда предварительно загружают слитки металла. В этих печах пламя должно быть неинтенсивным и коптящим. Оно не должно бить в металл, так как последний может абсорбировать из пламени водород. Его, как правило, удаляют в конце плавления путем вдувания газообразного хлора. Избыточный кислород также нежелателен, хотя он и способствует образованию на поверхности расплавленного металла защитной окисной пленки. Толщина этой пленки может превысить минимально допустимую величину и привести к излишним потерям металла от переокис-ления. [c.314]
chem21.info
 Литий-кислородный аккумуляторВ то время как многие факторы способствуют развитию современных электромобилей, основными факторами, которые сдерживают электромобили от поездки, по дальности на одной зарядке, равной запасу хода бензиновых транспортных средств, является литий-ионный аккумулятор, а именно его плотность энергии, вес и стоимость. Однако, это может измениться в ближайшее время, благодаря литий-кислородным аккумуляторам. Исследователи из Кембриджского университета в Великобритании создали лабораторную демонстрацию лития с кислородом, или «литий-воздушный» аккумулятор, который имеет плотность энергии в 10 раз выше плотности энергии литий-ионных батарей, используемых в современных электромобилях. По данным исследования, она примерно эквивалентна плотности энергии бензина, пишется в последнем выпуске журнала Science. Также этот аккумулятор более чем на 90% эффективнее большинства литий-ионных аккумуляторов, используемых на данный момент и может быть пополнен более 2000 раз, говорится в исследовании.  Аккумуляторная батарея автомобиля Тесла модель S Тем не менее, как и в случае с другими батареями нового поколения, есть несколько практических проблем, которые необходимо решить, прежде чем литий-воздушные батареи станут достойной альтернативой бензина. Прототип аккумулятора в настоящее время работает только в лаборатории, так как исследователи ищут способы, чтобы превратить его в жизнеспособный продукт. Например, металлический электрод должен быть защищен от образующихся в металлическом литии волокон (дендритов), которые могут привести к взрыву батареи. Кроме того, батарея может использовать только чистый кислород, а не обычный воздух из атмосферы, содержащей другие газы, включая двуокись углерода и азота, а также влагу. Все эти компоненты потенциально вредны для металлического электрода. Но вот где новый аккумулятор получает действительно захватывающие отзывы: литий-воздушные батареи могут быть в пять раз дешевле и в пять раз легче, чем сегодняшние литий-ионные. Если эти аккумуляторы будут по-настоящему в 10 раз более мощными и в пять раз легче, чем батареи, в настоящее время использующиеся в электромобилях, запас хода может быть расширен до 650 км или больше без остановки для подзарядки, как предполагают исследователи. Эта технология также может повлиять на мобильные устройства. Представьте, если аккумулятор вашего смартфона будет в 10 раз тоньше, или в 10 раз мощнее, если у него останется такой же размер.  Аккумулятор электромобиля Nissan Leaf «То, чего мы добились, является значительным шагом вперед для данной технологии и предполагает совершенно новые области для исследования. Мы не решили все проблемы, присущие этой химии, но наши результаты показывают маршруты вперед для изготовления практического устройства»,- написал профессор отдела химии Кембриджа, Клэр Грей. Хотя исследователи продемонстрировали батарею в лаборатории, они прогнозируют, что до начала производства готовых версий пройдет почти десять лет. Таким образом, хотя ваш следующий автомобиль, возможно, будет не с литий-воздушным аккумулятором, то следующий — вполне вероятно. |
Новичок в электромобилях? Начни отсюда
Электромобили. Плюсы и минусы Как почти все в жизни, электромобили имеют свои плюсы и минусы. На сайтах для рекламы электромобилей, как правило, намного больше преимуществ, чем недостатков, но это не значит, что мы не можем предложить честную оценку плюсов и минусов автомобилей, которые используют электроэнергию вместо нефти. Гибридный автомобиль. Что это Гибридный автомобиль лучше всего определить как средство, имеющее двигатель, способный переключаться между ископаемым топливом и альтернативным источником топлива. Как купить электромобиль Если вы подумываете о покупке электромобиля или просто хотите знать, из-за чего весь сыр-бор, это руководство предназначено в качестве резюме, чтобы помочь прояснить ситуацию. Домашняя зарядная станция. Обзор EVSE по существу не более, чем электрические устройства, позволяющие водителям безопасно подключить электромобиль к источнику электричества 220-вольт. Тем не менее, существуют важные различия между различными домашними зарядными устройствами.
Читать все статьи нашего Гида |
ekoavto.com
Представлены литий-кислородные аккумуляторы для электромобилей — Naked Science
©REUTERS/TAO LIU/HANDOUT VIA REUTERS
Два года назад одну из первых моделей литий-кислородного аккумулятора представила компания IBM в сотрудничестве с Сент-Эндрюсским университетом Шотландии. Один из электродов устройства был обычным электролитом, а второй представлял собой пустотелую углеродную мембрану. Планировалось, что она будет наполняться воздухом из окружающей среды, после чего кислород вступает в химическую реакцию с литием.Между тем, по данным Reuters, для нормальной работы литий-воздушных батарей будет все же требоваться чистый кислород, а не воздух, которым мы дышим. Также эксперты отмечают проблемы с безопасностью литий-кислородных устройств.
Ранее канадские ученые предложили в качестве альтернативы натрий-кислородные батареи. Как сообщалось весной текущего года в журнале Nature Chemistry, процесс их работы заключался в катализаторе переноса протонной фазы. Катализатор переносит образующиеся молекулы супероксида натрия (NaO2) в раствор. Там они разряжаются, формируя при этом кубические нанокристаллы. При перезарядке батареи эти кубические кристаллы растворяются в реакции, протекающей также с участием катализатора протонной фазы.naked-science.ru
Важный прорыв ученых на пути к созданию литий-кислородных аккумуляторов
Химики в Университете Уотерлу в Канаде успешно решили две наиболее важные проблемы, связанные с литий-кислородными аккумуляторами и создали рабочий прототип с почти 100-процентной кулоновской эффективностью.
Опубликованная недавно в журнале Science работа доказала, что четырёхэлектронная конверсия в литий-кислородной электрохимии легко обратима. Учёные впервые добились четырёхэлектронной конверсии, которая удваивает электронную ёмкость аккумуляторов на основе оксида лития (также называемых литий-воздушными).

«Существуют ограничения, накладываемые законами термодинамики, — говорит Линда Назар, ведущий автор проекта и профессор химического факультета. — Наша работа направлена на решение фундаментальных вопросов, которыми учёные занимаются уже длительное время».
Высокая теоретическая плотность энергии литий-кислородных (Li-O2) аккумуляторов и относительно малый вес сделали их «Священным Граалем» в области перезаряжаемых батарей. Но из-за давних проблем с химическим составом и стабильностью они представляли скорее академический интерес.
Две наиболее серьёзные проблемы возникают как результат реакции промежуточного продукта (супероксида LiO2) и пероксида (Li2O2) с пористым графитовым катодом, что разрушает ячейку изнутри. Кроме того, в этом процессе супероксид расходует органический электролит, что значительно сокращает число рабочих циклов аккумулятора.
Группа Назар заменила органический электролит на более стабильную расплавленную неорганическую соль, а пористый графитовый катод — на бифункциональный катализатор на основе оксида металла. Затем, эксплуатируя батарею при температуре 150 °С, они обнаружили, что вместо Li2O2 образуется более стабильный Li2O. В результате получается легко обратимая литий-кислородная батарея с кулоновской эффективностью близкой к 100 процентам.
Накапливая кислород в оксиде лития Li2O вместо пероксида Li2O2, батарея не только сохранила превосходные показатели зарядки, но и достигла максимальной доли четырёхэлектронной конверсии, увеличив теоретический объём запасаемой энергии на 50 процентов.
«Заменив электролит и катод и подняв температуру, мы добились отличной работы системы», — подвела итог Линда Назар.
ПОХОЖИЕ ЗАПИСИ
© Gearmix 2013 Права на опубликованный перевод принадлежат владельцам вебсайта gearmix.ru Все графические изображения, использованные при оформлении статьи принадлежат их владельцам. Знак охраны авторского права распространяется только на текст статьи. Использование материалов сайта без активной индексируемой ссылки на источник запрещено.
gearmix.ru
Прорыв на пути к созданию перезаряжаемой литий-кислородной батареи
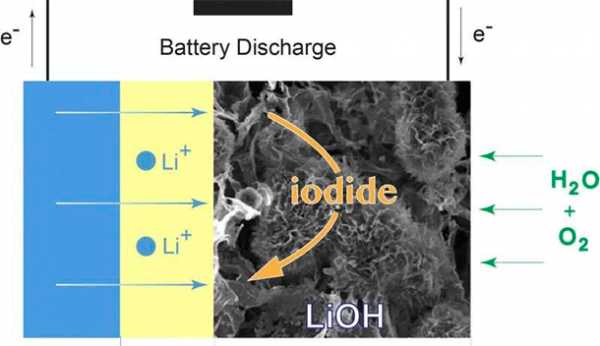
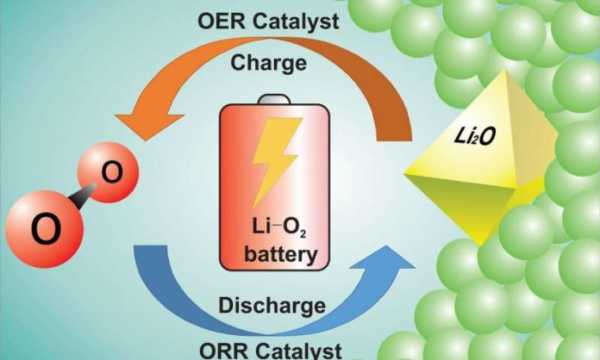 Четырехэлектронный окислительно-восстановительный процесс в Li-кислородной ячейке электрокатализируется бифункциональным литиевым сплавом на основе оксида никеля с расплавленной солью при повышенной температуре с образованием Li2OИзображение: Chun Xia and Chun Yuen Kwok
Четырехэлектронный окислительно-восстановительный процесс в Li-кислородной ячейке электрокатализируется бифункциональным литиевым сплавом на основе оксида никеля с расплавленной солью при повышенной температуре с образованием Li2OИзображение: Chun Xia and Chun Yuen Kwok Химики из Университета Ватерлоо успешно разрешили две из самых сложных проблем, связанных с литиево-кислородными батареями, и в результате создали рабочую батарею с почти 100-процентной кулоновской эффективностью.
Новая работа, появившаяся на этой неделе в Science, доказывает, что четырехэлектронное преобразование для электрохимии литий-кислород сильно обратимо. Команда первой достигла четырехэлектронного преобразования, которое удваивает электронное хранение литий-кислородных, также известных как литиево-воздушных, батарей.
«Существуют ограничения, основанные на термодинамике», — сказала Линда Назар, ученый из Канады по исследованиям в области полупроводниковых материалов и старший автор проекта. «Тем не менее, наша работа посвящена фундаментальным вопросам, которые люди давно пытаются решить».
Высокая теоретическая плотность энергии литий-кислородных (Li-O2) батарей и их относительно небольшой вес сделали их Святым Граалем систем перезаряжаемых батарей. Но давние проблемы с химией и стабильностью батареи сохранили их чисто академическим любопытством.
Две из серьезных проблем связаны с промежуточным звеном химии клеток (супероксид, LiO2) и пероксидным продуктом (Li2O2), взаимодействующим с пористым углеродным катодом, разрушающим клетку изнутри. Кроме того, супероксид потребляет органический электролит в процессе, что значительно ограничивает продолжительность цикла.
Назар и ее коллеги переключили органический электролит на более стабильную неорганическую расплавленную соль и пористый углеродный катод на бифункциональный катализатор на основе оксида металла. Затем, эксплуатировав батарею при 150°C, они обнаружили, что вместо Li2O2 образуется более стабильный продукт Li2O. Это приводит к высокооборотной Li-кислородной батарее с кулоновской эффективностью, достигающей 100 процентов.
Сохраняя O2 в качестве оксида лития (Li2O) вместо пероксида лития (Li2O2), батарея не только поддерживала отличные характеристики зарядки, но и достигала максимального четырехэлектронного переноса в системе, тем самым увеличивая теоретическое сохранение энергии на 50 процентов.
«Заменяя электролит и электродный хозяин и повышая температуру, мы показываем, что система работает замечательно», — сказала Линда Назар, которая также является профессором университета на кафедре химии в Ватерлоо.
C. Xia el al., «A high-energy-density lithium-oxygen battery based on a reversible four-electron conversion to lithium oxide,» Science (2018). science.sciencemag.org/cgi/doi … 1126/science.aas9343
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
ab-news.ru
Соединения лития с кислородом - Справочник химика 21
СОЕДИНЕНИЯ ЛИТИЯ С КИСЛОРОДОМ [c.44]
По мнению иностранных специалистов, возможной областью применения соединений лития является ракетная техника, где в качестве ракетного топлива можно использовать гидрид, борид лития и металлический литий. Сжигание 1 кг лития или некоторых его соединений дает до 4000 ккал (обычное ракетное топливо — керосин — 2300 ккал/кг). Перхлорат и нитрат лития характеризуются высоким содержанием кислорода (60,1 и 69,5% соответственно), а используемый в твердом ракетном топливе окислитель — перхлорат аммония — содержит лишь 54,4% кислорода. [c.13]
Органические соединения щелочных металлов. Соединения лития, натрия, калия вступают в те же реакции, что и магнийорганические соединения. Однако из-за крайней чувствительности этих соединений к кислороду воздуха (самовоспламенение ) и влаге, с органическими соединениями щелочных металлов работать менее удобно, чем с магнийорганическими. Поэтому их применяют только в тех случаях, когда требуются соединения с повышенной реакционной способностью. [c.327]Наряду с этим для определения содержания кислорода может быть использована реакция 0 (7, n)F a. В этом случае проба исследуемого вещества с добавкой соединения лития подвергается облучению в реакторе. [c.127]
Литий. Энергично разлагает воду, в хлоре, парах брома и иода воспламеняется . Будучи накален, литий горит в углекислом газе. Образует прочные соединения с кислородом, азотом, фосфором, серой и водородом. Хранят литий в парафине. Необходимо иметь в виду, что в закупоренных банках, где под слоем парафина хранится литий, создается сравнительно высокий вакуум [c.189]
Скорость и равномерность испарения пробы из канала угольного электрода дуги, обдуваемой потоком газа, а также вероятность попадания паров в зону возбуждения, характеризуемая величиной у (см. 4.2.1), зависят не только от состава стабилизирующего газа, но и от скорости его потока. На примере определения примесей в синтетических силикатных образцах, смешанных или сплавленных с буфером (соединением лития), показано [986], что в случае испарения пробы из канала анода графитовой дуги, стабилизированной потоком газовой смеси аргон—кислород (9 1), наибольшие значения у достигнуты при малой скорости потока (Юл/мин). [c.158]
Соединения лития, элемента с сильно выраженным электроположительным характером, более реакционноспособны, чем соединения Гриньяра. Поэтому они не так просты в обраш,ении, как реактивы Гриньяра. С литийорганическими соединениями необходимо работать при полном отсутствии влаги, кислорода и диоксида углерода в среде инертного газа (лучше всего аргона). [c.216]
Воспламеняющие (окисляющие) реактивы. Эти соединения, выделяя кислород, способствуют развитию пожара или горению другого вещества. К ним относятся перекиси металлов, некоторые кислоты и их соли, в том числе перекиси калия, натрия, лития, бария, кальция, магния, стронция, цинка, свинца, а также перекись водорода (пергидроль), азотная кислота и ее соли, соли кислот азотистой, хлорноватистой, бромноватистой, хлористой, хлорноватой, бромноватой, йодноватой и йодной, хлорная кислота и ее соли, соли надсерной, надборной и марганцовой кислот, хромовый ангидрид и соли хромовых кислот. [c.89]
Инертных газов металлический литий не растворяет. При взаимодействии лития с воздухом образуется продукт, где соотношение ЫгОл 3 1. При высокой влажности (100%) нит-ридообразование уступает место процессу образования гидроокиси лития ЫОН, которая частично карбонизируется [28]. Литий взаимодействует с азотом особенно интенсивно лишь при 300° С и полностью превращается в нитрид лития при 350° С. С сухим кислородом при низких температурах литий не реагирует, но при 200° С горит, при этом образуется окись лития. Пе-рекисные соединения лития вследствие сильного поляризующего действия его иона не образуются. [c.13]
Перхлорат лития и нитрат лития отличаются исключительно выгодными характеристиками по сравнению другими неорганическими окислителями, прежде всего из-за высокого содержания кислорода — в перхлорате лития кислорода 60,1%, в нитрате лития — 69,5%, в то время, как в перхлорате аммония, который применяется в большинстве высококачественных типов твердого ракетного горючего, содержание кислорода составляет только 54,4%. Кроме того, перхлорат и нитрат лития обладают более высокой плотностью, вполне удовлетворительны в отношении показателей токсичности и коррозионного действия, они также весьма стабильны, если защищены от воздействия воды. Пер хлорат и нитрат лития легко растворяются в спирте (в метаноле, например, растворяется 65% перхлората лития), что позволяет использовать их в производстве горючего с высоким содержанием энергии, большой плотностфю и высоким содержанием кислорода для жидкостных ракетных двигателей. По совокупности свойств эти соединения являются весьма перспективными окислителями для производства сложных типов ракетного горючего, а так- [c.20]
Выделение металла на катоде происходит при атмосферном давлении и высокой температуре. В этих условиях образуется целый ряд соединений лития с азотом, кислородом и другими составляющими элементами воздуха. Литий, полученный таким способом, обычно загрязнен другими щелочными металлами. Дальнейшая его очистка производится методом вакуумной дистилляции [1]. [c.80]
Экстрагент кислород- содержащих соединений серусодержащих соединений Лите- ратура [c.92]
Щелочные металлы и их соединения широко используются технике. Литий применяется в ядерной энергетике. В частности, изотоп Li служит промышленным источником для производства трития, а изотоп Li используется как теплоноситель в урановых реакторах. Благодаря способности лития легко соединяться с водородом, азотом, кислородом, серой, ои применяется в металлургии для удаления следов этнх элементов из металлов и сплавов. LiF и Li l входят в состав флюсов, используемых при ]]лавке металлов и сварке магння и алюминия. Используется лтий и его соединения и в качестве топлива для ракет. Смазки, содержащие соединения лития, сохраняют свои с1юйства при температурах от —60 до - -150°С. Гидроксид лития входит в состав электролита щелочных аккумуляторов (см. 244), благодаря чему в 2—3 раза возрастает срок их службы. Применяется литий также в керамической, стекольной и других отраслях химической промышленности. Вообще, по значимости в современной технике этот металл является одним из важнейших редких элементов. [c.564]
Соединения с кислородом. Как уже отмечалось, щелочные металлы активно соединяются с кислородом, причем состав продуктов этого взаимодействия зависит от природы металла. Например литий с кислородом в основном образует оксид LiaO [c.225]
Соединения с кислородом. Окись лития ЫгО — бесцветное кристаллическое вещество с кубической гранецентрированной решеткой типа флюорита СаРз а = 4,628 А), построенной из четырех молекул (2 = 4) [10, 18]. Плотность 2,013г/см (25°) [10], температура плавления 1427° [10], кипения — около 2600° [10], теплота образования Д//°298 = —142,4 ккал/моль [10]. Термически устойчивое соединение [10]. Сублимация начинается выше 1000°. В вакууме давление пара ЬцО при 1000° еще незначительно, ко в присутствии паров воды возрастает. Это объясняется реакцией, в которой благоприятное изменение свободной энергии определяется возрастанием энтропии с образованием второй молекулы газа [10] [c.9]
При окислении на воздухе щелочные металлы образуют различные кислородные соединения-, литий — оксид Ь1гО, натрий — пероксид КагОг, а калий, рубидий и цезий — надпероксиды КО2, КЬОг и СзОг. Металлы ПА-группы с кислородом образуют оксиды МО. [c.114]
Расчет парциальных давлений лития и кислорода над LI2O, основанный на принятых в Справочнике термодинамических свойствах соединений лития, привел к значениям, которые на 7% меньше вычисленных в работе [758]. Соответствующая разность была учтена при проведении расчетов, так как в работе [758] парциальные давления лития и кислорода были использованы при вычислении давлений LiO. [c.881]
Перекиси металлов. Для щелочных металлов, кроме лития, и для высших щелочноземельных металлов именно перекиси, а не окиси являются нормальными продуктами их соединения с кислородом. Наличие в структуре ЫагОа спаренных атомов кислорода, образующих отрицательно двухзарядный анион О2" , доказано при помощи структурного анализа перекиси натрия. [c.165]
Следовательно, с увеличением атомного веса химические свойства элементов изменяются периодически. Через определенное число элементов свойства как бы повторяются (разумеется, с некоторыми качественными отличиями). Периодически изменяются также й формы соединений элементов. Например, аналогичны соединения с кислородом у лития и натрия (Li20, МазО), у бора и алюминия (В2О3, А1аОз), у азота и фосфора (КаОз, РгОв) и т. д. [c.73]
Из других элементов второго периода периодической системы бор и бериллий образуют расщепляемые на антиподы соединения, в которых центральный атом является четырехлигандным (т. е. связан с четырьмя атомами или группами от латинского слова ligare — связывать). Четырехлигандные соединения остальных элементов второго периода — лития, кислорода, фтора и неона — неизвестны. [c.64]
Позевский и Коггешелл [50] провели недавно исследование для того, чтобы выяснить, можно ли применить представление о характеристичности для частот валентных колебаний С—Н к соединениям, содержащим кислород и серу. Они исследовали 24 содержащих серу соединения и 45 кислородсодержащих соединений, используя высокую дисперсию призмы из фтористого лития. Полученные ими результаты приводятся ниже. [c.19]
Снова обращает на себя внимание соединение лития Ь102. Оно было синтезировано совсем недавно, и имеются убедительные доказательства того, что молекула представляет собой равносторонний треугольник. Атом лития можно представить себе внедренным в связь кислород — кислород в кластерной группировке. Возможно, ли, что это сказывается влияние незанятых валентных орб.италей [c.239]
Использование во вторичной реакции тритонов кислорода требует применения при определении изотопного состава лития одинаковых кислородных соединений для образцов и эталонов,, например, Liz Oa или же добавления соединений, содержащих кислород (в частности, возможно использование водных растворов солей лития) при облучении нейтронами. Ранее вторичная реакция с 0 была использована для определения примеси кислорода в бериллии [1138] и других материалах [255, 650, 651,. 1019, 1020]. [c.125]
chem21.info
Высокотемпературный литий-кислородный (воздушный) аккумулятор
Изобретение относится к электрохимическим устройствам, в частности к вторичным источникам тока, работающим при высоких температурах, и может быть использовано для аккумулирования электрической энергии в различных отраслях народного хозяйства. Изобретение позволяет повысить электрические характеристики с одновременным понижением рабочей температуры. Аккумулятор состоит из анода (металлический литий), катода (газодиффузионный кислородный электрод) и двух электролитов (твердого и расплавленного). Твердый электролит - литийпроводящий. 2 з.п.ф-лы, 3 ил., 2 табл. Референт В.Р.Чернова
Изобретение относится к вторичным источникам тока, работающим при высоких температурах, и может быть использовано для аккумулирования электрической энергии в различных отраслях народного хозяйства, где необходимы высокая удельная энергия и, одновременно, высокая удельная мощность, в частности, в электротранспорте.
Одной из наиболее эффективных электрохимических пар является пара литий-кислород, расчетная удельная энергоемкость которой может достигать величины 4500 Втч/кг, а без учета веса окислителя, т.е. при работе на воздухе - до 10000 Втч/кг. Учитывая соотношение реальной и теоретической удельной энергии в традиционных и разрабатываемых аккумуляторах, можно ожидать, что предлагаемый вариант аккумулятора обеспечит реальную удельную энергоемкость не менее 200 Втч/кг, что пока недостижимо для любых других видов аккумуляторов. Используемые в настоящее время традиционные аккумуляторы для электротранспорта с водным электролитом: свинцовые, никель-кадмиевые и никель-гидридные имеют энергоемкость менее 100 Втч/кг. Разрабатываемые высокотемпературные аккумуляторы для электромобиля имеют следующую практическую энергоемкость: натрий-никель- хлоридные 100-120 Втч/кг Bohm (H) Techn. Mitt. RTT. 68, 425, 1990), натрий-серные 120-150 Втч/кг (Садуорс Дж., Тилли А. Серно-натриевые аккумуляторы. - М.: Мир. 1988), литий (сплав лития с алюминием) - дисульфиджелезные - 150-180 Втч/кг (Разработка герметичной аккумуляторной батареи на основе системы Li(сплав)/FeS с биполярными электродами для электромобиля. ЭИ, ППЭ, N 2,2-11, 1994). Наиболее близким является литий-кислородный аккумулятор [l] (Kristina W. Semkow and Antony F. Sammells. J. Electrochem. Soc. 134, 2084-5, 1987) с электрохимической системой (см. табл.1), работающий в интервале 600-850oC. Токообразующий процесс описывается следующей реакцией: Описанный аккумулятор имеет целый ряд существенных недостатков: 1. Высок рабочий температурный интервал (заявленный в статье он составляет 600 - 850oC. Известно, что используемый в аккумуляторе твердый электролит на основе оксида циркония удовлетворительно работает при температурах порядка 800oC. Снижение рабочей температуры приводит к существенному ухудшению рабочих характеристик, что видно из приводимого в статье графика - см. фиг. 2[1] (снижение температуры с 800 до 650oC ухудшает характеристики примерно в два раза). 2. Наличие в анодном расплаве растворенного оксида лития неизбежно должно вести к взаимодействию его с твердым электролитом с образованием цирконата лития, что приведет к невозможности сколько-нибудь длительной работы аккумулятора. Видимо, по этой причине в работе не приводятся данные о количестве циклов заряд-разряд, которые являются одной из главных характеристик работы любого аккумулятора. К коррозии твердого электролита с образованием того же продукта будет приводить и литий, растворенный в электролите, из анодного сплава. 3. Использование в качестве анодного материала литиевого сплава FeSi2Lix, а не чистого лития приводит к существенному снижению активности анода. Использовать же чистый литий данная конструкция не позволяет опять же по причине коррозии (взаимодействие растворенного в анодном расплаве лития с материалом твердого электролита). Использование сплава приводит также к многоступенчатости разрядной кривой (см. фиг. 4 [1]) и к снижению величины НРЦ. 4. Использование в качестве анодного материала литиевого сплава неизбежно обуславливает низкий ток (а значит длительное время) заряда, так как процесс интеркаляции лития - медленный. Кроме того, в случае перезаряда возможно разрушение сплава. Задачей настоящего изобретения является повышение электрических характеристик аккумулятора с одновременным понижением рабочей температуры. Решение поставленной задачи достигается тем, что предлагаемый высокотемпературный литий-кислородный (воздушный) аккумулятор имеет электрохимическую схему, приведенную в табл.2. Токоооразующая реакция имеет вид 2Li + 1/2 O2 = Li2O. В предлагаемом аккумуляторе в качестве анодного материала используется чистый литий, что предпочтительнее использования сплава. Система с анодом из чистого лития имеет следующие преимущества: а. более высокая ЭДС, б. более высокая энергоемкость, в. возможность вести заряд аккумулятора большими токами, г. нет опасности перезаряда. В предлагаемом аккумуляторе используется твердый электролит с высокой литийкатионной проводимостью и низкой электронной проводимостью, который коррозионно устойчив к расплавленному электролиту и к растворенным в нем компонентам (Li и Li2O). В качестве твердого электролита использовали один из двойных оксидов лития и следующих элементов: Al, Be, Y, Sc, Zr, Hf и лантонидов. Расплавленный электролит не содержит фторидов, которые также являются коррозионно активными агентами. Катод (кислородный электрод) предлагаемого аккумулятора представляет собой газодиффузионный электрод. В качестве материала катода могут быть использованы либо литированный оксид никеля, либо кобальтиты и манганиты лантана-стронция, либо ферриты и кобальтиты лития или композиты на их основе, либо другие ионно-электронные проводники. Ионно-электронные проводники предпочтительнее, поскольку имеет место доставка кислорода к зоне электрохимической реакции через объем электрода и отпадает необходимость в применении пористых электродов. На фиг. 1 представлена лабораторная модель аккумулятора с катодом из кобальтита лантана-стронция. Пример 1. В стакан из оксида бериллия 1 помещен предварительно приготовленный карбонатно-хлоридный электролит, содержащий растворенный оксид лития 2. В расплав помещена анодная камера, выполненная в виде трубки из оксида бериллия 3. К дну трубки приварена таблетка твердого литийпроводящего электролита 4. Внутри трубки помещен анодный материал из расплавленного лития 5. Рядом с анодной камерой в расплав 2 помещен катод из кобальтита лантана-стронция 6, выполненный в виде пробирки, через которую с помощью газоподводящих трубок 7 осуществляли проток рабочего газа (кислород, воздух). Собранную конструкцию помещали в электрическую печь, температуру которой поднимали до 620oC. Данную модель аккумулятора испытывали на разряд в гальваностатическом режиме при плотности тока 100 мА/см2. Расчет плотности тока проводили на площадь твердого электролита. В процессе разряда была снята I - V - кривая (фиг. 3, кривая 1). Пример 2. Лабораторная модель аккумулятора с катодом из литированного оксида никеля (фиг. 2). В стакан из оксида бериллия 1 помещали карбонатно-хлоридный расплав 2, содержащий растворенный оксид лития. В расплав помещали трубку из оксида бериллия 3, которая выполняла роль анодной камеры. К дну трубки была приварена таблетка твердого литийпроводящего электролита 4. Внутрь трубки помещали небольшое количество расплавленного электролита из смеси галогенидов лития 5. Анодный токоотвод 6 был выполнен из крупноячеистого железа. Катод аккумулятора был выполнен из крупноячеистого никеля в виде кольца 7, опоясывающего анодную камеру. При погружении катода в расплав поверхность никеля окислялась и, взаимодействуя с расплавом, литировалась. Катодным газом, в данном случае, служил окружающий воздух. Литий в анодное пространство не загружали, а получали его в процессе заряда аккумулятора. Заряд проводили в потенциостатическом режиме при напряжении 3 В, разряд - 1 в гальваностатическом режиме при плотности тока 100 мА/см2. Данный вариант аккумулятора подвергали циклированию. На фиг. 3 приведена разрядная кривая аккумулятора, полученная при 620oC после пятого цикла (кривая 2). Для сравнения на этом же рисунке приведены разрядные кривые прототипа, полученные при 650(3) и 850oC (4). Из приведенного графика видно, что наши разрядные кривые, полученные при пониженной температуре, существенно превосходят разрядные кривые прототипа. Если взять, например, значение плотности тока 100 мА/с2, то напряжение на клеммах аккумулятора будет для наших примеров для температуры 620oC 2,0 В (пример 1) и 2,2 В (пример 2). Для прототипа - 1, 2 В (650oC и 1,7 В (800oC). Таким образом, поставленную задачу можно считать выполненной: при меньшем значении рабочей температуры получены более высокие электрические характеристики.Формула изобретения
1. Высокотемпературный литий-кислородный (воздушный) аккумулятор, содержащий анод, катод и находящиеся между ними твердый и расплавленный электролиты, отличающийся тем, что анод выполнен из лития, контактирует с твердым литийпроводящим электролитом, с противоположной стороны которого расположен оксидный или оксидно галогенидный расплавленный электролит, с помещенным в него катодом. 2. Аккумулятор по п.1, отличающийся тем, что в качестве твердого электролита используется оксидная композиция с высокой литийкатионной проводимостью, коррозионно-устойчивая по отношению к литию и расплавленному электролиту. 3. Аккумулятор по п.1, отличающийся тем, что расплавленный электролит представляет собой композицию литиевых солей кислородсодержащих кислот или их смесь с галогенидами лития.РИСУНКИ
Рисунок 1, Рисунок 2, Рисунок 3, Рисунок 4, Рисунок 5www.findpatent.ru