Содержание
Молекула ДНК на зеленом фоне. Стоковое фото № 4820601, фотограф Sergey Nivens / Фотобанк Лори
Для полноценной работы с фотобанком необходимо, чтобы в браузере был включён JavaScript.
Пожалуйста, включите его.
Интернет | стандартная¹ лицензия | расширенная² лицензия | |
| www | 1000×500 пикс., 72 dpi | 200 ₽р. | 1 200 ₽р. 1482×742 |
Интернет и полиграфия | |||
| A7 | 13×6 см 1482×742 пикс., | 260 ₽р. | 1 200 ₽р. |
| A6 | 18×9 см 2097×1049 пикс. | 360 ₽р. | 2 200 ₽р. |
| A5 | 25×13 см 2966×1483 пикс., | 700 ₽р. | 4 400 ₽р. |
| A4 | 36×18 см 4194×2098 пикс., | 1 900 ₽р. | 6 800 ₽р. |
Другие виды | |||
| Использование в наружной рекламе | — | 9 600 ₽р. | |
| Печать в частных целях³ | 1 400 ₽р. | — | |
(пакетом дешевле)
Время верстать календари!
Изображение № 4820601
©
Sergey Nivens
/ Фотобанк ЛориDNA molecule is located in front of a colored background.
 abstract collage
abstract collage
- Похожие изображения
Входит
в один альбом.- Рубрики каталога
Наука
107023,
Москва,
площадь Журавлёва, д. 10, офис 214,
Фотобанк Лори(адрес для отправки документов курьером)
125009,
Москва,
ул. Тверская, д. 9,
Тверская, д. 9,
а/я 123,
Фотобанк Лори(почтовый адрес — только для писем и документов)
Все контакты и реквизиты
Покупателям
- О фотобанке
- Условия лицензий
- Образцы лицензий и договоров
- Договор оферты на оказание услуг
- Реквизиты ООО «Лори»
Авторам
- Агентский договор
- Инструкция по работе с фотобанком
- Список авторов фотобанка
- Баннеры фотобанка Лори
- Политика конфиденциальности
Мы в социальных сетях
Спецпроекты
- Наши работы в действии
- Проект «Хорошая кухня»
- Эксклюзивная коллекция
Основные разделы
- Свежие поступления
- Последние продажи
- Тематические подборки
- Рубрики фотобанка
- Справка по фотобанку
Наши друзья
Генетические ножницы: острым по живому
Декабрь 2020 г.
Джеймс Нертон, внештатный журналист
7 октября 2020 г. Нобелевская премия по химии была присуждена директору подразделения Общества Макса Планка по изучению патогенов профессору Эмманюэль Шарпантье (Берлин, Германия) и исследователю из Калифорнийского университета в Беркли профессору Дженнифер А. Дудне (США) «за метод редактирования генома». Открытые ими «генетические ножницы» CRISPR-Cas9 — одно из важнейших научных достижений этого столетия. Это открытие способно кардинально изменить сельское хозяйство и медицину и даже помочь в лечении наследственных болезней, таких как болезнь Гентингтона, муковисцидоз и некоторые виды рака. Вместе с тем, как отмечают сами исследователи, оно порождает сложные этические, патентные и политические вопросы, изучение которых только начинается.
Профессор Дженнифер А. Дудна (слева) и профессор Эмманюэль Шарпантье (справа) совместно удостоились Нобелевской премии по химии за открытие «генетических ножниц» CRISPR-Cas9, ставших одним из важнейших научных достижений XXI века. (Фото: KEYSTONE/dpa/Alexander Heinl)
(Фото: KEYSTONE/dpa/Alexander Heinl)
Сотрудничество между профессором Шарпантье и профессором Дудной позволило им объединить свой опыт в области изучения патогенных бактерий и РНК-интерференции соответственно. Оно началось в 2011 г. и оказалось, по словам профессора Шарпантье, «непродолжительным и интенсивным», но его результаты будут влиять на нашу жизнь в течение многих лет. Главным достижением ученых было обнаружение того, что CRISPR — встроенный в ДНК бактерий естественный защитный механизм — и фермент Cas9 можно запрограммировать на разрезание молекулы ДНК в любой точке.
Как объяснил председатель Нобелевского комитета по химии профессор Клас Густафссон в статье, опубликованной Шведской королевской академией наук , «создание этой технологии позволило ученым изменять нуклеотидные последовательности ДНК в самых разных клетках и организмах. Манипуляции с геномом более не представляют трудностей при проведении экспериментов. Сегодня технология CRISPR-Cas9 широко используется в фундаментальной науке, биотехнологиях и при разработке терапевтических средств будущего».
ДНК (дезоксирибонуклеиновая кислота) — присутствующая во всех клетках молекула, которая содержит генетические инструкции.
РНК (рибонуклеиновая кислота) — одноцепочечная молекула, которую иногда называют «сородичем» ДНК.
CRISPR (короткие палиндромные повторы, регулярно расположенные группами) — группы повторяющихся последовательностей ДНК.
Cas — CRISPR-ассоциированные белки, которые вырезают вирусную ДНК. Известно 93 таких белка, один из которых — Cas9.
TracrRNA — транс-активационная РНК, благодаря которой длинная РНК, созданная на основе последовательности CRISPR, переходит в активную форму.
Революционный инструмент для создания биологических систем
“CRISPR-Cas9 — эффективный инструмент, который сделал редактирование генов более быстрым, точным, дешевым и простым. Эта технология способна также кардинально изменить жизнь общества и может применяться во многих сферах, в том числе в медицине, сельском хозяйстве и производстве биотоплива», — отмечает директор Центра права, медицины и наук о жизни Кембриджского университета доктор Кэти Лидделл (Соединенное Королевство). Согласно данным Реестра исследований в области редактирования генома человека Всемирной организации здравоохранения, по состоянию на октябрь 2020 г. проводилось 115 клинических исследований с применением технологий редактирования генома человека, в том числе для лечения широко распространенных генетических заболеваний, таких как серповидноклеточная анемия и бета-талассемия. В марте 2020 г. генная терапия с использованием технологии CRISPR-Cas9 была впервые проведена у человека, а именно у пациента с редким заболеванием — амаврозом Лебера (тип 10), который приводит к развитию слепоты у детей и в настоящее время не поддается лечению никакими другими методами. В данном случае генная терапия была использована для удаления в соответствующем гене (CEP290) мутации, вызывающей амавроз Лебера.
Согласно данным Реестра исследований в области редактирования генома человека Всемирной организации здравоохранения, по состоянию на октябрь 2020 г. проводилось 115 клинических исследований с применением технологий редактирования генома человека, в том числе для лечения широко распространенных генетических заболеваний, таких как серповидноклеточная анемия и бета-талассемия. В марте 2020 г. генная терапия с использованием технологии CRISPR-Cas9 была впервые проведена у человека, а именно у пациента с редким заболеванием — амаврозом Лебера (тип 10), который приводит к развитию слепоты у детей и в настоящее время не поддается лечению никакими другими методами. В данном случае генная терапия была использована для удаления в соответствующем гене (CEP290) мутации, вызывающей амавроз Лебера.
Вместе с тем технология CRISPR-Cas9 получила и порцию критики — из-за затяжных (и все еще не закончившихся) патентных тяжб и этических споров о «детях на заказ». По словам профессора Колледжа права Иллинойского университета в Урбане-Шампейне (США) Джейкоба C. Шеркова, это подтверждает тот факт, что CRISPR-Cas9 является «важнейшим достижением в области биотехнологий за последние 40 лет». «Эта технология позволяет ученым, исследователям и разработчикам точно редактировать геном живой клетки. Другими словами, можно редактировать программное обеспечение, которое делает нас живыми», — добавляет он.
Шеркова, это подтверждает тот факт, что CRISPR-Cas9 является «важнейшим достижением в области биотехнологий за последние 40 лет». «Эта технология позволяет ученым, исследователям и разработчикам точно редактировать геном живой клетки. Другими словами, можно редактировать программное обеспечение, которое делает нас живыми», — добавляет он.
Ответственный подход к разработкам
Оба нобелевских лауреата еще на раннем этапе осознали значение своего открытия. Профессор Дудна рассказала о том, что к 2014 г. она стала ощущать все большую необходимость проведения широкого обсуждения этических аспектов. В начале 2020 г. она заявила корреспонденту газеты Financial Times: «Мы должны думать о более широких последствиях этой грандиозной технологии и о том, как использовать ее возможности ответственным образом». При содействии профессора Дудны был создан Институт инновационной геномики в Беркли (Калифорния, США), ректором и председателем правления которого она в настоящее время является. Задачи института заключаются в повышении осведомленности широкой общественности, предоставлении ресурсов широкому кругу субъектов и установлении ориентиров для этичного использования генных технологий.
Задачи института заключаются в повышении осведомленности широкой общественности, предоставлении ресурсов широкому кругу субъектов и установлении ориентиров для этичного использования генных технологий.
Этические вопросы вышли на передний план в ноябре 2018 г., когда китайский ученый Хэ Цзянькуй объявил, что использовал технологию CRISPR-Cas9 в ходе эксперимента по рождению девочек-близнецов с отредактированным геномом. Другие ученые осудили это исследование, в том числе профессор Дудна, которая сразу же прилетела в Гонконг (САР) для проведения расследования. Впоследствии Хэ Цзянькуй был уволен из университета, в котором работал, оштрафован и приговорен к трем годам лишения свободы.
Манипуляции с геномом более не представляют трудностей при проведении экспериментов.
Это был из ряда вон выходящий случай: исследование Хэ Цзянькуя не было регламентировано, а его результаты не были опубликованы и вообще вызывают сомнение с научной точки зрения (к его заявлению о том, что генетически модифицированные эмбрионы будут невосприимчивы к ВИЧ, отнеслись с изрядным скептицизмом). Профессор Шерков отмечает, что этические споры о редактировании человеческих эмбрионов с целью предотвратить генетические заболевания или добиться определенных черт не являются чем-то новым и ведутся с момента появления экстракорпорального оплодотворения (ЭКО) в 1970-х гг. «Некоторые опасения по поводу CRISPR-Cas9 сильно преувеличены. Эта технология не так уж и отличается от методов, используемых в настоящее время», — отмечает он.
Профессор Шерков отмечает, что этические споры о редактировании человеческих эмбрионов с целью предотвратить генетические заболевания или добиться определенных черт не являются чем-то новым и ведутся с момента появления экстракорпорального оплодотворения (ЭКО) в 1970-х гг. «Некоторые опасения по поводу CRISPR-Cas9 сильно преувеличены. Эта технология не так уж и отличается от методов, используемых в настоящее время», — отмечает он.
С ним согласна и доктор Лидделл, которая отмечает следующее: «Например, у нас, в Соединенном Королевстве, имеется опыт широкого, прагматичного обсуждения спорных с этической точки зрения вопросов, таких как ЭКО и пренатальный скрининг. Важно внимательно изучить аргументы о том, действительно ли редактирование унаследованных генов наносит реальный вред обществу или общечеловеческим ценностям». Во многих странах (включая Соединенное Королевство) исследования в области экстракорпорального оплодотворения регулируются тем или иным государственным органом, что позволяет обсуждать и решать новые вопросы по мере их возникновения.
Роль патентной системы
Этические вопросы, возникающие в связи с CRISPR-Cas9, не ограничиваются редактированием зародышевой линии человека. Возможность использования данной технологии для преобразования биологических систем порождает следующие вопросы: кто должен решать, каким образом и кем эта технология может использоваться и какие способы ее применения безопасны и социально приемлемы; каким исследованиям необходимо отдавать приоритет; как обеспечить справедливый доступ к передовым терапевтическим средствам, один курс лечения которыми может стоить миллионы долларов, особенно в финансируемых государством системах здравоохранения; каковы социально-экономические последствия модификации генов сельскохозяйственных или энергетических культур для фермеров и сельскохозяйственных рабочих и какое влияние такое использование этой технологии окажет на экологические системы.
Некоторые из этих вопросов неизбежно касаются роли патентной системы, которая призвана стимулировать инновации на благо всего общества. За последнее десятилетие ученые подали тысячи патентных заявок, связанных с технологией CRISPR, что свидетельствует о важности патентов в привлечении и стимулировании инвестиций в научные исследования и технологические разработки. Как сказала сама профессор Дудна: «Создан огромный пласт ИС [интеллектуальной собственности]. Интересно, во что все это выльется в будущем, когда у нас появятся реально полезные продукты». Компания MPEG LA, занимающаяся лицензированием использования стандартов, предложила даже создать совместную платформу для лицензирования CRISPR-Cas9 (патентный пул) в целях расширения доступа к соответствующим запатентованным технологиям.
За последнее десятилетие ученые подали тысячи патентных заявок, связанных с технологией CRISPR, что свидетельствует о важности патентов в привлечении и стимулировании инвестиций в научные исследования и технологические разработки. Как сказала сама профессор Дудна: «Создан огромный пласт ИС [интеллектуальной собственности]. Интересно, во что все это выльется в будущем, когда у нас появятся реально полезные продукты». Компания MPEG LA, занимающаяся лицензированием использования стандартов, предложила даже создать совместную платформу для лицензирования CRISPR-Cas9 (патентный пул) в целях расширения доступа к соответствующим запатентованным технологиям.
Хронология исследований
1953 г.: Фрэнсис Крик и Джеймс Уотсон устанавливают молекулярную структуру ДНК.
1987 г.: Йоcидзуми Исино обнаруживает повторяющиеся структуры в ДНК прокариотов.
1993 г.: Франсиско Хуан Мартинес Мохика придумывает термин «CRISPR».
2005 г.: Мохика выдвигает предположение о том, что CRISPR обеспечивает защиту от внедрения чужеродной ДНК.
2008 г.: Эрик Сонтеймер и Лучано Маррафинни определяют, что механизм CRISPR представляет собой инструмент для редактирования генов.
Весна 2011 г.: микробиолог Эмманюэль Шарпантье и биохимик Дженнифер Дудна проводят встречу во время конференции в Пуэрто-Рико и впервые обсуждают CRISPR-Cas9.
Июнь 2012 г.: профессор Шарпантье и профессор Дудна вместе с другими исследователями публикуют в журнале Science результаты своего исследования под названием «Программируемая двойная-РНК-направляемая эндонуклеаза ДНК в адаптивном иммунитете бактерий» (A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity).
Март 2013 г.: Венский университет и Калифорнийский университет подают в США заявку на патент под названием «Способы и композиции для направляемой РНК целевой модификации ДНК и для направляемой РНК модуляции транскрипции» (Methods and compositions for RNA-directed target DNA modification and for RNA-directed modulation of transcription) (дата приоритета — 25 мая 2012 г. ). В числе изобретателей указаны профессор Шарпантье и профессор Дудна.
). В числе изобретателей указаны профессор Шарпантье и профессор Дудна.
Декабрь 2012 г.: Фэн Чжан из Института Бродов публикует статью, демонстрирующую, что CRISPR работает в клетках эукариотов, а затем подает заявки на патенты в США. В ВПТЗ США начинается серия разбирательств между Калифорнийским университетом в Беркли и Институтом Бродов по делу о столкновении патентных притязаний, последнее решение по которому опубликовано в сентябре 2020 г.
Октябрь 2020 г.: профессор Шарпантье и профессор Дудна удостоены Нобелевской премии по химии «за разработку метода редактирования генома».
И грянут патентные битвы
Профессор Шарпантье и профессор Дудна подали первую заявку в США в 2013 г., и на основании Договора о патентной кооперации (опубликован под условным обозначением WO/2013/176772) ее действие распространяется на многие другие страны. С 2015 г. Калифорнийский университет в Беркли и Венский университет (заявители на получение патента) ведут в Ведомстве США по патентам и товарным знакам (ВПТЗ США) спор по делу о столкновении патентных притязаний с Институтом Бродов (США) с целью определить, является ли заявка последнего действительной. Споры между ними ведутся и в других юрисдикциях. Эти споры все еще рассматриваются, что, по словам профессора Шеркова, повышает вероятность дальнейших судебных разбирательств. «Один из основных вопросов заключается в том, почему эти споры не урегулированы и кто не желает их урегулирования. Ставки очень высоки, и мы еще можем увидеть масштабное разбирательство относительно того, кто первым придумал “единую направляющую РНК”, и различные ученые будут в этом разбирательстве свидетелями», — отмечает Шерков.
Споры между ними ведутся и в других юрисдикциях. Эти споры все еще рассматриваются, что, по словам профессора Шеркова, повышает вероятность дальнейших судебных разбирательств. «Один из основных вопросов заключается в том, почему эти споры не урегулированы и кто не желает их урегулирования. Ставки очень высоки, и мы еще можем увидеть масштабное разбирательство относительно того, кто первым придумал “единую направляющую РНК”, и различные ученые будут в этом разбирательстве свидетелями», — отмечает Шерков.
До сих пор, что может показаться удивительным, патентные споры касались широты охраны и приоритета, а не патентоспособности объектов. По словам директора Научно-исследовательского института интеллектуальной собственности Королевы Марии Лондонского университета (Соединенное Королевство) профессора Дункана Мэтьюса патентная система является «частью механизма регулирования технологий», таких как CRISPR-Cas9. В частности, во многих законах о патентах предусмотрена возможность признания изобретения непатентоспособным в случае нарушения принципов морали или общественного порядка. Соответствующие положения определены в национальном патентном законодательстве и рассматриваются в документе , подготовленном Постоянным комитетом ВОИС по патентному праву (последнее обновление — в апреле 2020 г.). «Я считаю, что патентные эксперты Европейского патентного ведомства, которое применяет положение о признании изобретения непатентоспособным в случае нарушения принципов морали, отлично работают, не отклоняя заявки полностью, а принимая притязания на комбинации или векторные системы (способы доставки) для редактирования генома. Они следуют букве закона», — отмечает профессор Мэттьюс, который создал экспертную группу по патентам и редактированию генома для изучения этого вопроса. «Что касается других патентных систем, то, возможно, еще слишком рано судить [как будут толковаться такие положения], и еще не было споров, касающихся признания изобретений непатентоспособными на том основании, что они нарушают принципы морали или представляют собой продукты природы».
Соответствующие положения определены в национальном патентном законодательстве и рассматриваются в документе , подготовленном Постоянным комитетом ВОИС по патентному праву (последнее обновление — в апреле 2020 г.). «Я считаю, что патентные эксперты Европейского патентного ведомства, которое применяет положение о признании изобретения непатентоспособным в случае нарушения принципов морали, отлично работают, не отклоняя заявки полностью, а принимая притязания на комбинации или векторные системы (способы доставки) для редактирования генома. Они следуют букве закона», — отмечает профессор Мэттьюс, который создал экспертную группу по патентам и редактированию генома для изучения этого вопроса. «Что касается других патентных систем, то, возможно, еще слишком рано судить [как будут толковаться такие положения], и еще не было споров, касающихся признания изобретений непатентоспособными на том основании, что они нарушают принципы морали или представляют собой продукты природы».
Мы должны думать о более широких последствиях этой грандиозной технологии и о том, как использовать ее возможности ответственным образом.
Дженнифер А. Дудна
Патенты в качестве механизма регулирования технологий
Профессор Мэттьюс считает, что в работе больше внимания следует уделять вопросу о том, должны ли патентные ведомства позволять патентовать изобретения в области генома: «До настоящего момента дебаты о редактировании генома человека, как правило, не касались патентов. Недавно я удостоился чести выступить перед Консультативным комитетом экспертов ВОЗ, который занимается вопросом о патентах в качестве части механизма регулирования редактирования генома человека». Международная группа экспертов ВОЗ была создана в декабре 2018 г., а в июле 2019 г. опубликовала заявление по вопросам контроля и надзора.
Профессор Мэттьюс отмечает, что патентная система может стать средством предотвращения недобросовестных исследований: «Патенты можно было бы использовать ответственным образом, чтобы не допустить бесконтрольного использования технологий с помощью системы оценки соответствия этическим нормам».
Открытие профессора Шарпантье и профессора Дудны показало, что молекулу ДНК можно «разрезать» в любой точке, используя для этого CRISPR — встроенный в ДНК бактерий естественный защитный механизм — и фермент Cas9. (Фото: © Йохан Йарнеcтад/Шведская королевская академия наук)
Смелый взгляд в будущее
Хотя непосвященным детали технологии редактирования генома могут показаться сложными, ученые говорят об относительной простоте инструмента CRISPR-Cas9, благодаря которой он стал доступен исследователям во всем мире в самых разных областях. По словам профессора Шеркова, «в течение последних нескольких лет стали набирать обороты академические исследования, посвященные CRISPR», несмотря на широко освещаемые патентные битвы. «Возможности CRISPR ограничены лишь человеческой фантазией», — отмечает он.
Огромный вклад в эти исследования внесли нобелевские лауреаты, и имя каждого их них фигурирует в десятках патентных заявок. Профессор Шарпантье лицензировала ИС биотехнологическим компаниям CRISPR Therapeutics и ERS Genomics, а профессор Дудна стала одним из учредителей компаний Caribou Biosciences, Intellia Therapeutics и Mammoth Biosciences. «Впервые в истории Нобелевскую премию по химии разделили две женщины, и они станут примером для подражания, особенно для увлеченных наукой девушек во всем мире», — говорит доктор Лидделл.
«Впервые в истории Нобелевскую премию по химии разделили две женщины, и они станут примером для подражания, особенно для увлеченных наукой девушек во всем мире», — говорит доктор Лидделл.
Возможности CRISPR ограничены лишь человеческой фантазией.
Джейкоб C. Шерков
Их работа вдохновила сотни других исследователей, опубликовавших статьи о применении CRISPR-Cas9 в различных организмах. Ученые исследуют потенциал и других систем, связанных с CRISPR, таких как Cas12a и Cas13, в том числе для диагностики и лечения COVID-19. В некоторых из этих исследований используются мощные инструменты на основе искусственного интеллекта, включая машинное обучение и глубокое обучение, с тем чтобы добиться большей предсказуемости и уменьшить вероятность побочных эффектов. Менее чем за 10 лет, прошедших после эпохального открытия профессора Шарпантье и профессора Дудны, уже удалось добиться огромных успехов, и, кажется, не за горами и другие достижения.
Прочесть историю по ДНК | Наука и жизнь
Ещё совсем недавно заглянуть в прошлое — узнать, где жили люди, какой образ жизни вели, на каком языке говорили и кого из них можно считать нашими предками, — могли только археологи, историки и лингвисты. В последние десятилетия к ним присоединились генетики, которые создали мощнейший инструмент — исследование древней ДНК (палеоДНК). Молекула ДНК, основной носитель информации в клетке, оказалась поразительно устойчива и сохраняется в ископаемых останках в течение десятков тысяч лет. В ней законсервированы ответы на многие вопросы истории человечества.
Археологи работают в Денисовой пещере. На заднем плане видны пронумерованные культурные слои пещеры. Фото А. П. Бужиловой.
Приготовление образца для выделения древней ДНК (высверливание ткани зуба). Фото Олега Балановского.
Образцы для выделения древней ДНК облучают ультрафиолетом, чтобы уничтожить биологические молекулы на поверхности, которые могут принадлежать современному человеку. Вся внутренняя ДНК при этом остаётся нетронутой.Фото Олега Балановского.
Вся внутренняя ДНК при этом остаётся нетронутой.Фото Олега Балановского.
Раскопки Денисовой пещеры (Алтайский край) позволили впервые установить строгую хронологическую последовательность развития и смены древних культур от эпохи раннего неолита до этнографической современности. По мнению заведующего лабораторией млекопитающих Палеонтологического института им. А. А. Борисяка РАН А. К. Агаджаняна, обитатели 11-го культурного слоя Денисовой пещеры пользовались огнём. Именно в этом слое были найдены останки древнего человека, представляющего особую ветвь в эволюции рода Homo. Этот вид получил название денисовского человека. Фото Александра Агаджаняна.
Скелетные останки человека из курганного могильника Натухаевская-3 в Краснодарском крае (майкопская культура). Фото А. Д. Колпаковой.
Ключевые миграции, сформировавшие генофонд Европы. Неолитические земледельцы с Ближнего Востока и из Анатолии пришли в Европу и смешались с мезолитическими охотниками-собирателями в генофонде первых неолитических европейских земледельцев (короткие белые стрелки). Они же внесли вклад в генофонд кочевников бронзового века ямной культуры (пунктирная розовая стрелка). Миграция «ямников» в Европу добавила степной компонент в генофонд европейских земледельцев (жёлтая стрелка). Рисунок О. П. Балановского.
Они же внесли вклад в генофонд кочевников бронзового века ямной культуры (пунктирная розовая стрелка). Миграция «ямников» в Европу добавила степной компонент в генофонд европейских земледельцев (жёлтая стрелка). Рисунок О. П. Балановского.
По материалам статьи: I. Morozova et al. Toward high-resolution population genomics using archaeological samples // DNA research, 2016, published online: July 19, 2016, doi: 10.1093/dnares/dsw029.
‹
›
Открыть в полном размере
Надо сказать, что и по современной ДНК генетики реконструируют исторические события: по сегодняшней структуре генофонда догадываются, какие события могли её сформировать, а используя знания о скорости мутаций, отсчитывают время назад по так называемым молекулярным часам. Но современная ДНК даёт возможность лишь смоделировать прошлое, а древняя ДНК — непосредственно прочитать то, что в ней записано.
Первую древнюю ДНК генетики выделили ещё в 1984 году из высохшей мышцы вымершего родственника зебры. В 1991-м ДНК впервые извлекли из ископаемых костей человека. Но её анализ целиком зависел от развития технологий, поэтому стал возможен с появлением метода полимеразной цепной реакции (ПЦР) и вышел на новый уровень с возникновением методов секвенирования нового поколения. Эти методы радикально облегчили прочтение последовательности нуклеотидов (кирпичиков, из которых состоит ДНК). Самое главное — они позволяют прочитать не целую молекулу, а разорванную на мелкие кусочки, как обычно и происходит с ДНК в процессе длительного хранения в ископаемых костях. В 1991 году биологи впервые извлекли палеоДНК человека, в 2010-м смогли прочитать древний геном целиком — из костей неандертальца возрастом 38 тыс. лет и из костей палеоэскимоса возрастом 4 тыс. лет.
В 1991-м ДНК впервые извлекли из ископаемых костей человека. Но её анализ целиком зависел от развития технологий, поэтому стал возможен с появлением метода полимеразной цепной реакции (ПЦР) и вышел на новый уровень с возникновением методов секвенирования нового поколения. Эти методы радикально облегчили прочтение последовательности нуклеотидов (кирпичиков, из которых состоит ДНК). Самое главное — они позволяют прочитать не целую молекулу, а разорванную на мелкие кусочки, как обычно и происходит с ДНК в процессе длительного хранения в ископаемых костях. В 1991 году биологи впервые извлекли палеоДНК человека, в 2010-м смогли прочитать древний геном целиком — из костей неандертальца возрастом 38 тыс. лет и из костей палеоэскимоса возрастом 4 тыс. лет.
С этого времени число прочитанных древних геномов нарастает лавинообразно, с каждым годом публикуется всё больше статей в этой области. Вторгшись в храм древности со своими ДНК-перфораторами, генетики расспросили старожилов храма — прежде всего, археологов — о проблемах, которые надо решить. По словам этнографа и антрополога М. В. Витова, «антропологические измерения предоставляют историку чрезвычайно обильный и многочисленный, но однообразный и односторонний материал». Это в полной мере относится и к генетике. О древних эпохах генетика предоставляет также материал обильный, но односторонний: только о движениях самого населения, но не о его культуре или языке. Зато на вопрос о населении: была на данной территории преемственность населения или его смена произошла в результате миграции — древняя ДНК даёт прямой ответ. Эти ответы порой подтверждают построения археологов, историков и лингвистов, порой они оказываются неожиданными. С данного момента начинается тот междисциплинарный диалог между представителями биологических наук (генетики и антропологии) и гуманитарных дисциплин (археологии, истории, лингвистики), который может привести к взаимопониманию и сближению точек зрения. Так уточняется картина мира. «Генетика вносит важный фрагмент в общий пазл. Не больше, но и не меньше» — так о роли генетики в изучении истории человека сказал Вольфганг Хаак, один из ведущих специалистов созданного недавно Института истории человечества Общества Макса Планка (Max Planck Institute for the Science of Human History) в Йене, Германия.
По словам этнографа и антрополога М. В. Витова, «антропологические измерения предоставляют историку чрезвычайно обильный и многочисленный, но однообразный и односторонний материал». Это в полной мере относится и к генетике. О древних эпохах генетика предоставляет также материал обильный, но односторонний: только о движениях самого населения, но не о его культуре или языке. Зато на вопрос о населении: была на данной территории преемственность населения или его смена произошла в результате миграции — древняя ДНК даёт прямой ответ. Эти ответы порой подтверждают построения археологов, историков и лингвистов, порой они оказываются неожиданными. С данного момента начинается тот междисциплинарный диалог между представителями биологических наук (генетики и антропологии) и гуманитарных дисциплин (археологии, истории, лингвистики), который может привести к взаимопониманию и сближению точек зрения. Так уточняется картина мира. «Генетика вносит важный фрагмент в общий пазл. Не больше, но и не меньше» — так о роли генетики в изучении истории человека сказал Вольфганг Хаак, один из ведущих специалистов созданного недавно Института истории человечества Общества Макса Планка (Max Planck Institute for the Science of Human History) в Йене, Германия.
Почему это трудно
Изучать древнюю ДНК очень непросто, поэтому даже сегодня в мире существует лишь несколько лабораторий, которые делают это качественно. Самая большая проблема — загрязнение (специалисты говорят — контаминация) материала. Лежащие в земле тысячи лет кости заселены бактериями и грибами, поэтому первая задача состоит в том, чтобы отделить человеческую ДНК от микробной. С другой стороны, надо не допустить её загрязнения современной ДНК, прежде всего, от людей, которые с ней работают. Поэтому помещения для работы с древней ДНК должны отвечать стандартам чистоты, а сами исследователи работать в экипировке, напоминающей космические скафандры.
Есть ещё одна проблема: в ископаемых образцах, в данном случае в человеческих останках из древних захоронений, содержится очень мало ДНК, пригодной для выделения и анализа. Иногда специалистам приходится работать всего лишь с несколькими молекулами. Наконец, и самих образцов, то есть человеческих останков, в которых сохранилась ДНК, пока ещё мало. Поэтому трудно набрать нужную статистику, что создаёт трудности в интерпретации полученных результатов. Кстати, сохранность ДНК в палеоматериале зависит в первую очередь не от возраста останков, а от условий, в которых они хранились в природе. Главные её враги — высокая температура и влажность. Именно поэтому большинство изученных древних геномов относятся к средней полосе или северу; в Южной Европе и на Ближнем Востоке останков гораздо меньше, а в Африке пока только один материал оказался пригодным для изучения.
Поэтому трудно набрать нужную статистику, что создаёт трудности в интерпретации полученных результатов. Кстати, сохранность ДНК в палеоматериале зависит в первую очередь не от возраста останков, а от условий, в которых они хранились в природе. Главные её враги — высокая температура и влажность. Именно поэтому большинство изученных древних геномов относятся к средней полосе или северу; в Южной Европе и на Ближнем Востоке останков гораздо меньше, а в Африке пока только один материал оказался пригодным для изучения.
В нашей стране лаборатории, которые пытаются работать с древней ДНК, можно пересчитать по пальцам. Собственно, лабораторный анализ проводят лишь новосибирские исследователи (группа Александра Пилипенко) и группа Евгения Рогаева в Институте общей генетики (ИОГен) РАН. Некоторые исследовательские коллективы, например лаборатории популяционной генетики человека в Медико-генетическом научном центре (МГНЦ) и Институте общей генетики РАН, успешно сотрудничают с ведущими зарубежными коллективами, участвуют в биоинформационном анализе и обобщении данных. Помимо всего прочего, Россия — неисчерпаемый источник палеоматериала, где благодаря холодному климату останки хорошо сохраняются.
Помимо всего прочего, Россия — неисчерпаемый источник палеоматериала, где благодаря холодному климату останки хорошо сохраняются.
Как пересекались «параллельные человечества»
Прежде всего, исследования древней ДНК дали возможность описать наши отношения с другими видами людей, уточнив представление о «чистоте» вида Homo sapiens. О неандертальцах науке известно очень давно, и антропологи много спорили, смешивались ли ветви сапиенсов и неандертальцев. Эти вымершие представители «другого человечества» генетически были изучены в группе Сванте Паабо, самого известного в мире специалиста по древней ДНК (Институт эволюционной антропологии Общества Макса Планка в Лейпциге, нем. Max Planck Institut fur evolutionare Anthropologie). Сначала он изучил митохондриальную ДНК неандертальца (небольшого размера молекулы ДНК, содержащиеся в митохондриях и передающиеся по материнской линии) и заявил о полном отсутствии смешения. Но когда спустя несколько лет он же секвенировал остальной геном неандертальца, то сменил тезис на противоположный: выяснилось, что около 2% генома современного человека имеет неандертальское происхождение. Дальнейшие исследования показали, что эта доля варьирует от 1 до 4% по Евразии, но практически отсутствует у населения Африки южнее Сахары. И неудивительно — такое генетическое наследство сапиенсы могли получить только при скрещивании с неандертальцами, а поскольку межвидовая метисация происходила после выхода человека из Африки, то у современных африканцев нет её следов.
Дальнейшие исследования показали, что эта доля варьирует от 1 до 4% по Евразии, но практически отсутствует у населения Африки южнее Сахары. И неудивительно — такое генетическое наследство сапиенсы могли получить только при скрещивании с неандертальцами, а поскольку межвидовая метисация происходила после выхода человека из Африки, то у современных африканцев нет её следов.
После того как генетики научились находить последовательности неандертальской ДНК, спрятанные в современном геноме, выяснилось, что у разных людей неандертальское генетическое наследство различно как по размеру, так и по набору фрагментов ДНК. Генетики из Вашингтонского университета (Vernot, Akey, 2014) подсчитали его в 665 геномах жителей Европы и Восточной Азии и выяснили: суммарно в их геномах спрятано около 600 миллионов нуклеотидов, унаследованных от неандертальцев, что составляет около 20% неандертальского генома. Иными словами, пятая часть генома неандертальцев не исчезла окончательно, а живёт в современном человечестве. Хотя у каждого отдельного человека, как сказано выше, доля неандертальской ДНК составляет от 1 до 4%. Интересно и то, что в азиатских популяциях её чуть больше, чем в европейских. Учёные объясняют это вторым потоком неандертальских генов, затронувшим только Восточную Азию.
Хотя у каждого отдельного человека, как сказано выше, доля неандертальской ДНК составляет от 1 до 4%. Интересно и то, что в азиатских популяциях её чуть больше, чем в европейских. Учёные объясняют это вторым потоком неандертальских генов, затронувшим только Восточную Азию.
Где и когда сапиенсы плодотворно общались с неандертальцами? Первоначально считали, что это случилось вскоре после выхода первых людей из Африки, то есть 50—60 тыс. лет назад, на Ближнем Востоке, где мигранты сделали остановку. Но открытие 2015 года показало, что не только там и не только тогда. При исследовании ДНК древнейшего человека современного вида на территории Европы (в Румынии) возрастом 37—42 тыс. лет обнаружилось, что в ДНК индивида Oase 1 число неандертальских фрагментов существенно больше, чем в других, столь же древних, найденных на территории России: в образце Костенки-14 (Воронежская область) возрастом 36—39 тыс. лет, в образце из Усть-Ишима близ Байкала возрастом 42—43 тыс. лет и в нескольких других. В геноме Oase 1 неандертальская ДНК составила более 7%, причём её фрагменты достигали значительной длины. Это говорит о недавней метисации с неандертальцами, так как с течением времени длинные фрагменты становятся короткими. Авторы подсчитали, что предки Oase 1 скрещивались с неандертальцами всего за четыре—шесть поколений до его рождения. Очевидно, уже в Европе. Правда, след от этой недавней метисации не дошёл до нашего времени: учёные не обнаружили генетического сходства Oase 1 с последующими популяциями.
В геноме Oase 1 неандертальская ДНК составила более 7%, причём её фрагменты достигали значительной длины. Это говорит о недавней метисации с неандертальцами, так как с течением времени длинные фрагменты становятся короткими. Авторы подсчитали, что предки Oase 1 скрещивались с неандертальцами всего за четыре—шесть поколений до его рождения. Очевидно, уже в Европе. Правда, след от этой недавней метисации не дошёл до нашего времени: учёные не обнаружили генетического сходства Oase 1 с последующими популяциями.
О денисовце — ещё одном виде человека, жившем в Евразии одновременно с сапиенсами и неандертальцами, — мир узнал после того, как тот же Сванте Паабо прочитал сначала митохондриальный, а потом и ядерный геном из фаланги пальца, найденной в 2008 году в Денисовой пещере на Алтае. Эта история замечательна тем, что денисовца определили как отдельный вид человека исключительно по ДНК. Можно сказать, что на сегодняшний день о денисовце мы не знаем ничего, кроме его генома (костные фрагменты ничтожны: помимо первоначальной фаланги пальца позже найдено ещё два зуба). Сейчас генетики изучили ДНК из всех трёх фрагментов и узнали, что денисовцы жили в той пещере от 100 до 50 тыс. лет назад, возможно, в какой-то период делили её с неандертальцами, а возможно, заселялись в неё дважды (Sawyer, 2015). Жили они, похоже, почти по всей Азии, а особенно большой след оставили в геномах жителей островов у юго-восточной оконечности Азии; так, в Меланезии он достигает 2—4%.
Сейчас генетики изучили ДНК из всех трёх фрагментов и узнали, что денисовцы жили в той пещере от 100 до 50 тыс. лет назад, возможно, в какой-то период делили её с неандертальцами, а возможно, заселялись в неё дважды (Sawyer, 2015). Жили они, похоже, почти по всей Азии, а особенно большой след оставили в геномах жителей островов у юго-восточной оконечности Азии; так, в Меланезии он достигает 2—4%.
Заселение Европы
В последние годы появилось множество работ, в которых с помощью анализа древней ДНК показано, как человечество осваивало Европу, какие группы внесли свой вклад в генофонд современного населения. В самых общих чертах картина такова. После того как человек современного типа достиг Европы (от 40 до 35 тыс. лет назад), группы охотников-собирателей обитали в разных её частях и практически не смешивались друг с другом. Последний факт получен как раз генетиками: образцы древней ДНК охотников-собирателей верхнего палеолита показывают, что их популяции в разных регионах были генетически очень различны.
В неолите произошла революция — люди перешли от присваивающего хозяйства к производящему: от охоты и собирательства к земледелию и скотоводству. Она радикально поменяла образ жизни наших предков и стимулировала развитие технологий. Земледелие, возникнув впервые около VII тысячелетия до н. э. на Ближнем Востоке, в течение последующих тысячелетий распространилось в Европу. Один из главных вопросов, которые пытаются решить специалисты разных наук, состоит в том, привело ли оно к смене населения. Существуют две гипотезы: культурная диффузия, когда происходит передача навыков земледелия между соседними группами населения, а сами они практически остаются на месте, и демическая диффузия, когда технологии передаются вместе с мигрирующим населением.
Определить, была ли миграция (то есть поток генов), — дело генетиков. Сначала они изучили древнюю митохондриальную ДНК (мтДНК) из европейской неолитической популяции (культуры линейно-ленточной керамики) и показали её сходство с мтДНК населения Ближнего Востока. Это свидетельствует, что ближневосточные земледельцы действительно мигрировали в Европу, принеся с собой технологии выращивания культурных растений. Вывод о ближневосточной неолитической миграции подтвердился и тогда, когда генетики смогли секвенировать полный ядерный геном из древних образцов. Авторы статьи в «Nature» под руководством ведущих специалистов по древней ДНК Дэвида Райха (Гарвардская медицинская школа в Бостоне) и Йоханнеса Краузе (Институт истории человечества Общества Макса Планка в Йене) изучали, из каких групп населения формировался генофонд Европы. По их гипотезе, основными источниками стали три древние популяции. Первая — европейские охотники-собиратели (жившие в Европе со времён палеолита), вторая — ближневосточные земледельцы (которые мигрировали в Европу и смешались с местными аборигенами), третью условно назвали «древними североевразийцами» (тоже охотники-собиратели, впервые генетически изученные в образце со стоянки Мальта в Сибири).
Это свидетельствует, что ближневосточные земледельцы действительно мигрировали в Европу, принеся с собой технологии выращивания культурных растений. Вывод о ближневосточной неолитической миграции подтвердился и тогда, когда генетики смогли секвенировать полный ядерный геном из древних образцов. Авторы статьи в «Nature» под руководством ведущих специалистов по древней ДНК Дэвида Райха (Гарвардская медицинская школа в Бостоне) и Йоханнеса Краузе (Институт истории человечества Общества Макса Планка в Йене) изучали, из каких групп населения формировался генофонд Европы. По их гипотезе, основными источниками стали три древние популяции. Первая — европейские охотники-собиратели (жившие в Европе со времён палеолита), вторая — ближневосточные земледельцы (которые мигрировали в Европу и смешались с местными аборигенами), третью условно назвали «древними североевразийцами» (тоже охотники-собиратели, впервые генетически изученные в образце со стоянки Мальта в Сибири).
Чем больше древних геномов стало возможно прочитать, тем точнее становилась эта картина. Когда число древних образцов ДНК достигло 94 (от палеолита до железного века), та же команда опубликовала в «Nature» очередную статью, в которой описала генетический след другой большой миграции в Европу. Эта миграция в позднем неолите и начале бронзового века происходила из причерноморско-каспийских степей. Авторы связывают её с населением археологической ямной культуры, жившим в этих местах 5 тыс. лет назад. (Культура получила название из-за обычая погребения умерших в открытых ямах.) «Степной» генетический компонент они выявили в западноевропейских популяциях бронзового века, в населении культуры шнуровой керамики.
Когда число древних образцов ДНК достигло 94 (от палеолита до железного века), та же команда опубликовала в «Nature» очередную статью, в которой описала генетический след другой большой миграции в Европу. Эта миграция в позднем неолите и начале бронзового века происходила из причерноморско-каспийских степей. Авторы связывают её с населением археологической ямной культуры, жившим в этих местах 5 тыс. лет назад. (Культура получила название из-за обычая погребения умерших в открытых ямах.) «Степной» генетический компонент они выявили в западноевропейских популяциях бронзового века, в населении культуры шнуровой керамики.
Итак, две большие миграционные волны сыграли ведущую роль в предыстории Европы. Первая — в раннем неолите — принесла в Европу гены первых земледельцев с Ближнего Востока, вторая — в позднем неолите — гены степняков ямной культуры. Но если первая — неолитическая миграция с Ближнего Востока — признаётся практически всеми специалистами и в этом генетики совпадают с археологами, то по поводу степной миграции бронзового века ломается много копий. Здесь с генетиками не согласны как археологи, так и лингвисты. Большинство археологов (в частности, Лев Самуилович Клейн) не находят археологических подтверждений миграции «ямников» и не усматривают связи их культуры с европейской культурой шнуровой керамики. Лингвисты же выступают против попыток авторов связать эту миграцию с распространением в Европу индоевропейских языков, поскольку место возникновения и пути распространения этой самой многочисленной семьи языков до сих пор представляют предмет бурных дискуссий.
Здесь с генетиками не согласны как археологи, так и лингвисты. Большинство археологов (в частности, Лев Самуилович Клейн) не находят археологических подтверждений миграции «ямников» и не усматривают связи их культуры с европейской культурой шнуровой керамики. Лингвисты же выступают против попыток авторов связать эту миграцию с распространением в Европу индоевропейских языков, поскольку место возникновения и пути распространения этой самой многочисленной семьи языков до сих пор представляют предмет бурных дискуссий.
Да и сами генетики сейчас с осторожностью относятся к выводу о миграции ямной культуры. Например, хотя в нескольких древних образцах «ямников» обнаружена гаплогруппа (вариант) Y-хромосомы R1b (который обычно ассоциируется с Европой), более подробный анализ, выполненный в ИОГен РАН, показал, что это не западная, а восточная ветвь R1b, так что в современной Европе искать её не стоит. С осторожностью говорит об этом и один из авторов работы Вольфганг Хаак: «Возможно, правильнее назвать этот генетический след “похожим на ямную степным предковым компонентом”».
Другая группа исследователей под руководством Эске Виллерслева (Eske Willerslev из Центра географической генетики Музея естественной истории университета Копенгагена, Дания), прочитав уже более сотни древних геномов, рассмотрела период бронзового века. Эта эпоха (от 3 до 1 тыс. лет назад), когда камень уступает место металлу, сопровождается радикальными культурными и социальными изменениями в жизни людей. Они касаются не только хозяйственного уклада — возникает новое понимание имущественных отношений, семьи и личности. И снова встаёт тот же вопрос, что и с неолитом: была ли это циркуляция людей или идей?
Мортен Аллентофт (Morten E. Allentoft) и его коллеги (также из центра географической генетики музея естественной истории университета Копенгагена) склоняются к первой версии. Миграции (циркуляции людей) в бронзовом веке были очень интенсивными, и именно в этом периоде, через сложные процессы экспансии, смешения и замещения популяций, сформировались основные археологические культуры. Авторы также указывают на миграцию ямной культуры из степей, генетический след которой они находят в ряде европейских культур. Более того, они проследили миграцию ямной культуры в Сибирь, где она дала начало афанасьевской культуре Алтае-Саянского региона.
Авторы также указывают на миграцию ямной культуры из степей, генетический след которой они находят в ряде европейских культур. Более того, они проследили миграцию ямной культуры в Сибирь, где она дала начало афанасьевской культуре Алтае-Саянского региона.
Надо сказать, что в работах разных генетиков много противоречий, которые не всегда можно объяснить. Более того, иногда одна и та же команда в последующих публикациях значительно перерабатывает свои же собственные выводы, сделанные ранее. Но процесс идёт, и по мере того как прочитанных древних геномов будет больше, а качество прочтения — надёжнее, картина реконструкции заселения Евразии должна становиться точнее.
Светлая кожа, молоко и голубые глаза
По древней ДНК можно проследить и то, как у наших предков изменялись признаки внешности, строение тела или обмен веществ. В процессе расселения по Евразии человек попадал в новые условия обитания, в которых какие-то признаки оказывались полезными. Генетические варианты, отвечающие за эти полезные признаки, повышают приспособляемость индивида и поддерживаются естественным отбором. При этом частота генетических вариантов (аллелей) повышается и признаки распространяются в популяции.
Генетические варианты, отвечающие за эти полезные признаки, повышают приспособляемость индивида и поддерживаются естественным отбором. При этом частота генетических вариантов (аллелей) повышается и признаки распространяются в популяции.
Исследование естественного отбора, происходившего в человеческих популяциях за 8 тыс. лет, по древней ДНК предприняла уже упомянутая команда Дэвида Райха. В геномах 83 индивидов, от палеолита до бронзы, генетики изучили однонуклеотидный полиморфизм (SNP, «снипы») — участки, где происходит замена одного нуклеотида другим. Из 400 тыс. изменчивых участков они выбрали те, которые оказывают влияние на синтез белков и, следовательно, на те или иные признаки. Для каждой такой функционально важной SNP-мутации оценили её частоту в древних и современных популяциях и проверили, поддерживалась ли эта мутация естественным отбором. Таких полезных мутаций, которые помогали выживать нашим предкам, оказалось несколько.
Одна из них находится в составе гена лактазы (фермента, расщепляющего молочный сахар — лактозу). Эта мутация обеспечивает синтез лактозы в течение всей жизни, поэтому обладающие ею взрослые могут пить молоко, а обладатели исходного варианта гена без мутации могут пить молоко только в младенчестве. Так вот, мутантный ген исследователи не нашли в раннем неолите, не нашли даже у скотоводов ямной культуры, несмотря на то что те использовали рогатый скот. Получается, что мутация впервые распространилась в популяции примерно 4 тыс. лет назад, а значит, люди стали способны употреблять в пищу молоко далеко не сразу после того, как одомашнили животных. Но эта привычка оказалась настолько полезной, что возникшая мутация распространялась очень быстро и сегодня имеется у 70% европейцев.
Эта мутация обеспечивает синтез лактозы в течение всей жизни, поэтому обладающие ею взрослые могут пить молоко, а обладатели исходного варианта гена без мутации могут пить молоко только в младенчестве. Так вот, мутантный ген исследователи не нашли в раннем неолите, не нашли даже у скотоводов ямной культуры, несмотря на то что те использовали рогатый скот. Получается, что мутация впервые распространилась в популяции примерно 4 тыс. лет назад, а значит, люди стали способны употреблять в пищу молоко далеко не сразу после того, как одомашнили животных. Но эта привычка оказалась настолько полезной, что возникшая мутация распространялась очень быстро и сегодня имеется у 70% европейцев.
Другой признак — светлая кожа, которую обеспечивают варианты (аллели) двух генов, влияющих на пигментацию. У западноевропейских охотников-собирателей таких аллелей не было вовсе или же они были очень редки, так что, вероятно, кожа у них была довольно тёмной. Анализ показал, что первый аллель уже в раннем неолите достигает высокой частоты, а второй в то время только возникает, но быстро распространяется. У современных европейцев эти светлокожие варианты встречаются почти поголовно, за исключением испанцев.
У современных европейцев эти светлокожие варианты встречаются почти поголовно, за исключением испанцев.
В европейских популяциях бронзового века достигает заметной частоты и аллель, отвечающий за голубой цвет глаз. Но у него сильный географический градиент — высокая частота на севере и низкая на юге. Это понятно, так как светлый цвет радужки на юге неблагоприятен: он не защищает сетчатку от интенсивного солнечного излучения.
Некоторые самые полезные гены пришли из «параллельного человечества». Например, ген, обеспечивающий выживание на большой высоте (в условиях недостатка кислорода) у современных жителей Тибета, был позаимствован ими у денисовцев. Есть данные, что ген, позволяющий эскимосам эффективно согреваться при метаболизме жиров, тоже получен ими от денисовцев. Постепенно накапливается всё больше примеров того, что Homo sapiens, выйдя из Африки в Евразию и столкнувшись с новыми для себя климатическими условиями, воспользовался для адаптации генами, полученными от смешения с денисовцами и неандертальцами, которые к тому времени уже многие десятки тысячелетий обитали в Евразии и успели приспособиться к самым разным климатическим зонам.
Это лишь несколько примеров открытий, которые сделаны благодаря палеоДНК. Кто знает, какие ещё события прошлого генетикам удастся прочитать по ДНК? Обрывки двойных спиралей, разбросанные по планете, хранят информацию наподобие бортовых «чёрных ящиков» в ожидании экспертов, способных её точно прочитать и правильно понять.
Фотография 51 Розалинды Франклин (1952 г.)
Фотография 51 Розалинд Франклин (1952 г.) дезоксирибонуклеиновой кислоты или ДНК. Фотография 51 или Фото 51 раскрывала информацию о трехмерной структуре ДНК, показывая, как пучок рентгеновских лучей рассеивается на чистом волокне ДНК. Франклин сделал Фото 51 после того, как ученые подтвердили, что ДНК содержит гены. Морис Уилкинс, коллега Франклина, показал Джеймсу Уотсону и Фрэнсису Крику Фото 51 без ведома Франклина. Уотсон и Крик использовали это изображение для разработки своей структурной модели ДНК. В 19В 62 году, после смерти Франклина, Уотсон, Крик и Уилкинс разделили Нобелевскую премию по физиологии и медицине за свои открытия в области ДНК. Фотография Франклина 51 помогла ученым узнать больше о трехмерной структуре ДНК и позволила ученым понять роль ДНК в наследственности.
Фотография Франклина 51 помогла ученым узнать больше о трехмерной структуре ДНК и позволила ученым понять роль ДНК в наследственности.
Рентгеновская кристаллография, метод, который Франклин использовал для получения фото 51 ДНК, — это метод, который ученые используют для определения трехмерной структуры кристалла. Кристаллы представляют собой твердые тела с правильными повторяющимися единицами атомов. Некоторые биологические макромолекулы, такие как ДНК, могут образовывать волокна, подходящие для анализа с помощью рентгеновской кристаллографии, поскольку их твердые формы состоят из атомов, расположенных в регулярном порядке. На фото 51 использовались волокна ДНК, кристаллы ДНК, впервые полученные в 1970-е годы. Для проведения рентгеновской кристаллографии ученые помещают очищенное волокно или кристалл в рентгеновскую трубку. Рентгеновская трубка генерирует рентгеновские лучи, попадающие на очищенный материал. Рентгеновские лучи — это электромагнитные волны, которые имеют более короткую длину волны и более высокую энергию, чем видимый свет.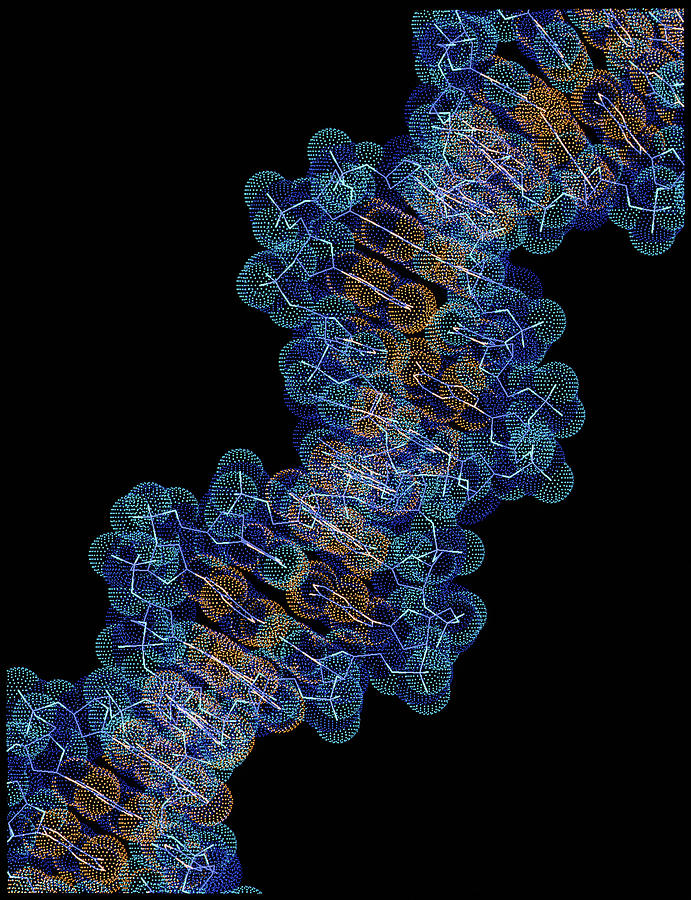 Из-за своей короткой длины волны рентгеновские лучи могут проходить через кристалл и взаимодействовать с электронами атомов внутри кристалла. Когда рентгеновские лучи взаимодействуют с электронами в кристалле, рентгеновские лучи рассеиваются или дифрагируют под углами, которые указывают на расположение атомов в кристалле или его структуру. Когда рентгеновские лучи рассеиваются, они падают на пленку, закрепленную за кристаллом, и оставляют узор из темных следов. Рисунок темных пятен на пленке дает ученым информацию о структуре кристалла.
Из-за своей короткой длины волны рентгеновские лучи могут проходить через кристалл и взаимодействовать с электронами атомов внутри кристалла. Когда рентгеновские лучи взаимодействуют с электронами в кристалле, рентгеновские лучи рассеиваются или дифрагируют под углами, которые указывают на расположение атомов в кристалле или его структуру. Когда рентгеновские лучи рассеиваются, они падают на пленку, закрепленную за кристаллом, и оставляют узор из темных следов. Рисунок темных пятен на пленке дает ученым информацию о структуре кристалла.
Ученые начали собирать рентгеновские дифрактограммы ДНК в 1930-х годах, прежде чем они подтвердили, что ДНК содержит гены. Уильям Томас Эстбери, кристаллограф, работающий в Университете Лидса в Лидсе, Англия, получил первые дифракционные картины ДНК в 1937 году. Однако дифракционные картины Эстбери были размытыми и их было трудно интерпретировать. Во время экспериментов Эстбери ученые определили химический состав ДНК. Однако в то время ученые в целом согласились с тем, что ДНК просто обеспечивает структурную поддержку клеток и что белок должен быть генетическим материалом. В 1944 Освальд Эйвери, Колин Маклауд и Маклин Маккарти опубликовали результаты эксперимента, в ходе которого ДНК была выделена как материал, содержащий гены.
В 1944 Освальд Эйвери, Колин Маклауд и Маклин Маккарти опубликовали результаты эксперимента, в ходе которого ДНК была выделена как материал, содержащий гены.
Морис Уилкинс, ученый, работавший в Королевском колледже Лондона, собрал рентгеновские дифрактограммы ДНК в 1950 году. Уилкинс и его аспирант Рэймонд Гослинг, позже аспирант Франклина, собрали рентгеновские дифрактограммы ДНК. очищенный таким образом, что производились более длинные волокна, чем те, которые были доступны Эстбери. Собирая волокна ДНК для просмотра, Уилкинс и Гослинг смогли связать множество тонких волокон вместе и туго стянуть их, чтобы получить больший образец для лучшей дифракции рентгеновских лучей. Кроме того, два исследователя держали волокна ДНК смачиваемыми водой, держа их во влажной среде. Полученная рентгенограмма ДНК была более высокого качества, чем любые ранее собранные картины.
Франклин, специалист в области рентгеновской кристаллографии, продолжила предыдущие эксперименты по рентгеновской кристаллографии ДНК с Гослинг, когда она присоединилась к лаборатории Королевского колледжа в Лондоне в 1951 году. До прихода в лабораторию Франклин проводила эксперименты по дифракции рентгеновских лучей на углероде. соединений в правительственной лаборатории в Париже, Франция, и опубликовал несколько статей по рентгеновской кристаллографии угля и угольных соединений. В ходе ранней работы Франклин в Королевском колледже Лондона она обнаружила, что волокна ДНК с более высоким содержанием воды дают другую дифракционную картину, чем волокна ДНК с более низким содержанием воды, что указывает на то, что влажная и сухая ДНК принимают разные трехмерные конформации. Позже Франклин определил более сухую конформацию ДНК как ДНК A-формы, а более влажную конформацию ДНК — как ДНК B-формы. По состоянию на 2018 год ученые продолжают использовать обозначения формы A и формы B для двух конформаций ДНК. В дополнение к идентификации двух форм ДНК Франклин определил, что дифракционные картины Эсбери ДНК произошли от смеси А- и В-форм ДНК.
До прихода в лабораторию Франклин проводила эксперименты по дифракции рентгеновских лучей на углероде. соединений в правительственной лаборатории в Париже, Франция, и опубликовал несколько статей по рентгеновской кристаллографии угля и угольных соединений. В ходе ранней работы Франклин в Королевском колледже Лондона она обнаружила, что волокна ДНК с более высоким содержанием воды дают другую дифракционную картину, чем волокна ДНК с более низким содержанием воды, что указывает на то, что влажная и сухая ДНК принимают разные трехмерные конформации. Позже Франклин определил более сухую конформацию ДНК как ДНК A-формы, а более влажную конформацию ДНК — как ДНК B-формы. По состоянию на 2018 год ученые продолжают использовать обозначения формы A и формы B для двух конформаций ДНК. В дополнение к идентификации двух форм ДНК Франклин определил, что дифракционные картины Эсбери ДНК произошли от смеси А- и В-форм ДНК.
Усовершенствовав свои методы сбора изображений дифракции рентгеновских лучей ДНК, Франклин получила Фото 51 из эксперимента по рентгеновской кристаллографии, который она провела 6 мая 1952 года.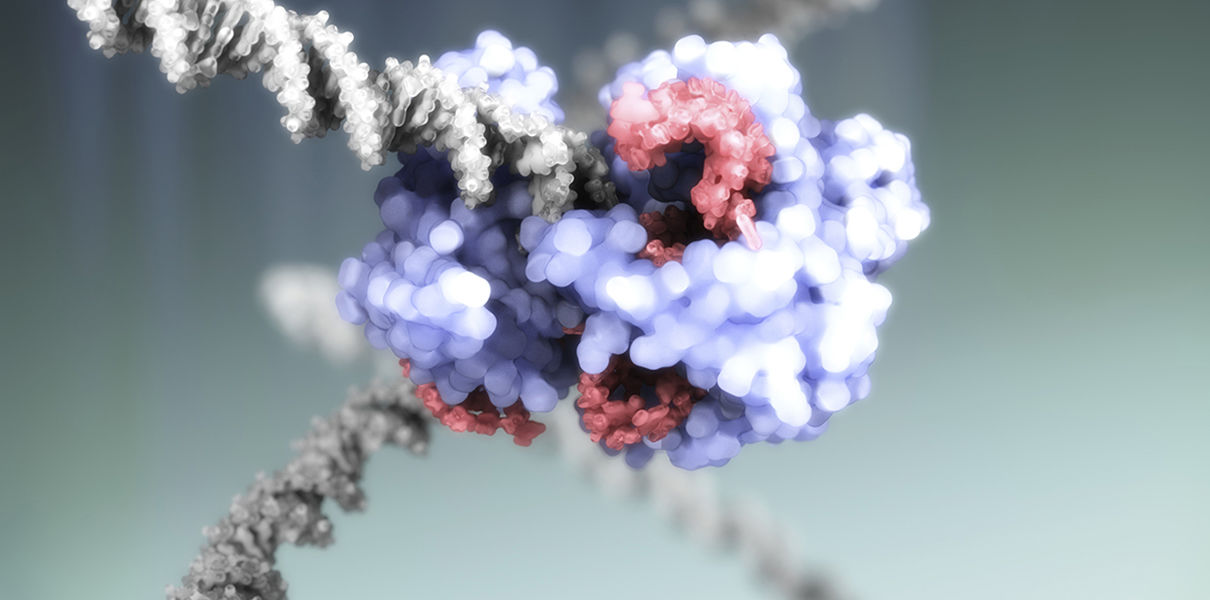 Во-первых, она минимизировала количество рентгеновских лучей, рассеиваемых воздухом, окружающим кристалл. путем прокачки газообразного водорода вокруг кристалла. Поскольку водород имеет только один электрон, он плохо рассеивает рентгеновские лучи. Она прокачивала газообразный водород через раствор соли, чтобы поддерживать заданную гидратацию волокон ДНК. Франклин настроил концентрацию соли в растворе и влажность вокруг кристалла, чтобы ДНК оставалась полностью в B-форме. После воздействия на волокна ДНК рентгеновских лучей в общей сложности в течение шестидесяти двух часов Франклин собрал полученную дифракционную картину и пометил ее номером 51, которая стала фотографией 51.
Во-первых, она минимизировала количество рентгеновских лучей, рассеиваемых воздухом, окружающим кристалл. путем прокачки газообразного водорода вокруг кристалла. Поскольку водород имеет только один электрон, он плохо рассеивает рентгеновские лучи. Она прокачивала газообразный водород через раствор соли, чтобы поддерживать заданную гидратацию волокон ДНК. Франклин настроил концентрацию соли в растворе и влажность вокруг кристалла, чтобы ДНК оставалась полностью в B-форме. После воздействия на волокна ДНК рентгеновских лучей в общей сложности в течение шестидесяти двух часов Франклин собрал полученную дифракционную картину и пометил ее номером 51, которая стала фотографией 51.
На фото 51 представлена четкая дифракционная картина ДНК B-формы. Крайний край дифракционной картины представляет собой черный ромб. Алмаз имеет закругленные углы, причем самые темные углы расположены вверху и внизу пленки. Ромбовидная форма дифракционной картины ДНК состоит не из тонких четких линий, а из толстых нечетких границ, которые меняются в темноте, так что границы исчезают с левой и правой сторон пленки. Внутри бриллианта крестообразная форма, похожая на букву «Х». Форма X не состоит из непрерывных линий. Вместо этого вдоль каждой линии X расположены четыре горизонтальные черточки, называемые пятнами, которые становятся темнее по мере приближения к центру пленки. В центре пленки есть отверстие с темными пятнами снаружи от центрального отверстия.
Внутри бриллианта крестообразная форма, похожая на букву «Х». Форма X не состоит из непрерывных линий. Вместо этого вдоль каждой линии X расположены четыре горизонтальные черточки, называемые пятнами, которые становятся темнее по мере приближения к центру пленки. В центре пленки есть отверстие с темными пятнами снаружи от центрального отверстия.
Исследователи могли интерпретировать картину дифракции рентгеновских лучей ДНК, зная о составе ДНК, которые были у ученых в то время, когда Франклин собирал фото 51. За годы до работы Франклина ученые определили, что ДНК состоит из цепочки повторяющихся единиц, называемых нуклеотидами. Каждый нуклеотид имеет три ключевые особенности. Каждый нуклеотид состоит из центрального сахарного кольца, называемого дезоксирибозой. К одному концу кольца дезоксирибозы присоединена отрицательно заряженная фосфатная группа, состоящая из атомов фосфора и кислорода. К другому концу кольца дезоксирибозы присоединена молекула, называемая основанием, состоящая из одинарных или двойных колец углерода и азота. В ДНК есть четыре типа оснований.
В ДНК есть четыре типа оснований.
Используя имеющиеся знания о составе ДНК и математических методах, Франклин узнал о некоторых ключевых особенностях структуры ДНК B-формы из Фото 51. Присутствие формы X на дифракционной картине указало Франклину, что нити ДНК были спиральный. Каждая черточка в форме X отмечает повторение атомов или атомных повторов в ДНК. Поэтому, исходя из расстояний между черточками, Франклин определил расстояние между нуклеотидами, наименьшими повторяющимися единицами в ДНК. Углы формы X показали Франклину радиус ДНК, или половину горизонтального расстояния от одной стороны молекулы до другой. По расстоянию между верхом и низом внешнего ромба Франклин обнаружил, что между каждым витком молекулы ДНК находится десять нуклеотидов. Наконец, более светлая природа алмаза в верхней и нижней части пленки показала Франклину, что основания ДНК обращены внутрь спирали, тогда как фосфатные группы обращены наружу. Зная плотность образцов ее ДНК, массу на единицу объема, Франклин также пришла к выводу, что ДНК состоит из двух цепей. В то время как Франклин получил Фото 51 в мае 1952, она завершила анализ Фото 51 только в начале 1953 года.
В то время как Франклин получил Фото 51 в мае 1952, она завершила анализ Фото 51 только в начале 1953 года.
Используя доступные знания о составе ДНК и математических методах, Франклин узнала о некоторых ключевых особенностях структуры ДНК В-формы из Фото 51. Присутствие X-форма на дифракционной картине показала Франклину, что нити ДНК были спиральными. Каждая черточка в форме X отмечает повторение атомов или атомных повторов в ДНК. Поэтому, исходя из расстояний между черточками, Франклин определил расстояние между нуклеотидами, наименьшими повторяющимися единицами в ДНК. Углы формы X показали Франклину радиус ДНК, или половину горизонтального расстояния от одной стороны молекулы до другой. По расстоянию между верхом и низом внешнего ромба Франклин обнаружил, что между каждым витком молекулы ДНК находится десять нуклеотидов. Наконец, более светлая природа алмаза в верхней и нижней части пленки показала Франклину, что основания ДНК обращены внутрь спирали, тогда как фосфатные группы обращены наружу. Зная плотность образцов ее ДНК, массу на единицу объема, Франклин также пришла к выводу, что ДНК состоит из двух цепей. В то время как Франклин получил Фото 51 в мае 1952, она завершила анализ Фото 51 только в начале 1953 года.
Зная плотность образцов ее ДНК, массу на единицу объема, Франклин также пришла к выводу, что ДНК состоит из двух цепей. В то время как Франклин получил Фото 51 в мае 1952, она завершила анализ Фото 51 только в начале 1953 года.
В январе 1953 года Уотсон посетила Королевский колледж Лондона. Во время визита Уилкинс показал Уотсону одно из рентгенографических изображений ДНК Франклина, которое, как утверждают историки, было одним из самых четких изображений ДНК, Фото 51, без ведома Франклина. По изображению Уотсон сделал вывод, что ДНК имеет спиральную форму. Во время встречи с Уилкинсом Уотсон также получил необходимые размеры ДНК, полученные из Фото 51, которые он и Крик позже использовали для разработки предложенной ими структуры ДНК. Позже Уотсон и Крик получили внутренний исследовательский отчет Королевского колледжа Лондона, написанный Франклин о ее дифракционных изображениях ДНК. Из этого отчета Крик определил, что ДНК состоит из двух цепей, каждая из которых направлена в противоположные стороны.
Уотсон и Крик, два ученых из Кембриджского университета в Кембридже, Англия, опирались на фотографию Франклина 51, чтобы предложить трехмерную структуру ДНК, а в апреле 1953 года они предложили трехмерную структуру ДНК, частично основанную на на Фото 51. Предложенная ими модель состояла из двух спиральных нитей повторяющихся нуклеотидов, навитых друг на друга, образующих двойную спираль. Между каждым витком двойной спирали было десять нуклеотидов. Фосфатные группы обращены наружу от двойной спирали, а основания ДНК обращены горизонтально внутрь спирали. Две нити удерживаются вместе за счет взаимодействия между основаниями каждой нити. Нити ДНК шли в противоположных направлениях. По состоянию на 2019 годПредложенная Уотсоном и Криком структура ДНК осталась проверенной структурой с несколькими вариациями ДНК В-формы, основной формы ДНК в живых клетках.
Позже, в мае 1953 года, Уотсон и Крик предложили механизм репликации ДНК, используя структуру их ДНК. Их механизм репликации, позже названный полуконсервативной репликацией, описывал, как копировать молекулу ДНК, содержащую гены, и передавать гены от клетки к клетке и от родителя к потомству. Многие особенности ДНК В-формы, представленные на Фото 51, необходимы для полуконсервативной репликации, например, основания ДНК, обращенные горизонтально внутрь двойной спирали. Кроме того, некоторые аспекты ДНК B-формы, как показано на фото 51, создавали проблемы для полуконсервативной репликации. Уотсон и Крик предположили, что цепи ДНК должны разматываться и разделяться для репликации. Однако из-за спиральной природы ДНК, как показано на картине дифракции рентгеновских лучей на Фото 51, некоторые ученые утверждали, что нити ДНК будет слишком сложно раскрутить и разделить. Прошло несколько лет, прежде чем ученые приняли полуконсервативную репликацию из-за предполагаемой сложности раскручивания спиральных нитей.
Многие особенности ДНК В-формы, представленные на Фото 51, необходимы для полуконсервативной репликации, например, основания ДНК, обращенные горизонтально внутрь двойной спирали. Кроме того, некоторые аспекты ДНК B-формы, как показано на фото 51, создавали проблемы для полуконсервативной репликации. Уотсон и Крик предположили, что цепи ДНК должны разматываться и разделяться для репликации. Однако из-за спиральной природы ДНК, как показано на картине дифракции рентгеновских лучей на Фото 51, некоторые ученые утверждали, что нити ДНК будет слишком сложно раскрутить и разделить. Прошло несколько лет, прежде чем ученые приняли полуконсервативную репликацию из-за предполагаемой сложности раскручивания спиральных нитей.
За открытия, связанные с ДНК, Уотсон, Крик и Уилкинс получили в 1962 году Нобелевскую премию по физиологии и медицине. Франклин также внесла свой вклад в понимание структуры ДНК, особенно благодаря своей коллекции Фото 51. Она также независимо определила многие важные особенности структуры ДНК, используя Фото 51. Нобелевская премия никогда не присуждается посмертно, и Франклин умерла в 1958 году до присуждения Нобелевская премия 1962 года. Некоторые споры и предположения окружают Нобелевскую премию 1962 года относительно Франклин и ее вклада в модель ДНК Уотсона и Крика. Только после публикации Уотсона, книга Двойная спираль: личный отчет об открытии структуры ДНК в 1968 году был броском, который Франклин сыграл в открытии структуры ДНК.
Нобелевская премия никогда не присуждается посмертно, и Франклин умерла в 1958 году до присуждения Нобелевская премия 1962 года. Некоторые споры и предположения окружают Нобелевскую премию 1962 года относительно Франклин и ее вклада в модель ДНК Уотсона и Крика. Только после публикации Уотсона, книга Двойная спираль: личный отчет об открытии структуры ДНК в 1968 году был броском, который Франклин сыграл в открытии структуры ДНК.
Фото 51, четкая рентгенограмма ДНК, показывает структурные особенности ДНК, необходимые для научного понимания трехмерной структуры ДНК. Поняв структуру ДНК, ученые смогли узнать, как ДНК функционирует как генетический материал. Структура ДНК, показанная на Фото 51, связана с основными функциями гена, как его информация сохраняется и передается от клетки к клетке и от родителя к потомству.
- Эсбери, Уильям Томас, Сильвия Дикинсон и Кеннет Бейли. «Рентгеновская интерпретация денатурации и структура глобулинов семян». Биохимический журнал 10 (1935): 2351–60.
 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1266766/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1266766/ - Эйвери, Освальд, Теодор, Колин Манро Маклауд и Маклин Маккарти. «Исследования химической природы вещества, вызывающего трансформацию пневмококковых типов: индукция трансформации фракцией дезоксирибонуклеиновой кислоты, выделенной из пневмококка типа III». Журнал экспериментальной медицины 79 (1944): 134–58. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2135445/pdf/137.pdf (по состоянию на 8 марта 2018 г.).
- Франклин, Розалинд Э., «Влияние связывающих электронов на рассеяние рентгеновских лучей углеродом». Природа 165 (1950): 71–2.
- Франклин, Розалинд Э. и Рэймонд Г. Гослинг. «Молекулярная конфигурация тимонуклеата натрия». Природа 171 (1953): 740–1.
- Гамильтон, Леонард Д., «ДНК: модели и реальность». Природа , 18 (1968): 633–7
- Джадсон, Гораций Фриланд. Восьмой день творения. Нью-Йорк: Колд-Спринг-Харбор: Лабораторное издательство Колд-Спринг-Харбор, 1996.

- Клуг, Аарон. «Розалинда Франклин и открытие структуры ДНК». Nature 219 (1968): 808–10 и 843–4.
- Клуг, Аарон. «Розалинда Франклин и двойная спираль». Природа 248 (1974): 787–8.
- Лукас, Аманд А. «А-ДНК и Б-ДНК: сравнение их исторических рентгеновских дифракционных изображений». Журнал химического образования 85 (2008): 737.
- Лукас, Аманд. А. Филипп Ламбен, Ришар Мересс и Мишель Мато. «Выявление основной структуры B-ДНК на основе лазерно-оптического моделирования ее рентгеновской дифракционной диаграммы». Журнал химического образования 76 (1999): 378.
- Мэддокс, Бренда. Розалинда Франклин: темная леди ДНК. Лондон: Издательство HarperCollins, 2002.
- Мэддокс, Бренда. «Двойная спираль и «обиженная героиня». Природа 421 (2003): 407–8.
- Марш, Ричард Э. «Биографические мемуары Роберта Брейнарда Кори». Национальная академия наук, 72 (1997) 51–69.
 https://www.nap.edu/read/5859/chapter/5 (по состоянию на 21 января 2019 г.).
https://www.nap.edu/read/5859/chapter/5 (по состоянию на 21 января 2019 г.). - Сэйр, Энн. Розалинда Франклин и ДНК. Нью-Йорк: WW Norton & Company, 1975.
- Уотсон, Джеймс Д. Двойная спираль: личный отчет об открытии структуры ДНК. Нью-Йорк: Athenaeum Press, 19.68.
- Уотсон, Джеймс Д. и Фрэнсис Х.К. Крик. «Молекулярная структура нуклеиновых кислот». Природа 171 (1953): 737–738. https://www.genome.gov/edkit/pdfs/1953.pdf (по состоянию на 21 января 2019 г.).
- Уотсон, Джеймс Д. и Фрэнсис Х.К. Крик. «Генетические последствия структуры дезоксирибонуклеиновой кислоты». Природа 171 (1953): 964–7. https://profiles.nlm.nih.gov/ps/access/SCBBYX.pdf (по состоянию на 21 января 2019 г.).
Эрнандес, Виктория, «Фотография 51, Розалинд Франклин (1952)». Энциклопедия проекта «Эмбрио» (30 декабря 2019 г.). ISSN: 1940-5030 http://embryo.asu.edu/handle/10776/13138.
Университет штата Аризона. Школа наук о жизни. Центр биологии и общества. Энциклопедия проекта «Эмбрион».
Школа наук о жизни. Центр биологии и общества. Энциклопедия проекта «Эмбрион».
Авторские права Попечительского совета штата Аризона Лицензия Creative Commons Attribution-NonCommercial-Share Alike 3.0 Unported (CC BY-NC-SA 3.0) http://creativecommons.org/licenses/by-nc-sa/3.0/
Кристаллография, рентген; ДНК; Молекулярная структура; ДНК, B-форма; Молекулярная конформация; ДНК, А-форма; ДНК; спирали ДНК; TNA (Нуклеиновая кислота, Дезоксирибонуклеиновая кислота, Рентгеновская кристаллография, Тимонуклеиновая кислота, Литература
Фрэнсис Крик, Розалинд Франклин, Джеймс Уотсон и Морис Уилкинс
Домашняя страница / Обучение / Исторические биографии
В Королевском колледже Лондона Розалинда Франклин получила изображения ДНК с помощью рентгеновской кристаллографии. Эту идею впервые выдвинул Морис Уилкинс. Изображения Франклина позволили Джеймсу Уотсону и Фрэнсису Крику создать свою знаменитую двухцепочечную или двойную спиральную модель.
В 1962 году Уотсон (1928 г. р.), Крик (1916–2004) и Уилкинс (1916–2004) совместно получили Нобелевскую премию по физиологии и медицине за свои 1953 определение структуры дезоксирибонуклеиновой кислоты (ДНК). Коллега Уилкинса Франклин (1920–1958), умерший от рака в возрасте 37 лет, не удостоился такой чести. Причины ее исключения обсуждались и до сих пор неясны. Существует положение о Нобелевской премии, в котором говорится, что «сумма премии ни в коем случае не может быть разделена между более чем тремя лицами». Тот факт, что она умерла до присуждения премии, также мог быть фактором, хотя условие против посмертных наград не было введено до 19 г.74.
Открытие структуры ДНК
Молекула, являющаяся основой наследственности, ДНК, содержит образцы для построения белков в организме, включая различные ферменты. Новое понимание наследственности и наследственных заболеваний стало возможным после того, как было установлено, что ДНК состоит из двух цепей, скрученных вокруг друг друга, или двойных спиралей, состоящих из чередующихся фосфатных и сахарных групп, и что эти две цепи удерживаются вместе водородными связями между парами молекул ДНК. органические основания — аденин (А) с тимином (Т) и гуанин (Г) с цитозином (Ц). Современная биотехнология также основывается на знании структуры ДНК — в данном случае на способности ученого модифицировать ДНК клеток-хозяев, которые затем будут производить желаемый продукт, например, инсулин.
органические основания — аденин (А) с тимином (Т) и гуанин (Г) с цитозином (Ц). Современная биотехнология также основывается на знании структуры ДНК — в данном случае на способности ученого модифицировать ДНК клеток-хозяев, которые затем будут производить желаемый продукт, например, инсулин.
Основой для работы четырех ученых послужили несколько научных прорывов: прогресс, достигнутый рентгеноструктурными анализаторами в изучении органических макромолекул; растущие данные генетиков о том, что за наследственность отвечает ДНК, а не белок в хромосомах; Эксперимент Эрвина Чаргаффа показал, что в ДНК имеется равное количество оснований А и Т, а также оснований G и С; и открытие Лайнуса Полинга, что молекулы некоторых белков имеют спиралевидную форму, сделанное благодаря использованию атомных моделей и глубокому знанию возможного расположения различных атомов.
Розалинд Франклин в Париже.
Витторио Луццати
Розалинда Франклин
Из четырех исследователей ДНК только Розалинда Франклин имела степень в области химии. Она родилась в известной семье лондонских банкиров, где всех детей — девочек и мальчиков — поощряли развивать их индивидуальные способности. Она училась в Newnham College, одном из женских колледжей Кембриджского университета. Она получила степень в 1941 году, в разгар Второй мировой войны, и поступила в аспирантуру в Кембридже вместе с Рональдом Норришем, будущим лауреатом Нобелевской премии. Всего через год она отказалась от своей исследовательской стипендии, чтобы внести свой вклад в военные усилия Британской ассоциации исследований использования угля. Там она провела фундаментальные исследования свойств угля и графита. Она ненадолго вернулась в Кембридж, где представила диссертацию, основанную на этой работе, и получила докторскую степень по физической химии.
Она родилась в известной семье лондонских банкиров, где всех детей — девочек и мальчиков — поощряли развивать их индивидуальные способности. Она училась в Newnham College, одном из женских колледжей Кембриджского университета. Она получила степень в 1941 году, в разгар Второй мировой войны, и поступила в аспирантуру в Кембридже вместе с Рональдом Норришем, будущим лауреатом Нобелевской премии. Всего через год она отказалась от своей исследовательской стипендии, чтобы внести свой вклад в военные усилия Британской ассоциации исследований использования угля. Там она провела фундаментальные исследования свойств угля и графита. Она ненадолго вернулась в Кембридж, где представила диссертацию, основанную на этой работе, и получила докторскую степень по физической химии.
После войны через друга-француза она получила назначение в Центральную лабораторию химико-технических услуг в Париже, где познакомилась с техникой рентгеновской кристаллографии (см. видео на этой странице) и быстро стал уважаемым авторитетом в этой области. В 1951 году она вернулась в Англию в Королевский колледж Лондона, где ей было поручено модернизировать рентгеновскую кристаллографическую лабораторию для работы с ДНК.
В 1951 году она вернулась в Англию в Королевский колледж Лондона, где ей было поручено модернизировать рентгеновскую кристаллографическую лабораторию для работы с ДНК.
Морис Уилкинс
Морис Уилкинс с рентгеновским кристаллографическим оборудованием около 19 лет54.
Королевский колледж Лондона и Гораций Фриланд Джадсон
В Королевском колледже уже работал Морис Уилкинс, новозеландский физик, получивший образование в Кембридже. В качестве нового кандидата наук он работал во время Второй мировой войны над усовершенствованием экранов электронно-лучевых трубок для использования в радарах, а затем был отправлен в Соединенные Штаты для работы над Манхэттенским проектом. Как и многие другие физики-ядерщики, он разочаровался в своем предмете, когда его применили к созданию атомной бомбы; вместо этого он обратился к биофизике, работая со своим кембриджским наставником Джоном Т. Рэндаллом, который претерпел подобное обращение, сначала в Сент-Эндрюсском университете в Шотландии, а затем в Королевском колледже Лондона.
Это была идея Уилкинса исследовать ДНК методами рентгеновской кристаллографии, которую он уже начал реализовывать, когда Франклин был назначен Рэндаллом. Отношения между Уилкинсом и Франклином, к сожалению, были плохими и, вероятно, замедлили их развитие.
Джеймс Уотсон и Фрэнсис Крик
Тем временем в 1951 году 23-летний Джеймс Уотсон, американец, родившийся в Чикаго, прибыл в Кавендишскую лабораторию в Кембридже. У Уотсона было две степени по зоологии: степень бакалавра в Чикагском университете и степень доктора в Университете Индианы, где он заинтересовался генетикой. Он работал под руководством Сальвадора Э. Лурии в Индиане над бактериофагами, вирусами, проникающими в бактерии с целью размножения, — тема, за которую Лурия получил Нобелевскую премию по физиологии и медицине в 1919 году.69. Уотсон отправился в Данию для работы над докторской диссертацией, чтобы продолжить изучение вирусов и исправить свое относительное невежество в химии. Весной 1951 года на конференции на Зоологической станции в Неаполе Уотсон услышал доклад Уилкинса о молекулярной структуре ДНК и увидел его недавние рентгеновские кристаллографические фотографии ДНК. Он был на крючке.
Он был на крючке.
Джеймс Уотсон и Фрэнсис Крик Джеймс Уотсон и Фрэнсис Крик со своей моделью ДНК в Кавендишских лабораториях в 1953 году. Чтобы запросить разрешение на использование этой фотографии, посетите веб-сайт научной фотобиблиотеки по адресу photoresearchers.com.
А. Баррингтон Браун
Вскоре Уотсон перешел в Кавендишскую лабораторию, где велось несколько важных проектов в области рентгеновской кристаллографии. Под руководством Уильяма Лоуренса Брэгга Макс Перуц исследовал гемоглобин, а Джон Кендрю изучал миоглобин, белок в мышечной ткани, хранящий кислород. (Перуц и Кендрю получили Нобелевскую премию по химии за свою работу в том же году, когда премия была присуждена исследователям ДНК — в 1962 году.)
Под руководством Перуца работал Фрэнсис Крик, который получил степень бакалавра физики в Университетском колледже Лондона и помогал разрабатывать радары и магнитные мины во время Второй мировой войны. Крик, еще один физик-биолог, должен был писать диссертацию по рентгеновской кристаллографии гемоглобина, когда прибыл Уотсон, стремясь нанять коллегу для работы над ДНК.
Вдохновленные успехом Полинга в работе с молекулярными моделями, Уотсон и Крик быстро собрали несколько моделей ДНК и попытались собрать все доказательства, которые смогли собрать. Отличные рентгеновские снимки Франклин, к которым они получили доступ без ее разрешения, имели решающее значение для правильного решения. Четверо ученых объявили о структуре ДНК в статьях, опубликованных вместе в одном номере журнала 9.0101 Природа .
Отдельные карьерные пути
Затем они разошлись в разные стороны. Франклин поступила в Биркбек-колледж в Лондоне, чтобы работать в лаборатории Дж. Д. Бернала, что было для нее гораздо более подходящим местом, чем Королевский колледж. Перед своей безвременной смертью от рака она внесла важный вклад в рентгеноструктурный анализ структуры вируса табачной мозаики, ставший важной вехой в этой области. К концу жизни она подружилась с Фрэнсисом Криком и его женой и перевела свою лабораторию в Кембридж, где занялась опасной работой над полиовирусом. Уилкинс применил рентгеновские методы для структурного определения мембран нервных клеток и рибонуклеиновой кислоты (РНК) — молекулы, связанной с химическим синтезом в живой клетке, — по мере продвижения по служебной лестнице и ответственности в Королевском колледже.
Уилкинс применил рентгеновские методы для структурного определения мембран нервных клеток и рибонуклеиновой кислоты (РНК) — молекулы, связанной с химическим синтезом в живой клетке, — по мере продвижения по служебной лестнице и ответственности в Королевском колледже.
Последующая карьера Уотсона в конце концов привела его в Лабораторию количественной биологии Колд-Спринг-Харбор (CSHL) на Лонг-Айленде, штат Нью-Йорк, где в качестве директора с 1968 года он возглавил ее к новым высотам в качестве центра исследований в области молекулярной биологии. С 1988 по 1992 год он возглавлял Национальный центр исследований генома человека при Национальном институте здравоохранения. После этого он вернулся в CSHL в качестве канцлера. Расистские высказывания Уотсона об интеллекте африканцев в 2007 году привели к тому, что CSHL вынудила его уйти в отставку, хотя Лаборатория назвала его почетным профессором и почетным попечителем. Когда Уотсон удвоил свои расистские взгляды в документальном фильме 2018 года, лаборатория аннулировала эти почести и разорвала отношения с Уотсоном. Слава Уотсона как первооткрывателя структуры ДНК также сделала его постоянное публичное выражение сексистских взглядов на женщин в науке и его предыдущие евгенистские комментарии о гомосексуализме особенно вредными в первые десятилетия 21-го века.
Слава Уотсона как первооткрывателя структуры ДНК также сделала его постоянное публичное выражение сексистских взглядов на женщин в науке и его предыдущие евгенистские комментарии о гомосексуализме особенно вредными в первые десятилетия 21-го века.
Информация, содержащаяся в этой биографии, последний раз обновлялась 28 июля 2022 года.
Функция ДНК в значительной степени зависит от ее структуры. Трехмерная структура ДНК была впервые предложена Джеймсом Уотсоном и Фрэнсисом Криком в 1953 году. Это одно из самых известных научных открытий всех времен.
Рентгеновская дифракция кристаллов ДНК приводит к получению на рентгеновской пленке крестообразной формы, типичной для молекул спиралевидной формы.
Джеймс и Фрэнсис использовали доказательства, которыми поделились другие, особенно Розалинда Франклин и Морис Уилкинс, чтобы определить форму ДНК. Розалинда работала с Морисом в Королевском колледже Лондона. Она пропустила рентгеновские лучи через кристаллы молекулы ДНК, а затем использовала фотопленку, чтобы записать, куда падают рассеянные рентгеновские лучи. Затем тени на пленке использовались для определения того, где в ДНК лежат плотные молекулы. Этот метод называется рентгеновской дифракцией. Кристаллы ДНК имели на рентгеновской пленке крестообразную форму, типичную для молекул с спиральной формой. Полученный рентгеновский снимок был назван Фотография 51, и Морис поделился им с Джеймсом и Фрэнсисом.
Затем тени на пленке использовались для определения того, где в ДНК лежат плотные молекулы. Этот метод называется рентгеновской дифракцией. Кристаллы ДНК имели на рентгеновской пленке крестообразную форму, типичную для молекул с спиральной формой. Полученный рентгеновский снимок был назван Фотография 51, и Морис поделился им с Джеймсом и Фрэнсисом.
Фотография 51, рентгеновский снимок, сделанный Розалиндой Франклин и ее аспирантом Рэймондом Гослингом. Перекрестный рисунок, видимый на рентгеновском снимке, подчеркивает спиральную структуру ДНК.
Изображение предоставлено: Wellcome Images
В 1953 году Джеймс Уотсон и Фрэнсис Крик опубликовали свою теорию о том, что ДНК должна иметь форму двойной спирали.
В 1953 году Джеймс Уотсон и Фрэнсис Крик опубликовали свою теорию о том, что ДНК должна иметь форму двойной спирали. Двойная спираль напоминает закрученную лестницу. Каждый «вертикальный» полюс лестницы сформирован из основы чередующихся сахарных и фосфатных групп. Каждое основание ДНК (аденин, цитозин, гуанин, тимин) прикреплено к остову, и эти основания образуют ступени. На каждый полный поворот спирали ДНК приходится десять «ступенек».
Каждое основание ДНК (аденин, цитозин, гуанин, тимин) прикреплено к остову, и эти основания образуют ступени. На каждый полный поворот спирали ДНК приходится десять «ступенек».
Шаблон из молекулярной модели ДНК Фрэнсиса Крика и Джеймса Уотсона 1953 года.
Изображение предоставлено Wikimedia Commons.
Джеймс и Фрэнсис предположили, что каждая «ступенька» спирали ДНК состоит из пары оснований.
Джеймс и Фрэнсис предположили, что каждая «ступенька» спирали ДНК состоит из пары оснований, соединенных водородными связями. Согласно правилам Эрвина Чаргаффа, A всегда будет образовывать водородные связи с T, а C с G.
Иллюстрация, показывающая структуру двойной спирали ДНК.
Изображение предоставлено: Genome Research Limited.
От структуры к функции
Представление о том, что ДНК состоит из последовательности пар оснований вдоль сахаро-фосфатного остова, позволило Джеймсу Уотсону и Фрэнсису Крику сделать два важных вывода:
Порядок оснований в каждой цепи составляет цифровой код, который несет в себе инструкции для жизни.
- Две нити ДНК обеспечивают простой механизм копирования молекулы. Если разделить, каждая нить обеспечивает шаблон для создания другой нити. Разделяя таким образом двойную спираль, можно создать две идентичные «дочерние» молекулы.
- Порядок или последовательность оснований на каждой цепи составляет цифровой код, который несет в себе инструкции для жизни. Если мы сможем понять код, мы приблизимся к пониманию того, как работают клетки.
Расшифровка кода жизни
Один большой вопрос остался без ответа. Как перейти от нити ДНК к белку?
Даже после огромного прорыва Фрэнсиса Крика и Джеймса Уотсона один большой вопрос остался без ответа. Как перейти от нити ДНК к белку?
Многие ученые поставили перед собой задачу, но особенно трое, Маршалл Уоррен Ниренберг, Хар Гобинд Корана и Роберт Уильям Холли, первыми открыли, как четыре основания ДНК могут быть преобразованы в 20 строительных блоков белков, также известных как аминокислоты.
Для этого они сконструировали очень простую цепь РНК, состоящую из цепи, состоящей только из одного основания, повторяющегося снова и снова; в данном случае это было основание урацил, или U. В лаборатории это привело к производству белка, состоящего только из одного типа аминокислоты, аминокислоты фенилаланина. С помощью этого простого эксперимента в 1961, они взломали первую букву кода, цепочка Us переводится в цепочку фенилаланина. Затем они могли бы продолжить эксперимент, но используя другие базы, чтобы узнать другие буквы кода.
Каждый кодон определяет аминокислоту, которая добавляется к белку во время синтеза.
В конце концов они определили, что буквы в ДНК читаются блоками по три, называемыми «кодонами». Каждый кодон определяет аминокислоту, которая добавляется к белку во время синтеза.
В 1968 году трое ученых были награждены за свою работу Нобелевской премией по физиологии и медицине.
Маршалл Уоррен Ниренберг празднует получение Нобелевской премии с шампанским в мензурке.

 ,
,
 abstract collage
abstract collage Тверская, д. 9,
Тверская, д. 9,
 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1266766/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1266766/
 https://www.nap.edu/read/5859/chapter/5 (по состоянию на 21 января 2019 г.).
https://www.nap.edu/read/5859/chapter/5 (по состоянию на 21 января 2019 г.).