Содержание
Названия химических элементов
Названия химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннессин |
| 118 | Og | Oganesson | Оганессон |
https://iupac. org/what-we-do/periodic-table-of-elements/
org/what-we-do/periodic-table-of-elements/
Нейросеть-переводчик называет молекулы не хуже настоящих химиков
У химических веществ есть названия и формулы. Например, C₂H₅OH – это формула, а «этанол» или «этиловый спирт» – это названия. На заре развития науки химии веществам давали простые (их ещё называют тривиальные) названия, но по мере того, как число изученных молекул росло в геометрической прогрессии, доступные слова для молекул быстро закончились. Как-никак, химических элементов не только больше, чем букв в любом алфавите, но и соединяться они могут в «слова» длиной в несколько сотен букв и больше, что невозможно даже в немецком языке с его Donaudampfschiffahrtsgesellschaftskapitän. Да и самим химикам хотелось навести какой-то порядок в химической терминологии. Так появилась система наименований химических соединений – номенклатура ИЮПАК, которую разрабатывает Международный союз теоретической и прикладной химии.
С номенклатурой ИЮПАК многие могли встретиться в курсе школьной химии, когда в задачке требовалось назвать «по ИЮПАК» изобутиловый спирт каким-нибудь 2-метилпропанолом-1. Собственно, эта номенклатура содержит свод правил, как следует назвать молекулу, чтобы потом по этому названию можно было однозначно восстановить его формулу. Эти правила дают конкретные указания, как нумеровать атомы, в какой последовательности записывать названия химических групп и т.д. Но если для простых молекул названия получаются однозначно определённые, то для сложных молекул возможны варианты, когда несколько названий будут правильными с точки зрения номенклатуры. Но обратная ситуация, когда одному названию соответствует несколько разных химических веществ, номенклатура исключает – в этом её несравненное достоинство.
Собственно, эта номенклатура содержит свод правил, как следует назвать молекулу, чтобы потом по этому названию можно было однозначно восстановить его формулу. Эти правила дают конкретные указания, как нумеровать атомы, в какой последовательности записывать названия химических групп и т.д. Но если для простых молекул названия получаются однозначно определённые, то для сложных молекул возможны варианты, когда несколько названий будут правильными с точки зрения номенклатуры. Но обратная ситуация, когда одному названию соответствует несколько разных химических веществ, номенклатура исключает – в этом её несравненное достоинство.
По мере всё большей компьютеризации нашей жизни, и химической науки в том числе, идентификация вещества по его названию стала не такой важной, какой она была в прошлом веке. Компьютерам проще обрабатывать цифры и формулы, чем разбираться в семантике названий N-(4-гидроксифенил)ацетамида. Так появились более «цифровые» номенклатуры, например, SMILES (Simplified Molecular Input Line Entry System). Предыдущая молекула (а это обычный парацетамол) в номенклатуре SMILES будет выглядеть, как CC(=O)Nc1ccc(O)cc1. Тем не менее, номенклатура ИЮПАК всё равно ещё в ходу: она используется в патентах, государственных и регуляторных документах, да и сами химики продолжают называть с помощью неё как новые, так и уже известные соединения.
Предыдущая молекула (а это обычный парацетамол) в номенклатуре SMILES будет выглядеть, как CC(=O)Nc1ccc(O)cc1. Тем не менее, номенклатура ИЮПАК всё равно ещё в ходу: она используется в патентах, государственных и регуляторных документах, да и сами химики продолжают называть с помощью неё как новые, так и уже известные соединения.
Чтобы облегчить людям процесс присвоения правильных имён молекулам, существуют коммерческие программы. Несмотря на то, что сами правила алгоритмизированы, их всё равно настолько много и они весьма непростые, поэтому и компьютеризация номенклатуры – процесс трудозатратный. Так что не удивительно, что те, кто это уже сделали, хотят на этом заработать. Однако благодаря работе исследователей из Сколтеха, МГУ имени М. В. Ломоносова и компании Syntelly у всех ленивых и экономных химиков появился отличный инструмент, позволяющий быстро, правильно и, что немаловажно, бесплатно называть органические молекулы.
Чтобы решить эту задачу, исследователи использовали «Трансформер» – одну из самых мощных современных нейросетей, созданную компанией Google для машинного перевода с одного языка на другой. Но вместо перевода с русского на китайский команда обучила нейросеть «переводить» молекулу из структурного представления SMILES в наименование по ИЮПАК и наоборот. Для обучения и тестирования сети авторы исследования использовали самую большую в мире открытую базу химических веществ PubChem, содержащую около 100 миллионов соединений. Формулы молекул в формате SMILES, как и их названия в номенклатуре ИЮПАК, состоят из универсальных «кирпичиков» – букв, цифр, символов и их комбинаций.
Но вместо перевода с русского на китайский команда обучила нейросеть «переводить» молекулу из структурного представления SMILES в наименование по ИЮПАК и наоборот. Для обучения и тестирования сети авторы исследования использовали самую большую в мире открытую базу химических веществ PubChem, содержащую около 100 миллионов соединений. Формулы молекул в формате SMILES, как и их названия в номенклатуре ИЮПАК, состоят из универсальных «кирпичиков» – букв, цифр, символов и их комбинаций.
Нейросеть, анализируя миллионы сочетаний формула-название может выработать свои внутренние «правила» перевода одного в другое. И оказалось, что делать это она может очень хорошо. На молекулах среднего размера её точность приближается к 100%, а в целом по тестовой выборке из базы данных PubChem точность перевода составила 98.9%. С чем модель справлялась плохо, так это названия очень больших молекул – в них были либо пропущены некоторые буквы, либо целые фрагменты молекулы. Нейросети подобного типа могут работать с длинными последовательностями, так что, возможно, что ошибки были связаны с небольшим количеством очень больших молекул, и нейросеть просто не успела обучиться на таких примерах.
Как отмечают авторы работы, они не просто сделали удобный инструмент для учёных, но, что более важно, им удалось показать, что нейронные сети способны достаточно точно решать алгоритмические задачи. «И человек, и нейронная сеть хорошо справятся, к примеру, с задачей различения фотографий кошек и собак, для которой невозможно эффективное алгоритмическое решение без машинного обучения. В то же время человек плохо перемножает многозначные числа, а простейший калькулятор делает это мгновенно и с абсолютной точностью – это пример чисто алгоритмической задачи, как и генерация названий по номенклатуре ИЮПАК», — поясняет Сергей Соснин, руководитель исследования.
Статья с результатами работы опубликована в Nature в открытом доступе. А поэкспериментировать с нейросетевым «химиком-номенклатурщиком» можно на страничке проекта Syntelly.
По материалам Сколтеха.
Фото: Пример молекулы циклического пептида, для которой нейросеть проекта Syntelly даёт корректное название по правилам ИЮПАК.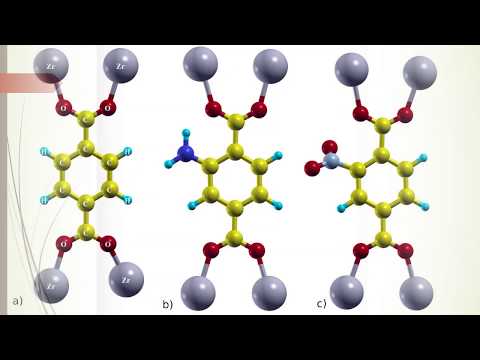 Хотя авторы работы отмечают, что в названиях подобных больших молекул нейросеть пока часто делает ошибки. Илл.: L. Krasnov et al, Nature, 2021.
Хотя авторы работы отмечают, что в названиях подобных больших молекул нейросеть пока часто делает ошибки. Илл.: L. Krasnov et al, Nature, 2021.
3.6: Молекулярные соединения – формулы и названия
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37956
Цели обучения
- Получение названий распространенных типов неорганических соединений с использованием систематического подхода
Характеристики связывания неорганических молекулярных соединений отличаются от характеристик ионных соединений, и они также называются с использованием другой системы. Заряды катионов и анионов определяют их соотношение в ионных соединениях, поэтому указание названий ионов дает достаточно информации для определения химических формул.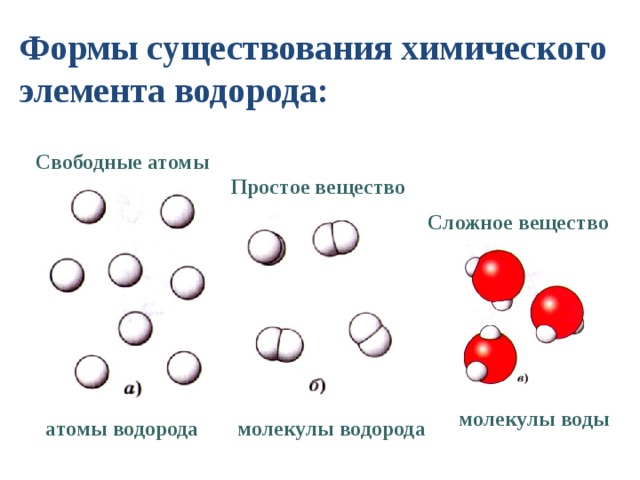 Однако, поскольку ковалентная связь допускает значительные вариации соотношений комбинаций атомов в молекуле, названия молекулярных соединений должны явно идентифицировать эти соотношения.
Однако, поскольку ковалентная связь допускает значительные вариации соотношений комбинаций атомов в молекуле, названия молекулярных соединений должны явно идентифицировать эти соотношения.
Соединения, состоящие из двух элементов
Когда два неметаллических элемента образуют молекулярное соединение, часто возможны несколько соотношений комбинаций. Например, углерод и кислород могут образовывать соединения CO и CO 2 . Поскольку это разные вещества с разными свойствами, они не могут оба иметь одинаковое название (нельзя оба называться оксидом углерода). Чтобы справиться с этой ситуацией, мы используем метод именования, который чем-то похож на тот, который используется для ионных соединений, но с добавлением префиксов для указания количества атомов каждого элемента. Название более металлического элемента (тот, что дальше слева и/или внизу таблицы Менделеева) стоит первым, за ним следует название более неметаллического элемента (тот, что дальше справа и/или вверху) с окончанием изменен на суффикс — иде . Количество атомов каждого элемента обозначено греческими префиксами, показанными в таблице \(\PageIndex{3}\).
Количество атомов каждого элемента обозначено греческими префиксами, показанными в таблице \(\PageIndex{3}\).
| Номер | Префикс | Номер | Префикс | |
|---|---|---|---|---|
| 1 (иногда опускается) | моно- | 6 | гекса- | |
| 2 | ди- | 7 | гепта- | |
| 3 | три- | 8 | окта- | |
| 4 | тетра- | 9 | нон- | |
| 5 | пента- | 10 | дека- |
Когда присутствует только один атом первого элемента, префикс моно — из этой части обычно удаляется. Таким образом, CO называется окисью углерода, а CO 2 — двуокисью углерода. Когда две гласные стоят рядом, a в греческом префиксе обычно опускается. Некоторые другие примеры показаны в таблице \(\PageIndex{4}\).
Таким образом, CO называется окисью углерода, а CO 2 — двуокисью углерода. Когда две гласные стоят рядом, a в греческом префиксе обычно опускается. Некоторые другие примеры показаны в таблице \(\PageIndex{4}\).
Есть несколько общих имен, с которыми вы столкнетесь, продолжая изучать химию. Например, хотя NO часто называют оксидом азота, его собственное название — монооксид азота. Аналогично N 2 O известен как закись азота, несмотря на то, что в наших правилах указано название закись азота. (И H 2 O обычно называют водой, а не монооксидом дигидрогена.) Вы должны запоминать общие названия соединений, когда сталкиваетесь с ними.
Например, хотя NO часто называют оксидом азота, его собственное название — монооксид азота. Аналогично N 2 O известен как закись азота, несмотря на то, что в наших правилах указано название закись азота. (И H 2 O обычно называют водой, а не монооксидом дигидрогена.) Вы должны запоминать общие названия соединений, когда сталкиваетесь с ними.
Наименование ковалентных соединений
Назовите следующие ковалентные соединения:
- SF 6
- Н 2 О 3
- Класс 2 О 7
- Р 4 О 6
Раствор
Поскольку эти соединения состоят исключительно из неметаллов, мы используем префиксы для обозначения количества атомов каждого элемента:
- гексафторид серы
- триоксид диазота
- дихлоргептоксид
- гексоксид тетрафосфора
Упражнение \(\PageIndex{2}\)
Напишите формулы следующих соединений:
- пентахлорид фосфора
- монооксид диазота
- гептафторид йода
- четыреххлористый углерод
Ответ:
(а) PCl 5 ; (б) N 2 О; (в) IF 7 ; (d) CCl 4
Бинарные кислоты
Некоторые соединения, содержащие водород, относятся к важному классу веществ, известных как кислоты. Химия этих соединений более подробно рассматривается в последующих главах этого текста, а пока достаточно отметить, что многие кислоты выделяют ионы водорода, H + при растворении в воде. Чтобы обозначить это особое химическое свойство, смеси воды с кислотой дается название, производное от названия соединения. Если соединение представляет собой бинарную кислоту (состоящую из водорода и одного другого неметаллического элемента):
Химия этих соединений более подробно рассматривается в последующих главах этого текста, а пока достаточно отметить, что многие кислоты выделяют ионы водорода, H + при растворении в воде. Чтобы обозначить это особое химическое свойство, смеси воды с кислотой дается название, производное от названия соединения. Если соединение представляет собой бинарную кислоту (состоящую из водорода и одного другого неметаллического элемента):
- Слово «водород» заменяется префиксом гидро-
- Название другого неметаллического элемента изменяется путем добавления суффикса — ic
- Слово «кислота» добавлено вторым словом
Например, когда газ HCl (хлороводород) растворяется в воде, раствор называется соляной кислотой . Несколько других примеров этой номенклатуры показаны в таблице \(\PageIndex{5}\).
Оксикислоты
Многие соединения, содержащие три или более элементов (например, органические соединения или координационные соединения), подчиняются специальным правилам номенклатуры, которые вы узнаете позже. Тем не менее, мы кратко обсудим важные соединения, известные как оксикислоты, соединения, которые содержат водород, кислород и, по крайней мере, еще один элемент и связаны таким образом, что придают соединению кислотные свойства (вы узнаете подробности этого в следующей главе). Типичные оксикислоты состоят из водорода в сочетании с многоатомным кислородсодержащим ионом. Назвать оксикислоты:
Тем не менее, мы кратко обсудим важные соединения, известные как оксикислоты, соединения, которые содержат водород, кислород и, по крайней мере, еще один элемент и связаны таким образом, что придают соединению кислотные свойства (вы узнаете подробности этого в следующей главе). Типичные оксикислоты состоят из водорода в сочетании с многоатомным кислородсодержащим ионом. Назвать оксикислоты:
- Пропустить «водород»
- Начните с корневого имени аниона
- Заменить – ate на – ic или – ite на – ous
- Добавить «кислота»
Например, рассмотрите H 2 CO 3 (который у вас может возникнуть соблазн назвать «гидрокарбонатом»). Чтобы назвать это правильно, «водород» опущен; — ate карбоната заменить на — ic ; и прибавляется кислота — поэтому ее имя — угольная кислота. Другие примеры приведены в таблице \(\PageIndex{6}\). Есть некоторые исключения из общего метода именования (например, H 2 SO 4 называется серной кислотой, а не серной кислотой, а H 2 SO 3 — сернистой, а не сернистой кислотой).
| Формула | Название аниона | Название кислоты |
|---|---|---|
| HC 2 H 3 O 2 | ацетат | уксусная кислота |
| HNO 3 | нитрат | азотная кислота |
| HNO 2 | нитрит | азотистая кислота |
| HClO 4 | перхлорат | хлорная кислота |
| H 2 CO 3 | карбонат | угольная кислота |
| H 2 SO 4 | сульфат | серная кислота |
| H 2 SO 3 | сульфит | сернистая кислота |
| H 3 Заказ на покупку 4 | фосфат | фосфорная кислота |
Резюме
Химики используют правила номенклатуры, чтобы четко называть соединения. Ионные и молекулярные соединения называются несколько по-разному. Бинарные ионные соединения обычно состоят из металла и неметалла. Сначала пишется название металла, затем название неметалла с измененным окончанием на – ide . Например, K 2 O называется оксидом калия. Если металл может образовывать ионы с разными зарядами, после названия металла в скобках следует римская цифра, указывающая его заряд. Таким образом, FeCl 2 представляет собой хлорид железа (II), а FeCl 3 представляет собой хлорид железа (III). Некоторые соединения содержат многоатомные ионы; следует запомнить названия обычных многоатомных ионов. Молекулярные соединения могут образовывать соединения с различным соотношением их элементов, поэтому префиксы используются для указания количества атомов каждого элемента в молекуле соединения. Примеры включают SF 6 , гексафторид серы, и N 2 O 4 , четырехокись азота. Кислоты представляют собой важный класс соединений, содержащих водород и имеющих особые правила номенклатуры.
Ионные и молекулярные соединения называются несколько по-разному. Бинарные ионные соединения обычно состоят из металла и неметалла. Сначала пишется название металла, затем название неметалла с измененным окончанием на – ide . Например, K 2 O называется оксидом калия. Если металл может образовывать ионы с разными зарядами, после названия металла в скобках следует римская цифра, указывающая его заряд. Таким образом, FeCl 2 представляет собой хлорид железа (II), а FeCl 3 представляет собой хлорид железа (III). Некоторые соединения содержат многоатомные ионы; следует запомнить названия обычных многоатомных ионов. Молекулярные соединения могут образовывать соединения с различным соотношением их элементов, поэтому префиксы используются для указания количества атомов каждого элемента в молекуле соединения. Примеры включают SF 6 , гексафторид серы, и N 2 O 4 , четырехокись азота. Кислоты представляют собой важный класс соединений, содержащих водород и имеющих особые правила номенклатуры. Бинарные кислоты называются с использованием префикса 9.0036 hydro-, заменив суффикс –ide на –ic и добавив слово «кислота»; HCl — соляная кислота. Оксикислоты названы путем изменения окончания аниона на — ic и добавления «кислоты»; H 2 CO 3 – угольная кислота.
Бинарные кислоты называются с использованием префикса 9.0036 hydro-, заменив суффикс –ide на –ic и добавив слово «кислота»; HCl — соляная кислота. Оксикислоты названы путем изменения окончания аниона на — ic и добавления «кислоты»; H 2 CO 3 – угольная кислота.
Авторы и ссылки
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
5.8: Именование молекулярных соединений — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98012
Цели обучения
- Определить название простого молекулярного соединения по его химической формуле.
Молекулярные соединения
Молекулярные соединения представляют собой неорганические соединения, которые принимают форму дискретных молекул . Примеры включают такие знакомые вещества, как вода \(\left( \ce{H_2O} \right)\) и углекислый газ \(\left( \ce{CO_2} \right)\). Эти соединения сильно отличаются от ионных соединений, таких как хлорид натрия \(\left( \ce{NaCl} \right)\). Ионные соединения образуются, когда атомы металлов отдают один или несколько своих электронов атомам неметаллов. Образовавшиеся катионы и анионы электростатически притягиваются друг к другу.
Эти соединения сильно отличаются от ионных соединений, таких как хлорид натрия \(\left( \ce{NaCl} \right)\). Ионные соединения образуются, когда атомы металлов отдают один или несколько своих электронов атомам неметаллов. Образовавшиеся катионы и анионы электростатически притягиваются друг к другу.
Так что же удерживает атомы молекулы вместе? Вместо того, чтобы образовывать ионы, атомы молекулы делят свои электронов таким образом, что между парой атомов образуется связь . В молекуле диоксида углерода есть две такие связи, каждая из которых возникает между атомом углерода и одним из двух атомов кислорода.
Рисунок \(\PageIndex{1}\): Молекулы углекислого газа состоят из центрального атома углерода, связанного с двумя атомами кислорода.
Более крупные молекулы могут иметь много-много связей, которые удерживают молекулу вместе. В большом образце данного молекулярного соединения все отдельные молекулы идентичны.
Наименование бинарных молекулярных соединений
Напомним, что молекулярная формула показывает количество атомов каждого элемента, содержащегося в молекуле. Молекула воды содержит два атома водорода и один атом кислорода, поэтому ее формула \(\ce{H_2O}\). Молекула октана, входящего в состав бензина, содержит 8 атомов углерода и 18 атомов водорода. Молекулярная формула октана: \(\ce{C_8H_{18}}\).
Молекула воды содержит два атома водорода и один атом кислорода, поэтому ее формула \(\ce{H_2O}\). Молекула октана, входящего в состав бензина, содержит 8 атомов углерода и 18 атомов водорода. Молекулярная формула октана: \(\ce{C_8H_{18}}\).
Рисунок \(\PageIndex{2}\): Двуокись азота \(\left( \ce{NO_2} \right)\) представляет собой красновато-коричневый токсичный газ, который является заметным загрязнителем воздуха, вырабатываемым двигателями внутреннего сгорания.
Называние бинарных (двухэлементных) молекулярных соединений аналогично именованию простых ионных соединений. Первый элемент в формуле просто указан с использованием имени элемента. Имя второго элемента берется из основы имени элемента и добавляется суффикс — ide . Система числовых префиксов используется для указания количества атомов в молекуле. В таблице \(\PageIndex{1}\) перечислены эти числовые префиксы.
| Количество атомов в соединении | Префикс имени элемента |
|---|---|
| 1 | моно-* |
| 2 | ди- |
| 3 | три- |
| 4 | тетра- |
| 5 | пента- |
| 6 | шестигранник |
| 7 | гепта- |
| 8 | окта- |
| 9 | нон- |
| 10 | дека- |
*Этот префикс не используется для имени первого элемента.
Примечание
- Обычно менее электроотрицательный элемент пишется в формуле первым, хотя есть несколько исключений. Углерод всегда стоит первым в формуле, а водород стоит после азота в такой формуле, как \(\ce{NH_3}\). Порядок обычных неметаллов в формулах бинарных соединений следующий: \(\ce{C}\), \(\ce{P}\), \(\ce{N}\), \(\ce{H}\), \(\ce{S}\), \(\ce{I}\), \(\ce{Br}\), \(\ce{Cl}\), \(\ce{O}\), \(\ce{F}\).
- a или o в конце префикса обычно опускается из имени, когда имя элемента начинается с гласной. Например, четыре атома кислорода — это тетр 9.0045 или оксид вместо тетра или оксид.
- Префикс «моно» не добавляется к имени первого элемента, если в молекуле есть только один атом первого элемента.
Некоторые примеры молекулярных соединений перечислены в таблице \(\PageIndex{2}\).
| Формула | Имя |
|---|---|
| \(\ce{НЕТ}\) | монооксид азота |
| \(\ce{N_2O}\) | монооксид диазота |
| \(\ce{S_2Cl_2}\) | сера дихлорид |
| \(\ce{Cl_2O_7}\) | семиокись дихлора |
Обратите внимание, что префикс моно- не используется с азотом в первом соединении, но используется с кислородом в обоих первых двух примерах. \(\ce{S_2Cl_2}\) подчеркивает, что формулы молекулярных соединений не сводятся к их наименьшим соотношениям. o из моно- и a из гепта- исключаются из названия в сочетании с оксидом.
\(\ce{S_2Cl_2}\) подчеркивает, что формулы молекулярных соединений не сводятся к их наименьшим соотношениям. o из моно- и a из гепта- исключаются из названия в сочетании с оксидом.
Упражнение \(\PageIndex{1}\)
Напишите название для каждого соединения.
- ЦФ 4
- SeCl 2
- СО 3
- Ответ a:
- четырехфтористый углерод
- Ответ б:
- дихлорид селена
- Ответ c:
- триоксид серы
Простые молекулярные соединения с общими названиями
Для некоторых простых ковалентных соединений мы используем общие названия, а не систематические названия. Мы уже встречались с этими соединениями, но перечислим их здесь явно:
- H 2 O: вода
- NH 3 : аммиак
- CH 4 : метан
- H 2 O 2 : перекись водорода
Метан — простейшее органическое соединение. Органические соединения представляют собой соединения с атомами углерода и называются по отдельной номенклатурной системе.
Органические соединения представляют собой соединения с атомами углерода и называются по отдельной номенклатурной системе.
Некоторые соединения имеют как ковалентные, так и ионные связи
Если вы вспомните введение многоатомных ионов, вы помните, что связи, удерживающие многоатомные ионы вместе, являются ковалентными. Как только многоатомный ион построен с ковалентными связями, он реагирует с другими веществами как ион. Связь между многоатомным ионом и другим ионом будет ионной. Примером такой ситуации является соединение нитрата натрия. Нитрат натрия состоит из иона натрия и нитрат-иона. Ион нитрата удерживается вместе ковалентными связями, а ион нитрата связан с ионом натрия ионной связью.
Резюме
- Молекулярное соединение обычно состоит из двух или более неметаллических элементов.
- Молекулярные соединения обозначаются сначала первым элементом, а затем вторым элементом с использованием основы названия элемента плюс суффикса -ide.

