Нобелевская премия по медицине и физиологии 2016: за самоедство. Нобелевская премия по физиологии и по медицине
Нобелевская премия по медицине и физиологии 2016: за самоедство
В 2016 году Нобелевскую премию по физиологии и медицине присудили профессору Токийского технологического института Ёсинори Осуми. Японский ученый удостоился ее за свои фундаментальные работы, объяснившие миру, как происходит аутофагия — ключевой процесс переработки и реутилизации клеточных компонентов.
Ёсинори Осуми стал четвертым японцем, которому присвоена Нобелевская премия по медицине и физиологии. Первым был Судзуми Тонегава: за открытие генетического принципа образования разнообразных антител. Затем в 2012 году премию получил Синъя Яманака за работу с индуцированными стволовыми клетками, о чем «биомолекула» уже писала [1]. Год назад лауреатом премии стал Сатоси Омура, вложивший в руки врачей новое оружие для борьбы с червями-паразитами, вызывающими заболевания у людей [2]. Интересно, что за такой короткий срок сразу три премии отправились в Страну Восходящего Солнца.
Рисунок 1. Дрожжи Saccharomyces cerevisiae — главные герои Нобелевской премии после самого лауреата.
Аутофагия, за изучение которой вручена премия в этом году, — это совокупность процессов, позволяющих клетке при помощи лизосом избавляться от скоплений внутриклеточного «мусора» и пришедших в негодность органелл [3]. В ходе аутофагии компонент клетки, которому суждено быть уничтоженным, окружается двухслойной мембраной, формируя аутофагосому. На следующем этапе с аутофагосомой сливается лизосома, и лизосомные ферменты начинают расщеплять содержимое аутофагосомы до самых мелких молекул. Так клетка уничтожает старые или дефектные компоненты, а «останки» используются повторно. За открытие лизосом в свое время также была присуждена Нобелевская премия по физиологии и медицине: в 1974 году ее получил бельгиец Кристиан де Дюв [4]. Он же, кстати, и придумал термин «аутофагия» в 1963 году. Так что, в определенном смысле, у премии, врученной в этом году, есть своя «нобелевская» история.
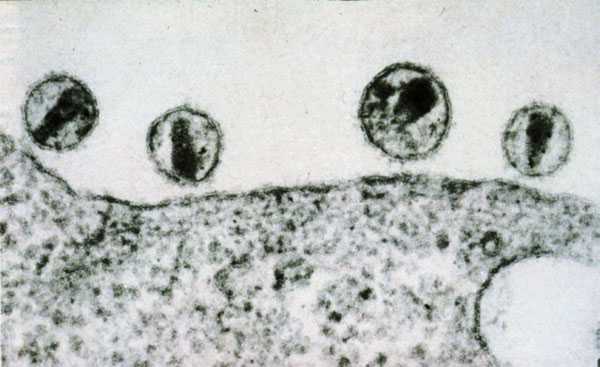
Сам процесс аутофагии был известен с 1960-х годов, но его молекулярные основы оставались для ученых неясными. Чтобы изучить, как протекает аутофагия, Осуми выбрал обычные пекарские дрожжи Saccharomyces cerevisiae (рис. 1). В эксперименте он использовал не простые, а мутантные клетки дрожжей: они были лишены нескольких протеолитических ферментов. Кроме этого ученые дополнительно простимулировали аутофагию, поместив клетки в среду, бедную питательными веществами (а считалось, что клетка начинает заниматься «самоедством» именно в условиях голодания). В цитоплазме клетки стали возникать аутофагосомы, и через три часа вакуоли дрожжей целиком ими заполнились (рис. 2). Ученые исследовали образовавшиеся органеллы, и оказалось, что они по составу и химической активности не отличались от окружавшей их цитоплазмы. Это означало, что процесс аутофагии был приостановлен за счет недостатка протеолитических ферментов [5]. Они должны были поступать из лизосом, но вследствие генетического дефекта ферменты не были синтезированы клеткой.

Рисунок 2. Дрожжевая клетка с вакуолью, заполненной аутофагосомами, в которых не происходит расщепления содержимого. Буквой V обозначена вакуоль, а буквами AB — аутофагосомы, которые не слились с лизосомами.
В этой же работе были опубликованы данные о том, что ключевую роль для блокирования аутофагии у дрожжей сыграло отсутствие фермента протеиназы B, закодированного в гене PRB1. Еще через год были опубликованы данные о 15 ключевых генах, задействованных в аутофагии [6]. Дальнейшие исследования, которые с коллегами проводил Ёсинори Осуми, открыли сложный каскад биохимических реакций, позволяющий дрожжевым клеткам запускать процесс аутофагии [7].
Благодаря работам Ёсинори Осуми другие ученые получили инструменты для изучения аутофагии не только у дрожжей, но и у других живых существ, включая человека. В ходе дальнейших исследований было установлено, что аутофагия — это консервативный процесс, и у людей он происходит приблизительно так же. При помощи аутофагии клетки нашего тела получают недостающие энергетические и строительные ресурсы, мобилизуя внутренние резервы. Аутофагия задействована при удалении поврежденных клеточных структур, что важно для поддержания нормальной работы клетки. Также этот процесс — один из механизмов программируемой клеточной смерти. Нарушения аутофагии могут лежать в основе рака и болезни Паркинсона. Кроме этого, аутофагия направлена на борьбу с внутриклеточными инфекционными агентами, например, с возбудителем туберкулеза. Возможно, благодаря тому, что когда-то дрожжи открыли нам секрет аутофагии, мы получим лекарство от этих и других заболеваний.
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Названы лауреаты Нобелевской премии-2015 по физиологии и медицине;
- Аутофагия, протофагия и остальные;
- The Nobel prize in physiology or medicine 1974. Сайт Нобелевского комитета;
- Takeshige K., Baba M., Tsuboi S., Noda T., Ohsumi Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. J. Cell. Biol. 119, 301–311;
- Tsukada M. and Ohsumi Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cervisiae. FEBS Lett. 333, 169–174;
- Mizushima N., Noda T., Yoshimori T., Tanaka Y., Ishii T., George M.D. et al. (1998). A protein conjugation system essential for autophagy. Nature. 395, 395–398.
Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки
Нобелевскую премию по физиологии и медицине в 2012 году получили Джон Гардон (John B. Gurdon) и Шинья Яманака (Shinya Yamanaka) «за открытие факта, что зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние». Их открытие продолжает ряд исследований, опровергающих догмы: ранее считалось, что процесс клеточной дифференциации — это «билет в один конец», и клетки, обретшие специализацию, уже никогда не могут вернуться в первичное состояние, когда все пути к дифференциации в различные клеточные линии еще открыты. (Такое состояние называют плюрипотентным.) В 1962 году британский биолог развития Гардон заложил первый камень в фундамент нового здания, показав, что пересадка ядра эпителиальной клетки взрослой лягушки в икринку, лишенную клеточного ядра, успешно дает начало нормальному головастику, в свою очередь развивающемуся во взрослую лягушку. Это исследование стало предтечей более поздних экспериментов по клонированию животных.
Однако все еще было непонятно, можно ли целую клетку также заставить «де-дифференцироваться», а потом — превратиться в любую из множества других специализированных клеток. В 2006 году положительный ответ на этот вопрос дал японец Шинья Яманака, использовавший небольшой набор транскрипционных факторов для такого «перепрограммирования». Полученные им клетки получили название индуцированных плюрипотентных стволовых клеток (ИПСК).
Оба этих открытия показали, что казавшееся незыблемым состояние дифференциации при «умелом» воздействии вполне можно отменить и полностью изменить тот путь, по которому предстоит развиваться клетке. Работы этих ученых открыли баснословные перспективы в биологии и медицине.
Предыстория
В процессе нормального развития каждая клетка проходит путь от изначального недифференцированного состояния, характерного для оплодотворенной яйцеклетки (зиготы) и клеток раннего эмбриона, до специализированных клеточных форм, медленно делящихся и служащих для выполнения всего спектра клеточных функций (рис. 1А). Наиболее «многофункциональную» клетку — зиготу — называют тотипотентной, то есть, дающей начало абсолютно всем другим типам клеток.
По мере развития, клетки становятся все более специализированными и все менее подверженными «неожиданным» превращениям. Во взрослом организме число стволовых клеток невелико, и они располагаются в строго определенных местах (например, костном мозге), играя роль источника для пополнения популяции дифференцированных клеток. Эта закономерность и сформировала представление, что развитие клеток возможно лишь в одном направлении, и никогда дифференциация не обернется вспять. Конрад Уэддингтон (Conrad Hal Waddington) использовал метафору горного ландшафта, в которой плюрипотентная клетка находится на вершине горы, а специализированные клетки лежат в долинах, «скатываясь» каждая по своей траектории (изображающей путь дифференциации) (рис. 1Б). Эта метафора подчеркивает сложность или невозможность обратного пути «в гору» и, значит, превращения одних клеток в другие.
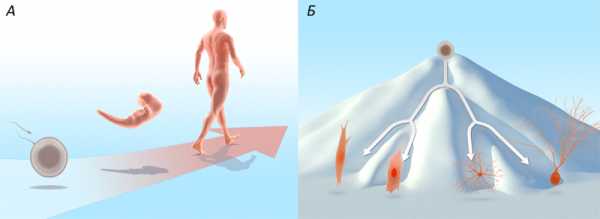
Рисунок 1. Развитие организма и дифференциация клетки. А: нормальное развитие человека из оплодотворенной яйцеклетки до взрослого организма иллюстрирует идею однонаправленного процесса развития. Б: Иллюстрация Уэддингтона [1] для процесса клеточной дифференциации. «Эпигенетический ландшафт» задает путь, который проходит каждая клетка в процессе обретения специализации. Эти картина призвана подчеркнуть, что путь «обратно» невозможен или сильно затруднен.
Однако теоретическая возможность «перепрограммирования» не исключалась полностью; Ханс Шпеман, нобелевский лауреат по физиологии и медицине 1935 года, первым предложил идею «пересадки» ядер дифференцированных клеток в цитоплазму яйцеклетки, чтобы изучить способность к дифференциации.
Перепрограммирование с помощью ядра соматической клетки
Первые попытки пересадки ядер были сделаны не Гардоном; еще в 1952 году Бриггс (Robert Briggs) и Кинг (Thomas King) разработали технологию «пересадки» ядра соматической клетки лягушки Rana pipiens в оплодотворенную икринку, ядро которой предварительно разрушали [2]. Амфибии хорошо подходят для таких экспериментов, потому что их икра крупная и развивается не внутриутробно. В этой работе было показано, что пересадка ядра из эмбриональных клеток действительно может дать начало нормальному головастику, но аналогичный опыт с более дифференцированными клетками к успеху не привел. Поэтому, хотя фактически они проделали ту же работу, что и Гардон несколькими годами позже, им пришлось сделать вывод, что дифференцированные клетки необратимы в своем развитии [3].
Джон Гардон, эмбриолог, закончивший Оксфорд, выбрал для своих опытов другую лягушку — «ветерана» лабораторных исследований Xenopus laevis. Он уничтожал ядро яйцеклетки ультрафиолетовым светом и пересаживал в цитоплазму ядро от дифференцированной клетки эпителия, и в части опытов ему удалось получить нормально плавающих и развивающихся головастиков (рис. 2; [4]). Так что Гардону, в противоположность своим предшественникам, удалось показать именно то, что пересадка ядра от дифференцированных клеток способна вернуть генетическую программу к состоянию плюрипотентности. Однако много лет прошло, прежде чем научное сообщество восприняло эти революционные работы всерьез.
Исследования Гардона подвели подкоп под парадигму необратимости развития, впервые наглядно продемонстрировав, что ядро дифференцированной клетки вполне может быть возвращено на плюрипотентный этап и дать начало всем типам соматических и половых клеток, — если его поместить в цитоплазму яйцеклетки, «настроенной» на этот режим.

Рисунок 2. Перепрограммирование ядра клетки эпителия лягушки. Гардон использовал ультрафиолет, чтобы разрушить ядро икринки лягушки (1), а потом пересаживал туда другое ядро, полученное из эпителия головастика (2). В большинстве случаев клетки погибли, однако несколько из них развились в головастиков и затем — во взрослых лягушек (3). Этот опыт подтвердил, что генетическая информация сохраняется неизменной на протяжении всего срока жизни клетки, и может в подходящих условиях быть задействована вновь. Более поздние исследования, основанные на том же принципе, привели к клонированию млекопитающих (4).
Атака клонов
Работы Гардона положили начало технологии, называемой терапевтическим клонированием (somatic cell nuclear transfer). В 1997 году с помощью этого метода (конечно, с существенными изменениями) появилась на свет знаменитая овечка Долли [5]. Важным дополнением стало то, что ядро перед пересадкой ввергали в покоящееся состояние, что позволяло лучше «синхронизовать» ядро с клеткой, его лишенной. С тех пор уже удалось клонировать довольно много млекопитающих — не только овцу, но и мышь, корову, свинью, волка и степного кота. Метод пересадки ядер также позволил совершить ряд важных открытий в иммунологии.
Эра перепрограммированных клеток
Гардон наглядно доказал, что перенос ядра в окружение раннего эмбрионального развития способен «перезапустить» программу развития. Однако можно ли такое сделать, не извлекая ядро из клетки? Многие ученые продолжали считать это невозможным, полагая эпигенетические изменения, произошедшие в дифференцированной клетке, слишком далеко зашедшими, чтобы можно было их обратить вспять. Наверное, так считал и Яманака, когда он начал заниматься эмбриональными стволовыми клетками (ЭСК) [6], впервые выделенными и культивированными Мартином Эвансом (лауреатом Нобелевской премии по физиологии и медицине 2008 года [7]).
Лаборатория Яманаки работала над поиском факторов, поддерживающих в ЭСК программу плюрипотентности. Было найдено несколько десятков генов, активность которых в ЭСК была намного выше, чем в дифференцированных клетках, и, кроме того, уже открыли, что слияние ЭСК и специализированной клетки может дать две плюрипотентные клетки [8].
Вооруженная этим знанием, группа Яманаки внедрила в клетку (выбрали фибробласт) вектор с 24 генами, заставившими часть клеток дать колонии, подобные стволовым клеткам, и принялась по одному удалять гены из этого набора. В результате был установлен список из всего четырех генов, необходимых для «перепрограммирования» клетки: Myc, Oct3/4, Sox2 и Klf4 (рис. 3) [9]*. Полученные клетки, названные Яманакой индуцированными плюрипотентными стволовыми клетками (ИПСК), получались в результате изобретенной процедуры с крайне низким выходом, но применяемые технологии селекции позволяют обнаружить даже одну перепрограммированную клетку на сотни тысяч. Далее последовала серия работ этой и других лабораторий, в которых исследователи оптимизировали состав перепрограммирующих факторов и способ введения вектора в клетку, чтобы повысить эффективность перепрограммирования и снизить вероятность образования опухолевых клеток в результате вызываемой метаморфозы [10].

Рисунок 3. Способ перепрограммирования специализированной клетки в стволовую. Начиная с набора 24 транскрипционных факторов и постепенно сужая этот перечень (1), Такахаши и Яманака установили, что всего четыре гена (Myc, Oct3/4, Sox2 и Klf4) могут преобразить фибробласт, вернув его в состояние плюрипотентности (2) [9]. Полученные ИПСК (3) могут давать начало тератомам, что используется как маркер плюрипотентной клетки, а также использоваться в технологии получения химерных мышей (традиционно, для этого использовали ЭСК [7]).
Открытие Яманаки — важнейшее фундаментальное открытие в биологии, поскольку именно оно впервые продемонстрировало, что дифференцированная клетка может снова вернуться в «детство» и стать плюрипотентной. Весьма простая технология получения ИПСК мгновенно была взята на вооружение сотнями лабораторий по всему миру.
Перспективы использования стволовых клеток в медицине
С момента появления технология получения ИПСК была существенно усовершенствована. В частности, теперь не нужно использовать векторы на основе ретровирусов, которые встраиваются в произвольное место генома и могут повредить его или даже запустить программу онкологической трансформации. Теперь используют аденовирусы или другие вирусные векторы, не встраивающиеся в хромосомы, а также РНК, белковые транскрипционные факторы и эписомальные плазмиды. В некоторых случаях число перепрограммирующих факторов можно снизить до одного — например, нейрональные стволовые клетки мыши превращаются в ИПСК введением одного только фактора Oct4 [12].
Открытие Яманаки также сообщило новый импульс поиску способов трансдифференцировки — то есть, превращению одного типа клеток в другой, минуя стадию стволовых клеток. Это возвращает нас в 1960–80-е годы, к работам по имагинальному диску дрозофилы и к таким генам как Antennapedia, MyoD, GATA1 и Pax5. В частности, уже тогда удалось превратить фибробласты в миобласты активацией гена MyoD [13]. Под впечатлением от работ Яманаки быстро нашли способ превратить экзокринные клетки поджелудочной железы в эндокринные [14], а фибробласты — в кардиомиоциты [15]. Есть даже пример превращения друг в друга клеток разных зародышевых листков — мезодермальных фибробластов в эктодермальные нейроны (на что потребовалось три транскрипционных фактора) [16].
Наиболее трепетные ожидания, связанные со стволовыми клетками, заключаются в возможности замещать больные или утраченные клетки прямо в ткани, восстанавливая организм буквально по клеточкам. В самом общем виде такая формула подходит для лечения практически любой болезни — хоть Альцгеймера, хоть Паркинсона, хоть диабета, хоть последствий инфаркта. Конечно, это все находится в туманной дымке светлого будущего, но некоторые реальные перспективы тоже есть. В частности, клеточная терапия с применением ИПСК обещает освободить врачей от проблемы иммунной несовместимости. Конечно, особое внимание нужно уделить безопасности — ведь, как уже было сказано, ИПСК могут иметь как привнесенные при перепрограммировании мутации, так и быть онкогенными сами по себе. В общем, несмотря на то, что ИПСК сулят совершенно баснословные преимущества для медицины, пока что имеется «снежный ком» проблем, связанных с ними [17].
Другая перспектива, уже ставшая твердой действительностью, — возможность получать линии бессмертных клеток (ИПСК), соответствующих различным редким генетическим заболеваниям, и изучать как саму болезнь, так и действие на нее разрабатываемых лекарственных средств (рис. 4) [18]. ИПСК уже получены для таких заболеваний как амиотрофический латеральный склероз (болезнь Шарко), синдром Ретта, спинальная мышечная атрофия (СМА), недостаточность антитрипсина α1, семейная гиперхолестеринемия, а также для различных кардиологических заболеваний. В некоторых из этих клеточных моделей удается связать наблюдаемый фенотип с болезнью: в частности, в случае клеток из СМА, это затухание функций моторных нейронов. Некоторый прогресс есть даже в изучении заболеваний со сложной генетикой, таких как шизофрения.

Рисунок 4. ИПСК в медицине. Из тканей пациентов, страдающих различными заболеваниями, можно выделить соответствующие клетки и превратить их в ИПСК. Колонии этих клеток можно дифференцировать в другие типы клеток и использовать их в лечении, или же изучать на них болезнь и действие лекарств.
Исследуют на культурах специфичных для конкретных болезней ИПСК и действие разрабатываемых лекарств. В частности, на модели наследственной вегетативной дистонии проведен скрининг базы химических веществ и найден прототип лекарства кинетин, который способен частично обратить последствия нарушенного сплайсинга гена IKBKAP, вызывающего эту болезнь [19]. Аналогично, показано лекарственное действие бета-блокаторов и блокаторов ионных каналов на ИПСК из модели синдрома удлинения QT интервала [20]. Так ИПСК уже вошли если не в клиническую, то в лабораторную практику и служат «испытательными стендами» для изучения различных болезней и действия на них разрабатываемых лекарств.
* * *
Открытие того, что зрелые дифференцированные клетки можно вернуть в плюрипотентное состояние или даже, минуя его, превратить один тип клеток в другой, стало поворотным в эмбриологии, биологии развития и всей молекулярной биологии. Это знание уже осветило все уголки физиологии и медицины, и практические применения в виде новых видов лечения наверняка не заставят себя ждать.
По материалам пресс-релиза Нобелевского комитета.
- Waddington C.H. (1957). The Strategy of the Genes; a Discussion of Some Aspects of Theoretical Biology. Allen & Unwin;
- Briggs R., King T.J. (1952). Transplantation of Living Nuclei From Blastula Cells into Enucleated Frogs’ Eggs. Proc. Natl. Acad. Sci. U.S.A. 38, 455–463;;
- King T.J., Briggs R. (1955). Changes in the Nuclei of Differentiating Gastrula Cells, as Demonstrated by Nuclear Transplantation. Proc. Natl. Acad. Sci. U.S.A. 41, 321–325;;
- Gurdon J.B. (1962). The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles. J. Embryol. Exp. Morphol. 10, 622–640;;
- Wilmut I., Schnieke A.E., McWhir J., Kind A.J., Campbell K.H. (1997). Viable offspring derived from fetal and adult mammalian cells. Nature 385, 810–813;;
- Щадящие стволовые клетки;
- Нобелевскую премию по физиологии и медицине вручили за технологию нокаутирования мышей;
- Tada M., Takahama Y., Abe K., Nakatsuji N., Tada T. (2001). Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells. Curr. Biol. 11,1553—1558;
- Takahashi K., Yamanaka S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663–676;;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Kim J.B., Greber B., Araúzo-Bravo M.J., Meyer J., Park K.I., Zaehres H., Schöler H.R. (2009). Direct reprogramming of human neural stem cells by OCT4. Nature 461, 649–643;;
- Davis R.L., Weintraub H., Lassar A.B. (1987). Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell 51, 987–1000;;
- Zhou Q., Brown J., Kanarek A., Rajagopal J., Melton D.A. (2008). In vivo reprogramming of adult pancreatic exocrine cells to β-cells. Nature 455, 627–632;;
- Ieda M., Fu J.D., Delgado-Olguin P., Vedantham V., Hayashi Y., Bruneau B.G., Srivastava D. (2010). Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell 142, 375–386;;
- Pang Z.P., Yang N., Vierbuchen T., Ostermeier A., Fuentes D.R., Yang T.Q., Citri A., Sebastiano V., Marro S., Südhof T.C., Wernig M. (2011). Induction of human neuronal cells by defined transcription factors. Nature 476, 220–223;;
- Снежный ком проблем с плюрипотентностью;
- Onder T.T., Daley G.Q. (2012). New lessons learned from disease modeling with induced pluripotent stem cells. Curr. Opin. Genet. Dev. doi: 10.1016/j.gde.2012.05.005;
- Lee G., Papapetrou E.P., Kim H., Chambers S.M., Tomishima M.J., Fasano C.A., Ganat Y.M., Menon J., Shimizu F., Viale A., Tabar V., Sadelain M., Studer L. (2009). Modelling pathogenesis and treatment of familial dysautonomia using patient-specific iPSCs. Nature 461, 402–406;;
- Itzhaki I., Maizels L., Huber I., Zwi-Dantsis L., Caspi O., Winterstern A., Feldman O., Gepstein A., Arbel G., Hammerman H., Boulos M., Gepstein L. (2011). Modelling the long QT syndrome with induced pluripotent stem cells. Nature 471, 225–229..
biomolecula.ru
Нобелевская премия по физиологии и медицине — 2013

В 2013 году самая престижная научная премия вручена Рэнди Шекману, Джеймсу Ротману и Томасу Зюдхофу за раскрытие механизмов везикулярного транспорта — главной транспортной системы в наших клетках. Разнообразные молекулы, упакованные в пузырьки-везикулы, постоянно пересылаются из одного отдела клетки в другой, а также секретируются наружу. Точная доставка возможна благодаря комплексу белков, которые выступают как в качестве «адреса», так и в качестве «почтового отделения» в каждом клеточном отделе. Работы свежеиспеченных Нобелевских лауреатов позволили прояснить этот механизм в деталях: какие гены кодируют компоненты системы везикулярного транспорта, что за белки в этом участвуют и, наконец, как регулируется внутри- и межклеточный трафик.
Работа, удостоенная Нобелевской премии в этом году, не является результатом одного гениального открытия, или научным прорывом. Это — результат многолетнего кропотливого труда, благодаря которому удалось в деталях изучить один из базовых процессов в клеточной физиологии — внутриклеточный транспорт. Трое ученых — Рэнди Шекман, Джеймс Ротман и Томас Зюдхоф — внесли каждый свой вклад в эту работу, используя разные подходы — генетический (Шекман), биохимический (Ротман) и физиологический (Зюдхоф).
Джеймс Ротман (James E. Rothman) родился в 1950 году в штате Массачусетс, США. Он получил докторскую степень (PhD) в 1976 году в Гарварде, затем работал в не менее знаменитом Массачусетском технологическом институте, а потом в Стэнфордском университете, где он и начал исследования в области везикулярного транспорта. В настоящее время он является профессором Йельского университета, где возглавляет кафедру клеточной биологии. Рэнди Шекман (Randy W. Schekman) родился в 1948 году в штате Минессота, США. Докторскую степень он получил в Стэнфорде, под руководством Артура Корнберга — Нобелевского лауреата 1959 года, открывшего механизм синтеза нуклеиновых кислот. Затем Шекман перешел в Калифорнийский университет в Беркли, где и работает до сих пор в статусе профессора кафедры молекулярной и клеточной биологии. Томас Зюдхоф (Thomas C. Südhof) родился в 1955 году в Геттингене, Германия. В отличие от своих коллег по премии, он получил степень доктора медицины (1982), а затем степень в области нейрохимии. Однако Зюдхоф недолго пробыл немецким ученым: уже в 1983 году он перебрался в Техасский юго-западный университет в Далласе (США), где работал вместе с Майклом Брауном и Джозефом Голдстейном — лауреатами Нобелевской премии 1985 года за изучение метаболизма холестерина. В настоящее время он является профессором кафедры молекулярной и клеточной физиологии в Стэнфордском университете.Так как эукариотическая клетка — сложно организованная структура со множеством «отделов», в процессе ее жизнедеятельности возникает необходимость передавать грузы из одного отдела (компартмента) в другой, а также посылать их за пределы клетки. Такая необходимость обусловлена разделением труда между компартментами: например, белки часто синтезируются на рибосомах, расположенных в эндоплазматическом ретикулуме, а используются в каком-нибудь другом отделе или вообще секретируются наружу. Чтобы груз был доставлен по адресу, его нужно упаковать в пузырек — везикулу (рис. 2) и снабдить специальным сигнальным белком. В качестве грузов могут выступать самые разнообразные молекулы: гормоны (в том числе инсулин), ферменты, строительные белки и др. Отдельным немаловажным примером клеточного транспорта является передача сигнала между нейронами — она осуществляется посредством выброса в синаптическую щель нейромедиаторов, упакованных в такие же везикулы.
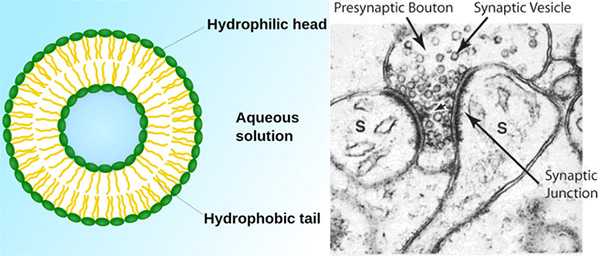
Изучение везикулярного транспорта имеет не только фундаментальное значение: среди болезней, связанных с нарушением процессов переноски грузов, диабет второго типа и эпилепсия. Бактерии из рода Clostridium, которые являются возбудителями ботулизма и столбняка, при помощи своих токсинов как раз портят белки, участвующие в формировании везикул в синаптических щелях. В результате этого блокируется выброс нейромедиаторов между нейронами либо между нейроном и мышцей, что приводит к параличу.
О существовании внутриклеточного транспорта было известно еще с начала ХХ века (везикулы можно разглядеть в обычный световой микроскоп). Однако с молекулярной точки зрения детали этого процесса начали проясняться с выходом в свет работы Шекмана в 1979 году в журнале PNAS. Работая на пекарских дрожжах, Шекман вместе со своим коллегой Питером Новиком идентифицировал гены, продукты которых обеспечивают нормальный внутриклеточный транспорт. Ученые проанализировали сотни штаммов мутантных дрожжей и выбрали среди них носителей так называемых термочувствительных мутаций (такие клетки нормально растут при комнатной температуре, но если их содержать при температуре 37°С, в них начинают накапливаться поломки). Отобранные мутанты были неспособны нормально экспортировать наружу ферменты для размещения на клеточной стенке. При повышении температуры в этих клетках начинали накапливаться везикулы, хорошо заметные в микроскоп (рис. 3).

Шекман проанализировал генотип полученных мутантов по везикулярному транспорту и в конечном итоге идентифицировал 23 гена, которые можно было разделить на три группы, в зависимости от того, откуда и куда должны были направляться везикулы, — транспорт, ассоциированный с эндоплазматическим ретикулумом, с комплексом Гольджи или с поверхностью клетки. В своих последующих работах он обнаружил промежуточные стадии в формировании везикул и связал их с мутациями в конкретных генах (гены были обозначены аббревиатурой sec — от secretory).
Джеймс Ротман в своих работах подошел к изучаемому вопросу с другой стороны. В Стэнфордской лаборатории несколькими годами позже он с коллегами восстанавливал процесс транспорта in vitro, то есть в пробирке. Ученые пытались воссоздать процесс транспортировки белка вируса везикулярного стоматита в комплекс Гольджи в клетках млекопитающих (вирусный белок был выбран потому, что при инфекции он накапливается в клетках в больших количествах, и с ним удобно работать). В нескольких последовательно вышедших статьях Ротман описал в деталях клеточный транспорт белка и попутно выделил ключевые компоненты, необходимые для формирования и транспорта везикул. Первым найденным белком оказался NSF (N-ethylmaleimide-sensitive factor), затем был идентифицирован SNAP (soluble NSF-attachment protein). В совместной работе с Шекманом они установили, что белки NSF и SNAP соответствуют продуктам ранее идентифицированных Шекманом генов sec17 и sec 18. Таким образом, оказалось, что процесс внутриклеточного транспорта универсален среди эукариот и совпадает в деталях как у дрожжей, так и у млекопитающих.
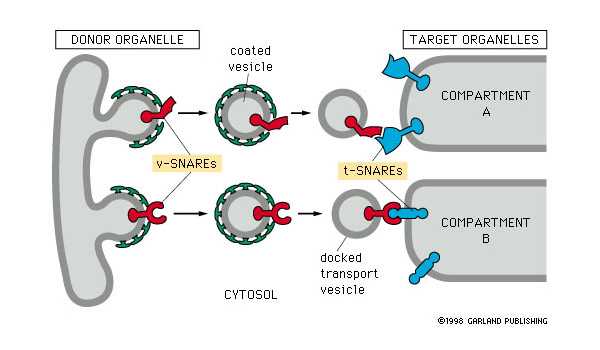
Продолжая работу по выделению ассоциированных с везикулами белков, Ротман обнаружил еще три ключевых белка: синаптобревин, SNAP-25 и синтаксин. Эти белки были ранее найдены другими учеными в синапсах (областях контакта между нейронами), однако их функции оставались неизвестными. Ротман объединил их в группу SNARE (soluble NSF-attachment protein receptors). Синаптобревин был ассоциирован с везикулами, а SNAP-25 и синтаксин — с клеточными мембранами. Это открытие позволило Ротману сформулировать SNARE-гипотезу — ключевую гипотезу, объясняющую принцип внутри- и межклеточного транспорта. Согласно ей, в процессе формирования и доставки везикул участвуют белки, принадлежащие к двум группам — v-SNARE (v — от vesicle ‘везикула’) и t-SNARE (t — от target ‘мишень’), которые специфически узнают друг друга. Благодаря специфическому узнаванию, доставка осуществляется точно в нужное место (рис. 4). Гипотеза была подтверждена в дальнейших работах как Ротмана, так и других научных групп. (Синаптобревин, помимо прочего, является мишенью при развитии ботулизма и столбняка.)
Томас Зюдхоф по образованию был нейрофизиологом и изучал, каким образом происходит передача сигнала в синапсах между нейронами. Его заинтересовал процесс выброса нейромедиатора в синаптическую щель. Молекулы нейромедиатора упаковываются в везикулы и точно в определенное время должны выделиться в пространство между мембранами двух нейронов (рис. 2, справа). Оказалось, что этот процесс зависит от внутриклеточных колебаний концентрации кальция. Зюдхоф сосредоточил свое внимание на двух белках — комплексине и синаптотагмине. В это время (начало 90-х годов) уже получила распространение технология, позволяющая выращивать нокаутных (см.: Нобелевская премия по физиологии и медицине — 2007, «Элементы», 12.10.2007) по определенному гену животных. Изучая мышей с нарушенной функцией генов, кодирующих комплексин или синаптотагмин, он определил, что эти два белка реагируют на концентрацию кальция и являются «привратниками», предотвращающими постоянное неконтролируемое образование везикул. Оказалось, что синаптотагмин, с одной стороны, является сенсором кальция, а с другой стороны, взаимодействует с SNARE-белками и запускает механизм формирования везикулы. Зюдхоф также идентифицировал белок Munc18, мутация в котором соответствовала дрожжевому фенотипу sec1-1, описанному Шекманом. Этот белок, и семейство, к которому он принадлежит, получили общее название SM-белков (от Sec/Munc). Оказалось, что вместе с SNARE-белками они участвуют в процессе формирования везикул.
Таким образом, работы Шекмана, Ротмана и Зюдхофа стали частями одной мозаики, описывающей транспортную систему клетки с участием пузырьков-везикул. Они во многом определили, как пузырьки формируются, как они находят свое место доставки и каким образом регулируется их образование точно в определенное время. Однако можно заметить, что в мозаике не хватает кусочка: везикулы внутри клетки не плавают сами по себе, а путешествуют по цитоскелету вдоль микротрубочек при помощи специальных моторных белков — динеина и кинезина. За изучение моторных белков и транспорта с их участием в 2012 году другая троица американских ученых получила престижную премию Ласкера. Эту премию считают предвестником Нобелевcкой, так что, возможно, недостающее звено в картине внутриклеточного транспорта в ближайшие годы тоже будет удостоено высочайшей награды (надо сказать, что и лауреаты этого года в разное время становились лауреатами премии Ласкера).
Источники:1) Пресс-релиз на сайте Нобелевского комитета.2) J. Zierath, U. Lendahl. Machinery Regulating Vesicle Traffic, A Major Transport System in our Cells. Статья на сайте Нобелевского комитета.
Дарья Спасская
elementy.ru
НОБЕЛЕВСКАЯ ПРЕМИЯ ПО ФИЗИОЛОГИИ И МЕДИЦИНЕ 2008 ГОДА
Харальд цур Хаузен родился в 1936 году в Германии, получил степень доктора медицины в университете Дюссельдорфа.
Вирус папилломы (HPV) состоит из круговой молекулы ДНК в белковой оболочке. HPV инфицирует базальные клетки эпителия шейки матки, проникая туда через микротрещины.
Ежегодная заболеваемость раком во всём мире. Онкологические заболевания, вызванные разными типами вируса папилломы человека, показаны жёлтым цветом.
Частица ВИЧ взаимодействует с рецепторами (CD4) на поверхности CD4<sup>+</sup> T лимфоцитов, что приводит к деформации мембраны лимфоцита и последующему слиянию вируса с клеткой.
ВИЧ относится к лентивирусам («медленным» вирусам) — подгруппе ретровирусов (РНК-содержащих вирусов, способных к обратной транскрипции).
Люк Монтанье родился в 1932 года в Шабри (Франция). Учился в Пуатье и в Париже, стажировался в ведущих вирусологических лабораториях Великобритании.
Франсуаза Барре-Синусси родилась в 1947 году в Париже. Она изучала ретровирусы в Национальном институте здравоохранения и медицинских исследований и в институте Пастера.
‹
›
В 2008 году Нобелевский комитет присудил премию по физиологии и медицине за открытие вирусов, ежегодно уносящих миллионы человеческих жизней. Половина премии присуждена Харальду цур Хаузену «за открытие вирусов папилломы человека, вызывающих рак шейки матки», другую половину разделят Франсуаза Барре-Синусси и Люк Монтанье «за открытие вируса иммунодефицита человека».
РАКОВЫЙ ВИРУС
Злокачественные опухоли, развивающиеся из клеток эпителиальной ткани, довольно часто поражают половые органы и генитальный тракт как у женщин, так и у мужчин. Самая распространённая среди них — опухоль шейки матки: по уровню заболеваемости она на втором месте среди онкологических заболеваний у женщин (печальную пальму первенства держит рак молочной железы). Каждый год рак шейки матки уносит 250 тысяч жизней. Учёные давно предполагали, что рак шейки матки и другие генитальные разновидности рака вызываются каким-то вирусом, передающимся половым путём, например вирусом герпеса.
В начале 1970-х годов немецкий исследователь Харальд цур Хаузен успешно использовал для идентификации вирусов новую в то время технику гибридизации in situ (от лат. «на месте», то есть прямо на образце). Метод заключается в следующем. Молекулу РНК вируса, «меченную» флуоресцентной или радиоактивной меткой, добавляют в образец опухолевой ткани. РНК образует прочный комплекс (гибридизуется) с вирусной ДНК, содержащейся в ткани. Комплекс легко «увидеть» с помощью авторадиографии или флуоресцентного микроскопа.
Однако с герпесом у Хаузена ничего не получилось: ДНК вируса герпеса в образце опухоли шейки матки обнаружить не удалось. Поэтому учёный предположил, что рак шейки матки обусловлен не вирусом герпеса, а другим агентом — вирусом папилломы человека (HPV — human papilloma virus). Предположение неожиданное, поскольку вирус папилломы считался в то время довольно безобидным. HPV поражает эпителиальные ткани и вызывает появление доброкачественных опухолей, похожих на бородавки.
Хаузен также высказал соображение, что ДНК вируса папилломы встраивается в геном клетки «хозяина», то есть опухолевые клетки хранят генетическую информацию вируса. Причём вирус папилломы не воспроизводит в клетке свои копии, как это обычно происходит при вирусной инфекции, а как бы «спит» внутри инфицированных клеток.
В 1974 году Хаузен опубликовал данные первого эксперимента по гибридизации культуры клеток опухолевой ткани шейки матки с РНК вируса папилломы. И снова никакой ДНК вируса папилломы в опухоли он не обнаружил. Свою неудачу Хаузен объяснил тем, что существуют различные разновидности вируса папилломы, поэтому РНК одного вида не взаимодействует в ДНК вируса другого вида. Очень скоро он нашёл экспериментальные доказательства своей гипотезы.
В 1976 году гипотезу Хаузена о «папилломной» природе рака шейки матки подтвердили канадские исследователи А. Мейселс и Р. Фортин. С помощью электронной микроскопии им удалось сфотографировать вирус папилломы в опухолевых клетках шейки матки и влагалища.
В 1977 году в лаборатории Хаузена из проб бородавок выделили и идентифицировали три разновидности вируса папилломы. Через год из кондиломы получили HPV четвёртого типа, принципиально отличный от трёх предыдущих. В 1980 году группе Хаузена удалось клонировать ДНК вируса шестого типа, поражающего гениталии. Сегодня считается, что HPV 6 — основная причина генитальной кондиломы. HPV 16 был найден более чем у половины пациентов с раком шейки матки, влагалища и пениса. Затем сотрудники Хаузена клонировали ген HPV 18. Вирусы папилломы 16-го и 18-го типов, вместе взятые, «покрывают» 82% случаев генитального рака.
Вирус папилломы — маленькая двадцатигранная частица диаметром 52—54 нм. Вирусные частицы содержат одну циклическую молекулу ДНК — около 8 тысяч пар — в оболочке из 72 белков. Сейчас известно более 100 генотипов HPV. Теперь, когда стало возможным идентифицировать все или почти все существующие в природе генотипы вируса, HPV обнаруживается у 99,7% пациенток с раком шейки матки. К счастью, в большинстве случаев вирусы уничтожаются иммунной системой до начала ракового перерождения эпителия: почти 90% инфицированных HPV 16 и 18 излечиваются в течение двух лет.
На протяжении жизни до 80% сексуально активного населения инфицируются какой-либо разновидностью HPV. Риск развития онкологических заболеваний зависит от типа вируса и генетической и иммунологической предрасположенности человека.
Как же происходит онкогенное перерождение клеток эпителия? Современные исследования полностью подтвердили гипотезу Хаузена. Вирусная ДНК встраивается в геном клеток в строго определённом месте хромосомы. В ДНК вируса папилломы имеются два генетических участка — E6 и E7. Когда вирусная ДНК интегрируется в геном клетки «хозяина», эти гены активируются и в инфицированной клетке начинают синтезироваться соответствующие белки Е6 и Е7. Они тормозят биохимические процессы, призванные бороться с раковыми клетками, тем самым провоцируя канцерогенез.
Уже создана профилактическая вакцина, которая представляет собой смесь структурных белков (без ДНК) вирусов HPV 6, 11, 16 и 18, играющих ключевую роль в развитии рака шейки матки. По расчётам, всеобщая вакцинация сможет предотвратить 70% случаев рака шейки матки. Пока не ясно, помогает ли вакцина при уже свершившемся злокачественном перерождении. Также неизвестна длительность действия вакцины — достаточно одной иммунизации или нужно вводить вакцину многократно.
БЫСТРОЕ ОТКРЫТИЕ МЕДЛЕННОГО ВИРУСА
В 1981 году в Калифорнии и Нью-Йорке появилась новая ранее не описанная болезнь. Она косила здоровых молодых людей: у них постепенно ослабевал иммунитет, и пациенты умирали от злокачественных опухолей, бактериальных инфекций, в том числе туберкулёза, аутоиммунных заболеваний. Тогда же врачи обнаружили, что у больных изменяется состав лимфоцитов — клеток крови, отвечающих за иммунитет. Болезнь назвали «Aquired Immune Deficiency Syndrom» (AIDS), что переводится на русский язык как «Синдром приобретённого иммунодефицита» (СПИД). Число больных СПИДом росло с катастрофической быстротой. В группе наибольшего риска оказались гомосексуалисты и наркоманы. Выяснилось, что СПИД передаётся половым путём, через плаценту от матери к ребенку, а также при переливании крови. Многие учёные в ту пору высказывали сомнения в том, что разнообразные симптомы, в которые вовлечены все системы организма, могут иметь одну-единственную причину.
С конца 1982 года несколько вирусологических лабораторий приступили к поиску возбудителя СПИДа. У больных СПИДом в крови быстро исчезают CD4+ T лимфоциты, поэтому логично было предположить, что именно эти клетки служат мишенью болезнетворного агента. В 1982 году группа вирусной онкологии отделения вирусологии Института Пастера (Париж, Франция) под руководством Люка Монтанье и Франсуазы Барре-Синусси занялась исследованием CD4+ T лимфоцитов у пациентов на ранней стадии СПИДа. Они обнаружили, что клеточная среда CD4+ T лимфоцитов содержит фермент — обратную транскриптазу, которая активна в так называемых ретровирусах (РНК- содержащих вирусах, способных к обратной транскрипции). Учёным сразу стало понятно, что искать нужно именно ретровирус, и открытие не заставило себя ждать. Изучая мембрану CD4+ T клеток в электронный микроскоп, учёные увидели типичные ретровирусные частицы.
В течение всего лишь одного года группа Люка Монтанье и Франсуазы Барре-Синусси выделила и охарактеризовала новый ретровирус размером 90—130 нм в цилиндрической белковой оболочке. Результаты признало научное сообщество. В 1985 году геном ВИЧ был независимо расшифрован в Институте Пастера и других научных центрах в Европе и США. Оказалось, что вирус состоит из 9 генов, кодирующих синтез 15 вирусных белков.
В 1984 году аналогичный вирус выделили в группе американского профессора Роберта Галло. Впоследствии американская и французская группы пришли к соглашению, что открытые ими вирусы относятся к одному и тому же типу, который назвали «Human Immunodeficiency Virus Type I» (HIV-I), или вирус иммунодефицита человека (ВИЧ). Претензия Роберта Галло на первенство в открытии и полученный им патент на методику анализа крови на ВИЧ вызвали многолетние споры между американской и французской сторонами. В конечном итоге они разрешились признанием приоритета группы Монтанье.
Вирусы, сходные с ВИЧ, найдены у шимпанзе и горилл. Новые исследования показали, что «человеческий» возбудитель СПИДа впервые проявил себя задолго до американской пандемии начала 1980-х — между 1902 и 1921 годами в бассейне реки Конго. Самый первый случай ВИЧ задокументирован в 1959 году. С 1981 года от этой болезни умерло более 25 миллионов человек. Более 33 миллионов людей заражены ВИЧ, каждый год болезнь уносит миллионы жизней.
Быстрое выявление возбудителя СПИДа группой Люка Монтанье и Франсуазы Барре-Синусси способствовало скорейшей разработке способов борьбы с этим заболеванием. Уже существуют методы лечения, позволяющие на десятилетия отодвинуть смерть заражённого СПИДом. Имеющиеся на сегодняшний день препараты снижают скорость распространения вируса в организме, замедляют гибель CD4+ T лимфоцитов, поддерживают иммунную систему. Около 3 млн человек принимают антиретровирусные препараты, однако еще 6 млн больных в развивающихся странах нуждаются в медицинской помощи. Поэтому нельзя сказать, что глобальная эпидемия СПИДа находится под контролем.
До сих пор нет лекарства, полностью вылечивающего от СПИДа, или вакцины, которая бы уменьшала риск заражения вирусом. Прогресс в разработке вакцины ограничен недостаточным пониманием механизма развития иммунитета к ВИЧ. Сложность лечения обусловлена длительным латентным периодом вирусной инфекции. Но интенсивные исследования продолжаются, и в будущем меры борьбы со СПИДом наверняка станут доступнее и эффективнее.
www.nkj.ru
Нобелевская премия по физиологии и медицине — 2008

Нобелевскую премию по физиологии и медицине 2008 года разделят Харальд цур Хаузен («за открытие вирусов папилломы человека, вызывающих рак шейки матки») и Франсуаза Барре-Синусси и Люк Монтанье («за открытие вируса иммунодефицита человека»). Значение этих открытий для борьбы с раком и СПИДом огромно. От них зависит спасение миллионов человеческих жизней.
Нобелевский комитет присудил премию по физиологии и медицине этого года трем ученым, открытия которых сыграли огромную роль в борьбе с вирусами человека, ежегодно отнимающими сотни тысяч и миллионы жизней. Половину премии, «за открытие вирусов папилломы человека, вызывающих рак шейки матки» («for his discovery of human papilloma viruses causing cervical cancer»), получит Харальд цур Хаузен (Harald zur Hausen) из Германского центра исследования рака (DKFZ, Deutsches Krebsforschungszentrum) в Гейдельберге. Другую половину премии, присужденную «за открытие вируса иммунодефицита человека» («for their discovery of human immunodeficiency virus»), разделят Франсуаза Барре-Синусси (Françoise Barré-Sinoussi) из Института Пастера (Institut Pasteur) в Париже и Люк Монтанье (Luc Montagnier), который раньше также работал в Институте Пастера, а в настоящее время возглавляет основанный при его участии Всемирный фонд исследования и предупреждения СПИДа (Fondation mondiale recherche et prévention sida) при ЮНЕСКО.
Харальд цур Хаузен родился в 1936 году в Гельзенкирхене (Германия). Он учился в Боннском, Гамбургском и Дюссельдорфском университетах. В Дюссельдорфском университете он получил степень доктора медицины и несколько лет работал в подчиненном университету Институте медицинской микробиологии. В середине шестидесятых цур Хаузер переехал в Филадельфию (США), где вначале работал в Лаборатории вирусологии знаменитой Детской больницы, а впоследствии преподавал в Пенсильванском университете. В 1969 году он вернулся в Германию и стал профессором в Вюрцбургском университете, затем работал в университетах в Эрлангене и Нюрнберге и во Фрайбурге в Брайсгау, а с 1983 года — в Германском центре исследования рака, который он возглавлял в течение 20 лет (1983–2003).
Вирусы папилломы человека (ВПЧ) передаются от человека к человеку. Некоторые разновидности ВПЧ безвредны, некоторые вызывают образование бородавок на коже, некоторые поражают половые органы (передаваясь половым путем). В середине семидесятых Харальд цур Хаузен обнаружил, что женщины, страдающие раком шейки матки, неизменно заражены ВПЧ. В то время многие специалисты полагали, что рак шейки матки вызывается вирусом простого герпеса (Herpes simplex virus), но цур Хаузен нашел в раковых клетках не вирусы герпеса, а вирусы папилломы, и предположил, что развитие рака происходит в результате заражения именно вирусом папилломы. Впоследствии ему и его коллегам удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль.
В середине восьмидесятых годов были начаты исследования, благодаря которым на сегодня уже получены и запущены в производство несколько вакцин, инъекция которых позволяет, по крайней мере на несколько лет, свести к нулю риск заражения определенными типами ВПЧ (в том числе 16 и 18). Таким образом, благодаря открытию цур Хаузена были разработаны высокоэффективные средства для предотвращения рака шейки матки.
Теперь первоочередная задача — внедрение этих средств. Около 5% всех случаев заболевания раком в мире приходится на рак шейки матки, и больше двухсот тысяч женщин умирают каждый год от этой болезни. Широкое распространение вакцинации от ВПЧ позволит спасти сотни тысяч женщин. Решение Нобелевского комитета наверняка принесет пользу делу: присужденная цур Хаузену премия, вероятно, поможет привлечь внимание людей во всём мире к проблеме предотвращения рака шейки матки и будет способствовать распространению спасительной вакцинации.
Франсуаза Барре-Синусси родилась в 1947 году в Париже, там же училась и в 1974 году получила докторскую степень. Объектом ее исследований стали ретровирусы (к которым относится и ВИЧ). Она изучала эту группу вирусов в Национальном институте здравоохранения и медицинских исследований (Inserm, Institut national de la santé et de la recherche médicale) и в Пастеровском институте, где продолжает трудиться и сегодня. В 1983 году Франсуаза Барре-Синусси работала под руководством Люка Монтанье и вместе с ним принимала участие в исследовании, позволившем впервые выделить и описать вирус иммунодефицита человека, вызывающий СПИД. Люк Монтанье родился в 1932 году в коммуне Шабри в департаменте Эндр (Франция). Он учился в Пуатье и в Париже, некоторое время работал в Париже, а затем стажировался в ведущих вирусологических лабораториях Великобритании, где изучал, в частности, механизм репликации РНК-содержащих вирусов. Вернувшись в Париж, он вначале исследовал ретровирусы в Институте Кюри, а в 1972 году был приглашен Жаком Моно (Jaques Monod), выдающимся исследователем механизмов регуляции работы генов, в новообразованное отделение вирусологии Института Пастера, где Монтанье организовал и возглавил группу вирусной онкологии, которая проводила исследования, посвященные механизмам возникновения злокачественных опухолей в результате вирусных инфекций. Сотрудниками этой группы и был впервые выделен возбудитель СПИДа. В 1993 году Люк Монтанье и генеральный директор ЮНЕСКО Федерико Майор (Federico Mayor) учредили Всемирный фонд исследования и предупреждения СПИДа. Монтанье возглавил этот фонд и по сей день руководит им.В 1982 году группа Люка Монтанье начала исследования с целью выявить возможного возбудителя недавно описанного необычного заболевания — синдрома приобретенного иммунодефицита, характеризующегося прогрессирующим ослаблением жизненно важной иммунной системы. В 1983 году вирус был выделен (поначалу он получил другое название, но сегодня он известен как ВИЧ — вирус иммунодефицита человека). Вскоре после открытия ВИЧ в Институте Пастера его выделили и в США, в группе Роберта Галло (Robert Gallo), сотрудничавшей с группой Монтанье, из образцов, полученных от французской группы. Претензия Роберта Галло на первенство в открытии и полученный им патент на методику анализа крови на ВИЧ вызвали многолетние споры между американской и французской сторонами. Эти споры в конечном итоге разрешились признанием приоритета группы Монтанье. К сожалению, споры о приоритете отняли у исследователей много времени и немало помешали работе в области изучения ВИЧ и поиска и внедрения средств, позволяющих выявлять, предупреждать и лечить ВИЧ-инфекцию.
С 1981 года, когда был впервые описан СПИД, от этой болезни умерло больше 25 миллионов человек. Больше 33 миллионов живущих сегодня людей заражены ВИЧ, и каждый год болезнь уносит новые миллионы жизней. СПИД называли чумой XX века. Давно наступил XXI век, а число людей, зараженных ВИЧ, продолжает расти, и порядка двух миллионов зараженных, значительную долю которых составляют дети, ежегодно умирают от СПИДа. К счастью, уже разработаны методы лечения, позволяющие на десятилетия отодвинуть смерть зараженного СПИДом человека. Но к сожалению, это лечение стоит дорого, и позволить его себе могут в основном лишь достаточно состоятельные люди. При этом СПИД более всего распространен как раз на самом бедном континенте — в Африке. Кроме того, до сих пор не удалось разработать, и неизвестно, удастся ли, ни способов полного выведения ВИЧ из зараженного организма, ни вакцины, прививка которой сводила бы к нулю (или хотя бы существенно уменьшала) риск заражения СПИДом. Но продолжаются интенсивные исследования, и в будущем меры борьбы со СПИДом наверняка станут доступнее и действеннее.
Открытие группой Люка Монтанье вируса, вызывающего СПИД, было сделано вскоре после открытия самой болезни. Быстрое выявление возбудителя СПИДа очень помогло последовавшей затем разработке способов борьбы с этим заболеванием.
Премия, по традиции, будет вручена лауреатам 10 декабря, в день смерти Альфреда Нобеля, в его родном городе — Стокгольме. В прошлом году Нобелевскую премию по физиологии и медицине получили Марио Капекки (Mario R. Capecchi) из Университета Юты (США), Оливер Смитис (Oliver Smithies) из Университета Северной Каролины (США) и Мартин Эванс (Sir Martin J. Evans) из Кардиффского университета (Великобритания) за изобретение метода нокаута генов (gene knockout).
Источники:1) Nobel prize for viral discoveries // BBC News. 6 October 2008.2) Alison Abbott. Virus discoveries secure Nobel prize in medicine // Nature News. Published online 6 October 2008.
Cм. также:1) The Nobel Prize in Physiology or Medicine 2008 (сообщение на официальном сайте Нобелевского комитета).2) Петр Петров. Нобелевская премия по физиологии и медицине — 2007, «Элементы», 12.10.2007.
Петр Петров
elementy.ru
Нобелевская премия по физиологии и медицине — 2009
Нобелевская премия по физиологии и медицине 2009 года присуждена Элизабет Блэкберн, Кэрол Грейдер и Джеку Шостаку «за открытие того, как теломеры и фермент теломераза защищают хромосомы». Механизм защиты хромосом от укорачивания при каждом делении был впервые предсказан в 1971 году Алексеем Матвеевичем Оловниковым; впоследствии его теоретические построения были подтверждены на практике экспериментаторами, которые и удостоились этой Нобелевской премии. Теломеры играют определенную роль в возрастных изменениях клеток и всего организма и в развитии злокачественных заболеваний. Дальнейшие исследования их динамики и принципов работы удлиняющего их фермента теломеразы могут помочь найти новые пути борьбы со старением и раком.
Премию по физиологии и медицине в этом году вновь, уже третий раз подряд, разделят трое ученых. Она присуждена «за открытие того, как теломеры и фермент теломераза защищают хромосомы» («for the discovery of how chromosomes are protected by telomeres and the enzyme telomerase»). Первооткрыватели теломеразы и обеспечиваемого этим ферментам механизма защиты хромосом от укорачивания живут и работают в США. Это Элизабет Блэкберн (Elizabeth H. Blackburn) из Калифорнийского университета в Сан-Франциско (University of California, San-Francisco), Кэрол Грейдер (Carol W. Greider) из Школы медицины Университета Джонса Хопкинса (Johns Hopkins University) и Джек Шостак (Jack W. Szostak) из Гарвардской школы медицины (Harvard Medical School).
Элизабет Блэкберн родилась в 1948 году в Австралии — в Хобарте, столице Тасмании, — в семье врачей. Когда она была школьницей, ее семья переехала в Мельбурн, где Блэкберн училась в Мельбурнском университете в колледже и в магистратуре. Затем она поступила в аспирантуру в Кембридж и получила там степень доктора философии. Впоследствии Блэкберн два года работала в Йельском университете, после чего (в 1978 году) перешла в Калифорнийский университет в Беркли, где и были сделаны ее важнейшие открытия, связанные с теломеразой. В 1990-м она перешла в другой филиал того же огромного университета — Калифорнийский университет в Сан-Франциско, где работает и по сей день. Кроме того, она является сотрудницей Института Солка (Salk Institute) в Сан-Диего, а с 2002-го по 2004 год работала в составе Президентского совета по биоэтике. Ее исключение из этого совета связывают с ее позицией по вопросу исследований эмбриональных стволовых клеток, которая была неугодна администрации Джорджа Буша-младшего, наложившего вето на федеральное финансирование этих важнейших исследований. В апреле нынешнего года Блэкберн была избрана президентом Американской ассоциации онкологических исследований (American Association for Cancer Research) и в следующем году должна возглавить эту ассоциацию. Кэрол Грейдер родилась в 1961 году в Сан-Диего (штат Калифорния). В 1983 году она получила степень бакалавра в Калифорнийском университете в Санта-Барбаре, после чего перешла в Калифорнийский университет в Беркли, где ее научным руководителем стала Элизабет Блэкберн. Уже в 1985 году в журнале Cell была опубликована статья Грейдер и Блэкберн, сообщавшая об открытии теломеразы. Получив докторскую степень в 1987 году, Грейдер стала сотрудницей Лаборатории в Колд-Спринг-Харбор (Cold Spring Harbor Laboratory), а в 1997 году перешла в Университет Джонса Хопкинса, где и по сей день работает профессором. Лаборатория, возглавляемая Кэрол Грейдер, продолжает исследования теломер и теломеразы. Джек Шостак родился в Лондоне в 1952 году. Вскоре его родители переехали в Монреаль, где он учился в колледже Университета Макгилла и в 1972 году стал бакалавром. Докторскую степень он получил в 1977 году в Корнелле, где оставался еще два года, после чего перешел в Гарвардскую школу медицины, где работает и сегодня, профессором отделения генетики. Помимо Гарварда, Шостак является сотрудником еще двух учреждений — Массачусетской неспециализированной больницы (Massachussets General Hospital) и Медицинского института Говарда Хьюза (Howard Hughes Medical Institute). Кроме открытия теломеразы, Шостак первым синтезировал искусственные хромосомы дрожжей. Создание таких искусственных хромосом нашло широкое применение в картировании генов животных, в том числе человека, и в развитии технологий генной инженерии. В настоящее время гарвардская лаборатория Шостака занимается прежде всего вопросами, связанными с происхождением жизни, и работает над искусственным синтезом живых клеток.Теломеры — концевые участки хромосом, состоящие из повторяющихся последовательностей нуклеотидов, — были открыты в пятидесятые годы XX века. Теломеры можно увидеть даже в световой микроскоп: готовящиеся к делению или делящиеся клетки можно окрасить таким образом, чтобы теломеры отличались по цвету от центральных частей каждой хромосомы. Теломеры имеются только у эукариот (организмов, в клетках которых есть ядро), а у бактерий и архей хромосомы замкнуты в кольцо и теломер не имеют. Эти концевые участки хромосом не содержат генов: записанная на теломерах информация не считывается на матричные РНК и ничего не кодирует. Собственно, информации в теломерах содержится довольно мало, ведь они состоят из повторяющихся одинаковых последовательностей нескольких нуклеотидов. Эти последовательности довольно однообразны. В частности, у всех позвоночных, а также у многих грибов и протистов это всегда ЦЦЦТАА, а у высших растений — по-видимому, всегда ЦЦЦТААА.
Поначалу функции теломер были неизвестны, как не была известна и последовательность входящих в их состав нуклеотидов. В конце пятидесятых годов был открыт фермент ДНК-полимераза, обеспечивающий удвоение молекул ДНК. Чтобы начать работать, этот фермент должен присоединиться к синтезируемому другим ферментом праймеру — короткому сидящему на цепочке ДНК фрагменту РНК, который впоследствии удаляется. При этом ДНК-полимераза может двигаться по цепочке ДНК только в одном направлении — от 5'-конца к 3'-концу. В результате ДНК-полимераза не может полностью скопировать всю молекулу ДНК: на одном из концов, к которому она прикрепляется, должен оставаться нескопированный фрагмент. На это впервые обратили внимание, независимо друг от друга, Алексей Матвеевич Оловников (Оловников А.М. 1971. Принцип маргинотомии в матричном синтезе полинуклеотидов // Доклады АН СССР. Т. 201. С. 1496–1499; Olovnikov A.M. 1973. A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon // Journal of Theoretical Biology. V. 41. P. 181–190) и Джеймс Уотсон (Watson J.D. 1972. Origin of concatemeric T7 DNA // Nature New Biology. V. 239. P. 197–201). Получалось, что хромосомы должны укорачиваться при каждом делении клетки за счет некопируемых концевых участков. Уотсон предположил, как эта проблема должна решаться у бактериофагов, ДНК которых тоже не замкнута в кольцо, а Оловников описал, как она может решаться у эукариот, и выдвинул гипотезу о существовании фермента, способного добавлять к концу хромосомы повторяющиеся последовательности. Он также предположил, что регуляция работы этого фермента может играть ключевую роль в старении организма (за счет постепенного укорачивания концевых участков хромосом у клеток, которые должны разделиться лишь ограниченное число раз) и что неполадки в механизме такой регуляции могут быть причиной бесконтрольного деления клеток злокачественных опухолей.
Вскоре в теломерах некоторых организмов были действительно открыты повторяющиеся последовательности. Опыты, проведенные в лаборатории Джека Шостака в Гарвардской школе медицины, показали, что чужеродные фрагменты ДНК, внедренные в клетки дрожжей, способны удваиваться, но, в отличие от собственной ДНК дрожжей, существуют в делящихся клетках недолго. Элизабет Блэкберн, будучи аспиранткой в Кембридже, освоила разработанные на тот момент методики секвенирования ДНК (чтения последовательности нуклеотидов) и впоследствии в Йеле установила, какая именно последовательность повторяется на концах хромосом у инфузории Tetrahymena thermophila (ЦЦЦЦАА). Встретившись на конференции в 1980 году, Шостак и Блэкберн задумали совместный эксперимент, результаты которого указывали на то, что именно теломеры защищают собственные хромосомы дрожжей от деградации при неоднократном делении клеток. Исследователи присоединили фрагменты с повторяющейся последовательностью нуклеотидов, обнаруженной у инфузории, к небольшим чужеродным фрагментам ДНК и внедрили полученные молекулы в дрожжевые клетки. Такие молекулы успешно удваивались в дрожжевых клетках, наряду с собственными хромосомами дрожжей, причем на их концах в итоге оказывалась повторяющаяся последовательность нуклеотидов, свойственная собственным теломерам дрожжей. Публикация этих результатов в журнале Cell была первой работой, экспериментально показавшей защитную роль теломер.

Шостак и Блэкберн, вслед за Оловниковым, предположили, что наращивание теломер обеспечивается определенным ферментом. Начались поиски этого фермента. В 1984 году его впервые смогла выделить Кэрол Грейдер, бывшая тогда еще студенткой и работавшая под руководством Элизабет Блэкберн. В статье, также опубликованной в Cell, Грейдер и Блэкберн впервые описали свойства открытого ими фермента и назвали его теломеразой. Изучая этот фермент, они обнаружили входящий в его состав фрагмент РНК, на матрице которого и синтезируются повторяющиеся последовательности нуклеотидов, добавляемые теломеразой к концевым участкам хромосом. Это открытие было описано в статье, опубликованной в Nature.

Дальнейшие исследования, проведенные в лабораториях Блэкберн и Шостака, показали, что лишенные теломеразы клетки рано или поздно прекращают делиться и умирают. Многие типы раковых клеток, напротив, обладают повышенной активностью теломеразы, что способствует их бесконтрольному делению и образованию злокачественных опухолей. Как и предполагал Оловников, теломеры оказались важным инструментом регуляции как старения, так и возникновения рака. В настоящее время уже разработаны и проходят испытания лекарственные препараты, которые, возможно, позволят бороться с рядом форм рака за счет подавления активности теломеразы в раковых клетках.
С работой теломеразы связано также развитие врожденного дискератоза (dyskeratosis congenita) — редкого наследственного заболевания, которое вызывает преждевременное старение кожи. Симптомы этой болезни связаны с нарушениями в регуляции длины теломер. Врожденный дискератоз пока не умеют лечить, но дальнейшие исследования могут позволить найти способы останавливать его развитие.
Хотя общий принцип работы теломеразы уже ясен, еще предстоит выяснить многие важные подробности, в частности механизмы регуляции, не позволяющие теломерам неограниченно разрастаться и определяющие их сокращение у стареющих клеток. Что касается роли теломер в старении, здесь тоже по-прежнему многое остается неясным, хотя сокращение их длины действительно характерно для стареющих эукариотических клеток.
Согласно завещанию Альфреда Нобеля, каждую премию могут разделить не более троих ученых. Жаль, что в число получивших эту премию не вошел Оловников, предсказавший отмеченное ею открытие. Вместе с тем, Блэкберн, Грейдер и Шостак, посвятившие многие годы успешным экспериментальным исследованиям теломер и теломеразы, несомненно, достойны этой награды.
В этом году одну Нобелевскую премию впервые в истории разделили две женщины. Среди тех, кто исследует теломеры сегодня, женщин необычайно много. Возможно, что это неслучайно: пример Элизабет Блэкберн и Кэрол Грейдер, открывших теломеразу и выяснивших структуру этого фермента, вдохновляет других женщин продолжать исследования в этой области.
Основные источники:1) Alison Abbot. Chromosome protection scoops Nobel // Nature News. Published online 7 October 2009.2) Gretchen Vogel. Three Americans win Physiology or Medicine Nobel // ScienceNOW Daily News. Published online 5 October 2009.3) The Nobel Prize in Physiology or Medicine 2009 (сообщение на сайте Нобелевского комитета).
Cм. также:1) Найдено средство против бесконечного деления раковых клеток, «Элементы», 08.04.2005.2) Нобелевская премия по физиологии и медицине — 2008, «Элементы», 09.10.2008.
Петр Петров
elementy.ru
Нобелевская премия по физиологии и медицине — 2012

8 октября 2012 года началась очередная Нобелевская неделя. Традиционно первыми объявляют лауреатов премии по физиологии или медицине (почему-то по-русски ее обычно называют премией по физиологии и медицине). Лауреатами стали британец Джон Гёрдон (John Bertrand Gurdon) из кембриджского Гёрдоновского института (Gurdon Institute) и японец Синъя Яманака (Shinya Yamanaka), сотрудник Института сердечно-сосудистых заболеваний Глэдстона в Сан-Франциско (Gladstone Institute of Cardiovascular Disease in San Francisco) и профессор Университета Киото (Kyoto University). Как сказано в официальной формулировке Нобелевского комитета, традиционно оглашенной на шведском, русском, французском и немецком языках (на них свободно говорил сам Нобель), премия присуждена за «открытие возможности перепрограммирования дифференцированных клеток в плюрипотентные».
Лауреаты двух поколений
Нужно сказать, что два лауреата этого года, по прихоти судьбы, необыкновенным образом «рифмуются». Оба принадлежат к наиболее традиционным культурам — британской и японской. В тот год, когда родился второй, вышла «нобелевская статья первого» (Гёрдон почти на 30 лет старше: он родился в 1933 году, а Яманака — в 1962-м).
Кроме этого, «нобелевка» — это не первая премия, которую Гёрдон и Яманака получают вместе. В 2009 году они удостоились почетной премии Альберта Ласкера («вторая американская нобелевская премия по медицине» — так ее называют) в номинации Basic. Кстати, почти половина лауреатов этой номинации потом получают Нобелевскую премию.
А вот престижную израильскую премию Вольфа по медицине они получили оба, но порознь — Гёрдон в 1989 году, а Яманака в 2011-м. Помимо множества других премий, полученных обоими учеными, Яманака также лауреат престижнейшей «технологической» премии Millenium.
«Старший» же лауреат отмечен еще и более почетными наградами. В июне1995 года Джон Бертран Гёрдон получил звание рыцаря-бакалавра и право прибавлять к своему имени титул «сэр», а в 2004 году удостоился еще более весомого признания: кембриджский Институт клеточной биологии и рака при благотворительных фондах Wellcome Trust и Cancer Research UK был переименован в Гёрдоновский институт.
Практически все комментаторы отмечают работы Гёрдона и Яманаки как прорывные. Многие авторы поздравлений на «стене» Нобелевского комитета и вовсе называют их «новой эрой» в истории человечества.
Что же за прорыв в науке совершили эти ученые, принадлежащие к разным поколениям, чьи работы разделяет более 40 лет?
Чтобы ответить на этот вопрос, придется начать издалека.
Стволовые клетки, или Туда и обратно
Каждый многоклеточный организм состоит из множества типов клеток, которые могут очень отличаться друг от друга — сравните, например, красные клетки крови, эритроциты, с клетками костной ткани, остеобластами. Однако генетическая информация, хранящаяся во всех соматических типах клеток — от гепатоцита до нейрона, — абсолютно идентична. Как же это возможно?
Ответ прост: в разных типах клеток экспрессируются разные гены. То есть хотя весь геном во всех клетках одинаков, но действующая, рабочая часть генома в каждом типе клеток своя, и чем сильнее отличаются в двух клетках эти «рабочие» части генома, тем сильнее будут отличаться друг от друга сами клетки.
И вот тут возникает другой вопрос: почему разные типы клеток так отличаются по экспрессии генов? На этот вопрос уже замечательно ответил Александр Марков, я лишь расскажу об этом кратко.
Как известно, каждый многоклеточный организм развивается из одной-единственной клетки — зиготы. При первых делениях зигота дает почти одинаковые клетки, однако с каждым последующим делением различия между получающимися клетками увеличиваются. Причина этого в том, что разные клетки зародыша оказываются в разных условиях. Во-первых, зигота сама по себе несимметрична, и плотность различных веществ в разных ее участках отличается, поэтому при делении зиготы клетки, «получившие в наследство» тот или другой участок цитоплазмы, будут немного отличаться друг от друга. Во-вторых, на клетки в разных участках зародыша по-разному влияют определенные физические параметры, например сила тяжести: клетку в нижней части зародыша она будет «тянуть» в ту сторону, где нет других клеток, а клетку в верхней — наоборот, туда, где другие клетки есть. В-третьих, постепенно сами клетки начинают влиять друг на друга: выделяемые соседями вещества меняют метаболизм клетки, запускают или выключают в ней экспрессию определенных генов и таким образом определяют ее судьбу. И так далее.
Итак, с каждым делением клетки всё сильнее отличаются друг от друга и от зиготы, от которой они произошли. Постепенно клетки образовывают три слоя — наружный (эктодерму), срединный (мезодерму) и внутренний (энтодерму). Затем клетки и в этих трех слоях начинают всё сильнее отличаться друг от друга под влиянием соседних клеток и различных физических факторов и в конце концов образуют все органы и ткани организма. Таким образом из совершенно недифференцированной зиготы получаются терминально дифференцированные (то есть абсолютно специализированные) клетки.
Однако у терминально дифференцированных клеток есть один большой недостаток: они не могут делиться. А поскольку все они рано или поздно стареют, то, если где-то в организме не будет неисчерпаемых ресурсов дифференцированных клеток, организм очень быстро «износится» и умрет.
И такой ресурс есть. Называется он (как вы, наверное, уже догадались) «стволовые клетки» Мне приятно отметить, что существование таких клеток постулировал и название для них придумал великий русский ученый Александр Максимов в 1908 году. Потомки стволовых клеток во взрослом организме постоянно обновляют ткани по схеме, изображенной на рис. 1. Свое депо стволовых клеток существует у каждой ткани, даже у сердечной и нервной, о которых раньше считалось, что они неспособны к восстановлению. Чем чаще обновляется ткань, тем больше у нее стволовых клеток: например, стволовых клеток кожи гораздо больше, чем нейральных. Каждая ткань состоит из нескольких типов клеток, и стволовые клетки этой ткани могут дать начало любому из них, но не клеткам другой, «неродной» ткани. Например, гемопоэтические стволовые клетки могут дать начало только клеткам крови, а нейронам — не могут. Стволовые клетки делятся постоянно, но очень редко; в случае, если ткань повреждена и нуждается в срочном восстановлении, они начинают делиться активней. Больше всего (из зрелых организмов) стволовых клеток у новорожденных младенцев; с возрастом их количество постепенно уменьшается, однако функционировать они продолжают даже в глубокой старости.
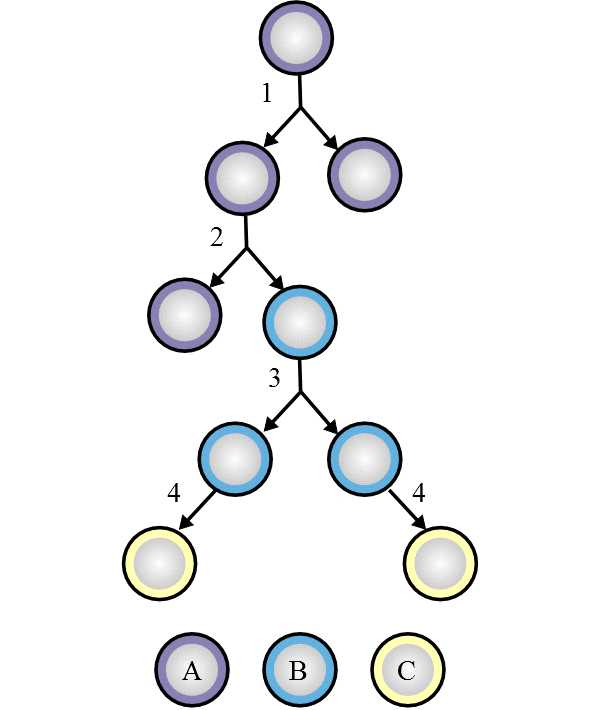
Подведем итог. Перед нами несколько типов стволовых клеток.
Самая универсальная стволовая клетка — зигота. Она дает начало всем типам клеток организма, а также, скажем так, не совсем организма — например, клеткам плаценты. Теми же свойствами обладают бластомеры — клетки, образовавшиеся при нескольких первых делениях зиготы. Из зиготы или бластомера можно вырастить целый организм. Такие клетки называются тотипотентными стволовыми клетками.
Чуть менее универсальны клетки, образующиеся при нескольких последующих зародышевых делениях (до разделения на зародышевые листки). Они могут дать начало всем клеткам организма, но не плаценте, поэтому целый новый организм из одной такой клетки вырастить невозможно. Эти клетки называются плюрипотентными стволовыми клетками (ПСК).
Уже специализированы мультипотентные стволовые клетки — то есть те, которые могут дать начало множеству клеточных типов, характерных для организма, но не всем. Мультипотентные клетки бывают, если можно так выразиться, «более или менее потентными» — то есть могут давать начало большему или меньшему количеству типов клеток. К мультипотентным относятся и некоторые из стволовых клеток, активных во взрослом организме, о которых говорилось выше. Постепенная дифференцировка потомков мультипотентных клеток приводит к появлению олигопотентных (дающих начало только небольшому количеству типов клеток) и унипотентных (дающих начало только одному типу) клеток.
Итак, получается, что путь живого организма — это путь постепенной дифференцировки: все изменения в стволовых клетках приводят к уменьшению «потентности» (а то и полному ее исчезновению). Тотипотентные клетки превращаются в плюрипотентные, те — в мультипотентные, ну и так далее, и пути обратно, кажется, нет.
Но настоящий ученый как раз и должен искать путь там, где его, кажется, нет. Собственно, за этот поиск (оказавшийся успешным) и получили в понедельник Нобелевские премии Джон Гёрдон и Синъя Яманака.
Аb ovo
Начнем — по старшинству — с Гёрдона. Он проводил свои нобелевские эксперименты в 1962 году, в те полузабытые времена, когда никто не помышлял о секвенировании генома, знания о стволовых клетках помещались в годовой курс лекций, а знаменитой клеточной линии HeLa исполнилось всего десять лет.
Гёрдон пытался найти ответ на вопрос, несет ли ядро дифференцированной клетки достаточно информации, чтобы дать начало новому организму. (Мы знаем ответ, но пятьдесят лет назад этот ответ был совершенно не очевиден.)
И Гёрдон сделал очень простую вещь — взял и пересадил в яйцеклетку шпорцевой лягушки (Xenopus laevis) с разрушенным ядром ядро дифференцированной клетки (клетки эпителия кишечника) головастика того же вида. Потребовалось довольно много экспериментов, но в результате исследователю удалось получить из такой «химерной» яйцеклетки здорового головастика. (Отметим в скобках, что сходные, но неудачные эксперименты проводились и до Гёрдона. Видимо, Гёрдон отличался от своих предшественников просто большим терпением и настойчивостью).

Это был огромный прорыв. Из результатов Гёрдона следовало сразу множество выводов, главный из которых таков: дифференцировка — вещь обратимая. Даже ядро дифференцированной клетки, будучи помещено в подходящие условия, способно дать начало новому организму. Открытие Гёрдона перевернуло все предыдущие представления о дифференцировке и «стволовости» и вызвало целый вал многочисленных исследований — от клонирования млекопитающих (первой, как все помнят, была клонирована овечка) до работ Синъи Яманаки.
Кстати, и само слово «клонирование» появилось в связи с работами Гёрдона. В 1963 году известный британский биолог и популяризатор науки Джон Холдейн описывал результаты Гёрдона и одним из первых употребил слово «клон» в применении к вылупившемуся из «взрослого» ядра головастику. А шпорцевая лягушка по-прежнему остается любимой «игрушкой» Гёрдона — на персональной страничке ученого опубликованы ссылки на его прошлогодние работы, где он по-прежнему экспериментирует с яйцеклетками Xenopus.
40 лет спустя
А что сделал Яманаки? Нечто еще более революционное и неслыханное, чем Гёрдон. В 2006 году ему удалось — безо всякой пересадки ядра — превратить вполне дифференцированный мышиный фибробласт (клетку кожи) в плюрипотентную стволовую клетку (такие клетки получили название индуцированные плюрипотентные стволовые клетки, ИПСК или iPSC). Перед тем как рассказать, каким образом ему это удалось, сделаем небольшую историческую справку.
Со времен экспериментов Гёрдона наука далеко шагнула вперед, и были разработаны тонкие методики, позволяющие вставить в клетку какой-либо ген и таким образом вызвать в этой клетке экспрессию белка, кодируемого данным геном. Одним из главных «транспортных средств», используемых для засовывания генов в клетку, являются вирусы, в частности ретровирусы. В геноме вируса «освобождают место», вырезая опасный генетический материал, и на это место вшивают гены необходимых белков. Вирус заражает клетку, но вместо своей вирусной ДНК вставляет в геном клетки эти гены. Гены начинают экспрессироваться, влиять на различные физиологические процессы в клетке и на экспрессию других генов и таким образом меняют судьбу клетки. Подробнее обо всём этом можно прочесть в статье «Молекулярное клонирование, или Как поместить в клетку чужеродный генетический материал»).
Вернемся к экспериментам Яманаки. Как уже было сказано, клетки различных типов отличаются друг от друга различной экспрессией тех или иных генов. Яманака и его команда сравнивали экспрессию генов в дифференцированных и эмбриональных стволовых клетках. Они выделили несколько десятков генов, чья повышенная активность была характерна именно для стволовых клеток. Эти гены они в разных сочетаниях вставляли в дифференцированные клетки путем молекулярного клонирования, чтобы заставить эти клетки дедифференцироваться обратно.
И вот наступил прорыв. После долгих экспериментов Яманаке удалось показать, что для перепрограммирования дифференцированной клетки в плюрипотентную стволовую достаточно повышения экспрессии всего четырех генов! Названия этих генов музыкой звучат для «стволовых» биологов, и они выпалят их, даже будучи разбуженными посреди ночи: Oct3/4, Sox2, Klf4 и c-Myc.
Но и это еще не всё. Яманака показал, что полученные плюрипотентные стволовые клетки могут обратно дифференцироваться в клетки различных тканей, например нервной или ткани кишечника — то есть отмотал дифференцировку назад, а потом снова вперед. Он дал ученым простой в использовании инструмент, с помощью которого можно делать с дифференцировкой практически всё, что только душе угодно. Это открытие буквально перевернуло научный мир.

Поскольку работа Яманаки была проведена относительно недавно, она вызвала не столь долгое «эхо» из последующих работ, как работа Гёрдона. Однако тема эта стремительно развивается. За прошедшие с работы Яманаки шесть лет была разработана методика по превращению одного типа дифференцированных клеток в другой минуя стадию стволовых клеток. Также нельзя не упомянуть работу китайских ученых, которые умудрились с помощью совершенно невероятной технологии получить из плюрипотентных клеток эмбрион, а затем взрослую мышь (Xiao-yang Zhao, Wei Li et al, 2009. iPS cells produce viable mice through tetraploid complementation). Иными словами, тесные оковы, сковывающие все движения ученых в работах с дифференцированными и стволовыми клетками, пали, и стало возможным проведение огромного количества исследований, о которых раньше нельзя было и мечтать.
Надо отметить еще одно важное следствие работы Яманаки. До этого плюрипотентные клетки человека получали относительно аморальным путем — из клеток эмбриона (и потому они назывались эмбриональными стволовыми клетками). В некоторых странах использование их было запрещено, в других — связано с серьезными юридическими трудностями. Открытие Яманаки открыло перед человечеством практически неисчерпаемый ресурс плюрипотентных клеток, происхождение которых не оставляет пятна ни на чьей совести.
Оригинальные статьи лауреатов:1) J. B. Gurdon The Developmental Capacity of Nuclei taken from Intestinal Epithelium Cells of Feeding Tadpoles // J Embryol Exp Morphol. V. 10. P. 622–640. December 1962.2) Kazutoshi Takahashi, Koji Tanabe, Mari Ohnuki, Megumi Narita, Tomoko Ichisaka, Kiichiro Tomoda, Shinya Yamanaka. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors // Cell. V. 131. Issue 5. Pp. 861–872. 30 November 2007.
elementy.ru















