Содержание
Нобелевская премия по физиологии и медицине — 2021
Нобелевская премия по физиологии и медицине в этом году была вручена Дэвиду Джулиусу (David Julius) и Ардему Патапутяну (Ardem Patapoutian) «за открытие рецепторов, обеспечивающих восприятие температурных и механических стимулов». Рецепторы термочувствительности (сначала рецепторы горячего, а через некоторое время и рецепторы холодного) были открыты в 1997–2003 годах. Пальма первенства тут принадлежит Джулиусу, открывшему три таких рецептора. Еще несколько рецепторов этих типов открыл чуть позднее Патапутян. Пара наших важнейших механорецепторов была открыта группой Патапутяна в работах 2010–2017 годов. В основу исследований, за которые была присуждена премия, лег чуть ли не весь арсенал современной генетики — клонирование, гибридизация ДНК, секвенирование, сравнительный анализ последовательностей, изучение структуры белков, — и, конечно же, эксперименты непосредственно на клеточных культурах и на животных, которые позволили во всей полноте установить механизм, обеспечивающий сенсорное восприятие разнообразных стимулов.
Дэвид Джулиус (David Julius) родился в Нью-Йорке в 1955 году, степень бакалавра получил в Массачусетском технологическом институте, а степень доктора философии (Ph. D.) — в Калифорнийском университете в Беркли. С 1990 года работает в Калифорнийском университете в Сан-Франциско. Ардем Патапутян (Ardem Patapoutian), рожденный в Ливане в 1967 году, переехал в США в 1986 году. Он окончил Калифорнийский университет в Лос-Анджелесе, а докторскую степень получил в Калтехе в 1996 году. С 2000 года работает в Научно-исследовательском институте Скриппса (Scripps Research). Таким образом, все отмеченные премией работы обоих лауреатов проводились на территории США.
Работа Джулиуса уже была отмечена несколькими престижными наградами, в частности, он получил Премию за прорыв в области медицины за 2020 год («за прояснение механизмов болевой чувствительности»).
Чем же примечательны исследования лауреатов? Все начиналось с довольно незамысловатых — даже «детских» — вопросов. Каким образом компоненты перца и мяты вызывают ощущения горячего и холодного? Каким образом мы ощущаем прикосновения и работу собственных мышц и внутренних органов? Как мы слышим? Как горячее, холодное, или механическое воздействие на тело заставляют чувствовать боль? Удивительно, но к концу XX века детальных ответов на эти вопросы у физиологов толком не было.
Каким образом компоненты перца и мяты вызывают ощущения горячего и холодного? Каким образом мы ощущаем прикосновения и работу собственных мышц и внутренних органов? Как мы слышим? Как горячее, холодное, или механическое воздействие на тело заставляют чувствовать боль? Удивительно, но к концу XX века детальных ответов на эти вопросы у физиологов толком не было.
Собственно, нервные пути, по которым распространяются те или иные ощущения, проделывая путь от кожи или иных участков тела, где находятся чувствительные нервные окончания, к спинному мозгу (и далее в головной мозг — где формируются уже осознанные ощущения), были в основном более или менее известны физиологам уже в 1980-х. И уже тогда было хорошо известно, что возбуждение начинается с изменения электрического потенциала на цитоплазматической мембране чувствительных нейронов, а значит, с открывания каких-то ионных каналов, встроенных в мембраны этих клеток. Так что целью Джулиуса и Патапутяна было выяснить, какие именно белки обеспечивают определенные формы чувствительности, какими свойствами они обладают, какими генами обеспечивается их синтез и насколько широки их функции в организме.
Первой на эту тема стала опубликованная в 1997 году статья от команды Дэвида Джулиуса, где сообщалось об открытии рецептора, чувствительного к капсаицину (алкалоиду, ответственному за остроту перца), и, вместе с тем, к умеренно высоким температурам — от 43°C (M. J. Caterina et al., 1997. The capsaicin receptor: a heat-activated ion channel in the pain pathway). Собственно, о том, что это должен быть один и тот же рецептор, было известно заранее, а использовать химический индуктор для экспериментов технически проще — меньше риска получения побочных эффектов из-за повреждения клеток и т. п. Схема работы (ее проводили на клетках мышей) показана на рис. 3. Искомый белок сначала обозначили VR1 (от vanilloid receptor — ванилоидный рецептор), но затем сравнительный анализ показал, что по своей структуре он сходен с белком TRP (transient receptor potential), ранее обнаруженным в зрительных сенсорах у дрозофил. Это и стало причиной того, что впоследствии название было изменено на TRPV1 (transient receptor potential cation channel subfamily V member 1). Любопытно, что гомолог белка VR1 птиц не реагирует на капсаицин, поэтому птицы спокойно едят перец и распространяют его семена, а вот млекопитающих острота отпугивает (этот факт тоже был установлен в группе Джулиуса, S. Jordt, D. Julius, 2002. Molecular basis for species-specific sensitivity to «hot» chili peppers).
Любопытно, что гомолог белка VR1 птиц не реагирует на капсаицин, поэтому птицы спокойно едят перец и распространяют его семена, а вот млекопитающих острота отпугивает (этот факт тоже был установлен в группе Джулиуса, S. Jordt, D. Julius, 2002. Molecular basis for species-specific sensitivity to «hot» chili peppers).
Этот белок, как и все прочие члены семейства TRP (в сумме их у млекопитающих обнаружилось аж 28), формирует ионный канал, который в открытом состоянии пропускает разнообразные моновалентные и дивалентные неорганические катионы (в первую очередь это Na+ и Ca2+), а также способен пропускать и органические катионы, в том числе довольно крупные. Ионный канал формируется четырьмя молекулами белка. Каждая отдельная белковая молекула имеет шесть гидрофобных участков, которые пронизывают мембрану, заякоривая в ней белок. Концы белковых молекул выходят на противоположные стороны от мембраны, формируя внеклеточный и внутриклеточный домены. Через них рецептор может взаимодействовать с другими молекулами экзогенного или эндогенного происхождения, которые могут влиять на работу канала.
TRPV1, будучи терморецептором, изменяет свою конформацию при воздействии повышенной температуры таким образом, что канал переходит в открытое состояние. Аналогичные изменения в конформации белка возникают и при взаимодействии с капсаицином красного перца, некоторыми пептидами (токсинами паука), а также с продуктами гидролиза мембранных фосфолипидов ферментом фосфолипазой — фосфоинозитидами. Открытие канала приводит к деполяризации мембраны нервного окончания и возникновению потенциала действия, направляемого далее в ЦНС. Возникающие при этом ощущения — это то самое чувство ожога, то есть боли, которая заставляет нас отдергивать руку от горячего, и заливать холодной водой пожар во рту после обеда в индийском ресторане.
Этот же рецептор оказался причастен и к возникновению боли в месте воспаления. Оказалось, что порог активирующей его температуры снижается на фоне повышения кислотности среды. При pH 6,4 канал открывается уже при 37°C, то есть при обычной температуре тела, а если pH опускается до 5,9 — то и при 32°C. Кислая среда создается в области воспаления за счет работы лейкоцитов. Но тут же можно вспомнить и жгучую боль от укуса муравья (ведь его «оружие» — муравьиная кислота). Надо отметить, что Джулиус с коллегами продолжает активные исследования рецептора TRPV1: буквально месяц назад в журнале Cell вышла статья, посвященная изменениям его структуры при разных условиях (K. Zhang et al., 2021. Structural snapshots of TRPV1 reveal mechanism of polymodal functionality; к ней прилагается видео, показывающее модель открывания рецептора TRPV1 при связывании с пептидным токсином паука DkTx)
Кислая среда создается в области воспаления за счет работы лейкоцитов. Но тут же можно вспомнить и жгучую боль от укуса муравья (ведь его «оружие» — муравьиная кислота). Надо отметить, что Джулиус с коллегами продолжает активные исследования рецептора TRPV1: буквально месяц назад в журнале Cell вышла статья, посвященная изменениям его структуры при разных условиях (K. Zhang et al., 2021. Structural snapshots of TRPV1 reveal mechanism of polymodal functionality; к ней прилагается видео, показывающее модель открывания рецептора TRPV1 при связывании с пептидным токсином паука DkTx)
Через два года после пионерской работы Джулиуса. вышла публикация о еще одном похожем рецепторе. Его сначала назвали VRL-1, теперь же он обозначается TRPV2. Его активация требует более высоких температур (от 52°C), и он не реагирует ни на капсаицин, ни на кислотность среды. Сходство по аминокислотной последовательности для двух мышиных белков — 49%. Оба белка имеют ортологи и у человека.
Следующим на очереди стал рецептор холода. Сложно сказать, насколько это удивительно или закономерно, но один и тот же рецептор был описан в двух статьях, вышедших практически одновременно в начале 2002 года в двух престижнейших журналах: статья Дэвида Джулиуса — в журнале Nature (D. D. McKemy et al., 2002. Identification of a cold receptor reveals a general role for TRP channels in thermosensation), а статья Ардема Патапутяна — в журнале Cell (A. M. Peier et al., 2002. A TRP channel that senses cold stimuli and menthol). Новооткрытый белок Джулиус назвал CMR1, а Патапутян TRPM8 — это название и было оставлено в итоге, поскольку снова это был белок из семейства TRP. Поиски рецептора опять велись при помощи вещества-агониста. Только на этот раз эту роль выполнял ментол — вещество из мяты перечной. Да-да, этот холодок от мятной жвачки вовсе неспроста — ментол действительно активирует те же самые нервные окончания, которые сообщают мозгу о прикосновении к чему-то прохладному, — причем, через взаимодействие с теми же самыми рецепторными каналами.
Сложно сказать, насколько это удивительно или закономерно, но один и тот же рецептор был описан в двух статьях, вышедших практически одновременно в начале 2002 года в двух престижнейших журналах: статья Дэвида Джулиуса — в журнале Nature (D. D. McKemy et al., 2002. Identification of a cold receptor reveals a general role for TRP channels in thermosensation), а статья Ардема Патапутяна — в журнале Cell (A. M. Peier et al., 2002. A TRP channel that senses cold stimuli and menthol). Новооткрытый белок Джулиус назвал CMR1, а Патапутян TRPM8 — это название и было оставлено в итоге, поскольку снова это был белок из семейства TRP. Поиски рецептора опять велись при помощи вещества-агониста. Только на этот раз эту роль выполнял ментол — вещество из мяты перечной. Да-да, этот холодок от мятной жвачки вовсе неспроста — ментол действительно активирует те же самые нервные окончания, которые сообщают мозгу о прикосновении к чему-то прохладному, — причем, через взаимодействие с теми же самыми рецепторными каналами.
В течение следующего года в лаборатории Патапутяна были открыты еще два терморецептора из семейства TRP. Один из них, TRPA1, реагирует на очень низкие температуры — такие, при взаимодействии с которыми может даже ощущаться боль. Кроме того, позднее было установлено, что канал из этого белка может активироваться при взаимодействии с широким спектром летучих веществ и ядов, вызывая раздражение в слизистых оболочках (кашель, слезоточивость) и чувство боли и зуда (например, при укусах некоторых насекомых, скорпионов и т. д.). С мутациями этого белка связаны некоторые синдромы хронической боли и гиперчувствительности.
Интересно, что среди нервных волокон, несущих рецепторы холода, примерно у половины одновременно присутствуют и рецепторы горячего. Как эти волокна дифференцируют разные стимулы и доносят правильную информацию в мозг — пока не совсем понятно.
Еще один рецептор, TRPM3 — реагирует на мягкое тепло. Этот рецептор обнаруживается на мембранах кератиноцитов кожи, а не нейронов, где обычно находятся все выше упомянутые рецепторы. Предполагается, что работа этого рецептора может быть существенна в отношении скорости появления возрастных изменений кожи.
Предполагается, что работа этого рецептора может быть существенна в отношении скорости появления возрастных изменений кожи.
Если вас беспокоит зубная боль, то ее виновника опознали совсем недавно (L. Bernal et al., 2021. Odontoblast TRPC5 channels signal cold pain in teeth). Им оказался рецепторный белок TRPC5, экспрессирующийся в одонтобластах — особых клетках, которые размещаются в пульпе зуба. Из-за этого белка мы испытываем это ужасное ощущение, когда, откусив мороженого, вместо ожидаемого удовольствия, вдруг чувствуешь, как от холода начинают неприятно болеть все зубы одновременно.
Интересно, что рецептор TRPV2 был обнаружен также в клетках внутренних органов, не являющихся нейронами (например, на фибробластах — клетках соединительной ткани). В этих клетках он регулирует транспорт кальция внутрь в ответ на сигналы, не связанные с повышенной температурой (M. Kanzaki et al. 1999. Translocation of a calcium-permeable cation channel induced by insulin-like growth factor-I). В частности, было установлено, что этот канал регулируется связыванием с инсулиноподобным фактором роста — важнейшим белком, поддерживающим деление клеток у животных.
В частности, было установлено, что этот канал регулируется связыванием с инсулиноподобным фактором роста — важнейшим белком, поддерживающим деление клеток у животных.
Практические аспекты описываемых работ лежат в области медицинской проблематики, связанной с поиском причин патологических болей и разработкой средств для их оптимального лечения. Вот лишь один пример. Как было сказано выше, рецепторные ионные каналы TRPV1 и TRPV2 способны пропускать органические катионы. Это их свойство стало предпосылкой для разработки нового подхода к проведению анестезии. Всем знакомый лидокаин, будучи неполярным органическим соединением, может проникать через липидную клеточную мембрану посредством диффузии. В нейронах он связывает изнутри и блокирует работу каналов натрия, чем и обусловлен его анестезирующий эффект. Проникновение лидокаина в клетки неизбирательно — воздействие оказывается на все типы нейронов. В области инъекции теряется не только всякая чувствительность, но и возможность управлять мышцами. В эксперименте ученые проводили инъекцию в заднюю конечность смеси из катионных производных лидокаина и капсаицина (он был нужен для стимуляции открытия канала TRPV1). В итоге порог болевой чувствительности был заметно повышен, но при этом крысы в полной мере сохранили способность двигать ногами и воспринимать неболевые стимулы в области инъекции.
В эксперименте ученые проводили инъекцию в заднюю конечность смеси из катионных производных лидокаина и капсаицина (он был нужен для стимуляции открытия канала TRPV1). В итоге порог болевой чувствительности был заметно повышен, но при этом крысы в полной мере сохранили способность двигать ногами и воспринимать неболевые стимулы в области инъекции.
Еще один важный класс рецепторов, который был открыт и изучен в работах лауреатов — это так называемые механорецепторы, реагирующие на давление или другие виды механического воздействия (как внешнего, так и внутреннего). По крайней мере для животных белки с функцией механорецепторов впервые были идентифицированы в 2010 году группой Патапутяна (B. Coste et al., 2010. Piezo1 and Piezo2 Are Essential Components of Distinct Mechanically Activated Cation Channels). У позвоночных их оказалось два: PIEZO1 и PIEZO2 (открытие было сделано на культуре мышиных нейробластов). У большинства видов, впрочем, обнаруживается только один этих гомологов. Гомологичный им белок был выявлен, между прочим, и у растений (в частности, на клетках корневого чехлика, см. S. A. R. Moustavi et al., 2021. PIEZO ion channel is required for root mechanotransduction in Arabidopsis thaliana), а также у одноклеточных эукариот. Вместе с тем белки PIEZO не имеют признаков гомологии с некоторыми другими белками-механорецепторами, выявленными намного раньше у бактерий и архей.
S. A. R. Moustavi et al., 2021. PIEZO ion channel is required for root mechanotransduction in Arabidopsis thaliana), а также у одноклеточных эукариот. Вместе с тем белки PIEZO не имеют признаков гомологии с некоторыми другими белками-механорецепторами, выявленными намного раньше у бактерий и архей.
В 2012 году группой Патапутяна было подтверждено предположение, что белки PIEZO формируют пору (ионный канал) в мембранах клеток млекопитающих (B. Coste et al., 2012. Piezos are pore-forming subunits of mechanically activated channels). Оказалось, что каждая пора состоит из трех одинаковых молекул белка, но при этом сами белки не имеют жесткой предсказываемой структуры. Предполагается наличие 16–18 гидрофобных участков, пронизывающих мембрану.
И, наконец, только в 2016 году этой же научной группой было окончательно доказано, что стимулом для активации ионного канала, образованного белками PIEZO, является непосредственно деформация билипидного слоя мембраны, а не какие-то дополнительные молекулы-посредники (R. Syeda et al., 2016. Piezo1 channels are inherently mechanosensitive).
Syeda et al., 2016. Piezo1 channels are inherently mechanosensitive).
У млекопитающих сходство аминокислотных последовательностей паралогов PIEZO1 и PIEZO2 составляет 42%. Оба белка обнаруживаются в нервных окончаниях, подходящих к чувствительным структурам в коже и мышцах (клетки Меркеля, тельца Мейснера, нервно-мышечные веретена, сухожильный орган Гольджи). Именно работой этих ионных каналов обеспечивается восприятие тактильных ощущений в коже (S. S. Ranade et al., 2015. Piezo2 is the major transducer of mechanical forces for touch sensation in mice), а также проприоцепция — способность ощущать положение собственных частей тела относительно друг друга, чувствовать напряжение собственных мышц (S. Woo et al., 2015. Piezo2 is the principal mechanotransduction channel for proprioception).
У людей особенно высокая концентрация механорецепторов обнаруживается в коже ладоней и пальцев. Скопления механорецепторов обнаруживаются в чувствительных участках кожи и у животных, которые в значительной мере полагаются на осязание при добывании пищи, — например, в отростках на носу у крота-звездоноса, на кончике клюва уток и в волосяных фолликулах у основания вибрисс кошек и мышей.
Некоторые нервные окончания могут содержать одновременно белки PIEZO и TRPV2 — такие нервные окончания несут в мозг болевые сигналы, связанные с некоторыми механическими воздействиями (например, укол иглой).
Нельзя не сказать и о том, что, начав с изучения механорецепторов в качестве «деталей» механизма сенсорного восприятия, ученые столкнулись с гораздо более широкой функциональной ролью этих белков. На этот факт указывает уже хотя бы то, что попытки получить мышей с нокаутом любого из двух белков PIEZO оказались совершенно бесполезными. Эмбрионы гибли на ранних сроках развития.
На сегодняшний день известно около 25 мутаций, затрагивающих эти белки, которые приводят к тяжелым порокам развития у людей. Белок PIEZO2 экспрессируется только в нейронах. Аномалии в этом белке приводят к нарушению развития опорно-двигательного аппарата — атрофии мышц, врожденному сколиозу и т. д. Белок PIEZO1 оказался достаточно широко экспрессируемым в разных типах клеток. Особенно высока его концентрация в легких, почках, мочевом пузыре, сердце и кровеносных сосудах. Все это полостные органы, функционирование которых подразумевает механические сжатия и растяжения. Недостаточность функционирования PIEZO1 в эмбриональном периоде приводит к невозможности нормального развития системы кровеносных сосудов. Но, в то же время, избыточность функции белков PIEZO бывает связана с гиперчувствительностью к боли и синдромами хронических болей, среди которых широко и печально известна мигрень (A. Della Pietra et al., 2020. The Emerging Role of Mechanosensitive Piezo Channels in Migraine Pain). Для любопытствующих можем порекомендовать обстоятельный обзор разнообразия функций механорецепторов PIEZO у млекопитающих (J. Wu et al., 2016. Touch, Tension, and Transduction — the Function and Regulation of Piezo Ion Channels).
Все это полостные органы, функционирование которых подразумевает механические сжатия и растяжения. Недостаточность функционирования PIEZO1 в эмбриональном периоде приводит к невозможности нормального развития системы кровеносных сосудов. Но, в то же время, избыточность функции белков PIEZO бывает связана с гиперчувствительностью к боли и синдромами хронических болей, среди которых широко и печально известна мигрень (A. Della Pietra et al., 2020. The Emerging Role of Mechanosensitive Piezo Channels in Migraine Pain). Для любопытствующих можем порекомендовать обстоятельный обзор разнообразия функций механорецепторов PIEZO у млекопитающих (J. Wu et al., 2016. Touch, Tension, and Transduction — the Function and Regulation of Piezo Ion Channels).
Также оказалось, что белок PIEZO1 в больших количествах присутствует на адипоцитах — основных клетках жировой ткани. Как выяснилось, этот рецептор составляет важное звено в контроле созревания адипоцитов и функционирования жировой ткани, в том числе при употреблении высококалорийной диеты (S. Wang et al., 2020. Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway in mice).
Wang et al., 2020. Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway in mice).
В настоящее время исследованиями различных аспектов работы температурных, болевых и механических рецепторов, открытых группами Джулиуса и Патапутяна, занимаются сотни лабораторий по всему миру. Изучение этих белков не только позволило разобраться в деталях генерирования тех или иных сенсорных ощущений у человека, но и привело к пониманию, что те же самые рецепторы вовлечены в обеспечение нормального развития и функционирования множества тканей и органов в нашем теле. Получаемые фундаментальные знания в конечном итоге помогают в поиске оптимальных стратегий решения медицинских задач. В особенности это касается аспектов патологической боли, в том числе хронической, которая серьезно снижает качество жизни многих людей.
Татьяна Романовская
Нобелевскую премию по физиологии и медицине вручили за исследование рецепторов температуры и осязания
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, EPA / Reuters
Нобелевский комитет в Стокгольме назвал имя лауреатов премии в области медицины или физиологии. Ими стали Дэвид Джулиус и Ардем Патапутян. Они открыли, каким образом температура или, например, прикосновение превращаются в человеческие ощущения.
Вручение прошло дистанционно и транслировалось на сайте Нобелевского комитета.
Открытие Джулиуса и Патапутяна нобелевское жюри сочло прорывным. «Лауреаты нынешнего года позволили нам понять, как температура или механическая сила инициируют нервные импульсы, которые позволяют нам воспринимать мир и адаптироваться», — заявили в комитете.
Эта технология потенциально может применяться в разных областях — от медицины до виртуальной реальности и роботостроения.
Премия в области медицины вручается, по словам члена Нобелевской ассамблеи профессора Джулин Зират, «по очень узким критериям».
- Перекрыть раку кислород.
 Суть Нобелевской премии 2020 года по медицине в 100 и 500 словах
Суть Нобелевской премии 2020 года по медицине в 100 и 500 словах - Как обмануть рак? Объясняем открытие лауреатов Нобелевской премии 2020 года в 100 и 500 словах
«Мы искали открытие, которое открыло двери и помогло нам увидеть проблему в новом свете», — говорит она.
«Уровень открытия должен быть очень высоким. Это не может быть изобретением или усовершенствованием чего-то существующего. Должно быть именно открытие», — добавила она в интервью перед вручением премии.
Автор фото, Getty Images
Подпись к фото,
Из-за пандемии премию в этом году вручали дистанционно
Родившийся в 1955 году Джулиус работает в Калифорнийском университете в Сан-Франциско и в последние десятилетия изучает молекулярные механизмы, помогающие людям ощущать прикосновение и боль. Группа ученых под его руководством выявила целое семейство чувствительных к температуре рецепторов, позволяющих нервным волокнам определять высокие и низкие температуры, используя свойства натуральных продуктов, в частности, острого перца.
Автор фото, Steve Babuljak
Подпись к фото,
Дэвид Джулиус
Ардем Патапутян родился в Бейруте в 1967 году. Он тоже работает в Калифорнии, в медицинском институте Говарда Хьюза.
В его лаборатории удалось выявить и описать ионные каналы, которые активируются изменениями тепловой энергии и, таким образом, функционируют как молекулярные термометры человеческого организма.
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Николай Воронин, корреспондент Би-би-си по науке
Представьте, что вы решили босиком прогуляться по утреннему полю и идете по прохладной, набухшей росой траве…
Стоп! Откуда вы знаете, что трава прохладная? Что она покрыта росой?
Мы настолько привыкли доверять своим органам чувств, что редко задумываемся о том, как именно они работают. На ощупь отличить холодный предмет от горячего, а твердый от мягкого (ученые называют эту способность соматосенсорикой) не составляет труда даже с закрытыми глазами. Но как мы это делаем — что за механизм лежит в основе этих ощущений — наука не могла объяснить на протяжении тысячелетий. Еще в XVII веке французский философ Рене Декарт предположил, что раз при попадании на кожу огня мы чувствуем ожог и боль, она должна быть каким-то образом связана с мозгом, чтобы передать туда соответствующий сигнал.
На ощупь отличить холодный предмет от горячего, а твердый от мягкого (ученые называют эту способность соматосенсорикой) не составляет труда даже с закрытыми глазами. Но как мы это делаем — что за механизм лежит в основе этих ощущений — наука не могла объяснить на протяжении тысячелетий. Еще в XVII веке французский философ Рене Декарт предположил, что раз при попадании на кожу огня мы чувствуем ожог и боль, она должна быть каким-то образом связана с мозгом, чтобы передать туда соответствующий сигнал.
В конце XIX века на коже были обнаружены чувствительные точки, реагирующие на тот или иной раздражитель, но — опять же — как и почему это происходит, оставалось загадкой.
В 1906 Камилло Гольджи и Сантьяго Рамон-и-Кахаль получили Нобелевскую премию за описание структуры нервной системы. В 1932 награду разделили Чарлз Шеррингтон и Эдгар Эдриан — за «открытия, касающиеся функций нейронов», в том числе соматосенсорных. Еще 12 лет спустя, в 1944, премия была присуждена Джозефу Эрлангеру и Герберту Спенсеру Гассеру — за описание различных функций, которые могут выполнять одиночные нервные волокна.
Дэвид Джулиус заметил, что острая пища вызывает в организме точно такую же реакцию, как и горячая — и предположил, что алкалоид капсаицин (именно обеспечивает жгучий вкус разным видам перца) активирует некий специфический фрагмент ДНК — тот же, что и высокая температура. Перебрав тысячи вариантов, он, наконец, обнаружил ответственный за эту реакцию белок, получивший название TRPV1. А следом и второй — TRPV2, реагирующий на еще более высокую температуру.
Белок, ответственный за ощущение холода, оба лауреата открыли почти одновременно, в 2002 году. А вот с протеином, обеспечивающим ощущение физического прикосновения, Ардему Патапутяну не повезло. Профессор составил список из 72 генов — потенциальных кандидатов на роль осязательного рецептора — и начал отключать их один за другим, проверяя, не пропало ли осязание. Нужный ген оказался последним, 72-м.
Таким образом ученые выяснили, как именно соматосенсорная система позволяет нам чувствовать не только температуру и прикосновение, но и боль, и даже движение собственного тела. Неудивительно, что в решении Нобелевского комитета сказано, что научные работы новоиспеченных лауреатов «раскрыли одну из загадок природы, на молекулярном уровне объяснив […] нашу способность воспринимать и интерпретировать как окружающий мир, так и наши собственные внутренние ощущения».
Неудивительно, что в решении Нобелевского комитета сказано, что научные работы новоиспеченных лауреатов «раскрыли одну из загадок природы, на молекулярном уровне объяснив […] нашу способность воспринимать и интерпретировать как окружающий мир, так и наши собственные внутренние ощущения».
На этой неделе нобелевский комитет объявит обладателей премии еще в четырех областях. Во вторник объявят обладателя премии по физике, в среду — по химии, в четверг — по литературе. 11 октября объявят лауреатов премии в области экономики.
В пятницу в столице Норвегии будет объявлен лауреат Нобелевской премии мира. На нее претендуют 329 кандидатов.
NobelPrize.org
Лауреат медицины 1945 года, сэр. Александр Флеминг получил премию за открытие пенициллина
© Нобель Медиа. Фото: Александр Махмуд
27 ноября 1895 года Альфред Нобель подписал свою последнюю волю и завещание, отдав большую часть своего состояния ряду Нобелевских премий. Как описано в завещании Нобеля, одна часть была посвящена «человеку, который сделает самое важное открытие в области физиологии или медицины». Узнайте больше о Нобелевской премии по физиологии и медицине от 19с 01 по 2022 год.
Узнайте больше о Нобелевской премии по физиологии и медицине от 19с 01 по 2022 год.
Количество Нобелевских премий по физиологии и медицине
113 Нобелевские премии по физиологии и медицине присуждаются с 1901 года. Она не присуждалась девять раз: в 1915, 1916, 1917, 1918, 1921, 1925, 1940, 1941 и 1942 годах.
Почему в те годы не присуждались премии в области медицины? В уставе Нобелевского фонда сказано: «Если ни одна из рассматриваемых работ не окажется имеющей значение, указанное в первом абзаце, призовые деньги сохраняются до следующего года. Если даже в этом случае приз не может быть присужден, сумма будет добавлена к ограниченным фондам Фонда». Во время Первой и Второй мировых войн было присуждено меньше Нобелевских премий.
Совместные и неразделенные Нобелевские премии по физиологии и медицине
40 премий в области медицины были вручены только одному лауреату.
34 премии в области медицины разделили между собой два лауреата.
39 наград в области медицины были поделены между тремя лауреатами.
Почему? В уставе Нобелевского фонда сказано: сумма премии может быть разделена поровну между двумя работами, каждая из которых считается достойной премии. Если работа, подлежащая награждению, создана двумя или тремя лицами, премия присуждается им совместно. Ни в коем случае сумма приза не может быть разделена между более чем тремя лицами.
Количество лауреатов Нобелевской премии по физиологии и медицине
225 человек были награждены с 1901 по 2022 год.
Список всех лауреатов Нобелевской премии по физиологии и медицинеne
Самый молодой лауреат медицины
На сегодняшний день самым молодым лауреатом Нобелевской премии по физиологии и медицине является Фредерик Г. Бантинг, которому было 32 года, когда он был удостоен премии в области медицины в 1923 году.
Старейший лауреат медицины
Самым пожилым лауреатом Нобелевской премии по физиологии и медицине на сегодняшний день является Пейтон Роус, которому было 87 лет, когда он был удостоен премии в области медицины в 1966 году.
Женщины-лауреаты Нобелевской премии по физиологии и медицине
Из 225 человек, удостоенных Нобелевской премии по физиологии и медицине, 12 женщин. Из этих 12 Барабара МакКлинток — единственная, кто получил неразделенную Нобелевскую премию.
1947 — Герти Кори
1977 — Розалин Ялоу
1983 — Барбара МакКлинток
1986 — Рита Леви-Монтальчини
1988 — Гертруда Б. Элион
1995 — Кристиана Нюссляйн-Фольхард
2004 — Линда Б. Бак
2008 — Франсуаза Барре-Синусси
2009 — Элизабет Х. Блэкберн и Кэрол В.2 20 May-Britt Moser
2015 – Tu Youyou
Список всех женщин-лауреатов Нобелевской премии
Неоднократные лауреаты Нобелевской премии по физиологии и медицине
Никто не был удостоен Нобелевской премии по физиологии или медицине более одного раза. И все же…
Список многократных лауреатов Нобелевской премии в других призовых категориях
Посмертные Нобелевские премии по физиологии и медицине
Посмертных Нобелевских премий по химии не было. С 1974 года Устав Нобелевского фонда предусматривает, что Нобелевская премия не может быть присуждена посмертно, если смерть не наступила после объявления Нобелевской премии. До 1974 года Нобелевская премия присуждалась посмертно только дважды: Дагу Хаммаршельду (Нобелевская премия мира 1961) и Эрик Аксель Карлфельдт (Нобелевская премия по литературе 1931 г.).
С 1974 года Устав Нобелевского фонда предусматривает, что Нобелевская премия не может быть присуждена посмертно, если смерть не наступила после объявления Нобелевской премии. До 1974 года Нобелевская премия присуждалась посмертно только дважды: Дагу Хаммаршельду (Нобелевская премия мира 1961) и Эрик Аксель Карлфельдт (Нобелевская премия по литературе 1931 г.).
После объявления Нобелевской премии по физиологии и медицине в 2011 году было обнаружено, что один из лауреатов в области медицины, Ральф Штайнман, скончался тремя днями ранее. Совет Нобелевского фонда рассмотрел устав, и интерпретация цели приведенного выше правила привела к выводу, что Ральф Штейнман должен оставаться лауреатом Нобелевской премии, поскольку Нобелевская ассамблея Каролинского института объявила лауреатов Нобелевской премии 2011 года в физиологии или медицине, не зная о его смерти.
Семья лауреатов Нобелевской премии по физиологии и медицине
Супружеские пары:
Герти Кори и Карл Кори, лауреаты Нобелевской премии по физиологии и медицине 1947 г.
Мэй-Бритт Мозер и Эдвард И. Мозер, лауреаты Нобелевской премии по физиологии и медицине 2014 г.
Отец и сын:
Ганс фон Эйлер-Хелпин (отец), лауреат Нобелевской премии по химии 1929 г.
Ульф фон Эйлер (сын), лауреат Нобелевской премии по физиологии и медицине 1970.
Артур Корнберг (отец), лауреат Нобелевской премии по физиологии и медицине 1959 г.
Роджер Д. Корнберг (сын), лауреат Нобелевской премии по химии 2006 г.
Суне Бергстрем (отец), лауреат Нобелевской премии по физиологии и медицине 1982 г.
Сванте Паабо (сын), лауреат Нобелевской премии по физиологии и медицине 2022 г.
Братья:
Ян Тинберген (премия по экономическим наукам) и Николаас Тинберген (премия по медицине)
Вынужден отказаться от Нобелевской премии
Власти вынудили двух лауреатов Нобелевской премии по химии отказаться от Нобелевской премии. Адольф Гитлер запретил трем немецким лауреатам Нобелевской премии получать Нобелевскую премию — двое из которых были удостоены Нобелевской премии по химии, Рихард Кун в 1938 году и Адольф Бутенандт в 1939 году.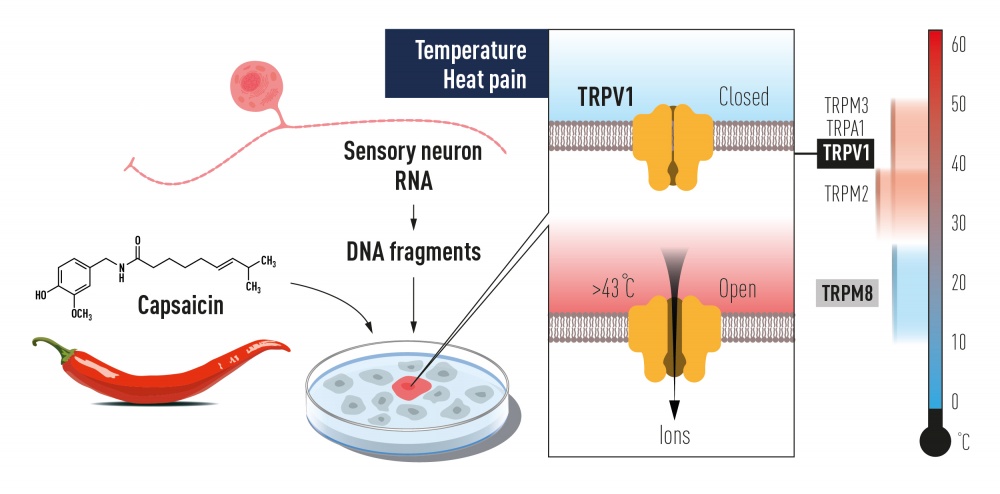 Третий человек, Герхард Домагк, был удостоен Нобелевской премии по физиологии и медицине. в 1939 году. Все они могли позже получить Нобелевский диплом и медаль, но не сумму премии.
Третий человек, Герхард Домагк, был удостоен Нобелевской премии по физиологии и медицине. в 1939 году. Все они могли позже получить Нобелевский диплом и медаль, но не сумму премии.
Партнерство лауреатов Нобелевской премии в области биомедицинских наук
Многие длительные научные партнерства привели к Нобелевским премиям:
| Партнеры | Годы Партнерство | Финики |
| Майкл С. Браун и Джозеф Л. Гольдштейн | 40 | 1972-настоящее время |
| Карл Кори и Герти Кори | 34 | 1922-56 |
| Уильям Х. Стейн и Стэнфорд Мур | 33 | 1939-72 |
Андре Ф.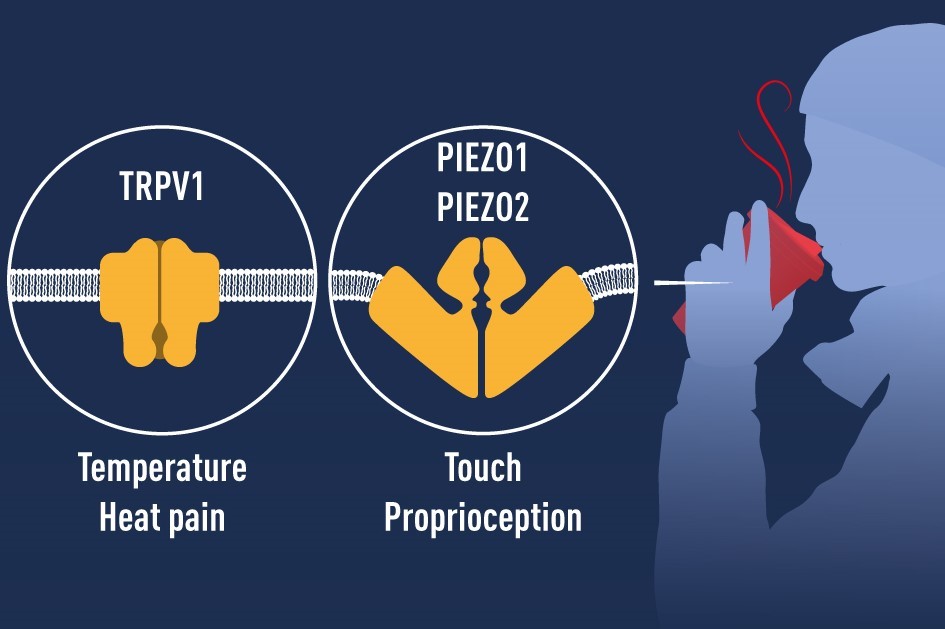 Курнан и Дикинсон В. Ричардс Курнан и Дикинсон В. Ричардс | 30 | 1932-62 |
| Джордж Х. Хитчингс и Гертруда Б. Элион | 23 | 1944-67 |
| Дэвид Х. Хьюбел и Торстен Н. Визель | 20 | 1958-78 |
| Дж. Майкл Бишоп и Гарольд Э. Вармус | 19 | 1971-90 |
| Филип С. Хенч и Эдвард С. Кендалл | 16 | 1934-50 |
| Эдмонд Х. Фишер и Эдвин Г. Кребс | 11 | 1953-64 |
| Франсуа Джейкоб и Жак Моно | 9 | 1957-66 |
| Джеймс Уотсон и Фрэнсис Крик | 2 | 1951-53 |
Список составлен в 2012 г. с разрешения Джозефа Л. Гольдштейна.
с разрешения Джозефа Л. Гольдштейна.
Номинации на Нобелевскую премию по физиологии и медицине
В базе данных номинаций можно найти интересные факты о номинациях, например, что австрийский невролог и основатель психоанализа Зигмунд Фрейд (1856-1939) 32 раза номинировался на Нобелевскую премию по физиологии и медицине, но ни разу не был присужден. В 1929 году Нобелевский комитет по медицине нанял эксперта, который пришел к выводу, что в дальнейшем исследовании Фрейда нет необходимости, поскольку работа Фрейда не имеет доказанной научной ценности. Фрейд также однажды был номинирован на премию 1936 Нобелевская премия по литературе лауреата Нобелевской премии Ромена Роллана, знакомого Фрейда.
Номинанты на Нобелевскую премию держатся в секрете уже 50 лет.
Изучите базу данных номинантов на Нобелевскую премию
Медаль Нобелевской премии по физиологии и медицине
Медаль Нобелевской премии по физиологии и медицине была разработана шведским скульптором и гравером Эриком Линдбергом и представляет собой гения медицины, держащего на коленях раскрытую книгу и собирающего воду, вытекающую из скалы, чтобы утолить жажду больной девушки.
Подробнее о Нобелевской медали по физиологии и медицине
Дипломы Нобелевской премии
Каждый диплом Нобелевской премии является уникальным произведением искусства, созданным ведущими шведскими и норвежскими художниками и каллиграфами.
Подробнее о дипломах Нобелевской премии
Сумма Нобелевской премии
Альфред Нобель оставил большую часть своего состояния, более 31 миллиона шведских крон (сегодня примерно 1 702 миллиона шведских крон), которые были преобразованы в фонд и инвестированы в «надежные ценные бумаги». Доход от инвестиций должен был «ежегодно распределяться в виде призов тем, кто в течение предыдущего года принес наибольшую пользу человечеству».
Сумма Нобелевской премии на 2022 год установлена в размере 10 миллионов шведских крон (SEK) за полную Нобелевскую премию.
Подробнее о сумме Нобелевской премии
* Почему лица и организации, удостоенные Нобелевской премии, называются лауреатами Нобелевской премии?
Слово «лауреат» означает лавровый венок. В греческой мифологии бог Аполлон представлен с лавровым венком на голове. Лавровый венок представляет собой круглую корону из ветвей и листьев лавра (на латыни: Лавр благородный ). В Древней Греции лавровыми венками награждали победителей в знак почета – как в спортивных состязаниях, так и в поэтических состязаниях.
В греческой мифологии бог Аполлон представлен с лавровым венком на голове. Лавровый венок представляет собой круглую корону из ветвей и листьев лавра (на латыни: Лавр благородный ). В Древней Греции лавровыми венками награждали победителей в знак почета – как в спортивных состязаниях, так и в поэтических состязаниях.
Ссылки на другие факты о Нобелевских премиях:
Факты о Нобелевской премии по физике
Факты о Нобелевской премии по химии
Факты о Нобелевской премии по физиологии и медицине
Факты о Нобелевской премии по литературе
Факты о Нобелевская премия мира
Факты о премии в области экономических наук
Факты обо всех Нобелевских премиях
Впервые опубликовано 5 октября 2009 г.
Пресс-релиз: Нобелевская премия по физиологии и медицине 2021
Дэвид Джулиус
Ардем Патапутян
Английский
Английский (pdf)
Шведский
Шведский (pdf)
Пресс-релиз
2021-10-04
Нобелевская ассамблея Каролинского института
сегодня решил наградить
Нобелевская премия по физиологии и медицине 2021 года
вместе с
Давид Джулиус и Ардем Патапутян
за открытие рецепторов температуры и прикосновения
Наша способность ощущать тепло, холод и прикосновение необходима для выживания и лежит в основе нашего взаимодействия с окружающим миром. В нашей повседневной жизни мы принимаем эти ощущения как должное, но как инициируются нервные импульсы, чтобы можно было воспринимать температуру и давление? На этот вопрос ответили лауреаты Нобелевской премии этого года.
В нашей повседневной жизни мы принимаем эти ощущения как должное, но как инициируются нервные импульсы, чтобы можно было воспринимать температуру и давление? На этот вопрос ответили лауреаты Нобелевской премии этого года.
Дэвид Джулиус использовал капсаицин, острое соединение перца чили, вызывающее ощущение жжения, для выявления сенсора в нервных окончаниях кожи, который реагирует на тепло. Ардем Патапутян использовал чувствительные к давлению клетки, чтобы открыть новый класс датчиков, которые реагируют на механические раздражители в коже и внутренних органах. Эти прорывные открытия положили начало интенсивной исследовательской деятельности, которая привела к быстрому расширению нашего понимания того, как наша нервная система воспринимает тепло, холод и механические раздражители. Лауреаты выявили важные недостающие звенья в нашем понимании сложного взаимодействия между нашими чувствами и окружающей средой.
Как мы воспринимаем мир?
Одной из величайших загадок, стоящих перед человечеством, является вопрос о том, как мы воспринимаем окружающую среду. Механизмы, лежащие в основе наших чувств, вызывали наше любопытство на протяжении тысячелетий, например, как свет воспринимается глазами, как звуковые волны воздействуют на наши внутренние уши и как различные химические соединения взаимодействуют с рецепторами в нашем носу и рту, создавая запах и вкус. . У нас есть и другие способы восприятия окружающего мира. Представьте себе, что вы идете босиком по лужайке в жаркий летний день. Вы можете почувствовать тепло солнца, ласку ветра и отдельные травинки под ногами. Эти впечатления от температуры, прикосновения и движения необходимы для нашей адаптации к постоянно меняющемуся окружению.
Механизмы, лежащие в основе наших чувств, вызывали наше любопытство на протяжении тысячелетий, например, как свет воспринимается глазами, как звуковые волны воздействуют на наши внутренние уши и как различные химические соединения взаимодействуют с рецепторами в нашем носу и рту, создавая запах и вкус. . У нас есть и другие способы восприятия окружающего мира. Представьте себе, что вы идете босиком по лужайке в жаркий летний день. Вы можете почувствовать тепло солнца, ласку ветра и отдельные травинки под ногами. Эти впечатления от температуры, прикосновения и движения необходимы для нашей адаптации к постоянно меняющемуся окружению.
В 17 веке философ Рене Декарт представил себе нити, соединяющие различные участки кожи с мозгом. Таким образом, прикосновение ноги к открытому огню будет посылать механический сигнал в мозг (рис. 1). Позднее открытия показали существование специализированных сенсорных нейронов, которые регистрируют изменения в окружающей среде. Джозеф Эрлангер и Герберт Гассер получили Нобелевскую премию по физиологии и медицине в 1944 году за открытие различных типов сенсорных нервных волокон, которые реагируют на различные раздражители, например, в ответ на болезненное и безболезненное прикосновение. С тех пор было продемонстрировано, что нервные клетки узко специализированы для обнаружения и преобразования различных типов стимулов, что позволяет тонко воспринимать наше окружение; например, наша способность ощущать разницу в текстуре поверхностей кончиками пальцев или наша способность различать приятное и болезненное тепло.
С тех пор было продемонстрировано, что нервные клетки узко специализированы для обнаружения и преобразования различных типов стимулов, что позволяет тонко воспринимать наше окружение; например, наша способность ощущать разницу в текстуре поверхностей кончиками пальцев или наша способность различать приятное и болезненное тепло.
До открытий Давида Джулиуса и Ардема Патапутяна наше понимание того, как нервная система воспринимает и интерпретирует окружающую среду, все еще содержало фундаментальный нерешенный вопрос: как температурные и механические раздражители преобразуются в электрические импульсы в нервной системе?
Рисунок 1 Иллюстрация, показывающая, как философ Рене Декарт представлял себе, как тепло посылает механические сигналы в мозг.
Наука накаляется!
Во второй половине 1990-х годов Дэвид Джулиус из Калифорнийского университета в Сан-Франциско, США, увидел возможность значительного прогресса, проанализировав, как химическое соединение капсаицин вызывает ощущение жжения, которое мы чувствуем, когда соприкасаемся с перцем чили. Уже было известно, что капсаицин активирует нервные клетки, вызывая болевые ощущения, но как это химическое вещество на самом деле выполняет эту функцию, оставалось нерешенной загадкой. Джулиус и его коллеги создали библиотеку из миллионов фрагментов ДНК, соответствующих генам, которые экспрессируются в сенсорных нейронах, способных реагировать на боль, тепло и прикосновение. Джулиус и его коллеги предположили, что библиотека будет включать фрагмент ДНК, кодирующий белок, способный реагировать на капсаицин. Они экспрессировали отдельные гены из этой коллекции в культивируемых клетках, которые в норме не реагируют на капсаицин. После кропотливых поисков был идентифицирован единственный ген, способный сделать клетки чувствительными к капсаицину (рис. 2). Найден ген восприятия капсаицина! Дальнейшие эксперименты показали, что идентифицированный ген кодирует новый белок ионного канала, и этот недавно открытый рецептор капсаицина позже был назван TRPV1. Когда Джулиус исследовал способность белка реагировать на тепло, он понял, что открыл чувствительный к теплу рецептор, который активируется при температурах, воспринимаемых как болезненные (рис.
Уже было известно, что капсаицин активирует нервные клетки, вызывая болевые ощущения, но как это химическое вещество на самом деле выполняет эту функцию, оставалось нерешенной загадкой. Джулиус и его коллеги создали библиотеку из миллионов фрагментов ДНК, соответствующих генам, которые экспрессируются в сенсорных нейронах, способных реагировать на боль, тепло и прикосновение. Джулиус и его коллеги предположили, что библиотека будет включать фрагмент ДНК, кодирующий белок, способный реагировать на капсаицин. Они экспрессировали отдельные гены из этой коллекции в культивируемых клетках, которые в норме не реагируют на капсаицин. После кропотливых поисков был идентифицирован единственный ген, способный сделать клетки чувствительными к капсаицину (рис. 2). Найден ген восприятия капсаицина! Дальнейшие эксперименты показали, что идентифицированный ген кодирует новый белок ионного канала, и этот недавно открытый рецептор капсаицина позже был назван TRPV1. Когда Джулиус исследовал способность белка реагировать на тепло, он понял, что открыл чувствительный к теплу рецептор, который активируется при температурах, воспринимаемых как болезненные (рис. 2).
2).
Рисунок 2 Дэвид Джулиус использовал капсаицин из перца чили для идентификации TRPV1, ионного канала, активируемого болезненным теплом. Были идентифицированы дополнительные родственные ионные каналы, и теперь мы понимаем, как различные температуры могут индуцировать электрические сигналы в нервной системе.
Открытие TRPV1 стало крупным прорывом, который привел к открытию дополнительных термочувствительных рецепторов. Независимо друг от друга Дэвид Джулиус и Ардем Патапутян использовали химическое вещество ментол для идентификации TRPM8, рецептора, который, как было показано, активируется холодом. Были идентифицированы дополнительные ионные каналы, связанные с TRPV1 и TRPM8, и было обнаружено, что они активируются в диапазоне различных температур. Многие лаборатории проводили исследовательские программы для изучения роли этих каналов в тепловом ощущении с использованием генетически модифицированных мышей, у которых отсутствовали эти недавно открытые гены. Открытие Дэвидом Джулиусом TRPV1 стало прорывом, который позволил нам понять, как различия в температуре могут индуцировать электрические сигналы в нервной системе.
Открытие Дэвидом Джулиусом TRPV1 стало прорывом, который позволил нам понять, как различия в температуре могут индуцировать электрические сигналы в нервной системе.
Исследования под давлением!
Пока разворачивались механизмы температурного восприятия, оставалось неясным, как механические раздражители могут быть преобразованы в наши чувства осязания и давления. Ранее исследователи находили механические сенсоры у бактерий, но механизмы, лежащие в основе осязания у позвоночных, оставались неизвестными. Ардем Патапутян, работающий в Scripps Research в Ла-Хойя, Калифорния, США, хотел идентифицировать неуловимые рецепторы, которые активируются механическими раздражителями.
Патапутян и его сотрудники впервые идентифицировали клеточную линию, которая испускала измеримый электрический сигнал, когда отдельные клетки постукивали микропипеткой. Предполагалось, что рецептор, активируемый механической силой, представляет собой ионный канал, и на следующем этапе были идентифицированы 72 гена-кандидата, кодирующие возможные рецепторы. Эти гены были инактивированы один за другим, чтобы обнаружить ген, ответственный за механочувствительность в исследуемых клетках. После напряженных поисков Патапутян и его коллеги сумели идентифицировать единственный ген, молчание которого делало клетки нечувствительными к протыканию микропипеткой. Был обнаружен новый и совершенно неизвестный механочувствительный ионный канал, которому было присвоено название Piezo1, в честь греческого слова, обозначающего давление (í; píesi). Благодаря его сходству с Piezo1 был обнаружен второй ген, названный Piezo2. Было обнаружено, что сенсорные нейроны экспрессируют высокие уровни Piezo2, и дальнейшие исследования твердо установили, что Piezo1 и Piezo2 являются ионными каналами, которые напрямую активируются при оказании давления на клеточные мембраны (рис. 3).
Эти гены были инактивированы один за другим, чтобы обнаружить ген, ответственный за механочувствительность в исследуемых клетках. После напряженных поисков Патапутян и его коллеги сумели идентифицировать единственный ген, молчание которого делало клетки нечувствительными к протыканию микропипеткой. Был обнаружен новый и совершенно неизвестный механочувствительный ионный канал, которому было присвоено название Piezo1, в честь греческого слова, обозначающего давление (í; píesi). Благодаря его сходству с Piezo1 был обнаружен второй ген, названный Piezo2. Было обнаружено, что сенсорные нейроны экспрессируют высокие уровни Piezo2, и дальнейшие исследования твердо установили, что Piezo1 и Piezo2 являются ионными каналами, которые напрямую активируются при оказании давления на клеточные мембраны (рис. 3).
Рисунок 3 Patapoutian использовал культивированные механочувствительные клетки для идентификации ионного канала
, активируемого механической силой. После кропотливой работы Piezo1 был идентифицирован
. На основании сходства с Piezo1 был обнаружен второй ионный канал
На основании сходства с Piezo1 был обнаружен второй ионный канал
(Piezo2).
Прорыв Патапутяна привел к серии статей его и других групп, демонстрирующих, что ионный канал Piezo2 необходим для осязания. Более того, было показано, что Piezo2 играет ключевую роль в критически важном восприятии положения и движения тела, известном как проприоцепция. В дальнейшей работе было показано, что каналы Piezo1 и Piezo2 регулируют дополнительные важные физиологические процессы, включая кровяное давление, дыхание и контроль мочевого пузыря.
Все имеет смысл!
Новаторские открытия каналов TRPV1, TRPM8 и Piezo лауреатами Нобелевской премии этого года позволили нам понять, как тепло, холод и механическое воздействие могут инициировать нервные импульсы, которые позволяют нам воспринимать окружающий мир и адаптироваться к нему. Каналы TRP играют центральную роль в нашей способности воспринимать температуру. Канал Piezo2 наделяет нас осязанием и способностью чувствовать положение и движение частей нашего тела. Каналы TRP и Piezo также способствуют многочисленным дополнительным физиологическим функциям, которые зависят от температуры восприятия или механических раздражителей. Интенсивные текущие исследования, основанные на открытиях, удостоенных Нобелевской премии в этом году, сосредоточены на выяснении их функций в различных физиологических процессах. Эти знания используются для разработки методов лечения широкого спектра болезненных состояний, включая хроническую боль (рис. 4).
Каналы TRP и Piezo также способствуют многочисленным дополнительным физиологическим функциям, которые зависят от температуры восприятия или механических раздражителей. Интенсивные текущие исследования, основанные на открытиях, удостоенных Нобелевской премии в этом году, сосредоточены на выяснении их функций в различных физиологических процессах. Эти знания используются для разработки методов лечения широкого спектра болезненных состояний, включая хроническую боль (рис. 4).
Рисунок 4 Основополагающие открытия лауреатов Нобелевской премии этого года объяснили, как тепло, холод и прикосновение могут инициировать сигналы в нашей нервной системе. Выявленные ионные каналы важны для многих физиологических процессов и болезненных состояний.
Ключевые публикации
Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Д.Д., Юлиус Д. . Рецептор капсаицина: активируемый нагреванием ионный канал болевого пути. Природа 1997:389:816-824.
Томинага М., Катерина М.Дж., Мальмберг А.Б., Розен Т.А., Гилберт Х., Скиннер К., Рауманн Б.Е., Басбаум А.И., Юлий Д. . Клонированный рецептор капсаицина интегрирует несколько раздражителей, вызывающих боль. Нейрон 1998:21:531-543.
Катерина М.Дж., Леффлер А., Мальмберг А.Б., Мартин В.Дж., Трафтон Дж., Петерсен-Цейц К.Р., Кольценбург М., Басбаум А.И., Юлий Д. . Нарушение ноцицепции и болевой чувствительности у мышей, лишенных рецептора капсаицина. Наука 2000:288:306-313
МакКеми Д.Д., Нойхаузер В.М., Юлиус Д. . Идентификация холодового рецептора выявляет общую роль TRP-каналов в термоощущении. Природа 2002:416:52-58
Пейер А.М., Мокрич А., Хергарден А.С., Рив А.Дж., Андерссон Д.А., Стори Г.М., Эрли Т.Дж., Драгони И., Макинтайр П., Беван С., Патапутян А. . Канал TRP, воспринимающий холодовые раздражители и ментол. Сотовый 2002:108:705-715
Кост Б., Матур Дж., Шмидт М. , Эрли Т.Дж., Ранаде С., Петрус М.Дж., Дубин А.Е., Патапутян А. . Piezo1 и Piezo2 являются важными компонентами различных механически активированных катионных каналов. Наука 2010:330:55-60
, Эрли Т.Дж., Ранаде С., Петрус М.Дж., Дубин А.Е., Патапутян А. . Piezo1 и Piezo2 являются важными компонентами различных механически активированных катионных каналов. Наука 2010:330:55-60
Ранаде С.С., Ву С.Х., Дубин А.Е., Мошураб Р.А., Ветцель С., Петрус М., Матур Дж., Бегай В., Кост Б., Мейнквист Дж., Уилсон А.Дж., Франциско А.Г., Редди К., Цю З., Вуд Дж.Н., Левин Г.Р., Патапутян А . Piezo2 является основным преобразователем механических сил для осязания у мышей. Природа 2014:516:121-125
Ву С.-Х., Лукач В., де Ноой Дж. К., Зайцева Д., Криддл Ч. Р., Франсиско А., Джесселл Т. М., Уилкинсон К. А., Патапутян А . Piezo2 является основным каналом мехонотрансдукции для проприоцепции. Природа нейронауки 2015:18:1756-1762
Дэвид Джулиус родился в 1955 году в Нью-Йорке, США. Он получил докторскую степень. в 1984 году из Калифорнийского университета в Беркли и был научным сотрудником Колумбийского университета в Нью-Йорке. Дэвид Джулиус был принят на работу в Калифорнийский университет в Сан-Франциско в 1989 году, где он сейчас является профессором.
Дэвид Джулиус был принят на работу в Калифорнийский университет в Сан-Франциско в 1989 году, где он сейчас является профессором.
Ардем Патапутян родился в 1967 году в Бейруте, Ливан. В юности он переехал из раздираемого войной Бейрута в Лос-Анджелес, США, и получил степень доктора философии. в 1996 году из Калифорнийского технологического института, Пасадена, США. Он был научным сотрудником в Калифорнийском университете в Сан-Франциско. С 2000 года он работает научным сотрудником Scripps Research, Ла-Хойя, Калифорния, где в настоящее время является профессором. Он является исследователем Медицинского института Говарда Хьюза с 2014 года.
Иллюстрации: © Нобелевский комитет по физиологии и медицине. Иллюстратор: Маттиас Карлен
Нобелевская ассамблея, состоящая из 50 профессоров Каролинского института, присуждает Нобелевскую премию по физиологии и медицине. Его Нобелевский комитет оценивает номинации. С 1901 года Нобелевская премия присуждается ученым, сделавшим важнейшие открытия на благо человечества.

 Суть Нобелевской премии 2020 года по медицине в 100 и 500 словах
Суть Нобелевской премии 2020 года по медицине в 100 и 500 словах