Содержание
Нобелевская премия по химии — 2018 • Татьяна Романовская • Новости науки на «Элементах» • Нобелевские премии, Химия, Молекулярная биология
Нобелевскую премию по химии в 2018 году разделили между собой трое ученых: половина премии досталась американской исследовательнице Фрэнсис Арнольд «за направленную эволюцию ферментов», вторую половину поровну поделили американец Джордж Смит и Грег Уинтер из Великобритании — «за фаговый дисплей пептидов и антител». Исследования, которые удостоились премии, имеют ярко выраженный прикладной характер, а объединяет их то, что все авторы связаны с разработкой методов для получения полезных для человека белков и пептидов, основанных на имитации естественного «метода» биологической эволюции, а именно — на сочетании случайной изменчивости и неслучайного отбора. Все лауреаты имеют за плечами долгий путь исследовательской работы и множество престижных наград и премий.
Белки (также называемые полипептидами) — это наиважнейший класс биополимеров. Каждый полипептид представляет собой цепочку из соединенных одна за другой аминокислот, количество которых может быть очень разным, от нескольких штук до нескольких сотен, а иногда их может быть даже больше тысячи. Короткие цепочки (менее сотни аминокислот) обычно называют не белками, а пептидами: разница здесь скорее количественная, чем качественная. В природе белки строятся в основном из двадцати разновидностей аминокислот. Полипептидные цепочки далее сворачиваются определенным образом, приобретая разнообразные пространственные конфигурации, превращаясь во что-то вроде деталек конструктора LEGO (рис. 2).
Каждый полипептид представляет собой цепочку из соединенных одна за другой аминокислот, количество которых может быть очень разным, от нескольких штук до нескольких сотен, а иногда их может быть даже больше тысячи. Короткие цепочки (менее сотни аминокислот) обычно называют не белками, а пептидами: разница здесь скорее количественная, чем качественная. В природе белки строятся в основном из двадцати разновидностей аминокислот. Полипептидные цепочки далее сворачиваются определенным образом, приобретая разнообразные пространственные конфигурации, превращаясь во что-то вроде деталек конструктора LEGO (рис. 2).
Важность белков для живой природы невозможно переоценить. Во-первых, белки — это строительные блоки, из которых выстроены и сами живые клетки, и остов межклеточного вещества, к которому клетки прикрепляются. Можно наглядно убедиться, что если взять, к примеру, сердце и удалить из него все клетки (эта процедура называется децеллюляризацией), то белковый остов, который при этом останется, полностью сохранит форму полноценного органа (см. картинку дня «Децеллюляризованное сердце»).
картинку дня «Децеллюляризованное сердце»).
Во-вторых, значительная часть белков — ферменты, то есть они являются биологическими катализаторами, которые имеют ряд важных отличительных свойств и преимуществ по сравнению с обычными химическими катализаторами небелковой природы. А именно — необычайно высокую эффективность, специфичность к конкретному типу субстрата и регулируемость: фермент под воздействием определенных внешних факторов или посредством взаимодействия с ним другого белка может переходить из активной формы в неактивную, и наоборот.
В-третьих, некоторые белки — антитела — служат в качестве нанооружия против вражеских агентов (бактерий, вирусов или токсинов), попадающих в организм из внешней среды, выполняя, таким образом, защитную функцию. Это обеспечивается благодаря способности антител прочно связываться с самыми разными молекулами-антигенами.
А еще есть белки-рецепторы, позволяющие живым клеткам воспринимать сигналы (химические или физические) из внешней среды, а также белки-регуляторы, которые управляют реакциями клеток на полученные сигналы, в частности, осуществляя активацию или инактивацию определенных ферментов (белкам-рецепторам и регуляторам посвящена другая нобелевская премия этого года — по физиологии и медицине, см. новость Нобелевская премия по физиологии и медицине — 2018, «Элементы», 04.10.2018).
новость Нобелевская премия по физиологии и медицине — 2018, «Элементы», 04.10.2018).
Нет ничего удивительного в том, что люди видят перспективы в приручении этих замечательных молекул для решения широкого круга задач, выходящих за рамки сугубо естественных процессов. Мы хотели бы создавать новые виды катализаторов, не изобретенных самой природой, а также белки и пептиды, которые бы эффективно связывали любой вид молекул, который нас интересует.
Чтобы получать новые белки с заданными свойствами, их, по идее, нужно сначала изобрести. Свойства белков зависят от пространственной конформации белковой молекулы, а также от распределения в молекуле электрических зарядов. Эти характеристики, в свою очередь, определяются свойствами аминокислот, из которых построен белок. Причем важно не только, какие аминокислоты и в каком количестве входят в цепочку, но и в каком порядке они расположены. Теоретически, зная свойства аминокислот и строение полипептидной цепочки, можно было бы предсказывать конфигурацию и химические свойства конечного белка. А раз так, то почему бы не изобретать белки под свои цели точно так же, как инженеры изобретают всевозможные технические устройства — от шариковых ручек до компьютеров? Увы, не все так просто. Дело в том, что зачастую для одной и той же цепочки аминокислот существует несколько возможных устойчивых конфигураций, а кроме того, в момент взаимодействия с другими молекулами в реакционной смеси конфигурация может меняться из-за перераспределения зарядов в молекуле. Все это крайне затрудняет возможности «рационального дизайна» новых необходимых белков и пептидов.
А раз так, то почему бы не изобретать белки под свои цели точно так же, как инженеры изобретают всевозможные технические устройства — от шариковых ручек до компьютеров? Увы, не все так просто. Дело в том, что зачастую для одной и той же цепочки аминокислот существует несколько возможных устойчивых конфигураций, а кроме того, в момент взаимодействия с другими молекулами в реакционной смеси конфигурация может меняться из-за перераспределения зарядов в молекуле. Все это крайне затрудняет возможности «рационального дизайна» новых необходимых белков и пептидов.
Выход из этого затруднения есть, и он изобретен миллиарды лет назад самой природой — это метод проб и ошибок: генерирование случайного разнообразия с последующим отбором продуктов, обладающих нужными свойствами. Это и есть, по сути, «метод» природной эволюции белков, и именно за приручение принципа дарвиновской эволюции в целях лабораторной белковой инженерии и была вручена в этом году нобелевская премия по химии.
Премия разделена на две части неспроста — подходы, которые использовала Фрэнсис Арнольд (Frances H. Arnold) для «направленной эволюции ферментов» существенно отличаются от подхода «фагового дисплея», разработанного Джорджем Смитом (George P. Smith) и адаптированного Грегом Уинтером (Sir Gregory P. Winter) для получения специфичных пептидов и антител. Поэтому мы тоже рассмотрим эти две части по отдельности.
Arnold) для «направленной эволюции ферментов» существенно отличаются от подхода «фагового дисплея», разработанного Джорджем Смитом (George P. Smith) и адаптированного Грегом Уинтером (Sir Gregory P. Winter) для получения специфичных пептидов и антител. Поэтому мы тоже рассмотрим эти две части по отдельности.
Фрэнсис Арнольд получила свой первый «неестественный» (non-natural) фермент в 1993 году (K. Chen, F. H. Arnold, 1993. Tuning the activity of an enzyme for unusual environments: sequential random mutagenesis of subtilisin E for catalysis in dimethylformamide). Тогда был получен новый вариант фермента субтилизина Е, который катализирует расщепление и образование пептидных связей (соединений между аминокислотами в пептидных цепочках), причем, благодаря методу направленной эволюции и внесению в исходно взятый природный белок 10 аминокислотных замен, удалось заставить фермент работать в органическом растворителе (60% диметилформамиде) и повысить термостабильность на 18 градусов. По техническим причинам достаточно часто возникает необходимость проводить некоторые реакции химического синтеза в органических растворителях при повышенных температурах, так что этот результат имеет большое значение для практической химии.
По техническим причинам достаточно часто возникает необходимость проводить некоторые реакции химического синтеза в органических растворителях при повышенных температурах, так что этот результат имеет большое значение для практической химии.
Работа прошла через следующие этапы: сначала был найден подходящий природный ген. Выбор гена, с которого следует начать, — вопрос не всегда простой. По словам самой Фрэнсис Арнольд, иногда это вопрос интуиции. Но общий принцип состоит в том, чтобы, по возможности, постараться найти белок, который проявляет способность катализировать нужную реакцию хотя бы в очень слабой степени. Выбранный ген встроили в плазмиду (кольцевую молекулу ДНК), чтобы его можно было размножать в бактериях — кишечных палочках — это достаточно стандартная процедура в генной инженерии (см. подробный рассказ об этом). Далее, при помощи полимеразной цепной реакции (ПЦР) в этот ген ввели четыре заранее спроектированных замены. На этом этапе ученые руководствовались расчетами, основанными на компьютерном моделировании. Эти замены должны были изменить в желаемом направлении форму активного центра фермента и обеспечить более эффективную его работу в требуемых условиях. Нужные замены ввели при помощи праймеров, содержащих замещенные нуклеотиды. Дальше дело за бактериями — в процессе роста и деления они размножают плазмиду и одновременно синтезируют белок, закодированный в этой плазмиде. После этого белок выделяют и тестируют на уровень ферментативной активности.
Эти замены должны были изменить в желаемом направлении форму активного центра фермента и обеспечить более эффективную его работу в требуемых условиях. Нужные замены ввели при помощи праймеров, содержащих замещенные нуклеотиды. Дальше дело за бактериями — в процессе роста и деления они размножают плазмиду и одновременно синтезируют белок, закодированный в этой плазмиде. После этого белок выделяют и тестируют на уровень ферментативной активности.
Активность оставалась все еще слишком низкой. Чтобы улучшить результат, на следующем этапе ген провели через три раунда «мутагенной ПЦР». В такой ПЦР мутации вводятся случайным образом благодаря специально подобранным условиям — таким, в которых фермент ДНК-полимераза совершает «ошибки» чаще обычного. После каждого раунда вводили гены в бактерий, выделяли фермент и проводили скрининг (массовую проверку) с целью поиска самого эффективно работающего варианта. В итоге в белке появилось еще шесть дополнительных замен, и, вуаля! — получен необходимый высоко эффективный фермент.
В дальнейшем Фрэнсис Арнольд, а также другие исследователи, взявшие на вооружение предложенный ею метод, получили еще множество полезных ферментов с необычными свойствами. Методика совершенствовалась: к методам генерирования случайных мутаций добавились методы, предусматривающие также случайный обмен участками между мутантными последовательностями. Либо, в качестве альтернативы, используется обмен участками между природными генами, составляющими большое генное семейство — за время эволюционной истории они уже естественным образом накопили множество мутаций, а комбинаторный подход может помочь на этой базе получить ферменты с новыми свойствами.
Так, очень плодотворными оказались работы по получению катализаторов для необычных химических реакций с семейством генов цитохрома P450. На рис. 4 приведен частичный список естественных и «неестественных» реакций, которые катализируются этой группой ферментов.
Общая схема направленной эволюции ферментов, в ее современном виде, показана на рис. 5.
5.
Таким образом, практический выход работы Фрэнсис Арнольд состоит в том, что посредством предложенного ею метода удается получать катализаторы для реакций, использующихся в фармацевтике и для синтеза искусственных материалов, которые либо не встречаются в природе (например, образование связи между атомом углерода и атомом кремния), либо должны осуществляться в аномальных условиях (в присутствии органических растворителей или химикатов, при высоких или низких температурах и т. д.). Но, кроме того, есть и фундаментальное значение: чем больше получают в лабораториях разных белков, химические и физические свойства которых впоследствии изучаются и сопоставляются, улучшая понимание физики биополимеров, тем выше становится предсказательная сила виртуальных моделей, предназначенных для целенаправленного дизайна нужных белков или для предсказания свойств пока неизученных природных белков.
Теперь поговорим о методе фагового дисплея. В первоначальной версии метод был разработан Джорджем Смитом в 1985 году.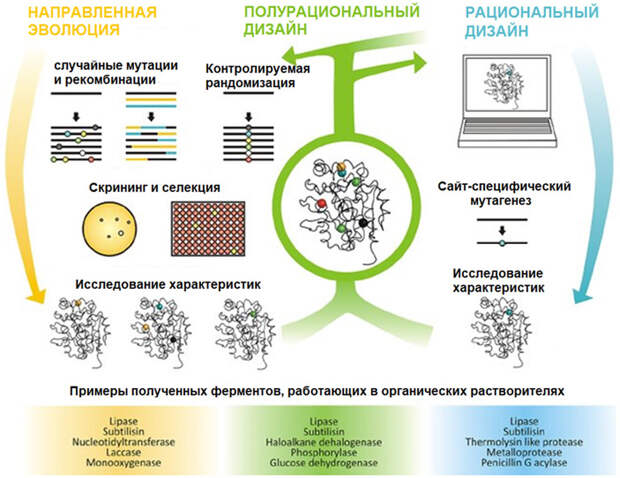 Метод основан на использовании бактериофага M13, который размножается в бактериях — кишечных палочках (E. coli). Фаг M13 хорош тем, что его капсид достаточно велик, чтобы вместить геном фага вместе со вставками, даже большими. Суть метода фагового дисплея состоит в том, что в геном бактериофага встраивается фрагмент, кодирующий какой-то интересующий нас пептид, либо целый белок, либо серия разнообразных фрагментов. В самом простом варианте это может быть набор совершенно случайных последовательностей. Встраивание производится в рамку считывания одного из генов, которые кодируют белки капсида (всего у M13 таких белков пять). В результате такого встраивания фрагмента на поверхности фаговых частиц оказываются выставлены (в связке с собственными белками фага) закодированные в данном фрагменте пептиды. Фаги размножаются в бактериях — и по мере размножения естественным образом с некоторой частотой приобретают мутации. В итоге, после извлечения фаговых частиц из зараженных бактерий (миллиарды частиц за один раунд), получаем набор разнообразных версий исходно встроенного фрагмента и кодируемого этим фрагментом пептида.
Метод основан на использовании бактериофага M13, который размножается в бактериях — кишечных палочках (E. coli). Фаг M13 хорош тем, что его капсид достаточно велик, чтобы вместить геном фага вместе со вставками, даже большими. Суть метода фагового дисплея состоит в том, что в геном бактериофага встраивается фрагмент, кодирующий какой-то интересующий нас пептид, либо целый белок, либо серия разнообразных фрагментов. В самом простом варианте это может быть набор совершенно случайных последовательностей. Встраивание производится в рамку считывания одного из генов, которые кодируют белки капсида (всего у M13 таких белков пять). В результате такого встраивания фрагмента на поверхности фаговых частиц оказываются выставлены (в связке с собственными белками фага) закодированные в данном фрагменте пептиды. Фаги размножаются в бактериях — и по мере размножения естественным образом с некоторой частотой приобретают мутации. В итоге, после извлечения фаговых частиц из зараженных бактерий (миллиарды частиц за один раунд), получаем набор разнообразных версий исходно встроенного фрагмента и кодируемого этим фрагментом пептида. Все эти версии будут представлены на поверхности фагов — это и есть «фаговый дисплей». Так мы получаем первичную библиотеку фаговых частиц.
Все эти версии будут представлены на поверхности фагов — это и есть «фаговый дисплей». Так мы получаем первичную библиотеку фаговых частиц.
Фаговые частицы далее можно отобрать по способности связываться с нужными молекулами, а затем те частицы, которые прошли отбор, потому что связываются лучше других, можно снова использовать для заражения бактерий. Отбор проводится при помощи целлюлозных фильтров или магнитных бус, на которых закреплены нужные молекулы (получить представление о том, как происходит сбор нужных молекул на магнитные бусы можно, посмотрев небольшое видео). «Правильные» фаги останутся на носителе, а «неправильные» будут безжалостно смыты. Практика применения фагового дисплея показывает, что достаточно лишь пяти раундов, чтобы получить пептиды с очень высокой эффективностью связывания. Затем образцы ДНК, выделенной из фага, секвенируют, а на основе полученной селектированной последовательности исследователь может составлять генетические конструкции, которые дадут возможность получать необходимые белки в требуемых количествах в любом подходящем объекте — к примеру, в тех же кишечных палочках или дрожжах. Этот метод Грег Уинтер, другой лауреат премии, адаптировал для получения антител к определенным антигенам. Схема, которую он использовал, показана на рис. 6.
Этот метод Грег Уинтер, другой лауреат премии, адаптировал для получения антител к определенным антигенам. Схема, которую он использовал, показана на рис. 6.
Существенным плюсом метода Уинтера является в первую очередь уход от необходимости использования иммунизированных животных для получения антител и гибридом (гибридов лимфоцитов и раковых клеток) для их массовой наработки. Фаговый дисплей — более быстрая, дешевая и гуманная методика. Кроме того, этот метод позволяет получать чисто человеческие антитела, что важно, если антитела используются в качестве лекарства — ведь антитела от животных, введенные в организм человека, сами по себе вызвали бы у человека сильный иммунный ответ.
Если требуется получить не только эффективное, но и специфичное связывание, то не составит труда включить в общую схему этап отбора против неселективно взаимодействующих частиц. В настоящее время фаговый дисплей используется отнюдь не только в небольших лабораториях, но и в массовом производстве лекарств и реактивов на основе антител (а информация о пептидах, связывающих разные антигены, собирается в общедоступную базу данных BDB). Вот лишь некоторые сферы их применения: обнаружение антигенов в исследуемых образцах (в частности, в целях диагностики), приготовление вакцин, противоопухолевые антитела, антитела для подавления аутоиммунных реакций, антитоксины, направленная доставка лекарств к больным тканям (включая раковые опухоли). В последнее десятилетие эту технологию научились применять и для более эффективной эволюции и отбора белков с ферментативной активностью.
Вот лишь некоторые сферы их применения: обнаружение антигенов в исследуемых образцах (в частности, в целях диагностики), приготовление вакцин, противоопухолевые антитела, антитела для подавления аутоиммунных реакций, антитоксины, направленная доставка лекарств к больным тканям (включая раковые опухоли). В последнее десятилетие эту технологию научились применять и для более эффективной эволюции и отбора белков с ферментативной активностью.
В заключение следует сказать, что мы находимся отнюдь не в конце пути, а лишь в его начале (как обычно). Необходимость применения метода случайного поиска говорит нам о том, как мало мы еще знаем и насколько слабы наши предсказательные возможности. Но по мере того, как накапливаются знания, приобретенные методом проб и ошибок, мы все же двигаемся в сторону повышения разрешения картинки, по которой мы судим об окружающем мире.
Татьяна Романовская
Нобелевскую премию по химии присудили за направленную эволюцию ферментов, пептидов и антител
Нобелевская премия по химии в 2018 году присуждена Фрэнсис Арнольд (Frances H. Arnold) за направленную эволюцию ферментов, а также Джорджу Смиту (George P. Smith) и сэру Грегори Винтеру (Sir Gregory P. Winter) за фаговый дисплей пептидов и антител. За прямой трансляцией церемонии объявления лауреатов вы можете следить на официальном сайте Нобелевской премии. Подробнее с заслугами ученых, удостоенных премии в этом году, можно ознакомиться в официальном пресс-релизе Нобелевского комитета.
Arnold) за направленную эволюцию ферментов, а также Джорджу Смиту (George P. Smith) и сэру Грегори Винтеру (Sir Gregory P. Winter) за фаговый дисплей пептидов и антител. За прямой трансляцией церемонии объявления лауреатов вы можете следить на официальном сайте Нобелевской премии. Подробнее с заслугами ученых, удостоенных премии в этом году, можно ознакомиться в официальном пресс-релизе Нобелевского комитета.
BREAKING NEWS:
The Royal Swedish Academy of Sciences has decided to award the #NobelPrize in Chemistry 2018 with one half to Frances H. Arnold and the other half jointly to George P. Smith and Sir Gregory P. Winter. pic.twitter.com/lLGivVLttB
Половина премии достанется Фрэнсис Арнольд, другая половина будет поровну поделена между Джорджем Смитом и Грегори Винтером. «Этим исследователям удалось — с разным вкладом — предложить новые методы комбинаторной химии и биологии для получения биокатализаторов, ферментов и антител с новыми свойствами. Их работы были начаты где-то в 1980-е, и они легли в основу методов получения большого количества различных искусственных ферментов, а также ферментов и антител с измененными свойствами. Эта премия по химии, но она, конечно, имеет обширные биотехнологические и медицинские приложения, например, для лечения онкологических и аутоиммунных заболеваний. Эти предложения будут революционно менять облик терапевтических препаратов следующего десятилетия. К счастью, и в России эти работы тоже проводились на достаточно высоком уровне», — сказал N + 1 Александр Габибов, исполняющий обязанности директора Института биоорганической химии имени Шемякина и Овчинникова РАН.
Эта премия по химии, но она, конечно, имеет обширные биотехнологические и медицинские приложения, например, для лечения онкологических и аутоиммунных заболеваний. Эти предложения будут революционно менять облик терапевтических препаратов следующего десятилетия. К счастью, и в России эти работы тоже проводились на достаточно высоком уровне», — сказал N + 1 Александр Габибов, исполняющий обязанности директора Института биоорганической химии имени Шемякина и Овчинникова РАН.
При направленной эволюции ферментов в последовательность гена, кодирующего синтез этого белка, случайным образом вносят мутации, после чего выбирают белок с нужными свойствами, например с увеличенной активностью. Впервые подобный синтез в 1993 году провела Фрэнсис Арнольд. Сейчас с помощью него можно получать большое количество различных ферментов, которые используются как в биотопливе, так и при производстве лекарственных препаратов.
Фаговый дисплей — лабораторный метод изучения взаимодействий белков с другими белками, пептидными последовательностями и ДНК, который основан на использовании бактериофагов — вирусов, которые заражают бактерию — для соотнесения белков и генетической информации, кодирующей их. Джордж Смит впервые описал этот метод в 1985 году, показав, что изменение в одном из генов бактериофага «отображается» в структуре белков, расположенных на поверхности вируса. Позже Грегори Винтер продемонстрировал, что такой метод можно использовать для производства новых лекарств, например антител, способных нейтрализовать токсические вещества, противостоять аутоиммунным заболеваниям и раку.
Джордж Смит впервые описал этот метод в 1985 году, показав, что изменение в одном из генов бактериофага «отображается» в структуре белков, расположенных на поверхности вируса. Позже Грегори Винтер продемонстрировал, что такой метод можно использовать для производства новых лекарств, например антител, способных нейтрализовать токсические вещества, противостоять аутоиммунным заболеваниям и раку.
«Фаговый дисплей — это самый быстрый способ получения антител, способных специфично связываться с раковыми клетками. Например, если вы хотите увеличить эффективность какого-то антитела в тысячу раз, вы берете его ген и вставляете в вирус так, чтобы нужный белок оказался на поверхности. После этого методом случайной эволюции можно создать библиотеку вирусов и проверять работу антитела во все более и более сложных условиях, выбирая те вирусные частицы, которые оказались лучшими. В результате можно получить последовательность, которой нет в природе, но имеющую нужные нам свойства», — пояснил Константин Северинов, профессор Сколтеха и университета Ратгерса.
По предварительным прогнозам Clarivate Analytics, основанным на данных о цитировании статей ученых, наиболее вероятными кандидатами на получение премии в этом году считались Эрик Якобсен, Джордж Шелдрик и Джоанн Стабб. Первый из этих ученых внес значительный вклад в развитие каталитических реакций органического синтеза, в частности реакции эпоксидирования, которая сейчас носит его имя. Шелдрик создал и поддерживает систему компьютерных программ SHELX, используемую в структурной кристаллографии. А Стабб описала механизм работы ферментов из класса рибонуклеотидредуктаз, которые превращают рибонуклеотиды в дезоксирибонуклеотиды и играют играют фундаментальную роль в синтезе и починке ДНК.
Ранее были объявлены Нобелевские лауреаты этого года в других областях. Премии по медицине были удостоены Джеймс Эллисон (James Allison) и Тасуку Хондзё (Tasuku Honjo) за разработки в области терапии рака путем активации иммунного ответа. Подробнее об их работах вы можете прочитать в нашем материале «Спустить собак с цепи». Лауреатами премии по физике стали Артур Эшкин (Arthur Ashkin) за разработку оптического пинцета и его применение в области биологии, а также Жерар Муру (Gerard Mourou) и Донна Стрикленд (Donna Strickland) — за разработку метода генерации высокоинтенсивных ультракоротких оптических импульсов. О том, как работают эти лазерные системы и где они используются, можно узнать в материале «Скальпель и пинцет». Вручение Нобелевских медалей состоится 10 декабря в Стокгольме на традиционной официальной церемонии.
Лауреатами премии по физике стали Артур Эшкин (Arthur Ashkin) за разработку оптического пинцета и его применение в области биологии, а также Жерар Муру (Gerard Mourou) и Донна Стрикленд (Donna Strickland) — за разработку метода генерации высокоинтенсивных ультракоротких оптических импульсов. О том, как работают эти лазерные системы и где они используются, можно узнать в материале «Скальпель и пинцет». Вручение Нобелевских медалей состоится 10 декабря в Стокгольме на традиционной официальной церемонии.
Напомним, что в 2017 году Нобелевской премии по химии были удостоены Жак Дюбоше (Jacques Dubochet), Иоахим Франк (Joachim Frank) и Ричард Хендерсон (Richard Henderson) с формулировкой «за развитие криоэлектронной микроскопии высокого разрешения для определения структуры биомолекул в растворах». Криоэлектронная микроскопия позволяет определить структуру белков и макромолекулярных комплексов с разрешением, близким к атомарному, без необходимости их кристаллизации. О принципах работы и важности метода можно прочитать в нашем материале «Тени во льду»..jpg?v1664795819)
Лауреатами премии в 2016 году стали Жан-Пьер Соваж (Jean-Pierre Sauvage), сэр Фрейзер Стоддарт (Sir J. Fraser Stoddart) и Бернард Феринга (Bernard L. Feringa) «за проектирование и синтез молекулярных машин». Молекулярные машины — это молекулы, или комплексы из нескольких молекул, способные к простейшим механическим действиям. Подробно о том, как создаются и используются такие объекты можно прочитать в материале «Машина из пробирки».
Александр Дубов
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Пресс-релиз: Нобелевская премия по химии 2018
Фрэнсис Х. Арнольд
Джордж П. Смит
Сэр Грегори П. Винтер
Английский
Английский (pdf)
Шведский
Шведский (pdf)
3 октября 2018 г.
Шведская королевская академия наук приняла решение присудить Нобелевскую премию по химии за 2018 год
с половиной до
Фрэнсис Х. Арнольд
Арнольд
Калифорнийский технологический институт, Пасадена, США
«для направленного выделения ферментов»
и другая половина совместно с
Джордж П. Смит
Университет Миссури, Колумбия, США
и
Сэр Грегори П. Винтер
Лаборатория молекулярной биологии MRC, Кембридж, Великобритания
«для фагового дисплея пептидов и антител»
Сила эволюции раскрывается в многообразии жизни. Нобелевские лауреаты по химии 2018 года взяли под свой контроль эволюцию и использовали ее в целях, приносящих наибольшую пользу человечеству. Ферменты, полученные путем направленной эволюции, используются для производства всего, от биотоплива до фармацевтических препаратов. Антитела, полученные с помощью метода, называемого фаговым дисплеем, могут бороться с аутоиммунными заболеваниями и в некоторых случаях излечивать метастатический рак.
С тех пор, как около 3,7 миллиарда лет назад появились первые семена жизни, почти каждая трещина на Земле была заполнена различными организмами. Жизнь распространилась на горячие источники, глубокие океаны и сухие пустыни, и все потому, что эволюция решила ряд химических проблем. Химические инструменты жизни — белки — были оптимизированы, изменены и обновлены, создавая невероятное разнообразие.
Жизнь распространилась на горячие источники, глубокие океаны и сухие пустыни, и все потому, что эволюция решила ряд химических проблем. Химические инструменты жизни — белки — были оптимизированы, изменены и обновлены, создавая невероятное разнообразие.
Лауреаты Нобелевской премии по химии этого года были вдохновлены силой эволюции и использовали те же принципы — генетические изменения и отбор — для разработки белков, решающих химические проблемы человечества.
Половина Нобелевской премии по химии этого года присуждена Фрэнсис Х. Арнольд . В 1993 году она провела первую направленную эволюцию ферментов, представляющих собой белки, катализирующие химические реакции. С тех пор она усовершенствовала методы, которые теперь обычно используются для разработки новых катализаторов. Использование ферментов Фрэнсис Арнольд включает более экологически безопасное производство химических веществ, таких как фармацевтические препараты, и производство возобновляемых видов топлива для более экологичного транспортного сектора.
Вторую половину Нобелевской премии по химии в этом году разделят Джордж П. Смит и сэр Грегори П. Винтер . В 1985 году Джордж Смит разработал элегантный метод, известный как фаговый дисплей, в котором бактериофаг — вирус, поражающий бактерии, — может использоваться для выделения новых белков. Грегори Винтер использовал фаговый дисплей для направленной эволюции антител с целью производства новых фармацевтических препаратов. Первый препарат, основанный на этом методе, адалимумаб, был одобрен в 2002 г. и применяется при ревматоидном артрите, псориазе и воспалительных заболеваниях кишечника. С тех пор фаговый дисплей производит антитела, которые могут нейтрализовать токсины, противодействовать аутоиммунным заболеваниям и излечивать метастатический рак.
Мы находимся в начале революции направленной эволюции, которая во многих отношениях приносит и будет приносить величайшую пользу человечеству.
Иллюстрации
Иллюстрации можно использовать бесплатно в некоммерческих целях. Атрибут ”© Йохан Ярнестад/Шведская королевская академия наук”
Атрибут ”© Йохан Ярнестад/Шведская королевская академия наук”
(R)evolution (pdf)
Эволюция ферментов (pdf)
Фаговый дисплей (pdf)
Эволюция антител (pdf)
Подробнее о премии этого года
Популярная информация
Pdf 550 kB
Научное обоснование
Pdf 1073 Kb
Фрэнсис Х. Арнольд , родилась в 1956 году в Питтсбурге, США. Кандидат наук. 1985 г., Калифорнийский университет, Беркли, США. Лайнус Полинг Профессор химического машиностроения, биоинженерии и биохимии Калифорнийского технологического института, Пасадена, США.
http://fhalab.caltech.edu
Джордж П. Смит , родился в 1941 году в Норуолке, США. Кандидат наук. 1970, Гарвардский университет, Кембридж, США. Кураторы – заслуженный профессор биологических наук Университета Миссури, Колумбия, США.
http://biology.missouri.edu/people/?person=94
Сэр Грегори П. Винтер , родился в 1951 году в Лестере, Великобритания. Кандидат наук. 1976. Кембриджский университет, Великобритания. Почетный руководитель исследования, Лаборатория молекулярной биологии MRC, Кембридж, Великобритания.
Кандидат наук. 1976. Кембриджский университет, Великобритания. Почетный руководитель исследования, Лаборатория молекулярной биологии MRC, Кембридж, Великобритания.
www2.mrc-lmb.cam.ac.uk/group-leaders/emeritus/greg-winter/
Сумма приза: 9 миллионов шведских крон, половина из которых принадлежит Фрэнсис Арнольд, а другая половина делится между Джорджем Смитом и Грегори Винтером.
Дополнительная информация: www.kva.se и http://www.nobelprize.org
Контакт для прессы : Кайса Ваагхалс, пресс-атташе, +46 70 878 67 63, [email protected]
Эксперт: Сара Сногеруп Линс, член Нобелевского комитета по химии, +46 70 250 77 66, [email защищен]
Шведская королевская академия наук, основанная в 1739 г., является независимой организацией, общей целью которой является продвижение наук и укрепление их влияния в обществе. Академия берет на себя особую ответственность за естественные науки и математику, но стремится способствовать обмену идеями между различными дисциплинами.
Nobel Prize® является зарегистрированным товарным знаком Нобелевского фонда.
Чтобы процитировать этот раздел
стиль MLA: Пресс-релиз. Нобелевская премия.org. Nobel Prize Outreach AB 2022. Вс. 18 декабря 2022 г.
Наверх
Back To TopВозвращает пользователей к началу страницы
Смотрите трансляции с Нобелевской недели
Смотрите лекции о вручении Нобелевской премии 2022 года, Нобелевский концерт, Диалог Нобелевской недели, церемонии вручения премии в Осло и Стокгольме и Форум Нобелевской премии мира здесь, на nobelprize.org.
Выберите категорию или категории, по которым вы хотите отфильтровать
Физика
Химия
Медицина
Литература
Мир
Экономические науки
Выберите категорию или категории, которые вы хотите отфильтровать по
Физика
Химия
Медицина
Литература
Мир
Экономические науки
Уменьшить год на один
Выберите год, в котором вы хотите искать
Увеличить год на один
Нобелевская премия по химии 2018 г.
 — Популярная информация
— Популярная информация
Фрэнсис Х. Арнольд
Джордж П. Смит
Сэр Грегори П. Винтер
Научно-популярный фон:
(р)эволюция в химии (pdf)
Информация о Populärvetenskaplig:
En (r)evolution inom kemin (pdf)
(р)эволюция в химии
Сила эволюции раскрывается в многообразии жизни. Нобелевская премия по химии 2018 года присуждена Фрэнсис Х. Арнольд, Джорджу П. Смиту и сэру Грегори П. Винтеру за то, как они взяли под контроль эволюцию и использовали ее на благо человечества. Ферменты, разработанные путем направленной эволюции, теперь используются, среди прочего, для производства биотоплива и фармацевтических препаратов. Антитела, полученные с помощью метода, называемого фаговым дисплеем, могут бороться с аутоиммунными заболеваниями и, в некоторых случаях, излечивать метастатический рак.
Мы живем на планете, где утвердилась мощная сила: эволюция. С тех пор, как около 3,7 миллиарда лет назад появились первые семена жизни, почти каждая трещина на Земле была заполнена организмами, приспособленными к окружающей среде: лишайниками, которые могут жить на голых склонах гор, археями, которые процветают в горячих источниках, чешуйчатыми рептилиями, приспособленными для сухих пустынь и медузы, которые светятся в темноте океанских глубин.
В школе мы изучаем эти организмы по биологии, но давайте изменим угол зрения и наденем очки химика. Жизнь на Земле существует потому, что эволюция решила множество сложных химических проблем. Все организмы способны извлекать материалы и энергию из своей собственной экологической ниши и использовать их для создания уникального химического творения, которое они составляют. Рыбы могут плавать в полярных океанах благодаря белкам-антифризам в их крови, а мидии могут прилипать к камням, потому что они разработали подводный молекулярный клей, и это лишь некоторые из бесчисленных примеров.
Великолепие химии жизни заключается в том, что она запрограммирована в наших генах, что позволяет ей передаваться по наследству и развиваться. Небольшие случайные изменения в генах меняют эту химию. Иногда это приводит к ослаблению организма, иногда к более крепкому. Постепенно развивалась новая химия, и жизнь на Земле становилась все более сложной.
Рис. 1. Лауреаты Нобелевской премии по химии 2018 г. использовали эволюцию и усовершенствовали ее в своих лабораториях.
Этот процесс зашел так далеко, что дал начало трем настолько сложным индивидуумам, что им удалось самостоятельно справиться с эволюцией. Нобелевская премия по химии 2018 года присуждена Фрэнсис Х. Арнольд, Джорджу П. Смиту и сэру Грегори П. Винтеру за то, что они произвели революцию как в химии, так и в разработке новых фармацевтических препаратов посредством направленной эволюции. Начнем со звезды ферментной инженерии: Фрэнсис Арнольд.
Ферменты – самые острые химические орудия жизни
Даже в 1979 году, когда Фрэнсис Арнольд только что получила диплом инженера-механика и аэрокосмонавта, у нее была четкая цель: приносить пользу человечеству путем разработки новых технологий. США решили, что к 2000 году 20% электроэнергии будут поступать из возобновляемых источников, и они работали с солнечной энергией. Однако перспективы будущего этой отрасли радикально изменились после президентских выборов 1981 года, поэтому вместо этого она обратила свой взор на новую технологию ДНК. Как она выразилась сама: «Было ясно, что совершенно новый способ производства материалов и химикатов, которые нам нужны в нашей повседневной жизни, станет возможным благодаря способности переписать код жизни».
США решили, что к 2000 году 20% электроэнергии будут поступать из возобновляемых источников, и они работали с солнечной энергией. Однако перспективы будущего этой отрасли радикально изменились после президентских выборов 1981 года, поэтому вместо этого она обратила свой взор на новую технологию ДНК. Как она выразилась сама: «Было ясно, что совершенно новый способ производства материалов и химикатов, которые нам нужны в нашей повседневной жизни, станет возможным благодаря способности переписать код жизни».
Вместо того, чтобы производить фармацевтические препараты, пластмассы и другие химические вещества с использованием традиционной химии, для которой часто требуются сильные растворители, тяжелые металлы и едкие кислоты, ее идея состояла в том, чтобы использовать химические инструменты жизни: ферменты. Они катализируют химические реакции, происходящие в организмах Земли, и если бы она научилась создавать новые ферменты, она могла бы коренным образом изменить химию.
Человеческая мысль имеет ограничения
Первоначально, как и многие другие исследователи в конце XIX в. В 80-х годах Фрэнсис Арнольд попыталась использовать рациональный подход к перестройке ферментов, чтобы придать им новые свойства, но ферменты представляют собой чрезвычайно сложные молекулы. Они построены из 20 различных видов строительных блоков — аминокислот, которые можно комбинировать бесконечно. Один фермент может состоять из нескольких тысяч аминокислот. Они связаны между собой длинными цепочками, которые складываются в специальные трехмерные структуры. Внутри этих структур создается среда, необходимая для катализа той или иной химической реакции.
В 80-х годах Фрэнсис Арнольд попыталась использовать рациональный подход к перестройке ферментов, чтобы придать им новые свойства, но ферменты представляют собой чрезвычайно сложные молекулы. Они построены из 20 различных видов строительных блоков — аминокислот, которые можно комбинировать бесконечно. Один фермент может состоять из нескольких тысяч аминокислот. Они связаны между собой длинными цепочками, которые складываются в специальные трехмерные структуры. Внутри этих структур создается среда, необходимая для катализа той или иной химической реакции.
Используя логику, чтобы попытаться понять, как эту сложную архитектуру следует реконструировать, чтобы придать ферменту новые свойства, сложно, даже при современных знаниях и мощности компьютеров. В начале 1990-х, смирившись перед превосходством природы, Фрэнсис Арнольд решила отказаться от этого, по ее словам, «несколько высокомерного подхода» и вместо этого нашла вдохновение в собственном методе природы для оптимизации химии: эволюции.
Арнольд начинает играть с эволюцией
В течение нескольких лет она пыталась изменить фермент под названием субтилизин, чтобы он не катализировал химические реакции в растворе на водной основе, а работал в органическом растворителе, диметилформамиде (ДМФ). Теперь она создала случайные изменения — мутации — в генетическом коде фермента, а затем ввела эти мутировавшие гены в бактерии, производящие тысячи различных вариантов субтилизина.
После этого задача состояла в том, чтобы выяснить, какой из всех этих вариантов лучше всего работает в органическом растворителе. В эволюции мы говорим о выживании наиболее приспособленных; в направленной эволюции этот этап называется отбором.
Фрэнсис Арнольд использовала тот факт, что субтилизин расщепляет молочный белок, казеин. Затем она выбрала вариант субтилизина, наиболее эффективно расщепляющий казеин в растворе с 35% ДМФ. Впоследствии она ввела новый цикл случайных мутаций в этот субтилизин, в результате чего был получен вариант, еще лучше работавший в ДМФА.
В третьем поколении субтилизина она обнаружила вариант, который работал в ДМФА в 256 раз лучше, чем исходный фермент. Этот вариант фермента сочетал в себе десять различных мутаций, преимущества которых никто не мог заранее выяснить.
Этим Фрэнсис Арнольд продемонстрировала способность случайности и направленного отбора, а не исключительно человеческой рациональности, управлять развитием новых ферментов. Это был первый и самый решительный шаг к той революции, которую мы сейчас наблюдаем.
Следующий важный шаг был сделан Виллемом П. К. Стеммером, голландским исследователем и предпринимателем, который умер в 2013 году. Он представил еще одно измерение направленной эволюции ферментов: спаривание в пробирке.
Рис. 2. Основной принцип направленной эволюции ферментов. После нескольких циклов направленной эволюции фермент может стать в несколько тысяч раз более эффективным.
Сопряжение – для более стабильной эволюции
Одной из предпосылок естественной эволюции является то, что гены разных особей смешиваются, например, в результате спаривания или опыления. Затем можно объединить полезные свойства и получить более крепкий организм. В то же время менее функциональные генные мутации могут исчезать из поколения в поколение.
Затем можно объединить полезные свойства и получить более крепкий организм. В то же время менее функциональные генные мутации могут исчезать из поколения в поколение.
Виллем Стеммер использовал пробирку, эквивалентную спариванию: перетасовке ДНК. В 1994 году он продемонстрировал, что можно разрезать разные версии гена на мелкие кусочки, а затем с помощью инструментов ДНК-технологии собрать из кусочков полный ген, представляющий собой мозаику исходных версий.
Используя несколько циклов перетасовки ДНК, Виллем Стеммер изменил фермент так, что он стал намного эффективнее исходного фермента. Это показало, что скрещивание генов вместе — исследователи называют это рекомбинацией — может привести к еще более эффективной эволюции ферментов.
Новые ферменты производят устойчивое биотопливо
Инструменты ДНК-технологии совершенствовались с начала 1990-х годов, и количество методов, используемых в направленной эволюции, увеличилось. Фрэнсис Арнольд была в авангарде этих разработок; ферменты, производимые сейчас в ее лаборатории, могут катализировать химию, которой даже не существует в природе, производя совершенно новые материалы. Ее адаптированные ферменты также стали важными инструментами в производстве различных веществ, таких как фармацевтические препараты. Химические реакции ускоряются, образуется меньше побочных продуктов, а в некоторых случаях стало возможным исключить тяжелые металлы, необходимые для традиционной химии, что значительно снижает воздействие на окружающую среду.
Ее адаптированные ферменты также стали важными инструментами в производстве различных веществ, таких как фармацевтические препараты. Химические реакции ускоряются, образуется меньше побочных продуктов, а в некоторых случаях стало возможным исключить тяжелые металлы, необходимые для традиционной химии, что значительно снижает воздействие на окружающую среду.
Вещи также прошли полный круг: Фрэнсис Арнольд снова работает с производством возобновляемой энергии. Ее исследовательская группа разработала ферменты, которые превращают простые сахара в изобутанол, богатое энергией вещество, которое можно использовать для производства как биотоплива, так и экологически чистых пластиков. Одной из долгосрочных целей является производство топлива для более экологически чистого транспортного сектора. Альтернативное топливо, производимое белками Арнольда, можно использовать в автомобилях и самолетах. Таким образом, ее ферменты вносят свой вклад в более зеленый мир.
А теперь перейдем ко второй половине Нобелевской премии по химии 2018 года, когда направленная эволюция вместо этого привела к фармацевтическим препаратам, которые могут нейтрализовать токсины, бороться с прогрессированием аутоиммунных заболеваний и, в некоторых случаях, даже излечивать метастатический рак. Именно здесь жизненно важную роль играют крошечный вирус, заражающий бактерии, и метод, известный как фаговый дисплей.
Именно здесь жизненно важную роль играют крошечный вирус, заражающий бактерии, и метод, известный как фаговый дисплей.
Смит использует бактериофаги
Как это часто бывает, наука пошла по непредсказуемому пути. В первой половине 19 в.В 80-х годах Джордж Смит начал использовать бактериофаги — вирусы, поражающие бактерии — в основном в надежде, что их можно будет использовать для клонирования генов. Технология ДНК была еще молода, а геном человека был подобен неизведанному континенту. Исследователи знали, что он содержит все гены, необходимые для производства белков в организме, но определить конкретный ген для конкретного белка было сложнее, чем искать иголку в стоге сена.
Тем не менее, ученый, который нашел его, получил огромную пользу. Используя новые генетические инструменты того времени, ген можно было вставить в бактерии, которые, если повезет, могли массово производить исследуемый белок. Весь этот процесс назывался клонированием генов, и идея Джорджа Смита заключалась в том, что исследователи, ищущие гены, могут изобретательно использовать бактериофаги.
Бактериофаги – связующее звено между белком и его неизвестным геном
Бактериофаги просты по своей природе. Они состоят из небольшого фрагмента генетического материала, инкапсулированного в защитные белки. Когда они размножаются, они вводят свой генетический материал в бактерии и захватывают их метаболизм. Затем бактерии производят новые копии генетического материала фага и белков, образующих капсулу, из которых формируются новые фаги.
Идея Джорджа Смита заключалась в том, что исследователи должны иметь возможность использовать простую конструкцию фагов, чтобы найти неизвестный ген для известного белка. В то время были доступны большие молекулярные библиотеки, содержащие массу фрагментов различных неизвестных генов. Его идея заключалась в том, что эти неизвестные фрагменты гена можно соединить с геном одного из белков фаговой капсулы.
При получении новых фагов белки неизвестного гена оказывались на поверхности фага как часть белка капсулы (рис. 3).
Рисунок 3. Фаговый дисплей — Джордж Смит разработал этот метод для поиска неизвестных генов для известного белка
Антитела могут выуживать нужный белок
В результате получится смесь фагов, несущих на своей поверхности множество различных белков. На следующем этапе, как постулировал Джордж Смит, исследователи смогут использовать антитела к рыбным фагам, несущим различные известные белки из этого супа. Антитела — это белки, которые действуют как ракеты-мишени; они могут идентифицировать и связываться с одним белком среди десятков тысяч других с предельной точностью. Если бы исследователи поймали что-то в фаговом бульоне, используя антитело, которое, как им было известно, присоединено к известному белку, в качестве прилова они получили бы до сих пор неизвестный ген этого белка.
Это была элегантная идея, и в 1985 году Джордж Смит продемонстрировал, что она может работать. Он создал фаг, несущий на своей поверхности часть белка, пептида. Затем, используя антитело, он смог выловить фаг, который он сконструировал из супа из множества фагов.
Благодаря этому эксперименту Джордж Смит заложил основу того, что стало известно как фаговый дисплей. Метод гениален своей простотой. Его сила в том, что фаг действует как связующее звено между белком и его геном. Однако главный прорыв этого метода произошел не в области клонирования генов; вместо этого примерно в 1990, несколько исследовательских групп начали использовать фаговый дисплей для разработки новых биомолекул. Одним из тех, кто принял эту технику, был Грегори (Грег) Винтер, и именно благодаря его исследованиям фаговый дисплей теперь приносит человечеству огромную пользу. Чтобы понять почему, нам нужно поближе взглянуть на антитела.
Антитела могут блокировать патологические процессы
В лимфатической системе человека есть клетки, которые могут производить сотни тысяч различных типов антител. Используя хорошо разработанную систему, все эти клетки были протестированы таким образом, чтобы ни одно антитело не прикреплялось ни к одному из различных типов молекул организма. Однако это огромное разнообразие гарантирует, что всегда есть антитело, которое прикрепляется к вирусам или бактериям, которые нас заражают. Когда к ним прикрепляется антитело, оно посылает сигнал агрессивным иммунным клеткам уничтожить захватчиков.
Однако это огромное разнообразие гарантирует, что всегда есть антитело, которое прикрепляется к вирусам или бактериям, которые нас заражают. Когда к ним прикрепляется антитело, оно посылает сигнал агрессивным иммунным клеткам уничтожить захватчиков.
Поскольку антитела обладают высокой избирательностью и могут прикрепляться к одной молекуле среди десятков тысяч других, исследователи давно надеялись, что удастся разработать антитела, которые блокируют различные патологические процессы в организме и действуют как фармацевтические препараты. Первоначально для получения этих терапевтических антител мышам вводили различные мишени для фармацевтических препаратов, например белки из раковых клеток. Однако в 1980-х годах становилось все более очевидным, что этот метод имеет ограничения; некоторые вещества были токсичны для мышей, а другие не вызывали образования антител. Кроме того, было обнаружено, что полученные антитела распознаются иммунной системой пациентов как чужеродные и атакуют их. Это привело к разрушению антител мышей и возникновению побочных эффектов у пациентов.
Это привело к разрушению антител мышей и возникновению побочных эффектов у пациентов.
Именно это препятствие побудило Грега Винтера начать исследование потенциала фагового дисплея Джорджа Смита. Он хотел избежать использования мышей и иметь возможность создавать фармацевтические препараты на основе человеческих антител, поскольку они переносятся нашей иммунной системой.
Винтер наносит антитела на поверхность фагов
Антитела представляют собой Y-образные молекулы; это дальний конец каждого плеча, который прикрепляется к инородным телам. Грег Винтер соединил генетическую информацию этой части антитела с геном одного из белков капсулы фага и в 1990, он продемонстрировал, что это привело к тому, что сайт связывания антител оказался на поверхности фага. Антитело, которое он использовал, было разработано для присоединения к небольшой молекуле, известной как phOx. Когда Грег Винтер использовал phOx в качестве своего рода молекулярного рыболовного крючка, ему удалось вытащить фаг с антителом на его поверхности из супа из четырех миллионов других фагов.
После этого Грег Винтер показал, что может использовать фаговый дисплей в направленной эволюции антител. Он создал библиотеку фагов с миллиардами разновидностей антител на их поверхности. Из этой библиотеки он выудил антитела, которые прикреплялись к разным белкам-мишеням. Затем он случайным образом изменил это первое поколение антител и создал новую библиотеку, в которой он нашел антитела с еще более сильными связями с мишенью. Например, в 1994 он использовал этот метод для разработки антител, которые прикреплялись к раковым клеткам с высоким уровнем специфичности.
Первый в мире фармацевтический препарат на основе человеческого антитела
Грег Винтер и его коллеги основали компанию, основанную на фаговом дисплее антител. В 1990-х годах компания разработала лекарство, полностью основанное на человеческом антителе: адалимумаб. Антитело нейтрализует белок TNF-альфа, который вызывает воспаление при многих аутоиммунных заболеваниях. В 2002 году препарат был одобрен для лечения ревматоидного артрита и в настоящее время также используется для лечения различных видов псориаза и воспалительных заболеваний кишечника.
Успех адалимумаба стимулировал значительное развитие фармацевтической промышленности, и фаговый дисплей использовался, среди прочего, для производства противораковых антител. Один из них высвобождает клетки-киллеры организма, чтобы они могли атаковать опухолевые клетки. Рост опухоли замедляется, и в некоторых случаях даже пациенты с метастатическим раком излечиваются, что является историческим прорывом в лечении рака.
Другой одобренный фармацевтический препарат на основе антител нейтрализует бактериальный токсин, вызывающий сибирскую язву, а другой замедляет аутоиммунное заболевание, известное как волчанка; многие другие антитела в настоящее время проходят клинические испытания, например, для борьбы с болезнью Альцгеймера.
Рис. 4. Принцип направленной эволюции антител с использованием фагового дисплея. Этот метод используется для производства новых фармацевтических препаратов.
Начало новой эры в химии
Методы, разработанные лауреатами Нобелевской премии по химии 2018 года, в настоящее время разрабатываются на международном уровне для продвижения более экологичной химической промышленности, производства новых материалов, производства экологичного биотоплива, смягчения последствий заболеваний и спасения жизней. Направленная эволюция ферментов и фаговый дисплей антител позволили Фрэнсис Арнольд, Джорджу Смиту и Грегу Винтеру принести величайшую пользу человечеству и заложить основу для революции в химии.
Направленная эволюция ферментов и фаговый дисплей антител позволили Фрэнсис Арнольд, Джорджу Смиту и Грегу Винтеру принести величайшую пользу человечеству и заложить основу для революции в химии.
Ссылки и дополнительная литература
Дополнительную информацию о премиях этого года, включая научную базу на английском языке, можно найти на веб-сайте Шведской королевской академии наук www.kva.se и на http://nobelprize.org. Там вы можете посмотреть видеозаписи пресс-конференций, Нобелевских лекций и многое другое. Информация о выставках и мероприятиях, связанных с Нобелевскими премиями и Премией в области экономических наук, доступна на сайте www.nobelcenter.se.
Статьи
Арнольд, Ф. и Макуаре, К. А. (2016) Профиль стипендиата NAI: интервью с доктором Фрэнсис Арнольд. Технологии и инновации, 18 , 79-82
Harding, A. (2006) Profile Sir Greg Winter — гуманизатор антител. Ланцет, 368 , S50
Найтингейл, К. (2013) Грег Винтер: Новаторские препараты на основе антител. Insight, www.insight.mrc.ac.uk/2013/02/27/greg-winter-pioneering-antibody-drugs/
(2013) Грег Винтер: Новаторские препараты на основе антител. Insight, www.insight.mrc.ac.uk/2013/02/27/greg-winter-pioneering-antibody-drugs/
Trager, R. (2018) На месте с Фрэнсис Арнольд. Chemistry World, www.chemistryworld.com/culture/in-situ-with-frances-arnold/3008732.article
Видео
MoleCluesTV (4 июня 2017 г.) Фрэнсис Арнольд: Новые ферменты путем эволюции
www.youtube.com/watch?v=05r-FLGtsEQ
SlidesLive (23 ноября 2015 г.) Терапевтические антитела: революция в фармацевтике
https://slideslive.com/38895318/терапевтические антитела-революция в фармацевтике
Шведская королевская академия наук приняла решение о присуждении Нобелевской премии по химии за 2018 год
с половиной до
ФРАНСИС Х. АРНОЛЬД
Родился в 1956 году в Питтсбурге, США. Кандидат наук. 1985 г. , Калифорнийский университет, Беркли, США. Лайнус Полинг Профессор химического машиностроения, биоинженерии и биохимии Калифорнийского технологического института, Пасадена, США.
, Калифорнийский университет, Беркли, США. Лайнус Полинг Профессор химического машиностроения, биоинженерии и биохимии Калифорнийского технологического института, Пасадена, США.
http://fhalab.caltech.edu
«для направленного выделения ферментов»
и другая половина вместе с
ДЖОРДЖ П. СМИТ
Родился в 1941 году в Норуолке, США. Кандидат наук. 1970, Гарвардский университет, Кембридж, США. Кураторы – заслуженный профессор биологических наук Университета Миссури, Колумбия, США.
http://biology.missouri.edu/people/?person=94
и
СЭР ГРЕГОРИ П. УИНТЕР
Родился 19 лет51 в Лестере, Великобритания. Кандидат наук. 1976. Кембриджский университет, Великобритания. Почетный руководитель исследования, Лаборатория молекулярной биологии MRC, Кембридж, Великобритания.
www2.mrc-lmb.cam.ac.uk/group-leaders/emeritus/greg-winter/
«для фагового дисплея пептидов и антител»
Научные редакторы : Клас Густафссон, Гуннар фон Хейне и Сара Сногеруп Линсе, Нобелевский комитет по химии
Текст : Энн Фернхольм
Перевод : Клэр Барнс
Иллюстрации : © Йохан Ярнестад/Шведская королевская академия наук
Редактор : Энн Фернхольм
© Шведская королевская академия наук
Процитировать этот раздел
Стиль MLA: Популярная информация.
