Содержание
Периодическая таблица через 150 лет
Ю. Ц. Оганесян
По материалам доклада на Научной сессии Общего собрания членов РАН, посвященной закрытию Международного года Периодической таблицы 14 ноября 2019 г. В варианте статьи журнала «Вестник Российской академии наук» № 4 2020 г.
К началу 2019 г., провозглашенного ООН и ЮНЕСКО Международным годом Периодической таблицы химических элементов, 7-й период таблицы был уже заполнен новыми, самыми тяжелыми элементами. Согласно предсказаниям теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «магических» чисел протонов Z=114 и нейтронов N=184. Новые элементы с атомными номерами от 114 до 118 были синтезированы в Лаборатории ядерных реакций им. Г.Н. Флёрова Объединённого института ядерных исследований (ОИЯИ) в Дубне в 2000–2012 гг. в реакциях слияния ядер мишени – тяжёлых изотопов актиноидов (Z = 94–98) – с бомбардирующими ионами кальция-48. Из полученных экспериментальных результатов следует, что могут существовать ядра/элементы с атомными номерами более 118 и массами более 300 а.е.м. Для исследования ядерной и электронной структур новых элементов, а также их химических свойств, равно как и синтеза элементов начала 8-го периода Периодической таблицы, в Дубне создан новый экспериментальный комплекс Фабрика сверхтяжелых элементов (Фабрика СТЭ), где уже состоялся пуск нового ускорителя DC-280 и в ближайшее время начнутся эксперименты. Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
в реакциях слияния ядер мишени – тяжёлых изотопов актиноидов (Z = 94–98) – с бомбардирующими ионами кальция-48. Из полученных экспериментальных результатов следует, что могут существовать ядра/элементы с атомными номерами более 118 и массами более 300 а.е.м. Для исследования ядерной и электронной структур новых элементов, а также их химических свойств, равно как и синтеза элементов начала 8-го периода Периодической таблицы, в Дубне создан новый экспериментальный комплекс Фабрика сверхтяжелых элементов (Фабрика СТЭ), где уже состоялся пуск нового ускорителя DC-280 и в ближайшее время начнутся эксперименты. Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Ключевые слова: Периодическая таблица Д. И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
ПРОЛОГ
Предание гласит, что всё началось с письма, которое сэр Мартин Поляков, профессор Ноттингемского университета (Великобритания) и иностранный член РАН, направил 28 июля 2016 г. президенту Международного союза чистой и прикладной химии (ИЮПАК) члену-корреспонденту РАН Наталии Павловне Тарасовой:
«Уважаемая Наталия,
надеюсь, что Вы в порядке.
Как я понимаю, 2019 год станет 150-й годовщиной публикации Менделеевым Периодической таблицы. Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
С наилучшими пожеланиями,
Мартин Поляков»
Н.П. Тарасова поставила этот вопрос на заседании Исполнительного комитета ИЮПАК, который, как ей показалось, со здоровым скептицизмом поддержал идею Международного года Периодической таблицы и предложил России воплотить её в жизнь через ЮНЕСКО. Начиная с этого момента, вся деятельность по данному вопросу, проводимая Международным союзом чистой и прикладной химии в течение 18 месяцев, легла на плечи президента ИЮПАК и её коллег.
Начиная с этого момента, вся деятельность по данному вопросу, проводимая Международным союзом чистой и прикладной химии в течение 18 месяцев, легла на плечи президента ИЮПАК и её коллег.
Российская академия наук и российские химики с большим воодушевлением взялись за дело: написали обращение Менделеевского съезда (2016) и Российского химического общества к мировой научной общественности, президент РАН академик В.Е. Фортов направил письмо министру иностранных дел России С.В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых. Это случилось 28 ноября 2016 г. Все четыре элемента со своими названиями и символами заполнили и замкнули 7-й период Периодической таблицы Д. И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
А 20 декабря 2017 г. с интересной и необычной формулировкой – “признавая важность глобального расширения знаний о том, как химия способствует устойчивому развитию в области энергетики, образования, сельского хозяйства и здоровья,” – Генеральная Ассамблея ООН, затем и ЮНЕСКО провозгласили 2019-й Международным годом Периодической таблицы химических элементов – IYPT-2019.
НОВЫЕ ОБИТАТЕЛИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
В 1928 г. Георгий Антонович Гамов, наш соотечественник, выпускник Ленинградского государственного университета, уже известный к тому времени советский физик, предложил первую теоретическую модель атомного ядра в виде капли заряженной жидкости с плотностью, на 15 порядков превышающей плотность воды [1]. В новой науке, ядерной физике, этой работе суждено было сыграть большую роль. На основе капельной модели ядра Гамов создал теорию альфа-распада (1928) [2], Карл Фридрих фон Вайцзеккер предложил свою знаменитую формулу для расчёта энергии связи ядер (1935) [3], а Нильс Бор и Джон А. Уилер создали теорию ядерного деления (1939) [4]*.
Георгий Антонович Гамов, наш соотечественник, выпускник Ленинградского государственного университета, уже известный к тому времени советский физик, предложил первую теоретическую модель атомного ядра в виде капли заряженной жидкости с плотностью, на 15 порядков превышающей плотность воды [1]. В новой науке, ядерной физике, этой работе суждено было сыграть большую роль. На основе капельной модели ядра Гамов создал теорию альфа-распада (1928) [2], Карл Фридрих фон Вайцзеккер предложил свою знаменитую формулу для расчёта энергии связи ядер (1935) [3], а Нильс Бор и Джон А. Уилер создали теорию ядерного деления (1939) [4]*.
Согласно Бору и Уилеру, тяжёлое ядро предохраняет от разделения на две части потенциальный барьер. Высота барьера деления ядра урана составляет 6 МэВ. Поэтому если в ядро внести энергию более чем 6 МэВ (например, энергию захвата ядром нейтрона), оно моментально разделится на две части. В этом процессе выделяется энергия около 200 МэВ, что используется в атомных электростанциях. Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 1016 лет! По мере удаления от урана в область более тяжелых ядер, высота барьера деления быстро уменьшается, что приводит к резкому увеличению вероятности спонтанного деления. При исчезновении барьера деления ядро будет испытывать спонтанное деление за время около 10-19 с. В теории Бора и Уилера подобная критическая ситуация наступает при подходе к элементам с атомным номером 100. По сути, это и есть предел существования ядер.
Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 1016 лет! По мере удаления от урана в область более тяжелых ядер, высота барьера деления быстро уменьшается, что приводит к резкому увеличению вероятности спонтанного деления. При исчезновении барьера деления ядро будет испытывать спонтанное деление за время около 10-19 с. В теории Бора и Уилера подобная критическая ситуация наступает при подходе к элементам с атомным номером 100. По сути, это и есть предел существования ядер.
Ещё 60 лет назад такое макроскопическое, и в этом смысле классическое, описание процесса деления не вызывало сомнений. Особенно после синтеза первых искусственных элементов тяжелее урана, прекрасно подтверждающих капельную теорию деления: от урана (Z = 92) до калифорния (Z = 98) период полураспада относительно спонтанного деления уменьшился в 1014 раз [7]! Сомнения в прогнозах капельной модели деления возникли позже, после открытия в Лаборатории ядерных реакций им. Г.Н. Флёрова ОИЯИ спонтанно-делящихся изомеров (1962) [8]. Оказалось, что внутренняя структура ядра, наблюдаемая в основных состояниях, сохраняется и в сильно деформированных конфигурациях на пути к делению, продолжая играть важную роль в вероятности спонтанного деления тяжёлых ядер. Теперь уже более сложное описание коллективного движения в новой микроскопической теории давало одновременно также и новые предсказания границы масс ядер. Результаты оказались весьма неожиданными. Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы.
Г.Н. Флёрова ОИЯИ спонтанно-делящихся изомеров (1962) [8]. Оказалось, что внутренняя структура ядра, наблюдаемая в основных состояниях, сохраняется и в сильно деформированных конфигурациях на пути к делению, продолжая играть важную роль в вероятности спонтанного деления тяжёлых ядер. Теперь уже более сложное описание коллективного движения в новой микроскопической теории давало одновременно также и новые предсказания границы масс ядер. Результаты оказались весьма неожиданными. Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы. В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
| Рис. 1. Периоды полураспада ядер с Z ≥ 96 относительно спонтанного деления. Черные кружки – экспериментальные значения для актиноидов и изотопов 104 элемента. Открытые кружки – один из вариантов предсказаний для ядер c Z ≥ 106 и N ≥ 150. С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. |
Многие лаборатории мира буквально ринулись на поиски этих долгоживущих тяжеловесов. Но, к сожалению, все экстенсивные попытки найти их в природе, космических лучах и даже путём искусственного синтеза сверхтяжёлых элементов, предпринятые в течение 15 лет (1970–1985), не дали результатов. Оставляя пока вопрос о вероятности образования ядер с массой около 300 в процессах природного ядерного синтеза, отметим, что время жизни сверхтяжёлых долгожителей заметно меньше возраста Солнечной системы (4. 5∙109 лет) и они не дожили до наших дней. Что же касается искусственного синтеза, то все методы синтеза двадцати известных к тому времени искусственных элементов тяжелее урана, к сожалению, не пригодны для этих целей. Они “не дотягивают” до “острова” стабильности прежде всего из-за дефицита нейтронов в системе сливающихся ядер.
5∙109 лет) и они не дожили до наших дней. Что же касается искусственного синтеза, то все методы синтеза двадцати известных к тому времени искусственных элементов тяжелее урана, к сожалению, не пригодны для этих целей. Они “не дотягивают” до “острова” стабильности прежде всего из-за дефицита нейтронов в системе сливающихся ядер.
После 1985 г. мы кардинально изменили подход к синтезу сверхтяжёлых элементов. Для того чтобы добраться до “острова” и увидеть резкий подъём стабильности, предсказанный теорией, пришлось существенно усложнить эксперимент. Теперь вместо использования стабильных ядер в качестве материала мишени были выбраны тяжёлые изотопы трансурановых элементов (такие как плутоний-244 или кюрий-248), полученные в высокопоточном ядерном реакторе. Мишени из этих материалов подвергались бомбардировке ускоренными ионами кальция-48, исключительно редкого и дорогого изотопа природного кальция. Содержание кальция-48 в естественной смеси по отношению к основному изотопу кальцию-40 составляет всего 0. 2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
Высадка на берег “острова” в северо-западной его части была действительно впечатляющей. Вероятность образования тяжёлого изотопа 114-го элемента оказалась примерно в 500 раз выше, чем 113-го элемента, полученного в RIKEN. Еще более сильное отличие наблюдалось в свойствах ядер, в частности, во временах жизни, измеряемых обычно периодами полураспада. Повышение числа нейтронов на 8 единиц в ядрах, синтезированных с ионами кальция-48, увеличило их период полураспада примерно в 100 тысяч раз! Оба фактора: рост вероятности образования и стабильности ядер демонстрируют сильный эффект “магической” структуры N = 184, даже несмотря на то, что синтезированный изотоп 114-го элемента содержит всего 175 нейтронов. После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.
Повышение числа нейтронов на 8 единиц в ядрах, синтезированных с ионами кальция-48, увеличило их период полураспада примерно в 100 тысяч раз! Оба фактора: рост вероятности образования и стабильности ядер демонстрируют сильный эффект “магической” структуры N = 184, даже несмотря на то, что синтезированный изотоп 114-го элемента содержит всего 175 нейтронов. После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0. 5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
| Рис. 2, а. Таблица Менделеева (площадь 150 м2). на фасаде химического факультета Университета в городе Мурсия (Испания, 2017). В красной рамке показаны элементы, полученные с пучком кальция-48. |
Рис. 2, б. Область конца карты нуклидов: показаны изотопы от свинца до элемента 118. Красными квадратами обозначены самые тяжелые ядра: с массой 252 а.е.м. (No, 1962) и 294 а.е.м. (Og, 2004), полученные впервые в Лаборатории ядерных реакций ОИЯИ. Желтым цветом показана область ядер, полученных в реакциях с использованием мишеней из свинца и висмута. Розовое поле – область ядер синтезированных в реакциях с пучком ионов кальция-48. Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. Красными квадратами обозначены самые тяжелые ядра: с массой 252 а.е.м. (No, 1962) и 294 а.е.м. (Og, 2004), полученные впервые в Лаборатории ядерных реакций ОИЯИ. Желтым цветом показана область ядер, полученных в реакциях с использованием мишеней из свинца и висмута. Розовое поле – область ядер синтезированных в реакциях с пучком ионов кальция-48. Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. |
Заключая краткий экскурс в мир сверхтяжёлых, можно отметить, что уйдя от висмута, последнего стабильного элемента, в область больших масс и зарядов, мы наблюдаем удивительную живучесть атомных ядер. В области предельных кулоновских сил дополнительные связи протонов и нейтронов структурного свойства создают в тяжёлом ядре барьер деления и делают тем самым возможным существование сверхтяжёлых элементов.
Эксперименты проводились в Дубне на ускорителе У400 Лаборатории ядерных реакций им. Г.Н. Флерова (ОИЯИ) в сотрудничестве с ВНИИЭФ (Саров, Россия), НИИАР (Димитровград, Россия), а также с Ливерморской и Ок-Риджской национальными лабораториями (США), взявшими на себя труд по наработке мишенного материала и участвовавшими в ряде экспериментов.
ТЯЖЕЛЕЙШИЕ АТОМЫ И ХИМИЯ СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
На фотографии (см. рис. 2, а) изображена самая большая (150 м2) Периодическая таблица химических элементов, встроенная в фасад химического факультета Университета г. Мурсия (Испания).** На ней красной рамкой выделены сверхтяжёлые элементы от 112-го до 118-го, полученные в реакциях с кальцием-48, когда в качестве материала мишени использовались тяжёлые изотопы от урана (Z = 92) до калифорния (Z = 98), соответственно***.
В белой рамке находятся дочерние нуклиды – продукты альфа-распада ядер из красной рамки.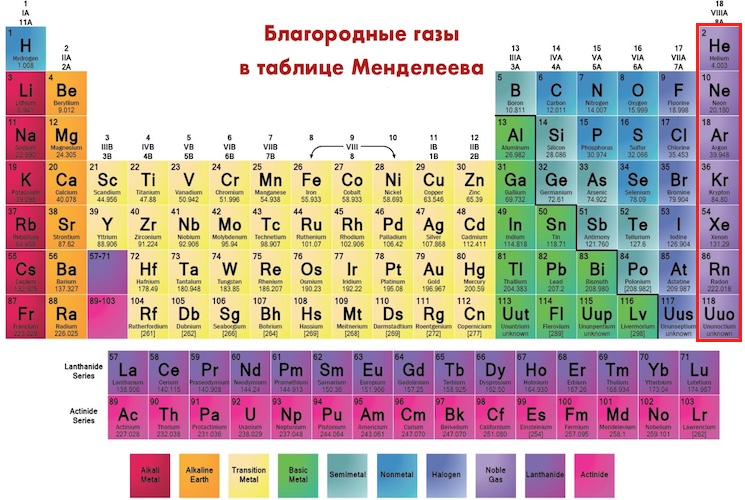 Они заполняют практически все оставшиеся клетки 7-го периода, вплоть до резерфордия (Z = 104). Дочерние ядра, берущие начало от нейтронно-избыточных материнских изотопов сверхтяжёлых элементов, тоже обогащены нейтронами, что значительно повышает их период полураспада и открывает широкие возможности для исследования химических свойств транс-актиноидов. Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg).
Они заполняют практически все оставшиеся клетки 7-го периода, вплоть до резерфордия (Z = 104). Дочерние ядра, берущие начало от нейтронно-избыточных материнских изотопов сверхтяжёлых элементов, тоже обогащены нейтронами, что значительно повышает их период полураспада и открывает широкие возможности для исследования химических свойств транс-актиноидов. Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Но это первый звонок. Дальнейшее увеличение заряда ядра будет более ощутимым. Поэтому, спустя 100 лет после открытия Вильямом Рамзаем радона (1904) [17], последнего до 2004 года представителя семейства благородных газов 18 группы таблицы, мы задаемся сегодня вопросом: а будет ли 118-ый элемент благородным газом? Релятивистский эффект сильнее проявляется на ближайших к ядру электронах, скорость которых максимальна [18-20], что приводит к сжатию внутренних орбит (рис. 3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М. Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М. Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
|
|
Рис. 3, а. Расчетная плотность электронов 118-го элемента (Og) в зависимости от радиуса (логарифмическая шкала) в двух вариантах расчета: в релятивистском (синяя кривая) и не релятивистском (красный пунктир) приближениях. Цифрами на графике указаны электронные оболочки (периоды). Видно сильное сжатие внутренних электронных оболочек, в то время как средний радиус внешних (валентных) электронов мало меняется |
| Рис. 3, б. Пространственные распределения (функции локализации) электронов 118-го элемента (Og), полученные в работе [20]. Хорошо видно размытие внешних электронов в сравнении с его гомологами — радоном и ксеноном |
На примере 118-го элемента можно видеть, что в конце 7-го периода у элементов, именуемых сегодня сверхтяжёлыми, появляются отличные от лёгких гомологов признаки. Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
далее).
Пока не видно принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то, что попытки их получения на старых установках в реакциях с ионами титана, хрома и даже железа, предпринятые в разных лабораториях, не увенчались успехом [24-26], это остаётся делом техники. Сложнее будет изучать их химические свойства из-за короткого периода полураспада, исчисляемого долями миллисекунды. Но здесь не ожидается сюрпризов. Большой скачок в химии будет иметь место при переходе от 118-го к 119-му элементу (от последней колонки таблицы к первой). По всей вероятности, 120-й элемент также в целом будет следовать своим лёгким гомологам второй колонки. Отклонения начнутся, скорее всего, после 121-го элемента с различными сценариями дальнейшего продолжения таблицы (рис. 4). Элемент 122 либо откроет новую серию так называемых супер-актиноидов [27], включающую ещё 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
| Рис. 4. Таблица Д.И. Менделеева с различными вариантами релятивистских расчетов. В синей рамке – сверхтяжёлые элементы, полученные в реакциях с пучком ионов кальция-48. |
ФАБРИКА СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
После открытия новых элементов, расположенных на “острове” стабильности, дальнейшее развитие исследований в этой области связано прежде всего с получением сверхтяжёлых нуклидов в значительно бóльших количествах. Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Новый комплекс с инфраструктурой для работы с высокорадиоактивными материалами расположен в отдельном строении (рис. 5, а). Там же находится новый сильноточный ускоритель тяжелых ионов – циклотрон DC-280 [28], пуск которого состоялся в марте 2019 года (рис. 5, б). Ускоритель доставляет пучки ионов в три экспериментальных зала, где размещаются сепарирующие каналы, химические и физические установки, а также другое экспериментальное оборудование. В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
| Рис. 5, а. Строение ускорительного комплекса «Фабрики СТЭ» |
| Рис. 5, б. Ускоритель тяжелых ионов — циклотрон DC-280 |
ЭПИЛОГ
За прошедшие 80 лет после открытия нептуния и плутония (1940) – первых искусственных элементов – Периодическая таблица пополнилась ещё 24 рукотворными элементами. Пять самых тяжёлых из них заняли своё место в таблице в последние семь лет. Искусственных элементов, как известно, в природе нет. А сверхтяжёлых элементов, скорее всего, не было и при зарождении Солнечной системы. Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Между тем Международный год Периодической таблицы — IYPT2019, начавший своё шествие в ЮНЕСКО 29 января 2019 г., закончился в Токио (Япония) 5 декабря. Огромное количество статей в научных, научно-популярных и совсем не научных изданиях, удивительный всплеск очень интересных работ в области ядерной физики, химии, атомной физики, астрофизики, истории науки – все посвященные 150-летию открытия Периодической таблицы химических элементов. Год был встречен с невероятным энтузиазмом не только научным миром, но и широкой общественностью. Форумы, конференции, симпозиумы, лекции, собрания научных обществ, академий наук многих стран мира, везде по-разному, но всегда одухотворенно и очень интересно.
Что-то объединяет людей. Быть может, также великие открытия и любовь к науке.
* В то же время в нашей стране теорию ядерного деления независимо развивал Я.И. Френкель [5].
** С 2019 года самая большая периодическая Таблица элементов (660 м2) находится в Австралии в государственном университете Эдит Коуэн (ECU) в г. Перт.
Перт.
*** К сожалению, калифорний – самый тяжёлый элемент, который может быть получен в ядерном реакторе в количестве, необходимом для изготовления мишени. Для синтеза 119 элемента и более тяжелых придется увеличивать массу и заряд бомбардирующих ионов.
Литература
1. Gamov G. Discussion оn the structure of atomic nuclei// Proc. of the Royal Society A. 1929. № 123. P. 386–387.
2. Gamov G. Zur Quantentheorie des Atomkernes // Zeitschrift fur Physik. 1928. V. 51. № ¾. P. 204–212.
3. Von Weizsäcker C.F. Zur Theorie der Kernmassen// Zeitschrift fur Physik. 1935. V. 96. P. 431.
4. Bohr N., Weeler J.A. The Mechanism of Nuclear Fission // Phys. Rev. 1939. V. 56. P. 426–450.
5. Френкель Я.И. Электрокапиллярная теория расщепления тяжёлых ядер медленными нейтронами // ЖЭТФ. 1939. № 6. С. 641–653.
6. Flerov , Petrjak . Spontaneous Fission of Uranium // Phys. Rev. 1940. V. 58. Р. 89.
Spontaneous Fission of Uranium // Phys. Rev. 1940. V. 58. Р. 89.
7. Seaborg G.T., Loveland W.D. Transuranium Nuclei // Treatise on Heavy-Ion Science / Edited by D.A. Bromley. V. 4. P. 289. N.Y.: Plenum Press, 1985.
8. Polikanov S.M., Druin A.V., Karnaukhov V.A. et al. Spontaneous fission with an anomalously short period // Soviet Physics JETP-USSR. 1962. № 15(6). P.1016–1021.
9. Morita K., Morimoto K., Kaji D. et al. Experiment on the Synthesis of Element 113 in the Reaction 209Bi (70Zn,n)278113 // J. Phys. Soc. Jpn. 2004. V.73. P. 2593–2596.
10. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al., Synthesis of Superheavy Nuclei in the 48Ca+244Pu Reaction // Phys. Rev. Lett. 1999. V. 83. P. 3154–3157.
11. Oganessian Yu.Ts., Utyonkoy V.K., Lobanov Yu.V. et al. Experiments on the synthesis of element 115 in the reaction 243Am(48Ca,xn)291−x115 // Phys. Rev. C. 2004. V. 69. № 021601(R).
Rev. C. 2004. V. 69. № 021601(R).
12. Oganessian Yu.Ts., Abdullin F.Sh., Bailey P.D. et al. Synthesis of a New Element with Atomic Number Z=117 // Phys. Rev. Lett. 2010. V. 104. № 142502.
13. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Phys. Rev. C. 2006. V. 74. № 044602.
14. Oganessian Yu.Ts., Utyonkov V.K. Super-heavy element research // Rep. Prog. Phys. 2015. V. 78. № 036301.
15. Eichler R., Aksenov N.V., Belozerov A.V. et al. Chemical characterization of element 112 // Nature. 2007. V. 447. P. 72–75.
16. Mewes J.-M., Smits O. R., Kresse G. et al. Copernicium: A Relativistic Noble Liquid // Angew. Chem. Int. Ed.2019. V.58, P.17964 – 17968
17. Ramsay W., Soddy F. Further Experiments on the Production of Helium from Radium // Proceedings of the Royal Society of London (1854–1905). 1904. V. 73. P. 346–358.
Ramsay W., Soddy F. Further Experiments on the Production of Helium from Radium // Proceedings of the Royal Society of London (1854–1905). 1904. V. 73. P. 346–358.
18. Pershina V. Relativity in the electronic structure of the heaviest elements and its influence on periodicities in properties // Radiochimica Acta. 2019. V. 107. Р. 833–864.
19. Eliav E., Borschevsky A., Kaldor U. Electronic Structure at the Edge of the Periodic Table // Nuclear Physics News. 2019. V. 29. Р. 16–20.
20. Lackenby B.G.C., Dzuba V.A, Flambaum V.V. Atomic structure calculations of superheavy noble element oganesson (Z=118) // Phys.Rev. A. 2018. V. 98. P. 042512.
21. Jerabek P., Schuetrumpf B., Schwerdtfeger P., Nazarewicz W. Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit// Phys. Rev. Lett. 2018. V. 120. Р. 053001.
22. Shabaev V.M., Tupitsyn I. I., Kaygorodov M.Y., Kozhedub Y.S. Localisation of electron states of Oganesson atoms // The 4th International Symposium on Superheavy Elements (SHE2019). Hakone, Japan. Dec.1–5, 2019
I., Kaygorodov M.Y., Kozhedub Y.S. Localisation of electron states of Oganesson atoms // The 4th International Symposium on Superheavy Elements (SHE2019). Hakone, Japan. Dec.1–5, 2019
23. Giuliani S. A., Matheson Z., Nazarewicz W. et al., Colloquium: Superheavy elements: Oganesson and beyond// Rev. Mod. Phys. 2019. V. 91. No. 1. P.01100.
24. Düllmann C.E. Superheavy Element Research at TASCA at GSI // Fission and Properties of Neutron-Rich Nuclei. 2013. V. 44. Р. 271–277.
25. Hofmann S., Heinz S., Mann R. et al. Review of even element super-heavy nuclei and search for element 120 // Eur. Phys. J. A. 2016. V. 52. Р. 180.
26. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Attempt to produce element 120 in the 244Pu+58Fe reaction // Phys. Rev. C. 2009. V. 79. Р. 024603.
27. Borschevsky A., Pershina V., Eliav E., Kaldor U. Ab initio predictions of atomic properties of element 120 and its lighter group-2 homologues // Phys. Rev. A. 2013. V. 87. P. 022502.
Rev. A. 2013. V. 87. P. 022502.
28. Gulbekian G.G., Dmitriev S.N., Itkis M.G. et al. Start-Up of the DC-280 Cyclotron, the Basic Facility of the Factory of Superheavy Elements of the Laboratory of Nuclear Reactions at the Joint Institute for Nuclear Research // Physics of Particles and Nuclei Letters. 2019. V. 16(6). Р. 866–875.
Новый взгляд на таблицу Менделеева: ученые ЮУрГУ систематизируют взаимодействия молекул
Размер шрифта
Межбуквенный интервал
Семейство шрифтов
- Новость
- 2018
- марта
- 05
- Новый взгляд на таблицу Менделеева: ученые ЮУрГУ систематизируют взаимодействия молекул
05.03.2018
Трансформация современных взглядов на физико-химические основы строения вещества — одна из наиболее важных современных тенденций в химии. В этом прорывном направлении работают ученые Южно-Уральского государственного университета. Новые фундаментальные знания в химии станут отправной точкой для следующего этапа развития материаловедения, а цифровые химические технологии ускорят воплощение практически значимых идей.
В этом прорывном направлении работают ученые Южно-Уральского государственного университета. Новые фундаментальные знания в химии станут отправной точкой для следующего этапа развития материаловедения, а цифровые химические технологии ускорят воплощение практически значимых идей.
Один из главных проектов международной лаборатории «Многомасштабного моделирования многокомпонентных функциональных материалов» ЮУрГУ — междисциплинарное исследование свойств химических связей и межмолекулярных взаимодействий, находящееся на стыке химии, физики и информатики. О проделанной работе рассказала заведующий лабораторией, доктор химических наук Екатерина Барташевич.
От молекул к межмолекулярным взаимодействиям
«Еще в конце ХХ века ученые-химики утверждали, что молекула определяет свойства вещества. Это утверждение не исчерпывает, однако, проблему микроскопической природы физико-химических свойств. Сталкиваясь с многообразием строения кристаллических и полимерных материалов, конденсированных сред, мы понимаем, что эти свойства будут определяться не только набором молекул, но и тем, как они связаны между собой.
Поэтому научное сообщество стремится систематизировать информацию о химических связях, чтобы перейти к алгоритмам, прогнозирующим строение многокомпонентных соединений. Этому способствует и интерес к материалам на основе органических соединений, к компонентам солнечных батарей, электрооптическим свойствам жидких кристаллов, лекарствам. Чтобы вырабатывать рекомендации к синтезу новых функциональных материалов, нужно, прежде всего, систематизировать знания о том, как могут взаимодействовать между собой частицы в веществе, и научиться использовать эти данные».
2019 год объявлен Международным годом периодической таблицы химических элементов. В настоящее время в области исследования межмолекулярных взаимодействий происходит выстраивание собственной периодической системы. Эта систематизация опирается на общность свойств элементов в рядах и определяет, как будут взаимодействовать между собой молекулы в веществе. Практический взгляд с позиций химии на физико-химические основы строения вещества являются основой таких исследований.
На пути к мировоззренческим изменениям в химии
«В основе выстраиваемой научным сообществом новой системы межмолекулярных взаимодействий — периодическая таблица Менделеева, которая является «фундаментом» базы знаний в химии, — подчеркивает Екатерина Владимировна. — В настоящее время для более крупных структурных единиц формируется своя система. Ее составляющие — уже не химические элементы, а связи между молекулами и их агломератами. В терминах новой классификации выделяют галогенную, халькогенную, пниктогенную, тетрельную связь и т.д. По силе, устойчивости и влиянию на свойства вещества их можно сравнивать с водородной связью, влияние которой на свойства жизненно важных соединений (например, белков и нуклеиновых кислот) хорошо известно даже из школьной программы. Галогенные связи обеспечивают пластичность некоторых кристаллических материалов, а халькогенные — низкотемпературную проводимость. Изучение и систематизация свойств межмолекулярных связей открывают путь к объективным прогнозам: когда известны закономерности строения, становится понятным, чего следует ожидать от той или иной комбинации свойств».

Новая система знаний в химии — путь к новым материалам
Деление межмолекулярных взаимодействия на галогенные, халькогенные, пниктогенные и тетрельные связи — это новый взгляд на периодическую систему. Официальное определение IUPAC (Международный союз по чистой и прикладной химии) галогенной связи было дано совсем недавно, в 2013 году. Ученые Южно-Уральского государственного университета одними из первых стали работать в этом направлении. Они принимали участие в I Международном симпозиуме по галогенным связям, ISXB-1, который проходил в Италии. Через два года, на ISXB-2 в Швеции, доклад Екатерины Барташевич вызвал серьезный интерес и получил признание в международном научном сообществе. Сегодня один из проектов лаборатории «Многомасштабного моделирования многокомпонентных функциональных материалов» поддерживается Российским фондом фундаментальных исследований.
«Безусловно, задачи моделирования свойств вещества носят междисциплинарный характер.
Если химические знания дополняются знаниями, например, из области квантовой кристаллографии и опираются на суперкомпьютерные вычисления, это помогает завладеть научными приоритетами. В феврале 2018 года в высокорейтинговом научном издании «Journal of Computational Chemistry» по теме характеризации химических связей опубликована наша совместная работа с профессором Владимиром Цирельсоном из Российского химико-технологического университета им. Д. И. Менделеева. Исследования молекулярных кристаллов с галогенными связями и поиск среди них новых структур с нелинейно-оптическими свойствами ведется совместно с профессором Артёмом Масуновым из Университета Центральной Флориды (США). Наша научная группа, в которую входят молодые ученые ЮУрГУ, Ирина Юшина и Александр Дьяков, ставит перед собой задачу обработать максимальный объем информации, используя эволюционные алгоритмы. В этой новой области очень много как проблем, так и возможностей».

Углубленное изучение свойств химических связей невозможно без цифровых технологий и неразрывно связано с введением результатов в практику. Фактически, на данном этапе в химии закладываются фундаментальные основы, которые уже востребованы в конструировании новых материалов.
Виктория Матвейчук
Современные алхимики: как создают новые химические элементы
Как синтезируются ядра новых химических элементов, что такое остров стабильности, где границы Периодической таблицы и чего ждать от Фабрики сверхтяжелых элементов, — об этом Indicator.Ru рассказал Юрий Оганесян, научный руководитель Лаборатории ядерных реакций им. Г. Н. Флерова в Объединенном институте ядерных исследований в Дубне.
— Юрий Цолакович, расскажите, пожалуйста, немного о том, как проходит синтез химических элементов в лабораторных условиях.
— Для этого нужно начать издалека. История изучения химических элементов насчитывает 22 века — можно сказать, она началась с Демокрита. Во времена Джона Дальтона (он жил в конце XVIII — первой половине XIX веков — прим. Indicator.Ru) считалось, что мир состоит из атомов. При Дальтоне было известно 36 химических элементов, и он полагал, что это и есть весь «алфавит» материального мира. В Периодической таблице Дмитрия Менделеева было уже 63 элемента, и он заметил, что между элементами есть определенная разница. Точнее, разницу замечали и до него, но он показал: можно разделить эти 63 элемента на восемь групп, и у элементов внутри одной группы будет одинаковая химическая активность, которая меняется при переходе в другую группу. Эту закономерность он и назвал Периодическим законом.
Во времена Джона Дальтона (он жил в конце XVIII — первой половине XIX веков — прим. Indicator.Ru) считалось, что мир состоит из атомов. При Дальтоне было известно 36 химических элементов, и он полагал, что это и есть весь «алфавит» материального мира. В Периодической таблице Дмитрия Менделеева было уже 63 элемента, и он заметил, что между элементами есть определенная разница. Точнее, разницу замечали и до него, но он показал: можно разделить эти 63 элемента на восемь групп, и у элементов внутри одной группы будет одинаковая химическая активность, которая меняется при переходе в другую группу. Эту закономерность он и назвал Периодическим законом.
Я думаю, в то время не все поняли значимость этого открытия. Но Менделеев понял сразу, что, раз там есть закономерность, атомы — уже не «буквы в алфавите». Закономерность предполагает наличие сложной структуры внутри самих атомов. И он начал искать эту структуру, потратив на это полжизни. Он полагал, что источником мироздания является некая среда, «эфир», в котором «плавают» атомы, и атомы состоят из некого вещества. 42 года спустя Эрнест Резерфорд предложил свою модель атома: с положительно заряженным ядром в центре и электронами вокруг, тем самым подтвердив мысль Менделеева о наличии сложной атомной структуры.
42 года спустя Эрнест Резерфорд предложил свою модель атома: с положительно заряженным ядром в центре и электронами вокруг, тем самым подтвердив мысль Менделеева о наличии сложной атомной структуры.
Давайте вернемся к синтезу. Вещество, из которого состоит Земля, возникло в результате Большого взрыва. А элементы, которые мы видим на Земле, появились во время становления и формирования нашей планеты. Этот процесс мы можем видеть и сейчас: если масса звезды больше массы Солнца, она эволюционирует определенным образом, и в конце концов мы наблюдаем так называемую вспышку сверхновой. Происходит синтез химических элементов, и все заканчивается возникновением нейтронной звезды. Вспышка длится несколько секунд. В нашей галактике такое происходит примерно один раз в тысячу лет, в других — чаще. Эти вспышки — это и есть космические лучи, выбросы вещества во Вселенную, которые регистрируются нашими детекторами. Так возникают элементы в природе.
— От водорода до урана, насколько я помню?
— Да, это первые 92 элемента. В лаборатории, конечно, мы не можем повторить ничего подобного. Искусственный синтез — это совсем другой процесс. Мы берем готовые элементы и превращаем один в другой. Сделать это человечество хотело с давних времен — помните алхимиков, которые пытались превратить свинец в золото? Конечно, ничего у них не получалось. Чтобы превратить один элемент в другой, надо изменить его ядро, а для этого нужна энергия, в миллионы раз большая той, что была в распоряжении древних ученых. А сегодня это возможно на специальных ускорителях: два ядра подходят близко друг к другу, между ними возникают ядерные силы (кстати, мы до сих пор не очень хорошо их понимаем), и одно ядро начинает «проглатывать» другое. Это называется реакцией слияния. Если такая реакция произошла — а это весьма редкий случай, — то вы получаете новое ядро с суммарной массой и суммарным зарядом. Оно обрастает электронами, и получается новый элемент. Самый интересный вопрос здесь: этот элемент будет похож на уже существующие, или же будет отличаться? И новые элементы великолепно вписываются в таблицу.
В лаборатории, конечно, мы не можем повторить ничего подобного. Искусственный синтез — это совсем другой процесс. Мы берем готовые элементы и превращаем один в другой. Сделать это человечество хотело с давних времен — помните алхимиков, которые пытались превратить свинец в золото? Конечно, ничего у них не получалось. Чтобы превратить один элемент в другой, надо изменить его ядро, а для этого нужна энергия, в миллионы раз большая той, что была в распоряжении древних ученых. А сегодня это возможно на специальных ускорителях: два ядра подходят близко друг к другу, между ними возникают ядерные силы (кстати, мы до сих пор не очень хорошо их понимаем), и одно ядро начинает «проглатывать» другое. Это называется реакцией слияния. Если такая реакция произошла — а это весьма редкий случай, — то вы получаете новое ядро с суммарной массой и суммарным зарядом. Оно обрастает электронами, и получается новый элемент. Самый интересный вопрос здесь: этот элемент будет похож на уже существующие, или же будет отличаться? И новые элементы великолепно вписываются в таблицу.
Сейчас мы, имея возможность сливать ядра, можем идти дальше и дальше, синтезируя все новые элементы.
— У Периодической таблицы есть границы? Есть предел элементов, которые можно синтезировать?
— Конечно. Все в мире имеет начало и имеет конец. А где границы таблицы и чем они определяются… Собственно, этот вопрос и был основным мотивом для меня заниматься этим делом. Мотив был подогрет еще тем, что само ядерное вещество, о котором я говорил, не аморфно, оно имеет внутреннюю структуру. Если она проявляется, можно продлить время существования ядра, до сверхтяжелых элементов.
— Продлить насколько?
— Знаете, есть такое научное предсказание: если уйти достаточно далеко от урана, то будет зона — остров — со сверхтяжелыми элементами, достаточно долгоживущими. В середине этого острова будут элементы, которые будут жить миллионы и даже миллиарды лет. А это уже интересно, потому что возраст Земли исчисляется миллиардами лет. Не значит ли это, что такие элементы надо искать в недрах Земли? Но искали везде, и в космосе, и в Земле… Не нашли. Ну, это ни о чем не говорит: может, они были, но распались, потому что время их жизни немного меньше. Но вот что касается острова стабильности — он был предметом интенсивных исследований с момента появления этой теории, с 1969 года.
Ну, это ни о чем не говорит: может, они были, но распались, потому что время их жизни немного меньше. Но вот что касается острова стабильности — он был предметом интенсивных исследований с момента появления этой теории, с 1969 года.
Этот остров охватывает много элементов, но он требует, чтобы ядра имели много нейтронов. Дойти до «вершины» острова мы, наверно, никогда не сможем, мы пока только прикоснулись, подошли к нему. Время жизни элементов повысилось в сто тысяч раз, но это все равно еще всего лишь секунды. А на вершине острова — миллионы лет. Видите разницу? Конечно, новые установки вселяют некоторую надежду. Плюс один нейтрон к ядру — и время жизни элемента увеличивается в десять раз. В декабре 2018 года, совсем недавно, у нас в Дубне заработала «фабрика сверхтяжелых элементов» — ускоритель ДЦ-280. Строительство начали в 2012 году, и около месяца назад мы получили первый пучок ускоренных тяжелых ионов. Мы надеемся, что благодаря ДЦ-280 нам удастся получить 119, 120 и 121 элементы.
— Получится ли благодаря новой установке получать более значительное количество новых ядер, чем сейчас? Сейчас это «штучный товар», и это затрудняет исследования.
— Вы правы, новые ядра штучны. Мы были счастливы, когда получали один атом в день, в неделю… Новая установка, конечно, увеличит это количество, возможно, в сотни раз, но этого все равно будет недостаточно для накопления видимого количества вещества.
Беседа состоялась в рамках церемонии открытия года таблицы Менделеева в Париже. Мероприятие организовано при поддержке генерального партнера Международного года Периодической таблицы химических элементов в России благотворительного фонда Алишера Усманова «Искусство, наука и спорт».
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Новейшие элементы периодической таблицы
Символы и атомные номера химических элементов нихоний, московий, огнассен и теннессин (Dr_Micbrobe, iStockphoto)
Символы и атомные номера химических элементов нихоний, московий, огнассен и теннессин (Dr_Micbrobe, iStockphoto)
Кристал Чжоу
Удобочитаемость
8.17
Как это согласуется с моей учебной программой?
| Марка | Курс | Тема |
|---|
АБ
11
Наука о знаниях и трудоустройстве 20–4 (2006 г.)
Блок A: Применение вещества и химических изменений
AB
10
Наука о знаниях и трудоустройстве 10-4 (2006)
Модуль A: Исследование свойств материи
AB
9
Наука о знаниях и трудоустройстве 8, 9 (пересмотрено в 2009 г.)
Модуль B: Материя и химические изменения
AB
10
Наука 14 (2003 г., обновлено в 2014 г.)
Модуль A: Исследование свойств материи
АВ
9
Наука 7-8-9 (2003 г., обновлено в 2014 г.)
Блок B: Материя и химические изменения
до н.э.
7
Естествознание, 7 класс (июнь 2016 г.)
Большая идея: Элементы состоят из атомов одного типа, а соединения состоят из атомов разных элементов, химически объединенных.
до н.э.
9
Естествознание 9 класс (июнь 2016 г.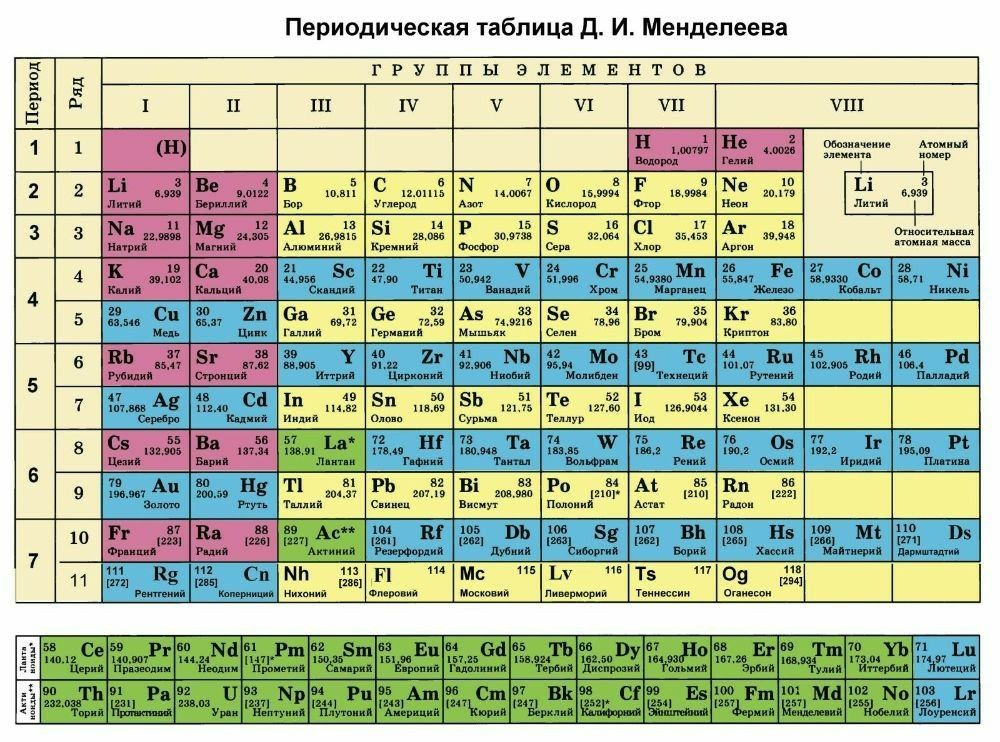 )
)
Большая идея: электронное расположение атомов влияет на их химическую природу.
МБ
9
Старший 1 Наука (2000)
Кластер 2: Атомы и элементы
NL
9
9 класс Наука
Блок 2: Атомы, элементы и соединения (пересмотрено в 2011 г.)
Нидерланды
12
Наука 3200 (2005)
Модуль 1: Химические реакции
NS
9
Наука 9 (2021)
Атомы и элементы
NU
9
Наука о знаниях и трудоустройстве 9 (Альберта, редакция 2009 г.)
Блок B: Материя и химические изменения
NU
9
Наука 9 (Альберта, 2003 г., обновлено в 2014 г.)
Блок B: Материя и химические изменения
NU
11
Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.)
Модуль A: Применение вещества и химических изменений
NU
10
Наука о знаниях и трудоустройстве 10-4 (2006)
Модуль A: Исследование свойств материи
НУ
10
Наука 14 (2003 г., обновлено в 2014 г.)
Модуль A: Исследование свойств материи
ON
9
Естествознание, 9 класс, академический (SNC1D)
Цепь C: атомы, элементы и соединения
ON
9
Прикладные науки 9 класса (SNC1P)
Strand C: Изучение материи
PE
9
Естествознание, 9 класс (пересмотрено в 2018 г. )
)
Знание контента: CK 2.1
YT
7
Science Grade 7 (Британская Колумбия, июнь 2016 г.)
Большая идея: электромагнитная сила производит как электричество, так и магнетизм.
ЮТ
9
Наука 9 класс(Британская Колумбия, июнь 2016 г.)
Большая идея: электронное расположение атомов влияет на их химическую природу.
СК
9
Наука 9 (2009)
Физические науки – атомы и элементы (AE)
до н.э.
8
Наука 8 класс (июнь 2016 г.)
Большая идея: поведение материи можно объяснить кинетической молекулярной теорией и атомной теорией.
КК
Раздел III
Наука и технология
Материальный мир
КК
Раздел III
Прикладная наука и технологии
Материальный мир
YT
8
Science Grade 8 (Британская Колумбия, июнь 2016 г.)
Большая идея: поведение материи можно объяснить кинетической молекулярной теорией и атомной теорией.
до н.э.
11
Химия 11 (июнь 2018 г.)
Большая идея: Атомы и молекулы являются строительными блоками материи.
КК
Раздел I
Наука и технология
Материальный мир: Организация
QC
Раздел II
Наука и технология
Материальный мир: Организация
YT
11
Химия 11 (Британская Колумбия, июнь 2018 г. )
)
Большая идея: Атомы и молекулы являются строительными блоками материи.
Периодическая таблица в последний раз обновлялась в 2016 году четырьмя новыми химическими элементами. Что такое химический элемент? Какова атомная структура новейших химических элементов? Как они получили свои имена?
Если бы вы открыли новый элемент, как бы вы его назвали? Вы бы назвали его в честь своего любимого телевизионного персонажа? Твой родной город? Самим собой? Международный союз теоретической и прикладной химии (IUPAC) устанавливает правила именования химических элементов. Говорят, что элементы могут быть названы в честь мифических персонажей, понятий, минералов, мест, свойств элементов или ученых. Однако, как только имя и символ выбраны, их уже нельзя изменить. Так что решайте тщательно!
В 2016 году в периодическую таблицу элементов были добавлены четыре новых элемента. Давайте немного узнаем об этих новейших элементах и о том, как они были названы. Но сначала давайте узнаем, что такое химические элементы.
Что такое химические элементы?
Химические элементы являются строительными блоками химии. Они составляют всю обычную материю Вселенной. Например, кислород является элементом. Это третий по распространенности элемент во Вселенной. Вы можете найти его в воде (H 2 O) и многих других молекулах, от которых зависят живые организмы.
Каждый элемент имеет свой атомный номер . Атомный номер говорит вам о количестве протонов в элементе. Например, углерод имеет атомный номер 6. Это означает, что у него шесть протонов. Протоны имеют положительный электрический заряд и находятся в ядро . Ядро представляет собой плотную область, расположенную в центре атома.
Различные способы описания атома углерода, включая структуру Льюиса, запись в периодической таблице и модель Бора (Источники: Let’s Talk Science на основе изображения K!roman, SVG: Marlus_Gancher через Wikimedia Commons, я [CC BY-SA 2. 5] через Wikimedia Commons, модификация Ahazard.sciencewriter [CC BY-SA 4.0] через Wikimedia Commons). Элементы
5] через Wikimedia Commons, модификация Ahazard.sciencewriter [CC BY-SA 4.0] через Wikimedia Commons). Элементы
также могут содержать нейтронов и электронов . Нейтроны — это тип частиц с примерно такой же массой, как протон. В отличие от протонов нейтроны не имеют электрического заряда. Но, как и протоны, они находятся в ядре.
Электроны имеют отрицательный электрический заряд. Они также намного меньше и легче. Они вращаются вокруг ядра.
Знаете ли вы?
Атомы определенного элемента имеют одинаковое количество протонов, но могут иметь разное количество нейтронов. Эти варианты называются изотопами.
Что такое периодическая таблица?
Периодическая таблица элементов представляет собой таблицу, в которой химические элементы расположены логическим образом. Они расположены на основе их атомного номера, электронных конфигураций и химических свойств. Строки периодической таблицы называются периодов .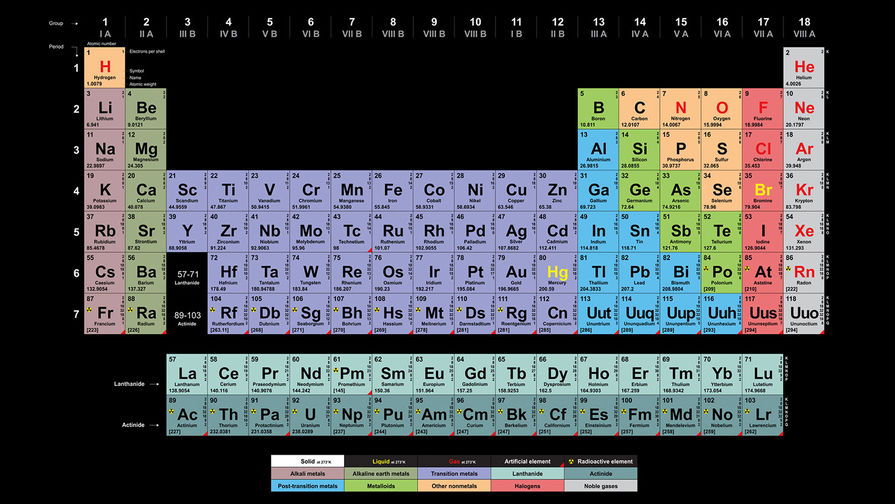 Столбцы называются группами .
Столбцы называются группами .
Вот изображение, которое поможет вам запомнить, что группы расположены вертикально, а периоды — горизонтально (© Let’s Talk Science, 2019).
Периодическая таблица, которой мы пользуемся сегодня, содержит семь периодов и 18 групп. Этот дизайн позволяет быстро найти символ элемента, атомный номер и атомную массу.
Таблица также может дать вам информацию о химических свойствах. Например, элементов в левой части периодической таблицы обычно 9.0107 металлы . Элементы в правой части обычно представляют собой 90 107 неметаллов 90 108 .
Когда в последний раз обновлялась периодическая таблица элементов?
В 2016 году в таблицу Менделеева были добавлены четыре новых элемента. Это означает, что седьмой период периодической таблицы завершен.
Эти четыре элемента пронумерованы 113, 115, 117 и 118. Их открыли исследовательские группы из Японии, России и США. Помните, мы говорили, что элементы могут быть названы в честь места? Итак, три из этих элементов были названы в честь мест, где они были обнаружены. Их имена Нихоний, Московиум и Теннессин. Четвертый элемент называется Оганесон. Он был назван в честь русского физика-ядерщика Юрия Оганесяна.
Их имена Нихоний, Московиум и Теннессин. Четвертый элемент называется Оганесон. Он был назван в честь русского физика-ядерщика Юрия Оганесяна.
Инфографика с атомными номерами, названиями, символами и происхождением названий атомных элементов 113, 115, 117 и 118 (© Let’s Talk Science, 2019).
Что такое сверхтяжелые элементы?
Все четыре новейших элемента представляют собой очень нестабильные сверхтяжелые металлы. Тяжелые элементы — это те элементы, атомный номер которых больше 92. Сверхтяжелые элементы обычно имеют атомные номера больше 112. Сверхтяжелые элементы также более радиоактивны и нестабильны , чем другие элементы.
Сверхтяжелые элементы в природе не встречаются. Новые элементы были созданы в лабораториях. Ученые используют машины, называемые ускорителями частиц , чтобы заставить ионов (заряженного элемента) одного элемента столкнуться с ионами другого элемента. Ионы – это заряженные атомы. Когда ядра сталкиваются друг с другом, они могут соединиться. Если ядра соединяются, создается новый элемент. Но эти искусственно созданные элементы существуют лишь доли секунды, прежде чем они распадаются на другие элементы.
Ионы – это заряженные атомы. Когда ядра сталкиваются друг с другом, они могут соединиться. Если ядра соединяются, создается новый элемент. Но эти искусственно созданные элементы существуют лишь доли секунды, прежде чем они распадаются на другие элементы.
Знаете ли вы?
Ускорители частиц разгоняют заряженные частицы до скоростей, близких к скорости света.
Создание сверхтяжелых элементов (2016) от Chemistry World (5:40 мин.).
Производить новые элементы очень сложно. Все новые элементы быстро распадаются. Это происходит потому, что их ядра упакованы большим количеством протонов. Протоны заряжены положительно, поэтому отталкиваются друг от друга. Это делает атомы очень нестабильными. Например, период полураспада нихония составляет всего десять секунд. Когда элементы распадаются, они высвобождают частицы и энергию.
Знаете ли вы?
Тяжелые металлы на самом деле вовсе не тяжелые! Термин «тяжелый металл» относится к элементу с большим атомным весом (92-102) и высокой плотностью.
Почему эти четыре элемента имели такое большое значение, когда они были открыты?
Новейшие тяжелые элементы важны как с научной, так и с практической точки зрения. С научной точки зрения открытие может дать ученым лучшее понимание того, как ядра удерживаются вместе. Это могло бы, например, привести к разработке более безопасных и эффективных ядерных реакторов.
Ранее открытые тяжелые элементы также нашли практическое применение. Например, америций (Am) использовался в детекторах дыма. Плутоний (Pu) использовался в ядерном оружии, а также для питания беспилотных космических зондов.
Сейчас четыре новейших химических элемента используются только в исследованиях. Но ученые рассчитывают, что в ближайшем будущем они найдут для них практическое применение.
Знаете ли вы?
Первый искусственный тяжелый элемент был создан с помощью ускорителей элементарных частиц в Калифорнийском университете в Беркли. Этот элемент с атомным номером 93, теперь известный как нептуний.
Хотя седьмой период периодической таблицы элементов завершен, сама таблица может быть неполной. Некоторые ученые считают, что у периодической таблицы нет ограничений. Никто точно не знает, сколько времени это займет, но вполне возможно, что в будущем будут обнаружены новые элементы. В периодической таблице элементов однажды может появиться совершенно новая восьмая строка. Если это произойдет, пришло время для нового плаката таблицы Менделеева в вашем классе химии!
Нашли ли мы все элементы? (2016) от Reactions (5:10 мин.).
Отправные точки
- Какие элементы периодической таблицы вы используете в своей повседневной жизни?
- Если бы вы могли назвать новый элемент, как бы вы его назвали и почему?
- Как вы думаете, какое название химического элемента самое интересное? Почему?
- Несмотря на то, что элемент 113 был создан дважды, на его повторное создание ушло семь лет.
 Стоит ли создание новых элементов времени и финансовых вложений? Объяснять.
Стоит ли создание новых элементов времени и финансовых вложений? Объяснять. - Как развитие новых технологий способствовало открытию новых элементов? Объяснять.
- Есть ли еще открытые элементы? Объяснять.
- Каков процесс присвоения имен новым элементам после их открытия?
- Каковы преимущества изучения сверхтяжелых металлов? Зачем ученым тратить время на их создание?
- Как периодическая таблица элементов демонстрирует, что «научные знания являются предварительными и могут изменяться»?
- Должны ли ученые получать деньги за открытие нового элемента? Почему или почему нет?
- Четыре элемента, упомянутые в статье, были открыты разными группами ученых из Японии, России и США. Совпадает ли этот факт с вашим обычным представлением о том, как работают ученые? Объяснять.
- Эта статья поддерживает преподавание и изучение химии и естественных наук. Основное внимание уделяется разработке периодической таблицы, открытию химических элементов и базовой атомной структуры.
 Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы.
Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы. - Для ознакомления с этой темой учителя могут провести учащихся в групповом обсуждении, чтобы рассмотреть основы периодической таблицы – что это такое, как она была создана, как она существует, почему она важна и т. д.
В качестве альтернативы, прежде чем учащиеся прочитают статью, учителя могут попросить их заполнить раздел «До» стратегии обучения «Руководство по прогнозированию» для этой статьи. После прочтения и просмотра учителя могут предложить учащимся заполнить раздел «После» Руководства по прогнозированию. Студенты могли обсудить свои ответы и прояснить любые вопросы, которые у них могут остаться. Готовые к использованию воспроизводимые файлы для этой стратегии можно загрузить в форматах [документ Google] и [PDF]. Ключ ответа доступен в формате [PDF].
- В качестве продолжения учитель может провести групповое обсуждение открытия новых элементов в периодической таблице и того, что это может означать для будущего.

- В заключение учащиеся могут заполнить листок на выход, чтобы закрепить свое понимание видео и обсуждаемых тем. Учителя могли собирать и анализировать предоставленные ответы, чтобы оценить глубину понимания учащимися этой темы. Готовый к использованию Exit Slip, воспроизводимый для этого видео, можно загрузить в форматах [Google doc] и [PDF].
Связь и связь
- Какие элементы периодической таблицы вы используете в своей повседневной жизни?
- Если бы вы могли назвать новый элемент, как бы вы его назвали и почему?
- Как вы думаете, какое название химического элемента самое интересное? Почему?
Связь науки и техники с обществом и окружающей средой
- Несмотря на то, что элемент 113 был создан дважды, на его повторное создание ушло семь лет. Стоит ли создание новых элементов времени и финансовых вложений? Объяснять.
- Как развитие новых технологий способствовало открытию новых элементов? Объяснять.

Изучение концепций
- Есть ли еще элементы, которые предстоит открыть? Объяснять.
- Каков процесс присвоения имен новым элементам после их открытия?
- Каковы преимущества изучения сверхтяжелых металлов? Зачем ученым тратить время на их создание?
Природа науки/природа технологии
- Как периодическая таблица элементов демонстрирует, что «научные знания являются предварительными и могут изменяться»?
- Должны ли ученые получать деньги за открытие нового элемента? Почему или почему нет?
- Четыре элемента, упомянутые в статье, были открыты разными группами ученых из Японии, России и США. Совпадает ли этот факт с вашим обычным представлением о том, как работают ученые? Объяснять.
Рекомендации по обучению
- Эта статья поддерживает преподавание и изучение химии и естественных наук. Основное внимание уделяется разработке периодической таблицы, открытию химических элементов и базовой атомной структуры.
 Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы.
Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы. - Для ознакомления с этой темой учителя могут провести учащихся в групповом обсуждении, чтобы рассмотреть основу таблицы Менделеева – что это такое, как она была создана, как она существует, почему она важна и т. д.
В качестве альтернативы, прежде чем учащиеся прочитают статью, учителя могут попросить их заполнить раздел «До» стратегии обучения «Руководство по прогнозированию» для этой статьи. После прочтения и просмотра учителя могут предложить учащимся заполнить раздел «После» Руководства по прогнозированию. Студенты могли обсудить свои ответы и прояснить любые вопросы, которые у них могут остаться. Готовые к использованию воспроизводимые файлы для этой стратегии можно загрузить в форматах [документ Google] и [PDF]. Ключ ответа доступен в формате [PDF].
- В качестве продолжения учитель может провести групповое обсуждение открытия новых элементов в периодической таблице и того, что это может означать для будущего.

- В заключение учащиеся могут заполнить листок на выход, чтобы закрепить свое понимание видео и обсуждаемых тем. Учителя могли собирать и анализировать предоставленные ответы, чтобы оценить глубину понимания учащимися этой темы. Готовый к использованию Exit Slip, воспроизводимый для этого видео, можно загрузить в форматах [Google doc] и [PDF].
Четыре элемента будут добавлены в периодическую таблицу. Вот что вам нужно знать.
Стол полон!
Сандбх/Викисклад
Почему мы здесь?
В периодическую таблицу скоро добавятся четыре новых элемента: нихоний (Nh, элемент 113), московий (Mc, элемент 115), теннессин (Ts, элемент 117) и оганесон (Og, элемент 118).
Когда вы говорите «новый» …
Новый стол. Большинство из них были впервые синтезированы еще в 2002 или 2003 году (и все они теоретически существовали задолго до этого).
Подождите, я думал, что элементы — это основа всех вещей. Что вы имеете ввиду под словом «синтезировано»? Или «теоретически существует»?
Давайте немного вернемся к повторению школьного курса естествознания: простейшей единицей материи является атом, состоящий из трех основных частей: положительно заряженного протона, незаряженного нейтрона и отрицательно заряженного электрона. Протоны и нейтроны находятся в ядре, а атомы определяются тем, сколько протонов содержится в ядре — отсюда берется номер элемента (называемый атомным номером).
Протоны и нейтроны находятся в ядре, а атомы определяются тем, сколько протонов содержится в ядре — отсюда берется номер элемента (называемый атомным номером).
Из 118 известных элементов 94 естественным образом обнаружены на Земле. Остальные 24 не встречаются в природе, а вместо этого были созданы в лаборатории — синтезированы — с помощью процесса, который включает добавление протонов к ядрам до тех пор, пока общее количество протонов не станет таким, которого никогда раньше не достигали. Ученые считают, что элементов может быть от 170 до 210, в зависимости от того, сколько протонов они могут добавить к ядрам.
Как можно «добавить больше протонов» в ядро?
com/_components/slate-paragraph/instances/cq-article-74f8515b967651be0441a481da0378a8-component-9@published»> Все элементы, которые еще предстоит открыть, а также все элементы, открытые в последние десятилетия, являются сверхтяжелыми элементами, которые к тому же очень радиоактивны. Их создание включает в себя разбивание более мелких элементов в надежде, что они сольются. Но даже когда они создаются, они настолько радиоактивны, что крайне нестабильны, иногда длятся всего доли секунды. Практически сразу после образования они исчезают.
Понятно… так что, новые элементы имеют какое-то значение? Что мы собираемся сделать с ними , просто создать их и позволить им исчезнуть?
Для этих элементов да. Но есть вещи, называемые «островками стабильности». Несмотря на общую тенденцию к тому, что элементы становятся менее стабильными по мере увеличения размера, иногда встречается элемент с «магическим числом» протонов и нейтронов, что делает его гораздо более стабильным, чем он должен быть по сравнению с его размером. Эксперты считают, что следующий островок стабильности, вероятно, появится где-то между элементами 120 и 126, но это всего лишь оценка. Это мог быть 127-й или 171-й элемент. Мог быть 118-й (нет).
Но есть вещи, называемые «островками стабильности». Несмотря на общую тенденцию к тому, что элементы становятся менее стабильными по мере увеличения размера, иногда встречается элемент с «магическим числом» протонов и нейтронов, что делает его гораздо более стабильным, чем он должен быть по сравнению с его размером. Эксперты считают, что следующий островок стабильности, вероятно, появится где-то между элементами 120 и 126, но это всего лишь оценка. Это мог быть 127-й или 171-й элемент. Мог быть 118-й (нет).
Как только мы достигнем следующего острова, у нас будет сверхстабильный элемент, который может существовать от минут до миллионов лет (по сравнению с микросекундной продолжительностью жизни его соседей). Это может иметь несколько промышленных применений — например, это может быть более мощный генератор ядерной энергии. Хотя теперь мы знаем, что недавно открытые элементы не имеют особого практического применения, мы можем думать о них как о ступеньках на пути к элементу, который может иметь практическое применение.
Если они были обнаружены более десяти лет назад, почему они так долго не добавлялись?
Суть науки в воспроизводимости. Как только одна группа ученых заявляет, что открыла новый элемент (или, по сути, совершила какой-либо революционный научный акт), другие ученые должны подтвердить открытие, повторив эксперимент и посмотрев, получатся ли они те же результаты. Возможно, вы слышали, что в психологической и биомедицинской областях происходит что-то вроде кризиса, когда ученые не могут воспроизвести открытия других ученых. Это огромная проблема, потому что, если другие ученые не могут подтвердить результаты, воспроизведя их, люди могут просто лгать о том, что было обнаружено их исследованием. Как, скажем, этот новый элемент, который они только что открыли.
Как, скажем, этот новый элемент, который они только что открыли.
Такое когда-нибудь случалось?
Да! И совсем недавно тоже. В 1999 году команда из Калифорнии заявила, что синтезировала два новых элемента, 116 и 118 (которые в настоящее время фактически синтезированы и вскоре будут добавлены в периодическую таблицу как оганесон), но когда другие исследователи не смогли повторить эксперимент, один исследователь признал, что сфабриковал данные.
Итак, кто будет называть новые элементы?
com/_components/slate-paragraph/instances/cq-article-74f8515b967651be0441a481da0378a8-component-18@published»> Кто бы их ни обнаружил, конечно.
Значит, ученые могут называть их как хотят?
Не совсем так. IUPAC—
Кто?
Международный союз теоретической и прикладной химии. Среди прочего, это люди, которые контролируют то, что происходит в периодической таблице.
О, хорошо. Вперед, продолжать.
Во всяком случае, IUPAC говорит, что элементы должны быть названы в честь одной из пяти вещей: ученого, места, минерала или вещества, описания элемента или мифологической ссылки. Из новых элементов три названы в честь мест и один назван в честь человека.
Подождите, мифологическая отсылка? Вы должны привести мне пример.
Есть 15 элементов, названных в честь мифологического персонажа или ссылки. Торий и ванадий названы в честь скандинавского бога войны Тора и богини красоты Ванадис соответственно. Из греческой мифологии гелий назван в честь бога солнца Гелиоса, иридий — в честь богини радуги Ирис, а титан — в честь титанов.
Торий и ванадий названы в честь скандинавского бога войны Тора и богини красоты Ванадис соответственно. Из греческой мифологии гелий назван в честь бога солнца Гелиоса, иридий — в честь богини радуги Ирис, а титан — в честь титанов.
Это не говоря уже обо всех элементах, названных в честь планет (нынешних или бывших) — ртути, фосфора (старое название Венеры), урана, нептуния, плутония — каждый из которых получил свое название от мифологических персонажей. То же самое для двух элементов, названных в честь астероидов: палладия и церия.
Хорошо, но ни один из этих новых элементов не назван в честь мифологии. Так в честь чего назван нихоний?
com/_components/slate-paragraph/instances/cq-article-74f8515b967651be0441a481da0378a8-component-29@published»> Название основано на японском слове Nippon , которое является одним словом для самой Японии, где был обнаружен этот элемент, и означает «Страна восходящего солнца». Ранее известный как унунтрий (это название основано на неуклюжем и нелюбимом среди химиков соглашении об именах элементов, которые еще не были обнаружены или проверены по их атомному номеру — un+un+tri+um=one+one+three+um , или 113, его атомный номер), у нихония период полураспада составляет 20 секунд, что делает его самым долгоживущим из новых элементов. Другие предложенные названия включали японий, рикений (в честь института, в котором он был открыт) и нишинаниум (в честь японского физика).
Московиум?
com/_components/slate-paragraph/instances/cq-article-74f8515b967651be0441a481da0378a8-component-31@published»> Имени Москвы.
Город?
Нет, технически он назван в честь Московской «области», где находится лаборатория, обнаружившая московий. Области похожи на штаты США, так что на самом деле есть Москва, Москва. Типа Нью-Йорк, Нью-Йорк. В частности, лаборатория, обнаружившая московий, находится в городе Дубна.
Что было дальше?
Теннессин.
Правильно. Назван в честь Теннесси?
Вы поняли. Исследователи из Университета Вандербильта и Университета Теннесси-Ноксвилля объединились, чтобы открыть этот элемент в 2010 году, что сделало его самым последним синтезированным элементом. Кроме того, это всего лишь второй элемент, названный в честь штата США, первым из которых является калифорний.
А оганесон?
Оганессон, ранее известный как элемент 118, назван в честь Юрия Оганесяна, российского физика-ядерщика. И московий, и оганесон были обнаружены в одном месте, в Объединенном институте ядерных исследований. Это тот же исследовательский центр, где впервые были синтезированы многие другие элементы. Фактически, ОИЯИ открыл или помог открыть пять из шести самых последних элементов.
И московий, и оганесон были обнаружены в одном месте, в Объединенном институте ядерных исследований. Это тот же исследовательский центр, где впервые были синтезированы многие другие элементы. Фактически, ОИЯИ открыл или помог открыть пять из шести самых последних элементов.
Итак… какой-то мертвец?
Вообще-то он еще жив! Он был одним из ученых, которые помогли открыть этот элемент. Если предложенное название будет доработано, оганесон станет вторым элементом, названным в честь живого человека (первым был сиборгий, названный в честь Гленна Сиборга).
Так что же уникального в этих элементах?
com/_components/slate-paragraph/instances/cq-article-74f8515b967651be0441a481da0378a8-component-43@published»> Если честно, самое интересное в этих элементах, наверное, то, насколько они нестабильны. Все они радиоактивны и имеют чрезвычайно короткий период полураспада, то есть время, необходимое для исчезновения половины количества элемента. Для простоты, если вы начнете с четырех фунтов радиоактивного вещества и подождете один период полураспада, у вас останется два фунта чистого вещества.
Мы упоминали, что период полураспада нихония составляет около 20 секунд. Московий еще короче, его период полураспада составляет 220 миллисекунд. У Теннесси всего 78 миллисекунд. Если вы хотите получить представление о том, как быстро распадается теннессин, запустите приложение секундомера и постарайтесь запускать и останавливать его как можно быстрее. Вероятно, вы получите что-то вроде 0:00:15, что составляет 150 миллисекунд. За это время прошло почти два периода полураспада теннессина.
Вероятно, вы получите что-то вроде 0:00:15, что составляет 150 миллисекунд. За это время прошло почти два периода полураспада теннессина.
Оганесон—
Дайте угадаю: его период полураспада еще короче.
А, да. Вроде как выбил из моих парусов ветер.
Извините.
К счастью, в этом есть кое-что еще. На сегодняшний день оганесон является самым тяжелым известным элементом, и он не вступает в реакцию и не связывается легко с другими элементами. Он также находится в крайней правой части таблицы Менделеева, в столбце (или «семействе») благородных газов, таких как неон и аргон, которые, как известно, инертны и редко реагируют с чем-либо. что оганесон на самом деле является твердым телом, что делает его первым известным «благородным твердым телом», твердой версией благородного газа. Однако трудно быть уверенным, поскольку когда-либо наблюдались только три, а то и четыре атома оганесона.
На сегодняшний день оганесон является самым тяжелым известным элементом, и он не вступает в реакцию и не связывается легко с другими элементами. Он также находится в крайней правой части таблицы Менделеева, в столбце (или «семействе») благородных газов, таких как неон и аргон, которые, как известно, инертны и редко реагируют с чем-либо. что оганесон на самом деле является твердым телом, что делает его первым известным «благородным твердым телом», твердой версией благородного газа. Однако трудно быть уверенным, поскольку когда-либо наблюдались только три, а то и четыре атома оганесона.
PeterHermesFurian/iStock
Что будет дальше?
Ну, если вы присмотритесь, то увидите, что мы заполнили последнюю строку таблицы Менделеева. Это означает, что когда будет обнаружен следующий элемент, нам придется изменить дизайн таблицы… немного.
Это означает, что когда будет обнаружен следующий элемент, нам придется изменить дизайн таблицы… немного.
Какая головная боль. Как скоро все это закончится?
Имена были объявлены 8 июня, и у общественности есть пять месяцев — до 8 ноября — чтобы выразить любые опасения по поводу предложенных имен. После этого IUPAC, как ожидается, формализует имена и обновит периодическую таблицу.
Но эти имена окончательные, верно? Общественность может только возражать, а не голосовать?
com/_components/slate-paragraph/instances/cq-article-74f8515b967651be0441a481da0378a8-component-56@published»> После катастрофы с Боати МакБотфейс, это кажется разумным подходом, да.
* Исправление от 16 октября 2017 г.: Первоначально в этой части столбец в периодической таблице ошибочно определялся как представляющий «период», хотя на самом деле он представляет «семью». (Возврат.)
объяснитель
Наука
Физика
Периодическая таблица элементов — ИЮПАК
Последний выпуск Периодической таблицы (от 4 мая 2022 г.) включает самые последние сокращенные стандартные значения атомного веса, опубликованные Комиссией ИЮПАК по изотопному содержанию и атомному весу (CIAAW), составленные как часть Таблицы стандартных атомных весов 2021 г. 2021 г. Для элементов, у которых отсутствуют изотопы с характерным изотопным содержанием в природных земных образцах, массовое число нуклида с самым длительным подтвержденным периодом полураспада указано в квадратных скобках. См. PAC (AOP, 4 мая 2022 г.; https://doi.org/10.1515/pac-2019).-0603) для получения полной информации или посетите сайт Commission II.1 @ciaaw.org
2021 г. Для элементов, у которых отсутствуют изотопы с характерным изотопным содержанием в природных земных образцах, массовое число нуклида с самым длительным подтвержденным периодом полураспада указано в квадратных скобках. См. PAC (AOP, 4 мая 2022 г.; https://doi.org/10.1515/pac-2019).-0603) для получения полной информации или посетите сайт Commission II.1 @ciaaw.org
Загрузите версию в формате PDF (размер Letter или A4) или A3 (PDF) или см. более ранние версии
Ознакомьтесь со SPECIAL Chem Int Январь 2019 г. — Международный год Периодической таблицы (МГПТ) — при участии Яна Ридейка, Натальи Тарасовой, Г.Дж. Ли, Сигурд Хофманн, Эрик Шерри, Юрис Мейя, Норман Э. Холден, Тайлер Б. Коплен, Питер Махаффи, Ян Миллс, Роберто Марквардт и другие.
Периодическая таблица элементов и изотопов IUPAC (IPTEI) для образовательного сообщества
— следуйте проекту IUPAC 2007-038-3-200 и последующему проекту 2014-024-1-200
— читайте «Атомные массы: нет Longer Constants of Nature», Chem Int 33(2), 10–15 (2011), https://doi. org/10.1515/ci.2011.33.2.10
org/10.1515/ci.2011.33.2.10
— ознакомьтесь с интерактивной версией на iupac.org/isotopes- материя (или см. выпуск)
– Узнайте больше, почему изотопы имеют значение! https://iupac.org/100/stories/why-isotopes-matter/
— Ознакомьтесь с последним поэлементным обзором IPTEI, включая таблицу всех известных стабильных и радиоактивных изотопов для каждого элемента и примеры практического применения изотопных измерений и технологий https://iupac.org/iptei/
— Доступ по адресу http: //ciaaw.org/periodic-table-isotopes.htm полное разрешение этой таблицы в формате PDF (предоставлено Королевским центром визуализации в науке).
Благодаря своей работе, связанной с химическими элементами, ИЮПАК может выпускать периодическую таблицу, которая соответствует современным требованиям. Участие IUPAC охватывает различные аспекты таблицы и данных, которые она раскрывает, и несколько отчетов и рекомендаций, некоторые из которых совсем недавно, свидетельствуют об этом вкладе.
В частности, IUPAC принимает непосредственное участие в следующем:
- установление критериев для открытия нового элемента
- определение структуры временного имени и символа
- оценка требований, приводящих к проверке и присвоению открытия элемента
- координирует присвоение имени новому элементу, вовлекает исследовательскую лабораторию и допускает общественное обсуждение
- создание точных правил для как назвать новый элемент
- определение групп 1-18 и собирательных имен
- определение того, какие элементы относятся к группе 3
- регулярный пересмотр стандартных атомных весов
Таблица принадлежит вам, чтобы использовать . Подробная информация о последнем выпуске представлена выше . Подробная информация ниже содержит несколько ссылок на журнал IUPAC в Pure and Applied Chemistry 9. 0351 ( PAC ) и журнал Chemistry International ( CI ).
0351 ( PAC ) и журнал Chemistry International ( CI ).
- Критерии открытия нового элемента
Оценка того, был ли элемент «обнаружен», — непростая задача. Изучая профили открытия трансфермиевых элементов в начале 90-х годов, IUPAC и IUPAP установили ряд критериев, которые должны быть выполнены для признания открытия элемента. Подробности в PAC 1991, Vol. 63, № 6, стр. 879-886 (https://doi.org/10.1351/pac199163060879) и PAC 1993, Vol. 65, № 8, стр. 1757-1814 (https://doi.org/10.1351/pac199365081757)
В ноябре 2018 года IUPAC/IUPAP выпустил предварительный отчет ОБ ОТКРЫТИИ НОВЫХ ЭЛЕМЕНТОВ. Представлены критерии и рекомендации по установлению приоритета открытия потенциальных новых элементов. — узнать больше
- Временное название и условное обозначение
Несмотря на то, что элемент может быть заявлен, до того, как заявление будет подтверждено и до того, как элемент будет официально назван, элемент имеет временное имя и символ. Соответствующие рекомендации, устанавливающие эту систематическую номенклатуру, были опубликованы в 1978 г.; см. PAC 1979, Vol. 51, № 2, стр. 381-384; https://doi.org/10.1351/pac197951020381
Соответствующие рекомендации, устанавливающие эту систематическую номенклатуру, были опубликованы в 1978 г.; см. PAC 1979, Vol. 51, № 2, стр. 381-384; https://doi.org/10.1351/pac197951020381
В результате, именно так в марте 2016 года элемент 113 был назван унунтрием или с символом Uut.
История трехбуквенных символов изложена в статье, подготовленной Ларсом Эрстрёмом и Норманом Холденом и опубликованной в Chem Int 2016, Vol. 38, № 2, с. 4-8; https://doi.org/10.1515/ci-2016-0204
- Проверка и присвоение обнаружения элемента
Заявления об открытии новых элементов время от времени появляются в научной литературе. IUPAC вместе с IUPAP участвует в оценке этих заявлений. В результате выпускаются технические отчеты IUPAC, в которых анализируются все соответствующие ссылки и признаются лаборатории(и), заявления которых соответствуют согласованным критериям.
В 2016 году было выпущено два таких отчета, которые охватывают элементы 113, 115, 117 и элемент 118; См. PAC 2016, Vol. 88, № 1-2, стр. 139-153; https://doi.org/10.1515/pac-2015-0502 и PAC 2016, Vol. 88, № 1-2, стр. 155-160; https://doi.org/10.1515/pac-2015-0501
PAC 2016, Vol. 88, № 1-2, стр. 139-153; https://doi.org/10.1515/pac-2015-0502 и PAC 2016, Vol. 88, № 1-2, стр. 155-160; https://doi.org/10.1515/pac-2015-0501
- Именование нового элемента
После проверки обнаружения нового элемента и присвоения приоритета его обнаружения можно начинать процесс именования. Лаборатории, которой поручено открытие, предлагается предложить название и условное обозначение. Затем IUPAC рассмотрит предложение и, если оно будет согласовано, после дополнительного 5-месячного публичного рассмотрения, формализует название. Самый последний пример таких рекомендаций был опубликован в 2012 году и касался названий и символов элементов 114 и 116; См. PAC 2012, Том. 84, № 7, стр. 1669-1672; https://doi.org/10.1351/PAC-REC-11-12-03
Краткий обзор текущих процедур опубликован в недавней статье Джона Кориша; См. CI 2016, Vol. 38, № 2, стр. 9-11; https://doi. org/10.1515/ci-2016-0205
org/10.1515/ci-2016-0205
8 июня 2016 г. IUPAC опубликовал предварительные названия для последних 4 элементов 113, 115, 117 и 118 — см. объявил утвержденные названия и символы — см. релиз.
Для размышлений об опыте именования элементов в 2016 г. см. Chem Int , апрель 2017 г., стр. 30–21, автор Ян Ридейк; https://doi.org/10.1515/CI-2017-0222
См. Архив с более ранним компиляцией и ссылками
- Группы 1-18 и собирательные имена
- Группа 3
3
3
3
3
- 9013
Опять же, у IUPAC есть набор рекомендаций, определяющих, какое имя может носить элемент. И корень, и окончание должны соответствовать согласованным рекомендациям. Подробные рекомендации были опубликованы в 2002 г., а пересмотренная версия опубликована в 2016 г. для лучшего учета элементов в группах 17 и 18. См. 9. 0350 PAC 2002, Том. 74, № 5, стр. 787-791; https://doi.org/10.1351/pac200274050787 и PAC 2016, Vol. 88, № 4, стр. 401-405 https://doi.org/10.1515/pac-2015-0802 (или https://iupac.org/project/2015-031-1-200)
0350 PAC 2002, Том. 74, № 5, стр. 787-791; https://doi.org/10.1351/pac200274050787 и PAC 2016, Vol. 88, № 4, стр. 401-405 https://doi.org/10.1515/pac-2015-0802 (или https://iupac.org/project/2015-031-1-200)
С 1988 г. IUPAC рекомендовал просто нумеровать группы (, т.е. . столбцы) от 1 до 18. орг/10.1351/pac198860030431)
Лантаноиды и актиноиды являются собирательными названиями, также рекомендованными IUPAC. Лантаноиды (от La до Lu) предпочтительнее лантанидов, и хотя лантаноид означает «подобный лантану» и поэтому не должен включать лантан, однако лантан стал широко использоваться. Актиноиды включают от Ac до Lr.
Время от времени обсуждался вопрос о том, какие именно элементы должны быть помещены в группу 3. Недавно был инициирован проект IUPAC для решения этого вопроса.

 Поэтому научное сообщество стремится систематизировать информацию о химических связях, чтобы перейти к алгоритмам, прогнозирующим строение многокомпонентных соединений. Этому способствует и интерес к материалам на основе органических соединений, к компонентам солнечных батарей, электрооптическим свойствам жидких кристаллов, лекарствам. Чтобы вырабатывать рекомендации к синтезу новых функциональных материалов, нужно, прежде всего, систематизировать знания о том, как могут взаимодействовать между собой частицы в веществе, и научиться использовать эти данные».
Поэтому научное сообщество стремится систематизировать информацию о химических связях, чтобы перейти к алгоритмам, прогнозирующим строение многокомпонентных соединений. Этому способствует и интерес к материалам на основе органических соединений, к компонентам солнечных батарей, электрооптическим свойствам жидких кристаллов, лекарствам. Чтобы вырабатывать рекомендации к синтезу новых функциональных материалов, нужно, прежде всего, систематизировать знания о том, как могут взаимодействовать между собой частицы в веществе, и научиться использовать эти данные».
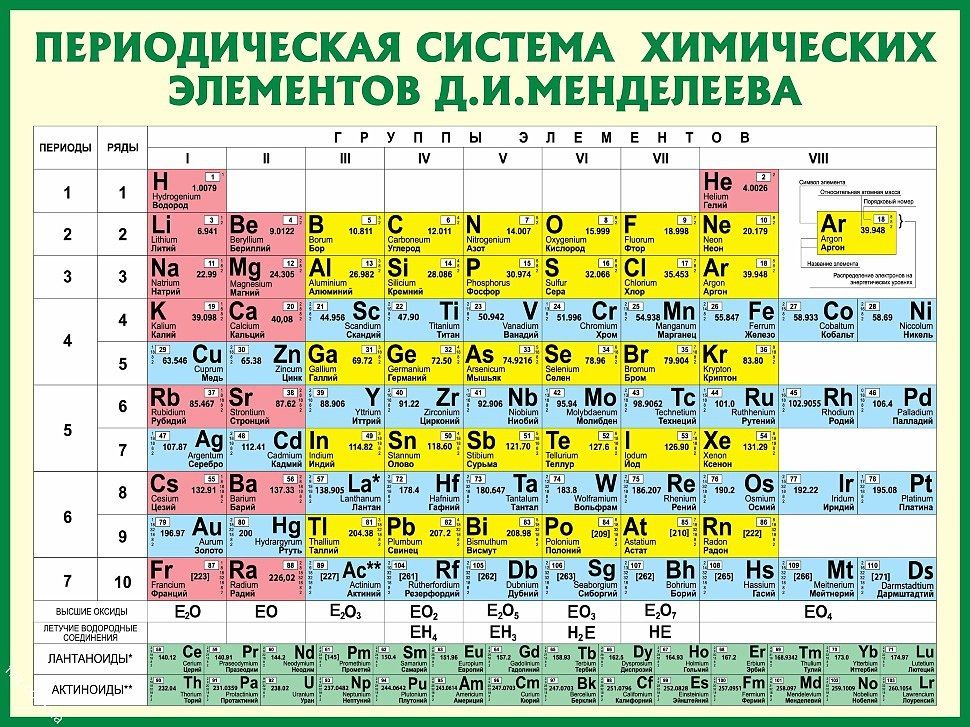 Если химические знания дополняются знаниями, например, из области квантовой кристаллографии и опираются на суперкомпьютерные вычисления, это помогает завладеть научными приоритетами. В феврале 2018 года в высокорейтинговом научном издании «Journal of Computational Chemistry» по теме характеризации химических связей опубликована наша совместная работа с профессором Владимиром Цирельсоном из Российского химико-технологического университета им. Д. И. Менделеева. Исследования молекулярных кристаллов с галогенными связями и поиск среди них новых структур с нелинейно-оптическими свойствами ведется совместно с профессором Артёмом Масуновым из Университета Центральной Флориды (США). Наша научная группа, в которую входят молодые ученые ЮУрГУ, Ирина Юшина и Александр Дьяков, ставит перед собой задачу обработать максимальный объем информации, используя эволюционные алгоритмы. В этой новой области очень много как проблем, так и возможностей».
Если химические знания дополняются знаниями, например, из области квантовой кристаллографии и опираются на суперкомпьютерные вычисления, это помогает завладеть научными приоритетами. В феврале 2018 года в высокорейтинговом научном издании «Journal of Computational Chemistry» по теме характеризации химических связей опубликована наша совместная работа с профессором Владимиром Цирельсоном из Российского химико-технологического университета им. Д. И. Менделеева. Исследования молекулярных кристаллов с галогенными связями и поиск среди них новых структур с нелинейно-оптическими свойствами ведется совместно с профессором Артёмом Масуновым из Университета Центральной Флориды (США). Наша научная группа, в которую входят молодые ученые ЮУрГУ, Ирина Юшина и Александр Дьяков, ставит перед собой задачу обработать максимальный объем информации, используя эволюционные алгоритмы. В этой новой области очень много как проблем, так и возможностей».
 Стоит ли создание новых элементов времени и финансовых вложений? Объяснять.
Стоит ли создание новых элементов времени и финансовых вложений? Объяснять. Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы.
Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы.

 Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы.
Введенные понятия включают атомный номер, протоны, нейтроны, электроны, период, тяжелые металлы и сверхтяжелые металлы.