Содержание
Что такое оптогенетика? — azimp-micro.ru
История развития, определение и основные принципы оптогенетики. Современные применения оптогенетической стимуляции.
В течение многих лет нейробиологи хотели понять, как поведение и когнитивная деятельность связаны с активностью нейронных цепей. Для исследования этих вопросов, ученые первоначально использовали затратные по времени фармакологические и неточные методы электростимуляции для контроля активности нейронов. Однако, при наличии различных классов нейронов, сообщающихся через обширные, сложные сети и быстрые электрические сигналы, необходимо идентифицировать метод с высоким пространственным и высоким временным разрешением для точного управления отдельными нейронами и причинно-следственной декодировки функции активности нейронных цепей.
В 1979 году Фрэнсис Крик предложил новое решение: использовать свет для управления нейроном (Boyden et al. 2005). Выведенная из этой самой идеи и с усилиями многих других ученых, родилась революционная техника оптогенетики.
Оптогенетика, генетический метод активации или ингибирования отдельных нейронов светом, была изобретена в 2005 году Карлом Дейссеротом и Эдвардом Бойденом (Boyden et al. 2005). Примечательно, что развитие оптогенетики началось с открытия Питера Гегеманна, который успешно экспрессировал деполяризующий синий свет опсин, канал родопсин-2 (ChR2), в клеточной культуре (Nagel et al. 2003).
Развивая эти открытия, Дейссерот и Бойден вирусно экспрессировали ChR2 в нейронах, они впервые продемонстрировали, что нейроны могут быть активированы с помощью синего света (Boyden et al. 2005).
С точностью до миллисекунды оптогенетика позволила быстро контролировать всплески нейронов. В качестве метода, использующего как оптику, так и генетику, термин «оптогенетика» был придуман на основе этих экстраординарных открытий.
Оптогенетически экспрессирующие клетки (в синем цвете) активируются при освещении синим светом
Как работает оптогенетика
Оптогенетика стала возможной благодаря открытию опсинов, таких как ChR2.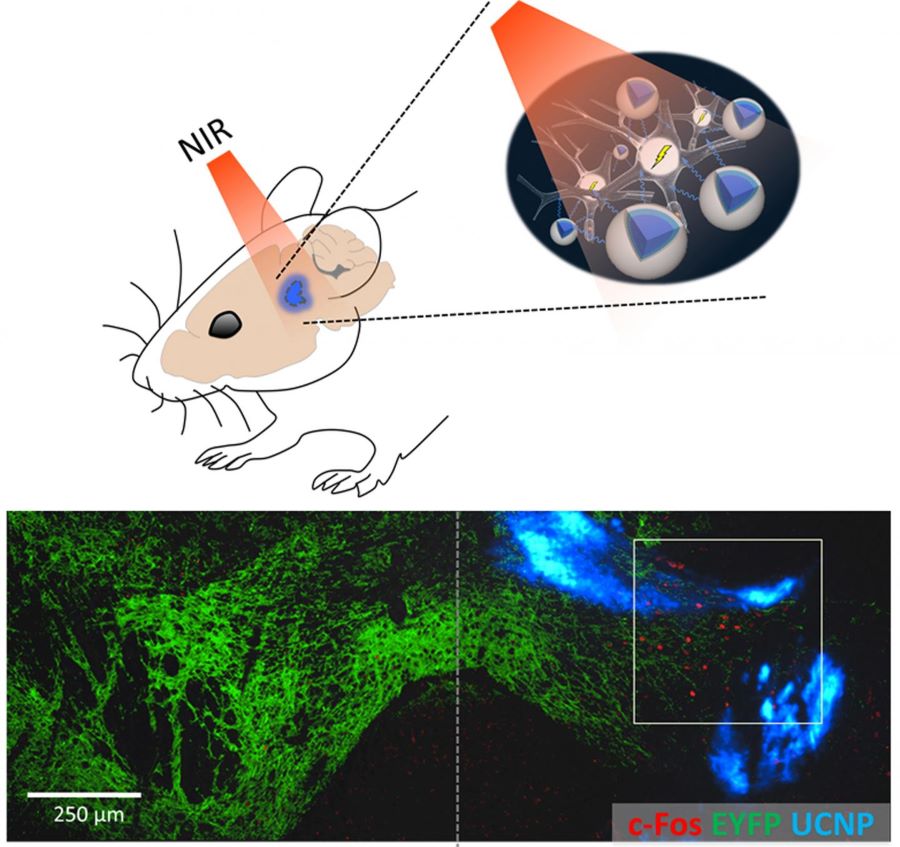 Опсины — это светочувствительные каналы, которые вызывают деполяризацию или гиперполяризацию клетки через такие механизмы, как приток ионов или белковые сигнальные каскады (Kim et al. 2017). Опсины чувствительны к определенным длинам волн света.
Опсины — это светочувствительные каналы, которые вызывают деполяризацию или гиперполяризацию клетки через такие механизмы, как приток ионов или белковые сигнальные каскады (Kim et al. 2017). Опсины чувствительны к определенным длинам волн света.
Например, синий свет (~470 нм) активирует ChR2, что приводит к притоку ионов Na+, в свою очередь деполяризующих нейрон (Boyden et al. 2005). Вирусная экспрессия позволила исследователям экспрессировать оптогенетические опсины в мозге животных, таких как грызуны.
Междисциплинарное сотрудничество между нейробиологами, биологами и инженерами привело к расширению оптогенетического инструментария. Опсины были открыты для манипулирования нейронами, включающимися или выключающимися с различной скоростью и с различными длинами волн (см. Таблицу 1).
Например, было обнаружено, что галоргдопсин, ингибирующий опсин, отключает нейроны, а красные активированные опсины, такие как JAWS, проникают глубже в мозг (Kim et al. 2017). Кроме того, вирусные стратегии экспрессии оптогенетических белков в головном мозге усовершенствовались, что позволило ученым манипулировать активностью определенных классов клеток для изучения общемозговых проекций (Kim et al.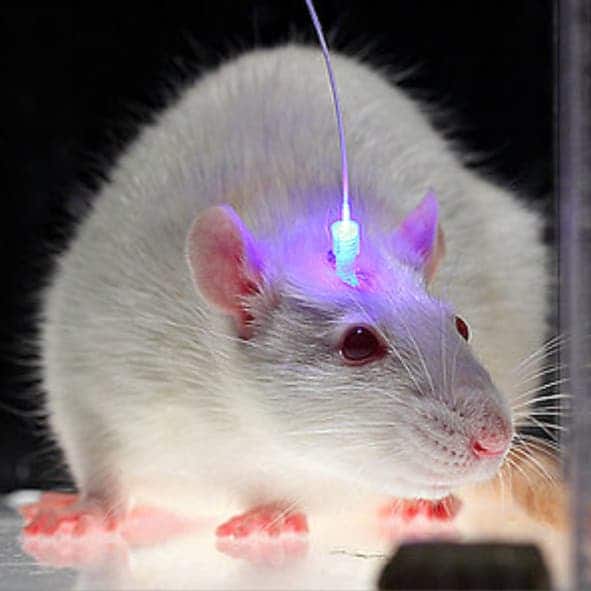 2017).
2017).
|
Оптогенетические конструкты
|
Длина волны возбуждения
|
Функция
|
|
ChR2
|
470 нм
|
Активация
|
|
GtACR2
|
470 нм
|
Ингибирование
|
|
ArchT
|
540 нм
|
Ингибирование
|
|
C1v1
|
560 нм
|
Активация
|
|
NpHr
|
590 нм
|
Ингибирование
|
|
bReaChES
|
590 нм
|
Активация
|
|
Chrimson
|
590 нм
|
Активация
|
|
ReaChR
|
620 нм
|
Активация
|
|
JAWS
|
620 нм
|
Ингибирование
|
Применения оптогенетической стимуляции
Оптогенетика принесла пользу многим научным областям, позволив ученым контролировать активность различных типов клеток с точностью до миллисекунды.
В нейробиологии оптогенетика позволила ученым причинно-следственно связать нейронные цепи, поведение и функции (Kim et al. 2017). Кроме того, оптогенетика может быть выполнена как в экспериментах in vitro с электрофизиологией, так и в экспериментах со свободным поведением животных, чтобы исследовать связь между типами клеток и поведением. Большое преимущество для нейробиологов состоит в том, что оптогенетика была адаптирована для использования на грызунах, приматах, свободноживущих нематодах, дрозофилах и данио-рерио для изучения нейронных корреляций когнитивной деятельности и поведения.
Как точный метод контроля клеточной активности, оптогенетика оказала влияние на научные области, выходящие за рамки нейробиологии, с недавним вкладом в клеточную биологию и исследования сердца (Repina et al. 2017; Ferenczi et al. 2019).
С клинической точки зрения применение оптогенетики стало использоваться для изучения восстановления зрения и глубокой стимуляции мозга при двигательных заболеваниях (Towne & Thompson 2016).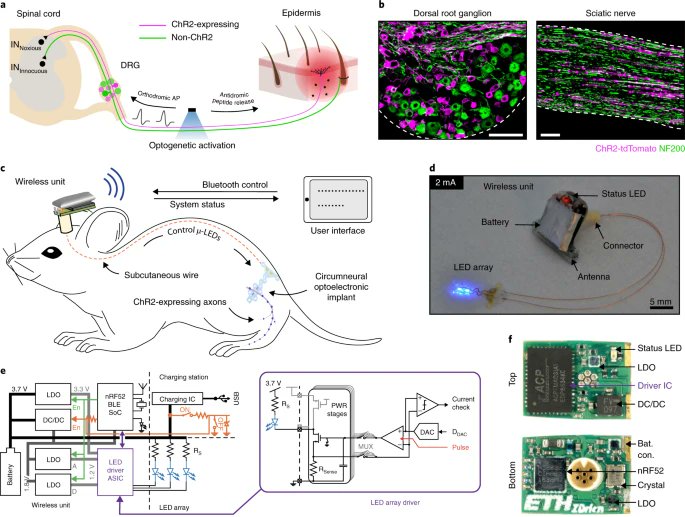
С помощью причинного-следственного метода для тщательного анализа функции активности нейронов в реальном времени оптогенетика продвинула наше понимание мозга и может однажды привести к значительным клиническим результатам.
Пример, демонстрирующий использование оптогенетики в электрофизиологии (исследование среза мозга)
Оптогенетика: самые светлые мысли | Наука и жизнь
Мозг состоит из миллиардов клеток — нейронов, организованных в сложные сети. Следить за работой отдельных групп нейронов трудно, ещё сложнее ими управлять. Однако около десяти лет назад у исследователей появился уникальный инструмент для изучения нервных клеток. Теперь включать или выключать нейроны можно, просто направив на них луч света, причём прямо в мозге. Метод, «осветивший» в последние годы изучение мозга, называют оптогенетикой.
Мышь со встроенным в мозг оптоволокном для доставки света. Фото: http://bioeng.psu.edu/labs/Zhang-Lab/Research. html (Университет штата Пенсильвания, США).
html (Университет штата Пенсильвания, США).
Состояния покоя и возбуждения нейрона определяются разницей в концентрации положительных ионов K+ и Na+ внутри клетки и за её пределами. В состоянии покоя положительные ионы K+ эффективно выводятся из нейрона за счёт диффузии (А).
С помощью оптогенетики исследователи могут управлять нейронами, используя свет. Рисунок из статьи Lizzie Buchen// Nature, vol. 465, 6 may 2010.
Нейрон, подготовленный для управления светом. Светочувствительные ионные каналы клетки содержат участок, флуоресцирующий зелёным светом.
‹
›
Открыть в полном размере
В ожидании нового метода
Работу любой системы удобно изучать, поочередно выключая отдельные её части. Таким способом можно выявить те из них, что важны для работы всей системы. Определив ключевые элементы системы, полезно научиться ими манипулировать, тогда мы сможем управлять процессом по своему усмотрению и изучать его в деталях. Однако когда речь идёт об исследовании нервной системы, применение такого подхода сталкивается с серьёзными трудностями.
В мозге человека находится около 80 миллиардов нейронов, образующих сложные разветвлённые сети. Считается, что каждая отдельная нейронная сеть может определять некую элементарную функцию. Взаимодействие этих сетей в разных зонах мозга обеспечивает сложную нервную деятельность. Долгие годы о функциях структур мозга судили по нарушениям, которые появлялись при повреждении его участков, или по тому, какие зоны мозга активны при выполнении испытуемым различных заданий.
Интересные результаты были получены в экспериментах на животных, в мозг которых вживляли электроды, чтобы искусственно возбуждать те или иные участки мозга. На животных проводили и исследования с использованием химических веществ, способных избирательно тормозить работу нейронов определённого типа. Однако каждый из этих методов имеет существенные недостатки: либо действие одновременно на большое количество нейронов, либо низкое временн?е разрешение. Даже самый малый вживлённый в мозг электрод неизбирательно возбуждает все окружающие его нервные клетки, а самый современный химический ингибитор действует гораздо дольше, чем естественные стимулы.
Инструментарий
Идею управлять нейронами «точечно» впервые чётко высказал в 1979 году Френсис Крик (получивший Нобелевскую премию за открытие структуры ДНК). Спустя двадцать лет, в 1999-м, он предложил использовать для возбуждения нейронов свет. Световое излучение имеет много преимуществ: оно быстро достигает объекта, его легко дозировать и представлять в виде коротких импульсов. В 2005 году группа исследователей из Стэнфордского университета под руководством Карла Диссерота сумела вызвать возбуждение нервных клеток, облучая их светом. Для этого нейроны пришлось подвергнуть генно-инженерным манипуляциям. Новый метод получил название оптогенетики и за последние годы произвёл настоящую революцию в исследованиях нервной системы.
Чтобы нейрон стал светочувствительным, он должен иметь белок — рецептор света. Пример нейронов, чувствительных к свету «от природы», — клетки сетчатки глаза. Они содержат рецептор родопсин, который состоит из белка, называемого опсином, и кофактора ретиналя — производного витамина А. Под действием света ретиналь меняет свою структуру, и эти изменения передаются на белок, который активирует сигнальные пути нейрона, вызывающие его возбуждение. В покое нейрон заряжен отрицательно: внутри клетки концентрация натрия и прочих положительных ионов мала. При возбуждении включаются ионные каналы в наружной мембране нейрона, закачивающие положительный натрий внутрь. Заряд внутри клетки становится положительным. В таком состоянии нейрон возбуждён и готов передать сигнал остальным нейронам в сети.
Под действием света ретиналь меняет свою структуру, и эти изменения передаются на белок, который активирует сигнальные пути нейрона, вызывающие его возбуждение. В покое нейрон заряжен отрицательно: внутри клетки концентрация натрия и прочих положительных ионов мала. При возбуждении включаются ионные каналы в наружной мембране нейрона, закачивающие положительный натрий внутрь. Заряд внутри клетки становится положительным. В таком состоянии нейрон возбуждён и готов передать сигнал остальным нейронам в сети.
Первые попытки создать нейроны, управляемые светом, заключались в переносе в них опсиновых генов млекопитающих. Чтение нового гена в таких нейронах приводит к синтезу светочувствительного белка. Эти работы, проводившиеся в начале 2000-х, имели очень ограниченный успех. Под действием света искусственные нейроны с родопсином активировались медленно и нестабильно. Сигнальные системы нейронов не предназначены для взаимодействия с родопсином. Казалось, оптогенетика, едва возникнув, зашла в тупик. Решение пришло неожиданно.
Решение пришло неожиданно.
Не только животным нужно чувствовать свет. Светочувствительными рецепторами обладают, например, одноклеточные водоросли. Их «зрение» также основано на работе родопсинов. Замечательное свойство этих белков заключается в том, что они не только воспринимают свет, но и сами играют роль ионных каналов и вызывают возбуждение клетки. Поэтому их принято называть канальными родопсинами. Оказалось, что эти белки работают гораздо стабильнее родопсинов млекопитающих. Нейроны, несущие их на своей поверхности, дают быстрый и чёткий ответ на световое излучение. Первый канальный родопсин открыли американцы Д. Остерхельт и В. Стокениус в 1971 году, но прошло более 30 лет, прежде чем родопсины микроорганизмов и нейроны млекопитающих «встретились». В ходе исследований родопсинов микробов открыли целый ряд светочувствительных белков с разными свойствами. Одни из них проводят ионы натрия, другие — сразу несколько типов положительных ионов. Есть родопсины, напротив, выводящие положительные ионы из клеток. Они способны снимать возбуждение. Таким образом, можно не только целенаправленно активировать, но и выключать нейроны. Особого внимания заслуживают родопсины, воспринимающие свет с разной длиной волны. Это позволяет одновременно и независимо управлять разными группами нейронов с помощью, например, синего и красного света.
Они способны снимать возбуждение. Таким образом, можно не только целенаправленно активировать, но и выключать нейроны. Особого внимания заслуживают родопсины, воспринимающие свет с разной длиной волны. Это позволяет одновременно и независимо управлять разными группами нейронов с помощью, например, синего и красного света.
В 2002 году биологи из Франкфурта описали новый родопсин одноклеточной зелёной водоросли Chlamydomonas reinhardtii. Этот белок стал первым канальным родопсином, использованным для управления нейронами. Сначала обнадёживающие результаты были получены на культурах клеток. Следующий шаг — управление нейронами в мозге живого организма — стал возможен благодаря развитию генно-инженерных методов. В 2005 году, вскоре после экспериментов с культурами клеток, группа под руководством Хирому Яво из Университета Тохоку в Японии провела эксперимент с мозгом живой мыши.
Существуют два способа доставить ген родопсина в клетки мозга. Первый предполагает получение трансгенного организма. Так, например, ген родопсина может быть встроен в геном мыши на стадии эмбрионального развития, и тогда все клетки тела будут его содержать. Но работать этот ген станет не во всех клетках, а лишь там, где он будет активирован. Активностью гена можно управлять. Обычно для этого в последовательности ДНК перед геном размещают «управляющий» участок. Чтобы ген активировался, этот участок должен быть прочитан белками клетки. Существуют последовательности, которые могут быть прочитаны только в клетках определённого типа. Современной генетике известны сотни таких сигналов для разных клеток и тканей, в том числе и для разных типов нейронов. Есть ряд замечательных модификаций этого подхода, позволяющих использовать библиотеки трансгенных животных (созданные в других исследованиях) для нацеливания родопсинов в разные клетки нервной системы. Однако получение трансгенной мыши требует нескольких месяцев.
Так, например, ген родопсина может быть встроен в геном мыши на стадии эмбрионального развития, и тогда все клетки тела будут его содержать. Но работать этот ген станет не во всех клетках, а лишь там, где он будет активирован. Активностью гена можно управлять. Обычно для этого в последовательности ДНК перед геном размещают «управляющий» участок. Чтобы ген активировался, этот участок должен быть прочитан белками клетки. Существуют последовательности, которые могут быть прочитаны только в клетках определённого типа. Современной генетике известны сотни таких сигналов для разных клеток и тканей, в том числе и для разных типов нейронов. Есть ряд замечательных модификаций этого подхода, позволяющих использовать библиотеки трансгенных животных (созданные в других исследованиях) для нацеливания родопсинов в разные клетки нервной системы. Однако получение трансгенной мыши требует нескольких месяцев.
Второй способ доставки гена в клетки работает гораздо быстрее. В нём используются вирусы, несущие ген родопсина. В случае введения в мозг достаточно большого количества вируса, проникающего в нейроны, наработка светочувствительных белков происходит очень эффективно. Генно-инженерные вирусы, используемые для этих целей, сильно изменены и не способны размножаться. Они эффективно проникают в клетки и нарабатывают в них родопсин, в остальном для организма экспериментального животного они безвредны.
В случае введения в мозг достаточно большого количества вируса, проникающего в нейроны, наработка светочувствительных белков происходит очень эффективно. Генно-инженерные вирусы, используемые для этих целей, сильно изменены и не способны размножаться. Они эффективно проникают в клетки и нарабатывают в них родопсин, в остальном для организма экспериментального животного они безвредны.
Отдельная задача — доставка света к нейронам, расположенным в глубине мозга. В большинстве случаев для этого используются оптоволоконные световоды. Источником света может служить лазер или светодиод. Конструкция устройств позволяет грызуну свободно перемещаться в клетке, несмотря на постоянно подключённый к голове кабель. С недавней разработкой родопсина, активируемого красным светом, задача освещения мозга упростилась. Красный свет хорошо проникает в ткани и в ряде задач при его использовании удастся отойти от внедрения в мозг оптоволокна.
Искусственные воспоминания
Благодаря оптогенетике множество вопросов, касающихся работы мозга, получили шанс на решение. Так, например, высокоточная прицельная активация или высокоточное прицельное выключение зон мозга позволили картировать области, ответственные за долговременную и кратковременную память. Кроме того, появилась возможность подойти к изучению памяти с новой стороны.
Так, например, высокоточная прицельная активация или высокоточное прицельное выключение зон мозга позволили картировать области, ответственные за долговременную и кратковременную память. Кроме того, появилась возможность подойти к изучению памяти с новой стороны.
Наше восприятие окружающего представлено в мозге сочетанием активных и бездействующих нейронов. Воспоминание — это воспроизведение той комбинации возбуждённых нейронов, которая когда-то возникла. В одной из недавних работ, выполненных в Массачусетском технологическом институте под руководством нобелевского лауреата Судзуми Тонегавы, у мышей при помощи света вызывали воспоминания и придавали им новый смысл. Это исследование основано на классическом подходе к изучению памяти с использованием мыши в качестве модельного объекта. В центре внимания находится реакция страха на электрический шок, возникающая в комнате, где животное когда-то его испытывало.
Представим себе мышь в комнате А, здесь она ведёт себя обычно. Перенесём грызуна в комнату Б с другим окружением и подвергнем слабому электрическому шоку. Теперь при каждом переносе в комнату Б мышь будет испытывать страх даже без шока. Оценить страх в данном случае достаточно просто: обычно очень подвижный грызун группируется и замирает. Воспоминание о комнате Б ассоциируется у животного с болевым ощущением. Нейробиологам удалось сделать светочувствительными только те нейроны, которые активировались во время нахождения мыши в комнате А. Комбинация светочувствительных нейронов в данном случае — записанное воспоминание об этой комнате. Далее экспериментаторы вызывали это воспоминание с помощью света во время электрического шока в комнате Б. Стала ли мышь после этого бояться удара в комнате А, где никогда раньше его не испытывала? Правильный ответ: да.
Перенесём грызуна в комнату Б с другим окружением и подвергнем слабому электрическому шоку. Теперь при каждом переносе в комнату Б мышь будет испытывать страх даже без шока. Оценить страх в данном случае достаточно просто: обычно очень подвижный грызун группируется и замирает. Воспоминание о комнате Б ассоциируется у животного с болевым ощущением. Нейробиологам удалось сделать светочувствительными только те нейроны, которые активировались во время нахождения мыши в комнате А. Комбинация светочувствительных нейронов в данном случае — записанное воспоминание об этой комнате. Далее экспериментаторы вызывали это воспоминание с помощью света во время электрического шока в комнате Б. Стала ли мышь после этого бояться удара в комнате А, где никогда раньше его не испытывала? Правильный ответ: да.
Красота этой работы основана на более ранних исследованиях мозга, выявивших в нём участок, связанный с воспоминаниями. Это гиппокамп. Именно с его нейронами производились манипуляции в упомянутом эксперименте.
Возвращение к сетчатке
Итак, родопсины микробов признали удачным инструментом для создания светочувствительных клеток. Но можно ли микробные родопсины применить для лечения слепоты? Существует наследственное заболевание — пигментный ретинит, связанное с дегенерацией клеток сетчатки глаза. Оно вызывает прогрессирующую потерю зрения. Эффективного лечения для пигментного ретинита сегодня не существует. Значительная часть случаев этой болезни связана с нарушениями в гене, кодирующем родопсин. Этот ген важен для работы двух типов клеток-рецепторов в составе сетчатки. Это палочки, обладающие хорошей светочувствительностью, но не способные обеспечивать цветное зрение, и колбочки, позволяющие различать цвет, но менее чувствительные к интенсивности света. У больных пигментным ретинитом клетки палочки достаточно быстро гибнут, однако колбочки, потеряв способность воспринимать свет, живут ещё долгое время. Есть ли возможность заменить в оставшихся клетках неработающий родопсин на светочувствительный белок из бактерий? Группа исследователей из Швейцарии под руководством Ботонда Роска для ответа на этот вопрос использовала канальный родопсин архебактерий.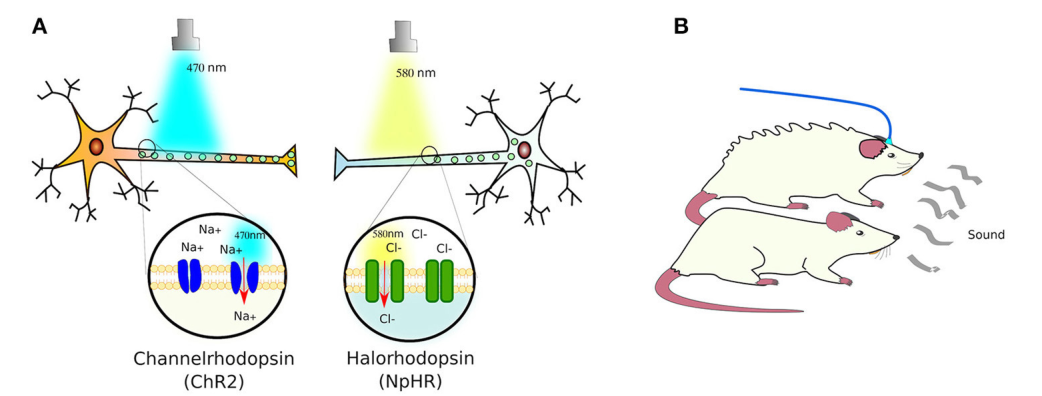
Существует мышиная модель пигментного ретинита. Если с помощью вирусов внести микробный родопсин в колбочки сетчатки, у грызунов наблюдается частичное восстановление зрения. В стандартных тестах такие мыши демонстрировали улучшение ориентации в пространстве в сравнении с больными грызунами без терапии. Интересно, что использованный в работе микробный белок, называемый eNpHR 3.0 (усовершенствованный галородопсин из Natronomonas pharaonis версии 3.0), — уже третья версия модифицированной исходной молекулы. Методами генетической инженерии постоянно ведётся усовершенствование микробных родопсинов для улучшения их работы в клетках млекопитающих.
Перенос такого метода лечения на человека — непростой шаг, поскольку в нём используются вирусы. Требуется много дополнительных контрольных экспериментов, чтобы показать полную безвредность этой технологии для людей. Тем не менее авторы показали эффективность работы белка eNpHR 3.0 в изолированных клетках сетчатки глаза человека. Подобные работы — серьёзное продвижение к терапии болезней, связанных с потерей активности нейронов. Например, если клетки, пострадавшие при нейродегенеративном заболевании, сделать светочувствительными, их работу можно вновь запустить, облучая светом.
Подобные работы — серьёзное продвижение к терапии болезней, связанных с потерей активности нейронов. Например, если клетки, пострадавшие при нейродегенеративном заболевании, сделать светочувствительными, их работу можно вновь запустить, облучая светом.
Не только нейроны
Возможность управлять почти любыми группами нейронов в мозге породила новые экспериментальные работы, многие из которых стали настоящим прорывом в своей области. Но сегодня приложение оптогенетики — это не только нейроны. Строго говоря, к оптогенетике можно отнести любой метод, предполагающий активацию какого-либо процесса светом, если возможность такой активации обеспечена методами генной инженерии.
На данный момент созданы системы, в которых свет может управлять активностью гена, выключать работу белков или запускать клеточную гибель. Примечательно, что в таких исследованиях используются не только белки, действующие как ионные каналы. Так, например, получен белок, названный KillerRed (красный киллер), вырабатывающий при облучении светом активные формы кислорода. Активный кислород способен разрушать любые органические молекулы. Облучение красным светом клетки с достаточно большим количеством белка KillerRed вызовет её гибель. Впрочем, подобный метод можно использовать не только для убийства целой клетки. С помощью генетических методов участок, генерирующий активные формы кислорода в небольших количествах, можно включить в любой клеточный белок. Тогда свет вызовет инактивацию всех таких белков в клетке, что позволит судить об их функции. Перспективной также может оказаться целенаправленная доставка светочувствительных молекул в клетки раковых опухолей для их уничтожения.
Активный кислород способен разрушать любые органические молекулы. Облучение красным светом клетки с достаточно большим количеством белка KillerRed вызовет её гибель. Впрочем, подобный метод можно использовать не только для убийства целой клетки. С помощью генетических методов участок, генерирующий активные формы кислорода в небольших количествах, можно включить в любой клеточный белок. Тогда свет вызовет инактивацию всех таких белков в клетке, что позволит судить об их функции. Перспективной также может оказаться целенаправленная доставка светочувствительных молекул в клетки раковых опухолей для их уничтожения.
Идея управления клетками с помощью света родилась задолго до появления оптогенетики. Однако для её реализации требовалось развитие ряда областей науки, в особенности генной инженерии. Интересно наблюдать, как из несвязанных работ по изучению светочувствительных белков микробов и мозга млекопитающих возник метод, признанный научным сообществом революционным. Объединив несколько научных областей, оптогенетика сегодня сама стала двигателем технологий, разрабатываемых под её запросы.
Что такое оптогенетика и как мы можем использовать ее, чтобы узнать больше о мозге? · Frontiers for Young Minds
Abstract
Как работает мозг? Это вопрос, который интересовал ученых на протяжении сотен лет. Чтобы понять, как работает мозг, ученым пришлось провести множество экспериментов и найти способы исследовать и тестировать мозг. В 2005 году была создана новая методика, названная оптогенетикой. Этот метод использует комбинацию света и генной инженерии (изменение генетической информации живого существа путем вставки или удаления информации в генетическом коде) для управления клетками мозга. Оптогенетика стала очень популярной и сейчас используется в лабораториях по исследованию мозга по всему миру. Это помогает нам открывать много нового о мозге. Здесь мы объясняем, что делает оптогенетику такой особенной для изучения мозга.
Специальные клетки мозга и нервной системы, называемые нейронами , работают вместе, чтобы производить все наши мысли и поведение.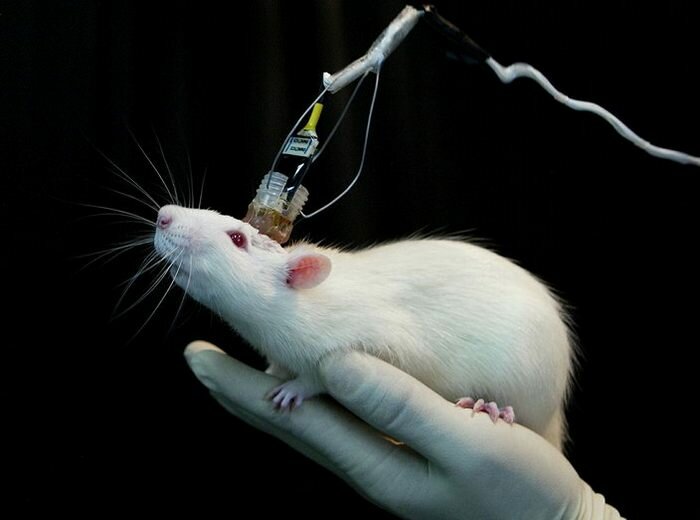 Чтобы понять, как мозг контролирует поведение, нам нужно понять, как взаимодействуют нейроны. Человеческий мозг очень сложен, но многие свойства человеческого мозга аналогичны свойствам других животных. Это означает, что нейробиологи (ученые, изучающие мозг и нервную систему) могут использовать простых животных, чтобы открывать новые сведения о человеческом мозге. Так была обнаружена связь между нейронами.
Чтобы понять, как мозг контролирует поведение, нам нужно понять, как взаимодействуют нейроны. Человеческий мозг очень сложен, но многие свойства человеческого мозга аналогичны свойствам других животных. Это означает, что нейробиологи (ученые, изучающие мозг и нервную систему) могут использовать простых животных, чтобы открывать новые сведения о человеческом мозге. Так была обнаружена связь между нейронами.
Как нейроны общаются друг с другом?
Нейроны общаются, используя комбинацию электрической и химической активности. Ранние ученые обнаружили это с помощью наблюдений и умных экспериментов. В конце 1700-х годов итальянский ученый по имени Луиджи Гальвани шел по рынку во время грозы. Он увидел в продаже несколько лягушачьих лапок и заметил, что они дергаются. Он предположил, что электричество бури активировало нервы в лягушачьих лапках. Он решил проверить эту гипотезу в своей лаборатории. Гальвани использовал предмет, который позволяет течь электрическому току, называемый электродом, для передачи электрического тока на нерв лягушки. Это заставило лягушачью лапку подергиваться. Это были первые исследования электростимуляции в нейробиологии [1]. Из этого открытия Гальвани сделал вывод, что нейроны могут использовать электрические сигналы для передачи информации. Это важно знать! Теперь, когда мы знаем, как нейроны разговаривают друг с другом, мы можем начать говорить на их языке. Мы можем использовать электрические сигналы, чтобы включить некоторые нейроны, и посмотреть, что произойдет дальше. Именно этим и начали заниматься ученые.
Это заставило лягушачью лапку подергиваться. Это были первые исследования электростимуляции в нейробиологии [1]. Из этого открытия Гальвани сделал вывод, что нейроны могут использовать электрические сигналы для передачи информации. Это важно знать! Теперь, когда мы знаем, как нейроны разговаривают друг с другом, мы можем начать говорить на их языке. Мы можем использовать электрические сигналы, чтобы включить некоторые нейроны, и посмотреть, что произойдет дальше. Именно этим и начали заниматься ученые.
Только в 1930-х годах электрическая стимуляция использовалась для картирования человеческого мозга. Доктор Уайлдер Пенфилд, нейрохирург, работал с пациентами, страдающими эпилепсией. Эпилепсия вызывает аномальные электрические сигналы в мозгу и может быть очень опасной. В крайних случаях требуется операция на головном мозге, чтобы остановить эпилепсию. Доктор Пенфилд хотел составить карту мозга своих пациентов, чтобы выяснить, какие части мозга наиболее важны. Это помогло бы ему узнать, какие области мозга он должен , а не работают. Для картирования мозга он использовал электрическую стимуляцию, как и Гальвани. Он опустил небольшой электрод в двигательные (двигательные) области мозга. Затем он послал небольшой электрический сигнал и наблюдал за движениями пациента. Стимуляция в одной области мозга вызывала подергивание пальцев, а стимуляция в немного другой области мозга вызывала подергивание стопы. Это привело доктора Пенфилда к пониманию того, что определенные области мозга контролируют очень определенные области тела. Доктор Пенфилд заметил, что расположение двигательных областей мозга было одинаковым у всех его пациентов. Он создал диаграммы своих результатов, которые дали нам первую функциональную карту двигательных областей в человеческом мозгу [2]. Функциональные карты доктора Пенфилда, известные как гомункул, используются до сих пор.
Это помогло бы ему узнать, какие области мозга он должен , а не работают. Для картирования мозга он использовал электрическую стимуляцию, как и Гальвани. Он опустил небольшой электрод в двигательные (двигательные) области мозга. Затем он послал небольшой электрический сигнал и наблюдал за движениями пациента. Стимуляция в одной области мозга вызывала подергивание пальцев, а стимуляция в немного другой области мозга вызывала подергивание стопы. Это привело доктора Пенфилда к пониманию того, что определенные области мозга контролируют очень определенные области тела. Доктор Пенфилд заметил, что расположение двигательных областей мозга было одинаковым у всех его пациентов. Он создал диаграммы своих результатов, которые дали нам первую функциональную карту двигательных областей в человеческом мозгу [2]. Функциональные карты доктора Пенфилда, известные как гомункул, используются до сих пор.
С 1930-х годов эксперименты по стимуляции мозга изменились. Исследования с электростимуляцией имеют некоторые недостатки. Одна из проблем заключается в том, что мозг может быть поврежден при введении электрода. Другая проблема заключается в том, что электрическая стимуляция активирует ткань очень общим, неизбирательным образом (рис. 1А). Это все равно, что использовать бульдозер, когда подойдет лопата: бульдозер эффективен, но он не очень точен или осторожен. В 2005 году была создана новая техника для более точной стимуляции мозга. Эта техника называется оптогенетика .
Одна из проблем заключается в том, что мозг может быть поврежден при введении электрода. Другая проблема заключается в том, что электрическая стимуляция активирует ткань очень общим, неизбирательным образом (рис. 1А). Это все равно, что использовать бульдозер, когда подойдет лопата: бульдозер эффективен, но он не очень точен или осторожен. В 2005 году была создана новая техника для более точной стимуляции мозга. Эта техника называется оптогенетика .
- Рисунок 1
- A. В исследовании с электростимуляцией активируются все клетки, расположенные рядом с местом стимуляции. B. Синий свет обычно не влияет на нейроны. C. Синий свет избирательно активирует нейроны с канальным родопсином-2 (ChR2).
Что такое оптогенетика?
Оптогенетика — метод управления активностью нейронов с помощью света и генной инженерии . Генная инженерия — это процесс, при котором ученые изменяют информацию в генетическом коде (чертежах) живого существа. В оптогенетических исследованиях ученые берут генетический код нейронов, которые они хотят изучить, и добавляют к нему новый фрагмент кода. Новый код позволяет этим нейронам производить специальные белки, называемые опсинами , которые реагируют на свет. Опсины встречаются в природе и впервые были обнаружены у водорослей, которые используют эти белки, чтобы двигаться к свету. Но как опсин попадает в нейрон? Для этого требуются специальные лабораторные методы. Давайте посмотрим на мышь в качестве нашего примера. Чтобы ввести опсин в нейроны мыши, генетический код опсина должен быть тщательно вставлен в генетический код нейронов мыши. Если все сделано правильно, опсин должен быть у каждого нейрона мыши. Поскольку мы многое знаем о генетическом коде мыши, мы можем выбирать, куда поместить опсин. Мы можем вставить код в определенные типа нейрона или в определенное место в головном мозге. Мы можем выбрать, какими именно нейронами мы хотим управлять.
В оптогенетических исследованиях ученые берут генетический код нейронов, которые они хотят изучить, и добавляют к нему новый фрагмент кода. Новый код позволяет этим нейронам производить специальные белки, называемые опсинами , которые реагируют на свет. Опсины встречаются в природе и впервые были обнаружены у водорослей, которые используют эти белки, чтобы двигаться к свету. Но как опсин попадает в нейрон? Для этого требуются специальные лабораторные методы. Давайте посмотрим на мышь в качестве нашего примера. Чтобы ввести опсин в нейроны мыши, генетический код опсина должен быть тщательно вставлен в генетический код нейронов мыши. Если все сделано правильно, опсин должен быть у каждого нейрона мыши. Поскольку мы многое знаем о генетическом коде мыши, мы можем выбирать, куда поместить опсин. Мы можем вставить код в определенные типа нейрона или в определенное место в головном мозге. Мы можем выбрать, какими именно нейронами мы хотим управлять.
В неврологии самый популярный опсин называется канальный родопсин-2 (ChR2) .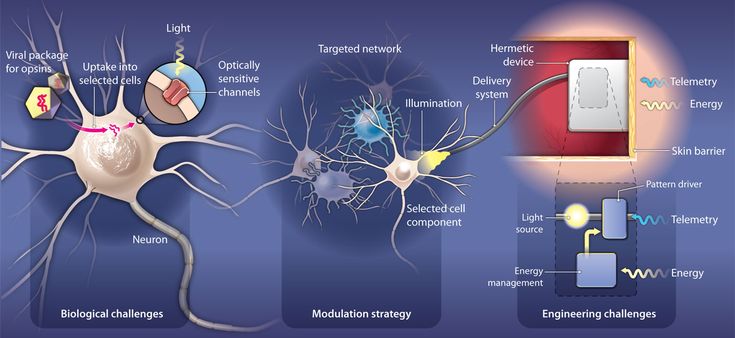 Этот опсин происходит из зеленых водорослей Chlamydomonas reinhardtii [3]. ChR2 активируется синим светом, а это означает, что он работает только тогда, когда на него светит синий свет, и не реагирует на другие типы света. Когда ChR2 вставляется в нейроны, это означает, что нейроны могут поворачиваться на на с синим светом. Нейроны с ChR2 будут включены только до тех пор, пока на них светит синий свет [4]. Это дает нам точный контроль над временем активности нейрона. В норме синий свет не влияет на нейроны (рис. 1В), поэтому синий свет будет влиять только на нейроны, имеющие ChR2 (рис. 1С).
Этот опсин происходит из зеленых водорослей Chlamydomonas reinhardtii [3]. ChR2 активируется синим светом, а это означает, что он работает только тогда, когда на него светит синий свет, и не реагирует на другие типы света. Когда ChR2 вставляется в нейроны, это означает, что нейроны могут поворачиваться на на с синим светом. Нейроны с ChR2 будут включены только до тех пор, пока на них светит синий свет [4]. Это дает нам точный контроль над временем активности нейрона. В норме синий свет не влияет на нейроны (рис. 1В), поэтому синий свет будет влиять только на нейроны, имеющие ChR2 (рис. 1С).
Оптогенетическая стимуляция более специфична, чем электрическая стимуляция
Как в городе много дорог, так и в мозгу есть много путей. Если мы хотим узнать, как точка А соединяется с точкой Б в городе, мы можем просто посмотреть на все дороги и нарисовать карту дорог. это типа структурная карта : она помогает нам понять, как устроены дороги. Но обычно есть много способов добраться из пункта А в пункт Б, так как же узнать, какой из них наиболее популярен? Чтобы понять это, нам нужно посмотреть на автомобили, движущиеся по дорогам, когда они едут из точки А в точку Б. Это функциональная карта : она помогает нам понять, как используются дороги. В мозгу нейроны подобны дорогам, а сигналы, передающиеся от нейрона к нейрону, подобны автомобилям. В норме мозг очень активен, и на дорогах постоянно много машин. По всей карте мозга автомобили начинают и останавливают свое путешествие в разное время. Потому что там так много активности, что мы не можем увидеть какие-либо закономерности или понять, как все взаимосвязано. Чтобы выяснить закономерности, было бы полезно иметь возможность контролировать, когда и где автомобили начинают свое путешествие.
Это функциональная карта : она помогает нам понять, как используются дороги. В мозгу нейроны подобны дорогам, а сигналы, передающиеся от нейрона к нейрону, подобны автомобилям. В норме мозг очень активен, и на дорогах постоянно много машин. По всей карте мозга автомобили начинают и останавливают свое путешествие в разное время. Потому что там так много активности, что мы не можем увидеть какие-либо закономерности или понять, как все взаимосвязано. Чтобы выяснить закономерности, было бы полезно иметь возможность контролировать, когда и где автомобили начинают свое путешествие.
Представьте себе, что в нашем городе на каждом подъезде стоят машины. Эти автомобили ждут сигнала, чтобы выехать на дороги (рис. 2А). В исследовании с электрической стимуляцией мы можем контролировать, когда автомобили начнут движение, но у нас нет достаточного контроля над тем, какие автомобили выйдут на дороги. При электростимуляции стимуляция носит общий характер. Все автомобили, находящиеся рядом со стимуляцией, будут отправлены в путь. Это означает, что предстоит много активности (рис. 2B). В исследовании оптогенетической стимуляции мы можем точно выбрать, какие машины мы хотим выпустить на дорогу и когда. Мы можем выбрать группу автомобилей по местоположению (например, мы можем выбрать, чтобы все автомобили в одном районе выезжали на дороги), или мы можем выбрать по типу автомобиля (например, мы могли выбрать, чтобы были только грузовики). выйти на дороги) (рис. 2C). Это избирательная стимуляция. В этом случае за движением автомобилей следить намного проще. Это говорит нам больше о том, как конкретные автомобили ведут себя на дорогах.
Это означает, что предстоит много активности (рис. 2B). В исследовании оптогенетической стимуляции мы можем точно выбрать, какие машины мы хотим выпустить на дорогу и когда. Мы можем выбрать группу автомобилей по местоположению (например, мы можем выбрать, чтобы все автомобили в одном районе выезжали на дороги), или мы можем выбрать по типу автомобиля (например, мы могли выбрать, чтобы были только грузовики). выйти на дороги) (рис. 2C). Это избирательная стимуляция. В этом случае за движением автомобилей следить намного проще. Это говорит нам больше о том, как конкретные автомобили ведут себя на дорогах.
- Рисунок 2
- A. Так же, как в городе много дорог, в мозгу есть много путей. B. Исследование с электростимуляцией похоже на отправку всех машин на дороги одновременно. C. Исследование оптогенетической стимуляции похоже на отправку на дороги только одного типа автомобиля.
Как оптогенетика используется для картирования мозга?
Оптогенетика может использоваться несколькими различными способами для картирования мозга мыши (рассмотрено в [5]).
Точно так же, как мы можем уменьшить масштаб дорожной карты города, чтобы увидеть основные автомагистрали (рис. 3А), или увеличить масштаб карты, чтобы увидеть один городской квартал (рис. 3В), мы также можем увеличить или уменьшить масштаб мозг. Мы можем уменьшить масштаб мозга, чтобы увидеть, как большие области мозга соединяются и работают вместе (рис. 3C). Такой общий обзор удобен, если нас интересует, как информация распространяется на большие расстояния в мозгу или какие области мозга связаны друг с другом. Например, через большие города, как правило, проходит больше дорог и автомагистралей, потому что многие люди едут в эти города и из них. Используя оптогенетику для стимуляции одной области мозга и регистрации ответов в других областях мозга, мы можем выяснить, какие области мозга имеют наибольший трафик. Это важно для понимания того, как возникает определенное поведение, но также может быть важно для понимания того, что происходит, если мозг поврежден в определенной области (например, если произойдет авария на четвертой улице, как будет изменен маршрут движения?).
- Рисунок 3
- A. Точно так же, как вы можете посмотреть на всю карту города, B. или увеличить масштаб отдельной дороги, вы также можете просмотреть связи во всем мозгу C. или увеличить конкретную группа ячеек Д.
Мы также можем увеличить масштаб мозга, чтобы увидеть, как соединяются отдельные нейроны (рис. 3D). Используя оптогенетику, мы можем исследовать, как нейроны работают вместе, используя свет, чтобы включить некоторые нейроны и записать реакцию других нейронов. Это подробное представление полезно для понимания того, как и когда нейроны взаимодействуют друг с другом. Это может быть очень полезно для исследования заболеваний, которые нарушают связь между нейронами в определенной области, что и происходит, когда у кого-то штрих (подробнее об этом читайте в следующем разделе).
Оптогенетическое картирование открывает множество возможностей для изучения работы мозга. По мере совершенствования оптогенетических методов и создания или открытия большего количества опсинов появляется возможность еще большего контроля в исследованиях стимуляции мозга. Возможно, мы сможем использовать несколько опсинов для одновременного управления несколькими разными типами нейронов. Поскольку каждый опсин реагирует на определенный тип света, мы могли бы использовать разный свет для управления разными типами нейронов. На самом деле, некоторые опсины превращают нейроны в от при наличии правильного типа освещения.
По мере совершенствования оптогенетических методов и создания или открытия большего количества опсинов появляется возможность еще большего контроля в исследованиях стимуляции мозга. Возможно, мы сможем использовать несколько опсинов для одновременного управления несколькими разными типами нейронов. Поскольку каждый опсин реагирует на определенный тип света, мы могли бы использовать разный свет для управления разными типами нейронов. На самом деле, некоторые опсины превращают нейроны в от при наличии правильного типа освещения.
В нашем примере с отображением автомобилей в городе мы могли бы использовать несколько сигналов для управления движением автомобилей. У нас может быть одна группа машин, выезжающих на дорогу, когда мы подаем один сигнал (скажем, синий свет), и другая группа машин, выезжающая на дорогу, когда мы подаем другой сигнал (скажем, красный свет). Используя эту настройку, мы могли бы начать экспериментировать с этими двумя наборами автомобилей: что произойдет, если автомобили на красный свет поедут первыми? Что произойдет, если машины с синим светом поедут первыми? Что будет, если они пойдут одновременно? Это поможет нам понять, как эти разные наборы автомобилей взаимодействуют друг с другом.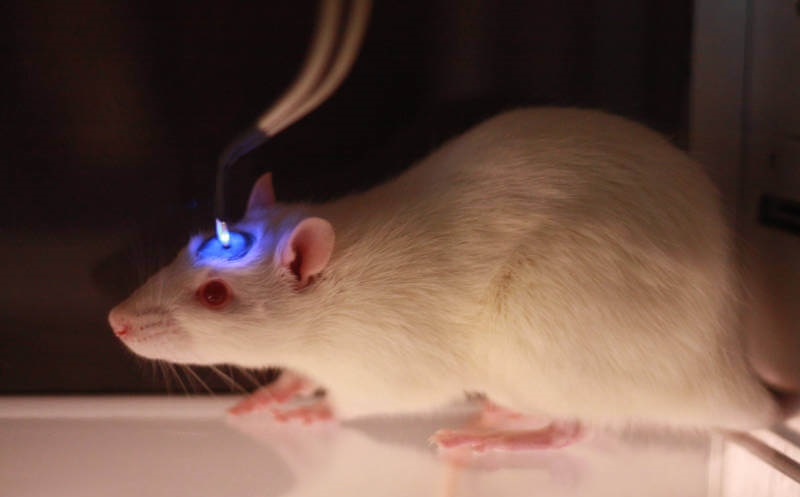
Так как же ученый выбирает, какую технику или какой опсин использовать? Ответ будет зависеть от вопроса, который ученый хочет исследовать. В следующем разделе будут освещены некоторые вопросы, которые были исследованы с помощью оптогенетики.
Недавние открытия с использованием оптогенетики
Ученые-мозговеды начали использовать оптогенетику в 2005 году [3]. С тех пор оптогенетические методы использовались для изучения мозга с разных точек зрения — от связи кластера отдельных нейронов до взаимодействия между большими областями мозга (обзор в [5]). Многие другие исследования использовали оптогенетические методы для изучения различных тем и вопросов. Некоторые недавние вопросы: где страх в мозгу? Как рассчитывается риск и вознаграждение? Как хранятся воспоминания? (рассмотрено в [6]). Мы использовали оптогенетику на мышах, чтобы исследовать, как мозг меняется после инсульта [7]. Инсульт случается, когда кровоснабжение области мозга нарушается или уменьшается. Это опасно, потому что кровоснабжение переносит кислород и другие важные питательные вещества, необходимые мозгу для выживания. Если какая-либо область мозга будет слишком долго обходиться без кислорода, нейроны в этой области в конечном итоге умрут. Это вызывает проблемы для этой конкретной области мозга и для любых других областей мозга, которые связаны с ней. В нашем исследовании мы хотели выяснить, как небольшой инсульт в одной области мозга влияет на многие другие области мозга. Для начала мы использовали ChR2, чтобы нарисовать функциональную карту мозга мыши. Мы сравнили карты между животными с инсультом и без инсульта. Мы обнаружили, что карты менялись со временем. Через 1 неделю после инсульта общая мозговая активность была очень низкой. Удивительно, но активность была низкой даже в области, удаленной от инсульта. К 8 неделям после инсульта общая мозговая активность повысилась, но не вернулась к норме. Из этих данных мы сделали вывод, что даже небольшой инсульт может сильно повлиять на работу мозга в целом. Понимание того, что происходит с мозгом после инсульта, может помочь ученым разработать более эффективные методы лечения пациентов с инсультом.
Если какая-либо область мозга будет слишком долго обходиться без кислорода, нейроны в этой области в конечном итоге умрут. Это вызывает проблемы для этой конкретной области мозга и для любых других областей мозга, которые связаны с ней. В нашем исследовании мы хотели выяснить, как небольшой инсульт в одной области мозга влияет на многие другие области мозга. Для начала мы использовали ChR2, чтобы нарисовать функциональную карту мозга мыши. Мы сравнили карты между животными с инсультом и без инсульта. Мы обнаружили, что карты менялись со временем. Через 1 неделю после инсульта общая мозговая активность была очень низкой. Удивительно, но активность была низкой даже в области, удаленной от инсульта. К 8 неделям после инсульта общая мозговая активность повысилась, но не вернулась к норме. Из этих данных мы сделали вывод, что даже небольшой инсульт может сильно повлиять на работу мозга в целом. Понимание того, что происходит с мозгом после инсульта, может помочь ученым разработать более эффективные методы лечения пациентов с инсультом.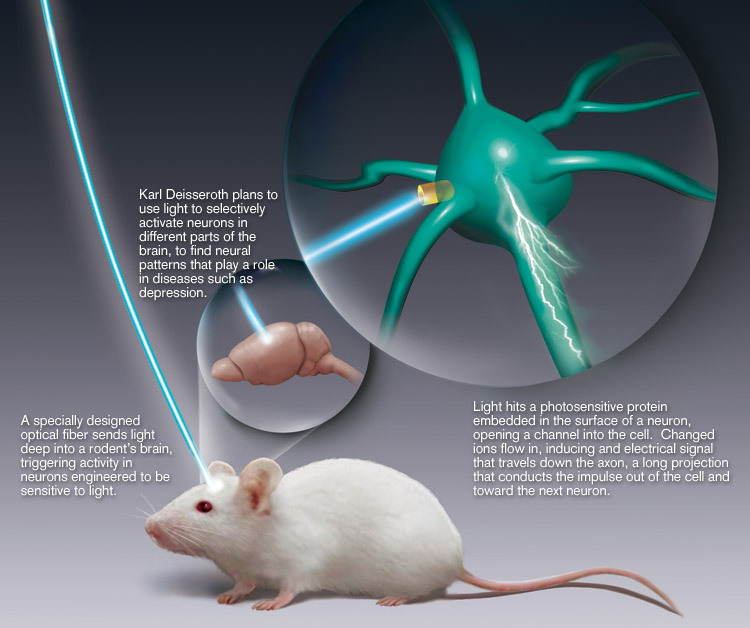 Это всего лишь один пример того, насколько полезной может быть оптогенетика для изучения вопросов о мозге. Вполне вероятно, что ученые, изучающие мозг, будут продолжать использовать оптогенетику еще много лет.
Это всего лишь один пример того, насколько полезной может быть оптогенетика для изучения вопросов о мозге. Вполне вероятно, что ученые, изучающие мозг, будут продолжать использовать оптогенетику еще много лет.
Глоссарий
Нейроны : ↑ Специальные клетки мозга общаются друг с другом, отправляя и получая электрические и химические сигналы. В мозгу миллиарды нейронов, и сигналы, посылаемые между этими клетками, являются основой всех наших мыслей и поведения. Нейроны иногда называют нервными клетками.
Исследование электростимуляции : ↑ Метод активации нейронов или нервных путей путем введения небольшого электрода и подачи электрического тока в ткани. Это вызывает изменение электрической активности ткани.
Неврология : ↑ Раздел науки, изучающий мозг и нервную систему.
Оптогенетика : ↑ Метод, использующий комбинацию света и генной инженерии для управления активностью клетки.
Генная инженерия : ↑ Процесс изменения информации в генетическом коде (чертежах) живого существа путем добавления или удаления информации. Генную инженерию иногда называют генетической модификацией.
Опсины : ↑ Белки, реагирующие на определенный тип света (например, ChR2 реагирует только на синий свет). В неврологии эти белки используются для контроля активности нейронов.
Channelrhod-Opsin-2 (ChR2) : ↑ Опсин, специфически реагирующий на синий свет. Когда ChR2 вставляется в нейроны, синий свет может использоваться для включения этих нейронов. ChR2 в настоящее время является наиболее популярным опсином для оптогенетических исследований.
Инсульт : ↑ В норме кровь переносит кислород и другие важные питательные вещества в мозг. Когда кровоснабжение нарушено или уменьшено, мозг не получает то, что ему нужно для правильного функционирования.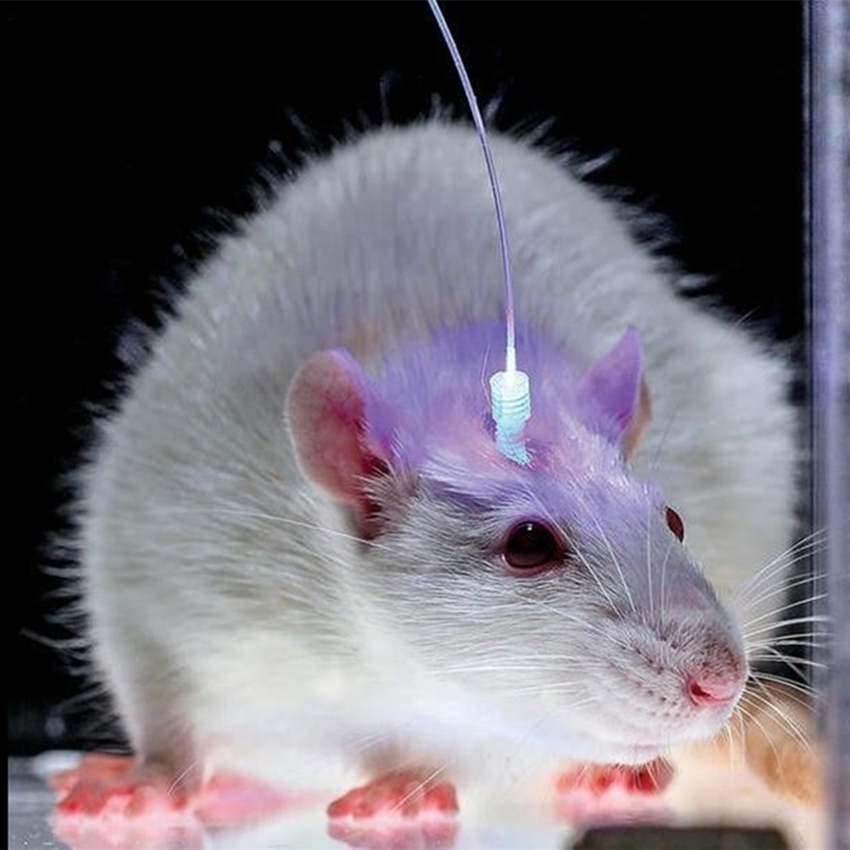 Это называется инсультом, и это может вызвать длительные проблемы и дисфункцию.
Это называется инсультом, и это может вызвать длительные проблемы и дисфункцию.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Исходная статья
↑ Лим, Д. Х., Ле Дью, Дж., Мохаджерани, М. Х., Ванни, М. П., и Мерфи, Т. Х. 2013. Оптогенетические подходы к функциональному картированию мозга мыши. Фронт. Неврологи. 7:54. doi:10.3389/fnins.2013.00054
Каталожные номера
[1] ↑ Колб, Б., Уишоу, И. К., и Тески, Г. К. 2016. Введение в мозг и поведение. 5-е изд. Нью-Йорк, штат Нью-Йорк: стоит.
[2] ↑ Пенфилд, В., и Эдвин, Б. 1937. Соматические двигательные и сенсорные представления в коре головного мозга человека при электростимуляции. Мозг 60 (4): 389–443. doi:10.1093/мозг/60.4.389
[3] ↑ Нагель Г. , Сцеллас Т., Хун В., Катерия С., Адеишвили Н., Бертольд П. и др. 2003. Channelrhodopsin-2, катион-селективный мембранный канал, непосредственно управляемый светом. проц. Натл. акад. науч. США 100:13940–5. doi:10.1073/pnas.1936192100
, Сцеллас Т., Хун В., Катерия С., Адеишвили Н., Бертольд П. и др. 2003. Channelrhodopsin-2, катион-селективный мембранный канал, непосредственно управляемый светом. проц. Натл. акад. науч. США 100:13940–5. doi:10.1073/pnas.1936192100
[4] ↑ Бойден, Э. С., Чжан, Ф., Бамберг, Э., Нагель, Г. и Дейссерот, К. 2005. Генетически направленный оптический контроль нервной активности в миллисекундном масштабе. Нац. Неврологи. 8:1263–8. дои: 10.1038/nn1525
[5] ↑ Лим Д. Х., Ле Дью Дж., Мохаджерани М. Х., Ванни М. П. и Мерфи Т. Х. 2013. Оптогенетические подходы к функциональному картированию мозга мыши. Фронт. Неврологи. 7:54. doi:10.3389/fnins.2013.00054
[6] ↑ Дейссерот, К. 2015. Оптогенетика: 10 лет микробных опсинов в неврологии. Нац. Неврологи. 18(9):1213–25. doi:10.1038/nn.4091
[7] ↑ Lim, D.H., LeDue, J., Mohajerani, M.H., and Murphy, T.H. 2014. Оптогенетическое картирование после инсульта выявляет масштабирование функциональных связей по всей сети и гетерогенное восстановление периинфарктного периода. Дж. Нейроски. 34(49): 16455–66. doi:10.1523/JNEUROSCI.3384-14.2014
Дж. Нейроски. 34(49): 16455–66. doi:10.1523/JNEUROSCI.3384-14.2014
Проливая свет на секреты мозга
Оптогенетика — это современный исследовательский инструмент, дающий нейробиологам невероятную возможность контролировать нейроны. Это метод нейромодуляции, использующий генную инженерию; нейроны модифицированы для экспрессии светочувствительных ионных каналов, что позволяет управлять ими с помощью света.
Одним из величайших преимуществ оптогенетики является то, что ее можно использовать для изучения живых свободно двигающихся животных.
История оптогенетики
В статье 1979 года Фрэнсис Крик объяснил, что, по его мнению, самой большой проблемой, стоящей перед нейробиологами, является необходимость контролировать один тип клеток мозга, в то время как другие остаются неизменными.
Электрическая стимуляция не может этого сделать, потому что она стимулирует все близлежащие клетки без разбора. Лекарства слишком медленны, чтобы действовать по сравнению с миллисекундными временными рамками событий в мозгу.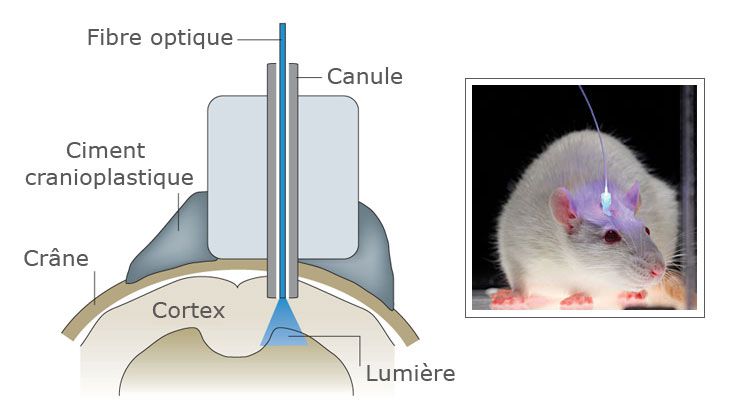
Крик позже предположил, что использование света может решить эту проблему, так как его можно включать и выключать очень быстро. Однако в то время не было известно, как сделать клетки мозга чувствительными к свету.
В 2005 году Карл Дайссерот и его коллеги опубликовали свою основополагающую статью «Миллисекундный генетически направленный оптический контроль нейронной активности» (не такой запоминающийся, как оптогенетика, верно?). Опубликованная в журнале Nature , это была первая исследовательская работа, полностью описывающая оптогенетику как стратегию, которая делает нейроны чувствительными к свету, а затем использует свет для их стимуляции. В документе показано, как, сочетая оптические технологии и достижения в области генетики, исследователи могут возбуждать или подавлять определенные нейроны в мозге и изучать выходные данные.
Как это работает?
История того, как работает оптогенетика, начинается со скромной зеленой водоросли Chlamydomonas Reinhardtii.
Этот простой организм использует фотосинтез для создания энергии, необходимой ему для жизни. Чтобы сделать этот процесс максимально эффективным, у него есть точка зрения. Эта светочувствительная часть клетки сообщает скромной одноклеточной водоросли, откуда исходит свет, чтобы она могла занять более выгодное положение.
Чтобы активировать прицел, C. Reinhardtii перемещает ионы через мембрану через ионные каналы. Когда свет правильной длины волны попадает на эти каналы, это вызывает изменение их формы; открывая их, чтобы ионы могли течь через мембрану. Наиболее часто используемым ионным каналом для стимуляции в оптогенетике является каналродопсин-2.
Изображение предоставлено: Karl Deisseroth
Нейроны запускаются таким же образом (путем перемещения ионов снаружи клетки внутрь). Как только определенное количество положительных ионов пересекает клеточную мембрану, достигается пороговое значение, вызывающее возбуждение нейрона.
Исследователи использовали генетику для экспрессии активируемых светом ионных каналов на нейронах головного мозга. Когда свет попадает на эти ионные каналы, они открываются, и ионы проникают в клетки и вызывают их возбуждение.
Когда свет попадает на эти ионные каналы, они открываются, и ионы проникают в клетки и вызывают их возбуждение.
Для экспрессии ионных каналов в головном мозге был создан генетически модифицированный вирус. Этот вирус при введении в область мозга способен рекомбинировать свою ДНК с ДНК клеток-хозяев. После рекомбинации вся клеточная динамика и механизмы, необходимые для экспрессии гена ионного канала, становятся доступными, и клетка начинает экспрессировать каналы на своей клеточной мембране.
Различные типы клеток головного мозга экспрессируют немного разные группы генов, поэтому они и отличаются друг от друга. У большинства генов есть промоторная область, и если она активна в клетке, то это вызовет экспрессию гена. Используя промотор, специфичный для определенного типа клеток в вашем трансгенном вирусе, можно экспрессировать светочувствительные ионные каналы только в этих клетках.
Почему оптогенетика меняет нейронауку?
Оптогенетика дает нейробиологам беспрецедентный уровень контроля над нейронами.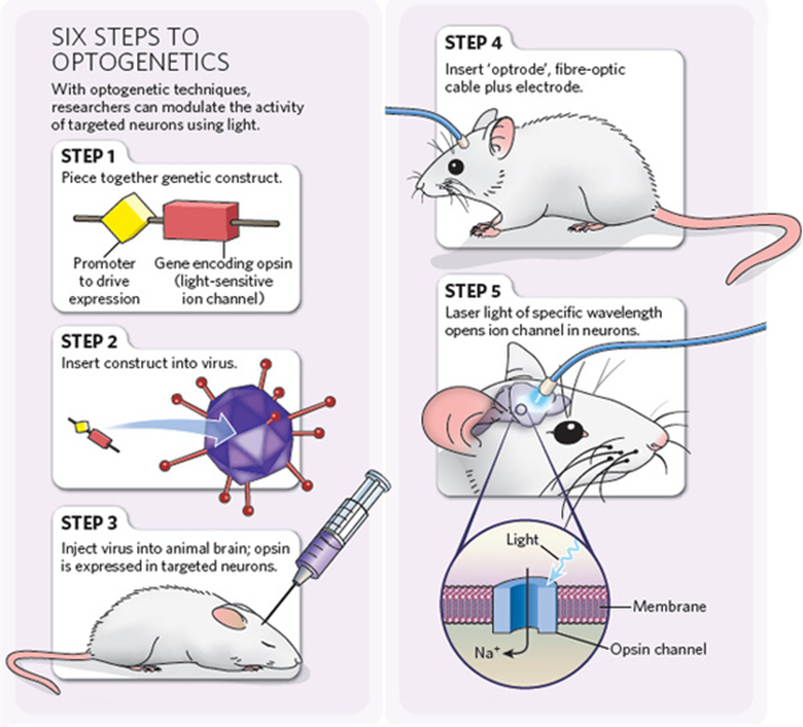
- Освещение только определенных областей мозга позволяет нацеливать манипуляции на определенное пространство (с лазерами эта область может быть незначительной).
- Использование световых импульсов позволяет нацеливать модуляцию на определенное время, обеспечивая высокое временное разрешение.
- Ограничение генетической модификации определенными типами клеток позволяет изучать функции, связанные только с этими клетками.
За 13 лет с тех пор, как Карл Дайссерот и его команда описали, как проводить оптогенетику, этот метод использовался для изучения многих областей функционирования мозга, например:
- Оптогенетические молекулы следующего поколения контролируют отдельные нейроны
- Более радужные перспективы лечения хронической боли
- «Стартовые нейроны» среднего мозга контролируют, ходим мы или бежим
Еще одна область, где оптогенетика может иметь потенциальное применение, — это клиника. В настоящее время глубокая стимуляция мозга является успешным методом лечения болезни Паркинсона.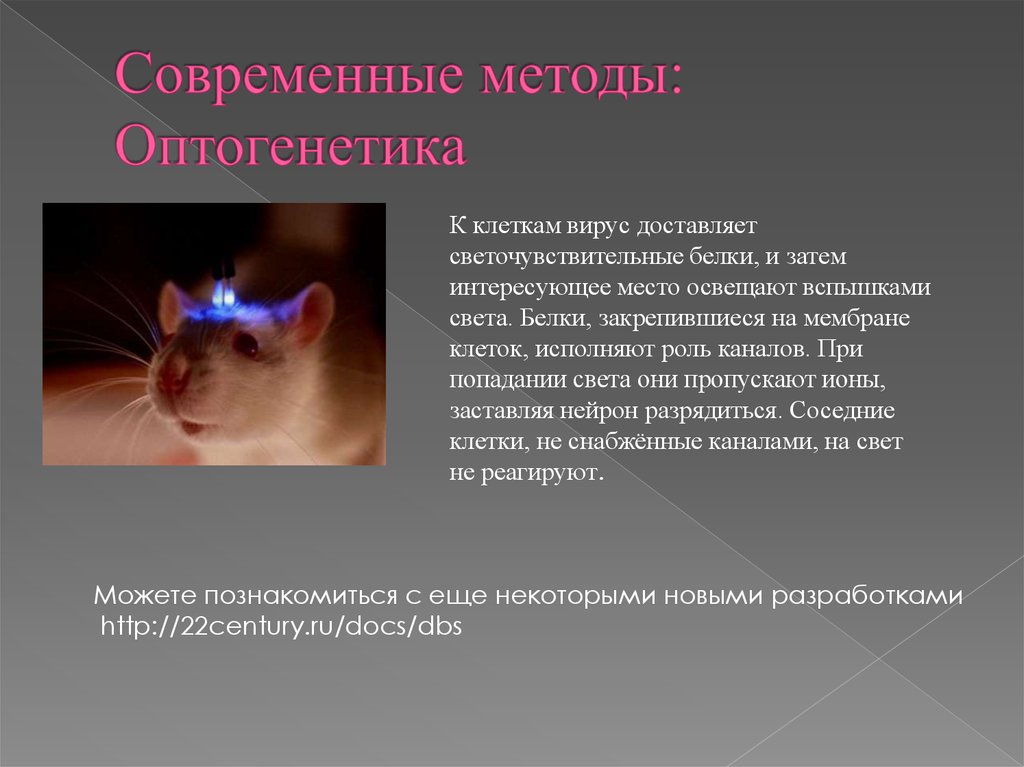 Это имплантированные в мозг электроды, которые можно включать и выключать, чтобы облегчить симптомы. Альтернативным лечением может быть имплантация светодиодов в мозг вместо электродов и использование их для стимуляции только нейронов, пораженных болезнью. Подробнее об этом читайте здесь.
Это имплантированные в мозг электроды, которые можно включать и выключать, чтобы облегчить симптомы. Альтернативным лечением может быть имплантация светодиодов в мозг вместо электродов и использование их для стимуляции только нейронов, пораженных болезнью. Подробнее об этом читайте здесь.
Галородопсин, ионный канал из архебактерий, использовался для подавления активности нейронов вскоре после открытия канала родопсина-2. Галородопсин активируется светом с другой длиной волны, чем канал родопсина-2, поэтому оба канала могут использоваться для независимой активации и ингибирования активности нейронов, но в одном и том же организме и/или клетках.
Недавно была проведена работа по созданию еще более светочувствительных ионных каналов, которые можно было бы имплантировать в различные типы клеток. Эд Бойден, член группы, опубликовавшей статью 2005 года, пытался создать ионные каналы, чувствительные к красному свету. Красный свет проходит через биологические ткани дальше, чем синий или желтый свет (цвета, которые активируют каналы родопсина-2 и галородопсина соответственно).
