Содержание
Сколько всего открыто химических элементов?
Содержание:
В памяти каждого человека наверняка всплывают обрывки знаний, полученных в школе, о химических элементах. Специалисты в различных отраслях имеют с ними дело ежедневно. Что же такое химический элемент, каковы его особенности и сколько всего элементов открыто?
Химический элемент и таблица Менделеева
Химический элемент – это совокупность атомов, ядра которых имеют одинаковый заряд. Для каждого элемента предусмотрено свое наименование на латыни и уникальный символ. Различные правила относительно деятельности ученые в этой области регламентируются международной организацией МСТПХ (Международный союз теоретической и прикладной химии).
Систематизированы они в Периодической системе химических элементов – таблице Менделеева. Над ее разработкой Дмитрий Менделеев, выдающийся русский ученый, трудился в 1869-1871 годах.
Таблица Менделеева (1869-1905)
Открытие периодического закона – именно его заслуга. Суть данного закона заключается в том, что свойства элементов имеют периодическую зависимость от их атомного веса, так же, как и свойства тел, которые данные элементы образуют.
Таблица Менделеева представлена в трех формах – короткой, длинной и сверхдлинной. Основным вариантом считается длинная или длиннопериодная вариация. Именно она изображается в современной образовательной литературе. В целом таблица отображает все открытые химические элементы, их принадлежность к периодам, группам, а также дополнительные свойства.
Как открывают новые химические элементы?
В 2019 году таблице Менделеева исполнилось 150 лет. Первый ее вариант содержал лишь 63 элемента. По состоянию на начало 2020 года учеными официально открыто 118 химических элементов, которые имеют соответствующие порядковые номера с 1 по 118. При этом 94 элемента имеют природное происхождение, а еще 24 открыты искусственным путем – при помощи проведения ядерных реакций.
Интересный факт: последний 118 химический элемент, официально открытый и подтвержденный 28 ноября 2016, носит название оганесон в честь Юрия Оганесяна – знаменитого академика. Это второй элемент, названный в честь ныне живущего человека (первый – сиборгий).
Раньше ученые открывали элементы, обнаруживая их в природе. Для этого исследовали различные минералы, разделяли их на отдельные компоненты. Но они не могут быть в бесконечном количестве – после урана последующие открытия осуществляются лишь синтетическим путем.
Как именно происходит процесс открытия нового элемента? Говоря простым языком, производится реакция слияния двух ядер. Одно ядро выступает «мишенью», а второе – атакующей частицей. Визуально это можно представить в виде капли жидкости, которая вибрирует и, в итоге, разделяется на две капли – образуется новый элемент.
Сложность заключается в том, что одни элементы могут существовать долго, а другие распадаются буквально за считанные минуты. Это затрудняет изучение и открытие новых элементов. Также ученые пытаются создать тяжелые элементы, что на практике является еще более сложной задачей.
В современной версии таблицы элементы 104-118 являются сверхтяжелыми. Это значит, что они обладают существенной атомной массой. Элементов, тяжелее урана, не обнаружено – все последующие образуются только искусственно. В настоящее время ученые занимаются активными поисками элементов под номерами 119 и 120.
Элементов, тяжелее урана, не обнаружено – все последующие образуются только искусственно. В настоящее время ученые занимаются активными поисками элементов под номерами 119 и 120.
Современная Периодическая система
Основная цель – понять, насколько большой может оказаться таблица, и какие силы заставляют столь тяжелые атомы держаться вместе. Сверхтяжелые элементы открывают путем объединения двух легких. По такой схеме были обнаружены элементы 113, 115, 117 и 118.
Интересный факт: ученые предполагают наличие некоторых элементов, но официально они еще не обнаружены. Такие элементы получают временное название (с приставкой Un- или Ун- в русском языке) и порядковый номер в таблице в соответствии с ожидаемой атомной массой. Например, 119 – Унуненний, 120 – Унбинилий и др.
Подобные исследования происходят лишь в считанных лабораториях, расположенных в разных странах мира. Есть такой специализированный объект и в России. Главным российским научным центром в данной области является Объединенный институт ядерных исследований, расположенный в технополисе Дубна (Московская область).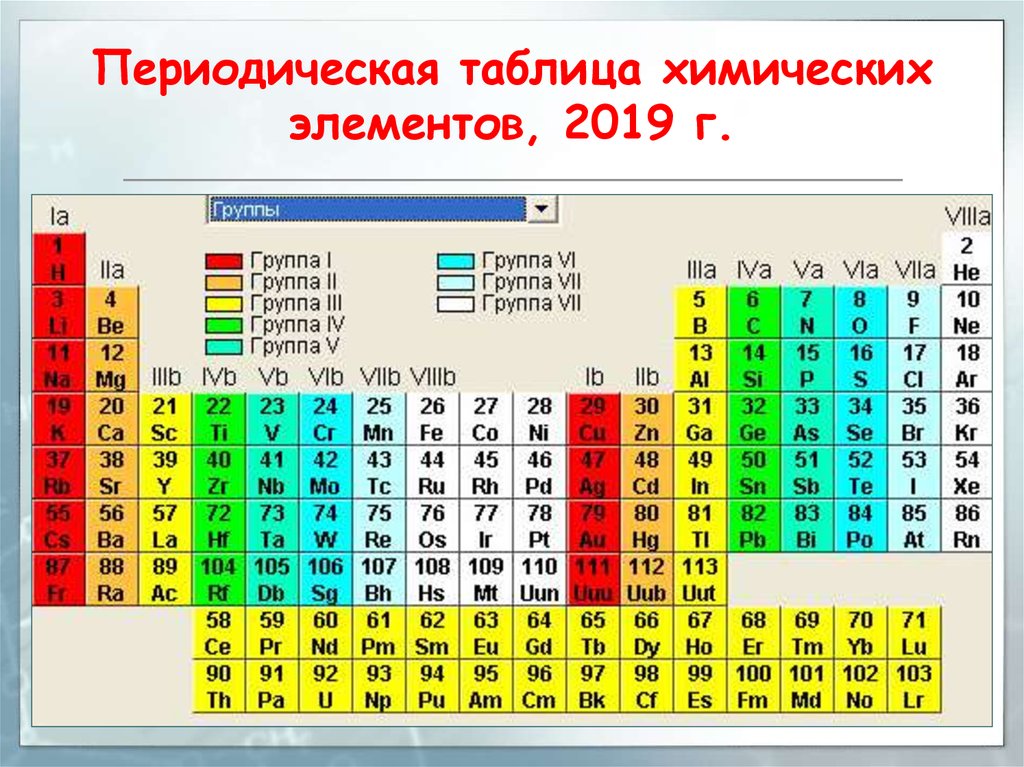
Именно здесь за последние 20 лет было искусственно создано 5 элементов – со 114 по 118. Также в Дубне создается Фабрика сверхтяжелых элементов – установка, которая должна упростить синтез.
Фабрика сверхтяжелых элементов
По состоянию на начало 2020 года официально подтверждено и занесено в таблицу Менделеева 118 химических элементов. Последний 118-й элемент, оганесон, синтезирован и утвержден в 2016 году. Назван в честь академика Оганесяна, который внес существенный вклад в экспериментальную ядерную физику. В современной науке открытие новых элементов – сложный и длительный процесс. Новые элементы создаются искусственным путем. Ученые активно работают над поиском 119 и 120 элементов Периодической системы.
Интересное видео о химических элементах
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Новые элементы периодической таблицы Менделеева получили официальные названия
Международный союз теоретической и прикладной химии (IUPAC) утвердил названия четырех новых элементов периодической таблицы Менделеева. Ни один из них «в живой природе» не встречается.
Ни один из них «в живой природе» не встречается.
По порядку рассчитайсь!
Отличить элемент естественного происхождения от синтезированного можно по атомному номеру (числу протонов в ядре). Элементы с числом меньше 92 (уран) можно наблюдать в природе, элементы с номерами 93-100 получают в реакторах. Если атомный номер больше 100 – значит, такой элемент можно синтезировать с помощью ускорителей частиц. Именно так родились на свет нихоний (Nihonium, Nh), московий (Moscovium, Mc), теннессин (Tennessine, Ts) и оганессон (Oganesson, Og).
Соответственно, новые элементы получили 113-й, 115-й, 117-й и 118-й атомные номера. После того, как Международный союз в январе 2016-го года официально их верифицировал, командам исследователей дали 5 месяцев на то, чтобы определиться с именами и двухбуквенными обозначениями новых химических элементов.
И наконец, 8 июня миру огласили весь список.
Японий? Нихоний!
«Нихон» (Nihon) по-японски означает то самое поэтическое словосочетание «Страна восходящего солнца». 113-й элемент таблицы Менделеева назван в честь страны, учеными которой был открыт. По мнению лауреата Нобелевской премии по химии Рёдзи Ноёри, «для ученых это, возможно, большая ценность, чем золотая олимпийская медаль».
113-й элемент таблицы Менделеева назван в честь страны, учеными которой был открыт. По мнению лауреата Нобелевской премии по химии Рёдзи Ноёри, «для ученых это, возможно, большая ценность, чем золотая олимпийская медаль».
Первооткрыватели нихония – группа ученых из Института физико-химических исследований (RIKEN), возглавляемая профессором Коскэ Моритой. Эксперименты по «выведению» нихония проводились в 2004-м, 2005-м, 2012-м годах. Пожалуй, описание опытов мало кто поймет, но ясно, что работа проделана колоссальная: получить японий исследователи смогли «бомбардируя на ускорителе мишень из висмута-209 пучком ионов цинка-70, разогнанных до одной десятой скорости света и висмута. В результате им удалось зафиксировать три цепочки распада, соответствующие событию рождения 113-го элемента – 23 июля 2004 года, 2 апреля 2005 года и 12 августа 2012 года. Время жизни ядра нового элемента составило от 4,9 до 0,3 миллисекунды».
Авторство, кстати, оспаривали также физики России и США, пришлось подключать международную комиссию из представителей теоретической и прикладной химии и физики. Эксперты пришли к выводу, что японцы все-таки синтезировали новый элемент раньше остальных своих коллег.
Эксперты пришли к выводу, что японцы все-таки синтезировали новый элемент раньше остальных своих коллег.
Как много в этом звуке
Согласно правилам IUPAC, вновь открытые элементы могут быть названы в честь мифологических понятий или персонажей (в том числе астрономических объектов), минералов или аналогичных веществ, географических регионов, свойств самого элемента или в честь какого-либо ученого.
При выборе названия для элемента №115 был использован именно географический принцип. Элемент получил имя «московий» – поскольку впервые был синтезирован специалистами Объединенного института ядерных исследований в Дубне, который расположен в Московской области. Почему не дубний? А потому что дубний к этому времени был уже открыт.
Согласно вердикту IUPAC, приоритет в открытии московия принадлежит ученым из ОИЯИ в Дубне, Окриджской национальной лаборатории и Ливерморской национальной лаборатории (США). При этом рабочая группа IUPAC отдельно отметила, что достоверные результаты, подтверждающие открытие элемента, были получены только в экспериментах, проведенных в ОИЯИ в 2010 году. «Название московий отдает должное Московскому региону, оно дано в честь древней русской земли, где находится Объединенный институт ядерных исследований», – уточняют в институте.
«Название московий отдает должное Московскому региону, оно дано в честь древней русской земли, где находится Объединенный институт ядерных исследований», – уточняют в институте.
По теме
1385
Новый владелец McDonald’s в России подал заявку на регистрацию бренда «Наше место»
Бывшая компания McDonald’s подала в Роспатент заявку на регистрацию одного бренда. Сообщается, что речь идет о товарном знаке «Наше место».
Первые пять месяцев после открытия элемент провел, кстати, под именем «унунпентий» – по своему порядковому, 115-му, номеру.
16-й штат, но 117-й элемент
Номер нового элемента по имени «теннессин» – 117. Унунсептий («один-один-седьмой») был открыт последним из элементов седьмого периода таблицы Менделеева.
Широкие массы о нем узнали задолго до официального признания: из 10-й серии 7-го сезона фантастического мультсериала «Футурама», показанной в августе 2012-го года.
В сериале унунсептий назвали «фарнсием» (Farnsium, Fa) – предположительно, в честь одного из главных героев «Футурамы», профессора Хьюберта Фарнсворта.
В реальной жизни синтезом этого элемента занимались все те же три объединившие усилия научные команды – из Дубны, Ок-Риджа и Ливермора, впервые он был получен ОИЯИ в Дубне в 2009 году. IUPAC, однако, порекомендовал дать элементу название «теннессин», чтобы отметить таким образом вклад ученых штата Теннесси (из Национальной лаборатории Ок-Ридж, Университета Вандербильта и Университета Теннесси в Ноксвилле) в дело изучения сверхтяжелых элементов.
Теннессин чуть не стал фарнсием…
В честь профессора
В названии еще одного элемента мерещится что-то скандинавское – оганессон… На самом деле, 118-й элемент назван в честь российского ученого, специалиста в области экспериментальной ядерной физики Юрия Оганесяна, академика РАН, научного руководителя лаборатории ядерных реакций им. Флерова в ОИЯИ в Дубне, заведующий кафедрой ядерной физики университета «Дубна».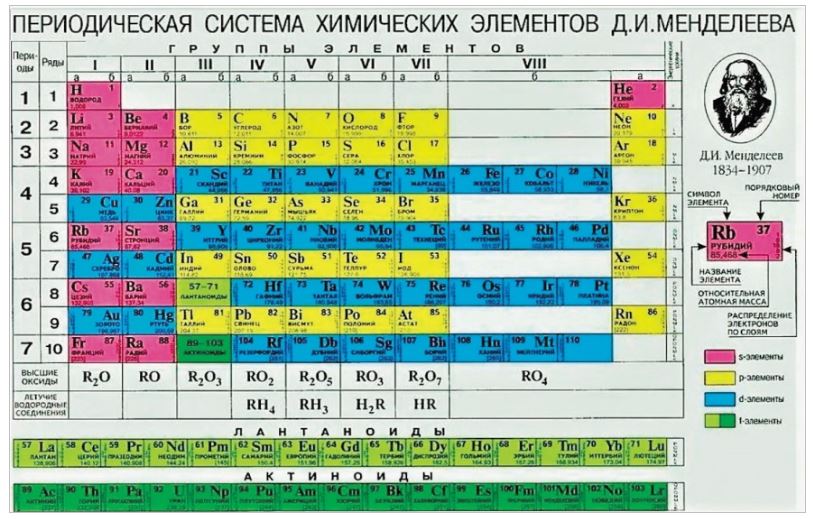
Предложение назвать новый элемент именем российского ученого, как отмечают в пресс-релизе ОИЯИ, «следует традиции оказания чести и отражает признание новаторского вклада профессора Юрия Оганесяна в исследование трансактинидных элементов. В числе его многих достижений – открытие сверхтяжелых элементов и значительный прогресс в ядерной физике сверхтяжелых элементов, включая экспериментальное подтверждение существования «острова стабильности».
Юрий Оганесян – «родитель» не одного химического элемента, а пяти, он открыл также (в соавторстве) резерфордий, дубний, сиборгий и борий. За открытие новой области стабильности сверхтяжелых элементов награжден Государственной премией Российской Федерации в области науки и технологий 2010 года.
На этом пока всё
Напомним, систему периодизации химических элементов по их атомной массе разработал в 1869 году русский ученый Дмитрий Менделеев. Согласно распространенной легенде, свою знаменитую таблицу он увидел во сне – хотя сам ученый эту версию так и не подтвердил, сказав: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
На сегодняшний день полная версия таблицы состоит из 126 элементов, при этом элементы 121-126 пока еще не удалось синтезировать. В предыдущий раз пустые места в периодической таблице Менделеева заполняли 5 лет назад: в 2011-м в нее добавили флеровий (114-й элемент) , названный в честь одного из основателей ОИЯИ Георгия Флёрова, и ливерморий (116-й) – получивший свое название в честь Ливерморской лаборатории.
Женщины периодической таблицы – Science in School
Author(s): Аннет Ликкнес [Annette Lykknes], Бригит Ван Тиггелен [Brigitte Van Tiggelen]
Перевод выполнен Надей Фёдоровой (Nadia Fedorova). Познакомьтесь со вкладом женщин-учёных в изучение химических элементов – и как это влияет на наше понимание природы…
В марте 1869 года русский химик Дмитрий Менделеев впервые докладывал об изобретённый им периодической системе химических элементов в Российской Академии Наук (Gordin, 2004). Менделеев разработал свою систему на основании сформулированного им же периодического закона, утверждающего что свойства элементов стоят в периодической зависимости от их атомного веса. Система Менделеева, достигшая полуторавековой годовщины, доказала свою устойчивость в свете новых научных открытий, начиная с открытия благородных газов и радиоактивных элементов и кончая квантовой физикой.
Менделеев разработал свою систему на основании сформулированного им же периодического закона, утверждающего что свойства элементов стоят в периодической зависимости от их атомного веса. Система Менделеева, достигшая полуторавековой годовщины, доказала свою устойчивость в свете новых научных открытий, начиная с открытия благородных газов и радиоактивных элементов и кончая квантовой физикой.
Впрочем история периодической таблицы элементов началась задолго до 1869 года, так же как и научный вклад внесённый в разработку периодической теории женщинами-учёными. История научных открытий часто представляется с точки зрения основных понятий и теорий, и упускает огромное количество экспериментальных работ и случайных наблюдений благодаря которым были разработаны эти понятия и теории. Именно эту забытую и неоценённую работу часто выполняли женщины. Желая изменить эту тенденцию, в год объявленный Международным Годом Периодической Таблицыw1, мы хотим рассказать истории нескольких женщин-учёных, чьи работы внесли важный вклад в изучение элементов периодической таблицы.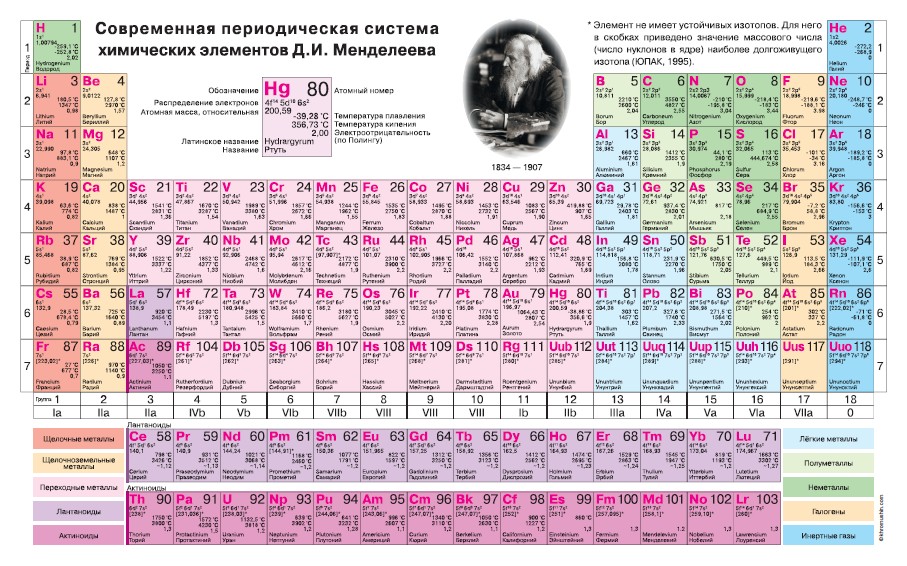
XVIII век
Мария-Анна Лавуазье и новая идея химического элемента
Портрет Марии-Анны и
Антуана Лавуазье [Marie-
Anne and Antoine Lavoisier]
(1788) (нажмите на
фотографию для
увеличения)
Жак-Луи Давид [Jacques-Louis
David], свободный доступ
Революция в химии, происшедшая во Франции в восьмидесятых годах восемнадцатого века, часто отмечается как начало современной химической науки. Центральной фигурой в этом процессе выступал французский аристократ Антуан Лавуазье [Antoine Lavoisier]. В своей работе Méthode de nomenclature chimique (1787), Лавуазье и его коллеги присвоили новые систематические имена всем известным в то время химическим элементам и разработали правила наименование химических соединений которые используются по сей день. Лавуазье также определил химический элемент как элементарную субстанцию которая не поддается разложению во время химического анализа, и составил таблицу содержащую 33 элемента. Хотя не все они признаются элементами в современной химии, работы Лавуазье положили конец эпохе в которой выделялись только четыре элемента, земля, воздух, огонь, и вода.
На известной картине Лавуазье изображён со своей женой Марией-Анной: он занят работой а она представлена в виде его музы-вдохновительницы. На самом деле, их отношения этим не ограничивались. Мария-Анна принимала активное участие в научной работе мужа. Она помогала ему в лаборатории, вела его корреспонденцию, принимала иностранных учёных в своём салоне, переводила зарубежные научные статьи на французский, и иллюстрировала научные книги. Кроме того, она сыграла большую роль в распространении новых химических идей, особенно идеи кислорода, когда она перевела и снабдила критическими комментариями работу ирландского химика Ричарда Кирвана [Richard Kirwan], скептически относившегося к идее синтеза воздуха из кислорода и водорода и придерживавшегося теории ‘флогистона’.
XIX век
Джейн Марсе знакомит широкую публику с химическими элементами
В 1806 году, спустя несколько десятилетий после революции в химической науке, швейцарка из Лондона по имени Джейн Марсе [Jane Marcet] написала учебник по химии который выдержал 16 английских и по меньшей мере 23 американских издания и был переведён на французский, немецкий и итальянский языки (Dreifuss & Sigrist, 2012).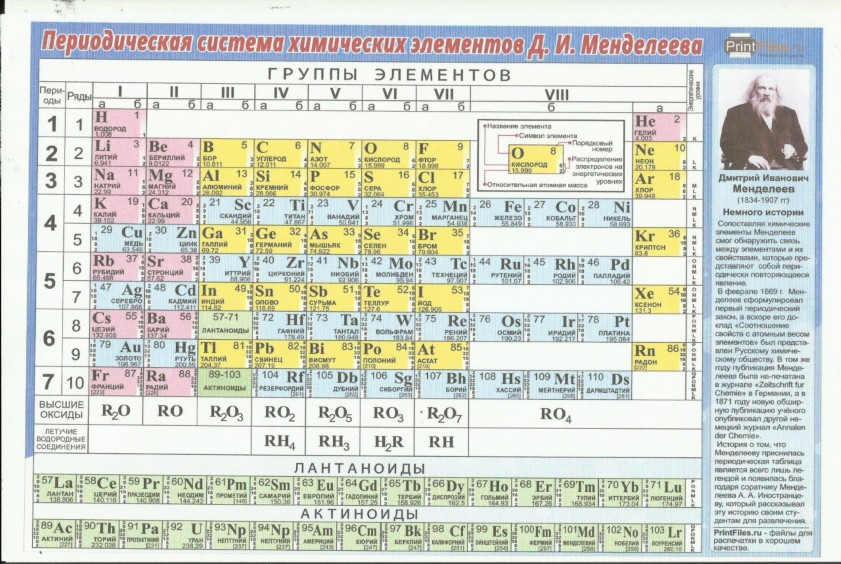
Учебник был написан в форме диалога и предназначен для женской аудитории, и его широкий успех сделал химию изысканным и благородным предметом интереса для широкой публики, включая женщин и девочек. Марсе включила в учебник новейшие на то время открытия в химии: взяв за основу таблицу химических элементов Лавуазье, она добавила в неё только-что открытые Хэмфри Дэви [Humphry Davy] щелочные и щелочноземельные металлы (Na, K, Mg, Ca, Sr, Ba). Кроме того в учебнике были упомянуты элементы теоретически предсказанные или практически полученные Йёнсом Якобом Берце́лиусом [Jöns Jacob Berzelius] и его учениками (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V), а также элементы открытые Уильямом Хайдом Волластоном [William Hyde Wollaston] (Rh, Pd), Смитсоном Теннантом [Smithson Tennant] (Os, Ir), и Чарльзом Хэтчеттом [Charles Hatchett] (колумбий, сейчас известный как Nb). Марсе вращалась в Лондонском научном обществе, и через своих знакомых она знала о многих открытиях которые ещё не стали достоянием общественности. Не смотря на это, первые издания её учебника были опубликованы анонимно.
Не смотря на это, первые издания её учебника были опубликованы анонимно.
Иллюстрация из учебника Джейн Марсе [Jane Marcet] “Беседы о химии” [Conversations on Chemistry], изображающая химический аппарат и способы его применения (нажмите на фотографию для увеличения)
Национальная медицинская библиотека США [US National Library of Medicine/archive.org], свободный доступ
Юлия Лермонтова и редкие платиновые металлы
Портрет Юлии Лермонтовой
[Julia Lermontova]
А Карвэйн [A Karvain]/Institut
Mittag-Leffler
Положение Юлии Лермонтовой [Julia Lermontova] намного отличалось от её предшественниц. Русская женщина-химик стала первой женщиной в Германии (и одной из первых в мире) получившей докторскую степень в химии в 1874 году. Современница Менделеева, она училась в Гейдельберге [Heidelberg] у Роберта Бунзена [Robert Bunsen], работала с Августом Вильгельмом фон Гофманом [Wilhelm von Hoffman] и получила свою докторскую степень в Гёттингене [Göttingen]. Лермонтова взяла на себя тяжёлую и кропотливую работу по определению места в периодической таблице для элементов платиновой группы (Ru, Rh, Pd, Os, Ir, Pt). Эти элементы очень близки друг к другу по своим свойствам и атомному весу. Необходимость точно определить их атомный вес требовала приготовления абсолютно чистых химических субстанций, для чего было необходимо точно повторять сложные аналитические измерения много раз подряд. Понятно что такая работа не пользовалась интересом у большинства учёных и обычно доставалась “пехотинцам от науки”, таким как Лермонтова. Научный вклад таких лабораторных химиков, многие из которых были женщинами и от которых требовалось получение чистых элементов или измерение точного атомного веса, огромен, но в большинстве своём забыт. Однако именно эта кропотливая работа ярко иллюстрирует проблемы с которыми сталкивались Менделеев и его современники в своих усилиях сгруппировать все известные элементы в осмысленную систему. Неопубликованные работы Лермонтовой, долгое время остававшиеся неизвестными, были обнаружены в архиве Менделеева почти сто лет спустя.
Лермонтова взяла на себя тяжёлую и кропотливую работу по определению места в периодической таблице для элементов платиновой группы (Ru, Rh, Pd, Os, Ir, Pt). Эти элементы очень близки друг к другу по своим свойствам и атомному весу. Необходимость точно определить их атомный вес требовала приготовления абсолютно чистых химических субстанций, для чего было необходимо точно повторять сложные аналитические измерения много раз подряд. Понятно что такая работа не пользовалась интересом у большинства учёных и обычно доставалась “пехотинцам от науки”, таким как Лермонтова. Научный вклад таких лабораторных химиков, многие из которых были женщинами и от которых требовалось получение чистых элементов или измерение точного атомного веса, огромен, но в большинстве своём забыт. Однако именно эта кропотливая работа ярко иллюстрирует проблемы с которыми сталкивались Менделеев и его современники в своих усилиях сгруппировать все известные элементы в осмысленную систему. Неопубликованные работы Лермонтовой, долгое время остававшиеся неизвестными, были обнаружены в архиве Менделеева почти сто лет спустя.
XX век
Мария Склодовская-Кюри и радиоактивные элементы
Мария и Пьер Кюри [Marie
and Pierre Curie] в своей
лаборатории, около 1900
года
Wellcome Collection,CC BY 4.0
Не смотря на то что научные работы Марии Склодовской-Кюри [Marie Curie] хорошо известны, их научный вклад всё равно поражает воображение. С тех пор как Мария, вместе с мужем Пьером и сотрудником Густавом Бемонтом [Gustave Bémont], открыла полоний и радий в 1898 году, они должны были проделать огромную работу, подвергая тонны минеральной смолы тщательному химическому анализу, чтобы получить 0.1 г хлорида радия в 1902 году (Quinn, 1995). Хотя Мария была женой Пьера, они работали независимо друг от друга до тех пор пока Пьер не осознал огромную важность работы жены и не присоединился к её лаборатории. Любопытно что в данном случае забытым учёным оказалась не женщина а мужчина, Бемонт.
Ида Ноддак-Такке и рений
Ида Ноддак-Такке [Ida
Noddack—Tacke] регулирует
рентгеновский
спектрометер в своей
лаборатории, 1944 год
Архив Католического
Университета в Левене
[Universiteitsarchief Katholieke
Universiteit te Leuven]
Немецкому химику Иде Ноддак-Такке [Ida Noddack-Tacke] пришлось проделать ту же изнуряющую работу что и Марии Склодовской-Кюри когда она трудилась над получением одного из самых редких металлов на земле, рения (Van Tiggelen, 2001).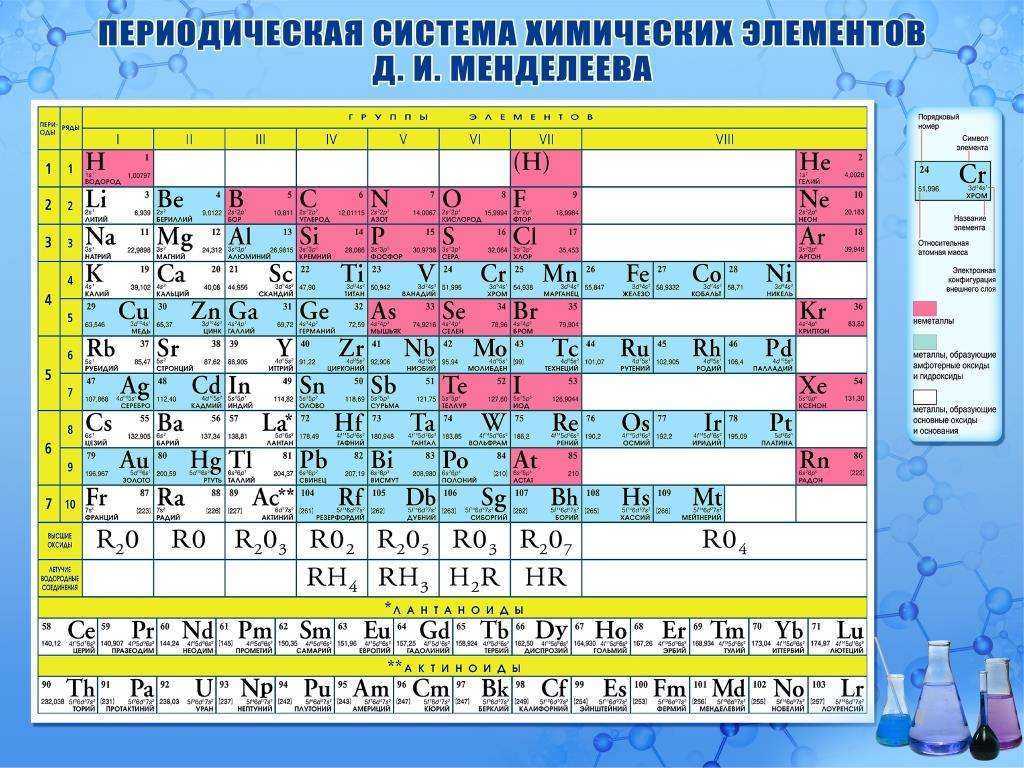 Открытие рения было объявлено Идой (вместе с её женихом Вальтером Ноддаком [Walter Noddack] и сотрудником Отто Бергом [Otto Berg], ещё одним забытым учёным) в 1925 году, но прошло ещё три года прежде чем были получены первые 120мг чистого рения, а его атомный вес был измерен только в 1929 году. Столько времени Иде и Вальтеру потребовалось чтобы найти места с богатыми залежами рениевой руды и проанализировать тысячи образцов для получения чистого элемента. Осталось большое количество лабораторных записей свидетельствующих о кропотливой и однообразной работе которая часто не приносила успеха. Несмотря на то что Ноддаки, также как Кюри, помогали друг другу в научной работе, Ида оставалась в финансовой зависимости от мужа и её академическая карьера полностью зависела от Вальтера.
Открытие рения было объявлено Идой (вместе с её женихом Вальтером Ноддаком [Walter Noddack] и сотрудником Отто Бергом [Otto Berg], ещё одним забытым учёным) в 1925 году, но прошло ещё три года прежде чем были получены первые 120мг чистого рения, а его атомный вес был измерен только в 1929 году. Столько времени Иде и Вальтеру потребовалось чтобы найти места с богатыми залежами рениевой руды и проанализировать тысячи образцов для получения чистого элемента. Осталось большое количество лабораторных записей свидетельствующих о кропотливой и однообразной работе которая часто не приносила успеха. Несмотря на то что Ноддаки, также как Кюри, помогали друг другу в научной работе, Ида оставалась в финансовой зависимости от мужа и её академическая карьера полностью зависела от Вальтера.
Стефани Хоровиц и доказательство радиоактивных изотопов
Стефани Хоровиц [Stefanie
Horovitz] в Институте Радия
[The Radium Institute] в
Вене, 1915 год
Австрийская Центральная
Физическая Библиотека
[Austrian Central Library for
Physics], Вена
Работа польского химика еврейского происхождения Стефани Хоровиц [Stefanie Horovitz] обеспечила первое авторитетное доказательство существования изотопов. Идея изотопов, элементов которые могут существовать в состоянии разного атомного веса, была изначально предложена английским химиком Фредериком Содди [Frederick Soddy] в 1913 году. Содди, в свою очередь, использовал термин предложенный английским доктором Маргарэт Тодд [Margaret Todd]. К этому времени было открыто около 35 радиоактивных элементов – намного больше чем количество пустых мест в периодической таблице. Существование изотопов разрешало эту проблему, так как многие вновь открытые радиоактивные элементы позже оказались изотопами ранее известных. Однако эта идея была вначале встречена скептически.
Идея изотопов, элементов которые могут существовать в состоянии разного атомного веса, была изначально предложена английским химиком Фредериком Содди [Frederick Soddy] в 1913 году. Содди, в свою очередь, использовал термин предложенный английским доктором Маргарэт Тодд [Margaret Todd]. К этому времени было открыто около 35 радиоактивных элементов – намного больше чем количество пустых мест в периодической таблице. Существование изотопов разрешало эту проблему, так как многие вновь открытые радиоактивные элементы позже оказались изотопами ранее известных. Однако эта идея была вначале встречена скептически.
Чтобы доказать существование изотопов, Содди выдвинул идею для экспериментального анализа: если свинец может существовать в виде разных изотопов, тогда атомный вес свинца полученного из урана будет отличаться от обычного свинца. В 1914 году эта работа была поручена Хоровиц её научным руководителем, Отто Хёнигшмидом [Otto Hönigschmid] из Венского Института Радия. Много дней Стефани провела в лаборатории изолируя образцы чистейшего свинца из радиоактивной урановой руды и измеряя их атомный вес с помощью точнейших гравиметрических методов.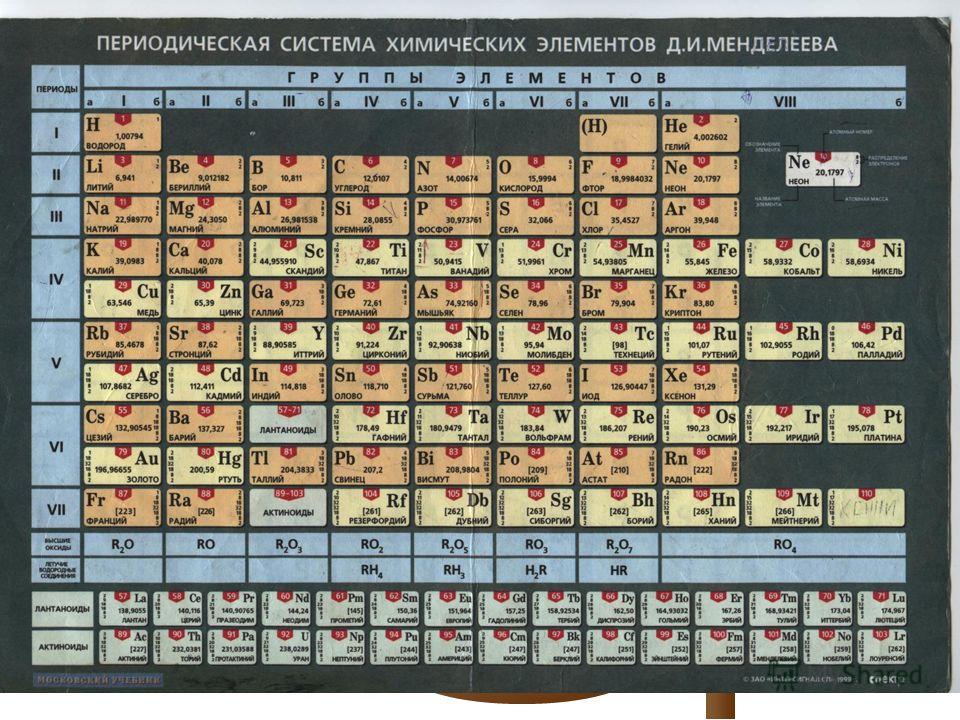 Её измерения показали разницу в атомном весе превышающую экспериментальную ошибку, тем самым раз и навсегда доказав существование изотопов.
Её измерения показали разницу в атомном весе превышающую экспериментальную ошибку, тем самым раз и навсегда доказав существование изотопов.
Кроме того, вместе с Хёнигшмидом, она помогла опровергнуть существование предположительно нового элемента названного ионием. Они доказали что ионий имел те-же спектроскопические и химические свойства что и торий, отличаясь от тория только атомным весом. В результате ионий был классифицирован как изотоп тория (Th-230).
Эллен Гледич и не радиоактивные изотопы
Портрет Эллен Гледич [Ellen
Gleditsch], 1927 год
Крис Кох [Chris Koch]
Хотя Эллен Гледич [Ellen Gleditsch] родилась и выросла в Норвегии, она получила первый опыт работы с радиоактивными элементами в лаборатории Марии Кюри в Париже (Lykknes, 2005). После этого она уехала в Америку, где её работа в Йельском Университете [Yale University] помогла установить точную величину периода полураспада радия (позднее классифицированного как изотоп RA-226). Эта работа, опубликованная в 1915 году, дала науке важную константу так как радий считался эталоном в этой исследовательской области.
Эта работа, опубликованная в 1915 году, дала науке важную константу так как радий считался эталоном в этой исследовательской области.
Позднее, работая в Гарвардском Университете [Harvard University], Гледич (как и Хоровиц) увлеклась работой с изотопами. Тогда уже было известно что атомный вес радиоактивных элементов (или продуктов радиоактивного распада) может меняться в зависимости от их геологической природы. Например, в рудах богатых природным торием, изобилие свинца-208 повышает атомный вес свинца, тогда как в урановых рудах (откуда получают свинец-206) атомный вес свинца будет ниже. Эта изменчивость изначально приписывалась только радиоактивным элементам.
Но изобретение масс-спектрографа, совершённое Фрэнсисом Астоном [Francis Aston] в 1919 году, опровергло это убеждение. Масс-спектрограф позволил произвести исключительно аккуратную классификацию элементов на основании их атомного веса и электрического заряда. Когда Астон объявил что он обнаружил два отдельных атомных веса хлора (35 и 37) со средним атомным весом в 35.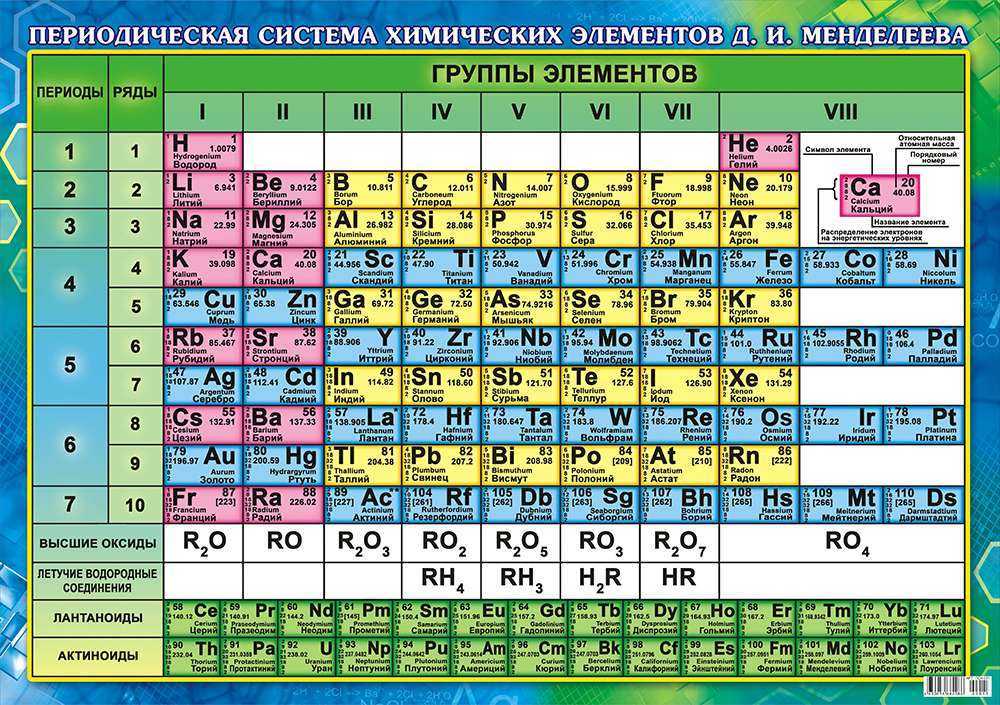 46, это было встречено скептически – получалось что и в этом случае изотопный состав зависит от геологической природы. Вся концепция постоянства атомного веса, на базе которой была построена периодическая система, оказалась под сомнением.
46, это было встречено скептически – получалось что и в этом случае изотопный состав зависит от геологической природы. Вся концепция постоянства атомного веса, на базе которой была построена периодическая система, оказалась под сомнением.
Когда Гледич и её сотрудники исследовали хлор полученный из разных источников, они обнаружили что изотопный состав хлора на самом деле не меняется от источника к источнику. Несмотря на то что Ирэн Кюри [Irène Curie] (дочь Пьера и Марии) получила противоположные результаты, Гледич заключила что образцы Кюри были загрязнены. В конце концов атомный вес хлора оказался постоянным и угроза стабильности атомного веса была предотвращена.
Комплексность и сотрудничество
На протяжение всего существования периодической системы женщины внесли значительный научный вклад в её развитие: в салонах VIII века; как переводчики научных трактатов; как авторы учебников и распространительницы знаний; как жёны, сёстры и дочери учёных, помогавшие им в научных исследованиях; как лаборанты, учителя, и профессора; в лабораториях, школах, в семьях, и на заводах (Watts, 2007). Истории отдельных женщин, которые обогатили науку периодической системы элементов, доказывают что научная работа сложна и многогранна и что она основана на взаимном сотрудничестве. Кроме того, эти истории не только знакомят нас с мало известным научным вкладом многих женщин (и мужчин): они также открывают перед нами истинную природу науки и научных исследований.
Истории отдельных женщин, которые обогатили науку периодической системы элементов, доказывают что научная работа сложна и многогранна и что она основана на взаимном сотрудничестве. Кроме того, эти истории не только знакомят нас с мало известным научным вкладом многих женщин (и мужчин): они также открывают перед нами истинную природу науки и научных исследований.
Благодарности
Авторы хотят поблагодарить всех кто предоставил статьи о женщинах-учёных и химических элементах в предстоящий том “Женщины в своей стихии: Вклад отдельных женщин в развитие периодической системы” [Women in their Element: Selected Women’s Contributions to the Periodic System] (публикуется World Scientific, Август 2019). Особенная благодарность следующим авторам: Патрис Брет [Patrice Bret] и Кейко Кавашима [Keiko Kawashima], Жизела Боек [Gisela Boeck], Питер Чайлдс [Peter Childs], Джон Хадсон [John Hudson], Мерилин и Джофри Рэйнер-Кэнем [Marelene and Geoffrey Rayner-Canham], и Кзэвиер Рок [Xavier Roqué].
References
- Dreifuss JJ, Sigrist NT (2012) The making of a bestseller: Alexander and Jane Marcet’s Conversations on Chemistry. In Lykknes A, Opitz DL, Van Tiggelen B (eds) For Better or For Worse? Collaborative Couples in the Sciences pp 19–32. Basel, Switzerland: Birkhäuser/Springer. ISBN: 3034802854
- Gordin MD (2004) A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York, USA: Basic Books. ISBN: 046502775X
- Lykknes A (2005) Ellen Gleditsch: Professor, Radiochemist, and Mentor. PhD thesis, Department of Chemistry, Norwegian University of Science and Technology, Trondheim, Norway.
- Quinn S (1995) Marie Curie: A Life. Cambridge, USA: Perseus Books. ISBN: 0201887940
- Van Tiggelen B (2001) The discovery of new elements and the boundary between physics and chemistry in the 1920s and 1930s. The case of elements 43 and 75. In Reinhardt C (ed) Chemical Sciences in the 20th Century: Bridging Boundaries pp 131–145.
 Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
Weinheim, Germany: Wiley-VCH. ISBN: 3527302719 - Watts R (2007) Women in Science: A Social and Cultural History. London, UK: Routledge. ISBN: 0415253071
Web References
Resources
- Узнайте больше о Международном Годе Периодической Таблицы на сайте IYPT2019.
- Прочитайте больше о Джейн Марсе и написанном ей учебнике в этой статье Chemistry World.
- Прочитайте краткие биографии Марии Склодовской-Кюри, Антуана Лавуазье и Джейн Марсе на сайте Института Научной Истории [Science History Institute].
- Исследуйте историю периодической таблицы прочитав об альтернативных путях расположения элементов. Смотрите:
- Lorch M (2019) Arranging the elements: the evolving design of the periodic table. Science in School 47: 26-29.
Author(s)
Аннет Ликкнес [Annette Lykknes] — профессор химического образования в Норвежском Университете Науки и Техники [Norwegian University of Science and Technology] в Норвегии.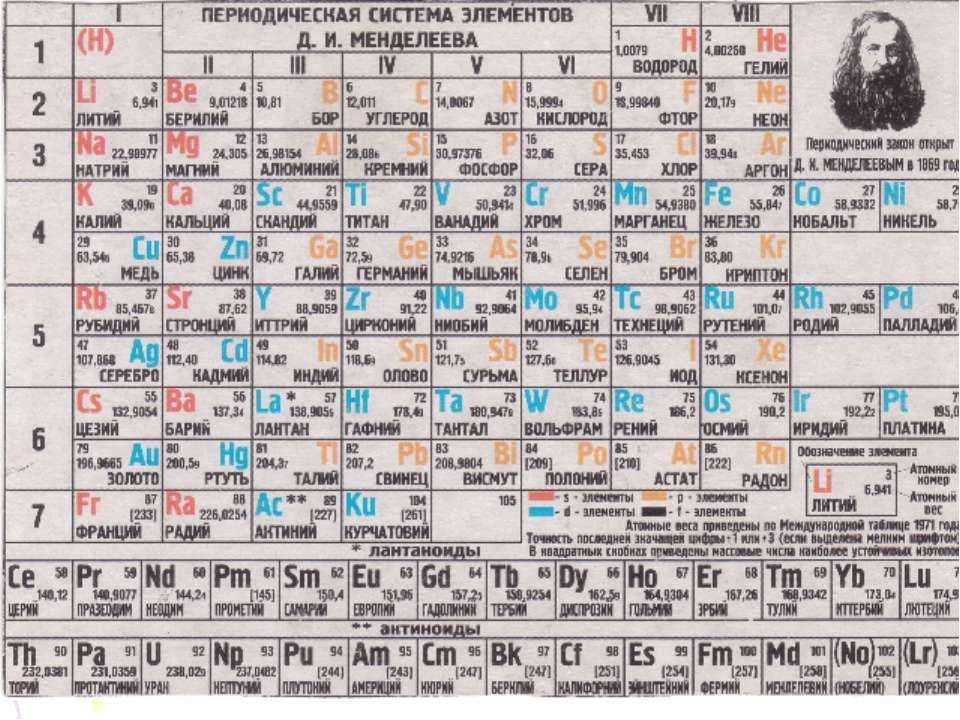 Она имеет степень магистра в области химического образования и докторскую степень по истории химии. С 2005 года она готовит преподавателей естественных наук. Ее научные интересы включают историю химии, научный вклад женщин и семейных пар, историю учебников по химии (как старых так и современных), природу науки, и преподавание естественных наук в школах через культуру и практику.
Она имеет степень магистра в области химического образования и докторскую степень по истории химии. С 2005 года она готовит преподавателей естественных наук. Ее научные интересы включают историю химии, научный вклад женщин и семейных пар, историю учебников по химии (как старых так и современных), природу науки, и преподавание естественных наук в школах через культуру и практику.
Бригит Ван Тиггелен [Brigitte Van Tiggelen] является директором по европейским операциям и старшим научным сотрудником Центра Исторических Исследований Института Истории Науки [Center for Historical Research at the Science History Institute] в Филадельфии, Пенсильвания, США. Она также является членом Центра Исторических Наук Католического Университета [Centre de Recherche en Histoire des Sciences, Université Catholique de Louvain] в Лувене, Бельгия. Она изучала физику и историю, и написала докторскую диссертацию по истории химии. Ее исследовательские интересы включают научный вклад семейных пар и женщин, историю отечественной науки и бельгийской химии. Она основала Mémosciences с целью популяризации истории науки, в особенности среди учителей средних школ.
Она основала Mémosciences с целью популяризации истории науки, в особенности среди учителей средних школ.
Review
Большинство людей, если их попросят назвать женщин внёсших научный вклад в развитие периодической таблицы, не смогут назвать ни одной. Эта статья даёт короткое но исключительно интересное представление о развитие этого фундаментального химического принципа, а также знакомит со многими забытыми учёными (как женщинами так и мужчинами) выполнившими большую научную работу но не получившими должного признания.
Эта статья может помочь стимулировать дискуссию, или послужить как материал для дополнительного чтения при изучении химии. Рекомендуется также делать меж-предметные ссылки в другие области науки где роль женщин недооценивается, например вычислительная техника, математика, и исследование космоса. Статья будет хорошим ресурсом для организованного классного чтения или как упражнение на понимание. Возможны следующие вопросы:
- Опишите роль Марии-Анны Лавуазье в установлении современной концепции химического элемента.

- Объясните почему учебник Джейн Марсе был успешным в популяризации химических элементов.
- Почему определение правильного расположения некоторых элементов в периодической таблице оказалось трудной задачей?
Кэрин Ховард [Caryn Howard], руководитель отдела химии, Школа Святой Марии [St Mary’s School], Калн, Великобритания
License
CC-BY
Download
Download this article as a PDF
Можем ли мы все еще находить новые химические элементы на Земле? › Спросите эксперта (ABC Science)
Возможно ли, что Земля все еще содержит элементы, которые еще предстоит найти? Как в лаборатории создаются сверхтяжелые элементы?
Периодическая таблица содержит более сотни химических элементов, основных строительных блоков всего, что нас окружает — живого и неживого.
Атомный номер элемента определяется количеством протонов в ядре атома этого элемента.
Некоторые элементы хорошо известны, такие как водород (1), кислород (8) и углерод (6), но менее известны; сиборгий (106), флеровий (114) и дармштадтий (110). Более трех четвертей элементов периодической таблицы существуют в природе на Земле или где-либо еще во Вселенной.
Более трех четвертей элементов периодической таблицы существуют в природе на Земле или где-либо еще во Вселенной.
Последним открытым в природе элементом был франций (87) в 1939 году. После этого открытия в лаборатории в 1940, с тех пор были обнаружены в природе.
Единственные элементы, которые еще предстоит открыть, попадают в категорию сверхтяжелых — элементы, содержащие более 104 протонов, — говорит доктор Элизабет Уильямс, физик-ядерщик из Австралийского национального университета.
Но маловероятно, что мы обнаружим какие-либо новые природные сверхтяжелые элементы на Земле, говорит Уильямс.
Она говорит, что для открытия новых природных сверхтяжелых элементов необходимы две вещи.
«Во-первых, должен существовать естественный процесс, производящий эти элементы, а во-вторых, элементы должны жить достаточно долго (и в достаточном количестве), чтобы мы могли обнаружить их существование.
Однако, — говорит она, — синтезируя супер -тяжелые элементы в лаборатории могут помочь ученым лучше понять свойства этих элементов и то, как они создаются, что затем поможет им понять, можно ли найти какие-либо еще встречающиеся в природе элементы, и если да, то каким образом. создать тяжелые элементы в лаборатории, этот естественный процесс должен быть довольно экстремальным, а также довольно распространенным, чтобы мы могли обнаружить новый элемент в окружающей среде».наверх
создать тяжелые элементы в лаборатории, этот естественный процесс должен быть довольно экстремальным, а также довольно распространенным, чтобы мы могли обнаружить новый элемент в окружающей среде».наверх
Создание тяжелых элементов
С 1939 года все вновь открытые химические элементы синтезируются в лаборатории. Большинство из них были сделаны с использованием ускорителя частиц.
Только за последний год исследователи создали атомы двух новых элементов: 117, известного пока как унунсептий, и 115, унунпентия.
«Обычно мы создаем эти элементы: у нас есть более легкий атом, скажем, кальций, и мы ускоряем его и разбиваем на фольгу, состоящую из более тяжелых атомов», — говорит Уильямс.
«Если ускоренный атом движется достаточно быстро, возможно, что его ядро - компактное ядро из протонов и нейтронов в его центре — может войти в контакт с ядром одного из более тяжелых атомов. Если это произойдет, произойдет шанс, что они сольются вместе, чтобы сформировать более тяжелый элемент».
Хотя лист фольги может показаться человеческому глазу твердым, в атомном масштабе он сильно отличается. Ядро занимает лишь крошечную часть пространства, которое занимает атом. Чтобы создать новый элемент, ядра каждого атома должны столкнуться и слиться.
«Если представить себе атом размером с Мельбурнское поле для крикета (примерно 170 метров в диаметре), то ядро представляет собой маленькую виноградинку в центре», — говорит она.
Но это еще не все.
Если два ядра направляются к столкновению, они должны преодолеть сильную силу отталкивания, препятствующую их слиянию в новый элемент. Это известно как электростатическая, или кулоновская, сила. Только если ядра ударятся с достаточной энергией, они преодолеют эту силу и сольются вместе. 9наверх
Остров стабильности
В настоящее время Уильямс и ее коллеги изучают новые способы создания новых тяжелых элементов.
«Мы знаем, что даже очень небольшие изменения в способах, которыми мы пытаемся производить эти элементы, оказывают существенное влияние на вероятность создания нового элемента», — говорит Уильямс.
«Например, как быстро мы ускоряем частицу пучка, что мы выбираем с точки зрения легких и тяжелых атомов, которые мы сталкиваем друг с другом, все это может повлиять на вероятность создания нового сверхтяжелого элемента.»
В настоящее время некоторые из более тяжелых синтетических элементов могут существовать несколько миллисекунд, а затем распадаться на более мелкие элементы, испуская альфа-частицы, фотоны и другие продукты распада.
Но ученые-ядерщики также изучают возможность существования группы тяжелых элементов, которые живут намного дольше тех, которые создаются сегодня. Они называют эту группу «островом стабильности».
«Ядра на острове стабильности близки к тому, что физики-ядерщики называют «магическими числами» протонов и нейтронов, — говорит Уильямс.
«Ядра с этим особым числом протонов или нейтронов более тесно связаны друг с другом, чем окружающие ядра. Это означает, что они, как правило, живут дольше, чем их непосредственные соседи. »
»
Предполагается, что эти относительно стабильные тяжелые элементы могут существовать несколько минут, а возможно, и дольше.
Уильямс и ее коллеги должны определить, какая комбинация протонов и нейтронов приведет их на остров.
«Мы предсказывали, что будет область относительной стабильности около 114 или 120 [протонов]. Некоторые говорят, что число нейтронов относительно стабильно около 184», — говорит Уильямс.
«Если мы сможем приблизиться к этим числам, то у нас должно получиться очень хорошо, но это трудно предсказать с точки зрения науки.»
Доктор Элизабет Уильямс дала интервью Даррену Осборну. Она научный сотрудник кафедры ядерной физики Австралийского национального университета. Ее внимание сосредоточено на изучении способов создания новых сверхтяжелых элементов.
Элементы и новые открытия — Университет Бирмингема
Что ограничивает или сдерживает количество известных нам химических элементов? Международный год Периодической таблицы, 2019 г.
Опубликовано 27 июня 2019 г.
Что ограничивает или сдерживает количество известных нам химических элементов? Международный год Периодической таблицы, 2019, посвящен 150-летию открытия периодической системы русским ученым Дмитрием Менделеевым в 1869 году. элементы. За четыре года до объявления Менделеева английский химик Джон Ньюлендс попытался опубликовать свою работу, в которой признавал сходство между элементами, названное им законом октав. Работа была отклонена Химическим обществом с довольно резким опровержением, предполагающим, что значение Закона Октав имеет немногим большую ценность, чем перечисление элементов в алфавитном порядке. Недостатком работы Ньюлендса было то, что не было места для будущих открытий элементов, с шаблоном, который иногда требовал двух элементов в одной коробке для создания последовательности. Менделеев, с другой стороны, оставлял пробелы там, где вещи не подходили, и руководствовался не только атомными весами, но и химическими свойствами и таким образом упорядочивал элементы.
Во времена Ньюлендса благородные газы, гелий, неон, аргон, криптон, еще не были открыты. Первая из них была обнаружена не на Земле, а на Солнце, где характерное поглощение света в хромосфере Солнца из-за квантовых скачков электронов на атомных орбитах приводит к провалам интенсивности на определенных длинах волн, линии Фраунгофера, выявили неизвестное доселе атомарное вещество. Позже он был выделен на Земле, где он образуется в результате радиоактивного альфа-распада тяжелых элементов с образованием газа, настолько легкого, что он ускользает от гравитационного притяжения Земли и исчезает в космосе. Элемент был назван в честь места его первого наблюдения — Гелиос.
Кислород был открыт Пристли в 1774 году, когда лучи солнечного света Гелиоса были сфокусированы на оксиде ртути, высвобождая газ, который делал мышей более активными и обладал жизнетворными свойствами. В 1780 году Пристли приехал в Бирмингем и стал членом Лунного общества вместе с Уоттом и Бултоном до начала 1790-х годов, когда он был вынужден бежать из города в ходе так называемых бунтов Пристли из-за своих политически и теологически противоречивых идей.
В более поздние времена первооткрыватели шли на крайние меры. Во время Второй мировой войны самым тяжелым известным элементом был номер 9.2 – уран. Трансурановые (помимо урана) элементы были частично обнаружены в радиоактивных осадках программы испытаний атомного оружия. Эйнштейний был обнаружен после анализа фильтровальной бумаги, пропущенной через взрывные облака при испытаниях атомной бомбы. Название иронично, учитывая его роль в программе создания бомбы. Здесь быстрый захват нейтронов во взрывоопасной среде взрыва бомбы создал экзотические изотопы, которые радиоактивно распались на новые элементы. Довольно предприимчивые коллеги предположили, что хорошим способом синтеза еще более экзотических элементов может быть двойная детонация, но вряд ли это сработает, если только не произойдет какой-нибудь несчастный случай.
Частью привлекательности поиска новых элементов является возможность назвать их. Имена говорят сами за себя. Америций, лоуренсий, калифорний, берклий, элементы 95, 97, 98 и 103 — все это дань огромной работе, проделанной в лаборатории Лоуренса в Беркли в Калифорнии, имена, которые никогда не будут потеряны во времени. Новейшие открытия имеют российское и японское происхождение, поскольку программа переместилась в страны, готовые сделать необходимые инвестиции.
Новейшие открытия имеют российское и японское происхождение, поскольку программа переместилась в страны, готовые сделать необходимые инвестиции.
Открытие элемента 113 в лаборатории RIKEN в Японии было названо Nihonium, что следует из японского названия Японии. Команду возглавлял обаятельный и скромный Морита-сан. Не менее впечатляющий Юрий Оганесян руководил работой в лаборатории Флерова под Москвой по открытию элементов 115, 117 и 118; названы Московиум, Теннессин и Оганесон. Последнее из них — замечательное признание для человека, посвятившего свою жизнь открытию и описанию новых химических элементов. Сотрудничество велось с Национальной лабораторией Ок-Ридж в Теннесси, где целью для создания этих новых элементов был уже синтетически синтезированный берклий, полученный в реакторе Ок-Ридж; синтез за синтезом.
Процесс создания этих элементов доводит эксперименты до предела, когда пучки экзотических ядер облучают экзотические мишени в течение нескольких недель подряд, доводя мишени до их точки плавления, чтобы создать несколько атомов нового элемента. Новые элементы идентифицируются по их альфа-распаду (или гелию) до известных элементов; точно так же, как гелий был впервые охарактеризован сам по себе, но теперь он является инструментом для открытия элементов.
Новые элементы идентифицируются по их альфа-распаду (или гелию) до известных элементов; точно так же, как гелий был впервые охарактеризован сам по себе, но теперь он является инструментом для открытия элементов.
Свойства этих новых элементов бросают вызов нашим представлениям о химии и таблице Менделеева. Атомный заряд настолько велик, электроны в атоме движутся так быстро, что их свойства изменяются, и новые элементы больше не следуют традиционному образцу. Наступает новая эра элементной химии.
Итак, на изначальный вопрос – так ли это, каков предел существования элементов? Ответ лежит в ядерной физике. Точно так же, как в атомной физике есть оболочки, где инертные газы соответствуют оболочкам, заполненным электронами, и периодическому паттерну, в ядрах есть оболочки. Ядра с замкнутыми оболочками из протонов и нейтронов более стабильны — это благородные ядра. Именно эти ядра дают надежду. Предсказан остров сверхтяжелых ядер, близких к элементу 126, замкнутой оболочке. Как это будет синтезировано, остается загадкой, но действительно может потребоваться двойное атомное устройство или, возможно, синтез может произойти, как мы говорим, в катаклизмических столкновениях нейтронных звезд где-то в космосе, наблюдаемых через гравитационные волны, которые создают многие элементы нашей планеты. вселенная. Его имя ждет.
Как это будет синтезировано, остается загадкой, но действительно может потребоваться двойное атомное устройство или, возможно, синтез может произойти, как мы говорим, в катаклизмических столкновениях нейтронных звезд где-то в космосе, наблюдаемых через гравитационные волны, которые создают многие элементы нашей планеты. вселенная. Его имя ждет.
Истории, сокрытые в периодической таблице
Конечно, не нужно быть ученым, чтобы поверить в мир, состоящий более чем из четырех элементов. Горняки семнадцатого века, пишет Уотерс, различали разные виды воздуха: они называли более легкий воздух, циркулировавший наверху пещеры, «огненным газом», потому что он легко воспламенялся, и тяжелые облака, которые висели у земли». удушье», потому что им было трудно дышать. В восемнадцатом веке местные жители окрестили пещеру недалеко от Неаполя Девятой.0074 Grotta del Cane : собаки, забредшие в пещеру, не в силах поднять голову над просачивающимся из-под земли газом, вскоре начали задыхаться; после возвращения на открытый воздух животные оживали.
По мере распространения этих наблюдений росло и убеждение, что должно быть много разных элементов. К концу восемнадцатого века ученые, комбинируя вещества, начали понимать, что некоторые материалы всегда реагируют в одних и тех же пропорциях, что предполагает наличие у них разной основной массы. (Всегда казалось, что для нейтрализации того же количества серной кислоты требуется немного больше аммиака, чем магнезии.) В 1803 году английский ученый Джон Дальтон предположил, что в таких реакциях участвуют атомы; он призвал своих сверстников помочь ему определить, сколько весят эти невидимые существа. Началось то, что Шерри называет «помешательством на поиске числовых закономерностей». Вскоре химики заметили закономерности, когда сгруппировали элементы в наборы по три штуки по атомному весу. (Например, литий, натрий и калий в воде шипят или взрываются; оказалось, что атомный вес натрия равен среднему значению атомного веса лития и калия.) Подобные эксперименты давали представление о порядке внутри элементной вселенной. Но работа раздражала. В 1836 году химик Жан Батист Андре Дюма, ученик Дальтона, в отчаянии опустил руки. «Что осталось от честолюбивой экскурсии, которую мы позволили себе в область атомов?» он написал. «Если бы я был мастером, я бы стер слово «атом» из науки».
Но работа раздражала. В 1836 году химик Жан Батист Андре Дюма, ученик Дальтона, в отчаянии опустил руки. «Что осталось от честолюбивой экскурсии, которую мы позволили себе в область атомов?» он написал. «Если бы я был мастером, я бы стер слово «атом» из науки».
Другие химики настаивали. По мере того, как атомные веса становились более точными, появлялось больше закономерностей. В 1864 году немецкий химик Юлиус Лотар Мейер опубликовал таблицу из двадцати восьми элементов. Элементы Мейера, расположенные в основном по возрастанию веса, также были выстроены в соответствии с их общими химическими свойствами, которые повторялись через равные промежутки времени. Пять лет спустя Менделеев опубликовал свою собственную периодическую таблицу, которая постепенно превратилась в ту версию, которой мы пользуемся сегодня. Подобно Мейеру, Менделеев организовал свои частицы в грубую сетку, ряды которой содержали элементы со схожими свойствами. Но он также украсил свой стол множеством заманчивых вопросительных знаков и пустых мест и сделал явные стихийные пророчества. Менделеев точно предсказал существование еще не открытых элементов, таких как галлий и германий, и предсказал их взаимодействие с другими элементами.
Менделеев точно предсказал существование еще не открытых элементов, таких как галлий и германий, и предсказал их взаимодействие с другими элементами.
Предсказания Менделеева были неверны так же часто, как и верны. Но, объясняет Шерри, русский химик был мастером рассказчика и, по сравнению с Мейером и другими конкурентами, более эффективным проповедником периодической системы. Менделеев использовал любую возможность, чтобы утверждать, иногда неосторожно, что характеристики элементов повторяются упорядоченным и предсказуемым образом. Он был одновременно неутомимым и непреклонным, по крайней мере до тех пор, пока волна научных мнений не повернулась против него. В конце 1850-х ученые обнаружили, что элементарный состав данного вещества можно определить по свету, который оно испускает при возгорании; в 1868 году французский астроном Жюль Янссен использовал этот метод, чтобы обнаружить гелий (элемент № 2) на поверхности Солнца во время полного солнечного затмения. Сначала Менделеев утверждал, что гелия не может быть; ему не было места в периодической таблице. Но примерно на рубеже двадцатого века, после того как были открыты другие благородные газы и доказано, что они имеют общие свойства с гелием, другие ученые сделали для них колонку, и Менделеев попал в очередь. (Колонна проходит справа, сверху торчит гелий.)
Но примерно на рубеже двадцатого века, после того как были открыты другие благородные газы и доказано, что они имеют общие свойства с гелием, другие ученые сделали для них колонку, и Менделеев попал в очередь. (Колонна проходит справа, сверху торчит гелий.)
Способность стола адаптироваться помогла ему выжить. В двадцатом веке ученые поняли, что периодичность не определяется атомным весом; вместо этого имело значение количество протонов, содержащихся в ядре каждого атома. Но и это открытие не сломало стол; после нескольких перетасовок стало точнее. За последние полтора века наши представления о Вселенной резко изменились. Но основной формат периодической таблицы сохранился.
Это не значит, что никто не пытался ее пересмотреть: Шерри отмечает, что с 1860-х годов было предложено более тысячи альтернативных периодических таблиц, часто с целью зафиксировать периодические закономерности, выпавшие из оригинала. Среди них трехмерная рождественская елка Фернандо Дюфура 1990 года; Спиральный узор Теодора Бенфея, напоминающий голову утки, 1964 г. ; и скульптура Уильяма Крукса в форме кренделя девятнадцатого века, которая сейчас находится в Музее науки в Лондоне. Эта последняя модель поместила уран в основу, предполагая, что химия никогда не столкнется с более крупным атомом. Но элементальный потолок продолжал расти. Истории о тридцати или около того элементах, открытых в прошлом столетии — некоторые из которых Менделеев и Мейер не могли себе представить — составляют большую часть книги «Сверхтяжелые: создание и разрушение периодической таблицы» (Блумсбери), написанной научным журналистом Китом Чепменом. .
; и скульптура Уильяма Крукса в форме кренделя девятнадцатого века, которая сейчас находится в Музее науки в Лондоне. Эта последняя модель поместила уран в основу, предполагая, что химия никогда не столкнется с более крупным атомом. Но элементальный потолок продолжал расти. Истории о тридцати или около того элементах, открытых в прошлом столетии — некоторые из которых Менделеев и Мейер не могли себе представить — составляют большую часть книги «Сверхтяжелые: создание и разрушение периодической таблицы» (Блумсбери), написанной научным журналистом Китом Чепменом. .
Ранние охотники за элементами использовали огонь для дистилляции своих элементов или смешивали минералы с кипящей кислотой. Эти методы были заменены в двадцатом веке технологиями, которые использовали электричество для расщепления атомов на куски. Более того, ученые поняли, что атомы имеют структуры, состоящие из протонов, нейтронов и электронов; эти структуры могут развалиться или стать больше. Эти события коренным образом изменили наше отношение к материи. Раньше обнаружить элемент было все равно, что найти доктора Ливингстона в Восточной Африке: вы знали, что он где-то там. Теперь грань между открытием и созданием размыта. Элементы, созданные в лаборатории, могут больше нигде не существовать.
Раньше обнаружить элемент было все равно, что найти доктора Ливингстона в Восточной Африке: вы знали, что он где-то там. Теперь грань между открытием и созданием размыта. Элементы, созданные в лаборатории, могут больше нигде не существовать.
Эпоха современной охоты за элементами началась в 1930-х годах, когда физик Эрнест Лоуренс поручил ученым Калифорнийского университета в Беркли разработать серию устройств, называемых циклотронами, которые используют электричество для выброса протонов в установленные мишени из фольги. внутри металлических камер. Вскоре исследователи обнаружили, что некоторые сверхзаряженные ядерные частицы могут прилипать к атомам в мишенях и создавать более крупные и тяжелые элементы. Частицы были бесконечно малы, и вероятность их столкновения была ничтожно мала. «Это похоже на стрельбу по птицам в темноте в стране, где мало птиц», — сказал Альберт Эйнштейн в 1919 году.34. Тем не менее, циклотроны Лоуренса позволили охотникам за элементами сделать триллионы выстрелов, и к 1937 году одно из его устройств создало технеций (элемент № 43), атом, предсказанный Менделеевым. Как и все элементы, родившиеся впервые в циклотронах, технеций был радиоактивным. Лоуренс получил Нобелевскую премию за свое изобретение в 1939 году; В том же году Эйнштейн сказал президенту Рузвельту заняться созданием ядерного оружия.
Как и все элементы, родившиеся впервые в циклотронах, технеций был радиоактивным. Лоуренс получил Нобелевскую премию за свое изобретение в 1939 году; В том же году Эйнштейн сказал президенту Рузвельту заняться созданием ядерного оружия.
Такие бомбы при детонации дополнительно заполняли таблицу Менделеева. Начиная с 1952 года США взрывали водородные бомбы вокруг Маршалловых островов. Затем исследователи отправили пилотов истребителей F-84 на взрывы. (Огненные шары, отмечает Чепмен, были достаточно горячими, чтобы «имитировать интенсивное горение Солнца».) Ученые оснастили законцовки крыльев F-84 фильтрами, способными улавливать атомы, образующиеся при взрыве. Прорываясь сквозь стебли грибовидных облаков, пытаясь удержать свои самолеты от грохота, пилоты, пишет Чампан, собирали «элементы, обычно присутствующие только в сливающихся нейтронных звездах». (Один пилот, Джимми Робинсон, вырвавшись из ядерной пыльной бури, обнаружил, что его двигатели заглохли; он погиб при попытке приземлиться на воду. ) Позднее в лаборатории Беркли физик Гленн Сиборг и его коллеги обнаружили двести атомов того, что станет элементом № 99 в фильтре, снятом с одной из плоскостей. Потребовались годы споров, чтобы рассекретить их открытие, но ученые из Беркли публично описали этот элемент в 1954 году. Они выпили «множество коктейлей» и в конце концов назвали свою новую частицу эйнштейнием в честь человека, предложившего бомбу.
) Позднее в лаборатории Беркли физик Гленн Сиборг и его коллеги обнаружили двести атомов того, что станет элементом № 99 в фильтре, снятом с одной из плоскостей. Потребовались годы споров, чтобы рассекретить их открытие, но ученые из Беркли публично описали этот элемент в 1954 году. Они выпили «множество коктейлей» и в конце концов назвали свою новую частицу эйнштейнием в честь человека, предложившего бомбу.
Даже в лабораторных условиях поиск новых элементов может быть опасен. В 1959 году Аль Гиорсо, физик из Беркли со стальными нервами — он, как известно, наполнял теннисные мячи радиоактивным материалом и гонял их — искал элемент № 102. Однажды, около обеда, он перегрузил ускоритель частиц гелием. при бомбардировке фильтра из кюрия; гелий раздувал кюриевый фильтр, пишет Чепмен, до тех пор, пока он не лопнул, как «воздушный шар, наполненный радиоактивным блеском». Гиорсо нырнул под облако, и здание эвакуировали. И все же, несмотря на свои трудности, Гиорсо, возможно, не был первым, кто открыл этот элемент.

 Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
Weinheim, Germany: Wiley-VCH. ISBN: 3527302719