Содержание
Печать органов: как продвинулись технологии 3D-биопринтинга и что мешает их развитию
Rusbase
12 ноября 2019
Искусственное создание человеческой кожи, тканей и внутренних органов может восприниматься как фантастика, но большая часть всего этого происходит прямо сейчас. В исследовательских центрах и больницах по всему миру достижения в области 3D-печати и биопечати предоставляют новые возможности для лечения людей и научных исследований. В ближайшие десятилетия биопечать может стать следующей важной вехой в здравоохранении и персонализированной медицине.
Расскажем о технологии биопечати, последних достижениях отрасли и ограничениях, с которыми сталкиваются специалисты.
Как работает 3D-принтер
Традиционные принтеры, такие, как у вас дома или офисе, работают в двух измерениях. Они могут печатать текст или изображения на плоской поверхности (обычно на бумаге), используя размеры x (горизонтальный) и y (вертикальный). 3D-принтеры добавляют еще одно измерение — глубину (z). В процессе печати головки принтера могут перемещаться вверх и вниз, влево и вправо, вперед и назад, но вместо того, чтобы доставлять чернила на бумагу, распределяют различные материалы — полимеры, металл, керамику и даже шоколад — до «печати» целостного, объемного предмета, слой за слоем в процессе, известном как «аддитивное производство».
3D-принтеры добавляют еще одно измерение — глубину (z). В процессе печати головки принтера могут перемещаться вверх и вниз, влево и вправо, вперед и назад, но вместо того, чтобы доставлять чернила на бумагу, распределяют различные материалы — полимеры, металл, керамику и даже шоколад — до «печати» целостного, объемного предмета, слой за слоем в процессе, известном как «аддитивное производство».
Чтобы создать 3D-объект, нужен его план — цифровой файл, созданный с помощью программного обеспечения для моделирования. После его создания сгенерированная компьютером модель отправляется на принтер. Выбранный вами материал загружен в устройство и готов к нагреву, чтобы легко вытекать из сопла принтера. Когда принтер читает план, его головка перемещается, внося последовательные слои выбранного материала для создания конечного продукта.
Когда каждый слой печатается, он превращается в твердую форму либо путем охлаждения, либо за счёт смешивания двух разных растворов, доставляемых головкой принтера. Новые слои точно ложатся на предыдущие, чтобы получился устойчивый, связный элемент. Таким способом можно создать практически любую форму, включая движущуюся.
Новые слои точно ложатся на предыдущие, чтобы получился устойчивый, связный элемент. Таким способом можно создать практически любую форму, включая движущуюся.
3D-печать позволяет создавать объекты с геометрическими структурами, которые было бы трудно или невозможно сделать другими способами. Широкий ассортимент продуктов уже создается с использованием 3D-принтеров, включая ювелирные изделия, одежду, игрушки, высококачественные промышленные товары. Даже 10-летний московский школьник научился работать на 3D-принтере: печатает 3D-фигуры на заказ и продает их через Instagram.
Как работает биопринтер
Биопринтеры работают почти так же, как и 3D-принтеры, с одним ключевым отличием — они наносят слои биоматериала, который может включать живые клетки, для создания сложных структур, таких как кровеносные сосуды или ткани кожи.
Живые клетки? Где они их берут? Каждая ткань в организме состоит из разных типов клеток. Необходимые клетки (почек, кожи и так далее) берут у пациента и затем культивируют до тех пор, пока их не станет достаточно для создания «био-чернил», которые загружаются в принтер. Это не всегда возможно, поэтому для некоторых тканей берут стволовые клетки, которые способны становиться любой клеткой в теле (организме), или, например, свиной коллагеновый белок, морские водоросли и другие.
Это не всегда возможно, поэтому для некоторых тканей берут стволовые клетки, которые способны становиться любой клеткой в теле (организме), или, например, свиной коллагеновый белок, морские водоросли и другие.
Часто в биопечати используют хитозан — полисахарид, полученный из внешнего скелета моллюсков (например, креветок) или путем брожения грибов. Этот материал имеет высокую биосовместимость и обладает антибактериальными свойствами. Его недостаток — низкая скорость гелеобразования. Другой популярный материал — полисахарид, выделенный из морских водорослей, под названием агароза. Его преимущества — высокая стабильность и возможность нетоксичного сшивания при исследованиях. Однако этот биоматериал не разлагается и обладает плохой клеточной адгезией (способностью клеток слипаться друг с другом и с другими субстратами).
Первичный структурный белок, который содержится в коже и других соединительных тканях — коллаген — имеет высокую биологическую значимость. Он является наиболее распространенным белком млекопитающих и основным компонентом соединительной ткани. К его недостаткам для биопечати относят свойство кислоторастворимости. Больше информации о биоматериалах можно найти здесь.
Он является наиболее распространенным белком млекопитающих и основным компонентом соединительной ткани. К его недостаткам для биопечати относят свойство кислоторастворимости. Больше информации о биоматериалах можно найти здесь.
На основе компьютерных проектов и моделей, часто сканирований и МРТ, сделанных непосредственно у пациента, головки принтера размещают ячейки именно там, где они необходимы, и в течение нескольких часов органический объект строится из большого количества очень тонких слоев.
Биопринтер Organovo создает ткани, которые имитируют структуру и состав различных органов человека
Источник: Pbs.org
«Строительные леса» для замены ушей или носа в лаборатории Университета Уэйк Форест в Уинстон-Сейлеме, Северная Каролина
Источник: CBS News
Компьютер отображает изображение «лесов» для человеческого уха, созданного в лаборатории Университета Уэйк Форест в Уинстон-Сейлеме, Северная Каролина
Источник: CBS News
Как правило, нужно больше, чем просто клетки, поэтому большинство биопринтеров также поставляют какой-то органический или синтетический «клей» — растворимый гель или коллагеновый каркас, к которому клетки могут прикрепляться и расти. Это помогает им формироваться и стабилизироваться в правильной форме. Удивительно, но некоторые клетки могут принять правильное положение сами по себе без каких-либо «строительных лесов». Как они узнают, куда идти? А как клетки эмбриона развиваются в матке или ткань взрослого человека движется для восстановления повреждений? Так же и здесь.
Это помогает им формироваться и стабилизироваться в правильной форме. Удивительно, но некоторые клетки могут принять правильное положение сами по себе без каких-либо «строительных лесов». Как они узнают, куда идти? А как клетки эмбриона развиваются в матке или ткань взрослого человека движется для восстановления повреждений? Так же и здесь.
Университеты, исследователи и частные компании по всему миру вовлечены в развитие технологий биопечати. Давайте посмотрим на некоторые из удивительных вещей, над которыми они работают.
Биопринтинг в России
3D Bioprinting Solutions — лаборатория биотехнологических исследований, основанная медицинской компанией INVITRO. Деятельность лаборатории — разработка и производство биопринтеров и материалов в области трехмерной биопечати и научные исследования. 23 августа 2019 года лаборатория «3Д Биопринтинг Солюшенс» отправила на МКС новую партию кювет для продолжения экспериментов по биопечати в космосе, начатых в 2018 году. Об этом сообщили в пресс-центре лаборатории. На этот раз на первом в мире космическом биопринтере Organ.Aut планируется использовать органические и неорганические компоненты для сборки костной ткани.
На этот раз на первом в мире космическом биопринтере Organ.Aut планируется использовать органические и неорганические компоненты для сборки костной ткани.
Симпозиум «Биофабрикация в космосе»
Источник: Zdrav.Expert
Магнитный биопринтер Organ.Aut
Источник: Zdrav.Expert
Также космонавты будут выращивать белковые кристаллы и экспериментировать с печатью биоплёнок бактерий для изучения их поведения в условиях невесомости. Российские учёные ожидают получить уникальные научные данные, которые могут быть применимы при разработке новых лекарственных препаратов.
Научный руководитель компании «3Д Биопринтинг Солюшенс» и ведущий научный сотрудник Института регенеративной медицины, кандидат медицинских наук Владимир Миронов в своем выступлении на кафедре анатомии Сеченовского Университета 2 сентября отметил: «Живые клетки, ткани и органы человека будут синтезированы уже в текущем столетии. Для этого морфологические науки, такие как микроскопическая анатомия и гистология, надо оцифровизировать или диджитализировать, то есть перевести в цифровой формат и сделать доступными для компьютерных программ роботических биопринтеров, так как без цифровых моделей нельзя напечатать человеческие ткани и органы».
Биопринтинг в мире
Ежегодно миллионы людей во всем мире нуждаются в пересадке кости. Современные костные трансплантаты часто используют синтетический материал на основе цемента в сочетании с собственной костью пациента. Однако применение этих материалов имеет ряд ограничений — некоторые трансплантаты вызывали отторжение и воспалительные процессы у пациентов. Воспроизведение естественного «интерфейса» кость-хрящ также было проблематичным.
Тем не менее, команда из Университета Суонси в 2014 году разработала технологию биопечати, которая позволяет создать искусственный костный протез в точной форме требуемой кости, используя биосовместимый материал, который является одновременно долговечным и регенеративным. Над аналогичными исследованиями в то же время работали и ученые из Ноттингемского университета в Англии.
Чтобы напечатать небольшую кость, требуется около двух часов. Поэтому хирурги могут сделать её прямо в операционной. Затем эта часть кости покрывается стволовыми клетками взрослого человека, способными развиваться практически в любой другой тип клеток. Это сочетается с био-чернилами из принтера — комбинацией полимолочной кислоты (которая обеспечивает механическую прочность кости) и альгината — гелеобразного вещества, которое служит амортизирующим материалом для клеток. Затем конечный продукт имплантируется в организм, где в течение примерно трех месяцев полностью исчезнет и будет заменен новой костью.
Затем эта часть кости покрывается стволовыми клетками взрослого человека, способными развиваться практически в любой другой тип клеток. Это сочетается с био-чернилами из принтера — комбинацией полимолочной кислоты (которая обеспечивает механическую прочность кости) и альгината — гелеобразного вещества, которое служит амортизирующим материалом для клеток. Затем конечный продукт имплантируется в организм, где в течение примерно трех месяцев полностью исчезнет и будет заменен новой костью.
Исследователи надеются, что в будущем биопечатаемые кости могут быть созданы с достаточной надежностью, чтобы поддержать сложную реконструкцию позвоночника, и что костный материал будет дополнительно улучшен для повышения его совместимости с клетками хряща.
Источник: ETH Zurich
Успешные опыты 3D-печати человеческого хряща в скором времени могут полностью заменить искусственные имплантаты людям, нуждающимся в реконструктивной хирургии. Еще в 2015 году ученые в Цюрихе разработали технологию, которая позволит больницам печатать полноразмерный имплантат человеческого носа менее чем за 20 минут. Они считают, что любой хрящевой имплантат может быть изготовлен по их методике.
Они считают, что любой хрящевой имплантат может быть изготовлен по их методике.
Исследователь Матти Кести описал технологию так:
“
«Серьезная автомобильная авария может привести к тому, что водитель или пассажир получат сложные травмы носа. Нос можно восстановить, создав 3D-модель на компьютере. В то же время выполняется биопсия пациента, и клетки хряща удаляются из тела пострадавшего, например, из колена, пальца, уха или осколков разбитого носа. Клетки нерестятся в лаборатории и смешиваются с биополимером. Из этой суспензии с помощью биопринтера создается модель хряща носа, которая имплантируется пациенту во время операции. В процессе биополимер используется просто как форма. Впоследствии он расщепляется собственными хрящевыми клетками организма. И через пару месяцев невозможно будет различить трансплантат и собственный носовой хрящ человека».
Матти Кести
Поскольку имплантат был выращен из собственных клеток организма, риск отторжения будет гораздо ниже, чем для имплантата, сделанного, скажем, из силикона. Дополнительное преимущество заключается в том, что биоимплантат растет вместе с пациентом, что особенно важно для детей и молодых людей.
Дополнительное преимущество заключается в том, что биоимплантат растет вместе с пациентом, что особенно важно для детей и молодых людей.
Если человек сильно обожжен, здоровую кожу можно взять из другой части тела и использовать для покрытия пораженного участка. Иногда неповрежденной кожи не хватает.
Исследователи, работающие в Медицинской школе Уэйк Форест, успешно разработали, построили и протестировали принтер, который может печатать клетки кожи непосредственно на ожоговой ране. Сканер очень точно определяет размер и глубину повреждений. Эта информация передается на принтер, и печатается кожа для покрытия раны. В отличие от традиционных кожных трансплантатов, требуется только участок кожи, размер которого составляет одну десятую от размера ожога, чтобы вырастить достаточное количество клеток для печати. Пока эта технология находится на экспериментальной стадии, и исследователи надеются, что она будет широко доступна в течение следующих пяти лет.
Как уже упоминалось, 3D-принтеры печатают изделия послойно, и поскольку кожа представляет собой многослойный орган с различными типами клеток, она хорошо подходит для данного типа технологий. Тем не менее, исследователям предстоит решить еще много задач, в частности, как предотвратить повреждение клеток от тепла, выделяемого принтером. И конечно же, как и большинство частей человеческого тела, кожа более сложная, чем кажется на первый взгляд — есть нервные окончания, кровеносные сосуды и множество других аспектов, которые необходимо учитывать.
Кровеносные сосуды
Инженер-биомеханик Моника Мойя держит чашку Петри с печатными биотрубками на основе альгината. Биотрубки могут действовать как временные кровеносные сосуды, аналогичные кровеносным сосудам, которые помогают создать участок живой ткани.
Источник:embodi3D
Учитывая, что в теле человека десятки тысяч километров вен, артерий и капилляров, исследователи работают над тем, чтобы заменить их, если они когда-нибудь износятся. Создание жизнеспособных кровеносных сосудов также важно для правильной работы всех других потенциальных биопечатных частей тела.
Создание жизнеспособных кровеносных сосудов также важно для правильной работы всех других потенциальных биопечатных частей тела.
Инженер-биомеханик Моника Мойя из Ливерморской национальной лаборатории им. Лоуренса использует биопечать для создания кровеносных сосудов. Материалы, созданные ее биопринтерами, спроектированы таким образом, чтобы позволить маленьким кровеносным сосудам развиваться самостоятельно.
Эта разработка требует времени, поэтому распечатываются пробирки с клетками и другими биоматериалами, чтобы помочь доставить жизненно важные питательные вещества в окружающую печатную среду. Через некоторое время самосборные капилляры соединяются с биопечатными трубками и начинают самостоятельно доставлять питательные вещества в клетки, имитируя работу этих структур в организме человека.
Внутренние органы
Многие исследователи надеются, что через 20 лет списки пациентов, ожидающих пересадки органов, уйдут в прошлое. Они представляют мир, в котором любой орган может быть напечатан и пересажен всего за несколько часов, без отторжения и осложнений, потому что эти органы будут созданы из клеток тела в соответствии с индивидуальными особенностями каждого пациента. В настоящее время биопечать полностью функциональных сложных внутренних органов невозможна, но исследования постоянно ведутся (и не без успеха).
В настоящее время биопечать полностью функциональных сложных внутренних органов невозможна, но исследования постоянно ведутся (и не без успеха).
Мочевой пузырь
Например, мочевой пузырь уже печатают. В 2013 году в Университете Уэйк Форест в США исследователи успешно взяли клетки из исходного, плохо функционирующего мочевого пузыря пациента, культивировали их и добавили дополнительные питательные вещества. Затем была напечатана трехмерная форма мочевого пузыря пациента и пропитанные через нее культивируемые клетки. Форма была помещена в инкубатор и, когда она достигла нужной кондиции, её пересадили в тело пациента. Форма со временем разрушится, оставив только органический материал. Та же команда успешно создала жизнеспособные уретры.
Врачи и ученые Института регенеративной медицины Уэйк Форест (WFIRM) были первыми в мире, кто создал органы и ткани, выращенные в лабораторных условиях, которые были успешно пересажены в человека. Прямо сейчас они работают над выращиванием тканей и органов для более чем 30 различных областей тела, от почек и трахеи до хрящей и легких. Также они стремятся ускорить доступность этих методов лечения для пациентов.
Также они стремятся ускорить доступность этих методов лечения для пациентов.
Ученые в Австралии тоже занимаются подобными исследованиями. Они использовали человеческие стволовые клетки для выращивания почечного органа, который содержит все необходимые типы клеток для почек. Такие клетки могут служить ценным исходным источником для биопечати более сложной структуры почек.
Доктор медицины, профессор урологии, профессор Института регенеративной медицины Энтони Атала показывает почку, созданную биопринтером. Модифицированный настольный струйный принтер распыляет клетки вместо чернил. Клетки культивировали у пациента, а структурный шаблон для почки получили из МРТ (поэтому он имеет правильный размер и форму).
Используя эту технологию, еще в 2001 году Атала напечатал и успешно пересадил мочевой пузырь для молодого человека Джейка.
Источник: TedEd
Сердце
Клетки сердца, органоиды, выращенные в лаборатории. Источник
Удивительно, но именно сердце человека может стать одним из самых легких органов для печати, поскольку оно, по сути, представляет собой насос с трубками. Конечно, всё не так просто, но многие исследователи считают, что человечество научится печатать сердца раньше, чем почки или печень.
Конечно, всё не так просто, но многие исследователи считают, что человечество научится печатать сердца раньше, чем почки или печень.
Исследователи Института регенеративной медицины Уэйк Форест в апреле 2015 года создали «органоиды» — напечатанные на 3D-принтере полностью функциональные, бьющиеся сердечные клетки.
В апреле 2019 года израильские ученые напечатали первое в мире трехмерное сердце. Оно еще очень маленькое, размером с вишню, но способно выполнять свои функции. Трехмерное сердце с кровеносными сосудами использует персонализированные «чернила» из коллагена, белка, который поддерживает клеточные структуры, и других биологических молекул.
Исследователь из Тель-Авивского университета держит первое в мире трехмерное печатное сердце, 15 апреля 2019 года.
Источник: Haaretz
«Это первый случай, когда кто-либо где-либо успешно спроектировал и напечатал целое сердце с клетками, кровеносными сосудами, желудочками и камерами», — рассказал ученый Тель-Авивского университета профессор Тал Двир.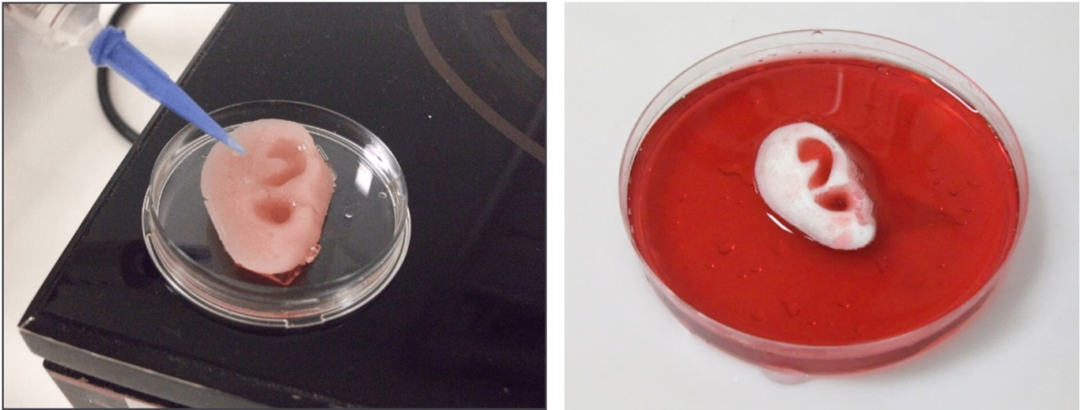
До сих пор ученым удавалось печатать ткани хряща и, например, аортального клапана, но задача заключалась в том, чтобы создать ткани с васкуляризацией — кровеносными сосудами, включая капилляры, без которых органы не могут выжить, не говоря уже о функционировании.
Тель-авивские ученые начали с жировой людской ткани и разделили клеточные и неклеточные компоненты. Затем они перепрограммировали клетки, чтобы те превратились в недифференцированные стволовые клетки, которые затем могли бы стать сердечными или эндотелиальными. Эндотелий — однослойный пласт плоских клеток, выстилающий внутреннюю поверхность сердечных полостей, кровеносных и лимфатических сосудов. Клетки эндотелия исполняют множество функций сосудистой системы, например, контролируют артериальное давление, регулируют компоненты свертывания крови и формирование новых кровеносных сосудов.
Неклеточные материалы, включая большое количество белков, были переработаны в «персонализированный гидрогель», который служил «чернилами для печати».
Пройдут годы, прежде чем эта технология сможет создавать органы для эффективной трансплантации. Тем не менее, достижения ученых в Тель-Авиве являются огромной вехой на этом пути.
Медицинские исследования и фармакология
Одна из ключевых потенциальных областей использования биопечатных живых материалов — это область медицинских испытаний и исследований лекарственных препаратов. Биопечатные ткани обладают несколькими типами клеток с разной плотностью и ключевыми архитектурными особенностями. Благодаря этому исследователи могут изучать воздействие различных заболеваний на организм, этапы прогрессирования заболевания и возможные способы лечения в естественной микросреде.
Одним из самых впечатляющих достижений последних лет является разработка «настольного мозга» в Центре передовых технологий ARC в 2016 году. Исследователи смогли с помощью 3D-принтера создать трехмерную печатную шестислойную структуру, включающую нервные клетки, которые имитируют структуру мозговой ткани.
Это открывает огромные потенциальные выгоды для исследователей, фармацевтических и частных компаний, потому что позволит им тестировать новые продукты и лекарства на ткани, которая точно отражает реакции ткани человеческого мозга, в отличие от образцов животных, которые могут вызывать совершенно другую реакцию. «Настольный мозг» также может быть использован для дальнейшего исследования таких заболеваний, как шизофрения или болезнь Альцгеймера.
Мы еще далеки от печати мозга, но способность располагать клетки так, чтобы они образовывали нейронные сети, является значительным шагом вперед. Позволяя исследователям работать с человеческими тканями в режиме реального времени, можно значительно ускорить процессы тестирования и давать более реалистичные и точные результаты. Это также снизит необходимость использования лабораторных животных для медицинских анализов и потенциально опасных испытаний на людях.
Медицинские тренажеры и реестры данных
Источник: Simbionix
В настоящее время в мире используется около 3000 медицинских тренажеров, помогающих врачам практиковаться в выполнении сложных процедур. Виртуальные кровеносные сосуды, 3D-печатные органы… и ни одно животное не страдает!
Виртуальные кровеносные сосуды, 3D-печатные органы… и ни одно животное не страдает!
Американская компания 3D Systems создала отраслевой сегмент под названием VSP (Virtual Surgical Planning). Этот подход к персонализированной хирургии сочетает в себе знания в области медицинской визуализации, хирургического моделирования и 3D-печати. Хирурги, впервые использующие медицинский симулятор Simbionix, часто сообщают о чувстве физической боли, сопереживая своему виртуальному пациенту — опыт настолько реалистичен. Органы и ткани выглядят совершенно реальными. При сшивании органа хирург видит на экране иглу, попадающую в ткань, и натягивает нить. Если врач делает что-то не так, виртуальные кровеносные сосуды ломаются, и орган начинает кровоточить. Эти симуляторы были разработаны израильской компанией «Симбионикс», которую в 2014 году выкупила 3D Systems.
3 сентября 2019 года Общество радиологии Северной Америки (RSNA) и Американский колледж радиологии (ACR) объявили о запуске нового реестра клинических данных медицинской 3D-печати, чтобы собирать сведения о результатах лечения с использованием 3D-печати по месту оказания медицинской помощи. Эта информация станет мощным инструментом для оценки и улучшения качества обслуживания пациентов в режиме реального времени, будет стимулировать текущие исследования и разработки, информировать пациентов и медицинских работников о наилучшем курсе лечения.
Эта информация станет мощным инструментом для оценки и улучшения качества обслуживания пациентов в режиме реального времени, будет стимулировать текущие исследования и разработки, информировать пациентов и медицинских работников о наилучшем курсе лечения.
“
«Создание объединенного реестра 3D-печати RSNA-ACR имеет важное значение для развития клинической 3D-печати. Реестр позволит собирать данные в поддержку надлежащего использования этой технологии и ее значения для принятия клинических решений».
Уильям Уидок, профессор радиологии в Университете Мичигана и председатель RSNA 3D Printing Special Interest Group (SIG)
По данным RSNA, сведения в реестре позволят провести необходимый анализ, чтобы продемонстрировать клиническую ценность 3D-печати. Из-за большого разнообразия клинических показаний, различных технологий для создания физических моделей из медицинских изображений и сложности моделей проблематично выбрать оптимальный метод лечения. Реестр поможет решить эту проблему.
Программное обеспечение для биопечати
Производитель биопринтеров и программного обеспечения для биопечати Allevi 5 сентября 2019 года представил программное обеспечение Allevi Bioprint Pro. Встроенная генерация моделей и интегрированная нарезка позволит больше сосредоточиться на проведении экспериментов, а не на настройке принтера. Программа работает полностью в облаке, а это означает, что можно создавать свои биоструктуры, определять материалы и отслеживать отпечатки прямо из веб-браузера на любом компьютере.
По словам команды разработчиков, новый биопринтер с вышеуказанным ПО мощный и простой в использовании и представляет собой еще один кусочек головоломки на пути к печати органов с помощью 3D-принтера.
В то же время первая компания в сегменте bio-ink CELLINK объявила о выпуске нового продукта, призванного стать самой гибкой платформой для биопечати на рынке. В не имеющем на данный момент аналогов биопринтере BIO X6 реализована возможность объединения большего количества материалов для биопечати, ячеек и инструментов.
Почему всё это так долго?
Сложная структура тела
Тело человека и его различные компоненты намного сложнее пластиковой игрушки. Человеческий орган имеет сложную сеть клеток, тканей, нервов и структур, которые должны быть расположены определенным образом для правильного функционирования. От размещения тысяч крошечных капилляров в печени до фактического получения напечатанного сердца, которое «бьётся» и сжимается в людском теле — еще много исследований и испытаний.
Правовое регулирование
Кроме того, биопечатные технологии, как и все новые медицинские методы лечения, должны пройти тесты безопасности и надлежащие процессы правового регулирования, прежде чем станут доступны.
Специальное программное и аппаратное обеспечение
Также необходимо время для разработки специального программного и аппаратного обеспечения. Написать эти программы можно лишь имея соответствующие данные (медицинские, клинические, статистические, математические и так далее), которые кто-то должен предварительно собрать, проанализировать, систематизировать и перевести в цифровую форму.
Работа над всеми этими этапами требует интеграции технологий из различных областей, включая инженерию, науку о биоматериалах, клеточную биологию, физику, математику и медицину. Так что нам нужно быть немного более терпеливыми.
Главное — знать, что те, кто работает на местах, врачи и инженеры, программисты и ученые каждый день делают успехи как в самой технологии биопечати, так и в понимании того, как ее можно использовать и совершенствовать. Хотя мы еще не совсем там, нет сомнений, что лет через 10-20 медицина будет совсем другой в том числе благодаря биопечати.
Коротко о главном
Биопечать – это расширение традиционной 3D-печати.
Биопринтинг может производить живые ткани, кости, кровеносные сосуды и, возможно, целые органы для использования в медицинских процедурах, тренировках медперсонала и тестировании.
Клеточная сложность живого организма привела к тому, что 3D-биопечать развивается медленнее, чем обычная 3D-печать.
Технология биопечати может дать возможность генерировать ткани, специфичные для пациента, для разработки точных, целенаправленных и полностью персонализированных процедур.
Нам еще предстоит пройти долгий путь, прежде чем мы сможем создать полностью функционирующие и жизнеспособные органы для трансплантации человеку.
Материалы по теме:Россия первой в мире напечатала живые ткани в космосе с помощью биопринтера
5 самых удивительных вещей, созданных с помощью 3D-печати
В 2021 году на орбиту отправится ракета, напечатанная на 3D-принтере
«Экспонаты трогать разрешается»: как 3D-печать трансформирует музеи
© Rusbase, 2019
Автор: Надежда Алейник
Фото на обложке: etonastenka, Depositphotos
Когда мы сможем печатать новые органы на 3D-принтере
Фото: Александр Рюмин / ТАСС
Миллионы людей в мире ждут своей очереди на пересадку органов. В одном только Китае в листе ожидания 1,5 млн человек, в США — 113 тыс., из них, в среднем, 20 человек в день умирают, так и не дождавшись донора. Новую почку — самый востребованный орган — приходится ждать от трех до пяти лет. Эту проблему можно решить: напечатав нужные органы на специальных 3D-принтерах.
В одном только Китае в листе ожидания 1,5 млн человек, в США — 113 тыс., из них, в среднем, 20 человек в день умирают, так и не дождавшись донора. Новую почку — самый востребованный орган — приходится ждать от трех до пяти лет. Эту проблему можно решить: напечатав нужные органы на специальных 3D-принтерах.
Правда, не раньше, чем в ближайшие десять лет.
Технология биопринтинга: как и зачем сегодня печатают органы?
(Видео: РБК)
Принцип примерно тот же, что и в обычной 3D-печати: на специальном принтере мы получаем трехмерный объект.
Первый этап — предпринтинг: сначала создают цифровую модель будущего органа или ткани. Для этого используют снимки, полученные на МРТ или КТ.
Затем печатают, слой за слоем — эта технология называется аддитивной. Только вместо обычного 3D-принтера здесь специальный биопринтер, а вместо чернил — биоматериалы. Это могут быть стволовые клетки человека, которые в организме выполняют роль любых клеток; свиной коллагеновый белок или клеточный материал на основе морских водорослей.
Если клетки живые, их берут с помощью биопсии и подготавливают в биореакторе: пока они не размножатся делением до нужного количества. Во время печати биопринтер полимеризует клеточную структуру — то есть связывает ее с помощью ультрафиолетового света, нагревания или охлаждения. Клеточные слои связываются при помощи гидрогеля — органического или искусственного.
Затем полученную структуру помещают в биосреду, где она «дозревает» перед пересадкой. Это — самый долгий этап: он может длиться несколько недель. За это время структура стабилизируется, а клетки готовы выполнять свои функции.
Потом орган пересаживают и следят за тем, как он приживается.
Биопринтинг: как печатают живые органы на 3D-принтере
(Видео: РБК)
Помимо обычных аддитивных есть и другие биопринтеры. Одни из них печатают коллагеном непосредственно на открытую рану: так можно быстро нарастить новую кожу даже в полевых условиях. В этом случае этап дозревания (постпринтинга) пропускают.
Есть также принтеры, которые печатают в открытом космосе, в условиях невесомости. В будущем их можно будет применять на МКС:
В мире более 100 компаний, которые выпускают биопринтеры для печати 3D. 39% из них — в США, 35% — в Европе (из них больше половины — во Франции и Германии), 17% — в Азии, 5% — в Латинской Америке.
В России биопринтеры выпускает 3D Bioprinting Solutions, она же занимается исследованиями в области биопринтинга.
Самый дешевый и компактный биопринтер — Tissue Scribe американской 3D Cultures, стоит от $1,5 тыс.
На втором месте — австралийский Rastrum от Inventia за $5 тыс.
Биопринтер Aether из США можно купить от $9 тыс.
Средний сегмент — от $10 тыс. и больше — представлен Bio X от CELLINK (Швеция), Regemat 3D испанской RX1 и канадским Aspect Biosystems.
От $100 тыс. стоят 3D Bioplotter немецкой EnvisionTEC, еще дороже — российский FABION (3D Bioprinting Solutions).
Наконец, самые дорогие биопринтеры — больше $200 тыс. — это NovoGen MMX от Organovo (США) и NGB-R от Poietis (Франция).
Помимо стоимости принтера, сам процесс печати — это еще плюс 15—20% от цены всего проекта. Еще дороже обойдется получение необходимого клеточного материала.
Пока что самым успешным опытом оказалась пересадка хрящевых тканей — тех самых ушей китайским детям.
Небольшие кости из искусственных клеток печатают на принтере, а затем покрывают слоем. Их планируют пересаживать вместо сломанного или поврежденного участка, после чего они за три месяца полностью регенерируют. В будущем технологию хотят использовать для травм позвоночника.
Самое перспективное направление — 3D-печать кожи. Уже через пять лет обещают, что это можно будет сделать прямо на человеке, поверх или вместо поврежденного участка. Кожу и другие ткани печатают из клеток больных раком, чтобы протестировать различные варианты терапии.
Более сложные органы — такие как почки или сердце — пока что печатают только в виде прототипов или пересаживают мышам, но не людям.
Чтобы органы хорошо приживались и функционировали в организме человека, берут клетки пациента, а потом они делятся, пока их не будет достаточно для печати. Существуют целые институты, которые создают клеточные линии для биопринтинга. Но проблема в том, что у клеток есть предел деления, после которого они уже не пригодны для использования. Поэтому можно напечатать модель сердца, но не в натуральную величину — то есть оно не подходит для пересадки человеку.
Вторая проблема — в том, что напечатанный орган должен функционировать в связке с остальным организмом: переваривать пищу, выделять гормоны, доставлять кровь и кислород. За все это отвечает сложная система клеток, тканей, нервов и сосудов. Воспроизвести ее в точности пока что не получается.
Наконец, технологии биопринтинга пока что никак не регулируются. Все исследования должны пройти все стадии тестов — в том числе на человеке, а потом — получения патентов.
Пока что эксперты прогнозируют внедрение технологий не раньше, чем через 10—15 лет. К тому времени биопринтеры и клеточные материалы станут широко доступными, и пользоваться биопечатью смогут даже в самых отдаленных регионах.
К тому времени биопринтеры и клеточные материалы станут широко доступными, и пользоваться биопечатью смогут даже в самых отдаленных регионах.
Что еще почитать:
- История и технология биопечати (ENG)
- Обзор текущего состояния биопринтинга и главных проблем
- Как биопринтинг изменит нашу жизнь (ENG)
- Видео: как выглядит процесс биопечати (ENG)
- Видео: графика, объясняющая процесс печати из живых клеток (ENG)
- Видео: 3D-печать уха (ENG)
Подписывайтесь и читайте нас в Яндекс.Дзене — технологии, инновации, эко-номика, образование и шеринг в одном канале.
все о печати органов на 3D-принтере
Печать органов на 3D принтере или биопринтинг — перспективная технология выращивания здоровых и живых органов взамен поврежденных или отсутствующих. Кроме 3D-принтера, для биопринтинга нужна модель органа, клеточный материал пациента и среда, где орган сохранится до имплантации.
Напечатанные органы лучше протезов и трансплантированных частей тела. Их возможности идентичны родным и они не отторгаются иммунной системой, если созданы из ДНК пациента. Биопринтинг сократит время на получение нужного органа и сохранит жизнь больным, которым нужна незамедлительная пересадка.
Печать органов на 3Д принтере уже успешно опробована на животных. Ученые Северо-Западного Университета внедрили стерилизованным мышам искусственные яичники и они родили здоровых мышат. В китайской компании Sichuan Revotek макакам-резусам имплантировали кровеносные сосуды, выращенные из материала этих же макак.
Из человеческих частей тела, пока печатаются только внутренние ткани и кожа. Создаются уменьшенные, но работающие копии ушей и носов. Первая печать органов человека ожидается к 2030-му году.
Как работает биопринтинг
Исследовательские группы или компании развивают разные концепции биопечати:
- Каркасная. Наращивание живых клеток на неорганическую основу, исчезающую с развитием естестественных связей между клетками.
 Главная сложность — подобрать материал, который настолько же эластичный или жёсткий, как заменяемый орган. Он должен быстро деградировать, чтобы не мешать укреплению межклеточного матрикса и раствориться, не оставив токсичных соединений. Для каркасной печати подходит гидрогель, титан, желатин, синтетические и биополимеры.
Главная сложность — подобрать материал, который настолько же эластичный или жёсткий, как заменяемый орган. Он должен быстро деградировать, чтобы не мешать укреплению межклеточного матрикса и раствориться, не оставив токсичных соединений. Для каркасной печати подходит гидрогель, титан, желатин, синтетические и биополимеры.
- Бескаркасная. Нанесение готовыми клетками на гидрогелевую основу. Пока клетки в принтере, они охлаждены и находятся в тонких гидрогелевых сфероидах. При печати температура повышается до 36,6°, сфероиды рассеиваются и клетки постепенно сами формируют природный каркас — клеточный матрикс. Эта печать менее распространена, чем каркасная — появилась позже и сложнее воспроизводима.
- Мимикрия. Технология будущего, предполагает создание полных копий органов сразу. Для неё разрабатывается биопечать на молекулярном уровне и проводятся глубокие исследования природы клеток.
Способы 3D печати органов
Струйные. Первые устройства для биопечати были струйными, этим методом печатают и обычные принтеры. Они хранят биологический материал в картриджах, который распыляется на гидрогелевую подложку, как краска на бумагу. Недостатки — неточный выброс капель и закупорка распыляющего сопла с возможной гибелью клеточного материала. Струйная печать органов на принтере не подходит для вязких материалов, поскольку они не распыляются. Область применения ограничивается восстановлением костной, хрящевой ткани, мышц и кожи. Достоинства — дешевизна и массовая воспроизводимость.
Первые устройства для биопечати были струйными, этим методом печатают и обычные принтеры. Они хранят биологический материал в картриджах, который распыляется на гидрогелевую подложку, как краска на бумагу. Недостатки — неточный выброс капель и закупорка распыляющего сопла с возможной гибелью клеточного материала. Струйная печать органов на принтере не подходит для вязких материалов, поскольку они не распыляются. Область применения ограничивается восстановлением костной, хрящевой ткани, мышц и кожи. Достоинства — дешевизна и массовая воспроизводимость.
Микроэкструзионные. Этот способ применяется в неорганической 3D-печати. Для печати используется пневматическая подача материала в подвижную головку-экструдер, которая укладывает клетки. Чем больше головок, тем точнее и быстрее работает принтер. Недостатки — чем плотнее укладываются клетки, тем меньше их выживает. При сопоставимой плотности укладки, от микроэкструзионной печати погибает больше клеток, чем при струйной печати. Достоинства — подходит для 3D печати органов высокой плотности, тонкая настройка подачи материала за счет регулирования давления.
Достоинства — подходит для 3D печати органов высокой плотности, тонкая настройка подачи материала за счет регулирования давления.
Лазерные. Распространены в промышленности, но применяются в биопечати. Используют лазер для нагревания стекла с жидким клеточным субстратом. В точке концентрации луча создается избыточное давление, которое выталкивает клетки на нужный участок подложки. Между лучом и стеклом с биоматериалом размещается отражающий элемент, которая снижает мощность луча. Недостатки — повышенное содержание металла в клетках от испарения отражающего элемента. Цена. Достоинства — контролируемая вплоть до отдельных клеток, укладка биоматериала.
Кто предлагает 3D печать органов
Биопринтинговые компании, которые предлагают 3D-печать органов или продают биопринтеры:
- Organovo — Сан Диего, США. Печатает и продаёт ткань печени «exVive3D» фармацевтическим компаниям. В 2009, Organovo совместно с австрийской Invetech выпустили первый серийный принтер для биопечати — Novogen.

- BioBots — стартап, презентовавший дешевый коммерческий биопринтер на TechCrunch 2013. Сегодня для покупки доступна модель Biobot 1, Biobot 2 пока в разработке, но уже представлен на сайте компании.
- 3D Bioprinting Solutions — Россия, Москва. Сосредоточена на бескаркасной печати, разработала свой 3D-принтер FABION и работает над собственной технологией органопринтинга
- Cyfuse Biomedical — Токио, Япония. Разработали биопринтер Regenovo, который применялся для печати кожи и успешно выращивал 2-мм сосуды.
Сколько стоит 3D-биопринтер
Средняя цена биопринтера — четверть миллиона долларов, но доступны и бюджетные модели ценой до $10 000. Большинство принтеров, доступных для покупки — экструзионного типа и работают с каркасной печатью.
- 3D Bioplotter — $200,000. Envision TEC, Германия.
- Novogen MMX — $250,00. Organovo, США.
- Biobot 1 — $10 000. Biobots, США.

- 3DDiscovery — $200,000. RegenHU & Biofactory, Швейцария.
- BioAssemblyBot — $160 000. Advanced Solutions, Нидерланды.
Поддержка больного аппаратами жизнеобеспечения стоит около $75 тыс. в год. За 10 лет, больной потратит $1 млн. Принтер стоит $200, 000 и примерно столько же — операция. Учитывая, сколько стоит печать органов, операция с применением 3D биопринтинга удешевляется на 50%.
Перспективы биопечати
3D биопечать прошла путь от концепции до работающей и коммерчески успешной технологии. Пока основные клиенты биопринтинговых компаний — крупные фармацевтические корпорации. Они ускоряют тестирование лекарств, сразу испытывая их на распечатанных тканях человека.
Дорогие биопринтеры не появятся в городских клиниках через 5 лет, но некоторые пациенты уже выздоравливают благодаря 3D печати. Челюсть 83-летней женщины из Бельгии поразил остеомиелит. Восстановление стоило дороже и продлилось бы дольше, чем удаление больной челюсти и имплантация распечатанной новой. Команда врачей под руководством профессора Жюля Пукана выполнила операцию и женщина могла говорить сразу после операции. Развитие биопечати приведёт к медицинской практике, где проще удалить поврежденную конечность и вырастить новую, чем лечить травмы, которые сейчас лечат без ампутации.
Команда врачей под руководством профессора Жюля Пукана выполнила операцию и женщина могла говорить сразу после операции. Развитие биопечати приведёт к медицинской практике, где проще удалить поврежденную конечность и вырастить новую, чем лечить травмы, которые сейчас лечат без ампутации.
Медицина далекого будущего минимизирует механическое вмешательство в организм. Скальпель останется в прошлом — рой нанороботов будет печатать органы сразу внутри организма. На 2018, намечена полноценная печать человеческого органа на принтере — почки. Затем распечатают бронхи, артерии и сердце. Но даже до клинических испытаний на людях около 10 лет, а массовая 3D печать органов человека и частей тела наступит ещё позже.
Кроме врачей, биопринтинг привлекателен для косметологов и пластических хирургов. Желание оставаться молодым и красивым, а не лечение редких и сложных болезней, сделает 3Д печать органов человека массовой. Возможно, люди будущего будут менять органы и внешность так же просто, как смартфоны.
3D-печатных органов: будущее трансплантации
Си-Эн-Эн
—
Что, если бы врачи могли просто напечатать почку, используя клетки пациента, вместо того, чтобы искать совместимого донора и надеяться, что тело пациента не отторгнет пересаженную почку?
По словам Дженнифер Льюис, профессора Института биологической инженерии Висса при Гарвардском университете, это может произойти не раньше, чем через десять лет благодаря 3D-биопечати органов. Биопечать органов — это использование технологий 3D-печати для послойной сборки нескольких типов клеток, факторов роста и биоматериалов для производства биоискусственных органов, которые идеально имитируют свои естественные аналоги, согласно исследованию 2019 года. исследование.
исследование.
Этот тип регенеративной медицины находится в стадии разработки, и движущей силой этого нововведения является «настоящая человеческая потребность», — сказал Льюис.
По данным Управления ресурсов и услуг здравоохранения, по состоянию на 10 июня в США 106 075 мужчин, женщин и детей находятся в национальном списке ожидания на трансплантацию органов. Однако живые доноры предоставляют в среднем только около 6000 органов в год, и ежегодно насчитывается около 8000 умерших доноров, каждый из которых предоставляет в среднем 3,5 органа.
47-летний Стив Верз станет первым мужчиной в мире, которому напечатают глаз, напечатанный на 3D-принтере, сообщает офтальмологическая больница Мурфилдс. Ранее в этом месяце он попробовал на глаз размер, как показано здесь.
Ранее в этом месяце он попробовал на глаз размер, как показано здесь.
Центр биомедицинских исследований Мурфилдс
Британцу впервые в мире напечатали глаз на 3D-принтере
Причиной этого несоответствия является «сочетание людей, которые переживают катастрофические события со здоровьем, но их органы недостаточно высокого качества для донорства, или они изначально не внесены в список доноров органов, и тот факт, что это на самом деле очень трудно найти подходящую пару», чтобы тело пациента не отторгало пересаженный орган, сказал Льюис.
И хотя живые доноры являются вариантом, «делать операцию тому, кто в ней не нуждается», — это большой риск, — сказал доктор Энтони Атала, директор Института регенеративной медицины Уэйк Форест. «Таким образом, живые родственные доноры обычно не являются предпочтительным путем, потому что тогда вы забираете орган у кого-то еще, кому он может понадобиться, особенно сейчас, когда мы стареем дольше».
«Таким образом, живые родственные доноры обычно не являются предпочтительным путем, потому что тогда вы забираете орган у кого-то еще, кому он может понадобиться, особенно сейчас, когда мы стареем дольше».
Атала и его коллеги были ответственны за выращивание человеческих мочевых пузырей в лаборатории вручную в 2006 году и впервые имплантировали людям сложный внутренний орган, спасая жизни троих детей, которым они имплантировали мочевые пузыри.
Каркас мочевого пузыря засеян клетками в Институте регенеративной медицины Уэйк Форест.
Предоставлено Институтом регенеративной медицины Уэйк Форест
По данным Управления ресурсов и услуг здравоохранения, каждый день 17 человек умирают в ожидании трансплантации органов. И каждые девять минут в список ожидания добавляется еще один человек, сообщает агентство. Более 90% людей из списка на трансплантацию в 2021 году нуждались в почках.
И каждые девять минут в список ожидания добавляется еще один человек, сообщает агентство. Более 90% людей из списка на трансплантацию в 2021 году нуждались в почках.
«Около миллиона человек во всем мире нуждаются в почке. Таким образом, у них терминальная стадия почечной недостаточности, и они должны пройти диализ», — сказал Льюис. «После того, как вы переходите на диализ, вам остается жить пять лет, и каждый год уровень вашей смертности увеличивается на 15%. Диализ очень тяжел для вашего тела. Так что это действительно мотивирует взяться за эту грандиозную задачу печати органов».
«Антигипертензивные таблетки не являются дефицитом. Все, кто в них нуждается, могут их получить», — заявила Мартин Ротблатт, генеральный директор и председатель United Therapeutics, на конференции Life Itself, мероприятии, посвященном здоровью и благополучию, организованному в партнерстве с CNN. United Therapeutics является одним из спонсоров конференции.
Все, кто в них нуждается, могут их получить», — заявила Мартин Ротблатт, генеральный директор и председатель United Therapeutics, на конференции Life Itself, мероприятии, посвященном здоровью и благополучию, организованному в партнерстве с CNN. United Therapeutics является одним из спонсоров конференции.
«Нет никакой практической причины, по которой любой, кому нужна почка — или легкое, сердце, печень — не сможет их получить», — добавила она. «Мы используем технологии для решения этой проблемы».
Чтобы начать процесс биопечати органа, врачи обычно начинают с собственных клеток пациента. Они берут биопсию органа с помощью небольшой иглы или проводят малоинвазивную хирургическую процедуру, при которой удаляется небольшой кусочек ткани, «меньше половины размера почтовой марки», — сказал Атала. «Взяв этот небольшой кусочек ткани, мы можем разделить клетки (и) вырастить и расширить клетки вне тела».
«Взяв этот небольшой кусочек ткани, мы можем разделить клетки (и) вырастить и расширить клетки вне тела».
Этот рост происходит в стерильном инкубаторе или биореакторе, сосуде из нержавеющей стали под давлением, который помогает клеткам питаться питательными веществами, называемыми «средами». Врачи подкармливают их каждые 24 часа, поскольку клетки имеют собственный метаболизм, сказал Льюис. По словам Атала, каждый тип клеток имеет свою среду, и инкубатор или биореактор действует как устройство, похожее на печь, имитирующее внутреннюю температуру и насыщение кислородом человеческого тела.
«Затем мы смешиваем его с этим гелем, который похож на клей», — сказал Атала. «Каждый орган в вашем теле имеет клетки и клей, который скрепляет его. По сути, это также называется «внеклеточный матрикс».
«Каждый орган в вашем теле имеет клетки и клей, который скрепляет его. По сути, это также называется «внеклеточный матрикс».
Ричард Рот с Самирой Джафари
Предоставлено Самирой Джафари
Донорство живых органов спасает жизни. Так вы станете донором
По словам Льюиса, этот клей — прозвище Атала для биочернил, пригодной для печати смеси живых клеток, богатых водой молекул, называемых гидрогелями, а также среды и факторов роста, которые помогают клеткам продолжать размножаться и дифференцироваться. Гидрогели имитируют внеклеточный матрикс человеческого тела, который содержит такие вещества, как белки, коллаген и гиалуроновая кислота.
Неклеточный образец клея может быть изготовлен в лаборатории и «будет иметь те же свойства ткани, которую вы пытаетесь заменить», — сказал Атала.
По словам Льюиса, используемые биоматериалы обычно должны быть нетоксичными, биоразлагаемыми и биосовместимыми, чтобы избежать отрицательного иммунного ответа. Коллаген и желатин являются двумя наиболее распространенными биоматериалами, используемыми для биопечати тканей или органов.
Оттуда врачи загружают каждый биочернил — в зависимости от того, сколько типов клеток они хотят напечатать — в печатную камеру, «используя печатающую головку и сопло для выдавливания чернил и наращивания материала слой за слоем», — сказал Льюис. По словам Атала, создание тканей с персонализированными свойствами возможно благодаря программированию принтеров с данными изображений пациента, полученными с помощью рентгеновских лучей или сканов.
«С цветным принтером у вас есть несколько разных картриджей, и каждый картридж печатает свой цвет, и вы выбираете свой (окончательный) цвет», — добавил Атала. Биопечать такая же; вы просто используете клетки вместо традиционных чернил.
По словам Льюиса, продолжительность процесса печати зависит от нескольких факторов, в том числе от печатаемого органа или ткани, точности разрешения и количества необходимых печатающих головок. Но обычно это длится от нескольких до нескольких часов. По словам Атала, время от биопсии до имплантации составляет от четырех до шести недель.
3D-принтер засевает различные типы клеток на каркас почки в Институте регенеративной медицины Уэйк Форест.
Предоставлено Институтом регенеративной медицины Уэйк Форест
Конечная задача состоит в том, чтобы «заставить органы работать так, как они должны», поэтому достижение этого «является Святым Граалем», сказал Льюис.
«Точно так же, как если бы вы собирали орган у донора, вы должны немедленно поместить этот орган в биореактор и начать перфузию, иначе клетки умрут», — добавила она. Перфузировать орган означает снабжать его жидкостью, обычно кровью или кровезаменителем, путем ее циркуляции по кровеносным сосудам или другим каналам.
По словам Льюиса, в зависимости от сложности органа иногда возникает необходимость дальнейшего созревания ткани в биореакторе или в дополнительных соединениях.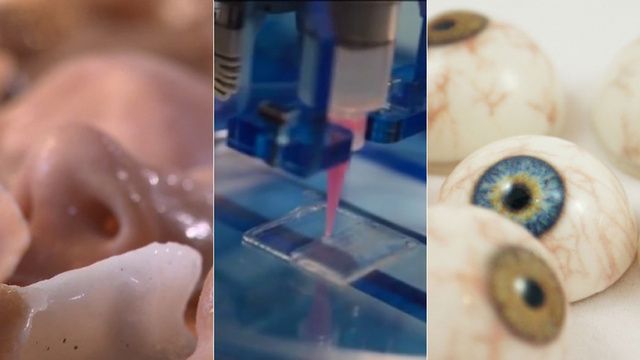 «Есть просто ряд проблем с сантехникой, которые необходимо решить, чтобы заставить этот печатный орган действительно функционировать так же, как человеческий орган в естественных условиях (имеется в виду в теле). И, честно говоря, это еще не решено полностью».
«Есть просто ряд проблем с сантехникой, которые необходимо решить, чтобы заставить этот печатный орган действительно функционировать так же, как человеческий орган в естественных условиях (имеется в виду в теле). И, честно говоря, это еще не решено полностью».
После имплантации биопечатного органа пациенту он со временем естественным образом деградирует — и это нормально, поскольку именно так он и задуман.
«Вы, наверное, задаетесь вопросом: «Ну, а что тогда происходит с тканью? Он развалится?» На самом деле, нет», — сказал Атала. «Эти клеи растворяются, и клетки чувствуют, что мост рушится; они чувствуют, что у них больше нет твердой опоры. Поэтому клетки делают то же, что и в вашем собственном теле, а именно создают свой собственный мост и создают свой собственный клей».
Поэтому клетки делают то же, что и в вашем собственном теле, а именно создают свой собственный мост и создают свой собственный клей».
Атала и Льюис консервативны в своих оценках количества лет, оставшихся до того, как полностью функционирующие биопринтированные органы можно будет имплантировать людям.
«Область развивается быстро, но я имею в виду, я думаю, что мы говорим о десятилетии с лишним, даже несмотря на весь достигнутый огромный прогресс», — сказал Льюис.
«Много лет назад я научился никогда не предсказывать, потому что всегда ошибаешься», — сказал Атала. «Существует так много факторов с точки зрения производства и (правила Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США). В конце концов, наш интерес, конечно же, заключается в том, чтобы технологии были прежде всего безопасными для пациента».
«Существует так много факторов с точки зрения производства и (правила Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США). В конце концов, наш интерес, конечно же, заключается в том, чтобы технологии были прежде всего безопасными для пациента».
Всякий раз, когда биопечать органов становится доступным вариантом, доступность для пациентов и тех, кто за ними ухаживает, не должна быть проблемой.
Они будут «наверняка доступны», — сказал Атала. «Затраты, связанные с отказом органов, очень высоки. Только на содержание одного пациента на диализе уходит более четверти миллиона долларов в год, только на содержание одного пациента на диализе. Так что гораздо дешевле создать орган, который можно имплантировать пациенту».
Так что гораздо дешевле создать орган, который можно имплантировать пациенту».
Средняя стоимость трансплантации почки в 2020 году составляла 442 500 долларов, согласно исследованию, опубликованному Американским обществом нефрологов, в то время как 3D-принтеры продаются по цене от нескольких тысяч до 100 000 долларов, в зависимости от их сложности. Но даже несмотря на то, что доступны недорогие принтеры, дорогостоящие части биопечати могут включать в себя поддержание банков клеток для пациентов, культивирование клеток и безопасное обращение с биологическими материалами, сказал Льюис.
Некоторые из основных расходов на нынешнюю трансплантацию органов — это «извлечение органа у донора, транспортные расходы, а затем, конечно же, операция, через которую проходит реципиент, а затем весь уход и мониторинг», — сказал Льюис. «Некоторые из этих затрат все равно будут в игре, даже если это будет биопечать».
«Некоторые из этих затрат все равно будут в игре, даже если это будет биопечать».
На пути к 3D-печатным органам
В течение многих лет ученые предсказывали, что 3D-печать, которая использовалась для изготовления игрушек, домов, научных инструментов и даже пластикового кролика, который содержал код ДНК для его собственную репликацию — однажды ее можно будет использовать для печати живых частей человеческого тела, чтобы смягчить нехватку донорских органов. До сих пор исследователи также использовали 3D-печать в медицине и стоматологии для создания зубных имплантатов, протезов и моделей, на которых хирурги могли практиковаться, прежде чем делать надрезы на пациенте. Но многие исследователи вышли за рамки печати пластиком и металлом — печати клетками, которые затем формируют живые ткани человека.
Пока еще никто не напечатал полностью функциональные человеческие органы для трансплантации, но ученые приближаются к этому, создавая кусочки ткани, которые можно использовать для тестирования лекарств, и разрабатывая методы преодоления трудностей воссоздания сложной биологии тела.
Первые шаги
Изображение конфокальной микроскопии, показывающее распечатанные на 3D-принтере стволовые клетки, дифференцирующиеся в костные клетки80-е годы. Он мог печатать небольшие объекты, разработанные с использованием программного обеспечения для автоматизированного проектирования (САПР). Дизайн будет фактически нарезан на слои толщиной всего в три тысячных миллиметра. Затем типография объединит этот дизайн в законченный продукт.
Принтер мог использовать две основные стратегии для нанесения рисунка: он мог выдавливать пасту через очень тонкий наконечник, печатая рисунок, начиная с нижнего слоя и продвигаясь вверх, при этом каждый слой поддерживался предыдущими слоями. В качестве альтернативы, он может начать с контейнера, наполненного смолой, и использовать направленный лазер для затвердевания частей этой смолы, чтобы создать твердый объект сверху вниз, который будет поднят и удален из окружающей смолы.
Когда дело доходит до печати клеток и биоматериалов для изготовления копий частей тела и органов, применяются те же две стратегии, но возможность работать с биологическими материалами таким образом требует участия клеточных биологов, инженеров, специалистов по биологии развития, материаловедов.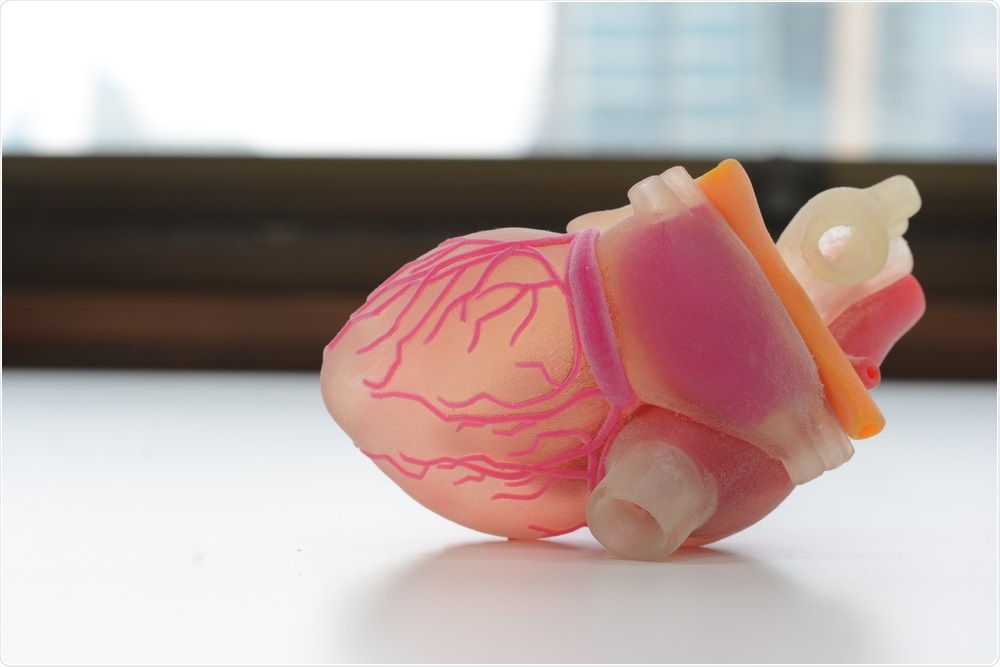 , и другие.
, и другие.
На данный момент ученые напечатали мини-органоиды и микрофлюидные модели тканей, также известные как органы на чипах. Оба дали практическое и теоретическое понимание функции человеческого тела. Некоторые из этих моделей используются фармацевтическими компаниями для тестирования лекарств, прежде чем перейти к исследованиям на животных и, в конечном итоге, к клиническим испытаниям. Одна группа, например, напечатала сердечные клетки на чипе и подключила его к биореактору, прежде чем использовать его для проверки сердечной токсичности известного лекарства от рака, доксорубицина. Команда показала, что частота сокращений клеток резко снизилась после воздействия препарата.
Однако ученым еще предстоит создать органы, которые действительно воспроизводят множество структурных характеристик и функций тканей человека. «Существует ряд компаний, которые пытаются делать такие вещи, как 3D-печать ушей», и исследователи уже сообщали о пересадке 3D-печатных ушей детям с врожденными дефектами, из-за которых уши недоразвиты, отмечает Робби Боулз, биоинженер. в Университете Юты. По его словам, трансплантация ушей — это «своего рода первое доказательство концепции 3D-печати для медицины».
в Университете Юты. По его словам, трансплантация ушей — это «своего рода первое доказательство концепции 3D-печати для медицины».
Исследователи использовали методы 3D-печати в надежде разработать ткани, которые можно было бы трансплантировать людям. Некоторые печатные ткани, такие как кожа и кости, уже тестируются на людях, в то время как многие другие находятся на ранней стадии разработки.
См. полный заголовок
УЧЕНЫЙ ПЕРСОНАЛ
Боулз добавляет, что исследователи еще «далеко» от печати более сложных тканей и органов, которые можно трансплантировать в живые организмы. Но для многих ученых именно это и является целью. По данным United Network for Organ Sharing, по состоянию на февраль 2020 года более 112 000 человек в США ожидают пересадки органов. Каждый день умирает около 20 из них.
В течение многих лет инженеры-биологи пытались построить трехмерные каркасы, которые они могли бы засеять стволовыми клетками, которые в конечном итоге дифференцировались бы и вырастали в формы органов, но «в значительной степени эти методы не позволяют вам ввести вид организации градиентов и паттернов в ткани», — говорит Боулз. «Нет никакого контроля над тем, куда попадают клетки в этой ткани». Напротив, 3D-печать позволяет исследователям очень точно управлять размещением клеток — достижение, которое может привести к лучшему контролю над развитием органов.
«Нет никакого контроля над тем, куда попадают клетки в этой ткани». Напротив, 3D-печать позволяет исследователям очень точно управлять размещением клеток — достижение, которое может привести к лучшему контролю над развитием органов.
Дифференциация
В идеале органы, напечатанные на 3D-принтере, должны быть построены из клеток, которые иммунная система пациента могла бы распознать как свои собственные, чтобы избежать иммунного отторжения и потребности пациентов в приеме иммунодепрессантов. Такие органы потенциально могут быть построены из индуцированных плюрипотентных стволовых клеток, специфичных для конкретного пациента, но одна из проблем заключается в том, чтобы заставить клетки дифференцироваться в подтип зрелых клеток, который необходим для построения определенного органа. «Сложность заключается в том, чтобы объединиться и создать сложные паттерны клеток и биоматериалов, чтобы обеспечить различные функции различных тканей и органов», — говорит Боулз.
Чтобы имитировать паттерны, наблюдаемые в естественных условиях, ученые впечатывают клетки в гидрогели или другие среды с помощью молекулярных сигналов и градиентов, предназначенных для того, чтобы уговорить клетки организоваться в живые органы.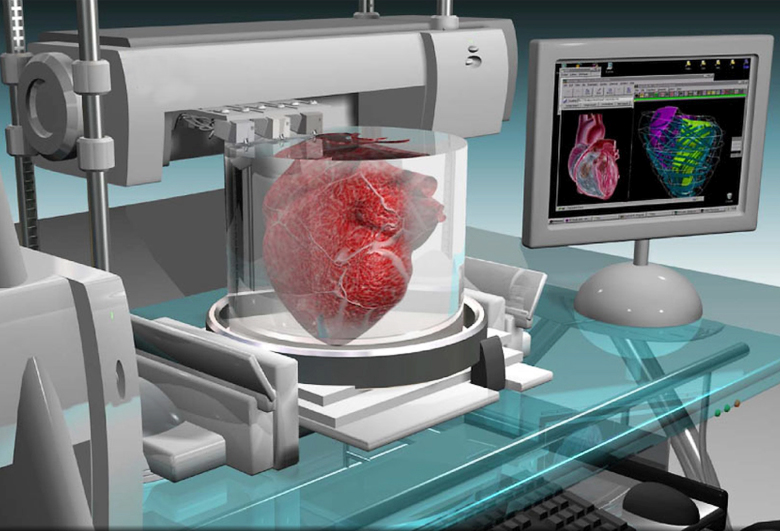 Ученые также могут использовать 3D-печать для создания таких гидрогелей. С помощью других методов «достигнутые паттерны, как правило, были двухмерными», — сообщает Эбен Альсберг, биоинженер из Университета Иллинойса, в электронном письме The Scientist . «Трехмерная биопечать позволяет гораздо лучше контролировать представление сигнала в 3D».
Ученые также могут использовать 3D-печать для создания таких гидрогелей. С помощью других методов «достигнутые паттерны, как правило, были двухмерными», — сообщает Эбен Альсберг, биоинженер из Университета Иллинойса, в электронном письме The Scientist . «Трехмерная биопечать позволяет гораздо лучше контролировать представление сигнала в 3D».
На данный момент исследователи создали участки ткани, имитирующие части определенных органов, но им не удалось воспроизвести сложность или плотность клеток целого органа. Но возможно, что для некоторых пациентов даже пластырь будет эффективным лечением. В конце 2016 года компания Organovo объявила о начале программы по разработке напечатанной на 3D-принтере ткани печени для трансплантации человека после того, как исследование показало, что трансплантированные участки напечатанных на 3D-принтере клеток печени успешно приживаются в мышиной модели генетического аппарата. заболевания печени и повысил несколько биомаркеров, которые свидетельствовали об улучшении функции печени.
Сосуды
Только в последние несколько лет исследователи начали продвигаться вперед в решении одной из самых сложных задач в печати трехмерных органов: создании сосудов. После того, как пластыри были имплантированы в печень мыши в исследовании Organovo, кровь доставлялась к ней окружающей тканью печени, но весь орган должен был быть подготовлен для кровотока.
«Чтобы любые клетки оставались живыми, [орган] нуждается в кровоснабжении, поэтому это не может быть просто огромный кусок ткани», — говорит Кортни Гегг, старший директор по тканевой инженерии в Prellis Biologics, которая производит и продает каркасы для поддержки тканей, напечатанных на 3D-принтере. «Это было признано одним из ключевых вопросов».
Марк Скайлар-Скотт, биоинженер из Института Висса, говорит, что эта проблема «десятилетиями сдерживала развитие тканевой инженерии». Но в 2018 году Себастьяну Узелу, Скайлару-Скотту и команде из Института Висса удалось напечатать на 3D-принтере крошечный бьющийся желудочек сердца с кровеносными сосудами. По словам Узела, через несколько дней после печати ткани он пришел в лабораторию и нашел кусок дергающейся ткани, что было одновременно «очень пугающим и волнующим».
По словам Узела, через несколько дней после печати ткани он пришел в лабораторию и нашел кусок дергающейся ткани, что было одновременно «очень пугающим и волнующим».
Чтобы клетки оставались живыми, [орган] нуждается в кровоснабжении, поэтому это не может быть просто огромный кусок ткани.
—Courtney Gegg, Prellis Biologics
Вместо того, чтобы печатать вены слоями, команда использовала встроенную печать — метод, при котором вместо построения снизу предметного стекла вверх материал выдавливается прямо в ванну или матрица. Эта стратегия, которая позволяет исследователям печатать «свободную форму в 3D», говорит Скайлар-Скотт, вместо того, чтобы печатать каждый слой один поверх другого для поддержки структуры, является более эффективным способом печати сосудистого дерева. . Матриксом в данном случае был клеточный материал, из которого состоял желудочек сердца. Желатиновые чернила мягко отодвинули эти клетки в сторону, чтобы создать сеть каналов. После завершения печати комбинация нагревалась. Это тепло заставило клеточный матрикс затвердеть, но желатин стал жидким, поэтому его можно было затем смыть, оставив место для протекания крови.
После завершения печати комбинация нагревалась. Это тепло заставило клеточный матрикс затвердеть, но желатин стал жидким, поэтому его можно было затем смыть, оставив место для протекания крови.
Но это не значит, что проблема полностью решена. В желудочке команды Института Висса были кровеносные сосуды, но не так много, как в полноразмерном сердце. Гегг отмечает, что для того, чтобы действительно имитировать человеческую биологию, «отдельная клетка должна находиться в пределах 200 микрон от вашего ближайшего источника крови. . . . Все должно быть очень, очень близко». Это гораздо сложнее, чем то, что исследователи напечатали до сих пор.
Из-за препятствий, связанных с добавлением сосудистой системы, и многих других проблем, с которыми по-прежнему сталкиваются ткани, напечатанные на 3D-принтере, созданные в лаборатории органы не будут доступны для трансплантации в ближайшее время. Тем временем 3D-печать частей тканей помогает ускорить как фундаментальные, так и клинические исследования человеческого тела.
Эмма Ясински — внештатный репортер из Флориды. Подпишитесь на нее в Твиттере @EmmaYas24 .
3D-печатные органы приближаются к клиническим испытаниям
С помощью 3D-печати и электропрядения группа биоинженеров из Института регенеративной медицины Уэйк Форест под руководством Энтони Атала выращивает жизнеспособные ткани и органы для пациентов. Хотя многие из этих напечатанных на 3D-принтере органов остаются на стадии исследований, некоторые должны быть готовы к клиническим испытаниям в течение года или двух.
Уже более 25 лет Атала работает над созданием клеток тканей в лаборатории. От пальцев и ушей до почек и сердец его команда теперь может создать 40 различных структур органов и тканей.
Что такое электропрядение?
Эти процедуры начинаются с взятия небольшого образца клеток пациента из области, которую биоинженеры пытаются воссоздать. Например, для кожи им нужен всего лишь трансплантат размером с почтовую марку. Затем в биореакторе они реплицируют эти клетки до тех пор, пока их не станет достаточно для выращивания органа.
Например, для кожи им нужен всего лишь трансплантат размером с почтовую марку. Затем в биореакторе они реплицируют эти клетки до тех пор, пока их не станет достаточно для выращивания органа.
3D-биопринтеры наносят различные типы клеток так же, как цветной 3D-принтер наносит различные типы полимеров. Фото: Уэйк Форест
Следующим шагом является построение внеклеточного матрикса или каркаса, на котором формируются клетки. Затем команда засевает матрицу стимуляторами роста и биохимическими веществами, которые побуждают клетки развиваться определенным образом. Матрица также обеспечивает механические силы, которые формируют развитие клеток.
Для изготовления таких структур, как кожа или кровеносные сосуды, лаборатория использует электропрядение, метод 3D-печати, который напоминает машины, используемые для превращения сахара в сладкую вату.
Биоинженеры используют эту технику для вращения полимерного гидрогеля на высоких скоростях, заставляя полимер удлиняться в длинные нити волокна. Затем они помещают тонкий стержень в центр машины. Волокна гидрогеля прилипают к стержню так же, как пушистая сладкая вата прикрепляется к бумажному конусу. Ученые манипулируют формой губчатого полимера, изменяя напряжение, пока не имитируют структуру, которую создают.
Затем они помещают тонкий стержень в центр машины. Волокна гидрогеля прилипают к стержню так же, как пушистая сладкая вата прикрепляется к бумажному конусу. Ученые манипулируют формой губчатого полимера, изменяя напряжение, пока не имитируют структуру, которую создают.
Дополнительная литература: 3D-печать живой кожи с кровеносными сосудами
Как только исследователи достигают желаемой формы, они распыляют клетки из биореактора на матрицу, многократно наслаивая ее, чтобы она соответствовала естественным структурам. Например, чтобы воссоздать кожу, они начали с применения клеток из подкожного слоя, а затем из дермы и эпидермиса.
После наложения на матрицу структура помещается в инкубатор, имитирующий условия человеческого организма. Там эта комбинация матрицы, биохимических веществ и клеток начинает жить собственной жизнью, используя матрицу в качестве ориентира.
Хотя этот метод идеально подходит для простых и легких структур, таких как кожа и кровеносные сосуды, ему не хватает точности и способности создавать твердые трехмерные структуры, такие как сердце.
Как печатать цельные органы?
Чтобы создать твердый орган, исследователям нужен способ стимулировать рост кровеносных сосудов, чтобы каждая клетка в органе получала кислород и питательные вещества и могла удалять отходы. Создание этих деревьев кровеносных сосудов, которые разветвляются от крупных артерий к мельчайшим сосудам, десятилетиями ставило исследователей в тупик. Тем не менее, команда Atala разработала несколько потенциальных решений.
Один из нескольких 3D-принтеров, предназначенных для печати клеток. Фото: Уэйк Форест
Первое решение начинается с существующего донорского органа, такого как печень. Во-первых, биоинженеры Wake Forest помещают его в шейкер, очень похожий на стиральную машину, с мягкими моющими средствами примерно на две недели.
«После прохождения через шейкер вы можете держать орган, и он будет выглядеть и ощущаться как орган, но в нем не будет клеток», — сказал Атала. «По сути, мы сохранили скелет органа».
«По сути, мы сохранили скелет органа».
Этот скелет состоит из коллагена, белка, содержащегося в соединительной ткани организма и его внеклеточном матриксе. Подобно электропряденной матрице, коллагеновая матрица обеспечивает структуру и механические силы, необходимые клеткам для деления и выполнения функций, связанных с органами. Затем скелет органа откладывается вместе с клетками печени пациента, которые повторно заселяют орган, возвращая его к жизни со многими функциями печени человека.
Несмотря на то, что этот метод многообещающий, он по-прежнему требует ожидания донорского органа для работы. 3D-печать может помочь в этом. Этот метод требует гораздо большего понимания самого органа, но обещает освободить пациентов от ожидания донорского органа.
Дополнительная литература: 3D-биопринтер печатает здоровую кожу на пациентах за считанные минуты
«В таком органе, как сердце, происходит так много всего, что мы не сможем увидеть, если не начнем с нуля», — сказал Атала. «Мы смотрим на структуру с точки зрения 360 градусов, чтобы убедиться, что мы можем воспроизвести функциональность органа всеми возможными способами, иначе он не выживет».
«Мы смотрим на структуру с точки зрения 360 градусов, чтобы убедиться, что мы можем воспроизвести функциональность органа всеми возможными способами, иначе он не выживет».
Один из способов сделать это — продолжать строить органы и учиться на билдах. С этой целью Атала и его команда разработали более дюжины принтеров для выполнения сложных процессов создания твердого органа. Принтеры работают как цветные струйные принтеры, но вместо чернил их картриджи содержат ячейки, разделенные по типу.
Для начала в биопринтер загружается информация о пациенте и органе, схема того, что нужно построить. Через систему сопел принтер наносит слои клеток в виде густого геля. Это медленно создает структуру органа, сохраняя при этом жизнь встроенных в него клеток.
В то время как команда все еще осваивает эту топографическую форму инженерии, 3D-печать дает исследователям возможность проработать детали. Путем проб и ошибок они успешно запрограммировали принтеры на печать даже мельчайших кровеносных сосудов внутри сложного органа.
Является ли 3D-биопечать будущим трансплантации органов?
Независимо от того, какой из этих методов использует команда, требуется от четырех до шести недель, чтобы создать здоровую замену пациенту. Поскольку замещающая ткань или орган изготавливаются из собственных клеток пациента, вероятность отторжения практически отсутствует, а это означает, что пациенты выздоравливают быстрее, чем когда-либо прежде, и им не нужно принимать лекарства, чтобы их иммунная система не атаковала трансплантат.
Дополнительная литература: 10 основных тенденций биоинженерии на 2020 год
«Возможность создавать эти структуры из собственных клеток пациента, чтобы они действительно могли адаптироваться и исцеляться, — это наша надежда», — сказал Атала. «Мы хотим убедиться, что сможем охватить как можно больше пациентов».
Атала говорит, что более простые структуры, такие как кожа и кровеносные сосуды, уже прошли успешные испытания на людях и будут в клинике через пару лет.

 Главная сложность — подобрать материал, который настолько же эластичный или жёсткий, как заменяемый орган. Он должен быстро деградировать, чтобы не мешать укреплению межклеточного матрикса и раствориться, не оставив токсичных соединений. Для каркасной печати подходит гидрогель, титан, желатин, синтетические и биополимеры.
Главная сложность — подобрать материал, который настолько же эластичный или жёсткий, как заменяемый орган. Он должен быстро деградировать, чтобы не мешать укреплению межклеточного матрикса и раствориться, не оставив токсичных соединений. Для каркасной печати подходит гидрогель, титан, желатин, синтетические и биополимеры. 
