Содержание
Стала известна дата первой в мире операции по пересадке человеческой головы
11 сентября 2015
11:27
Стала известна примерная дата первой в мире трансплантации человеческой головы. По некоторым данным, 30-летний россиянин Валерий Спиридонов ляжет под нож в декабре 2017 года. Как ожидается, операция, которую проведет итальянский нейрохирург Серджио Канаверо, продлится 36 часов.
Стала известна примерная дата первой в мире трансплантации человеческой головы. Как сообщает Fox News, 30-летний россиянин Валерий Спиридонов ляжет под нож в декабре 2017 года. Как ожидается, операция, которую проведет итальянский нейрохирург Серджио Канаверо, продлится 36 часов.
Согласно подсчетам Канаверо, понадобится два года, чтобы произвести все необходимые вычисления и спланировать все детали этой процедуры. По словам Спиридонова, операция будет проведена сразу, как только врачи будут на 99% уверены в ее успехе.
Между тем, по данным информагентства «Синьхуа», помогать Канаверо во время пересадки головы будет китайский специалист.
«Успешная трансплантация головы будет переломным моментом в истории, когда станет возможным излечение неизлечимых больных, – сказал Канаверо китайским журналистам. – Единственный человек в мире, который может возглавить такой проект, – Рен Сяопинь».
Канаверо имеет в виду китайского трансплантолога, который в 2013 году пересадил голову мыши. С тех пор Рен Сяопинь и его команда провели порядка тысячи подобных опытов на мышах, добиваясь, чтобы после пересадки головы животные прожили как можно дольше. В текущем году хирург планировал провести такую же операцию с участием приматов.
В какой стране будет проведена трансплантация человеческой головы, пока не сообщается. Однако, как отмечает «Синьхуа», в Китае нет законов, которые запрещали бы подобные процедуры на территории страны.
в мире
новости
Ранее по теме
Став отцом в США, программист Валерий Спиридонов решил не рисковать головой
В Китае впервые успешно пересадили человеческую голову
Первую пересадку головы решили сделать китайцу
Первую в мире пересадку человеческой головы хотят провести в Германии
Серджио Канаверо: первая в мире пересадка человеческой головы должна пройти в России
Хирург Серджио Канаверо: мы доказали, что трансплантация головы возможна
Амбиции против «скучной» науки.
 Почему Серджио Канаверо так и не пересадил голову человеку
Почему Серджио Канаверо так и не пересадил голову человеку
Почти десять лет назад СМИ облетела новость о том, что итальянский ученый планирует пересадку головы уже в ближайшие годы. Но этого не случилось, а интерес к этой теме постепенно утих. Разбираемся, почему амбициозный план провалился. О разнице между строгой наукой и околонаучными сенсациями — в материале ТАСС
«Я сделаю первую пересадку головы человеку» — таким заголовком открывалась большая статья The Guardian 2015 года, посвященная Серджио Канаверо. В последний раз идея срастить голову и тело всерьез обсуждалась в 1970-х годах. Дальше — долгое затишье. И вот теперь малоизвестный итальянский хирург заявлял, что существует технология, которая позволит это сделать. Более того — в ближайшие годы.
Канаверо не боялся смелых параллелей. В одном интервью он спокойно заявил, что вдохновляется образом доктора Франкенштейна. В другом — сравнил свою задачу с высадкой человека на Луну. «Мы должны отправиться на Луну, чтобы проверить, кто мы есть, проверить наши навыки, нашу уверенность, увидеть, что мы за люди!» — заявил он. Канаверо вел себя как человек, который не сомневается в успехе — словно самой уверенности достаточно, чтобы все удалось.
Канаверо вел себя как человек, который не сомневается в успехе — словно самой уверенности достаточно, чтобы все удалось.
О плане Канаверо написали едва ли не все крупные газеты и журналы мира. Но дата операции несколько раз переносилась (хотя хирург и нашел донора, готового рискнуть жизнью во имя науки). Если посмотреть на динамику поисковых запросов в Google, имя Канаверо в последний раз было на слуху в 2017 году. Дальше поводов говорить о себе он почти не давал.
Последователь и вдохновитель
Мысль о пересадке головы (или, точнее, донорского тела), по словам Канаверо, стала его идеей фикс еще в школьные годы. Он вспоминал, как однажды прочел в газете о попытке трансплантации головы обезьяне в США — и с тех пор решил, что станет первым, кто проведет такую операцию на человеке. Впрочем, ровно такие же амбиции были и у его предшественника — американца Роберта Уайта. Именно его опыты и вдохновили Канаверо.
Уайт, как и его итальянский коллега, был очарован образом Франкенштейна — до той степени, что называл его «основателем и движущей силой трансплантационной хирургии». Интерес к этой теме у него возник еще в школе — когда учитель биологии отметил, насколько виртуозно тот вскрывал лягушку, и посоветовал стать нейрохирургом. Уайт совету последовал. За свою жизнь он провел более 10 тыс. операций и опубликовал более 900 научных работ, трудился в самых авторитетных медицинских институтах — включая Клинику Мейо и Гарвардскую медицинскую школу.
Интерес к этой теме у него возник еще в школе — когда учитель биологии отметил, насколько виртуозно тот вскрывал лягушку, и посоветовал стать нейрохирургом. Уайт совету последовал. За свою жизнь он провел более 10 тыс. операций и опубликовал более 900 научных работ, трудился в самых авторитетных медицинских институтах — включая Клинику Мейо и Гарвардскую медицинскую школу.
Однако широкой общественности Уайт запомнился именно своими экспериментами по пересадке головы. В 1970-х годах Уайт и его коллеги работали над способом поддержать «жизнь» мозга вне тела. Успех такой процедуры открывал огромные исследовательские перспективы. Можно было напрямую наблюдать, как мозг реагирует на лекарства, изменение температуры, инфекции, как работает защитная система мозга, как на его активность влияет отсутствие тела и защитной оболочки в виде черепа.
Такой способ действительно был найден. Для жизни мозга необходимо прежде всего питание, поступающее с кровью. Если приток крови падает, наступает ишемия — смерть тканей из-за голодания. Однако ранние эксперименты показали, что охлажденному мозгу нужно меньше кислорода, чтобы выжить. Впоследствии охлаждение головного мозга стало стандартной процедурой для защиты от ишемии пациентов с травмами мозга и инсультом.
Однако ранние эксперименты показали, что охлажденному мозгу нужно меньше кислорода, чтобы выжить. Впоследствии охлаждение головного мозга стало стандартной процедурой для защиты от ишемии пациентов с травмами мозга и инсультом.
Успешно изолировав мозг собак и обезьян, Уайт и его команда подняли ставки: на этот раз кровообращение должны были поддерживать не только аппараты, но и донорское тело. Операция, проведенная на четырех макаках, привлекла широкое внимание общественности. Зоозащитники окрестили Уайта «доктором Мясником» (позднее он даже включил это прозвище в название своей автобиографии). Но опыт оказался успешным: через три-четыре часа после операции головы продемонстрировали способность жевать, глотать, следить глазами за действиями людей. Головы также демонстрировали реакции, заученные до процедуры, — то есть высшие нервные функции не были утрачены. Однако они не могли двигать конечностями, потому что мозг голов не получал сигналы от спинного мозга тела.
Много проблем, мало решений
Между пересадкой головы и поддержанием жизни в ней в течение суток и успешной пересадкой головы человеку — огромная дистанция. Канаверо, в отличие от своего предшественника, не мог похвастаться большим опытом в этой области. Общий список научных статей Канаверо к 2015 году включал около 30 наименований. В основном его работы были посвящены нейропатической боли — хроническому синдрому, который развивается в результате травмы спинного мозга (и не только ее).
Канаверо, в отличие от своего предшественника, не мог похвастаться большим опытом в этой области. Общий список научных статей Канаверо к 2015 году включал около 30 наименований. В основном его работы были посвящены нейропатической боли — хроническому синдрому, который развивается в результате травмы спинного мозга (и не только ее).
Описание
Книга Серджио Канаверо «Medicus Magnus»
© EPA-EFE/LISI NIESNER
Предотвращение гибели клеток от ишемии — лишь одна из подзадач, которую пришлось бы решать. Даже в случае успеха пришлось бы столкнуться с другими препятствиями. Например, как справиться с реакцией отторжения? Даже при пересадке донорских органов иммунная система пациента стремится отторгнуть новую ткань. И спустя 5 лет после операции организм пытается отторгнуть новый орган (например, в случае сердца частота хронического отторжения доходит до 80%). С этим борются с помощью высоких доз препаратов, подавляющих действие иммунитета. Но и они подрывают здоровье. В случае с пересадкой головы потребовались бы просто чудовищные дозы.
Но и они подрывают здоровье. В случае с пересадкой головы потребовались бы просто чудовищные дозы.
Но самая сложная проблема, не нашедшая решения, — как срастить спинной мозг и вызвать регенерацию нейронов. Именно это позволило бы голове управлять новым телом. Получить живую голову на неподвижном теле (да еще нуждающемся в постоянной медицинской поддержке) — не тот прорыв, аналогичный высадке на Луну, на который рассчитывал Канаверо. Для самого пациента такое состояние обернулось бы постоянным страданием. Тогда в чем смысл?
Спинной мозг, если сильно огрублять, похож на кабель с миллионами проводов. Причем каждый из проводов имеет собственную морфологию. Нервные волокна можно соединить, и они начнут проводить сигналы. Например, операции по пересадке конечностей уже стали рутинными. Однако даже в этом случае функции конечности восстанавливаются в лучшем случае на 60%. При рассечении и сращении нервов остается шрам, и даже при идеальном совмещении сигнал не будет проходить идеально. Это может приводить к потере чувствительности отдельных органов или их частей и даже отмиранию.
Это может приводить к потере чувствительности отдельных органов или их частей и даже отмиранию.
Канаверо, впрочем, не был голословен. Он представил собственный протокол сшивания спинного мозга — GEMINI (по-английски аббревиатура читается как «близнецы»). Главный козырь Канаверо был в том, чтобы использовать для сшивания нервных волокон полиэтиленгликоль (ПЭГ). Это вещество, как показали предыдущие опыты, хорошо склеивает поврежденные клеточные мембраны. Однако эти опыты были проведены на червях, и авторы отдельно отмечали: на млекопитающих этот способ нужно проверять отдельно, ведь у червей толщина соединяемых нервных отростков (аксонов) гораздо меньше.
Другим предложением Канаверо было воспользоваться альтернативным путем регенерации. Канаверо отвергал общепринятое мнение о том, что управление моторными функциями тела зависит в первую очередь от пучков длинных нервных волокон в спинном мозге. Он утверждал, что можно восстановить двигательные функции тела благодаря регенерации нервных волокон ближнего действия, которые являются частью дополнительной сети клеток в спинном мозге, называемой проприоспинальными нейронами. Впрочем, в этом пункте Канаверо ссылался на работу аж 1937 года. И в ней не было нужных экспериментальных данных.
Впрочем, в этом пункте Канаверо ссылался на работу аж 1937 года. И в ней не было нужных экспериментальных данных.
Результаты не на высоте амбиций
И снова нужно отдать должное Канаверо — его построения не были только теоретическими. Однако именно его собственные практические результаты и вызвали скепсис ученых. В 2017 году имя Канаверо вновь всплыло в заголовках новостей. «Проведена первая в мире пересадка головы человека» — лишь один такой пример. Некоторые сообщения, впрочем, были более осторожными (и близкими к истине): «Итальянский нейрохирург объявил об успешной пересадке головы человеку».
А речь шла о пересадке головы… одного трупа другому. Ее Канаверо реализовал в сотрудничестве с азиатскими хирургами Рен Сяопином и Си-Юн Кимом. Ученые сообщали о применении протокола GEMINI, приводили конкретные техники фиксации, подробно описывали процесс сшивания нейронов. Но условия эксперимента исключали саму возможность нужного результата. Ведь у трупа невозможна никакая регенерация — а именно она и стала бы убедительным доказательством успеха всей процедуры. Ведь Канаверо собирался переходить к операциям на живом человеке.
Ведь Канаверо собирался переходить к операциям на живом человеке.
Впрочем, Канаверо и его китайские коллеги проводили и эксперименты на животных. Но и к ним у внимательных коллег были претензии. В 2016 году Си-Юн Ким опубликовал статью о сращении спинного мозга у крыс с применением ПЭГ. Как утверждали авторы, после операции в ответ на электрическую стимуляцию усов крысы двигали лапками. Но это доказывало лишь то, что сигнал каким-то образом проходил через спинной мозг. Рефлексы удалось частично восстановить — но это никак не доказывало, что такая крыса могла осознанно управлять своими конечностями.
Сам Канаверо уже в 2019 году представил статью об успешном применении ПЭГ на собаках породы бигль. Согласно описанию эксперимента, дюжине собак перерезали спинной мозг на уровне 10-го позвонка. Затем семи случайно выбранным собакам ввели в район разреза ПЭГ, а пяти — физраствор. Затем на протяжении полугода собак оценивали по шкале подвижности BBB, делали МРТ спинного мозга и диффузную трактографию (анализ целостности нервных путей).
По результатам этого опыта у контрольной группы подвижность составляла 4/20, в то время как у группы с ПЭГ — 7, 12 и 18. При этом три собаки умерли до окончания опыта. Данные гистологического исследования и трактографии показывали, что спинной мозг в присутствии ПЭГ сращивается значительно лучше (без него сращение также было). Но есть нюанс: статья была опубликована в журнале Surgical Neurology International, а оба автора были редакторами этого журнала по разделу «Трансплантация головы и спинного мозга» — того самого раздела, где опубликована статья. А это уже конфликт интересов — нарушение научной этики.
Амбиции не решают все
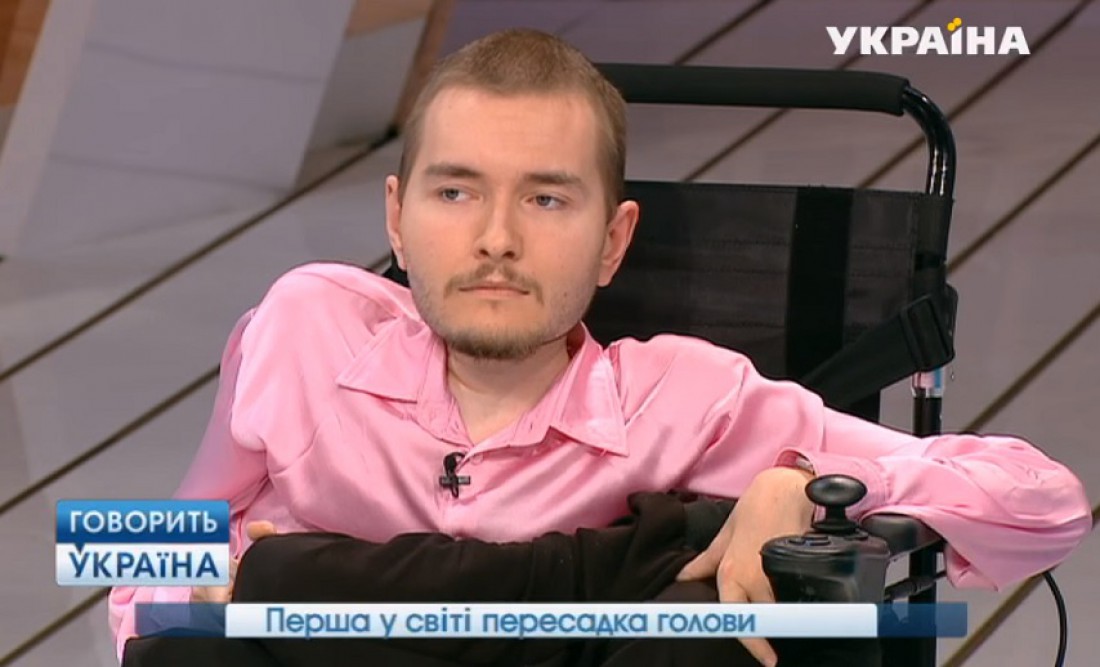
В начале своего квеста по пересадке головы Канаверо излучал уверенность. До той степени, что даже нашел потенциального пациента — россиянина Валерия Спиридонова, страдающего от врожденной спинальной мышечной атрофии. При таком диагнозе мышцы и скелет больного еще в раннем детстве останавливаются в развитии. Возможности лечения доступны лишь в детском возрасте. Еще в 2015 году Спиридонов рассказывал, что операция запланирована на 2017 год.
Еще в 2015 году Спиридонов рассказывал, что операция запланирована на 2017 год.
Описание
Валерий Спиридонов
© Сергей Фадеичев/ТАСС
По плану Канаверо операция должна была занять 36 часов, в ней должны были быть задействованы несколько десятков специалистов, а ее стоимость превысила бы $11 млн. Сначала провести ее планировали в США, но затем Канаверо переключился на Китай. Вероятно, из-за того, что научное сообщество в США было настроено более критически, а вот с китайскими коллегами его взаимодействие сложилось лучше. Да и законодательство в Китае позволяет более свободно проводить такие исследования — правда, на животных.
По словам Спиридонова, в итоге операцию пришлось отложить на неопределенный срок. Он успел переехать в Америку, жениться и завести ребенка. Канаверо с тех пор не отказался от своих планов. По словам хирурга, препятствие скорее техническое: как достать совместимое донорское тело. В Китае, как он утверждает, это будет проще. Задержку он объясняет тем, что попытки получить поддержку проекта были отвергнуты медицинским сообществом в США и Европе.
В Китае, как он утверждает, это будет проще. Задержку он объясняет тем, что попытки получить поддержку проекта были отвергнуты медицинским сообществом в США и Европе.
Коллеги Канаверо критикуют не только изъяны в его исследованиях. Сама фигура ученого, его поведение и заявления действительно вызывают скепсис. Но у этого есть объяснение. «В истории науки были ученые, которые шли на риск и даже делали невозможное, — говорит психофизиолог, профессор биофака МГУ имени М. В. Ломоносова, заведующий лабораторией нейрофизиологии и нейрокомпьютерных интерфейсов Александр Каплан. — Но этому предшествовала длительная подготовка, многочисленные эксперименты на животных. Данных, которые предъявил Канаверо, явно недостаточно для такой задачи. Вероятно, он действительно хороший хирург и имеет большой опыт проведения сложных операций. Но для реальной пересадки головы этого мало. Не разработаны подходы, не решены сопутствующие проблемы, такие как отторжение тканей».
Согласно строгим научным стандартам, ученые должны провести достаточное количество тестов на животных, прежде чем проводить любую новую хирургическую операцию на теле человека. И результаты должны быть воспроизводимы — это главное условие. Результаты, полученные в одной лаборатории, не удается повторить в другой. Возможно, однажды мечта о пересадке головы станет реальностью. Но одних амбиций и веры в себя недостаточно.
И результаты должны быть воспроизводимы — это главное условие. Результаты, полученные в одной лаборатории, не удается повторить в другой. Возможно, однажды мечта о пересадке головы станет реальностью. Но одних амбиций и веры в себя недостаточно.
Антон Солдатов
История трансплантации головы: обзор
После тщательного поиска литературы по истории трансплантации головы мы обнаружили 30 статей, описывающих пять технических проблем, связанных с трансплантацией головы (рис. 1).
Рис. 1
Процесс отбора исследований для идентифицированных статей
Увеличенное изображение
Начало трансплантации головы и анастомозов сосудов
С начала 1900-х годов люди обсуждают возможность трансплантации головы [17, 18]. Однако трансплантологическая хирургия в то время столкнулась со многими проблемами.
Одной из основных проблем трансплантационной хирургии был надежный сосудистый анастомоз.
Проблема, с которой столкнулись сосудистые хирурги, заключалась в том, как перерезать и восстановить поврежденный сосуд, а затем восстановить кровоток, не прерывая кровообращение. Костные, серебряные и золотые трансплантаты и трансплантаты из рассасывающихся материалов использовались в начале 1900-х годов, но эти материалы давали неопределенные и переменные результаты у пациентов [18].
Французский хирург, доктор Алексис Каррель, изменил эти результаты, применив более надежный метод сшивания разорванных сосудов: он использовал тонкие иглы и чрезвычайно тонкие нити в качестве швов и расширил отверстие разорванного сосуда с помощью трех удерживающих швов до образуют треугольную форму. Его метод оказался эффективным в защите от послеоперационных кровотечений и эмболий, а также в профилактике стриктур в месте шва [18]. Каррелю удалось успешно применить эту методику для реконструкции сосудов и трансплантации целых органов (главным образом, при операциях, затрагивающих щитовидную железу и почки) [18].
В 1908 году Каррел и американский физиолог доктор Чарльз Гатри провели первую пересадку головы собаки. Они прикрепили голову одной собаки к шее другой собаки, соединив артерии таким образом, что кровь текла сначала к обезглавленной голове, а затем к голове реципиента. Обезглавленная голова была без кровотока в течение примерно 20 минут, и, хотя собака демонстрировала слуховые, зрительные и кожные рефлекторные движения рано после процедуры, ее состояние вскоре ухудшилось, и ее усыпили через несколько часов [9]., 11].
Хотя их работа в области трансплантации головы не была особенно успешной, Каррел и Гатри внесли значительный вклад в понимание анастомоза сосудов в области трансплантологии. В 1912 г. они были удостоены Нобелевской премии по физиологии и медицине за работу по пересадке конечностей и органов [17].
Еще одна веха в истории трансплантации головы была достигнута в 1950-х годах благодаря работе советского ученого и хирурга доктора наук Владимира Демихова. Как и его предшественники Каррел и Гатри, Демихов внес заметный вклад в область трансплантационной хирургии, особенно торакальной хирургии. Он усовершенствовал доступные в то время методы поддержания кровоснабжения при трансплантации органов и смог провести первую успешную операцию коронарного шунтирования у собак в 1953. Четыре собаки прожили более 2 лет после этой операции [14].
Как и его предшественники Каррел и Гатри, Демихов внес заметный вклад в область трансплантационной хирургии, особенно торакальной хирургии. Он усовершенствовал доступные в то время методы поддержания кровоснабжения при трансплантации органов и смог провести первую успешную операцию коронарного шунтирования у собак в 1953. Четыре собаки прожили более 2 лет после этой операции [14].
В 1954 г. Демихов также предпринял попытку трансплантации собачьей головы (рис. 2). Собаки Демихова демонстрировали большую функциональную работоспособность, чем собаки Гатри и Карреля, могли двигаться, видеть и глотать воду [9]. Пошаговая документация протокола Демихова, опубликованная в 1959 году, показывает, как его команда бережно сохраняла кровоснабжение легких и сердца собаки-донора:
Рис. 2
Двухголовая собака из эксперимента Демихова. Перепечатано из Константинова [14]
Изображение полного размера
Сначала они сделали разрез у основания шеи крупной собаки, обнажив яремную вену, аорту и сегмент позвоночника.
Затем они просверлили два отверстия в костной части одного позвонка и продели в каждое из отверстий две пластмассовые нити, одну красную и одну белую… Потом он и Демихов, ловко орудуя скальпелем, иглой и ниткой, с бесконечными усилиями приступили к обнажению маленькие кровеносные сосуды, затягивая тугим узлом вокруг каждого из них по очереди, по мере того как они постепенно врезались в жизненно важные органы Шавки. Наконец Демихов перерезал позвоночник [16].
Таким образом, несмотря на то, что у этой собаки была ампутирована остальная часть тела, голова и передние лапы все еще сохраняли и использовали легкие и сердце [16, 24]. На третьем этапе трансплантации основные кровеносные сосуды головы этой собаки были соединены с соответствующими сосудами собаки-хозяина [16]. Максимальный срок, в течение которого любая собака пережила эту операцию, составил 29 дней, что также больше, чем у собак Гатри и Каррела, но большинство умерло в течение нескольких дней [9].
Это ограниченное выживание было в основном связано с иммунным ответом реципиента на донора, а следующей серьезной проблемой трансплантации головы было отсутствие иммунодепрессантов, доступных в то время [1, 9]. ]. Без эффективных способов управления реакциями иммунного отторжения между донором и реципиентом работу Демихова нельзя было рассматривать в клинической сфере для использования у людей [1]. Вопрос иммуносупрессии будет рассмотрен ниже.
]. Без эффективных способов управления реакциями иммунного отторжения между донором и реципиентом работу Демихова нельзя было рассматривать в клинической сфере для использования у людей [1]. Вопрос иммуносупрессии будет рассмотрен ниже.
В 1965 году Роберт Уайт, американский нейрохирург, также предпринял попытку трансплантации головы.
Его целью было провести трансплантацию мозга в изолированное тело, в отличие от Гатри и Демихова, которые пересаживали всю верхнюю часть тела собаки, а не только изолированный мозг [1].
Это потребовало от него внедрения других методов перфузии, чем его предшественники.
Фактически, поддержание притока крови к изолированному мозгу было самой большой проблемой для Уайта. Он создал сосудистые петли для сохранения анастомозов между внутренней верхнечелюстной и внутренней сонной артериями собаки-донора. Эта система была названа «аутоперфузией», поскольку она позволяла мозгу перфузироваться собственной системой сонных артерий даже после разрыва тела второго шейного позвонка [25]. Далее головной мозг располагали между яремной веной и сонной артерией реципиента [15]. Используя эти методы перфузии, Уайт смог успешно пересадить мозг шести собак в сосудистую сеть шеи шести крупных собак-реципиентов. Собаки выживали от 6 ч до 2 дней [25].
Далее головной мозг располагали между яремной веной и сонной артерией реципиента [15]. Используя эти методы перфузии, Уайт смог успешно пересадить мозг шести собак в сосудистую сеть шеи шести крупных собак-реципиентов. Собаки выживали от 6 ч до 2 дней [25].
С помощью непрерывного мониторинга электроэнцефалограммы (ЭЭГ) Уайт отслеживал жизнеспособность трансплантированной мозговой ткани и сравнивал активность трансплантированного мозга с мозгом реципиента. Более того, используя имплантируемый записывающий модуль, он также отслеживал метаболическое состояние мозга посредством измерения потребления кислорода и глюкозы и продемонстрировал, что пересаженный мозг после операции находится в высокоэффективном метаболическом состоянии, что является еще одним свидетельством функционального успеха операции. трансплантаты [25].
С помощью своего протокола аутоперфузии и последующего отслеживания функции мозга Уайт продемонстрировал краткосрочную осуществимость трансплантации чистого мозга, а не верхней части тела.
Уайт выразил заинтересованность в использовании этих методов для разработки модельной системы, с помощью которой он мог бы вызывать образование опухолей, менингит или энцефалит в трансплантируемом мозге, а затем проверять, может ли циркулирующая кровь нормального животного-реципиента восстановить функциональность поврежденного мозга [15]. .
В 1970 г. Уайт провел первую обменную трансплантацию головного мозга у приматов (рис. 3). Он выполнил четыре цефалосоматических ассоциации между изолированными головами обезьян и изолированными телами обезьян, используя прямой шов сонных и яремных вен. Шейную ламинэктомию выполняли на уровне четвертого-шестого мозговых позвонков. Из-за последующего спинального шока и гипотонии после пересечения была начата инфузия катехоламинов и механическая поддержка легких, которая поддерживалась в течение оставшейся части эксперимента [15]. Через три-четыре часа после операции каждый головной мозг был способен жевать, глотать пищу, отслеживать глазами и кусать при оральной стимуляции [26]. Более того, с помощью ЭЭГ-мониторинга Уайт продемонстрировал, что эти мозги демонстрируют характерный паттерн бодрствования [26].
Более того, с помощью ЭЭГ-мониторинга Уайт продемонстрировал, что эти мозги демонстрируют характерный паттерн бодрствования [26].
Рис. 3
Из оригинальной статьи Уайта, показывающий изолированный головной мозг примата, трансплантированный изолированному телу обезьяны через прямой шов сонных и яремных сосудов. Перепечатано с сайта White 1971 [26]
Изображение в полный размер
Несмотря на вышеупомянутые достижения, реваскуляризация головного мозга оставалась сложной задачей, а выживаемость составляла от 6 до 36 часов [26]. Из-за сужения, развившегося в яремной вене у линии шва, затруднен венозный отток от головы [26]. Таким образом, прямой шов оказался недостаточно успешным для обеспечения беспрепятственного кровотока, и головные мозги требовали постоянной инфузии гепарина; в конечном итоге это привело к кровопотере и стало фактором, ограничивающим продолжительность этого эксперимента [26]. Более того, Уайт признал, что пересечение шейного отдела позвоночника было еще одним ограничением его методов, так как требовало осуществления постоянной респираторной поддержки животного [15]. Перерезка позвоночника, реваскуляризация и ишемия головного мозга будут рассмотрены ниже.
Перерезка позвоночника, реваскуляризация и ишемия головного мозга будут рассмотрены ниже.
Дальнейшая модификация оптимальных сосудистых анастомозов была произведена много лет спустя, в 2015 году, китайским хирургом Xiao-Ping Ren [22]. В отличие от ранее описанного прямого анастомоза, он использовал метод, при котором перерезали только одну сонную артерию и контралатеральную яремную вену, что позволяло неповрежденной сонной артерии и яремной вене непрерывно перфузировать головку донора на протяжении всей процедуры (рис. 4) [ 22]. Используя этот протокол для трансплантации головы и тела мышам, он смог поддерживать кровяное давление у мышей выше 100/60 мм рт. ст. в течение всей процедуры. Более того, записи ЭЭГ головы как донора, так и реципиента после операции показали нормальную электрическую активность [22]. Перерезая только один сонный и яремный сосуд, метод Рена сводил к минимуму травму реципиента, предотвращал развитие ишемии, а также позволял сохранить неповрежденную функцию головного мозга [26]. Более половины его мышей выживали в течение периода, превышающего 24 часа, при этом самая продолжительная выживаемость составляла 6 месяцев [22]. В то время как трансплантация головы собаки и примата Уайта продемонстрировала краткосрочный успех, отчасти из-за осложнений, связанных со свертыванием крови, гепаринизацией и ишемией, протокол реваскуляризации Рена позволил мышам выжить в более долгосрочной перспективе [22].
Более половины его мышей выживали в течение периода, превышающего 24 часа, при этом самая продолжительная выживаемость составляла 6 месяцев [22]. В то время как трансплантация головы собаки и примата Уайта продемонстрировала краткосрочный успех, отчасти из-за осложнений, связанных со свертыванием крови, гепаринизацией и ишемией, протокол реваскуляризации Рена позволил мышам выжить в более долгосрочной перспективе [22].
Рис. 4
( a ) Яремно-сонное перекрестное кровообращение в мышиной модели трансплантации головы. ( b ) Проведена первая трансплантация головы обезьяны с перекрестным кровообращением. Перепечатано из Ren 2016 [21]
Изображение полного размера
Иммуносупрессия
В 1912 году, когда Гатри и Каррел были представлены к Нобелевской премии, было признано, что работа, которую они выполнили, «не имеет применения к человеку», и что органы, пересаженные от одного к другому, вырождаются у своих новых владельцев. Хотя был достигнут прогресс в понимании поддержания перфузии во время трансплантационной хирургии, такие вопросы, как иммуносупрессия, оставались важными.
Хотя был достигнут прогресс в понимании поддержания перфузии во время трансплантационной хирургии, такие вопросы, как иммуносупрессия, оставались важными.
В 1950-х и 60-х годах лицо трансплантационной хирургии изменилось. Проблема, которая мешала долгосрочному успеху экспериментов Карреля, Гатри и Демихова, была решена. Были обнаружены иммунодепрессанты, такие как азатиоприн, 6-меркаптопурин и кортикостероиды, и группы врачей по всему миру начали проводить трансплантацию почек и сердца человека [1].
Когда Уайт проводил свои эксперименты по трансплантации в 1960-х и 70-х годах, иммунодепрессанты уже были доступны. Уайт использовал эти препараты при трансплантации обезьяньей головы и смог предотвратить возникновение реакции гиперотторжения у приматов, что продемонстрировано гистологическим исследованием мозговой ткани после их смерти [26]. Однако это произошло за счет чрезвычайно высоких доз иммуносупрессии [1, 25]. На самом деле, высокие дозы иммунодепрессантов, необходимые для предотвращения отторжения, фактически способствовали гибели обезьян Уайта 9. дней после трансплантации.
дней после трансплантации.
Ранняя неудача у обезьян Уайта была, по крайней мере, частично из-за токсичности высоких доз иммунодепрессантов. Кроме того, трансплантаты с вовлечением кожи представляли собой дополнительную проблему. Из-за высокой иммуногенности кожной ткани трансплантаты рук и лица не реагировали на иммунодепрессанты того времени [1]. Лишь в 1999 году была обнаружена комбинация иммуносупрессивных агентов, которая была эффективна в предотвращении отторжения кожи без токсичности при использовании в правильных дозах [13]. В частности, считалось, что более низкие дозы комбинаций такролимуса и микофенолата мофетила предотвращают отторжение тканей, не вызывая системной токсичности у реципиента, что представляет собой идеальный баланс для пациентов с трансплантацией кожи [13]. Действительно, в 2006 году первый аллотрансплантат человеческого лица оказался успешным с использованием тимоглобулина, такролимуса, микофенолата мофетила и преднизолона [8]. Однако еще предстоит определить, сохранятся ли эффективность и безопасность этих новых иммунодепрессантов при трансплантации головы человека.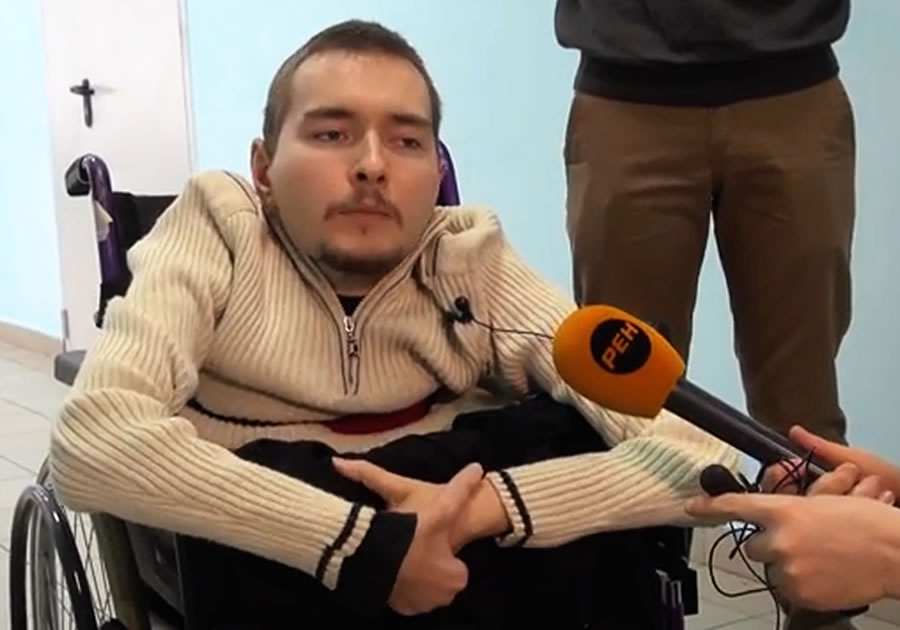
Ren [22] подчеркнул, что было особенно трудно изучать иммунное отторжение у пациентов с трансплантацией головы из-за их краткосрочной выживаемости. Тем не менее, он считает, что его протокол перекрестного кровообращения, который продлевает выживаемость пациентов с трансплантацией головы, позволит тщательно изучить иммуноопосредованные реакции отторжения и приведет к пониманию оптимальных режимов иммуносупрессии при трансплантации головы.
Спинной анастомоз
Дополнительным аспектом трансплантации головы, с которым Уайт и его предшественники боролись, было слияние спинного мозга донор-реципиент. В своем исследовании трансплантации головы у приматов Уайт отметил, что разрыв спинного мозга во время процедуры в конечном итоге приведет к необходимости постоянной респираторной поддержки после трансплантации [26]. Как успешно соединить спинной мозг донора и реципиента и обеспечить усиление двигательной функции, не обсуждалось до недавних экспериментов Рена и итальянского нейрохирурга, доктора Серджио Канаверо.
В 2014 году Рен предложил альтернативу традиционному методу трансплантации головы путем пересечения спинного мозга. До Рена пересечение происходило на уровне С3/С4 и, следовательно, не сохраняло ствол мозга донора [20]. Самостоятельное дыхание и кровообращение были потеряны, и потребовались аппараты жизнеобеспечения. Это было серьезным ограничением, которое Уайт признал в своих экспериментах на приматах [26]. Напротив, при выполнении трансплантации головы мыши, которая сохраняла целостность донорского ствола мозга, животное-донор Рен могло дышать самостоятельно после трансплантации. Использование Реном участка пересечения над стволом мозга, таким образом, обещает независимое дыхание донора и более длительное время выживания по сравнению с традиционными пересечениями С3/С4, выполненными Уайтом и его предшественниками [20].
Примерно в то же время, что и Рен, Канаверо также представил свой собственный протокол трансплантации головы «HEAVEN» или «Предприятие по анастомозу головы» [6]. GEMINI является компонентом «HEAVEN», который отличает его от предыдущих моделей трансплантации головы, решая саму проблему целостности спинного мозга.
GEMINI является компонентом «HEAVEN», который отличает его от предыдущих моделей трансплантации головы, решая саму проблему целостности спинного мозга.
Протокол спинального анастомоза Канаверо требует острого, строго контролируемого рассечения спинного мозга, в отличие от того, что происходит при травматическом повреждении спинного мозга [4]. Он утверждает, что контролируемое рассечение позволит сохранить целостность ткани и последующее восстановление и слияние [6]. В частности, он подчеркивает, как его протокол будет использовать вторичный путь в головном мозге, кортико-трункоретикулопроприоспинальный путь [4]. Эта «проприоспинальная межнейронная система», впервые открытая Чарльзом Шеррингтоном в начале 19 века.00s, представляет собой систему внутренних волокон серого вещества, которая образует сеть связей между сегментами спинного мозга. При повреждении первичного корково-спинномозгового пути разорванные аксоны корково-спинномозгового пути могут образовывать новые связи через эти проприоспинальные нейроны (PNs) [4]. Многочисленные исследования на животных показали, что проприоспинальные нейроны действуют как «анатомический мост» и обеспечивают двигательную функцию и восстановление у животных с поврежденным корково-спинномозговым трактом [6]. В GEMINI Канаверо планирует провести контролируемое рассечение спинного мозга с минимальным повреждением серого вещества [4]. Его теория состоит в том, что поддержание этих PN серого вещества позволит добиться функционального восстановления после перерезки спинного мозга у людей, перенесших трансплантацию головы [4].
Многочисленные исследования на животных показали, что проприоспинальные нейроны действуют как «анатомический мост» и обеспечивают двигательную функцию и восстановление у животных с поврежденным корково-спинномозговым трактом [6]. В GEMINI Канаверо планирует провести контролируемое рассечение спинного мозга с минимальным повреждением серого вещества [4]. Его теория состоит в том, что поддержание этих PN серого вещества позволит добиться функционального восстановления после перерезки спинного мозга у людей, перенесших трансплантацию головы [4].
В недавнем обзоре признается важная роль пропиоспинальных нейронов в восстановлении после травмы спинного мозга [10]. Однако этот регенеративный ответ PN исходит из исследований на многочисленных моделях животных, включая кошек, крыс и мышей, которые имеют другие схемы спинного мозга и регенеративные способности, чем люди [10]. Например, авторы этого обзора описывают классический эксперимент, в котором кошкам выполняли пересечение спинного мозга на поясничном уровне.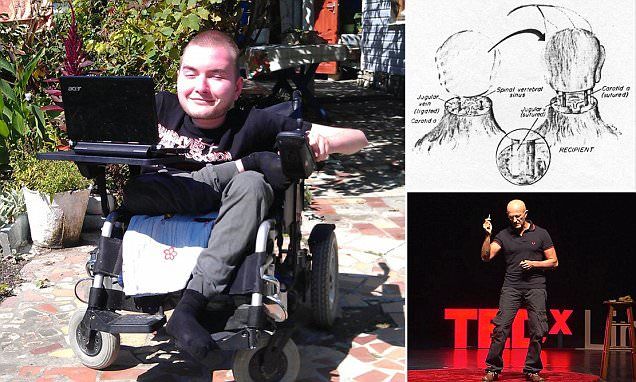 Примечательно, что эти кошки со спинализацией смогли восстановить походку задними конечностями с нагрузкой, которая очень напоминала нормальную кошачью походку [10]. Однако далее авторы признали, что, несмотря на то, что у разных видов действительно существует много общего с точки зрения структурной и функциональной реорганизации спинномозговых цепей под очагами поражения, кошки особенно пластичны в том смысле, что они являются единственными видами млекопитающих, которые могут восстанавливать ходьбу без внешней стимуляции позвоночника. поясничный отдел спинного мозга [10]. Таким образом, еще предстоит выяснить, сохранятся ли те же регенеративные принципы, которые наблюдались на животных моделях, после перерезки спинного мозга человека.
Примечательно, что эти кошки со спинализацией смогли восстановить походку задними конечностями с нагрузкой, которая очень напоминала нормальную кошачью походку [10]. Однако далее авторы признали, что, несмотря на то, что у разных видов действительно существует много общего с точки зрения структурной и функциональной реорганизации спинномозговых цепей под очагами поражения, кошки особенно пластичны в том смысле, что они являются единственными видами млекопитающих, которые могут восстанавливать ходьбу без внешней стимуляции позвоночника. поясничный отдел спинного мозга [10]. Таким образом, еще предстоит выяснить, сохранятся ли те же регенеративные принципы, которые наблюдались на животных моделях, после перерезки спинного мозга человека.
Однако следует отметить, что подобные эксперименты проводились и на приматах. В вышеупомянутом обзоре авторы описывают один эксперимент, в котором приматы перенесли неполное повреждение шейного отдела спинного мозга и после реорганизации, опосредованной проприоспинальными нейронами, смогли восстановить значительные движения рук и пальцев [10]. Тем не менее, авторы признают, что точный механизм, с помощью которого PN приводят к «перенастройке» после травмы, остается неясным [10]. Они подчеркивают, что необходимо провести большое количество исследований, направленных на понимание молекулярной основы и фундаментальной физиологии повторной проводки, прежде чем можно будет по-настоящему использовать терапевтический потенциал проприоспинальной схемы [10].
Тем не менее, авторы признают, что точный механизм, с помощью которого PN приводят к «перенастройке» после травмы, остается неясным [10]. Они подчеркивают, что необходимо провести большое количество исследований, направленных на понимание молекулярной основы и фундаментальной физиологии повторной проводки, прежде чем можно будет по-настоящему использовать терапевтический потенциал проприоспинальной схемы [10].
Фузогены
Недавняя разработка «фузогенов» также способствовала прогрессу в области спинального анастомоза и восстановления. «Фузогены» относятся к полимерам, таким как полиэтиленгликоль (ПЭГ), полоксамеры и полоксамины, которые обладают способностью сплавлять мембраны клеток вместе [10]. В 2004 году группа под руководством доктора Ричарда Боргенса из Университета Пердью лечила собак с параличом нижних конечностей с помощью инъекций ПЭГ в течение 72 часов после травмы спинного мозга и обнаружила, что более половины пролеченных собак смогли ходить в течение 2 недель после лечения [2]. . Следует отметить, что сам Боргенс заявил, что, хотя результаты его исследования показали, что ПЭГ может принести явную пользу собакам с острым повреждением спинного мозга, существуют значительные различия между собачьим и человеческим спинным мозгом, которые необходимо устранить, прежде чем эта терапия сможет достичь человека. клиническая область [2]. Кроме того, Боргенс индуцировал повреждение спинного мозга в своей модели с помощью техники сжатия/раздавливания с постоянным смещением [7]. Этот тип повреждения заметно отличается от типа рассечения, которое выполняется при трансплантации головы, и, следовательно, ограничивает применимость успеха Borgens с ПЭГ в процедуре трансплантации головы.
. Следует отметить, что сам Боргенс заявил, что, хотя результаты его исследования показали, что ПЭГ может принести явную пользу собакам с острым повреждением спинного мозга, существуют значительные различия между собачьим и человеческим спинным мозгом, которые необходимо устранить, прежде чем эта терапия сможет достичь человека. клиническая область [2]. Кроме того, Боргенс индуцировал повреждение спинного мозга в своей модели с помощью техники сжатия/раздавливания с постоянным смещением [7]. Этот тип повреждения заметно отличается от типа рассечения, которое выполняется при трансплантации головы, и, следовательно, ограничивает применимость успеха Borgens с ПЭГ в процедуре трансплантации головы.
В своем обзоре 2012 года Чо и Боргенс [7] описали свой успех в применении наночастиц ПЭГ у морских свинок с травмой спинного мозга. Они провели тестирование применения ПЭГ in vivo и измерили физиологическое восстановление с помощью соматосенсорных вызванных потенциалов (ССВП). Опять же, они смогли продемонстрировать несколько примечательных особенностей ПЭГ как фузогена, в том числе его специфичность к поврежденным участкам, «запечатывание» разрушенных мембран, снижение образования активных форм кислорода и перекисного окисления липидов, а также, как уже упоминалось, функциональное восстановление по измерению. восстановлением проводимости ССВП [7]. Однако, как и прежде, у морских свинок в исследовании Чо и Боргенса не было перерезки спинного мозга; вместо этого у животных, которым они применяли ПЭГ, была компрессионная травма спинного мозга [7]. Таким образом, успех, который Cho и Borgens продемонстрировали в отношении использования ПЭГ после компрессионного повреждения, нельзя напрямую обобщить на процедуру пересечения спинного мозга, как это произошло бы при трансплантации головы.
восстановлением проводимости ССВП [7]. Однако, как и прежде, у морских свинок в исследовании Чо и Боргенса не было перерезки спинного мозга; вместо этого у животных, которым они применяли ПЭГ, была компрессионная травма спинного мозга [7]. Таким образом, успех, который Cho и Borgens продемонстрировали в отношении использования ПЭГ после компрессионного повреждения, нельзя напрямую обобщить на процедуру пересечения спинного мозга, как это произошло бы при трансплантации головы.
В своем протоколе GEMINI Канаверо обсудил вышеупомянутую работу Боргенса и Чо на собаках и морских свинках, а также описал свой план использования ПЭГ для восстановления нервных мембран после перерезки спинного мозга человека [4, 6]. В дополнение к тому факту, что эти животные перенесли компрессионную травму и не перерезали спинной мозг, еще одно ограничение исследований, на которые опирался Канаверо, заключается в том, что они сосредоточены на эффективности ПЭГ в качестве фузогена у крыс, собак или морских свинок. , с редкими доказательствами его использования в качестве фузогена спинного мозга у людей [6]. Несмотря на то, что первая фаза испытаний безопасности с использованием ПЭГ на неповрежденных людях-добровольцах была успешно завершена, могут потребоваться дальнейшие исследования и испытания, прежде чем ПЭГ можно будет применять к пострадавшим людям [4, 7].
, с редкими доказательствами его использования в качестве фузогена спинного мозга у людей [6]. Несмотря на то, что первая фаза испытаний безопасности с использованием ПЭГ на неповрежденных людях-добровольцах была успешно завершена, могут потребоваться дальнейшие исследования и испытания, прежде чем ПЭГ можно будет применять к пострадавшим людям [4, 7].
В недавней редакционной статье о своем протоколе GEMINI Канаверо предположил, что в дополнение к фузогенам можно также использовать электрическую стимуляцию для ускорения восстановления нейронов, разорванных во время пересечения спинного мозга [5]. Он упомянул об успешном клиническом применении стимуляции спинного мозга (SCS) у людей с повреждением спинного мозга [5]. Однако в одном из исследований, на которые он ссылается, описываются три пациента с хроническим неполным повреждением спинного мозга, которые перед стимуляцией передвигались со вспомогательными устройствами [12]. Он также упомянул об эффективности СКС при реабилитации после инсульта и травм нервной системы. Тем не менее, эти травмы пациентов не отражают тех, которые возникают после острого пересечения спинного мозга, которое может произойти во время трансплантации головы человека. Следовательно, как и в случае с фузогенами, необходимо провести дополнительные исследования, чтобы понять, насколько безопасными и эффективными могут быть СКС, в частности, после пересечения спинного мозга.
Тем не менее, эти травмы пациентов не отражают тех, которые возникают после острого пересечения спинного мозга, которое может произойти во время трансплантации головы человека. Следовательно, как и в случае с фузогенами, необходимо провести дополнительные исследования, чтобы понять, насколько безопасными и эффективными могут быть СКС, в частности, после пересечения спинного мозга.
Реваскуляризация, нейропротекция, церебральная ишемия
Как описано выше в разделе об анастомозе сосудов, проведенная Ren et al. в 2015 г. трансплантация головы мышам была успешной для поддержания притока крови к реципиентному мозгу в течение всей процедуры [20] . Ключевым в этом эксперименте было то, что мозг животного-реципиента перфузировался кровотоком из сонной артерии животного-донора через соединение с одной из его собственных сонных артерий (рис. 2) [21]. Кроме того, кровь дренировали обратно во внутреннюю яремную вену донора через собственную внутреннюю яремную вену реципиента [21]. Этот доступ к яремно-каротидному перекрестному кровообращению позволил обеспечить непрерывную перфузию ткани головного мозга реципиента и тем самым предотвратить развитие церебральной ишемии [21]. Однако при проведении трансплантации головы у людей Ren et al. [21] предполагают, что будет короткий период цереброваскулярной остановки из-за технических ограничений, таких как физическое расстояние между каталками.
Этот доступ к яремно-каротидному перекрестному кровообращению позволил обеспечить непрерывную перфузию ткани головного мозга реципиента и тем самым предотвратить развитие церебральной ишемии [21]. Однако при проведении трансплантации головы у людей Ren et al. [21] предполагают, что будет короткий период цереброваскулярной остановки из-за технических ограничений, таких как физическое расстояние между каталками.
Индуцированная гипотермия является широко используемым нейропротекторным методом лечения пациентов с остановкой сердца, инсультом и гипоксически-ишемической энцефалопатией [21]. В ранних экспериментах White et al. [26] на обезьянах он применил глубокую гипотермию (<25 °C) для защиты трансплантированного мозга во время ишемических периодов процедуры. Однако в модели Рена, описанной выше, ему удалось успешно провести трансплантацию головы с индукцией лишь умеренной гипотермии у мышей (29).-33 °C), менее агрессивная температура, чем у White et al. пришлось использовать [21].
Что касается гипотермии, Ren et al. [21] признали, что оптимальное время охлаждения еще не установлено. Однако они не думали, что это будет проблемой в предложенном их командой протоколе цефалосоматического анастомоза (CSA), поскольку тело донора с мертвым мозгом не подвергается гипотермии, а тело реципиента (хотя оно может страдать от осложнений гипотермии, таких как брадикардия). , гипотензия и тромбоз) не будет иметь никакого значения, поскольку его тело в конечном итоге будет выброшено [21].
В дополнение к оптимизации гипотермии также проводились исследования по изучению фармакологических агентов для сохранения функции мозга после процедурной ишемии [21]. Например, перфторан, переносящее газ фторированное органическое соединение, использовался в качестве кровезаменителя при гипотермии, и в рандомизированном исследовании с участием 50 пациентов было показано, что он обеспечивает существенную нейропротекцию и поддерживает церебральную оксигенацию [19, 21]. Сероводород также может быть кандидатом для использования при ЦСА из-за его потенциальной роли в качестве нейропротекторного газа [21]. Однако до сих пор ни одно клиническое исследование не продемонстрировало его эффективность у больных с церебральной ишемией [21].
Однако до сих пор ни одно клиническое исследование не продемонстрировало его эффективность у больных с церебральной ишемией [21].
Таким образом, хотя протокол перекрестного кровообращения и умеренной гипотермии, предложенный Ren et al., доказал свою эффективность в предотвращении церебральной ишемии при трансплантации головы мышей, необходимы дальнейшие исследования его применения на людях, а также дополнительной безопасности, обеспечиваемой нейропротекторными агентами. выполняться.
Обезболивание
Проблема боли, которая не рассматривалась ранними исследователями трансплантации головы, вероятно, потому, что они проводили эксперименты на мышах и приматах. Канаверо и др. [3] в этом году опубликовали статью, в которой признают развитие боли как возможное послеоперационное осложнение после трансплантации головы. Они предполагают, что с центральной нейропатической болью (ЦББ) можно бороться посредством селективного поражения субтеменного белого вещества, которое нацелено на сенсорный компонент хронической боли [3]. Они считают, что с помощью высокоинтенсивного сфокусированного ультразвука можно свести к минимуму кровотечение, осуществлять мониторинг в реальном времени и избежать сопутствующих повреждений [3]. Эта процедура все еще является экспериментальной, и ни одно клиническое исследование не показало, что она действительно облегчит симптомы КПК. Действительно, как указывает автор, необходимы дальнейшие исследования перед потенциальным применением хронического посттрансплантационного КПК [3].
Они считают, что с помощью высокоинтенсивного сфокусированного ультразвука можно свести к минимуму кровотечение, осуществлять мониторинг в реальном времени и избежать сопутствующих повреждений [3]. Эта процедура все еще является экспериментальной, и ни одно клиническое исследование не показало, что она действительно облегчит симптомы КПК. Действительно, как указывает автор, необходимы дальнейшие исследования перед потенциальным применением хронического посттрансплантационного КПК [3].
Соображения на будущее
Эксперименты по трансплантации головы проводились более века, начиная с собак в 1908 году и заканчивая моделями приматов в 1970-х годах. За последние десятилетия улучшения в сосудистой хирургии, иммуносупрессивных препаратах и восстановлении спинного мозга в некоторой степени возродили энтузиазм в отношении потенциальных трансплантаций головы человека.
Многочисленные пресс-релизы подтверждают, что автор большинства недавних исследований по трансплантации головы намерен провести первую трансплантацию головы человека в декабре 2017 года. Его цитируют: «Мы уже доказали все, что должны были доказать. [23].
Его цитируют: «Мы уже доказали все, что должны были доказать. [23].
Наш исторический обзор определяет несколько важных соображений, связанных с выполнением жизнеспособной трансплантации головы, включая поддержание перфузии центральной нервной системы, анастомоз и спондилодез позвоночника, а также контроль боли (таблица 3). Недавние публикации отличаются от более ранних публикаций, поскольку они предлагают методы, которые позволили бы поддерживать функцию спинного мозга и ствола головного мозга после трансплантации, что необходимо для долгосрочной жизнеспособности и автономии человека-реципиента. Однако, как подробно описано выше, недавние исследования в этой области были редкими, в них преобладала одна группа, и частично они зависели от процедур, проведенных на собаках, мышах и макаках-резусах в 19 веке.70-е годы. Насколько методы Каррела, Гатри, Демихова, Уайта и их сотрудников можно перенести на нервную систему человека, неясно, и требует дальнейшего изучения, прежде чем мы даже рассмотрим возможность предложить людям эту процедуру. Таким образом, несмотря на прогресс, достигнутый после первых экспериментов в 1908 г., остаются некоторые важные технические проблемы (таблица 3).
Таким образом, несмотря на прогресс, достигнутый после первых экспериментов в 1908 г., остаются некоторые важные технические проблемы (таблица 3).
Таблица 3 Технические проблемы при выполнении безопасной и жизнеспособной трансплантации головы человека
Полноразмерная таблица
Помимо технических проблем, прежде чем приступать к такой процедуре, необходимо рассмотреть важные этические вопросы. К ним относятся такие вопросы, как: как успешная трансплантация изменит смысл человеческой идентичности? Хотя в литературе и средствах массовой информации эта процедура называется трансплантацией головы, на самом деле это трансплантация тела, при которой мозг человека получает новое тело. Тогда возникает вопрос: как пациенты, вышедшие из такой изменяющей жизнь процедуры, отреагируют на получение нового тела, которое будет контролировать и ассоциироваться с их личностью? Это сложные вопросы, требующие дальнейшего изучения. Помимо технических проблем, эти вопросы необходимо будет решить до перехода этих исследований в клиническую практику.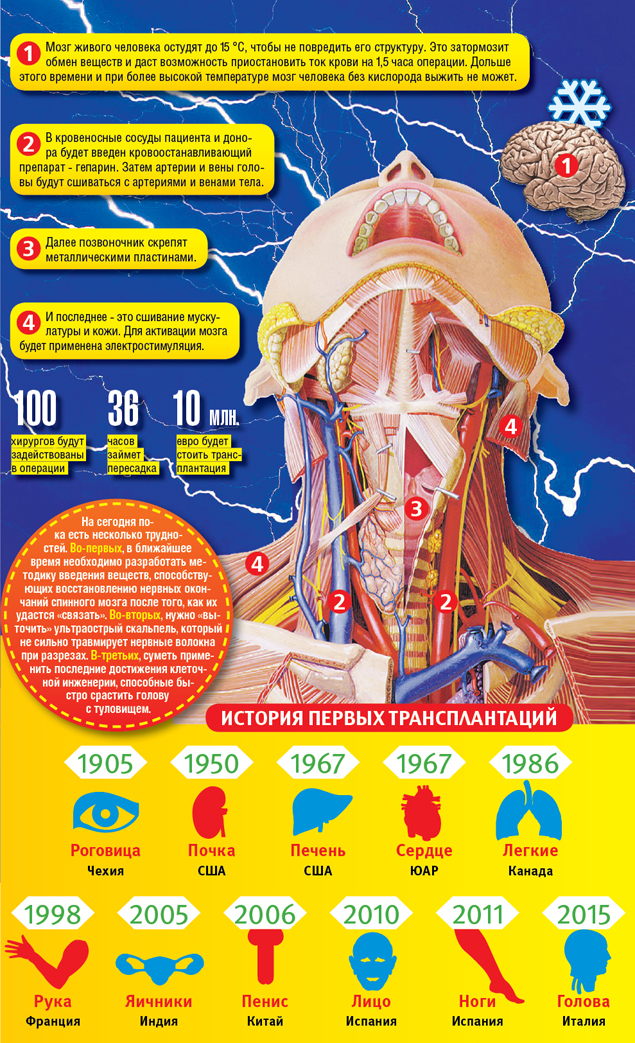
Первая трансплантация головы человека успешно выполнена на трупе, Серджио Канаверо объявляет
Tech & Science
Ханна Осборн
Серхио Канаверо.
Джефф Дж. Митчелл / Getty Images
Технологии и наука
Пересадка головы
Китай
Ученые провели трансплантацию головы трупу человека, сообщил нейрохирург, проводивший операцию.
На пресс-конференции в Вене, Австрия, Серджио Канаверо сказал, что его команда смогла отделить голову от одного тела и соединить ее с телом другого путем слияния позвоночника, нервов и кровеносных сосудов. Он сказал, что следующим шагом будет проведение операции на живом человеке, Телеграф сообщает.
«Проведена первая трансплантация человеческого трупа. Следующим этапом является полная замена головы между донорами органов с мертвым мозгом», — сказал он. «И это последний шаг к формальной пересадке головы по состоянию здоровья, которое неизбежно».
Канаверо сказал, что «большое количество» людей вызвались стать его первым пациентом, перенесшим операцию по пересадке головы. Предполагается, что он проведет операцию в Китае в декабре.
Итальянский нейрохирург не представил на конференции никаких доказательств своих утверждений. Вместо этого он сказал, что научная статья с подробностями процедуры будет опубликована «в ближайшие несколько дней».
«Слишком долго природа диктовала нам свои правила», — сказал он. «Мы рождаемся, растем, стареем и умираем. В течение миллионов лет люди развивались, и 100 миллиардов человек умерли. Это массовый геноцид. руки. Это изменит все. Это изменит вас на каждом уровне».
Канаверо сказал, что его команде удалось сократить время операции до 18 часов. «После нескольких трансплантаций в Китае состоялась первая полноценная репетиция. Операция длилась 18 часов. В 2015 году я упомянул, что она должна занять 36 часов, но китайцы значительно улучшили этот показатель, и операция прошла успешно». 0003
0003
«Следующим шагом будет полная трансплантация головы донорам органов с мертвым мозгом, и первая трансплантация человеческой головы по медицинским показаниям будет проведена в ближайшее время. Дата будет сообщена из Сяопина в ближайшие несколько дней.»
С момента объявления своего плана Канаверо подвергся шквалу критики. Большинство экспертов согласны с тем, что его план неправдоподобен, и большинство из них указывает, что при современных технологиях слияние спинного мозга невозможно.
Существуют также серьезные этические проблемы относительно законности такой процедуры и опасения, что операция не удастся, но голова останется живой.
Джерри Сильвер, профессор неврологии в Университете Кейс Вестерн Резерв в Огайо, недавно сообщил Newsweek , что технически голова может быть прикреплена к респиратору, где она может оставаться живой в течение нескольких дней, испытывая невероятную боль. «Каждый мускул, кости, все было разорвано», — сказал он. «Вы можете себе представить боль от всех этих порезанных вещей? Это самое ужасное.

 Затем они просверлили два отверстия в костной части одного позвонка и продели в каждое из отверстий две пластмассовые нити, одну красную и одну белую… Потом он и Демихов, ловко орудуя скальпелем, иглой и ниткой, с бесконечными усилиями приступили к обнажению маленькие кровеносные сосуды, затягивая тугим узлом вокруг каждого из них по очереди, по мере того как они постепенно врезались в жизненно важные органы Шавки. Наконец Демихов перерезал позвоночник [16].
Затем они просверлили два отверстия в костной части одного позвонка и продели в каждое из отверстий две пластмассовые нити, одну красную и одну белую… Потом он и Демихов, ловко орудуя скальпелем, иглой и ниткой, с бесконечными усилиями приступили к обнажению маленькие кровеносные сосуды, затягивая тугим узлом вокруг каждого из них по очереди, по мере того как они постепенно врезались в жизненно важные органы Шавки. Наконец Демихов перерезал позвоночник [16].