Содержание
Ген и интересен: почему за расшифровку ДНК древних людей дали Нобелевку | Статьи
Нобелевскую премию 2022 года за открытия в области физиологии и медицины присудили за исследование генов древних людей. Ее получил шведский ученый Сванте Паабо, который «прочитал» особенности ДНК неандертальцев, а также денисовцев. Эти данные позволили выяснить, как именно современный человек сложился в того, кем он остается по сей день. Кроме того, информация, полученная из предложенного Сванте Паабо метода по секвенированию генома, помогла понять происхождение мутаций человека, связанных с его здоровьем, в том числе реакцией на инфекционные заболевания. Интересно, что самые важные открытия лауреат этого года сделал совместно с учеными из России. «Известия» пообщались с коллегами Паабо и выяснили, в чем значимость исследований предков для современной науки.
Древние сибиряки
Нобелевскую премию в области медицины в 2022 году получил Сванте Паабо (Svante Pääbo) за изучение генетических основ эволюции человека и геномов вымерших гоменидов (подсемейства приматов, к которому относятся люди и человекообразные обезьяны). Это шведский биолог, основатель Института эволюционной антропологии им. Макса Планка в Германии, а также адъюнкт-профессор Окинавского института науки и технологий, которому удалось расшифровать ДНК древних людей и, в частности, денисовского человека. Его останки обнаружили в Денисовой пещере на Алтае не так давно — в 2008 году. Раскопками там руководит заместитель директора Института археологии и этнографии Сибирского отделения РАН Михаил Шуньков.
Это шведский биолог, основатель Института эволюционной антропологии им. Макса Планка в Германии, а также адъюнкт-профессор Окинавского института науки и технологий, которому удалось расшифровать ДНК древних людей и, в частности, денисовского человека. Его останки обнаружили в Денисовой пещере на Алтае не так давно — в 2008 году. Раскопками там руководит заместитель директора Института археологии и этнографии Сибирского отделения РАН Михаил Шуньков.
Фото: commons.wikimedia.org
Денисова пещера, Солонешенский район, Алтайский край
— Тогда была сделана первая находка в рамках нашей совместной работы, — рассказал ученый «Известиям». — С его исследованиями мы были знакомы и раньше, так как изначально Сванте секвенировал ДНК египетских мумий и неандертальцев, в том числе и от материалов из пещер Алтая. Затем мы нашли фалангу девочки в Денисовой пещере, но мы не могли определить, человек это или другое млекопитающее. Благодаря методике, разработанной под руководством Сванте Паабо в конце 2010 года, удалось определить, что эти останки принадлежат новому виду ископаемого человека, который по названию пещеры получил название «денисовец».
Методика заключается в расшифровке генома, при которой достаточно фрагмента одной нитки из двойной спирали ДНК. Например, в распоряжении ученых был всего лишь один фрагмент биологического материала из косточки мизинца, найденного в пещере. Этого оказалось достаточно, чтобы определить, что он принадлежит смуглой кареглазой девочке с темными волосами.
По словам Михаила Шунькова, новые методы исследования выдвинули археологию как науку на новый уровень — секвенировать теперь стало можно не только образцы костей, но и древних отложений, в которых также обнаруживают ДНК древних людей.
Ген и интересен
Фото: Global Look Press/Ahmed Gomaa
— Это позволило сформулировать гипотезу происхождения современного человека, то есть нас с вами, — рассказал «Известиям» директор Института археологии и этнографии СО РАН, руководитель грантов РНФ Анатолий Деревянко, который и передавал Паабо генетические материалы.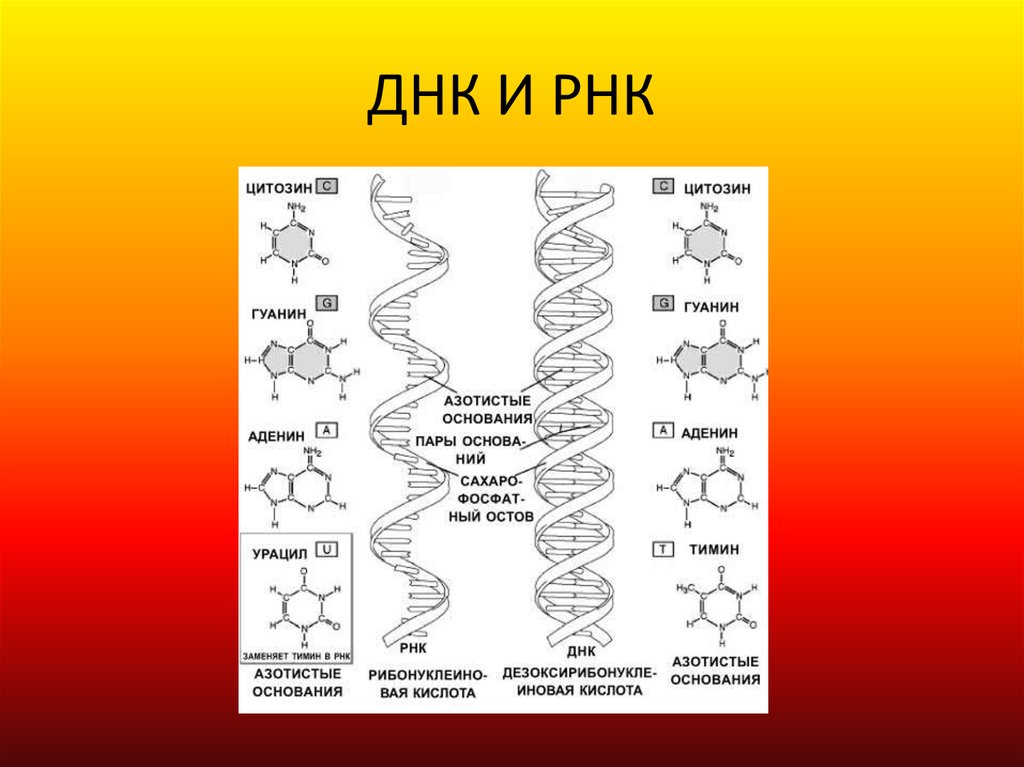 — Оказывается, что в хронологическом интервале в 60–120 тыс. лет назад в Африке и Евразии расселялись три таксона (виды, объединенные едиными признаками). Люди современного типа в Африке, неандертальцы — в Европе, а денисовцы — в Северной и Центральной Азии.
— Оказывается, что в хронологическом интервале в 60–120 тыс. лет назад в Африке и Евразии расселялись три таксона (виды, объединенные едиными признаками). Люди современного типа в Африке, неандертальцы — в Европе, а денисовцы — в Северной и Центральной Азии.
Открытия Паабо дали ученым представление о том, как именно сложился человек в том виде, как сейчас.
«Это генетический рецепт для того, чтобы быть современным человеком», — заявил после открытия сам Свантэ Паабо.
Ген предков
Благодаря работам Паабо выяснилось, что и неандертальцы, и денисовцы существовали параллельно и, как позже было доказано, скрещивались между собой, а также с предками современных людей. Такой обмен генами сыграл важнейшую роль в формировании современного человека, и в том числе его иммунитета.
«Это в ближайшие годы даст нам огромное представление о физиологии человека», — заявил во время объявления номинанта профессор медицинской биохимии Каролинского института в Стокгольме Нильс-Йоран Ларссон.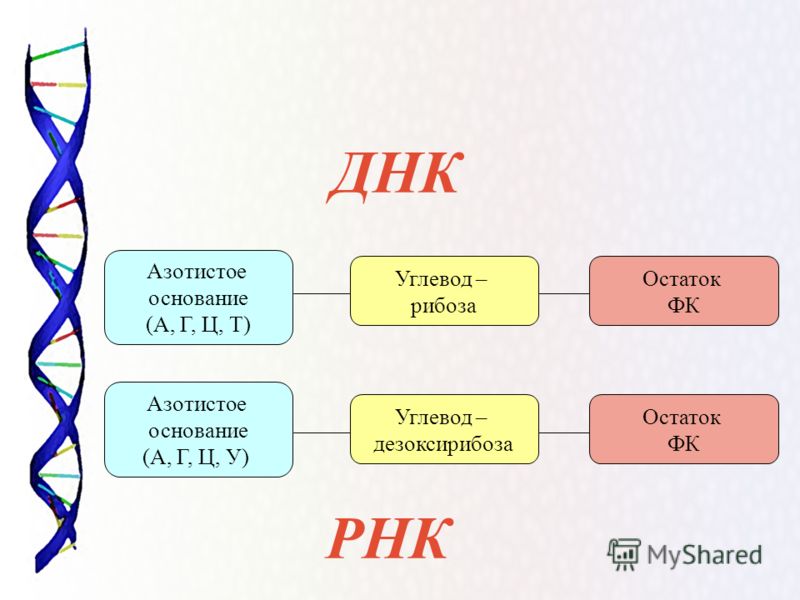
Ген и интересен
Шведский генетик Сванте Паабо, директор Лейпцигского Института эволюционной антропологии им. Макса Планка
Фото: REUTERS/Max-Planck Institute/Frank Vinken
Эксперт Национальной технологической инициативы «Хелснет», российский ученый-генетик, академик РАН, специалист в области генетики терапевтических заболеваний Михаил Воевода добавил, что благодаря этому исследованию мы получили более полное представление об эволюции генома человека и его предков, понимаем, какие гены вообще существовали и как они могут быть связаны с предрасположенностью к разным заболеваниям.
— Его работы — основополагающие, — уверен директор лаборатории геномной инженерии МФТИ Павел Волчков. — Если говорить о скрещивании, именно за счет биологического разнообразия у нас есть большое количество вариантов генов, в частности генов системы распознавания, в том числе патогенов и антигенной репрезентации. Еще из интересного: в 2002 году Сванте Паабо нашел ген, отсутствие которого или повреждения в котором влияют на лингвистические возможности вида или конкретного индивида.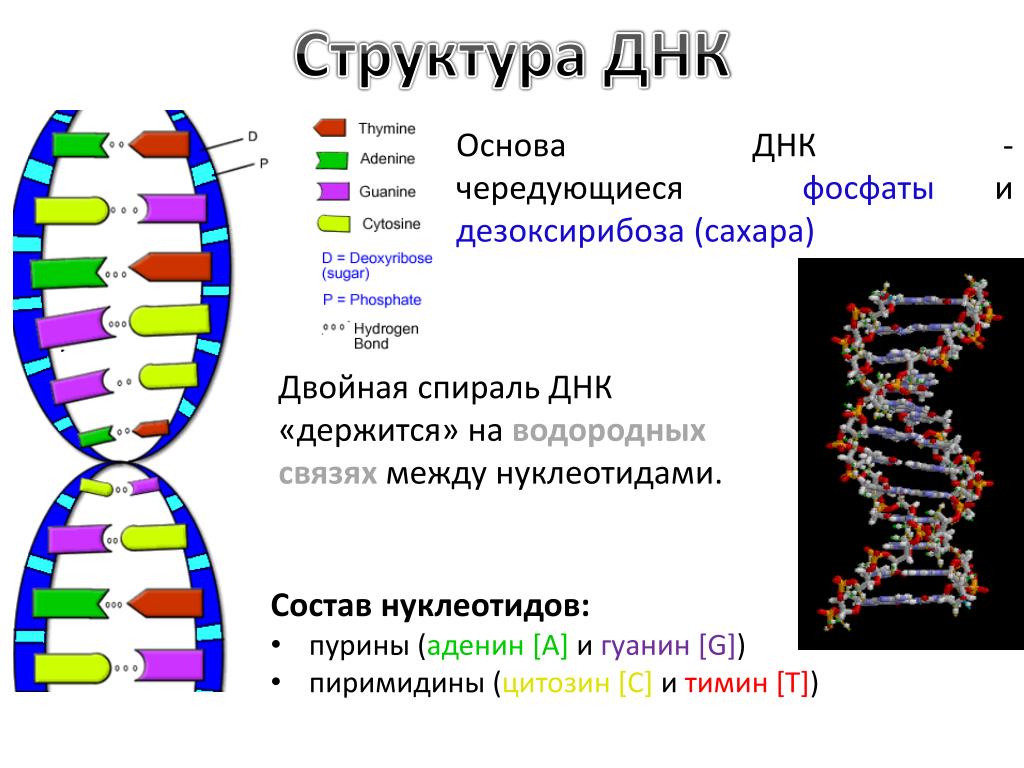
По словам эксперта, шведский ученый с помощью методов секвенирования смог показать эволюционное происхождение людей, а также частично объяснить, почему не все ветви древних людей получили развитие.
Неандертальское наследство
Как рассказал генеральный директор и сооснователь компании Genotek Валерий Ильинский, информация о неандертальских генах может быть полезна и для оценки риска заболеваний.
— К примеру, жители Ирана имеют гораздо больше вариантов генов, унаследованных от неандертальцев, чем, допустим, жители Монголии. В недавнем исследовании была высказана гипотеза о том, что более высокая смертность от SARS CoV-2 среди населения Ирана связана с распространением в стране генетических вариантов, присущих неандертальцам, — эти генетические варианты, как предполагают авторы статьи, предрасполагают людей к более тяжелому течению заболевания и смерти, — рассказал специалист.
Ген и интересен
Фото: Global Look Press/Jochen Tack
Кроме того, благодаря секвенированию генома ученым удалось узнать, что частое возникновение диабета 2-го типа у индейцев Южной Америки связано с мутацией, которую их предки унаследовали от неандертальцев десятки тысяч лет назад. В целом современные люди унаследовали от неандертальцев от 0% до 2% своего генома.
В целом современные люди унаследовали от неандертальцев от 0% до 2% своего генома.
— В области современной генетики человека, в том числе медицинской генетике, очень важна информация о схожести и различии геномов современного человека и гоминид для выявления генетических локусов, связанных с фенотипом, — добавила ведущий научный сотрудник лаборатории ДНК-диагностики медико-генетического научного центра имени академика Н.П. Бочкова, к.м.н. Ольга Щагина. — Можно также исследовать гены, отвечающие за приобретение человеком разумным в процессе эволюции различных способностей. Из наиболее ярких примеров — приобретение человеком способности усваивать молочный сахар — лактозу, связанную с появлением фермента лактазы, ген которой — LCT — отсутствует в геноме неандертальцев.
Для многих ученых имя лауреата премии по медицине этого года стало неожиданностью, так как открытие Паабо находится довольно далеко от медицины как таковой и он не фигурировал в списках компании Clarivate. Этот перечень составляют ежегодно на основе цитируемости — аналитики отбирают самые значимые, на их взгляд, области науки и ищут в них работы, на которые исследователи ссылаются чаще всего.
Этот перечень составляют ежегодно на основе цитируемости — аналитики отбирают самые значимые, на их взгляд, области науки и ищут в них работы, на которые исследователи ссылаются чаще всего.
Как генетика определяет нашу жизнь
Значение генетики в жизни человека сложно переоценить. Внешний вид человека, его физические параметры, цвет кожи и глаз, даже предрасположенность к той или иной деятельности закладывается еще до рождения на генетическом уровне. Генетика во многом определяет даже состояние здоровья человека.
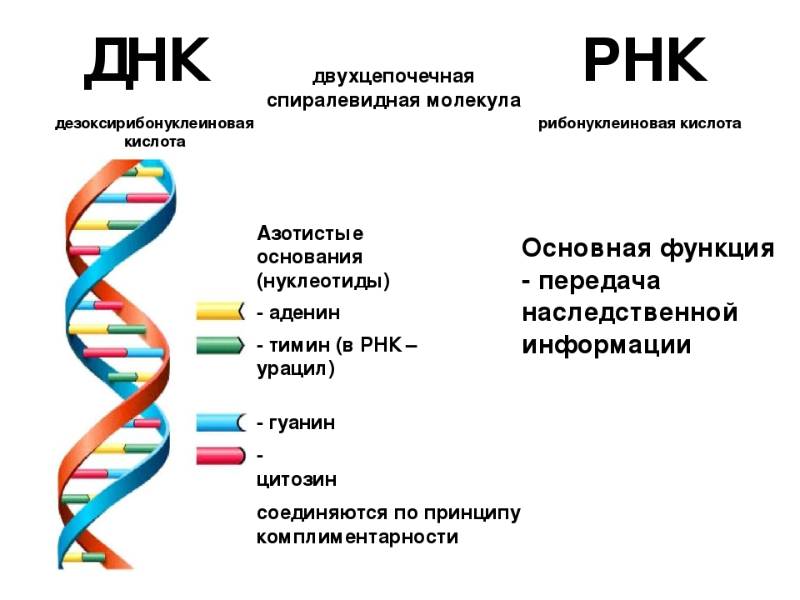
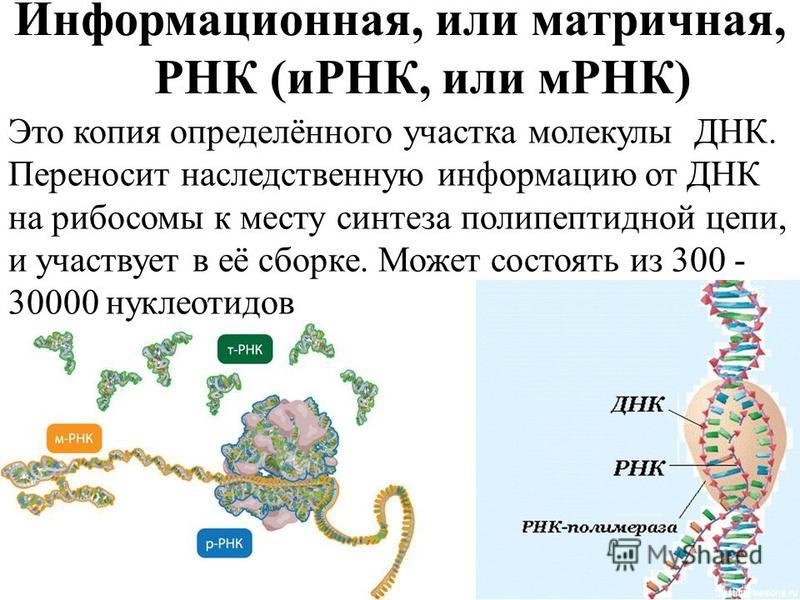
Человек состоит из бессчетного количества клеток. Каждая клетка имеет собственную молекулу ДНК (дезоксирибонуклеиновую кислоту). Фактически ДНК представляет собой хранилище информации о конкретном человеке.
Уникальность ДНК
Удивительно, что каждый человек имеет свою собственную ДНК, другой такой же нет ни у кого в мире. Одинаковых ДНК не может быть даже у идентичных внешне близнецов. Поразительно и то, что во всех клетках человека при этом записана одинаковая ДНК.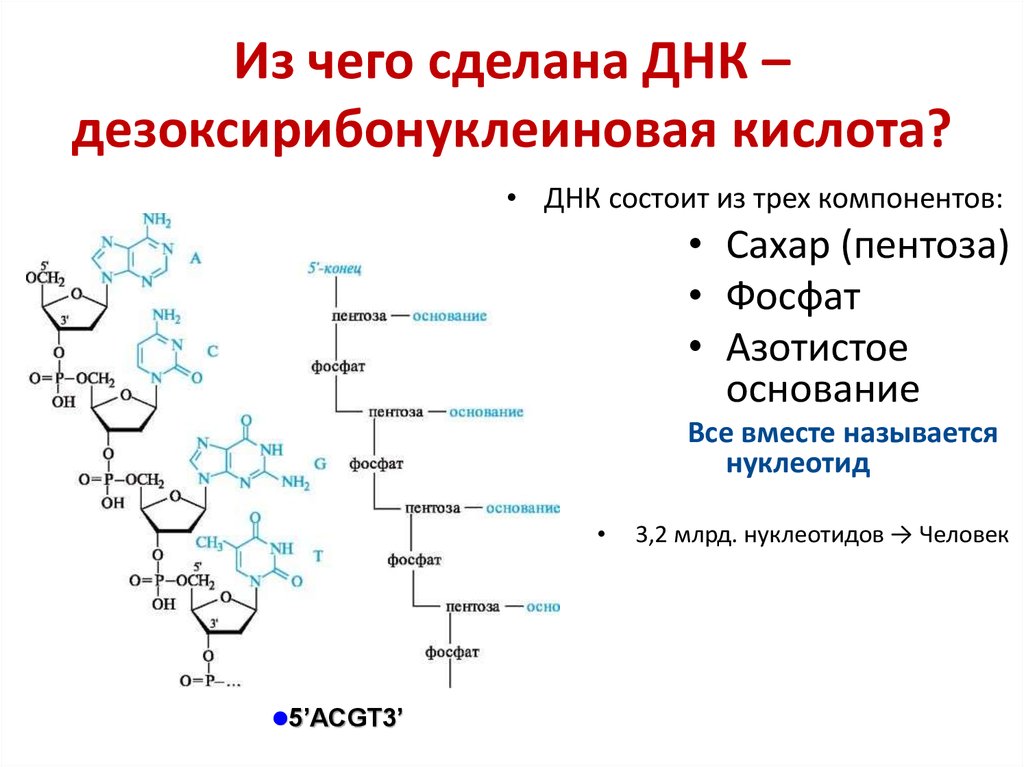
Но если существует запись со всей информацией о человеке, значит, ее можно расшифровать. Сегод
ня существуют крупные частные компании, которые не только на уровне теории изучают роль генетики в жизни человека, но и на практике занимаются расшифровкой ДНК самых разных людей и для различных целей и задач.
За последние десятилетия технология расшифровки ДНК перестала быть уделом фантазий футурологов и стала вполне доступной рядовым гражданам.
Популярность услуги расшифровки ДНК
Если в 2001 году расшифровка ДНК одного человека обходилась примерно в 100 млн долларов, сегодня эта же расшифровка современными методами обойдется в относительно скромные 1000$.
Данные услуги пользуются популярностью (особенно на Западе). В США еще в 2019 году было более 25 млн человек, которые изучили свой геном. Взрослые заказывают такую услугу как для себя, так и своему ребенку.
Это позволяет не только выявить потенциальные таланты и предрасположенность ребенка к какой-то деятельности, но и предупредить развитие наследственных заболеваний.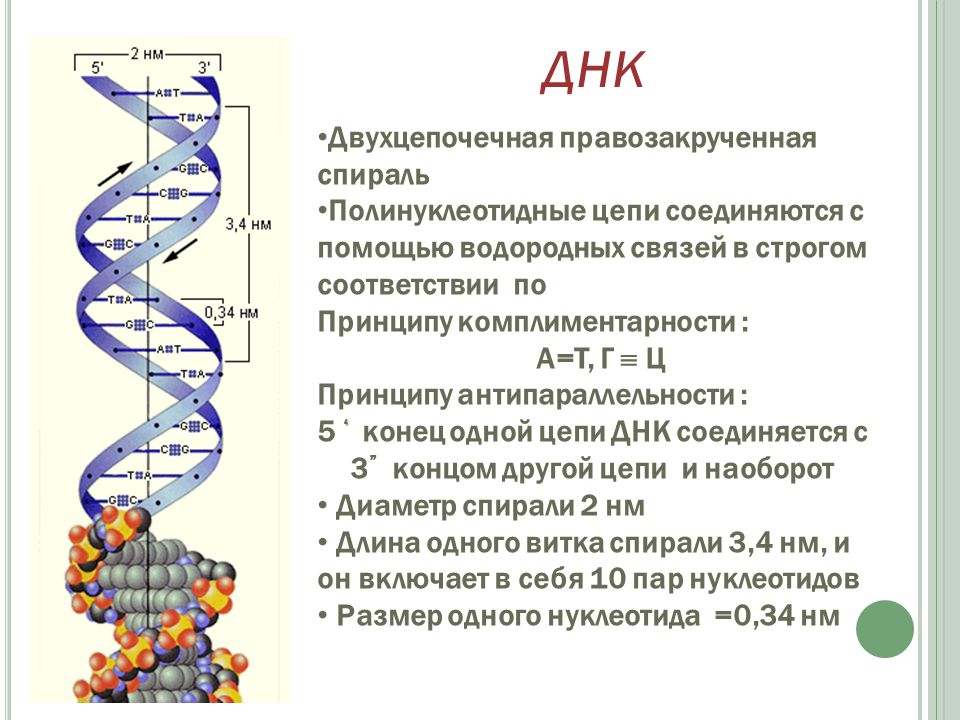
В России большой популярностью пользуется так называемый «генетический паспорт». Он позволяет:
- Более детально рассказать о происхождении человека, о путях миграции его предков. Можно также выявить родственников, сделавших аналогичный тест.
- Отследить состояние здоровья и генетическую предрасположенность человека к каким-либо заболеваниям, а также выявить наличие возможных аллергических реакций на какие-либо препараты и лекарства.
Как ДНК влияет на поведение человека
Генетика изучает также влияние ДНК и информацию, которая в ней заложена, на поведение человека, его образ действий, характер и настроение.
Отчасти поведение человека диктуют условия окружающей среды, но также большую роль в формировании этого поведения играют гены.
Данная наука активно и быстро развивается. Современные ученые-генетики могут рассказать о человеке, его физическом состоянии и образе мышления больше, чем любые другие врачи.
Как происходит процедура сдачи теста? Зачастую в России используется слюна. Это легко, быстро и безболезненно. Как отмечалось ранее, ДНК человека хотя и уникальна, но одинакова во всех клетках человека, будь то клетки мозга или клетки слюны.
Это легко, быстро и безболезненно. Как отмечалось ранее, ДНК человека хотя и уникальна, но одинакова во всех клетках человека, будь то клетки мозга или клетки слюны.
После сдачи анализа материал уходит в лабораторию. Человеку потребуется ждать около месяца до получения результатов генетического теста. Выбору компании, которая будет проводить исследования, стоит уделить большое внимание. Крайне важно, чтобы компания бережно и надежно хранила конфиденциальные данные заказчика.
В результате человек получает на 100% точный отчет о состоянии своего здоровья, о происхождении и другие данные на основе его ДНК.
Современная технология анализа ДНК невероятно точная, однако при этом наука в данном направлении быстро и активно развивается. Ученые не исключают новых прорывных открытий в генетике и анализе генома человека уже в ближайшие годы.
генов с вариантами последовательностей — DECIPHER v11.17
Это список генов, для которых у DECIPHER есть варианты последовательностей пациентов в открытом доступе или варианты последовательностей исследования DDD.
Эти страницы содержат информацию о генах и их транскриптах, совпадающих вариантах, зарегистрированных у пациентов из открытого доступа, и связанных фенотипах.
Показать: Все геныГены, кодирующие белокВероятно чувствительные к дозе геныГены, связанные с болезньюМоноаллельные геныБиаллельные гены
| Name / Description | Location | pLI | LOEUF | sHet | pHaplo | pTriplo | GenCC | OMIM / Morbid | G2P | ClinGen | Open-access sequence variants | Links | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Загрузка … | |||||||||||||
Современная роль Decipher® Test. , Джемал А. Статистика рака, 2015. CA Cancer J Clin. 2015;65:5–29. [PubMed] [Google Scholar]
2. Д’Амико А.В., Уиттингтон Р., Малкович С.Б. и соавт. Биохимический исход после радикальной простатэктомии, дистанционной лучевой терапии или интерстициальной лучевой терапии при клинически локализованном раке предстательной железы. ДЖАМА. 1998;280:969–974. [PubMed] [Google Scholar]
ДЖАМА. 1998;280:969–974. [PubMed] [Google Scholar]
3. Partin AW, Kattan MW, Subong EN, et al. Комбинация простатспецифического антигена, клинической стадии и шкалы Глисона для прогнозирования патологической стадии локализованного рака предстательной железы. Мультиинституциональное обновление. ДЖАМА. 1997; 277:1445–1451. [PubMed] [Google Scholar]
4. Eggener SE, Scardino PT, Walsh PC, et al. Прогнозирование 15-летней специфической смертности от рака предстательной железы после радикальной простатэктомии. Дж Урол. 2011; 185:869–875. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Stephenson AJ, Scardino PT, Eastham JA, et al. Послеоперационная номограмма, прогнозирующая 10-летнюю вероятность рецидива рака предстательной железы после радикальной простатэктомии. Дж. Клин Онкол. 2005; 23:7005–7012. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Boehm K, Larcher A, Beyer B, et al. Определение наиболее информативного инструмента прогнозирования смертности от рака после радикальной простатэктомии: сравнительный анализ трех широко используемых моделей предоперационного прогнозирования. [опубликовано онлайн 10 августа 2015 г.]. Евр Урол. doi: 10.1016/j.eururo.2015.07.051. [ПубМед]
[опубликовано онлайн 10 августа 2015 г.]. Евр Урол. doi: 10.1016/j.eururo.2015.07.051. [ПубМед]
7. Karnes RJ, Bergstralh EJ, Davicioni E, et al. Валидация геномного классификатора, предсказывающего метастазирование после радикальной простатэктомии в группе риска. Дж Урол. 2013;190:2047–2053. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Thompson RH, Blute ML, Slezak JM, et al. Актуален ли алгоритм оценки GPSM для пациентов с раком предстательной железы в современную эпоху? Дж Урол. 2007; 178: 459–463. [PubMed] [Google Scholar]
9. Choeurng V, Luo B, Ross A, et al. Повторная калибровка моделей прогнозирования геномного риска при раке предстательной железы для улучшения прогнозов на индивидуальном уровне. Дж. Клин Онкол. 2015;33:e16122. [Академия Google]
10. Кляйн Э.А., Юсефи К., Хаддад З. и соавт. Геномный классификатор улучшает прогнозирование метастатического заболевания в течение 5 лет после хирургического вмешательства у пациентов с раком предстательной железы высокого риска без лимфоузлов, перенесших радикальную простатэктомию без адъювантной терапии. Евр Урол. 2015; 67: 778–786. [PubMed] [Google Scholar]
Евр Урол. 2015; 67: 778–786. [PubMed] [Google Scholar]
11. Cooperberg MR, Hilton JF, Carroll PR. Шкала CAPRA-S: простой инструмент для улучшения прогнозирования исходов после радикальной простатэктомии. Рак. 2011;117:5039–5046. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Cooperberg MR, Davicioni E, Crisan A, et al. Комбинированное значение проверенных клинических и геномных инструментов стратификации риска для прогнозирования смертности от рака предстательной железы в когорте простатэктомии высокого риска. Евр Урол. 2015;67:326–333. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Ross AE, Johnson MH, Yousefi K, et al. Тканевая геномика дополняет стратификацию риска после простатэктомии в когорте мужчин среднего и высокого риска с естественным течением заболевания. Евр Урол. 2016;69:157–165. [PubMed] [Академия Google]
14. Гласс А.Г., Лео М.С., Хаддад З. и др. Валидация геномного классификатора для прогнозирования рецидива после простатэктомии в медицинских учреждениях по месту жительства. [опубликовано онлайн 25 ноября 2015 г.]. Дж Урол . doi: 10.1016/j.juro.2015.11.044. [PubMed]
[опубликовано онлайн 25 ноября 2015 г.]. Дж Урол . doi: 10.1016/j.juro.2015.11.044. [PubMed]
15. Saylor PJ, Smith MR. Метаболические осложнения андрогенной депривационной терапии рака предстательной железы. Дж Урол. 2009; 181:1998–2006. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Антонаракис Э.С., Фэн З., Трок Б.Дж. и др. Естественная история метастатического прогрессирования у мужчин с рецидивом простат-специфического антигена после радикальной простатэктомии: долгосрочное наблюдение. БЖУ Интерн. 2012;109: 32–39. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Patel AR, Stephenson AJ. Лучевая терапия рака предстательной железы после простатэктомии: адъювантная или спасительная? Нат Рев Урол. 2011; 8: 385–392. [PubMed] [Google Scholar]
18. Stephenson AJ, Scardino PT, Kattan MW, et al. Прогнозирование результатов спасительной лучевой терапии рецидива рака предстательной железы после радикальной простатэктомии. Дж. Клин Онкол. 2007;25:2035–2041. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007;25:2035–2041. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Trock BJ, Han M, Freedland SJ, et al. Специфическая выживаемость при раке предстательной железы после спасительной лучевой терапии по сравнению с наблюдением у мужчин с биохимическим рецидивом после радикальной простатэктомии. ДЖАМА. 2008;299: 2760–2769. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Ross AE, Feng FY, Ghadessi M, et al. Геномный классификатор, предсказывающий прогрессирование метастатического заболевания у мужчин с биохимическим рецидивом после простатэктомии. Рак простаты Prostatic Dis. 2014; 17:64–69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Thompson IM, Tangen CM, Paradelo J, et al. Адъювантная лучевая терапия патологического рака предстательной железы T3N0M0 значительно снижает риск метастазов и улучшает выживаемость: долгосрочное наблюдение в рандомизированном клиническом исследовании. Дж Урол. 2009 г.;181:956–962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Wiegel T, Bottke D, Steiner U, et al. Послеоперационная адъювантная лучевая терапия фазы III после радикальной простатэктомии по сравнению с радикальной простатэктомией только при раке предстательной железы pT3 с послеоперационным неопределяемым простат-специфическим антигеном: ARO 96-02/AUO AP 09/95. Дж. Клин Онкол. 2009; 27: 2924–2930. [PubMed] [Google Scholar]
Wiegel T, Bottke D, Steiner U, et al. Послеоперационная адъювантная лучевая терапия фазы III после радикальной простатэктомии по сравнению с радикальной простатэктомией только при раке предстательной железы pT3 с послеоперационным неопределяемым простат-специфическим антигеном: ARO 96-02/AUO AP 09/95. Дж. Клин Онкол. 2009; 27: 2924–2930. [PubMed] [Google Scholar]
23. Bolla M v, Poppel H, Tombal B, European Organization for Research Treatment of Cancer, Radiation Oncology Genito-Urinary Groups et al. Послеоперационная лучевая терапия после радикальной простатэктомии по поводу рака предстательной железы высокого риска: долгосрочные результаты рандомизированного контролируемого исследования (исследование EORTC 229).11) Ланцет. 2012;380:2018–2027. [PubMed] [Google Scholar]
24. Abdollah F, Suardi N, Cozzarini C, et al. Выбор оптимального кандидата для адъювантной лучевой терапии после радикальной простатэктомии по поводу рака предстательной железы: анализ долгосрочной выживаемости. Евр Урол. 2013;63:998–1008. [PubMed] [Google Scholar]
Евр Урол. 2013;63:998–1008. [PubMed] [Google Scholar]
25. Maurice MJ, Zhu H, Abouassaly R. Низкое использование немедленного и отсроченного послеоперационного облучения при раке предстательной железы с неблагоприятными патологическими особенностями. Дж Урол. 2015;194:972–976. [PubMed] [Академия Google]
26. Kalbasi A S-M, Clure S, Mitra N, et al. Низкие показатели адъювантной лучевой терапии у пациентов с неметастатическим раком предстательной железы с патологическими особенностями высокого риска. Рак. 2014; 120:3089–3096. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Suardi N, Gallina A, Lista G, et al. Влияние адъювантной лучевой терапии на восстановление удержания мочи после радикальной простатэктомии. Евр Урол. 2014; 65: 546–551. [PubMed] [Google Scholar]
28. Den RB, Yousefi K, Trabulsi EJ, et al. Геномный классификатор выявляет мужчин с неблагоприятной патологией после радикальной простатэктомии, которым показана адъювантная лучевая терапия. Дж. Клин Онкол. 2015;33:944–951. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клин Онкол. 2015;33:944–951. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Den RB, Feng FY, Showalter TN, et al. Геномный классификатор рака предстательной железы прогнозирует биохимическую неудачу и метастазы у пациентов после послеоперационной лучевой терапии. Int J Radiat Oncol Biol Phys. 2014;89:1038–1046. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Badani K, Thompson DJ, Buerki C, et al. Влияние геномного классификатора риска метастазирования на послеоперационные рекомендации по лечению больных раком предстательной железы: отчет исследовательской группы DECIDE. Онкотаргет. 2013; 4: 600–609.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Michalopoulos SN, Kella N, Payne R P-A S Group, et al. Влияние геномного классификатора на решения послеоперационного лечения у пациентов с раком предстательной железы высокого риска: результаты исследования PRO-ACT. Curr Med Res Opin. 2014;30:1547–1556. [PubMed] [Google Scholar]
32. Badani KK, Thompson DJ, Brown G, et al. Влияние теста геномного классификатора на решения клинической практики для пациентов с раком предстательной железы высокого риска после операции. БЖУ Интерн. 2015;115:419–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Badani KK, Thompson DJ, Brown G, et al. Влияние теста геномного классификатора на решения клинической практики для пациентов с раком предстательной железы высокого риска после операции. БЖУ Интерн. 2015;115:419–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Nguyen PL, Shin H, Yousefi K, et al. Влияние геномного классификатора метастатического риска на рекомендации по лечению после простатэктомии врачами-радиологами и урологами. Урология. 2015;86:35–40. [PubMed] [Google Scholar]
34. Mohler JL, Armstrong AJ, Bahnson RR, et al. Рак простаты, версия 1.2016. J Natl Compr Canc Netw. 2016;14:19–30. [PubMed] [Google Scholar]
35. Knudsen BS, Kim HL, Erho N, et al. J Мол Диагн. 2016. Применение клинического полнотранскриптомного анализа для определения стадии и прогноза рака предстательной железы, диагностированного в образцах биопсии иглы. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Lee HJ, Yousefi K, Haddad Z, et al. Рес Реп Урол. 2016. Оценка геномного классификатора у пациентов с радикальной простатэктомией с метастазами в лимфатические узлы. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Оценка геномного классификатора у пациентов с радикальной простатэктомией с метастазами в лимфатические узлы. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Klein EA, Haddad Z, Yousefi K, et al. Расшифровка геномного классификатора, измеренная на биопсии предстательной железы, предсказывает риск метастазирования. [опубликовано онлайн 22 января 2016 г.]. Урология . doi: 10.1016/Юрология.2016.01.012. [PubMed]
38. Hurley PJ, Hughes RM, Simons BW, et al. Андроген-регулируемый SPARCL1 в микроокружении опухоли ингибирует метастатическое прогрессирование. Рак рез. 2015;75:4322–4334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Prensner JR, Zhao S, Erho N, et al. Биомаркеры РНК, связанные с метастатическим прогрессированием рака предстательной железы: многоцентровой высокопроизводительный анализ SChLAP1. Ланцет Онкол. 2014; 15:1469–1480. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Chakravarty D, Sboner A, Nair SS, et al. LncRNA NEAT1, регулируемая альфа-рецептором эстрогена, является важным модулятором рака предстательной железы. Нац коммун. 2014;5:5383. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нац коммун. 2014;5:5383. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Hu BR, Fairey AS, Madhav A, et al. Экспрессия AXIN2 предсказывает рецидив рака предстательной железы и регулирует инвазию и рост опухоли. [опубликовано онлайн 15 января 2016 г.]. Простата . doi: 10.1002/pros.23151.
[Epub перед печатью] [Бесплатная статья PMC] [PubMed]
42. Hurley PJ, Sundi D, Shinder B, et al. Варианты зародышевой линии аспорина различаются в зависимости от расы, модулируют микроокружение опухоли и по-разному связаны с метастатическим раком предстательной железы. Клин Рак Рез. 2016; 22: 448–458. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Prensner JR, Sahu A, Iyer MK, et al. ИнкРНК PCGEM1 и PRNCR1 не вовлечены в резистентный к кастрации рак предстательной железы. Онкотаргет. 2014;5:1434–1438. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Prensner JR, Iyer MK, Sahu A, et al. Длинная некодирующая РНК SChLAP1 способствует развитию агрессивного рака предстательной железы и противодействует комплексу SWI/SNF. Нат Жене. 2013;45:1392–1398. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нат Жене. 2013;45:1392–1398. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Tomlins SA, Alshalalfa M, Davicioni E, et al. Характеристика 1577 первичных раков предстательной железы раскрывает новые биологические и клинико-патологические представления о молекулярных подтипах. Евр Урол. 2015; 68: 555–567. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Чжао С.Г., Эванс Дж.Р., Котари В. и соавт. Ландшафт прогностических генов-выбросов при раке предстательной железы высокого риска [опубликовано онлайн 2 декабря 2015 г.] Clin Cancer Res. doi: 10.1158/1078-0432.CCR-15-1250. [PubMed]
47. Yamoah K, Johnson MH, Choeurng V, et al. Новая сигнатура биомаркера, которая может предсказать агрессивное заболевание у афроамериканских мужчин с раком простаты. Дж. Клин Онкол. 2015; 33: 2789–2796. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Faisal FA, Sundi D, Tosoian JJ, et al. Расовые вариации молекулярных подтипов рака предстательной железы и передачи сигналов рецепторов андрогенов отражают анатомическое расположение опухоли [опубликовано онлайн 9 октября, 2015] Евро Урол.

 0038
0038