Содержание
Расшифровка ДНК — Нож
Как только выяснилось, что в ДНК содержится код жизни — набор инструкций, используемых клеткой для производства белков, которые в действительности и обеспечивают жизнедеятельность организма, а также формируют его части, ученые начали прилагать массу усилий, чтобы «взломать» этот код и выяснить, как работают эти механизмы. На решение этой задачи ушло много лет; над ней трудилось множество групп исследователей, которые проводили сложные биохимические эксперименты, хотя описать их подробно не позволяет формат этой книги. Но мы по крайней мере расскажем о принципах, лежавших в основе этих исследований, и о результатах всей этой работы.
Рассказ о расшифровке ДНК начинается с книги физика, а не биолога. Один из пионеров квантовой теории Эрвин Шредингер (1887–1961) был заинтригован идеей, что квантовые процессы могут играть важную роль при внесении изменений в молекулы, несущие код жизни, — то есть при мутациях. В то время, в 1940-е гг., носителями генетической информации все еще считались белки, но гипотезы Шредингера, опубликованные в 1944 г. , не зависели от того, что конкретно это были за молекулы. Он проводил различие между кристаллом такого вещества, как поваренная соль, который состоит из бесконечного повторения одинаковых мотивов из атомов натрия и хлора, и кристаллом, который он назвал апериодическим, чье строение можно сравнить с «рафаэлевским гобеленом, который дает не скучное повторение, но сложный, последовательный и полный значения рисунок» *, хотя этот рисунок и соткан из нитей ограниченного количества цветов. Информацию, переносимую молекулами жизни, Шредингер называл «шифровальным кодом» и указывал, как с помощью даже ограниченного числа символов (например, отдельных молекулярных групп) информацию можно передавать так же эффективно, как с помощью букв алфавита. Он отмечал, что «не нужно особенно большого количества атомов в такой структуре, чтобы обеспечить почти безграничное число возможных комбинаций» и что в азбуке Морзе два знака (точка и тире), объединенные в группы не более чем по четыре, дают тридцать различных кодирующих групп — достаточно, чтобы охватить весь английский алфавит и некоторые знаки препинания.
, не зависели от того, что конкретно это были за молекулы. Он проводил различие между кристаллом такого вещества, как поваренная соль, который состоит из бесконечного повторения одинаковых мотивов из атомов натрия и хлора, и кристаллом, который он назвал апериодическим, чье строение можно сравнить с «рафаэлевским гобеленом, который дает не скучное повторение, но сложный, последовательный и полный значения рисунок» *, хотя этот рисунок и соткан из нитей ограниченного количества цветов. Информацию, переносимую молекулами жизни, Шредингер называл «шифровальным кодом» и указывал, как с помощью даже ограниченного числа символов (например, отдельных молекулярных групп) информацию можно передавать так же эффективно, как с помощью букв алфавита. Он отмечал, что «не нужно особенно большого количества атомов в такой структуре, чтобы обеспечить почти безграничное число возможных комбинаций» и что в азбуке Морзе два знака (точка и тире), объединенные в группы не более чем по четыре, дают тридцать различных кодирующих групп — достаточно, чтобы охватить весь английский алфавит и некоторые знаки препинания. Немного забегая вперед, скажем, что число перестановок четырех разных знаков равно 24 (4 × 3 × 2 × 1), а 20 разных знаков — приблизительно 24 × 10 (24 с 17 нулями). Четырехбуквенного кода достаточно, чтобы описать все двадцать аминокислот в составе белков; разных аминокислот вполне достаточно, чтобы описать все разнообразие белков в живых организмах.
Немного забегая вперед, скажем, что число перестановок четырех разных знаков равно 24 (4 × 3 × 2 × 1), а 20 разных знаков — приблизительно 24 × 10 (24 с 17 нулями). Четырехбуквенного кода достаточно, чтобы описать все двадцать аминокислот в составе белков; разных аминокислот вполне достаточно, чтобы описать все разнообразие белков в живых организмах.
Книга Шредингера «Что такое жизнь?» (What is Life?) оказала огромное влияние как на биологов, так и на физиков, которые во время Второй мировой войны насмотрелись на смерть и хотели исследовать жизнь. Среди тех, кто позже особо отмечал влияние идей Шредингера, были Морис Уилкинс, Эрвин Чаргафф, Фрэнсис Крик и Джеймс Уотсон. А сразу после публикации первых статей Уотсона и Крика о ДНК этой темой заинтересовался еще один физик, Георгий Гамов (1904–1968).
Его внимание привлекла скорее вторая статья кембриджской группы о ДНК, опубликованная в журнале Nature 30 мая 1953 г. В то время он находился с визитом в Калифорнийском университете в Беркли, куда приехал из Вашингтона, где тогда работал.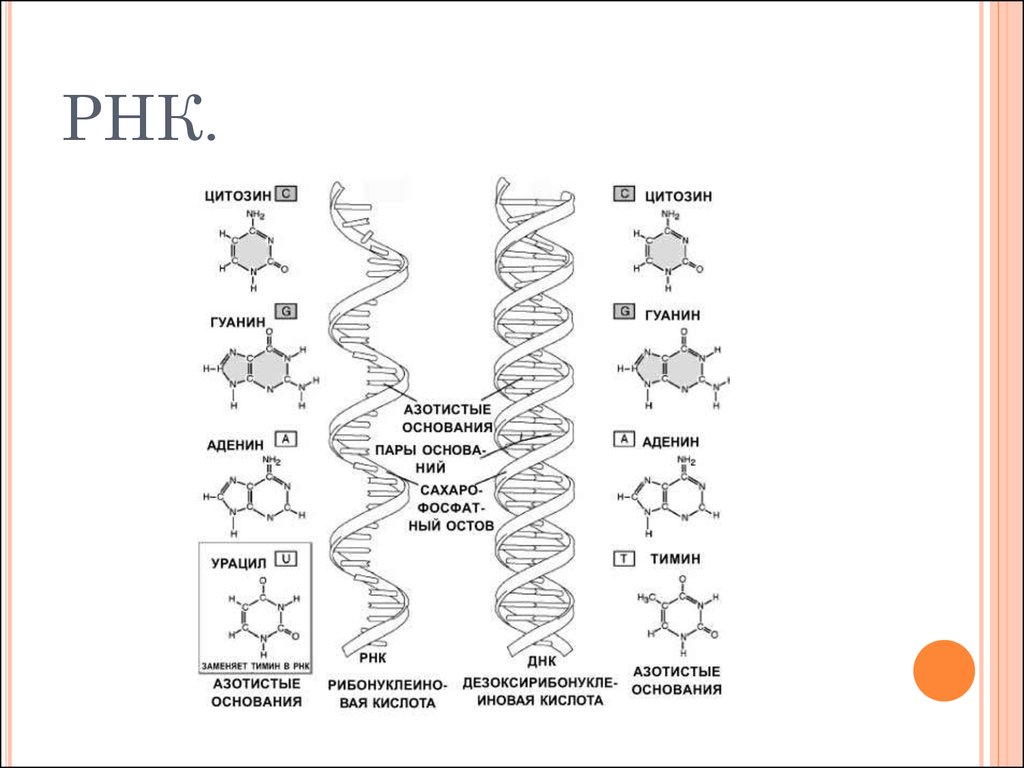 Позже он вспоминал:
Позже он вспоминал:
Я шел по коридору радиационной лаборатории и наткнулся на Луиса Альвареса с журналом Nature в руках… Он сказал: «Взгляните, какую чудесную статью написали Уотсон и Крик». Так я ее впервые и увидел. А затем я вернулся в Вашингтон и начал размышлять о ней.
Плоды этих размышлений были опубликованы в журнале Nature в феврале 1954 г. Гамов ухватился за открытие, что ДНК состоит из четырех типов оснований, апериодически распределенных по ее нити, и подчеркнул, что молекулы белка могут строиться из цепочек аминокислот, удерживаемых рядом с ДНК так, что каждая аминокислота расположена напротив определенной кодирующей группы оснований ДНК. Детали предложенного им механизма были ошибочны, однако он объяснял:
Наследственные свойства любого конкретного организма можно выразить в виде длинного числа, записанного с использованием четырехзначной системы. С другой стороны, ферменты, чей состав должен полностью определяться молекулой дезоксирибонуклеиновой кислоты, являются длинными пептидными цепочками, образованными примерно двадцатью различными аминокислотами, и их можно считать длинными «словами», записанными 20-буквенным алфавитом.
В результате кропотливой работы, последовавшей за этим предположением, были установлены два ключевых факта. Во-первых, цепочки аминокислот не строятся непосредственно на ДНК. Когда клетке нужен конкретный белок (а как она «узнает», когда он ей нужен, до сих пор во многом остается загадкой), необходимый фрагмент ДНК высвобождается из двойной спирали одной из хромосом, используется как шаблон при синтезе цепочки РНК, а затем снова скручивается в спираль и упаковывается обратно в хромосому. Получившаяся цепочка РНК используется как шаблон для синтеза белка, после чего расщепляется для повторного использования ее компонентов. Во-вторых, хотя генетический код содержит четыре буквы, эти буквы используются для образования трехбуквенных слов (кодонов), каждое из которых обозначает конкретную аминокислоту или, в некоторых случаях, команды «старт» или «стоп» для строительства новой пептидной цепочки. Поскольку именно РНК, а не ДНК непосредственно участвует в синтезе белков, эти четыре буквы — A, У, Г и Ц.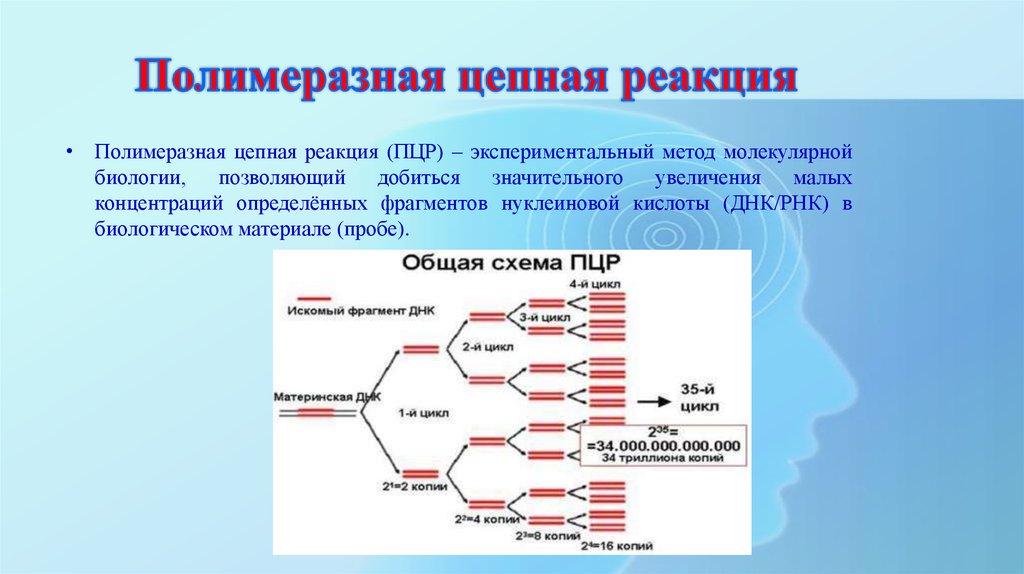 Например, тройка АГУ является кодоном аминокислоты серин, ГГУ — это валин, ЦЦА — пролин, а УАГ означает «стоп». Таким образом, последовательность оснований в молекуле РНК, например УЦЦAГУAГЦГГAЦAГ, следует читать как УЦЦ AГУ AГЦ ГГA ЦAГ.
Например, тройка АГУ является кодоном аминокислоты серин, ГГУ — это валин, ЦЦА — пролин, а УАГ означает «стоп». Таким образом, последовательность оснований в молекуле РНК, например УЦЦAГУAГЦГГAЦAГ, следует читать как УЦЦ AГУ AГЦ ГГA ЦAГ.
Чтобы продемонстрировать, как это влияет на эволюцию, мы приведем пример из нашего алфавита. Вот предложение из трехбуквенных слов: КОТ БЫЛ СЫТ ПЕС БЫЛ ЗОЛ. За счет простой мутации, изменившей всего одну букву, в цепочке может появиться бессмысленное слово: КУТ БЫЛ СЫТ ПЕС БЫЛ ЗОЛ, и это может быть, а может и не быть важным для процессов, протекающих в клетке. Или может появиться новое правильное слово («правильное» в том смысле, что оно кодирует другую аминокислоту ): КИТ БЫЛ СЫТ ПЕС БЫЛ ЗОЛ. В результате изменения одной аминокислоты в клетке может начаться синтез бесполезного белка. Или иногда может получиться белок даже более эффективный, чем исходный. Более резкие мутации могут менять целые слова — например, слово КОТ может превратиться в ЛЕВ — или вообще удалять слова: КОТ БЫЛ СЫТ БЫЛ ЗОЛ.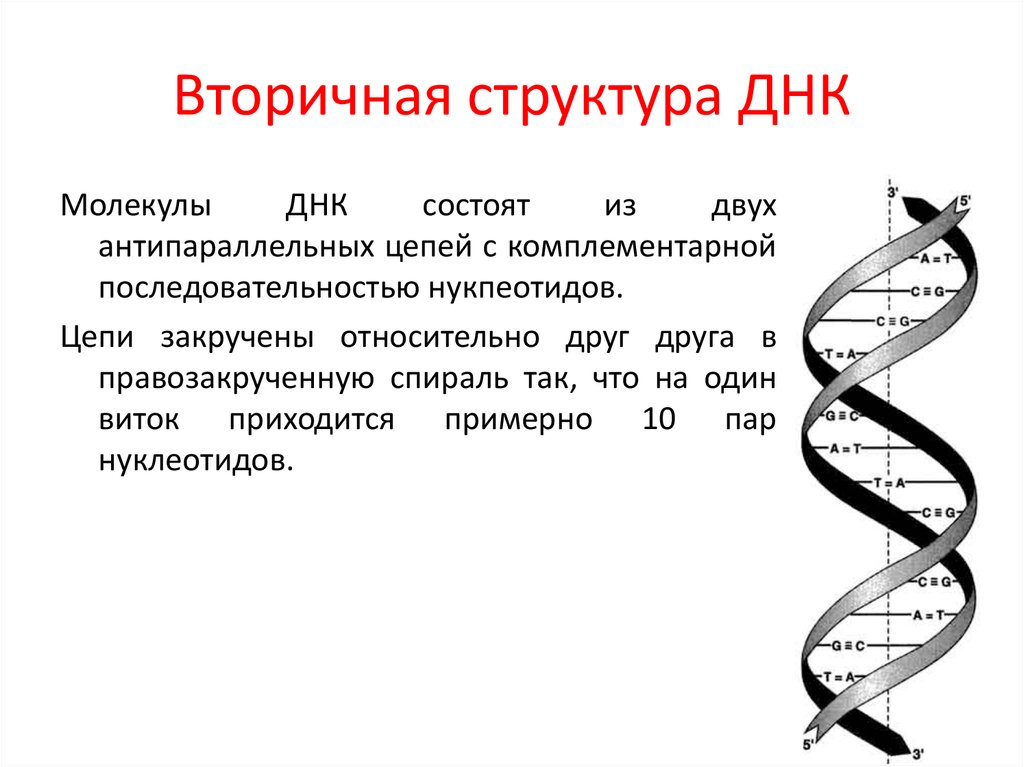 А пропуск (или добавление) одной буквы может полностью изменить весь текст. Например, если убрать из исходного сообщения первую букву К, то мы получим ОТБ ЫЛС ЫТП ЕСБ ЫЛЗ ОЛ.
А пропуск (или добавление) одной буквы может полностью изменить весь текст. Например, если убрать из исходного сообщения первую букву К, то мы получим ОТБ ЫЛС ЫТП ЕСБ ЫЛЗ ОЛ.
Вы можете сами поразвлечься с другими примерами. Для эволюции важно то, что такие ошибки могут возникать в результате сбоев копирования, когда хромосомы перетасовываются, перед тем как попасть в половые клетки, которые передают гены следующему поколению. Могут происходить и более серьезные изменения, например, когда целые участки ДНК неправильно соединяются после кроссинговера или вообще удаляются. В детали этого процесса мы вдаваться не будем.
Что здесь действительно важно, так это то, что был открыт источник неидеально точного копирования генетического материала, который является одной из основ эволюции. Учитывая все вышеизложенное, давайте снова вернемся к эволюции на уровне целых организмов и рассмотрим открытия, которые были сделаны во второй половине XX в.
Основы для этих открытий были заложены еще в 1930-е гг. , но тогда эти исследования не получили широкого признания. Хотя к тому времени ученые уже в основном изучали все более мелкие формы жизни, одна исследовательница продолжала заниматься крупными организмами, как Грегор Мендель. Ее имя — Барбара Макклинток (1902–1992). Организмом, который она изучала, была кукуруза, которая, как и менделевский горох, давала всего одно поколение в год. Макклинток сближало с Менделем еще и то, что результаты ее работы были оценены в полной мере только через 40 лет, но она, в отличие от Менделя, дожила до этого момента.
, но тогда эти исследования не получили широкого признания. Хотя к тому времени ученые уже в основном изучали все более мелкие формы жизни, одна исследовательница продолжала заниматься крупными организмами, как Грегор Мендель. Ее имя — Барбара Макклинток (1902–1992). Организмом, который она изучала, была кукуруза, которая, как и менделевский горох, давала всего одно поколение в год. Макклинток сближало с Менделем еще и то, что результаты ее работы были оценены в полной мере только через 40 лет, но она, в отличие от Менделя, дожила до этого момента.
Макклинток родилась спустя два года после повторного открытия законов Менделя и училась в Колледже сельского хозяйства и естественных наук при Корнеллском университете в Итаке, штат НьюЙорк, который окончила в 1923 г. В своей нобелевской лекции, произнесенной в 1983 г., она вспоминала: «Я начала активно заниматься генетикой через 21 год после повторного открытия принципов наследственности Менделя в 1900 г., когда эти принципы еще не были приняты большинством биологов». Она отучилась в аспирантуре Корнеллского университета, в 1927 г. защитила диссертацию, разработав методы анализа хромосом кукурузы, и продолжила работать в этом направлении после получения докторской степени. Для ее исследований не имело значения, из чего состоят хромосомы, поскольку Макклинток и созданную ею группу ученых интересовали хромосомы в целом и гены как участки хромосом, а также их влияние на организм. Кукуруза (маис), которую она изучала, — гораздо более интересный объект для исследований, чем однообразная желтая кукуруза из супермаркета. У дикой кукурузы разноцветные зерна, и они расположены в початке рядами, так что их очень удобно учитывать. Вместо того чтобы рассматривать глаза крошечных мушек или изучать под микроскопом бактерии, все, что вам нужно сделать для выявления изменений (мутаций), это вскрыть початок и изучить узоры из разноцветных зерен, представленные во всей своей красе.
Она отучилась в аспирантуре Корнеллского университета, в 1927 г. защитила диссертацию, разработав методы анализа хромосом кукурузы, и продолжила работать в этом направлении после получения докторской степени. Для ее исследований не имело значения, из чего состоят хромосомы, поскольку Макклинток и созданную ею группу ученых интересовали хромосомы в целом и гены как участки хромосом, а также их влияние на организм. Кукуруза (маис), которую она изучала, — гораздо более интересный объект для исследований, чем однообразная желтая кукуруза из супермаркета. У дикой кукурузы разноцветные зерна, и они расположены в початке рядами, так что их очень удобно учитывать. Вместо того чтобы рассматривать глаза крошечных мушек или изучать под микроскопом бактерии, все, что вам нужно сделать для выявления изменений (мутаций), это вскрыть початок и изучить узоры из разноцветных зерен, представленные во всей своей красе.
Читайте также
Парадокс добродетели: как в ходе эволюции развились наши представления о добре и зле
Но для изучения генов все равно нужен был микроскоп.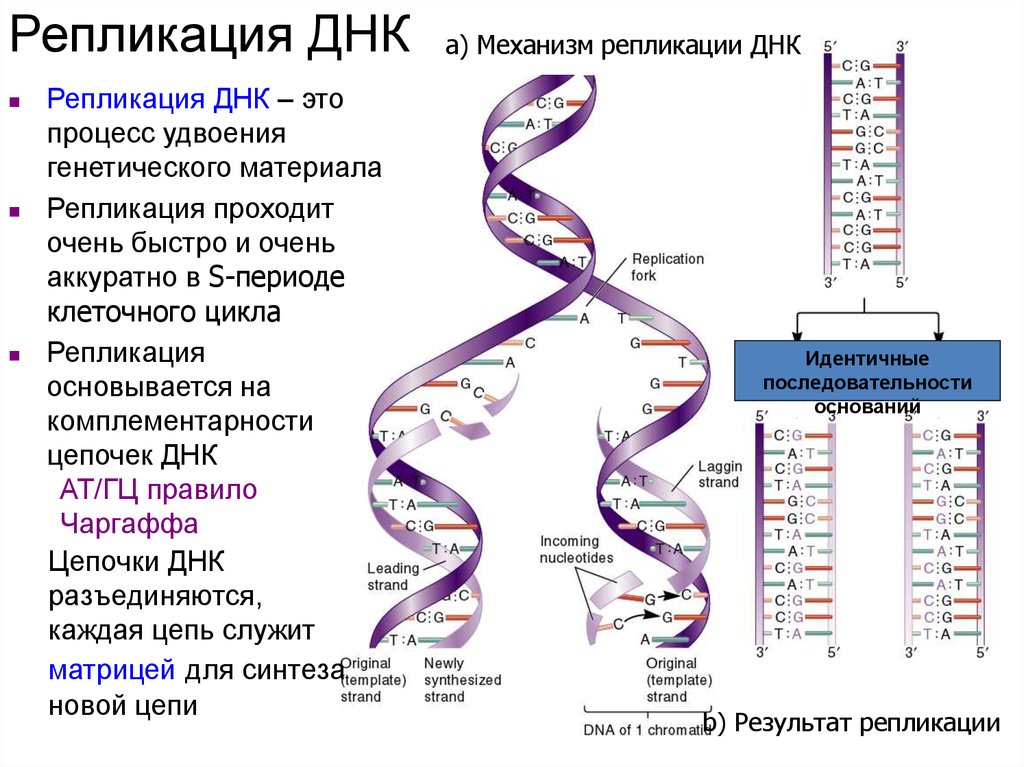 Чтобы сделать их видимыми, Макклинток разработала усовершенствованные методы окрашивания хромосом, благодаря чему первой описала морфологию десяти хромосом кукурузы. Самое значимое открытие на раннем этапе исследований Макклинток сделала в 1929 г. с помощью студентки Гарриет Крейтон (1909–2004). У одной линии кукурузы зерна были либо темные, либо светлые, что свидетельствовало о присутствии хромосомы с двумя разными аллелями (такую пару называют «гетерозиготной»). Нечто подобное предполагалось и раньше, в частности во время экспериментов Томаса Моргана с плодовыми мушками. Но тогда существование разных аллелей так и осталось лишь предположением. Макклинток и Крейтон пошли гораздо дальше: окрашивая хромосомы и изучая их под микроскопом, они обнаружили, что эти два типа кукурузы отличаются друг от друга за счет видимого различия между аллелями. У хромосомы растений с темными зернами имелся «бугорок», который отсутствовал в хромосоме растений со светлыми зернами. Это стало первым прямым эмпирическим доказательством того, что физические различия в хромосомах влияют на весь организм — на его фенотип.
Чтобы сделать их видимыми, Макклинток разработала усовершенствованные методы окрашивания хромосом, благодаря чему первой описала морфологию десяти хромосом кукурузы. Самое значимое открытие на раннем этапе исследований Макклинток сделала в 1929 г. с помощью студентки Гарриет Крейтон (1909–2004). У одной линии кукурузы зерна были либо темные, либо светлые, что свидетельствовало о присутствии хромосомы с двумя разными аллелями (такую пару называют «гетерозиготной»). Нечто подобное предполагалось и раньше, в частности во время экспериментов Томаса Моргана с плодовыми мушками. Но тогда существование разных аллелей так и осталось лишь предположением. Макклинток и Крейтон пошли гораздо дальше: окрашивая хромосомы и изучая их под микроскопом, они обнаружили, что эти два типа кукурузы отличаются друг от друга за счет видимого различия между аллелями. У хромосомы растений с темными зернами имелся «бугорок», который отсутствовал в хромосоме растений со светлыми зернами. Это стало первым прямым эмпирическим доказательством того, что физические различия в хромосомах влияют на весь организм — на его фенотип. Когда Морган посетил Корнеллский университет и узнал об этой работе, которая легла в основу диссертации Крейтон, он настоятельно рекомендовал опубликовать ее как можно скорее, и в 1931 г. она вышла в журнале Proceedings of the National Academy of Sciences. Всего через два года Морган получил Нобелевскую премию «за открытия, связанные с ролью хромосом в наследственности».
Когда Морган посетил Корнеллский университет и узнал об этой работе, которая легла в основу диссертации Крейтон, он настоятельно рекомендовал опубликовать ее как можно скорее, и в 1931 г. она вышла в журнале Proceedings of the National Academy of Sciences. Всего через два года Морган получил Нобелевскую премию «за открытия, связанные с ролью хромосом в наследственности».
Геном человека наконец расшифрован полностью
01 апреля 2022
16:54
Ольга Мурая
Теперь в человеческом геноме не осталось ни одного белого пятна.
Фото Pixabay.
Новые данные раскроют немало секретов функционирования организма и помогут лечить многие генетические заболевания, включая онкологические.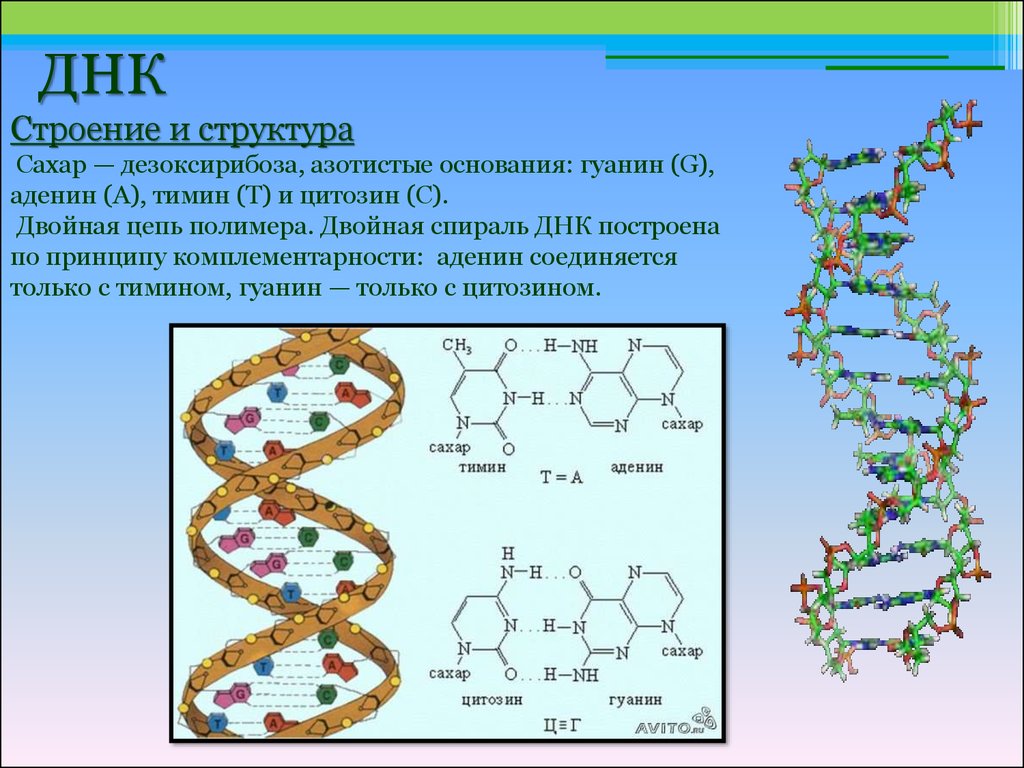
Учёные впервые расшифровали человеческий геном полностью. Это чёткая последовательность из трёх миллиардов оснований-«букв», в которой больше не осталось пробелов.
Такая точность имеет решающее значение для понимания того, каким разным может быть геном человека и какую роль генетика играет в различных заболеваниях.
Два десятилетия назад учёные уже заявляли о завершении проекта «Геном человека», но это сообщение было несколько преждевременным. Несомненно, это было важным достижением: исследователи всего мира получили доступ к ДНК-последовательности большинства генов в человеческом геноме (правда, речь шла о европеоидной расе).
Однако 8% генома человека всё ещё оставались не секвенированными («не прочитанными») и оставались неизученными. Это примерно 151 миллион пар оснований, разбросанных по всему геному, которые пренебрежительно описывались некоторыми исследователями как «мусорная ДНК» без чёткой функции.
Упущенные области включали почти идентичные повторяющиеся участки, содержащие функциональные гены, а также центромеры и теломеры — участки в середине и на концах хромосом соответственно. Эти области содержат длинные серии повторяющихся последовательностей.
Эти области содержат длинные серии повторяющихся последовательностей.
В то время повторы генетического кода считались не функциональными. Позднее стало понятно, что это не так.
Кроме того, более ранняя технология секвенирования ДНК позволяла считывать только относительно короткие серии последовательностей, что усложняло задачу «дешифровки» и склеивания отдельных «прочитанных» участков.
Благодаря секвенсорам ДНК нового поколения, исследователи могут декодировать гораздо более длинные фрагменты, до миллиона пар оснований или «букв» ДНК. Это означает, что расшифрованные «куски» намного крупнее и их легче собрать обратно в исходную последовательность.
Итак, воспользовавшись скачком технологий, большая международная группа учёных декодировала последние восемь процентов генома человека. Эти фрагменты нашего генома, как и ожидалось, содержат больше, чем просто мусор.
В новых данных были таинственные участки некодирующей ДНК: они не становятся шаблонами для белков, но всё же играют решающую роль во многих клеточных функциях.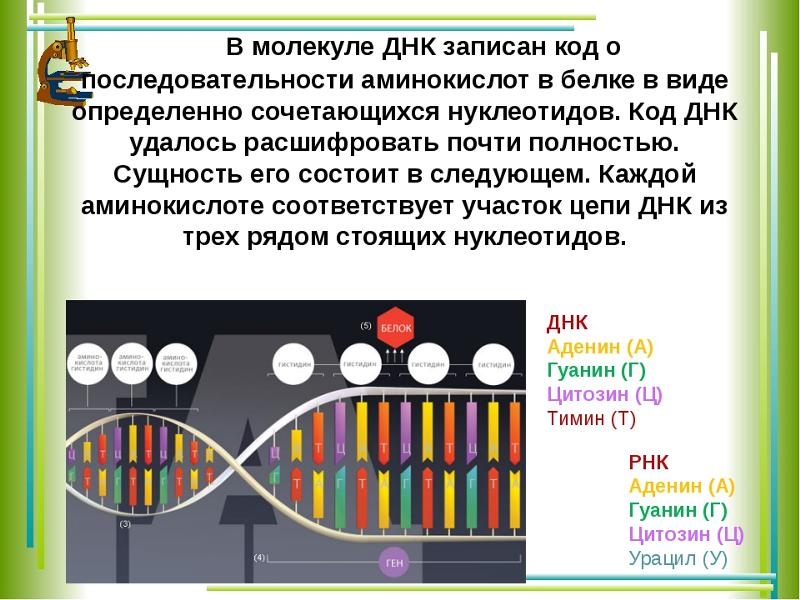 В частности, они могут лежать в основе состояний, при которых клеточное деление выходит из-под контроля (так появляется раковая опухоль).
В частности, они могут лежать в основе состояний, при которых клеточное деление выходит из-под контроля (так появляется раковая опухоль).
Эти недостающие восемь процентов подарили учёным совершенно новое понимание того, как делятся клетки. Это позволит исследователям изучить ряд болезней, причины которых раньше были неясны.
Проект «Геном человека» (Human Genome Project) дал учёным представление о большей части человеческого генома. Стало понятно, что подавляющая часть человеческих хромосом богата генами, слабо «упакована» и способна к интенсивному синтезу РНК — эти участки называются эухроматин.
Однако также в геноме есть настоящий лабиринт из плотно закрученной спирали гетерохроматина — он занимает меньшую часть генома и не производит белки.
У учёных поначалу были веские причины недооценивать гетерохроматин. Ведь эухроматиновые области содержат больше генов и их проще секвенировать.
Точно так же, как головоломку из непохожих частей легче собрать, чем головоломку, состоящую из одинаковых частей (представьте себе паззл, где все детали одного цвета), с инструментами геномики того времени эухроматическую ДНК было анализировать легче, чем её гетерохроматический аналог.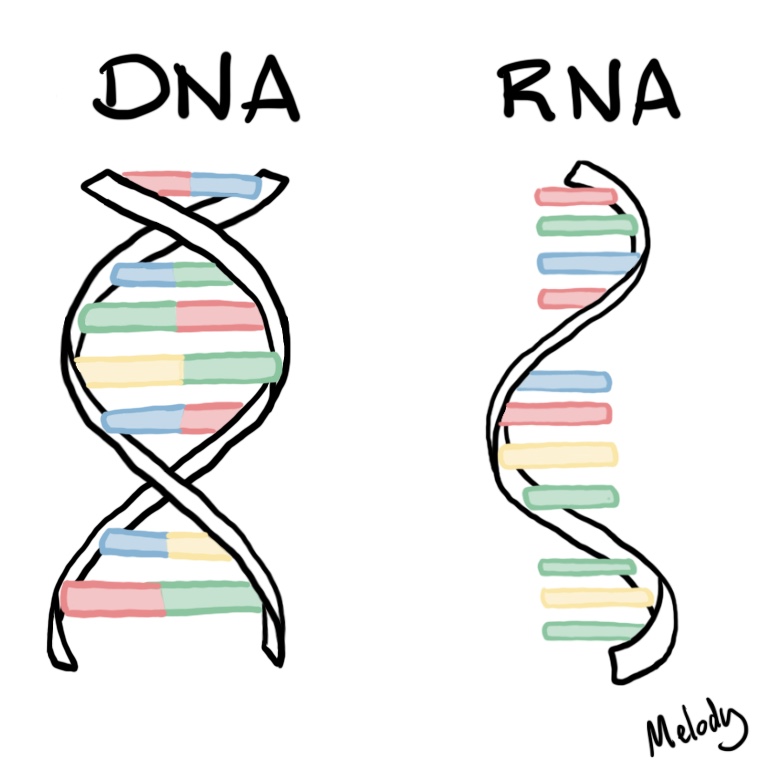
В результате генетики остались со значительным пробелом в знаниях о том, что управляет некоторыми основными клеточными функциями. Более того, даже не весь эухроматический геном был правильно секвенирован. Исследователям ещё нужно было исправить некоторые ошибки, такие как ложные повторы.
Новые инструменты позволили учёным наконец описать действительно полный человеческий геном — его эухроматиновые области были изменены и «очищены» от ошибок, а гетерохроматиновые области полностью отображены.
Теперь каждая пара оснований человеческого генома предстала перед исследователями во всех подробностях.
Авторы новой работы рассчитывают, что она даст совершенно новую информацию для исследований заболеваний, связанных с гетерохроматическим геномом. Главным из них является рак, связанный с аномалиями в центромерах — участках в пересечении хроматид (парных структурных элементов хромосомы).
Раковые клетки начинают бесконтрольно делиться, когда определённые гены гетерохроматиновых центромер работают чересчур активно. Соответственно, полное представление о геноме центромер может открыть двери для новых методов лечения онкологических состояний.
Соответственно, полное представление о геноме центромер может открыть двери для новых методов лечения онкологических состояний.
Новое прорывное исследование было опубликовано в авторитетном издании Science.
Напомним, ранее мы рассказывали о противоречивом проекте по сборке человеческого генома в лабораторных условиях, а ещё о том, как геном рыбки данио-рерио может помочь в изучении редких болезней.
Больше новостей из мира науки и медицины вы найдёте в разделах «Наука» и «Медицина» на медиаплатформе «Смотрим».
Подписывайтесь на наши страницы в соцсетях. «Смотрим» – Telegram и Яндекс.Дзен, Вести.Ru – Одноклассники, ВКонтакте, Яндекс.Дзен и Telegram.
наука
медицина
генетика
ДНК
рак
хромосома
общество
новости
Самое читаемое
геном
Генетические исследования
Такой подход позволяет оперативно получить максимально полную и объективную информацию о предрасположенности каждого отдельного пациента к определенным заболеваниям, своевременно выявить патологии плода у беременных и достоверно определять отцовство и степень родства. С каждым днем перечень генетических исследований расширяется. Это дает людям больше шансов на выздоровление и долголетие и позволяет лечащим врачам подбирать наиболее эффективные методы лечения.
С каждым днем перечень генетических исследований расширяется. Это дает людям больше шансов на выздоровление и долголетие и позволяет лечащим врачам подбирать наиболее эффективные методы лечения.
Генетические исследования: что это такое и в чем их особенность?
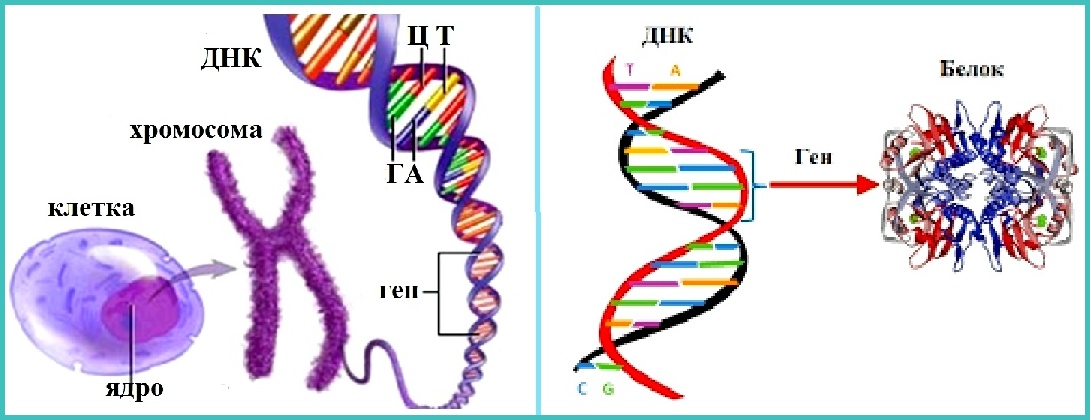
Каждый человек – обладатель уникального набора макромолекул дезоксирибонуклеиновой кислоты (ДНК). Он присутствует в каждой клетке живого организма, и именно он отвечает за хранение и передачу программы развития от прародителя к потомкам. Соответственно, изучив последовательность расположения нуклеотидов в двойной спирали ДНК, а также степень ее скрученности, можно расшифровать генетический код человека и:
-
диагностировать врожденные патологии; -
определить физические и интеллектуальные склонности; -
выявить мутации и полиморфизмы, вызванные наследственными или внешними факторами.
На данный момент уже известно почти 5 000 заболеваний, передающихся по наследству. Из них около 2 000 относятся к тяжелым патологиям. На основе расшифрованной транскрипции генетического кода врачи могут не только подбирать наиболее действенные методики медикаментозной терапии, но и выявить склонности к определенному заболеванию еще до проявления клинических признаков. Это дает возможность значительно облегчить протекание болезни или вообще предотвратить ее развитие.
Из них около 2 000 относятся к тяжелым патологиям. На основе расшифрованной транскрипции генетического кода врачи могут не только подбирать наиболее действенные методики медикаментозной терапии, но и выявить склонности к определенному заболеванию еще до проявления клинических признаков. Это дает возможность значительно облегчить протекание болезни или вообще предотвратить ее развитие.
Виды генетических исследований
Предиктивная медицина позволяет каждому получить информацию о своей склонности к болезням или избыточной массе. При этом многие мультифакторные патологии могут развиваться лишь при определенных условиях. Соответственно, упразднив риски, пациент может, если не избежать заболевания, то значительно минимизировать его клинические проявления. В Северо-западном центре доказательной медицины предлагается возможность сдать генетические анализы, наиболее широко востребованные в современной медицинской практике.
Выявление предрасположенности к заболеваниям
Онкология, дисфункция эндокринной системы, болезни сердечно-сосудистой системы, аутоиммунные и метаболические изменения в органах и мягких тканях – это далеко не полный список заболеваний, которые проявляются уже в той стадии, когда медикаментозное лечение может оказаться неэффективным. ДНК-скрининги позволяют выявить у пациентов врожденную склонность к тому или иному заболеванию задолго до его развития и обострения и подтвердить диагноз при нетипичной симптоматике. Также генетические тесты актуальны для выявления заболеваний с гендерными факторами: гемофилия, рак молочной железы, синдром Клайнфельтера и прочие.
ДНК-скрининги позволяют выявить у пациентов врожденную склонность к тому или иному заболеванию задолго до его развития и обострения и подтвердить диагноз при нетипичной симптоматике. Также генетические тесты актуальны для выявления заболеваний с гендерными факторами: гемофилия, рак молочной железы, синдром Клайнфельтера и прочие.
Установление родства
Вопросы крови – самые сложные. ДНК-текст позволяет подтвердить отцовство и кровное родство людей. Анализ может с высокой степенью достоверности не только установить первичную степень родства, но и установить являются ли люди родственниками второй линии:
-
родными и сводными братьями и сестрами; -
внуками, кузенами и племянниками; -
бабушками и дедушками; -
дядями и тетями.
Для проведения исследования необходим биоматериал двух предполагаемых родственников. В случае судебных разбирательств забор биологического материала должен проводиться в присутствии законных представителей ребенка и с соблюдением всех процессуальных норм.
Выявление хромосомных болезней плода
Данный анализ может проводиться по желанию родителей и по назначению врача. Входит в комплексную пренатальную диагностику, если:
-
возраст потенциальной мамы больше 32 лет; -
УЗИ показало отстающее/аномальное развитие плода; -
получены анализы с ненормативными отклонениями по биохимическим маркерам; -
имеются клинические основания, предполагающие вероятность повреждения 9, 13, 16, 18 и 21 хромосомы.
Скрининг направлен на исследование крови матери и позволяет еще в первом триместре выявить распространенные хромосомные аномалии плода или подтвердить его физиологически нормальное развитие. Проводится с 10 недели при одноплодной и многоплодной беременности. Позволяет избежать болезненных инвазивным процедур, представляющих риск для плода и матери: амниоцентеза, биопсии ворсин хориона и короцентеза.
Фармакогенетические исследования
Наиболее действенный инструмент, позволяющий определить насколько организм конкретного пациента откликается на медикаментозную терапию, ведь большинство фармацевтических препаратов имеют побочные эффекты и взаимодействуют с полиморфизмами в человеческом геноме.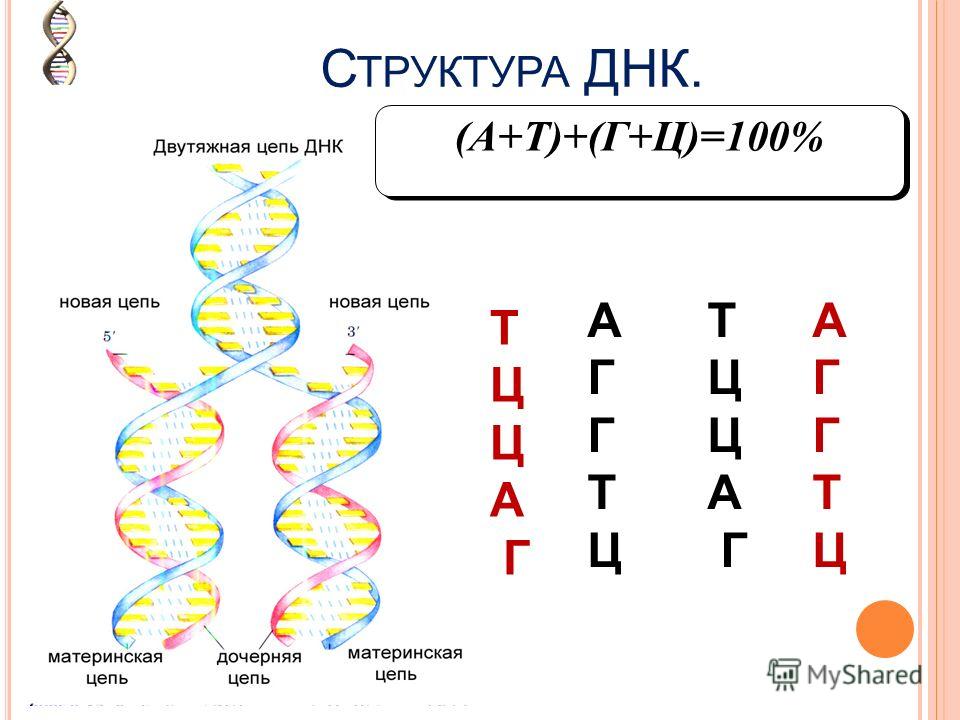 Данное исследование дает возможность:
Данное исследование дает возможность:
-
выявить индивидуальную непереносимость и гиперчувствительность к отдельным веществам; -
минимизировать побочные явления и исключить прием малоэффективных препаратов; -
с высокой долей достоверности предположить характер иммунного ответа на лечение; -
диагностировать мутагенез, спровоцированный медикаментозными средствами.
На сегодняшний момент фармакогенетические скрининги наиболее широко применимы в онкологии. Это обусловлено тем, что исследования особенностей генома пациента, уже ослабленного развитием злокачественных новообразований, дает возможность подобрать терапию, обеспечивающую максимальный эффект и дающую минимально возможную токсикацию организма. В эндокринологии, терапии вирусных гепатитов и кардиологии также активно используются фармакогенетические тесты. Причем не только для подбора препаратов, но и для отслеживания динамики лечения.
Генетический паспорт
Это цифровой банк данных о ДНК-профиле пациента. Кроме информации о структуре генома человека, генетический паспорт содержит интерпретирующую часть, в которой расшифрованы основные генетические показатели и маркеры. Количество последних может варьироваться и определяется самим пациентом.
Наличие генетического паспорта существенно упрощает выявление патологических рисков различного характера, включая наследственные болезни у детей и биологическую совместимость супругов, вероятность донорства. А также позволяет выполнять идентификацию личности по биологическим следам.
Генетические предрасположенности к заболеваниям
Уже ни у кого не вызывает сомнений тот факт, что наследственность играет ключевую роль при развитии многих заболеваний у человека как в детском, так и в зрелом возрасте. Но всегда ли болезни родителей передаются детям и внукам? Генетические скрининги помогут избежать ложных сомнений и выявить склонность к заболеваниям:
-
сердечно-сосудистым.
-
онкологическим. -
гипертоническим.
Кардио- и онкомаркеры достоверно выявляют мутации генов. В первом случае исследуют, как правило, мутагенез ACE, ADRB1, apoE, GPllb/llla, MTHFR,CCR2, во втором варианте исследуют более 200 генов. Поэтому если в вашей семье имели место такие заболевания у родителей, бабушек и дедушек, врачи рекомендуют пройти генетические исследования, для выявления предрасположенностей заболеваний, вызываемых полиморфизмом.
Также не стоит игнорировать ДНК-тесты людям, у которых нарушен сон, проявляется нервная раздражительность, стенокардия и систематические перепады давления. Это первичные симптомы, предвещающие не только ишемическую болезнь и гипертонию, но и инфаркт миокарда и инсульты головного мозга. К тому же скрининги позволят не только подтвердить патологическую наследственность, но и установить механизмы, вызывающие артериальную гипертонию и влияние PPAC на работу сердечно-сосудистой системы, функцию эндотелия и накопление в организм избыточной жидкости.
При явном лишнем или недостаточном весе, хронической усталости, инфантильности к физическим нагрузкам и головных болях стоит пройти обследование на сахарный диабет.
Если подтвердится наследственная предрасположенность к данному заболеванию, то это позволит:
- выявить аномалии инсулина и его трансмембранного рецептора;
-
подобрать наиболее эффективную медикаментозную терапию; -
организовать рациональное питание с учетом генетических особенностей организма.
Таким образом, ДНК-тесты помогут выявить еще на бессимптомной стадии онкологические, сердечно-сосудистые и эндокринные заболевания. А также помогут установить наследственный или приобретенных характер болезни и упразднить негативные факторы, усугубляющие развитие и течение заболевания.
Методы проведения исследований
В нашем центре установлено современное высокотехнологичное оборудование и широко используются передовые мировые методики. Это дает возможность нам оперативно и на высоком качественном уровне выполнять многочисленные лабораторные исследования и генетические тесты.
Это дает возможность нам оперативно и на высоком качественном уровне выполнять многочисленные лабораторные исследования и генетические тесты.
-
Химический синтез ДНК. Наиболее важный метод молекулярных исследований. Характеризует белковую и нуклеиновую структуру и реакционную способность биополимеров. Проводится в несколько этапов в условиях автоматизированного цикла, поэтому занимает продолжительное количество времени и отличается высокой чистотой результатов. -
Рестрикция. Рутинный метод, основанный на расщеплении ДНК и изучении рестрикцидных эндонуклеаз. Позволяет получить данные об отдельных фрагментах и последовательностях расположения нуклеотидов и выявить внутриклеточные защитные механизмы, в том числе и реакцию чужеродный белок. Используется в фармакогенетике и диагностики врожденных и приобретенных патологий. -
ПЦР. Полимеразная цепная реакция – молекулярно-биологический метод исследования. Обеспечивает высокую аналитическую точность и позволяет успешно проводить амплификацию и сращивание фрагментов ДНК. ПЦР применима, как для подтверждения кровного родства, так и для выявления предрасположенностей к различным заболеваниям.
Обеспечивает высокую аналитическую точность и позволяет успешно проводить амплификацию и сращивание фрагментов ДНК. ПЦР применима, как для подтверждения кровного родства, так и для выявления предрасположенностей к различным заболеваниям.
-
Гибридизация с использованием ДНК-зондов. Реакционный метод, направленный на изучение структурных последовательностей в ДНК и определение числа отдельных нуклеотидных фрагментов. Введение специальных маркеров (радиоактивные зонды или пластинки с иммобилизованными ДНК-зондами) позволяет в процессе гибридизации выявить отдельные гены и их многочисленные фрагменты-копии, а также транскрибируемые и нетраскрибируемые ДНК. Результаты исследования позволяют судить о дифференцировке клеток у эмбриона.
Исследуемый материал
Чаще всего генетические скрининги проводятся на венозной крови пациента и мягком соскобе буккального эпителия (слизистая оболочка щеки). Также исследования проводятся на слюне, сперме, живом волосе и ногтевой пластине.
Также исследования проводятся на слюне, сперме, живом волосе и ногтевой пластине.
Подготовка к анализу
Особой подготовки для проведения генетических исследований не требуется. Биологический материал можно сдавать в любое время суток, натощак и после еды. Но все же для достоверности результата специалисты рекомендуют отложить исследования больным вирусными и инфекционными заболеваниями, а также пациентам в день прохождения физиопроцедур и рентгенографической диагностики.
Где сдать анализы
Северо-Западный центр доказательной медицины обладает обширной структурой филиалов и лабораторных терминалов, что дает возможность любому желающему сдать ДНК-анализы в удобное для него время. Вы также можете заказать выезд специалиста на адресную точку. Он прибудет в указанное время домой или офис с набором для забора биоматериала и проведет все манипуляции профессионально и безболезненно даже для новорожденного.
Обращайтесь. Мы используем уникальную систему кодирования биологического материала и гарантируем достоверность и полную конфиденциальность исследований.
Мы используем уникальную систему кодирования биологического материала и гарантируем достоверность и полную конфиденциальность исследований.
Сможем ли мы когда-нибудь полностью расшифровать код жизни?
Вот 12-й отрывок из моей колонки BBC
В 2001 году проект «Геном человека» предоставил нам почти полный черновик из 3 миллиардов букв нашей ДНК. Мы присоединились к элитному клубу видов с последовательностями их геномов, который растет с каждым месяцем.
Эти геномы содержат информацию, необходимую для создания соответствующих владельцев, но эту информацию мы все еще пытаемся разобрать. На сегодняшний день никто не может взять код из генов организма и предсказать все детали его формы, поведения, развития, физиологии — совокупность признаков, известную как его фенотип. И тем не менее, основа этих деталей есть, и все они запечатлены в отрезках As, Cs, Gs и Ts. «Клетки довольно надежно знают, как это делать», — говорит Леонид Кругляк из Принстонского университета. «Каждый раз, когда вы начинаете с генома курицы, вы получаете курицу, и каждый раз, когда вы начинаете с генома слона, вы получаете слона».
«Каждый раз, когда вы начинаете с генома курицы, вы получаете курицу, и каждый раз, когда вы начинаете с генома слона, вы получаете слона».
По мере развития наших технологий и понимания, сможем ли мы, в конце концов, взглянуть на груду необработанных последовательностей ДНК и собрать всю работу организма, которому они принадлежат? Точно так же, как физики могут использовать законы механики для предсказания движения объекта, могут ли биологи использовать фундаментальные идеи генетики и молекулярной биологии для предсказания черт и недостатков тела исключительно на основе его генов? Можем ли мы поместить геном в черный ящик и распечатать изображение человека? Или муха? Или мышь?
Нелегко. В сложных организмах некоторые признаки можно проследить до конкретных генов. Если, например, вы смотрите на конкретный вариант гена MC1R, скорее всего, перед вами млекопитающее с рыжими волосами. Действительно, люди предсказали, что некоторые неандертальцы были рыжими именно по этой причине.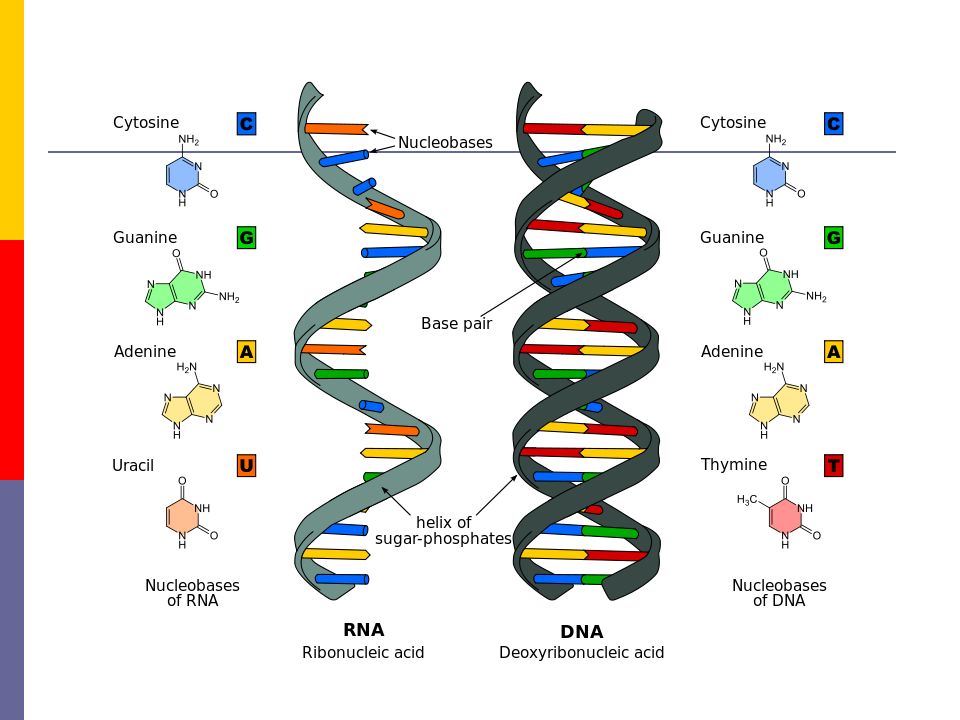 «Но помимо этого, предсказывая [если что-то] мышь, кит или броненосец, мы все равно не преуспеем», — говорит Кругляк.
«Но помимо этого, предсказывая [если что-то] мышь, кит или броненосец, мы все равно не преуспеем», — говорит Кругляк.
[Бернхард Палссон из Калифорнийского университета в Сан-Диего соглашается. «Секвенирование шерстистого мамонта не предскажет его свойства», — говорит он. «Но вы могли бы добиться большего успеха с бактериями». С более простыми и меньшими геномами это теоретически должно облегчить предсказание основных особенностей их метаболизма, а также того, растут ли они с использованием кислорода или без него. Несмотря на то, что мы можем секвенировать бактериальный геном менее чем за день и всего за 50 фунтов стерлингов, нам все равно будет сложно определить важные признаки, например, насколько хорошо болезнетворный микроб заражает своего хозяина.
Трудно даже найти все гены в маленьком геноме. Ранее в этом году ученые обнаружили новый ген в вирусе гриппа, геном которого состоит всего из 14 000 букв (достаточно мало, чтобы поместиться в 100 твитов), и его секвенировали снова и снова.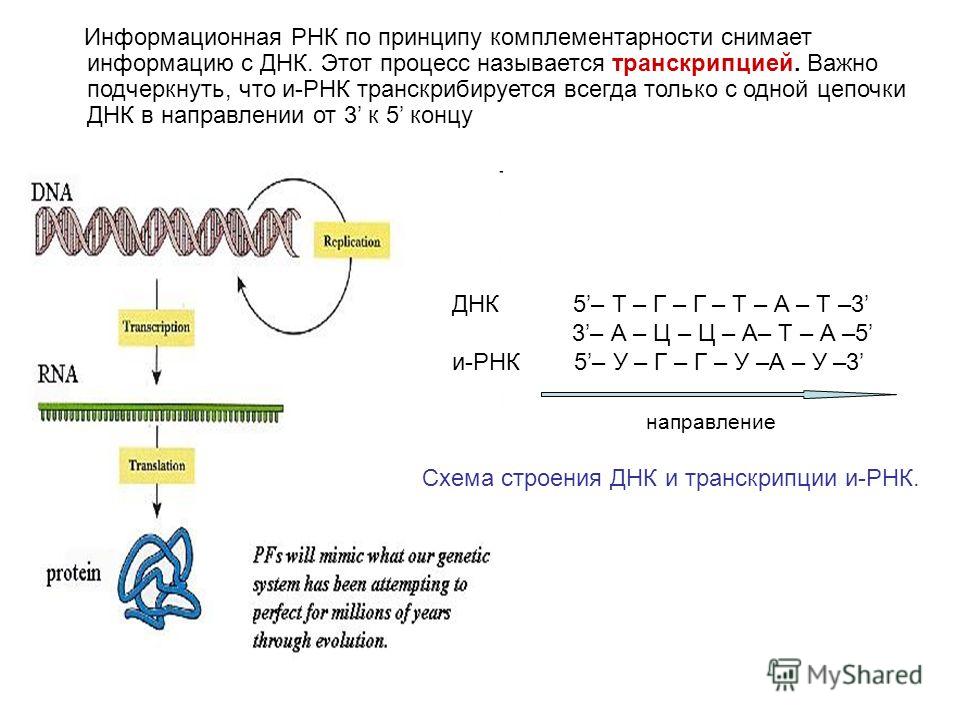 Неудивительно, что наш собственный геном с 3 миллиардами букв полон ошибок и пробелов, несмотря на то, что он якобы «полный». В мае другая группа показала, что в эталонном геноме человека отсутствует ген, который, возможно, повлиял на эволюцию нашего большого мозга. «Нет генома, который был бы полностью изучен даже с точки зрения входящих в него генов», — говорит Маркус Коверт из Стэнфордского университета. «Как правило, функция от четвертого до пятого генов неизвестна».
Неудивительно, что наш собственный геном с 3 миллиардами букв полон ошибок и пробелов, несмотря на то, что он якобы «полный». В мае другая группа показала, что в эталонном геноме человека отсутствует ген, который, возможно, повлиял на эволюцию нашего большого мозга. «Нет генома, который был бы полностью изучен даже с точки зрения входящих в него генов», — говорит Маркус Коверт из Стэнфордского университета. «Как правило, функция от четвертого до пятого генов неизвестна».
Гены кодируют инструкции по сборке белков, молекулярных машин, которые выполняют жизненно важные функции в наших клетках. Белок — это длинная цепь аминокислот, и мы можем предсказать эту цепочку с идеальной точностью. Но цепь также складывается, как оригами, в сложную трехмерную форму, и форма диктует все, что делает белок, от химических реакций, которые он ускоряет, до других молекул, к которым он прилипает. Распознавание этих форм — кропотливая работа, включающая выращивание чистых кристаллов белков и бомбардировку их рентгеновскими лучами. Несмотря на наличие сотен таких структур, даже самые мощные компьютеры с трудом могут точно вычислить форму белка на основе последовательностей ДНК, которые их производят. «Я считаю этот вызов удушающим, — говорит Палссон.
Несмотря на наличие сотен таких структур, даже самые мощные компьютеры с трудом могут точно вычислить форму белка на основе последовательностей ДНК, которые их производят. «Я считаю этот вызов удушающим, — говорит Палссон.
Гены, кодирующие белки, составляют всего 1,5 процента нашего генома. Остальное включает в себя много того, что считается бесполезным мусором, не имеющим заметной функции. Но он также содержит регуляторные последовательности, которые контролируют, когда, где и как используются наши гены. Нам нужно определить их, если мы когда-либо собираемся предсказать, как геном приводит к живому, дышащему организму. Технология для этого разрабатывается, и проект ENCODE — Энциклопедия элементов ДНК — нашел ей хорошее применение, составив каталог различных регуляторных последовательностей в нашем собственном геноме. Но в ENCODE участвовало 442 ученых, интенсивно проводивших эксперименты в течение десятилетия, и даже его беспрецедентный каталог неполный.
И даже если у нас есть вся эта информация — каждый ген, структура белка и регуляторная последовательность — нам все равно нужно выяснить, как все это работает вместе и как оно взаимодействует с окружающей средой. Нам потребуются закономерности: когда и где активируются различные гены по мере развития организма. Нам нужны тайминги: как быстро происходят химические реакции в клетке и как белки ускоряют этот процесс.
Нам потребуются закономерности: когда и где активируются различные гены по мере развития организма. Нам нужны тайминги: как быстро происходят химические реакции в клетке и как белки ускоряют этот процесс.
Здесь наши метафоры подвели нас. Авторы научных статей любят сравнивать геном с учебником или чертежом. Это говорит о том, что он хранит информацию, но приукрашивает его жужжащую, динамичную природу — белки стыкуются и выключаются, чтобы контролировать активность генов, огромные участки ДНК, которые складываются и разворачиваются, открывая или скрывая свои последовательности, паразитические прыгающие гены, которые копируют себя и прыгать по всему геному… Ни один из наших информационных хранилищ — ни ноты, ни книги рецептов — не является таким запутанным.
Это не остановило некоторых ученых от попыток смоделировать эту сложность. В июле Коверт объявил, что создал грубую симуляцию целого организма — одноклеточного микроба под названием Mycoplasma genitalium. Модель Коверта моделирует, как используются все 525 генов бактерии, белки, которые они производят, как быстро действуют белки, как они взаимодействуют и многое другое.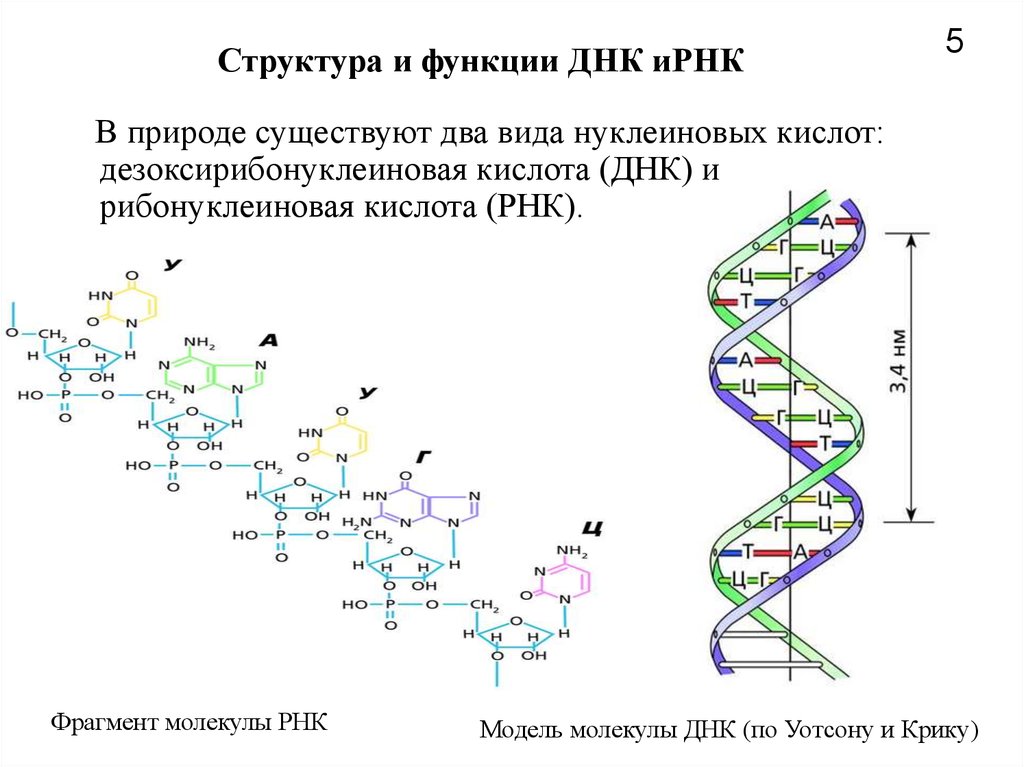 Он не совсем точен, но отражает большую часть образа жизни M.genitalium . Двое коллег написали, что проект «следует похвалить только за его смелость».
Он не совсем точен, но отражает большую часть образа жизни M.genitalium . Двое коллег написали, что проект «следует похвалить только за его смелость».
Тем не менее, стимуляция была достигнута с большим трудом. При 525 генах M.genitalium имеет наименьший геном за пределами вирусов (для сравнения, у людей 20-25 000 генов), урезанный до крайнего минимализма своей жизнью в качестве паразита. Это может быть одно из самых простых живых существ, которые мы можем себе представить, но для моделирования этого микроба потребовалось около 1900 экспериментов и множество заимствованных знаний. «Примерно половина нашей модели основана на экспериментах, проведенных на других бактериях», — говорит Коверт. «Не может быть, чтобы [геном] сам по себе был предсказательным».
Тайное также необходимо учитывать среду обитания M.genitalium . Он живет только в стабильной среде нашей уретры, без света и при постоянной температуре. «Но даже тогда он иногда видит, как иммунная система идет за ним, и нет никакого способа смоделировать это», — говорит Коверт.
Влияние окружающей среды становится еще более важным для более сложных свободноживущих организмов. Температура и кислотность влияют на поведение белков. Пища, которую потребляет организм, поражающие его инфекции и конкуренты, с которыми он взаимодействует, — все это влияет на то, как он развивается и как используются его гены. Многие из этих факторов оставляют следы на самом геноме — «эпигенетические» метки, которые диктуют размещение генов и могут передаваться следующему поколению. Окружение явно имеет значение. Делая предсказания на основе генома, слон в комнате — это комната.
Тем не менее, подход Коверта указывает путь вперед — рассвет виртуальной биологии. Вы можете секвенировать геном, построить модель или симуляцию, сравнить ее с реальным организмом, устранить недостатки модели и исправить эти недостатки с помощью дальнейших экспериментов. Промыть и повторить. В конце концов, у вас будет зоопарк моделей. Если у вас есть новый геном, начните со сравнения его с одной из существующих симуляций и действуйте исходя из этого. Это не совсем тот черный ящик, который мы себе представляли, но хоть что-то.
Это не совсем тот черный ящик, который мы себе представляли, но хоть что-то.
Если ученые пытаются найти грибы или бактерии, которые могут выполнять определенную работу — скажем, очищать опасные отходы, производить определенные питательные вещества — было бы полезно идентифицировать такие организмы только по их геномам. «Мы можем использовать секвенирование для поиска фенотипов, соответствующих нашей цели», — говорит Нильсен. И если эта цель состоит в искусственном создании новых форм жизни, как пытаются сделать такие люди, как Крейг Вентер, то предсказание становится необходимым, а не желаемым. «Вы будете беспокоиться о побочных эффектах и вам понадобится вычислительный инструмент, который поможет их избежать», — говорит Коверт. «Когда мы говорим о рациональном проектировании нового организма, вы хотите предсказать фенотип».
«Сомневаюсь, что мы когда-нибудь добьемся стопроцентного предсказания, потому что биология очень изменчива», — говорит Йенс Нильсен из Технологического университета Чалмерса в Швеции. Но Кругляк добавляет: «Я не думаю, что в принципе есть какие-то шоу-стопы, которые сделали бы это невозможным. Просто потребовалось бы гораздо больше работы и дальнейшего технологического развития, помимо того, что мы можем сделать сегодня».
Но Кругляк добавляет: «Я не думаю, что в принципе есть какие-то шоу-стопы, которые сделали бы это невозможным. Просто потребовалось бы гораздо больше работы и дальнейшего технологического развития, помимо того, что мы можем сделать сегодня».
Еще из «Будем ли мы когда-нибудь…?»
- Будем ли мы когда-нибудь… предсказывать землетрясения?
- Будем ли мы когда-нибудь… фотосинтезировать, как растения?
- Сможем ли мы когда-нибудь пробежать 100 метров за 9 секунд?
- Сможем ли мы когда-нибудь клонировать мамонта?
- Будет ли у нас когда-нибудь вакцина против ВИЧ?
- Будем ли мы лечить болезни до рождения?
- Будет ли у нас когда-нибудь надежный детектор лжи?
- Поговорим ли мы когда-нибудь с дельфинами?
- Вернем ли мы когда-нибудь зрение слепым?
- Будем ли мы когда-нибудь выращивать органы?
- Сможем ли мы когда-нибудь расшифровать сны?
Эксклюзивный контент для подписчиков
Почему люди так одержимы Марсом?
Как вирусы формируют наш мир
Эпоха собачьих бегов в США подходит к концу будет исследовать красную планету
Почему люди так одержимы Марсом?
Как вирусы формируют наш мир
Эра собачьих бегов в США подходит к концу
Узнайте, как люди представляли себе жизнь на Марсе на протяжении всей истории
Узнайте, как новый марсоход НАСА будет исследовать красную планету
5
Неужели люди настолько одержимы Марсом?
Как вирусы формируют наш мир
Эпоха собачьих бегов в США подходит к концу
Узнайте, как люди представляли себе жизнь на Марсе на протяжении всей истории
Узнайте, как новый марсоход НАСА будет исследовать красную планету
Подробнее
Расшифровка ДНК | Penn State University
Выглядит как безобидная тарабарщина, пока вы не узнаете, что это ДНК-сигнатура болезни Гентингтона.
«У многих людей, казненных на суде над ведьмами в Салеме, могла быть болезнь Хантингтона», — сказал Роберт Симпсон. Молекулярный биолог и врач Симпсон прочитал первую в этом году лекцию Frontiers of Science в Penn State на тему «Как исследования ДНК работают в медицине, праве и науке».
У матери народного певца Вуди Гатри была болезнь: ее лицо дергалось, губы рычали, а зубы показывались, писал Гатри. Она начинала тихим ворчащим голосом и постепенно начинала говорить так громко, как только могло выдержать ее горло; и ее руки поднимались по бокам, затем за спиной и двигались всевозможными изгибами. «Описание матери Вуди, безусловно, соответствует представлению раннего жителя Новой Англии о ком-то, одержимом духами», — сказал Симпсон.
Исследования ДНК стерли клеймо таких наследственных болезней. Понимание вовлеченных мутаций может привести к улучшению лечения, даже к терапии для исправления генетических дефектов. Тесты, разработанные для изучения генов, меняют историю и законы.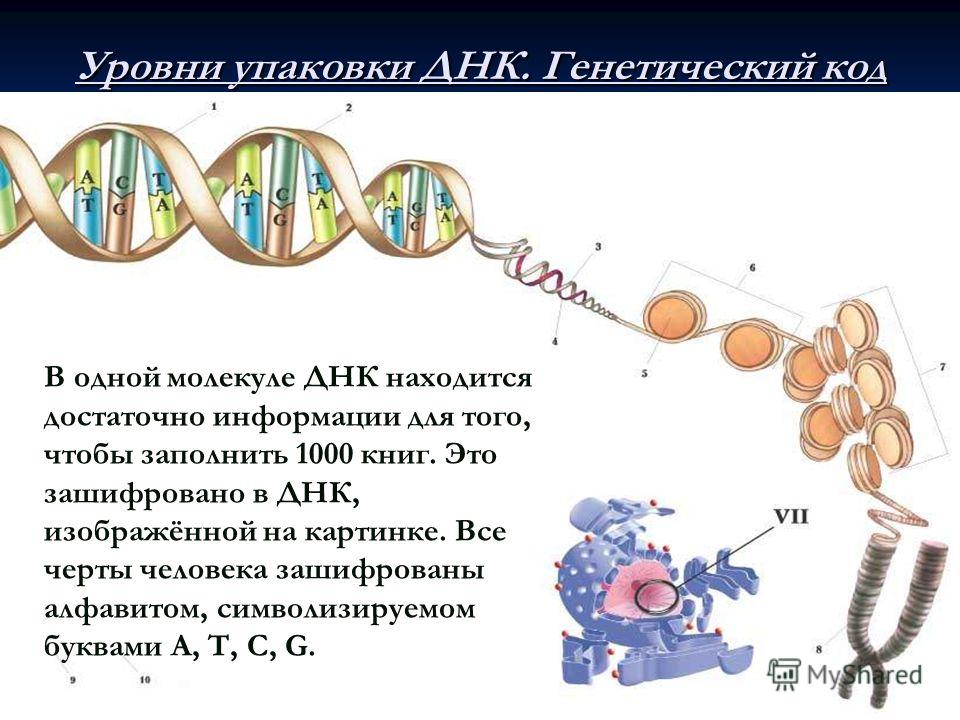 Тестирование ДНК осудило преступников на основании волос. Он нашел чернокожих потомков для Томаса Джефферсона. И связал некоего президента с запачканным синим платьем.
Тестирование ДНК осудило преступников на основании волос. Он нашел чернокожих потомков для Томаса Джефферсона. И связал некоего президента с запачканным синим платьем.
«Близится большая революция, — сказал Симпсон, — сравнимая с тем, когда появился микроскоп».
Как работает ДНК «Удивительной статистикой человеческого генома, — сказал он, — является длина уникальной последовательности. Оказывается, она составляет от 16 до 20 пар оснований, или примерно полдюйма нити, вытянутой из Нью-Йорка. Йорк на западное побережье».
Если вы превратите эту нить в беговую молнию, пары оснований будут зубцами. Для молнии размером с геном человека потребуется около 3 миллиардов зубов. Сверните его в шар диаметром 50 футов, и вы получите представление о том, как ваши гены — все 100 000 — втиснуты в 23 пары хромосом в ядре каждой из ваших клеток.
Эти аналогии, длинная нить и спиральная застежка-молния, дают представление о том, насколько огромен, тонок и труден для понимания геном человека.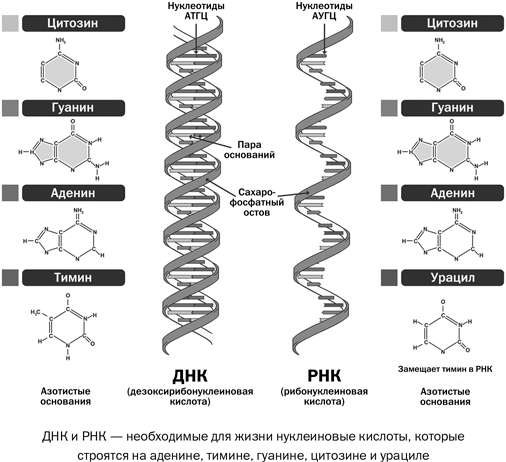 Но чтобы понять, как расшифровать содержащуюся в нем информацию, нужно думать о ней как о книге.
Но чтобы понять, как расшифровать содержащуюся в нем информацию, нужно думать о ней как о книге.
«Измеряется как манхэттенские телефонные книги, каждая из которых содержит около 1000 страниц, напечатанных шрифтом из 10 пунктов, — сказал Симпсон, — геном бактерии E. coli составляет примерно треть книги. Пекарские дрожжи, которыми я специализируюсь, целую книгу. Геном человека займет двести книг».
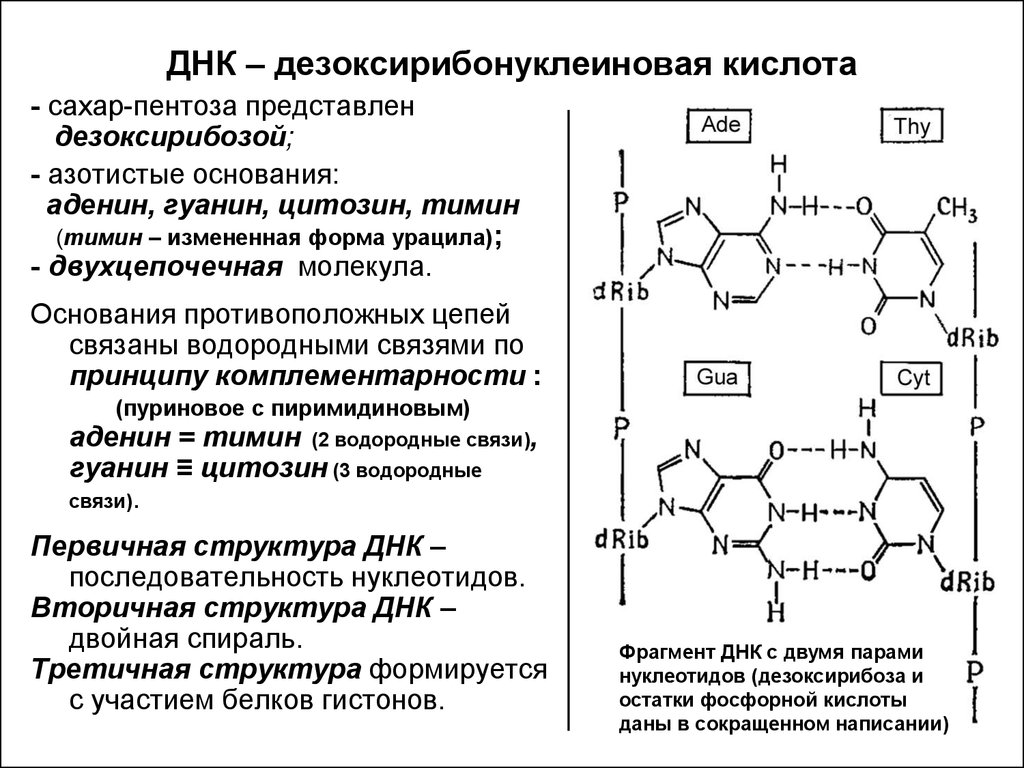
Эти 200 000 страниц генетической информации, кодирующие все, от цвета ваших глаз до вероятности рака толстой кишки, написаны на языке ДНК. По структуре это двойная спираль: две нити сахаров и фосфатов, связанные парами четырех оснований, А, Т, С или G. Четыре основания составляют алфавит. Каждое слово на этом языке состоит из трех букв и обозначает одну аминокислоту. Каждое предложение, которое может состоять из многих сотен слов, является геном. Но чтобы читать геном человека как книгу, ученым еще предстоит выяснить грамматику: где заканчиваются генетические предложения, что такое существительное и что такое глагол и что именно они означают?
Две вещи делают эту задачу возможной:
Во-первых, это спаривание оснований. Основания ДНК соединяются очень специфическим образом. A соединяется только с T, тогда как C соединяется только с G. Если вы знаете последовательность оснований на одной цепи распакованного фрагмента ДНК, вы можете легко угадать последовательность на другой цепи. Кроме того, отдельные нити ДНК липкие. Подобно магнитам, они найдут свое дополнение и соберутся вместе, если смогут.
Основания ДНК соединяются очень специфическим образом. A соединяется только с T, тогда как C соединяется только с G. Если вы знаете последовательность оснований на одной цепи распакованного фрагмента ДНК, вы можете легко угадать последовательность на другой цепи. Кроме того, отдельные нити ДНК липкие. Подобно магнитам, они найдут свое дополнение и соберутся вместе, если смогут.
Во-вторых, как указал Симпсон, каждый набор из 16–20 основ (больше слова, но меньше предложения) уникален. Это как если бы во всех произведениях Шекспира барду только один раз сказали быть или не быть.
Но так же, как произведения Шекспира отличаются от произведений Стивена Кинга, точная последовательность A-T-C-G генома одного человека не будет такой же, как у другого человека. Эти полиморфизмы могут привести к физическим различиям (голубые глаза против карих). Они могут вызвать заболевание или увеличить риск его возникновения. Но многие из них так же неуловимы, как разница в группе крови. Десять вариаций или аллелей можно найти в одном и том же месте ДНК десяти человек, и все они нормальны.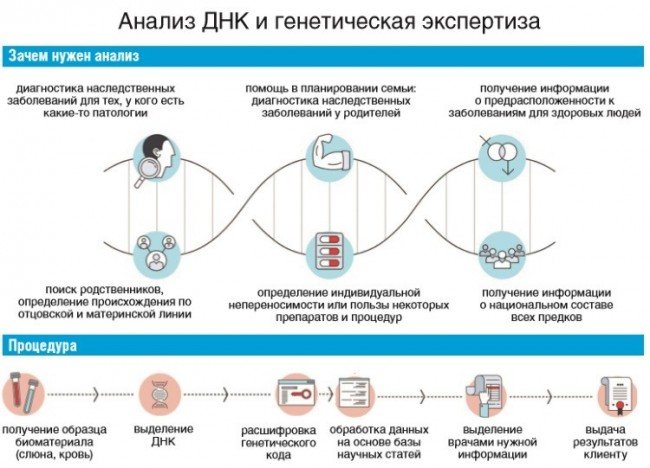
Этот факт делает возможной ДНК-дактилоскопию, используемую экспертами-криминалистами для раскрытия уголовных дел. Это также позволяет исследователям ДНК находить ген, не зная точно, что он делает. Чтобы найти ген Хантингтона, исследователи взяли образцы ДНК большой венесуэльской семьи, у которой было много пациентов с болезнью Хантингтона. Используя ферменты, которые разрезают ДНК всякий раз, когда они находят определенную короткую последовательность, исследователи разрезали ДНК до тех пор, пока она не стала похожа на тарелку спагетти. Они рассортировали макароны по длине и увидели, что структура фрагментов ДНК у людей с заболеванием отличается от тех, у кого его нет. Связав закономерности с генеалогическим древом пациентов, исследователи увидели, что у всех людей с этим заболеванием был один очень длинный фрагмент. Этот фрагмент на хромосоме 4 должен содержать мутацию — все эти повторы CAG.
Генетический Гутенберг На секвенирование гена болезни Хантингтона ушло 10 лет.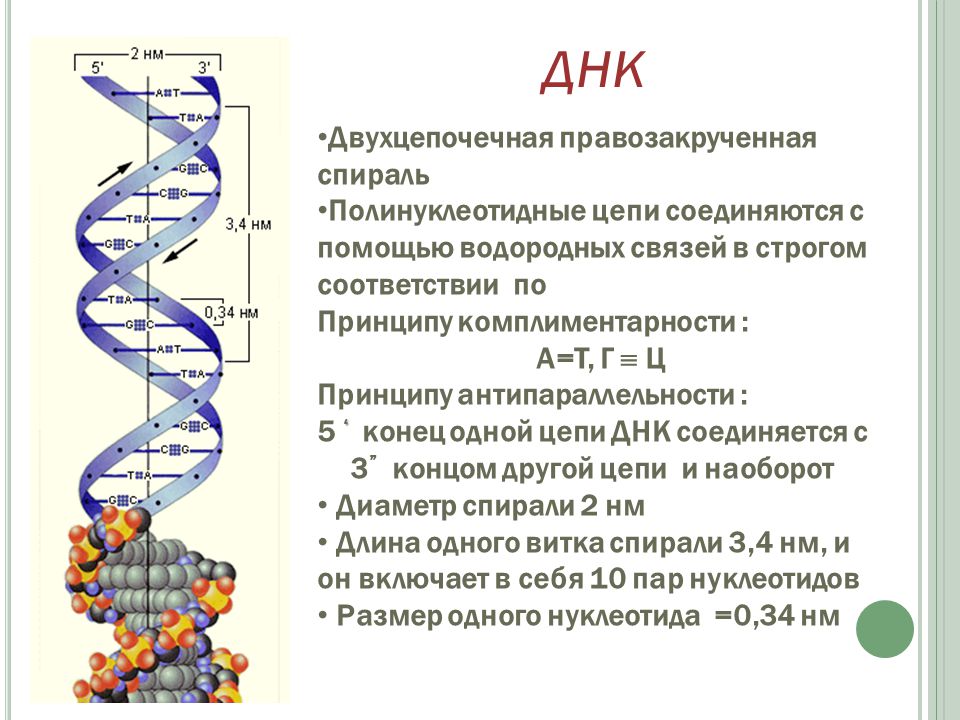 Теперь расшифровка ДНК стала быстрее благодаря методу, называемому ПЦР или полимеразной цепной реакцией.
Теперь расшифровка ДНК стала быстрее благодаря методу, называемому ПЦР или полимеразной цепной реакцией.
ПЦР для генов то же, что пресс Гутенберга для письменного слова. Все, что требуется, — это тепло, запатентованный фермент (первоначально найденный в горячем источнике в Йеллоустонском национальном парке) и два праймера, биты ДНК длиной от 16 до 20 оснований, которые примыкают к гену, который вы хотите скопировать. Смешайте праймеры с образцом ДНК. Добавьте свободные нуклеотиды, каждый из которых представляет собой основание со своим каркасом из сахаров и фосфатов, и фермент горячего источника, известный как taq-полимераза. Нагрейте почти до кипения: ДНК разделится на две отдельные нити. По мере остывания праймеры, будучи небольшими и быстрыми, прилипают до того, как две нити снова застегиваются. Затем в работу вступает taq-полимераза.
Полимераза – это обычный фермент, входящий в состав клеточного набора для восстановления. Taq-полимераза из бактерии Thermus aquaticus, обитающей в горячих источниках, лучше всего подходит для ПЦР, потому что она работает в горячей воде, где застывает большинство белков.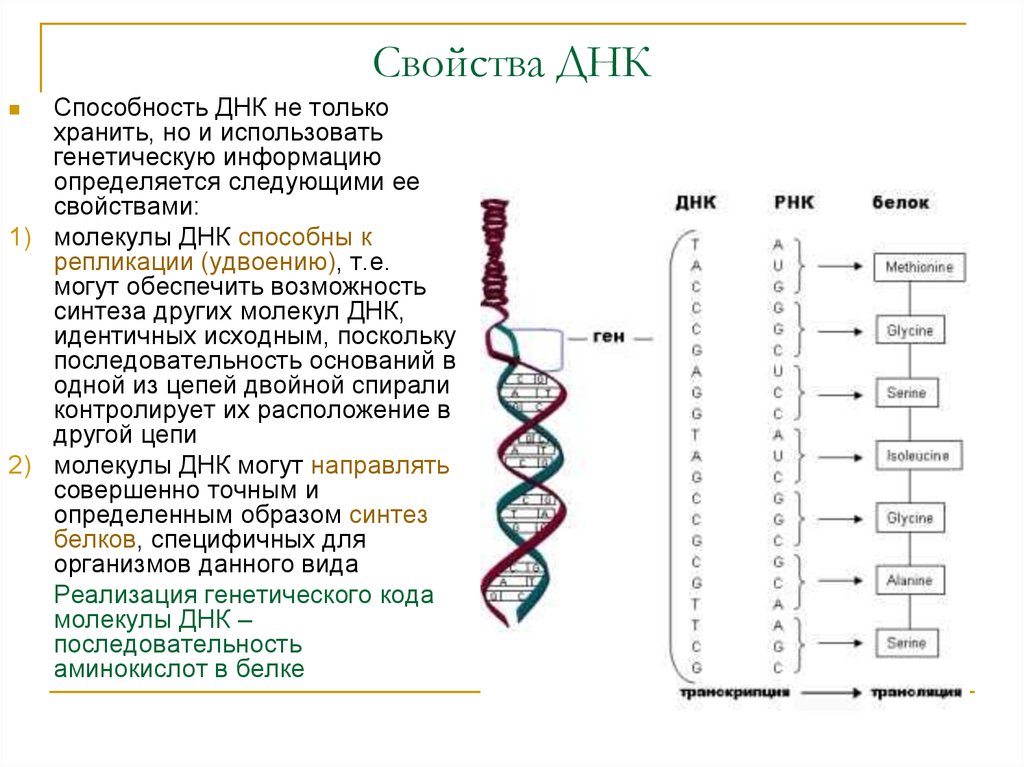 Работа полимеразы состоит в том, чтобы сделать полимер — связать молекулы в цепь. Начиная с одного праймера, он проходит по цепи ДНК, идентифицирует каждое основание, находит его партнера среди свободных нуклеотидов и связывает их вместе. Когда он доходит до второго праймера, он останавливается. Теперь вместо одного двухцепочечного фрагмента ДНК у нас есть два. «Каждый раз, когда мы повторяем этот процесс, — сказал Симпсон, — новый продукт соединяется с исходной молекулой, которую нужно копировать». Это цепная реакция. «Цифры поразительны: 25 циклов могут произвести более 30 миллионов копий».
Работа полимеразы состоит в том, чтобы сделать полимер — связать молекулы в цепь. Начиная с одного праймера, он проходит по цепи ДНК, идентифицирует каждое основание, находит его партнера среди свободных нуклеотидов и связывает их вместе. Когда он доходит до второго праймера, он останавливается. Теперь вместо одного двухцепочечного фрагмента ДНК у нас есть два. «Каждый раз, когда мы повторяем этот процесс, — сказал Симпсон, — новый продукт соединяется с исходной молекулой, которую нужно копировать». Это цепная реакция. «Цифры поразительны: 25 циклов могут произвести более 30 миллионов копий».
До ПЦР, чтобы получить достаточное количество копий гена для его секвенирования, его нужно было клонировать. Сначала вы встроили ген в плазмидный вектор (небольшое кольцо ДНК бактерии). Вы поместили плазмиду обратно в бактериальную клетку и позволили ей вырасти в колонию, а затем извлекли человеческую ДНК.
Клонирование всегда было медленным шагом в исследованиях ДНК. Это также заняло много места в лаборатории: чтобы охватить весь геном человека, потребовался бы миллион колоний бактерий, каждая из которых росла бы в своей чашке Петри. «С помощью ПЦР, — сказал Симпсон, — вы можете сохранить ген в виде кода в компьютере. Любой может получить доступ к информации и синтезировать ДНК».
«С помощью ПЦР, — сказал Симпсон, — вы можете сохранить ген в виде кода в компьютере. Любой может получить доступ к информации и синтезировать ДНК».
Используя ПЦР, исследователи систематизировали все, что известно о последовательности нормального человеческого генома. Эта «физическая карта» в настоящее время содержит 25 000 ориентиров или «сайтов, помеченных последовательностями», для которых известна точная последовательность A-T-C-G. Для создания этой карты потребовалось 15 миллионов ПЦР-реакций — задача стала несколько менее геркулесовой благодаря роботизированной машине, которая может выполнять 150 000 реакций за раз.
ПЦР также устраняет человеческий фактор при судебно-медицинской идентификации ДНК. Коммерческим наборам требуется всего 28 ПЦР-реакций, чтобы идентифицировать человека — с частотой ошибок 1 на 50 миллиардов. «По сути, это универсальный код продукта — штрих-код — для человека», — сказал Симпсон.
ДНК-чип
Следующим большим шагом после ПЦР будет ДНК-чип.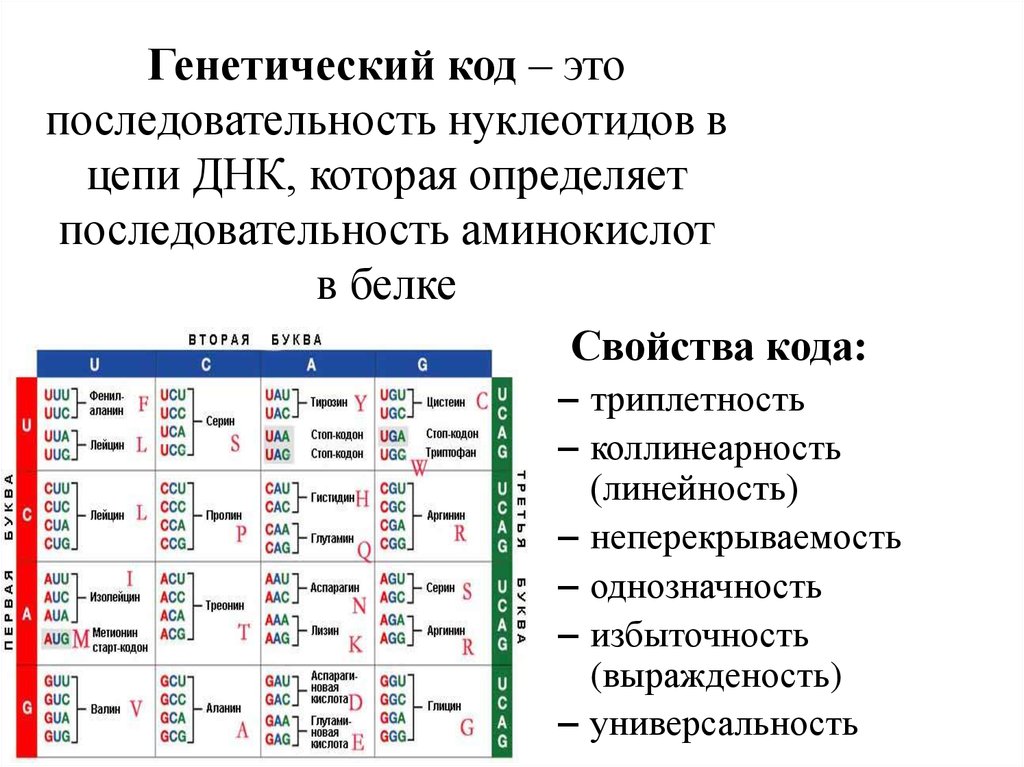 Используя приемы полупроводниковой промышленности, ученые выращивают 65 000 различных олигонуклеотидов (коротких фрагментов одноцепочечной ДНК) на чипе площадью полдюйма. (Чипы следующего поколения вмещают 400 000 штук.) Среди прочего, теперь вы можете получить человеческий ген-супрессор опухоли p53 и гены рака молочной железы BRCA1 или BRCA2, а также два гена, часто мутирующих в устойчивых к лекарственным препаратам штаммах вируса СПИДа, каждый на своем собственный чип. Вы можете сделать чип, соответствующий любому гену, если вы знаете последовательность гена.
Используя приемы полупроводниковой промышленности, ученые выращивают 65 000 различных олигонуклеотидов (коротких фрагментов одноцепочечной ДНК) на чипе площадью полдюйма. (Чипы следующего поколения вмещают 400 000 штук.) Среди прочего, теперь вы можете получить человеческий ген-супрессор опухоли p53 и гены рака молочной железы BRCA1 или BRCA2, а также два гена, часто мутирующих в устойчивых к лекарственным препаратам штаммах вируса СПИДа, каждый на своем собственный чип. Вы можете сделать чип, соответствующий любому гену, если вы знаете последовательность гена.
Поскольку биты на чипе представляют собой отдельные нити ДНК, они липкие. Они ищут свою пару. Вы можете взять образец крови у больного СПИДом, извлечь ДНК, нанести ее на чип и посмотреть, по рисунку прилипших кусочков, есть ли у пациента лекарственно-устойчивый штамм. «Весь анализ занимает пять минут».
«С помощью этих чипов, — добавил Симпсон, — мы можем начать изучать полигенные заболевания, заболевания, на которые влияет несколько генов.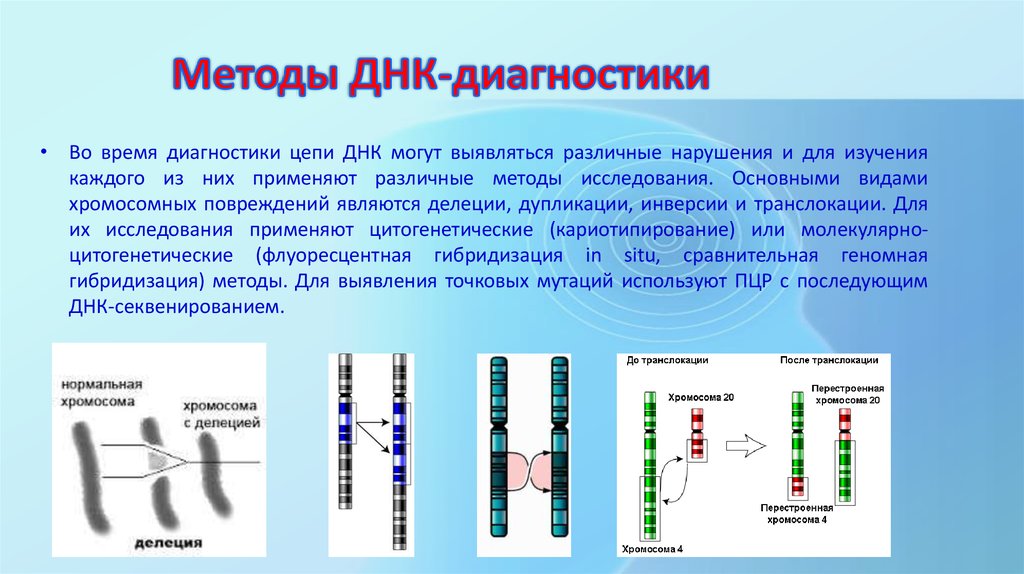 Гипертония, диабет, некоторые формы рака. Почему.»
Гипертония, диабет, некоторые формы рака. Почему.»
Роберт Симпсон, доктор медицинских наук, заведующий кафедрой молекулярной биологии им. Верна М. Уилламана в Penn State, 308 Althouse Lab, University Park, PA 16802; 814-863-0276; [email protected]. Он является экспертом по структуре хроматина, комплекса белок-ДНК, обнаруженного в ядрах клеток.
Последнее обновление 1 мая 1999 г.
Тест может показать, можно ли лечить рак простаты гормонами
,
Персонал НЦИ
Оценивая будущий риск распространения рака простаты и смерти, тест Decipher может помочь пациентам и их врачам принимать решения о лечении.
Кредит: Национальный институт рака
Большое исследование подтвердило, что генетический тест может правильно предсказать, насколько вероятно повторное распространение рака простаты (метастазирование) в другие части тела. Исследователи пришли к выводу, что тест может помочь людям с раком простаты и их врачам выбрать наиболее подходящее лечение.
Исследователи пришли к выводу, что тест может помочь людям с раком простаты и их врачам выбрать наиболее подходящее лечение.
Если уровень ПСА у человека начинает повышаться после операции по удалению всей предстательной железы (радикальная простатэктомия), это обычно означает, что рак вернулся. Стандартным лечением рака предстательной железы, рецидивирующего после простатэктомии, является лучевая терапия, либо отдельно, либо в сочетании с гормональной терапией.
Поскольку гормональная терапия может вызывать неприятные побочные эффекты, в том числе приливы, потерю энергии и потерю полового влечения, лечение обычно предназначено для пациентов с агрессивным раком, который с большей вероятностью распространяется, объяснил ведущий исследователь исследования Феликс Фэн. , доктор медицины Калифорнийского университета в Сан-Франциско.
Большинство людей с рецидивирующим раком простаты «не нуждаются в гормональной терапии, если только они не нуждаются в ней», — добавил он. Но в настоящее время сложно определить, у каких пациентов агрессивный рак, который может потребовать добавления гормональной терапии.
Но в настоящее время сложно определить, у каких пациентов агрессивный рак, который может потребовать добавления гормональной терапии.
Новое исследование показало, что тест на генетические биомаркеры, названный Decipher, может иметь возможность сделать именно это. Используя данные клинического испытания, спонсируемого NCI, исследователи обнаружили, что люди с более высокими баллами по расшифровке чаще болеют раком, который распространяется спустя годы, и умирают от рака. Результаты, опубликованные 11 февраля в JAMA Oncology также показал, что гормональная терапия помогает людям с более высокими показателями жить дольше, но менее полезна для людей с более низкими показателями.
Хотя тест Decipher был разработан почти десять лет назад, новые результаты важны, поскольку ранее не было достаточно доказательств, чтобы рекомендовать его рутинное использование при лечении пациентов, объяснил Шон МакГуайр, доктор медицинских наук, в сопроводительной редакционной статье. .
.
Необходимость лучшего биомаркера
В настоящее время врачи используют определенные критерии, такие как степень опухоли и уровень ПСА, чтобы рекомендовать пациентам с рецидивирующим раком простаты гормональную терапию в дополнение к лучевой терапии. Но исследования показали, что эти характеристики не очень хороши для выявления людей, которые действительно нуждаются в комбинированном лечении.
«Пациент может иметь повышенный уровень ПСА и умереть от чего-то другого», а не от рака простаты в будущем, объяснил Адам Совальски, доктор философии, глава отдела генетики рака простаты NCI, который не участвовал в исследовании. исследование.
Тест Decipher был разработан для удовлетворения потребности в надежном биомаркере, и ретроспективные исследования, проведенные в прошлое, показали, что он действительно превосходит стандартные маркеры, такие как уровень ПСА. Тест рассматривает активность 22 генов в опухолях предстательной железы и подсчитывает баллы от 0 до 1.
В рамках нового исследования д-р Фэн и его коллеги решили проверить, насколько хорошо работает тест в контексте клинического испытания, в ходе которого участники следили за прошлым временем. Они применили тест Decipher к опухолевой ткани, удаленной во время операции у 352 пациентов, участвовавших в более раннем клиническом испытании. Из этих пациентов 89% были белыми.
Участники исследования, у которых у всех был повышенный уровень ПСА после операции, были случайным образом распределены для получения лучевой терапии отдельно или в сочетании с бикалутамидом (Casodex), типом гормональной терапии. Медицинские результаты участников отслеживались в течение примерно 13 лет.
Оценка теста Decipher в контексте этого предыдущего исследования позволила исследователям определить, может ли тест предсказать результаты у пациентов, которые еще не получали лечения, и может ли он предсказать, насколько хорошо будет работать это лечение, объяснил доктор Совальски.
Результаты теста на расшифровку
После учета различий в возрасте участников, расе, этнической принадлежности, методах лечения рака и других факторах исследователи обнаружили, что рак предстательной железы с большей вероятностью распространяется у людей с более высокими показателями по расшифровке, чем у людей с более низкими показателями. баллы.
баллы.
«Примечательно то, что [тестирование] этих образцов предсказало развитие метастазов за 10 или более лет до того, как эти метастазы развились», — сказал доктор Совальский.
Счета испытаний были также сильно связаны с риском умереть от рака простаты и умереть в целом во время периода изучения, найденной команды.
В дополнение к рассмотрению оценок по непрерывной шкале от 0 до 1, исследователи также распределили оценки по трем заранее определенным группам: низкая (оценка ниже 0,45), средняя (от 0,45 до 0,6) и высокая (оценка от 0,45 до 0,6). балл выше 0,6). В целом 42% мужчин имели низкий балл, 38% средний балл и 20% высокий балл.
Исследователи обнаружили, что эти группы также тесно связаны с риском метастазирования, смерти от рака простаты и общей выживаемостью. Например, метастазы возникали у 15% людей с высокими баллами, но только у 6% людей с низкими баллами. И хотя менее 1% людей с низкими баллами умерли от рака предстательной железы, 10% людей с высокими баллами умерли от этого заболевания.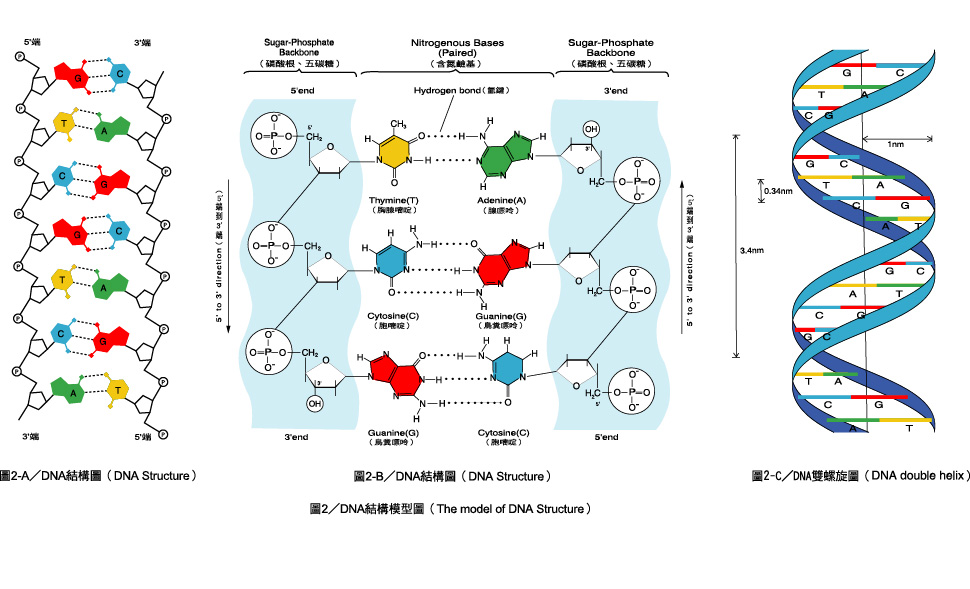
Наличие пороговых значений для низких и высоких показателей может помочь врачам легко определить наиболее подходящее лечение, пояснил доктор Фэн.
Хотя исследование не было предназначено для выявления взаимосвязи между показателями Decipher и тем, насколько хорошо работает гормональная терапия, доктор МакГуайр отметил, что результаты действительно свидетельствуют о том, что гормональная терапия помогает людям с высокими и средними показателями жить дольше. Гормональная терапия также помогла людям с низкими баллами жить дольше, но улучшение было минимальным по сравнению с тем, что наблюдалось у людей с более высокими баллами.
Тест «Расшифровка» «может выявить подгруппу пациентов с заболеванием [прогноз] настолько благоприятным, что им не нужно добавлять гормональную терапию к лучевой терапии», — пояснил доктор Фэн. Несколько исследователей получали гонорары или работали на Decipher Biosciences, компанию, которая делает тест Decipher.
Использование в повседневном медицинском обслуживании
Текущие руководства ведущих медицинских организаций (таких как Американское общество клинической онкологии) не рекомендуют рутинное использование теста Decipher.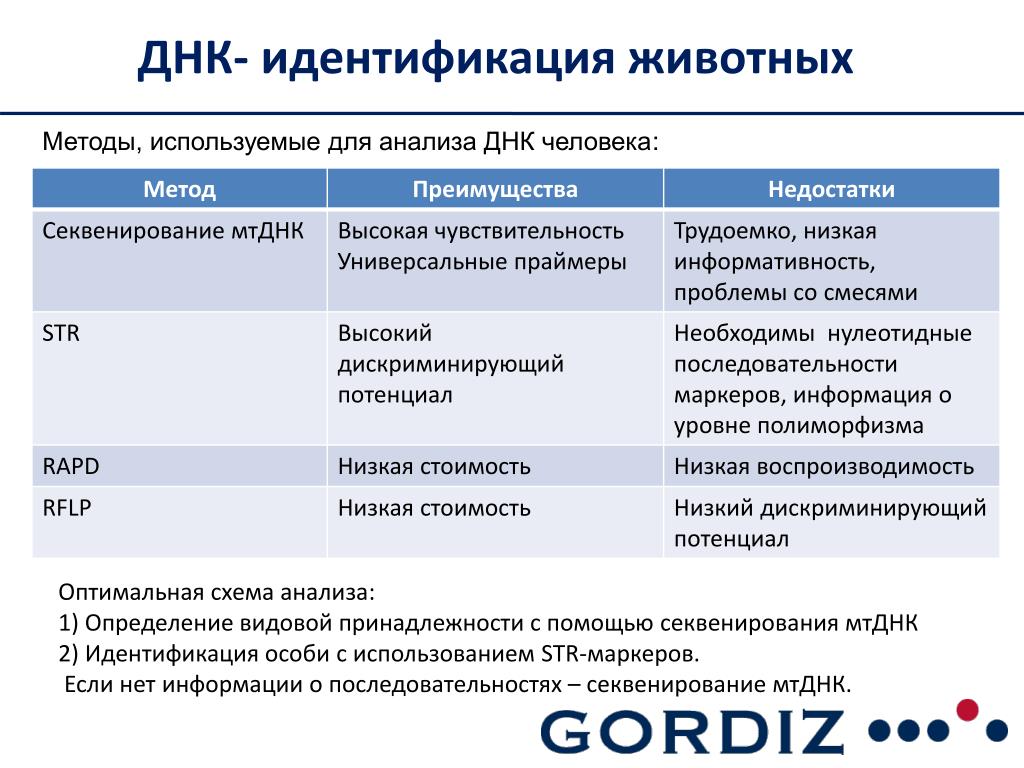 Но результаты нового исследования должны побудить эти организации пересмотреть такие рекомендации «на основе убедительности доказательств», пишет доктор Макгуайр. Он добавил, что использование теста в повседневной медицинской практике «должно стать обычным явлением».
Но результаты нового исследования должны побудить эти организации пересмотреть такие рекомендации «на основе убедительности доказательств», пишет доктор Макгуайр. Он добавил, что использование теста в повседневной медицинской практике «должно стать обычным явлением».
Вопрос о том, следует ли добавлять гормональную терапию к лучевой терапии для пациентов с повышением уровня ПСА после операции, «это вопрос, который я постоянно вижу в своей практике», — сказал д-р Фэн. «Мои пациенты очень хотят знать, есть ли хорошие шансы на пользу гормональной терапии. Такие тесты важны, потому что, если мы сможем предоставить больше информации пациентам и врачам, они вместе смогут сделать лучший выбор».
Расшифровка уже доступна для пациентов, и ее стоимость покрывается многими страховыми компаниями, включая Medicare, сказал доктор Фэн. Кроме того, не требуется дополнительная процедура, если опухолевая ткань легкодоступна после операции на простате.
Есть еще много вопросов о том, как использовать тест Decipher в различных группах пациентов с раком простаты, пишет доктор Макгуайр.


 Обеспечивает высокую аналитическую точность и позволяет успешно проводить амплификацию и сращивание фрагментов ДНК. ПЦР применима, как для подтверждения кровного родства, так и для выявления предрасположенностей к различным заболеваниям.
Обеспечивает высокую аналитическую точность и позволяет успешно проводить амплификацию и сращивание фрагментов ДНК. ПЦР применима, как для подтверждения кровного родства, так и для выявления предрасположенностей к различным заболеваниям.