Содержание
Расщепление воды с эффективностью 100%: полдела сделано / Хабр
alizar
Научно-популярное Энергия и элементы питания Нанотехнологии Химия
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Теги:
- вода
- электролиз
- восстановление
- водородное топливо
- солнечная энергия
- фотолиз
Хабы:
- Научно-популярное
- Энергия и элементы питания
- Нанотехнологии
- Химия
Всего голосов 26: ↑23 и ↓3 +20
Просмотры
69K
Комментарии
75
Анатолий Ализар
@alizar
автор, фрилансер
Telegram
Комментарии
Комментарии 75
Расщепление воды – Наука – Коммерсантъ
3K
1 мин.
…
Опыт Карлайла и Николсона был простым, как все гениальное. Чуть раньше в том же 1800 году итальянец Вольта сделал первую в истории человечества химическую батарейку — вольтов столб из сложенных поочередно в столбик кружочков меди и цинка с прокладками между ними из сукна, смоченного в соленой воде. Карлайл и Николсон проводки от вольтова столба опустили в воду. На них образовались пузырьки газа, на одном проводке — водорода, а другом — кислорода.
Предыдущая фотография
Фото:
Henry Bone
Фото:
T. Blood
Blood
Следующая фотография
1
/
2
Фото:
Henry Bone
Фото:
T. Blood
Оценить всю глубину своего открытия Карлайл и Николсон не смогли и, соответственно, не сумели извлечь из него все крывшиеся в нем научные дивиденды. Не потому что были химиками-самоучками (Карлайл был хирургом, а Николсон и вовсе самоучкой в буквальном смысле этого слова), а потому что вряд ли кто-нибудь другой, будь он семи пядей во лбу, смог бы это сделать, уж слишком широкое поле для научных и практических приложений открыл их опыт.
Не потому что были химиками-самоучками (Карлайл был хирургом, а Николсон и вовсе самоучкой в буквальном смысле этого слова), а потому что вряд ли кто-нибудь другой, будь он семи пядей во лбу, смог бы это сделать, уж слишком широкое поле для научных и практических приложений открыл их опыт.
Поначалу все были загипнотизированы самим фактом того, что электричество способно менять природу материи, на детали опыта всеобщий восторг не распространялся. Эти детали исследовали уже другие ученые, и в отличие от Карлайла и Николсона они остались в истории науки авторами фундаментальных открытий.
Первым был химик Хэмфри Дэви, который, неоднократно повторяя опыт и каждый раз получая из воды только водород и кислород, стал первооткрывателем химического состава воды. Он же, пропуская ток через растворы разных солей, получил на электродах химические элементы калий, натрий, магний, стронций, барий, кальций, бор и хлор. Открыл их!
Повторяя опыт Карлайла и Николсона, Гей-Люссак открыл закон объемных отношений газов, а Авогадро — свой «закон Авогадро». В конце концов, Берцелиус окончательно определил формулу воды Н2О. А Майкл Фарадей сформулировал законы электролиза — того явления, которое открыли Карлайл и Николсон в своем опыте и без которого немыслима современная промышленность.
В конце концов, Берцелиус окончательно определил формулу воды Н2О. А Майкл Фарадей сформулировал законы электролиза — того явления, которое открыли Карлайл и Николсон в своем опыте и без которого немыслима современная промышленность.
О них же самих сегодня никто не помнит, хотя последние лет тридцать их опыт во всевозможных вариантах со всевозможными катализаторами с упорством маньяков воспроизводят тысячи химиков по всему миру, пытаясь экономически рентабельно разложить воду на водород и кислород, чтобы создать водородный двигатель для автомобиля. А когда эта задача будет решена, о Карлайле и Николсоне опять «первооткрыватели» топлива из воды вряд ли вспомнят.
Сергей Петухов
Картина дня
Вся лента
Производство водорода: Электролиз | Департамент энергетики
Электролиз — многообещающий вариант безуглеродного производства водорода из возобновляемых и ядерных ресурсов. Электролиз — это процесс использования электричества для расщепления воды на водород и кислород. Эта реакция происходит в устройстве, называемом электролизером. Размер электролизеров может варьироваться от небольшого оборудования размером с прибор, которое хорошо подходит для мелкомасштабного распределенного производства водорода, до крупномасштабных центральных производственных объектов, которые могут быть напрямую связаны с возобновляемыми или другими формами энергии, не выделяющими парниковых газов. производство электроэнергии.
Электролиз — это процесс использования электричества для расщепления воды на водород и кислород. Эта реакция происходит в устройстве, называемом электролизером. Размер электролизеров может варьироваться от небольшого оборудования размером с прибор, которое хорошо подходит для мелкомасштабного распределенного производства водорода, до крупномасштабных центральных производственных объектов, которые могут быть напрямую связаны с возобновляемыми или другими формами энергии, не выделяющими парниковых газов. производство электроэнергии.
Как это работает?
Как и топливные элементы, электролизеры состоят из анода и катода, разделенных электролитом. Различные электролизеры работают по-разному, в основном из-за разного типа используемого электролита и ионных частиц, которые он проводит.
Электролизеры с мембраной из полимерного электролита
В электролизере с мембраной из полимерного электролита (ПЭМ) электролит представляет собой твердый специальный пластиковый материал.
- Вода реагирует на аноде с образованием кислорода и положительно заряженных ионов водорода (протонов).
- Электроны проходят через внешнюю цепь, а ионы водорода избирательно перемещаются через ФЭУ к катоду.
- На катоде ионы водорода соединяются с электронами из внешней цепи, образуя газообразный водород. Анодная реакция: 2H 2 O → O 2 + 4H + + 4e — Катодная реакция: 4H + + 4e — → 2H 94 2 94
Щелочные электролизеры
Щелочные электролизеры работают за счет транспорта ионов гидроксида (OH —) через электролит от катода к аноду с образованием водорода на стороне катода. Электролизеры, в которых в качестве электролита используется жидкий щелочной раствор гидроксида натрия или калия, уже много лет имеются в продаже. Новые подходы с использованием твердых щелочных обменных мембран (AEM) в качестве электролита показывают многообещающие результаты в лабораторных масштабах.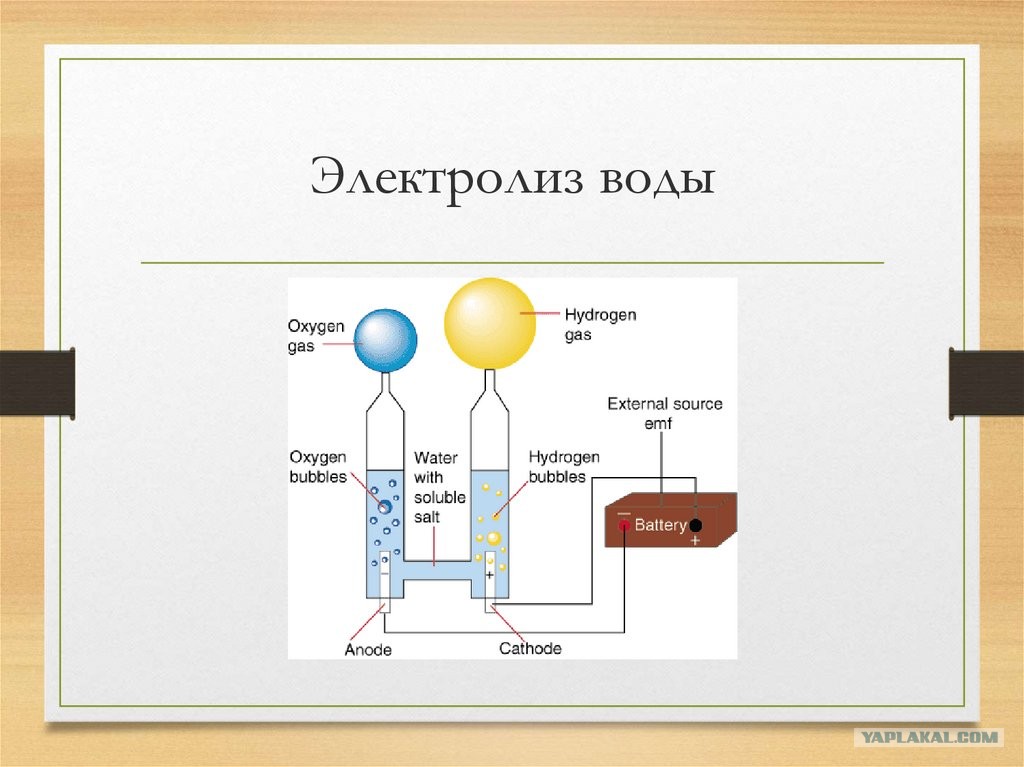
Электролизеры твердого оксида
Электролизеры твердого оксида, в которых в качестве электролита используется твердый керамический материал, избирательно проводящий отрицательно заряженные ионы кислорода (O 2-) при повышенных температурах генерируют водород несколько другим способом.
- Пар на катоде соединяется с электронами из внешней цепи с образованием газообразного водорода и отрицательно заряженных ионов кислорода.
- Ионы кислорода проходят через твердую керамическую мембрану и реагируют на аноде, образуя газообразный кислород и генерируя электроны для внешней цепи.
Твердооксидные электролизеры должны работать при температурах, достаточно высоких для нормального функционирования твердооксидных мембран (около 700–800 °C по сравнению с электролизерами на основе PEM, которые работают при 70–90°C и коммерческие щелочные электролизеры, которые обычно работают при температуре ниже 100°C). Усовершенствованные лабораторные твердооксидные электролизеры на основе протонпроводящих керамических электролитов демонстрируют перспективность снижения рабочей температуры до 500–600°C. Твердооксидные электролизеры могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), для уменьшения количества электроэнергии, необходимой для производства водорода из воды.
Твердооксидные электролизеры могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), для уменьшения количества электроэнергии, необходимой для производства водорода из воды.
Почему рассматривается этот путь?
Электролиз — это ведущий способ производства водорода для достижения цели Hydrogen Energy Earthshot по снижению стоимости чистого водорода на 80% до 1 доллара за 1 килограмм за 1 десятилетие («1 1 1»). Водород, полученный с помощью электролиза, может привести к нулевым выбросам парниковых газов, в зависимости от используемого источника электроэнергии. Источник необходимой электроэнергии, включая его стоимость и эффективность, а также выбросы в результате производства электроэнергии, необходимо учитывать при оценке преимуществ и экономической целесообразности производства водорода с помощью электролиза. Во многих регионах страны сегодняшняя электросеть не идеальна для обеспечения электроэнергией, необходимой для электролиза, из-за выбросов парниковых газов и количества необходимого топлива из-за низкой эффективности процесса производства электроэнергии. Производство водорода с помощью электролиза используется для возобновляемых источников (ветер, солнце, гидро, геотермальная энергия) и ядерной энергии. Эти пути производства водорода приводят к практически нулевым выбросам парниковых газов и загрязняющих веществ; тем не менее, стоимость производства должна быть значительно снижена, чтобы быть конкурентоспособным с более зрелыми способами, основанными на углероде, такими как риформинг природного газа.
Производство водорода с помощью электролиза используется для возобновляемых источников (ветер, солнце, гидро, геотермальная энергия) и ядерной энергии. Эти пути производства водорода приводят к практически нулевым выбросам парниковых газов и загрязняющих веществ; тем не менее, стоимость производства должна быть значительно снижена, чтобы быть конкурентоспособным с более зрелыми способами, основанными на углероде, такими как риформинг природного газа.
Потенциал для синергии с производством энергии из возобновляемых источников
Производство водорода посредством электролиза может предложить возможности для синергии с динамической и прерывистой выработкой энергии, что характерно для некоторых технологий возобновляемых источников энергии. Например, хотя стоимость энергии ветра продолжает снижаться, присущая ветру изменчивость является препятствием для эффективного использования энергии ветра. Водородное топливо и производство электроэнергии могут быть интегрированы в ветряную электростанцию, что позволит гибко переключать производство, чтобы наилучшим образом соответствовать доступности ресурсов с эксплуатационными потребностями системы и рыночными факторами. Кроме того, во времена избыточного производства электроэнергии ветряными электростанциями вместо того, чтобы сокращать электроэнергию, как это обычно делается, можно использовать эту избыточную электроэнергию для производства водорода путем электролиза.
Кроме того, во времена избыточного производства электроэнергии ветряными электростанциями вместо того, чтобы сокращать электроэнергию, как это обычно делается, можно использовать эту избыточную электроэнергию для производства водорода путем электролиза.
Важно отметить…
- Электроэнергия в настоящее время не является идеальным источником электроэнергии для электролиза, поскольку большая часть электроэнергии вырабатывается с использованием технологий, которые приводят к выбросам парниковых газов и являются энергоемкими. Выработка электроэнергии с использованием технологий возобновляемой или ядерной энергии, либо отдельно от сети, либо в качестве растущей части сети, является возможным вариантом преодоления этих ограничений для производства водорода с помощью электролиза.
- Министерство энергетики США и другие организации продолжают усилия по снижению стоимости производства электроэнергии на основе возобновляемых источников и развитию более эффективного производства электроэнергии на основе ископаемого топлива с улавливанием, утилизацией и хранением углерода.
 Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире.
Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире.
Исследования сосредоточены на преодолении проблем
- Достижение целевого показателя стоимости чистого водорода Hydrogen Shot в размере 1 доллара США за кг H 2 к 2030 г. (и промежуточная цель 2 долл. США/кг H 2 к 2025 г.) за счет лучшего понимания компромиссов между производительностью, стоимостью и долговечностью электролизных систем при прогнозируемых будущих динамических режимах работы с использованием CO 2 — без электричества .
- Снижение капитальных затрат электролизера и баланса системы.
- Повышение энергоэффективности преобразования электроэнергии в водород в широком диапазоне условий эксплуатации.
- Углубление понимания процессов деградации элементов и батарей электролизера и разработка стратегий смягчения последствий для увеличения срока службы.
Water — Scientific American
Share на Facebook
Поделиться в Twitter
Share на Reddit
Share на Linkedin
по электронной почте
4
4
по электронной почте.
 0014
0014
Знаете ли вы, что воду можно разделить на два составных элемента, используя всего несколько предметов домашнего обихода? Посмотрите, из чего на самом деле состоит ваша вода, в этом занятии по разрушению молекул. Все, что нужно, это немного сока! Авторы и права: Джордж Рецек
Ключевые понятия
Вода
Химия
Электричество
Молекулы
Введение
Пользуешься им каждый день и без него не выживешь — нет, это не интернет, а вода! Это одно из самых важных соединений в мире, и проблема становится все более важной во всем мире. Вы, наверное, слышали, что во многих местах засуха или загрязнение воды ограничивают запасы чистой питьевой воды, и эти запасы продолжают сокращаться. Размышляя об этом, задумывались ли вы когда-нибудь, почему мы не делаем воду сами? Из чего на самом деле состоит вода? В этой научной деятельности вы будете использовать энергию в виде электричества для расщепления воды на отдельные компоненты; так что соберите все материалы и приготовьтесь узнать, что это такое, — и разделите их сами!
Фон
Чтобы узнать, из чего состоит вода, полезно посмотреть на ее химическую формулу: h3O. Это в основном говорит нам о том, что молекула воды состоит из двух элементов: водорода и кислорода или, точнее, двух атомов водорода (h3) и одного атома кислорода (O). Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву. К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Это в основном говорит нам о том, что молекула воды состоит из двух элементов: водорода и кислорода или, точнее, двух атомов водорода (h3) и одного атома кислорода (O). Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву. К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Если делать воду из ее элементов так опасно, то как насчет обратной реакции? Разделить воду на два компонента гораздо проще, и это называется электролизом воды. Получение водорода или кислорода таким способом кажется простым. Но, как вы, вероятно, подозревали, эта обратная реакция требует затрат энергии, поэтому ее также называют эндотермической реакцией. При электролизе воды источником энергии, используемой для протекания реакции, является электричество. Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита 9.0138, , такие как соль или кислота. Электролит растворяется в воде и разделяется на ионы (электрически заряженные частицы), которые перемещаются в растворах и таким образом могут проводить электричество. Чтобы добавить электричества в раствор, вам также понадобятся два электрических проводника, которые соприкасаются с водой. Они называются электродами и в основном представляют собой металлы или другие проводящие материалы. Когда на электроды подается электрический ток, ионы (электрически заряженные атомы) в электролите, включая положительно заряженные протоны (H + ) и отрицательно заряженные гидроксильные ионы (ОН — ), образующиеся в результате самоионизации воды, начинают двигаться к электроду с противоположным зарядом, где образуется либо водород, либо кислород.
Получение водорода или кислорода таким способом кажется простым. Но, как вы, вероятно, подозревали, эта обратная реакция требует затрат энергии, поэтому ее также называют эндотермической реакцией. При электролизе воды источником энергии, используемой для протекания реакции, является электричество. Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита 9.0138, , такие как соль или кислота. Электролит растворяется в воде и разделяется на ионы (электрически заряженные частицы), которые перемещаются в растворах и таким образом могут проводить электричество. Чтобы добавить электричества в раствор, вам также понадобятся два электрических проводника, которые соприкасаются с водой. Они называются электродами и в основном представляют собой металлы или другие проводящие материалы. Когда на электроды подается электрический ток, ионы (электрически заряженные атомы) в электролите, включая положительно заряженные протоны (H + ) и отрицательно заряженные гидроксильные ионы (ОН — ), образующиеся в результате самоионизации воды, начинают двигаться к электроду с противоположным зарядом, где образуется либо водород, либо кислород. Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Материалы
- Водонепроницаемая рабочая зона
- Помощник для взрослых
- Графит для механического карандаша (достаточно толстый, чтобы не сломаться) или деревянный карандаш и нож, чтобы ваш взрослый помощник извлек графит
- Клей
- Play-Doh или другая глина
- Два или три одноразовых пластиковых стаканчика (лучше всего подходят прозрачные пластиковые стаканчики на 18 унций).
- Ножницы
- Перманентный маркер
- Две металлические кнопки
- Дистиллированная вода
- Пищевая сода
- Аккумулятор на девять вольт
- Две прозрачные соломинки (большой размер)
- Чайная ложка
- Медицинская капельница
- Таймер
- Бумажные полотенца
- Индикаторные полоски pH (дополнительно)
- Поваренная соль (хлорид натрия — NaCl) (по желанию)
Подготовка
- Ваша рабочая зона должна быть водонепроницаемой; разливы воды могут произойти во время деятельности.

- Соберите свой прочный механический графитовый карандаш. Убедитесь, что у вас есть два куска длиной около 2,5 см (один дюйм). Если вы решите использовать деревянный карандаш, попросите взрослого взять нож и извлечь из карандаша графитовый грифель. (Для этого у вас также должно получиться два куска длиной примерно 2,5 сантиметра). Это будут ваши графитовые электроды.
- Аккуратно отрежьте ножницами (или отрежьте взрослым) открытый конец одного пластикового стаканчика так, чтобы он был на высоте девятивольтовой батареи. В нижней части чашки прорежьте отверстие, чтобы кончик батареи (с двумя полюсами) мог пройти через него.
- Возьмите другую чашку и держите дно этой чашки поверх девятивольтовой батареи. Несмываемым маркером на внутренней стороне чашки нарисуйте две точки внизу, где чашка соприкасается с двумя полюсами батареи.
- Снимите чашку с батареи и с помощью чертежной кнопки проделайте по одному отверстию в каждой отмеченной точке на дне пластиковой чаши.

- Аккуратно вставьте два графитовых (карандашных) штифта в два отверстия, по одному в каждое. Возможно, вам придется сделать отверстия немного больше, чтобы они подходили.
- Используйте клей, чтобы запечатать вокруг графитовых штифтов на внешней стороне чашки и дайте ему высохнуть. Это должно предотвратить просачивание воды. Убедитесь, что графитовые контакты не все покрыты клеем, иначе они больше не будут контактировать с батареей.
- Поместите вырезанную чашку открытой стороной вниз на батарею. Дно чашки и аккумулятор должны совпадать, образуя ровную поверхность, на которую можно поставить другую чашку.
- Поместите чашку с графитовыми штифтами на перевернутую обрезанную чашку сверху батареи. Он должен сидеть там прочно, и каждый из графитовых штифтов должен касаться одного из полюсов батареи.
- Заклейте один конец обеих соломинок для питья пластилином Play-Doh или глиной.
Процедура
- Возьмите чашку с графитовыми штифтами и налейте в чашку около 300 миллилитров дистиллированной воды подальше от батареи.
 Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.
Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах. - Как и раньше, поместите его на перевернутую обрезанную чашку сверху батареи так, чтобы каждый из графитовых штифтов касался одного из полюсов батареи. Возможно, вам придется немного прижать его, чтобы установить хорошее соединение. Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах?
- Снимите чашу с дистиллированной водой с аккумулятора. Насыпьте одну чайную ложку пищевой соды и размешайте ее в дистиллированной воде, пока все не растворится. Как вы думаете, что изменит пищевая сода? Какую функцию он выполняет?
- Теперь снова поставьте чашку на батарею и соедините графитовые электроды с полюсами батареи.
 Что вы наблюдаете сейчас? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?
Что вы наблюдаете сейчас? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному? - Засуньте нос в чашку и понюхайте продукты реакции. Есть запах? Если да, то как он пахнет?
- Снова снимите чашку с батареи. С помощью пипетки наполните обе закупоренные большие соломинки раствором пищевой соды из чашки с графитовыми штифтами. Когда они наполнятся, закройте каждую одним пальцем и переверните вверх дном. Опустите их в чашку с раствором пищевой соды и осторожно поместите их поверх графитовых штифтов (по одной соломинке на каждую), чтобы соломинки оставались полностью заполненными раствором пищевой соды. Если соломинки не стоят вертикально, вы можете прислонить их к краю чашки.
 Как вы думаете, что будет с соломинкой?
Как вы думаете, что будет с соломинкой? - После того, как соломинки будут размещены поверх графитовых штифтов, поставьте чашку обратно на батарею. Оставьте его там на 10 минут и немного нажмите на чашку, чтобы убедиться, что электроды остаются подключенными и электродные реакции происходят непрерывно в течение всего этого времени. Обратите внимание на огромные соломинки, которые вы надеваете на графитовые булавки. Что происходит с водой, которую вы туда заливаете? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них?
- По истечении 10 минут отметьте уровень воды в каждой соломинке несмываемым маркером. Насколько больше воды было вытеснено продуктами реакции на отрицательном полюсе по сравнению с положительным полюсом? Одинаковые, двойные или тройные?
- Дополнительно: Если у вас есть тест-полоски для измерения pH, которые могут измерять кислотность или щелочность растворов, используйте их для измерения pH в каждой большой соломинке после того, как уровень воды упадет примерно на 50 процентов.
 Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?
Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так? - Дополнительно: Повторите эксперимент, но вместо пищевой соды в дистиллированную воду добавьте чайную ложку поваренной соли (хлорида натрия или NaCl) и дайте электролизу поработать пять минут. Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так?
- Дополнительно: Замените графитовые электроды металлическими кнопками. Для этого вам может понадобиться свежая чашка. Вставьте кнопки в дно чашки так, чтобы они не касались друг друга, но так, чтобы каждая из них касалась одного из полюсов батареи, как только вы поместите чашку на батарею.
 При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
Наблюдения и результаты
Удалось ли вам разделить воду на водород и кислород? Вы видели много пузырьков на обоих графитовых штифтах? Первоначально, когда вы ставили чашку с дистиллированной водой на аккумулятор, вы, вероятно, не видели, что происходит на графитовых электродах. Это связано с тем, что дистиллированная вода не очень хорошо проводит электричество, поэтому электродные реакции отсутствуют или возможны лишь незначительные реакции. Однако, если вы добавите электролиты, такие как пищевая сода, добавленные ионы могут проводить электричество, и вы должны были увидеть пузырьки газа, появляющиеся на обоих графитовых штифтах. С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
Присмотревшись, вы могли заметить, что на графитовом электроде, подключенном к отрицательному полюсу батареи, образовалось больше газа, чем на другой стороне. Сбор двух газов с помощью гигантских соломинок, вероятно, продемонстрировал это еще лучше. Через 10 минут уровень воды на отрицательном полюсе должен был быть примерно вдвое меньше, чем на положительном полюсе, а это означает, что вы собрали примерно вдвое больше газообразного водорода по сравнению с кислородом. Разница связана с тем, что на одну молекулу воды приходится два атома водорода на один атом кислорода, как объяснялось выше. Это означает, что для образования одной молекулы кислорода (O2) требуется две молекулы воды (2 ч3О). Однако в то же время из двух молекул воды (2 ч3О) можно получить две молекулы водорода (2 ч3). В то время как на электродах образуются водород и кислород, остаточными продуктами реакции из воды являются протоны (H + на стороне кислорода) и ионы гидроксила (ОН — на стороне водорода). Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Могут происходить и другие электродные реакции, если в растворе есть ионы, конкурирующие с образованием водорода или кислорода. Возможно, вы заметили, что после того, как вы добавили соль (хлорид натрия) в электролит, он начал пахнуть, как в бассейне. Вместо кислорода на положительном полюсе батареи вырабатывается хлор, который также используется для дезинфекции воды в бассейне. Если вы использовали металлические кнопки в качестве электродов вместо графитовых штифтов, металл (обычно сталь или латунь) будет растворяться или подвергаться коррозии на положительном полюсе батареи, и вместо (или в дополнение) к выделению газа вы должны увидеть, что металлическая кнопка становится красно-коричневой. Это свидетельствует о том, что электролиз — это не только способ расщепления воды на компоненты, но и способ запуска других реакций, которые в противном случае не происходили бы самопроизвольно.

 Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире.
Производство электроэнергии на основе ветра, например, быстро растет в Соединенных Штатах и во всем мире. 0014
0014

 Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.
Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах. Что вы наблюдаете сейчас? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?
Что вы наблюдаете сейчас? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?  Как вы думаете, что будет с соломинкой?
Как вы думаете, что будет с соломинкой?  Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?
Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?  При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?