Содержание
Твердые вещества: свойства, строение, плотность и примеры
Твердые вещества: свойства, строение, плотность и примеры
Твердые вещества — это те вещества, которые способны образовывать тела и имеют объем. По своей форме они отличаются от жидкостей и газов. Твердые тела сохраняют форму своего тела из-за того, что их частицы не могут свободно перемещаться. Они различаются по плотности, пластичности, электропроводности и цвету. У них есть и другие свойства. Так, например, большинство этих веществ растворяются при нагревании, приобретая жидкое агрегатное состояние. Некоторые из них при нагревании сразу превращаются в газ (сублимация). Но есть и такие, которые разлагаются на другие вещества.
Содержание
- 1 Виды твердых веществ
- 2 Типы кристаллических твердых веществ
- 3 Общие понятия о твердом теле
- 4 Что такое кристаллы
- 5 Изучение твердых веществ
- 6 Особенности твердых веществ
- 7 Свойства твердых веществ
- 8 Зонная структура
- 9 Другие свойства
- 10 Самые твердые вещества в природе
Виды твердых веществ
Все твердые вещества делятся на две группы.
- Аморфный, в котором отдельные частицы находятся хаотично. Другими словами: у них нет четкой (определенной) структуры. Эти твердые вещества способны плавиться в определенном диапазоне температур. Наиболее распространены стекло и смола.
- Кристаллические, которые в свою очередь делятся на 4 типа: атомарные, молекулярные, ионные, металлические. В них частицы встречаются только по определенному шаблону, а именно в узлах кристаллической решетки. Его геометрия может сильно различаться в разных веществах.
Кристаллические твердые тела по количеству преобладают над аморфными.
Типы кристаллических твердых веществ
В твердом состоянии почти все вещества имеют кристаллическую структуру. Они различаются по своему строению. Кристаллические решетки содержат на своих узлах различные частицы и химические элементы. Они согласились с тем, что получили свои имена. Каждый вид имеет свои характерные свойства:
- В кристаллической решетке металла узлы содержат только положительно заряженные ионы химических веществ.
 Между ними находятся свободные электроны, через которые идеально проходит тепловая и электрическая энергия. Именно поэтому все металлы отличаются такой характеристикой, как проводимость.
Между ними находятся свободные электроны, через которые идеально проходит тепловая и электрическая энергия. Именно поэтому все металлы отличаются такой характеристикой, как проводимость. - В молекулярной кристаллической решетке связь между частицами характеризуется слабостью. Вещества этого типа отличаются легкостью кипения и плавления. Они отличаются своей летучестью, из-за чего имеют определенный запах. К таким твердым веществам относятся лед, сахар. Молекулярные движения в твердых телах этого типа отличаются своей активностью.
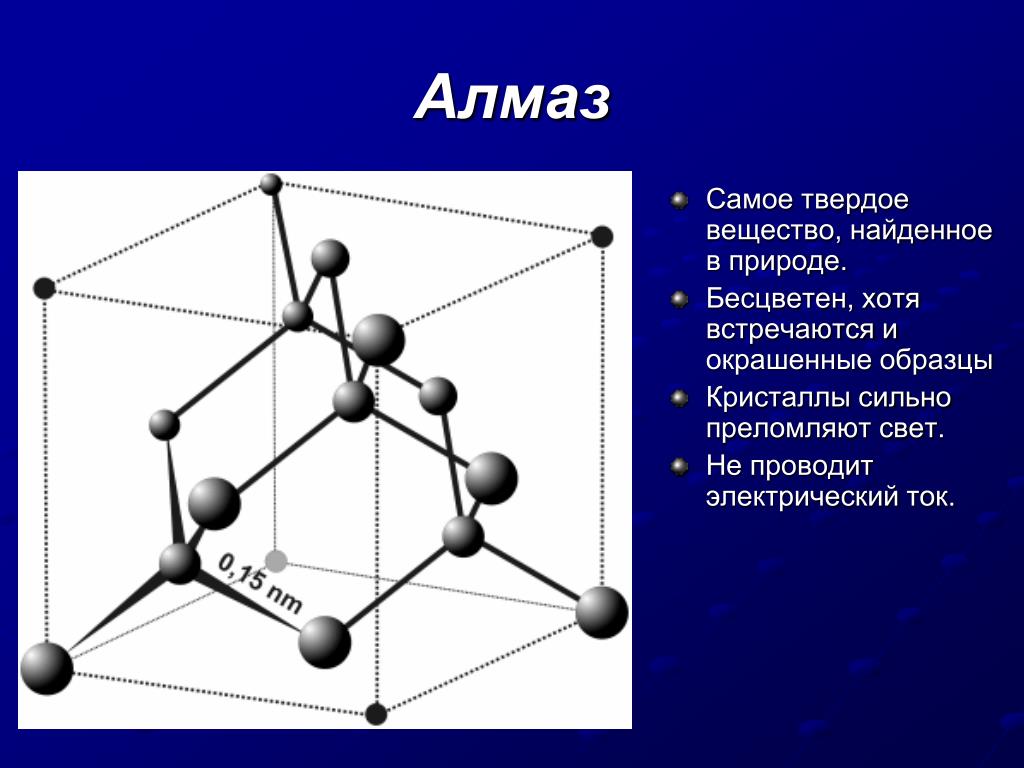
- В атомной кристаллической решетке частицы твердого тела связаны ковалентной связью. Он отличается своей прочностью. Благодаря этому такие вещества имеют высокую температуру плавления и кипения. К этому типу относятся кварц и алмаз.
- В ионной кристаллической решетке соответствующие частицы, положительно и отрицательно заряженные, чередуются в узлах. Они удерживаются вместе за счет электростатического притяжения. Такой тип решетки существует в щелочах, солях, основных оксидах.
 Многие вещества этого типа легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавкие. Практически все они не имеют запаха, так как нелетучие. Вещества с ионной решеткой не способны проводить электрический ток, так как в их составе нет свободных электронов. Типичным примером ионного твердого вещества является поваренная соль. Эта кристаллическая решетка делает его хрупким. Это связано с тем, что любое его смещение может привести к появлению сил отталкивания ионов.
Многие вещества этого типа легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавкие. Практически все они не имеют запаха, так как нелетучие. Вещества с ионной решеткой не способны проводить электрический ток, так как в их составе нет свободных электронов. Типичным примером ионного твердого вещества является поваренная соль. Эта кристаллическая решетка делает его хрупким. Это связано с тем, что любое его смещение может привести к появлению сил отталкивания ионов.
Общие понятия о твердом теле
Твердые тела и вещества практически одно и то же. Эти термины называются одним из 4 агрегатных состояний. Твердые тела имеют устойчивую форму и характер теплового движения атомов. Кроме того, последние совершают небольшие колебания вблизи положений равновесия. Раздел науки, изучающий состав и внутреннее строение, называется физикой твердого тела. Есть и другие важные области знаний, связанные с такими веществами. Изменение формы под действием внешних воздействий и движений называется механикой деформируемого тела.
Из-за различных свойств твердых тел они нашли применение в различных технических устройствах, созданных руками человека. Чаще всего их использование основывалось на таких свойствах, как твердость, объем, масса, эластичность, пластичность, хрупкость. Современная наука позволяет использовать другие качества твердых тел, которые можно обнаружить только в лабораторных условиях.
Что такое кристаллы
Кристаллы — это твердые тела с частицами, расположенными в определенном порядке. У каждого химического вещества своя структура. Его атомы образуют трехмерную периодическую упаковку, называемую кристаллической решеткой. Твердые тела имеют разную структурную симметрию. Кристаллическое состояние твердого тела считается стабильным, поскольку оно имеет минимальное количество потенциальной энергии.
Подавляющее большинство твердых (природных) материалов состоит из огромного количества беспорядочно ориентированных одиночных зерен (кристаллов). Такие вещества называют поликристаллическими. К ним относятся технические сплавы и металлы, а также многие горные породы. Природные или синтетические монокристаллы называют монокристаллическими.
К ним относятся технические сплавы и металлы, а также многие горные породы. Природные или синтетические монокристаллы называют монокристаллическими.
Чаще всего такие твердые вещества образуются состоянием жидкой фазы, представленной расплавом или раствором. Иногда их получают из газообразного состояния. Этот процесс называется кристаллизацией. Благодаря научно-техническому прогрессу процедура выращивания (синтеза) различных веществ приобрела промышленные масштабы. Большинство кристаллов имеют естественную форму в виде правильных многогранников. Их размеры очень разные. Так, природный кварц (горный хрусталь) может весить до сотен килограммов, а алмазы — до нескольких граммов.
В аморфных твердых телах атомы постоянно колеблются вокруг случайно расположенных точек. Они поддерживают некоторый ближний порядок, но нет дальнего порядка. Это связано с тем, что их молекулы расположены на расстоянии, которое можно сравнить с их размерами. Самый распространенный пример такого твердого тела в нашей жизни — стеклообразное состояние. Аморфные вещества часто рассматриваются как жидкости с бесконечно высокой вязкостью. Время их кристаллизации иногда настолько велико, что оно вообще не проявляется.
Аморфные вещества часто рассматриваются как жидкости с бесконечно высокой вязкостью. Время их кристаллизации иногда настолько велико, что оно вообще не проявляется.
Именно перечисленные выше свойства этих веществ делают их уникальными. Аморфные твердые вещества считаются нестабильными, потому что со временем они могут стать кристаллическими.
Молекулы и атомы, составляющие твердое тело, имеют большую плотность. Они практически удерживают свое положение друг относительно друга относительно других частиц и слипаются за счет межмолекулярного взаимодействия. Расстояние между молекулами твердого тела в разных направлениях называется параметром кристаллической решетки. Структура вещества и его симметрия определяют многие свойства, такие как электронная зона, спайность и оптика. Когда твердое тело подвергается достаточно большой силе, эти качества могут тем или иным образом нарушаться. В этом случае твердое тело подвержено остаточным деформациям.
Атомы твердых тел совершают колебательные движения, определяющие их тепловую энергию. Поскольку они незначительны, их можно наблюдать только в лабораторных условиях. Молекулярная структура твердого тела во многом влияет на его свойства.
Поскольку они незначительны, их можно наблюдать только в лабораторных условиях. Молекулярная структура твердого тела во многом влияет на его свойства.
Изучение твердых веществ
Характеристики, свойства этих веществ, их качество и движение частиц изучаются различными разделами физики твердого тела.
Для исследования используются: радиоспектроскопия, структурный анализ рентгеновскими лучами и другие методы. Таким образом изучаются механические, физические и термические свойства твердых тел. Твердость, сопротивление нагрузке, предел прочности, фазовые превращения изучают материаловедение. Это во многом перекликается с физикой твердого тела. Есть еще одна важная современная наука. Изучение существующих веществ и синтез новых веществ осуществляется с помощью химии твердого тела.
Особенности твердых веществ
Характер движения внешних электронов атомов твердого тела определяет многие его свойства, например электрические. Всего существует 5 классов таких тел.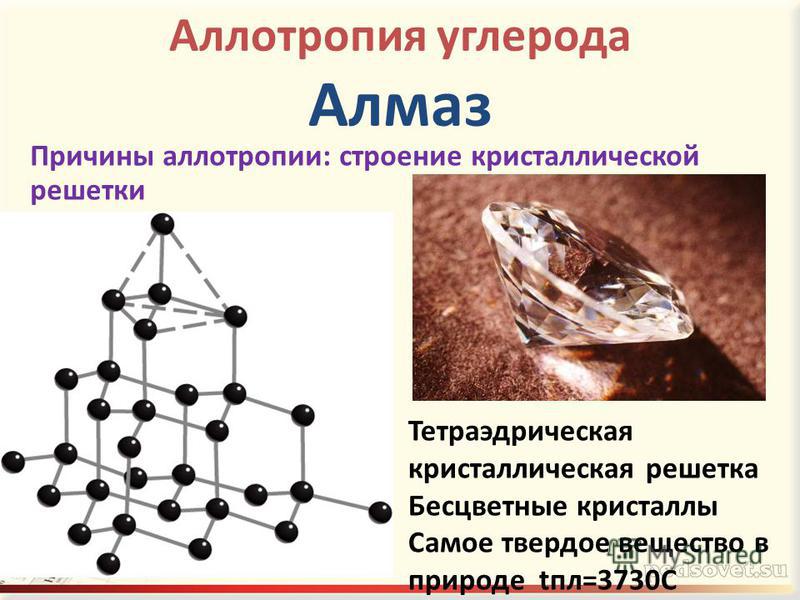 Они устанавливаются по типу связи между атомами:
Они устанавливаются по типу связи между атомами:
- Водород, который образуется между положительно поляризованными атомами одной молекулы или ее части и самой маленькой отрицательно поляризованной частицей другой молекулы или части. Эти соединения включают лед.
- Металлический, образованный комбинацией валентных электронов атомов. В результате появляется обычное электронное облако, которое смещается под действием электрического напряжения. Металлическая связь образуется, когда связываемые атомы велики. Это те, кто может отдавать электроны. Для многих металлов и сложных соединений эта связь образует твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Среди неметаллических соединений можно отметить: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлическими связями (металлы) различаются по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb).
- Ионный, главной особенностью которого является сила электростатического притяжения.
 Его характеристики: отражение и поглощение света в инфракрасной области. При низких температурах ионная связь характеризуется низкой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl).
Его характеристики: отражение и поглощение света в инфракрасной области. При низких температурах ионная связь характеризуется низкой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl). - Ковалентная, осуществляется парой электронов, принадлежащих обоим атомам. Эта связь делится на: одинарную (простую), двойную и тройную. Эти названия указывают на наличие электронных пар (1, 2, 3). Двойные и тройные связи называются кратными. Есть еще одно деление этой группы. Таким образом, в зависимости от распределения электронной плотности различают полярные и неполярные связи. Первый состоит из разных атомов, а второй такой же. Такое твердое состояние вещества, примерами которого являются алмаз (C) и кремний (Si), отличается своей плотностью. Самые твердые кристаллы принадлежат именно ковалентной связи.
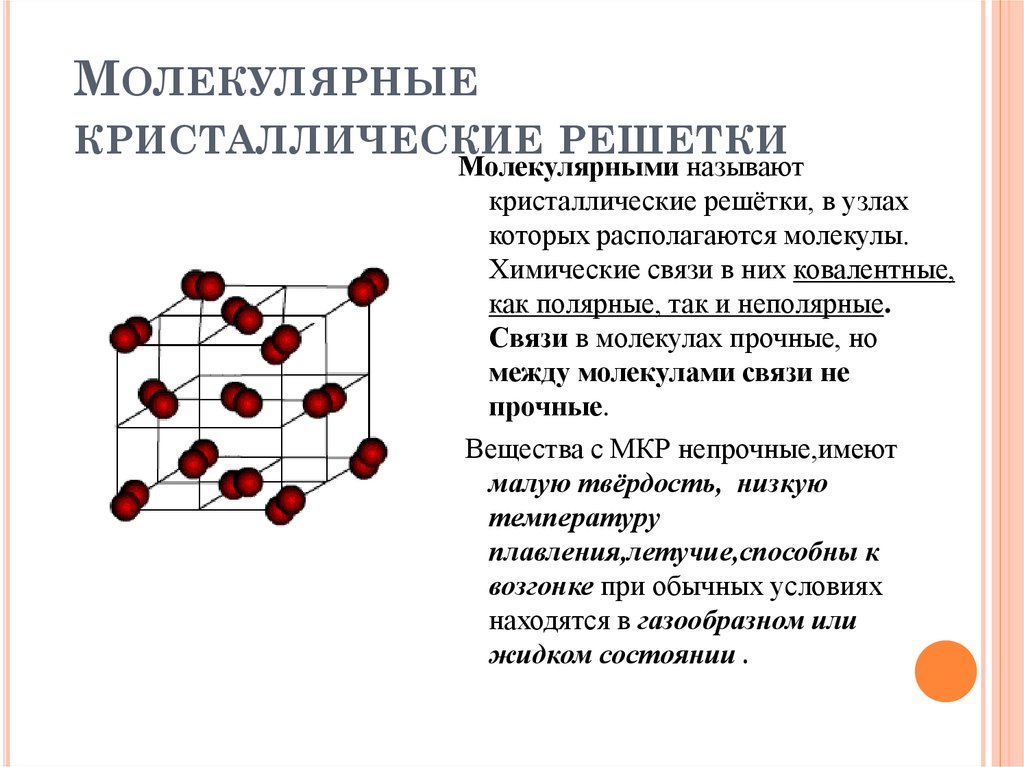
- Молекулярный, возникающий в кристаллах, образованных из отдельных молекул вещества. Он характеризуется промежутками между молекулами с нулевой электронной плотностью.
 Силы, связывающие атомы в таких кристаллах, значительны. В этом случае молекулы притягиваются друг к другу только за счет слабого межмолекулярного притяжения. Поэтому связи между ними легко разрушаются при нагревании. Связи между атомами разрушить гораздо труднее. Молекулярная связь делится на ориентационную, дисперсионную и индуктивную. Примером такого вещества является твердый метан.
Силы, связывающие атомы в таких кристаллах, значительны. В этом случае молекулы притягиваются друг к другу только за счет слабого межмолекулярного притяжения. Поэтому связи между ними легко разрушаются при нагревании. Связи между атомами разрушить гораздо труднее. Молекулярная связь делится на ориентационную, дисперсионную и индуктивную. Примером такого вещества является твердый метан.
Свойства твердых веществ
Что мы знаем сегодня? Ученые давно изучают свойства твердого состояния вещества. Под воздействием температур он тоже меняется. Переход такого тела в жидкость называется плавлением. Превращение твердого тела в газообразное состояние называется сублимацией. При понижении температуры твердое вещество кристаллизуется. Некоторые вещества под воздействием холода переходят в аморфную фазу. Ученые называют этот процесс витрификацией.
Во время фазовых переходов изменяется внутренняя структура твердых тел. Максимальный порядок он приобретает при понижении температуры.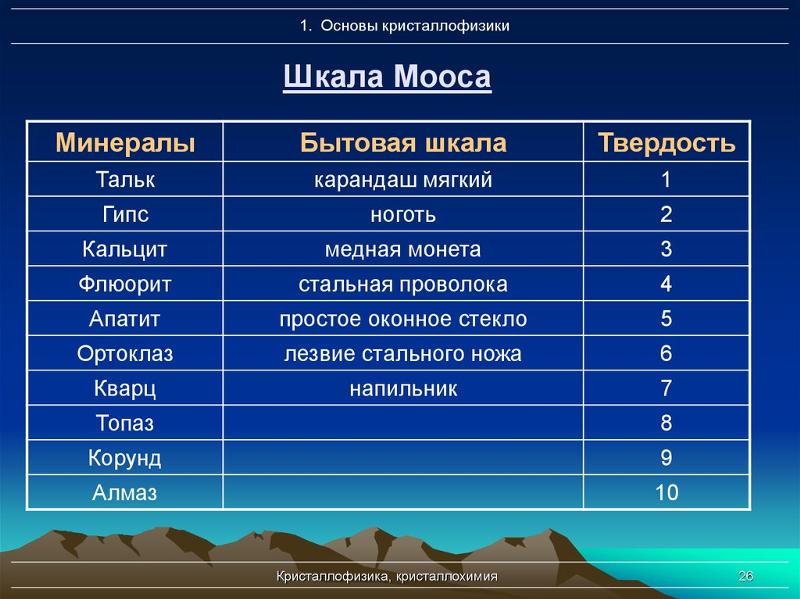 При атмосферном давлении и температуре T> 0 K все вещества, существующие в природе, затвердевают. Исключением из этого правила является только гелий, для кристаллизации которого требуется давление 24 атм.
При атмосферном давлении и температуре T> 0 K все вещества, существующие в природе, затвердевают. Исключением из этого правила является только гелий, для кристаллизации которого требуется давление 24 атм.
Твердое состояние вещества придает ему различные физические свойства. Они характеризуют специфическое поведение тел под действием определенных полей и сил. Эти свойства разделены на группы. Существует 3 метода воздействия, соответствующих 3 видам энергии (механическое, тепловое, электромагнитное). Следовательно, существует 3 группы физических свойств твердых тел:
- Электромагнитный, связанный с воздействием на твердое тело потоков микрочастиц и электромагнитных волн высокой жесткости. Для этого условно указываются радиационные свойства.
- Термический, проявляющийся при воздействии тепловых полей. Одно из важнейших свойств — температура плавления, при которой тело становится жидким. Он содержится в кристаллических твердых телах. Аморфные тела обладают скрытой теплотой плавления, поскольку переход их в жидкое состояние с повышением температуры происходит постепенно.
 При достижении определенного тепла аморфное тело теряет упругость и приобретает пластичность. Это состояние означает, что он достигает температуры стеклования. При нагревании происходит деформация твердого тела. К тому же он очень часто расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на механические свойства, такие как текучесть, пластичность, твердость и прочность.
При достижении определенного тепла аморфное тело теряет упругость и приобретает пластичность. Это состояние означает, что он достигает температуры стеклования. При нагревании происходит деформация твердого тела. К тому же он очень часто расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на механические свойства, такие как текучесть, пластичность, твердость и прочность. - Механические свойства, связанные с напряжениями и деформациями тел. По этим критериям твердые тела делятся на упругие, реологические, стойкие и технологические. В состоянии покоя такое тело сохраняет форму, но может изменяться под действием внешней силы. При этом его деформация может быть пластической (исходная форма не возвращается), упругой (возвращается к исходной форме) или деструктивной (при достижении определенного порога происходит дезинтеграция / разрушение). Реакция на приложенную силу описывается упругими модулями. Твердое тело сопротивляется не только сжатию, удлинению, но и сдвигу, скручиванию и изгибу.
 Прочность твердого тела называется его сопротивлением разрушению.
Прочность твердого тела называется его сопротивлением разрушению.
Зонная структура
Твердые вещества также классифицируются по так называемой зонной структуре. Итак, среди них выделяются:
- Полупроводники характеризуются отсутствием зоны проводимости и валентной зоны. Интервал между ними менее 4 эВ. Для переноса электронов из валентной зоны в проводящую зону требуется меньше энергии, чем для диэлектриков. Чистые полупроводники (нелегированные и собственные) плохо проводят.
- Диэлектрики, зоны которых не перекрываются. Интервал между ними превышает 4 эВ. Для переноса электронов из валентной зоны в проводящую зону требуется много энергии. Благодаря этим свойствам диэлектрики практически не проводят ток.
- Проводники, характеризующиеся тем, что их зоны проводимости и валентные зоны перекрываются. В этом случае электроны могут перемещаться между ними, получая наименьшую энергию. Все металлы считаются проводниками. Когда к такому телу прикладывается разность потенциалов, образуется электрический ток (из-за свободного движения электронов между точками с самым низким и самым высоким потенциалом).

Движение молекул в твердых телах определяет их электромагнитные свойства.
Другие свойства
Твердые тела также разлагаются на основе их магнитных свойств. Есть три группы:
- Тела с упорядоченной магнитной структурой и дальним атомным порядком. В узлах их решетки периодически обнаруживаются частицы с магнитными моментами. Такие твердые вещества и вещества часто используются в различных сферах деятельности человека.
- Парамагнетики, возникающие в результате ориентации электронов проводимости и магнитных моментов атомов. Согласно закону Кюри их восприимчивость уменьшается пропорционально температуре. Так что при 300К это 10-5.
- Диамагнетики, свойства которых мало зависят от температуры или агрегатного состояния.
Самые твердые вещества в природе
Какие они? Плотность твердых тел во многом определяет их твердость. В последние годы ученые открыли несколько материалов, которые претендуют на звание «самого прочного тела». Самым твердым веществом является фуллерит (кристалл с молекулами фуллерена), который примерно в 1,5 раза тверже алмаза. К сожалению, в настоящее время он доступен только в очень малых количествах.
Самым твердым веществом является фуллерит (кристалл с молекулами фуллерена), который примерно в 1,5 раза тверже алмаза. К сожалению, в настоящее время он доступен только в очень малых количествах.
На сегодняшний день самым твердым веществом, которое может быть использовано в промышленности, является лонсдейлит (гексагональный алмаз). Он на 58% тверже алмаза. Лонсдейлит — аллотропная модификация углерода. Его кристаллическая решетка очень похожа на решетку алмаза. Ячейка лонсдейлита содержит 4 атома, а алмаз — 8. Из широко используемых кристаллов алмаз сегодня остается самым твердым.
Поделиться:
- Предыдущая записьЖивотные в почве. Обитатели почвы и их приспособленность к среде
- Следующая записьЧто такое лучевая симметрия? Какие животные имеют лучевую симметрию?
×
Рекомендуем посмотреть
Adblock
detector
свойства, строение, плотность и примеры
Твердыми называют такие вещества, которые способны образовывать тела и имеют объем. От жидкостей и газов они отличаются своей формой. Твердые вещества сохраняют форму тела благодаря тому, что их частицы не способны свободно перемещаться. Они отличаются по своей плотности, пластичности, электропроводности и цвету. Также у них есть и другие свойства. Так, например, большинство данных веществ плавятся во время нагревания, приобретая жидкое агрегатное состояние. Некоторые из них при подогреве сразу же превращаются в газ (возгоняются). Но есть еще и те, которые разлагаются на иные вещества.
От жидкостей и газов они отличаются своей формой. Твердые вещества сохраняют форму тела благодаря тому, что их частицы не способны свободно перемещаться. Они отличаются по своей плотности, пластичности, электропроводности и цвету. Также у них есть и другие свойства. Так, например, большинство данных веществ плавятся во время нагревания, приобретая жидкое агрегатное состояние. Некоторые из них при подогреве сразу же превращаются в газ (возгоняются). Но есть еще и те, которые разлагаются на иные вещества.
Виды твердых веществ
Все твердые вещества подразделяют на две группы.
- Аморфные, в которых отдельные частицы располагаются хаотично. Другими словами: в них нет четкой (определенной) структуры. Эти твердые вещества способны плавиться в каком-то установленном промежутке температур. К самым распространенным из них можно отнести стекло и смолу.
- Кристаллические, которые, в свою очередь, подразделяются на 4 типа: атомные, молекулярные, ионные, металлические. В них частицы располагаются только по определенной схеме, а именно в узлах кристаллической решетки.
 Ее геометрия в разных веществах может сильно различаться.
Ее геометрия в разных веществах может сильно различаться.
Твердые кристаллические вещества преобладают над аморфными по своей численности.
Типы кристаллических твердых веществ
В твердом состоянии практически все вещества имеют кристаллическую структуру. Они отличаются своим строением. Кристаллические решетки в своих узлах содержат различные частицы и химические элементы. Именно в соответствии с ними они и получили свои названия. У каждого типа имеются характерные для него свойства:
- В атомной кристаллической решетке частицы твердого вещества связаны ковалентной связью. Она отличается своей прочностью. Благодаря этому такие вещества отличаются высокой температурой плавления и кипения. К этому типу относятся кварц и алмаз.
- В молекулярной кристаллической решетке связь между частицами отличается своей слабостью. Вещества такого типа характеризуются легкостью закипания и плавления. Они отличаются летучестью, благодаря которой имеют определенный запах.
 К таким твердым телам относятся лед, сахар. Движения молекул в твердых веществах этого типа отличаются своей активностью.
К таким твердым телам относятся лед, сахар. Движения молекул в твердых веществах этого типа отличаются своей активностью. - В ионной кристаллической решетке в узлах чередуются соответствующие частицы, заряженные положительно и отрицательно. Они удерживаются электростатическим притяжением. Данный тип решетки существует в щелочах, солях, основных оксидах. Многие вещества этого вида легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавки. Практически все они не имеют запаха, поскольку для них характерна нелетучесть. Вещества с ионной решеткой неспособны проводить электрический ток, поскольку в их составе нет свободных электронов. Типичный пример ионного твердого вещества – поваренная соль. Такая кристаллическая решетка придает ей хрупкость. Это связано с тем, что любой ее сдвиг может привести к возникновению сил отталкивания ионов.
- В металлической кристаллической решетке в узлах присутствуют только ионы химических веществ, заряженные положительно.
 Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Именно поэтому любые металлы отличаются такой особенностью, как проводимость.
Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Именно поэтому любые металлы отличаются такой особенностью, как проводимость.
Общие понятия о твердом теле
Твердые тела и вещества – это практически одно и то же. Этими терминами называют одно из 4 агрегатных состояний. Твердые тела имеют стабильную форму и характер теплового движения атомов. Причем последние совершают малые колебания рядом с положениями равновесия. Раздел науки, занимающийся изучением состава и внутренней структуры, называют физикой твердого тела. Существуют и другие важные области знаний, занимающиеся такими веществами. Изменение формы при внешних воздействиях и движении называют механикой деформируемого тела.
Благодаря различным свойствам твердых веществ они нашли применение в разных технических приспособлениях, созданных человеком. Чаще всего в основе их употребления лежали такие свойства, как твердость, объем, масса, упругость, пластичность, хрупкость. Современная наука позволяет использовать и другие качества твердых веществ, которые можно обнаружить исключительно в лабораторных условиях.
Современная наука позволяет использовать и другие качества твердых веществ, которые можно обнаружить исключительно в лабораторных условиях.
Что такое кристаллы
Кристаллы – это твердые тела с расположенными в определенном порядке частицами. Каждому химическому веществу соответствует своя структура. Его атомы образуют трехмерно-периодическую укладку, называемую кристаллической решеткой. Твердые вещества обладают различной симметрией структуры. Кристаллическое состояние твердого тела считается устойчивым, поскольку имеет минимальное количество потенциальной энергии.
Подавляющее большинство твердых материалов (природных) состоит из огромного числа беспорядочно ориентированных отдельных зерен (кристаллитов). Такие вещества называют поликристаллическими. К ним относят технические сплавы и металлы, а также множество горных пород. Монокристаллическими называют одиночные природные или синтетические кристаллы.
Чаще всего такие твердые тела образуются из состояния жидкой фазы, представленного расплавом или раствором.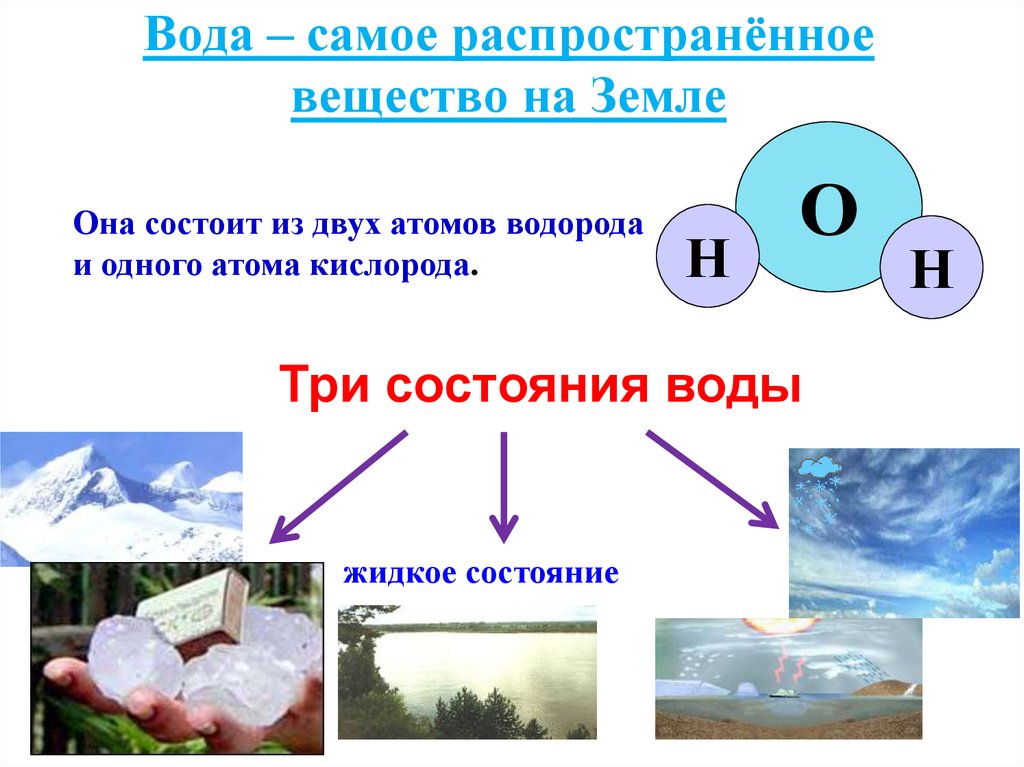 Иногда их получают и из газообразного состояния. Этот процесс называют кристаллизацией. Благодаря научно-техническому прогрессу процедура выращивания (синтеза) различных веществ получила промышленный масштаб. Большинство кристаллов имеет естественную форму в виде правильных многогранников. Их размеры бывают самыми разными. Так, природный кварц (горный хрусталь) может весить до сотен килограммов, а алмазы – до нескольких грамм.
Иногда их получают и из газообразного состояния. Этот процесс называют кристаллизацией. Благодаря научно-техническому прогрессу процедура выращивания (синтеза) различных веществ получила промышленный масштаб. Большинство кристаллов имеет естественную форму в виде правильных многогранников. Их размеры бывают самыми разными. Так, природный кварц (горный хрусталь) может весить до сотен килограммов, а алмазы – до нескольких грамм.
В аморфных твердых телах атомы находятся в постоянном колебании вокруг хаотически находящихся точек. В них сохраняется определенный ближний порядок, но отсутствует дальний. Это обусловлено тем, что их молекулы расположены на расстоянии, которое можно сравнить с их размером. Наиболее часто встречающимся в нашей жизни примером такого твердого вещества является стеклообразное состояние. Аморфные вещества часто рассматриваются как жидкость с бесконечно большой вязкостью. Время их кристаллизации иногда так велико, что и вовсе не проявляется.
Именно вышеперечисленные свойства данных веществ делают их уникальными. Аморфные твердые тела считаются нестабильными, поскольку со временем могут перейти в кристаллическое состояние.
Аморфные твердые тела считаются нестабильными, поскольку со временем могут перейти в кристаллическое состояние.
Молекулы и атомы, из которых состоит твердое вещество, упакованы с большой плотностью. Они практически сохраняют свое взаимоположение относительно иных частиц и держатся вместе благодаря межмолекулярному взаимодействию. Расстояние между молекулами твердого вещества в различных направлениях именуют параметром кристаллической решетки. Структура вещества и ее симметричность определяют множество свойств, таких как электронная зона, спайность и оптика. При воздействии на твердое вещество достаточно большой силы эти качества могут быть в той или иной степени нарушены. При этом твердое тело поддается остаточной деформации.
Атомы твердых тел совершают колебательные движения, которыми обусловлено обладание ими тепловой энергией. Поскольку они ничтожно малы, их можно наблюдать только при лабораторных условиях. Молекулярное строение твердого вещества во многом влияет на его свойства.
Изучение твердых веществ
Особенности, свойства данных веществ, их качества и движение частиц изучаются различными подразделами физики твердого тела.
Для исследования используются: радиоспектроскопия, структурный анализ при помощи рентгена и другие методы. Так изучаются механические, физические и тепловые свойства твердых веществ. Твердость, сопротивление нагрузкам, предел прочности, фазовые превращения изучает материаловедение. Оно в значительной степени перекликается с физикой твердых тел. Существует и другая важная современная наука. Исследование существующих и синтезирование новых веществ проводятся химией твердого состояния.
Особенности твердых веществ
Характер движения внешних электронов атомов твердого вещества определяет многие его свойства, например, электрические. Существует 5 классов таких тел. Они установлены в зависимости от типа связи атомов:
- Ионная, основной характеристикой которой является сила электростатического притяжения. Ее особенности: отражение и поглощение света в инфракрасной области.
 При малой температуре ионная связь отличается малой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl).
При малой температуре ионная связь отличается малой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl). - Ковалентная, осуществляемая за счет электронной пары, которая принадлежит обоим атомам. Такая связь подразделяется на: одинарную (простую), двойную и тройную. Эти названия говорят о наличии пар электронов (1, 2, 3). Двойные и тройные связи называют кратными. Существует еще одно деление этой группы. Так, в зависимости от распределения электронной плотности выделяют полярную и неполярную связь. Первая образуется разными атомами, а вторая – одинаковыми. Такое твердое состояние вещества, примеры которого — алмаз (С) и кремний (Si), отличается своей плотностью. Самые твердые кристаллы относятся именно к ковалентной связи.
- Металлическая, образующаяся путем объединения валентных электронов атомов. В результате чего возникает общее электронное облако, которое смещается под воздействием электрического напряжения. Металлическая связь образуется тогда, когда связываемые атомы большие.
 Именно они способны отдавать электроны. У многих металлов и сложных соединений данной связью образуется твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Из неметаллических соединений можно отметить следующие: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлической связью (металлы) разнообразны по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb).
Именно они способны отдавать электроны. У многих металлов и сложных соединений данной связью образуется твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Из неметаллических соединений можно отметить следующие: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлической связью (металлы) разнообразны по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb). - Молекулярная, возникающая в кристаллах, которые образуются отдельными молекулами вещества. Ее характеризуют промежутки между молекулами с нулевой электронной плотностью. Силы, связывающие атомы в таких кристаллах, значительны. При этом молекулы притягиваются друг к другу только слабым межмолекулярным притяжением. Именно поэтому связи между ними легко разрушаются при нагревании. Соединения между атомами разрушаются намного сложнее. Молекулярная связь подразделяется на ориентационную, дисперсионную и индукционную. Примером такого вещества является твердый метан.

- Водородная, которая возникает между положительно поляризованными атомами молекулы или ее части и отрицательно поляризованной наименьшей частицей иной молекулы либо другой части. К таким связям можно отнести лед.
Свойства твердых веществ
Что нам известно на сегодняшний день? Ученые давно изучают свойства твердого состояния вещества. При воздействии на него температур изменяется и оно. Переход такого тела в жидкость называют плавлением. Трансформация твердого вещества в газообразное состояние называется сублимацией. При понижении температуры происходит кристаллизация твердого тела. Некоторые вещества под действием холода переходят в аморфную фазу. Этот процесс ученые называют стеклованием.
При фазовых переходах изменяется внутренняя структура твердых тел. Наибольшую упорядоченность она приобретает при понижении температуры. При атмосферном давлении и температуре Т > 0 К любые вещества, существующие в природе, затвердевают. Только гелий, для кристаллизации которого нужно давление в 24 атм, составляет исключение из этого правила.
Твердое состояние вещества придает ему различные физические свойства. Они характеризуют специфическое поведение тел под воздействием определенных полей и сил. Эти свойства подразделяют на группы. Выделяют 3 способа воздействия, соответствующие 3 видам энергии (механической, термической, электромагнитной). Соответственно им существует 3 группы физических свойств твердых веществ:
- Механические свойства, связанные с напряжением и деформацией тел. По этим критериям твердые вещества делят на упругие, реологические, прочностные и технологические. В покое такое тело сохраняет свою форму, но оно может изменяться под действием внешней силы. При этом его деформация может быть пластической (начальный вид не возвращается), упругой (возвращается в первоначальную форму) или разрушительной (при достижении определенного порога происходит распад/разлом). Отзыв на прилагаемое усилие описывают модулями упругости. Твердое тело сопротивляется не только сжатию, растяжению, но и сдвигам, кручению и изгибам.
 Прочностью твердого тела называют его свойство сопротивляться разрушению.
Прочностью твердого тела называют его свойство сопротивляться разрушению. - Термические, проявляющиеся при воздействии тепловых полей. Одно из самых важных свойств – температура плавления, при которой тело переходит в жидкое состояние. Оно отмечается у кристаллических твердых веществ. Аморфные тела обладают скрытой теплотой плавления, поскольку их переход в жидкое состояние при повышении температуры происходит постепенно. По достижении определенной теплоты аморфное тело теряет упругость и приобретает пластичность. Это состояние означает достижение им температуры стеклования. При нагревании происходит деформация твердого тела. Причем оно чаще всего расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на такие механические характеристики, как текучесть, пластичность, твердость и прочность.
- Электромагнитные, связанные с воздействием на твердое вещество потоков микрочастиц и электромагнитных волн большой жесткости. К ним условно относят и радиационные свойства.

Зонная структура
Твердые вещества классифицируются и по так называемой зонной структуре. Так, среди них различают:
- Проводники, отличающиеся тем, что зоны их проводимости и валентности перекрываются. При этом электроны могут перемещаться между ними, получая малейшую энергию. К проводникам относятся все металлы. При приложении к такому телу разности потенциалов образуется электрический ток (благодаря свободному передвижению электронов между точками с наименьшим и большим потенциалом).
- Диэлектрики, зоны которых не перекрываются. Интервал между ними превышает 4 эВ. Для проведения электронов из валентной в проводимую зону необходима большая энергия. Благодаря таким свойствам диэлектрики практически не проводят ток.
- Полупроводники, характеризующиеся отсутствием зон проводимости и валентности. Интервал между ними меньше 4 эВ. Для перевода электронов из валентной в проводимую зону необходима энергия меньшая, чем для диэлектриков. Чистые (нелегированные и собственные) полупроводники плохо пропускают ток.

Движения молекул в твердых веществах обуславливают их электромагнитные свойства.
Другие свойства
Твердые тела подразделяются и по своим магнитным свойствам. Есть три группы:
- Диамагнетики, свойства которых мало зависят от температуры или агрегатного состояния.
- Парамагнетики, являющиеся следствием ориентации электронов проводимости и магнитных моментов атомов. Согласно закону Кюри, их восприимчивость убывает пропорционально температуре. Так, при 300 К она составляет 10-5.
- Тела с упорядоченной магнитной структурой, обладающие дальним порядком атомов. В узлах их решетки периодически располагаются частицы с магнитными моментами. Такие твердые тела и вещества часто используются в разных сферах деятельности человека.
Самые твердые вещества в природе
Какие же они? Плотность твердых веществ во многом определяет их твердость. За последние годы ученые открыли несколько материалов, которые претендуют на звание «наиболее прочного тела».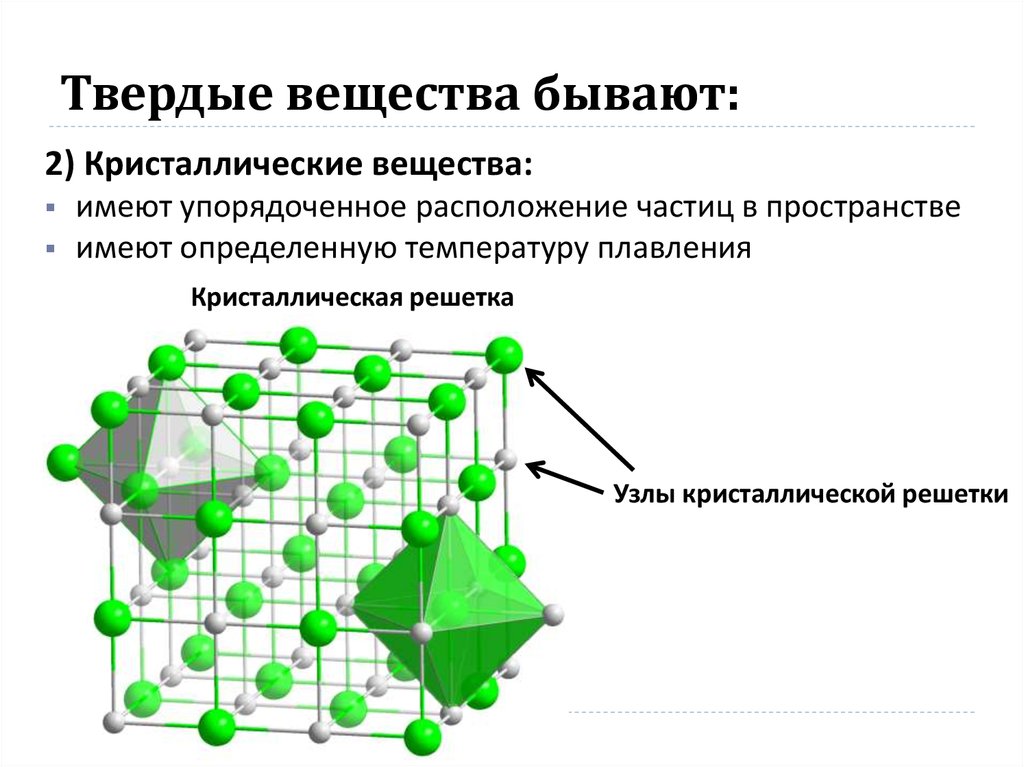 Самое твердое вещество – это фуллерит (кристалл с молекулами фуллерена), который примерно в 1,5 раза тверже алмаза. К сожалению, он пока доступен только в крайне малых количествах.
Самое твердое вещество – это фуллерит (кристалл с молекулами фуллерена), который примерно в 1,5 раза тверже алмаза. К сожалению, он пока доступен только в крайне малых количествах.
На сегодняшний день самое твердое вещество, которое в дальнейшем, возможно, будет использоваться в промышленности, – лонсдейлит (гексагональный алмаз). Он на 58% тверже бриллианта. Лонсдейлит – аллотропная модификация углерода. Его кристаллическая решетка очень напоминает алмазную. Ячейка лонсдейлита содержит 4 атома, а бриллианта – 8. Из широко используемых кристаллов на сегодня самым твердым остается алмаз.
Самое твердое вещество | Физика Фургон
Категория
Выберите категориюО фургоне физикиЭлектричество и магнитыВсе остальноеСвет и звукДвижение вещейНовая и захватывающая физикаСостояния материи и энергииКосмосПод водой и в воздухе
Подкатегория
Поиск
Задайте вопрос
Последний ответ: 22.10.2007
Вопрос:
Какое известно самое твердое вещество?
— Эрика (10 лет)
Старшая школа Эммердейла, Лондон
A:
Эрика —
Самым твердым известным веществом является алмаз. [но см. примечание ниже] Алмаз полностью состоит из углерода. (Еще одна вещь, полностью сделанная из углерода, — это графит, одно из самых мягких веществ.) Твердость алмаза составляет примерно 10,5–14,5 миллионов фунтов на квадратный дюйм.
[но см. примечание ниже] Алмаз полностью состоит из углерода. (Еще одна вещь, полностью сделанная из углерода, — это графит, одно из самых мягких веществ.) Твердость алмаза составляет примерно 10,5–14,5 миллионов фунтов на квадратный дюйм.
Второе по твердости вещество представляет собой соединение алюминия, магния и бора. Впервые он был сделан в 1992 году учеными лаборатории Эймса в Айове. Его твердость составляет 6,67 миллиона фунтов на квадратный дюйм (примерно вдвое меньше, чем у алмаза). Дополнительную информацию можно найти на странице https://books.google.com/books?id=2866dn1ssCEC&pg=RA1-PA64&dq=19.92+Эймс+Лаборатория+в+Айове+корунд+пресс+релиз&hl=en&newbks=1&newbks_redir=0&sa=X&ved=2ahUKEwiIr4GXi-vmAhXYKs0KHafzA00Q6AEwAHoECAEQAg#v=onepage&q=1992%20Ames%20Laboratory%20in%20Iowa%20press20Laboratory%20in%20Iowa%20corundum
Подобные твердые вещества очень полезны для таких вещей, как сверла, поскольку обычные сверла сломаются, если вы попытаетесь пройти через что-то более твердое, чем они. Поэтому, когда они хотят прорезать что-то /очень/твердое, вместо этого они используют алмазные сверла. Но поскольку алмазы такие дорогие, иногда вместо них используют соединения алюминия, магния и бора, о которых я упоминал.
Поэтому, когда они хотят прорезать что-то /очень/твердое, вместо этого они используют алмазные сверла. Но поскольку алмазы такие дорогие, иногда вместо них используют соединения алюминия, магния и бора, о которых я упоминал.
-Тамара
(опубликовано 22.10.2007)
Продолжение #1: новый жесткий материал
В:
Пожалуйста, исправьте свой ответ девушке.
Существует более одного вещества. Один из них будет известен как «Сверхтвердый фуллерит C60».
— Лос-Анджелес
ЛУИСВИЛЬ, Кентукки.
А:
Мы рады передать эту информацию. См. статью в Википедии и ссылки в ней.
спасибо,
Майк В.
Lee H
(опубликовано 22.10.2007)
Дополнение №2: вюрцит и лонсдейлит
Q:
Это не вопрос, это поправка. Алмаз — самое твердое природное вещество, встречающееся на Земле. Но это не самое твердое вещество. Нитрид бора вюрцит (синтетический) и лонсдейлит (полученный из метеоритов) тверже.
— Марси Сиви (39 лет)
Ватерлоо, Айова, США
A:
Спасибо за совет. Насколько я могу судить, настоящие образцы этих материалов не такие твердые, как существующие алмазы. Есть расчеты, указывающие на то, что их бездефектные версии должны быть тверже бездефектного алмаза. Однако это не очень термодинамически стабильные материалы, поэтому, возможно, неудивительно, что не было найдено ни одного близкого к идеальному образца.
Mike W.
(опубликовано 26.10.2011)
Дополнение к этому ответу
Связанные вопросы
Что такое композитный материал?
Будет ли спичечный коробок, полный ядер, весить больше, чем Земля?
использование погруженного веса для расчета плотности
объем воды в зависимости от температуры
Плотность булочки?
измерение плотности маффинов
Связь между температурой и плотностью?
Плотность
Какой водный эквивалент снега?
Является ли бетон хорошим проводником тепла?
Все еще интересно?
Вопросы и ответы по Expore в связанных категориях
- Плотность и твердость
Какое самое твердое вещество в организме человека?
Какое самое твердое вещество в организме человека?
Самое твердое вещество в организме содержит до 96% минералов. Остальное состоит из воды и других органических материалов. Основным минералом в этом веществе является гидроксиапатит, представляющий собой кристаллический фосфат кальция. После полного формирования это вещество не содержит кровеносных сосудов или нервов.
Остальное состоит из воды и других органических материалов. Основным минералом в этом веществе является гидроксиапатит, представляющий собой кристаллический фосфат кальция. После полного формирования это вещество не содержит кровеносных сосудов или нервов.
Толщина этого вещества у человека разная, но в среднем достигает 2,5 мм в самой толстой части. Цвет часто варьирует от светло-желтого до сероватого (голубовато-белого). Большое количество минералов в этом веществе объясняет не только его прочность, но и хрупкость. По шкале твердости Мооса он занимает 5 баллов из 10.
Вы знаете, что это такое?
Эмаль!
Зубная эмаль – самое твердое вещество в организме.
Эмаль образуется на зубе, пока зуб развивается в десне, прежде чем он прорежется в рот. Зубная эмаль является одной из четырех основных тканей, из которых состоит зуб человека и многих других животных, включая некоторые виды рыб. В норме он составляет видимую часть зуба, покрывающую коронку. Три другие ткани, из которых состоит зуб, — это дентин, цемент и пульпа зуба. Реминерализация зубов может частично исправить незначительное повреждение зуба, но любой другой ущерб не может быть устранен организмом. Шкала модуля Юнга является мерой жесткости твердого материала. Эмаль имеет модуль Юнга 83 ГПа. Эмаль не содержит коллагена, который содержится в других твердых тканях, таких как дентин и кость, но содержит два уникальных класса белков: амелогенины и эмалины. Хотя роль этих белков до конца не изучена, считается, что они способствуют развитию эмали, выступая в качестве основы для формирования минералов.
Три другие ткани, из которых состоит зуб, — это дентин, цемент и пульпа зуба. Реминерализация зубов может частично исправить незначительное повреждение зуба, но любой другой ущерб не может быть устранен организмом. Шкала модуля Юнга является мерой жесткости твердого материала. Эмаль имеет модуль Юнга 83 ГПа. Эмаль не содержит коллагена, который содержится в других твердых тканях, таких как дентин и кость, но содержит два уникальных класса белков: амелогенины и эмалины. Хотя роль этих белков до конца не изучена, считается, что они способствуют развитию эмали, выступая в качестве основы для формирования минералов.
Можно ли восстановить зубную эмаль?
Самым твердым веществом в организме является зубная эмаль. Зубная эмаль не является живой тканью, поэтому она не может регенерироваться естественным путем, как другие ткани нашего тела. Когда наша кожа рвется, она заживает. Мы стрижем волосы и ногти, и они снова отрастают. Даже наши сломанные кости срастаются. Это потому, что эти ткани на нашем теле живые. Зубную эмаль нельзя восстановить, но можно реминерализовать. Кислота из пищи и напитков вытягивает кальций и фосфаты из зуба, что ослабляет эмаль. Специальные зубные пасты и жидкости для полоскания рта могут на самом деле выталкивать кальций и фосфаты обратно в зуб, что приводит к затвердеванию эмали. Фтор в зубной пасте и жидкости для полоскания рта захватывает минералы из слюны и выталкивает их обратно в зуб.
Зубную эмаль нельзя восстановить, но можно реминерализовать. Кислота из пищи и напитков вытягивает кальций и фосфаты из зуба, что ослабляет эмаль. Специальные зубные пасты и жидкости для полоскания рта могут на самом деле выталкивать кальций и фосфаты обратно в зуб, что приводит к затвердеванию эмали. Фтор в зубной пасте и жидкости для полоскания рта захватывает минералы из слюны и выталкивает их обратно в зуб.
Зубная эмаль тверже алмаза?
Зубная эмаль не тверже алмаза. Твердость материала или минералов Шкала Мооса — это шкала твердости, используемая для классификации минералов. Используя ряд различных минералов и позиций, шкала Мооса является грубой мерой сопротивления гладкой поверхности царапанью по шкале от 1 до 10. Алмазы — самый твердый природный материал. Зубная эмаль имеет 5 баллов по шкале твердости Мооса. Это означает, что ваши зубы тверже золота, серебряного железа и даже стали! Существует несколько различных тестов и шкал твердости, включая тест на твердость по Виккерсу, шкалу Бринелля и тест на твердость по Янке.

 Между ними находятся свободные электроны, через которые идеально проходит тепловая и электрическая энергия. Именно поэтому все металлы отличаются такой характеристикой, как проводимость.
Между ними находятся свободные электроны, через которые идеально проходит тепловая и электрическая энергия. Именно поэтому все металлы отличаются такой характеристикой, как проводимость. Многие вещества этого типа легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавкие. Практически все они не имеют запаха, так как нелетучие. Вещества с ионной решеткой не способны проводить электрический ток, так как в их составе нет свободных электронов. Типичным примером ионного твердого вещества является поваренная соль. Эта кристаллическая решетка делает его хрупким. Это связано с тем, что любое его смещение может привести к появлению сил отталкивания ионов.
Многие вещества этого типа легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавкие. Практически все они не имеют запаха, так как нелетучие. Вещества с ионной решеткой не способны проводить электрический ток, так как в их составе нет свободных электронов. Типичным примером ионного твердого вещества является поваренная соль. Эта кристаллическая решетка делает его хрупким. Это связано с тем, что любое его смещение может привести к появлению сил отталкивания ионов. Его характеристики: отражение и поглощение света в инфракрасной области. При низких температурах ионная связь характеризуется низкой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl).
Его характеристики: отражение и поглощение света в инфракрасной области. При низких температурах ионная связь характеризуется низкой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl). Силы, связывающие атомы в таких кристаллах, значительны. В этом случае молекулы притягиваются друг к другу только за счет слабого межмолекулярного притяжения. Поэтому связи между ними легко разрушаются при нагревании. Связи между атомами разрушить гораздо труднее. Молекулярная связь делится на ориентационную, дисперсионную и индуктивную. Примером такого вещества является твердый метан.
Силы, связывающие атомы в таких кристаллах, значительны. В этом случае молекулы притягиваются друг к другу только за счет слабого межмолекулярного притяжения. Поэтому связи между ними легко разрушаются при нагревании. Связи между атомами разрушить гораздо труднее. Молекулярная связь делится на ориентационную, дисперсионную и индуктивную. Примером такого вещества является твердый метан. При достижении определенного тепла аморфное тело теряет упругость и приобретает пластичность. Это состояние означает, что он достигает температуры стеклования. При нагревании происходит деформация твердого тела. К тому же он очень часто расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на механические свойства, такие как текучесть, пластичность, твердость и прочность.
При достижении определенного тепла аморфное тело теряет упругость и приобретает пластичность. Это состояние означает, что он достигает температуры стеклования. При нагревании происходит деформация твердого тела. К тому же он очень часто расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на механические свойства, такие как текучесть, пластичность, твердость и прочность. Прочность твердого тела называется его сопротивлением разрушению.
Прочность твердого тела называется его сопротивлением разрушению.
 Ее геометрия в разных веществах может сильно различаться.
Ее геометрия в разных веществах может сильно различаться. К таким твердым телам относятся лед, сахар. Движения молекул в твердых веществах этого типа отличаются своей активностью.
К таким твердым телам относятся лед, сахар. Движения молекул в твердых веществах этого типа отличаются своей активностью.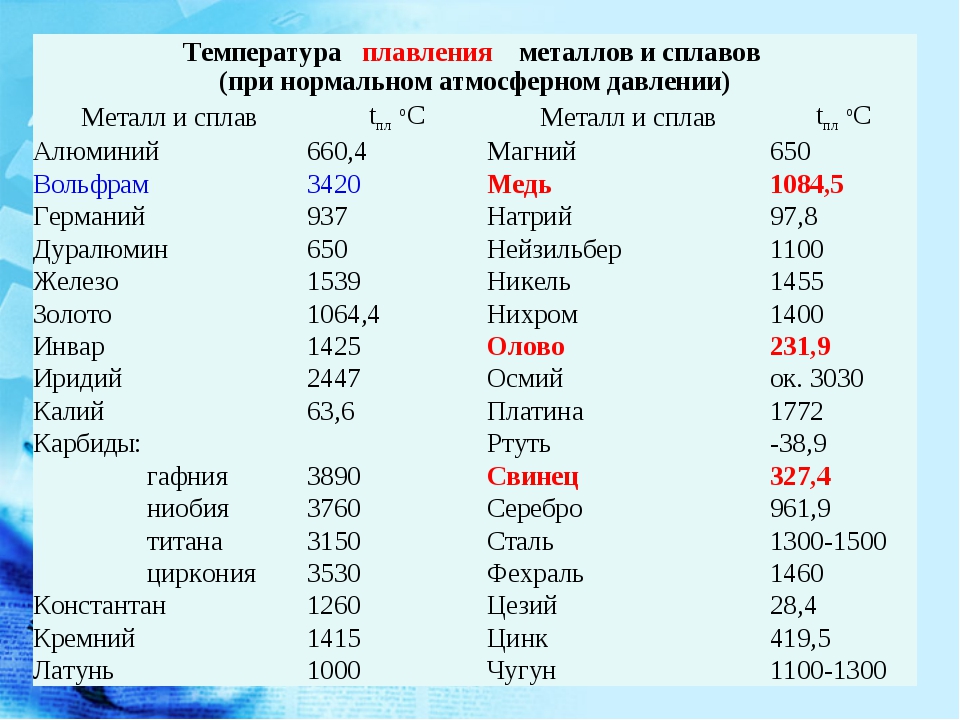 Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Именно поэтому любые металлы отличаются такой особенностью, как проводимость.
Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Именно поэтому любые металлы отличаются такой особенностью, как проводимость. При малой температуре ионная связь отличается малой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl).
При малой температуре ионная связь отличается малой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl). Именно они способны отдавать электроны. У многих металлов и сложных соединений данной связью образуется твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Из неметаллических соединений можно отметить следующие: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлической связью (металлы) разнообразны по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb).
Именно они способны отдавать электроны. У многих металлов и сложных соединений данной связью образуется твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Из неметаллических соединений можно отметить следующие: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлической связью (металлы) разнообразны по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb).
 Прочностью твердого тела называют его свойство сопротивляться разрушению.
Прочностью твердого тела называют его свойство сопротивляться разрушению.