Содержание
Изменение картинки пользователя в окне входа на Mac
Поиск по этому руководству
Добро пожаловать!
Строка меню
Spotlight
Пункт управления
Siri
Центр уведомлений
Рабочий стол
Dock
Finder
Подключение к интернету
Просмотр веб-сайтов
Регулировка громкости
Создание снимка экрана или записи экрана
Просмотр и редактирование файлов при помощи Быстрого просмотра
Быстрая запись короткой заметки
Настройка Экранного времени для себя
Настройка фокусирования для сосредоточения на задаче
Редактирование фотографий и видео в приложении «Фото»
Использование функции «Что на картинке?» с фотографиями
Получение маршрутов в приложении «Карты»
Создание записи в приложении «Диктофон»
Использование жестов трекпада и мыши
Использование панели Touch Bar
Использование Touch ID
Использование сочетаний клавиш
Обновление macOS
Встроенные приложения
Открытие приложений
Работа с окнами приложений
Использование приложений в полноэкранном режиме
Использование приложений в режиме Split View
Загрузка приложений из Mac App Store
Установка и переустановка приложений из Mac App Store
Установка и удаление других приложений
Изменение системных настроек
Изменение картинки на рабочем столе
Использование заставок
Добавление учетной записи электронной почты и других учетных записей
Использование быстрых команд для автоматизации задач
Создание Memoji в приложении «Сообщения»
Изменение картинки, представляющей Вас или других людей в приложениях
Смена языка системы
Улучшение видимости экрана
Создание документов и работа с ними
Открытие документов
Использование диктовки
Добавление примечаний к файлам
Объединение файлов в один файл PDF
Печать документов
Организация рабочего стола с помощью стопок
Группировка файлов по папкам
Добавление тегов к файлам и папкам
Отправка электронных писем
Использование функции «Онлайн-текст» для взаимодействия с текстом на фотографии
Резервное копирование файлов
Восстановление файлов
Создание Apple ID
Управление настройками Apple ID
Что такое iCloud?
Что такое iCloud+?
Настройка iCloud на компьютере Mac
Хранение файлов в iCloud Drive
Обмен файлами с помощью Общего доступа к файлам iCloud
Управление хранилищем iCloud
Использование Фото iCloud
Что такое «семейный доступ»?
Настройка Семейного доступа
Добавление пользователей на Mac
Настройка Экранного времени для ребенка
Совместное использование покупок с членами семьи
Совершение вызова FaceTime
Использование SharePlay для совместного просмотра и прослушивания
Отправка текстовых сообщений
Предоставление общего доступа к календарю членам семьи
Просмотр контента, которым с Вами поделились
Просмотр геопозиций друзей и близких
Многопользовательские игры с друзьями
Использование Непрерывности для работы с несколькими устройствами Apple
Потоковая передача аудио и видео через AirPlay
Использование клавиатуры и мыши или трекпада для управления несколькими устройствами
Использование iPad в качестве второго дисплея
Передача задач между устройствами
Вставка фотографий и отсканированных документов с iPhone или iPad
Вставка зарисовок с iPhone или iPad
Копирование и вставка с использованием нескольких устройств
Использование Apple Watch для разблокировки Mac
Совершение и прием вызовов на Mac
Пересылка файлов между устройствами с помощью AirDrop
Синхронизация музыки, книг и других материалов между устройствами
Воспроизведение музыки
Прослушивание подкастов
Просмотр фильмов и телешоу
Чтение и прослушивание книг
Чтение новостей
Отслеживание курсов акций
Подписка на Apple Music
Подписка на Apple TV+
Подписка на Apple Arcade
Подписка на Apple News+
Подписка на подкасты и каналы
Управление подписками в App Store
Просмотр семейных подписок на сервисы Apple
Управление файлами cookie и другими данными веб-сайтов в Safari
Использование режима частного доступа в Safari
Просмотр отчетов о конфиденциальности в Safari
О паролях
Сброс пароля для входа в систему Mac
Создание и автозаполнение надежных паролей
Обеспечение безопасности Apple ID
Настройка защиты компьютера Mac
Защита конфиденциальности в Почте
Сохранение конфиденциальности
Оплата через Apple Pay в Safari
Использование функции «Вход с Apple» для приложений и веб-сайтов
Защита компьютера Mac от вредоносного ПО
Управление доступом к камере
Поиск пропавшего устройства
Начало работы с функциями универсального доступа
Зрение
Слух
Моторика и координация
Основные
Изменение яркости экрана
Подключение беспроводной клавиатуры, мыши или трекпада
Подключение других беспроводных устройств
Подключение монитора, телевизора или проектора
Добавление принтера
Использование встроенной камеры
Использование наушников AirPods с компьютером Mac
Экономия энергии на Mac
Оптимизация хранилища
Запись CD- и DVD-дисков
Управление домашними аксессуарами
Запуск системы Windows на компьютере Mac
Ресурсы для Mac
Ресурсы для устройств Apple
Авторские права
Можно изменить картинку, которая будет отображаться рядом с Вашим именем или именем другого пользователя в окне входа на Mac. Вы можете выбрать фото из своей медиатеки, сделать снимок на камеру своего Mac, выбрать Memoji или эмодзи, использовать инициалы как монограмму и использовать другие варианты изображения. Ваше изображение для экрана входа также используется в качестве Вашей картинки Apple ID и картинки в личной карточке в Контактах.
Вы можете выбрать фото из своей медиатеки, сделать снимок на камеру своего Mac, выбрать Memoji или эмодзи, использовать инициалы как монограмму и использовать другие варианты изображения. Ваше изображение для экрана входа также используется в качестве Вашей картинки Apple ID и картинки в личной карточке в Контактах.
См. такжеНастройка обычных, гостевых пользователей и групп на Mac
Максимальное количество символов:
250
Не указывайте в комментарии личную информацию.
Максимальное количество символов: 250.
Благодарим вас за отзыв.
Брекет система: лечение, фото, в Москве
Установка брекет системы
Патологический прикус — это не только эстетическая проблема. При неправильном расположении зубов идет дополнительная, незапланированная природой, нагрузка на зубные корни и десны, вследствие чего могут происходить различные неприятные вещи, такие как воспаление десен или шаткость зубов. Поэтому исправление прикуса даёт не только визуальный эффект, выражающийся в красоте вашей улыбки, но и улучшает функциональность и здоровье дентального ряда. Если не повезло с идеальной улыбкой – не стоит расстраиваться! В настоящее время исправление прикуса уже практически доведено до совершенства и успешно осуществляется с помощью установки брекет-систем и других ортодонтических конструкций.
Поэтому исправление прикуса даёт не только визуальный эффект, выражающийся в красоте вашей улыбки, но и улучшает функциональность и здоровье дентального ряда. Если не повезло с идеальной улыбкой – не стоит расстраиваться! В настоящее время исправление прикуса уже практически доведено до совершенства и успешно осуществляется с помощью установки брекет-систем и других ортодонтических конструкций.
Лечение брекет системой
Недостатком этого метода является длительность лечения для достижения результата. Но это единственный метод исправления прикуса и восстановления эстетики дентального ряда в современной стоматологии. Брекеты носятся в среднем 2 года. Причем значительный результат уже проявляется после двух-трех месяцев применения брекет-системы, и у пациента может возникнуть иллюзия, что пора уже снимать брекеты. Но столь короткого срока недостаточно для стабилизации зуба в новом положении и если брекеты снять, то зуб может снова прийти в движение и занять привычное для него ранее неправильное положение.
В каком возрасте лучше проводить лечение брекет-системами
В детстве и юности зубные ряды имеют более высокую пластичность, поэтому исправление прикуса в более юном возрасте будет эффективнее. Но это не значит, что у взрослых исправление прикуса невозможно. Можно сказать что практически в любом возрасте есть возможность исправить прикус, просто процесс исправления может оказаться более длительным.
Из чего состоит брекет-система
Брекет-система это сложная конструкция, которая состоит из следующих элементов:
- специальных пластин, которые устанавливаются на каждый зуб и крепятся врачом-ортодонтом при помощи специального раствора, собственно брекетов;
- металлических дуг, которые продеваются в пластины и формируют в систему, именно металлические дуги создают необходимое давление в нужном направлении, что заставляет зуб принять желательное положение;
- замочков или лигатур, которые крепятся на пластинах и позволяют провести металлическую дугу.

Типы брекет-систем
Брекет-системы подразделяются в зависимости от материала из которого изготавливаются. Вот основные типы брекетов:
- Металлические. Это наиболее распространенный тип брекетов. Он является самым давним, проверенным, а главное дешевым видом брекетов.
- Пластиковые. Применяются в случаях, когда нет необходимости в длительном ношении брекетов и чаще всего для исправления прикуса у детей.
- Керамические. Главными своими достоинствами имеют меньший размер и оттенок максимально похожий на цвет зубной эмали, что делает их малозаметными.
- Сапфировые. Сложно сказать, что у них есть преимущества перед керамическими, но многие считают их более эстетичными. К тому же их цена тоже больше чем у керамических.
Также брекет-системы делятся на два типа по способу установки:
- внешние или вестибулярные, они крепятся с наружной стороны зубов;
- внутренние или лингвальные, крепятся с внутренней стороны зубов, они же называются невидимыми.

Внутренние брекеты незаметны со стороны и считаются более эстетичными. Они чаще всего устанавливаются взрослым пациентам, так как ношение брекетов у взрослых занимает более длительный период. При их изготовлении используется металл, содержащий золото, что существенно увеличивает их стоимость. Чаще используются внешние брекет-системы, так как они способны справиться с более сложными нарушениями прикуса, чем лингвальные. Также в пользу внешних брекетов играет их значительно меньшая стоимость.
Установка брекет системы
Установка систем брекетов происходит не одномоментно. Ей предшествует подготовительный этап. Для того, чтобы правильно установить брекет-систему, необходимо произвести исследование состояния зубов. Проводятся рентгенологические исследования зубов (выполняется снимок всех зубов — ортопантограмма), делаются фотографии зубов и лица и слепки для точной настройки брекет-системы. Также перед установкой брекет системы нужно произвести полную санацию ротовой полости – лечение всех зубов. Это очень важно потому, что ношение брекетов продлится около двух лет и желательно, чтобы за этот период не возникло никаких проблем.
Это очень важно потому, что ношение брекетов продлится около двух лет и желательно, чтобы за этот период не возникло никаких проблем.
Далее следует сама установка брекет-системы. Врач-ортодонт фиксирует специальным раствором пластины на зубах, крепит на них замочки и устанавливает металлические дуги. Процесс установки длится до 3-х часов. На процедуру необходимо приходить сытым, это значительно снизит слюноотделение.
Гигиена полости рта при ношении брекетов
Очень важно правильно осуществлять гигиенические процедуры при ношении брекетов. Для этого существуют специальные зубные щетки и гигиенические средства, которые вам поможет подобрать стоматолог-ортодонт. Так как при ношении брекетов повышается риск повреждения зубов, чтобы избежать проблем в дальнейшем, к вопросу гигиены полости рта в этот период необходимо отнестись очень серьезно.
Настройка системы брекетов
После установки системы брекетов в среднем через два месяца проводится её настройка. При этом металлическая дуга или натягивается сильнее или же меняется на новую. Это необходимо для коррекции процесса исправления прикуса.
При этом металлическая дуга или натягивается сильнее или же меняется на новую. Это необходимо для коррекции процесса исправления прикуса.
Привыкание к брекет системам
К сожалению, после установки системы брекетов, может ощущаться дискомфорт. Он выражается в неприятных ощущениях в деснах и губах, возможно даже небольших воспалениях. Также может ощущаться незначительная боль из-за давления на зубы. В течение одной или двух недель происходит привыкание и неприятные ощущения исчезают.
Также возможны дискомфортные или даже болевые ощущения после каждой настройки системы брекетов, которые тоже проходят через недельку другую. Лечение с использованием брекетов длительный и не всегда комфортный процесс. Но результат стоит затраченных усилий и терпения. Наградой станет идеальная блистательная улыбка, которая будет радовать вас и окружающих.
Фонд Росконгресс – Информационно-аналитическая система Росконгресс
«За прошедшие годы Фонд вырос в крупную, авторитетную структуру, завоевал признание — как эффективный организатор важнейших конгрессов и выставок — как в России, так и за ее пределами».
Владимир Путин, Президент Российской Федерации
Рус
Eng
عربي
ЕЛКВход в ЕЛК
Единый личный кабинет (ЕЛК) – это информационно-коммуникационная площадка и сервисная платформа для участников всех мероприятий Фонда Росконгресс.
Если у вас нет аккаунта, вы можете зарегистрироваться. После завершения регистрации на указанную в форме электронную почту придет письмо с логином и паролем для входа в ЕЛК.
Если вы уже зарегистрированы в ЕЛК, но забыли логин и пароль, вы можете воспользоваться функцией восстановления логина и пароля на странице входа в ЕЛК или написать на почту weboffice@roscongress.org.
Подробнее
Новости
В Салехарде стартовало мероприятие-спутник Конгресса молодых ученых
4 октября 2022
6 октября 2022 г. в Москве состоится Церемония награждения победителей XIII литературной Премии «Радуга» — молодых итальянских и российских писателей и переводчиков.
в Москве состоится Церемония награждения победителей XIII литературной Премии «Радуга» — молодых итальянских и российских писателей и переводчиков.
3 октября 2022
Алтай – столица счастья: подведены итоги II Алтайского экологического форума «Нить природы»
3 октября 2022
Алтай – место силы экотуризма
1 октября 2022
Компетенции Фонда
Организация мероприятий
Работа с участниками мероприятий
Организация информационного центра
Организация многоканального колл-центра
Развитие инноваций
Международное и региональное сотрудничество
Формирование социальной экосистемы
Организация спортивных и зрелищных мероприятий
Организация культурных мероприятий, кинопроизводство
Организация сервисов
Экспертно-аналитическая работа
Информационно-медийное сопровождение
Возможности для неформального общения
Видео-канал
00 :01 :31
ICJI EEF22 aftermovie
30 сентября 2022
00 :13 :01
КОСМОДРОМ «ВОСТОЧНЫЙ» И КОСМОГРАД ЦИОЛКОВСКИЙ | ДЕНЬ КОСМОНАВТИКИ
12 апреля 2022
00 :12 :49
АМУРСКАЯ ОБЛАСТЬ. БЛАГОВЕЩЕНСК
БЛАГОВЕЩЕНСК
7 апреля 2022
00 :13 :09
ПРИМОРСКИЙ КРАЙ. ЧАСТЬ 3
4 февраля 2022
00 :59 :00
4-ая промышленная революция и роботизация уже идут! Что могут сегодня роботы?Когда они заменят тебя?
29 декабря 2021
00 :24 :51
АРКТИЧЕСКИЕ РЕГИОНЫ РОССИИ: ЯНАО
23 декабря 2021
00 :23 :54
АРКТИЧЕСКИЕ РЕГИОНЫ РОССИИ: МУРМАНСКАЯ ОБЛАСТЬ
9 декабря 2021
00 :53 :53
НОВАЯ ЕДА. Сельское хозяйство и экология. Что мы будем есть в будущем?
Сельское хозяйство и экология. Что мы будем есть в будущем?
7 октября 2021
00 :14 :59
ЧЕЛЯБИНСКАЯ ОБЛАСТЬ: ПРИРОДНЫЕ БОГАТСТВА И АКТИВНЫЙ ОТДЫХ. ЧАСТЬ 2.
13 сентября 2021
00 :08 :23
ДВФУ – ЦЕНТР ПРИТЯЖЕНИЯ ТАЛАНТОВ НА ОСТРОВЕ РУССКИЙ
1 сентября 2021
00 :15 :04
ВЛАДИВОСТОК: ТОЧКА РОСТА ДАЛЬНЕГО ВОСТОКА. ЧАСТЬ 1.
31 августа 2021
00 :16 :13
ЮЖНЫЙ УРАЛ. ОТ РОДИНЫ РУССКОГО БУЛАТА ДО ЧИСТЕЙШИХ ОЗЕР И КАМЕННЫХ РЕК. ЧАСТЬ 1.
ОТ РОДИНЫ РУССКОГО БУЛАТА ДО ЧИСТЕЙШИХ ОЗЕР И КАМЕННЫХ РЕК. ЧАСТЬ 1.
23 августа 2021
00 :00 :40
Крупномасштабные учения в арктической зоне
12 августа 2021
00 :08 :09
КОСМОДРОМ БАЙКОНУР | РАКЕТА «СОЮЗ-2» СТАРТУЕТ С СИМВОЛИКОЙ ЧУВАШСКОЙ РЕСПУБЛИКИ
15 июля 2021
01 :31 :26
IT по-крупному: B2B- и B2G-коммуникации в туризме
11 июня 2021
00 :01 :36
Как мы оказались в новой реальности?
2 июня 2021
00 :12 :20
Стартап Ержана, кофе без кофе, робопицца, голосование за носки
23 мая 2021
00 :25 :26
Стартап на сверчках: как продавать муку из насекомых | Бизнес на корме для животных ONTO pet food
17 мая 2021
00 :10 :31
Покупка Twitter, Джессика Альба стартапер, здоровые предприниматели — новости стартапов за неделю
16 мая 2021
00 :21 :48
ГОРНАЯ ШОРИЯ: ПОЧЕМУ ЭТО НАДО УВИДЕТЬ?
13 мая 2021
Ближайшие мероприятия
Российское
Открытый областной медиафорум профессионального мастерства среди редакций и журналистов средств массовой информации «Черное золото России – 2022»
5-7 октября 2022
Кемерово, Россия
Российское
Российская энергетическая неделя – 2022
12-14 октября 2022
Москва, Россия
rusenergyweek. com
com
Зарубежное
XV Веронский Евразийский экономический форум
27-28 октября 2022
Баку, Азербайджан
Российское
Первый Российский винодельческий форум
24-26 ноября 2022
Москва, Россия
Российское
II Конгресс молодых ученых
1-3 декабря 2022
Федеральная территория «Сириус», Парк науки и искусства «Сириус»
Российское
VII Международная конференция по квантовым технологиям ICQT-2023
17-21 июля 2023
Москва, Россия
Экспертное мнение
Экспертное мнение
04.10.2022
Артем Довлатов: «Результаты работы будут заметны для всех жителей Дальнего Востока»
Экспертное мнение
29. 09.2022
09.2022
О реакции китайской стороны на ВЭФ-2022
Экспертное мнение
07.09.2022
Яркие цитаты ВЭФ-2022: Участники форума об энергетике и климате
Экспертное мнение
07.09.2022
Яркие цитаты ВЭФ-2022: Участники форума о развитии Дальнего Востока
Экспертное мнение
07.09.2022
Яркие цитаты ВЭФ-2022: Участники форума о транспорте и туризме
Экспертное мнение
06.09.2022
Яркие цитаты ВЭФ-2022: Участники форума об образовании, технологическом и экономическом развитии
Олег Бочаров
,
Александр Бугаев
,
Сергей Королев
,
Максим Паршин
,
Игорь Семенов
,
Анна Цивилева
,
Алексей Чекунков
,
Андрей Костин
,
Дмитрий Чернышенко
,
Игорь Шувалов
,
Игорь Краснов
,
Игорь Кобзев
Инновационная инфраструктура
МСП
Образование
Предпринимательство
Прикладные разработки
Экономический прогресс
Экспертное мнение
06. 09.2022
09.2022
Яркие цитаты ВЭФ-2022: Участники форума о международном сотрудничестве
Экспертное мнение
05.09.2022
Сможет ли ВЭФ открыть для нас окно возможностей в Китае?
Важные темы
Арктика
COVID-19
СидимДомаЭкономика
Здравоохранение
Квантовые технологии
Аналитика
Аналитический дайджест
19.09.2022
Спортивная ассоциация ШОС, Кубок мира по хоккею и триумф самбистов на ЧЕ
Фонд Росконгресс представляет дайджест спортивных новостей за период с 16 по 19 сентября 2022 года.
Аналитический дайджест
15.09.2022
Cамбисты прорвали санкционную блокаду, итоги Vladivostok Open и где смотреть ЧР по лыжероллерам
Фонд Росконгресс представляет дайджест спортивных новостей за период с 10 по 15 сентября 2022 года.
Аналитический дайджест
08.09.2022
Итоги опроса участников Восточного экономического форума — 2022
В рамках проведения Восточного экономического форума Фонд Росконгресс и Всероссийский Центр Изучения Общественного Мнения (ВЦИОМ) провели опрос. Цель опроса определить восприятие Форума его участниками.
Исследование
08.09.2022
«Восточный вектор»: новый путь россиян. Значение Востока для жителей России в контексте новой реальности
Значение Востока для жителей России в контексте новой реальности
Результаты социологического опроса взрослого населения РФ на тему отношения к идее сотрудничества со странами Востока в новой реальности.
Исследование
08.09.2022
Горизонты урбанизации Дальнего Востока
В аналитическом докладе, подготовленном авторским коллективом ЦК НТИ по большим данным на базе МГУ имени М.В.Ломоносова при поддержке Фонда Росконгресс к VII Восточному экономическому форуму, анализируются перспективы урбанизации Дальнего Востока России.
Аналитический дайджест
06.09.2022
Торговые отношения России и Китая: потенциал роста
Исследовательский центр ITI подготовил информационно-аналитический дайджест «Торговые отношения России и Китая: потенциал роста», в котором рассматриваются значимость России как торгового партнера Китая по основным категориям экспорта, тенденции импортного спроса Китая, региональные и транспортные аспекты торговли. Исследование подготовлено в рамках экспертно-аналитического сотрудничества ITI с Фондом Росконгресс.
Исследование подготовлено в рамках экспертно-аналитического сотрудничества ITI с Фондом Росконгресс.
Исследование
04.09.2022
Национальный перечень перспективных проектов 2022
Исследование InfraOne Research посвящено вопросам развития инфраструктурных проектов из национального перечня перспективных проектов в рамках текущей нестабильной геополитической и экономической ситуации, введенных ограничений и санкций, а также последствий пандемии.
Исследование
04.09.2022
Перспективы и проблемы использования технологий Искусственного интеллекта в регионах Российской Федерации
В исследовании, подготовленном экспертами ЦСР на основе опроса должностных лиц, дана оценка готовности органов исполнительной власти и местного самоуправления к использованию технологий искусственного интеллекта, рассматриваются плюсы и минусы работы с данной технологией.
Статьи
Партнеры
виды, устройство, монтаж, преимущества и недостатки сплит-систем
- Главная
- Статьи
- Статьи. Важное о кондиционерах
Сплит-система кассетного типа – это та же самая обычная классическая сплит-система за исключением внутреннего блока. Обычный кондиционер имеет настенный внутренний блок, в кассетной же сплит-системе этот блок размещается под потолком. Выглядит он также по-другому. В остальном никаких отличий от обычной настенной сплит-системы нет. Кондиционеры кассетного типа устанавливаются преимущественно в бизнес-центрах, офисах, квартирах на этапе застройки дома или ремонта помещения, в ресторанах, кафе, в административных учреждениях.
Устройство кассетной сплит-системы
Кассетная сплит-система – это холодильное оборудование, предназначенное для охлаждения воздушных масс до заданной температуры. Кондиционер состоит из двух блоков – внешнего и внутреннего. Внешний блок визуально ничем не отличается от блоков классической сплит-системы, он устанавливается с уличной стороны помещения. Внутренний блок упрощенно представляет собой короб, стенки которого при установке будут скрыты, и фронтальную решетку, которая может иметь незначительные отличия в дизайне в зависимости от бренда кондиционера. Внутренний блок размещается непосредственно в самом помещении в межпотолочном пространстве.
На фото: Устройство кассетной сплит-системы
Блоки независимы друг от друга изначально, при монтаже их соединение происходит за счет крепления трубопроводов и электрических соединений.
Внутренний блок
Внутренние блоки кассетных сплит-систем могут быть разными по дизайну (как отмечалось выше) и габаритам – это зависит от производительности кондиционера: чем мощнее оборудование, тем больше внутренний блок.
На фото: Внутренний блок кассетной сплит-системы
Внутренний модуль сплит-системы всегда неизменен и состоит из нескольких элементов:
- Холодильный контур внутреннего блока, который включает в себя теплообменник испарителя. Он предназначен для охлаждения воздуха в помещении. Теплообменник внутреннего блока охлаждает воздух в помещении.
- Центробежный вентилятор – отвечает за циркуляцию воздуха.
- Система фильтров – обеспечивает очищение воздуха от вредных примесей, спор, бактерий. Количество фильтров может быть разным в зависимости от модели кондиционера.
- Система распределения воздуха – регулирует направление воздушного потока в нужном направлении.
- Наружная декоративная воздухозаборная решетка.
Внешний блок
Вид наружного блока также может отличаться габаритами и незначительными элементами дизайна. Внутреннее наполнение остается неизменным.
Внутреннее наполнение остается неизменным.
На фото: Внешний блок кассетного кондиционера
Строение наружного блока:
- Наружный корпус, выполненный из антикоррозийных материалов.
- Холодильный контур, который состоит из теплообменника конденсатора.
- Компрессор, отвечающий за работу всей сплит-системы. От него зависит мощность кондиционера и ресурс работы.
- Вентилятор конденсатора – благодаря ему происходит циркуляция воздуха через теплообменник конденсатора.
Принцип работы кассетной сплит-системы
Кассетная сплит-система работает по принципу классической сплит-системы. Для работы кондиционера используется хладагент, который не разрушает озоновый слой, самый часто используемый на сегодняшний день фреон – R410A. Контур заполняется фреоном после монтажа всей системы. При подключении кондиционера в сеть начинается циркуляция хладагента внутри контура. Происходит охлаждение испарителя. Вентилятор внутреннего блока забирает теплый воздух из помещения, прогоняет его через уже холодный испаритель и сам охлаждается. Далее холодный воздух поступает через каналы для вывода воздуха в помещение.
Происходит охлаждение испарителя. Вентилятор внутреннего блока забирает теплый воздух из помещения, прогоняет его через уже холодный испаритель и сам охлаждается. Далее холодный воздух поступает через каналы для вывода воздуха в помещение.
На фото: Принцип работы сплит-системы, фреон R410A
Плюсы и минусы кассетных кондиционеров
Как и у любой техники, у кассетных спит-систем есть свои плюсы и минусы.
Плюсы кассетных сплит-систем
К достоинствам кассетных кондиционеров можно отнести следующие характеристики:
- Равномерное и быстрое охлаждение помещения. Это связано со спецификой монтажа внутреннего блока. Так как он расположен под потолком, то может распределять воздушные потоки более равномерно. Если кондиционер смонтирован правильно, то все помещение будет охлаждаться более быстро и эффективно.
- Эргономичный дизайн и запотолочная установка предполагают значительную экономию пространства, в отличие от настенных кондиционеров, внутренний блок которых должен быть размещен на стене комнаты, чем может испортить дизайн помещения.

- Производительность и время охлаждения также можно отнести к плюсам системы. Кассетные кондиционеры имеют более высокую производительность и, соответственно, на охлаждение большого помещения тратиться меньше времени.
Недостатки кассетных сплит-систем
Кондиционеры кассетного типа, как уже упоминалось выше, должны устанавливаться в межпотолочном пространстве, и это не всегда является плюсом.
Монтаж кассетной сплит-системы может быть осуществлен только на этапе ремонтных работ, так как она должна устанавливаться между основным потолком и навесным потолком. Это делает невозможным или крайне неудобным установку кондиционера в уже готовом и отремонтированном помещении.
Для установки кассетного внутреннего блока нужно соблюдать расстояние между полом и потолком – оно должно быть не менее 3 м, т.е. кассетные кондиционеры могут устанавливаться только в помещениях с высокими потолками.
Стоимость кассетной сплит-системы на порядок выше классического настенного кондиционера.
Подвесной потолок также должен соответствовать определенным требованиям – расстояние между обычным потолком и натяжным потолком должно составлять не менее 350 мм.
Монтаж кассетной сплит-системы
В монтаже наружного блока кассетной сплит-системы нет никаких отличий от установки классической сплит-системы. Однако есть существенные отличия при монтаже внутреннего блока. Это связано с тем, что установка возможна только в подпотолочное пространство.
На фото: Монтаж внутреннего блока сплит-системы
При монтаже необходимо соблюдать несколько требований:
- Поверхность, на которую крепится внутренний блок, должна быть строго горизонтальной, никаких отклонений не допускается, иначе это повредит работе кондиционера.
- Необходимо оставить расстояние между основным потолком и навесным потолком – не менее 350 мм.

- Вся потолочная конструкция должна выдержать четырехкратный вес внутреннего блока.
- Необходимо соблюдать расстояние до преград при монтаже блока, которые впоследствии будут препятствовать равномерному распределению воздушных масс.
Также при монтаже необходимо учесть места оконных и дверных проемов, количество оборудования, которое выделяет тепло. Рекомендуется устанавливать внутренний блок по центру помещения.
На фото: Монтаж внутреннего блока по центру помещения
Следует учесть, что кондиционер крепится путем подвеса, для чего будут нужны подвесные металлические крепежи, которые монтируются на основной потолок. Перед монтажом необходимо сделать разметку, куда будут крепиться подвесные стержни.
На фото: Монтаж сплит-системы на потолке
Сам внутренний блок крепится на стержни и выравнивается, после чего осуществляется подсоединение дренажной линии. Она должна быть установлена под уклоном, без изгибов и перепадов высот. После этого осуществляется подводка трубок холодильного контура.
Она должна быть установлена под уклоном, без изгибов и перепадов высот. После этого осуществляется подводка трубок холодильного контура.
На этом этапе, при правильном подключении всех соединений, можно устанавливать подвесной потолок и крепить наружную панель внутреннего блока.
Есть вопрос? Задайте его специалисту!
- Имя
- Тема вопроса
- Общие вопросыСервисБытовые кондиционерыТепловое оборудованиеПолупромышленные кондиционерыУвлажнители и очистители воздухаМультизональные системыЧиллерыФанкойлыПрецизионные кондиционерыКрышные кондиционерыКомпрессорно-конденсаторные блокиВентиляция
- Вопрос
Нажимая кнопку «Отправить», я даю свое согласие на обработку моих персональных данных и принимаю условия
«Согласия на обработку персональных данных Пользователей»
Водосточная система Аквасистем — цвета, цена, фото
Расчет водостока
Калькулятор расчета водостока
Подбор цвета
Программа подбора цвета
Главная/Водосток/Металлические водостоки/Aquasystem
Металлический водосток Aquasystem — два размера и множество цветов. Актуальные цены на водосточные системы Аквасистем. Полная комплектация, фото, инструкции по установке водостоков. Замер, доставка и монтаж.
Актуальные цены на водосточные системы Аквасистем. Полная комплектация, фото, инструкции по установке водостоков. Замер, доставка и монтаж.
Основа водосточной системы — холоднокатаная горячеоцинкованная сталь концерна SSAB, с толщиной 0,6-0,7 мм.
Покрытие водостока – полиуретан (пурал) GreenCoat. Также есть вариант из меди — толщиной 0,6 мм и из цинк-титана — толщиной 0,7 мм.
Размеры водостока
Основные размеры системы 125/90 и 150/100. Это хорошо зарекомендовавшие себя варианты, которые применяют не только российские, но зарубежные производители.
| 150/100 | 125/100 | длина | |
| водосточный желоб | 150 мм | 125 мм | 3м |
| водосточная труба | 100 мм | 100 мм | 3м и 1м |
Скачать прайс-лист:
| Металлические водостоки |
Цвета водостока Аквасистем
Цвета водостока выбраны популярные, из тех, которые чаще всего используют производители кровель – зеленые (6005, rr11), коричневые (8017, rr 32), красные и серые варианты (rr 29 и rr 23), белый цвет (rr 20).
Водосточные системы Аквасистем также производятся — с матовым покрытием (в трех цветах), просто медные и цинк-титановые.
6005
8017
rr11
rr20
rr23
rr29
rr32
С матовым покрытием
8017 матовый
rr23 матовый
rr32 матовый
Без покрытия
Оцинкованный
Цинк-титан
Медь
.
Видео инструкции
В видео инструкции можно посмотреть способы монтажа водостока на дом. Если останутся вопросы, звоните к нам, объясним.
Водосток Аквасистем — из чего изготовлен, надежность и долговечность
Установка водосточной системы Aquasystem
Элементы водостока
Система состоит из множества элементов – желоб, держатели, соединители, воронка, колено, трубы 1 и 3 м и т.д. Каждая деталь важна и должна быть установлена правильно. Поэтому перед монтажом, ознакомьтесь с рекомендациями производителя по установке водосточной системы. Рассчитать количество и стоимость сможет наш специалист.
желоб
колено
отвод
хомут трубы
крюк длинный
крюк короткий
соединитель желобов
соединитель труб
тройник
труба 1м
труба 3м
угол 90
угол 135
S-обвод
воронка желоба
воронка водосборная
заглушка полукруглая
заглушка с резиновым уплотнителем
.
Фото водостока
На фото показаны дома с установленной системой Аквасистем. Качественные элементы прекрасно смотрятся на жилых и административных зданиях, дачах, коттеджах, сараях и гаражах.
Сертификаты
Вся продукция разработана на основе ГОСТ 2.114, и подтверждена Сертификатом соответствия.
сертификат соответствия
приложение
приложение
Водосток Аквасистем
Более 15 лет компания Стил Технолоджи производит систему стальных водостоков Аквасистем.
Водосточная система Aquasystem выпускается в двух размерах. Для производства используются материалы: медь, оцинкованный металл, цинк-титан, металл с полиуретановым покрытием.
Купить водослив Aquasystem можно в наших офисах продаж и дистанционно. Мы организуем доставку до вашего участка или до терминала ТК в другом городе.
Как первые четыре установки HIMARS помогут Украине в противостоянии с Россией?
- Павел Аксенов
- Русская служба Би-би-си
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Getty Images
Подпись к фото,
Американские HIMARS на учениях в Морокко
Новый пакет боеприпасов, вооружений и военной техники, который США передадут Украине, включает в себя реактивные системы залпового огня HIMARS, которые давно хотят получить украинские военные.
Вашингтон пока отправляет Киеву всего четыре таких установки.
«HIMARS позволит им [украинцам] получить больше возможностей для противостояния. Сейчас гаубицы, которые мы им уже предоставили ранее, могут стрелять на расстояние около 30 км. Дальность HIMARS более чем в два раза больше, что позволит им — даже с меньшим количеством пусковых установок — более успешно противостоять [российским войскам]», — сказал замминистра обороны США Колин Каль на брифинге в Пентагоне.
Вечером 2 июня президент Украины Владимир Зеленский поблагодарил США за отправку Украине «современных ракетных систем залпового огня HIMARS». По его словам, в Киеве «работают над тем, чтобы вывести объем поставок именно современных боевых систем на более высокий уровень».
Сколько именно РСЗО хочет получить Украина, неизвестно, но, по мнению экспертов, четыре пусковые установки не смогут переломить ход боевых действий.
Автор фото, Getty Images
Подпись к фото,
РСЗО HIMARS на колесном шасси легче и мобильней
По словам израильского эксперта Давида Гендельмана, сейчас Киев благодарен за поставки любых вооружений, но чуда ждать от этих РСЗО не стоит.
«В таком количестве они [HIMARS] какого-то системного эффекта дать не могут. Возможно, это первая ласточка, и она лишь предвещает в будущем расширение количества. Эти четыре установки, если они будут действовать вместе, как уменьшенная батарея, на каком-то ограниченном участке определенный эффект дадут. Но понятно, что это не то количество, которое хотела Украина. Им нужно на порядок больше», — сказал эксперт.
По словам Давида Гендельмана, Украине нужны «сотни систем залпового огня».
Советник главы офиса президента Украины Алексей Арестович назвал четыре реактивных системы залпового огня HIMARS, которые передают американцы, «учебными», дальше они «приедут в товарных количествах». «Думаю, что менее чем о дивизионе (18 установок) нечего и говорить, скорее всего, будет больше — два-три, посмотрим», — заявил Арестович.
«Думаю, что менее чем о дивизионе (18 установок) нечего и говорить, скорее всего, будет больше — два-три, посмотрим», — заявил Арестович.
О том, что это число пусковых установок — лишь первая партия, говорил на брифинге и представитель Пентагона. Он также сказал, что они будут использоваться для обучения. Однако когда и сколько систем будет поставлено в будущем, он не уточнил.
- Война в Украине: как долго Запад сможет сохранять единство мнений?
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Штаты не единственная страна, которая передает Укране системы залпового огня. 2 июня стало известно, что несколько систем M270B1 MLRS, которые отличаются от колесных HIMARS гусеничным шасси и увеличенным вдвое боезапасом, собирается поставить Украине Великобритания, но их точное число и сроки поставок неизвестны. Великобритания имеет на вооружении 35 таких систем.
Великобритания имеет на вооружении 35 таких систем.
Ранее президент Владимир Зеленский признавал, что системы залпового огня укрепят ВСУ. «У меня нет секретов. Мы обращаемся ко всем странам с просьбой поставить нам системы MLRS, с помощью которых Украина сможет забрать инициативу и начать освобождать свою территорию», — сказал он.
В нынешнем конфликте артиллерия, частью которой являются РСЗО, играет очень важную роль. Поставки других артиллерийских систем Киеву — более многочисленные.
Например, Украина уже получила из США более 100 гаубиц М777, у Польши Киев закупил е60 самоходных артиллерийских установок «Краб» калибра 155 миллиметров (еще 18 САУ были безвозмездно отправлены Украине на прошлой неделе).
В мае уже Польша обращалась к США с официальным запросом на закупку 500 боевых модулей M142 HIMARS для производства локализованной версии этой ракетной системы. Она планирует через несколько лет получить 80 батарей таких пусковых установок.
«Смерчи», «Ольхи» и «Ураганы»
На вооружении ВСУ уже имеются дальние реактивные системы залпового огня, которые они применяли на фронте.
Согласно справочнику Military Balance 2021, в начале 2021 года в украинской армии было 70 единиц старых советских РСЗО 9П140 «Ураган» калибра 220 миллиметров, а также 81 единица более мощных 300-миллиметровых 9A52 «Смерч» и более 80 единиц модернизированных в Украине «Смерчей», которые называются «Ольха».
У России в арсенале больше дальних систем залпового огня, по данным Military Balance, в начале 2021 года в ВС РФ было 206 «Ураганов», а также 120 «Смерчей» и «Торнадо-С».
Автор фото, Getty Images
Подпись к фото,
РСЗО «Смерч» активно используют в ходе конфликта — часть этой российской ракеты нашли в районе Бородянки
2 марта пресс-служба украинского КБ «Луч» сообщила, что с 24 февраля ВСУ «нанесли около 50 точных ракетных ударов ракетами Р624 «Ольха». Это новые высокоточные и дальние ракеты, которые были созданы всего несколько лет назад. Сколько их было произведено, неизвестно, но, судя по публикациям в открытых источниках, их было сделано всего около сотни.
Это новые высокоточные и дальние ракеты, которые были созданы всего несколько лет назад. Сколько их было произведено, неизвестно, но, судя по публикациям в открытых источниках, их было сделано всего около сотни.
Для украинской «Ольхи», «Смерча» и его обновленной российской версии «Торнадо С» было создано множество разных ракет с кассетными, кумулятивными, осколочно-фугасными и даже термобарическими боеприпасами.
- На линии фронта под огнем российской артиллерии. Один день на позициях под Изюмом
Дальность некоторых специальных снарядов достигает 120 километров, но большинство ракет стреляет максимум на 90 километров.
Кроме того, «Смерч» (и его обновленные версии) может применяться для дистанционного минирования — некоторые ракеты разбрасывают противотанковые и противопехотные мины.
Сколько ракет осталось в арсеналах ВСУ и ВС РФ спустя три месяца боевых действий, неизвестно.
Автор фото, AFP
Подпись к фото,
Этот украинский «Смерч» был сфотографирован под Краматорском в 2015 году
«Ураган» — менее мощная и более старая система, довольно сложная в применении, но, тем не менее, она способна стрелять на 35 километров, что тоже позволяет обстреливать позиции противника с расстояния, которое превышает дальность действия самых распространенных и многочисленных систем РСЗО «Град» и гаубиц Д-30.
Никаких данных о том, сколько боеприпасов осталось для этих РСЗО в Украине и России, и в каком состоянии они находятся, нет.
О количестве боеприпасов для HIMARS, которые поставят американцы, пока ничего не сообщалось, однако известно, что это будут высокоточные ракеты GMLRS.
В отличие от «Смерча» и «Ольхи», и тем более от старого советского «Урагана», боеприпасы для HIMARS можно поставлять из-за границы. Расход ракет в любом военном конфликте очень велик, и ВСУ нужно постоянно их восполнять.
РСЗО против важных целей
Ракетные системы залпового огня M270 MLRS и M142 HIMARS — ближайшие «родственники». Они отличаются шасси и числом пусковых контейнеров.
MLRS был создан еще в 1970-х годах прошлого века, в войска стал поступать в 1983 году, и с тех пор уже несколько раз модернизировался. HIMARS появился в конце 1990-х годов как более мобильная и легкая версия пусковой установки.
Два пусковых контейнера MLRS смонтированы на гусеничном шасси, а всего один такой же блок у HIMARS установлен на шестиколесном грузовике.
В каждый пусковой контейнер можно зарядить по шесть ракет калибра 277 миллиметров, или одну оперативно-тактическую ракету ATACMS с дальностью до 300 километров.
Кроме нее MLRS, как и HIMARS, может использовать еще два типа боеприпасов. Первый — ракета М26 с максимальной дальностью в 32 километра или ее улучшенная современная версия M26A1 с дальностью до 45 километров. В пусковой контейнер помещается шесть таких ракет.
В пусковой контейнер помещается шесть таких ракет.
Второй боеприпас — управляемая ракета GMLRS с дальностью до 70 километров. Такие ракеты США собираются поставить вместе с РСЗО.
Украина, добиваясь получения американских MLRS, рассчитывает получить не только дальнобойные пусковые установки, увеличив их общее число в войсках, но также обрести оружие, способное действовать более точно.
Тактика, которой придерживаются ВСУ, — точные удары по хорошо разведанным целям. Украинские военные, судя по комментариям наблюдателей и экспертов, более широко используют разведку и корректировку работы артиллерии при помощи дронов.
Именно с этой целью они хотят получить американские ракетные системы, которые изначально были рассчитаны на уничтожение конкретных объектов, а не на создание «огневого вала».
Структура и функция суперкомплексов фотосистемы
Введение
Фотосинтез осуществляет ряд биофизических и биохимических процессов, в конечном итоге преобразуя солнечную энергию в химическую энергию. Кислородный фотосинтез расщепляет молекулы воды до кислорода, необходимого для поддержания аэробной жизни на Земле (Dismukes et al., 2001). Считается, что фотосинтез развился только один раз за всю историю эволюции цианобактерий. Что касается водорослей и высших растений, они приобрели способность к фотосинтезу через эндосимбионты цианобактерий, которые эволюционировали в хлоропласты растений (Томиока и Сугиура, 19).83). Листья растений являются основными органами фотосинтеза, в каждой клетке мезофилла насчитывается около 100 хлоропластов (Woodson, 2016). Благодаря своей важной роли в сборе света и производстве энергии хлоропласты являются жизненно важными органеллами фотосинтезирующих клеток водорослей и высших растений, выступая в качестве поставщиков источников углерода и энергии. Хлоропласт представляет собой крупную органеллу со сложной структурой, состоящую из двух наружных мембран, называемых оболочкой хлоропласта, и третьей обширно складчатой внутренней мембранной системы, называемой тилакоидом (Arvidsson and Sundby, 19).
Кислородный фотосинтез расщепляет молекулы воды до кислорода, необходимого для поддержания аэробной жизни на Земле (Dismukes et al., 2001). Считается, что фотосинтез развился только один раз за всю историю эволюции цианобактерий. Что касается водорослей и высших растений, они приобрели способность к фотосинтезу через эндосимбионты цианобактерий, которые эволюционировали в хлоропласты растений (Томиока и Сугиура, 19).83). Листья растений являются основными органами фотосинтеза, в каждой клетке мезофилла насчитывается около 100 хлоропластов (Woodson, 2016). Благодаря своей важной роли в сборе света и производстве энергии хлоропласты являются жизненно важными органеллами фотосинтезирующих клеток водорослей и высших растений, выступая в качестве поставщиков источников углерода и энергии. Хлоропласт представляет собой крупную органеллу со сложной структурой, состоящую из двух наружных мембран, называемых оболочкой хлоропласта, и третьей обширно складчатой внутренней мембранной системы, называемой тилакоидом (Arvidsson and Sundby, 19). 99; Кирхгоф, 2013). Мембрана тилакоидов состоит из двух морфологически различных доменов: домена грана, который характеризуется примерно 5–20 слоями цилиндрических стопок тилакоидных мембранных дисков (Mullineaux, 2005; Mustárdy et al., 2008), и доменом ламелл стромы, которые открытые стромой пары мембран, соединяющие стопки гран (Dekker and Boekema, 2005).
99; Кирхгоф, 2013). Мембрана тилакоидов состоит из двух морфологически различных доменов: домена грана, который характеризуется примерно 5–20 слоями цилиндрических стопок тилакоидных мембранных дисков (Mullineaux, 2005; Mustárdy et al., 2008), и доменом ламелл стромы, которые открытые стромой пары мембран, соединяющие стопки гран (Dekker and Boekema, 2005).
Существует два типа фотосистем у цианобактерий, водорослей и высших растений, называемых фотосистемой I (PSI, пластоцианин-ферредоксиноксидоредуктаза) и фотосистемой II (PSII, вода-пластохиноноксидоредуктаза), обе из которых представляют собой мультисубъединичные мембранные комплексы. PSI расположен в пластинке стромы тилакоида, в то время как PSII находится в домене сложенной граны (Albertsson, 2001; Dekker and Boekema, 2005). Каждая фотосистема состоит из основного комплекса и периферийной антенной системы, светособирающего комплекса I (LHCI) для PSI и светособирающего комплекса II (LHCII) для PSII соответственно. Недавно сообщалось о новых структурах фотосистем с атомным разрешением и подробном понимании процесса расщепления воды с развитием криоэлектронной микроскопии отдельных частиц, последовательной кристаллографии с временным разрешением и других методов. Здесь мы рассмотрим недавний прогресс в изучении структур и функций фотосистем различного происхождения, уделяя особое внимание PSII-LHCII.
Здесь мы рассмотрим недавний прогресс в изучении структур и функций фотосистем различного происхождения, уделяя особое внимание PSII-LHCII.
Биохимия фотосистем
Полные реакции фотосинтеза у цианобактерий, водорослей и растений осуществляются четырьмя основными белковыми суперкомплексами, включая PSI, PSII, цитохром b 6 f (пластохинон-пластоцианиноксидоредуктаза) и F-АТФаза (протон-движущая сила -управляемая АТФ-синтаза) (Nelson and Benshem, 2004; Nelson and Yocum, 2006). И суперкомплексы PSI, и PSII связывают молекулы хлорофилла, чтобы ощущать разные спектры и интенсивности света (Remelli et al., 19).99; Нельсон и Йокум, 2006 г.; Кроче и ван Амеронген, 2013 г.; ван Амеронген и Кроче, 2013 г.; Каффарри и др., 2014 г.; Рубан, 2015). Свет, собранный хлорофиллами и другими пигментами в ФС1 и ФСII, переносится в фотосинтетический реакционный центр (РЦ), дополнительно вызывая возбуждение хлорофиллов, известное как Р680 для ФСII и Р700 для ФС1, чтобы инициировать транслокацию протонов через мембрану (Нельсон и Юнг). , 2015). В ФСII P680 претерпевает разделение зарядов, и генерируемые электроны последовательно передаются акцептору хинона феофитину и пластохинону (Grabolle and Dau, 2005; Johnson, 2016). Между тем, молекула воды, подлинный донор электронов, окисляется до молекулярного кислорода, и P680 в конечном итоге восстанавливается. После реакции электроны в конечном итоге переносятся на цитохром b 9, встроенный в тилакоид.0011 6 f, который окисляет пластохинолы до пластохинонов и восстанавливает пластоцианины (Cramer et al., 1996). А затем пластоцианин окисляется PSI, во время которого восстановленный белок-носитель электронов ферредоксин используется для восстановления NADP + до NADPH с помощью фермента ферредоксин-NADP + редуктазы (FNR) (Brettel and Leibl, 2001; Sétif, 2001; Голбек, 2006). Вместе ФС II создает наиболее положительный окислительно-восстановительный потенциал, в то время как ФС1 генерирует мощный природный восстановитель НАДФН (Надежда, 2000; Хольцварт и др.
, 2015). В ФСII P680 претерпевает разделение зарядов, и генерируемые электроны последовательно передаются акцептору хинона феофитину и пластохинону (Grabolle and Dau, 2005; Johnson, 2016). Между тем, молекула воды, подлинный донор электронов, окисляется до молекулярного кислорода, и P680 в конечном итоге восстанавливается. После реакции электроны в конечном итоге переносятся на цитохром b 9, встроенный в тилакоид.0011 6 f, который окисляет пластохинолы до пластохинонов и восстанавливает пластоцианины (Cramer et al., 1996). А затем пластоцианин окисляется PSI, во время которого восстановленный белок-носитель электронов ферредоксин используется для восстановления NADP + до NADPH с помощью фермента ферредоксин-NADP + редуктазы (FNR) (Brettel and Leibl, 2001; Sétif, 2001; Голбек, 2006). Вместе ФС II создает наиболее положительный окислительно-восстановительный потенциал, в то время как ФС1 генерирует мощный природный восстановитель НАДФН (Надежда, 2000; Хольцварт и др. , 2006; Нельсон, 2011). Фотокаталитическая активность ФСII и ФСI связана цитохромом b 6 f комплекс, а протонно-движущая сила, возникающая в ходе этого процесса, используется F-АТФазой для образования АТФ, который вместе с НАДФН поступает в качестве энергетических соединений для синтеза сахара из углекислого газа по темновой реакции (Pfannschmidt, 2003). ).
, 2006; Нельсон, 2011). Фотокаталитическая активность ФСII и ФСI связана цитохромом b 6 f комплекс, а протонно-движущая сила, возникающая в ходе этого процесса, используется F-АТФазой для образования АТФ, который вместе с НАДФН поступает в качестве энергетических соединений для синтеза сахара из углекислого газа по темновой реакции (Pfannschmidt, 2003). ).
Первая структура PSI из термофильной цианобактерии Synechococcus elongatus ( S. elongatus ) показала комплекс с 12 белковыми субъединицами и 127 кофакторами (96 хлорофиллов, 22 каротиноидов, 2 филлохинона, 3 Fe 4 S 4 кластеров и 4 липида), обеспечивая самую первую подробную молекулярную архитектуру PSI (Fromme et al., 2001; Jordan et al., 2001). S. elongatus PSI представляет собой тример диаметром 210 Å и максимальной высотой 90 Å (Jordan et al., 2001), тогда как растительный суперкомплекс PSI представляет собой мономер (Ben-Shem et al., 2003). Основной комплекс в значительной степени консервативен от цианобактерий до растений с девятью встроенными в мембрану субъединицами, тогда как комплексы LHCI различаются по составу субъединиц, связывающим пигментам и размерам из-за различных мест обитания цианобактерий, водорослей и растений (Ben-Shem et al. , 2003; Цинь и др., 2015). Однако, хотя PSI и PSII произошли от одного и того же предка, принадлежащего к одному и тому же надсемейству, их структуры в значительной степени различаются.
, 2003; Цинь и др., 2015). Однако, хотя PSI и PSII произошли от одного и того же предка, принадлежащего к одному и тому же надсемейству, их структуры в значительной степени различаются.
Структура цианобактериального суперкомплекса ФС II
Гомдимер ФС II из Thermosynechococcus elongatus ( T. elongatus ) имеет размеры 105 Å в глубину (45 Å в мембране), 205 Å в длину и 110 Å в ширину. (Феррейра и др., 2004). Суперкомплекс ФСII у цианобактерий включает белки реакционного центра (РЦ) D1 и D2, антенные субъединицы CP47 и CP43, 13 мембранных внутренних малых субъединиц (PsbE, PsbF, PsbH-M, PsbN, PsbX, PsbY, PsbZ и PsbYcf12). и 3 внешние субъединицы (PsbO, PsbU и PsbV). Структуры D1 и D2 сходны друг с другом, обе содержат пять спиралей, наклоненных относительно плоскости мембраны (Zouni et al., 2001; Kamiya and Shen, 2003), и они образуют центр комплекса PSII. CP43 и CP47 окружают ядро D1-D2 аналогичными структурами из шести спиралей соответственно. Впоследствии Лолл и соавт. (2005) предоставили первую полную структуру цианобактериальной фотосистемы II, дав полное представление о кофакторах ФСII. Они показали положение 20 белковых субъединиц и их взаимодействие с 77 кофакторами (рис. 1А). Общие структуры суперкомплекса и белковых субъединиц сходны с теми, о которых сообщалось ранее (Zouni et al., 2001; Kamiya and Shen, 2003; Biesiadka et al., 2004). Долгое время считалось, что липиды играют роль в сборке и функционировании ФСII, и впервые авторы показали, что липид интегрально связан с ФСII. Одиннадцать липидов, окружающих RC, образуют пояс, отделяющий его от антенны и малых белковых субъединиц, в то время как остальные липиды в основном расположены на границе раздела мономер-мономер. Свойство богатого липидами придает ФСII как структурную гибкость для локальной мобильности, так и удобство в распознавании субъединиц (Гуськов и др., 2009).). В их исследовании одиннадцать молекул каротиноидов были смоделированы как β-каротины в полностью транс-конфигурациях, а в исследовании Guskov et al.
(2005) предоставили первую полную структуру цианобактериальной фотосистемы II, дав полное представление о кофакторах ФСII. Они показали положение 20 белковых субъединиц и их взаимодействие с 77 кофакторами (рис. 1А). Общие структуры суперкомплекса и белковых субъединиц сходны с теми, о которых сообщалось ранее (Zouni et al., 2001; Kamiya and Shen, 2003; Biesiadka et al., 2004). Долгое время считалось, что липиды играют роль в сборке и функционировании ФСII, и впервые авторы показали, что липид интегрально связан с ФСII. Одиннадцать липидов, окружающих RC, образуют пояс, отделяющий его от антенны и малых белковых субъединиц, в то время как остальные липиды в основном расположены на границе раздела мономер-мономер. Свойство богатого липидами придает ФСII как структурную гибкость для локальной мобильности, так и удобство в распознавании субъединиц (Гуськов и др., 2009).). В их исследовании одиннадцать молекул каротиноидов были смоделированы как β-каротины в полностью транс-конфигурациях, а в исследовании Guskov et al. был идентифицирован дополнительный Car15. (2009). В исследовании Гуськова и соавт. (2009), они также успешно отнесли малые белковые субъединицы Psbycf12, PsbY и PsbX к ранее не назначенным позициям (Loll et al., 2005; Guskov et al., 2009). Сводная информация о составе субъединиц, включая взаимодействие субъединиц и кофакторов в PSII из T. elongatus представлен в табл. 1 (Гуськов и др., 2009). В 2009 г. Брозер и соавт. представили первую структуру мономерной формы основного комплекса ФСII (ФСIIcc) с высокой способностью к выделению кислорода из T. elongatus (Broser et al., 2010). Сборка белковых субъединиц, тетрапиррольных кофакторов и негемового железа в мономерном PSIIcc идентична таковой в димерной структуре.
был идентифицирован дополнительный Car15. (2009). В исследовании Гуськова и соавт. (2009), они также успешно отнесли малые белковые субъединицы Psbycf12, PsbY и PsbX к ранее не назначенным позициям (Loll et al., 2005; Guskov et al., 2009). Сводная информация о составе субъединиц, включая взаимодействие субъединиц и кофакторов в PSII из T. elongatus представлен в табл. 1 (Гуськов и др., 2009). В 2009 г. Брозер и соавт. представили первую структуру мономерной формы основного комплекса ФСII (ФСIIcc) с высокой способностью к выделению кислорода из T. elongatus (Broser et al., 2010). Сборка белковых субъединиц, тетрапиррольных кофакторов и негемового железа в мономерном PSIIcc идентична таковой в димерной структуре.
РИСУНОК 1. Общие структуры основного комплекса ФСII из Tynechococcus elongatus (A) и шпинат (B) . Интерфейс мономер-мономер обозначен черной пунктирной линией. Показаны только четыре большие субъединицы и внутренние субъединицы ФСII. Субъединицы D1 (синий), D2 (салатовый), CP43 (желтый) и CP47 (голубой), а также другие малые субъединицы помечены в мономере слева. Кофакторы показаны палочками, включая Chl (зеленый), Car (оранжевый), гем (светло-пурпурный) и липиды (красный). Кластер Mn показан в сферах.
Субъединицы D1 (синий), D2 (салатовый), CP43 (желтый) и CP47 (голубой), а также другие малые субъединицы помечены в мономере слева. Кофакторы показаны палочками, включая Chl (зеленый), Car (оранжевый), гем (светло-пурпурный) и липиды (красный). Кластер Mn показан в сферах.
ТАБЛИЦА 1. Трансмембранные (ТМ) спирали, хлорофиллы и другие кофакторы РЦ ФС II из цианобактерий и растений 1 .
Во время фотосинтеза окисление воды происходит в кислород-выделяющем комплексе (ККК), который включает кластер Mn 4 CaO 5 в качестве каталитического центра. Разделение воды представляет собой процесс, выполняемый в пять последовательных стадий, именуемых от S 0 до S 4 . Это модельная система для синтеза катализаторов окисления неорганической воды и выделения дикислорода (Kanady and Agapie, 2011; Mukherjee et al., 2012). В работе Ferreira et al. (2004), они сообщили, что OEC содержит «кубаноподобный» Mn 9.0011 3 CaO 4 кластер, связанный с четвертым Mn моно-μ-оксо-мостиком, который ранее специально не предполагался. Однако ни воду, ни гидроксид нельзя было наблюдать, чтобы точно определить место окисления воды в их исследовании. В первой полной структуре ФС II кластер Mn 4 Ca был предложен как «Y-образный крючок», что значительно отличалось от «кубаноподобной» модели (Loll et al., 2005). Затем рентгеновская структура PSII с разрешением 1,9 Å из T. vulcanus показала четкую картину Mn 4 CaO 5 , в котором электронные плотности для каждого иона металла и атомов кислорода с оксо-мостиками были полностью разделены, что позволило четко определить принадлежность каждого из атомов. Они обнаружили, что кластер OEC Mn 4 CaO 5 демонстрирует конформацию «искаженного кресла» с тремя атомами Mn, одним Ca и четырьмя атомами кислорода, образующими асимметричное кубаноподобное основание сиденья, и четвертый Mn (Mn 4 ) вместе. с пятым атомом кислорода (O 4 ), образующим спинку стула (Umena et al., 2011). Впоследствии одновременная фемтосекундная рентгеновская спектроскопия и дифракция системы ФС II показали, что карты электронной плотности темного и освещенного состояний подобны с общим коэффициентом корреляции (КК) 0,77 (КК 0 означает отсутствие корреляции; КК 1 указывает на полную корреляцию), предполагая отсутствие существенных конформационных изменений между S 1 и S 2 (Kern et al.
Однако ни воду, ни гидроксид нельзя было наблюдать, чтобы точно определить место окисления воды в их исследовании. В первой полной структуре ФС II кластер Mn 4 Ca был предложен как «Y-образный крючок», что значительно отличалось от «кубаноподобной» модели (Loll et al., 2005). Затем рентгеновская структура PSII с разрешением 1,9 Å из T. vulcanus показала четкую картину Mn 4 CaO 5 , в котором электронные плотности для каждого иона металла и атомов кислорода с оксо-мостиками были полностью разделены, что позволило четко определить принадлежность каждого из атомов. Они обнаружили, что кластер OEC Mn 4 CaO 5 демонстрирует конформацию «искаженного кресла» с тремя атомами Mn, одним Ca и четырьмя атомами кислорода, образующими асимметричное кубаноподобное основание сиденья, и четвертый Mn (Mn 4 ) вместе. с пятым атомом кислорода (O 4 ), образующим спинку стула (Umena et al., 2011). Впоследствии одновременная фемтосекундная рентгеновская спектроскопия и дифракция системы ФС II показали, что карты электронной плотности темного и освещенного состояний подобны с общим коэффициентом корреляции (КК) 0,77 (КК 0 означает отсутствие корреляции; КК 1 указывает на полную корреляцию), предполагая отсутствие существенных конформационных изменений между S 1 и S 2 (Kern et al. , 2013). Однако с помощью серийной кристаллографии с временным разрешением авторы получили структуры ФС II в темном состоянии S 1 и предполагаемом S 3 , в которых они обнаружили, что расстояние между кубаном Mn 3 O x Ca и отдаленный выступающий Mn (болтающийся Mn) увеличился в предполагаемом состоянии S 3 , что позволило связать вторую молекулу воды во время перехода состояния S 2 в S 3 (Kupitz et al., 2014). Более того, с помощью фемтосекундного рентгеновского лазера на свободных электронах (XFEL), «без радиационного повреждения», Suga et al. (2015, 2017) обнаружили, что расстояния Mn-Mn и Mn-O показали заметные различия в OEC из XFEL: все расстояния примерно на 0,1–0,2 Å короче, чем расстояния из структур рентгеновской дифракции (XRD). Кроме того, положение O5 также необычно. Результаты показали, что он действует скорее как ион гидроксида, а не как нормальный дианион кислорода, служащий одним из атомов кислорода субстрата (Suga et al.
, 2013). Однако с помощью серийной кристаллографии с временным разрешением авторы получили структуры ФС II в темном состоянии S 1 и предполагаемом S 3 , в которых они обнаружили, что расстояние между кубаном Mn 3 O x Ca и отдаленный выступающий Mn (болтающийся Mn) увеличился в предполагаемом состоянии S 3 , что позволило связать вторую молекулу воды во время перехода состояния S 2 в S 3 (Kupitz et al., 2014). Более того, с помощью фемтосекундного рентгеновского лазера на свободных электронах (XFEL), «без радиационного повреждения», Suga et al. (2015, 2017) обнаружили, что расстояния Mn-Mn и Mn-O показали заметные различия в OEC из XFEL: все расстояния примерно на 0,1–0,2 Å короче, чем расстояния из структур рентгеновской дифракции (XRD). Кроме того, положение O5 также необычно. Результаты показали, что он действует скорее как ион гидроксида, а не как нормальный дианион кислорода, служащий одним из атомов кислорода субстрата (Suga et al. , 2015). В их недавней работе описаны индуцированные светом структурные изменения в ФС II при двухкратном освещении, смоделирован шестой атом кислорода (O6), близкий к O5, и сделаны важные выводы для механизма образования связи O=O (Suga et al., 2017). . Кроме того, сообщалось, что ион хлорида необходим для выделения кислорода, и есть два сайта связывания аниона, расположенные по обеим сторонам кластера MnCa на одинаковом расстоянии от кластера для стабилизации его структуры (Kawakami et al., 2009).).
, 2015). В их недавней работе описаны индуцированные светом структурные изменения в ФС II при двухкратном освещении, смоделирован шестой атом кислорода (O6), близкий к O5, и сделаны важные выводы для механизма образования связи O=O (Suga et al., 2017). . Кроме того, сообщалось, что ион хлорида необходим для выделения кислорода, и есть два сайта связывания аниона, расположенные по обеим сторонам кластера MnCa на одинаковом расстоянии от кластера для стабилизации его структуры (Kawakami et al., 2009).).
Структура растительного суперкомплекса ФСII
Растительный ФСII имеет сходную общую структуру димерного суперкомплекса с ФСII цианобактерий. Первая структура растительного комплекса ФСII-LHCII из шпината была получена 17 лет назад при 17 Å (Nield et al., 2000), а недавно была получена структура шпината 3,2 Å C 2 S 2 -типа (C: ядро комплекса ФСII). ; S: сильно ассоциированный тример LHCII) о структуре суперкомплекса сообщалось с развитием методов криоэлектронной микроскопии отдельных частиц (Wei et al. , 2016) (рис. 1B). Совсем недавно структура доминирующего типа суперкомплекса в растениях, C 2 S 2 M 2 -тип (M: умеренно связанные LHCII) также был решен при 2,7 и 3,2 Å для штабелированных и нештабелированных форм из Pisum sativum (горох) и при 5,3 Å из Arabidopsis. thaliana соответственно (Su et al., 2017; van Bezouwen et al., 2017). По сравнению со структурой суперкомплекса типа C 2 S 2 шпината структура, описанная Su et al. (2017) был определен в более физиологических условиях, содержащих три мономера светособирающего комплекса (ССК) (CP29, CP26 и CP24) и два тримера (S-LHCII и M-LHCII) на ядро. Напротив, CP24 и M-LHCII отсутствуют в предыдущей структуре Wei et al. (2016). Растительный ФС II действительно демонстрирует тот же состав и организацию субъединиц и кофакторов, что и их цианобактериальные аналоги (таблица 1). Каталитический центр внутри основного комплекса состоит из четырех крупнейших внутренних мембранных субъединиц PsbA (D1), PsbB (CP47), PsbC (CP43) и PsbD (D2).
, 2016) (рис. 1B). Совсем недавно структура доминирующего типа суперкомплекса в растениях, C 2 S 2 M 2 -тип (M: умеренно связанные LHCII) также был решен при 2,7 и 3,2 Å для штабелированных и нештабелированных форм из Pisum sativum (горох) и при 5,3 Å из Arabidopsis. thaliana соответственно (Su et al., 2017; van Bezouwen et al., 2017). По сравнению со структурой суперкомплекса типа C 2 S 2 шпината структура, описанная Su et al. (2017) был определен в более физиологических условиях, содержащих три мономера светособирающего комплекса (ССК) (CP29, CP26 и CP24) и два тримера (S-LHCII и M-LHCII) на ядро. Напротив, CP24 и M-LHCII отсутствуют в предыдущей структуре Wei et al. (2016). Растительный ФС II действительно демонстрирует тот же состав и организацию субъединиц и кофакторов, что и их цианобактериальные аналоги (таблица 1). Каталитический центр внутри основного комплекса состоит из четырех крупнейших внутренних мембранных субъединиц PsbA (D1), PsbB (CP47), PsbC (CP43) и PsbD (D2).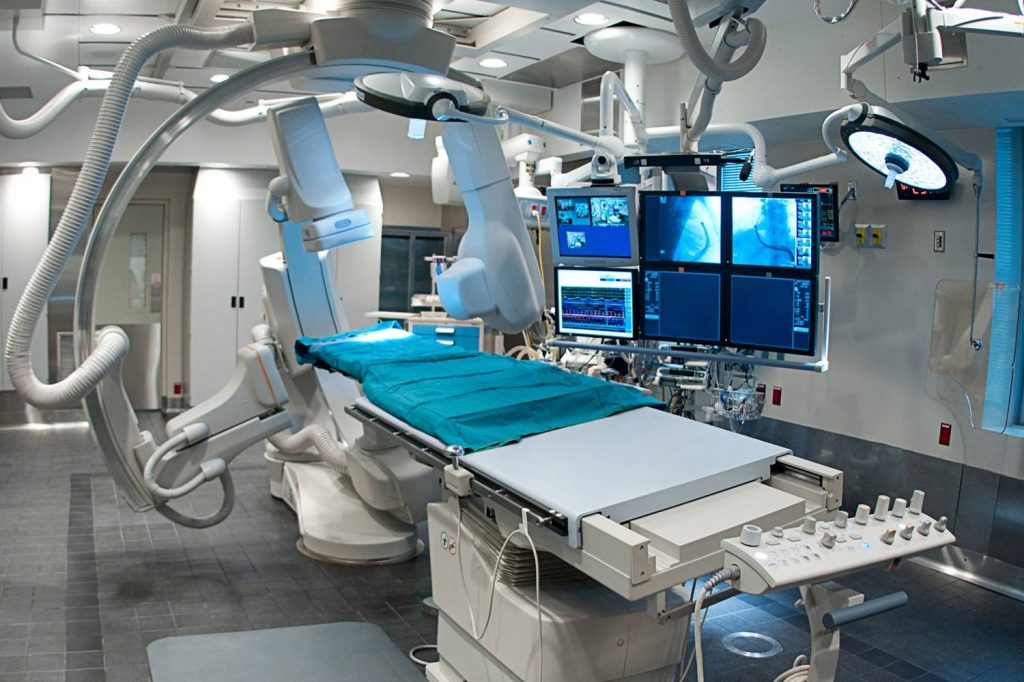 В частности, D1 и D2 образуют фотохимический RC, который отвечает за разделение заряда и перенос электронов, а CP47 и CP43 действуют как белки внутренней антенны, участвующие в сборе света и транспортировке энергии от периферической антенны к RC. В коровом комплексе также есть 12 низкомолекулярных (ММ) трансмембранных субъединиц, окружающих реакционный центр, образующих ремнеобразную структуру. В комплексе PSII-LHCII шпината такими субъединицами являются PsbE, PsbF, PsbH-M, PsbTc, PsbW, PsbX и PsbZ. Большинство этих субъединиц структурно консервативны с одной трансмембранной спиралью, за исключением PsbZ с двумя спиралями. Эти субъединицы необходимы как для димеризации, так и для стабилизации основного комплекса, а также для ассоциации между основным комплексом и комплексом периферической антенны. Кроме того, они связывают цитохром b -559 для защиты комплекса PSII от фотоповреждений. Три внешние субъединицы PsbO, PsbP и PsbQ составляют OEC, который также включает люминальный домен CP43 и С-концевой домен D1, защищая аппарат расщепления воды.
В частности, D1 и D2 образуют фотохимический RC, который отвечает за разделение заряда и перенос электронов, а CP47 и CP43 действуют как белки внутренней антенны, участвующие в сборе света и транспортировке энергии от периферической антенны к RC. В коровом комплексе также есть 12 низкомолекулярных (ММ) трансмембранных субъединиц, окружающих реакционный центр, образующих ремнеобразную структуру. В комплексе PSII-LHCII шпината такими субъединицами являются PsbE, PsbF, PsbH-M, PsbTc, PsbW, PsbX и PsbZ. Большинство этих субъединиц структурно консервативны с одной трансмембранной спиралью, за исключением PsbZ с двумя спиралями. Эти субъединицы необходимы как для димеризации, так и для стабилизации основного комплекса, а также для ассоциации между основным комплексом и комплексом периферической антенны. Кроме того, они связывают цитохром b -559 для защиты комплекса PSII от фотоповреждений. Три внешние субъединицы PsbO, PsbP и PsbQ составляют OEC, который также включает люминальный домен CP43 и С-концевой домен D1, защищая аппарат расщепления воды. Среди них PsbO стабилизирует комплекс Mn, тогда как PsbP и PsbQ участвуют в оптимизации выделения кислорода при физической концентрации ионов кальция и хлорида. Сравнение структуры также показало, что гибкие области этих субъединиц претерпевают значительные конформационные изменения, когда они связываются с коровым комплексом (Wei et al., 2016). Вне ядра комплекса находится LHCII, структура которого в суперкомплексе ФСII почти такая же, как и у гороха LHCII (Standfuss et al., 2005).
Среди них PsbO стабилизирует комплекс Mn, тогда как PsbP и PsbQ участвуют в оптимизации выделения кислорода при физической концентрации ионов кальция и хлорида. Сравнение структуры также показало, что гибкие области этих субъединиц претерпевают значительные конформационные изменения, когда они связываются с коровым комплексом (Wei et al., 2016). Вне ядра комплекса находится LHCII, структура которого в суперкомплексе ФСII почти такая же, как и у гороха LHCII (Standfuss et al., 2005).
LHCII растений занимает около 30% всех белков в мембране хлоропластов, поэтому представляет собой самый распространенный мембранный белок на Земле (Peter and Thornber, 1991; Standfuss et al., 2005). LHCII действует как гетеротример, состоящий из Lhcb1, Lhcb2 и Lhcb3. Каждый полипептид пересекает тилакоидную мембрану трижды, при этом его С-конец расположен на люминальной стороне (Kuhlbrandt et al., 1994). Комплекс LHCII жизненно важен как для фотосинтеза, так и для образования гран хлоропластов. Для первой функции гетеротримеры LHCII связаны с комплексом сердцевины фотосистемы минорными антенными субъединицами Lhcb4 (CP29), Lhcb5 (CP26) и Lhcb6 (CP24). В суперкомплексе шпината PSII-LHCII два гетеротримера LHCII вместе с двумя белками CP26 фланкируют кор-димерный комплекс с обеих сторон (Wei et al., 2016). Тогда как в суперкомплексе C 2 S 2 M 2 из Arabidopsis и гороха присутствуют четыре тримера LHCII, из которых два прочно связанных тримера LHCII (S 2 ) вместе с CP26 и CP24, и умеренно связанные тримеры (M 2 ) с CP29 вместе составляют основной комплекс для транспорта электронов (Su et al., 2017; van Bezouwen et al., 2017). Для второй функции стромальная поверхность тримера LHCII заряжена отрицательно, тогда как его первые 15 остатков на N-конце содержат 4 положительно заряженных остатка. Этот поразительный паттерн заряда напоминает «липучку-подобную» моду, гарантирующую неспецифические взаимодействия тримеров LHCII в соседних тилакоидных мембранах (Standfuss et al., 2005), что кажется существенным для образования хлоропластных гран. Сообщалось, что конститутивная экспрессия Lhcb1 значительно увеличивает количество гран в трансгенных растениях табака (Labate et al.
В суперкомплексе шпината PSII-LHCII два гетеротримера LHCII вместе с двумя белками CP26 фланкируют кор-димерный комплекс с обеих сторон (Wei et al., 2016). Тогда как в суперкомплексе C 2 S 2 M 2 из Arabidopsis и гороха присутствуют четыре тримера LHCII, из которых два прочно связанных тримера LHCII (S 2 ) вместе с CP26 и CP24, и умеренно связанные тримеры (M 2 ) с CP29 вместе составляют основной комплекс для транспорта электронов (Su et al., 2017; van Bezouwen et al., 2017). Для второй функции стромальная поверхность тримера LHCII заряжена отрицательно, тогда как его первые 15 остатков на N-конце содержат 4 положительно заряженных остатка. Этот поразительный паттерн заряда напоминает «липучку-подобную» моду, гарантирующую неспецифические взаимодействия тримеров LHCII в соседних тилакоидных мембранах (Standfuss et al., 2005), что кажется существенным для образования хлоропластных гран. Сообщалось, что конститутивная экспрессия Lhcb1 значительно увеличивает количество гран в трансгенных растениях табака (Labate et al. , 2004), в то время как нокдаун Lhcb1 и Lhcb2 препятствует образованию гран в стопках (Andersson et al., 2003; Garab, 2014, 2016). В недавней работе, чтобы выяснить, как суперкомплексы ФСII-LHCII взаимодействуют друг с другом в хлоропластном тилакоиде, авторы выделили суперкомплексы ФСII-LHCII в ионной концентрации, которая напоминает нативную среду хлоропластов, и обнаружили, что большинство суперкомплексов существуют в паре C 2 S 2 М форма (Albanese et al., 2017). Это исследование предоставило новое понимание того, как соседние тилакоиды могут быть связаны, чтобы опосредовать укладку мембран гран посредством взаимодействий между парами суперкомплексов PSII-LHCII.
, 2004), в то время как нокдаун Lhcb1 и Lhcb2 препятствует образованию гран в стопках (Andersson et al., 2003; Garab, 2014, 2016). В недавней работе, чтобы выяснить, как суперкомплексы ФСII-LHCII взаимодействуют друг с другом в хлоропластном тилакоиде, авторы выделили суперкомплексы ФСII-LHCII в ионной концентрации, которая напоминает нативную среду хлоропластов, и обнаружили, что большинство суперкомплексов существуют в паре C 2 S 2 М форма (Albanese et al., 2017). Это исследование предоставило новое понимание того, как соседние тилакоиды могут быть связаны, чтобы опосредовать укладку мембран гран посредством взаимодействий между парами суперкомплексов PSII-LHCII.
Кофакторы суперкомплекса PSII-LHCII незаменимы для выполнения соответствующих функций. Как и у цианобактерий, эти кофакторы в основном включают хлорофиллы, каротиноиды, липиды и т. д. (табл. 1). В шпинате C 2 S 2 Суперкомплекс PSII-LHCII, всего 105 молекул хлорофилла, 28 β-каротинов и ксантофиллов, один гем, один кластер Mn 4 CaO 5 , один пластохинон и многочисленные липиды. Интересно, что мономер LHCII демонстрирует сходство аминокислотной последовательности и структуры с таковыми у CP29, однако тип, количество и расположение хлорофиллов, которые они связывают, значительно отличаются (Liu et al., 2004; Standfuss et al., 2005; Pan и др., 2011). Как крупнейшие связанные с хромофорами антенные субъединицы, LHCII содержит Chls, которые поглощают солнечное излучение с различными длинами волн 660 ± 20 нм.
Интересно, что мономер LHCII демонстрирует сходство аминокислотной последовательности и структуры с таковыми у CP29, однако тип, количество и расположение хлорофиллов, которые они связывают, значительно отличаются (Liu et al., 2004; Standfuss et al., 2005; Pan и др., 2011). Как крупнейшие связанные с хромофорами антенные субъединицы, LHCII содержит Chls, которые поглощают солнечное излучение с различными длинами волн 660 ± 20 нм.
Выводы и перспективы
Фотосинтез играет очень важную роль в производстве молекулярного кислорода, контроле содержания углекислого газа в атмосфере и глобальном обеспечении продовольствием. Структурная информация о фотосистемах бесценна для нашего понимания фотосинтеза, вероятно, самого важного процесса на Земле. Эта информация также поможет разработать искусственную систему фотосинтеза для улучшения производства биоэнергии и повышения продуктивности сельского хозяйства. Совсем недавно структура крупнейшего светособирающего комплекса, фикобилисомы (PBS) из 9Также сообщалось о 0023 Griffithsia pacifica (Zhang et al. , 2017). Как основная светособирающая антенна у цианобактерий и красных водорослей, она демонстрирует очень высокую скорость передачи энергии с высоким квантовым выходом (Glazer, 1989). Структурная информация PBS обеспечит прочную основу для понимания ее путей передачи энергии и дальнейшего применения в конструкциях механизмов искусственного сбора света.
, 2017). Как основная светособирающая антенна у цианобактерий и красных водорослей, она демонстрирует очень высокую скорость передачи энергии с высоким квантовым выходом (Glazer, 1989). Структурная информация PBS обеспечит прочную основу для понимания ее путей передачи энергии и дальнейшего применения в конструкциях механизмов искусственного сбора света.
Недавние достижения в крио-ЭМ одиночных частиц предоставили беспрецедентную структурную информацию об этих огромных мембранных комплексах. Тем не менее, есть также несколько открытых вопросов, на которые нужно ответить. Во-первых, точный механизм реакции, лежащий в основе окисления воды и возможных структурных перестроек во время переходов в S-состояние, все еще не определен структурами ФС II в более промежуточных S-состояниях. Во-вторых, до сих пор не совсем понятно, почему в ФСII функционирует только одна цепь переноса электрона (как в бактериальных РЦ), тогда как в ФСI функционируют обе (Santabarbara et al., 2010). Поскольку статические структуры, решенные до сих пор, не дали убедительных ключей в этом отношении, новые исследования, изучающие динамическую природу ФС II, могли бы пролить больше света на это, что очень важно, чтобы сделать ФС II не только протонным насосом, но и местом O 2 эволюция. В-третьих, требуется больше структурной информации для выяснения локализации и функций PsbR и PsbS, субъединиц ФС II, которые необходимы для активности выделения кислорода (Аллахвердиева и др., 2007) и фотозащиты растений (Фан и др., 2015), соответственно. Наконец, новые структуры фотосистем цианобактерий, водорослей и растений с высоким разрешением позволят лучше понять эволюцию оксигенного фотосинтеза, на основе которого можно будет разработать более совершенные искусственные фотосинтетические механизмы.
В-третьих, требуется больше структурной информации для выяснения локализации и функций PsbR и PsbS, субъединиц ФС II, которые необходимы для активности выделения кислорода (Аллахвердиева и др., 2007) и фотозащиты растений (Фан и др., 2015), соответственно. Наконец, новые структуры фотосистем цианобактерий, водорослей и растений с высоким разрешением позволят лучше понять эволюцию оксигенного фотосинтеза, на основе которого можно будет разработать более совершенные искусственные фотосинтетические механизмы.
Вклад авторов
JG написал рукопись с помощью HW и QY. YF рассмотрел и отредактировал рукопись.
Финансирование
Работа выполнена при поддержке Национального фонда естественных наук Китая (гранты № 31400635 и 31670766).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы приносим свои извинения коллегам, чьи работы не могут быть процитированы из-за нехватки места.
Ссылки
Albanese, P., Melero, R., Engel, B.D., Grinzato, A., Berto, P., Manfredi, M., et al. (2017). Гороховые суперкомплексы PSII-LHCII образуют пары, образуя соединения через стромальный промежуток. Науч. Респ. 7:10067. doi: 10.1038/s41598-017-10700-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Альбертссон, П. (2001). Количественная модель доменной структуры фотосинтетической мембраны. Тенденции Растениеводство. 6, 349–354. doi: 10.1016/S1360-1385(01)02021-0
Полный текст CrossRef | Google Scholar
Аллахвердиева Ю., Мамедов Ф., Суорса М., Стайринг С., Васс И. и Аро Э. М. (2007). Взгляд на функцию белка PsbR у Arabidopsis thaliana. Биохим. Биофиз. Acta 1767, 677–685. doi: 10.1016/j.bbabio.2007.01.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Андерссон Дж. , Вентворт М., Уолтерс Р. Г., Ховард К. А., Рубан А. В., Хортон П. и др. (2003). Отсутствие белков Lhcb1 и Lhcb2 светособирающего комплекса фотосистемы II влияет на фотосинтез, укладку гран и приспособленность. Plant J. Cell Mol. биол. 35, 350–361. doi: 10.1046/j.1365-313X.2003.01811.x
, Вентворт М., Уолтерс Р. Г., Ховард К. А., Рубан А. В., Хортон П. и др. (2003). Отсутствие белков Lhcb1 и Lhcb2 светособирающего комплекса фотосистемы II влияет на фотосинтез, укладку гран и приспособленность. Plant J. Cell Mol. биол. 35, 350–361. doi: 10.1046/j.1365-313X.2003.01811.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Арвидссон П.О. и Сандби К. (1999). Модель топологии тилакоидной мембраны хлоропластов. Функц. биол. растений 26, 687–694. doi: 10.1071/PP99072
CrossRef Полный текст | Google Scholar
Бен-Шем А., Фролоу Ф. и Нельсон Н. (2003). Кристаллическая структура фотосистемы растений I. Природа 426, 630–635. doi: 10.1038/nature02200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бесиадка Дж., Лолл Б., Керн Дж., Ирганг К. Д. и Зуни А. (2004). Кристаллическая структура цианобактериальной фотосистемы II с разрешением 3,2 Å: более пристальный взгляд на Mn-кластер. Физ. хим. хим. физ. 6, 4733–4736. doi: 10.1039/B406989G
Физ. хим. хим. физ. 6, 4733–4736. doi: 10.1039/B406989G
CrossRef Полный текст | Google Scholar
Бреттель К. и Лейбл В. (2001). Перенос электрона в фотосистеме I. Биохим. Биофиз. Acta 1507, 100–114. doi: 10.1016/S0005-2728(01)00202-X
Полный текст CrossRef | Google Scholar
Брозер М., Габдулхаков А., Керн Дж., Гуськов А., Мюх Ф., Сенгер В. и др. (2010). Кристаллическая структура мономерной фотосистемы II из Thermosynechococcus elongatus при разрешении 3,6 Å. Дж. Биол. хим. 285, 26255. doi: 10.1074/jbc.M110.127589
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Каффарри С., Тибилетти Т., Дженнингс Р. К. и Сантабарбара С. (2014). Сравнение архитектуры и функционирования фотосистемы I и фотосистемы II растений. Курс. прот. Пептидная наука. 15, 296–331. doi: 10.2174/13815666140327102218
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Крамер В. А., Сориано Г. М., Пономарев М., Хуанг Д., Чжан Х., Мартинес С. Э. и др. (1996). Некоторые новые структурные аспекты и старые споры о цитохромном комплексе b6f оксигенного фотосинтеза. год. Преподобный Завод Физиол. Завод Мол. биол. 47, 477–508. doi: 10.1146/annurev.arplant.47.1.477
А., Сориано Г. М., Пономарев М., Хуанг Д., Чжан Х., Мартинес С. Э. и др. (1996). Некоторые новые структурные аспекты и старые споры о цитохромном комплексе b6f оксигенного фотосинтеза. год. Преподобный Завод Физиол. Завод Мол. биол. 47, 477–508. doi: 10.1146/annurev.arplant.47.1.477
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Кроче Р. и ван Амеронген Х. (2013). Светосбор в фотосистеме I. Photosynth. Рез. 116, 153–166. doi: 10.1007/s11120-013-9838-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Деккер, Дж. П., и Бокема, Э. Дж. (2005). Надмолекулярная организация белков мембран тилакоидов зеленых растений. Биохим. Биофиз. Acta 1706, 12–39. doi: 10.1016/j.bbabio.2004.09.009
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Дисмукес Г.К., Климов В.В., Баранов С.В., Козлов Ю.Н., ДасГупта Дж., Тырышкин А. (2001). Происхождение атмосферного кислорода на Земле: инновации оксигенного фотосинтеза. Проц. Натл. акад. науч. США 98, 2170–2175. doi: 10.1073/pnas.061514798
Проц. Натл. акад. науч. США 98, 2170–2175. doi: 10.1073/pnas.061514798
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Fan, M., Li, M., Liu, Z., Cao, P., Pan, X., Zhang, H., et al. (2015). Кристаллические структуры белка PsbS, необходимого для фотозащиты растений. Нац. Структура Мол. биол. 22, 729–735. doi: 10.1038/nsmb.3068
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Феррейра К.Н., Айверсон Т.М., Маглауи К., Барбер Дж. и Ивата С. (2004). Архитектура фотосинтетического центра выделения кислорода. Наука 303, 1831–1838. doi: 10.1126/science.10
- -041942
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нельсон Н. и Йокум К.Ф. (2006). Строение и функции фотосистем I и II. год. Преподобный завод биол. 57, 521–565. doi: 10.1146/annurev.arplant.57.032905.105350
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нильд Дж., Орлова Е.В., Моррис Е.П., Гоуэн Б., ван Хил М. и Барбер Дж. (2000). Трехмерная карта суперкомплекса фотосистемы II растений, полученная с помощью криоэлектронной микроскопии и анализа отдельных частиц. Нац. Структура биол. 7, 44–47. doi: 10.1038/71242
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Pan, X., Li, M., Wan, T., Wang, L., Jia, C., Hou, Z., et al. (2011). Структурное понимание регуляции энергии светособирающего комплекса CP29 из шпината. Нац. Структура Мол. биол. 18, 309–315. doi: 10.1038/nsmb.
 2008
2008PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Питер, Г. Ф., и Торнбер, Дж. П. (1991). Биохимический состав и организация светособирающих белков-пигментов фотосистемы II высших растений. Дж. Биол. хим. 266, 16745–16754.
Реферат PubMed | Google Scholar
Пфанншмидт, Т. (2003). Окислительно-восстановительные сигналы хлоропластов: как фотосинтез контролирует свои собственные гены. Trends Plant Sci. 8, 33–41. doi: 10.1016/S1360-1385(02)00005-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цинь X., Суга М., Куанг Т. и Шен Дж. Р. (2015). Фотосинтез. Структурная основа путей переноса энергии в растительном суперкомплексе PSI-LHCI. Наука 348, 989–995. doi: 10.1126/science.aab0214
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ремелли Р., Варотто К., Сандона Д., Кроче Р. и Басси Р. (1999). Связывание хлорофилла с мономерным светособирающим комплексом.
 Анализ мутаций хромофор-связывающих остатков. Дж. Биол. хим. 274, 33510–33521. doi: 10.1074/jbc.274.47.33510
Анализ мутаций хромофор-связывающих остатков. Дж. Биол. хим. 274, 33510–33521. doi: 10.1074/jbc.274.47.33510PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Рубан А.В. (2015). Эволюция под солнцем: оптимизация сбора света при фотосинтезе. Дж. Эксп. Бот. 66, 7–23. doi: 10.1093/jxb/eru400
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сантабарбара С., Галуппини Л. и Казацца А. П. (2010). Двунаправленный перенос электрона в реакционном центре фотосистемы I. J. Integr. биол. растений 52, 735–749. doi: 10.1111/j.1744-7909.2010.00977.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сетиф, П. (2001). Восстановление ферредоксина и флаводоксина фотосистемой I. Биохим. Биофиз. Acta 1507, 161–179. doi: 10.1016/S0005-2728(01)00205-5
CrossRef Полный текст | Google Scholar
Стандфус Дж., Ак Т.В.С., Ламборджини М. и Кюльбрандт В. (2005).
 Механизмы фотозащиты и нефотохимического тушения в светособирающем комплексе гороха при разрешении 2,5 Å. EMBO J. 24, 919–928. doi: 10.1038/sj.emboj.7600585
Механизмы фотозащиты и нефотохимического тушения в светособирающем комплексе гороха при разрешении 2,5 Å. EMBO J. 24, 919–928. doi: 10.1038/sj.emboj.7600585PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Su, X., Ma, J., Wei, X., Cao, P., Zhu, D., Chang, W., et al. (2017). Структура и механизм сборки растительного суперкомплекса ФСII-LHCII типа C2S2M2. Наука 357, 815–820. doi: 10.1126/science.aan0327
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Суга М., Акита Ф., Хирата К., Уэно Г., Мураками Х., Накадзима Ю. и др. (2015). Нативная структура фотосистемы II с разрешением 1,95 Å, наблюдаемая фемтосекундными импульсами рентгеновского излучения. Природа 517, 99–103. doi: 10.1038/nature13991
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Суга М., Акита Ф., Сугахара М., Кубо М., Накадзима Ю., Накане Т. и др. (2017). Индуцированные светом структурные изменения и место образования связи O = O в ФС II, зафиксированное XFEL.
 Природа 543, 131–135. doi: 10.1038/nature21400
Природа 543, 131–135. doi: 10.1038/nature21400PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Томиока Н. и Сугиура М. (1983). Полная нуклеотидная последовательность гена 16S рибосомной РНК сине-зеленой водоросли Anacystis nidulans. Мол. Генерал Жене. 191, 46–50. doi: 10.1007/BF00330888
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Умена Ю., Каваками К., Шен Дж. Р. и Камия Н. (2011). Кристаллическая структура выделяющей кислород фотосистемы II при разрешении 1,9Å. Природа 473, 55–60. doi: 10.1038/nature09913
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
van Bezouwen, L.S., Caffarri, S., Kale, R.S., Kouřil, R., Thunnissen, A.W.H., Oostergetel, G.T., et al. (2017). Субъединичная и хлорофилловая организация суперкомплекса фотосистемы II растений. Нац. Растения 3:17080. doi: 10.1038/nplants.2017.80
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
ван Амеронген Х.
 и Кроче Р. (2013). Сбор света в фотосистеме II. Фотосинтез. Рез. 116, 251–263. doi: 10.1007/s11120-013-9824-3
и Кроче Р. (2013). Сбор света в фотосистеме II. Фотосинтез. Рез. 116, 251–263. doi: 10.1007/s11120-013-9824-3PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Wei, X., Su, X., Cao, P., Liu, X., Chang, W., Li, M., et al. (2016). Структура суперкомплекса фотосистемы II-LHCII шпината с разрешением 3,2 Å. Природа 534, 69–74. doi: 10.1038/nature18020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вудсон, Дж. Д. (2016). Контроль качества хлоропластов – баланс производства энергии и стресса. Новый фитол. 212, 36–41. doi: 10.1111/nph.14134
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zhang, J., Ma, J., Liu, D., Qin, S., Sun, S., Zhao, J., et al. (2017). Структура фикобилисом красной водоросли Griffithsia pacifica. Природа 551, 57–63. doi: 10.1038/nature24278
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zouni, A.
 , Witt, H.T., Kern, J., Fromme, P., Krauss, N., Saenger, W., et al. (2001). Кристаллическая структура фотосистемы II из Synechococcus elongatus с разрешением 3,8 Å. Природа 409, 739–743. doi: 10.1038/35055589
, Witt, H.T., Kern, J., Fromme, P., Krauss, N., Saenger, W., et al. (2001). Кристаллическая структура фотосистемы II из Synechococcus elongatus с разрешением 3,8 Å. Природа 409, 739–743. doi: 10.1038/35055589PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сравнение архитектуры и функционирования фотосистемы I и фотосистемы II растений
1. Bekker A, Holland HD, Wang PL, Rumble D, Stein HJ, Hannah JL, Coetzee LL, Beukes NJ. Датировка подъема кислорода в атмосфере. Природа. 2004; 427:117–120. [PubMed] [Google Scholar]
2. Hohmann-Marriott MF, Blankenship RE. Эволюция фотосинтеза. Анну. Преподобный завод биол. 2011; 62: 515–548. [PubMed] [Академия Google]
3. Hasan SS, Yamashita E, Ryan CM, Whitelegge JP, Cramer WA. Консервация липидных функций в комплексах цитохрома bc. Дж. Мол. биол. 2011; 414:145–162. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Eaton-Rye JJ, Trypathy BC, Sharkey TD, Kallas T.
 В фотосинтезе Пластидная биология Преобразование энергии и ассимиляция углерода в фотосинтезе и дыхании. Спрингер Дортрехт. 2012; 34: 501–560. [Google Scholar]
В фотосинтезе Пластидная биология Преобразование энергии и ассимиляция углерода в фотосинтезе и дыхании. Спрингер Дортрехт. 2012; 34: 501–560. [Google Scholar]5. Yoon HS, Hackett JD, Ciniglia C, Pinto G, Bhattacharya D. Молекулярная хронология происхождения фотосинтезирующих эукариот. Мол. биол. Эвол. 2004;21:809–818. [PubMed] [Google Scholar]
6. Арчибальд Дж.М. Загадка пластидной эволюции. Курс. биол. 2009; 19: Р81–Р88. [PubMed] [Google Scholar]
7. Килинг П.Дж. Эндосимбиотическое происхождение, диверсификация и судьба пластид. Филос. Транс. Р. Соц. Б-Биол. науч. 2010; 365:729–748. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Килинг П.Дж. Численность и влияние пластидных эндосимбиозов на эукариотическую эволюцию. Анну. Преподобный завод биол. 2013; 64: 583–607. [PubMed] [Академия Google]
9. Сандерсон М.Дж., Торн Дж.Л., Викстром Н., Бремер К. Молекулярные данные о времени расхождения растений. Являюсь. Дж. Бот. 2004; 91:1656–1665. [PubMed] [Google Scholar]
10.
 Хортон П., Рубан А.В., Уолтерс Р.Г. Регулирование сбора света в зеленых растениях. Анну. Преподобный Завод Физиол. Завод Мол. биол. 1996; 47: 655–684. [PubMed] [Google Scholar]
Хортон П., Рубан А.В., Уолтерс Р.Г. Регулирование сбора света в зеленых растениях. Анну. Преподобный Завод Физиол. Завод Мол. биол. 1996; 47: 655–684. [PubMed] [Google Scholar]11. Деммиг-Адамс Б., Адамс ВОВ, Матту А.К., Янссон С. В фотозащите, регулировании генов фотоингибирования и окружающей среде. Достижения в области фотосинтеза и дыхания. . Спрингер Дордрехт. 2006; 21: 145–153. [Академия Google]
12. Бланкеншип Молекуляр Р. Механизмы фотосинтеза. Блэквелл Сайенс Оксфорд. 2002 [Google Scholar]
13. Козиол А.Г., Борза Т., Исида К., Килинг П., Ли Р.В., Дернфорд Д.Г. Прослеживание эволюции светособирающих антенн у организмов, содержащих хлорофилл a/b. Завод Физиол. 2007; 143:1802–1816. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Баллоттари М., Жирардон Дж., Даллосто Л., Басси Р. Эволюция и функциональные свойства светособирающих комплексов фотосистемы II у эукариот. Биохим Биофиз Акта. 2012; 1817: 143–157. [PubMed] [Академия Google]
15.
 Нейлсон Дж.А., Дернфорд Д.Г. Структурно-функциональная диверсификация светособирающих комплексов фотосинтезирующих эукариот. Фотосинтез. Рез. 2010;106:57–71. [PubMed] [Google Scholar]
Нейлсон Дж.А., Дернфорд Д.Г. Структурно-функциональная диверсификация светособирающих комплексов фотосинтезирующих эукариот. Фотосинтез. Рез. 2010;106:57–71. [PubMed] [Google Scholar]16. Нельсон Н. Фотосистемы и глобальные эффекты оксигенного фотосинтеза. Биохим. Биофиз. Акта. 2011; 1807: 856–863. [PubMed] [Google Scholar]
17. Амунтс А., Топорик Х., Боровикова А., Нельсон Н. Определение структуры и улучшенная модель фотосистемы растений I. J. Biol. хим. 2010; 285:3478–3486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Jordan P, Fromme P, Witt HT, Klukas O, Saenger W, Krauss N. Трехмерная структура фотосистемы цианобактерий I на 2. Разрешение. Природа. 2001; 411:909–917. [PubMed] [Google Scholar]
19. Гуськов А., Керн Дж., Габдулхаков А., Брозер М., Зуни А., Сенгер В. Цианобактериальная фотосистема II с разрешением 2.-A и роль хинонов в липидах, каналах и хлоридах. Нац. Структура Мол. биол. 2009 г.; 16:334–342. [PubMed] [Google Scholar]
20.
 Umena Y, Kawakami K, Shen JR, Kamiya N. Кристаллическая структура фотосистемы II, выделяющей кислород, при разрешении 1. A. Nature. 2011; 473:55–60. [PubMed] [Академия Google]
Umena Y, Kawakami K, Shen JR, Kamiya N. Кристаллическая структура фотосистемы II, выделяющей кислород, при разрешении 1. A. Nature. 2011; 473:55–60. [PubMed] [Академия Google]21. Nield J, Orlova EV, Morris EP, Gowen B, van Heel M, Barber J. Трехмерная карта суперкомплекса фотосистемы II растений, полученная с помощью криоэлектронной микроскопии и анализа отдельных частиц. Нац. Структура биол. 2000;7:44–47. [PubMed] [Google Scholar]
22. Nield J, Balsera M, De Las Rivas J, Barber J. Исследование с помощью трехмерной электронной криомикроскопии внешних доменов выделяющего кислород комплекса шпината. Белок PsbO. Дж. Биол. хим. 2002; 277:15006–15012. [PubMed] [Академия Google]
23. Rhee KH, Morris EP, Barber J, Kuhlbrandt W. Трехмерная структура реакционного центра фотосистемы II растений при разрешении 8 A. Природа. 1998; 396: 283–284. [PubMed] [Google Scholar]
24. Buchel C, Kuhlbrandt W. Структурные различия во внутренней части фотосистемы II между высшими растениями и цианобактериями.
 Фотосинтез рез. 2005; 85: 3–13. [PubMed] [Google Scholar]
Фотосинтез рез. 2005; 85: 3–13. [PubMed] [Google Scholar]25. Hankamer B, Morris E, Nield J, Gerle C, Barber J. Трехмерная структура димера ядра фотосистемы II высших растений, определенная с помощью электронной микроскопии. J Struct Biol. 2001; 135: 262–269.. [PubMed] [Google Scholar]
26. Shi LX, Hall M, Funk C, Schroder WP. Фотосистема II представляет собой растущий комплекс, обновляющий недавно открытые компоненты и низкомолекулярные белки. Биохим. Биофиз. Акта. 2012; 1817: 13–25. [PubMed] [Google Scholar]
27. Shi LX, Schroder WP. Низкомолекулярные субъединицы фотосинтетической супракомплексной фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2004; 1608: 75–96. [PubMed] [Google Scholar]
28. Miyake C, Yokota A. Циклический поток электронов внутри PSII в мембранах тилакоидов. Физиология клеток растений. 2001; 42: 508–515. [PubMed] [Академия Google]
29. Barber J, Morris E, Buchel C. Выявление структуры хлорофилл-связывающих белков фотосистемы II CP43 и CP47.
 Биохим. Биофиз. Акта. 2000;1459:239–247. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта. 2000;1459:239–247. [PubMed] [Google Scholar]30. Buchel C, Morris E, Barber J. Кристаллизация CP43, хлорофилл-связывающего белка фотосистемы II: анализ молекулярной упаковки с помощью электронной микроскопии. Дж. Структура. биол. 2000; 131:181–186. [PubMed] [Google Scholar]
31. Ghanotakis DF, de Paula JC, Demetriou DM, Bowlby NR, Petersen J, Babcock GT, Yocum CF. Выделение и характеристика белка массой 47 кДа и D1-D2-цитохрома b-559сложный. Биохим. Биофиз. Акта. 1989; 974: 44–53. [PubMed] [Google Scholar]
32. Bricker TM, Roose JL, Fagerlund RD, Frankel LK, Eaton-Rye JJ. Внешние белки Фотосистемы II. Биохим. Биофиз. Акта. 2012; 1817: 121–142. [PubMed] [Google Scholar]
33. Jensen PE, Bassi R, Boekema EJ, Dekker JP, Jansson S, Leister D, Robinson C, Scheller HV. Структурная функция и регуляция фотосистемы растений I. Биохим. Биофиз. Акта-Биоэнергия. 2007; 1767: 335–352. [PubMed] [Академия Google]
34. Нельсон Н., Бен-Шем А.
 Структура фотосистемы I и эволюция фотосинтеза. Биоэссе. 2005; 27: 914–922. [PubMed] [Google Scholar]
Структура фотосистемы I и эволюция фотосинтеза. Биоэссе. 2005; 27: 914–922. [PubMed] [Google Scholar]35. Аро Э.М., Вирджин И., Андерссон Б. Фотоингибирование инактивации фотосистемы-2, повреждение и обмен белков. Биохим. Биофиз. Акта. 1993; 1143: 113–134. [PubMed] [Google Scholar]
36. Nixon PJ, Michoux F, Yu J, Boehm M, Komenda J. Последние достижения в понимании сборки и ремонта фотосистемы II. Анна. Бот. 2010; 106:1–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Коменда Дж., Соботка Р., Никсон П.Дж. Сборка и поддержание комплекса Photosystem II в хлоропластах и цианобактериях. Курс. мнение биол. растений 2012; 15: 245–251. [PubMed] [Google Scholar]
38. Heathcote P, Jones MR, Fyfe PK. Структура и функции фотосинтетических реакционных центров I типа. Филос. Транс. Р. Соц. Б-Биол. науч. 2003; 358: 231–243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Deisenhofer J, Norris JR. Фотосинтетический реакционный центр. Academic Press Inc Сан-Диего.
 1993 [Google Scholar]
1993 [Google Scholar]40. Diner BA, Schlodder E, Nixon PJ, Coleman WJ, Rappaport F, Lavergne J, Vermaas WFJ, Chisholm DA. Сайт-направленные мутации в D1-His198 и D2-His197 фотосистемы II у Synechocystis PCC 6803. Сайты разделения первичного заряда и стабилизации катионов и триплетов. Биохимия. 2001;40:9265–9281. [PubMed] [Google Scholar]
41. Динер Б.А., Раппапорт Ф. Структура, динамика и энергетика первичной фотохимии фотосистемы II оксигенного фотосинтеза. Анну. Преподобный завод биол. 2002; 53: 551–580. [PubMed] [Академия Google]
42. Мюллер М.Г., Никлас Дж., Любиц В., Хольцварт А.Р. Исследования сверхбыстрого нестационарного поглощения реакционных центров Фотосистемы I Chlamydomonas reinhardtii.1 Новая интерпретация стадий захвата энергии и раннего переноса электронов в Фотосистеме I. Биофиз. Дж. 2003; 85: 3899–3922. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Muller MG, Slavov C, Luthra R, Redding KE, Holzwarth AR. Независимая инициация первичного переноса электрона в двух ветвях реакционного центра фотосистемы I.
 проц. Натл. акад. науч. США. 2010;107:4123–4128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2010;107:4123–4128. [Бесплатная статья PMC] [PubMed] [Google Scholar]44. Сантабарбара С., Хиткот П., Эванс М.С. Моделирование реакций переноса электрона в Фотосистеме I с помощью теории электронного туннелирования: филлохиноны, связанные с субъединицами реакционного центра PsaA и PsaB ФС I, почти изоэнергетичны железо-серному кластеру F(X). Биохим. Биофиз. Акта. 2005; 1708: 283–310. [PubMed] [Google Scholar]
45. Сантабарбара С., Галуппини Л., Казацца А.П. Двунаправленный перенос электрона в реакционном центре фотосистемы I. J. Integr. биол. растений 2010; 52: 735–749.. [PubMed] [Google Scholar]
46. Boekema EJ, Jensen PE, Schlodder E, van Breemen JF, van Roon H, Scheller HV, Dekker JP. Фотосистема I зеленых растений связывает светособирающий комплекс I на одной стороне комплекса. Биохимия. 2001;40:1029–1036. [PubMed] [Google Scholar]
47. Kouril R, van Oosterwijk N, Yakushevska AE, Boekema EJ. Фотосистема I поиск тримеров зеленых растений.
 Фоточ. Фотобио. науч. 2005;4:1091–1094. [PubMed] [Google Scholar]
Фоточ. Фотобио. науч. 2005;4:1091–1094. [PubMed] [Google Scholar]48. Galka P, Santabarbara S, Khuong TT, Degand H, Morsomme P, Jennings RC, Boekema EJ, Caffarri S. Функциональный анализ фотосистемы растений I-светособирающий комплекс II суперкомплекса что светособирающий комплекс II, слабо связанный с фотосистемой II, является очень эффективной антенной для фотосистемы I в состоянии II. Растительная клетка. 2012;24:2963–2978. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Chitnis PR. Фотосистема I: функция и физиология. Анну. Преподобный Завод Физиол. Завод Мол. биол. 2001; 52: 593–626. [PubMed] [Google Scholar]
50. Gobets B, van Grondelle R. Перенос энергии и улавливание в фотосистеме I. Biochim. Биофиз. Акта. 2001;1057:80–99. [PubMed] [Google Scholar]
51. Карапетян Н.В. Организация и роль длинноволновых хлорофиллов в фотосистеме I цианобактерий Spirulina. член Клеточная биол. 1998;12:571–584. [PubMed] [Google Scholar]
52. Голбек Дж.
 Х., Кроче Р., Басси Р., Гараб Г. Механизмы и эффекты фотосинтеза. Академическое издательство Клувера. 1998: 421–424. [Google Scholar]
Х., Кроче Р., Басси Р., Гараб Г. Механизмы и эффекты фотосинтеза. Академическое издательство Клувера. 1998: 421–424. [Google Scholar]53. Morosinotto T., Breton J., Bassi R., Croce R. Природа хлорофиллового лиганда в белках Lhca определяет флуоресценцию в дальнем красном цвете, типичную для фотосистемы I. J. Biol. хим. 2003; 278:49223–49229. [PubMed] [Google Scholar]
54. Castelletti S, Morosinotto T, Robert B, Caffarri S, Bassi R, Croce R. Рекомбинантные Lhca2 и Lhca3 субъединицы фотосистемы I антенной системы. Биохимия. 2003;42:4226–4234. [PubMed] [Академия Google]
55. Гараб Г., Дженнингс Р.К., Кроче Р., Дорра Д., Гарласки Ф.М., Хольцварт А.Р., Ривадосси А., Зуккелли Г., Гараб Г. В книге «Механизм и эффекты фотосинтеза» / XI. Междунар. конгр. Фотосинтез, Будапешт, 1998. Kluwer Academic Publishers, Дордрехт. 1998: 271–276. [Google Scholar]
56. Takahashi T, Inoue-Kashino N, Ozawa S, Takahashi Y, Kashino Y, Satoh K. Комплекс фотосистемы II in vivo представляет собой мономер.
 Дж. Биол. хим. 2009; 284:15598–15606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Биол. хим. 2009; 284:15598–15606. [Бесплатная статья PMC] [PubMed] [Google Scholar]57. Seibert M, DeWit M, Staehelin LA. Структурная локализация O2-выделяющего аппарата в виде мультимерных (тетрамерных) частиц на люменальной поверхности фотосинтетических мембран, подвергнутых замораживанию. Дж. Клеточная биология. 1987;105:2257–2265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Kouril R, Oostergetel GT, Boekema EJ. Тонкая структура организации гранальной тилакоидной мембраны с помощью криоэлектронной томографии. Биохим. Биофиз. Акта-Биоэнергия. 2011; 1807: 368–374. [PubMed] [Google Scholar]
59. Daum B, Nicastro D, Il JA, McIntosh JR, Kuhlbrandt W. Расположение фотосистемы II и АТФ-синтазы в мембранах хлоропластов шпината и гороха. Растительная клетка. 2010; 22:1299–1312. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Boekema EJ, van Breemen JF, van Roon H, Dekker JP. Расположение суперкомплексов фотосистемы II в кристаллических макродоменах внутри тилакоидной мембраны хлоропластов зеленых растений.
 Дж. Мол. биол. 2000; 301:1123–1133. [PubMed] [Google Scholar]
Дж. Мол. биол. 2000; 301:1123–1133. [PubMed] [Google Scholar]61. Caffarri S, Kouril R, Kereiche S, Boekema EJ, Croce R. Функциональная архитектура суперкомплексов фотосистемы II высших растений. Эмбо Дж. 2009; 28:3052–3063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Caffarri S, Broess K, Croce R, van Amerongen H. Перенос энергии возбуждения и улавливание в комплексах фотосистемы II высших растений с антеннами разных размеров. Биофиз. Дж. 2011; 100:2094–2103. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Baena-Gonzalez E, Barbato R, Aro EM. Роль фосфорилирования в цикле репарации и олигомерная структура фотосистемы II. Планта. 1999; 208:196–204. [Google Scholar]
64. Аро Э.М., Суорса М., Рокка А., Аллахвердиева Ю., Пааккаринен В., Салим А., Батчикова Н., Ринтамаки Э. Динамика фотосистемы II протеомный подход к белковым комплексам тилакоидов. Дж. Эксп. Бот. 2005; 56: 347–356. [PubMed] [Google Scholar]
65. Жолио П., Жолио А. Кинетический этюд фотохимической реакции высвобождения кислорода в ходе фотосинтеза.
 CR Acad. науч. Париж. 1964;258:4622–4625. [PubMed] [Google Scholar]
CR Acad. науч. Париж. 1964;258:4622–4625. [PubMed] [Google Scholar]66. Лаворел Дж., Жолио П. Связанная модель фотосинтетической единицы. Биофиз. Дж. 1972; 12: 815–831. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Батлер В.Л. Распределение энергии в фотохимическом аппарате фотосинтеза. Анна. Преподобный Завод Физиол. 1978; 29: 345–378. [Google Scholar]
68. Китаджима М., Батлер В.Л. Спектры возбуждения фотосистемы I и фотосистемы II в хлоропластах и спектральные характеристики распределения квантов между двумя фотосистемами. Биохим. Биофиз. Акта. 1975;408:297–305. [PubMed] [Google Scholar]
69. den Haan GA, Duysens LNM, Egberts DJN. Кинетика выхода флуоресценции в микросекундном диапазоне в хлореллах pyrenoidosa и хлоропластах шпината в присутствии гидроксиламина. Биохим. Биофиз. Акта. 1974; 368: 409–421. [PubMed] [Google Scholar]
70. Sonneveld A, Rademaker H, Duysens LNM. Перенос и захват энергии возбуждения в фотосистеме II по тушению флуоресценции хлорофилла а2 динитробензолом и каротиноидным триплетом.
 Матричная модель. Биохим. Биофиз. Акта. 1980;593:272–289. [PubMed] [Google Scholar]
Матричная модель. Биохим. Биофиз. Акта. 1980;593:272–289. [PubMed] [Google Scholar]71. Trissl HW, Law CJ, Cogdell RJ. Перенос энергии вверх в пурпурных бактериях, содержащих Lh3, при комнатной температуре. Биохим. Биофиз. Акта-Биоэнергия. 1999;1412:149–172. [PubMed] [Google Scholar]
72. Lavergne J, Trissl HW. Теория индукции флуоресценции в фотосистеме II: вывод аналитических выражений в модели, включающей равновесие экситон-радикальная пара и ограниченный перенос энергии между фотосинтетическими единицами. Биофиз. Дж. 1995;68:2474–2492. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Батлер В.Л., Китадзима М. Тушение флуоресценции в фотосистеме II хлоропластов. Биохим. Биофиз. Акта. 1975; 376: 116–125. [PubMed] [Google Scholar]
74. Бернхардт К., Триссл Х.В. Теории кинетики и выхода флуоресценции и фотохимии Как, если вообще можно, экспериментально различить разные модели организации антенн? Биохим. Биофиз. Акта-Биоэнергия. 1999;1409:125–142. [PubMed] [Академия Google]
75.
 Дуйсенс Л.Н. Перенос и улавливание энергии возбуждения в фотосистеме II. Сиба нашел симптом. 1978: 323–340. [PubMed] [Google Scholar]
Дуйсенс Л.Н. Перенос и улавливание энергии возбуждения в фотосистеме II. Сиба нашел симптом. 1978: 323–340. [PubMed] [Google Scholar]76. Paillotin G, Geacintov NE, Breton J. Теория основных уравнений индукции флуоресценции, фотохимического выхода и тушения синглет-триплетных экситонов в фотосинтетических системах. Биофиз. Дж. 1983; 44: 65–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Paillotin G, Swenberg CE, Breton J, Geacintov NE. Анализ явления флуоресценции, вызванной пикосекундным лазером, в фотосинтетических мембранах с использованием подхода основного уравнения. Биофиз. Дж. 1979;25:513–534. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Kirchhoff H, Lenhert S, Buchel C, Chi L, Nield J. Исследование организации фотосистемы II в фотосинтетических мембранах с помощью атомно-силовой микроскопии. Биохимия. 2008; 47: 431–440. [PubMed] [Google Scholar]
79. Jennings RC, Garlaschi FM, Forti G, Gerola PD. Доказательства структурной роли хлорофилла в хлорофилл-белковых комплексах.
 Биохим. Биофиз. Акта. 1979; 581: 87–95. [PubMed] [Академия Google]
Биохим. Биофиз. Акта. 1979; 581: 87–95. [PubMed] [Академия Google]80. Чоу В.С., Ким Э.Х., Хортон П., Андерсон Дж.М. Гранальная укладка тилакоидных мембран в хлоропластах высших растений: действующие физико-химические силы и вытекающие из этого функциональные последствия. Фотохим. Фотобиол. науч. 2005;4:1081–1090. [PubMed] [Google Scholar]
81. Барбер Дж., Чоу В.С. Механизм контроля укладки и разборки тилакоидных мембран хлоропластов. Фебс Летт. 1979; 105: 5–10. [Google Scholar]
82. Чоу В.С., Миллер С., Андерсон Дж.М. Поверхность заряжает неоднородным латеральным распределением двух фотосистем и стопкой тилакоидов. Биохим. Биофиз. Акта. 1991;1057:69–77. [Google Scholar]
83. Ким Э.Х., Чоу В.С., Хортон П., Андерсон Дж.М. Укладка тилакоидных мембран с помощью энтропии. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1708: 187–195. [PubMed] [Google Scholar]
84. Андерссон Б., Андерсон Дж. М. Латеральная гетерогенность в распределении хлорофилл-белковых комплексов тилакоидных мембран хлоропластов шпината.
 Биохим. Биофиз. Акта. 1980; 593: 427–440. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта. 1980; 593: 427–440. [PubMed] [Google Scholar]85. Dekker JP, Boekema EJ. Надмолекулярная организация белков мембран тилакоидов зеленых растений. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 12–39.. [PubMed] [Google Scholar]
86. Jennings RC, Garlaschi FM, Gerola PD, Forti G. Проникновение химотрипсина в зону раздела и локализация флавопротеина хлоропласта и фотосистемы II. Биохим. Биофиз. Акта. 1979; 546: 207–219. [PubMed] [Google Scholar]
87. Андерсон Дж.М. Последствия пространственного разделения фотосистем I и II в тилакоидных мембранах хлоропластов высших растений. Фебс Летт. 1981; 124:1–10. [Google Scholar]
88. Аллен Дж. Ф. Фосфорилирование белков в регуляции фотосинтеза. Биохим. Биофиз. Акта. 1982;1098:275–335. [PubMed] [Google Scholar]
89. Жолио П., Беннун П., Жолио А. Новые доказательства, подтверждающие передачу энергии между фотосинтетическими единицами. Биохим. Биофиз. Акта. 1973; 305: 317–328. [PubMed] [Google Scholar]
90.
 Маршо Т.В., Кок Б. Регуляция фотосинтеза катионами в хлоропластах шпината. Биохим. Биофиз. Акта. 1974; 333: 353–365. [PubMed] [Google Scholar]
Маршо Т.В., Кок Б. Регуляция фотосинтеза катионами в хлоропластах шпината. Биохим. Биофиз. Акта. 1974; 333: 353–365. [PubMed] [Google Scholar]91. Jennings RC, Garlaschi FM, Gerola PD, Forti G. Образование грана в хлоропластах может способствовать передаче энергии между единицами фотосистемы-II. Фебс Летт. 1980;117:332–334. [Google Scholar]
92. Kouril R, Dekker JP, Boekema EJ. Надмолекулярная организация фотосистемы II зеленых растений. Биохим. Биофиз. Акта. 2012; 1817: 2–12. [PubMed] [Google Scholar]
93. Betterle N, Ballottari M, Zorzan S, de Bianchi S, Cazzaniga S, Dall’osto L, Morosinotto T, Bassi R. Необходима светоиндуцированная диссоциация гетероолигомера антенны для индукции нефотохимического тушения. Дж. Биол. хим. 2009; 284:15255–15266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Джонсон М.П., Горал Т.К., Даффи К.Д., Мозг А.П., Муллино К.В., Рубан А.В. Рассеивание фотозащитной энергии включает реорганизацию светособирающих комплексов фотосистемы II в мембранах гран хлоропластов шпината.
 Растительная клетка. 2011; 23:1468–1479. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Растительная клетка. 2011; 23:1468–1479. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Хольцварт А.Р., Милославина Ю., Нилкенс М., Янс П. Идентификация двух участков тушения, активных в регуляции фотосинтетического сбора света, изученных с помощью флуоресценции с временным разрешением. хим. физ. Буквы. 2009 г.;483:262–267. [Google Scholar]
96. Фальковски П.Г., Нолл А.Х., Грин Б. В кн.: Эволюция первичных продуцентов в море. Эльзевир Оксфорд. 2007: 37–53. [Google Scholar]
97. Янссон С. Путеводитель по генам Lhc и их родственникам у арабидопсиса. Тенденции Растениевод. 1999; 4: 236–240. [PubMed] [Google Scholar]
98. Dainese P, Bassi R. Стехиометрия субъединиц антенной системы фотосистемы-II хлоропластов и состояние агрегации белков, связывающих хлорофилл-a/b. Дж. Биол. хим. 1991;266:8136–8142. [PubMed] [Google Scholar]
99. Jennings RC, Bassi R, Garlaschi FM, Dainese P, Zucchelli G. Распределение спектральных форм хлорофилла в хлорофилл/белковых комплексах антенны фотосистемы-II.
 Биохимия. 1993; 32:3203–3210. [PubMed] [Google Scholar]
Биохимия. 1993; 32:3203–3210. [PubMed] [Google Scholar]100. Camm EL, Green BR. Широкое распространение некоторых минорных хлорофилл-белковых комплексов в некоторых растениях и водорослях. Завод Физиол. 1981; 67: 1061–1063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Дунахай Т.Г., Штехелин Л.А. Выделение и характеристика нового белкового комплекса минорного хлорофилла a/b (CP24) из шпината. Завод Физиол. 1986; 80: 429–434. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Bassi R, Hoyer-hansen G, Barbato R, Giacometti GM, Simpson DJ. Хлорофилл-белки антенной системы фотосистемы-II. Дж. Биол. хим. 1987; 262:13333–13341. [PubMed] [Google Scholar]
103. Caffarri S, Croce R, Cattivelli L, Bassi R. Взгляд в LHCII: дифференциальный анализ комплексов Lhcbl-3, образующих главный тримерный антенный комплекс фотосинтеза высших растений. Биохимия. 2004;43:9467–9476. [PubMed] [Google Scholar]
104. Alboresi A, Caffarri S, Nogue F, Bassi R, Morosinotto T.
 In silico и биохимический анализ фотосинтетической антенны Physcomitrella patens: идентификация субъединиц, которые развились при адаптации к земле. ПЛОС ОДИН. 2008;3:e2033. [Статья бесплатно PMC] [PubMed] [Google Scholar]
In silico и биохимический анализ фотосинтетической антенны Physcomitrella patens: идентификация субъединиц, которые развились при адаптации к земле. ПЛОС ОДИН. 2008;3:e2033. [Статья бесплатно PMC] [PubMed] [Google Scholar]105. Ganeteg U, Klimmek F, Jansson S. Lhca5 белок типа LHC, связанный с фотосистемой I. Plant Mol. биол. 2004; 54: 641–651. [PubMed] [Академия Google]
106. Баллоттари М., Далл’Осто Л., Моросинотто Т., Басси Р. Контрастное поведение фотосистем I и антенных систем II высших растений во время акклиматизации. Дж. Биол. хим. 2007; 282:8947–8958. [PubMed] [Google Scholar]
107. Klimmek F, Sjodin A, Noutsos C, Leister D, Jansson S. Обильно и редко экспрессируемые гены белка Lhc демонстрируют различные схемы регуляции в растениях. Завод Физиол. 2006; 140:793–804. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Storf S, Jansson S, Schmid VHR. Связывание пигмента, флуоресцентные свойства и поведение олигомеризации Lhca5, нового светособирающего белка.
 Дж. Биол. хим. 2005; 280:5163–5168. [PubMed] [Академия Google]
Дж. Биол. хим. 2005; 280:5163–5168. [PubMed] [Академия Google]109. Wientjes E, Oostergetel GT, Jansson S, Boekema EJ, Croce R. Роль комплексов Lhca в надмолекулярной организации фотосистемы высших растений I. J. Biol. хим. 2009; 284:7803–7810. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Alboresi A, Gerotto C, Cazzaniga S, Bassi R, Morosinotto T. Антенный белок с красным смещением, связанный с фотосистемой II у Physcomitrella patens. Дж. Биол. хим. 2011; 286:28978–28987. [Бесплатная статья PMC] [PubMed] [Google Scholar]
111. Бен-Шем А., Фролов Ф., Нельсон Н. Кристаллическая структура фотосистемы растений I. Природа. 2003; 426: 630–635. [PubMed] [Google Scholar]
112. Schmid VHR, Cammarata KV, Bruns BU, Schmidt GW. In vitro восстановление светособирающего комплекса фотосистемы I LHCI-730 Для организации пигмента антенны требуется гетеродимеризация. проц. Натл. акад. науч. США. 1997; 94: 7667–7672. [Бесплатная статья PMC] [PubMed] [Google Scholar]
113.
 Schmid VHR, Potthast S, Wiener M, Bergauer V, Paulsen H, Storf S. Пигментное связывание светособирающих белков фотосистемы I. Дж. Биол. хим. 2002; 277:37307–37314. [PubMed] [Академия Google]
Schmid VHR, Potthast S, Wiener M, Bergauer V, Paulsen H, Storf S. Пигментное связывание светособирающих белков фотосистемы I. Дж. Биол. хим. 2002; 277:37307–37314. [PubMed] [Академия Google]114. Croce R, Morosinotto T, Castelletti S, Breton J, Bassi R. Антенные комплексы Lhca фотосистемы высших растений I. Biochim. Биофиз. Акта-Биоэнергия. 2002; 1556: 29–40. [PubMed] [Google Scholar]
115. Wientjes E, Croce R. Светособирающие комплексы фотосистемы I высших растений: Lhca1/4 и Lhca2/3 образуют два гетеродимера, излучающих красное. Биохим. Дж. 2011; 433:477–485. [PubMed] [Google Scholar]
116. Jennings RC, Zucchelli G, Santabarbara S. Неоднородность фотохимического захвата как функция длины волны в фотосистеме растений I (PSI-LHCI). Биохим. Биофиз. Акта-Биоэнергия. 2013;1827:779–785. [PubMed] [Google Scholar]
117. Peter GF, Thornber JP. Биохимический состав и организация фотосистемы высших растений II Светособирающие пигменты-белки. Дж. Биол. хим. 1991; 266:16745–16754.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]118. De Luca C, Varotto C, Svendsen I, De Laureto PP, Bassi R. Множественные светособирающие II полипептиды из хлоропластов мезофилла кукурузы являются отдельными генными продуктами. Дж. Фотохим. Фотобиол. Б. 1999; 49: 50–60. [PubMed] [Академия Google]
119. Яковски Г., Кацпжак К., Янссон С. Идентификация гетеротримеров Lhcb1/Lhcb2/Lhcb3 основного светособирающего хлорофиллового комплекса a/b-белка Фотосистемы II (LHC II). Биохим. Биофиз. Акта-Биоэнергия. 2001; 1504: 340–345. [PubMed] [Google Scholar]
120. Boekema EJ, van Roon H, Calkoen F, Bassi R, Dekker JP. Множественные типы ассоциации фотосистемы II и ее светособирающей антенны в частично солюбилизированных мембранах фотосистемы II. Биохимия. 1999; 38: 2233–2239. [PubMed] [Академия Google]
121. Якушевская А.Е., Дженсен П.Е., Кегстра В., ван Роон Х., Шеллер Х.В., Бокема Е.Дж., Деккер Дж.П. Надмолекулярная организация фотосистемы II и связанной с ней светособирающей антенны у Arabidopsis thaliana.
 Евро. Дж. Биохим. 2001; 268:6020–6028. [PubMed] [Google Scholar]
Евро. Дж. Биохим. 2001; 268:6020–6028. [PubMed] [Google Scholar]122. Liu Z, Yan H, Wang K, Kuang T, Zhang J, Gui L, An X, Chang W. Кристаллическая структура основного светособирающего комплекса шпината при разрешении 2,2 A. . Природа. 2004; 428: 287–292. [PubMed] [Академия Google]
123. Standfuss R, van Scheltinga ACT, Lamborghini M, Kuhlbrandt W. Механизмы фотозащиты и нефотохимического тушения в светособирающем комплексе гороха при 2. Разрешение. Эмбо Дж. 2005; 24: 919–928. [Бесплатная статья PMC] [PubMed] [Google Scholar]
124. Pan X, Li M, Wan T, Wang L, Jia C, Hou Z, Zhao X, Zhang J, Chang W. Структурное понимание регуляции энергии света -уборочный комплекс СР29 из шпината. Нац. Структура Мол. биол. 2011;18:309–315. [PubMed] [Академия Google]
125. Bassi R, Croce R, Cugini D, Sandona D. Мутационный анализ антенного белка высших растений обеспечивает идентификацию хромофоров, связанных во множестве сайтов. проц. Натл. акад. науч. США. 1999;96:10056–10061.
 [PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]126. Рубан А.В., Ли П.Дж., Вентворт М., Янг А.Дж., Хортон П. Определение стехиометрии и силы связывания ксантофиллов со светособирающими комплексами фотосистемы II. Дж. Биол. хим. 1999; 274:10458–10465. [PubMed] [Академия Google]
127. Croce R, Canino g, Ros F, Bassi R. Организация хромофора в антенном белке фотосистемы II высших растений CP26. Биохимия. 2002;41:7334–7343. [PubMed] [Google Scholar]
128. Passarini F, Wientjes E, Hienerwadel R, Croce R. Молекулярная основа сбора света и фотозащиты в CP24: уникальные особенности новейшего антенного комплекса. Дж. Биол. хим. 2009; 284:29536–29546. [Бесплатная статья PMC] [PubMed] [Google Scholar]
129. Caffarri S, Croce R, Breton J, Bassi R. Главный антенный комплекс фотосистемы II имеет сайт связывания ксантофилла, не участвующий в сборе света. Дж. Биол. хим. 2001;276:35924–35933. [PubMed] [Google Scholar]
130. Ремелли Р., Варотто С., Сандона Д., Кроче Р.
 , Басси Р. Связывание хлорофилла с мономерным светособирающим комплексом. Анализ мутаций остатков, связывающих хромофор. Дж. Биол. хим. 1999; 274:33510–33521. [PubMed] [Google Scholar]
, Басси Р. Связывание хлорофилла с мономерным светособирающим комплексом. Анализ мутаций остатков, связывающих хромофор. Дж. Биол. хим. 1999; 274:33510–33521. [PubMed] [Google Scholar]131. Caffarri S, Passarini F, Bassi R, Croce R. Специфический сайт связывания неоксантина в мономерных антенных белках CP26 и CP29 Фотосистемы II. Фебс Летт. 2007; 581:4704–4710. [PubMed] [Академия Google]
132. Caffarri S, Frigerio S, Olivieri E, Righetti PG, Bassi R. Дифференциальное накопление продуктов гена Lhcb в тилакоидных мембранах растений Zea mays, выращенных в условиях контрастного освещения и температуры. Протеомика. 2005; 5: 758–768. [PubMed] [Google Scholar]
133. Dall’Osto L, Holt NE, Kaligotla S, Fuciman M, Cazzaniga S, Carbonera D, Frank HA, Alric J, Bassi R. Зеаксантин защищает фотосинтез растений, модулируя выход триплетов хлорофилла в специальные светособирающие антенные блоки. Дж. Биол. хим. 2012; 287:41820–41834. [Бесплатная статья PMC] [PubMed] [Google Scholar]
134.
 Янс П., Хольцварт А.Р. Роль ксантофиллового цикла и лютеина в фотозащите фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 182–193. [PubMed] [Google Scholar]
Янс П., Хольцварт А.Р. Роль ксантофиллового цикла и лютеина в фотозащите фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 182–193. [PubMed] [Google Scholar]135. Кроче Р., Мюллер М.Г., Басси Р., Хольцварт А.Р. Кинетика передачи энергии от хлорофилла b к хлорофиллу а в антенном комплексе CP29: сравнительное исследование поглощения фемтосекунд между нативными и восстановленными белками. Биофиз. Дж. 2003; 84: 2508–2516. [Бесплатная статья PMC] [PubMed] [Google Scholar]
136. Giuffra E, Cugini D, Croce R, Bassi R. Реконструкция и свойства связывания пигмента рекомбинантного CP29. Евро. Дж. Биохим. 1996; 238:112–120. [PubMed] [Google Scholar]
137. Dall’Osto L, Caffarri S, Bassi R. Механизм нефотохимической диссипации энергии, независимый от PsbS, обнаружен конформационным изменением в белке антенны CP26. Растительная клетка. 2005;17:1217–1232. [Бесплатная статья PMC] [PubMed] [Google Scholar]
138. Рубан А.В., Хортон П. Цикл ксантофилла модулирует кинетику нефотохимического рассеивания энергии в изолированных светособирающих комплексах, интактных хлоропластах и листьях шпината.
 Завод Физиол. 1999;119:531–542. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Завод Физиол. 1999;119:531–542. [Бесплатная статья PMC] [PubMed] [Google Scholar]139. Croce R, Zucchelli G, Garlaschi FM, Jennings RC. Исследование теплового расширения хлорофиллов антенны в ядрах PSI-200, LHCI и PSI. Биохимия. 1998; 37:17355–17360. [PubMed] [Google Scholar]
140. Dall’Osto L, Cazzaniga S, North H, Marion-Poll A, Bassi R. Мутант Arabidopsis aba4-1 обнаруживает специфическую функцию неоксантина в защите от фотоокислительного стресса. Растительная клетка. 2007;19:1048–1064. [Бесплатная статья PMC] [PubMed] [Google Scholar]
141. Зубик М., Лучовский Р., Грудзинский В., Господарек М., Грычинский И., Грычинский З., Добруцкий Ю.В., Грущецкий В.И. Индуцированная светом изомеризация ксантофилла неоксантина, связанного с LHCII: возможные последствия для фотозащиты растений. Биохим. Биофиз. Акта-Биоэнергия. 2013; 1807: 1237–1243. [PubMed] [Google Scholar]
142. Паскаль А.А., Лю З.Ф., Бросс К., ван Оорт Б., ван Амеронген Х., Ван С., Хортон П., Роберт Б.
 , Чанг В.Р., Рубан А. Молекулярные основы фотозащиты и контроля фотосинтетический светособирающий. Природа. 2005; 436: 134–137. [PubMed] [Академия Google]
, Чанг В.Р., Рубан А. Молекулярные основы фотозащиты и контроля фотосинтетический светособирающий. Природа. 2005; 436: 134–137. [PubMed] [Академия Google]143. Роберт Б., Хортон П., Паскаль А.А., Рубан А.В. Взгляд на молекулярную динамику светособирающих белков растений in vivo. Тенденции Растениевод. 2004; 9: 385–390. [PubMed] [Google Scholar]
144. Ruban AV, Berera R, Ilioaia C, van Stokkum IHM, Kennis JTM, Pascal AA, van Amerongen H, Robert B, Horton P, van Grondelle R. Идентификация механизма фотозащиты Рассеивание энергии у высших растений. Природа. 2007; 450: 575–578. [PubMed] [Google Scholar]
145. Ballottari M, Govoni C, Caffarri S, Morosinotto T. Стехиометрия антенных полипептидов LHCI и характеристика щелевых и линкерных пигментов в высших растениях Photosystem I. Eur. Дж. Биохим. 2004;271:4659–4665. [PubMed] [Google Scholar]
146. Bennett J, Steinback KE, Arntzen CJ. Фосфопротеины хлоропластов: регуляция переноса энергии возбуждения путем фосфорилирования полипептидов тилакоидных мембран.
 проц. Натл. акад. науч. США. 1980; 77: 5253–5257. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 1980; 77: 5253–5257. [Бесплатная статья PMC] [PubMed] [Google Scholar]147. Allen JF, Bennett J, Steinback KE, Arntzen CJ. Фосфорилирование белков хлоропластов связывает окислительно-восстановительное состояние пластохинона с распределением энергии возбуждения между фотосистемами. Природа. 1981;291:25–29. [Google Scholar]
148. Rintamaki E, Martinsuo P, Pursiheimo S, Aro EM. Совместная регуляция фосфорилирования светособирающего комплекса II через систему пластохинола и ферредоксина-тиоредоксин в хлоропластах. проц. Натл. акад. науч. США. 2000;97:11644–11649. [Бесплатная статья PMC] [PubMed] [Google Scholar]
149. Мактавиш Х. Демонстрация переходов состояний фотосинтеза в природе Затенение фотосинтезирующей тканью вызывает переход в состояние-1. Фотосинтез. Рез. 1988;17:247–254. [PubMed] [Google Scholar]
150. Wientjes E, van Amerongen H, Croce R. LHCII представляет собой антенну обеих фотосистем после длительной акклиматизации.
 Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 420–426. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 420–426. [PubMed] [Google Scholar]151. Yamada Y, Tang XS, Itoh S, Satoh K. Очистка и свойства комплекса реакционных центров фотосистемы II, выделяющей кислород, из шпината. Биохим. Биофиз. Акта. 1987; 891: 129–137. [Google Scholar]
152. Sugiura M, Inoue Y. Высокоочищенный термостабильный комплекс ядра фотосистемы II, выделяющий кислород, из термофильной цианобактерии Synechococcus elongatus, имеющей His-меченный CP43. Физиология клеток растений. 1999;40:1219–1231. [PubMed] [Google Scholar]
153. Smith PJ, Peterson S, Masters VM, Wydrzynski T, Styring S, Krausz E, Pace RJ. Магнитооптические измерения пигментов в полностью активных комплексах ядра фотосистемы II растений. Биохимия. 2002; 41:1981–1989. [PubMed] [Google Scholar]
154. Kouril R, Wientjes E, Bultema JB, Croce R, Boekema EJ. Яркое освещение и слабое освещение Влияние акклиматизации к свету на состав и организацию фотосистемы II у Arabidopsis thaliana.
 Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 411–419.. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 411–419.. [PubMed] [Google Scholar]155. Беддард Г.С., Портер Г. Гашение концентрации в хлорофилле. Природа. 1976; 260: 366–367. [Google Scholar]
156. Аллен Дж. Ф. Фосфорилирование белков в регуляции фотосинтеза. Биохим. Биофиз. Акта. 1992; 1098: 275–335. [PubMed] [Google Scholar]
157. Wollman FA. Переходы состояний раскрывают динамику и гибкость фотосинтетического аппарата. Эмбо Дж. 2001; 20: 3623–3630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
158. Лемей С., Роше Ж.Д. Переходы состояний на перекрестке сигнальных путей тилакоидов. Фотосинтез. Рез. 2010; 106:33–46. [PubMed] [Google Scholar]
159. Минагава Дж. Переходы состояний Молекулярное ремоделирование фотосинтетических суперкомплексов, которое контролирует поток энергии в хлоропластах. Биохим. Биофиз. Акта-Биоэнергия. 2011; 1807: 897–905. [PubMed] [Google Scholar]
160. Croce R, Zucchelli G, Garlaschi FM, Bassi R, Jennings RC. Уравновешивание возбужденного состояния в фотосистеме I — светособирающем I комплексе П700 практически изоэнергетично с его антенной.
 Биохимия. 1996;35:8572–8579. [PubMed] [Google Scholar]
Биохимия. 1996;35:8572–8579. [PubMed] [Google Scholar]161. Palsson LO, Flemming C, Gobets B, van Grondelle R, Dekker JP, Schlodder E. Перенос энергии и разделение заряда в окислении фотосистемы I P700 при селективном возбуждении хлорофиллов длинноволновой антенны. Синехококк удлиненный. Биофиз. Дж. 1998; 74: 2611–2622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
162. Ихалайнен Дж. А., Дженсен П. Е., Халдруп А., ван Стоккум И. Х. М., ван Грондель Р., Шеллер Х. В., Деккер Дж. П. Организация пигмента и динамика переноса энергии в выделенных комплексах фотосистемы I (PSI) из Arabidopsis thaliana, лишенных субъединиц PSI-G PSI-K PSI-L или PSI-N. Биофиз. Дж. 2002; 83:2190–2201. [Бесплатная статья PMC] [PubMed] [Google Scholar]
163. Passarini F, Wientjes E, van Amerongen H, Croce R. Фотосистема I светособирающий комплекс Lhca4 принимает несколько конформаций. Красные формы и тушение возбужденного состояния являются взаимоисключающими. Биохим. Биофиз. Акта-Биоэнергия.
 2010; 1797: 501–508. [PubMed] [Google Scholar]
2010; 1797: 501–508. [PubMed] [Google Scholar]164. Staehelin LA, Arntzen CJ, Anderson JM, Barrett J, Staehelin LA, Arntzen CJ. В Энциклопедии физиологии растений Фотосинтез III Новая серия 19. Springer Berlin. 1986: 269–285. [Google Scholar]
165. Garlaschi FM, Zucchelli G, Jennings RC. Изучение изменений светопоглощения и фотохимической активности суспензий хлоропластов и листьев в результате светорассеяния и светофильтрации через слои хлоропластов и растительности. Фотосинтез. Рез. 1989; 20: 207–220. [PubMed] [Google Scholar]
166. Rivadossi A, Zucchelli G, Garlaschi FM, Jennings RC. Значение красных форм хлорофилла PSI в сборе света листьями. Фотосинтез. Рез. 1999;60:209–215. [Google Scholar]
167. Леонг Т.И., Андерсон Дж.М. Адаптация тилакоидных мембран хлоропластов гороха к интенсивности света.1. Изучение распределения хлорофилл-белковых комплексов. Фотосинтез. Рез. 1984; 5: 105–115. [PubMed] [Google Scholar]
168. Gobets B, Van Amerongen H, Monshouwer R, Kruip J, Rogner M, van Grondelle R, Dekker JP.
 Поляризованная флуоресцентная спектроскопия с выбранным сайтом изолированных частиц фотосистемы I. Биохим. Биофиз. Акта. 1994;1188:75–85. [Академия Google]
Поляризованная флуоресцентная спектроскопия с выбранным сайтом изолированных частиц фотосистемы I. Биохим. Биофиз. Акта. 1994;1188:75–85. [Академия Google]169. Ихалайнен Дж.А., Гобетс Б., Шнее К., Браззоли М., Кроче Р., Басси Р., ван Гронделл Р., Корппи-Томмола Дж.Е.И., Деккер Дж.П. Доказательства наличия двух спектроскопически различных димеров светособирающего комплекса I из зеленых растений. Биохимия. 2000;39:8625–8631. [PubMed] [Google Scholar]
170. Engelmann E, Tagliabue T, Karapetyan NV, Garlaschi FM, Zucchelli G, Jennings RC. Спектроскопия КД свидетельствует об экситонных взаимодействиях с участием смещенных в красную область форм хлорофилла в фотосистеме I. Febs Lett. 2001;499:112–115. [PubMed] [Google Scholar]
171. Морозинотто Т., Кастеллетти С., Бретон Дж., Басси Р., Кроче Р. Анализ мутаций антенного комплекса Lhca1. Формы поглощения низкой энергии возникают в результате взаимодействий пигмент-пигмент. Дж. Биол. хим. 2002; 277:36253–36261. [PubMed] [Google Scholar]
172.
 Mozzo M, Morosinotto T, Bassi R, Croce R. Изучение структуры Lhca3 с помощью анализа мутаций. Биохим. Биофиз. Акта-Биоэнергия. 2006; 1757:1607–1613. [PubMed] [Google Scholar]
Mozzo M, Morosinotto T, Bassi R, Croce R. Изучение структуры Lhca3 с помощью анализа мутаций. Биохим. Биофиз. Акта-Биоэнергия. 2006; 1757:1607–1613. [PubMed] [Google Scholar]173. Zucchelli G, Santabarbara S, Jennings RC. Спектр поглощения Q(y) светособирающего комплекса II, определенный структурным анализом деформаций макроцикла хлорофилла. Биохимия. 2012;51:2717–2736. [PubMed] [Академия Google]
174. Jennings RC, Garlaschi FM, Engelmann E, Zucchelli G. Форма эмиссионной полосы при комнатной температуре спектральной формы хлорофилла с самой низкой энергией LHCI. Фебс Летт. 2003; 547: 107–110. [PubMed] [Google Scholar]
175. Croce R, Chojnicka A, Morosinotto T, Ihalainen JA, van Mourik F, Dekker JP, Bassi R, van Grondelle R. Низкоэнергетические формы светособирающих комплексов фотосистемы I Спектроскопический свойства и характеристики взаимодействия пигмент-пигмент. Биофиз. Дж. 2007; 93: 2418–2428. [Бесплатная статья PMC] [PubMed] [Google Scholar]
176.
 Дженнингс Р.С., Зуккелли Г., Энгельманн Э., Гарласки Ф.М. Состояния длинноволнового хлорофилла растений LHCI при комнатной температуре: сравнение с PSI-LHCI. Биофиз. Дж. 2004; 87: 488–497. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дженнингс Р.С., Зуккелли Г., Энгельманн Э., Гарласки Ф.М. Состояния длинноволнового хлорофилла растений LHCI при комнатной температуре: сравнение с PSI-LHCI. Биофиз. Дж. 2004; 87: 488–497. [Бесплатная статья PMC] [PubMed] [Google Scholar]177. French CS. Распределение и действие в фотосинтезе некоторых форм хлорофилла. проц. Натл. акад. науч. США. 1971; 68: 2893–2897. [PMC free article] [PubMed] [Google Scholar]
178. Zucchelli G, Dainese P, Jennings RC, Breton J, Garlaschi FM, Bassi R. Гауссово разложение спектров поглощения и линейного дихроизма внешних антенных комплексов фотосистемы II. Биохимия. 1994;33:8982–8990. [PubMed] [Google Scholar]
179. Zucchelli G, Garlaschi FM, Jennings RC. Анализ термического уширения спектра поглощения Light Harvesting Complex II. Биохимия. 1996; 35:16247–16254. [PubMed] [Google Scholar]
180. Zucchelli G, Brogioli D, Casazza AP, Garlaschi FM, Jennings RC. Деформация кольца хлорофилла модулирует электронную энергию Qy в хлорофилл-белковых комплексах и генерирует спектральные формы.
 Биофиз. Дж. 2007; 93:2240–2254. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз. Дж. 2007; 93:2240–2254. [Бесплатная статья PMC] [PubMed] [Google Scholar]181. Ван Амеронген Х., Валкунас Л., ван Гронделл Р. Фотосинтетические экситоны. World Scientific Publishing Co.Pte.Ldt. Сингапур. 2000 [Google Scholar]
182. Ренгер Т., Мэй В. Моделирование спектров частотной области Структурно-функциональные отношения в фотосинтетических пигмент-белковых комплексах. физ. Преподобный Летт. 2000; 84: 5228–5231. [PubMed] [Google Scholar]
183. Zucchelli G, Morosinotto T, Garlaschi FM, Bassi R, Jennings RC. Низкоэнергетические излучающие состояния субъединицы Lhca4 фотосистемы высших растений I. Febs Lett. 2005;579: 2071–2076. [PubMed] [Google Scholar]
184. Форстер Т. Межмолекулярный перенос энергии и флуоресценция. Анна. физ. Лейпциг. 1948; 2: 55–75. [Google Scholar]
185. Кенкре В.М., Нокс Р.С. Теория скоростей передачи быстрого и медленного возбуждения. физ. Преподобный Летт. 1974; 33: 803–806. [Google Scholar]
186. Шипман Л.
 Л., Хаусман Д.Л. Скорость переноса Форстера для хлорофилла а. Фотохим. Фотобиол. 1979; 29: 1163–1167. [Google Scholar]
Л., Хаусман Д.Л. Скорость переноса Форстера для хлорофилла а. Фотохим. Фотобиол. 1979; 29: 1163–1167. [Google Scholar]187. van Grondelle R, Dekker JP, Gillbro T, Sundstrom V. Перенос энергии и улавливание в фотосинтезе. Биохим. Биофиз. Акта. 1994;1187:1–65. [Google Scholar]
188. Jennings RC, Bassi R, Zucchelli G, Dunitz JD, Hafner K, Ito S, Lehn JM, Raymond KN, Rees CW, Thiem J, Vogtle F. In Topics in Current Chemistry Vol. 77 Электронный перенос II. Спрингер Берлин. 1996: 147–181. [Google Scholar]
189. Montroll EW. Случайные блуждания по решеткам III Расчет времен первого прохождения в приложении к захвату экситонов на фотосинтезирующих элементах. Дж. Матем. физ. 1969; 10: 753–765. [Google Scholar]
190. Перлштейн Р.М. Миграция и захват экситонов при фотосинтезе. Фотохим. Фотобиол. 1982;35:835–844. [Google Scholar]
191. Otten HA. Математический анализ связи между выходом флуоресценции (бактерио) хлорофилла и концентрацией ловушек реакционных центров при фотосинтезе.
 Дж. Теор. биол. 1974; 46: 75–100. [PubMed] [Google Scholar]
Дж. Теор. биол. 1974; 46: 75–100. [PubMed] [Google Scholar]192. Валкунас Л., Кудзмаускас С., Люолия В. Некогерентная миграция возбуждения в нечистых молекулярных структурах. сов. физ. Собирать. (лейт. физ. каток). 1986; 26:1–11. [Google Scholar]
193. Оуэнс Т.Г., Уэбб С.П., Альберте Р.С., Мец Л., Флеминг Г.Р. Структура антенны и динамика возбуждения в фотосистеме И.И. Исследования препаратов фотосистемы I, выделенных детергентом, с использованием флуоресцентного анализа с временным разрешением. Биофиз. Дж. 1988;53:733–745. [Бесплатная статья PMC] [PubMed] [Google Scholar]
194. Beddard GS. Экситонное взаимодействие в реакционном центре фотосистемы I. Дж. Физ. хим. Б. 1998; 102:10966–10973. [Google Scholar]
195. Кроче Р., Дорра Д., Хольцварт А.Р., Дженнингс Р.К. Затухание флуоресценции и спектральная эволюция в интактной фотосистеме I высших растений. Биохимия. 2000; 39: 6341–6348. [PubMed] [Google Scholar]
196. Engelmann ECM, Zucchelli G, Garlaschi FM, Casazza AP, Jennings RC.
 Влияние наружных антенных комплексов на скорость фотохимического захвата тилакоидов ячменя Photosystem II. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 276–286. [PubMed] [Академия Google]
Влияние наружных антенных комплексов на скорость фотохимического захвата тилакоидов ячменя Photosystem II. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 276–286. [PubMed] [Академия Google]197. Engelmann E, Zucchelli G, Casazza AP, Brogioli D, Garlaschi FM, Jennings RC. Влияние фотосистемы I-светособирающего комплекса I антенных доменов на затухание флуоресценции. Биохимия. 2006; 45: 6947–6955. [PubMed] [Google Scholar]
198. Jennings RC, Elli G, Garlaschi FM, Santabarbara S, Zucchelli G. Селективное тушение флуоресценции основных хлорофилл-белковых комплексов с помощью фотохимии указывает на то, что фотосистема II частично ограничена диффузией. Фотосинтез. Рез. 2000;66:225–233. [PubMed] [Академия Google]
199. Дженнингс Р.С., Зуккелли Г., Кроче Р., Гарласки FM. Скорость фотохимического захвата красных спектральных состояний в PSI-LHCI определяется термической активацией передачи энергии объемным хлорофиллам. Биохим. Биофиз. Акта-Биоэнергия. 2003;1557:91–98. [PubMed] [Google Scholar]
200.
 Holzwarth AR, Muller MG, Niklas J, Lubitz W. Флуоресценция рекомбинации заряда в реакционных центрах фотосистемы I Chlamydomonas reinhardtii. Дж. Физ. хим. Б. 2005; 109:5903–5911. [PubMed] [Академия Google]
Holzwarth AR, Muller MG, Niklas J, Lubitz W. Флуоресценция рекомбинации заряда в реакционных центрах фотосистемы I Chlamydomonas reinhardtii. Дж. Физ. хим. Б. 2005; 109:5903–5911. [PubMed] [Академия Google]201. Хольцварт А.Р., Мюллер М.Г., Реус М., Новачик М., Сандер Дж., Рогнер М. Кинетика и механизм переноса электронов в интактной фотосистеме II и в изолированном реакционном центре Феофитин является первичным акцептором электронов. проц. Натл. акад. науч. США. 2006; 103: 6895–6900. [Бесплатная статья PMC] [PubMed] [Google Scholar]
202. Мелкозернов А.Н., Лин С., Бланкеншип Р.Е. Фемтосекундная транзиентная спектроскопия и экситонные взаимодействия в фотосистеме I. J. Phys. хим. Б. 2000; 104:1651–1656. [PubMed] [Академия Google]
203. Мелкозернов А.Н. Перенос энергии возбуждения в фотосистеме I от оксигенных организмов. Фотосинтез. Рез. 2001; 70: 129–153. [PubMed] [Google Scholar]
204. Славов С., Баллоттари М., Моросинотто Т., Басси Р., Хольцварт А.Р.
 Кинетика разделения зарядов, ограниченная ловушками, в комплексах фотосистемы I высших растений. Биофиз. Дж. 2008; 94:3601–3612. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кинетика разделения зарядов, ограниченная ловушками, в комплексах фотосистемы I высших растений. Биофиз. Дж. 2008; 94:3601–3612. [Бесплатная статья PMC] [PubMed] [Google Scholar]205. Ihalainen JA, Croce R, Morosinotto T, van Stokkum IHM, Bassi R, Dekker JPX, van Grondelle R. Пути затухания возбуждения белков Lhca. Флуоресценция с временным разрешением. исследование. Дж. Физ. хим. Б. 2005; 109: 21150–21158. [PubMed] [Google Scholar]
206. Ихалайнен Дж. А., Климмек Ф., Ганетег У., ван Стоккум И.Х.М., ван Грондель Р., Янссон С., Деккер Дж.П. Захват энергии возбуждения в комплексах фотосистемы I, обедненных Lhca1 и Lhca4. Фебс Летт. 2005; 579: 4787–4791. [PubMed] [Google Scholar]
207. Wientjes E, van Stokkum IH, van Amerongen H, Croce R. Роль отдельных Lhcas в улавливании энергии возбуждения фотосистемы I. Биофиз. Дж. 2011; 101:745–754. [Бесплатная статья PMC] [PubMed] [Google Scholar]
208. Тумино Г., Казацца А.П., Энгельманн Э., Гарласки Ф.М., Зуккелли Г.
 , Дженнингс Р.К. Спектр времени жизни флуоресценции фотохимического комплекса ядра фотосистемы II растений не вызывает специфического тушения реакционных центров. Биохимия. 2008;47:10449–10457. [PubMed] [Google Scholar]
, Дженнингс Р.К. Спектр времени жизни флуоресценции фотохимического комплекса ядра фотосистемы II растений не вызывает специфического тушения реакционных центров. Биохимия. 2008;47:10449–10457. [PubMed] [Google Scholar]209. Щепаняк М., Сандер Дж., Новачик М., Мюллер М.Г., Рогнер М., Хольцварт А.Р. Разделение заряда, стабилизация и релаксация белков в остовных частицах фотосистемы II с закрытым реакционным центром. Биофиз. Дж. 2009 г.;96:621–631. [Бесплатная статья PMC] [PubMed] [Google Scholar]
210. Broess K, Trinkunas G, van Hoek A, Croce R, van Amerongen H. Определение времени миграции возбуждения в фотосистеме II Последствия для организации мембраны и разделения зарядов параметры. Биохим. Биофиз. Акта-Биоэнергия. 2008; 1777: 404–409. [PubMed] [Google Scholar]
211. Милославина Ю., Щепаняк М., Мюллер М.Г., Сандер Дж., Новачик М., Рогнер М., Хольцварт А.Р. Кинетика разделения зарядов в неповрежденных частицах ядра фотосистемы II ограничена ловушкой. Исследование пикосекундной флуоресценции.
 Биохимия. 2006; 45: 2436–2442. [PubMed] [Академия Google]
Биохимия. 2006; 45: 2436–2442. [PubMed] [Академия Google]212. Рулофс Т.А., Хольцварт А.Р. В поисках предполагаемого долгоживущего релаксированного состояния пары радикалов в закрытой фотосистеме II. Кинетическое моделирование данных пикосекундной флуоресценции. Биофиз. Дж. 1990; 57:1141–1153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
213. Roelofs TA, Lee CH, Holzwarth AR. Глобальный целевой анализ кинетики пикосекундной флуоресценции хлорофилла из хлоропластов гороха. Новый подход к характеристике первичных процессов в альфа- и бета-единицах фотосистемы II. Биофиз. Дж. 1992;61:1147–1163. [Бесплатная статья PMC] [PubMed] [Google Scholar]
214. Schatz GH, Brock H, Holzwarth AR. Пикосекундная кинетика изменения флуоресценции и оптической плотности частиц фотосистемы II, возбужденных при низкой плотности фотонов. проц. Натл. акад. науч. США. 1987; 84: 8414–8418. [Бесплатная статья PMC] [PubMed] [Google Scholar]
215. Schatz GH, Brock H, Holzwarth AR.
 Кинетическая и энергетическая модель первичных процессов в фотосистеме II. Биофиз. Дж. 1988; 54: 397–405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кинетическая и энергетическая модель первичных процессов в фотосистеме II. Биофиз. Дж. 1988; 54: 397–405. [Бесплатная статья PMC] [PubMed] [Google Scholar]216. ван Оорт Б., Альбертс М., де Бьянки С., Далл’Осто Л., Басси Р., Тринкунас Г., Кроче Р., ван Амеронген Х. Влияние истощения антенн в фотосистеме II на перенос энергии возбуждения у Arabidopsis thaliana. Биофиз. Дж. 2010; 98: 922–931. [Бесплатная статья PMC] [PubMed] [Google Scholar]
217. Pawlowicz N, Groot M, van Stokkum I, Breton J, van Grondelle R. Разделение заряда и перенос энергии в основном комплексе Photosystem II, изученном с помощью фемтосекундного среднего инфракрасного диапазона. спектроскопия. Фотосинтез. Рез. 2007;91: 149–149. [Бесплатная статья PMC] [PubMed] [Google Scholar]
218. Groot ML, Pawlowicz NP, van Wilderen LJGW, Breton J, van Stokkum IHM, van Grondelle R. Исходный донор и акцептор электронов в изолированных реакционных центрах Photosystem II, идентифицированных с фемтосекундная спектроскопия среднего ИК-диапазона.
 проц. Натл. акад. науч. США. 2005; 102:13087–13092. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2005; 102:13087–13092. [Бесплатная статья PMC] [PubMed] [Google Scholar]219. ван дер Вейдж де Вит К.Д., Деккер Дж.П., ван Грондель Р., ван Стоккум И.Х. Разделение заряда практически необратимо в комплексах кора фотосистемы II с окисленным первичным акцептором хинона. Дж. Физ. хим. А. 2011; 115:3947–3956. [PubMed] [Google Scholar]
220. Peterman EJG, Van Amerongen H, van Grondelle R, Dekker JP. Природа возбужденного состояния реакционного центра фотосистемы II зеленых растений Исследование методом флуоресцентной спектроскопии высокого разрешения. проц. Натл. акад. науч. США. 1998;95:6128–6133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
221. Бартер Л.М., Бьянкиетти М., Джинс С., Шилстра М.Дж., Ханкамер Б., Дайнер Б.А., Барбер Дж., Дюррант Дж.Р., Клуг Д.Р. Связь между передачей энергии возбуждения, захватом и размером антенны в фотосистеме II. Биохимия. 2001;40:4026–4034. [PubMed] [Академия Google]
222. Бартер LMC, Durrant JR, Klug DR.
 Количественные структурно-функциональные отношения для реакционного центра Photosystem II: надмолекулярное поведение в естественном фотосинтезе. проц. Натл. акад. науч. США. 2003; 100:946–951. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Количественные структурно-функциональные отношения для реакционного центра Photosystem II: надмолекулярное поведение в естественном фотосинтезе. проц. Натл. акад. науч. США. 2003; 100:946–951. [Бесплатная статья PMC] [PubMed] [Google Scholar]223. Gobets B, van Stokkum IHM, van Mourik F, Dekker JP, van Grondelle R. Зависимость кинетики флуоресценции от длины волны возбуждения в частицах фотосистемы I из Synechocystis PCC 6803 и Синехококк удлиненный. Биофиз. Дж. 2003; 85: 3883–389.8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
224. Van Amerongen H, van Grondelle R. Понимание функции передачи энергии LHCII, основного светособирающего комплекса зеленых растений. Дж. Физ. хим. Б. 2001; 105: 604–617. [Google Scholar]
225. Парсон В.В., Грин Б.Р., Ван Амеронген Х., Деккер Дж.П. Светособирающая антенна в фотосинтезе. Kluwer Academic Publishers Дортрехт. 2003: 219–251. [Google Scholar]
226. Gobets B, Valkunas L, van Grondelle R. Преодоление разрыва между структурными и решеточными моделями: параметризация переноса энергии и захвата в Photosystem I.
 Biophys. Дж. 2003; 85: 3872–3882. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Biophys. Дж. 2003; 85: 3872–3882. [Бесплатная статья PMC] [PubMed] [Google Scholar]227. Ихалайнен Дж.А., ван Стоккум ИХМ, Гибасевич К., Джермано М., ван Грондель Р., Деккер Дж.П. Кинетика захвата возбуждения в интактной фотосистеме I Chlamydomonas reinhardtii и Arabidopsis thaliana. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 267–275. [PubMed] [Google Scholar]
228. Wientjes E, Roest G, Croce R. От красного к синему к дальнему красному в Lhca4: как белок модулирует спектральные свойства пигментов? Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 711–717. [PubMed] [Академия Google]
229. Gobets B, van Stokkum IH, Rogner M, Kruip J, Schlodder E, Karapetyan NV, Dekker JP, van Grondelle R. Измерения эмиссии флуоресценции с временным разрешением частиц фотосистемы I различных цианобактерий в единой компартментальной модели. Биофиз. Дж. 2001; 81: 407–424. [Бесплатная статья PMC] [PubMed] [Google Scholar]
230. Cardona T, Sedoud A, Cox N, Rutherford AW. Разделение зарядов в фотосистеме II: сравнительный и эволюционный обзор.
 Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 26–43. [PubMed] [Академия Google]
Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 26–43. [PubMed] [Академия Google]231. Раппапорт Ф., Куни А., Сюн Л., Сайр Р., Лавернь Р.М. Рекомбинация заряда и термолюминесценция в фотосистеме II. Биофиз. Дж. 2005; 88: 1948–1958. [Бесплатная статья PMC] [PubMed] [Google Scholar]
232. Шринивасан Н., Голбек Дж. Х. Белково-кофакторные взаимодействия в биоэнергетических комплексах, роль филлохинонов А1А и А1В в фотосистеме I. Биохим. Биофиз. Акта-Биоэнергия. 2009; 1787: 1057–1088. [PubMed] [Google Scholar]
233. Шринивасан Н., Сантабарбара С., Раппапорт Ф., Карбонера Д., Реддинг К., ван дер Эст А., Голбек Дж. Х. Изменение Н-связи на филлохинон А(1А) в Фотосистеме I: влияние на кинетику и энергетику переноса электрона. Дж. Физ. Хим Б. 2011; 115: 1751–1759.. [PubMed] [Google Scholar]
234. Охаши С., Иэмура Т., Окада Н., Ито С., Фурукава Х., Окуда М., Ониши-Камеяма М., Огава Т., Мияшита Х., Ватанабэ Т., Ито С., О-ока Х. , Иноуэ К., Кобаяши М. Обзор хлорофиллов и хинонов в реакционных центрах фотосистемы I типа.
 Фотосинтез. Рез. 2010; 104:305–319. [PubMed] [Google Scholar]
Фотосинтез. Рез. 2010; 104:305–319. [PubMed] [Google Scholar]235. Лолл Б., Керн Дж., Сенгер В., Зуни А., Бесиадка Дж. На пути к полному расположению кофакторов в структуре фотосистемы с разрешением 3 ангстрем II. . Природа. 2005; 438:1040–1044. [PubMed] [Академия Google]
236. Saito K, Shen JR, Ishikita H. Влияние аксиального лиганда на катионные свойства пары хлорофиллов в фотосистеме II из Thermosynechococcus vulcanus. Биофиз. Дж. 2012; 102:2634–2640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
237. Saito K, Umena Y, Kawakami K, Shen JR, Kamiya N, Ishikita H. Деформация хлориновых колец в кристаллической структуре Photosystem II. Биохимия. 2012;51:4290–4299. [PubMed] [Google Scholar]
238. Кок Б. Об обратимом изменении поглощения при 705 млн лет у фотосинтезирующих организмов. Короткое сообщение. 1956;22:399–401. [PubMed] [Google Scholar]
239. Hiyama T, Ke B. Дальнейшее исследование P430: возможный первичный акцептор электронов фотосистемы I.
 Arch. Биохим. Биофиз. 1971; 147: 99–108. [PubMed] [Google Scholar]
Arch. Биохим. Биофиз. 1971; 147: 99–108. [PubMed] [Google Scholar]240. Doring G, Stiel HH, Witt HT. Вторая реакция хлорофилла в электронной цепи фотосинтеза — Регистрация методом повторяющегося возбуждения. З. Натурфорш. 1967; 22Б: 639–644. [PubMed] [Google Scholar]
241. Doring G, Bailey JL, Kreutz W, Witt HT. Активный хлорофилл-а-II в световой реакции II фотосинтеза. Натурвиссеншафтен. 1968;55:220. [PubMed] [Google Scholar]
242. Климов В.В., Клеваник А.В., Шувалов В.А., Красновский А.А. Восстановление феофитина в первичной световой реакции фотосистемы II. Фебс Летт. 1977; 82: 183–186. [PubMed] [Google Scholar]
243. Durrant JR, Giorgi LB, Barber J, Klug DR, Porter G. Характеристика триплетных состояний в изолированных реакционных центрах фотосистемы II Тушение кислорода как механизм фотоповреждения. Биохим. Биофиз. Акта. 1990; 1017: 167–175. [Google Scholar]
244. Witt H, Bordignon E, Carbonera D, Dekker JP, Karapetyan N, Teutloff C, Webber A, Lubitz W, Schlodder E.
 Видоспецифичные различия спектроскопических свойств P700 анализ влияния неконсервативные аминокислотные остатки путем сайт-направленного мутагенеза фотосистемы I из Chlamydomonas reinhardtii. Дж. Биол. хим. 2003; 278:46760–46771. [PubMed] [Академия Google]
Видоспецифичные различия спектроскопических свойств P700 анализ влияния неконсервативные аминокислотные остатки путем сайт-направленного мутагенеза фотосистемы I из Chlamydomonas reinhardtii. Дж. Биол. хим. 2003; 278:46760–46771. [PubMed] [Академия Google]245. Raszewski G, Diner BA, Schlodder E, Renger T. Спектроскопические свойства пигментов реакционных центров в основных комплексах фотосистемы II: пересмотр мультимерной модели. Биофиз. Дж. 2008; 95: 105–119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
246. Golbeck JH, Renger T, Schlodder E. In: Photosystem I: The Light-Driven Plastocyanin: Ferredoxin Oxidoreductase. Kluwer Academic Publishers Дордрехт. 2006; 24: 595–610. [Google Scholar]
247. Carbonera D, Collareta P, Giacometti G. Триплетное состояние P700 в интактной среде, обнаруженное с помощью ODMR, хорошо разрешенный триплет минус синглетный спектр. Биохим. Биофиз. Акта-Биоэнергия. 1997;1322:115–128. [Google Scholar]
248. Kwa SLS, Tilly NT, Eijckelhoff C, van Grondelle R, Dekker JP.
 Спектроскопия выбора сайта комплекса реакционных центров фотосистемы II. Идентификация флуоресцирующих частиц на 4. . Дж. Физ. хим. 1994; 98: 7712–7716. [Google Scholar]
Спектроскопия выбора сайта комплекса реакционных центров фотосистемы II. Идентификация флуоресцирующих частиц на 4. . Дж. Физ. хим. 1994; 98: 7712–7716. [Google Scholar]249. Янковяк Р., Танг Д., Смолл Г. Дж., Зайберт М. Временное и постоянное горение дырок реакционного центра Фотосистемы II. Дж. Физ. хим. 1989; 93: 1649–1654. [Google Scholar]
250. Карбонера Д., Джакометти Г., Агостини Г. Хорошо разрешенный триплет ODMR минус синглетный спектр P680 из частиц PSII. Фебс Летт. 1994;343:200–204. [PubMed] [Google Scholar]
251. Brettel K. Перенос электрона и расположение окислительно-восстановительных кофакторов в фотосистеме I. Biochim. Биофиз. Акта-Биоэнергия. 1997;1318:322–373. [Google Scholar]
252. Webber AN, Lubitz W. P700 первичный донор электронов фотосистемы I. Biochim. Биофиз. Акта-Биоэнергия. 2001; 1507: 61–79. [PubMed] [Google Scholar]
253. Rappaport F, Guergova-Kuras M, Nixon PJ, Diner BA, Lavergne J. Кинетика и пути рекомбинации зарядов в фотосистеме II.
 Биохимия. 2002;41:8518–8527. [PubMed] [Академия Google]
Биохимия. 2002;41:8518–8527. [PubMed] [Академия Google]254. Витт ХТ. Преобразование энергии в функциональной мембране фотосинтеза. Анализ методами светового и электрического импульсов. Центральная роль электрического поля. Биохим. Биофиз. Акта. 1979; 505: 355–427. [PubMed] [Google Scholar]
255. Haenel MW, Lintner B, Benn R, Rufinska A, Schroth G, Kruger C, Hirsch S, Irngartinger H, Schweitzer D. Transanulare Wechselwirkung bei [m n] 29 Modelle fur Amin- Aromaten -Exiplexe Synthesen Stukturen und spektroskopische Eigenschaften изомер [2]нафталино[2](2,6)-пиридинофан и [2]нафталино[2](2,6)пиридинофан-1,11-диен. хим. Бер. 1985;118:4884–4906. [Google Scholar]
256. Хоуп А.Б. Перенос электронов между цитохромом f, пластоцианином и фотосистемой I: кинетика и механизмы. Биохим. Биофиз. Акта-Биоэнергия. 2000;1456:5–26. [PubMed] [Google Scholar]
257. Ван Бест Дж. А., Матис П. Кинетика восстановления окисленного первичного донора электронов фотосистемы II в хлоропластах шпината и в клетках хлореллы в микросекундном и наносекундном диапазонах времени после импульсного возбуждения.
 Биохим. Биофиз. Акта. 1978;503:178–188. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта. 1978;503:178–188. [PubMed] [Google Scholar]258. Nuijs AM, van Gorkom HJ, Plijter JJ, Duysens LNM. Разделение первичного заряда и возбуждение хлорофилла а в частицах фотосистемы II из шпината по данным пикосекундной абсорбционно-разностной спектроскопии. Биохим. Биофиз. Акта. 1986; 848: 167–175. [Google Scholar]
259. Brettel K, Schlodder E, Witt HT. Наносекундная кинетика восстановления фотоокисленного хлорофилла aII (P-680) в одиночных вспышках в качестве зонда для электронного пути, высвобождения H+- и накопления заряда в комплексе, выделяющем O-2. Биохим. Биофиз. Акта. 1984;766:403–415. [Google Scholar]
260. ван Горком Х.Дж. Перенос электрона в фотосистеме II. Фотосинтез. Рез. 1985; 6: 97–112. [PubMed] [Google Scholar]
261. Галлий П.М., Марлер Х.Дж., Сантабарбара С., Галуппини Л. В Справочнике по цианобактериям: биохимия, биотехнология и применение. Издательство Nova Science, Нью-Йорк. 2009: 1–50. [Google Scholar]
262.
 Nuijs AMV, Shuvalov HJ, van Gorkom JJ, Plijter LNM. Пикосекундная разностная спектроскопия поглощения по Дюйсенсу первичных реакций и возбужденных состояний антенны в частицах Фотосистемы I. Биохим. Биофиз. Акта. 1987;850:310–318. [Google Scholar]
Nuijs AMV, Shuvalov HJ, van Gorkom JJ, Plijter LNM. Пикосекундная разностная спектроскопия поглощения по Дюйсенсу первичных реакций и возбужденных состояний антенны в частицах Фотосистемы I. Биохим. Биофиз. Акта. 1987;850:310–318. [Google Scholar]263. Шувалов В.А., Клеваник А.В., Шарков А.В., Крюков П.Г., Ке Б. Пикосекундная спектроскопия реакционных центров фотосистемы I. Фебс Летт. 1979; 107: 313–316. [PubMed] [Google Scholar]
264. Бросс К., Тринкунас Г., ван дер Вейдж-де Вит К.Д., Деккер Дж.П., ван Хук А., ван Амеронген Х. Пересмотр переноса энергии возбуждения и разделения заряда в мембранах фотосистемы II. Биофиз. Дж. 2006; 91:3776–3786. [PMC free article] [PubMed] [Google Scholar]
265. Новодережкин В.И., Андрижиевская Е.Г., Деккер Дж.П., ван Гронделл Р. Пути и временные рамки разделения первичных зарядов в реакционном центре фотосистемы II, выявленные с помощью одновременного совпадения времени -разрешенная флуоресценция и переходное поглощение. Биофиз.
 Дж. 2005; 89: 1464–1481. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. 2005; 89: 1464–1481. [Бесплатная статья PMC] [PubMed] [Google Scholar]266. Джонс Л.В., Кок Б. Фотоингибирование реакций хлоропластов.I. Кинетика и спектры действия. Завод Физиол. 1966; 41: 1037–1043. [Бесплатная статья PMC] [PubMed] [Google Scholar]
267. Джонс Л.В., Кок Б. Фотоингибирование реакций хлоропластов. II. Несколько эффектов. Завод Физиол. 1966; 41: 1044–1049. [Бесплатная статья PMC] [PubMed] [Google Scholar]
268. Sinclair J, Park YI, Chow WS, Anderson JM. Теория мишеней и фотоинактивация Фотосистемы II. Фотосинтез. Рез. 1996;50:33–40. [PubMed] [Google Scholar]
269. Santabarbara S, Garlaschi FM, Zucchelli G, Jennings RC. Влияние заселенности возбужденных состояний фотосистемы II на фотоингибирование изменений параметров флуоресценции хлорофилла. Биохим. Биофиз. Акта-Биоэнергия. 1999;1409:165–170. [PubMed] [Google Scholar]
270. Tyystjarvi E, Aro EM. Константа скорости фотоингибирования, измеренная в листьях, обработанных линкомицином, прямо пропорциональна интенсивности света.
 проц. Натл. акад. науч. США. 1996;93:2213–2218. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 1996;93:2213–2218. [Бесплатная статья PMC] [PubMed] [Google Scholar]271. Барбер Дж., Прасил О., Адир Н., Охад И., Барбер Дж. В работе «Структура фотосистем и молекулярная биология». Эльзевир Амстердам. 1992: 295–348. [Google Scholar]
272. Охад И., Кайл Д.Дж., Хиршберг Дж. Светозависимая деградация QB-белка в изолированных тилакоидах гороха. Эмбо Дж. 1985; 4: 1655–1659. [Бесплатная статья PMC] [PubMed] [Google Scholar]
273. Матту А.К., Мардер Дж.Б., Эдельман М. Динамика реакционного центра фотосистемы II. Клетка. 1989;56:241–246. [PubMed] [Google Scholar]
274. Бабу Т.С., Янсен М.А.К., Гринберг Б.М., Габа В., Малкин С., Матту А.К., Эдельман М. Усиленная деградация белков D1 и D2 фотосистемы II под действием смеси фотосинтетически активного излучения и УФ-В. радиация Зависимость от окислительно-восстановительного статуса фотосистемы II. Фотохим. Фотобиол. 1999; 69: 553–559. [Google Scholar]
275. Янсен М.А., Матту А.
 К., Эдельман М. Деградация белков D1-D2 в хлоропластах. Кинетика насыщения сложным светом. Евро. Дж. Биохим. 1999;260:527–532. [PubMed] [Google Scholar]
К., Эдельман М. Деградация белков D1-D2 в хлоропластах. Кинетика насыщения сложным светом. Евро. Дж. Биохим. 1999;260:527–532. [PubMed] [Google Scholar]276. Bowers PG, Porter G. Квантовый выход образования триплетов в растворе хлорофилла. проц. Р. Соц. А. 1967; 296: 435–441. [Google Scholar]
277. Kramer H, Mathis P. Квантовый выход и скорость образования триплетного состояния каротиноидов в фотосинтетических структурах. Биохим. Биофиз. Акта. 1980; 593: 319–329. [PubMed] [Google Scholar]
278. Groot ML, Peterman EJ, van Kan PJM, van Stokkum IHM, Dekker JP, van Grondelle R. Зависящие от температуры триплетные и флуоресцентные квантовые выходы реакционного центра фотосистемы II, описанные в термодинамическом анализе. модель. Биофиз. Дж. 1994;67:318–330. [Статья бесплатно PMC] [PubMed] [Google Scholar]
279. Moya I, Silvestri M, Vallon O, Cinque G, Bassi R. Анализ флуоресценции с временным разрешением антенных белков фотосистемы II в мицеллах и липосомах моющих средств.
 Биохимия. 2001;40:12552–12561. [PubMed] [Google Scholar]
Биохимия. 2001;40:12552–12561. [PubMed] [Google Scholar]280. Красновский А.А. Замедленное свечение и фосфоресценция растительных пигментов. Фотохим. Фотобиол. 1992; 36: 733–741. [Google Scholar]
281. Wolff C, Witt HT. О метастабильных состояниях каротиноидов в первичных актах фотосинтеза. Регистрация методом повторяющейся ультракороткоимпульсной фотометрии. З. Натурфорш. Б. 1969;24:1031–1037. [PubMed] [Google Scholar]
282. Mathis P, Butler WL, Satoh K. Триплетное состояние каротиноидов и тушение флуоресценции хлорофилла в хлоропластах и субхлоропластных частицах. Фотохим. Фотобиол. 1979; 30: 603–614. [Google Scholar]
283. Джаворфи Т., Гараб Г., Накви К.Р. Повторное исследование триплет-минус-синглетного спектра хлоропластов. Спектрохим. Акта А Мол. биомол. Спектроск. 2000; 56А: 211–214. [PubMed] [Google Scholar]
284. Truscott TG. Фотофизика и фотохимия каротиноидов. Дж. Фотохим. Фотобиол. Б. 1990;6:359–371. [Google Scholar]
285. Frank HA, Cua A, Chynwat V, Young A, Gosztola D, Wasielewski MR.
 Фотофизика каротиноидов, связанных с циклом ксантофилла в фотосинтезе. Фотосинтез. Рез. 1994; 41: 389–395. [PubMed] [Google Scholar]
Фотофизика каротиноидов, связанных с циклом ксантофилла в фотосинтезе. Фотосинтез. Рез. 1994; 41: 389–395. [PubMed] [Google Scholar]286. Frank HA, Cogdell RJ. Каротиноиды в фотосинтезе. Фотохим. Фотобиол. 1996; 63: 257–264. [PubMed] [Google Scholar]
287. Siefermann-Harms D. Каротиноиды в фотосинтезе.I. Расположение в фотосинтетических мембранах и светособирающая функция. Биохим. Биофиз. Акта. 1985;811:325–355. [Google Scholar]
288. Santabarbara S, Bordignon E, Jennings RC, Carbonera D. Триплетные состояния хлорофилла, связанные с фотосистемой II тилакоидов. Биохимия. 2002;41:8184–8194. [PubMed] [Google Scholar]
289. Santabarbara S, Jennings RC, Carbonera D. Анализ триплетных состояний фотосистемы II в тилакоидах с помощью флуоресценции обнаружил магнитный резонанс в отношении окислительно-восстановительного состояния первичного хинона-акцептора Q (A). хим. физ. 2003; 294: 257–266. [Академия Google]
290. Santabarbara S, Agostini G, Casazza AP, Syme CD, Heathcote P, Bohles F, Evans MCW, Jennings RC, Carbonera D.
 Триплетные состояния хлорофилла, связанные с фотосистемой I и фотосистемой II в тилакоидах зеленой водоросли Chlamydomonas reinhardtii. Биохим. Биофиз. Акта-Биоэнергия. 2007; 1767: 88–105. [PubMed] [Google Scholar]
Триплетные состояния хлорофилла, связанные с фотосистемой I и фотосистемой II в тилакоидах зеленой водоросли Chlamydomonas reinhardtii. Биохим. Биофиз. Акта-Биоэнергия. 2007; 1767: 88–105. [PubMed] [Google Scholar]291. Сантабарбара С., Агостини Г., Хиткот П., Карбонера Д. Флуоресцентное магнитно-резонансное исследование триплетных состояний каротиноидов, связанных с фотосистемой II изолированных тилакоидных мембран шпината. Фотосинтез. Рез. 2005; 86: 283–29.6. [PubMed] [Google Scholar]
292. Santabarbara S, Carbonera D. Триплетные состояния каротиноидов, связанные с формами фотосистемы I, излучающими длинноволновые хлорофиллы, в изолированных тилакоидных мембранах. Дж. Физ. хим. Б. 2005; 109:986–991. [PubMed] [Google Scholar]
293. Groot ML, Frese RN, de Weerd FL, Bromek K, Pettersson A, Peterman EJ, van Stokkum IH, van Grondelle R, Dekker JP. Спектроскопические свойства белка сердцевинной антенны СР43 фотосистемы II. Биофиз. Дж. 1999;77:3328–3340. [Бесплатная статья PMC] [PubMed] [Google Scholar]
294.
 Карбонера Д., Джакометти Г., Агостини Г., Ангерхофер А., Ауст В. ODMR триплетов каротиноидов и хлорофилла в комплексах CP43 и CP47 шпината. хим. физ. лат. 1992; 194: 275–281. [Google Scholar]
Карбонера Д., Джакометти Г., Агостини Г., Ангерхофер А., Ауст В. ODMR триплетов каротиноидов и хлорофилла в комплексах CP43 и CP47 шпината. хим. физ. лат. 1992; 194: 275–281. [Google Scholar]295. Searle GFW, Schaafsma TJ. Флуоресценция обнаружила магнитно-резонансный хлорофилл первичного донора и внутреннего ядра антенны в белке реакционного центра фотосистемы-I — инверсия знака и перенос энергии. Фотосинтез. Рез. 1992;32:193–206. [PubMed] [Google Scholar]
296. Ван дер Вос Р., Франкен Э.М., Хофф А.Дж. ADMR-исследование влияния олигомеризации на триплеты каротиноидов и на перенос триплетов в светособирающем комплексе-II (LHC-II) шпината. Биохим. Биофиз. Акта-Биоэнергия. 1994; 1188: 243–250. [Google Scholar]
297. Peterman EJ, Dukker FM, van Grondelle R, Van Amerongen H. Триплетные состояния хлорофилла а и каротиноидов в светособирающем комплексе II высших растений. Биофиз. Дж. 1995;69:2670–2678. [Бесплатная статья PMC] [PubMed] [Google Scholar]
298. Schodel R, Irrgang KD, Voigt J, Renger G.
 Скорость образования триплетов каротиноидов в солюбилизированном светособирающем комплексе II (LHCII) из шпината. Биофиз. Дж. 1998; 75:3143–3153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Скорость образования триплетов каротиноидов в солюбилизированном светособирающем комплексе II (LHCII) из шпината. Биофиз. Дж. 1998; 75:3143–3153. [Бесплатная статья PMC] [PubMed] [Google Scholar]299. Barzda V, Peterman EJG, van Grondelle R, Van Amerongen H. Влияние агрегации на образование триплетов в светособирающем хлорофилле a/b пигментно-белковом комплексе II зеленых растений. Биохимия. 1998;37:546–551. [PubMed] [Google Scholar]
300. Lampoura SS, Barzda V, Owen GM, Hoff AJ, Van Amerongen H. Агрегация LHCII приводит к перераспределению триплетов по центральным ксантофиллам в LHCII. Биохимия. 2002;41:9139–9144. [PubMed] [Google Scholar]
301. Mozzo M, Dall’Osto L, Hienerwadel R, Bassi R, Croce R. Фотозащита в антенных комплексах фотосистемы II — роль отдельных ксантофиллов в тушении триплетов хлорофилла. Дж. Биол. хим. 2008; 283:6184–6192. [PubMed] [Google Scholar]
302. Ди Валентин М., Биазибетти Ф., Сеола С., Карбонера Д. Идентификация участков тушения триплетов хлорофилла по отношению к структуре LHC-II высших растений.
 Данные ЭПР. спектроскопия. Дж. Физ. хим. Б. 2009; 113:13071–13078. [PubMed] [Google Scholar]
Данные ЭПР. спектроскопия. Дж. Физ. хим. Б. 2009; 113:13071–13078. [PubMed] [Google Scholar]303. Carbonera D, Agostini G, Morosinotto T, Bassi R. Тушение триплетных состояний хлорофилла каротиноидами в восстановленной субъединице Lhca4 периферического светособирающего комплекса фотосистемы I. Биохимия. 2005; 44:8337–8346. [PubMed] [Академия Google]
304. Croce R, Mozzo M, Morosinotto T, Romeo A, Hienerwadel R, Bassi R. Синглетные и триплетные переходы каротиноидов в антенных комплексах фотосистемы высших растений I. Биохимия. 2007; 46:3846–3855. [PubMed] [Google Scholar]
305. Требст А., Депка Б. Роль каротина в быстром обороте и сборке фотосистемы II у Chlamydomonas reinhardtii. Фебс Летт. 1997; 400:359–362. [PubMed] [Google Scholar]
306. Болычевцева Ю.В., Рахимбердиева М.Г., Карапетян Н.В., Попов В.И., Москаленко А.А., Кузнецова Н.Ю. Развитие каротиноид-дефицитных мембран в пластидах проростков ячменя, обработанных норфлуразоном. Дж. Фотохим. Фотобиол.
 Б. 1995;27:153–160. [Google Scholar]
Б. 1995;27:153–160. [Google Scholar]307. Faludi-Dániel Á, Fridvalszky L, Gyurján I. Пигментный состав и структура пластид в листьях каротиноидной мутантной кукурузы. Планта. 1968; 78: 184–195. [PubMed] [Google Scholar]
308. Фалуди-Даниэль А., Амес Дж., Надь А.Х. Окисление Р700 и перенос энергии у нормальной кукурузы и у мутантов с дефицитом каротиноидов. Биохим. Биофиз. Акта. 1970; 197: 60–68. [PubMed] [Google Scholar]
309. Inwood W, Yoshihara C, Zalpuri R, Kim KS, Kustu S. Ультраструктура мутантного штамма Chlamydomonas reinhardtii, лишенного фитоенсинтазы, напоминает бесцветную водоросль. Мол. Завод. 2008;1:925–937. [Бесплатная статья PMC] [PubMed] [Google Scholar]
310. McCarthy SS, Kobayashi MC, Niyogi KK. Белые мутанты Chlamydomonas reinhardtii дефектны по фитоенсинтазе. Генетика. 2004; 168:1249–1257. [Бесплатная статья PMC] [PubMed] [Google Scholar]
311. Santabarbara S, Casazza AP, Ali K, Economou CK, Wannathong T, Zito F, Redding KE, Rappaport F, Purton S.
 Потребность в каротиноидах в сборке и функция фотосинтетических комплексов у Chlamydomonas reinhardtii. Завод Физиол. 2013; 161: 535–546. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Потребность в каротиноидах в сборке и функция фотосинтетических комплексов у Chlamydomonas reinhardtii. Завод Физиол. 2013; 161: 535–546. [Бесплатная статья PMC] [PubMed] [Google Scholar]312. Кроче Р., Вайс С., Басси Р. Участки связывания каротиноидов главного светособирающего комплекса II высших растений. Дж. Биол. хим. 1999; 274:29613–29623. [PubMed] [Google Scholar]
313. Сантабарбара С., Неверов К.В., Гарласки Ф.М., Зукчелли Г., Дженнингс Р.С. Участие несвязанных хлорофиллов антенны в фотоингибировании тилакоидов. Фебс Летт. 2001; 491:109–113. [PubMed] [Google Scholar]
314. Сантабарбара С., Каццалини И., Ривадосси А., Гарласки Ф.М., Зуккелли Г., Дженнингс Р.С. Фотоингибирование in vivo и in vitro включает слабо связанные комплексы хлорофилл-белок. Фотохим. Фотобиол. 2002; 75: 613–618. [PubMed] [Академия Google]
315. Тюйстъярви Э., Кинг Н., Хакала М., Аро Э.М. Искусственные тушители флуоресценции хлорофилла не защищают от фотоингибирования. Дж. Фотохим.
 Фотобиол. Б. 1999; 48: 142–147. [Google Scholar]
Фотобиол. Б. 1999; 48: 142–147. [Google Scholar]316. Bittar EE, Chow WS. В продвинутой молекулярной и клеточной биологии. JAI Press Inc Гринвич. 1994; 10: 151–196. [Google Scholar]
317. Пауэлс С.Б. Фотоингибирование фотосинтеза, вызванное видимым светом. Анна. Преподобный Завод Физиол. Завод Мол. биол. 1984; 35:15–44. [Академия Google]
318. Тыстъярви Е. Фотоингибирование фотосистемы II и фотоповреждение выделяющего кислород марганцевого кластера. Координ. хим. 2008; 252:361–376. [Google Scholar]
319. Васс И. Молекулярные механизмы фотоповреждения в комплексе Photosystem II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 209–217. [PubMed] [Google Scholar]
320. Робинсон Х.Х., Крофтс А.Р. Кинетика окислительно-восстановительных реакций хинонового акцепторного комплекса фотосистемы II и путь дезактивации. Фебс Летт. 1983;153(1):221–226. [Google Scholar]
321. Styring S, Virgin I, Ehrenberg A, Andersson B. Сильное световое фотоингибирование транспорта электронов в фотосистеме II.
 Нарушение функции первого акцептора хинона. ОК. Биохим. Биофиз. Акта. 1990 г.; 1015: 269–278. [Google Scholar]
Нарушение функции первого акцептора хинона. ОК. Биохим. Биофиз. Акта. 1990 г.; 1015: 269–278. [Google Scholar]322. Vass I, Styring S, Hundal T, Koivuniemi A, Aro EM, Andersson B. Обратимые и необратимые интермедиаты при фотоингибировании фотосистемы II Стабильные восстановленные виды QA способствуют образованию триплетов хлорофилла. проц. Натл. акад. науч. США. 1992;89:1408–1412. [Бесплатная статья PMC] [PubMed] [Google Scholar]
323. Van Mieghem FJE, Nitschke W, Mathis P, Rutherford AW. Влияние электроноакцепторного комплекса хинон-железо на фотохимию реакционного центра Фотосистемы II. Биохим. Биофиз. Акта. 1989; 977: 207–214. [Google Scholar]
324. Van Mieghem FJE, Satoh K, Rutherford AW. Хлорофилл наклонен на 30 o относительно мембраны в реакционном центре фотосистемы II. Биохим. Биофиз. Акта. 1991; 1058: 379–385. [Академия Google]
325. Vass I, Styring S. Характеристика состояний промотирования триплета хлорофилла в фотосистеме-II, последовательно индуцируемых во время фотоингибирования.
 Биохимия. 1993; 32:3334–3341. [PubMed] [Google Scholar]
Биохимия. 1993; 32:3334–3341. [PubMed] [Google Scholar]326. Den Blanken HJ, Hoff AJ, Jongenelis APJM, Diner BA. Триплет-минус-синглетный разностный спектр высокого разрешения частиц фотосистемы II. Фебс Летт. 1983; 157: 21–27. [Google Scholar]
327. Telfer A, Bishop SM, Phillips D, Barber J. Изолированный фотосинтетический реакционный центр фотосистемы II как сенсибилизатор для образования синглетного кислорода. Обнаружение и определение квантового выхода с использованием метода химического захвата. Дж. Биол. хим. 1994;269:13244–13253. [PubMed] [Google Scholar]
328. Макферсон А.Н., Телфер А., Барбер Дж., Траскотт Т.Г. Прямое обнаружение синглетного кислорода из изолированных реакционных центров фотосистемы II. Биохим. Биофиз. Акта. 1993;1143:301–309. [Google Scholar]
329. Карбонера Д., Ди Валентин М., Джакометти Г., Агостини Г. FDMR триплетов хлорофилла в интегрированных частицах и изолированных реакционных центрах фотосистемы.. Идентификация триплета P680.
 Биохим. Биофиз. Акта-Биоэнергия. 1994; 1185: 167–176. [Академия Google]
Биохим. Биофиз. Акта-Биоэнергия. 1994; 1185: 167–176. [Академия Google]330. Hillmann B, Brettel K, van Mieghem F, Kamlowski A, Rutherford AW, Schlodder E. Реакции рекомбинации заряда в фотосистеме II.. Разностные спектры переходного поглощения и их температурная зависимость. Биохимия. 1995; 34:4814–4827. [PubMed] [Google Scholar]
331. Фейкема В.О., Гаст П., Кленина И.Б., Проскуряков И.И. ЭПР-характеристика триплетного состояния в реакционных центрах фотосистемы II с однократно восстановленным первичным акцептором Q(A). Биохим. Биофиз. Акта-Биоэнергия. 2005;1709: 105–112. [PubMed] [Google Scholar]
332. Setif P, Brettel K. Фотохимия фотосистемы I в сильно восстановительных условиях: изучение образования триплетного состояния P700 из вторичной радикальной пары (P700+ -A-1). Биохим. Биофиз. Акта. 1990;1020:232–238. [Google Scholar]
333. Hideg E, Vass I. Синглетный кислород не вырабатывается в фотосистеме-I в фотоингибирующих условиях. Фотохим. Фотобиол.
 1995; 62: 949–952. [Google Scholar]
1995; 62: 949–952. [Google Scholar]334. Сетлик И., Сулейман И., Аллахвердиев И., Недбал Л., Сетликова Е., Климов В.В. Три типа фотоинактивации фотосистемы II.I. Повреждающие процессы на акцепторной стороне. Фотосинтез. Рез. 1990;23:39–48. [PubMed] [Google Scholar]
335. Jegerschld C, Virgin I, Styring S. Светозависимая деградация белка D1 в фотосистеме II ускоряется после ингибирования реакции расщепления воды. Биохимия. 1990; 29: 6179–6186. [PubMed] [Google Scholar]
336. Ямшита Т., Батлер В.Л. Фотоокисление фотосистемой II триотмытого хлоропласта. Завод Физиол. 1969; 44: 1342–1346. [Бесплатная статья PMC] [PubMed] [Google Scholar]
337. Hakala M, Tuominen I, Keranen M, Tyystjarvi T, Tyystjarvi E. Доказательства роли комплекса марганца, выделяющего кислород, в фотоингибировании фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 68–80. [PubMed] [Академия Google]
338. Фаллер П., Паскаль А., Резерфорд А.В. окислительно-восстановительные реакции бета-каротина в фотосистеме II: путь переноса электрона.
 Биохимия. 2001;40:6431–6440. [PubMed] [Google Scholar]
Биохимия. 2001;40:6431–6440. [PubMed] [Google Scholar]339. Hanley J, Deligiannakis Y, Pascal A, Faller P, Rutherford AW. Окисление каротиноидов в фотосистеме II. Биохимия. 1999; 38:8189–8195. [PubMed] [Google Scholar]
340. Шинопулос К.Е., Брудвиг Г.В. Цитохром b559 и циклический перенос электрона в фотосистеме II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 66–75. [PubMed] [Академия Google]
341. Tracewell CA, Brudvig GW. Множественные окислительно-восстановительные хлорофиллы во вторичных путях переноса электронов фотосистемы II, выделяющей кислород. Биохимия. 2008;47:11559–11572. [Бесплатная статья PMC] [PubMed] [Google Scholar]
342. Томпсон Л.К., Брудвиг Г.В. Цитохром b559 может защищать фотосистему II от фотоингибирования. Биохимия. 1988; 27: 6653–6658. [PubMed] [Google Scholar]
343. Scheller HV, Haldrup A. Фотоингибирование фотосистемы I. Planta. 2005; 221:5–8. [PubMed] [Академия Google]
344. Соноике К. Фотоингибирование фотосистемы I.
 Физиол. Плантарум. 2011; 142:56–64. [PubMed] [Google Scholar]
Физиол. Плантарум. 2011; 142:56–64. [PubMed] [Google Scholar]345. Kudoh H, Sonoike K. Необратимое повреждение фотосистемы I при охлаждении на свету: причина деградации хлорофилла после возвращения к нормальной температуре роста. Планта. 2002; 215: 541–548. [PubMed] [Google Scholar]
346. Соноике К., Терашима И., Иваки М., Ито С. Разрушение железо-серных центров Фотосистемы-I в листьях Cucumis sativus L. при слабом освещении при низких температурах. Фебс Летт. 1995;362:235–238. [PubMed] [Google Scholar]
347. Тьюс С.Е., Моллер Б.М., Шеллер Х.В. Фотоингибирование Фотосистемы I повреждает как белки реакционных центров PSI-A и PSI-B, так и расположенные на акцепторной стороне малые полипептиды Фотосистемы I. Фотосинтез. Рез. 1999; 60: 75–86. [Google Scholar]
348. Барбато Р., Фризо Г., Ригони Ф., Веккья Ф.Д., Джакометти Г.М. Структурные изменения и латеральное перераспределение фотосистемы-II при фотоингибировании тилакоидов на донорской стороне. Дж. Клеточная биология.
 1992; 119: 325–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1992; 119: 325–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]349. Koivuniemi A., Aro EM, Andersson B. Деградация D1- и D2-белков фотосистемы II у высших растений регулируется обратимым фосфорилированием. Биохимия. 1995; 34:16022–16029. [PubMed] [Google Scholar]
350. Zhang S, Scheller HV. Светособирающий комплекс II связывается с несколькими малыми субъединицами фотосистемы I. J. Biol. хим. 2004; 279:3180–3187. [PubMed] [Google Scholar]
351. Alboresi A, Ballottari M, Hienerwadel R, Giacometti GM, Morosinotto T. Антенные комплексы защищают фотосистему I от фотоингибирования. BMC Растение Биол. 2009 г.;9:71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
352. Forti G, Caldiroli G. Переходы состояний у Chlamydomonas reinhardtii. Роль реакции Мелера в переходе из состояния 2 в состояние 1. Завод Физиол. 2005; 137: 492–499. [Бесплатная статья PMC] [PubMed] [Google Scholar]
353. Форти Г., Элли Г. Функция аскорбиновой кислоты в фотосинтетическом фосфорилировании.
 Завод Физиол. 1995;109:1207–1211. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Завод Физиол. 1995;109:1207–1211. [Бесплатная статья PMC] [PubMed] [Google Scholar]354. Форти Г., Элли Г. Стимуляция фотофосфорилирования аскорбатом в зависимости от интенсивности света. Завод Физиол. 1996;112:1509–1511. [Бесплатная статья PMC] [PubMed] [Google Scholar]
355. Асада К. Круговорот воды в хлоропластах: удаление активного кислорода и рассеивание избыточных фотонов. Анну. Преподобный Завод Физиол. Завод Мол. биол. 1999; 50: 601–639. [PubMed] [Google Scholar]
356. Андерсон Дж. М. Фоторегуляция состава, функции и структуры мембран тилакоидов. Анну. Преподобный Завод Физиол. Завод Мол. биол. 1986; 37: 93–136. [Google Scholar]
357. Андерсон Дж. М., Чоу В. С., Goodchild DJ. Организация тилакоидной мембраны при акклиматизации к солнечному свету. Ауст. J. Физиол растений. 1988;15:11–26. [Google Scholar]
358. Бейли С., Уолтерс Р.Г., Янссон С., Хортон П. Акклиматизация Arabidopsis thaliana к световой среде: существование отдельных реакций при слабом и сильном освещении.
 Планта. 2001; 213: 794–801. [PubMed] [Google Scholar]
Планта. 2001; 213: 794–801. [PubMed] [Google Scholar]359. Хортон П., Рубан А.В., Вентворт М. Аллостерическая регуляция светособирающей системы фотосистемы II. Филос. Транс. Р. Соц. Б-Биол. науч. 2000;355:1361–1370. [Бесплатная статья PMC] [PubMed] [Google Scholar]
360. Деммиг-Адамс Б. Каротиноиды и фотозащита растений Роль ксантофилла зеаксантина. Биохим. Биофиз. Акта. 1990;1020:1–24. [Google Scholar]
361. Холт Н.Е., Флеминг Г.Р., Нийоги К.К. К пониманию механизма нефотохимического тушения в зеленых растениях. Биохимия. 2004; 43:8281–8289. [PubMed] [Google Scholar]
362. Раджагопал С., Бухов Н.Г., Таймир-Риахи Х.А., Карпентьер Р. Контроль рассеяния энергии и фотохимической активности в фотосистеме I с помощью НАДФ-зависимых обратимых конформационных изменений. Биохимия. 2003;42:11839–11845. [PubMed] [Google Scholar]
363. Бонавентура С., Майерс Дж. Флуоресценция и выделение кислорода Chlorella pyrenoidosa. Биохим. Биофиз. Акта. 1969;189:366–383.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]364. Finazzi G, Forti G. Метаболическая гибкость зеленой водоросли Chlamydomonas reinhardtii, выявленная связью между переходами состояний и циклическим потоком электронов. Фотосинтез. Рез. 2004; 82: 327–338. [PubMed] [Google Scholar]
365. Eberhard S, Finazzi G, Wollman FA. Динамика фотосинтеза. Анну. Преподобный Жене. 2008; 42: 463–515. [PubMed] [Google Scholar]
366. Noctor G, Ruban AV, Horton P. Модуляция дельта-pH-зависимого нефотохимического тушения флуоресценции хлорофилла в хлоропластах шпината. Биохим. Биофиз. Акта. 1993;1183:339–344. [Google Scholar]
367. Nilkens M, Kress E, Lambrev P, Miloslavina Y, Muller M, Holzwarth AR, Jahns P. Идентификация медленно индуцируемого зеаксантин-зависимого компонента нефотохимического тушения флуоресценции хлорофилла, возникающего при Состояние арабидопсиса. Биохим. Биофиз. Акта-Биоэнергия. 2010; 1797: 466–475. [PubMed] [Google Scholar]
368. Ламбрев П.Х., Милославина Ю., Янс П.
 , Хольцварт А.Р. О связи нефотохимического тушения и фотозащиты Фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 760–769.. [PubMed] [Google Scholar]
, Хольцварт А.Р. О связи нефотохимического тушения и фотозащиты Фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 760–769.. [PubMed] [Google Scholar]369. Jennings RC, Garlaschi FM, Forti G. Исследования медленного снижения флуоресценции в изолированных хлоропластах. Биохим. Биофиз. Акта. 1976; 423: 264–274. [PubMed] [Google Scholar]
370. Crofts AR, Yerkes CT. Молекулярный механизм q(E)-тушения. Фебс Летт. 1994; 352: 265–270. [PubMed] [Google Scholar]
371. Yamamoto HY, Nakayama TO, Chichester CO. Исследования световых и темных взаимопревращений ксантофиллов листьев. Арка Биохим. Биофиз. 1962;97:168–173. [PubMed] [Google Scholar]
372. Yamamoto HY, Wang Y, Kamite L. Изменение оптической плотности хлоропластов в результате деэпоксидирования виолаксантина. Возможный компонент изменений 515 нм. Биохим. Биофиз. Рез. коммун. 1971; 42: 37–42. [PubMed] [Google Scholar]
373. Li XP, Gilmore AM, Caffarri S, Bassi R, Golan T, Kramer D, Niyogi KK.
 Регуляция фотосинтетического сбора света включает определение pH внутритилакоидного просвета белком PsbS. Дж. Биол. хим. 2004; 279:22866–22874. [PubMed] [Академия Google]
Регуляция фотосинтетического сбора света включает определение pH внутритилакоидного просвета белком PsbS. Дж. Биол. хим. 2004; 279:22866–22874. [PubMed] [Академия Google]374. Li XP, Bjorkman O, Shih C, Grossman AR, Rosenquist M, Jansson S, Niyogi KK. Пигментсвязывающий белок, необходимый для регуляции фотосинтетического сбора света. Природа. 2000; 403:391–395. [PubMed] [Google Scholar]
375. Джонсон М.П., Рубан А.В. Растения арабидопсиса, лишенные белка PsbS, обладают фотозащитной диссипацией энергии. Плант Дж. 2010; 61: 283–289. [PubMed] [Google Scholar]
376. Bassi R, Caffarri S. Белки Lhc и регуляция фотосинтетической функции сбора света ксантофиллами. Фотосинтез. Рез. 2000; 64: 243–256. [PubMed] [Академия Google]
377. Рубан А.В., Джонсон М.П., Даффи К.Д. Фотозащитный молекулярный переключатель в антенне фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 167–181. [PubMed] [Google Scholar]
378. ван Оорт Б., ван Хук А., Рубан А.
 В., ван Амеронген Х. Равновесие между погашенными и нетушенными конформациями основного светособирающего комплекса растений, изученное с помощью флуоресценции с временным разрешением под высоким давлением. Дж. Физ. хим. Б. 2007; 111:7631–7637. [PubMed] [Академия Google]
В., ван Амеронген Х. Равновесие между погашенными и нетушенными конформациями основного светособирающего комплекса растений, изученное с помощью флуоресценции с временным разрешением под высоким давлением. Дж. Физ. хим. Б. 2007; 111:7631–7637. [PubMed] [Академия Google]379. Сантабарбара С., Хортон П., Рубан А.В. Сравнение термодинамических ландшафтов развертывания и формирования энергодиссипативного состояния в изолированном светособирающем комплексе II. Биофиз. Дж. 2009; 97: 1188–1197. [Бесплатная статья PMC] [PubMed] [Google Scholar]
380. Крюгер Т.П., Илиоайя С., Джонсон М.П., Рубан А.В., Папагианнакис Э., Хортон П., ван Гронделл Р. Контролируемое нарушение в светособирающем комплексе II растений объясняет его фотозащитное действие. роль. Биофиз. Дж. 2012; 102: 2669–2676. [Бесплатная статья PMC] [PubMed] [Google Scholar]
381. Крюгер Т.П., Новодережкин В.И., Илиоая С., ван Гронделл Р. Спектральная динамика флуоресценции одиночных тримеров LHCII. Биофиз. Дж.
 2010;98:3093–3101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2010;98:3093–3101. [Бесплатная статья PMC] [PubMed] [Google Scholar]382. Wilk L, Grunwald M, Liao PN, Walla PJ, Kuhlbrandt W. Прямое взаимодействие основного светособирающего комплекса II и PsbS при нефотохимическом тушении. проц. Натл. акад. науч. США. 2013; 110:5452–5456. [Бесплатная статья PMC] [PubMed] [Google Scholar]
383. Краучман С., Рубан А., Хортон П. PsbS усиливает нефотохимическое тушение флуоресценции в отсутствие зеаксантина. Фебс Летт. 2006; 580:2053–2058. [PubMed] [Академия Google]
384. Niyogi KK, Grossman AR, Bj’rkman O. Мутанты Arabidopsis определяют центральную роль цикла ксантофилла в регуляции фотосинтетического преобразования энергии. Растительная клетка. 1998; 10:1121–1134. [Бесплатная статья PMC] [PubMed] [Google Scholar]
385. Джонсон М.П., Перес-Буэно М.Л., Зия А., Хортон П., Рубан А.В. Зеаксантин-независимый и зеаксантин-зависимый компоненты qE нефотохимического тушения включают общие конформационные изменения в антенне фотосистемы II у Arabidopsis.
 Завод Физиол. 2009 г.;149:1061–1075. [PMC free article] [PubMed] [Google Scholar]
Завод Физиол. 2009 г.;149:1061–1075. [PMC free article] [PubMed] [Google Scholar]386. Formaggio E, Cinque G, Bassi R. Функциональная архитектура главного светособирающего комплекса высших растений. Дж. Мол. биол. 2001; 314:1157–1166. [PubMed] [Google Scholar]
387. Рубан А.В., Янг А.Дж., Хортон П. Динамические свойства минорных белков, связывающих хлорофилл a/b фотосистемы II, модель in vitro для рассеивания фотозащитной энергии в фотосинтетической мембране зеленых растений. Биохимия. 1996;35:674–678. [PubMed] [Google Scholar]
388. de Bianchi S, Dall’Osto L, Tognon G, Morosinotto T, Bassi R. Белки минорной антенны CP24 и CP26 влияют на взаимодействие между субъединицами фотосистемы II и скорость транспорта электронов в мембранах гран. арабидопсиса. Растительная клетка. 2008;20:1012–1028. [Статья бесплатно PMC] [PubMed] [Google Scholar]
389. Jennings RC, Garlaschi FM, Zucchelli G. Индуцированное светом тушение флуоресценции в светособирающем белковом комплексе хлорофилла a/b.
 Фотосинтез. Рез. 1991;27:57–64. [PubMed] [Google Scholar]
Фотосинтез. Рез. 1991;27:57–64. [PubMed] [Google Scholar]390. Барзда В., Истокович А., Симиджиев И., Гараб Г. Индуцированные светом обратимые изменения в хиральной макроорганизации и диссипации энергии возбуждения тилакоидных мембран и макроагрегатов очищенного LHCII. Биофиз. Дж. 1996; 70:TU536–TU536. [Google Scholar]
391. Barzda V, Jennings RC, Zucchelli G, Garab G. Кинетический анализ светоиндуцированного тушения флуоресценции в светособирающем хлорофилле a/b пигментно-белковом комплексе фотосистемы II. Фотохим. Фотобиол. 1999;70:751–759. [Google Scholar]
392. Чех З., Раджагопал С., Цонев Т., Бушева М., Папп Э., Гараб Г. Термооптический эффект в тилакоидных мембранах хлоропластов. Термическая и световая стабильность пигментных массивов различной степени сложности. Биохимия. 2000;39:15250–15257. [PubMed] [Google Scholar]
393. Рубан А.В., Янг А., Хортон П. Модуляция тушения флуоресценции хлорофилла в изолированном светособирающем комплексе Фотосистемы II.
 Биохим. Биофиз. Акта-Биоэнергия. 1994;1186:123–127. [Google Scholar]
Биохим. Биофиз. Акта-Биоэнергия. 1994;1186:123–127. [Google Scholar]394. Ilioaia C, Johnson MP, Duffy CDP, Pascal AA, van Grondelle R, Robert B, Ruban AV. Происхождение изменений поглощения, связанных с рассеиванием фотозащитной энергии в отсутствие зеаксантина. Дж. Биол. хим. 2011; 286:91–98. [Бесплатная статья PMC] [PubMed] [Google Scholar]
395. Muller MG, Lambrev P, Reus M, Wientjes E, Croce R, Holzwarth AR. Синглетная диссипация энергии в светособирающем комплексе фотосистемы II не связана с передачей энергии каротиноидам. ХимФизХим. 2010;11:1289–1296. [PubMed] [Google Scholar]
396. Miloslavina Y, Wehner A, Lambrev PH, Wientjes E, Reus M, Garab G, Croce R, Holzwarth AR. Дальнекрасная флуоресценция является прямым спектроскопическим маркером образования олигомера LHCII при нефотохимическом тушении. Фебс Летт. 2008; 582:3625–3631. [PubMed] [Google Scholar]
397. Frank HA, Bautista JA, Josue JS, Young AJ. Механизм нефотохимического тушения в зеленых растениях: энергии низших возбужденных синглетных состояний виолаксантина и зеаксантина.
 Биохимия. 2000;39: 2831–2837. [PubMed] [Google Scholar]
Биохимия. 2000;39: 2831–2837. [PubMed] [Google Scholar]398. Bode S, Quentmeier CC, Liao PN, Hafi N, Barros T, Wilk L, Bittner F, Walla PJ. О регуляции фотосинтеза экситонными взаимодействиями каротиноидов и хлорофиллов. проц. Натл. акад. науч. США. 2009;106:12311–12316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
399. Holt NE, Zigmantas D, Valkunas L, Li XP, Niyogi KK, Fleming GR. Образование каротиноидных катионов и регуляция фотосинтетического сбора света. Наука. 2005; 307: 433–436. [PubMed] [Академия Google]
400. Ан Т.К., Авенсон Т.Дж., Баллоттари М., Ченг Ю.К., Нийоги К.К., Басси Р., Флеминг Г.Р. Архитектура состояния переноса заряда, регулирующего сбор света в белке антенны растения. Наука. 2008; 320: 794–797. [PubMed] [Google Scholar]
401. Авенсон Т.Дж., Ан Т.К., Нийоги К.К., Баллоттари М., Басси Р., Флеминг Г.Р. Лютеин может действовать как переключаемый гаситель переноса заряда в светособирающем комплексе CP26. Дж. Биол. хим. 2009; 284:2830–2835.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]402. Li ZR, Ahn TK, Avenson TJ, Ballottari M, Cruz JA, Kramer DM, Bassi R, Fleming GR, Keasling JD, Niyogi KK. Накопление лютеина в отсутствие зеаксантина восстанавливает нефотохимическое тушение у мутанта npq1 Arabidopsis thaliana. Растительная клетка. 2009 г.;21:1798–1812. [Бесплатная статья PMC] [PubMed] [Google Scholar]
403. Вормит М., Дрюв А. Квантово-химическое понимание рассеяния энергии и образования каротиноидных катион-радикалов в светособирающих комплексах. физ. хим. хим. физ. 2007; 9: 2917–2931. [PubMed] [Google Scholar]
404. Вормит М., Харбах Х.П.П., Мьюз Дж.М., Амари С., Вахтвейтл Дж., Дрю А. Перенос энергии возбуждения и образование каротиноидных катион-радикалов в светособирающих комплексах. Теоретическая перспектива. Биохим. Биофиз. Акта-Биоэнергия. 2009 г.;1787:738–746. [PubMed] [Google Scholar]
405. Вентворт М., Рубан А.В., Хортон П. Термодинамическое исследование механизма тушения флуоресценции хлорофилла в изолированных светособирающих комплексах фотосистемы II.
 Дж. Биол. хим. 2003; 278:21845–21850. [PubMed] [Google Scholar]
Дж. Биол. хим. 2003; 278:21845–21850. [PubMed] [Google Scholar]406. Гараб Г., Чех З., Ковач Л., Раджагопал С., Варкони З., Вентворт М., Мастарди Л., Дер А., Рубан А.В., Папп Э., Холценбург А., Хортон П. Индуцированный светом переход тримера в мономер в основном светособирающем антенном комплексе растений Термооптический механизм. Биохимия. 2002;41:15121–15129. [PubMed] [Google Scholar]
407. Ламбрев П.Х., Шмитт Ф.Дж., Куссин С., Шенген М., Варкони З., Эйхлер Х.Дж., Гараб Г., Ренгер Г. Размер функционального домена в агрегатах светособирающего комплекса II и тилакоидных мембран. Биохим. Биофиз. Акта-Биоэнергия. 2011; 1807: 1022–1031. [PubMed] [Google Scholar]
408. Добрикова А.Г., Варкони З., Крумова С.Б., Ковач Л., Костов Г.К., Тодинова С.Ю., Бушева М.С., Танева С.Г., Гараб Г. Структурные перестройки в тилакоидных мембранах хлоропластов, выявленные с помощью дифференциальной сканирующей калориметрии и спектроскопия кругового дихроизма. Термооптический эффект. Биохимия.
 2003;42:11272–11280. [PubMed] [Академия Google]
2003;42:11272–11280. [PubMed] [Академия Google]409. Humbeck K, Romer S, Senger H. Доказательства важной роли каротиноидов в сборке активной фотосистемы II. Планта. 1989; 179: 242–250. [PubMed] [Google Scholar]
410. Хаво М., Нийоги К.К. Цикл виолаксантина защищает растения от фотоокислительного повреждения более чем одним механизмом. проц. Натл. акад. науч. США. 1999; 96: 8762–8767. [Бесплатная статья PMC] [PubMed] [Google Scholar]
411. Havaux M, Dall’osto L, Bassi R. Зеаксантин обладает повышенной антиоксидантной способностью по отношению ко всем другим ксантофиллам в листьях арабидопсиса и действует независимо от связывания с антеннами PSII. Завод Физиол. 2007; 145:1506–1520. [Бесплатная статья PMC] [PubMed] [Google Scholar]
412. Мацубара С., Чоу В.С. Популяции реакционных центров фотоинактивированной фотосистемы II, характеризующиеся временем жизни флуоресценции хлорофилла а in vivo. проц. Натл. акад. науч. США. 2004; 101:18234–18239. [PMC free article] [PubMed] [Google Scholar]
413.
 Sarvikas P, Tyystjarvi T, Tyystjarvi E. Пересмотр кинетики длительного фотоингибирования Фотоингибированные центры Фотосистемы II не защищают активные центры от потери выделения кислорода. Фотосинтез. Рез. 2010; 103:7–17. [PubMed] [Академия Google]
Sarvikas P, Tyystjarvi T, Tyystjarvi E. Пересмотр кинетики длительного фотоингибирования Фотоингибированные центры Фотосистемы II не защищают активные центры от потери выделения кислорода. Фотосинтез. Рез. 2010; 103:7–17. [PubMed] [Академия Google]414. Bennett J. Фосфорилирование полипептидов хлоропластной мембраны. Природа. 1977; 269: 344–346. [Google Scholar]
415. Bennett J, Shaw EK, Michel H. Комплекс Cytochrome-b6f необходим для фосфорилирования светособирающего хлорофилла a/b комплекса-II в фотосинтетических мембранах хлоропластов. Евро. Дж. Биохим. 1988; 171: 95–100. [PubMed] [Google Scholar]
416. Jennings RC, Zucchelli G. Исследования фосфорилирования тилакоидов и нециклического транспорта электронов. Арка Биохим. Биофиз. 1986;246:108–113. [PubMed] [Google Scholar]
417. Bellafiore S, Barneche F, Peltier G, Rochaix JD. Переходы между состояниями и световая адаптация требуют наличия хлоропластной тилакоидной протеинкиназы STN7. Природа. 2005; 433: 892–895.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]418. Zito F, Finazzi G, Delosme R, Nitschke W, Picot D, Wollman FA. Сайт Qo комплексов цитохрома b6f контролирует активацию киназы LHCII. Эмбо Дж. 1999; 18: 2961–2969. [Бесплатная статья PMC] [PubMed] [Google Scholar]
419. Нильссон А., Стис Д., Дракенберг Т., Спангфорт М.Д., Форсен С., Аллен Дж.Ф. Фосфорилирование контролирует трехмерную структуру светособирающего комплекса II растений. Дж. Биол. хим. 1997; 272:18350–18357. [PubMed] [Google Scholar]
420. Pribil M, Pesaresi P, Hertle A, Barbato R, Leister D. Роль пластидной протеинфосфатазы TAP38 в дефосфорилировании LHCII и потоке электронов тилакоидов. PLoS. биол. 2010;8:e1000288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
421. Шапигузов А., Ингельссон Б., Самол И., Андрес С., Кесслер Ф., Роше Д.Д., Венер А.В., Гольдшмидт-Клермон М. Фосфатаза PPh2 специфически участвует в LHCII. дефосфорилирование и переходы состояний у арабидопсиса. проц. Натл. акад. науч. США. 2010; 107:4782–4787.
 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]422. Лунде С., Дженсен П.Е., Халдруп А., Кнётцель Дж., Шеллер Х.В. Субъединица PSI-H фотосистемы I необходима для переходов состояний при фотосинтезе растений. Природа. 2000; 408: 613–615. [PubMed] [Google Scholar]
423. Santabarbara S, Jennings RC. Размер популяции слабо связанных пигментов хлорофилла, участвующих в фотоингибировании тилакоидов, определяли с помощью стационарной флуоресцентной спектроскопии. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1709: 138–149. [PubMed] [Академия Google]
424. Sarvikas P, Hakala M, Patsikka E, Tyystjarvi T, Tyystjarvi E. Спектр действия фотоингибирования в листьях дикого типа и мутантов npq1-2 и npq4-1 Arabidopsis thaliana. Физиология клеток растений. 2006; 47: 391–400. [PubMed] [Google Scholar]
425. Havaux M, Kloppstech K. Защитные функции каротиноидных и флавоноидных пигментов от избыточного видимого излучения при температуре охлаждения исследованы у мутантов Arabidopsis npq и tt.
 Планта. 2001; 213:953–966. [PubMed] [Академия Google]
Планта. 2001; 213:953–966. [PubMed] [Академия Google]426. Крах Н.М., Логан Б.А. Потеря экспрессии psbS снижает вегетативный рост, репродуктивную способность и ограниченный светом, но не насыщенный светом фотосинтез у Arabidopsis thaliana (Brassicaceae), выращиваемых в условиях умеренного освещения. Являюсь. Дж. Бот. 2010; 97: 644–649. [PubMed] [Google Scholar]
427. Роуч Т., Кригер-Лишкай А. Роль белка PsbS в защите фотосистем I и II от яркого света у Arabidopsis thaliana. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 2158–2165. [PubMed] [Академия Google]
428. Кулхейм С., Агрен Дж., Янссон С. Быстрое регулирование светоуборки и приспособленности растений в поле. Наука. 2002; 297:91–93. [PubMed] [Google Scholar]
429. Pagano A, Cinque G, Bassi R. Реконструкция in vitro рекомбинантного светособирающего комплекса фотосистемы II CP24 и его спектроскопическая характеристика. Дж. Биол. хим. 1998; 273:17154–17165. [PubMed] [Google Scholar]
430. ван Роон Х.
 , ван Бреемен Дж. Ф., де Вирд Ф. Л., Деккер Дж. П., Бокема Э. Дж. Солюбилизация мембран тилакоидов зеленых растений с помощью n-додецил-альфа, D-мальтозида. Значение для структурной организации комплексов Photosystm II Photosystem I, АТФ-синтазы и цитохрома b6f. Фотосинтез. Рез. . 2000 г.; 64:155–166. [PubMed] [Академия Google]
, ван Бреемен Дж. Ф., де Вирд Ф. Л., Деккер Дж. П., Бокема Э. Дж. Солюбилизация мембран тилакоидов зеленых растений с помощью n-додецил-альфа, D-мальтозида. Значение для структурной организации комплексов Photosystm II Photosystem I, АТФ-синтазы и цитохрома b6f. Фотосинтез. Рез. . 2000 г.; 64:155–166. [PubMed] [Академия Google]431. Жолио П., Жолио А. Передача возбуждения между фотосинтетическими единицами: эксперимент 1964 года. Фотосинтез. Рез. 2003; 76: 241–245. [PubMed] [Google Scholar]
432. Fey H, Piano D, Horn R, Fischer D, Schmidt M, Ruf S, Schroder WP, Bock R, Buchel C. Выделение высокоактивных комплексов ядра фотосистемы II с His- меченая субъединица Cyt b(559) из транспластомных растений табака. Биохим. Биофиз. Акта-Биоэнергия. 2008; 1777: 1501–1509. [PubMed] [Google Scholar]
433. Wang ZG, Xu TH, Liu C, Yang CH. Быстрое выделение высокоактивных комплексов ядра фотосистемы II из шпината. Дж. Интегр. биол. растений 2010;52:793–800. [PubMed] [Google Scholar]
434.
 Bricker TM, Morvant J, Masri N, Sutton HM, Frankel LK. Выделение высокоактивного препарата Фотосистемы II из Synechocystis 6803 с использованием меченого гистидином мутанта СР 47. Биохим. Биофиз. Акта-Биоэнергия. 1998;1409:50–57. [PubMed] [Google Scholar]
Bricker TM, Morvant J, Masri N, Sutton HM, Frankel LK. Выделение высокоактивного препарата Фотосистемы II из Synechocystis 6803 с использованием меченого гистидином мутанта СР 47. Биохим. Биофиз. Акта-Биоэнергия. 1998;1409:50–57. [PubMed] [Google Scholar]435. Tang XS, Diner BA. Биохимическая и спектроскопическая характеристика нового комплекса ядра фотосистемы II, выделяющего кислород, из цианобактерии Synechocystis PCC 6803. Биохимия. 1994;33:4594–4603. [PubMed] [Google Scholar]
436. Setlikova E, Ritter S, Hienerwadel R, Kopecky J, Komenda J, Welte W, Setlik I. Очистка реакционного центра Photosystem II от термофильных цианобактерий с использованием аффинной хроматографии с иммобилизованным металлом . Фотосинтез. Рез. 1995; 43: 201–211. [PubMed] [Google Scholar]
PDB-101: Молекула месяца: Фотосистема II
Молекула месяца
По категориям По дате По названию Фотосистема II улавливает энергию солнечного света и использует ее для извлечения электронов из молекул воды
Фотосистема II из цианобактерий.
 Мембрана схематично показана серым цветом.
Мембрана схематично показана серым цветом. Три миллиарда лет назад наш мир полностью изменился. До этого жизнь на Земле зависела от ограниченных природных ресурсов, обнаруженных в местной среде, таких как органические молекулы, произведенные молнией, горячими источниками и другими геохимическими источниками. Однако эти ресурсы быстро истощались. Все изменилось, когда эти крошечные клетки обнаружили способ улавливать свет и использовать его для питания своих внутренних процессов. Открытие фотосинтеза открыло огромные новые возможности для роста и распространения, и жизнь на Земле процветала. Благодаря этому новому открытию клетки смогут извлекать углекислый газ из воздуха и объединять его с водой для создания сырья и энергии, необходимых для роста. Сегодня фотосинтез является основой жизни на Земле, обеспечивая (за некоторыми экзотическими исключениями) пищу и энергию, которые поддерживают жизнь каждого организма.
Цвета фотосинтеза
Современные клетки улавливают свет с помощью белков фотосистемы, например, изображенной здесь из записи PDB 1s5l .
 Эти фотосистемы используют набор ярко окрашенных молекул для улавливания света. Эти светопоглощающие молекулы включают зеленые хлорофиллы, которые состоят из плоской органической молекулы, окружающей ион магния, и оранжевые каротиноиды, которые имеют длинную цепочку углерод-углеродных двойных связей. Эти молекулы поглощают свет и используют его для возбуждения электронов. Затем высокоэнергетические электроны используются для питания ячейки.
Эти фотосистемы используют набор ярко окрашенных молекул для улавливания света. Эти светопоглощающие молекулы включают зеленые хлорофиллы, которые состоят из плоской органической молекулы, окружающей ион магния, и оранжевые каротиноиды, которые имеют длинную цепочку углерод-углеродных двойных связей. Эти молекулы поглощают свет и используют его для возбуждения электронов. Затем высокоэнергетические электроны используются для питания ячейки.Энергичные электроны
Фотосистема II является первым звеном в цепи фотосинтеза. Он улавливает фотоны и использует энергию для извлечения электронов из молекул воды. Эти электроны используются несколькими способами. Во-первых, когда электроны удаляются, молекула воды расщепляется на газообразный кислород, который испаряется, и ионы водорода, которые используются для синтеза АТФ. Это источник всего кислорода, которым мы дышим. Во-вторых, электроны передаются по цепочке белков-переносчиков электронов, получая по пути дополнительный импульс от фотосистемы I.
 Когда эти электроны двигаются по цепочке, они используются для перекачки ионов водорода через мембрану, обеспечивая еще большую мощность для фотосистемы I. Синтез АТФ. Наконец, электроны размещаются на молекуле-переносчике НАДФН, которая доставляет их к ферментам, строящим сахар из воды и углекислого газа.
Когда эти электроны двигаются по цепочке, они используются для перекачки ионов водорода через мембрану, обеспечивая еще большую мощность для фотосистемы I. Синтез АТФ. Наконец, электроны размещаются на молекуле-переносчике НАДФН, которая доставляет их к ферментам, строящим сахар из воды и углекислого газа.Реакционный центр фотосистемы II.
Скачать изображение в формате TIFF в высоком качестве
Реакционный центр
Сердцем фотосистемы II является реакционный центр, где энергия света преобразуется в движение возбужденных электронов. В центре находится ключевая молекула хлорофилла. Когда он поглощает свет, один из его электронов получает более высокую энергию. Затем этот заряженный электрон прыгает вниз через несколько других пигментированных молекул к пластохинону А и, наконец, к пластохинону В. Когда он получает достаточно электронов, этот небольшой хинон высвобождается из фотосистемы и передает свои электроны следующему звену в цепь переноса электрона.
 Конечно, это оставляет исходный хлорофилл без электрона. Верхняя половина реакционного центра предназначена для замены этого электрона низкоэнергетическим электроном из воды. Центр выделения кислорода лишает воду электрона и передает его аминокислоте тирозину, которая затем доставляет его хлорофиллу, подготавливая его к поглощению другого фотона.
Конечно, это оставляет исходный хлорофилл без электрона. Верхняя половина реакционного центра предназначена для замены этого электрона низкоэнергетическим электроном из воды. Центр выделения кислорода лишает воду электрона и передает его аминокислоте тирозину, которая затем доставляет его хлорофиллу, подготавливая его к поглощению другого фотона.Антенные белки (небольшие треугольные белки вверху и внизу), связанные с фотосистемой II. Центральная молекула хлорофилла реакционного центра показана стрелкой.
Скачать изображение в формате TIFF высокого качества
Сбор света
Конечно, весь этот процесс не был бы очень эффективным, если бы растениям приходилось ждать, пока фотоны попадут на этот особый хлорофилл в реакционном центре. К счастью, энергия возбужденного светом электрона легко передается через процесс резонансной передачи энергии. Благодаря тайнам квантовой механики энергия может переходить от молекулы к молекуле, пока они находятся достаточно близко друг к другу.
 Чтобы воспользоваться этим свойством, фотосистемы имеют большие антенны из светопоглощающих молекул, которые собирают свет и передают свою энергию внутрь реакционного центра. Растения даже вырабатывают специальные светособирающие белки, которые находятся рядом с фотосистемами и помогают собирать свет. На рисунке показан вид сверху на фотосистему II (запись PDB 1s5l ), демонстрируя все светопоглощающие молекулы внутри. Центральная молекула хлорофилла реакционного центра показана стрелкой (обратите внимание на второй реакционный центр в нижней половине — фотосистема II состоит из двух одинаковых половинок). Маленькие треугольные молекулы сверху и снизу, наполненные хлорофиллом и каротиноидами, представляют собой светособирающие белки (запись PDB 1rwt ).
Чтобы воспользоваться этим свойством, фотосистемы имеют большие антенны из светопоглощающих молекул, которые собирают свет и передают свою энергию внутрь реакционного центра. Растения даже вырабатывают специальные светособирающие белки, которые находятся рядом с фотосистемами и помогают собирать свет. На рисунке показан вид сверху на фотосистему II (запись PDB 1s5l ), демонстрируя все светопоглощающие молекулы внутри. Центральная молекула хлорофилла реакционного центра показана стрелкой (обратите внимание на второй реакционный центр в нижней половине — фотосистема II состоит из двух одинаковых половинок). Маленькие треугольные молекулы сверху и снизу, наполненные хлорофиллом и каротиноидами, представляют собой светособирающие белки (запись PDB 1rwt ).Изучение структуры
Центр выделения кислорода фотосистемы II представляет собой сложный кластер ионов марганца (пурпурный), кальция (сине-зеленый) и атомов кислорода (красный).
 Он захватывает две молекулы воды и удаляет четыре электрона, образуя газообразный кислород и четыре иона водорода. Фактический сайт связывания двух молекул воды точно не известен, но в структуре PDB 1s5l ион бикарбоната связан с кластером, что дает ключ к пониманию местоположения активного центра. На рисунке показаны два атома кислорода из этого иона (окрашены синим цветом): один связан с ионом марганца, другой связан с ионом кальция. Обратите внимание, что центр выделения кислорода окружен гистидинами, аспартатами и глутаматами, которые удерживают его на месте. Тирозин, показанный в середине, образует идеальный мост между водным участком и светопоглощающим хлорофиллом.
Он захватывает две молекулы воды и удаляет четыре электрона, образуя газообразный кислород и четыре иона водорода. Фактический сайт связывания двух молекул воды точно не известен, но в структуре PDB 1s5l ион бикарбоната связан с кластером, что дает ключ к пониманию местоположения активного центра. На рисунке показаны два атома кислорода из этого иона (окрашены синим цветом): один связан с ионом марганца, другой связан с ионом кальция. Обратите внимание, что центр выделения кислорода окружен гистидинами, аспартатами и глутаматами, которые удерживают его на месте. Тирозин, показанный в середине, образует идеальный мост между водным участком и светопоглощающим хлорофиллом.Это изображение было создано с помощью RasMol. Вы можете создать похожие изображения, щелкнув здесь коды доступа и выбрав один из вариантов просмотра в 3D. Когда вы отправитесь исследовать эту увлекательную молекулу, будьте готовы к испытаниям. Это очень сложно, и вам нужно будет потратить некоторое время, чтобы понять это.
 Если вы хотите посмотреть только на реакционный центр, попробуйте отобразить небелковые остатки с номерами 1-8, 40 и 41, а также тирозин 161 цепи А.
Если вы хотите посмотреть только на реакционный центр, попробуйте отобразить небелковые остатки с номерами 1-8, 40 и 41, а также тирозин 161 цепи А.Ссылки
- Дж. Барбер (2003) Фотосистема II: двигатель жизни. Ежеквартальные обзоры биофизики 36, 71-89.
- К.Н. Феррейра, Т.М. Айверсон, К. Маглауи, Дж. Барбер и С. Ивата (2004) Архитектура фотосинтетического центра выделения кислорода. Наука 303, 1831-1838. Перспектива А.В. Резерфорд и А. Буссак в этом же номере (страницы 1782-1784) также очень полезны.
Ноябрь 2004 г., Дэвид Гудселл
doi:10.2210/rcsb_pdb/mom_2004_11
О PDB-101
PDB-101 помогает преподавателям, студентам и широкой публике исследовать трехмерный мир белков и нуклеиновых кислот. Изучение их разнообразных форм и функций помогает понять все аспекты биомедицины и сельского хозяйства, от синтеза белка до здоровья и болезней до биологической энергии.

Почему ПДБ-101? Исследователи со всего мира делают эти 3D-структуры бесплатными в архиве Protein Data Bank (PDB). PDB-101 содержит вводные материалы, которые помогут новичкам начать изучение предмета («101», как в курсе начального уровня), а также ресурсы для расширенного обучения.
RCSB PDB (цитата) размещен на сайте
RCSB PDB является членом
Фотобиоэлектрохимические элементы на основе интегрированной фотосистемы II
Abstract
Фотосинтез представляет собой устойчивый процесс преобразования световой энергии в химическую энергию. Значительные исследовательские усилия направлены на применение фотосинтетических реакционных центров, фотосистем I и II, в качестве активных компонентов для индуцированного светом производства электроэнергии или топливных продуктов. Тем не менее, не известно интегрированное фотобиоэлектрохимическое устройство, вырабатывающее электрическую энергию при облучении водного раствора, включающее два соединенных между собой электрода.
 Здесь мы сообщаем о сборке фотобиотопливных элементов, которые генерируют электричество при облучении функционализированных биоматериалом электродов в водных растворах. Клетки состоят из электрически контактирующих фотоанодов, функционализированных фотосистемой II, и электрически соединенного катода, модифицированного билирубиноксидазой/углеродными нанотрубками. Подсветка фотоанодов приводит к окислению воды до O 2 и переносом электронов по внешней цепи к катоду, где О 2 повторно восстанавливается до воды.
Здесь мы сообщаем о сборке фотобиотопливных элементов, которые генерируют электричество при облучении функционализированных биоматериалом электродов в водных растворах. Клетки состоят из электрически контактирующих фотоанодов, функционализированных фотосистемой II, и электрически соединенного катода, модифицированного билирубиноксидазой/углеродными нанотрубками. Подсветка фотоанодов приводит к окислению воды до O 2 и переносом электронов по внешней цепи к катоду, где О 2 повторно восстанавливается до воды.У вас есть полный доступ к этой статье через ваше учреждение.
Скачать PDF
Скачать PDF
Введение
Фотосинтез – это устойчивый эффективный и сложный процесс преобразования световой энергии в химическую энергию, хранящуюся в топливных продуктах 1,2,3,4 .
 Фотосинтетический аппарат работает за счет сопряженного возбуждения двух реакционных центров (РЦ), состоящих из фотосистем I и II, ФС1 и ФСII. Фотовозбуждение PSI приводит к переносу электрона на звенья ферредоксина, что в конечном итоге приводит к продукции НАДФН, активирующей цикл Кальвина, и фиксации CO 2 в сахарах 5 . Фотовозбуждение ФС II приводит к переносу электрона на хинон Q A , акцептор, который стимулирует восстановление пластохинона-9., который посредством ряда процессов переноса электронов регенерирует PSI. Окисленные соединения, образующиеся в ФСII, окисляют комплекс Mn 4 O 5 , который катализирует выделение кислорода, регенерируя центр ФСII 6,7 . В последнее время обширные исследовательские усилия были направлены на разработку фотоэлектрохимических или солнечных элементов, имитирующих фотосинтез 8,9,10,11,12,13 , или на применение природных фотосистем для питания фотоэлектрохимических элементов.
Фотосинтетический аппарат работает за счет сопряженного возбуждения двух реакционных центров (РЦ), состоящих из фотосистем I и II, ФС1 и ФСII. Фотовозбуждение PSI приводит к переносу электрона на звенья ферредоксина, что в конечном итоге приводит к продукции НАДФН, активирующей цикл Кальвина, и фиксации CO 2 в сахарах 5 . Фотовозбуждение ФС II приводит к переносу электрона на хинон Q A , акцептор, который стимулирует восстановление пластохинона-9., который посредством ряда процессов переноса электронов регенерирует PSI. Окисленные соединения, образующиеся в ФСII, окисляют комплекс Mn 4 O 5 , который катализирует выделение кислорода, регенерируя центр ФСII 6,7 . В последнее время обширные исследовательские усилия были направлены на разработку фотоэлектрохимических или солнечных элементов, имитирующих фотосинтез 8,9,10,11,12,13 , или на применение природных фотосистем для питания фотоэлектрохимических элементов. Например, сообщалось о солнечных элементах, сенсибилизированных красителем, которые включают синтетические фотосенсибилизаторы и ферменты, и полученные гибридные системы были реализованы для производства водородного топлива 9.0015 14 или фототоки 15 . Тем не менее, в этих системах катодные реакции не были напрямую связаны с продуктом, образующимся на фотоанодах, что приводило к образованию отходов. Кроме того, сообщалось о различных микробных фотобиотопливных элементах (PBFC), в которых используются цельноклеточные бактерии, которые при фотооблучении производят топливные продукты, обеспечивающие источник электроэнергии 16,17,18 .
Например, сообщалось о солнечных элементах, сенсибилизированных красителем, которые включают синтетические фотосенсибилизаторы и ферменты, и полученные гибридные системы были реализованы для производства водородного топлива 9.0015 14 или фототоки 15 . Тем не менее, в этих системах катодные реакции не были напрямую связаны с продуктом, образующимся на фотоанодах, что приводило к образованию отходов. Кроме того, сообщалось о различных микробных фотобиотопливных элементах (PBFC), в которых используются цельноклеточные бактерии, которые при фотооблучении производят топливные продукты, обеспечивающие источник электроэнергии 16,17,18 .Различные биоэлектрохимические устройства, использующие RC, PSI и/или PSII в качестве компонентов, использующих свет для активации PBFC, производящих фототоки 19,20,21,22 , или топливные продукты 23,24,25 . Эти ПБТЭ требуют иммобилизации и электрического контакта светоулавливающих компонентов с опорами электродов до такой степени, что фотоиндуцированные процессы переноса электронов происходят между фотосинтетическими РЦ, что позволяет генерировать фототоки (или использовать их для синтеза топливных продуктов).
 ). Электрический контакт окислительно-восстановительных белков с электродами привлек значительные исследовательские усилия, направленные на разработку амперометрических биосенсоров 26,27,28,29 или биотопливные элементы 30,31,32,33,34,35 . Были разработаны различные методы интеграции окислительно-восстановительных белков с электродами в конфигурациях с электрическим контактом, в том числе модификация белков релейными единицами 36,37 , восстановление белков на реле-кофакторных единицах 38,39,40 и иммобилизация белков в окислительно-восстановительных полимерных матрицах 41 . Связанные принципы были реализованы для электрического соединения PSII с поверхностями электродов. Например, ФС II был нанесен на монослой меркаптобензохинона, собранный на электроде из золота, для сенсорных приложений 9.0015 42 . Фотовозбуждение комплекса, имитирующего нативный комплекс PSII/Q A , приводило к эволюции O 2 с генерацией фототока.
). Электрический контакт окислительно-восстановительных белков с электродами привлек значительные исследовательские усилия, направленные на разработку амперометрических биосенсоров 26,27,28,29 или биотопливные элементы 30,31,32,33,34,35 . Были разработаны различные методы интеграции окислительно-восстановительных белков с электродами в конфигурациях с электрическим контактом, в том числе модификация белков релейными единицами 36,37 , восстановление белков на реле-кофакторных единицах 38,39,40 и иммобилизация белков в окислительно-восстановительных полимерных матрицах 41 . Связанные принципы были реализованы для электрического соединения PSII с поверхностями электродов. Например, ФС II был нанесен на монослой меркаптобензохинона, собранный на электроде из золота, для сенсорных приложений 9.0015 42 . Фотовозбуждение комплекса, имитирующего нативный комплекс PSII/Q A , приводило к эволюции O 2 с генерацией фототока. Точно так же ФС II электрически контактировал с поверхностями электродов путем его иммобилизации в полимерных гидрогелях, состоящих из комплекса Os(II/III)-полипиридин, в качестве ретрансляторов переноса электронов 43 . Электрическая проводка ФСИ с электродами была продемонстрирована восстановлением нативной ФСИ, из которой витамин К 1 был исключен, на синтетический акцептор хинона, связанный с функционализированным электродом посредством электростатических взаимодействий 44 . Точно так же наночастицы Au или Pt (NP), модифицированные кластером железо-сера, были преобразованы в апо-PSI, что привело к связыванию и эволюции H 2 с помощью гибридной системы 45 . Кроме того, генно-инженерные фотосинтетические РЦ были ориентированы в конфигурации монослоя на подложках электродов с использованием комплекса His-tag Ni-NTA, и отслеживались результирующие фототоки в присутствии электронного медиатора 46,47 . Кроме того, выравнивание PSI на поверхности электродов было достигнуто с помощью сшитых бис-анилином нанокластеров Pt 48 или с использованием окислительно-восстановительных полимерных матриц в качестве реле переноса электронов 21 .
Точно так же ФС II электрически контактировал с поверхностями электродов путем его иммобилизации в полимерных гидрогелях, состоящих из комплекса Os(II/III)-полипиридин, в качестве ретрансляторов переноса электронов 43 . Электрическая проводка ФСИ с электродами была продемонстрирована восстановлением нативной ФСИ, из которой витамин К 1 был исключен, на синтетический акцептор хинона, связанный с функционализированным электродом посредством электростатических взаимодействий 44 . Точно так же наночастицы Au или Pt (NP), модифицированные кластером железо-сера, были преобразованы в апо-PSI, что привело к связыванию и эволюции H 2 с помощью гибридной системы 45 . Кроме того, генно-инженерные фотосинтетические РЦ были ориентированы в конфигурации монослоя на подложках электродов с использованием комплекса His-tag Ni-NTA, и отслеживались результирующие фототоки в присутствии электронного медиатора 46,47 . Кроме того, выравнивание PSI на поверхности электродов было достигнуто с помощью сшитых бис-анилином нанокластеров Pt 48 или с использованием окислительно-восстановительных полимерных матриц в качестве реле переноса электронов 21 . Хотя в этих системах была продемонстрирована генерация фототоков, во всех случаях в качестве стока (или источника) электронов использовался потенциостат, а для генерации стационарных токов в систему должны были быть включены жертвенные доноры или акцепторы электронов. На сегодняшний день не известно интегрированное фотобиоэлектрохимическое устройство (биофотоэлектрический элемент), вырабатывающее электрическую энергию при освещении двух соединенных между собой электродов.
Хотя в этих системах была продемонстрирована генерация фототоков, во всех случаях в качестве стока (или источника) электронов использовался потенциостат, а для генерации стационарных токов в систему должны были быть включены жертвенные доноры или акцепторы электронов. На сегодняшний день не известно интегрированное фотобиоэлектрохимическое устройство (биофотоэлектрический элемент), вырабатывающее электрическую энергию при освещении двух соединенных между собой электродов.Здесь мы сообщаем о сборке интегрированного PBFC, состоящего из электрода, модифицированного PSII, действующего как фотоанод для фотоиндуцированного окисления H 2 O в O 2 , и билирубиноксидазы/углеродных нанотрубок (BOD /CNTs)-функционализированный электрод, действующий как катод для восстановления O 2 до H 2 O. Освещение этой ячейки приводит к образованию электричества в отсутствие какого-либо добавленного жертвенного реагента.
Результаты
Фотобиоэлектрохимическая ячейка на основе полимера ФС II/бензохинона
Мы внедрили ФСII, выделенный из термофильной цианобактерии Mastigocladus laminosus (дополнительные рисунки S1–S4).
 Схема ПБТЭ представлена на рис. 1. Фотоанод был изготовлен путем первичной электрополимеризации меркаптобензохинона на поверхности Au, эффективная освещенная площадь около 0,13 см 2 . Полученная поли(меркапто- p -бензохинон), pMBQ, матрица показала квазиобратимую окислительно-восстановительную волну при E °’=-0,05 В по сравнению с каломельным электродом, насыщенным KCl (SCE), pH=7,4. Текущее пиковое значение окислительно-восстановительной волны показало линейную зависимость от скорости сканирования, что соответствует окислительно-восстановительной системе, ограниченной поверхностью. Покрытие поверхности хиноновыми звеньями на электроде соответствовало 4,7×10 -9 моль см -2 (электрохимическую характеристику матрицы pMBQ см. Дополнительный рисунок S5). Затем ФСII наносили на хиноновый слой с расчетом на то, что хинонные звенья будут связываться с участком Q B ФСII и действовать как электронные посредники, которые электрически связывают ФСII с электродом.
Схема ПБТЭ представлена на рис. 1. Фотоанод был изготовлен путем первичной электрополимеризации меркаптобензохинона на поверхности Au, эффективная освещенная площадь около 0,13 см 2 . Полученная поли(меркапто- p -бензохинон), pMBQ, матрица показала квазиобратимую окислительно-восстановительную волну при E °’=-0,05 В по сравнению с каломельным электродом, насыщенным KCl (SCE), pH=7,4. Текущее пиковое значение окислительно-восстановительной волны показало линейную зависимость от скорости сканирования, что соответствует окислительно-восстановительной системе, ограниченной поверхностью. Покрытие поверхности хиноновыми звеньями на электроде соответствовало 4,7×10 -9 моль см -2 (электрохимическую характеристику матрицы pMBQ см. Дополнительный рисунок S5). Затем ФСII наносили на хиноновый слой с расчетом на то, что хинонные звенья будут связываться с участком Q B ФСII и действовать как электронные посредники, которые электрически связывают ФСII с электродом. ФСII, связанный с полимером, впоследствии был сшит бис[сульфосукцинимидил] субератом (BS 3 ) с получением интегрированного фотоанода. Микрогравиметрические измерения микробаланса кристаллов кварца показали покрытие поверхности PSII, которое соответствовало 1,5×10 -12 моль см -2 . Зная размеры PSII 7 , это значение соответствует примерно 53% случайного плотно упакованного монослоя. На рис. 2а представлены спектры действия фототока при освещении электрода в чистом буферном растворе. Фотоиндуцированный хинон-опосредованный перенос электрона на электрод и сопутствующее окисление воды до O 2 дают наблюдаемый фототок. Спектр действия фототока, как и ожидалось, повторяет спектральные характеристики ФС II. Кроме того, интенсивность фототока регулируется продолжительностью процесса электроосаждения, применяемого для полимеризации полимера. Фототоки усиливаются при подаче потенциала электрополимеризации (0,6 В относительно SCE) в течение 50-минутного интервала времени, а затем выравниваются до значения насыщения.
ФСII, связанный с полимером, впоследствии был сшит бис[сульфосукцинимидил] субератом (BS 3 ) с получением интегрированного фотоанода. Микрогравиметрические измерения микробаланса кристаллов кварца показали покрытие поверхности PSII, которое соответствовало 1,5×10 -12 моль см -2 . Зная размеры PSII 7 , это значение соответствует примерно 53% случайного плотно упакованного монослоя. На рис. 2а представлены спектры действия фототока при освещении электрода в чистом буферном растворе. Фотоиндуцированный хинон-опосредованный перенос электрона на электрод и сопутствующее окисление воды до O 2 дают наблюдаемый фототок. Спектр действия фототока, как и ожидалось, повторяет спектральные характеристики ФС II. Кроме того, интенсивность фототока регулируется продолжительностью процесса электроосаждения, применяемого для полимеризации полимера. Фототоки усиливаются при подаче потенциала электрополимеризации (0,6 В относительно SCE) в течение 50-минутного интервала времени, а затем выравниваются до значения насыщения. Дальнейшее приложение потенциала в течение 15 мин вызывало уменьшение фототока на 20%. Влияние временного интервала электрополимеризации на результирующие фототоки можно объяснить функциями переноса заряда полимерной матрицы в улучшении эффективности электрического контакта ФС II с электродом. На первой фазе электрополимеризации (до 50 мин) происходит оптимальное покрытие электрода зарядотранспортной полимерной пленкой. Увеличение толщины полимера за счет дальнейшей электрополимеризации нарушает зарядотранспортные свойства пленки из-за наличия дефектов в полимерной матрице, что приводит к снижению значений фототока.
Дальнейшее приложение потенциала в течение 15 мин вызывало уменьшение фототока на 20%. Влияние временного интервала электрополимеризации на результирующие фототоки можно объяснить функциями переноса заряда полимерной матрицы в улучшении эффективности электрического контакта ФС II с электродом. На первой фазе электрополимеризации (до 50 мин) происходит оптимальное покрытие электрода зарядотранспортной полимерной пленкой. Увеличение толщины полимера за счет дальнейшей электрополимеризации нарушает зарядотранспортные свойства пленки из-за наличия дефектов в полимерной матрице, что приводит к снижению значений фототока.Рисунок 1: Схема фотоэлектрохимической ячейки поли(меркапто- p -бензохинон)/фотосистема II/билирубиноксидаза/углеродные нанотрубки.
Структура белка была первоначально опубликована в ref. 60. Авторское право, Американское общество биохимии и молекулярной биологии. На вставках изображены энергетические диаграммы, связанные с компонентами ячейки.

Изображение полного размера
Рис. 2: Работа анода поли(меркапто- п -бензохинон)/фотосистема II.
( a ) Спектры действия фототока, соответствующие аноду pMBQ/PSII после электрополимеризации при E =0,6 В по сравнению с насыщенным каломельным электродом (SCE) для: (i) 500, (ii) 1000, (iii) 2000 и (iv) 3000 с. ( b ) Зависимость фототока от внешнего потенциала, приложенного к аноду pMBQ/PSII. P =0,10 Вт, λ >400 нм. ( c ) Реакция фототока анода pMBQ/PSII на повторяющиеся циклы освещения и темноты. Примененный потенциал E =0,15 В относительно SCE, P =0,10 Вт (интенсивность мощности лампы при λ >400 нм). ( d ) Реакция фототока анода pMBQ/PSII на повторяющиеся циклы освещения (при различной интенсивности) и темноты. Освещение, λ >400 нм, интенсивность: (i) P = 0,04, (ii) P = 0,07 и (iii) P = 0,10 Вт. Приложенный потенциал: E = 0,15 В по сравнению с SCE.
 Все измерения проводили в фосфатном буферном растворе (0,1 М, рН=7,4).
Все измерения проводили в фосфатном буферном растворе (0,1 М, рН=7,4).Изображение в полный размер
Влияние приложенного потенциала на результирующий фототок показано на рис. 2б. Хотя при потенциалах выше E =0,0 В по сравнению с SCE фототоки имеют высокое значение, >300 нА, снижение приложенного потенциала ниже E =0,0 В резко снижает фототоки. Это согласуется с окислительно-восстановительным потенциалом матрицы pMBQ, E°’~-0,05 В по сравнению с SCE. При положительных потенциалах релейные звенья сохраняются в окисленном хиноидном состоянии, и, таким образом, фотоиндуцированный перенос электронов сопровождается непосредственной перекачкой электронов с релейных звеньев на электрод (ФСII соединен с электродом с помощью полимера pMBQ). Этот векторный перенос электронов сводит к минимуму реакции обратного переноса электронов и приводит к высоким фототокам. Когда потенциал становится отрицательным, релейные звенья переходят в гидрохиноновое состояние, не принимающее электроны от ФСII.
 В результате нарушается перенос электронов от белка к электроду, что приводит к рекомбинации электронно-дырочных частиц и значительному снижению фототоков. На рис. 2в показана переключаемая генерация фототока при циклическом включении-выключении освещения фотоанода. Очевидно, интенсивность фототока определяется интенсивностью света, используемого для освещения фотоанода (рис. 2г).
В результате нарушается перенос электронов от белка к электроду, что приводит к рекомбинации электронно-дырочных частиц и значительному снижению фототоков. На рис. 2в показана переключаемая генерация фототока при циклическом включении-выключении освещения фотоанода. Очевидно, интенсивность фототока определяется интенсивностью света, используемого для освещения фотоанода (рис. 2г).Катод фотобиоэлектрохимической ячейки состоял из композита БПК и окисленных УНТ, нанесенных на стеклоуглеродный (СУ) электрод. Было обнаружено, что отложение БПК на УНТ приводит к электрическому контакту фермента с объемным электродом, что приводит к биоэлектрокаталитическому восстановлению O 2 до воды (см. Дополнительный рисунок S6). Эти биоэлектрокаталитические функции БПК/УНТ ранее применялись для разработки биотопливных элементов с использованием глюкозы 49,50 или этанола 49 в качестве топлива. Соответственно, фотоанод pMBQ/PSII был соединен с катодом БПК/УНТ (рис.
 1). Облучение фотоанода на воздухе приводило к образованию фототока. Вольтамперная кривая разряда фотоэлектрохимического элемента при переменных сопротивлениях представлена на рис. 3а, а выходная мощность — на рис. 3б. Контрольные эксперименты показали, что мельчайшие токи генерировались в темноте. Кроме того, облучение системы в инертной атмосфере аргона привело к небольшому току, что может быть связано с образованием O 2 на фотоаноде или его возможной утечке в систему. В дальнейшем эксперименте термическая денатурация БПК блокировала формирование фототока при облучении системы под O 2 . Эти контрольные эксперименты показывают, что фотоанод pMBQ/PSII и катод БПК/УНТ действительно образуют единую систему, в которой фотоокисление воды до O 2 протекает на аноде одновременно с восстановлением O 2 на катоде. . Кроме того, ток, генерируемый системой, оставался довольно постоянным в течение 3 часов непрерывного облучения, а затем снижался на 15% при облучении в течение 10 часов.
1). Облучение фотоанода на воздухе приводило к образованию фототока. Вольтамперная кривая разряда фотоэлектрохимического элемента при переменных сопротивлениях представлена на рис. 3а, а выходная мощность — на рис. 3б. Контрольные эксперименты показали, что мельчайшие токи генерировались в темноте. Кроме того, облучение системы в инертной атмосфере аргона привело к небольшому току, что может быть связано с образованием O 2 на фотоаноде или его возможной утечке в систему. В дальнейшем эксперименте термическая денатурация БПК блокировала формирование фототока при облучении системы под O 2 . Эти контрольные эксперименты показывают, что фотоанод pMBQ/PSII и катод БПК/УНТ действительно образуют единую систему, в которой фотоокисление воды до O 2 протекает на аноде одновременно с восстановлением O 2 на катоде. . Кроме того, ток, генерируемый системой, оставался довольно постоянным в течение 3 часов непрерывного облучения, а затем снижался на 15% при облучении в течение 10 часов. Зная покрытие поверхности ФСII и плотность тока при максимальной мощности ячейки, мы оцениваем скорость оборота электронного переноса между ФСII и электродом как 518 е − с −1 . Это значение очень похоже на скорость оборота, наблюдаемую для ФС II в конфигурации монослоя 51 , что свидетельствует о том, что иммобилизация ФС II на полимерной матрице не влияет на его активность. ФСII, выделенный из термофильных бактерий, показал обнадеживающую стабильность, отражаемую снижением активности примерно на 20% при хранении при 4°С в течение 2 недель. Это говорит о том, что будущая иммобилизация PSII в защитных полимерных матрицах или дальнейшие генетические манипуляции с ним могут привести к стабильным конфигурациям клеток. Квантовый выход генерации фототока при λ =675 нм соответствует 1,0%. В предыдущих исследованиях сообщалось о фотосинтезирующих фотоэлектрохимических ячейках, которые показали эффективность фотопреобразования в диапазоне 0,2–3,3% (ссылки 52, 53).
Зная покрытие поверхности ФСII и плотность тока при максимальной мощности ячейки, мы оцениваем скорость оборота электронного переноса между ФСII и электродом как 518 е − с −1 . Это значение очень похоже на скорость оборота, наблюдаемую для ФС II в конфигурации монослоя 51 , что свидетельствует о том, что иммобилизация ФС II на полимерной матрице не влияет на его активность. ФСII, выделенный из термофильных бактерий, показал обнадеживающую стабильность, отражаемую снижением активности примерно на 20% при хранении при 4°С в течение 2 недель. Это говорит о том, что будущая иммобилизация PSII в защитных полимерных матрицах или дальнейшие генетические манипуляции с ним могут привести к стабильным конфигурациям клеток. Квантовый выход генерации фототока при λ =675 нм соответствует 1,0%. В предыдущих исследованиях сообщалось о фотосинтезирующих фотоэлектрохимических ячейках, которые показали эффективность фотопреобразования в диапазоне 0,2–3,3% (ссылки 52, 53). Тем не менее, в этих системах реализованы целые фотосинтезирующие клетки и диффузионные медиаторы переноса электронов. Преимущества нашей системы заключаются в том, что компоненты полностью интегрированы с держателями электродов, а медиатор диффузионного переноса электронов не должен растворяться в растворе электролита. Кроме того, сенсибилизированные красителем солнечные элементы обеспечивают альтернативную конфигурацию для преобразования световой энергии в электрическую 9.0015 54 . Этот метод значительно усовершенствовался за последние два десятилетия, и сообщалось об эффективности до 12% 55 . Эти системы включают, однако, диффузионный медиатор, которого нет в нашей клетке. Кроме того, можно использовать парадигму осаждения с большой площадью поверхности, существующую в сенсибилизированных красителем солнечных элементах, для иммобилизации биокомпонентов ФСII и БПК для повышения эффективности фотопреобразования.
Тем не менее, в этих системах реализованы целые фотосинтезирующие клетки и диффузионные медиаторы переноса электронов. Преимущества нашей системы заключаются в том, что компоненты полностью интегрированы с держателями электродов, а медиатор диффузионного переноса электронов не должен растворяться в растворе электролита. Кроме того, сенсибилизированные красителем солнечные элементы обеспечивают альтернативную конфигурацию для преобразования световой энергии в электрическую 9.0015 54 . Этот метод значительно усовершенствовался за последние два десятилетия, и сообщалось об эффективности до 12% 55 . Эти системы включают, однако, диффузионный медиатор, которого нет в нашей клетке. Кроме того, можно использовать парадигму осаждения с большой площадью поверхности, существующую в сенсибилизированных красителем солнечных элементах, для иммобилизации биокомпонентов ФСII и БПК для повышения эффективности фотопреобразования.Рисунок 3: Разряд фотобиотопливного элемента поли(меркапто- p -бензохинон)/фотосистема II/билирубиноксидаза/углеродные нанотрубки.

Кривая разряда (поляризации) элемента ( a ) и зависимость мощности элемента ( b ) от плотности тока разряда фотобиотопливного элемента pMBQ/PSII/BOD/CNTs. P =0,10 Вт, λ >400 нм. Измерения проводились на воздухе и с использованием переменных внешних сопротивлений. Электролитом служил фосфатный буфер (0,1 М, рН=7,4).
Изображение полного размера
A Фотобиоэлектрохимическая ячейка ФСII/бис-анилин-сшитые НЧ Au
Наш подход был расширен для создания интегрированного фотоанода, состоящего из сшитых бис-анилином наночастиц золота и ФСII, рис. 4а. Наночастицы золота диаметром 3,5 нм, модифицированные меркаптоэтансульфокислотой и меркаптоанилином, были электрополимеризованы на поверхности золота, модифицированной монослоем меркаптоанилина 56,57,58 . ФС II был нанесен на композит Au NPs, а затем ФС II был сшит с BS 3 для получения интегрированного электрода (покрытие поверхности примерно 8,5×10 -13 моль см -2 ).
 Бисанилиновые мостиковые звенья проявляют квазиобратимые окислительно-восстановительные свойства, E°~0,1 В по сравнению с SCE при pH=7,4, и окисляются при E >0,1 В до состояния хиноидного акцептора электронов. На рисунке 4b показан спектр действия фототока, генерируемого электродом, а на дополнительном рисунке S7 показано влияние приложенного потенциала на результирующий фототок. Видно, что при потенциалах E >0,1 В, где мостиковые звенья находятся в хиноидном состоянии, наблюдаются высокие значения фототока, тогда как при потенциалах ниже E =0,1 В, обнаружено резкое уменьшение фототока. Эти результаты согласуются с тем фактом, что хиноидное акцепторное состояние мостиковых единиц действует как проводное реле для передачи электронов от ФС II к электроду. Встроенный фотоанод был соединен с катодом БПК/УНТ для получения соответствующего ПБТЭ. На рис. 4в показан спектр действия фототока клетки. Выходная мощность при различных внешних сопротивлениях показана на рис.
Бисанилиновые мостиковые звенья проявляют квазиобратимые окислительно-восстановительные свойства, E°~0,1 В по сравнению с SCE при pH=7,4, и окисляются при E >0,1 В до состояния хиноидного акцептора электронов. На рисунке 4b показан спектр действия фототока, генерируемого электродом, а на дополнительном рисунке S7 показано влияние приложенного потенциала на результирующий фототок. Видно, что при потенциалах E >0,1 В, где мостиковые звенья находятся в хиноидном состоянии, наблюдаются высокие значения фототока, тогда как при потенциалах ниже E =0,1 В, обнаружено резкое уменьшение фототока. Эти результаты согласуются с тем фактом, что хиноидное акцепторное состояние мостиковых единиц действует как проводное реле для передачи электронов от ФС II к электроду. Встроенный фотоанод был соединен с катодом БПК/УНТ для получения соответствующего ПБТЭ. На рис. 4в показан спектр действия фототока клетки. Выходная мощность при различных внешних сопротивлениях показана на рис. 4в, вставка. Квантовый выход, при λ = 675 нм, что соответствует примерно 0,7%. Следует отметить, что, несмотря на пористую морфологию, связанную с бисанилин-сшитым композитом наночастиц Au, загрузка ФСII на эту матрицу примерно на 45% ниже по сравнению с пленкой pMBQ/ФСII. Это может быть связано с повышенной аффинностью связывания бензохиноновых звеньев с сайтом Q B ФСII, что позволяет концентрировать фотоактивный компонент на поверхности.
4в, вставка. Квантовый выход, при λ = 675 нм, что соответствует примерно 0,7%. Следует отметить, что, несмотря на пористую морфологию, связанную с бисанилин-сшитым композитом наночастиц Au, загрузка ФСII на эту матрицу примерно на 45% ниже по сравнению с пленкой pMBQ/ФСII. Это может быть связано с повышенной аффинностью связывания бензохиноновых звеньев с сайтом Q B ФСII, что позволяет концентрировать фотоактивный компонент на поверхности.Рис. 4. Работа фотоанода и биотопливного элемента на основе наночастиц Au/фотосистемы II, сшитых бис-анилином.
( a ) Схематическое представление сшитого бисанилин-анилином анода Au NPs/PSII. ( b ) Спектр действия фототока, соответствующий бисанилин-сшитому аноду Au NPs/PSII. ( c ) Кривая разряда (поляризации) элемента для фотобиотопливного элемента с бисанилин-сшитыми наночастицами золота/ФСII/билирубиноксидазой/углеродными нанотрубками (БПК/УНТ). Вставка: зависимость мощности ячейки от плотности разрядного тока.
 P =0,1 Вт, λ >400 нм. Измерения проводились на воздухе и с использованием переменных внешних сопротивлений. Электролитом служил фосфатный буфер (0,1 М, рН=7,4).
P =0,1 Вт, λ >400 нм. Измерения проводились на воздухе и с использованием переменных внешних сопротивлений. Электролитом служил фосфатный буфер (0,1 М, рН=7,4).Изображение полного размера
Обсуждение
В настоящем исследовании представлен новый подход к созданию интегрированных фотобиоэлектрохимических ячеек. Новизна системы заключается в том, что облучение функционализированных биоматериалом электродов в водном растворе приводит к выработке электроэнергии без добавления какого-либо расходуемого реагента. Системы состоят из электрически подключенного фотоанода PSII, который фотоиндуцирует инжекцию электронов в электрод при окислении воды до O 9 .0011 2 . Электроны, введенные в электрод, используются для биокаталитического восстановления O 2 на катоде (который состоит из электрически связанного БПК). Результирующие фототоки и электрическая мощность, однако, довольно низкие по трем основным возможным причинам: (i) поверхностное покрытие ФСII на фотоаноде низкое и соответствует 1,5×10 -12 моль см -2 (для системы pMBQ/ФСII) и 8,5×10 -13 моль см -2 (для системы бисанилин-сшитые НЧ Au/ФСII).
 Эти значения соответствуют примерно 53 и 30% покрытия случайного плотно упакованного монослоя ФСII в двух системах соответственно. (ii) Звенья ФС II не оптимально ориентированы на матрицах хинона (или наночастиц золота с бис-анилиновым мостиком), и, таким образом, электрический контакт ФС II с электродами не оптимизирован. В результате перенос заряда на электроды неэффективно конкурирует с реакциями рекомбинации в ФСII. (iii) Разность потенциалов между анодом и катодом ячейки относительно невелика, и существенная потеря потенциала сопровождает перенос электрона от ФС II к окислительно-восстановительному полимеру. Эти ограничения можно устранить, увеличив содержание ФСII на фотоаноде и повысив эффективность электрического соединения между ФСII и электродом 9.0015 13 . Содержание ФС II на электроде может быть увеличено за счет создания многослойных слоев ФС II, находящихся в электрическом контакте, или за счет придания шероховатости поверхности электрода. Повышение эффективности электрической проводки между ФС II и электродом может быть достигнуто за счет наноинженерии и выравнивания ФС II на единицах медиатора заряда, например, путем восстановления 40 белка на единицах хинона.
Эти значения соответствуют примерно 53 и 30% покрытия случайного плотно упакованного монослоя ФСII в двух системах соответственно. (ii) Звенья ФС II не оптимально ориентированы на матрицах хинона (или наночастиц золота с бис-анилиновым мостиком), и, таким образом, электрический контакт ФС II с электродами не оптимизирован. В результате перенос заряда на электроды неэффективно конкурирует с реакциями рекомбинации в ФСII. (iii) Разность потенциалов между анодом и катодом ячейки относительно невелика, и существенная потеря потенциала сопровождает перенос электрона от ФС II к окислительно-восстановительному полимеру. Эти ограничения можно устранить, увеличив содержание ФСII на фотоаноде и повысив эффективность электрического соединения между ФСII и электродом 9.0015 13 . Содержание ФС II на электроде может быть увеличено за счет создания многослойных слоев ФС II, находящихся в электрическом контакте, или за счет придания шероховатости поверхности электрода. Повышение эффективности электрической проводки между ФС II и электродом может быть достигнуто за счет наноинженерии и выравнивания ФС II на единицах медиатора заряда, например, путем восстановления 40 белка на единицах хинона. Разность потенциалов между анодом и катодом и, следовательно, выходную мощность фотобиоэлектрохимической ячейки можно улучшить путем химической настройки окислительно-восстановительного потенциала, связанного с окислительно-восстановительным полимером, опосредующим электроны, до значения, близкого к потенциал Q Б сайт.
Разность потенциалов между анодом и катодом и, следовательно, выходную мощность фотобиоэлектрохимической ячейки можно улучшить путем химической настройки окислительно-восстановительного потенциала, связанного с окислительно-восстановительным полимером, опосредующим электроны, до значения, близкого к потенциал Q Б сайт.Методы
Химические вещества
БПК (К.С. 1.3.3.5, из Myrothecium Verrucaria , активность 5 U мг -1 твердого вещества) был приобретен у Sigma. Фермент использовали без дополнительной очистки. Одностенные УНТ, ОУНТ, со средним диаметром около 2 нм были приобретены у Nanoport (Шэньчжэнь, Китай). ОУНТ кипятили с обратным холодильником в 2,5 М HNO -3- в течение 10 ч, затем промывали водой и осаждали с помощью центрифуги до получения средней длины 2 мкм. На протяжении всей работы использовалась сверхчистая вода из источника Nanopure (Barnstead).
Меркаптобензохинон, MBQ, был синтезирован в соответствии с описанным ранее методом 59 .
 НЧ Au, функционализированные 2-меркаптоэтансульфоновой кислотой и p -аминотиофенолом, получали в соответствии с ранее описанной процедурой 56 . Средний размер НЧ, оцененный с помощью просвечивающего электронного микроскопа, составил 3,5 нм.
НЧ Au, функционализированные 2-меркаптоэтансульфоновой кислотой и p -аминотиофенолом, получали в соответствии с ранее описанной процедурой 56 . Средний размер НЧ, оцененный с помощью просвечивающего электронного микроскопа, составил 3,5 нм.Экстракция и очистка ФС II
Около 60 г термофильной цианобактерии Mastigocladus laminosus 9Клетки 0024 суспендировали в буфере А (50 мМ MES-NaOH, pH=6,5, 20% глицерина, 5 мМ CaCl 2 , 5 мМ MgCl 2 и 1 мМ смеси ингибиторов протеаз, содержащей аминокапроновую кислоту, бензамидин). и фенилметилсульфонилфторид) и разрушали при 4 °C с помощью пяти циклов Bead Beater (Biospec Products) (20-секундное перемешивание и 5-минутная пауза) с использованием стеклянных шариков размером 0,1–1,0 мм. После отделения сломанных клеток от шариков целые клетки и клеточный дебрис удаляли из зеленого раствора центрифугированием в течение 2 мин при 2000 об/мин. Тилакоидные мембраны осаждали из полученного супернатанта ультрацентрифугированием при 35000 об/мин.
 в роторе Ti-50 в течение 20 мин. Зеленый осадок дважды промывали буфером Б (буфер А, содержащий дополнительно 5 мМ CaCl 9 ).0011 2 ) и отделяют центрифугированием при 35 000 об/мин.
в роторе Ti-50 в течение 20 мин. Зеленый осадок дважды промывали буфером Б (буфер А, содержащий дополнительно 5 мМ CaCl 9 ).0011 2 ) и отделяют центрифугированием при 35 000 об/мин.PSII экстрагировали и очищали путем гомогенизации тилакоидов в буфере C (40 мМ MES-NaOH, pH=6,0, 5% глицерина и 0,02% n -додецил β-D-мальтозида) до концентрации хлорофилла 1,6 мг мл. −1 . Добавляли н -Додецил β-D-мальтозид до конечной концентрации 0,6% и раствор перемешивали при комнатной температуре в течение 20 мин. После 100 мин ультрацентрифугирования при 50 000 об/мин. в роторе Ti-70 (при 4 °С) полученный супернатант фильтровали через фильтр 0,45 мкм и к отфильтрованному раствору добавляли эквивалентный объем 24% буфера D (буфер С, содержащий 50 мМ MgSO 4 ). Раствор загружали (15 мл мин -1 ) в анионообменную колонку TSK Toyo Pearl DEAE 650 для жидкостной хроматографии с быстрым белком (2,5 × 35 см 2 ), предварительно промытую 24% буфером D (дополнительный рисунок S1).
 Нагруженную колонку промывали в AKTA explorer (Amersham Pharmacia Biotech) с 2 объемами колонки (CV) 24% буфера D. После изократической стадии до 50% буфера D (0,5 CV) линейный градиент от 50 до 80% буфера D был запущен в 3 CV. Затем колонку промывали 3,5 CV 100% B. Элюирование с колонки проводили при 10 мл мин −1 . Фикобилипротеины (PBP) элюировали из колонки во время стадии промывки, а PSII получали при остром пике элюции при 50–65% буфера D. PSI элюировали из колонки при самой высокой применяемой концентрации MgSO 4 (100% буфер Б). Полученные PSII и PSI были проанализированы с помощью: ультрафиолетовой-видимой спектроскопии (дополнительный рисунок S2); Deriphat NativePAGE (дополнительный рисунок S3); и SDS-PAGE, в котором различные комплексы были полностью денатурированы (дополнительная рис. S4).
Нагруженную колонку промывали в AKTA explorer (Amersham Pharmacia Biotech) с 2 объемами колонки (CV) 24% буфера D. После изократической стадии до 50% буфера D (0,5 CV) линейный градиент от 50 до 80% буфера D был запущен в 3 CV. Затем колонку промывали 3,5 CV 100% B. Элюирование с колонки проводили при 10 мл мин −1 . Фикобилипротеины (PBP) элюировали из колонки во время стадии промывки, а PSII получали при остром пике элюции при 50–65% буфера D. PSI элюировали из колонки при самой высокой применяемой концентрации MgSO 4 (100% буфер Б). Полученные PSII и PSI были проанализированы с помощью: ультрафиолетовой-видимой спектроскопии (дополнительный рисунок S2); Deriphat NativePAGE (дополнительный рисунок S3); и SDS-PAGE, в котором различные комплексы были полностью денатурированы (дополнительная рис. S4).Дополнительный рисунок S2 показывает, что спектр ФС II (красный след) демонстрирует пик поглощения 673 нм, тогда как спектр ФС (синий след) демонстрирует пик 680 нм.
 Последнее указывало на высокую чистоту выделенных комплексов ФСII и ФСI. Для его дальнейшей характеристики были проведены анализы нативного и денатурированного ПААГ. Нативный 6% акриламидный гель подвергали электрофорезу в присутствии дерифата. На дополнительном рисунке S3 показано, что, когда гель подвергается воздействию ультрафиолетового света, ФСII (как в его мономерной (м), так и в димерной (г) формах) сильно флуоресцирует, тогда как полученный тримерный (т) ФСI не флуоресцирует. Хотя нативный гель дополнительно продемонстрировал высокую чистоту каждого из комплексов, наиболее надежное доказательство было получено при денатурированном электрофорезе в ПААГ с использованием 12,5% акриламида. Дополнительный рисунок S4 ясно показывает, что комплекс PSII содержит типичные субъединицы PSII (например, CP47, CP43, D1, D2 и т. д.), тогда как PSI содержит его типичные субъединицы (например, PsaA/B, PsaD и т. д.) . Более того, как показывает дополнительный рисунок S4, перекрестного загрязнения между двумя комплексами не существует.
Последнее указывало на высокую чистоту выделенных комплексов ФСII и ФСI. Для его дальнейшей характеристики были проведены анализы нативного и денатурированного ПААГ. Нативный 6% акриламидный гель подвергали электрофорезу в присутствии дерифата. На дополнительном рисунке S3 показано, что, когда гель подвергается воздействию ультрафиолетового света, ФСII (как в его мономерной (м), так и в димерной (г) формах) сильно флуоресцирует, тогда как полученный тримерный (т) ФСI не флуоресцирует. Хотя нативный гель дополнительно продемонстрировал высокую чистоту каждого из комплексов, наиболее надежное доказательство было получено при денатурированном электрофорезе в ПААГ с использованием 12,5% акриламида. Дополнительный рисунок S4 ясно показывает, что комплекс PSII содержит типичные субъединицы PSII (например, CP47, CP43, D1, D2 и т. д.), тогда как PSI содержит его типичные субъединицы (например, PsaA/B, PsaD и т. д.) . Более того, как показывает дополнительный рисунок S4, перекрестного загрязнения между двумя комплексами не существует. Чистые комплексы ФС II использовали для конструирования фотобиоэлектрохимических ячеек.
Чистые комплексы ФС II использовали для конструирования фотобиоэлектрохимических ячеек.Модификация электродов
Модифицированные pMBQ/PSII Au-электроды: чистые покрытые золотом предметные стекла (от Nunc International, Рочестер, США) реагировали с водным раствором MBQ, 10 мМ, в течение 5 часов. Электрополимеризацию МБХ, 0,2 мг мл -1 , растворенного в фосфатном буфере, РВ (0,1 М, рН=7,4), затем проводили на предметных стеклах, функционализированных МБХ, путем приложения постоянного потенциала, Е =0,6 В по сравнению с SCE, для фиксированных интервалов времени. После процесса электрополимеризации электроды промывали ФБ и реагировали со 100 мкл ФС II (1 мг хл мл −1 ). Полученные электроды, модифицированные pMBQ/PSII, сшивали с BS 3 , 0,01 мг/мл -1 в течение 30 минут и промывали PB.
Сшитые бис-анилином электроды Au NPs/PSII: чистые предметные стекла, покрытые золотом, реагировали с p -аминотиофенолом, 10 мМ, в этаноле в течение 5 часов.
 Затем слайды, функционализированные тиоанилином, подвергали электрополимеризации в присутствии модифицированных тиоанилином наночастиц Au с использованием фиксированного количества повторяющихся циклических вольтамперометрических сканирований в диапазоне от -0,1 до 1,1 В по сравнению с SCE и при скорости сканирования 100 мВ с −1 . После процесса электрополимеризации электроды промывали ФБ и реагировали с ФС II (1 мг хл мл -1 ). Полученные электроды сшивали BS -3- в течение 30 мин и промывали ФБ.
Затем слайды, функционализированные тиоанилином, подвергали электрополимеризации в присутствии модифицированных тиоанилином наночастиц Au с использованием фиксированного количества повторяющихся циклических вольтамперометрических сканирований в диапазоне от -0,1 до 1,1 В по сравнению с SCE и при скорости сканирования 100 мВ с −1 . После процесса электрополимеризации электроды промывали ФБ и реагировали с ФС II (1 мг хл мл -1 ). Полученные электроды сшивали BS -3- в течение 30 мин и промывали ФБ.ГХ-электроды, модифицированные БПК/УНТ: ОУНТ, 10 мг/мл -1 , диспергировали в диметилформамиде с получением стабильной суспензии. Дисперсию в объеме 5 мкл наносили на полированные электроды СУ для получения электрода СУ, модифицированного УНТ. Раствор БПК (5 мкл, 0,14 мг мл -1 ) в буфере HEPES (0,1 М, рН 7,2) наносили на электроды и через 30 мин добавляли 1 мкл BS 3 , 0,01 мг мл -1 . Затем электродам давали высохнуть на воздухе.

Электрохимическая характеристика электродов
Окислительно-восстановительный потенциал электрода, модифицированного pMBQ, определяли методом циклической вольтамперометрии. Линейная зависимость между анодным пиковым током и скоростью сканирования подтверждает удержание полимера на электроде (см. Дополнительный рисунок S5).
Биоэлектрокаталитические функции катода GC, модифицированного БПК/УНТ, были охарактеризованы путем отслеживания электрокаталитических катодных токов в присутствии O 2 с использованием циклической вольтамперометрии (экспериментальные результаты см. Дополнительный рисунок S6).
Измерения и приборы
Электрохимические измерения проводились с использованием потенциостата Autolab (ECO Chemie, Нидерланды) с программным обеспечением GPES. Насыщенный KCl ГЭП (или Ag-проволока) и углеродный стержень ( d= 5 мм) использовали в качестве электрода сравнения и противоэлектрода соответственно.
Фотоэлектрохимические измерения проводились с использованием самодельной системы, включающей ксеноновую лампу (Oriel, модель 6258, P =300 Вт), монохроматор (Oriel, модель 74000, разрешение 2 нм) и прерыватель (Oriel, модель 76994).
 Электрический выходной сигнал ячейки снимался синхронным усилителем (Stanford Research, модель SR 830 DSP). Частота прерывания затвора контролировалась генератором импульсов/задержек Stanford Research, модель DG535. Фотогенерированные токи измерялись между рабочим электродом из модифицированного Au и противоэлектродом из платиновой пластины. Квантовую эффективность оценивали путем измерения генерируемых фототоков и мощности света, поглощаемой соответствующими электродами, модифицированными ФСII. Поглощенная световая мощность, P , определяли путем вычитания суммы мощности света, связанного со светом, прошедшим через покрытые золотом предметные стекла, модифицированные полимеризованными слоями и элементами ФС II, и мощности света, отраженного от этих поверхностей, из мощности падающей лампы. Поглощенная световая мощность также была скорректирована для золотых поверхностей, модифицированных полимерными комплексами, но без блоков ФСII. Подстановка измеренного фототока I и мощности поглощенного света P , в уравнении (1) дает квантовый выход фототока.
Электрический выходной сигнал ячейки снимался синхронным усилителем (Stanford Research, модель SR 830 DSP). Частота прерывания затвора контролировалась генератором импульсов/задержек Stanford Research, модель DG535. Фотогенерированные токи измерялись между рабочим электродом из модифицированного Au и противоэлектродом из платиновой пластины. Квантовую эффективность оценивали путем измерения генерируемых фототоков и мощности света, поглощаемой соответствующими электродами, модифицированными ФСII. Поглощенная световая мощность, P , определяли путем вычитания суммы мощности света, связанного со светом, прошедшим через покрытые золотом предметные стекла, модифицированные полимеризованными слоями и элементами ФС II, и мощности света, отраженного от этих поверхностей, из мощности падающей лампы. Поглощенная световая мощность также была скорректирована для золотых поверхностей, модифицированных полимерными комплексами, но без блоков ФСII. Подстановка измеренного фототока I и мощности поглощенного света P , в уравнении (1) дает квантовый выход фототока.
Где h — постоянная Планка, c — скорость света в вакууме, λ — выбранная длина волны света, а e — заряд электрона.
В одном эксперименте потенциостат Autolab был соединен с фотоэлектрохимическим аппаратом, что позволяло измерять фототоки при приложении различных внешних потенциалов к бисанилин-сшитому электроду NPs/PSII Au (см. Дополнительный рисунок S7).
Для измерения PBFC катод GC, модифицированный БПК/УНТ, и соответствующий анод (pMBQ/PSII или сшитые бис-анилином наночастицы Au/PS-II) помещали в ячейку объемом 10 мл, заполненную ФБ (0,1 М, рН=7,4). Кривые разряда (поляризации) биотоплива регистрировали на воздухе (или азоте) при переменных внешних сопротивлениях и с помощью электрометра (Keithley 617). В этих экспериментах источником света служило оптоволокно (Fiber Lite, модель 190, P ~0,1 Вт) фирмы Dolan-Jenner.
Измерения микробаланса кристаллов кварца проводились с использованием самодельного прибора, соединенного с анализатором частоты (Fluke) и с использованием кристаллов кварца Au (AT-cut, 10 МГц).

Дополнительная информация
Как цитировать эту статью: Yehezkeli, O. et al . Фотобиоэлектрохимические элементы на основе интегрированной фотосистемы II. Нац. коммун. 3:742 doi: 10.1038/ncomms1741 (2012).
Ссылки
Ренгер, Г. Первичные процессы фотосинтеза: принципы и аппарат (издательство RSC, 2008).
Бюхнер, Т.Б. и Эвинген, Х.Н. Фотосинтез: теория и приложения в энергетике, биотехнологии и нанотехнологии (Издательство Nova Science, 2009).
Пессаракли, М. Справочник по фотосинтезу (Taylor & Francis, 2005).
Бланкеншип, RE Молекулярные механизмы фотосинтеза (Blackwell Science, 2002).
Basshamj, A., Benson, A. & Calvin, M. Путь углерода в фотосинтезе. Дж. Биол. хим. 185 , 781–787 (1950).

Google ученый
Yano, J. et al. Где вода окисляется до дикислорода: структура фотосинтетического кластера Mn4Ca. Наука 314 , 821–825 (2006).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Феррейра К.Н., Айверсон Т.М., Маглауи К., Барбер Дж. и Ивата С. Архитектура фотосинтетического центра выделения кислорода. Наука 303 , 1831–1838 (2004).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Кальянасундарам, К. и Гретцель, М. Искусственный фотосинтез: биомиметические подходы к преобразованию и хранению солнечной энергии. Курс. мнение Биотехнолог. 21 , 298–310 (2010).
КАС
СтатьяGoogle ученый
Бард, А. Дж.
 и Фокс, М. А. Искусственный фотосинтез: солнечное расщепление воды на водород и кислород. Согл. хим. Рез. 28 , 141–145 (1995).
и Фокс, М. А. Искусственный фотосинтез: солнечное расщепление воды на водород и кислород. Согл. хим. Рез. 28 , 141–145 (1995).КАС
СтатьяGoogle ученый
Гаст Д., Мур Т. А. и Мур А. Л. Имитация фотосинтетической передачи солнечной энергии. Согл. хим. Рез. 34 , 40–48 (2001).
КАС
СтатьяGoogle ученый
Hambourger, M. et al. Биология и технология получения фотохимического топлива. Хим. соц. Ред. 38 , 25–35 (2009).
КАС
СтатьяGoogle ученый
Youngblood, W. J. et al. Фотоассистированное полное расщепление воды в фотоэлектрохимической ячейке, сенсибилизированной красителем, поглощающим видимый свет. Дж. Ам. хим. соц. 131 , 926–927 (2009).
КАС
СтатьяGoogle ученый
Бланкеншип, Р.
 Э. Сравнение фотосинтетической и фотоэлектрической эффективности и выявление потенциала для улучшения. Наука 332 , 805–809 (2011).
Э. Сравнение фотосинтетической и фотоэлектрической эффективности и выявление потенциала для улучшения. Наука 332 , 805–809 (2011).ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Hambourger, M. et al. [FeFe]-гидрогеназа катализировала производство h3 в фотоэлектрохимическом биотопливном элементе. Дж. Ам. хим. соц. 130 , 2015–2022 (2008).
КАС
СтатьяGoogle ученый
Garza, L. et al. Фотоэлектрохимический биотопливный элемент на основе ферментов. J. Phys. хим. Б, 107 , 10252–10260 (2003).
Артикул
Google ученый
Тендер, Л. М. и др. Использование микробной энергии, генерируемой на морском дне. Нац. Биотехнолог. 20 , 821–825 (2002).
КАС
СтатьяGoogle ученый
Розенбаум, М.
 , Хе, З. и Анженент, Л. Т. Энергия света в биоэлектричество: фотосинтетические микробные топливные элементы. Курс. мнение Биотехнолог. 21 , 259–264 (2010).
, Хе, З. и Анженент, Л. Т. Энергия света в биоэлектричество: фотосинтетические микробные топливные элементы. Курс. мнение Биотехнолог. 21 , 259–264 (2010).КАС
СтатьяGoogle ученый
Ringeisen, B.R. et al. Высокая удельная мощность от миниатюрного микробного топливного элемента с использованием Shewanella Oneidensis DSP10. Окружающая среда. науч. Технол. 40 , 2629–2634 (2006).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Хэм, М.- Х. и др. Фотоэлектрохимические комплексы для преобразования солнечной энергии с химической и автономной регенерацией. Нац. хим. 2 , 929–936 (2010).
КАС
СтатьяGoogle ученый
Гринбаум, Э. Векторные фототоки и фотопроводимость в металлизированных хлоропластах.
 J. Phys. Chem 94 , 6151–6153 (1990).
J. Phys. Chem 94 , 6151–6153 (1990).КАС
СтатьяGoogle ученый
Бадура А., Коте Т., Шухманн В. и Рёгнер М. Подключение фотосинтетических ферментов к электродам. Энергетика Окружающая среда. науч. 4 , 3263–3274 (2011).
КАС
СтатьяGoogle ученый
Менье, С. Ф., Ян, X.-Y., Рук, Дж. К. и Су, Б.-Л. Биотопливные клетки на основе иммобилизации фотосинтетически активных биообъектов. ChemCatChem 3 , 476–488 (2011).
КАС
СтатьяGoogle ученый
Iwuchukwu, I.J. et al. Самоорганизующаяся фотосинтетическая наночастица для бесклеточного производства водорода. Нац. нанотехнологии. 5 , 73–79 (2010).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Миллсапс, Дж.
 Ф., Брюс, Б. Д., Ли, Дж. В. и Гринбаум, Э. Наноразмерный фотосинтез: фотокаталитическое производство водорода платинированными реакционными центрами фотосистемы I. Фотохим. Фотобиол. 73 , 630–635 (2001).
Ф., Брюс, Б. Д., Ли, Дж. В. и Гринбаум, Э. Наноразмерный фотосинтез: фотокаталитическое производство водорода платинированными реакционными центрами фотосистемы I. Фотохим. Фотобиол. 73 , 630–635 (2001).КАС
СтатьяGoogle ученый
Utschig, L.M. et al. Фотокаталитическое получение водорода из комплексов наночастиц нековалентной биогибридной фотосистемы I/Pt. J. Phys. хим. лат. 2 , 236–241 (2011).
КАС
СтатьяGoogle ученый
Хеллер, А. Электрическое соединение окислительно-восстановительных центров ферментов с электродами. J. Phys. хим. 96 , 3579–3587 (1992).
КАС
СтатьяGoogle ученый
Заяц М., Вилнер Б. и Вилнер И. Разработка амперометрических биосенсоров и биотопливных элементов путем восстановления ферментных электродов с электрическим контактом.
 Электроанализ 20 , 583–601 (2008).
Электроанализ 20 , 583–601 (2008).КАС
СтатьяGoogle ученый
Джерард М., Чаубей А. и Малхотра Б. Д. Применение проводящих полимеров в биосенсорах. Биосенс. Биоэлектрон. 17 , 345–359 (2002).
КАС
СтатьяGoogle ученый
Ван, Дж. Электрохимические биосенсоры глюкозы. Хим. Ред. 108 , 814–825 (2008 г.).
КАС
СтатьяGoogle ученый
Вилнер, И., Ян, Ю.-М., Вилнер, Б. и Тел-Веред, Р. Интегрированные биотопливные элементы на основе ферментов: обзор. Топливные элементы 9 , 7–24 (2009).
КАС
СтатьяGoogle ученый
Кац, Э., Вилнер, И. и Котляр, А. Б. Биотопливный элемент, не разделенный на глюкозу-О2, с биоинженерными поверхностями электродов.
 Дж. Электроанал. хим. 479 , 64–68 (1999).
Дж. Электроанал. хим. 479 , 64–68 (1999).КАС
СтатьяGoogle ученый
Мано, Н., Мао, Ф. и Хеллер, А. Миниатюрный биотопливный элемент, работающий в физиологическом буфере. Дж. Ам. хим. соц. 124 , 12962–12963 (2002 г.).
КАС
СтатьяGoogle ученый
Хеллер, А. Миниатюрные биотопливные элементы. Физ. хим. хим. физ. 6 , 209–216 (2004).
КАС
СтатьяGoogle ученый
Гао, Ф., Вири, Л., Моги, М., Пулен, П. и Мано, Н. Разработка проводов из гибридных нанотрубок для мощных биотопливных элементов. Нац. коммун. 1 , 2–5 (2010).
ОБЪЯВЛЕНИЕ
СтатьяGoogle ученый
Barton, S.C., Gallaway, J.
 & Atanassov, P. Ферментативные биотопливные элементы для имплантируемых и микромасштабных устройств. Хим. Ред. 104 , 4867–4886 (2004 г.).
& Atanassov, P. Ферментативные биотопливные элементы для имплантируемых и микромасштабных устройств. Хим. Ред. 104 , 4867–4886 (2004 г.).КАС
СтатьяGoogle ученый
Schuhmann, W., Ohara, T.J., Schmidt, H.-L. & Heller, A. Перенос электронов между глюкозооксидазой и электродами через окислительно-восстановительные посредники, связанные гибкими цепями с поверхностью фермента. Дж. Ам. хим. соц. 113 , 1394–1397 (1991).
КАС
СтатьяGoogle ученый
Вилнер И., Риклин А., Шохам Б., Ривензон Д. и Кац Э. Разработка новых биосенсорных ферментных электродов: многослойные массивы глюкозооксидазы, иммобилизованные на самособирающихся монослоях на электродах. Доп. Матер. 5 , 912–915 (1993).
КАС
СтатьяGoogle ученый
Willner, I.
 et al. Электрическая проводка глюкозооксидазы путем восстановления FAD-модифицированных монослоев, собранных на Au-электродах. Дж. Ам. хим. соц. 118 , 10321–10322 (1996).
et al. Электрическая проводка глюкозооксидазы путем восстановления FAD-модифицированных монослоев, собранных на Au-электродах. Дж. Ам. хим. соц. 118 , 10321–10322 (1996).КАС
СтатьяGoogle ученый
Fruk, L., Kuo, C.-H., Torres, E. & Niemeyer, C. Реконструкция апофермента как химический инструмент для структурной энзимологии и биотехнологии. Анжю. хим. Междунар. Эд. 48 , 1550–1574 (2009).
КАС
СтатьяGoogle ученый
Xiao, Y., Patolsky, F., Katz, E., Hainfeld, J. F. & Willner, I. «Подключение к ферментам»: наносоединение окислительно-восстановительных ферментов с помощью наночастицы золота. Наука 299 , 1877–1881 (2003).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Хеллер, А.
 Электропроводка окислительно-восстановительных ферментов. Согл. хим. Рез. 23 , 128–134 (1990).
Электропроводка окислительно-восстановительных ферментов. Согл. хим. Рез. 23 , 128–134 (1990).КАС
СтатьяGoogle ученый
Малый Дж. и др. Прямой безмедиаторный транспорт электронов между монослоем фотосистемы II и золотым электродом, модифицированным поли(меркапто- p -бензохиноном) — новая конструкция биосенсора для обнаружения гербицидов. Биосенс. Биоэлектрон. 21 , 923–932 (2005).
КАС
СтатьяGoogle ученый
Бадура, А. и др. Фотоиндуцированный перенос электронов между фотосистемой 2 через сшитые окислительно-восстановительные гидрогели. Электроанализ 20 , 1043–1047 (2008).
КАС
СтатьяGoogle ученый
Терасаки, Н. и др. Подключение молекулярной проволоки к фотосистеме I: восстановление системы фотоэлектрического преобразования на золотом электроде.
 Анжю. хим. Междунар. Эд. 48 , 1585–1587 (2009).
Анжю. хим. Междунар. Эд. 48 , 1585–1587 (2009).КАС
СтатьяGoogle ученый
Grimme, R.A., Lubner, C.E., Bryant, D.A. & Golbeck, JH. Фотосистема I/молекулярная проволока/биоконъюгаты металлических наночастиц для фотокаталитического производства h3. Дж. Ам. хим. соц. 130 , 6308–6309 (2008 г.).
КАС
СтатьяGoogle ученый
Лебедев Н. и др. Проводящая проводка иммобилизованного фотосинтетического реакционного центра к электроду цитохромом c. Дж. Ам. хим. соц. 128 , 12044–12045 (2006 г.).
КАС
СтатьяGoogle ученый
Траммелл С.А., Ван Л., Зулло Дж.М., Шашидхар Р. и Лебедев Н. Ориентированное связывание фотосинтетических реакционных центров на золоте с использованием самоорганизующихся монослоев Ni-NTA.
 Биосенс. Биоэлектрон. 19 , 1649–1655 (2004).
Биосенс. Биоэлектрон. 19 , 1649–1655 (2004).КАС
СтатьяGoogle ученый
Yehezkeli, O. et al. Генерация фототоков сшитыми бис-анилином композитами наночастиц Pt/фотосистемы I на электродах. J. Phys. хим. Б. 114 , 14383–14388 (2010).
КАС
СтатьяGoogle ученый
Yan, Y.-M., Yehezkeli, O. & Willner, I. Интегрированные электрически контактирующие NAD(P) + -зависимые ферментные/углеродные нанотрубчатые электроды для биосенсоров и биотопливных элементов. Хим. Евро. J. 13 , 10168–10175 (2007).
КАС
СтатьяGoogle ученый
Yehezkeli, O., Tel-Vered, R., Raichlin, S. & Willner, I. Нано-инженерные электроды, модифицированные флавин-зависимой глюкозодегидрогеназой/золотыми наночастицами, для определения глюкозы и биотопливных элементов.
 ACS Nano 5 , 2385–2391 (2011).
ACS Nano 5 , 2385–2391 (2011).КАС
СтатьяGoogle ученый
Бадура, А. и др. Световое расщепление воды для производства (био)водорода: фотосистема 2 как центральная часть биоэлектрохимического устройства. Фотохим. Фотобио. 82 , 1385–1390 (2006).
КАС
СтатьяGoogle ученый
Лам, К. Б., Джонсон, Э. А., Чиао, М. и Лин, Л. Фотосинтетическая электрохимическая ячейка МЭМС, работающая от субклеточных фотосистем растений. Дж. МЭМС 15 , 1243–1250 (2006).
КАС
СтатьяGoogle ученый
Цудзимура С., Вадано А., Кано К. и Икеда Т. Фотосинтетическая биоэлектрохимическая клетка с использованием цианобактерий и оксидазы, генерирующей воду. Фермент микроб. Технол. 29 , 225–231 (2001).

КАС
СтатьяGoogle ученый
Grätzel, M. Преобразование солнечной энергии фотогальваническими элементами, сенсибилизированными красителем. Неорг. хим. 44 , 6841–6851 (2005 г.).
Артикул
Google ученый
Yella, A. et al. Сенсибилизированные порфирином солнечные элементы с окислительно-восстановительным электролитом на основе кобальта (II/III) превышают 12-процентную эффективность. Наука 334 , 629–634 (2011).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Ехезкели, О., Ян, Ю.-М., Баравик, И., Тел-Веред, Р. и Вилнер, И. Интегрированные олигоанилиновые сшитые композиты наночастиц золота/электроды оксидазы глюкозы: общий Парадигма ферментных систем с электрическим контактом. Хим. Евро. J. 15 , 2674–2679 (2009).

КАС
СтатьяGoogle ученый
Фраскони, М., Тел-Веред, Р., Рискин, М. и Вилнер, И. Наэлектризованные селективные «губки», изготовленные из наночастиц золота. Дж. Ам. хим. соц. 132 , 9373–9382 (2010).
КАС
СтатьяGoogle ученый
Йехезкели О., Овиц О., Тел-Веред Р., Райхлин С. и Вилнер И. Реконструированные ферменты на электрополимеризуемых ФАД-модифицированных металлических наночастицах: функциональные единицы для сборки эффективно «связанных» ферментные электроды. Электроанализ 22 , 1817–1823 (2010).
КАС
СтатьяGoogle ученый
Алкалай, В. Моноалкоилмеркаптохиноны. простой метод синтеза. Хел. Чим. Acta XXX II , 578–585 (1947).
Артикул
Google ученый
Broser, M.
 et al. Кристаллическая структура мономерной фотосистемы II из thermosynechococcus elongatus при разрешении 3,6 Å. Дж. Биол. хим. 285 , 26255–26262 (2010).
et al. Кристаллическая структура мономерной фотосистемы II из thermosynechococcus elongatus при разрешении 3,6 Å. Дж. Биол. хим. 285 , 26255–26262 (2010).КАС
СтатьяGoogle ученый
Загрузить ссылки
Благодарности
Это исследование поддерживается Европейским исследовательским советом в рамках Седьмой рамочной программы Европейского сообщества (FP7/2007–2013)/ERC Advanced Grant номер 267574, проект NanoSensoMach. О.Ю. признает стипендию Леви Эшколь Министерства науки и технологий Израиля.
Информация об авторе
Авторы и организации
Институт химии, Центр нанонауки и нанотехнологий, Еврейский университет в Иерусалиме, Иерусалим, , Израиль
Омер Ехезкели, Ран Тель-Веред, Трифонов Александр, Вассерман Юлиан Itamar Willner
Факультет наук о растениях, Институт наук о жизни Зильбермана, Центр биогибридных комплексных систем Minerva, Еврейский университет в Иерусалиме, Иерусалим, , Израиль
Дорит Михаэли и Рэйчел Нечуштаи
Авторы
- Омер Йехезкели
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ran Tel-Vered
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Джулиан Вассерман
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Александр Трифонов
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Dorit Michaeli
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Rachel Nechushtai
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Академия - Itamar Willner
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
O.
 Y. и Р.Т.-В. провел фотоэлектрохимические эксперименты, проанализировал результаты и участвовал в оформлении статьи. Дж. В. построил экспериментальную установку для фотоэлектрохимических экспериментов. В. помогал в электрохимических измерениях. Д.М. выделили и очистили SPII. Р.Н. координировал выделение и очистку ФСII и участвовал в написании статьи. И. В. координировал проект и участвовал в планировании экспериментов, анализе результатов и оформлении статьи.
Y. и Р.Т.-В. провел фотоэлектрохимические эксперименты, проанализировал результаты и участвовал в оформлении статьи. Дж. В. построил экспериментальную установку для фотоэлектрохимических экспериментов. В. помогал в электрохимических измерениях. Д.М. выделили и очистили SPII. Р.Н. координировал выделение и очистку ФСII и участвовал в написании статьи. И. В. координировал проект и участвовал в планировании экспериментов, анализе результатов и оформлении статьи.Автор, ответственный за переписку
Итамар Вилнер.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют о конкурирующих финансовых интересах.
Дополнительная информация
Дополнительная информация
Дополнительные рисунки S1-S7 и дополнительные ссылки (PDF 904 kb)
Права и разрешения
Перепечатки и разрешения
0 Об этой статье0002 Дальнейшее чтение
Энергетический материал на основе фотосинтетических клеток для проточной батареи
- Чон Хёк Бэ
- Гу Ён Чо
- Сеунг Джай Бай
Журнал механических наук и технологий (2022)
Разработка и синтез гибридных наноструктур для устойчивой энергетики и восстановления окружающей среды
- Нареш А.
 Раджпурохит
Раджпурохит - Каушалья Бхакар
- Динеш Кумар
Арабский журнал наук о Земле (2022)
- Нареш А.
Производство фотосинтетического водорода микробными микрореакторами на основе капель в аэробных условиях
- Чжицзюнь Сюй
- Шэнлян Ван
- Стивен Манн
Nature Communications (2020)
Совершенствование фотоэлектрохимии фотосистемы II для полуискусственного фотосинтеза
- Дженни З.
 Чжан
Чжан - Эрвин Рейснер
Nature Reviews Chemistry (2020)
- Дженни З.
Генерация фотонапряжения комплексами ядра фотосистемы II, иммобилизованными на фильтре Millipore на электроде из оксида индия и олова
- Заспа Андрей Анатольевич
- Витухновская Лия Александровна
- Махир Д.
 Мамедов
Мамедов
Журнал биоэнергетики и биомембран (2020)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Обзор системной библиотеки фотографий для фотографий на Mac
Искать в этом руководстве
Добро пожаловать
Обзор импорта
Из фотографий iCloud
С камеры или телефона
С запоминающих устройств, DVD-дисков и т.
 д.
д.Из почты, Safari и других приложений
Импорт фотографий из другой библиотеки
Где фотографии, которые я импортировал?
Просмотрите свои фотографии
Просмотр отдельных фотографий
Добавьте заголовки, подписи и многое другое
Взаимодействуйте с текстом на фотографии с помощью Live Text
Используйте визуальный поиск, чтобы узнать о фотографии
Просмотр фотографий, которыми с вами поделились другие
Удалить фотографии или восстановить удаленные
Скрыть фотографии от просмотра
Просмотр серий фотографий
Воспроизведение видеоклипов
Просмотр воспоминаний
Персонализируйте воспоминания
Просмотр фотографий по тому, кто на них изображен
Просмотр фотографий по местоположению
Показать определенные типы элементов
Поиск фотографий по тексту, содержанию или дате
Поиск фотографий по ключевому слову
Что такое альбомы?
Создание альбомов
Создание смарт-альбомов
Группировать альбомы в папки
Основы редактирования
Обрезайте и выпрямляйте фотографии
Используйте фильтр, чтобы изменить фотографию
Настройте свет, экспозицию и другие параметры фотографии
Ретушь фотографий
Убрать эффект красных глаз
Отрегулируйте баланс белого фотографии
Применение корректировок кривых
Применить настройки уровней
Изменить определение
Применение изменений к определенным цветам
Снизить уровень шума
Повышение резкости фотографии
Изменение освещения фотографии в портретном режиме
Применить виньетку
Напишите или нарисуйте на фотографии
Используйте другие приложения при редактировании в Фото
Изменить живое фото
Изменить видео
Редактировать видео в кинематографическом режиме
Что такое общие альбомы?
Включите общие альбомы
Создать общий альбом
Добавляйте, удаляйте и редактируйте фотографии в общем альбоме
Добавить или удалить подписчиков
Подпишитесь на общие альбомы
Используйте сообщения и почту для обмена фотографиями
Используйте AirDrop для обмена фотографиями
Делитесь фотографиями с помощью других приложений и веб-сайтов
Экспорт фотографий, видео, слайд-шоу и воспоминаний
Создавайте слайд-шоу
Создавайте проекты с помощью сторонних приложений
Закажите профессиональную печать
Распечатайте свои фотографии
Обзор системной библиотеки фотографий
Создайте дополнительные библиотеки
Резервное копирование библиотеки фотографий
Восстановить из Time Machine
Восстановить библиотеку
Изменить место хранения фотографий и видео
Изменить настройки фотографий
Сочетания клавиш и жесты
Авторские права
При первом использовании Фото вы создаете новую библиотеку или выбираете библиотеку, которую хотите использовать.
 Эта библиотека автоматически становится вашей системной библиотекой фотографий . Хотя вы можете использовать несколько библиотек фотографий в программе «Фото», системная библиотека фотографий — единственная библиотека, которая может использовать фотографии iCloud и общие альбомы. Кроме того, некоторые приложения Apple и сторонние приложения также получают доступ к вашей системной библиотеке фотографий с помощью медиабраузера.
Эта библиотека автоматически становится вашей системной библиотекой фотографий . Хотя вы можете использовать несколько библиотек фотографий в программе «Фото», системная библиотека фотографий — единственная библиотека, которая может использовать фотографии iCloud и общие альбомы. Кроме того, некоторые приложения Apple и сторонние приложения также получают доступ к вашей системной библиотеке фотографий с помощью медиабраузера.По умолчанию ваша системная библиотека фотографий хранится в папке «Изображения» на вашем Mac, но вы можете переместить ее в другое место на вашем Mac или сохранить на внешнем устройстве хранения.
ПРЕДУПРЕЖДЕНИЕ. Если библиотека фотографий находится на внешнем диске, не используйте Time Machine для хранения резервной копии на этом внешнем диске. Разрешения для вашей библиотеки фотографий могут конфликтовать с разрешениями для резервной копии Time Machine.
При желании вы можете создавать дополнительные библиотеки фотографий и хранить их в любом месте на вашем Mac или на внешнем устройстве хранения.
 Однако имейте в виду следующее:
Однако имейте в виду следующее:Одновременно можно работать с фотографиями только в одной библиотеке. Для работы с фотографиями в другой библиотеке необходимо переключаться между библиотеками фотографий.
Если вы переключитесь на библиотеку, отличную от Системной медиатеки, внесенные вами изменения не отразятся в «Фото iCloud», так как «Фото iCloud» синхронизирует изменения только из вашей Системной медиатеки. Если вы создаете какие-либо другие библиотеки, убедитесь, что они созданы с помощью Time Machine.
По умолчанию все файлы, которые вы импортируете в приложение «Фото», сохраняются в текущей библиотеке фотографий. При желании вы можете настроить приложение «Фото», чтобы импортированные файлы оставались в исходных местах (например, на устройстве хранения) и не помещались в библиотеку. См. раздел Изменение места хранения файлов в приложении «Фото».
ПРЕДУПРЕЖДЕНИЕ: Во избежание случайного удаления или повреждения библиотеки фотографий не изменяйте содержимое библиотеки в Finder.

Открыть фотографии для меня
См. также Где находятся фотографии, импортированные в программу «Фото» на моем Mac? Резервное копирование библиотеки в программе «Фото» на MacВосстановление библиотеки из Time Machine в программе «Фото» на MacИспользование фотографий iCloud для хранения фотографий в iCloudЧто является общим альбомы в Фото на Mac?
Максимальное количество символов:
250Пожалуйста, не указывайте личную информацию в своем комментарии.
Максимальное количество символов — 250.
Спасибо за отзыв.
Affinity Photo — полный список функций
Мак
Аппаратное обеспечение
- Mac Pro, iMac, iMac Pro, MacBook, MacBook Pro, MacBook Air, Mac Mini
- Mac с чипом Apple M1/M1 Pro/M1 Max или процессором Intel
- Не менее 2 ГБ ОЗУ
- До 2,8 ГБ свободного места на жестком диске; больше во время установки
- Размер дисплея 1280×768 или лучше
- Поддерживает обычные дисплеи, дисплеи Retina и DCI-P3 с расширенным цветовым охватом
Операционная система
- 12 Монтерей
- 11 Биг-Сур
- 10.
 15 Каталина
15 Каталина - 10.14 Мохаве
- 10.13 Хай Сьерра
- 10.12 Сьерра
- 10.11 Эль-Капитан
- 10.10 Йосемити
- 10.9 Маверикс
Окна
Аппаратное обеспечение
- ПК на базе Windows (64-разрядная версия) с мышью или эквивалентным устройством ввода
- Аппаратное ускорение графического процессора *
- Видеокарты, совместимые с DirectX 10 и выше
- Минимум 2 ГБ ОЗУ (рекомендуется 4 ГБ ОЗУ)
- 953 МБ свободного места на жестком диске; больше во время установки
- Размер дисплея 1280×768 или лучше
* Требуется:
- —
Обновление Windows 10 от апреля 2020 г. (или более поздней версии)
(или более поздней версии) - —
Карта с поддержкой Direct3D уровня 12.0
Операционная система
Версия Affinity Store
- Окна ® 11
- Windows ® 10 (юбилейное обновление 1607 или выше)
- Windows ® 8.1
- Windows ® 7 (Service Pack 1; обновление платформы KB2670838; поддержка Aero)
Версия магазина Майкрософт
- Окна ® 11
- Windows ® 10 (юбилейное обновление 1607 или выше)
айпад
Аппаратное обеспечение
- Совместим с…
- iPad Pro (все модели)
- iPad Air (2, 3, 4 и 5)
- iPad (начиная с 2017 г.
 )
) - iPad Mini (5 и 6)
Операционная система
- iOS 12 или выше
Обзор
Ключ:
Новый
= Улучшения и функции, появившиеся в версии 1.10.
Текст
= Функциональность, новая для версии 1.9.
Производительность
- Аппаратное ускорение вычислений на графическом процессоре * обеспечивает сверхбыструю композицию, редактирование и рисование
- Значительное улучшение с использованием встроенных графических процессоров Intel
- Поддержка внешнего графического процессора (горячее подключение и отключение)
- Использование нескольких графических процессоров
- Более быстрый рендеринг живых фильтров
- Контрольное тестирование производительности
Быстрый и эффективный набор инструментов
- Панорамирование и масштабирование со скоростью 60 кадров в секунду и выше, если поддерживается, даже с огромными изображениями
- Интерактивные инструменты, предварительный просмотр в реальном времени, редактирование в реальном времени
- RAW и обычная обработка объединены в одном приложении
Профессиональный
- Профессиональные цветовые пространства и профили
- Поддерживаемые форматы файлов Pro, такие как PSD
- Поддерживаемые форматы RAW современных камер
- Полный набор 16-битных фильтров
- Субпиксельная точность и идеальная фиксация пикселей
- Настраиваемые панели инструментов, сочетания клавиш и панели (только для рабочего стола)
- Стили документов или сохранение собственных пользовательских настроек документа
- Работа с пикселями, точками, пиками и единицами физического документа
Красивый по дизайну
- Создан с нуля для профессиональных фотографов
- Оцените стильный и лаконичный интерфейс
Чистые рабочие места
- Выделенные персонажи (режимы) для определенных задач и наборов инструментов
- Лаконичный пользовательский интерфейс для редактирования RAW, редактирования фотографий, создания панорам, сглаживания и тонального отображения
- Экспорт профиля для точного управления регионами и настройками экспорта
Твердая история отмен
- Мгновенная отмена/возврат более 8000 шагов истории
- Сохранить историю, чтобы вы могли отменить шаги позже даже на разных компьютерах
- Бесшовное автосохранение защищает от непредвиденных отключений
- Функция Cycle Futures предотвращает потерю истории после редактирования из отмены
- Отображение шагов истории с миниатюрами и датой/временем
Улучшена производительность благодаря:
Новый
Графический рендеринг
Новый
Сшивка панорамы
Новый
Уменьшение окаймления и увеличение максимального радиуса
Новый
Несколько размещенных сэмплеров информационных страниц
Новый
Корректирующие слои при отключенном аппаратном ускорении
Новый
Документы с большим количеством слоев (более быстрая визуализация при панорамировании и перекомпоновке текста)
Новый
Размещенные изображения
Новый
Встроенные документы
Новый
Условия нехватки памяти (включая Windows OpenCL, предотвращающий переход с аппаратного на программный)
Новый
Преобразование документов между профилями ICC/пиксельными форматами
Новый
Документы, содержащие сглаженные непрозрачные слои (обычно результат слияния виден).

Нет подписки
- За единую разовую цену вы получите текущую версию (v1) приложения (в выбранной вами операционной системе). Вы можете оставить его себе, и вы даже будете получать бесплатные обновления программного обеспечения до тех пор, пока не станет доступна версия 2 (в настоящее время дата не запланирована). Затем вы можете просто продолжить использовать версию, которая у вас есть, или выбрать обновление до версии 2 за дополнительную плату.
Регистрация и доступ к учетной записи
*
- Регистрация в приложении (необязательно)
- Доступ в приложении и просмотр вашей учетной записи Affinity
- Синхронизация содержимого Affinity Store
- Установка бесплатных и приобретенных материалов Affinity Store (кисти, активы и т. д.)
Языки
- Английский (США и Великобритания)
- немецкий
- французский
- Испанский
- Португальский (бразильский)
- японский
- итальянский
- Китайский (упрощенный)
- Русский
Обработка RAW-изображений
Специальный редактор RAW с разделенным экраном
- Разработка RAW с ускорением на графическом процессоре
- Настройка файлов RAW и других слоев RGB в режиме «Разработка»
- Просматривайте свои корректировки вместе с оригиналом в режиме реального времени
- Автоматическое удаление горячих пикселей (только SerifLabs RAW Engine) (только для настольных компьютеров)
- Ручная коррекция объектива
- Обновлены RAW-библиотеки SerifLabs
- Поддержка Apple ProRAW (iPhone12)
Новый
Улучшения коррекции объектива для объективов Canon, Tamron и Sigma.

Новый
Поддержка профиля объектива ACM
Новый
Поддержка Raw CR3 (для Canon EOS 850D)
Новый
Улучшенный RAW-движок Serif Labs
Настройки и коррекция объектива
- Воздействие
- Контраст
- Ясность
- Насыщенность (улучшенная)
- Вибрация (улучшенная)
- Баланс белого (улучшенный)
- Тени
- Основные моменты
- Камера и выходные профили
- Пространственная коррекция объектива
- Уменьшение хроматических аберраций
- Удаление каймы
- Удалить виньетку объектива
- Виньетка после кадрирования
- Уточнение деталей
- Шумоподавление
- Добавление шума
- Кривые
- Черно-белый
- Раздельное тонирование
Инструменты разработки
- Окрашенные накладки
- Наложения градиента
- Режим наложения отсечения тонов
- Инструмент баланса белого
- Инструмент для удаления пятен
- Инструмент для удаления эффекта красных глаз
- Инструмент для обрезки и выпрямления
- Инструменты панорамирования и масштабирования
Подробная информация об изображении
- На гистограмме отображаются уровни и отсечение (представлены в выходном цветовом пространстве)
- Просмотр обрезанных теней и светлых участков в изображении
- Используйте прицелы для оценки интенсивности
- EXIF и другие поддерживаемые метаданные
- Редактирование метаданных с поддержкой IPTC
- Мелкая детализация метаданных Focus
Удобный рабочий процесс
- Встроенный ползунок истории только для редактирования RAW
- Сохранение снимков для разветвления ваших правок
- Сохранение наборов настроек для использования с другими изображениями
- Перейти в режим Фото для полного редактирования
- Выберите, следует ли автоматически применять базовые коррекции
- Удалить автоматическую кривую тонов и применить собственную
- Автоматическая коррекция объектива и шумоподавление
- Надежная коррекция профилированных линз с возможностью включения/выключения
- Вращение необработанного изображения
- Пожалуйста, посетите наш форум для получения списка поддержки RAW
Инструменты редактирования изображений и ретуши
Живое, неразрушающее редактирование
- Живые корректирующие слои
- Точное управление узлом в настройке кривых (только для рабочего стола)
- Слои живого фильтра
- Больше фильтров теперь работает с масками, настройками и резервными каналами
- Живые режимы наложения
- Живые градиенты
- Неразрушающее изменение размера слоя
- Сохраняемые выборки
- Динамические корректировки интеллектуальных фигур
- Режимы наложения теперь работают с масками, корректировками и живыми фильтрами
Слои и маски
- Расширенная обработка слоев с неограниченным количеством слоев
- Изменение размера слоя без потерь
- Вложение слоев в группы и группы внутри групп
- Перетащите, чтобы упорядочить слои и настройки
- Обрезка слоев путем перетаскивания
- Связанные слои
- Слои заполнения
- Слои узора
Новый
Создайте слой узора из текущего выделения (iPad)
Новый
Слои узоров можно зеркально отображать (iPad)
- Предпросмотр в режиме реального времени под соплом при рисовании масок
- Применение нескольких масок и корректировок
- Групповые маски и корректировки для формирования композитов
- Дополнительное перемещение слоев независимо от их дочерних слоев или масок
- Блокировка, скрытие, дублирование и объединение слоев
- Разблокировать все заблокированные слои одновременно
- Показать все скрытые слои одновременно
- Инвертировать любой тип слоя
- Перетаскивание слоев из одного документа в другой (только для Windows; плавающие и расположенные рядом)
Быстрые маски
- Быстро и легко создавайте маски из выделенных фрагментов
- Просмотр в виде наложения, прозрачности, черного или белого
каналы
- Просмотр и редактирование каналов изображений и слоев
- Работа с альфа-изображением
- Сделать маски из каналов
- Создание резервных каналов и каналов в градациях серого
- Изолировать и редактировать запасные каналы как слои
- Дублирование резервных каналов (в качестве резерва)
- Создание и добавление к выборкам на основе данных канала
- Инвертировать любой канал
- Параметры смешивания для каждого канала
Удалить ненужные объекты
- Кисть для рисования с учетом содержимого интеллектуально удаляет объекты, как по волшебству
Инструменты ретуши
- Кисти Dodge and Burn
- Губка и кисти для растушевки
- Clone Tool (использует несколько глобальных источников) (только для настольных компьютеров)
- Восстанавливающая кисть (использует несколько глобальных источников) (только для настольных компьютеров)
- Удаление пятен
- Инструмент для исправления
- Удаление эффекта красных глаз
- Кисти размытия и резкости
- Срединная кисть
- Кисть для замены цвета
- Кисть для рисования
- Автоматическая настройка контрастности, уровней, цвета и баланса белого
Разделение частот
- Разделитель частот, встроенный в качестве фильтра
- Независимое редактирование тона/цвета и текстуры с сохранением деталей там, где это необходимо
Новый
Выбор методов размытия для частотного разделения
Расширенные фильтры
- FFT Denoise — одно из нескольких средств удаления шума (только для настольных компьютеров)
- Эффективное удаление муара и других типов шума
- Фильтр Live Lighting позволяет редактировать свет на экране
- Изменение типов освещения, экстентов и добавление карт рельефа
- Удаление дымки включает впечатляющий ползунок расстояния
- Применить изображение с использованием произвольных уравнений канала
- Пользовательский фильтр искажений на основе уравнений
- Фильтр коррекции объектива с камерой, профилем объектива и выбором фокусного расстояния
Плагины
- Использование 64-разрядных Adobe ® Photoshop ® совместимых внешних модулей
- Установленные плагины обнаруживаются и проверяются на совместимость
- Поддержка подключаемого модуля LAB
- Редактирование 32-битных документов RGB
- Поддержка расширяется, со временем будет поддерживаться больше подключаемых модулей
Монтаж с расширенным динамическим диапазоном (HDR)
- Объединение экспозиций с брекетингом для создания 32-битных изображений
- Уникальная персона для расширенного тонального отображения
- Легкое редактирование в 32-битном формате неограниченного цвета
- Полная поддержка OpenColorIO
- Поддерживайте настоящий 32-битный рабочий процесс без потерь и предпросмотр всего тонального диапазона
- Многоканальный импорт и экспорт OpenEXR
- Импорт и экспорт сияния
Поддержка дисплеев HDR и EDR (только для настольных компьютеров)
- Воспользуйтесь преимуществами дисплеев, которые могут достигать высоких пиковых значений яркости, превышающих рассеянный белый цвет
- См.
 расширенный диапазон яркости 32-битных неограниченных документов HDR
расширенный диапазон яркости 32-битных неограниченных документов HDR - Получение предупреждений об отсечении на основе максимальной яркости дисплея
Стеки живых изображений
- Объединение и автоматическое выравнивание нескольких изображений
- Шумоподавление и удаление движущихся объектов из сцен
- Моделирование длинной выдержки и смешивание экспозиции
- Креативные покадровые эффекты и эффекты движения
- Более 10 режимов стека для очень разных результатов
- Изменение настроек оператора стека в режиме реального времени
Астрофотография Персона (только для ПК)
- Специальная персона для штабелирования
- Поддержка изображений RAW и FITS
- Стек света и калибровочные рамки (темные/темные плоские/плоские/смещенные)
- Наложение, растяжка тона и ретушь полностью в 32-битном режиме
- Стек файлов из разных сеансов с использованием файловых групп
- Создание полноцветных, составных (HaRGB, SHO), изображений в градациях серого или искусственных цветов
Новый
Отредактируйте имена сложенных изображений для лучшей организации
Новый
Сложите изображения для разных фильтров одновременно, используя группы файлов (автоматическое выравнивание позволяет избежать передискретизации)
Новый
Открывайте файлы FITS непосредственно в Photo Persona (управление демозаикой)
Новый
Поддержка изображений датчика FUJIFILM X-Trans
Сшивка панорамных изображений
- Автоматически объединять RAW и другие изображения в панорамы
- Создание вертикальных, горизонтальных и смешанных видов
- Включает автоматическую коррекцию цвета и перспективы
- Панорама включает инструменты Inpainting и Crop
- Кандидаты на сшивку найдены автоматически в папках
- профилей ICC
- Поддержка 32-битного HDR для сшивания с расширенным динамическим диапазоном
Поддерживается
Слияние фокусов
- Объединение изображений с несколькими зонами фокусировки для большей глубины резкости
- Создание объединенных изображений с резкостью спереди назад
- Простая ретушь результатов совмещения фокуса с использованием источников клонов
Живая проекция
- Панорамирование и предварительный просмотр 360 ° изображений в реальном времени
- Проектирование и редактирование равнопрямоугольных изображений 360 °
- Рисование, проецирование и редактирование нескольких перспективных плоскостей
- Временное проецирование в 2D для редактирования, затем повторное применение перспективы
Автоматизация с помощью макросов и пакетной обработки
- Запись и сохранение действий в виде макросов (только для рабочего стола)
- Редактировать отдельные записанные шаги и их параметры (только для ПК)
- Настройка параметров макроса после записи (только для рабочего стола)
- Импорт, экспорт и обслуживание библиотеки макросов
- Запуск пакетных заданий для массовой обработки и преобразования изображений
- Применение макросов в пакетных заданиях для удобного настраиваемого рабочего процесса (только для настольных компьютеров)
- Пакетная обработка поддерживает выражения масштабирования (ш, в и т/д)
Инструменты выделения
- Кисть Smart Selection
- Инструмент выделения заливки (волшебная палочка)
- Инструменты выделения выделения на основе формы
- Эллиптический инструмент выделения рисует из центра
- Добавить/вычесть/сохранить/загрузить выборки
- Выбор на основе диапазона цветов и тонов
- Выбор на основе альфа-канала (непрозрачный/прозрачный/частичный)
Уточнить выбор
- Выберите мелкие детали, такие как волосы и мех, с улучшенной очисткой
- Установка ширины границы уточнения, сглаживания, режима и размера растушевки
- Уточнение вывода в виде выделения, маски, нового слоя или нового слоя с маской
Обрезать и выпрямить
- Комбинированный инструмент обрезки и выпрямления помогает кадрировать изображения
- Ограничение исходным или другим соотношением сторон
- Предустановки обрезки или сохранение собственных настроек обрезки (только для настольных компьютеров)
- Композиционные наложения сетки третей, золотой спирали и диагоналей
- Обрезать с легкостью
- Затемните области за пределами кадрируемой области, чтобы улучшить композицию
- Выпрямление простым перетаскиванием через горизонт
Перспектива
- Редактирование перспективы в режиме реального времени
- Редактирование перспективы в одной и двух плоскостях
- Скрытие и отображение сеток, автоматическое вырезание слоев
- Просмотр изображений «до» и «после»
Инструмент деформации сетки
- Деформация сетки любого слоя в реальном времени
- Простое добавление узлов и изменение формы сетки
- Полностью редактируйте узлы с помощью знакомых элементов управления кривой
Полный набор инструментов для пластики
- Функция «Пластика» для искажения изображения
- Неразрушающий фильтр Live Liquify (использует Liquify Persona)
- См.
 деформации пользовательской сетки
деформации пользовательской сетки - Кисти «Нажать вперед» и «Нажать влево»
- Щетки Twil и Turbulence
- Сохранение и клонирование мешей для повышения эффективности
- Изменение интенсивности деформации с помощью ползунка Reconstruct Mesh
- Инструменты редактирования сетки и маски
- Смотрите раздельное изображение до и после
- Используйте расширенные элементы управления кистью для точной настройки деформации
- Встроенная история только для ваших шагов Liquefy
Расширенная гистограмма
- Просмотр всего изображения или выбранных каналов
- Ограничить вычисление гистограммы текущим слоем или выделением
- См. грубую гистограмму скорости, нажмите, чтобы уточнить
Усовершенствованное гамма-смешивание, диапазоны смешения и сглаживание
- Редактируемая цветовая гамма пространства смешения RGB для каждого объекта или слоя
- Применение нескольких значений в линейных или нелинейных смесях
- Установка параметров для значений по умолчанию
- Сохранение пользовательских карт покрытия для повторного использования
- Послойное иерархическое сглаживание
Новый
Диапазоны смешивания используют ускорение графического процессора
Подробная информация об изображении (только для настольных компьютеров)
- Просмотр подробного изображения и информации о яркости в режиме реального времени
- Мониторинг нехватки памяти и эффективности
- Информация отображается для всех цветовых пространств
- Переключение между различными областями и представлениями гистограммы
Метаданные EXIF
- Просмотр сводки, полных и необработанных метаданных
- Получить подробную информацию о фокусе в режиме разработки
- EXIF и другие поддерживаемые типы данных на основе XML
Инструменты кисти
- Инструмент «Пиксельная кисть с жесткими краями» для ретро-арта и тонкой прорисовки пользовательского интерфейса
- Полный ассортимент текстурированных насадок-кистей, которые подходят для всех инструментов-кистей
- См.
 ниже полную информацию о кистях и элементах управления
ниже полную информацию о кистях и элементах управления
Цвет
Профессиональный цвет
- Истинный сквозной CMYK
- Цветовые модели RGB, RGB Hex, LAB, CMYK и оттенки серого
- Профили управления цветом ICC и преобразование
- Плавное переключение между цветовыми режимами на лету
- Копировать шестнадцатеричные значения в буфер обмена
- Используйте цвета Pantone ®
- Установка способа рендеринга и компенсации черной точки (глобально и при преобразовании документа)
- Работа за границами цветового режима с выбранными настройками
- Сквозные рабочие процессы OpenColorIO (OCIO)
- Блокировка для предотвращения переключения цветового режима (только для настольных компьютеров)
Поддержка 16 бит на канал
- Режимы 16 бит на канал для пространств RGB/LAB/оттенков серого
- Включены 16-битные версии всех фильтров
- Работает на всем поддерживаемом оборудовании, без ограничений
Расширенный рендеринг
- Разделенный экран в реальном времени до/после просмотра для корректировок и разработки образа
- Предварительный просмотр в реальном времени каркаса, пикселей и сетчатки/пикселей с высоким разрешением
- Пользовательское гамма-смешивание для каждого объекта
Умная палитра цветов
- Специальный инструмент для фотоперсонажа
- Точно выберите цвет с помощью лупы над любой частью экрана
- Выборка, усредненная по точкам или цветам
- Выборка из текущего или всех слоев
- Захват в исходном цветовом пространстве, включая цвета CMYK, RGB и LAB
- Простая панель выбора цвета в качестве альтернативы
Палитры и образцы
- Использование цветов и палитр на основе всех доступных цветовых моделей
- Автоматически создавать палитры на основе цветов документа
- Импорт файлов Adobe ® Swatch Exchange (.
 ase) (только для настольных компьютеров)
ase) (только для настольных компьютеров) - Отображение палитр, созданных в других приложениях с использованием системных цветовых палитр Apple
- Используйте системную палитру цветов macOS
- Создание дополнительных, аналоговых и других цветовых аккордов (только для рабочего стола)
- Встроенные образцы цветов, оттенков серого и градиентов
- Создание палитры из любого изображения (только для рабочего стола)
Глобальные цвета (только для настольных компьютеров)
- Обновление объектов в документе при изменении их основного цвета
- Уровни оттенка сохраняются при обновлении основного цвета
- Используйте сплошные цвета или градиенты
Расширенное масштабирование и повторная выборка
- Изменение размера изображений или только холста
- Привязка холста, изменение единиц измерения и сохранение соотношения сторон
- Автоматическое масштабирование смешанных иллюстраций для получения результатов высочайшего качества
- Lanczos 3, бикубическая, билинейная и передискретизация ближайших соседей доступны
- Алгоритмы Pixel Art для повышения дискретизации пиксельной графики
Профессиональный цвет, совместимость и вывод
Соответствие цвета Pantone
®
- PANTONE ® Goe ™
- PANTONE ® GoeBridge™
- PANTONE ® + Formula Guide Solid (V2)
- PANTONE ® + CMYK
- PANTONE ® + цветной мостик (V2)
- PANTONE ® + металлик, неон и пастель
- Варианты с покрытием и без покрытия
Поддержка Photoshop
® PSD
- Точное открытие/сохранение файлов Adobe ® Photoshop ® PSD (включая 32-разрядную версию)
- Открытие очень больших файлов PSB
- Сохранение слоев, групп, градиентов, режимов наложения, контуров, масок и т.
 д.
д. - Поддерживает профессиональные цветовые режимы
- Использование PSD в другом поддерживаемом программном обеспечении
- Редактируемые встроенные смарт-объекты Photoshop PSD
- Плоское представление изображения PSD
PDF открыть и поместить
- Редактирование и сохранение PDF-файлов для совместимости с приложениями туда и обратно
- Сквозная передача PDF для абсолютной точности вывода (только для настольных компьютеров)
Pro Print и поддержка PDF/X
- Создание и редактирование файлов CMYK PDF/X для профессиональной печати
- Совместимость с PDF/X-1a, PDF/X-3 и PDF/X-4
- Использовать плашечные цвета
- Применить элементы управления надпечаткой
- Добавить метки обрезки, выпуска за обрез и обрезки
- Применение цветовых профилей ICC внутри и во время экспорта
Оптимизированная печать
- Печать напрямую из Affinity Photo
- Переключение между стандартным и расширенным диалоговыми окнами
- Управление компоновкой, масштабированием, согласованием цветов и обработкой бумаги
- Доступ к функциям драйвера принтера
- Сохранить как PDF из диалогового окна печати
Полный список открытия или импорта
- Adobe ® Фотошоп ® PSD
- Adobe ® Photoshop ® PSB
- Обширная библиотека импорта RAW (включая CR3)
- ДНГ
- PNG
- ТИФФ
- 12-битный TIFF в оттенках серого
- JPG
- GIF
- ТГА
- СВГ
- EPS
- PDF (улучшенный)
- PDF/X
- EXR (открытый EXR)
- HDR (Яркость)
- Adobe ® Illustrator ® AI (содержащий поток PDF)
- Устаревшие Adobe ® Illustrator ® Файлы AI
- Adobe ® FreeHand ® (версии с 9 по 11)
- Собственный файл Affinity Designer (только для настольных компьютеров)
- Собственный файл Affinity Publisher (включая навигацию по страницам)
- HEIF с картой глубины (как отдельный слой)
Полный список сохранения или экспорта
- Шаблон издателя (.
 aftemplate)
aftemplate) - Adobe ® Photoshop ® PSD
- TIFF (слои сохранены)
- PNG
- JPG
- Прогрессивный JPG
- GIF
- СВГ
- EPS
- EXR (открытый EXR)
- HDR (Яркость)
- PDF (также можно открыть в Adobe ® Illustrator ® ) (улучшено)
- ПДФ/Х-1а, ПДФ/Х-3, ПДФ/Х-4
- Общий формат файла Affinity
Экспорт документа
- Экспортировать как весь документ или текущий выбор
- Исключить фон из выбора
- Передискретизация
- Калькулятор размера файла
Экспорт пресетов
- Создание собственных предустановок экспорта
- Используйте популярные стили, поставляемые с Affinity Photo
- Используйте предустановки для сохранения целых изображений или определенных областей
- Установите формат экспорта по умолчанию
Срезы и графика Retina/high DPI
- Вывод отдельных слоев, групп или изображений в виде фрагментов
- Рисование фрагментов нестандартного размера во время экспорта
- Автоматически создавать срезы при размере слоя
- Автоимя файлов экспорта с использованием имен слоев/фрагментов
- Используйте предустановки фрагментов для популярных форматов изображений
- Применить предустановки слайсов к выбранным слайсам (только для рабочего стола)
- Несколько настроек экспорта, форматов и разрешений для каждого фрагмента (только для настольных компьютеров)
- Выводить все слайсы сразу, только один слайс или выбранные слайсы
- Скрыть содержимое слоя во время экспорта
- Исключить содержимое слоя из экспорта
- Вывод стандартной графики и графики с разрешением Retina/высоким разрешением за один раз
- Версии Retina/high DPI автоматически именуются с суффиксами @2x и @3x
- Экспорт в абсолютные размеры (только для настольных компьютеров)
- Доставка ресурсов дизайна пользовательского интерфейса (iOS)
Расширенный контроль экспорта
- Непрерывный экспорт обновляет файлы при каждом изменении изображения или дизайна
- Поддерживать EXIF или другие метаданные на выходе
- Встроить профиль ICC с экспортированным изображением
- Применение матового цвета
Эффективный формат файла Affinity
- Компактный и быстрый собственный формат файлов
- Также полностью редактируется в Affinity Designer и Affinity Publisher
Рабочие области и рабочие процессы
Простая настройка с диалоговым окном «Новый документ» (только для настольных компьютеров)
- На основе эскизов
- Предустановки для различных типов вывода, напр.
 Интернет
Интернет - Создание собственных пользовательских пресетов страниц
- Доступ к шаблонам фотографий (.aftemplate)
Пользовательские макеты панелей Studio (только для настольных компьютеров)
- Доковые или плавучие панели
- Группируйте и заказывайте панели по своему усмотрению
- Скрывайте и расширяйте панели по мере необходимости
- Названия динамических панелей позволяют сосредоточиться на том, что вы используете
- Создание и сохранение предустановок панели (и панели инструментов)
Повернуть холст
- Поверните рабочее пространство для более естественной ретуши и рисования
- Используйте клавиши, меню, сенсорные жесты и элементы управления графическим планшетом (только для настольных компьютеров)
- Отключить вращение холста для предотвращения случайного использования
- Поворот вида документа (холста) с помощью CMD/CTRL+колесо прокрутки мыши
Режимы экрана (только для рабочего стола)
- Работа с одним экраном или с несколькими мониторами
- Оптимизировано для обычных экранов и экранов Retina/высокого разрешения
Настраиваемые сочетания клавиш (только для рабочего стола)
- Применяйте свои любимые стили для максимально быстрого рабочего процесса
- Сохранение и загрузка наборов ярлыков
- Поддерживаются популярные сочетания клавиш
Настраиваемые панели инструментов (только для настольных компьютеров)
- Создание собственных панелей инструментов или настройка существующих панелей
- Изменение положения и реорганизация групп инструментов
- Настройка основной панели инструментов на один или несколько столбцов
- Добавьте кнопки панели инструментов для конкретных функций, которые вам нравятся, с помощью
Мощная история и снимки
- Мгновенное пролистывание более 8000 шагов истории
- Сохранить историю, чтобы вернуться к шагам из предыдущих сеансов
- Прокрутить процессы в файлах других фотографов
- Отмена действий, выполненных в других приложениях Affinity Suite
- Бесшовное автосохранение защищает от неожиданного завершения работы (только для настольных компьютеров)
- Сохранять состояния редактирования как снимки, чтобы вернуться к ним позже
Панель преобразования
- Точное перемещение и масштабирование с помощью панели Transform
- Введите значения в смешанных единицах
- Выполнение вычислений с использованием стандартных выражений
- Включить математические выражения, такие как Pi и Phi (только для настольных компьютеров)
Предварительный просмотр стоковых изображений
- Поиск стоковых изображений в Affinity Photo
- Добавьте предварительный просмотр в стек слоев в качестве рекомендаций
- Поиск коммерческих изображений и изображений, выпущенных моделью
- Stock Panel для доступа к бесплатным ресурсам изображений
Настройте параметры инструмента и пользовательского интерфейса
- Светлый или темный пользовательский интерфейс
- Настройка уровней серого фона и пользовательского интерфейса
- Задайте поведение и внешний вид инструмента в настройках
- Управляйте тем, как устройства ввода помогают вашему рабочему процессу
- Увеличение/уменьшение размера элемента управления инструментом и размера текста пользовательского интерфейса
Навигатор
- Посмотрите на миниатюру, где увеличено окно просмотра
- Сохранение представлений и быстрое переключение между представлениями (только для рабочего стола)
Эффективное копирование/вставка
- Высокая совместимость копирования/вставки изображений и векторов для других приложений
- Копирование/вставка в приложениях Affinity с форматированием или без него
- Вставка форматирования или эффектов из одного элемента в другой
- Копирование/вставка объединены для выравнивания
- Вставить внутрь и вставить выше/ниже/внутри текущего слоя
Дополнительные живые помощники
- Вся помощь ненавязчива и может быть скрыта/отключена/настроена
- Строка подсказок в нижней части пользовательского интерфейса содержит полезные подсказки (только для настольных компьютеров)
- Контекстная панель инструментов предоставляет живые элементы управления и параметры для каждого инструмента
- Assistant Manager настраивает слой, маску, кисть и поведение настройки
- Выберите, как Affinity Photo управляет задачами дизайна с использованием смешанных материалов
Активы для легкого доступа к сохраненному контенту
- Специальная панель для хранения активов
- Отлично подходит для хранения вырезок, фигур, мазков кисти и водяных знаков
- Импорт/экспорт активов
композитинг
- Изображения, размещенные как слои изображения, чтобы сохранить DPI и цветовое пространство
- Размещение нескольких изображений по щелчку для компоновки (только для настольных компьютеров)
- Управление DPI/масштабированием для всех размещенных изображений и документов (только для рабочего стола)
Новый
Перетаскивание файлов с нажатой клавишей Alt/Option предоставляет варианты размещения на панели «Поместить изображения».

Управление ресурсами (только для настольных компьютеров)
- Предупреждение об отсутствии ресурса при загрузке документа
- Политика размещения связанных/встроенных изображений при настройке документа
- Специализированный диспетчер ресурсов для управления изображениями/документами
- Показать статус размещенного изображения (или документа)
- Преобразование ресурсов из встроенных в связанные (и наоборот)
- Рекурсивные ссылки на ресурсы учитываются
- Собрать связанный ресурс в папку sidecar для переносимости проекта
Усовершенствования диспетчера ресурсов
Новый
Повторно связать несколько отсутствующих изображений «одной и той же папки» за одну операцию.
Новый
Включить/выключить столбцы
Новый
Столбец «Новый тип файла»
Новый
Файлы EPS могут быть связаны
Новый
Улучшения при управлении размещенными документами
Живые фильтры, настройки и эффекты
Живые корректирующие слои
- Уровни
- Баланс белого
- HSL (с цветовыми диапазонами оттенков и палитрой цветов)
- Перекрасить
- Черно-белый
- Яркость и контрастность
- Постеризация
- Вибрация
- Экспозиция
- Тени/Света (улучшено)
- Порог
- Кривые
- Канальный микшер
Новый
Карта градиента с глобальной поддержкой цвета (с аппаратным ускорением)
- Выборочный цвет
- Цветовой баланс
- Инверсия
- Мягкая проба
- 3D LUT (Трехмерная справочная таблица для настроек)
- Фильтр для объектива
- Раздельное тонирование
- Совместно используемые LUT
Слои живого фильтра
- Размытие по Гауссу
- Размытие коробки
- Срединное размытие
- Двустороннее размытие
- Размытие в движении
- Радиальное размытие
- Размытие объектива
- Эллиптическая глубина резкости
- Глубина резкости с наклоном и сдвигом
- Размытие поля
- Рассеянное свечение
- Максимальное/минимальное размытие
- Ясность
- Нерезкая маска
- Высокий проход
- Пульсация
- Вихревой
- Сферический
- Смещение
- Зажим/пробойник
- Искажение объектива
- Перспектива
- «Пластика» (с использованием образа «Пластика»)
- Денойз
- Добавить шум
- Рассеянный
- Пыль и царапины
- Виньетка
- Удаление каймы
- Освещение
- Тени/Света
- Полутона
- Процедурная текстура (с расширенными настройками)
- Вороной
Неразрушающее редактирование
- Живые, редактируемые фильтры, настройки, эффекты слоя и режимы наложения
- Просматривайте эффекты, режимы наложения и настройки мгновенно, без задержек
- Применить к любому слою изображения, группе — даже к векторному рисунку
- Редактируйте в любое время, вносите изменения без использования отмены
- Редактировать режимы наложения для каждого слоя, корректировки, фильтра, объекта и т.
 д.
д. - Действовать по запросам клиентов без дорогостоящей доработки
Эффекты живого слоя
- Размытие по Гауссу
- Внешняя тень
- Внутренняя тень
- Внешнее свечение
- Внутреннее свечение
- Контур
- 3D
- Скос/тиснение
- Цветное наложение
- Наложение градиента
- Эффекты слоя теперь работают с глобальными цветами
Живые режимы наложения
- Обычный
- Затемнить
- Более темный цвет
- Умножить
- Цветной затемненный
- Линейная запись
- Осветлить
- Более светлый цвет
- Экран
- Цвет Додж
- Добавить
- Накладка
- Мягкий свет
- Жесткий свет
- Яркий свет
- Штыревой фонарь
- Линейный свет
- Жесткая смесь
- Разница
- Исключение
- Вычесть
- Разделить
- оттенок
- Насыщенность
- Светимость
- Цвет
- Средний
- Отрицание
- Отражение
- Свечение
- Отрицательный контраст
- Стереть
Профессиональные инструменты рисования, эскиза и текстуры
Профессиональные кисти
- Добавьте глубины с помощью закругленных и текстурированных инструментов ретуширования
- Окрашивание с использованием высококачественных профессиональных насадок-кистей
- Создавайте картины любого размера, закрашивайте изображения любого размера без задержки
- Предварительный просмотр кисти на странице устанавливает ширину, твердость, расстояние между соплами и поворот
- Имитация натуральных материалов, включая акварель
- Настройте непрозрачность (накопление), жесткость, расстояние, поток, форму, вращение и яркость
- Чувствительность к давлению (дрожание) к вышеуказанным свойствам кисти
- Поддержка мокрого края с настраиваемыми профилями рампы
- Мультикисти (сочетание кистей для более интересного и менее равномерного мазка)
- Симметрия кисти (до 32 направлений) и опциональное зеркальное отображение кисти (до пяти отражений)
- Кисти с несколькими текстурами сопел могут устанавливать свой собственный контроллер/линейное изменение сопел
- Мокрые края и накопление теперь на цветных кистях/кистях с HSL variance
- Вращение сопла с помощью клавиш со стрелками влево и вправо (до и во время приложения хода)
- Прямые мазки, ограниченные осью X или Y
- Создание кистей изображений из любого выделенного пикселя
- Создание кистей интенсивности из любого выбора пикселей маски
Стабилизация инсульта
- Включить стабилизатор для очень плавных мазков кистью
- Веревочный режим или режим Windows для различных режимов сглаживания
Импорт/экспорт кистей
- Добавление наборов кистей Affinity из внешних источников и бесплатных подарков
- Импорт кистей Adobe ® (файлы .
 abr)
abr) - Экспорт пакетов кистей, чтобы поделиться с другими или создать их резервную копию
- Простая установка набора щеток двойным щелчком
- Общий доступ к кистям для использования в Affinity Designer
Пользовательские кисти
- Создание полностью настраиваемых растровых кистей с использованием собственных текстур
- Настройка поведения и параметров кисти, таких как влажные края и режим наложения
- Организация кистей по собственным категориям
- Установка кистей, сделанных другими пользователями
Планшет и сенсорное управление (только для настольных компьютеров)
- Рисование под давлением с помощью графических планшетов
- Расширенные элементы управления, такие как наклон, угол, скорость и другие входные данные
- Сопоставление кнопок графического планшета и команд колесика стилуса
- Поворот холста, панорамирование и масштабирование с помощью жестов трекпада
Векторы и дизайн смешанной дисциплины
Создание исходных векторов
- Рисование контуров и фигур с помощью лучшего в своем классе инструмента «Перо»
- Преобразование фигур в выборки
- Используйте библиотеку фигур, включающую интеллектуальные узлы настройки
- Полное редактирование контуров и фигур с помощью знакомого инструмента узла
- Выбор нескольких узлов, выравнивание и преобразование
- Привязка кривых и построений
- Пресеты для фигур или сохранение собственных фигур
Импорт/экспорт векторных изображений
- Открытие и редактирование файлов SVG, EPS, PDF, FH и AI
- Вывод SVG для эффективной веб-графики
- Сохранить как PDF или EPS для совместимости
Красивые градиенты
- Сверхплавные градиенты для наложений, фигур и масок
- Живые инструменты для перетаскивания градиентов на экран
- Перетаскивайте цвета на пути и узлы градиента
- Линейные и радиальные градиенты реагируют на масштабирование/сдвиг объекта с помощью редактирования манипулятора заполнения с перекосом
Шум и непрозрачность в градиентах
- Добавление текстуры к градиентам с шумом
- Смешивание цветных заливок и наложений с непрозрачностью
- Постепенно смешивайте шум и непрозрачность так же легко, как цвет
Вспомогательные средства для дизайна изображений/документов
- Добавление полей и направляющих
- Многоколонные направляющие
- Скрыть/показать линейки (только для рабочего стола)
- Изменение исходного положения разворота (только для настольных компьютеров)
- Переместите направляющие из области линейки при использовании нескольких инструментов (только для рабочего стола)
- Добавление пользовательских направляющих с помощью линеек или путем ввода значений (только для настольных компьютеров)
- Направляющие для измерения при перетаскивании
- Система привязки на основе кандидатов, включая Force Pixel Alignment
- Цветные квадратные, треугольные и аксонометрические сетки
Выровненная по пикселям графика
- Создание точных иллюстраций для веб-дизайна и дизайна пользовательского интерфейса
- Предварительный просмотр с точностью до пикселя при обычном уровне и уровне сетчатки/высоком разрешении на дюйм
- Привязка к сетке
- Динамическая привязка выравнивает элементы на лету
- Расширенные элементы управления привязкой включают сохраняемые предустановки
- Исключить объекты из привязки
- Привязка к границам выделения пикселей
Выравнивание и распространение
- Выравнивание по левому краю, центру, правому краю, верхнему, среднему, нижнему краю
- Маркеры выравнивания для точного выравнивания выделения по позиции на странице
- Работает с границами выделения, разворотом (монтажной областью), полями, первым/последним выделенным
- Автоматическое распределение элементов для равномерного распределения
- Простое управление Z-порядком с помощью слоев, панелей инструментов или сочетаний клавиш
Плавное переключение приложений
- Перемещение работы между продуктами Affinity
- (Affinity Designer и Affinity Publisher можно приобрести отдельно)
Общий формат родства и история
- Создавайте дизайн для разных дисциплин так же легко, как переключая инструменты или персонажей
- Сохраните файл в Affinity Photo или Affinity Designer, они полностью совместимы
- Отмена задач, выполненных в других приложениях Affinity
Точная типографика
Поддержка профессиональных шрифтов
- Добавление элегантного текста с помощью шрифтов OpenType, Type 1 и True Type
- Используйте расширенные функции OpenType, включая лигатуры
- Вставка текста-заполнителя при создании дизайна
- Вставка специальных символов и символов
- Скопируйте и вставьте стиль между объектами
- Резервные шрифты
Новый
Улучшено редактирование текста IME для японского и упрощенного китайского языков.

Новый
Добавлена поддержка эмодзи.
Предварительный просмотр шрифтов в реальном времени
- Предварительный просмотр шрифтов происходит мгновенно при создании или настройке текста
- Доступ к шрифтам по коллекциям для повышения эффективности
- Сначала просмотреть недавно использованные шрифты (только для настольных компьютеров)
- Просмотр последних, использованных или ваших любимых шрифтов (только для настольных компьютеров)
Живые предварительные просмотры функций OpenType
- На панели «Типографика» отображаются предварительные просмотры функций в реальном времени
- Простой выбор нужного стилистического набора каждый раз
- Предварительный просмотр лигатур, контекстных альтернатив, росчерков и многого другого
Браузер глифов
- Быстро вставляйте в текст специальные символы
- Отображение в порядке глифа или Юникода
- Фильтр по подмножеству шрифтов, например.

PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фромм П., Джордан П. и Краусс Н. (2001). Строение фотосистемы I. Биохим. Биофиз. Acta 1507, 5–31. doi: 10.1016/S0005-2728(01)00195-5
CrossRef Полный текст | Google Scholar
Гараб, Г. (2014). Иерархическая организация и структурная гибкость мембран тилакоидов. Биохим. Биофиз. Acta 1837, 481–494. doi: 10.1016/j.bbabio.2013.12.003
Биохим. Биофиз. Acta 1837, 481–494. doi: 10.1016/j.bbabio.2013.12.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гараб, Г. (2016). Самосборка и структурно-функциональная гибкость оксигенных фотосинтетических механизмов: личные перспективы. Фотосинтез. Рез. 127, 131–150. doi: 10.1007/s11120-015-0192-z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Глейзер А. Н. (1989). Направленная передача энергии в фотосинтетической антенне. Дж. Биол. хим. 264, 1–4.
Реферат PubMed | Google Scholar
Голбек, Дж. Х. (2006). Фотосистема I: управляемый светом пластоцианин: ферредоксин оксидоредуктаза . Дордрехт: Спрингер.
Google Scholar
Граболь М. и Дау Х. (2005). Энергетика первичного и вторичного переноса электронов в мембранных частицах фотосистемы II шпината на основе рекомбинационно-флуоресцентных измерений. Биохим. Биофиз. Acta 1708, 209–218. doi: 10.1016/j.bbabio.2005.03.007
doi: 10.1016/j.bbabio.2005.03.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гуськов А., Керн Дж., Габдулхаков А., Брозер М., Зуни А. и Сенгер В. (2009). Цианобактериальная фотосистема II с разрешением 2,9 Å и роль хинонов, липидов, каналов и хлорида. Нац. Структура Мол. биол. 16, 334–342. doi: 10.1038/nsmb.1559
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Хольцварт, А. Р., Мюллер, М. Г., Реус, М., Новачик, М., Сандер, Дж., и Рёгнер, М. (2006). Кинетика и механизм переноса электронов в интактной фотосистеме II и в изолированном реакционном центре: первичным акцептором электронов является феофитин. Проц. Натл. акад. науч. США 103, 6895–6900. doi: 10.1073/pnas.0505371103
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хоуп, А.Б. (2000). Перенос электронов между цитохромом f, пластоцианином и фотосистемой I: кинетика и механизмы. Биохим. Биофиз. Acta 1456, 5–26. doi: 10.1016/S0005-2728(99)00101-2
doi: 10.1016/S0005-2728(99)00101-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джонсон, член парламента (2016). Фотосинтез. Очерки биохимии. 60, 255–273. doi: 10.1042/EBC20160016
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джордан П., Фромм П., Витт Х. Т., Клукас О., Сенгер В. и Краусс Н. (2001). Трехмерная структура цианобактериальной фотосистемы I с разрешением 2,5 Å. Природа 411, 909–917. doi: 10.1038/35082000
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Камия Н. и Шен Дж. Р. (2003). Кристаллическая структура выделяющей кислород фотосистемы II из Thermosynechococcus vulcanus с разрешением 3,7 Å. Проц. Натл. акад. науч. США 100, 98–103. doi: 10.1073/pnas.0135651100
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Канади, Дж. С., и Агапи, Т. (2011). Синтетическая модель Mn3Ca-подсайта комплекса, выделяющего кислород, в фотосистеме II. Наука 333, 733–736. doi: 10.1126/science.1206036
Наука 333, 733–736. doi: 10.1126/science.1206036
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Каваками К., Умена Ю., Камия Н. и Шен Дж. Р. (2009). Расположение хлорида и его возможные функции в фотосистеме II с выделением кислорода, выявленные методом рентгеноструктурного анализа. Проц. Натл. акад. науч. США 106, 8567. doi: 10.1073/pnas.0812797106
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Керн Дж., Алонсо-Мори Р., Тран Р., Хаттне Дж., Гильдеа Р. Дж., Эколс Н. и др. (2013). Одновременная фемтосекундная рентгеновская спектроскопия и дифракция фотосистемы II при комнатной температуре. Наука 340, 491–495. doi: 10.1126/science.1234273
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кирхгоф, Х. (2013). Архитектурные переключатели в растительных тилакоидных мембранах. Фотосинтез. Рез. 116, 481–487. doi: 10.1007/s11120-013-9843-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Kuhlbrandt, W. , Wang, D.N., and Fujiyoshi, Y. (1994). Атомная модель светособирающего комплекса растений методом электронной кристаллографии. Природа 367, 614–621. doi: 10.1038/367614a0
, Wang, D.N., and Fujiyoshi, Y. (1994). Атомная модель светособирающего комплекса растений методом электронной кристаллографии. Природа 367, 614–621. doi: 10.1038/367614a0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Купиц К., Басу С., Гротьохан И., Фромм Р., Зацепин Н. А., Рендек К. Н. и др. (2014). Серийная кристаллография фотосистемы II с временным разрешением с использованием фемтосекундного рентгеновского лазера. Природа 513, 261–265. doi: 10.1038/nature13453
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лабате, М. Т., Ко, К., Ко, З. В., Пинто, Л. С., Реал, М. Дж., Романо, М. Р., и др. (2004). Конститутивная экспрессия Lhcb 1-2 гороха в табаке влияет на развитие растений, морфологию и способность к фотосинтезу. Завод Мол. биол. 55, 701–714. doi: 10.1007/s11103-004-1963-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Liu, Z., Yan, H., Wang, K. , Kuang, T., Zhang, J., Gui, L., et al. (2004). Кристаллическая структура основного светособирающего комплекса шпината при разрешении 2,72 Å. Природа 428, 287–292. doi: 10.1038/nature02373
, Kuang, T., Zhang, J., Gui, L., et al. (2004). Кристаллическая структура основного светособирающего комплекса шпината при разрешении 2,72 Å. Природа 428, 287–292. doi: 10.1038/nature02373
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лолл Б., Керн Дж., Сенгер В., Зуни А. и Бесиадка Дж. (2005). На пути к полному расположению кофакторов в структуре разрешения 3,0 Å фотосистемы II. Природа 438, 1040–1044. doi: 10.1038/nature04224
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мукерджи С., Стулл Дж. А., Яно Дж., Стамататос Т. С., Прингури К., Стич Т. А. и др. (2012). Синтетическая модель асимметричного [Mn3CaO4] кубанового ядра кислородообразующего комплекса фотосистемы II. Проц. Натл. акад. науч. США 109, 2257–2262. doi: 10.1073/pnas.11152
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Mullineaux, CW (2005). Функции и эволюция гран. Trends Plant Sci. 10, 521–525. doi: 10.1016/j.tplants.2005.09.001
10, 521–525. doi: 10.1016/j.tplants.2005.09.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мустарди Л., Баттл К., Штайнбах Г. и Гараб Г. (2008). Трехмерная сеть тилакоидных мембран растений: квазиспиральная модель сборки гранум-стромы. Растительная клетка 20, 2552–2557. doi: 10.1105/tpc.108.059147
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Нельсон, Н. (2011). Фотосистемы и глобальные эффекты оксигенного фотосинтеза. Биохим. Биофиз. Acta 1807, 856–863. doi: 10.1016/j.bbabio.2010.10.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нельсон Н. и Беншем А. (2004). Сложная архитектура оксигенного фотосинтеза. Нац. Преподобный Мол. Клеточная биол. 5, 971–982. doi: 10.1038/nrm1525
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нельсон Н. и Юнге В. (2015). Структура и перенос энергии в фотосистемах оксигенного фотосинтеза. год. Преподобный Биохим. 84, 659–683. doi: 10.1146/annurev-biochem-0
год. Преподобный Биохим. 84, 659–683. doi: 10.1146/annurev-biochem-0





 2008
2008 Анализ мутаций хромофор-связывающих остатков. Дж. Биол. хим. 274, 33510–33521. doi: 10.1074/jbc.274.47.33510
Анализ мутаций хромофор-связывающих остатков. Дж. Биол. хим. 274, 33510–33521. doi: 10.1074/jbc.274.47.33510 Механизмы фотозащиты и нефотохимического тушения в светособирающем комплексе гороха при разрешении 2,5 Å. EMBO J. 24, 919–928. doi: 10.1038/sj.emboj.7600585
Механизмы фотозащиты и нефотохимического тушения в светособирающем комплексе гороха при разрешении 2,5 Å. EMBO J. 24, 919–928. doi: 10.1038/sj.emboj.7600585 Природа 543, 131–135. doi: 10.1038/nature21400
Природа 543, 131–135. doi: 10.1038/nature21400 и Кроче Р. (2013). Сбор света в фотосистеме II. Фотосинтез. Рез. 116, 251–263. doi: 10.1007/s11120-013-9824-3
и Кроче Р. (2013). Сбор света в фотосистеме II. Фотосинтез. Рез. 116, 251–263. doi: 10.1007/s11120-013-9824-3 , Witt, H.T., Kern, J., Fromme, P., Krauss, N., Saenger, W., et al. (2001). Кристаллическая структура фотосистемы II из Synechococcus elongatus с разрешением 3,8 Å. Природа 409, 739–743. doi: 10.1038/35055589
, Witt, H.T., Kern, J., Fromme, P., Krauss, N., Saenger, W., et al. (2001). Кристаллическая структура фотосистемы II из Synechococcus elongatus с разрешением 3,8 Å. Природа 409, 739–743. doi: 10.1038/35055589 В фотосинтезе Пластидная биология Преобразование энергии и ассимиляция углерода в фотосинтезе и дыхании. Спрингер Дортрехт. 2012; 34: 501–560. [Google Scholar]
В фотосинтезе Пластидная биология Преобразование энергии и ассимиляция углерода в фотосинтезе и дыхании. Спрингер Дортрехт. 2012; 34: 501–560. [Google Scholar] Хортон П., Рубан А.В., Уолтерс Р.Г. Регулирование сбора света в зеленых растениях. Анну. Преподобный Завод Физиол. Завод Мол. биол. 1996; 47: 655–684. [PubMed] [Google Scholar]
Хортон П., Рубан А.В., Уолтерс Р.Г. Регулирование сбора света в зеленых растениях. Анну. Преподобный Завод Физиол. Завод Мол. биол. 1996; 47: 655–684. [PubMed] [Google Scholar] Нейлсон Дж.А., Дернфорд Д.Г. Структурно-функциональная диверсификация светособирающих комплексов фотосинтезирующих эукариот. Фотосинтез. Рез. 2010;106:57–71. [PubMed] [Google Scholar]
Нейлсон Дж.А., Дернфорд Д.Г. Структурно-функциональная диверсификация светособирающих комплексов фотосинтезирующих эукариот. Фотосинтез. Рез. 2010;106:57–71. [PubMed] [Google Scholar] Umena Y, Kawakami K, Shen JR, Kamiya N. Кристаллическая структура фотосистемы II, выделяющей кислород, при разрешении 1. A. Nature. 2011; 473:55–60. [PubMed] [Академия Google]
Umena Y, Kawakami K, Shen JR, Kamiya N. Кристаллическая структура фотосистемы II, выделяющей кислород, при разрешении 1. A. Nature. 2011; 473:55–60. [PubMed] [Академия Google] Фотосинтез рез. 2005; 85: 3–13. [PubMed] [Google Scholar]
Фотосинтез рез. 2005; 85: 3–13. [PubMed] [Google Scholar] Биохим. Биофиз. Акта. 2000;1459:239–247. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта. 2000;1459:239–247. [PubMed] [Google Scholar] Структура фотосистемы I и эволюция фотосинтеза. Биоэссе. 2005; 27: 914–922. [PubMed] [Google Scholar]
Структура фотосистемы I и эволюция фотосинтеза. Биоэссе. 2005; 27: 914–922. [PubMed] [Google Scholar] 1993 [Google Scholar]
1993 [Google Scholar] проц. Натл. акад. науч. США. 2010;107:4123–4128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2010;107:4123–4128. [Бесплатная статья PMC] [PubMed] [Google Scholar] Фоточ. Фотобио. науч. 2005;4:1091–1094. [PubMed] [Google Scholar]
Фоточ. Фотобио. науч. 2005;4:1091–1094. [PubMed] [Google Scholar] Х., Кроче Р., Басси Р., Гараб Г. Механизмы и эффекты фотосинтеза. Академическое издательство Клувера. 1998: 421–424. [Google Scholar]
Х., Кроче Р., Басси Р., Гараб Г. Механизмы и эффекты фотосинтеза. Академическое издательство Клувера. 1998: 421–424. [Google Scholar] Дж. Биол. хим. 2009; 284:15598–15606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Биол. хим. 2009; 284:15598–15606. [Бесплатная статья PMC] [PubMed] [Google Scholar] Дж. Мол. биол. 2000; 301:1123–1133. [PubMed] [Google Scholar]
Дж. Мол. биол. 2000; 301:1123–1133. [PubMed] [Google Scholar] CR Acad. науч. Париж. 1964;258:4622–4625. [PubMed] [Google Scholar]
CR Acad. науч. Париж. 1964;258:4622–4625. [PubMed] [Google Scholar] Матричная модель. Биохим. Биофиз. Акта. 1980;593:272–289. [PubMed] [Google Scholar]
Матричная модель. Биохим. Биофиз. Акта. 1980;593:272–289. [PubMed] [Google Scholar] Дуйсенс Л.Н. Перенос и улавливание энергии возбуждения в фотосистеме II. Сиба нашел симптом. 1978: 323–340. [PubMed] [Google Scholar]
Дуйсенс Л.Н. Перенос и улавливание энергии возбуждения в фотосистеме II. Сиба нашел симптом. 1978: 323–340. [PubMed] [Google Scholar] Биохим. Биофиз. Акта. 1979; 581: 87–95. [PubMed] [Академия Google]
Биохим. Биофиз. Акта. 1979; 581: 87–95. [PubMed] [Академия Google] Биохим. Биофиз. Акта. 1980; 593: 427–440. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта. 1980; 593: 427–440. [PubMed] [Google Scholar] Маршо Т.В., Кок Б. Регуляция фотосинтеза катионами в хлоропластах шпината. Биохим. Биофиз. Акта. 1974; 333: 353–365. [PubMed] [Google Scholar]
Маршо Т.В., Кок Б. Регуляция фотосинтеза катионами в хлоропластах шпината. Биохим. Биофиз. Акта. 1974; 333: 353–365. [PubMed] [Google Scholar] Растительная клетка. 2011; 23:1468–1479. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Растительная клетка. 2011; 23:1468–1479. [Бесплатная статья PMC] [PubMed] [Google Scholar] Биохимия. 1993; 32:3203–3210. [PubMed] [Google Scholar]
Биохимия. 1993; 32:3203–3210. [PubMed] [Google Scholar] In silico и биохимический анализ фотосинтетической антенны Physcomitrella patens: идентификация субъединиц, которые развились при адаптации к земле. ПЛОС ОДИН. 2008;3:e2033. [Статья бесплатно PMC] [PubMed] [Google Scholar]
In silico и биохимический анализ фотосинтетической антенны Physcomitrella patens: идентификация субъединиц, которые развились при адаптации к земле. ПЛОС ОДИН. 2008;3:e2033. [Статья бесплатно PMC] [PubMed] [Google Scholar] Дж. Биол. хим. 2005; 280:5163–5168. [PubMed] [Академия Google]
Дж. Биол. хим. 2005; 280:5163–5168. [PubMed] [Академия Google] Schmid VHR, Potthast S, Wiener M, Bergauer V, Paulsen H, Storf S. Пигментное связывание светособирающих белков фотосистемы I. Дж. Биол. хим. 2002; 277:37307–37314. [PubMed] [Академия Google]
Schmid VHR, Potthast S, Wiener M, Bergauer V, Paulsen H, Storf S. Пигментное связывание светособирающих белков фотосистемы I. Дж. Биол. хим. 2002; 277:37307–37314. [PubMed] [Академия Google] [PubMed] [Google Scholar]
[PubMed] [Google Scholar] Евро. Дж. Биохим. 2001; 268:6020–6028. [PubMed] [Google Scholar]
Евро. Дж. Биохим. 2001; 268:6020–6028. [PubMed] [Google Scholar] [PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar] , Басси Р. Связывание хлорофилла с мономерным светособирающим комплексом. Анализ мутаций остатков, связывающих хромофор. Дж. Биол. хим. 1999; 274:33510–33521. [PubMed] [Google Scholar]
, Басси Р. Связывание хлорофилла с мономерным светособирающим комплексом. Анализ мутаций остатков, связывающих хромофор. Дж. Биол. хим. 1999; 274:33510–33521. [PubMed] [Google Scholar] Янс П., Хольцварт А.Р. Роль ксантофиллового цикла и лютеина в фотозащите фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 182–193. [PubMed] [Google Scholar]
Янс П., Хольцварт А.Р. Роль ксантофиллового цикла и лютеина в фотозащите фотосистемы II. Биохим. Биофиз. Акта-Биоэнергия. 2012; 1817: 182–193. [PubMed] [Google Scholar] Завод Физиол. 1999;119:531–542. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Завод Физиол. 1999;119:531–542. [Бесплатная статья PMC] [PubMed] [Google Scholar] , Чанг В.Р., Рубан А. Молекулярные основы фотозащиты и контроля фотосинтетический светособирающий. Природа. 2005; 436: 134–137. [PubMed] [Академия Google]
, Чанг В.Р., Рубан А. Молекулярные основы фотозащиты и контроля фотосинтетический светособирающий. Природа. 2005; 436: 134–137. [PubMed] [Академия Google] проц. Натл. акад. науч. США. 1980; 77: 5253–5257. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 1980; 77: 5253–5257. [Бесплатная статья PMC] [PubMed] [Google Scholar] Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 420–426. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 420–426. [PubMed] [Google Scholar] Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 411–419.. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта-Биоэнергия. 2013; 1827: 411–419.. [PubMed] [Google Scholar]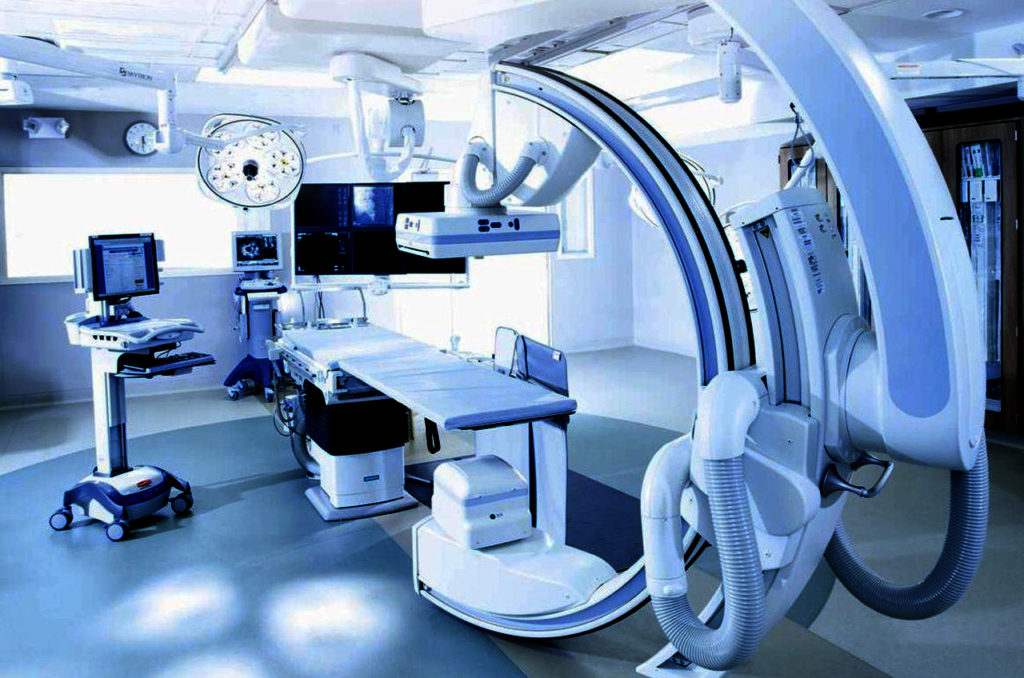 Биохимия. 1996;35:8572–8579. [PubMed] [Google Scholar]
Биохимия. 1996;35:8572–8579. [PubMed] [Google Scholar] 2010; 1797: 501–508. [PubMed] [Google Scholar]
2010; 1797: 501–508. [PubMed] [Google Scholar] Поляризованная флуоресцентная спектроскопия с выбранным сайтом изолированных частиц фотосистемы I. Биохим. Биофиз. Акта. 1994;1188:75–85. [Академия Google]
Поляризованная флуоресцентная спектроскопия с выбранным сайтом изолированных частиц фотосистемы I. Биохим. Биофиз. Акта. 1994;1188:75–85. [Академия Google] Mozzo M, Morosinotto T, Bassi R, Croce R. Изучение структуры Lhca3 с помощью анализа мутаций. Биохим. Биофиз. Акта-Биоэнергия. 2006; 1757:1607–1613. [PubMed] [Google Scholar]
Mozzo M, Morosinotto T, Bassi R, Croce R. Изучение структуры Lhca3 с помощью анализа мутаций. Биохим. Биофиз. Акта-Биоэнергия. 2006; 1757:1607–1613. [PubMed] [Google Scholar] Дженнингс Р.С., Зуккелли Г., Энгельманн Э., Гарласки Ф.М. Состояния длинноволнового хлорофилла растений LHCI при комнатной температуре: сравнение с PSI-LHCI. Биофиз. Дж. 2004; 87: 488–497. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дженнингс Р.С., Зуккелли Г., Энгельманн Э., Гарласки Ф.М. Состояния длинноволнового хлорофилла растений LHCI при комнатной температуре: сравнение с PSI-LHCI. Биофиз. Дж. 2004; 87: 488–497. [Бесплатная статья PMC] [PubMed] [Google Scholar] Биофиз. Дж. 2007; 93:2240–2254. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз. Дж. 2007; 93:2240–2254. [Бесплатная статья PMC] [PubMed] [Google Scholar] Л., Хаусман Д.Л. Скорость переноса Форстера для хлорофилла а. Фотохим. Фотобиол. 1979; 29: 1163–1167. [Google Scholar]
Л., Хаусман Д.Л. Скорость переноса Форстера для хлорофилла а. Фотохим. Фотобиол. 1979; 29: 1163–1167. [Google Scholar] Дж. Теор. биол. 1974; 46: 75–100. [PubMed] [Google Scholar]
Дж. Теор. биол. 1974; 46: 75–100. [PubMed] [Google Scholar] Влияние наружных антенных комплексов на скорость фотохимического захвата тилакоидов ячменя Photosystem II. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 276–286. [PubMed] [Академия Google]
Влияние наружных антенных комплексов на скорость фотохимического захвата тилакоидов ячменя Photosystem II. Биохим. Биофиз. Акта-Биоэнергия. 2005; 1706: 276–286. [PubMed] [Академия Google] Holzwarth AR, Muller MG, Niklas J, Lubitz W. Флуоресценция рекомбинации заряда в реакционных центрах фотосистемы I Chlamydomonas reinhardtii. Дж. Физ. хим. Б. 2005; 109:5903–5911. [PubMed] [Академия Google]
Holzwarth AR, Muller MG, Niklas J, Lubitz W. Флуоресценция рекомбинации заряда в реакционных центрах фотосистемы I Chlamydomonas reinhardtii. Дж. Физ. хим. Б. 2005; 109:5903–5911. [PubMed] [Академия Google] Кинетика разделения зарядов, ограниченная ловушками, в комплексах фотосистемы I высших растений. Биофиз. Дж. 2008; 94:3601–3612. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кинетика разделения зарядов, ограниченная ловушками, в комплексах фотосистемы I высших растений. Биофиз. Дж. 2008; 94:3601–3612. [Бесплатная статья PMC] [PubMed] [Google Scholar] , Дженнингс Р.К. Спектр времени жизни флуоресценции фотохимического комплекса ядра фотосистемы II растений не вызывает специфического тушения реакционных центров. Биохимия. 2008;47:10449–10457. [PubMed] [Google Scholar]
, Дженнингс Р.К. Спектр времени жизни флуоресценции фотохимического комплекса ядра фотосистемы II растений не вызывает специфического тушения реакционных центров. Биохимия. 2008;47:10449–10457. [PubMed] [Google Scholar] Биохимия. 2006; 45: 2436–2442. [PubMed] [Академия Google]
Биохимия. 2006; 45: 2436–2442. [PubMed] [Академия Google]