Содержание
Как ученые пытаются создать искусственные человеческие органы
Здоровье
И станет ли замена печени такой же привычной манипуляцией, как смена тормозных колодок в автомобиле.
Вадим Рощин
unsplash.com
В начале XXI века наука только-только подступалась к идее создания искусственных человеческих органов, которые можно было бы использовать для трансплантации. Спустя 20 лет десятки лабораторий по всему миру проводят эксперименты в этой области, мыши с искусственно выращенными яичниками приносят потомство, а производители косметики тестируют новинки на выращенной в пробирке коже – потому что на мышах и кроликах это делать теперь запрещено (по крайней мере в Европе). GQ поговорил с экспертами из трех российских центров, в которых пытаются наладить производство «запчастей» для человека, и о совершенно фантастических разработках, которые вот-вот изменят медицину и мир.
Биопринтинг
Биопринтинг – это «печать» тканей живых существ. Принцип такой же, как и в обычном офисном устройстве для распечатки документов, только вместо чернил из картриджа подается биоматериал – клетки различных тканей организма. К слову, первый биопринтер, созданный в 2001 году, представлял собой как раз модернизированный офисный девайс Hewlett Packard.
Юсеф Хесуани
Соучредитель и управляющий партнер лаборатории 3D Bioprinting Solutions.
«Многие представляют себе 3D-принтинг как послойную печать объектов из пластика согласно заданной цифровой модели – и это действительно самая близкая аналогия биопринтинга, – рассказывает Юсеф Хесуани, глава лаборатории 3D Bioprinting Solutions. – Естественно, мы избегаем в работе высоких температур, чтобы не повредить «расходный материал», в основе которого – белки. Способы печати бывают разными – мы, например, придумали технологию управления клетками с помощью магнитных полей. Исходный материал «левитирует» в жидкой питательной среде, а когда он попадает в магнитную ловушку – клетки начинают взаимодействовать друг с другом, и формируется нужная нам ткань.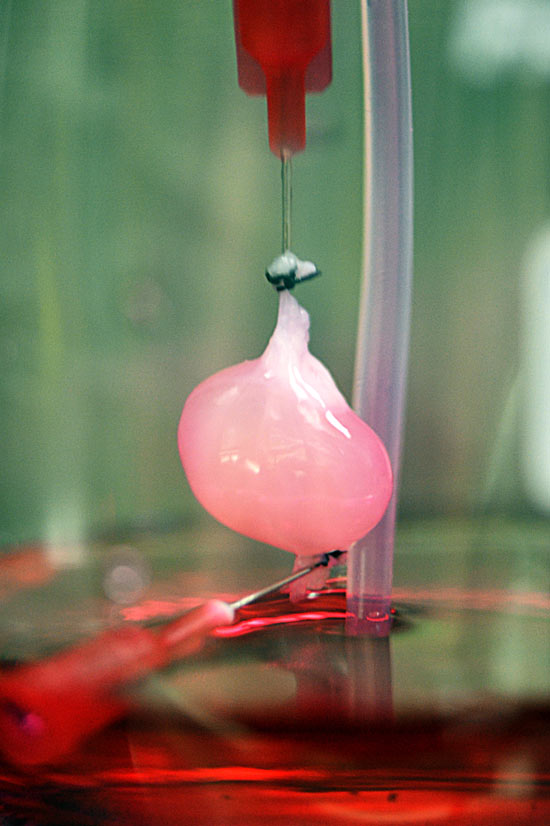 Еще одна технология – печать прямо в зоне дефекта, например, на месте повреждения кожи. Всю работу в этом случае выполняет роботический манипулятор, к которому мы приделали нашу форсунку с биоматериалами и для которого написали софт. Оператор выводит механическую руку в «точку ноль», а дальше робот сам начинает латать дефект».
Еще одна технология – печать прямо в зоне дефекта, например, на месте повреждения кожи. Всю работу в этом случае выполняет роботический манипулятор, к которому мы приделали нашу форсунку с биоматериалами и для которого написали софт. Оператор выводит механическую руку в «точку ноль», а дальше робот сам начинает латать дефект».
В российской лаборатории с помощью такого манипулятора уже проводили эксперименты по устранению дефектов кожи у крыс и минипигов. (За границей пошли еще дальше: в прошлом году интернациональная команда ученых в ОАЭ впервые сделала «заплатку» на коже человека.) Кроме того, в 2015 году в России напечатали мышиную щитовидную железу, которую потом успешно трансплантировали. Эксперимент доказал: биопринтинг позволяет создавать и заменять целые органы не только в теории, но и на практике. Щитовидную железу выбрали для опыта по нескольким причинам. Во-первых, легко проверить ее работоспособность – просто измерив уровень гормонов в крови. Во-вторых, в структуре щитовидки нет сложных участков, которые не могли бы воспроизвести существующие на данный момент принтеры. Тем временем ученые из Чикаго поставили схожий эксперимент – пересадили мышке напечатанный яичник. Опыт также был удачным, мышь дала потомство.
Тем временем ученые из Чикаго поставили схожий эксперимент – пересадили мышке напечатанный яичник. Опыт также был удачным, мышь дала потомство.
Биопринтер Fabion
На таком устройстве был создан «тканеинженерный конструкт» щитовидной железы мыши. Искусственную щитовидку успешно пересадили, гормональный баланс у грызуна был в норме.
А вот печатать жизнеспособные человеческие органы пока что мешают два ограничения. Первое – большой размер этих самых органов и, как следствие, их сложная структура. Современные технологии не позволяют создать внутри искусственного органа систему сосудов, необходимых для его нормальной работы после пересадки, – клетки внутри напечатанного объекта не получают питания и погибают от нехватки кислорода. В случае с мышиной щитовидной железой ученые использовали эмбриональные клетки, в которых уже заложена необходимая информация о сосудах, то есть условия для их прорастания были созданы заранее. Да и тот факт, что мышиный орган в десятки раз меньше человеческого, тоже сыграл важную роль в успешном завершении эксперимента.
Вторая проблема – нехватка материала. Для биопечати нужны клетки, которые сначала необходимо вырастить, а для этого требуется время. В случае с кожей, например, на подготовку уходит порядка 4–6 недель, но в целом у каждого типа клеток свои скорость и возможность деления. Клетки кожи и крови, например, постоянно обновляются – у них высокий регенеративный потенциал. А клетки эндокринных органов делают это значительно реже и воспроизводятся намного медленнее. Для печати мышиной щитовидной железы экспериментаторы взяли эмбриональные клетки, которые, по словам ученых, «дают отличный прирост в сотни процентов». Использование эмбриональных клеток человека в России запрещено, а клетки той же щитовидной железы растут заметно хуже, их прирост – всего 5–10 процентов.
Биопринтеры уже умеют «печатать» работоспособные органы животных и фрагменты кожи человека.
Наука развивается скачкообразно, и прорыв в сфере биопринтинга может случиться в любой момент: «В 2014 году Общество биофабрикации, членом которого является наша лаборатория, выпустило прогноз развития отрасли. И там говорилось, что искусственная кожа будет пересажена человеку примерно в 2030 году. А произошло это с опережением на десять лет, – говорит Юсеф Хесуани. – Поэтому вопрос о будущем – сложный. Биопринтинг – игра со множеством неизвестных. Когда мы открылись в 2013 году, мы были всего лишь шестой в мире коммерческой компанией, которая осваивала технологию трехмерной биопечати. А сейчас только производством биопринтеров занимаются больше 80 компаний в разных частях планеты, в том числе в Белоруссии и Армении».
И там говорилось, что искусственная кожа будет пересажена человеку примерно в 2030 году. А произошло это с опережением на десять лет, – говорит Юсеф Хесуани. – Поэтому вопрос о будущем – сложный. Биопринтинг – игра со множеством неизвестных. Когда мы открылись в 2013 году, мы были всего лишь шестой в мире коммерческой компанией, которая осваивала технологию трехмерной биопечати. А сейчас только производством биопринтеров занимаются больше 80 компаний в разных частях планеты, в том числе в Белоруссии и Армении».
В мире примерно половина компаний, экспериментирующих в области биопринтинга, существует с поддержкой государства, причем внимание этой технологии уделяют на самом высоком уровне. Так, весной президент США Джо Байден представил новый комитет по науке и объявил биопринтинг приоритетным направлением развития. Американцы уже готовят большую государственную программу, которая предусматривает солидные вложения в эту отрасль, поэтому можно предположить, что лучшие умы со всего мира будут переезжать поближе к этим деньгам.
По словам Юсефа Хесуани, заниматься наукой, запершись у себя в кабинете, сейчас крайне сложно, поэтому специалисты по биопринтингу из разных стран активно сотрудничают. Одновременно с этим развивается и конкуренция, ведь многие компании берут научные выкладки за основу бизнеса и уже могут похвастаться успешными кейсами их монетизации. Зарабатывать сегодня можно на производстве биопринтеров, расходных материалов к ним или же на печати образцов тканей – например, для исследования свойств лекарственных или косметических средств. Особенно это актуально в случае с клетками кожи: с 2012 года в Европе запрещены испытания косметики на животных, а тесты проводить нужно. Именно по этой причине гиганты уровня L’Oréal и BASF активно поддерживают компании, которые занимаются биопечатью кожи.
Биореакторы
Еще одно перспективное направление – выращивание органов в устройствах, именуемых биореакторами. В России этим занимаются в Национальном медицинском исследовательском центре трансплантологии и искусственных органов, а об особенностях технологии GQ рассказал глава центра Сергей Готье.
«Клетки не могут существовать в организме сами по себе – они закреплены на тонкой соединительнотканной основе, им там хорошо. В своих экспериментах мы в качестве такой основы используем специальные «подложки» – матриксы. У нас в институте разработаны и опробованы десятки матриксов и в итоге выбраны лучшие – те, которые могут обеспечить, например, жизнедеятельность хрящевых клеток и на основе которых можно вырастить новый хрящ. Но все-таки хрящ – это ткань, не орган. Основная задача, которую мы сейчас пытаемся решить, – обеспечить совместное существование большого количества клеток в одном конгломерате. Для этого нужно создать такую среду, которая могла бы не только питать клетки, но и выводить продукты распада, обмена веществ. Именно эту функцию и выполняют биореакторы, но в них пока что невозможно вырастить большой орган. Казалось бы, самая простая задача – создать миокардиоциты (мышечные клетки сердца. – Прим. GQ) и построить из них сердце. Мы делали такие попытки, и они были успешными, но пока только в случае с маленьким органом.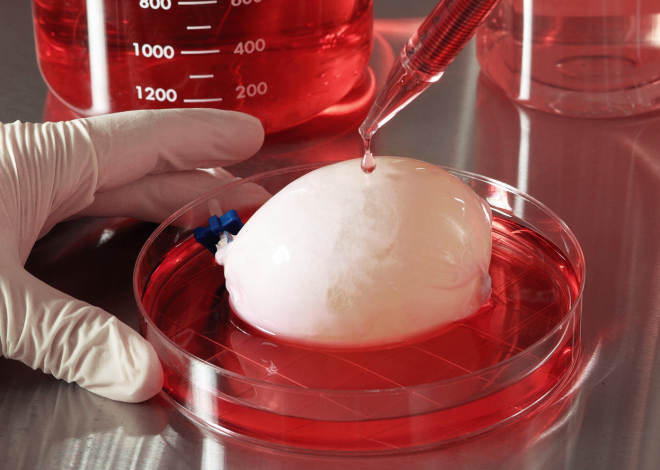 С сердцем мыши. Проблема в том, что сейчас у нас нет технологических возможностей для создания большого объема функционирующей ткани».
С сердцем мыши. Проблема в том, что сейчас у нас нет технологических возможностей для создания большого объема функционирующей ткани».
Сергей Готье
Директор НМИЦ трансплантологии и искусственных органов имени академика В. И. Шумакова Минздрава России.
Результаты экспериментов с биореактором помогают медикам и в других сферах – в том числе при восстановлении поврежденных донорских органов перед пересадкой. В российском Центре трансплантологии ежегодно проводят около 200 трансплантаций сердца (по мировым меркам это огромная цифра), а вот донорские легкие для пересадки используют намного реже. Причина в том, что легкие очень часто оказываются поврежденными при жизни человека и не годятся для операции. Что делать? Пытаться восстановить «некачественный» донорский орган вне организма. Выглядит это так: через кровеносную систему легких пропускают специально разработанный раствор, дыхательный аппарат имитирует вдохи и выдохи – создаются идеальные условия для регенерации клеток.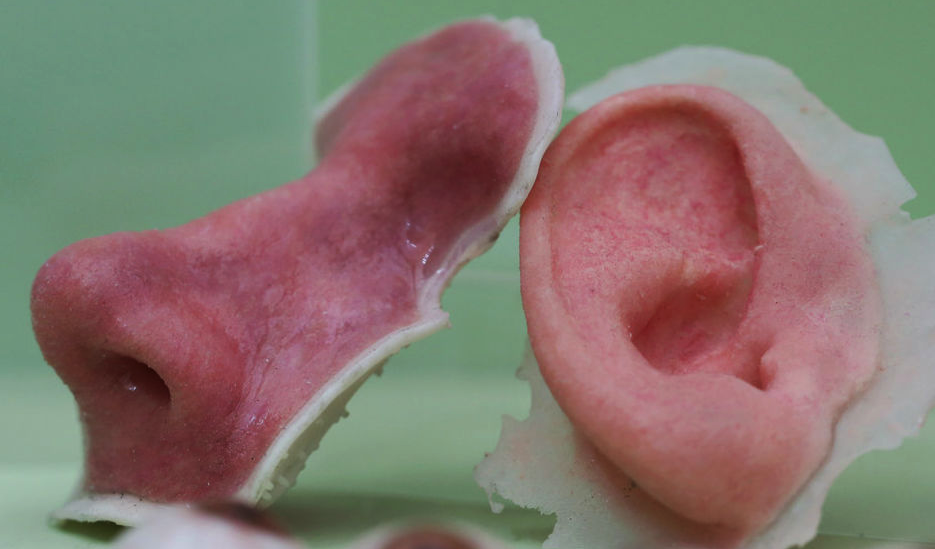 Таким образом можно восстановить до половины поврежденной ткани, а потом имплантировать «отремонтированный» орган пациенту.
Таким образом можно восстановить до половины поврежденной ткани, а потом имплантировать «отремонтированный» орган пациенту.
«Пока мы с вами ведем эту беседу, кто-то может совершить открытие, которое изменит медицину».
В ответ на вопрос, когда же в биореакторе получится вырастить полноценный орган, Сергей Готье просит воздержаться от каких-либо предсказаний: «Пока мы с вами ведем эту беседу, где-нибудь в Гонконге, в США или в России кто-то может воскликнуть: «Эврика!» – и совершить открытие, которое изменит медицину».
«Призрачные органы»
Третья технология, которая в будущем может лечь в основу производства «запасных частей» для человечества, – децеллюляризация. Необходимый орган (или его часть) в этом случае создается не с нуля. В качестве «каркаса» берется донорский орган, причем не обязательно человеческий. Затем будущую основу «отмывают» от клеток прошлого хозяина и «высаживают» на нее биоматериал будущего владельца. Полученный орган после трансплантации с меньшей вероятностью вызовет отторжение, так как организм будет воспринимать его как что-то знакомое и даже родное.
«Поместив донорский орган в специальные растворы, мы можем добиться того, что все его клетки будут смыты – останется только сетчатый каркас из фибриллярных белков, его «архитектурная основа», – объясняет Елена Петерсен из Центра внедрения геномных технологий МФТИ. – Далее мы заселяем каркас клетками пациента и при дальнейшем выращивании можем получить искусственный орган, который будет максимально естественным для будущего хозяина. Фактически речь идет о воссоздании взрослого органа с использованием донорского каркаса и специальным образом обработанных и пересаженных клеток пациента».
Эпитет «призрачные» появился из‑за бледно-белого цвета, который органы приобретают после децеллюляризации. А получающийся в итоге каркас, по сути, тот же матрикс. И трудности, с которым сталкивается технология, – такие же, как и у двух предыдущих. Метод выращивания полноценных трансплантатов на основе «бесклеточных заготовок» не может преодолеть барьер, связанный с доставкой кислорода и питательных веществ внутрь органа – наладить этот процесс пока не получается. Да, к любому объекту, пересаженному человеку, все равно прорастают сосуды – организм таким образом пытается его опознать, подвести к нему иммунные клетки. Загвоздка в том, что естественное формирование сосудов происходит медленнее, чем процесс гибели клеток внутри «призрачного органа» от нехватки питания и кислорода.
Да, к любому объекту, пересаженному человеку, все равно прорастают сосуды – организм таким образом пытается его опознать, подвести к нему иммунные клетки. Загвоздка в том, что естественное формирование сосудов происходит медленнее, чем процесс гибели клеток внутри «призрачного органа» от нехватки питания и кислорода.
Елена Петерсен
К. м. н., доцент департамента молекулярной и биологической физики МФТИ, заведующая лабораторией молекулярно-биологических и нейробиологических проблем и биоскрининга Центра внедрения геномных технологий МФТИ.
KUPRIANOFFOTO
Тем не менее эксперименты в этой области приносят все больше результатов. Так, наука уже дошла до пересадки человеку отдельных «отмытых» деталей – например, клапанов сердца. Раньше для этой операции использовались высушенные бычьи клапаны, которые сохраняли в себе клетки животного-донора. Сейчас человеку стараются трансплантировать «отмытые» части органов – иммунная реакция в этом случае менее выражена, риск отторжения ниже. В худшем случае картина выглядит так: иммунные клетки пациента обнаруживают чужеродные белки, начинается воспалительный процесс, пересаженный клапан перестает работать, возникают осложнения, и хирургам приходится проводить операцию по замене пересаженного клапана. А если заранее убрать все «враждебные» для человеческого организма клетки, то пересаженная деталь будет исправно выполнять свои функции и прослужит намного дольше. По словам Елены Петерсен, даже в сухих костных трансплантатах, используемых при протезировании зубов, сохраняются чужие клетки, и наш иммунитет их распознает. Когда чужих клеток не остается в принципе, реакция воспаления протекает практически незаметно, не приводя к каким-либо побочным эффектам.
В худшем случае картина выглядит так: иммунные клетки пациента обнаруживают чужеродные белки, начинается воспалительный процесс, пересаженный клапан перестает работать, возникают осложнения, и хирургам приходится проводить операцию по замене пересаженного клапана. А если заранее убрать все «враждебные» для человеческого организма клетки, то пересаженная деталь будет исправно выполнять свои функции и прослужит намного дольше. По словам Елены Петерсен, даже в сухих костных трансплантатах, используемых при протезировании зубов, сохраняются чужие клетки, и наш иммунитет их распознает. Когда чужих клеток не остается в принципе, реакция воспаления протекает практически незаметно, не приводя к каким-либо побочным эффектам.
«Я думаю, что в ближайшие лет 10–15 произойдет большой скачок в этой области, – резюмирует Елена, – а технология, которая приведет к созданию искусственных органов, скорее всего, будет смешанной, на стыке биопринтинга, трехмерных клеточных структур и сегментированной пересадки органов. Как пример – трансплантация долей печени, которая позволит постепенно вводить пересаженный орган в общую систему организма. Возможно, все это станет доступно нам уже в обозримом будущем».
Как пример – трансплантация долей печени, которая позволит постепенно вводить пересаженный орган в общую систему организма. Возможно, все это станет доступно нам уже в обозримом будущем».
Вероятно, вам также будет интересно:
Печать зубов на принтере и роботизированный осмотр. Какой будет стоматология завтра?
Что получается, когда мода и медицина объединяются
Фото: Gettyimages.com; Shutterstock/Fotodom; Владимир Купринов; архив пресс-службы
ТегимедицинаТехнологиитехнологии будущего
Выращивание органов: как это происходит?
В прессе то и дело мелькают сообщения о том, что ученые вырастили в пробирке почку или печень и уже научились печатать на 3D-принтере сердце или мозг. Такие новости обнадеживают обывателя, заставляя поверить: если вдруг что – обзавестись новой почкой не составит труда. В действительности все сложнее. Да, органы выращивают и даже успешно пересаживают их подопытным грызунам.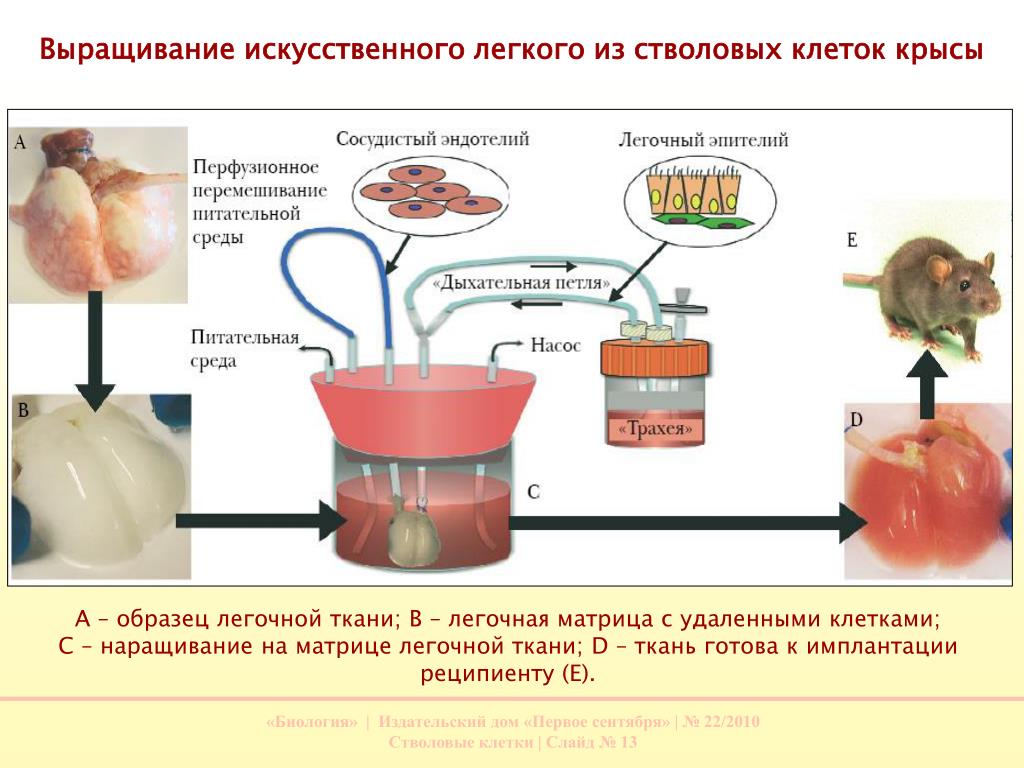 Но сам этот процесс очень сложный, долгий и не всегда предсказуемый. Регулярно случается так, что орган, несмотря на то, что технология его создания уже проработана, в итоге оказывается неприспособленным для терапевтического использования. Почему это случается? И как понять, что действительно вскоре станет обыденной процедурой в медицине, а что – является лишь основой для будущей революции?
Но сам этот процесс очень сложный, долгий и не всегда предсказуемый. Регулярно случается так, что орган, несмотря на то, что технология его создания уже проработана, в итоге оказывается неприспособленным для терапевтического использования. Почему это случается? И как понять, что действительно вскоре станет обыденной процедурой в медицине, а что – является лишь основой для будущей революции?
Термины и ассоциации
Самое популярное слово, используемое для характеристики процесса создания искусственных органов, – это «выращивание». В целом такой термин достаточно точно отражает суть рассматриваемого явления. Как, например, выращивают растение? Нужное зернышко бросают в почву, после чего удобряют. При выращивании органов происходит то же самое, с той разницей, что «зернышек» в почву бросают сразу много и самых разных. Саму же «почву» предварительно обрабатывают, придавая ей форму, соответствующую строению будущего органа.
Под «зернами» в данном случае подразумеваются клетки. Именно из них создают органы. Причем подчеркнем, не из одной-двух, а из нескольких десятков. «Почвой» являются «матриксы» – тканевые структуры, которые удерживают клетки вместе. Проще говоря, это основа, на которую нанизываются клетки. «Удобрениями» же для органа служат различные полезные вещества и элементы (цитокины, например), но также капилляры с кровью, которые нужно суметь правильно ввести. Этот процесс называется васкуляризация, его налаживание является одной из самых важнейших задач в биоинженерии. Но самое сложное – «подключить» готовый орган к нервной системе. Именно на этом этапе ученые чаще всего прогорают.
Именно из них создают органы. Причем подчеркнем, не из одной-двух, а из нескольких десятков. «Почвой» являются «матриксы» – тканевые структуры, которые удерживают клетки вместе. Проще говоря, это основа, на которую нанизываются клетки. «Удобрениями» же для органа служат различные полезные вещества и элементы (цитокины, например), но также капилляры с кровью, которые нужно суметь правильно ввести. Этот процесс называется васкуляризация, его налаживание является одной из самых важнейших задач в биоинженерии. Но самое сложное – «подключить» готовый орган к нервной системе. Именно на этом этапе ученые чаще всего прогорают.
К вопросу о клетках
Для создания органа необходимы стволовые клетки – то есть такие, которые еще не находятся на стадии развития и «не определились» со своей специализацией в организме. В зависимости от условий (количества цитокинов, структуры матрикса и т.д.) стволовая клетка может трансформироваться в нужную для конкретной задачи.
Клетки, уже «определившиеся» со своим назначением, называют специализированными. Их тоже можно использовать для выращивания органов, но для этого их нужно изменить, то есть вернуть в состояние стволовых клеток. Выбор типа клеток для создания органа зависит от определенной ситуации.
Их тоже можно использовать для выращивания органов, но для этого их нужно изменить, то есть вернуть в состояние стволовых клеток. Выбор типа клеток для создания органа зависит от определенной ситуации.
«Почва» для органов, или Что нужно знать о матриксах
Чаще всего используют матриксы из коллагенов разных типов, хитозана, фибрина и многих других веществ, а также из синтетических полимеров, к примеру, полиэтиленгликоля. Некоторые матриксы относятся к категории биодеградабельных. Такие сами со временем исчезают. Другие, наоборот, сохраняют свою форму на протяжении длительного периода. В биоинженерии используются оба вида, в зависимости опять же от ситуации и поставленных задач.
Создают матриксы по-разному. Вероятно, самый известный в массах способ – это 3D-печать. Но есть и другой – так называемый донорский. В качестве донорской основы для клеток часто используется трупный материал. Особенно «прославилась» в этом отношении трахея. Ее извлекают из тела умершего человека, очищают от клеток хозяина, а потом заселяют клетками того человека, которому требуется ее пересадка.
Исходя из этого, можно сказать, что сегодня ученые научились делать не органы в целом, а скорее основы для них, то есть матриксы. В мире есть всего несколько компаний, способных создать полноценный орган, что называется, с нуля, используя трехмерную биопечать (то есть 3D-принтер печатает орган напрямую клетками, заранее подготовленными для этой процедуры). Это очень сложная, требующая большой осторожности и точности работа.
И напоследок
Вне зависимости от того, идет ли речь о создании матрикса и последующем нанизывании на него клеток или печати готового органа на 3D-принтере, необходимо дорогостоящее оборудование, дорогие биокомпоненты и, конечно, опытные специалисты. Это значит, что как только появится очередное революционное открытие в данном направлении, воспользоваться его результатами смогут далеко не все и далеко не сразу. Определенно, настанет время, когда выращивание и пересадка органа нуждающемуся человеку не потребуют ни много усилий, ни много денег. Но не сейчас. Сейчас мы только на пути к этому и должны запастись терпением.
Но не сейчас. Сейчас мы только на пути к этому и должны запастись терпением.
Производитель органов
Регистрация завершена
За пределами лаборатории
биомедицинская инженерия,
Профессиональное развитие
Сидя рядом с… Энтони Атала, директор Института регенеративной медицины Уэйк Форест, Уинстон-Салем, Северная Каролина, США.
Шарлотта Баркер
|
Когда я был ребенком, в моей семье все еще был традиционный семейный врач. Он приходил на дом, когда кто-то из нас болел, и в то же время проверял остальных. Эти детские воспоминания о докторе, заботящемся не только о пациенте, но и о семье в целом, заставили меня сделать то же самое. Я по-прежнему принимаю пациентов и провожу операции параллельно с исследовательской деятельностью.
Определенно. Это держит меня ближе к пациенту и его потребностям и вдохновляет меня работать еще усерднее, чтобы найти лучшие решения. Во время моего медицинского образования у меня фактически не было намерения заниматься исследованиями — я стал клиницистом-исследователем по счастливой случайности. Я подал заявку на участие в программе обучения в Детской больнице Гарвардской медицинской школы, где недавно добавили необязательный исследовательский компонент. Они дали мне выбор: следовать прямому клиническому пути или получить сочетание клинического и исследовательского опыта. Я просто хотел стать хирургом, но каким-то образом д-р Алан Ретик, председатель программы, убедил меня, что я должен попробовать себя в исследовательской сфере. Конечно, как только я начал заниматься исследованиями, мне это понравилось.
Я подал заявку на участие в программе обучения в Детской больнице Гарвардской медицинской школы, где недавно добавили необязательный исследовательский компонент. Они дали мне выбор: следовать прямому клиническому пути или получить сочетание клинического и исследовательского опыта. Я просто хотел стать хирургом, но каким-то образом д-р Алан Ретик, председатель программы, убедил меня, что я должен попробовать себя в исследовательской сфере. Конечно, как только я начал заниматься исследованиями, мне это понравилось.
В то время исследовательская лаборатория только создавалась, так что у меня было больше свободы делать то, что я хотел, и это было попробовать вырастить человеческую ткань. Тканевая инженерия была в зачаточном состоянии, но в моей специальности определенно была клиническая потребность, и меня привлекал потенциал.
Это были ранние дни поля. Термин «регенеративная медицина» даже не был придуман. В то время было много проблем — прежде всего тот факт, что большинство нормальных человеческих клеток нельзя было выращивать вне тела. Потребовались годы, чтобы найти правильную комбинацию факторов для успешного культивирования клеток мочевыводящих путей.
Потребовались годы, чтобы найти правильную комбинацию факторов для успешного культивирования клеток мочевыводящих путей.
Еще одной задачей была разработка биоматериалов, которые позволили бы использовать эти клетки у пациентов — каркасов, на которых клетки могут расти. Также сложной задачей было создание сосудистой сети в тканях, чтобы ткани выжили после имплантации. Это потребовало много работы, но к концу 1990-х годов мы впервые имплантировали выращенные в лаборатории мочевые пузыри пациентам.
Мы очень волновались, узнав, что подобная процедура не предпринималась ранее. Вы можете провести столько доклинических испытаний, сколько хотите, и вы должны показать в них безопасность и эффективность, но в конечном итоге вы должны испытать это на пациенте. Это был процесс обучения, поскольку мы продолжали имплантировать эти органы. Сейчас мы готовимся начать клинические испытания фазы III.
Начиная со сложного органа, такого как мочевой пузырь, полого нетрубчатого органа, мы могли быть более амбициозными в более поздних испытаниях — было относительно легко расширить его до более простых плоских или трубчатых структур, таких как кожа или кровеносные сосуды, как мы уже решили многие проблемы дизайна.
Шумиха никоим образом не уникальна для регенеративной медицины; когда делается какой-либо научный прорыв, люди склонны увлекаться и думать, что он будет доступен пациентам через год или два. Конечно, все мы знаем, что в любой области науки это не так, поэтому мы должны оставаться на земле. Научные открытия требуют времени, чтобы превратиться в терапию, а терапия требует времени, чтобы ее отрегулировать и протестировать. Как человек, который занимался переводом как в фундаментальной науке, так и в клинической части спектра, я считаю, что образование очень важно. Мы должны найти баланс; мы хотим быть достаточно энтузиазмом, чтобы иметь возможность продвигать разработку технологий, которые имеют потенциальную клиническую пользу, но умерить эти ожидания, когда дело доходит до их конечного успеха и сроков.
В наших клинических испытаниях мы всегда ждали, пока завершится пятилетнее наблюдение, и всегда на серии пациентов, а не на отчетах об отдельных случаях, прежде чем публиковать результаты. Это позволило нам узнать, что технология была надежной и эффективной в долгосрочной перспективе, прежде чем результаты были обнародованы.
Это позволило нам узнать, что технология была надежной и эффективной в долгосрочной перспективе, прежде чем результаты были обнародованы.
Это потребовало много работы, но к концу 1990-х годов мы впервые имплантировали выращенные в лаборатории мочевые пузыри пациентам.
Абсолютно. За последние несколько десятилетий было сделано много достижений. В какой-то момент эта область считалась научной фантастикой. Люди действительно думали, что из культивируемых клеток невозможно создать ткани или органы. Теперь это научный факт — это не только возможно, но и воспроизводимо. Сконструированные ткани и органы используются в центрах по всему миру, и пациенты получают от этого пользу.
Здесь, в Уэйк Форест, мы сейчас работаем примерно с 30 различными тканями, 25 процентов из которых уже доставлены пациентам. Наша цель — увеличить этот процент и в конечном итоге помочь большему количеству пациентов с помощью этих технологий. Предстоит еще много работы, но я по-прежнему оптимистичен в отношении результатов для нашей области.
Электронная почта*
Выберите пароль
Я прочитал и понял
Уведомление о конфиденциальности *
Когда вы нажмете «Подписаться», мы отправим вам по электронной почте ссылку, которую вы должны нажать, чтобы подтвердить адрес электронной почты, указанный выше, и активировать подписку.
Если вы не получили это письмо, свяжитесь с нами по адресу
[электронная почта защищена].
Если вы хотите отказаться от подписки, вы можете обновить свои настройки в любой момент.
Об автореШарлотта Баркер
«Как редактор The Translational Scientist, я тесно сотрудничаю с нашей аудиторией, чтобы создавать яркий, увлекательный контент, отражающий тяжелую работу и страсть, необходимые для вывода на рынок новых лекарств. Я начал заниматься биомедицинскими публикациями в качестве редактора медицинских журналов и посвятил свою карьеру всему, от исследований на ранних стадиях до клинической медицины, так что я хорошо разбираюсь в этом. И я не могу представить себе более интересную, сложную или важную область для работы».
ПРОИЗВОДИТЕЛИ ОРГАНОВ | Киркус Отзывы
РОМАНА О ХИРУРГИЧЕСКОЙ ОТВЕТСТВЕННОСТИ
по
Ричард Ван Андерсон
‧
ДАТА ВЫПУСКА: 17 декабря 2017 г.
Во второй серии Ван Андерсона ( Изъятие органов , 2014 и т. д.) доктор Дэвид Макбрайд уклоняется от полиции и обезумевшего русского шпиона, пытаясь спасти жизнь больного почки.
Дэвид разыскивается полицией Нью-Йорка после того, как отомстил человеку, ответственному за смерть его беременной жены. Еще один человек, мошенник, правительственный агент, известный как «Мр. Белый», ранее шантажировал Дэвида в схеме с участием органов черного рынка. 26-летняя дочь Уайта, Хизер, в настоящее время умирает от болезни почек и нуждается в пересадке почки. Он хочет, чтобы Дэвид продолжил исследования мертвого хирурга, в ходе которых выращивались новые человеческие органы из стволовых клеток. В ответ Уайт утверждает, что может добиться лучшего лечения для отца Дэвида, страдающего слабоумием. К сожалению, Михаил Петровский, бывший сотрудник Федеральной службы безопасности России, также занимается исследованием и готов прибегнуть к насильственным методам в своей миссии, чтобы получить серию соответствующих записных книжек. Он и его головорезы преследуют нескольких человек, в том числе биохимика, который, возможно, спрятал самый важный блокнот. Дэвид и Уайт спешат защитить тех, кто в опасности, и обезопасить исследования раньше, чем это сделают русские. Это, конечно, ставит их обоих на линию огня, а копы все еще идут по следу Дэвида. Вторая часть серии Ван Андерсона умело расширяет историю предыдущей части. Например, некоторые новые подробности, касающиеся загадочного Уайта, делают его более сильным и интригующим персонажем; например, шпион оказывается лучше в слежке, чем в рукопашном бою, и в результате он так же уязвим, как и Дэвид.
26-летняя дочь Уайта, Хизер, в настоящее время умирает от болезни почек и нуждается в пересадке почки. Он хочет, чтобы Дэвид продолжил исследования мертвого хирурга, в ходе которых выращивались новые человеческие органы из стволовых клеток. В ответ Уайт утверждает, что может добиться лучшего лечения для отца Дэвида, страдающего слабоумием. К сожалению, Михаил Петровский, бывший сотрудник Федеральной службы безопасности России, также занимается исследованием и готов прибегнуть к насильственным методам в своей миссии, чтобы получить серию соответствующих записных книжек. Он и его головорезы преследуют нескольких человек, в том числе биохимика, который, возможно, спрятал самый важный блокнот. Дэвид и Уайт спешат защитить тех, кто в опасности, и обезопасить исследования раньше, чем это сделают русские. Это, конечно, ставит их обоих на линию огня, а копы все еще идут по следу Дэвида. Вторая часть серии Ван Андерсона умело расширяет историю предыдущей части. Например, некоторые новые подробности, касающиеся загадочного Уайта, делают его более сильным и интригующим персонажем; например, шпион оказывается лучше в слежке, чем в рукопашном бою, и в результате он так же уязвим, как и Дэвид. Энергичный рассказ сохраняет остроту с постоянным чувством угрозы: Хизер осталось жить ограниченное количество времени, а копы и русские, преследующие Дэвида, иногда на шаг опережают его. Как и в предыдущей части серии, здесь много медицинской терминологии, но в целом она понятна, поскольку Дэвид объясняет большую ее часть Уайту. Ван Андерсон также предлагает поразительные детали, например, когда Дэвид живо описывает ужасную рану, которую он получил во время событий последней книги.
Энергичный рассказ сохраняет остроту с постоянным чувством угрозы: Хизер осталось жить ограниченное количество времени, а копы и русские, преследующие Дэвида, иногда на шаг опережают его. Как и в предыдущей части серии, здесь много медицинской терминологии, но в целом она понятна, поскольку Дэвид объясняет большую ее часть Уайту. Ван Андерсон также предлагает поразительные детали, например, когда Дэвид живо описывает ужасную рану, которую он получил во время событий последней книги.
Похвальный триллер, который делает его медицинскую науку захватывающей и волнующей.
0
Паб Дата: 17 декабря 2017 г.
