Содержание
Что такое стволовые клетки | ivfrigastemcells.lv
Стволовые клетки – это клетки-предшественники всех клеток и тканей нашего организма. Стволовые клетки способны поддерживать свою численность с помощью деления и обладают способностью дифференцироваться (превращаться) в различные типы клеток.
С возрастом количество стволовых клеток в организме человека снижается. Истощение запаса стволовых клеток вследствие старения, тяжелых заболеваний или вредных привычек (курение и употребление алкоголя) лишает организм возможности самовосстановления. Из-за этого может нарушаться функционирование тех или иных органов.
Стволовые клетки человека условно разделяют на гемопоэтические и мезенхимальные
Гемопоэтические (кроветворные) стволовые клетки (ГСК) образуют разнообразие клеток крови, определяющих иммунитет, борющихся с инфекциями, переносящих кислород и участвующих в процессах свертывания крови. История клинического применения гемопоэтических стволовых клеток началась более 60 лет назад, и сейчас трансплантация гемопоэтических стволовых клеток — метод первого выбора при лечении гематологических, некоторых онкологических и ряда иммунологических и наследственных заболеваний.
Гемопоэтические стволовые клетки можно получить из костного мозга, периферической крови (после введения специальных препаратов) и из пуповинной крови. Если в первые десятилетия практически единственным источником служил костный мозг, то с 1988 года — с момента первой (и сразу успешной) трансплантации пуповинной крови профессором E. Gluckman мальчику с анемией Фанкони – пуповинная кровь заняла достойное место в современной трансплантологии.
Часто у пациента просто нет времени ждать вызова донора костного мозга, повторных анализов и подготовки донора к забору костного мозга, кроме того, учитывая жесткие требования по совпадению HLA-генотипа донора и пациента, подобрать образец костного мозга получается не для всех. В таких случаях трансплантация пуповинной крови – не просто альтернатива трансплантации костного мозга, а единственный шанс для пациента.
Но даже в менее «экстремальных» ситуациях, при возможности подбора донора костного мозга, предпочтение может быть отдано именно трансплантации пуповинной крови — за счет сниженных рисков отторжения и возникновения реакции трансплантат против хозяина (РТПХ).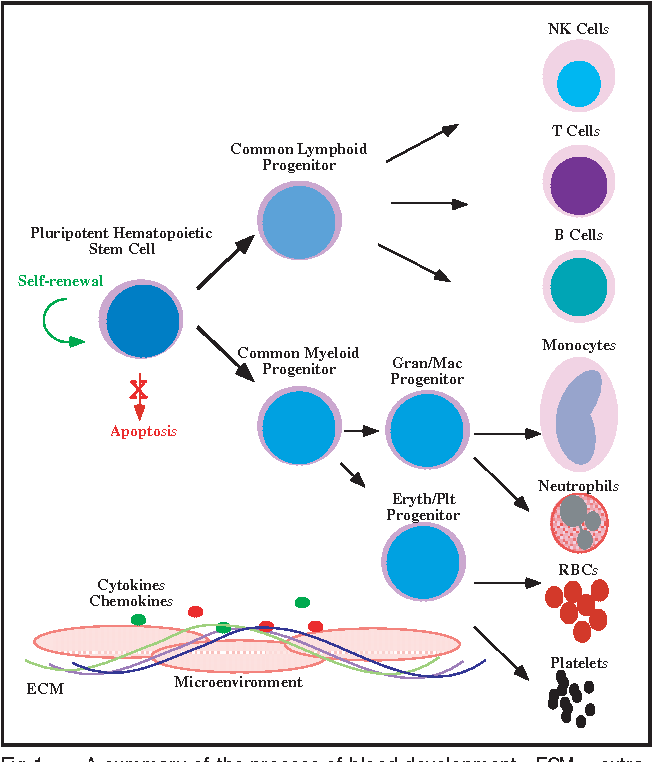 Поэтому пуповинная кровь становится все более востребованным источником гемопоэтических стволовых клеток для трансплантации, и на сегодняшний день, по данным World Marrow Donor Association (WMDA), проведено более 30 000 трансплантаций пуповинной крови.
Поэтому пуповинная кровь становится все более востребованным источником гемопоэтических стволовых клеток для трансплантации, и на сегодняшний день, по данным World Marrow Donor Association (WMDA), проведено более 30 000 трансплантаций пуповинной крови.
Мезенхимные (стромальные) стволовые клетки (МСК) способны превращаться в клетки костной, хрящевой, соединительной ткани, формировать элементы кровеносных сосудов. Кроме восполнения утраченных элементов этих тканей, мезенхимальные стволовые клетки синтезируют большой набор биологически активных веществ, с помощью которых могут изменять поведение других типов клеток, например, клеток иммунной системы.
Такие биологические функции мезенхимальных стволовых клеток сделали их востребованным источником для регенеративной терапии: к концу 2017 года в международной базе клинических испытаний зарегистрировано более 780 исследований с использованием МСК (https://clinicaltrials.gov). Многообещающие результаты были получены при применении МСК для восстановления тканей при травмах опорно-двигательного аппарата, язвах и ожогах, для профилактики и/или лечения реакции трансплантат против хозяина при онкологических заболеваниях, при терапии иммунопатологических процессов, ишемии нижних конечностей, патологии сердечно-сосудистой системы, дегенеративных процессов в хрящевой ткани и даже в реконструктивной стоматологии. Важно, что по результатам всех клинических исследований применение МСК не приводит к возникновению серьезных побочных эффектов.
Важно, что по результатам всех клинических исследований применение МСК не приводит к возникновению серьезных побочных эффектов.
В качестве основных источников получения мезенхимальных стволовых клеток выступают костный мозг, жировая ткань и ткани пуповины. В отличие от МСК костного мозга и жировой ткани, мезенхимальные стволовые клетки пуповины – это молодые клетки, не подвергавшиеся действию негативных факторов внешней среды и поэтому обладающие высокой функциональной активностью. Важным преимуществом мезенхимальных стволовых клеток пуповины является также совершенная безболезненность и безопасность сбора ткани для их получения, кроме того, в случае сохранения МСК пуповины эти клетки могут быть в любой момент разморожены и применены значительно быстрее, чем клетки из других источников.
Существует несколько источников стволовых клеток человека:
- костный мозг;
- жировая ткань;
- периферическая кровь;
- пуповинная кровь (забор стволовых клеток пуповинной крови производится только в момент рождения ребенка)
- ткань пуповины
Стволовые клетки | GxP News
войти в систему
Добро пожаловат!Войдите в свой аккаунт
Ваше имя пользователя
Ваш пароль
Вы забыли свой пароль?
Политика конфиденциальности
восстановление пароля
Восстановите свой пароль
Ваш адрес электронной почты
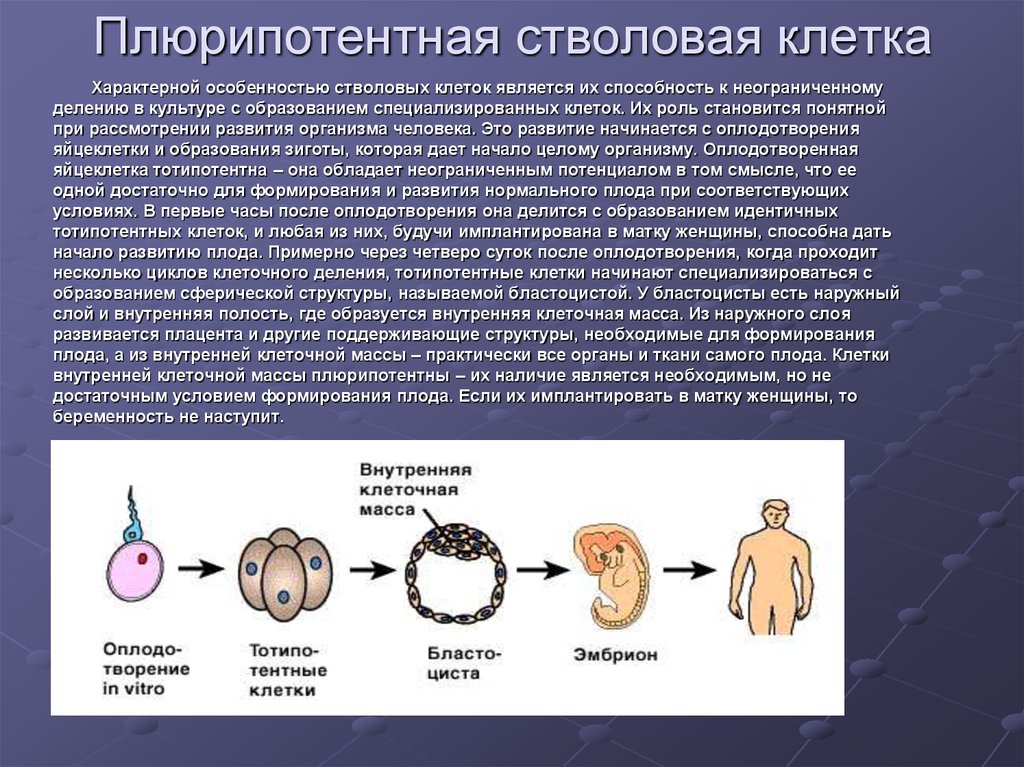
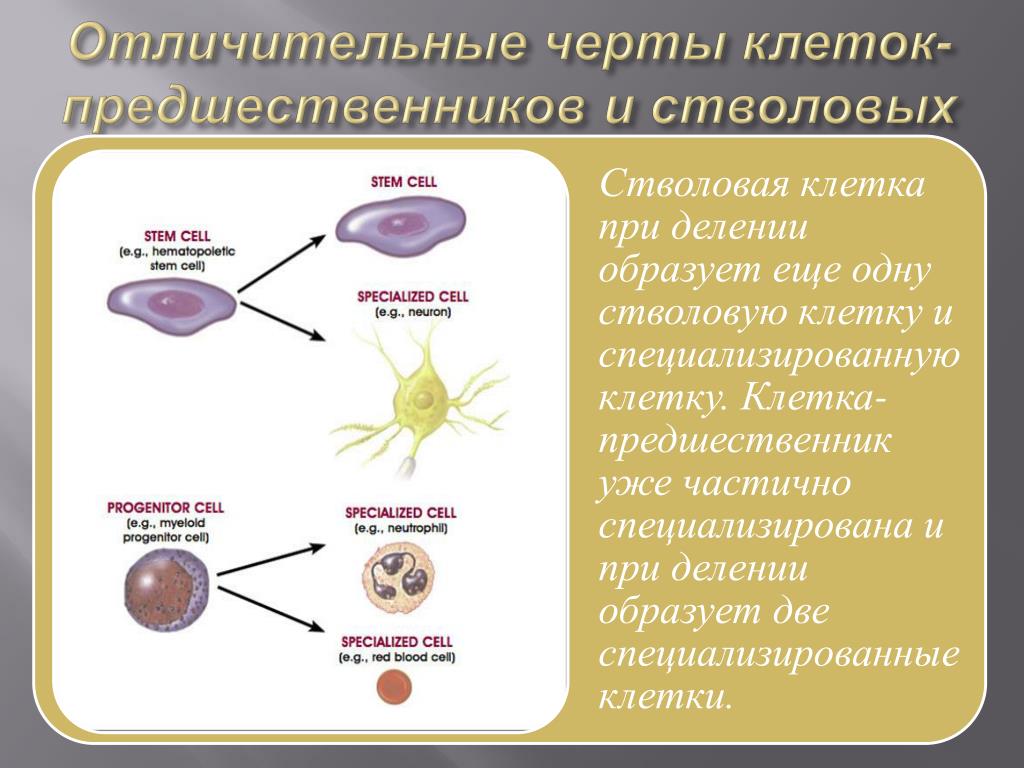
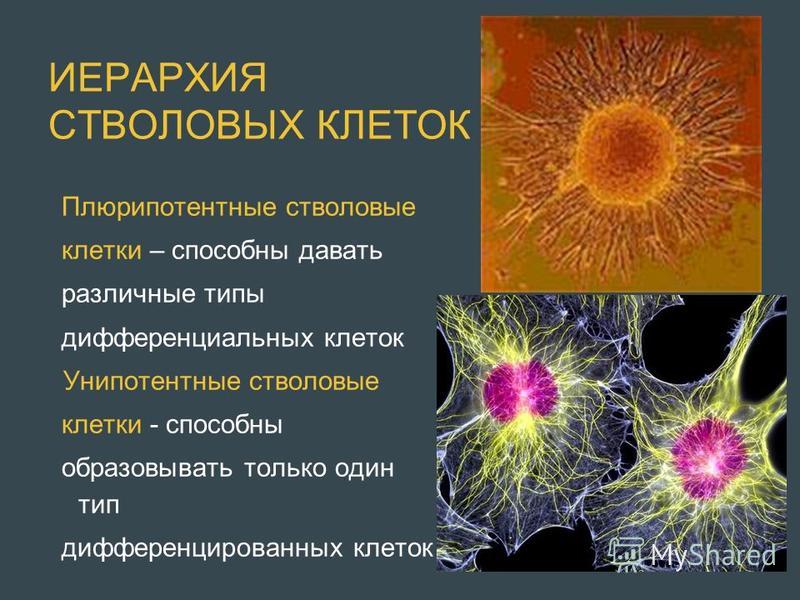
Стволовые клетки – иерархия особых клеток живых организмов, каждая из которых способна впоследствии изменяться (дифференцироваться) особым образом (то есть получать специализацию и далее развиваться как обычная клетка).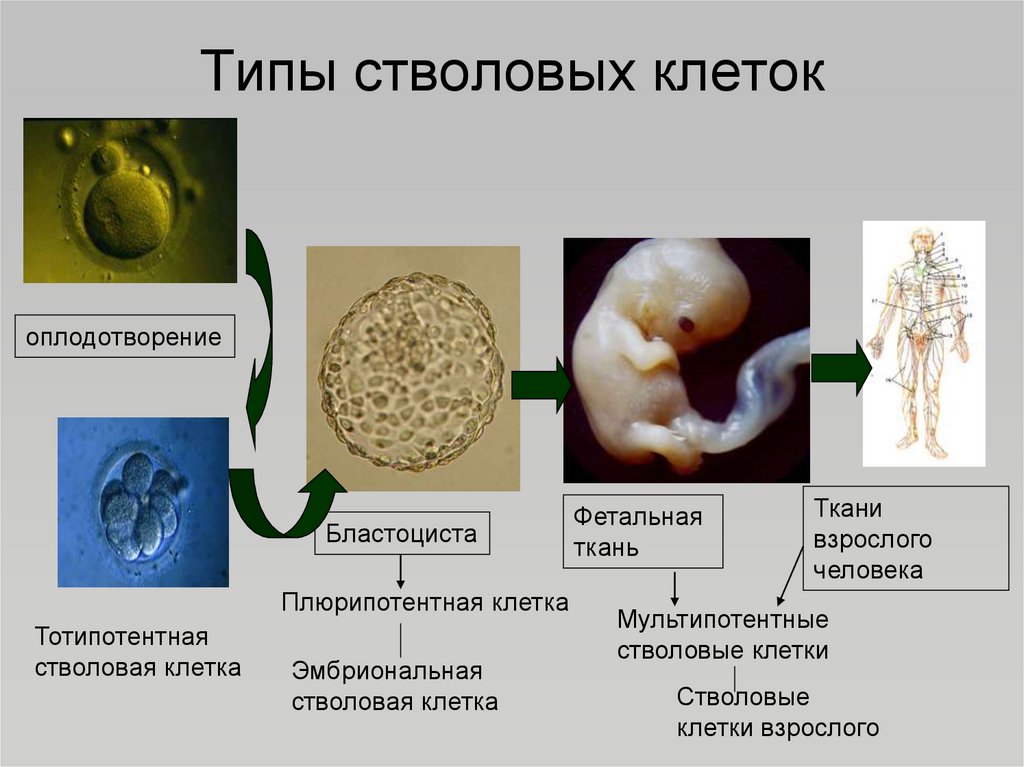 Стволовые клетки способны асимметрично делиться, из-за чего при делении образуется клетка, подобная материнской (самовоспроизведение), а также новая клетка, которая способна дифференцироваться.
Стволовые клетки способны асимметрично делиться, из-за чего при делении образуется клетка, подобная материнской (самовоспроизведение), а также новая клетка, которая способна дифференцироваться.
Описание стволовых клеток
Корнем иерархии стволовых клеток является тотипотентная зигота. Первые несколько делений зиготы сохраняют тотипотентность и при потере целостности зародыша это может приводить к появлению монозиготных близнецов. К ветвям иерархии относятся плюрипотентные (омнипотентные) и мультипотентные (бластные) стволовые клетки. Листьями (конечными элементами) иерархии являются зрелые унипотентные клетки тканей организма.
Нишами стволовых клеток называются места в ткани, где постоянно залегают стволовые клетки, делящиеся по мере надобности для дальнейшей дифференциации.
Стволовые клетки размножаются путём деления, как и все остальные клетки. Отличие стволовых клеток состоит в том, что они могут делиться неограниченно, а зрелые клетки обычно имеют ограниченное количество циклов деления.
Когда происходит созревание стволовых клеток, то они проходят несколько стадий. В результате, в организме имеется ряд популяций стволовых клеток различной степени зрелости. В нормальном состоянии, чем более зрелой является клетка, тем меньше вероятность того, что она сможет превратиться в клетку другого типа. Но всё же это возможно благодаря феномену трансдифференцировки клеток (англ. Transdifferentiation).
ДНК во всех клетках одного организма (кроме половых), в том числе и стволовых, одинакова. Клетки различных органов и тканей, например, клетки кости и нервные клетки, различаются только тем, какие гены у них включены, а какие выключены, то есть регулированием экспрессии генов, например, путем метилирования ДНК. Фактически, с осознанием существования зрелых и незрелых клеток был обнаружен новый уровень управления клетками. То есть, геном у всех клеток идентичен, но режим работы, в котором он находится — различен.
В различных органах и тканях взрослого организма существуют частично созревшие стволовые клетки, готовые быстро дозреть и превратиться в клетки нужного типа.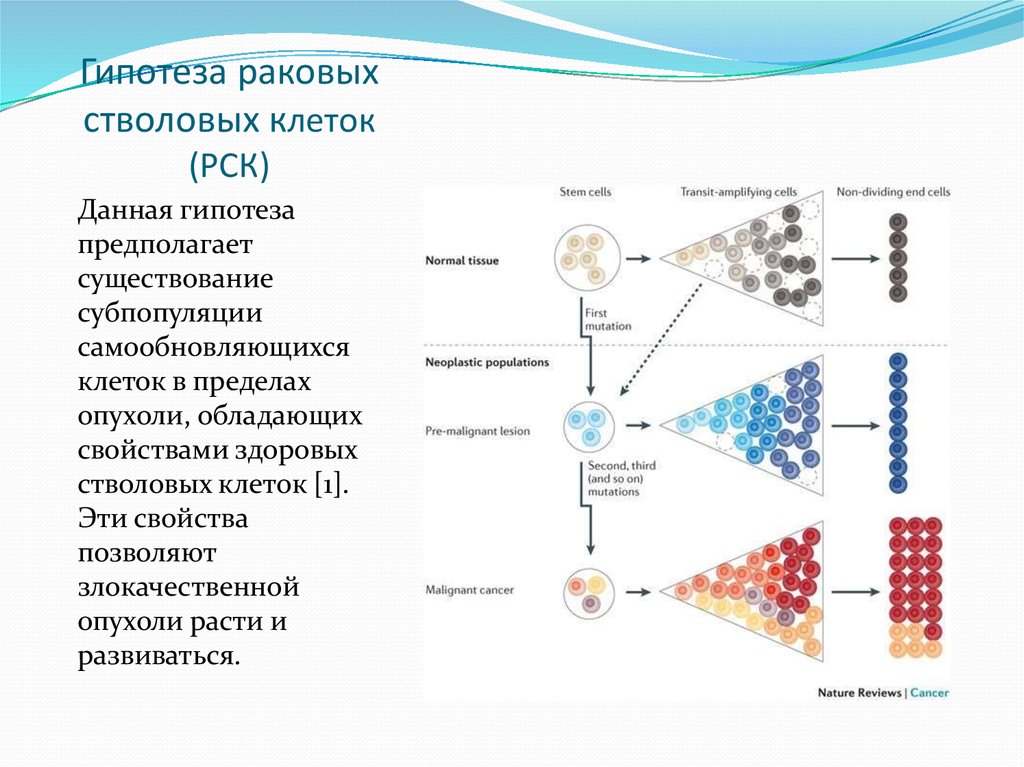 Они называются бластными клетками. Например, частично созревшие клетки мозга — это нейробласты, кости — остеобласты и так далее. Дифференцировку могут запускать как внутренние причины, так и внешние. Любая клетка реагирует на внешние раздражители, в том числе и на специальные сигналы цитокины. Например, есть сигнал (вещество), служащий признаком перенаселённости. Если клеток становится очень много, то этот сигнал сдерживает деление. В ответ на сигналы клетка может регулировать экспрессию генов.
Они называются бластными клетками. Например, частично созревшие клетки мозга — это нейробласты, кости — остеобласты и так далее. Дифференцировку могут запускать как внутренние причины, так и внешние. Любая клетка реагирует на внешние раздражители, в том числе и на специальные сигналы цитокины. Например, есть сигнал (вещество), служащий признаком перенаселённости. Если клеток становится очень много, то этот сигнал сдерживает деление. В ответ на сигналы клетка может регулировать экспрессию генов.
Источник: Википедия
Вернуться на главную страницу Глоссария
Предыдущая статьяСистема обеспечения стерильности
Следующая статьяСтерилизация
Manage consent
БОЛЬШЕ ИСТОРИЙ
Что такое стволовые клетки?
Что такое стволовые клетки?
Что такое стволовые клетки?
ПОЧЕМУ ВАЖНЫ СТВОЛОВЫЕ КЛЕТКИ?
Стволовые клетки обладают замечательным потенциалом развития во множество различных типов клеток в организме. Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать другим типом клеток с более специализированной функцией, например, мышечной клеткой, клеткой соединительной ткани или клеткой хряща.
Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать другим типом клеток с более специализированной функцией, например, мышечной клеткой, клеткой соединительной ткани или клеткой хряща.
УНИКАЛЬНЫЕ СВОЙСТВА ВСЕХ СТВОЛОВЫХ КЛЕТОК
Стволовые клетки отличаются от других видов клеток в организме. Все стволовые клетки, независимо от их источника, обладают тремя общими свойствами: они способны делиться и обновляться в течение длительного времени; они неспециализированы; и они могут давать начало специализированным типам клеток.
Подробнее
ЧТО ТАКОЕ ВЗРОСЛЫЕ СТВОЛОВЫЕ КЛЕТКИ?
Считается, что взрослая стволовая клетка представляет собой недифференцированную клетку, обнаруженную среди дифференцированных клеток в ткани или органе. Взрослая стволовая клетка может обновляться и дифференцироваться, давая некоторые или все основные специализированные типы клеток ткани или органа.
Подробнее
Описание стволовых клеток
Введение в стволовые клетки
Стволовые клетки обладают замечательным потенциалом развития во множество различных типов клеток в организме.
 Кроме того, во многих тканях они служат своего рода системой внутренней репарации, практически неограниченно делясь для пополнения других клеток. Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать другим типом клеток с более специализированной функцией.
Кроме того, во многих тканях они служат своего рода системой внутренней репарации, практически неограниченно делясь для пополнения других клеток. Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать другим типом клеток с более специализированной функцией.Учитывая их уникальные регенеративные способности, стволовые клетки открывают новые возможности для лечения заболеваний.
Исследования стволовых клеток продолжают расширять знания о том, как организм развивается из одной клетки и как здоровые клетки заменяют поврежденные клетки во взрослых организмах. Исследования стволовых клеток — одна из самых увлекательных областей современной биологии.
Уникальные свойства всех стволовых клеток
Стволовые клетки отличаются от других видов клеток в организме. Все стволовые клетки, независимо от их источника, обладают тремя общими свойствами: они способны делиться и обновляться в течение длительного времени; они неспециализированы; и они могут давать начало специализированным типам клеток.

Стволовые клетки неспециализированы. Одним из фундаментальных свойств стволовой клетки является то, что она не имеет каких-либо тканеспецифичных структур, позволяющих ей выполнять специализированные функции. Однако неспециализированные стволовые клетки могут давать начало специализированным клеткам.
Когда неспециализированные стволовые клетки дают начало специализированным клеткам, этот процесс называется дифференцировкой. В процессе дифференцировки клетка обычно проходит несколько стадий, на каждой стадии становясь все более специализированной. Внутренние сигналы контролируются генами клетки, которые разбросаны по длинным нитям ДНК и несут закодированные инструкции для всех клеточных структур и функций. Внешние сигналы для дифференцировки клеток включают химические вещества, выделяемые другими клетками, физический контакт с соседними клетками и определенные молекулы в микроокружении. Взаимодействие сигналов во время дифференцировки приводит к тому, что клеточная ДНК приобретает эпигенетические метки, которые ограничивают экспрессию ДНК в клетке и могут передаваться при клеточном делении.

Взрослые стволовые клетки обычно генерируют типы клеток ткани, в которой они находятся.
Что такое взрослые стволовые клетки?
Считается, что взрослая стволовая клетка представляет собой недифференцированную клетку, обнаруженную среди дифференцированных клеток в ткани или органе. Взрослая стволовая клетка может обновляться и дифференцироваться, давая некоторые или все основные специализированные типы клеток ткани или органа.
Основная роль взрослых стволовых клеток в живом организме заключается в поддержании и восстановлении ткани, в которой они находятся.
Исследования взрослых стволовых клеток вызвали большой интерес. Ученые обнаружили взрослые стволовые клетки в гораздо большем количестве тканей, чем они когда-то считали возможным. Это открытие заставило исследователей и клиницистов задаться вопросом, можно ли использовать взрослые стволовые клетки для трансплантации.
 Фактически, взрослые гемопоэтические или кроветворные стволовые клетки из костного мозга использовались в трансплантатах более 40 лет.
Фактически, взрослые гемопоэтические или кроветворные стволовые клетки из костного мозга использовались в трансплантатах более 40 лет.История исследований взрослых стволовых клеток началась более 60 лет назад.
Взрослые стволовые клетки были обнаружены во многих органах и тканях, включая головной мозг, костный мозг, периферическую кровь, кровеносные сосуды, скелетные мышцы, кожу, зубы, сердце, кишечник, печень, эпителий яичников и яички. Стволовые клетки могут оставаться в состоянии покоя (неделясь) в течение длительного периода времени, пока они не будут активированы в результате нормальной потребности в большем количестве клеток для поддержания тканей или в результате заболевания или повреждения ткани.
симметричных и асимметричных делений стволовых клеток: адаптация против рака?
1.
Моррисон С.Дж., Кимбл Дж. (2006)Асимметричные и симметричные деления стволовых клеток при развитии и раке. Природа
441: 1068–1074. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
2.
Shen Q, Goderie SK, Jin L, Karanth N, Sun Y и др. (2004) Эндотелиальные клетки стимулируют самообновление и расширяют нейрогенез нейральных стволовых клеток. Наука
304: 1338–1340. [PubMed] [Академия Google]
3.
Knoblich JA (2008) Механизмы асимметричного деления стволовых клеток. Клетка
132: 583–597. [PubMed] [Google Scholar]
4.
Фукс Э., Тумбар Т., Гуаш Г. (2004) Общение с соседями: стволовые клетки и их ниша. Клетка
116: 769–778. [PubMed] [Google Scholar]
5.
Чжун В., Чиа В. (2008)Нейрогенез и асимметричное деление клеток. Текущее мнение в нейробиологии
18: 4–11. [PubMed] [Google Scholar]
6.
Хо А.Д. (2005)Кинетика и симметрия делений гемопоэтических стволовых клеток. Экспериментальная гематология
33: 1–8. [PubMed] [Академия Google]
7.
Zhang YV, Cheong J, Ciapurin N, McDermitt DJ, Tumbar T (2009)Четкие фазы самообновления и дифференцировки в нише редко делящихся стволовых клеток волосяного фолликула. Клеточная стволовая клетка
5: 267–278. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
8.
Леффлер М., Родер И. (2002)Стволовые клетки тканей: определение, пластичность, гетерогенность, самоорганизация и модели — концептуальный подход. Клетки Ткани Органы
171: 8–26. [PubMed] [Google Scholar]
9.
Marshman E, Booth C, Potten CS (2002)Стволовая клетка эпителия кишечника. Биоэссе
24:91–98. [PubMed] [Google Scholar]
10.
Clayton E, Doupé DP, Klein AM, Winton DJ, Simons BD и др. (2007) Один тип клеток-предшественников поддерживает нормальный эпидермис. Природа
446: 185–189. [PubMed] [Google Scholar]
11.
Лю М., Плеже С., Коллинз А., Нобельс Дж., Ная Ф. и др. (2000) Потеря бета2/нейрода приводит к порокам развития зубчатой извилины и эпилепсии. Труды Национальной академии наук
97: 865–870. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12.
Симмонс С., Мэтлис С., Торнтон А., Чен С., Ван С. и др. (2003) Циклический 579штамм усиливает минерализацию матрикса мезенхимальными стволовыми клетками взрослого человека через сигнальный путь киназы, регулируемой внеклеточным сигналом (erk1/2). Журнал биомеханики
Журнал биомеханики
36: 1087–1096. [PubMed] [Google Scholar]
13.
Альварес-Буйла А., Лим Д. (2004) В долгосрочной перспективе: поддержание зародышевых ниш во взрослом мозге. Нейрон
41: 683–686. [PubMed] [Google Scholar]
14.
Саха С., Джи Л., де Пабло Дж., Палечек С. (2006)Ингибирование дифференцировки эмбриональных стволовых клеток человека механическим напряжением. Журнал клеточной физиологии
206: 126–137. [PubMed] [Академия Google]
15.
Lien W, Klezovitch O, Fernandez T, Delrow J, Vasioukhin V (2006) {alpha} e-catenin контролирует размер коры головного мозга, регулируя сигнальный путь hedgehog. STKE науки
311: 1609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16.
Адамс Г., Скадден Д. (2007) Нишевые возможности для терапии стволовыми клетками. Генная терапия
15: 96–99. [PubMed] [Google Scholar]
17.
Dehay C, Kennedy H (2007)Контроль клеточного цикла и развитие коры головного мозга. Обзоры природы Неврология
8: 438–450. [PubMed] [Академия Google]
18.
Орфорд К., Скадден Д. (2008) Деконструкция самообновления стволовых клеток: генетическое понимание регуляции клеточного цикла. Природа Обзоры Генетика
9: 115–128. [PubMed] [Google Scholar]
19.
Nusse R (2008)Передача сигналов Wnt и контроль стволовых клеток. Клеточные исследования
18: 523–527. [PubMed] [Google Scholar]
20.
Шпигель А., Калинкович А., Шивтиэль С., Коллет О., Лапидот Т. (2008)Регулирование стволовых клеток посредством динамических взаимодействий нервной и иммунной систем с микроокружением. Клеточная стволовая клетка
3: 484–492. [PubMed] [Google Scholar]
21.
Saha S, Ji L, De Pablo J, Palecek S (2008) Tgf [бета] / активин / узловой путь в ингибировании дифференцировки эмбриональных стволовых клеток человека механическим напряжением. Биофизический журнал
94: 4123–4133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22.
Сен Б., Се З., Кейс Н., Ма М., Рубин С. и др. (2008) Механическое напряжение ингибирует адипогенез в мезенхимальных стволовых клетках, стимулируя устойчивый сигнал β-катенина. Эндокринология
Эндокринология
149: 6065–6075. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23.
Гуилак Ф., Коэн Д., Эстес Б., Гимбл Дж., Лидтке В. и др. (2009)Контроль судьбы стволовых клеток посредством физического взаимодействия с внеклеточным матриксом. Клеточная стволовая клетка
5: 17–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24.
Lavado A, Lagutin O, Chow L, Baker S, Oliver G (2010) Prox1 необходим для созревания гранулярных клеток и поддержания промежуточных предшественников во время нейрогенеза головного мозга. биология PLoS
8: 1000460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25.
де Грааф С., Кауппи М., Болдуин Т., Хайланд С., Меткалф Д. и др. (2010) Регуляция гемопоэтических стволовых клеток их зрелым потомством. Труды Национальной академии наук
107: 21689–21694. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Li L, Clevers H (2010)Сосуществование покоящихся и активных взрослых стволовых клеток у млекопитающих. Наука
327: 542–545. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
27.
Саломони П., Калегари Ф. (2010)Контроль клеточного цикла нервных стволовых клеток млекопитающих: ограничение скорости g1. Тенденции в клеточной биологии
20: 233–243. [PubMed] [Google Scholar]
28.
Hsieh J (2012)Управление транскрипционным контролем нейрогенеза у взрослых. Гены и развитие
26: 1010–1021. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29.
Ордоньес-Моран П., Хюльскен Дж. (2012) Lrig1: новый главный регулятор эпителиальных стволовых клеток. Журнал EMBO
[Бесплатная статья PMC] [PubMed] [Google Scholar]
30.
Yatabe Y, Tavaré S, Shibata D (2001)Исследование стволовых клеток в толстой кишке человека с использованием 618 моделей метилирования. Труды Национальной академии наук
98: 10839–10844. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31.
Spradling A, Drummond-Barbosa D, Kai T (2001) Стволовые клетки находят свою нишу. ПРИРОДА ЛОНДОН-
98–104. [PubMed] [Google Scholar]
32.
Николас П., Ким К.М., Шибата Д., Таваре С. (2007)Популяция стволовых клеток крипты толстой кишки человека: анализ с помощью моделей метилирования. вычислительная биология PLoS
3: е28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33.
Кэмпбелл Ф., Уильямс Г., Эпплтон М., Диксон М., Харрис М. и др. (1996)Соматическая мутация после облучения и время стабилизации клонов в толстой кишке человека. кишки
39: 569–573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34.
Кляйн А.М., Саймонс Б.Д. (2011)Универсальные закономерности судьбы стволовых клеток в циклических тканях взрослых. Разработка
138: 3103–3111. [PubMed] [Google Scholar]
35.
Klein AM, Nakagawa T, Ichikawa R, Yoshida S, Simons BD (2010)Стволовые клетки зародышевой линии мыши подвергаются быстрому и стохастическому обмену. Клеточная стволовая клетка
7: 214–224. [PubMed] [Google Scholar]
36.
Lopez-Garcia C, Klein AM, Simons BD, Winton DJ (2010)Замена стволовых клеток кишечника следует схеме нейтрального дрейфа.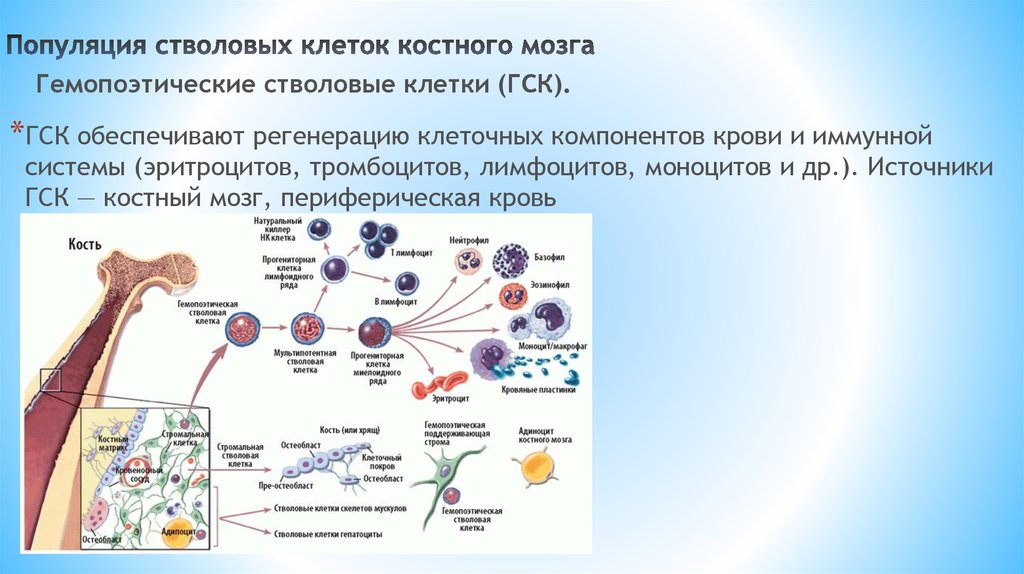 Наука
Наука
330: 822–825. [PubMed] [Академия Google]
37.
Снипперт Х.Дж., ван дер Флиер Л.Г., Сато Т., ван Эс Дж.Х., ван ден Борн М. и др. (2010) Гомеостаз кишечных крипт является результатом нейтральной конкуренции между симметрично делящимися стволовыми клетками lgr5. Клетка
143: 134–144. [PubMed] [Google Scholar]
38.
Саймонс Б.Д., Клеверс Х. (2011)Стратегии самообновления гомеостатических стволовых клеток во взрослых тканях. Клетка
145: 851–862. [PubMed] [Google Scholar]
39.
Doupé DP, Klein AM, Simons BD, Jones PH (2010)Упорядоченная архитектура эпидермиса уха мыши поддерживается клетками-предшественниками со случайной судьбой. Клетка развития
18: 317–323. [PubMed] [Академия Google]
40.
Reya T, Clevers H (2005)Передача сигналов Wnt в стволовых клетках и раке. Природа
434: 843–850. [PubMed] [Google Scholar]
41.
Кларк Р.Б., Андерсон Э., Хауэлл А., Поттен К.С. (2003) Регуляция эпителиальных стволовых клеток молочной железы человека. Пролиферация клеток
36: 45–58.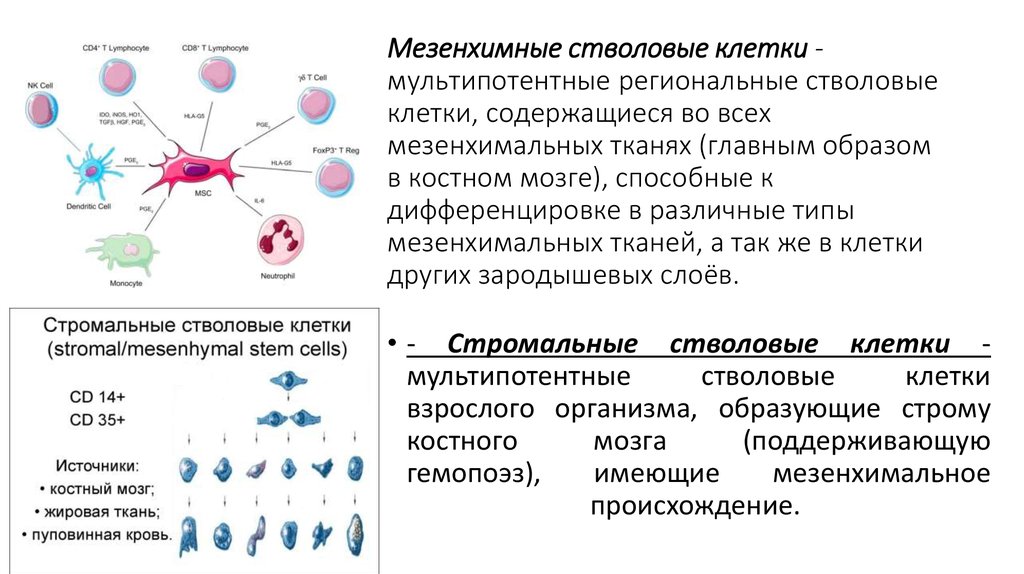 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
42.
Caussinus E, Gonzalez C (2005)Индукция роста опухоли за счет измененного асимметричного деления стволовых клеток у drosophila melanogaster. Генетика природы
37: 1125–1129. [PubMed] [Академия Google]
43.
Caussinus E, Hirth F (2007)Асимметричное деление стволовых клеток при развитии и раке. Асимметричное деление клеток
205–225. [PubMed] [Google Scholar]
44.
Aparicio S, Eaves C (2009) p53: новый главный герой на арене стволовых клеток. Клетка
138: 1060–2. [PubMed] [Google Scholar]
45.
Gonzalez C (2013)Drosophila melanogaster: модель и инструмент для исследования злокачественных новообразований и определения новых терапевтических средств. Природа Обзоры Рак
13: 172–183. [PubMed] [Google Scholar]
46. Vogelstein B, Kinzler KW (2002) Генетическая основа рака человека, том 821. McGraw-Hill, Medical Pub. Дивизия Нью-Йорк.
47.
Кнудсон А.Г. (1971)Мутация и рак: статистическое исследование ретинобластомы.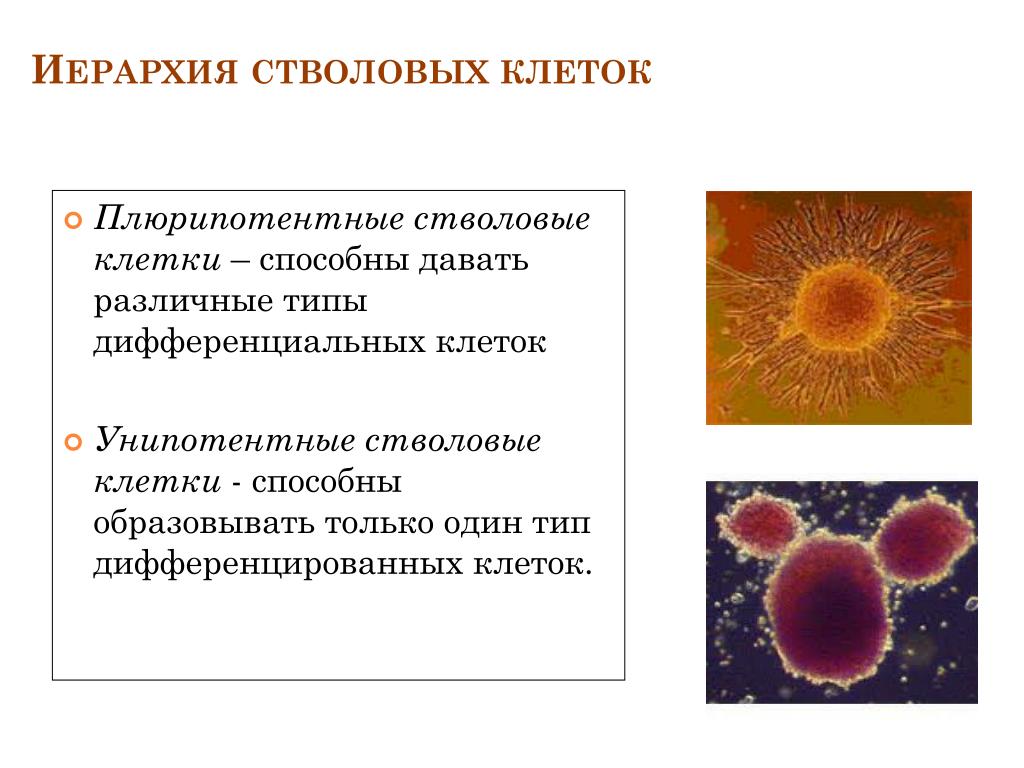 Труды Национальной академии наук
Труды Национальной академии наук
68: 820–823. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48.
Knudson AG (2001) Два генетических удара (более или менее) по раку. Природа Обзоры Рак
1: 157–162. [PubMed] [Google Scholar]
49.
Томлинсон И.П., Бодмер В.Ф. (1995)Отказ запрограммированной гибели и дифференцировки клеток как причины 655 опухолей: некоторые простые математические модели. Proc Natl Acad Sci USA
92: 11130–11134. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50.
д’Онофрио А., Томлинсон И.П. (2007)Нелинейная математическая модель клеточного оборота, дифференцировки и онкогенеза в кишечной крипте. Джей Теор Биол
244: 367–374. [PubMed] [Google Scholar]
51.
Джонстон М.Д., Эдвардс К.М., Бодмер В.Ф., Майни П.К., Чепмен С.Дж. (2007)Математическое моделирование динамики клеточной популяции в крипте толстой кишки и при колоректальном раке. Proc Natl Acad Sci USA
104: 4008–4013. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52.
Боман Б.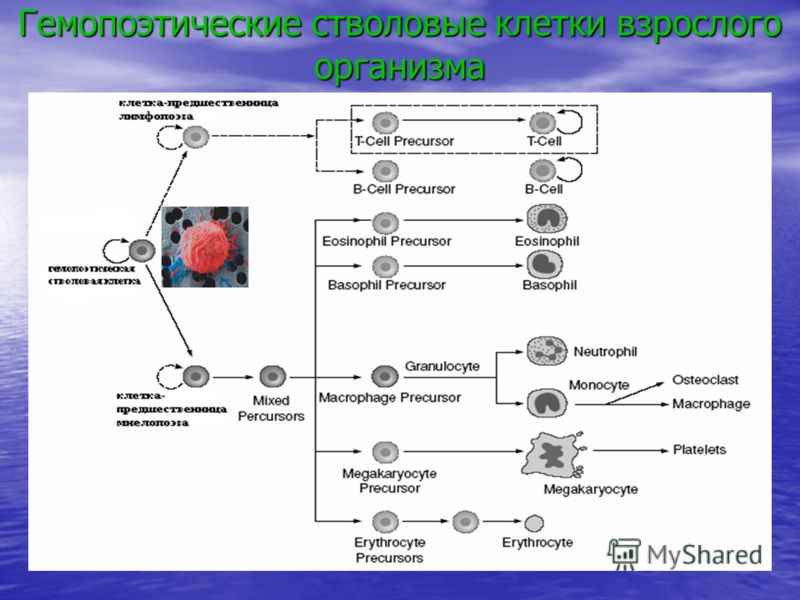 М., Филдс Дж.З., Кавано К.Л., Геттер А., Ранквист О.А. (2008)Как нарушение регуляции динамики крипт толстой кишки вызывает перенаселение стволовых клеток и вызывает рак толстой кишки. Рак Рез
М., Филдс Дж.З., Кавано К.Л., Геттер А., Ранквист О.А. (2008)Как нарушение регуляции динамики крипт толстой кишки вызывает перенаселение стволовых клеток и вызывает рак толстой кишки. Рак Рез
68: 3304–3313. [PubMed] [Google Scholar]
53.
Новак М.А., Мичор Ф., Иваса Ю. (2003) Линейный процесс соматической эволюции. Труды Национальной академии наук
100: 14966–14969. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54.
Харди К., Старк Дж. (2002) Математические модели баланса между апоптозом и пролиферацией. апоптоз
7: 373–381. [PubMed] [Академия Google]
55.
Yatabe Y, Tavare S, Shibata D (2001)Исследование стволовых клеток в толстой кишке человека с использованием моделей метилирования. Proc Natl Acad Sci USA
98: 10839–10844. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56.
Гангули Р., Пури И. (2006) Математическая модель гипотезы раковых стволовых клеток. Пролиферация клеток
39: 3–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57.
Гангули Р.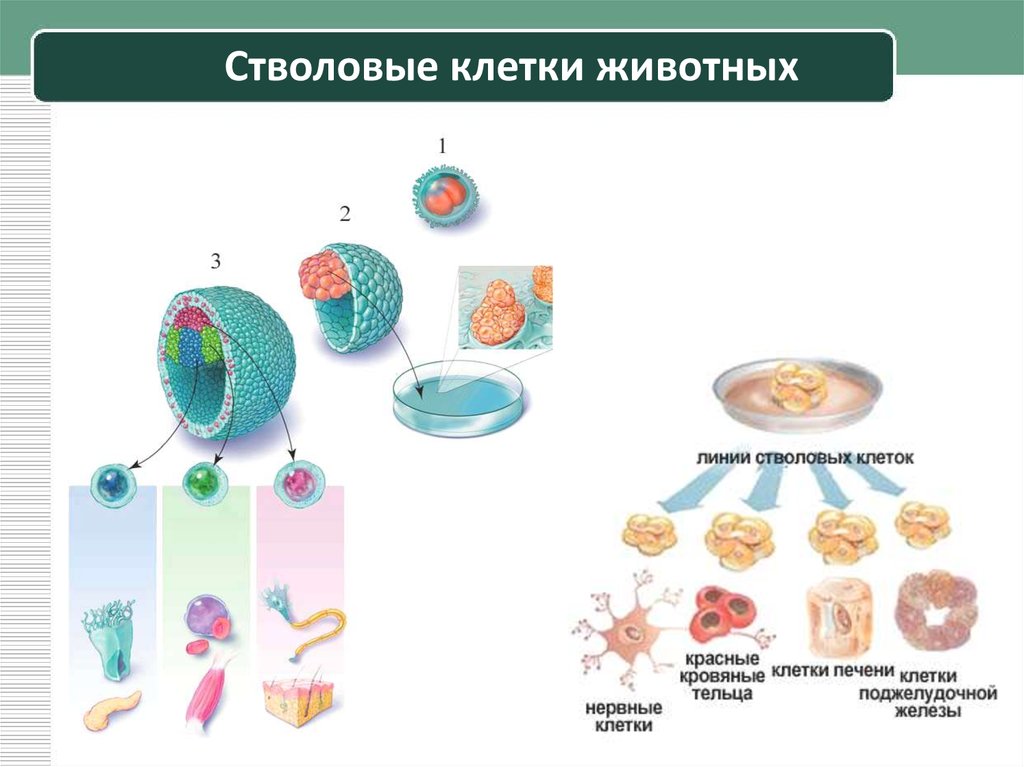 , Пури И. (2007)Математическая модель эффективности химиотерапевтических препаратов при остановке роста опухоли на основе гипотезы раковых стволовых клеток. Пролиферация клеток
, Пури И. (2007)Математическая модель эффективности химиотерапевтических препаратов при остановке роста опухоли на основе гипотезы раковых стволовых клеток. Пролиферация клеток
40: 338–354. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58.
Боман Б.М., Вича М.С., Филдс Дж.З., Ранквист О.А. (2007)Симметричное деление раковых стволовых клеток — ключевой механизм роста опухоли, на который следует обратить внимание в будущих терапевтических подходах. Клиническая фармакология и терапия
81: 893–898. [PubMed] [Google Scholar]
59.
Ашкенази Р., Джентри С.Н., Джексон Т.Л. (2008)Пути к приобретению мутаций моделирования туморогенеза в стволовых клетках и их потомстве. Неоплазия (Нью-Йорк, штат Нью-Йорк)
10: 1170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60.
Michor F (2008) Математические модели раковых стволовых клеток. Журнал клинической онкологии
26: 2854–2861. [PubMed] [Google Scholar]
61.
Tomasetti C, Levy D (2010)Роль симметричного и асимметричного деления стволовых клеток в развитии лекарственной устойчивости.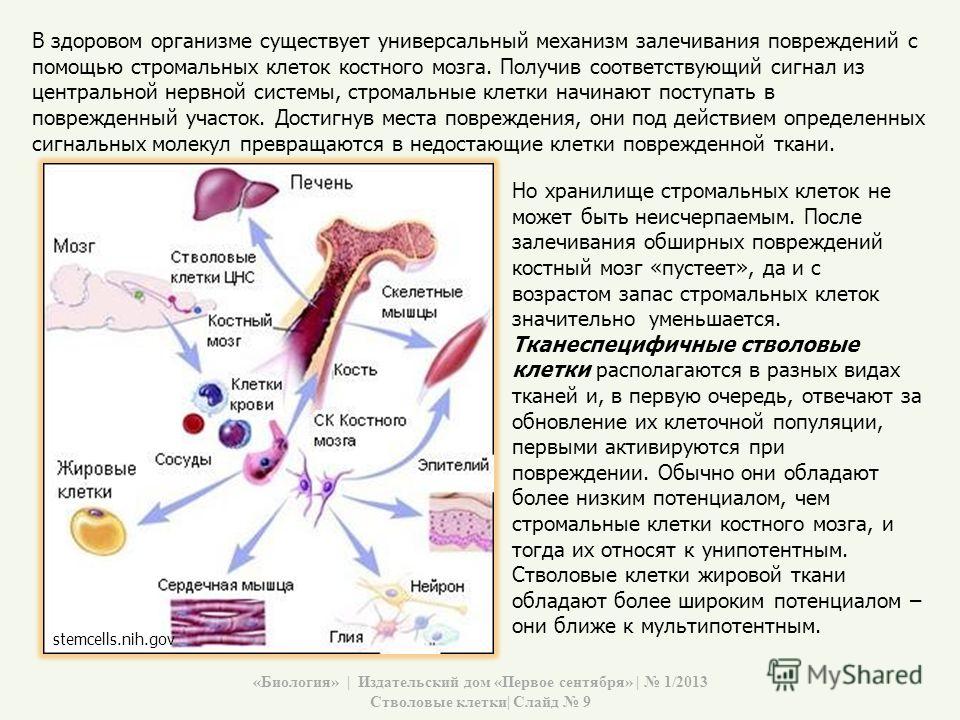 Труды Национальной академии наук
Труды Национальной академии наук
107: 16766–16771. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62.
Enderling H, Hahnfeldt P (2011) Раковые стволовые клетки в солидных опухолях: является ли «уклонение от апоптоза» отличительной чертой рака?
Прогресс в биофизике и молекулярной биологии
[PubMed] [Академия Google]
63.
Эндерлинг Х., Священник М.А., Андерсон А.Р., Вайдья Дж.С. (2007)Математическая модель развития рака молочной железы, местного лечения и рецидивов. Журнал теоретической биологии
246: 245–259. [PubMed] [Google Scholar]
64.
Эндерлинг Х., Андерсон А.Р., Священник М.А., Бехешти А., Хлатки Л. и др. (2009) Парадоксальные зависимости покоя и прогрессии опухоли от базовой кинетики клеток. Исследования рака
69: 8814–8821. [PubMed] [Google Scholar]
65.
Эндерлинг Х., Парк Д., Хлатки Л., Ханфельдт П. (2009 г.) Значение пространственного распределения стволовости и состояния пролиферации в определении радиоответа опухоли. Математическая модель Nat Phenom
4: 117–133. [Google Scholar]
[Google Scholar]
66.
Enderling H, Hlatky L, Hahnfeldt P (2009)Правила миграции: опухоли представляют собой конгломераты собственных метастазов. Британский журнал рака
100: 1917–1925. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67.
Piotrowska M, Enderling H, van der Heiden U, Mackey M (2008) Математическое моделирование 694 стволовых клеток, связанных с раком. Сложные системы в биомедицине
[Академия Google]
68.
Франк С.А., Новак М.А. (2003) Клеточная биология: предрасположенность к развитию рака. Природа
422: 494–494. [PubMed] [Google Scholar]
69.
Michor F, Nowak MA, Frank SA, Iwasa Y (2003)Стохастическое устранение раковых клеток. Труды Лондонского королевского общества, серия B: биологические науки
270: 2017–2024 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70.
Dingli D, Traulsen A, Michor F (2007) (a) симметричная репликация стволовых клеток и рак. вычислительная биология PLoS
3: е53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71.
Hormoz S (2013) Асимметрия популяции стволовых клеток может снизить скорость репликативного старения. Jour Theor Биография
331: 19–27. [PubMed] [Google Scholar]
72.
Новак М.А., Комарова Н.Л., Сенгупта А., Джаллепалли П.В., Ших И.М. и соавт. (2002) Роль хромосомной нестабильности в возникновении опухоли. Труды Национальной академии наук
99: 16226–16231. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73.
Комарова Н.Л., Сенгупта А., Новак М.А. (2003) Мутационно-селекционные сети инициации рака: гены-супрессоры опухолей и хромосомная нестабильность. Журнал теоретической биологии
223: 433–450. [PubMed] [Академия Google]
74.
Иваса Ю., Михор Ф., Новак М.А. (2004)Стохастические туннели в эволюционной динамике. Генетика
166: 1571–1579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75.
Вайсман Д.Б., Десаи М.М., Фишер Д.С., Фельдман М.В. (2009) Скорость, с которой бесполые популяции пересекают долины приспособленности. Теоретическая популяционная биология
75: 286–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
76.
Кэрнс Дж. (2006) Отбор мутаций и естественное течение рака. Наука о старении среды знаний
2006: ср1. [Академия Google]
77.
Карпович П., Морсхед С., Кам А., Джервис Э., Рамунас Дж. и др. (2005)Поддержка гипотезы бессмертной нити нервные стволовые клетки асимметрично делят ДНК in vitro. Журнал клеточной биологии
170: 721–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78.
Рандо Т.А. (2007) Гипотеза бессмертной нити: сегрегация и реконструкция. Клетка
129: 1239–1243. [PubMed] [Google Scholar]
79.
Lansdorp PM (2007) Бессмертные нити? дай мне перерыв. Клетка
129: 1244–1247. [PubMed] [Академия Google]
80.
Huttner WB, Kosodo Y (2005)Симметричное и асимметричное деление клеток во время нейрогенеза в развивающейся центральной нервной системе позвоночных. Текущее мнение в клеточной биологии
17: 648–657. [PubMed] [Google Scholar]
81.
Инь Т., Ли Л. (2006)Ниши стволовых клеток в костях.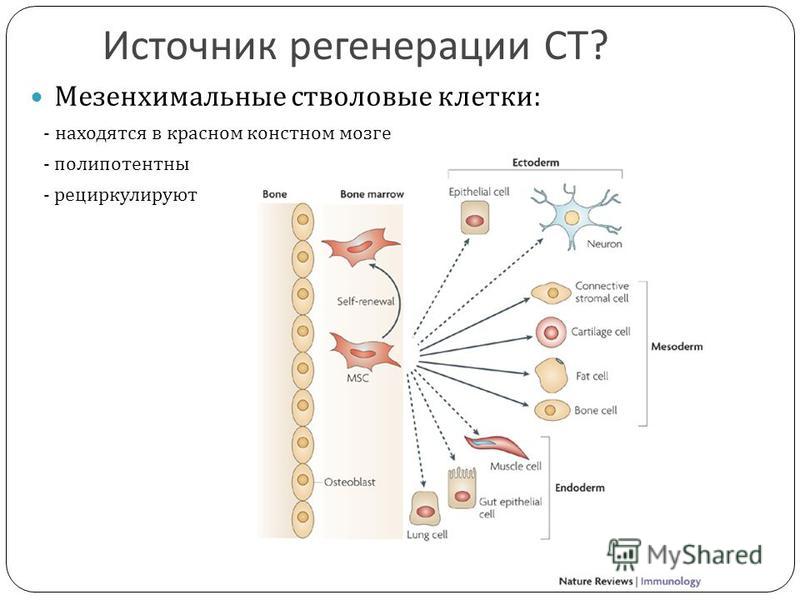 Журнал клинических исследований
Журнал клинических исследований
116: 1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82.
Noctor SC, Martínez-Cerdeño V, Ivic L, Kriegstein AR (2004)Кортикальные нейроны возникают в симметричных и асимметричных зонах деления и мигрируют через определенные фазы. Неврология природы
7: 136–144. [PubMed] [Академия Google]
83.
Morrison SJ, Spradling AC (2008)Стволовые клетки и ниши: механизмы, которые способствуют поддержанию стволовых клеток на протяжении всей жизни. Клетка
132: 598–611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84.
Эггер Б., Голд К.С., Брэнд А.Х. (2011)Регулирование баланса между симметричным и асимметричным делением стволовых клеток в развивающемся мозге. Летать
5: 237–241. [PubMed] [Google Scholar]
85.
Egger B, Gold KS, Brand AH (2010) Notch регулирует переключение с 731 симметричного на асимметричное деление нервных стволовых клеток в оптической доле дрозофилы. Разработка
137: 2981–2987. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Франк С.А. (2007) Динамика рака: заболеваемость, наследование и эволюция. Издательство Принстонского университета. [PubMed]
Франк С.А. (2007) Динамика рака: заболеваемость, наследование и эволюция. Издательство Принстонского университета. [PubMed]
87.
Lengauer C, Kinzler K, Vogelstein B (1997)Генетическая нестабильность при колоректальном раке. Природа
386: 623–627. [PubMed] [Google Scholar]
88.
Комарова Н.Л., Ван Л. (2004) Инициация колоректального рака: куда попали два удара?
Клеточный цикл
3: 1558–1565. [PubMed] [Академия Google]
89.
Cairns J (2002)Соматические стволовые клетки и кинетика мутагенеза и канцерогенеза. Труды Национальной академии наук
99: 10567–10570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90.
Jordan CT, Guzman ML, Noble M (2006) Раковые стволовые клетки. Медицинский журнал Новой Англии
355: 1253–1261. [PubMed] [Google Scholar]
91.
Нгуен Л.В., Ваннер Р., Диркс П., Ивз С.Дж. (2012)Раковые стволовые клетки: развивающаяся концепция. Природа Обзоры Рак
12: 133–143. [PubMed] [Академия Google]
92.
Vermeulen L, Sprick M, Kemper K, Stassi G, Medema J (2008) Раковые стволовые клетки — старые концепции, новые идеи.

 Кроме того, во многих тканях они служат своего рода системой внутренней репарации, практически неограниченно делясь для пополнения других клеток. Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать другим типом клеток с более специализированной функцией.
Кроме того, во многих тканях они служат своего рода системой внутренней репарации, практически неограниченно делясь для пополнения других клеток. Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать другим типом клеток с более специализированной функцией.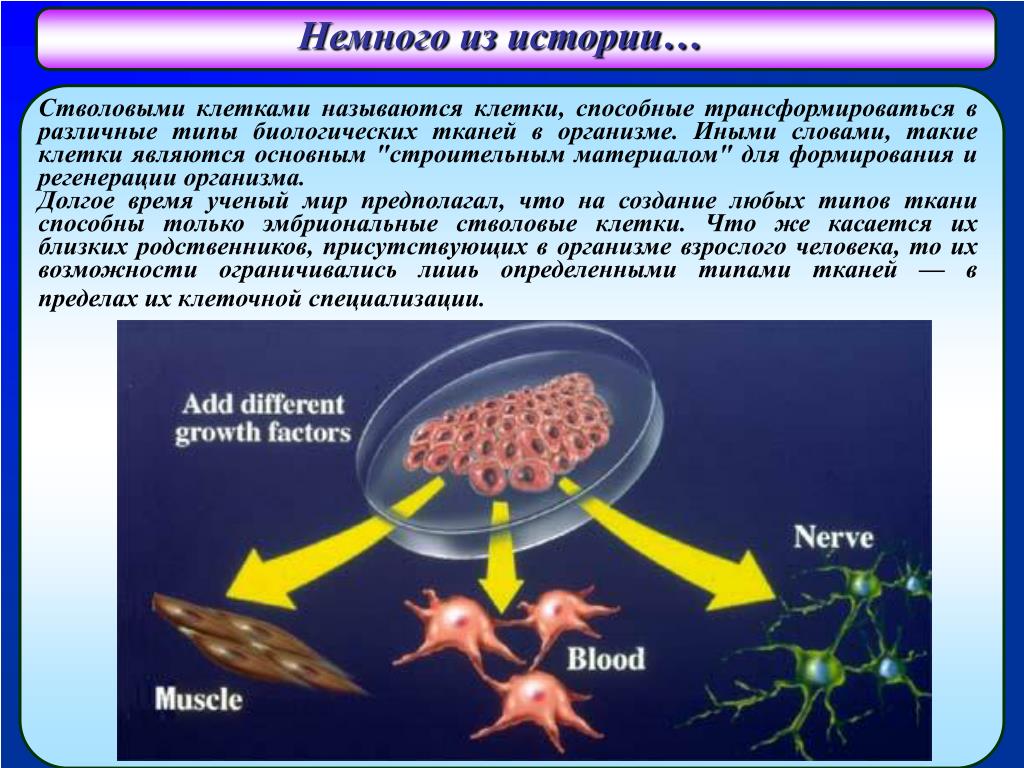

 Фактически, взрослые гемопоэтические или кроветворные стволовые клетки из костного мозга использовались в трансплантатах более 40 лет.
Фактически, взрослые гемопоэтические или кроветворные стволовые клетки из костного мозга использовались в трансплантатах более 40 лет.