Содержание
Хромосомные хвосты как защита от рака
Короткие теломеры на концах хромосом не дают клетке долго жить, тем самым защищая её от злокачественного превращения.
Хромосомные концы-хвосты называются теломерами, и про них мы слышим очень часто. Теломеры – один из индикаторов клеточного старения: чем клетка старше, тем её теломеры короче. Дело в том, что когда клетка делится, она удваивает каждую свою хромосому, чтобы каждой из двух дочерних клеток досталось по копии. Но белки, которые занимаются репликацией (удвоением ДНК) устроены так, что они не могут дочитать и докопировать нить ДНК до конца. То есть на конце каждой хромосомной ДНК есть кусок, который не копируется в новую ДНК, так что новая ДНК оказывается чуть короче, чем старая.
Человеческие хромосомы с теломерными участками на концах. (Фото: NIH Image Gallery / Flickr.com)
Открыть в полном размере
‹
›
Если бы на конце хромосомы сидели гены, кодирующие белки, или ещё какие-нибудь важные ДНК-последовательности, то случилась бы беда: в укороченной хромосоме их бы не было совсем, или же они были бы повреждены. Но на концах ДНК сидят бессмысленные теломеры, которые ничего не кодируют – они просто помогают клеткам делиться без вреда для генома. Однако теломеры не бесконечны. Когда они укорачиваются до определённого размера, клетка делиться уже не может. Иными словами, старая клетка – это та, которая исчерпала лимит делений. Дальше ей остаётся только умереть.
Но на концах ДНК сидят бессмысленные теломеры, которые ничего не кодируют – они просто помогают клеткам делиться без вреда для генома. Однако теломеры не бесконечны. Когда они укорачиваются до определённого размера, клетка делиться уже не может. Иными словами, старая клетка – это та, которая исчерпала лимит делений. Дальше ей остаётся только умереть.
Но ведь есть клетки, которые могут делиться очень и очень долго – стволовые клетки. У них работает фермент теломераза, которая удлиняет теломеры. Стволовые клетки постепенно превращаются в специализированные клетки (клетки кожи, клетки мышц, печени и т. д.), и вот у специализированных клеток теломераза уже не работает. Если специализированная клетка умерла, её можно заменить только с помощь стволовых клеток. Но почему бы теломеразе не работать и в обычных клетках, которые могли бы дальше жить и делиться?
Теломераза работает не только в стволовых клетках. У нас есть ещё одни клетки, способные к бесконечному делению – раковые. В недавней статье в eLife сотрудники Рокфеллеровского университета и Университета Неймегена пишут, что теломеры – это предохранитель от злокачественного перерождения. Дело в том, что пока клетка живёт и делится, в её ДНК накапливаются разнообразные мутации. В клетке есть специальные белки, которые их исправляют, но какие-то мутации всё же остаются. И постепенно их накапливается столько, что они уже ощутимо влияют на то, как клетка выполняет свою работу. Состарившаяся клетка уже не столько приносит пользу, сколько вредит. Более того, среди оставшихся мутаций часто оказываются такие, которые делают клетку злокачественной. Теперь она уже точно не выполняет никакой полезной работы и даже не обращает внимания на окружающие нормальные клетки – теперь она просто делится, формируя опухоль.
В недавней статье в eLife сотрудники Рокфеллеровского университета и Университета Неймегена пишут, что теломеры – это предохранитель от злокачественного перерождения. Дело в том, что пока клетка живёт и делится, в её ДНК накапливаются разнообразные мутации. В клетке есть специальные белки, которые их исправляют, но какие-то мутации всё же остаются. И постепенно их накапливается столько, что они уже ощутимо влияют на то, как клетка выполняет свою работу. Состарившаяся клетка уже не столько приносит пользу, сколько вредит. Более того, среди оставшихся мутаций часто оказываются такие, которые делают клетку злокачественной. Теперь она уже точно не выполняет никакой полезной работы и даже не обращает внимания на окружающие нормальные клетки – теперь она просто делится, формируя опухоль.
И вот тут очень кстати оказываются теломеры. Пусть у клетки сбились собственные внутриклеточные настройки, пусть теперь её внутренние сигналы понуждают её безостановочно делиться, но делиться она сможет до тех пор, пока теломеры не укоротятся до положенного предела.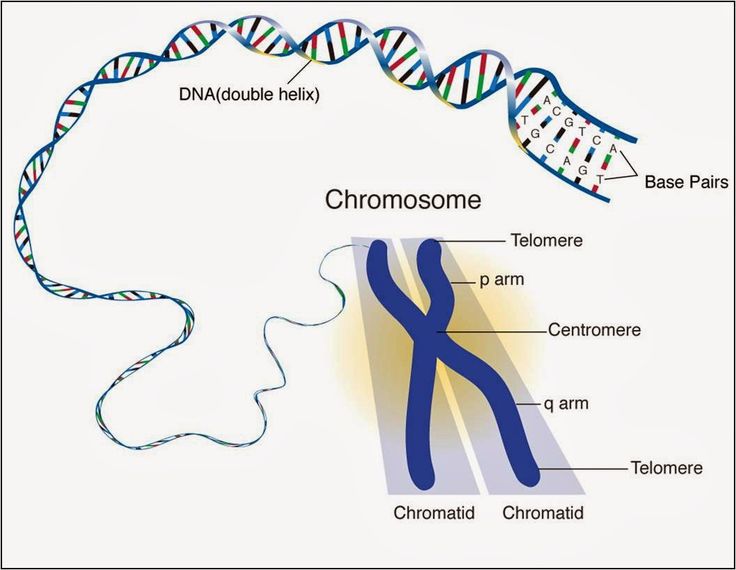 Когда он укоротятся, в клетке включится программа самоуничтожения.
Когда он укоротятся, в клетке включится программа самоуничтожения.
Тем не менее, злокачественные опухоли всё равно появляются. Однако, как утверждают авторы работы, опухоль может рассчитывать на успех только в том случае, если она сможет активировать теломеразу. Действительно, большинство злокачественных образований, которые обнаруживаются при клиническом обследовании, существуют с включённой теломеразой. Чтобы её включить, нужны опять же мутации. Вероятность появления мутаций тем больше, чем дольше клетка живёт. Представим, что теломеры у клетки изначально оказались длиннее обычного. Тогда она проживёт больше, у неё с большей вероятностью появится мутация в гене теломеразы, которая включится и начнёт наращивать теломеры, играя в пользу рака.
Теломераза существует не сама по себе, её активность зависит от других белков. В своей статье исследователи говорят об одном таком белке под названием TIN2. Сравнительно давно известно, что мутации в TIN2 как бы снимают предохранитель с теломеразы, которая начинает активно удлинять хромосомные хвосты.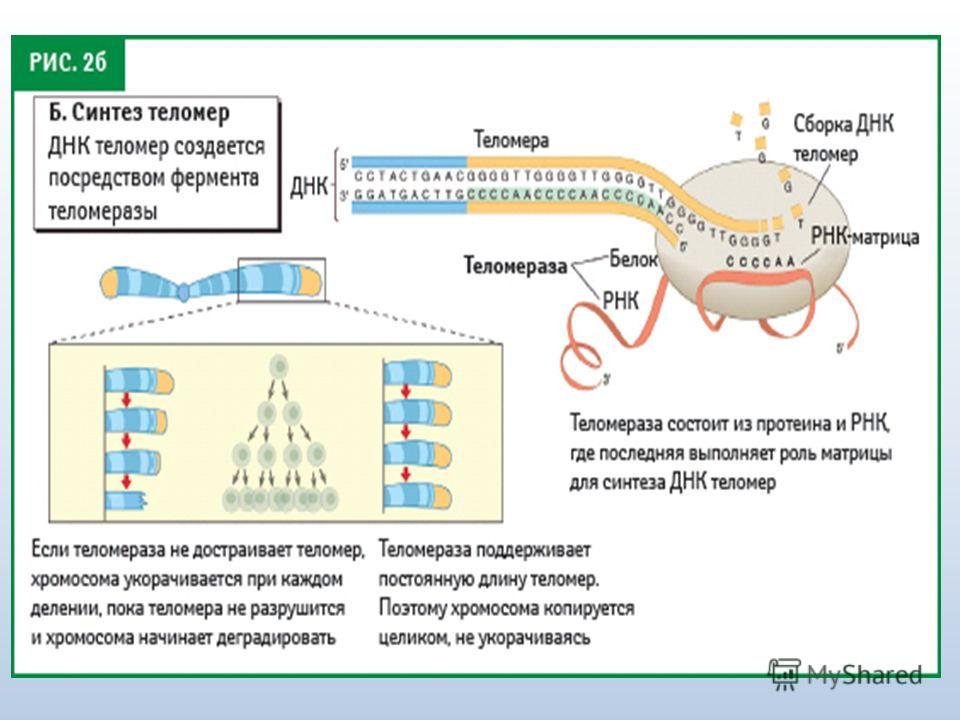 На этот раз удалось показать, что от TIN2 зависит начальная длина теломер, с которой клетка входит, так сказать, в зрелую жизнь.
На этот раз удалось показать, что от TIN2 зависит начальная длина теломер, с которой клетка входит, так сказать, в зрелую жизнь.
Авторы работы проанализировали гены нескольких семей, предрасположенных к онкозаболеваниям. У них удалось выявить характерные мутации в гене TIN2, переходящие из поколения в поколение. У подопытных клеток, которым вводили эту мутацию, теломеры оказывались намного длиннее, чем должны быть. Притом никаких других проблем изначально с ДНК не возникало, геном был стабилен, теломераза оставалась отключённой. Единственной аномалией оказывались слишком длинные теломеры, которые давали возможность прожить дольше.
Получается следующая последовательность событий: из-за мутации в белке TIN2 он перестаёт должным образом контролировать теломеразу, которая на ранних этапах развития награждает хромосомы слишком длинными хвостами. Затем теломераза засыпает, а клетки живут и работают, время от времени делясь и накапливая мутации (которые, кстати говоря, возникают и при удвоении ДНК).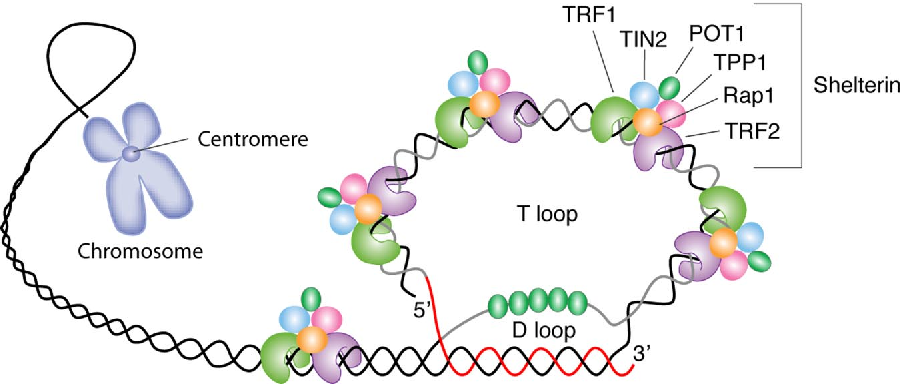 Из-за увеличенного срока жизни в клетках появляется больше мутаций, в том числе и злокачественных, и у этих мутаций больше шансов окончательно превратить клетку в раковую (в частности, они с большей вероятностью разбудят теломеразу и окончательно решат проблему с укорачивающимися теломерами).
Из-за увеличенного срока жизни в клетках появляется больше мутаций, в том числе и злокачественных, и у этих мутаций больше шансов окончательно превратить клетку в раковую (в частности, они с большей вероятностью разбудят теломеразу и окончательно решат проблему с укорачивающимися теломерами).
Получается, что короткие теломеры служат предохранителями от онкозаболеваний. Будь хромосомные концы подлиннее, рак был бы намного более распространён и, вероятно, был бы ещё более разнообразен. Впрочем, хотя гипотеза о теломерной защите от рака обсуждается давно, далеко не все с ней согласны. Хотя эта работа предлагает дополнительные (пусть и косвенные) аргументы в её пользу, споры среди специалистов об эволюционном значении теломер вряд ли стихнут так уж скоро.
Длинные теломеры – не панацея от старости, а путь к развитию рака
: 06.12.2020
О теломерах, защитных «колпачках» на кончиках хромосом, ученым известно довольно давно, но до сих пор в теломерной биологии остается масса вопросов. Один из основных можно сформулировать так: может ли увеличение теломер предотвратить старение, или это прямая дорога к развитию раковой опухоли? Частично ответ удалось получить, исследуя семьи с наследственной предрасположенностью к онкологическим заболеваниям
Один из основных можно сформулировать так: может ли увеличение теломер предотвратить старение, или это прямая дорога к развитию раковой опухоли? Частично ответ удалось получить, исследуя семьи с наследственной предрасположенностью к онкологическим заболеваниям
При каждом делении клетки хромосомы, содержащие наш генетический материал, становятся немного короче. Но функциональным последовательностям ДНК ничего не грозит: удар берут на себя расположенные на концах хромосом теломеры. Прежде чем они закончатся, клетка успевает выполнить примерно 50 делений, а затем наступает момент, называемый пределом Хейфлика, и клетка гибнет.
Наращивать теломеры способен фермент теломераза, которая в норме работает в стволовых и половых клетках, а в обычных клетках отсутствует. Зато теломераза активна в клетках большинства видов рака.
Из этих фактов возникла идея, что истощение резерва теломер блокирует развитие рака, и только те клетки, которым удается активировать теломеразу, могут преодолеть барьер и продолжать размножаться, превращаясь во все более злокачественные. Эта гипотеза была впервые предложена несколько десятилетий назад, но до сих пор не была доказана, хотя наблюдения и некоторые эксперименты на мышах вроде бы подтверждают ее.
Эта гипотеза была впервые предложена несколько десятилетий назад, но до сих пор не была доказана, хотя наблюдения и некоторые эксперименты на мышах вроде бы подтверждают ее.
Число клеточных делений, которые клетка может выполнить до остановки делений, зависит от начальной длины теломер. При рождении теломеры человека имеют определенную среднюю длину, характерную для нашего вида. Считается, что этого резерва теломер достаточно для поддержания деления клеток, необходимого для нормального развития и гомеостаза тканей. Если теломеры будут слишком длинными, их резерв не исчерпается вовремя, клетки получат дополнительные деления, во время которых могут произойти мутации, в том числе активирующие теломеразу, и создадутся благоприятные условия для развития рака.
Ученые из США и Нидерландов, занимаясь проблемой связи длины теломер и рака, обнаружили несколько голландских семей с наследственным раком разной локализации, у представителей которых были мутации в гене TINF2, кодирующем белок TIN2./13_m3.jpg) Этот белок принадлежит к группе белков, участвующих в регуляции длины теломер: снижение его функции способствует работе теломеразы.
Этот белок принадлежит к группе белков, участвующих в регуляции длины теломер: снижение его функции способствует работе теломеразы.
С помощью технологии редактирования генов CRISPR ученые создали и исследовали клетки, несущие такие же мутации, как в голландских семьях с предрасположенностью к онкологическим заболеваниям. Это были нормальные, здоровые клетки, их теломеры адекватно выполняли свою функцию, клеточный геном был стабилен. Просто в них были более длинные теломеры – как и у членов обследуемых семей.
Ученые пришли к выводу, что TINF2 можно назвать геном-супрессором опухоли. Инактивация даже одной его копии в результате мутации приводит к предрасположенности к раку, так как слишком длинные теломеры позволяют клеткам делиться дольше «положенного». Ученые считают, что вряд ли мутации TINF2 приводят к удлинению теломер в родительских клетках, скорее всего, ущербный TIN2 не способен в должной степени сдержать теломеразу, которая активна во время раннего эмбрионального развития.
Известно, что другие мутации TIN2, которые вызывают чрезмерное укорочение теломер, ведут к развитию синдромов недостаточности костного мозга. Таким образом, длина теломер должна находиться строго в определенных пределах, чтобы не возникало ни преждевременного истощения стволовых клеток, ни развития рака.
Фото: https://www.flickr.com
: 06.12.2020
Физическая активность и питание: две многообещающие стратегии поддержания теломер?
1. Организация Объединенных Наций . Старение населения мира. Отдел народонаселения по экономическим и социальным вопросам; Нью-Йорк, штат Нью-Йорк, США: 2009. [Google Scholar]
2. Старение населения и устойчивое развитие. [(по состоянию на 8 августа 2018 г.)]; Доступно в Интернете: http://www.un.org/en/development/desa/population/publications/pdf/popfacts/PopFacts_2017-1.pdf
3. Lopez-Otin C., Blasco M.A., Partridge L., Serrano М., Кремер Г. Признаки старения. Клетка. 2013;153:1194–1217. doi: 10.1016/j.cell.2013.05.039. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
Клетка. 2013;153:1194–1217. doi: 10.1016/j.cell.2013.05.039. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
4. Омодей Д., Фонтана Л. Ограничение калорий и профилактика возрастных хронических заболеваний. ФЭБС лат. 2011; 585:1537–1542. doi: 10.1016/j.febslet.2011.03.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Кеннеди Б.К., Бергер С.Л., Брюнет А., Кампизи Дж., Куэрво А.М., Эпель Э.С., Франчески К., Литгоу Г.Дж., Моримото Р.И., Пессин J.E. и др. Геронаука: связь старения с хроническими заболеваниями. Клетка. 2014;159: 709–713. doi: 10.1016/j.cell.2014.10.039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Kaeberlein M., Rabinovitch P.S., Martin G.M. Здоровое старение: лучшая профилактическая медицина. Наука. 2015; 350:1191–1193. doi: 10.1126/science.aad3267. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Цанетаку И.П., Нзиетчуенг Р., Перреа Д.Н., Бенетос А. Теломеры и их роль в старении и долголетии. Курс. Васк. Фармакол. 2014; 12:726–734. дои: 10.2174/1570161111666131219112946. [PubMed] [CrossRef] [Google Scholar]
Курс. Васк. Фармакол. 2014; 12:726–734. дои: 10.2174/1570161111666131219112946. [PubMed] [CrossRef] [Google Scholar]
8. Меркен Э.М., Карбоно Б.А., Кржисик-Уокер С.М., де Кабо Р. О мышах и людях: преимущества ограничения калорий, упражнений и миметиков. Старение Res. 2012; 11:390–398. doi: 10.1016/j.arr.2011.11.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Sanders J.L., Newman A.B. Длина теломер в эпидемиологии: биомаркер старения, возрастных заболеваний, того и другого или ни того, ни другого? Эпидемиол. 2013; 35:112–131. дои: 10.1093/эпирев/mxs008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Arnoult N., Karlseder J. Сложные взаимодействия между реакцией на повреждение ДНК и теломерами млекопитающих. Нац. Структура Мол. биол. 2015;22:859–866. doi: 10.1038/nsmb.3092. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Karlseder J., Smogorzewska A., de Lange T. Старение, вызванное измененным состоянием теломер, а не потерей теломер. Наука. 2002; 295:2446–2449. doi: 10.1126/science.1069523. [PubMed] [CrossRef] [Академия Google]
Наука. 2002; 295:2446–2449. doi: 10.1126/science.1069523. [PubMed] [CrossRef] [Академия Google]
12. Видачек Н.С., Наник Л., Равлич С., Сопта М., Герич М., Гайски Г., Гарай-Врховац В., Рубель И. Теломеры, питание и долголетие: можем ли мы действительно управлять своим старением? Дж. Геронтол. сер. биол. науч. Мед. науч. 2017;73:39–47. doi: 10.1093/gerona/glx082. [PubMed] [CrossRef] [Google Scholar]
13. Чилтон В., О’Брайен Б., Чарчар Ф. Теломеры, Старение и физические упражнения: виноваты по ассоциации? Междунар. Дж. Мол. науч. 2017;18:2573. doi: 10.3390/ijms18122573. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Arsenis N.C., You T., Ogawa E.F., Tinsley G.M., Zuo L. Физическая активность и длина теломер: влияние старения и потенциальные механизмы действия. Онкотаргет. 2017;8:45008–45019. doi: 10.18632/oncotarget.16726. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Greider CW Telomeres. Курс. мнение Клеточная биол. 1991; 3: 444–451. doi: 10.1016/0955-0674(91)
1991; 3: 444–451. doi: 10.1016/0955-0674(91)
-7. [PubMed] [CrossRef] [Google Scholar]
16. De Lange T. Shelterin: Белковый комплекс, формирующий и защищающий теломеры человека. Гены Дев. 2005;19: 21:00–21:10. doi: 10.1101/gad.1346005. [PubMed] [CrossRef] [Google Scholar]
17. Maciejowski J., de Lange T. Теломеры при раке: подавление опухоли и нестабильность генома. Нац. Преподобный Мол. Клеточная биол. 2017;18:175–186. doi: 10.1038/nrm.2016.171. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Чжан Ф., Ченг Д., Ван С., Чжу Дж. Специфическая регуляция гена теломеразы обратной транскриптазы у человека. Гены. 2016;7:30. doi: 10.3390/genes7070030. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Накамура Т.М., Чех Т.Р. Время обращения: происхождение теломеразы. Клетка. 1998; 92: 587–590. doi: 10.1016/S0092-8674(00)81123-X. [PubMed] [CrossRef] [Google Scholar]
20. Ю Г.Л., Брэдли Дж.Д., Аттарди Л.Д., Блэкберн Э.Х. In vivo изменение последовательностей теломер и старение, вызванное мутацией РНК теломеразы Tetrahymena. Природа. 1990; 344: 126–132. doi: 10.1038/344126a0. [PubMed] [CrossRef] [Google Scholar]
Природа. 1990; 344: 126–132. doi: 10.1038/344126a0. [PubMed] [CrossRef] [Google Scholar]
21. Harley CB, Futcher AB, Greider CW Теломеры укорачиваются при старении фибробластов человека. Природа. 1990;345:458–460. doi: 10.1038/345458a0. [PubMed] [CrossRef] [Google Scholar]
22. Мураки К., Нихан К., Хан Л., Мурнан Дж. П. Механизмы потери теломер и их последствия для хромосомной нестабильности. Фронт. Онкол. 2012;2:135. doi: 10.3389/fonc.2012.00135. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Von Zglinicki T. Окислительный стресс укорачивает теломеры. Тенденции биохим. науч. 2002; 27: 339–344. doi: 10.1016/S0968-0004(02)02110-2. [PubMed] [CrossRef] [Академия Google]
24. Авив А., Чен В., Гарднер Дж. П., Кимура М., Бримакомб М., Цао Х., Шринивасан С. Р., Беренсон Г. С. Динамика теломер лейкоцитов: продольные данные среди молодых людей в исследовании сердца Богалусы. Являюсь. Дж. Эпидемиол. 2009; 169: 323–329. doi: 10.1093/aje/kwn338. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Eitan E., Hutchison E.R., Mattson M.P. Укорочение теломер при неврологических расстройствах: множество вопросов без ответов. Тренды Нейроси. 2014; 37: 256–263. doi: 10.1016/j.tins.2014.02.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Eitan E., Hutchison E.R., Mattson M.P. Укорочение теломер при неврологических расстройствах: множество вопросов без ответов. Тренды Нейроси. 2014; 37: 256–263. doi: 10.1016/j.tins.2014.02.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Леунг К.В., Ларайя Б.А., Коулман-Фокс К., Буш Н.Р., Лин Дж., Блэкберн Э.Х., Адлер Н.Е., Эпель Э.С. Потребление сладких напитков и пищи и поддержание длины теломер лейкоцитов у беременных. Евро. Дж. Клин. Нутр. 2016;70:1086–1088. doi: 10.1038/ejcn.2016.93. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Lee JY, Jun NR, Yoon D., Shin C., Baik I. Связь между диетическими моделями в далеком прошлом и длиной теломер. Евро. Дж. Клин. Нутр. 2015;69: 1048–1052. doi: 10.1038/ejcn.2015.58. [PubMed] [CrossRef] [Google Scholar]
28. Leung C.W., Laraia B.A., Needham B.L., Rehkopf D.H., Adler N.E., Lin J., Blackburn E.H., Epel E.S. Сода и старение клеток: связь между потреблением подслащенных сахаром напитков и длиной теломер лейкоцитов у здоровых взрослых по данным Национального исследования здоровья и питания. Являюсь. Дж. Общественное здравоохранение. 2014;104:2425–2431. doi: 10.2105/AJPH.2014.302151. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Общественное здравоохранение. 2014;104:2425–2431. doi: 10.2105/AJPH.2014.302151. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Боккарди В., Эспозито А., Риццо М.Р., Марфелла Р., Барбьери М., Паолиссо Г. Средиземноморская диета, поддержание теломер и состояние здоровья пожилых людей. ПЛОС ОДИН. 2013;8:e62781. doi: 10.1371/journal.pone.0062781. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Crous-Bou M., Fung TT, Prescott J., Julin B., Du M., Sun Q., Rexrode K.M., Hu F.B., De Vivo I. Средиземноморская диета и длина теломер в исследовании здоровья медсестер: популяционное когортное исследование. БМЖ. 2014;349:g6674. doi: 10.1136/bmj.g6674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Borresen E.C., Brown D.G., Harbison G., Taylor L., Fairbanks A., O’Malia J., Bazan M., Rao S. , Бейли С.М., Вдовик М. и др. Рандомизированное контролируемое исследование по увеличению потребления фасоли или рисовых отрубей у выживших после колоректального рака. Нутр. Рак. 2016;68:1269–1280. doi: 10.1080/01635581.2016.1224370. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нутр. Рак. 2016;68:1269–1280. doi: 10.1080/01635581.2016.1224370. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Даниали Л., Бенетос А., Сассер Э., Карк Дж.Д., Лабат С., Кимура М., Десаи К., Граник М., Авив А. Теломеры укорачиваются с эквивалентной скоростью в соматических тканях взрослых. Нац. коммун. 2013;4:1597. doi: 10.1038/ncomms2602. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Liu J.J., Crous-Bou M., Giovannucci E., De Vivo I. Потребление кофе положительно связано с увеличением длины теломер лейкоцитов у медсестер. Исследование здоровья. Дж. Нутр. 2016; 146:1373–1378. doi: 10.3945/jn.116.230490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Паванелло С., Ходжа М., Диони Л., Бертацци П.А., Сненги Р., Налессо А., Феррара С.Д., Монтиши М., Баккарелли А. Укороченные теломеры у лиц, злоупотребляющих алкоголем. Междунар. Дж. Рак. 2011;129: 983–992. doi: 10.1002/ijc.25999. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
35. D’Mello M.J., Ross S.A., Briel M., Anand S.S., Gerstein H., Pare G. Связь между укороченной длиной теломер лейкоцитов и кардиометаболическими исходами : Систематический обзор и метаанализ. Цирк. Кардиовас. Жене. 2015; 8:82–90. doi: 10.1161/CIRCGENETICS.113.000485. [PubMed] [CrossRef] [Google Scholar]
D’Mello M.J., Ross S.A., Briel M., Anand S.S., Gerstein H., Pare G. Связь между укороченной длиной теломер лейкоцитов и кардиометаболическими исходами : Систематический обзор и метаанализ. Цирк. Кардиовас. Жене. 2015; 8:82–90. doi: 10.1161/CIRCGENETICS.113.000485. [PubMed] [CrossRef] [Google Scholar]
36. Хаят И., Ахмад А., Масуд Т., Ахмед А., Башир С. Пищевая ценность и полезные свойства фасоли ( Phaseolus vulgaris L.): обзор. крит. Преподобный Food Sci. Нутр. 2014; 54: 580–592. doi: 10.1080/10408398.2011.596639. [PubMed] [CrossRef] [Google Scholar]
37. Tanaka H., Beam M.J., Caruana K. Наличие слияния теломер при спорадическом раке толстой кишки независимо от стадии заболевания, статуса мутации TP53/KRAS, средней длины теломер и теломеразы. Мероприятия. Неоплазия. 2014; 16:814–823. doi: 10.1016/j.neo.2014.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Willett W.C., Sacks F., Trichopoulou A., Drescher G., Ferro-Luzzi A., Helsing E. , Trichopoulos D. Пирамида средиземноморской диеты: культурная модель здорового питания. Являюсь. Дж. Клин. Нутр. 1995; 61: 1402–1406 с. doi: 10.1093/ajcn/61.6.1402S. [PubMed] [CrossRef] [Google Scholar]
, Trichopoulos D. Пирамида средиземноморской диеты: культурная модель здорового питания. Являюсь. Дж. Клин. Нутр. 1995; 61: 1402–1406 с. doi: 10.1093/ajcn/61.6.1402S. [PubMed] [CrossRef] [Google Scholar]
39. Гарсия-Кальсон С., Мартинес-Гонсалес М.А., Разкин С., Корелла Д., Салас-Сальвадо Дж., Мартинес Дж.А., Залба Г., Марти А. Pro12Ala полиморфизм гена PPARgamma2 взаимодействует со средиземноморской диетой для предотвращения укорочения теломер в рандомизированном исследовании PREDIMED-NAVARRA. Цирк. Кардиовас. Жене. 2015;8:91–99. doi: 10.1161/CIRCGENETICS.114.000635. [PubMed] [CrossRef] [Google Scholar]
40. McNaughton S.A., Bates C.J., Mishra G.D. Качество питания связано со смертностью от всех причин у взрослых в возрасте 65 лет и старше. Дж. Нутр. 2012; 142:320–325. doi: 10.3945/jn.111.148692. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Milte C.M., Russell A.P., Ball K., Crawford D., Salmon J., McNaughton S.A. Качество питания и длина теломер у пожилых австралийских мужчин и женщин . Евро. Дж. Нутр. 2018; 57: 363–372. дои: 10.1007/s00394-016-1326-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Евро. Дж. Нутр. 2018; 57: 363–372. дои: 10.1007/s00394-016-1326-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Финкель Т. Метаболическая регуляция старения. Нац. Мед. 2015;21:1416–1423. doi: 10.1038/nm.3998. [PubMed] [CrossRef] [Google Scholar]
43. Sun L., Sadighi Akha A.A., Miller R.A., Harper J.M. Увеличение продолжительности жизни у мышей за счет ограничения пищи перед отъемом и ограничения метионина в среднем возрасте. Дж. Геронтол. сер. биол. науч. Мед. науч. 2009; 64: 711–722. doi: 10.1093/gerona/glp051. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Мэттисон Дж.А., Колман Р.Дж., Бизли Т.М., Эллисон Д.Б., Кемниц Дж.В., Рот Г.С., Ингрэм Д.К., Вайндрух Р., де Кабо Р., Андерсон Р.М. Ограничение калорийности улучшает здоровье и выживаемость макак-резусов. Нац. коммун. 2017;8:14063. doi: 10.1038/ncomms14063. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Сарасват К., Ризви С.И. Новые стратегии открытия лекарств против старения. Мнение эксперта. Препарат Дисков. 2017;12:955–966. doi: 10.1080/17460441.2017.1349750. [PubMed] [CrossRef] [Академия Google]
Мнение эксперта. Препарат Дисков. 2017;12:955–966. doi: 10.1080/17460441.2017.1349750. [PubMed] [CrossRef] [Академия Google]
46. Уолш М.Е., Ши Ю., Ван Реммен Х. Влияние диетических ограничений на окислительный стресс у грызунов. Свободный Радик. биол. Мед. 2014;66:88–99. doi: 10.1016/j.freeradbiomed.2013.05.037. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Гарсия-Кальсон С., Залба Г., Руис-Канела М., Шиваппа Н., Хеберт Дж. Р., Мартинес Дж. А., Фито М., Гомес -Gracia E., Martinez-Gonzalez M.A., Marti A. Диетический воспалительный индекс и длина теломер у субъектов с высоким риском сердечно-сосудистых заболеваний из исследования PREDIMED-NAVARRA: поперечный и продольный анализы за 5 лет. Являюсь. Дж. Клин. Нутр. 2015;102:897–904. doi: 10.3945/ajcn.115.116863. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
48. Oikawa S., Kawanishi S. Сайт-специфическое повреждение ДНК в последовательности GGG из-за окислительного стресса может ускорить укорочение теломер. ФЭБС лат. 1999; 453:365–368. doi: 10.1016/S0014-5793(99)00748-6. [PubMed] [CrossRef] [Google Scholar]
ФЭБС лат. 1999; 453:365–368. doi: 10.1016/S0014-5793(99)00748-6. [PubMed] [CrossRef] [Google Scholar]
49. Ахмед В., Лингнер Дж. Влияние окислительного стресса на биологию теломер. Отличаться. Рез. биол. Дайверы. 2018;99:21–27. doi: 10.1016/j.diff.2017.12.002. [PubMed] [CrossRef] [Академия Google]
50. Авив А. Длина теломер лейкоцитов: Рассказ о теломерах продолжается. Являюсь. Дж. Клин. Нутр. 2009; 89: 1721–1722. doi: 10.3945/ajcn.2009.27807. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Thomas P., Wang YJ, Zhong JH, Kosaraju S., O’Callaghan NJ, Zhou XF, Fenech M. Полифенолы виноградных косточек и куркумин снижают События нестабильности генома в модели трансгенной мыши с болезнью Альцгеймера. Мутат. Рез. 2009; 661: 25–34. doi: 10.1016/j.mrfmmm.2008.10.016. [PubMed] [CrossRef] [Академия Google]
52. Garcia-Calzon S., Moleres A., Martinez-Gonzalez M.A., Martinez J.A., Zalba G., Marti A. Общая антиоксидантная способность рациона связана с длиной теломер лейкоцитов у детей и подростков. клин. Нутр. 2015; 34: 694–699. doi: 10.1016/j.clnu.2014.07.015. [PubMed] [CrossRef] [Google Scholar]
клин. Нутр. 2015; 34: 694–699. doi: 10.1016/j.clnu.2014.07.015. [PubMed] [CrossRef] [Google Scholar]
53. Schwingshackl L., Hoffmann G. Средиземноморская диета, воспаление и функция эндотелия: систематический обзор и метаанализ интервенционных испытаний. Нутр. Метаб. Кардиовас. Дис. 2014;24:929–939. doi: 10.1016/j.numecd.2014.03.003. [PubMed] [CrossRef] [Google Scholar]
54. Марин С., Дельгадо-Листа Х., Рамирес Р., Карраседо Х., Кабальеро Х., Перес-Мартинес П., Гутьеррес-Марискаль Ф.М., Гарсия-Риос А., Дельгадо-Касадо Н., Круз-Тено С. и др. Средиземноморская диета снижает связанный со старением стресс в эндотелиальных клетках. Возраст. 2012; 34:1309–1316. doi: 10.1007/s11357-011-9305-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Beyne-Rauzy O., Recher C., Dastugue N., Demur C., Pottier G., Laurent G., Sabatier L., Mansat -Де Мас В. Фактор некроза опухоли альфа вызывает старение и хромосомную нестабильность в лейкемических клетках человека. Онкоген. 2004; 23:7507–7516. doi: 10.1038/sj.onc.1208024. [PubMed] [CrossRef] [Академия Google]
Онкоген. 2004; 23:7507–7516. doi: 10.1038/sj.onc.1208024. [PubMed] [CrossRef] [Академия Google]
56. Кондо Т., Хиросе М., Кагеяма К. Роль окислительного стресса и окислительно-восстановительной регуляции при атеросклерозе. Дж. Атеросклера. Тромбоз. 2009; 16: 532–538. doi: 10.5551/jat.1255. [PubMed] [CrossRef] [Google Scholar]
57. Masi S., Nightingale C.M., Day I.N., Guthrie P., Rumley A., Lowe G.D., von Zglinicki T., D’Aiuto F., Taddei S., Клейн Н. и др. Воспалительные, а не сердечно-сосудистые факторы риска связаны с короткой длиной теломер лейкоцитов у подростков 13-16 лет. Артериосклероз. Тромбоз сосудов. биол. 2012;32:2029–2034. doi: 10.1161/ATVBAHA.112.250589. [PubMed] [CrossRef] [Google Scholar]
58. Гомес-Дельгадо Ф., Алькала-Диас Дж. Ф., Гарсия-Риос А., Дельгадо-Листа Дж., Ортис-Моралес А., Рангель-Зунига О., Тинахонес Ф.Дж., Гонсалес-Гуардиа Л., Малагон М.М., Беллидо-Муньос Э. и др. Полиморфизм гена TNF-альфа взаимодействует со средиземноморской диетой, влияя на метаболизм триглицеридов и статус воспаления у пациентов с метаболическим синдромом: из клинического исследования CORDIOPREV. Мол. Нутр. Еда Рез. 2014;58:1519–1527. doi: 10.1002/mnfr.201300723. [PubMed] [CrossRef] [Google Scholar]
Мол. Нутр. Еда Рез. 2014;58:1519–1527. doi: 10.1002/mnfr.201300723. [PubMed] [CrossRef] [Google Scholar]
59. Денхэм Дж., О’Брайен Б.Дж., Чарчар Ф.Дж. Поддержание длины теломер и профилактика сердечно-метаболических заболеваний посредством физических упражнений. Спорт Мед. 2016;46:1213–1237. doi: 10.1007/s40279-016-0482-4. [PubMed] [CrossRef] [Google Scholar]
60. Loprinzi PD, Sng E. Физическая активность, специфичная для режима, и длина теломер лейкоцитов среди взрослых в США: влияние бега на клеточное старение. Пред. Мед. 2016;85:17–19. doi: 10.1016/j.ypmed.2016.01.002. [PubMed] [CrossRef] [Google Scholar]
61. Такер Л.А. Физическая активность и длина теломер у мужчин и женщин в США: исследование NHANES. Пред. Мед. 2017; 100:145–151. doi: 10.1016/j.ypmed.2017.04.027. [PubMed] [CrossRef] [Google Scholar]
62. Denham J., O’Brien BJ, Prestes P.R., Brown NJ, Charchar FJ Увеличение экспрессии генов, регулирующих теломеры, у спортсменов, занимающихся выносливостью, с длинными теломерами лейкоцитов. Дж. Заявл. Физиол. 2016; 120:148–158. doi: 10.1152/japplphysiol.00587.2015. [PubMed] [CrossRef] [Академия Google]
Дж. Заявл. Физиол. 2016; 120:148–158. doi: 10.1152/japplphysiol.00587.2015. [PubMed] [CrossRef] [Академия Google]
63. Rae D.E., Vignaud A., Butler-Browne GS, Thornell L.E., Sinclair-Smith C., Derman E.W., Lambert M.I., Collins M. Длина теломер скелетных мышц у здоровых, опытных бегунов на выносливость. Евро. Дж. Заявл. Физиол. 2010;109:323–330. doi: 10.1007/s00421-010-1353-6. [PubMed] [CrossRef] [Google Scholar]
64. Муньеса К.А., Верде З., Диас-Урена Г., Сантьяго К., Гутьеррес Ф., Диас Э., Гомес-Гальего Ф., Пареха-Галеано Х. , Соарес-Миранда Л., Люсия А. Длина теломер у элитных спортсменов. Междунар. Ж. Спортивная физиол. Выполнять. 2017;12:994–996. doi: 10.1123/ijspp.2016-0471. [PubMed] [CrossRef] [Google Scholar]
65. Denham J., Nelson C.P., O’Brien B.J., Nankervis S.A., Denniff M., Harvey J.T., Marques F.Z., Codd V., Zukowska-Szczechowska E., Samani Нью-Джерси и др. Более длинные теломеры лейкоцитов связаны с упражнениями на сверхвыносливость независимо от сердечно-сосудистых факторов риска. ПЛОС ОДИН. 2013;8:e69377. doi: 10.1371/journal.pone.0069377. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2013;8:e69377. doi: 10.1371/journal.pone.0069377. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Диман А., Борос Дж., Пулен Ф., Родригес Дж., Пурнель М., Эпископу Х., Бертран Л., Франко М. , Deldicque L., Decottignies A. Ядерный респираторный фактор 1 и упражнения на выносливость способствуют транскрипции теломер человека. науч. Доп. 2016;2:e1600031. doi: 10.1126/sciadv.1600031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Черкас Л.Ф., Ханкин Дж.Л., Като Б.С., Ричардс Дж.Б., Гарднер Дж.П., Сурдулеску Г.Л., Кимура М., Лу Х., Спектор Т.Д., Авив А. Связь между физической активностью в свободное время и длиной теломер лейкоцитов. Арка Стажер Мед. 2008; 168: 154–158. doi: 10.1001/archinternmed.2007.39. [PubMed] [CrossRef] [Google Scholar]
68. LaRocca T.J., Seals D.R., Pierce G.L. Длина теломер лейкоцитов сохраняется с возрастом у взрослых, тренируемых на выносливость, и связана с максимальной аэробной способностью. мех. Старение Дев. 2010; 131:165–167. doi: 10.1016/j.mad.2009.12.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Старение Дев. 2010; 131:165–167. doi: 10.1016/j.mad.2009.12.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Ludlow A.T., Zimmerman J.B., Witkowski S., Hearn J.W., Hatfield B.D., Roth S.M. Взаимосвязь между уровнем физической активности, длиной теломер и активностью теломеразы. Мед. науч. Спортивное упражнение. 2008;40:1764–1771. doi: 10.1249/MSS.0b013e31817c92aa. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Путерман Э., Лин Дж., Блэкберн Э., О’Донован А., Адлер Н., Эпель Э. Сила упражнений: буферизация Влияние хронического стресса на длину теломер. ПЛОС ОДИН. 2010;5:e10837. doi: 10.1371/journal.pone.0010837. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Werner C., Furster T., Widmann T., Poss J., Roggia C., Hanhoun M., Scharhag J., Buchner N., Meyer T., Kindermann W., et al. Физические упражнения предотвращают клеточное старение циркулирующих лейкоцитов и стенки сосудов. Тираж. 2009;120:2438–2447. doi: 10. 1161/CIRCULATIONAHA.109.861005. [PubMed] [CrossRef] [Google Scholar]
1161/CIRCULATIONAHA.109.861005. [PubMed] [CrossRef] [Google Scholar]
72. Санфт Т., Усискин И., Харриган М., Картмел Б., Лу Л., Ли Ф.Ю., Чжоу Ю., Чагпар А., Ферруччи Л.М., Пустаи Л. ., и другие. Рандомизированное контролируемое исследование снижения веса по сравнению с обычным уходом за длиной теломер у женщин с раком молочной железы: исследование образа жизни, физических упражнений и питания (LEAN). Рак молочной железы Res. Удовольствие. 2018 г.: 10.1007/s10549-018-4895-7. [PubMed] [CrossRef] [Google Scholar]
73. Chilton W.L., Marques F.Z., West J., Kannourakis G., Berzins S.P., O’Brien B.J., Charchar F.J. Сильные физические нагрузки приводят к регуляции связанных с теломерами генов и микроРНК. экспрессия в иммунных клетках. ПЛОС ОДИН. 2014;9:e92088. doi: 10.1371/journal.pone.0092088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Li B., Oestreich S., de Lange T. Идентификация Rap1 человека: значение для эволюции теломер. Клетка. 2000; 101:471–483. дои: 10.1016/S0092-8674(00)80858-2. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1016/S0092-8674(00)80858-2. [PubMed] [CrossRef] [Google Scholar]
75. Sfeir A., Kabir S., van Overbeek M., Celli G.B., de Lange T. Потеря Rap1 вызывает рекомбинацию теломер в отсутствие NHEJ или сигнала повреждения ДНК. . Наука. 2010; 327:1657–1661. doi: 10.1126/science.1185100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. О’Коннор М.С., Сафари А., Лю Д., Цинь Дж., Сунъян З. Белковый комплекс Rap1 человека и модуляция длины теломер. Дж. Биол. хим. 2004; 279:28585–28591. doi: 10.1074/jbc.M312913200. [PubMed] [CrossRef] [Google Scholar]
77. Martinez P., Blasco M.A. Теломерная и внетеломерная роль теломеразы и белков, связывающих теломеры. Нац. Преподобный Рак. 2011; 11: 161–176. doi: 10.1038/nrc3025. [PubMed] [CrossRef] [Google Scholar]
78. Клаки Т.Г., Ньето Н.К., Родони Б.М., Траустадоттир Т. Предварительные доказательства того, что возраст и пол влияют на экспрессию hTERT, вызванную физической нагрузкой. Эксп. Геронтол. 2017;96:7–11. doi: 10.1016/j.exger.2017.06.003. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/j.exger.2017.06.003. [PubMed] [CrossRef] [Академия Google]
79. Zietzer A., Buschmann E.E., Janke D., Li L., Brix M., Meyborg H., Stawowy P., Jungk C., Buschmann I., Hillmeister P. Острые физические нагрузки и длительные индивидуальные Терапия скорости сдвига повышает активность теломеразы в мононуклеарных клетках периферической крови человека. Акта Физиол. 2017; 220:251–262. doi: 10.1111/apha.12820. [PubMed] [CrossRef] [Google Scholar]
80. Путерман Э., Вайс Дж., Лин Дж., Шилф С., Слашер А.Л., Йохансен К.Л., Эпель Э.С. Аэробные упражнения удлиняют теломеры и снижают стресс у членов семьи, осуществляющих уход: рандомизированное контролируемое исследование — Премия Курта Рихтера, 2018 г. Психонейроэндокринология. 2018;98: 245–252. doi: 10.1016/j.psyneuen.2018.08.002. [PubMed] [CrossRef] [Google Scholar]
81. Саллам Н., Лахер И. Упражнения модулируют окислительный стресс и воспаление при старении и сердечно-сосудистых заболеваниях. Оксид. Мед. Клетка. Лонгев. 2016;2016:7239639. doi: 10.1155/2016/7239639. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Лонгев. 2016;2016:7239639. doi: 10.1155/2016/7239639. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Rosado-Perez J., Mendoza-Nunez V.M. Взаимосвязь между аэробной емкостью с окислительным стрессом и биомаркерами воспаления в крови пожилого городского населения Мексики. Доза-ответ. 2018;16:1559325818773000. doi: 10.1177/1559325818773000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Oeseburg H., de Boer R.A., van Gilst WH, van der Harst P. Биология теломер при здоровом старении и заболеваниях. Арка Пфлюгера. 2010; 459: 259–268. doi: 10.1007/s00424-009-0728-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
84. Kurz D.J., Decary S., Hong Y., Trivier E., Akhmedov A., Erusalimsky J.D. Хронический окислительный стресс нарушает целостность теломер и ускоряет начало старения эндотелиальных клеток человека. Дж. Клеточные науки. 2004;117:2417–2426. doi: 10.1242/jcs.01097. [PubMed] [CrossRef] [Google Scholar]
85. Richter T. , von Zglinicki T. Непрерывная корреляция между окислительным стрессом и укорочением теломер в фибробластах. Эксп. Геронтол. 2007;42:1039–1042. doi: 10.1016/j.exger.2007.08.005. [PubMed] [CrossRef] [Google Scholar]
, von Zglinicki T. Непрерывная корреляция между окислительным стрессом и укорочением теломер в фибробластах. Эксп. Геронтол. 2007;42:1039–1042. doi: 10.1016/j.exger.2007.08.005. [PubMed] [CrossRef] [Google Scholar]
86. Powers S.K., Ji L.L., Leeuwenburgh C. Изменения антиоксидантной способности скелетных мышц, вызванные тренировками: краткий обзор. Мед. науч. Спортивное упражнение. 1999; 31: 987–997. doi: 10.1097/00005768-199907000-00011. [PubMed] [CrossRef] [Академия Google]
87. Радак З., Чанг Х.Ю., Гото С. Системная адаптация к окислительной нагрузке, вызванной регулярными физическими упражнениями. Свободный Радик. биол. Мед. 2008; 44: 153–159. doi: 10.1016/j.freeradbiomed.2007.01.029. [PubMed] [CrossRef] [Google Scholar]
88. Пик Дж.М., Маркворт Дж.Ф., Носака К., Раастад Т., Уодли Г.Д., Коффи В.Г. Модулирование гормезиса, вызванного физическими упражнениями: меньше значит больше? Дж. Заявл. Физиол. 2015; 119: 172–189. doi: 10.1152/japplphysiol.01055.2014. [PubMed] [CrossRef] [Академия Google]
89. Мейер М., Пал Х.Л., Бауэрле П.А. Регуляция факторов транскрипции NF-каппа B и AP-1 посредством окислительно-восстановительных изменений. хим.-биол. Взаимодействовать. 1994; 91: 91–100. doi: 10.1016/0009-2797(94)
Мейер М., Пал Х.Л., Бауэрле П.А. Регуляция факторов транскрипции NF-каппа B и AP-1 посредством окислительно-восстановительных изменений. хим.-биол. Взаимодействовать. 1994; 91: 91–100. doi: 10.1016/0009-2797(94)
-9. [PubMed] [CrossRef] [Google Scholar]
90. Wu Z., Puigserver P., Andersson U., Zhang C., Adelmant G., Mootha V., Troy A., Cinti S., Lowell B., Scarpulla R.C. и соавт. Механизмы, контролирующие митохондриальный биогенез и дыхание через термогенный коактиватор PGC-1. Клетка. 1999; 98: 115–124. дои: 10.1016/S0092-8674(00)80611-Х. [PubMed] [CrossRef] [Google Scholar]
91. Ji L.L. Передача сигналов окислительно-восстановительного потенциала в скелетных мышцах: роль старения и упражнений. Доп. Физиол. Образовательный 2015; 39: 352–359. doi: 10.1152/advan.00106.2014. [PubMed] [CrossRef] [Google Scholar]
92. Osthus I.B., Sgura A., Berardinelli F., Alsnes I.V., Bronstad E., Rehn T., Stobakk P.K., Hatle H., Wisloff U., Nauman J. Длина теломер и длительные упражнения на выносливость: влияют ли тренировки на биологический возраст? Пилотное исследование. ПЛОС ОДИН. 2012;7:e52769. doi: 10.1371/journal.pone.0052769. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2012;7:e52769. doi: 10.1371/journal.pone.0052769. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
93. Аззалин С.М., Рейхенбах П., Хориаули Л., Джулотто Э., Лингнер Дж. Теломерный повтор, содержащий РНК и факторы надзора за РНК на концах хромосом млекопитающих. Наука. 2007; 318: 798–801. doi: 10.1126/science.1147182. [PubMed] [CrossRef] [Google Scholar]
94. Schoeftner S., Blasco M.A. Регулируемая в процессе развития транскрипция теломер млекопитающих с помощью ДНК-зависимой РНК-полимеразы II. Нац. Клеточная биол. 2008; 10: 228–236. дои: 10.1038/ncb1685. [PubMed] [CrossRef] [Академия Google]
95. Риппе К., Люк Б. ТЕРРА и состояние теломер. Нац. Структура Мол. биол. 2015; 22: 853–858. doi: 10.1038/nsmb.3078. [PubMed] [CrossRef] [Google Scholar]
Ученые нашли способ увеличить длину теломер человека
By Honor Whiteman, 26 января 2015 г. со старением и болезнями. Теперь исследователи из Медицинской школы Стэнфордского университета, Калифорния, говорят, что они нашли способ удлинить эти теломеры, что потенциально открывает двери для новых методов лечения многих возрастных и генетических состояний.
Поделиться на PinterestИсследователи говорят, что нашли способ удлинить теломеры человека — защитные колпачки на концах хромосом.
Исследовательская группа, возглавляемая Джоном Рамунасом, доктором философии, и Эдуардом Якубовым, доктором философии, публикует свои выводы в The FASEB Journal .
Хромосомы представляют собой нитевидные структуры, расположенные на концах нитей ДНК, которые содержат всю нашу генетическую информацию. Теломеры защищают наши хромосомы от повреждения во время клеточного деления.
Однако теломеры укорачиваются с каждым клеточным делением и могут достичь точки, когда они больше не могут защищать хромосомы, оставляя их открытыми для разрушения. Это приводит к старению и развитию болезней.
Изучение человеческих клеток в лаборатории важно для поиска новых способов лечения таких заболеваний, но команда говорит, что укорочение теломер затрудняет это; это позволяет исследователям контролировать клетки только в течение нескольких делений, прежде чем они умрут.
Но теперь Рамунас, Якубов и их команда говорят, что нашли способ увеличить длину теломер, что может увеличить количество человеческих клеток, доступных для изучения.
Чтобы увеличить длину теломер, команда использовала модифицированный тип рибонуклеиновой кислоты (РНК), который содержал кодирующую последовательность TERT.
TERT является активным компонентом теломеразы – фермента, экспрессируемого стволовыми клетками, который поддерживает здоровье теломер при их передаче следующему поколению. Хотя стволовые клетки экспрессируют TERT, исследователи отмечают, что большинство других типов клеток этого не делают.
В своем исследовании исследователи объясняют, что введение всего лишь трех применений модифицированной РНК (называемой модифицированной мРНК TERT) в клетки человека в течение нескольких дней увеличило длину теломер до 10%. Ученые отмечают, что молодые люди обладают теломерами длиной около 8000-10000 нуклеотидов, но модифицированная РНК, кодирующая TERT, увеличила длину теломер примерно на 1000 нуклеотидов.
Более того, исследователи говорят, что клетки кожи человека, обработанные модифицированной мРНК TERT, делились примерно в 28 раз больше, чем те, которые оставались необработанными, в то время как обработанные мышечные клетки человека делились примерно в три раза больше.
Рамунас говорит, что команда была приятно удивлена, обнаружив, что модифицированная мРНК TERT эффективно увеличивает длину теломер.
«Предыдущие попытки доставки TERT, кодирующего мРНК, вызывали иммунный ответ против теломеразы, что могло быть вредным», — добавляет он.
«Напротив, наша методика неиммуногенна. Существующие временные методы удлинения теломер действуют медленно, тогда как наш метод действует всего за несколько дней, чтобы обратить вспять укорочение теломер, которое происходит в течение более десяти лет нормального старения. Это говорит о том, что лечение с использованием нашего метода может быть коротким и нечастым».
Исследователи говорят, что их новая техника может привести к новым методам лечения возрастных заболеваний и генетических состояний, связанных с укорочением теломер, таких как мышечная дистрофия Дюшенна — наследственное нервно-мышечное заболевание, по оценкам, затрагивающее 1 из 3600 младенцев мужского пола в США.
