Содержание
Хромосомные хвосты как защита от рака
Короткие теломеры на концах хромосом не дают клетке долго жить, тем самым защищая её от злокачественного превращения.
Хромосомные концы-хвосты называются теломерами, и про них мы слышим очень часто. Теломеры – один из индикаторов клеточного старения: чем клетка старше, тем её теломеры короче. Дело в том, что когда клетка делится, она удваивает каждую свою хромосому, чтобы каждой из двух дочерних клеток досталось по копии. Но белки, которые занимаются репликацией (удвоением ДНК) устроены так, что они не могут дочитать и докопировать нить ДНК до конца. То есть на конце каждой хромосомной ДНК есть кусок, который не копируется в новую ДНК, так что новая ДНК оказывается чуть короче, чем старая.
Человеческие хромосомы с теломерными участками на концах. (Фото: NIH Image Gallery / Flickr.com)
Открыть в полном размере
‹
›
Если бы на конце хромосомы сидели гены, кодирующие белки, или ещё какие-нибудь важные ДНК-последовательности, то случилась бы беда: в укороченной хромосоме их бы не было совсем, или же они были бы повреждены. Но на концах ДНК сидят бессмысленные теломеры, которые ничего не кодируют – они просто помогают клеткам делиться без вреда для генома. Однако теломеры не бесконечны. Когда они укорачиваются до определённого размера, клетка делиться уже не может. Иными словами, старая клетка – это та, которая исчерпала лимит делений. Дальше ей остаётся только умереть.
Но на концах ДНК сидят бессмысленные теломеры, которые ничего не кодируют – они просто помогают клеткам делиться без вреда для генома. Однако теломеры не бесконечны. Когда они укорачиваются до определённого размера, клетка делиться уже не может. Иными словами, старая клетка – это та, которая исчерпала лимит делений. Дальше ей остаётся только умереть.
Но ведь есть клетки, которые могут делиться очень и очень долго – стволовые клетки. У них работает фермент теломераза, которая удлиняет теломеры. Стволовые клетки постепенно превращаются в специализированные клетки (клетки кожи, клетки мышц, печени и т. д.), и вот у специализированных клеток теломераза уже не работает. Если специализированная клетка умерла, её можно заменить только с помощь стволовых клеток. Но почему бы теломеразе не работать и в обычных клетках, которые могли бы дальше жить и делиться?
Теломераза работает не только в стволовых клетках. У нас есть ещё одни клетки, способные к бесконечному делению – раковые.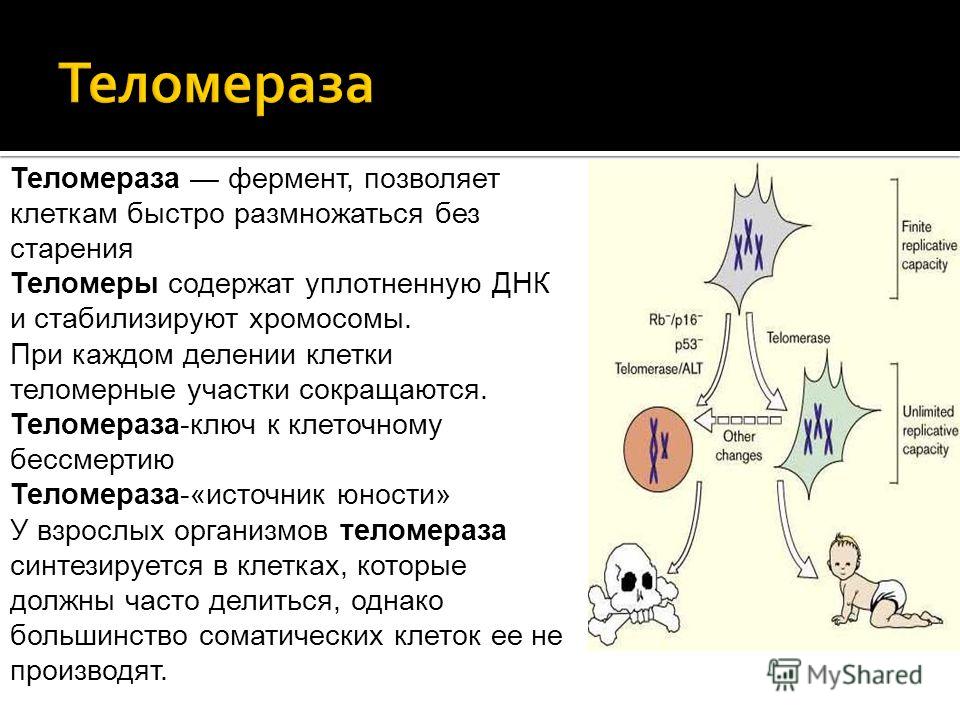 В недавней статье в eLife сотрудники Рокфеллеровского университета и Университета Неймегена пишут, что теломеры – это предохранитель от злокачественного перерождения. Дело в том, что пока клетка живёт и делится, в её ДНК накапливаются разнообразные мутации. В клетке есть специальные белки, которые их исправляют, но какие-то мутации всё же остаются. И постепенно их накапливается столько, что они уже ощутимо влияют на то, как клетка выполняет свою работу. Состарившаяся клетка уже не столько приносит пользу, сколько вредит. Более того, среди оставшихся мутаций часто оказываются такие, которые делают клетку злокачественной. Теперь она уже точно не выполняет никакой полезной работы и даже не обращает внимания на окружающие нормальные клетки – теперь она просто делится, формируя опухоль.
В недавней статье в eLife сотрудники Рокфеллеровского университета и Университета Неймегена пишут, что теломеры – это предохранитель от злокачественного перерождения. Дело в том, что пока клетка живёт и делится, в её ДНК накапливаются разнообразные мутации. В клетке есть специальные белки, которые их исправляют, но какие-то мутации всё же остаются. И постепенно их накапливается столько, что они уже ощутимо влияют на то, как клетка выполняет свою работу. Состарившаяся клетка уже не столько приносит пользу, сколько вредит. Более того, среди оставшихся мутаций часто оказываются такие, которые делают клетку злокачественной. Теперь она уже точно не выполняет никакой полезной работы и даже не обращает внимания на окружающие нормальные клетки – теперь она просто делится, формируя опухоль.
И вот тут очень кстати оказываются теломеры. Пусть у клетки сбились собственные внутриклеточные настройки, пусть теперь её внутренние сигналы понуждают её безостановочно делиться, но делиться она сможет до тех пор, пока теломеры не укоротятся до положенного предела.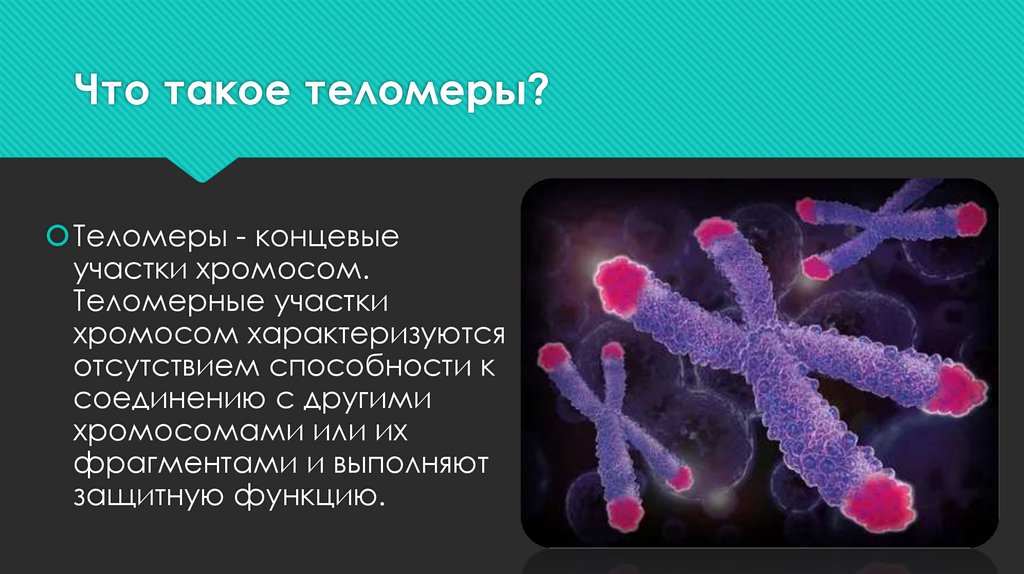 Когда он укоротятся, в клетке включится программа самоуничтожения.
Когда он укоротятся, в клетке включится программа самоуничтожения.
Тем не менее, злокачественные опухоли всё равно появляются. Однако, как утверждают авторы работы, опухоль может рассчитывать на успех только в том случае, если она сможет активировать теломеразу. Действительно, большинство злокачественных образований, которые обнаруживаются при клиническом обследовании, существуют с включённой теломеразой. Чтобы её включить, нужны опять же мутации. Вероятность появления мутаций тем больше, чем дольше клетка живёт. Представим, что теломеры у клетки изначально оказались длиннее обычного. Тогда она проживёт больше, у неё с большей вероятностью появится мутация в гене теломеразы, которая включится и начнёт наращивать теломеры, играя в пользу рака.
Теломераза существует не сама по себе, её активность зависит от других белков. В своей статье исследователи говорят об одном таком белке под названием TIN2. Сравнительно давно известно, что мутации в TIN2 как бы снимают предохранитель с теломеразы, которая начинает активно удлинять хромосомные хвосты.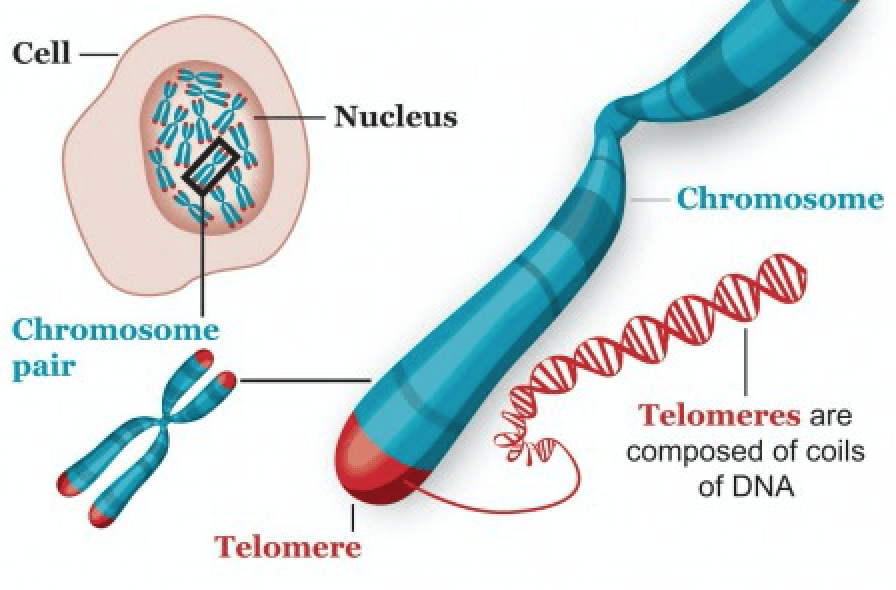 На этот раз удалось показать, что от TIN2 зависит начальная длина теломер, с которой клетка входит, так сказать, в зрелую жизнь.
На этот раз удалось показать, что от TIN2 зависит начальная длина теломер, с которой клетка входит, так сказать, в зрелую жизнь.
Авторы работы проанализировали гены нескольких семей, предрасположенных к онкозаболеваниям. У них удалось выявить характерные мутации в гене TIN2, переходящие из поколения в поколение. У подопытных клеток, которым вводили эту мутацию, теломеры оказывались намного длиннее, чем должны быть. Притом никаких других проблем изначально с ДНК не возникало, геном был стабилен, теломераза оставалась отключённой. Единственной аномалией оказывались слишком длинные теломеры, которые давали возможность прожить дольше.
Получается следующая последовательность событий: из-за мутации в белке TIN2 он перестаёт должным образом контролировать теломеразу, которая на ранних этапах развития награждает хромосомы слишком длинными хвостами. Затем теломераза засыпает, а клетки живут и работают, время от времени делясь и накапливая мутации (которые, кстати говоря, возникают и при удвоении ДНК). Из-за увеличенного срока жизни в клетках появляется больше мутаций, в том числе и злокачественных, и у этих мутаций больше шансов окончательно превратить клетку в раковую (в частности, они с большей вероятностью разбудят теломеразу и окончательно решат проблему с укорачивающимися теломерами).
Из-за увеличенного срока жизни в клетках появляется больше мутаций, в том числе и злокачественных, и у этих мутаций больше шансов окончательно превратить клетку в раковую (в частности, они с большей вероятностью разбудят теломеразу и окончательно решат проблему с укорачивающимися теломерами).
Получается, что короткие теломеры служат предохранителями от онкозаболеваний. Будь хромосомные концы подлиннее, рак был бы намного более распространён и, вероятно, был бы ещё более разнообразен. Впрочем, хотя гипотеза о теломерной защите от рака обсуждается давно, далеко не все с ней согласны. Хотя эта работа предлагает дополнительные (пусть и косвенные) аргументы в её пользу, споры среди специалистов об эволюционном значении теломер вряд ли стихнут так уж скоро.
Ученые выяснили, почему оксиданты сокращают жизнь
https://ria.ru/20161107/1480834586.html
Ученые выяснили, почему оксиданты сокращают жизнь
Ученые выяснили, почему оксиданты сокращают жизнь — РИА Новости, 07.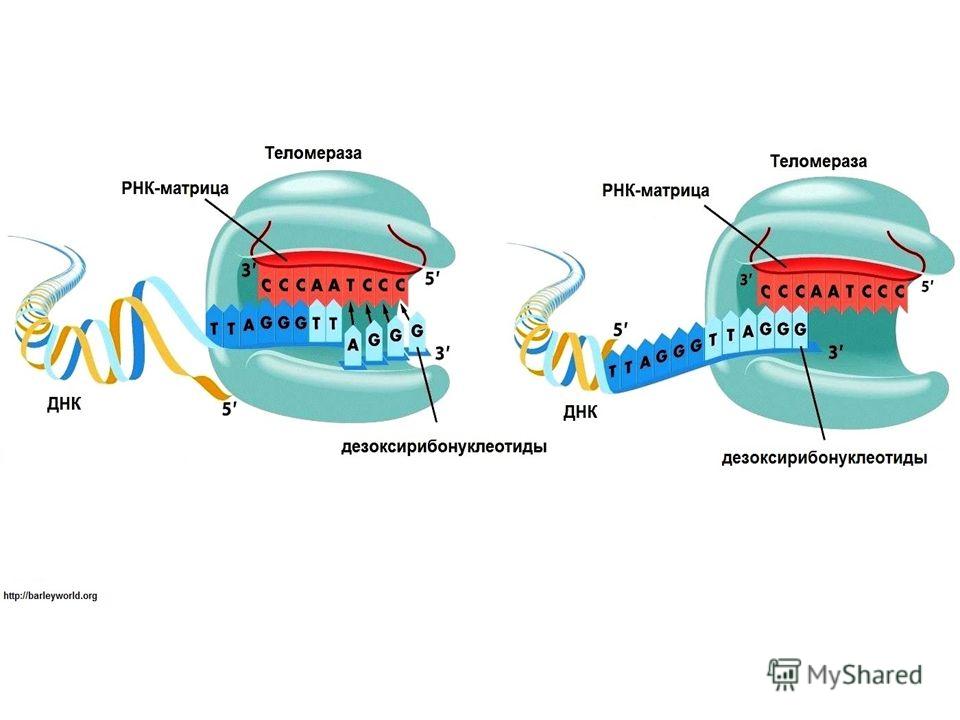 11.2016
11.2016
Ученые выяснили, почему оксиданты сокращают жизнь
Оксиданты ускоряют старение клеток нашего тела по той причине, что они повреждают «стройблоки», из которых собираются концевые участки хромосом при следующем делении клетки или при починке мутаций.
2016-11-07T19:21
2016-11-07T19:21
2016-11-07T19:21
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/141059/71/1410597161_0:191:4201:2554_1920x0_80_0_0_48c22e5220b4e110e866b8539b13ebc2.jpg
сша
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2016
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.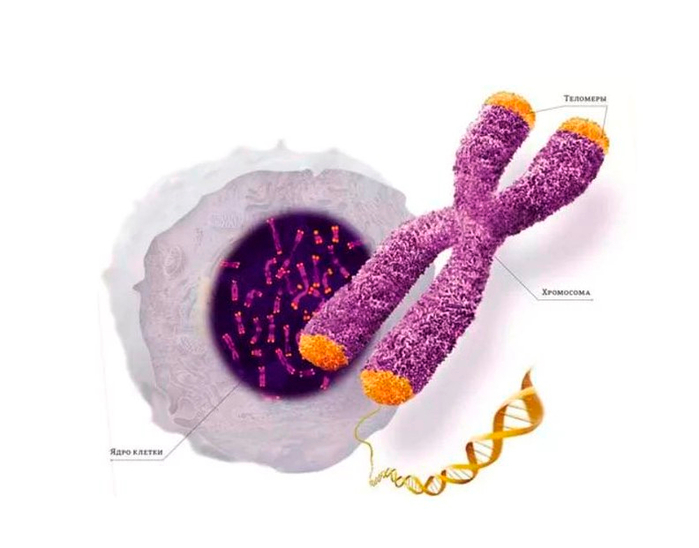 ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/141059/71/1410597161_100:0:3833:2800_1920x0_80_0_0_eefb0dc3366637ddce77a62f0826de4c.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, сша, долголетие, генетика
Открытия — РИА Наука, Наука, США, долголетие, генетика
МОСКВА, 7 ноя – РИА Новости. Оксиданты ускоряют старение клеток нашего тела по той причине, что они повреждают «стройблоки», из которых собираются концевые участки хромосом при следующем делении клетки или при починке мутаций, говорится в статье, опубликованной в журнале Nature Structural & Molecular Biology.
Оксиданты ускоряют старение клеток нашего тела по той причине, что они повреждают «стройблоки», из которых собираются концевые участки хромосом при следующем делении клетки или при починке мутаций, говорится в статье, опубликованной в журнале Nature Structural & Molecular Biology.
«Эти данные помогут нам выработать новые терапии для защиты теломер в здоровых клетках и позволят нам бороться с последствиями развития воспалений и старения. С другой стороны, этот же самый механизм можно использовать для того, чтобы укорачивать теломеры в раковых клетках и заставить их прекратить деление», — заявила Патрисия Опреско (Patricia Opresko) из университета Питтсбурга (США).
Теломеры — это концевые участки хромосом, находящихся в ядре каждой клетки человеческого организма. Теломеры защищают ДНК от повреждений. При каждом делении клетки они становятся короче, когда их длины оказывается недостаточно для нового деления, клетка погибает.
Относительно недавно ученые обнаружили, что длина теломер и их состояние могут меняться не только с возрастом, но и в результате различных процессов в организме, связанных с депрессией, бедностью и стрессом. В частности, большое количество оксидантов и других агрессивных молекул в клетках ведет к аномально быстрому сокращению в длине теломер, и, соответственно, к их ускоренному старению.
В частности, большое количество оксидантов и других агрессивных молекул в клетках ведет к аномально быстрому сокращению в длине теломер, и, соответственно, к их ускоренному старению.
4 октября 2016, 11:04
Ученые: тяготы в детстве сокращают жизнь на клеточном уровнеЛишения и тяжелые испытания в детстве искусственно старят клетки человека, сокращая длину защитных участков на концах хромосом, оберегающих ДНК от повреждений.
Опреско и ее коллеги выяснили, почему это происходит, наблюдая за тем, что происходит в культурах человеческих клеток, чьи теломеры они повреждали при помощи окислителей. К большому удивлению ученых, подобная процедура приводила не к сокращению длины концевых участков хромосом, а к их удлинению и включению ферментов, производящих починку теломер.
Удивленные этим фактом, ученые начали изучать этот процесс в «пошаговом» режиме, пытаясь понять, почему в реальной жизни молекулы-окислители действуют на теломеры обратным образом. Оказалось, что Опреско и ее коллеги искали повреждения не там, где они на самом деле возникали.
Оказалось, что Опреско и ее коллеги искали повреждения не там, где они на самом деле возникали.
Как выяснили ученые, теломеры укорачиваются при клеточном стрессе и большом числе окислителей по той причине, что эти агрессивные молекулы повреждают «стройблоки», из которых собираются теломеры – короткие цепочки из шести «букв»-нуклеотидов, которые фермент-теломераза присоединяет к концам хромосомы при ее копировании.
Если хотя бы одна буква в одном таком «стройблоке» будет повреждена, теломераза присоединит ее к собираемой нити ДНК, после чего фермент «заклинит» и он больше не сможет наращивать концевые участки хромосом. Более того, появление «бракованного» элемента приведет к появлению мутаций, потенциально фатальных для клетки или заставляющих ее уйти на покой.
30 июля 2016, 08:30
Ученые выяснили, почему зарядка продлевает жизньФизические упражнения и высокий уровень активности в старости могут продлевать жизнь человека по той причине, что они активируют ген NRF1, защищающий концы молекул ДНК от повреждений.
Данный эффект, как показали опыты ученых, можно использовать для подавления раковых клеток – подавление фермента, удаляющего подобные поврежденные «стройблоки» до того, как они присоединяются к теломерам, резко замедлило рост раковых клеток, у которых теломеры были изначально короткими.
Сейчас ученые, как рассказывает Опреско, пытаются понять, можно ли добиться обратного, удлиняя теломеры путем их повреждения при помощи лазерных импульсов, которые будут трогать только сами концевые участки хромосом и не будут повреждать свободные «стройблоки». Если у них получится реализовать эту идею, то тогда у ученых появится инструмент для удлинения теломер и потенциального продления жизни без внесения потенциально опасных РНК-препаратов или ретровирусов в клетки человека.
Счетчик клеточного времени – аналитический портал ПОЛИТ.РУ
В октябре 2009 года в Стокгольме были объявлены имена лауреатов Нобелевской премии по физиологии и медицине: Элизабет Блэкбёрн, Кэрол Грейдер и Джек Шостак. Эти американские учёные удостоились самой престижной научной награды за «открытие того, как теломеры и фермент теломераза защищают хромосомы»: проведенные ими исследования позволили не только определить, чем обусловлена продолжительность жизни клеток, но и объяснить некоторые особенности их злокачественного перерождения, что, по мнению ученых, в будущем поможет создать эффективные лекарства от неизлечимых болезней. «Полит.ру» публикует статью кандидатов химических наук Марии Зверевой и Марии Рубцовой, в которой речь пойдет о том, что такое теломеры, из чего состоит теломераза, а также какова связь между ними и продолжительностью человеческой жизни. Материал опубликован в журнале «Наука и жизнь» (2010. № 1).
Эти американские учёные удостоились самой престижной научной награды за «открытие того, как теломеры и фермент теломераза защищают хромосомы»: проведенные ими исследования позволили не только определить, чем обусловлена продолжительность жизни клеток, но и объяснить некоторые особенности их злокачественного перерождения, что, по мнению ученых, в будущем поможет создать эффективные лекарства от неизлечимых болезней. «Полит.ру» публикует статью кандидатов химических наук Марии Зверевой и Марии Рубцовой, в которой речь пойдет о том, что такое теломеры, из чего состоит теломераза, а также какова связь между ними и продолжительностью человеческой жизни. Материал опубликован в журнале «Наука и жизнь» (2010. № 1).
ХРОМОСОМЫ НУЖДАЮТСЯ В ЗАЩИТЕ
Генетическая информация хранится в ядрах клеток в виде дезоксирибонуклеиновой кислоты (ДНК), которая плотно упакована в линейные хромосомы. В середине 1970-х годов Джек Шостак в своей лаборатории в Медицинской школе Гарварда провёл эксперимент. Он добавил в дрожжевые клетки фрагменты чужеродных молекул ДНК и обнаружил, что они не могут долго оставаться в клетке в исходном виде и встраиваются в хромосомы. Так выяснилось, что обломки хромосом нестабильны: они постоянно обмениваются участками с другими хромосомами, перестраиваются, в их нуклеотидных цепочках образуются разрывы, в то время как сами хромосомы остаются в неизменном виде. К счастью, клетки обладают функцией репарации — в них имеется система молекулярной «починки» случайных разрывов в хромосомных цепочках.
Он добавил в дрожжевые клетки фрагменты чужеродных молекул ДНК и обнаружил, что они не могут долго оставаться в клетке в исходном виде и встраиваются в хромосомы. Так выяснилось, что обломки хромосом нестабильны: они постоянно обмениваются участками с другими хромосомами, перестраиваются, в их нуклеотидных цепочках образуются разрывы, в то время как сами хромосомы остаются в неизменном виде. К счастью, клетки обладают функцией репарации — в них имеется система молекулярной «починки» случайных разрывов в хромосомных цепочках.
Джек Шостак
Всё же оставалось неясным, почему ДНК в составе хромосом стабильна, а обломки без концевых последовательностей подвержены перестройкам. Исследования Пауля Германа Мюллера (лауреат Нобелевской премии по физиологии и медицине 1946 года) и Барбары Мак-Клинток (лауреат Нобелевской премии по физиологии и медицине 1983 года) в начале 1940-х годов показали, что концевые участки защищают хромосомы от перестроек и разрывов. Мюллер назвал эти особые участки теломерами — от двух греческих слов: telos — конец и meros — участок. Но что представляют собой эти участки и какую функцию они выполняют в клетке, учёные тогда ещё не знали.
Но что представляют собой эти участки и какую функцию они выполняют в клетке, учёные тогда ещё не знали.
ТЕЛОМЕРЫ СТАБИЛИЗИРУЮТ ХРОМОСОМЫ
В 1975 году Элизабет Блэкбёрн в лаборатории Джозефа Гала в Йельском университете, изучая внехромосомные молекулы ДНК инфузории, обнаружила, что концевые участки этих молекул содержат тандемные повторяющиеся последовательности, состоящие из шести нуклеотидов: на каждом конце таких повторов было от 20 до 70.
Элизабет Блэкбёрн
В дальнейших экспериментах Блэкбёрн и Шостак добавили в дрожжи молекулы ДНК с присоединёнными к ним повторами из инфузории и обнаружили, что молекулы ДНК стали стабильнее. В 1982 году в совместной публикации они предположили, что эти повторяющиеся последовательности нуклеотидов и есть теломеры.
Их догадка подтвердилась. Теперь уже точно известно, что теломеры состоят из повторяющихся нуклеотидных участков и набора специальных белков, особым образом организующих эти участки в пространстве. Теломерные повторы — весьма консервативные последовательности, например, повторы всех позвоночных состоят из шести нуклеотидов — TTAGGG, повторы всех насекомых из пяти — TTAGG, повторы большинства растений из семи — TTTAGGG. Благодаря наличию в теломерах устойчивых повторов клеточная система репарации не путает теломерный участок со случайным разрывом. Таким путём обеспечивается стабильность хромосом: конец одной хромосомы не может соединиться с разрывом другой.
Теломерные повторы — весьма консервативные последовательности, например, повторы всех позвоночных состоят из шести нуклеотидов — TTAGGG, повторы всех насекомых из пяти — TTAGG, повторы большинства растений из семи — TTTAGGG. Благодаря наличию в теломерах устойчивых повторов клеточная система репарации не путает теломерный участок со случайным разрывом. Таким путём обеспечивается стабильность хромосом: конец одной хромосомы не может соединиться с разрывом другой.
ТЕЛОМЕРЫ ПОСТОЯННО УКОРАЧИВАЮТСЯ
Теломерные повторы не просто стабилизируют хромосомы, они выполняют ещё одну важную функцию. Как известно, воспроизведение генетического материала от поколения к поколению происходит за счёт удвоения молекул ДНК с помощью специального фермента (ДНК-полимеразы). Этот процесс называется репликацией. Проблему «концевой репликации» ещё в 1970-х годах независимо сформулировали Алексей Матвеевич Оловников и нобелевский лауреат Джеймс Уотсон. Она заключается в том, что ДНК-полимераза неспособна полностью скопировать концевые участки линейных молекул ДНК, она лишь наращивает уже имеющуюся полинуклеотидную нить.
Откуда же берётся начальный участок? Специальный фермент синтезирует небольшую РНК-«затравку». Её размер (<20 нуклеотидов) невелик по сравнению с размером всей цепи ДНК. Впоследствии РНК-«затравка» удаляется специальным ферментом, а образовавшаяся при этом брешь заделывается ДНК-полимеразой. Удаление крайних РНК-«затравок» приводит к тому, что «дочерние» молекулы ДНК оказываются короче «материнских». То есть теоретически при каждом цикле деления клеток должна происходить потеря генетической информации. Но так происходит далеко не во всех клеточных популяциях. Почему?
ТЕЛОМЕРАЗА НЕ ДАЁТ ТЕЛОМЕРАМ УКОРАЧИВАТЬСЯ
Чтобы клетки не растеряли при делении часть генетического материала, теломерные повторы обладают способностью восстанавливать свою длину. В этом и заключается суть процесса «концевой репликации». Но учёные не сразу поняли, каким образом наращиваются концевые последовательности. Было предложено несколько различных моделей. Российский учёный А. М. Оловников предположил существование специального фермента (теломеразы), наращивающего теломерные повторы и тем самым поддерживающего длину теломер постоянной.
Оловников предположил существование специального фермента (теломеразы), наращивающего теломерные повторы и тем самым поддерживающего длину теломер постоянной.
В середине 1980-х годов в лабораторию Блэкбёрн пришла работать Кэрол Грейдер, и именно она обнаружила, что в клеточных экстрактах инфузории происходит присоединение теломерных повторов к синтетической теломероподобной «затравке». Очевидно, в экстракте содержался какой-то белок, способствовавший наращиванию теломер. Так блестяще подтвердилась догадка Оловникова и был открыт фермент теломераза. Кроме того, Грейдер и Блэкбёрн определили, что в состав теломеразы входят белковая молекула, которая, собственно, осуществляет синтез теломер, и молекула РНК, служащая матрицей для их синтеза.
Кэрол Грейдер
БЕЗ ТЕЛОМЕРАЗЫ КЛЕТКА СТАРЕЕТ, А С ТЕЛОМЕРАЗОЙ — ПЕРЕРОЖДАЕТСЯ
Позднее в лаборатории Шостака обнаружили, что определённые мутации в некоторых генах дрожжей приводят к быстрому укорочению теломер после каждого цикла деления клеток, в результате чего хромосомы становятся нестабильными, а клетки переходят в состояние старения (сенессенса). Теперь мы знаем, что эти гены кодируют теломеразу. Полученные данные подтвердили ещё одну гипотезу А. М. Оловникова о том, что потеря длины теломерных повторов в каждом раунде репликации хромосом зависит от числа делений клетки.
Теперь мы знаем, что эти гены кодируют теломеразу. Полученные данные подтвердили ещё одну гипотезу А. М. Оловникова о том, что потеря длины теломерных повторов в каждом раунде репликации хромосом зависит от числа делений клетки.
Итак, теломераза решает проблему «концевой репликации»: синтезирует повторы и поддерживает длину теломер. В отсутствие теломеразы с каждым клеточным делением теломеры становятся короче и короче, и в какой-то момент теломерный комплекс разрушается, что служит сигналом к программируемой гибели клетки. То есть длина теломер определяет, какое количество делений клетка может совершить до своей естественной гибели.
На самом деле у разных клеток могут быть разные сроки жизни. В эмбриональных стволовых клеточных линиях теломераза очень активна, поэтому длина теломер поддерживается на постоянном уровне. Вот почему эмбриональные клетки — «вечно молодые» и способны к неограниченному размножению. В обычных стволовых клетках активность теломеразы ниже, поэтому укорачивание теломер скомпенсировано лишь отчасти. В соматических клетках теломераза вовсе не работает, поэтому теломеры укорачиваются с каждым клеточным циклом. Укорочение теломер приводит к достижению предела Хайфлика — к переходу клеток в состояние сенессенса. После этого наступает массовая клеточная смерть. Уцелевшие клетки перерождаются в раковые (как правило, в этом процессе задействована теломераза). Раковые клетки способны к неограниченному делению и поддержанию длины теломер.
В соматических клетках теломераза вовсе не работает, поэтому теломеры укорачиваются с каждым клеточным циклом. Укорочение теломер приводит к достижению предела Хайфлика — к переходу клеток в состояние сенессенса. После этого наступает массовая клеточная смерть. Уцелевшие клетки перерождаются в раковые (как правило, в этом процессе задействована теломераза). Раковые клетки способны к неограниченному делению и поддержанию длины теломер.
Наличие теломеразной активности в тех соматических клетках, где она обычно не проявляется, может быть маркёром злокачественной опухоли и индикатором неблагоприятного прогноза. Так, если активность теломеразы появляется в самом начале лимфогранулематоза, то можно говорить об онкологии. При раке шейки матки теломераза активна уже на первой стадии.
Мутации в генах, кодирующих компоненты теломеразы или других белков, участвующих в поддержании длины теломер, являются причиной наследственной гипопластической анемии (нарушения кроветворения, связанные с истощением костного мозга) и врождённого Х-сцеплённого дискератоза (тяжёлое наследственное заболевание, сопровождающееся умственной отсталостью, глухотой, неправильным развитием слёзных каналов, дистрофией ногтей, различными дефектами кожи, развитием опухолей, нарушениями иммунитета и др. ).
).
ЗАЧЕМ ИЗУЧАТЬ ТЕЛОМЕРЫ И ТЕЛОМЕРАЗУ
Сейчас многие учёные заняты поиском взаимосвязи между активностью теломеразы и старением. Тут необходимо осознать, что длина теломер может контролировать продолжительность жизни клеток, но не всего организма. Старение как биологическое явление — более сложный многофакторный процесс. Гораздо более важна взаимосвязь между активностью теломеразы и риском развития раковых заболеваний. Учёные ищут вещества, влияющие на активность теломеразы и на структуру теломер, с целью создания новых противоопухолевых лекарственных препаратов.
Вот мы и пришли к заключению, что «открытие того, как теломеры и фермент теломераза защищают хромосомы» — это, безусловно, великое достижение современной науки, позволяющее понять, как генетическая информация передаётся от материнской клетки к дочерней без потерь, чем определяется продолжительность жизни клеток, а также некоторые особенности их злокачественного перерождения. Обретённые знания помогут в будущем создать лекарственные препараты, избавляющие людей от неизлечимых болезней. Это действительно выдающееся научное открытие. Но не стоит забывать о выдающихся гипотезах русского учёного А. М. Оловникова, которые подтвердились в работах нынешних нобелевских лауреатов.
Это действительно выдающееся научное открытие. Но не стоит забывать о выдающихся гипотезах русского учёного А. М. Оловникова, которые подтвердились в работах нынешних нобелевских лауреатов.
Детальное описание иллюстраций:
Теломераза активна не во всех клеточных популяциях. Максимальная активность наблюдается в «вечно молодых» эмбриональных клетках. В стволовых клетках теломераза работает не в полную силу. В большинстве соматических клеток теломераза «молчит», поэтому теломеры постоянно укорачиваются, что приводит к программируемой гибели клеточной популяции. При злокачественной трансформации теломераза активируется и клетки раковой опухоли начинают неконтролируемо делиться.
Физическая активность и питание: две многообещающие стратегии поддержания теломер?
1. Организация Объединенных Наций . Старение населения мира. Отдел народонаселения по экономическим и социальным вопросам; Нью-Йорк, штат Нью-Йорк, США: 2009. [Google Scholar]
2. Старение населения и устойчивое развитие. [(по состоянию на 8 августа 2018 г.)]; Доступно в Интернете: http://www.un.org/en/development/desa/population/publications/pdf/popfacts/PopFacts_2017-1.pdf
Старение населения и устойчивое развитие. [(по состоянию на 8 августа 2018 г.)]; Доступно в Интернете: http://www.un.org/en/development/desa/population/publications/pdf/popfacts/PopFacts_2017-1.pdf
3. Lopez-Otin C., Blasco M.A., Partridge L., Serrano М., Кремер Г. Признаки старения. Клетка. 2013;153:1194–1217. doi: 10.1016/j.cell.2013.05.039. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
4. Омодей Д., Фонтана Л. Ограничение калорий и профилактика возрастных хронических заболеваний. ФЭБС лат. 2011; 585:1537–1542. doi: 10.1016/j.febslet.2011.03.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Кеннеди Б.К., Бергер С.Л., Брюнет А., Кампизи Дж., Куэрво А.М., Эпель Э.С., Франчески К., Литгоу Г.Дж., Моримото Р.И., Пессин J.E. и др. Геронаука: связь старения с хроническими заболеваниями. Клетка. 2014;159: 709–713. doi: 10.1016/j.cell.2014.10.039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Kaeberlein M., Rabinovitch P. S., Martin G.M. Здоровое старение: лучшая профилактическая медицина. Наука. 2015; 350:1191–1193. doi: 10.1126/science.aad3267. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
S., Martin G.M. Здоровое старение: лучшая профилактическая медицина. Наука. 2015; 350:1191–1193. doi: 10.1126/science.aad3267. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Цанетаку И.П., Нзиетчуенг Р., Перреа Д.Н., Бенетос А. Теломеры и их роль в старении и долголетии. Курс. Васк. Фармакол. 2014; 12:726–734. дои: 10.2174/1570161111666131219112946. [PubMed] [CrossRef] [Google Scholar]
8. Меркен Э.М., Карбоно Б.А., Кржисик-Уокер С.М., де Кабо Р. О мышах и людях: преимущества ограничения калорий, упражнений и миметиков. Старение Res. 2012; 11:390–398. doi: 10.1016/j.arr.2011.11.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Sanders J.L., Newman A.B. Длина теломер в эпидемиологии: биомаркер старения, возрастных заболеваний, того и другого или ни того, ни другого? Эпидемиол. 2013; 35:112–131. дои: 10.1093/эпирев/mxs008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Arnoult N., Karlseder J. Сложные взаимодействия между реакцией на повреждение ДНК и теломерами млекопитающих. Нац. Структура Мол. биол. 2015;22:859–866. doi: 10.1038/nsmb.3092. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Нац. Структура Мол. биол. 2015;22:859–866. doi: 10.1038/nsmb.3092. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Karlseder J., Smogorzewska A., de Lange T. Старение, вызванное измененным состоянием теломер, а не потерей теломер. Наука. 2002; 295:2446–2449. doi: 10.1126/science.1069523. [PubMed] [CrossRef] [Академия Google]
12. Видачек Н.С., Наник Л., Равлич С., Сопта М., Герич М., Гайски Г., Гарай-Врховац В., Рубель И. Теломеры, питание и долголетие: можем ли мы действительно управлять своим старением? Дж. Геронтол. сер. биол. науч. Мед. науч. 2017;73:39–47. doi: 10.1093/gerona/glx082. [PubMed] [CrossRef] [Google Scholar]
13. Чилтон В., О’Брайен Б., Чарчар Ф. Теломеры, Старение и физические упражнения: виноваты по ассоциации? Междунар. Дж. Мол. науч. 2017;18:2573. doi: 10.3390/ijms18122573. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Arsenis N.C., You T., Ogawa E.F., Tinsley G.M., Zuo L. Физическая активность и длина теломер: влияние старения и потенциальные механизмы действия. Онкотаргет. 2017;8:45008–45019. doi: 10.18632/oncotarget.16726. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Онкотаргет. 2017;8:45008–45019. doi: 10.18632/oncotarget.16726. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Greider CW Telomeres. Курс. мнение Клеточная биол. 1991; 3: 444–451. doi: 10.1016/0955-0674(91)
-7. [PubMed] [CrossRef] [Google Scholar]
16. De Lange T. Shelterin: Белковый комплекс, формирующий и защищающий теломеры человека. Гены Дев. 2005;19: 21:00–21:10. doi: 10.1101/gad.1346005. [PubMed] [CrossRef] [Google Scholar]
17. Maciejowski J., de Lange T. Теломеры при раке: подавление опухоли и нестабильность генома. Нац. Преподобный Мол. Клеточная биол. 2017;18:175–186. doi: 10.1038/nrm.2016.171. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Чжан Ф., Ченг Д., Ван С., Чжу Дж. Специфическая регуляция гена теломеразы обратной транскриптазы у человека. Гены. 2016;7:30. doi: 10.3390/genes7070030. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Накамура Т.М., Чех Т.Р. Время обращения: происхождение теломеразы. Клетка. 1998; 92: 587–590. doi: 10.1016/S0092-8674(00)81123-X. [PubMed] [CrossRef] [Google Scholar]
Клетка. 1998; 92: 587–590. doi: 10.1016/S0092-8674(00)81123-X. [PubMed] [CrossRef] [Google Scholar]
20. Ю Г.Л., Брэдли Дж.Д., Аттарди Л.Д., Блэкберн Э.Х. In vivo изменение последовательностей теломер и старение, вызванное мутацией РНК теломеразы Tetrahymena. Природа. 1990; 344: 126–132. doi: 10.1038/344126a0. [PubMed] [CrossRef] [Google Scholar]
21. Harley CB, Futcher AB, Greider CW Теломеры укорачиваются при старении фибробластов человека. Природа. 1990;345:458–460. doi: 10.1038/345458a0. [PubMed] [CrossRef] [Google Scholar]
22. Мураки К., Нихан К., Хан Л., Мурнан Дж. П. Механизмы потери теломер и их последствия для хромосомной нестабильности. Фронт. Онкол. 2012;2:135. doi: 10.3389/fonc.2012.00135. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Von Zglinicki T. Окислительный стресс укорачивает теломеры. Тенденции биохим. науч. 2002; 27: 339–344. doi: 10.1016/S0968-0004(02)02110-2. [PubMed] [CrossRef] [Академия Google]
24. Авив А. , Чен В., Гарднер Дж. П., Кимура М., Бримакомб М., Цао Х., Шринивасан С. Р., Беренсон Г. С. Динамика теломер лейкоцитов: продольные данные среди молодых людей в исследовании сердца Богалусы. Являюсь. Дж. Эпидемиол. 2009; 169: 323–329. doi: 10.1093/aje/kwn338. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Чен В., Гарднер Дж. П., Кимура М., Бримакомб М., Цао Х., Шринивасан С. Р., Беренсон Г. С. Динамика теломер лейкоцитов: продольные данные среди молодых людей в исследовании сердца Богалусы. Являюсь. Дж. Эпидемиол. 2009; 169: 323–329. doi: 10.1093/aje/kwn338. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Eitan E., Hutchison E.R., Mattson M.P. Укорочение теломер при неврологических расстройствах: множество вопросов без ответов. Тренды Нейроси. 2014; 37: 256–263. doi: 10.1016/j.tins.2014.02.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Леунг К.В., Ларайя Б.А., Коулман-Фокс К., Буш Н.Р., Лин Дж., Блэкберн Э.Х., Адлер Н.Е., Эпель Э.С. Потребление сладких напитков и пищи и поддержание длины теломер лейкоцитов у беременных. Евро. Дж. Клин. Нутр. 2016;70:1086–1088. doi: 10.1038/ejcn.2016.93. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Lee JY, Jun NR, Yoon D., Shin C., Baik I. Связь между диетическими моделями в далеком прошлом и длиной теломер. Евро. Дж. Клин. Нутр. 2015;69: 1048–1052. doi: 10.1038/ejcn.2015.58. [PubMed] [CrossRef] [Google Scholar]
Евро. Дж. Клин. Нутр. 2015;69: 1048–1052. doi: 10.1038/ejcn.2015.58. [PubMed] [CrossRef] [Google Scholar]
28. Leung C.W., Laraia B.A., Needham B.L., Rehkopf D.H., Adler N.E., Lin J., Blackburn E.H., Epel E.S. Сода и старение клеток: связь между потреблением подслащенных сахаром напитков и длиной теломер лейкоцитов у здоровых взрослых по данным Национального исследования здоровья и питания. Являюсь. Дж. Общественное здравоохранение. 2014;104:2425–2431. doi: 10.2105/AJPH.2014.302151. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Боккарди В., Эспозито А., Риццо М.Р., Марфелла Р., Барбьери М., Паолиссо Г. Средиземноморская диета, поддержание теломер и состояние здоровья пожилых людей. ПЛОС ОДИН. 2013;8:e62781. doi: 10.1371/journal.pone.0062781. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Crous-Bou M., Fung TT, Prescott J., Julin B., Du M., Sun Q., Rexrode K.M., Hu F.B., De Vivo I. Средиземноморская диета и длина теломер в исследовании здоровья медсестер: популяционное когортное исследование. БМЖ. 2014;349:g6674. doi: 10.1136/bmj.g6674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
БМЖ. 2014;349:g6674. doi: 10.1136/bmj.g6674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Borresen E.C., Brown D.G., Harbison G., Taylor L., Fairbanks A., O’Malia J., Bazan M., Rao S. , Бейли С.М., Вдовик М. и др. Рандомизированное контролируемое исследование по увеличению потребления фасоли или рисовых отрубей у выживших после колоректального рака. Нутр. Рак. 2016;68:1269–1280. doi: 10.1080/01635581.2016.1224370. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Даниали Л., Бенетос А., Сассер Э., Карк Дж.Д., Лабат С., Кимура М., Десаи К., Граник М., Авив А. Теломеры укорачиваются с эквивалентной скоростью в соматических тканях взрослых. Нац. коммун. 2013;4:1597. doi: 10.1038/ncomms2602. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Liu J.J., Crous-Bou M., Giovannucci E., De Vivo I. Потребление кофе положительно связано с увеличением длины теломер лейкоцитов у медсестер. Исследование здоровья. Дж. Нутр. 2016; 146:1373–1378. doi: 10.3945/jn.116.230490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.3945/jn.116.230490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Паванелло С., Ходжа М., Диони Л., Бертацци П.А., Сненги Р., Налессо А., Феррара С.Д., Монтиши М., Баккарелли А. Укороченные теломеры у лиц, злоупотребляющих алкоголем. Междунар. Дж. Рак. 2011;129: 983–992. doi: 10.1002/ijc.25999. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
35. D’Mello M.J., Ross S.A., Briel M., Anand S.S., Gerstein H., Pare G. Связь между укороченной длиной теломер лейкоцитов и кардиометаболическими исходами : Систематический обзор и метаанализ. Цирк. Кардиовас. Жене. 2015; 8:82–90. doi: 10.1161/CIRCGENETICS.113.000485. [PubMed] [CrossRef] [Google Scholar]
36. Хаят И., Ахмад А., Масуд Т., Ахмед А., Башир С. Пищевая ценность и полезные свойства фасоли ( Phaseolus vulgaris L.): обзор. крит. Преподобный Food Sci. Нутр. 2014; 54: 580–592. doi: 10.1080/10408398.2011.596639. [PubMed] [CrossRef] [Google Scholar]
37. Tanaka H., Beam M. J., Caruana K. Наличие слияния теломер при спорадическом раке толстой кишки независимо от стадии заболевания, статуса мутации TP53/KRAS, средней длины теломер и теломеразы. Мероприятия. Неоплазия. 2014; 16:814–823. doi: 10.1016/j.neo.2014.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J., Caruana K. Наличие слияния теломер при спорадическом раке толстой кишки независимо от стадии заболевания, статуса мутации TP53/KRAS, средней длины теломер и теломеразы. Мероприятия. Неоплазия. 2014; 16:814–823. doi: 10.1016/j.neo.2014.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Willett W.C., Sacks F., Trichopoulou A., Drescher G., Ferro-Luzzi A., Helsing E., Trichopoulos D. Пирамида средиземноморской диеты: культурная модель здорового питания. Являюсь. Дж. Клин. Нутр. 1995; 61: 1402–1406 с. doi: 10.1093/ajcn/61.6.1402S. [PubMed] [CrossRef] [Google Scholar]
39. Гарсия-Кальсон С., Мартинес-Гонсалес М.А., Разкин С., Корелла Д., Салас-Сальвадо Дж., Мартинес Дж.А., Залба Г., Марти А. Pro12Ala полиморфизм гена PPARgamma2 взаимодействует со средиземноморской диетой для предотвращения укорочения теломер в рандомизированном исследовании PREDIMED-NAVARRA. Цирк. Кардиовас. Жене. 2015;8:91–99. doi: 10.1161/CIRCGENETICS.114.000635. [PubMed] [CrossRef] [Google Scholar]
40. McNaughton S.A., Bates C.J., Mishra G.D. Качество питания связано со смертностью от всех причин у взрослых в возрасте 65 лет и старше. Дж. Нутр. 2012; 142:320–325. doi: 10.3945/jn.111.148692. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
McNaughton S.A., Bates C.J., Mishra G.D. Качество питания связано со смертностью от всех причин у взрослых в возрасте 65 лет и старше. Дж. Нутр. 2012; 142:320–325. doi: 10.3945/jn.111.148692. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Milte C.M., Russell A.P., Ball K., Crawford D., Salmon J., McNaughton S.A. Качество питания и длина теломер у пожилых австралийских мужчин и женщин . Евро. Дж. Нутр. 2018; 57: 363–372. дои: 10.1007/s00394-016-1326-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Финкель Т. Метаболическая регуляция старения. Нац. Мед. 2015;21:1416–1423. doi: 10.1038/nm.3998. [PubMed] [CrossRef] [Google Scholar]
43. Sun L., Sadighi Akha A.A., Miller R.A., Harper J.M. Увеличение продолжительности жизни у мышей за счет ограничения пищи перед отъемом и ограничения метионина в среднем возрасте. Дж. Геронтол. сер. биол. науч. Мед. науч. 2009; 64: 711–722. doi: 10.1093/gerona/glp051. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Мэттисон Дж.А., Колман Р.Дж., Бизли Т.М., Эллисон Д.Б., Кемниц Дж.В., Рот Г.С., Ингрэм Д.К., Вайндрух Р., де Кабо Р., Андерсон Р.М. Ограничение калорийности улучшает здоровье и выживаемость макак-резусов. Нац. коммун. 2017;8:14063. doi: 10.1038/ncomms14063. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мэттисон Дж.А., Колман Р.Дж., Бизли Т.М., Эллисон Д.Б., Кемниц Дж.В., Рот Г.С., Ингрэм Д.К., Вайндрух Р., де Кабо Р., Андерсон Р.М. Ограничение калорийности улучшает здоровье и выживаемость макак-резусов. Нац. коммун. 2017;8:14063. doi: 10.1038/ncomms14063. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Сарасват К., Ризви С.И. Новые стратегии открытия лекарств против старения. Мнение эксперта. Препарат Дисков. 2017;12:955–966. doi: 10.1080/17460441.2017.1349750. [PubMed] [CrossRef] [Академия Google]
46. Уолш М.Е., Ши Ю., Ван Реммен Х. Влияние диетических ограничений на окислительный стресс у грызунов. Свободный Радик. биол. Мед. 2014;66:88–99. doi: 10.1016/j.freeradbiomed.2013.05.037. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Гарсия-Кальсон С., Залба Г., Руис-Канела М., Шиваппа Н., Хеберт Дж. Р., Мартинес Дж. А., Фито М., Гомес -Gracia E., Martinez-Gonzalez M.A., Marti A. Диетический воспалительный индекс и длина теломер у субъектов с высоким риском сердечно-сосудистых заболеваний из исследования PREDIMED-NAVARRA: поперечный и продольный анализы за 5 лет. Являюсь. Дж. Клин. Нутр. 2015;102:897–904. doi: 10.3945/ajcn.115.116863. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Клин. Нутр. 2015;102:897–904. doi: 10.3945/ajcn.115.116863. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
48. Oikawa S., Kawanishi S. Сайт-специфическое повреждение ДНК в последовательности GGG из-за окислительного стресса может ускорить укорочение теломер. ФЭБС лат. 1999; 453:365–368. doi: 10.1016/S0014-5793(99)00748-6. [PubMed] [CrossRef] [Google Scholar]
49. Ахмед В., Лингнер Дж. Влияние окислительного стресса на биологию теломер. Отличаться. Рез. биол. Дайверы. 2018;99:21–27. doi: 10.1016/j.diff.2017.12.002. [PubMed] [CrossRef] [Академия Google]
50. Авив А. Длина теломер лейкоцитов: Рассказ о теломерах продолжается. Являюсь. Дж. Клин. Нутр. 2009; 89: 1721–1722. doi: 10.3945/ajcn.2009.27807. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Thomas P., Wang YJ, Zhong JH, Kosaraju S., O’Callaghan NJ, Zhou XF, Fenech M. Полифенолы виноградных косточек и куркумин снижают События нестабильности генома в модели трансгенной мыши с болезнью Альцгеймера. Мутат. Рез. 2009; 661: 25–34. doi: 10.1016/j.mrfmmm.2008.10.016. [PubMed] [CrossRef] [Академия Google]
Мутат. Рез. 2009; 661: 25–34. doi: 10.1016/j.mrfmmm.2008.10.016. [PubMed] [CrossRef] [Академия Google]
52. Garcia-Calzon S., Moleres A., Martinez-Gonzalez M.A., Martinez J.A., Zalba G., Marti A. Общая антиоксидантная способность рациона связана с длиной теломер лейкоцитов у детей и подростков. клин. Нутр. 2015; 34: 694–699. doi: 10.1016/j.clnu.2014.07.015. [PubMed] [CrossRef] [Google Scholar]
53. Schwingshackl L., Hoffmann G. Средиземноморская диета, воспаление и функция эндотелия: систематический обзор и метаанализ интервенционных испытаний. Нутр. Метаб. Кардиовас. Дис. 2014;24:929–939. doi: 10.1016/j.numecd.2014.03.003. [PubMed] [CrossRef] [Google Scholar]
54. Марин С., Дельгадо-Листа Х., Рамирес Р., Карраседо Х., Кабальеро Х., Перес-Мартинес П., Гутьеррес-Марискаль Ф.М., Гарсия-Риос А., Дельгадо-Касадо Н., Круз-Тено С. и др. Средиземноморская диета снижает связанный со старением стресс в эндотелиальных клетках. Возраст. 2012; 34:1309–1316. doi: 10.1007/s11357-011-9305-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Beyne-Rauzy O., Recher C., Dastugue N., Demur C., Pottier G., Laurent G., Sabatier L., Mansat -Де Мас В. Фактор некроза опухоли альфа вызывает старение и хромосомную нестабильность в лейкемических клетках человека. Онкоген. 2004; 23:7507–7516. doi: 10.1038/sj.onc.1208024. [PubMed] [CrossRef] [Академия Google]
56. Кондо Т., Хиросе М., Кагеяма К. Роль окислительного стресса и окислительно-восстановительной регуляции при атеросклерозе. Дж. Атеросклера. Тромбоз. 2009; 16: 532–538. doi: 10.5551/jat.1255. [PubMed] [CrossRef] [Google Scholar]
57. Masi S., Nightingale C.M., Day I.N., Guthrie P., Rumley A., Lowe G.D., von Zglinicki T., D’Aiuto F., Taddei S., Клейн Н. и др. Воспалительные, а не сердечно-сосудистые факторы риска связаны с короткой длиной теломер лейкоцитов у подростков 13-16 лет. Артериосклероз. Тромбоз сосудов. биол. 2012;32:2029–2034. doi: 10.1161/ATVBAHA.112.250589. [PubMed] [CrossRef] [Google Scholar]
58. Гомес-Дельгадо Ф., Алькала-Диас Дж. Ф., Гарсия-Риос А., Дельгадо-Листа Дж., Ортис-Моралес А., Рангель-Зунига О., Тинахонес Ф.Дж., Гонсалес-Гуардиа Л., Малагон М.М., Беллидо-Муньос Э. и др. Полиморфизм гена TNF-альфа взаимодействует со средиземноморской диетой, влияя на метаболизм триглицеридов и статус воспаления у пациентов с метаболическим синдромом: из клинического исследования CORDIOPREV. Мол. Нутр. Еда Рез. 2014;58:1519–1527. doi: 10.1002/mnfr.201300723. [PubMed] [CrossRef] [Google Scholar]
Гомес-Дельгадо Ф., Алькала-Диас Дж. Ф., Гарсия-Риос А., Дельгадо-Листа Дж., Ортис-Моралес А., Рангель-Зунига О., Тинахонес Ф.Дж., Гонсалес-Гуардиа Л., Малагон М.М., Беллидо-Муньос Э. и др. Полиморфизм гена TNF-альфа взаимодействует со средиземноморской диетой, влияя на метаболизм триглицеридов и статус воспаления у пациентов с метаболическим синдромом: из клинического исследования CORDIOPREV. Мол. Нутр. Еда Рез. 2014;58:1519–1527. doi: 10.1002/mnfr.201300723. [PubMed] [CrossRef] [Google Scholar]
59. Денхэм Дж., О’Брайен Б.Дж., Чарчар Ф.Дж. Поддержание длины теломер и профилактика сердечно-метаболических заболеваний посредством физических упражнений. Спорт Мед. 2016;46:1213–1237. doi: 10.1007/s40279-016-0482-4. [PubMed] [CrossRef] [Google Scholar]
60. Loprinzi PD, Sng E. Физическая активность, специфичная для режима, и длина теломер лейкоцитов среди взрослых в США: влияние бега на клеточное старение. Пред. Мед. 2016;85:17–19. doi: 10.1016/j.ypmed.2016.01.002. [PubMed] [CrossRef] [Google Scholar]
61. Такер Л.А. Физическая активность и длина теломер у мужчин и женщин в США: исследование NHANES. Пред. Мед. 2017; 100:145–151. doi: 10.1016/j.ypmed.2017.04.027. [PubMed] [CrossRef] [Google Scholar]
Такер Л.А. Физическая активность и длина теломер у мужчин и женщин в США: исследование NHANES. Пред. Мед. 2017; 100:145–151. doi: 10.1016/j.ypmed.2017.04.027. [PubMed] [CrossRef] [Google Scholar]
62. Denham J., O’Brien BJ, Prestes P.R., Brown NJ, Charchar FJ Увеличение экспрессии генов, регулирующих теломеры, у спортсменов, занимающихся выносливостью, с длинными теломерами лейкоцитов. Дж. Заявл. Физиол. 2016; 120:148–158. doi: 10.1152/japplphysiol.00587.2015. [PubMed] [CrossRef] [Академия Google]
63. Rae D.E., Vignaud A., Butler-Browne GS, Thornell L.E., Sinclair-Smith C., Derman E.W., Lambert M.I., Collins M. Длина теломер скелетных мышц у здоровых, опытных бегунов на выносливость. Евро. Дж. Заявл. Физиол. 2010;109:323–330. doi: 10.1007/s00421-010-1353-6. [PubMed] [CrossRef] [Google Scholar]
64. Муньеса К.А., Верде З., Диас-Урена Г., Сантьяго К., Гутьеррес Ф., Диас Э., Гомес-Гальего Ф., Пареха-Галеано Х. , Соарес-Миранда Л., Люсия А. Длина теломер у элитных спортсменов. Междунар. Ж. Спортивная физиол. Выполнять. 2017;12:994–996. doi: 10.1123/ijspp.2016-0471. [PubMed] [CrossRef] [Google Scholar]
Междунар. Ж. Спортивная физиол. Выполнять. 2017;12:994–996. doi: 10.1123/ijspp.2016-0471. [PubMed] [CrossRef] [Google Scholar]
65. Denham J., Nelson C.P., O’Brien B.J., Nankervis S.A., Denniff M., Harvey J.T., Marques F.Z., Codd V., Zukowska-Szczechowska E., Samani Нью-Джерси и др. Более длинные теломеры лейкоцитов связаны с упражнениями на сверхвыносливость независимо от сердечно-сосудистых факторов риска. ПЛОС ОДИН. 2013;8:e69377. doi: 10.1371/journal.pone.0069377. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Диман А., Борос Дж., Пулен Ф., Родригес Дж., Пурнель М., Эпископу Х., Бертран Л., Франко М. , Deldicque L., Decottignies A. Ядерный респираторный фактор 1 и упражнения на выносливость способствуют транскрипции теломер человека. науч. Доп. 2016;2:e1600031. doi: 10.1126/sciadv.1600031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Черкас Л.Ф., Ханкин Дж.Л., Като Б.С., Ричардс Дж.Б., Гарднер Дж.П., Сурдулеску Г.Л., Кимура М. , Лу Х., Спектор Т.Д., Авив А. Связь между физической активностью в свободное время и длиной теломер лейкоцитов. Арка Стажер Мед. 2008; 168: 154–158. doi: 10.1001/archinternmed.2007.39. [PubMed] [CrossRef] [Google Scholar]
, Лу Х., Спектор Т.Д., Авив А. Связь между физической активностью в свободное время и длиной теломер лейкоцитов. Арка Стажер Мед. 2008; 168: 154–158. doi: 10.1001/archinternmed.2007.39. [PubMed] [CrossRef] [Google Scholar]
68. LaRocca T.J., Seals D.R., Pierce G.L. Длина теломер лейкоцитов сохраняется с возрастом у взрослых, тренируемых на выносливость, и связана с максимальной аэробной способностью. мех. Старение Дев. 2010; 131:165–167. doi: 10.1016/j.mad.2009.12.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Ludlow A.T., Zimmerman J.B., Witkowski S., Hearn J.W., Hatfield B.D., Roth S.M. Взаимосвязь между уровнем физической активности, длиной теломер и активностью теломеразы. Мед. науч. Спортивное упражнение. 2008;40:1764–1771. doi: 10.1249/MSS.0b013e31817c92aa. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Путерман Э., Лин Дж., Блэкберн Э., О’Донован А., Адлер Н., Эпель Э. Сила упражнений: буферизация Влияние хронического стресса на длину теломер. ПЛОС ОДИН. 2010;5:e10837. doi: 10.1371/journal.pone.0010837. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2010;5:e10837. doi: 10.1371/journal.pone.0010837. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Werner C., Furster T., Widmann T., Poss J., Roggia C., Hanhoun M., Scharhag J., Buchner N., Meyer T., Kindermann W., et al. Физические упражнения предотвращают клеточное старение циркулирующих лейкоцитов и стенки сосудов. Тираж. 2009;120:2438–2447. doi: 10.1161/CIRCULATIONAHA.109.861005. [PubMed] [CrossRef] [Google Scholar]
72. Санфт Т., Усискин И., Харриган М., Картмел Б., Лу Л., Ли Ф.Ю., Чжоу Ю., Чагпар А., Ферруччи Л.М., Пустаи Л. ., и другие. Рандомизированное контролируемое исследование снижения веса по сравнению с обычным уходом за длиной теломер у женщин с раком молочной железы: исследование образа жизни, физических упражнений и питания (LEAN). Рак молочной железы Res. Удовольствие. 2018 г.: 10.1007/s10549-018-4895-7. [PubMed] [CrossRef] [Google Scholar]
73. Chilton W.L., Marques F.Z., West J., Kannourakis G., Berzins S.P., O’Brien B. J., Charchar F.J. Сильные физические нагрузки приводят к регуляции связанных с теломерами генов и микроРНК. экспрессия в иммунных клетках. ПЛОС ОДИН. 2014;9:e92088. doi: 10.1371/journal.pone.0092088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J., Charchar F.J. Сильные физические нагрузки приводят к регуляции связанных с теломерами генов и микроРНК. экспрессия в иммунных клетках. ПЛОС ОДИН. 2014;9:e92088. doi: 10.1371/journal.pone.0092088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Li B., Oestreich S., de Lange T. Идентификация Rap1 человека: значение для эволюции теломер. Клетка. 2000; 101:471–483. дои: 10.1016/S0092-8674(00)80858-2. [PubMed] [CrossRef] [Google Scholar]
75. Sfeir A., Kabir S., van Overbeek M., Celli G.B., de Lange T. Потеря Rap1 вызывает рекомбинацию теломер в отсутствие NHEJ или сигнала повреждения ДНК. . Наука. 2010; 327:1657–1661. doi: 10.1126/science.1185100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. О’Коннор М.С., Сафари А., Лю Д., Цинь Дж., Сунъян З. Белковый комплекс Rap1 человека и модуляция длины теломер. Дж. Биол. хим. 2004; 279:28585–28591. doi: 10.1074/jbc.M312913200. [PubMed] [CrossRef] [Google Scholar]
77. Martinez P. , Blasco M.A. Теломерная и внетеломерная роль теломеразы и белков, связывающих теломеры. Нац. Преподобный Рак. 2011; 11: 161–176. doi: 10.1038/nrc3025. [PubMed] [CrossRef] [Google Scholar]
, Blasco M.A. Теломерная и внетеломерная роль теломеразы и белков, связывающих теломеры. Нац. Преподобный Рак. 2011; 11: 161–176. doi: 10.1038/nrc3025. [PubMed] [CrossRef] [Google Scholar]
78. Клаки Т.Г., Ньето Н.К., Родони Б.М., Траустадоттир Т. Предварительные доказательства того, что возраст и пол влияют на экспрессию hTERT, вызванную физической нагрузкой. Эксп. Геронтол. 2017;96:7–11. doi: 10.1016/j.exger.2017.06.003. [PubMed] [CrossRef] [Академия Google]
79. Zietzer A., Buschmann E.E., Janke D., Li L., Brix M., Meyborg H., Stawowy P., Jungk C., Buschmann I., Hillmeister P. Острые физические нагрузки и длительные индивидуальные Терапия скорости сдвига повышает активность теломеразы в мононуклеарных клетках периферической крови человека. Акта Физиол. 2017; 220:251–262. doi: 10.1111/apha.12820. [PubMed] [CrossRef] [Google Scholar]
80. Путерман Э., Вайс Дж., Лин Дж., Шилф С., Слашер А.Л., Йохансен К.Л., Эпель Э.С. Аэробные упражнения удлиняют теломеры и снижают стресс у членов семьи, осуществляющих уход: рандомизированное контролируемое исследование — Премия Курта Рихтера, 2018 г. Психонейроэндокринология. 2018;98: 245–252. doi: 10.1016/j.psyneuen.2018.08.002. [PubMed] [CrossRef] [Google Scholar]
Психонейроэндокринология. 2018;98: 245–252. doi: 10.1016/j.psyneuen.2018.08.002. [PubMed] [CrossRef] [Google Scholar]
81. Саллам Н., Лахер И. Упражнения модулируют окислительный стресс и воспаление при старении и сердечно-сосудистых заболеваниях. Оксид. Мед. Клетка. Лонгев. 2016;2016:7239639. doi: 10.1155/2016/7239639. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Rosado-Perez J., Mendoza-Nunez V.M. Взаимосвязь между аэробной емкостью с окислительным стрессом и биомаркерами воспаления в крови пожилого городского населения Мексики. Доза-ответ. 2018;16:1559325818773000. doi: 10.1177/1559325818773000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Oeseburg H., de Boer R.A., van Gilst WH, van der Harst P. Биология теломер при здоровом старении и заболеваниях. Арка Пфлюгера. 2010; 459: 259–268. doi: 10.1007/s00424-009-0728-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
84. Kurz D.J., Decary S., Hong Y., Trivier E. , Akhmedov A., Erusalimsky J.D. Хронический окислительный стресс нарушает целостность теломер и ускоряет начало старения эндотелиальных клеток человека. Дж. Клеточные науки. 2004;117:2417–2426. doi: 10.1242/jcs.01097. [PubMed] [CrossRef] [Google Scholar]
, Akhmedov A., Erusalimsky J.D. Хронический окислительный стресс нарушает целостность теломер и ускоряет начало старения эндотелиальных клеток человека. Дж. Клеточные науки. 2004;117:2417–2426. doi: 10.1242/jcs.01097. [PubMed] [CrossRef] [Google Scholar]
85. Richter T., von Zglinicki T. Непрерывная корреляция между окислительным стрессом и укорочением теломер в фибробластах. Эксп. Геронтол. 2007;42:1039–1042. doi: 10.1016/j.exger.2007.08.005. [PubMed] [CrossRef] [Google Scholar]
86. Powers S.K., Ji L.L., Leeuwenburgh C. Изменения антиоксидантной способности скелетных мышц, вызванные тренировками: краткий обзор. Мед. науч. Спортивное упражнение. 1999; 31: 987–997. doi: 10.1097/00005768-199907000-00011. [PubMed] [CrossRef] [Академия Google]
87. Радак З., Чанг Х.Ю., Гото С. Системная адаптация к окислительной нагрузке, вызванной регулярными физическими упражнениями. Свободный Радик. биол. Мед. 2008; 44: 153–159. doi: 10.1016/j.freeradbiomed.2007.01.029. [PubMed] [CrossRef] [Google Scholar]
88. Пик Дж.М., Маркворт Дж.Ф., Носака К., Раастад Т., Уодли Г.Д., Коффи В.Г. Модулирование гормезиса, вызванного физическими упражнениями: меньше значит больше? Дж. Заявл. Физиол. 2015; 119: 172–189. doi: 10.1152/japplphysiol.01055.2014. [PubMed] [CrossRef] [Академия Google]
Пик Дж.М., Маркворт Дж.Ф., Носака К., Раастад Т., Уодли Г.Д., Коффи В.Г. Модулирование гормезиса, вызванного физическими упражнениями: меньше значит больше? Дж. Заявл. Физиол. 2015; 119: 172–189. doi: 10.1152/japplphysiol.01055.2014. [PubMed] [CrossRef] [Академия Google]
89. Мейер М., Пал Х.Л., Бауэрле П.А. Регуляция факторов транскрипции NF-каппа B и AP-1 посредством окислительно-восстановительных изменений. хим.-биол. Взаимодействовать. 1994; 91: 91–100. doi: 10.1016/0009-2797(94)
-9. [PubMed] [CrossRef] [Google Scholar]
90. Wu Z., Puigserver P., Andersson U., Zhang C., Adelmant G., Mootha V., Troy A., Cinti S., Lowell B., Scarpulla R.C. и соавт. Механизмы, контролирующие митохондриальный биогенез и дыхание через термогенный коактиватор PGC-1. Клетка. 1999; 98: 115–124. дои: 10.1016/S0092-8674(00)80611-Х. [PubMed] [CrossRef] [Google Scholar]
91. Ji L.L. Передача сигналов окислительно-восстановительного потенциала в скелетных мышцах: роль старения и упражнений. Доп. Физиол. Образовательный 2015; 39: 352–359. doi: 10.1152/advan.00106.2014. [PubMed] [CrossRef] [Google Scholar]
Доп. Физиол. Образовательный 2015; 39: 352–359. doi: 10.1152/advan.00106.2014. [PubMed] [CrossRef] [Google Scholar]
92. Osthus I.B., Sgura A., Berardinelli F., Alsnes I.V., Bronstad E., Rehn T., Stobakk P.K., Hatle H., Wisloff U., Nauman J. Длина теломер и длительные упражнения на выносливость: влияют ли тренировки на биологический возраст? Пилотное исследование. ПЛОС ОДИН. 2012;7:e52769. doi: 10.1371/journal.pone.0052769. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
93. Аззалин С.М., Рейхенбах П., Хориаули Л., Джулотто Э., Лингнер Дж. Теломерный повтор, содержащий РНК и факторы надзора за РНК на концах хромосом млекопитающих. Наука. 2007; 318: 798–801. doi: 10.1126/science.1147182. [PubMed] [CrossRef] [Google Scholar]
94. Schoeftner S., Blasco M.A. Регулируемая в процессе развития транскрипция теломер млекопитающих с помощью ДНК-зависимой РНК-полимеразы II. Нац. Клеточная биол. 2008; 10: 228–236. дои: 10.1038/ncb1685. [PubMed] [CrossRef] [Академия Google]
95. Риппе К., Люк Б. ТЕРРА и состояние теломер. Нац. Структура Мол. биол. 2015; 22: 853–858. doi: 10.1038/nsmb.3078. [PubMed] [CrossRef] [Google Scholar]
Риппе К., Люк Б. ТЕРРА и состояние теломер. Нац. Структура Мол. биол. 2015; 22: 853–858. doi: 10.1038/nsmb.3078. [PubMed] [CrossRef] [Google Scholar]
5 стратегий замедления укорочения теломер
название
автор
свидание
Посмотреть все сообщения
По
Диана Ликальци, MS, RD, CDCES, 15 ноября 2021 г.
Старение — это сложный многофакторный процесс, который начинается в наших клетках и приводит к постепенному угасанию более крупных систем организма. Ученые предложили различные теории причин старения, включая окислительный стресс, митохондриальную дисфункцию, клеточное старение и укорочение теломер. Теломеры, структуры на концах хромосом, помогают защитить ДНК от повреждений и позволяют хромосомам правильно реплицироваться во время клеточного деления. Все больше данных указывает на то, что длина теломер уменьшается с возрастом, и скорость их укорочения может указывать на то, как быстро человек стареет. К счастью, диета и образ жизни могут влиять на скорость, с которой теломеры укорачиваются — замедлите скорость укорочения теломер, и вы сможете замедлить процесс старения. Давайте рассмотрим пять научно обоснованных стратегий, позволяющих сохранить теломеры более длинными и здоровыми.
Все больше данных указывает на то, что длина теломер уменьшается с возрастом, и скорость их укорочения может указывать на то, как быстро человек стареет. К счастью, диета и образ жизни могут влиять на скорость, с которой теломеры укорачиваются — замедлите скорость укорочения теломер, и вы сможете замедлить процесс старения. Давайте рассмотрим пять научно обоснованных стратегий, позволяющих сохранить теломеры более длинными и здоровыми.
Люди с более здоровым питанием, как правило, имеют более длинные теломеры, меньший риск хронических заболеваний и большую продолжительность жизни.[1] В этом недавнем метаанализе 2019 года проанализировано более 20 исследований — как обсервационных, так и интервенционных — для изучения связи между диетой и длиной теломер (TL). Исследователи обнаружили, что приверженность средиземноморской диете или диете, богатой растениями, была связана с более длинными теломерами (следует отметить, что не было никаких исследований, специально посвященных веганской или вегетарианской диете и TL). При рассмотрении изолированных продуктов неочищенные зерна, орехи и семена, а также кофе были связаны с более длинными теломерами. Исследователи также обнаружили, что диета, богатая каротиноидами, питательными веществами, содержащимися в листовой зелени, фруктах и овощах красно-оранжевого цвета, в значительной степени связана с более длинными теломерами.
При рассмотрении изолированных продуктов неочищенные зерна, орехи и семена, а также кофе были связаны с более длинными теломерами. Исследователи также обнаружили, что диета, богатая каротиноидами, питательными веществами, содержащимися в листовой зелени, фруктах и овощах красно-оранжевого цвета, в значительной степени связана с более длинными теломерами.
Средиземноморская и богатая растениями диета состоит из богатых питательными веществами продуктов с высоким содержанием клетчатки и здоровых жиров, богатых антиоксидантами, таких как омега-3 жирные кислоты. Компоненты этих диет помогают уменьшить воспаление и окислительный стресс в организме — два механизма, которые в противном случае могут ускорить укорочение теломер. Отдельные исследования дополнительно подтверждают взаимосвязь между питательными веществами богатой растениями диеты и TL. Одно крупное поперечное исследование показало, что у тех, кто потреблял больше клетчатки, также были более длинные теломеры, в то время как другое исследование показало, что диета, богатая омега-3, была связана с более медленным темпом укорочения теломер. Наконец, в этом исследовании женщины, которые потребляли пищу, богатую антиоксидантами, особенно витаминами Е и С и бета-каротином, имели более длинные теломеры и меньший риск развития рака молочной железы. Верно и обратное: низкое потребление этих питательных веществ было связано с более короткими теломерами и умеренным риском развития рака молочной железы.
Наконец, в этом исследовании женщины, которые потребляли пищу, богатую антиоксидантами, особенно витаминами Е и С и бета-каротином, имели более длинные теломеры и меньший риск развития рака молочной железы. Верно и обратное: низкое потребление этих питательных веществ было связано с более короткими теломерами и умеренным риском развития рака молочной железы.
Как физическая активность, так и упражнения помогают сохранить длину теломер.[2] В ходе одного крупномасштабного исследования, проведенного Национальным обследованием состояния здоровья и питания (NHANES), было обследовано более 5000 человек и сделан вывод, что у людей, которые больше занимаются спортом, теломеры длиннее, чем у тех, кто ведет малоподвижный образ жизни. Подобно диете, богатой питательными веществами, физическая активность помогает уменьшить окислительный стресс и воспаление в организме, помогая защитить теломеры от повреждений. Кроме того, у более активных людей может повышаться активность теломеразы — фермента, который помогает поддерживать длину теломер. Вернер и др. изучили активность теломер у спортсменов и обнаружили, что у спортсменов повышена активность теломеразы и снижено укорочение теломер по сравнению с теми, кто не занимается спортом.[3] 9Рис. 1. Потенциальное влияние физической активности и упражнений на длину теломер т. 8, 27. Авторские права Arsenis et al., 2017 г.
Вернер и др. изучили активность теломер у спортсменов и обнаружили, что у спортсменов повышена активность теломеразы и снижено укорочение теломер по сравнению с теми, кто не занимается спортом.[3] 9Рис. 1. Потенциальное влияние физической активности и упражнений на длину теломер т. 8, 27. Авторские права Arsenis et al., 2017 г.
Фолат, важный витамин группы В, содержащийся в продуктах питания, может играть роль в защите и увеличении длины теломер Некоторые исследования показывают, что люди с адекватным уровнем фолиевой кислоты имеют более длинные теломеры, в то время как Дефицит этого витамина может привести к повреждению ДНК и укорачиванию теломер[4-5].исследование показало, что люди с самым высоким уровнем фолиевой кислоты имели более короткие теломеры [6]. Фолиевая кислота часто добавляется в наши продукты питания (хлеб, крупы и макаронные изделия) и в поливитамины в ее синтетической форме, фолиевой кислоте. Фолиевая кислота действует в организме иначе, чем природный фолат, поскольку ее биодоступность значительно выше (85% по сравнению с 50%). [7] Чтобы обеспечить достаточное количество фолиевой кислоты, сосредоточьтесь на натуральных источниках витамина, включая шпинат, спаржу, артишоки, брокколи и большинство бобовых.
[7] Чтобы обеспечить достаточное количество фолиевой кислоты, сосредоточьтесь на натуральных источниках витамина, включая шпинат, спаржу, артишоки, брокколи и большинство бобовых.
Также существует тесная связь между витамином D и длиной теломер. Исследование, опубликованное в The Journal of Frailty & Aging , показало, что более высокие уровни витамина D связаны с большей длиной теломер. Витамин D выполняет множество функций в организме, в том числе его роль в модуляции воспаления — механизм, который также может защищать теломеры. Более того, добавки с витамином D также могут помочь удлинить уже укороченные теломеры. В рандомизированном контрольном исследовании пожилым людям с легкими когнитивными нарушениями (MCI) ежедневно вводили 800 МЕ витамина D. После 12 месяцев приема экспериментальная группа значительно улучшила показатели окислительного стресса и MCI, а также удлинила теломеры по сравнению с контрольной группой. . Это исследование предполагает, что витамин D может помочь уменьшить окислительный стресс, что приводит к более длинным и здоровым теломерам.
Хронические уровни стресса повышают уровень кортизола и усиливают окислительный стресс, оба фактора укорочения теломер.[8] В одном увлекательном исследовании у двух групп женщин измеряли воспринимаемый уровень стресса и длину теломер. Контрольную группу составили матери здоровых детей, а экспериментальную группу – матери хронически больных детей («воспитатели»). У лиц, осуществляющих уход, активность теломеразы была значительно снижена, а теломеры короче по сравнению с женщинами из контрольной группы. Авторы исследования также отметили, что разница в длине теломер между двумя группами была «эквивалентна 10 годам жизни», а это означает, что женщины, подвергавшиеся большему стрессу, сталкивались с большим риском возрастных проблем со здоровьем.
- Теломеры — это структуры на концах хромосом, и появляется все больше свидетельств того, что длина теломер уменьшается с возрастом — изменение, которое ученые теперь считают отличительной чертой старения.

- Сосредоточение внимания на растительной диете, полной клетчатки, антиоксидантов, витаминов и фитонутриентов, может привести к увеличению длины теломер.
- Физическая активность и упражнения уменьшают окислительный стресс и воспаление в организме, помогая защитить теломеры от повреждений.
- Выбирайте натуральные продукты, богатые фолиевой кислотой, а не продукты, обогащенные ее синтетическими вариантами (фолиевой кислотой), для оптимальной длины теломер.
- Более высокие уровни витамина D связаны с более длинными теломерами и могут удлинять уже укороченные теломеры.
- Держите под контролем уровень стресса и кортизола, поскольку они могут сократить теломеры и продолжительность жизни.
- Используйте InsideTracker для тестирования биомаркеров, связанных с длиной теломер, включая витамин D, фолиевую кислоту и кортизол (см. справа).
Диана Ликальци, MS, RD
Диана — контент-стратег и специалист по питанию в InsideTracker. Как зарегистрированный диетолог и самопровозглашенный «биохакер», Диана любит исследовать и тестировать последние тенденции и технологии в области питания и старения. Вы часто будете видеть Диану, завершающую 24-часовое голодание, проводящую эксперименты над собой или раскрывающую стратегии увеличения продолжительности жизни. Подпишитесь на нее в Instagram на @dietitian.diana.
Как зарегистрированный диетолог и самопровозглашенный «биохакер», Диана любит исследовать и тестировать последние тенденции и технологии в области питания и старения. Вы часто будете видеть Диану, завершающую 24-часовое голодание, проводящую эксперименты над собой или раскрывающую стратегии увеличения продолжительности жизни. Подпишитесь на нее в Instagram на @dietitian.diana.
Ссылки
[1] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316700/
[2] https://www.ncbi.nlm.nih. gov/pmc/articles/PMC5546536/
[3] https://pubmed.ncbi.nlm.nih.gov/19948976/
[4] https://academic.oup.com/jn/article/139/ 7/1273/4670470
[5] https://www.sciencedirect.com/science/article/pii/S0955286311000052
[6] https://now.tufts.edu/articles/lessons-aging-chromosomes
[7] https://ods.od.nih.gov/factsheets/Folate-HealthProfessional/
[8] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4028159/
Некоторые другие записи в блоге, которые, как мы думаем, вам понравятся!
Управляйте своим разумом с помощью этих трех стратегий от доктора Кэролайн Лиф
По
Мишель Дариан, MS, MPH, RD,
21 апреля 2021 г.

В погоне за большими, безумными и смелыми целями: письмо олимпийской чемпионки Шалан Флэнаган
По
Шалане Флэнаган,
9 апреля 2021 г.
Замедление, чтобы ускориться: олимпийская программа Тианны Бартолетты перед сном для повышения производительности
По
Тианна Бартолетта,
5 апреля 2021 г.
Категории
Вопросы?
Свяжитесь с нами по телефону (800) 513-2359 или электронной почте
Как естественным образом удлинить теломеры и улучшить старение
Теломеры становятся короче с возрастом. По этой причине они являются надежным маркером биологического возраста и здоровья. Узнайте, как естественным образом удлинить теломеры и замедлить процесс старения.
ПО ТЕМЕ: Рапамицин: как замедлить старение наших клеток Подобно колпачкам на концах шнурков, эти белки защищают концы нитей ДНК от укорочения и изнашивания.
Ученые связывают удлинение теломер с долголетием, снижением риска заболеваний и улучшением здоровья мозга.
Теломеры со временем становятся короче, потому что стареющие клетки не могут правильно воспроизводиться. В результате клетки теряют способность нормально функционировать, что ускоряет процесс старения.
К сожалению, более короткие теломеры являются частью старения. Кроме того, отсутствие активности, неправильное питание и стресс могут привести к более быстрому износу ваших теломер.
К счастью, вы можете укрепить свои теломеры всего за несколько недель, изменив образ жизни.
Как удлинить теломеры с помощью питательных веществ и диеты
Питание может оказывать значительное влияние на длину теломер. Обзор 2018 года выявил связь между потреблением определенных продуктов и более длинными теломерами, в том числе:
- Цельные продукты, цельные зерна, орехи и бобовые
- Свежие фрукты и 100% фруктовый сок
- Овощи
- Морские водоросли
- Молочные продукты
- Кофе
В обзоре также отмечается, что некоторые питательные вещества могут оказывать влияние.
Для синтеза, восстановления и метаболизма ДНК в клетке требуется фолиевая кислота. Это означает, что фолиевая кислота может удлинять и защищать теломеры. Кроме того, диета, богатая антиоксидантами, включающая витамин С, Е, полифенолы и селен, а также клетчатку, может способствовать увеличению длины теломер. Принимая во внимание, что другое исследование связало более высокие уровни омега-3 жирных кислот с меньшим воспалением и более медленным разрушением теломер.
Однако диета и режим питания могут быть столь же важны, как и содержание питательных веществ.
Например, западная диета, состоящая из большего количества обработанных продуктов, красного мяса и более высокого содержания сахара, может укорачивать теломеры.
С другой стороны, средиземноморская диета коррелирует с более длинными теломерами. Ученые считают, что именно антиоксидантные и противовоспалительные свойства этой диеты сохраняют длину теломер.
Некоторые исследования показывают, что голодание и диеты, имитирующие голодание, могут увеличить продолжительность жизни. Но нам нужно больше доказательств, чтобы определить, влияет ли это на длину теломер и как.
Но нам нужно больше доказательств, чтобы определить, влияет ли это на длину теломер и как.
Вот как можно удлинить теломеры с помощью диеты:
- Ешьте в основном цельные растительные продукты.
- Сократите потребление красного мяса, сахара и рафинированных, обработанных пищевых продуктов.
- Употребляйте жирные кислоты омега-3, содержащиеся в льняном семени, зеленых листовых овощах и высококачественных добавках с рыбьим жиром.
- Включите продукты, богатые антиоксидантами, такие как ягоды, сладкий картофель и зеленые листовые овощи.
- Добавьте бобовые, брокколи, шпинат и брюссельскую капусту для получения фолиевой кислоты и клетчатки.
Как удлинить теломеры с помощью упражнений
Теперь вы знаете, насколько важны упражнения для общего состояния здоровья. Но, согласно исследованию NHANES, физическая активность также оказывает значительное влияние на клеточное старение.
Более 5000 взрослых приняли участие в трехлетнем исследовании, в ходе которого ученые сравнивали влияние частоты, интенсивности и продолжительности 62 видов деятельности.
Исследование пришло к выводу, что у взрослых с высоким уровнем активности теломеры были длиннее, чем у людей с низким или средним уровнем активности. Кроме того, по их оценкам, более длинные теломеры снижают биологический возраст на семь-девять лет.
Взрослые должны еженедельно уделять 150 минут умеренным или энергичным упражнениям, чтобы получить все преимущества. Различные виды упражнений по-разному влияют на теломеры. Таким образом, ряд видов деятельности может иметь наибольшие преимущества против старения.
Найдите занятия, которые вам нравятся. Например, если вы не любите играть в gYunique, поработайте в саду. Кроме того, играйте в командные виды спорта или отправляйтесь в поход.
Самое главное, оставайтесь активными, потому что любая физическая активность лучше, чем ее отсутствие.
СВЯЗАННЫЕ: Как выучиться | Избавьтесь от упрямого жира и станьте стройнее
Как удлинить теломеры с помощью релаксации и снижения стресса
Стресс вреден для вашего здоровья. Это не только увеличивает риск сердечно-сосудистых заболеваний, но и снижает защиту вашей иммунной системы и заставляет вас стареть быстрее.
Это не только увеличивает риск сердечно-сосудистых заболеваний, но и снижает защиту вашей иммунной системы и заставляет вас стареть быстрее.
Другие состояния психического здоровья, такие как тревога и депрессия, также играют важную роль в длине теломер.
Ученые считают, что повышенный окислительный стресс может быть причиной укорочения теломер. Другим объяснением является более высокий уровень кортизола, поскольку он ингибирует уникальные ферменты, защищающие теломеры.
Какой бы ни была причина, мы знаем, что стресс вреден. Мы также знаем, что управление стрессом оказывает значительное влияние на здоровье. Таким образом, расслабление и снижение стресса жизненно важны для общего благополучия.
Появляется все больше доказательств того, что регулярная практика йоги и медитации стабилизирует теломеры, что делает их одним из лучших доступных методов управления стрессом.
Одно исследование отметило значительные изменения в биомаркерах участников после трех-шести месяцев регулярной практики йоги. Точно так же те, кто практиковал медитацию, имели большую длину теломер по сравнению с контрольной группой.
Точно так же те, кто практиковал медитацию, имели большую длину теломер по сравнению с контрольной группой.
Другое исследование измеряло влияние йогической медитации на активность теломеразы и психическое здоровье. Исследователи обнаружили, что активность теломеразы улучшилась на 43%, а психическое здоровье улучшилось на 50%.
Что такое теломераза? Теломераза — это тип enzYuniquee, который защищает и удлиняет теломеры.
Лучше всего то, что всего 12 минут ежедневной медитации могут помочь поддержать ваши теломеры, и вам не нужны специальные занятия для медитации. Послушайте управляемую медитацию или сосредоточьтесь на своем дыхании в течение определенного периода времени. Для занятых людей сделайте медитацию частью своей рутины перед сном.
Если вы новичок в йоге, лучше всего записаться на занятия, чтобы освоить основы. Начните с занятий йогой два или три раза в неделю. Затем доведите до пяти или более занятий в неделю.
Прежде всего, вы хотите снизить уровень стресса. И хотя йога и медитация прекрасны, все, что помогает вам расслабиться, полезно для вашего благополучия. Вот еще несколько способов расслабиться и снять стресс:
И хотя йога и медитация прекрасны, все, что помогает вам расслабиться, полезно для вашего благополучия. Вот еще несколько способов расслабиться и снять стресс:
- Искусство, ремесла и хобби
- Чтение
- Прослушивание музыки или игра на инструменте
- Садоводство
- Пешие прогулки или отдых на природе
- СПА-дни и массажи
*Если вы испытываете чрезмерный стресс, тревогу или депрессию, обратитесь к врачу. Ваш врач может назначить правильный курс действий для ваших нужд, который может значительно улучшить вашу повседневную жизнь.
Как удлинить теломеры: другие возможные факторы
Различные исследования пришли к выводу, что диета, физическая активность и снижение стресса влияют на теломеры. Но лишь несколько исследований выявили другие возможные факторы.
Есть некоторые свидетельства того, что социальное взаимодействие, дружба и физические отношения могут играть определенную роль. Эти взаимодействия могут снизить стресс и, следовательно, защитить теломеры, но эта теория до сих пор не имеет доказательств.
Эти взаимодействия могут снизить стресс и, следовательно, защитить теломеры, но эта теория до сих пор не имеет доказательств.
Некачественный сон также может укорачивать теломеры, так как усиливает окислительный стресс и воспаление. Таким образом, можно утверждать, что лучший сон равен более длинным теломерам.
Наконец, исследование выявило корреляцию между сидением за столом в течение всего дня и короткими теломерами. По этой причине возможно, что, проводя больше времени на ногах, теломеры могут удлиняться.
Хотя эти факторы могут влиять на длину теломер, пока нет достаточных доказательств в поддержку этих теорий.
Через несколько недель после изменения образа жизни ваши теломеры могут улучшиться. Некоторые из этих изменений требуют больше усилий, чем другие. Но чем раньше вы начнете, тем быстрее вы получите преимущества.
Почему бы не начать оптимизировать свое здоровье сегодня? Мы можем помочь замедлить процесс старения. Свяжитесь с нами для получения дополнительной информации и начните работу сегодня! У нас есть офисы, расположенные в Окале, Дейтоне, Фрутленд-Парке и Орландо, штат Флорида, и мы готовы помочь вам оптимизировать работу.
