инженерные проблемы и их решения
В медицинской литературе приводится описание удивительных случаев восстановления проводимости поврежденного спинного мозга при смещении позвонков при переломовывихе, или повреждением спинного мозга ранящим снарядом (пулей, ножом и др.). Однако следует отметить, что имеется большое количество препятствий, не дающих возможности в адекватной хирургическим вмешательствам мере проявиться компенсаторно-восстановительным механизмам спинного мозга, поскольку соединительная ткань (рубец) как правило растет быстрее нервного волокна, и пока отсутствуют методы, которые позволили бы справиться с этим [26,27].
В обзорной работе А.Г. Аганесова по хирургическому лечению осложненной травмы позвоночника приведено описание множества таких удивительных случаев [28]. Например, Briggs у мальчика 17 лет после перелома на уровне грудного позвонка Th20 сшил спинной мозг четырьмя биодеградируемыми кетгутовыми швами, после чего отмечалось восстановление функции мочевого пузыря и ног.
Stewart и Harte в 1901 г. сшили спинной мозг через 3 ч после огнестрельного ранения в области грудного позвонка Th7 [29], причем через 8 месяцев восстановились чувствительность и движения, произвольное мочеиспускание и испражнение, оставалось только ночное недержание мочи. В дальнейшем восстановились произвольные движения бедра, голени и пальцев стоп. Однако, через 6 лет восстановленные функции были утрачены. Уже после смерти больной в 1925 г. при патологоанатомическом исследовании было обнаружено сдавление спинного мозга плотной рубцовой тканью [30].
Lumb&Nornes впервые в эксперименте с 1967 г., Derlon, Yturraspe, Young, Gorman, Roy-Camille, Lechevalier с 70-х годов XX века разрабатывают способ соединения перерезанных концов спинного мозга после удаления части или целого позвонка. Эксперимент проводился на собаках и обезьянах [5] и заключался в удалении позвонка, укорочении позвоночника и соединении перерезанного спинного мозга.
Derlon писал, что необходимо удалить поврежденную часть спинного мозга, создав резаную рану и сопоставляя культи конец в конец, нельзя также удалять большую часть спинного мозга, так как это может нанести вред, но не указывает границы максимальной резекции спинного мозга [31].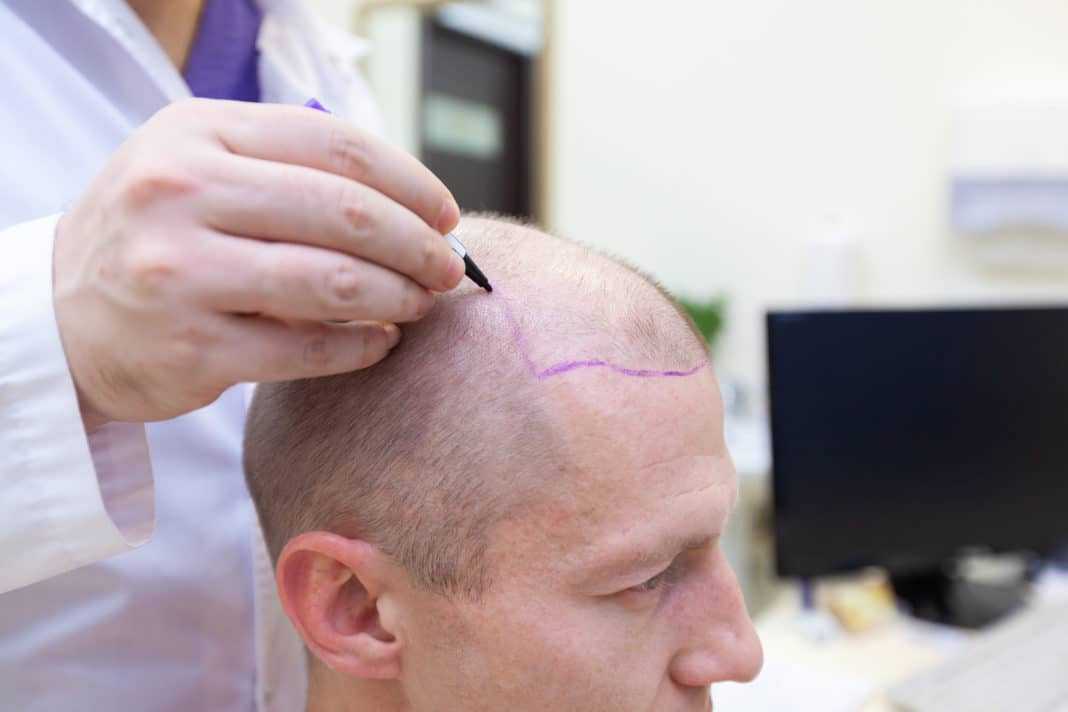
В СССР также проводились аналогичные исследования. С 1975 г. известны работы проф. В.И. Зяблова и его учеников, посвященные изучению регенерации перерезанных концов спинного мозга при последующем его соединении
В патенте А.В. Ковалева приводится резюме по исследованиям в области спинномозговых анастомозов в СССР [32]. В 1975 году В.И. Зяблов выдвигает научную концепцию о разрушающем действии (лизис, растворение клеток и тканей нервной системы под влиянием ферментов) патологически измененного ликвора при травме центральной нервной системы, в частности спинного мозга, на ткани. Был сделан вывод, что ликвор препятствует органотипичной репаративной регенерации нервной ткани [33]. Зяблов с соавторами разрабатывает новые способы оперативного вмешательства при травме спинного мозга, уменьшающих присутствие ликвора в зоне повреждения, в том числе, и на уровне изобретений, доказывает принципиальную возможность и практическую достижимость регенерации аксонов нервных клеток через зону повреждения спинного мозга в эксперименте при таком условии. В дальнейшем совместно с клиницистами (академик АМН СССР А.А. Корж, член-корр. АМН СССР Г.С. Юмашев) апробирует полученные им данные на спинальных больных в Москве и в Харькове и получает положительные результаты. Была впервые экспериментально подтверждена идея о патологическом лизирующем влиянии спинномозговой жидкости на поврежденную ткань спинного и головного мозга, были разработаны разные способы оперативного лечения, предотвращающие контакт поврежденного мозгового вещества с патологически измененным ликвором, способствующим образованию в зоне травмы кист и грубого глиосоединительнотканного рубца. Была разработана нейрохирургическая операция, одной из главных целей которой являлось снижение присутствия ликвора в зоне спинальной травмы [34]. Для предупреждения развития кист в области анастомоза после рассечения твердой оболочки спинномозговую жидкость (ликвор) удаляют из краниальной и каудальной частей подпаутинного пространства спинного мозга. Выше места его повреждения производят прокол по задней средней борозде спинного мозга до его центрального канала.
В дальнейшем совместно с клиницистами (академик АМН СССР А.А. Корж, член-корр. АМН СССР Г.С. Юмашев) апробирует полученные им данные на спинальных больных в Москве и в Харькове и получает положительные результаты. Была впервые экспериментально подтверждена идея о патологическом лизирующем влиянии спинномозговой жидкости на поврежденную ткань спинного и головного мозга, были разработаны разные способы оперативного лечения, предотвращающие контакт поврежденного мозгового вещества с патологически измененным ликвором, способствующим образованию в зоне травмы кист и грубого глиосоединительнотканного рубца. Была разработана нейрохирургическая операция, одной из главных целей которой являлось снижение присутствия ликвора в зоне спинальной травмы [34]. Для предупреждения развития кист в области анастомоза после рассечения твердой оболочки спинномозговую жидкость (ликвор) удаляют из краниальной и каудальной частей подпаутинного пространства спинного мозга. Выше места его повреждения производят прокол по задней средней борозде спинного мозга до его центрального канала. Место соединения концов укрывают мягкой мозговой оболочкой и герметизируют. Способ временно и частично позволяет удалить ликвор из зоны травмы, но не позволяет обеспечить длительное воздействие веществ, стимулирующих органотипическую регенерацию спинного мозга.
Место соединения концов укрывают мягкой мозговой оболочкой и герметизируют. Способ временно и частично позволяет удалить ликвор из зоны травмы, но не позволяет обеспечить длительное воздействие веществ, стимулирующих органотипическую регенерацию спинного мозга.
Учеником В.И. Зяблова Ю.Д. Розгонюком изучена морфология спинномозгового рубца при различных способах соединения концов спинного мозга после его перерезки в эксперименте [35]. Автором произведено 8 видов операций на 88 животных, что позволило сделать вывод о возможности регенерации спинного мозга соединением его культей конец в конец в условиях изоляции анастомоза от ликвора и сохранения сосудистой сети спинного мозга. Эти условия способствуют формированию рыхлого глиосоединительнотканного рубца между культями и прорастанию сквозь него регенерирующих нервных волокон.
Восстановление поврежденных нервов удалось ускорить с помощью введения в зону повреждения особых веществ, например, полиэтиленгликоля (ПЭГ) [36]. соответствующие исследования провели две группы специалистов Техасского университета в Остине, одной из которых руководил Кристофер Спает (С. S. Spaeth), а другой — Джордж Биттнер (G.D. Bittner). В экспериментах на крысах они выяснили, что поврежденные отростки седалищного нерва грызунов быстрее срастаются в присутствии ионов кальция [37]. Использование антиоксидантов, таких как мелатонин и метиленовый синий стимулировали восстановление нейронов [38,39]. Была разработана технология использования фьюзогенов на основе полиэтиленгликоля [40].
S. Spaeth), а другой — Джордж Биттнер (G.D. Bittner). В экспериментах на крысах они выяснили, что поврежденные отростки седалищного нерва грызунов быстрее срастаются в присутствии ионов кальция [37]. Использование антиоксидантов, таких как мелатонин и метиленовый синий стимулировали восстановление нейронов [38,39]. Была разработана технология использования фьюзогенов на основе полиэтиленгликоля [40].
Интересным примером использования современных технологий является случай 24-летней женщины, пострадавшей в результате скоростной лыжная авария. В этом случае спинномозговой рубец был иссечен, и в зазор установлена коллагеновая вставка. МРТ-томография показала, что в спинном мозге выросли новые аксоны и нервы.
В 2014 году польская команда сообщила о 38-летнем мужчине с травматическим разрезом спинного мозга на уровне грудного позвонка Т9. Через 2 года после травмы одна из обонятельных луковиц пациента была удалена и использована для получения культуры, содержащей клетки обонятельной оболочки и фибробласты обонятельного нерва. После резекции глиального рубца культивированные клетки трансплантировали в культю спинного мозга выше и ниже травмы, и в 8-миллиметровый промежуток, перекрытый четырьмя полосками аутологичного нерва. Пациент прошел интенсивную программу до и послеоперационной нейрореабилитации. Наблюдалось улучшение состояния пациента, частичное восстановление произвольных движений нижних конечностей и увеличение мышечной массы в левом бедре. Нейрофизиологические исследования подтвердили восстановление целостности кортикоспинальных путей и произвольный характер зарегистрированных мышечных сокращений [41].
После резекции глиального рубца культивированные клетки трансплантировали в культю спинного мозга выше и ниже травмы, и в 8-миллиметровый промежуток, перекрытый четырьмя полосками аутологичного нерва. Пациент прошел интенсивную программу до и послеоперационной нейрореабилитации. Наблюдалось улучшение состояния пациента, частичное восстановление произвольных движений нижних конечностей и увеличение мышечной массы в левом бедре. Нейрофизиологические исследования подтвердили восстановление целостности кортикоспинальных путей и произвольный характер зарегистрированных мышечных сокращений [41].
В работе Bozkurt et al. (2010) показано, что имплантация прогениторных клеток, выделенных из спинного мозга на хитозановом матриксе способствует восстановлению спинномозговой травмы на крысах [42].
В области клеточных технологий сверхсложность выделения и культивирования клеток-предшественников олигодендроцитов делают актуальным получение индуцированных плюрипотентных глиальных клеток и создание тканеинженерныхк конструкций на матриксе с анизотропной морфологией (например, структурированный коллаген/желатин). Альтернативным подходом является снижение воспаления и фиброза за счет инъекции активно секретирующих паракринные факторы клеток — прежде всего МСК.
Альтернативным подходом является снижение воспаления и фиброза за счет инъекции активно секретирующих паракринные факторы клеток — прежде всего МСК.
Проведена успешная трансплантация головы. С трупа на труп
Нейрохирурги впервые провели «репетицию» трансплантации головы на человеческих трупах — 18-часовой эксперимент провела в Китае команда врачей под руководством Сяопина Жэня (Xiaoping Ren) из Харбинского медицинского университета. Как сообщает газета The Telegraph, об успехе операции заявил на пресс-конференции в Вене итальянский нейрохирург Серджио Канаверо (Sergio Canavero).
Канаверо говорит о намерении пересадить голову парализованного человека на здоровое тело с 2013 года — тогда он опубликовал статью с описанием такой операции. Ученый заявлял, что главным препятствием на пути такой трансплантации до сих пор являлась невозможность восстановить целостность спинного мозга, но ему удалось разработать технологию для решения этой задачи. Сделать это, по его мнению, можно с помощью обработки среза полиэтиленгликолем, который в лабораторных условиях продемонстрировал способность «склеивать» поврежденные клеточные мембраны. Температура тела пациента во время операции должна быть снижена до 15 градусов Цельсия, а после операции он должен будет провести несколько недель в глубокой коме. Для восстановления проводимости спинного мозга потребуется электростимуляция.
Температура тела пациента во время операции должна быть снижена до 15 градусов Цельсия, а после операции он должен будет провести несколько недель в глубокой коме. Для восстановления проводимости спинного мозга потребуется электростимуляция.
В 2015 году сенсацию произвели сообщения, что согласие Канаверо на пересадку своей головы дал российский программист Валерий Спиридонов, парализованный в результате нейродегенеративного заболевания — спинальной мышечной атрофии. В 2016 году Канаверо заявил, что ему и его китайским и корейским коллегам во главе с Сяопином Жэнем удалось произвести пересадку головы обезьяне. Правда в этом случае о полноценной пересадке речи не шло — ученые не пытались соединить перерезанный спинной мозг. Эксперты, которые соглашаются комментировать эксперименты и планы Канаверо, крайне скептически отзываются о них.
Теперь Канаверо на пресс-конференции в Вене объявил об успехе операции по трансплантации головы на трупах. «Первая пересадка человеческой головы. .. реализована. Статья будет опубликована через несколько дней. Все говорили, что это невозможно, но хирургия была успешной», — цитирует слова хирурга The Independent.
.. реализована. Статья будет опубликована через несколько дней. Все говорили, что это невозможно, но хирургия была успешной», — цитирует слова хирурга The Independent.
По его словам, эксперимент показал, что возможно успешно соединить спинной мозг, нервы и кровеносные сосуды.
Канаверо не описал подробности операции, но отметил, что прежние расчеты показывали, что по его протоколу 2015 года она должна была длиться 36 часов, но китайские врачи усовершенствовали процедуру и сократили этот срок вдвое. «Следующий шаг — это полная трансплантация головы на донора с мертвым мозгом… Дата будет объявлена Сяопином в следующие несколько дней», — заявил Канаверо.
Он также объявил, что в будущем намерен попытаться осуществить не только трансплантацию головы, но и трансплантацию мозга. «Я должен объявить об этом. Моя главная цель — не трансплантация головы, моя главная цель — трансплантация мозга. Цель китайских медиков — лечить неизлечимые болезни, нейрологические заболевания. Но моя личная цель — продление жизни, поскольку я верю, что старение — это болезнь, и она должна быть вылечена», — заявил Канаверо. Он пообещал, что через несколько месяцев будет опубликована статья с описанием техники такой трансплантации.
Но моя личная цель — продление жизни, поскольку я верю, что старение — это болезнь, и она должна быть вылечена», — заявил Канаверо. Он пообещал, что через несколько месяцев будет опубликована статья с описанием техники такой трансплантации.
Поднявшийся в прессе шум по поводу «первой успешной трансплантации головы» вызвал удивление у экспертов. В частности, нейробиолог Дин Бернетт (Dean Burnett) в своем блоге в газете The Guardian перечисляет другие широко освещавшиеся в прессе успехи Канаверо, вызвавшие серьезные сомнения у других хирургов, и задается вопросом: почему он обращается к СМИ до того, как результаты будут опубликованы в научных журналах? Издание Gizmodo удивляется, почему успехом называют эксперименты с трупами — ведь не называют же лечением рака удаление опухоли у покойного при вскрытии.
Сергей Кузнецов
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Можно ли пересадить мозг в молодое новое тело? А вы бы?
Хирурги проводят операции на головном мозге, используя дополненную реальность, анимированный трехмерный мозг. High Tech Технологически … [+] Advanced Hospital. Футуристическая тема.
High Tech Технологически … [+] Advanced Hospital. Футуристическая тема.
getty
Старение влияет на всех нас и приводит к потере функций клеток и тканей, множественным заболеваниям и, в конечном итоге, к смерти. И даже после десятилетий надежных исследований и потраченных миллиардов долларов существует лишь несколько способов замедлить его и, возможно, обратить вспять с помощью фармакологических средств. Интересно, что программа интервенционных испытаний (IRP), проводимая Национальным институтом здоровья, показала, что лишь несколько лекарств хоть сколько-нибудь значимо увеличивают продолжительность жизни мышей. В то время как разработка терапевтических средств двойного назначения для борьбы со старением и болезнями одновременно имеет большие перспективы, прогресс в этой области очень медленный, поскольку существует менее горстки заслуживающих доверия компаний с адекватными ресурсами и опытом.
Одной из основных областей, которая может привести к существенному увеличению продолжительности жизни и восстановлению функций, является регенеративная медицина. Вместо того, чтобы продлевать срок службы ваших старых клеток и органов, можно заменить их новыми. Гипотетически в будущем может стать возможным даже терапевтическое клонирование, при котором большая часть тела заменяется «клонами без сознания» или даже обычными телами.
Вместо того, чтобы продлевать срок службы ваших старых клеток и органов, можно заменить их новыми. Гипотетически в будущем может стать возможным даже терапевтическое клонирование, при котором большая часть тела заменяется «клонами без сознания» или даже обычными телами.
Эта концепция жадно изображалась во многих научно-фантастических романах и фильмах, включая недавний сериал «Видоизмененный углерод». Большая часть современной научной фантастики сосредоточена на концепции загрузки мозга в компьютер. В недавнем романе Нила Стивенсона «Падение, или Уклонение в аду» представлена замечательная концепция альтернативной метавселенной, и на Amazon есть юмористический ситком «Загрузка», посвященный этому.
Однако, несмотря на новаторские усилия «Neuralink» Илона Маска, «Science Inc» Макса Ходака и многих других стартапов, перенос мозга без потери индивидуальности не представляется технологически возможным в обозримом будущем. Я сам некоторое время работал над интерфейсами мозг-компьютер и получил патенты в этой области, но решил отказаться от идеи и сосредоточиться на технологиях открытия лекарств.
В этой статье я сосредоточусь на нескольких многообещающих подходах к постепенной замене мозга и, возможно, к полной трансплантации мозга.
Трехмерное изображение сети нейронов на черном фоне.
getty
БОЛЬШЕ ОТ FORFORBES ADVISOR
Замена поврежденных клеток
С тех пор, как были открыты стволовые клетки, ученые искали способы «повторного засевания» стареющего мозга. Стволовые клетки — это недифференцированные клетки, которые могут трансформироваться в клетки любого типа, такие как клетки мышц или печени, кардиомиоциты и даже нейроны. С каждым пройденным этапом процесса дифференциации они становятся более приверженными и берут на себя новые функции. Создание человеческого тела, которое происходит в матке, происходит из стволовых клеток, и у взрослых людей мы в основном находим их в костном мозге. Во время развития стволовые клетки являются либо уни-, либо мультипотентными, что означает, что они могут дифференцироваться в один или несколько типов клеток, соответственно, в основном в клетки крови, иммунитета, мышц, жира, кожи, костей и хрящей. Однако теоретически и экспериментально путем воздействия на них специально разработанных коктейлей факторов роста их можно подтолкнуть в другом направлении. Поскольку городская легенда гласит, что количество нейронов, которые вы получаете как один человек, ограничено, было бы довольно удивительно использовать стволовые клетки для дифференцировки в нейроны или мозговую ткань, подобно тому, что происходит на эмбриональной стадии, верно? Но как?
Однако теоретически и экспериментально путем воздействия на них специально разработанных коктейлей факторов роста их можно подтолкнуть в другом направлении. Поскольку городская легенда гласит, что количество нейронов, которые вы получаете как один человек, ограничено, было бы довольно удивительно использовать стволовые клетки для дифференцировки в нейроны или мозговую ткань, подобно тому, что происходит на эмбриональной стадии, верно? Но как?
Исследования по внедрению стволовых клеток в мозг проводились еще в 1917 году Элизабет Хопкинс Данн, выдающимся ученым из Чикагского университета, которая в свое время была пионером во многих областях. Ей удалось успешно пересадить ткань центральной нервной системы в мозг взрослого млекопитающего, наблюдая за выживанием внедренной неонатальной ткани коры головного мозга. Несмотря на то, что другие пытались последовать ее примеру, к сожалению, в то время все пришли к выводу, что мозг не способен к адаптации, поэтому большинство подходов, основанных на использовании стволовых клеток, прекратились на добрых шестьдесят-семьдесят лет.
В настоящее время стволовые клетки используются для лечения таких заболеваний, как лейкемия, множественная миелома и тяжелая апластическая анемия, когда организм больше не может синтезировать новые клетки крови из костного мозга. В этих сценариях нездоровые клетки удаляются или разрушаются с помощью химиотерапии, и человек получает здоровые стволовые клетки, выделенные из костного мозга, периферической крови или пуповинной крови от близкого донора, скорее всего, с родственными связями. Этот тип трансплантации называется аллогенной трансплантацией, тогда как когда пациент получает стволовые клетки из собственного тела, это называется аутологичной трансплантацией. Существует много рисков, и самый большой из них — это отказ от трансплантата, процесс, называемый болезнью трансплантата против хозяина. Когда типы HLA (человеческий лейкоцитарный антиген = белки поверх лейкоцитов) как у донора, так и у пациента не совпадают, иммунная система пациента отторгает трансплантат и атакует его. Даже если трансплантат не отторгнут, химиотерапия, вероятно, вызовет серьезные побочные эффекты, такие как тошнота и рвота, боль в мышцах, воспаление и различные инфекции. С другой стороны, терапия стволовыми клетками всегда меняется к лучшему и уже экспериментально используется для лечения рака молочной железы и ювенильного хронического артрита.
Даже если трансплантат не отторгнут, химиотерапия, вероятно, вызовет серьезные побочные эффекты, такие как тошнота и рвота, боль в мышцах, воспаление и различные инфекции. С другой стороны, терапия стволовыми клетками всегда меняется к лучшему и уже экспериментально используется для лечения рака молочной железы и ювенильного хронического артрита.
Поскольку терапию стволовыми клетками можно использовать для лечения различных видов рака, ее потенциально можно использовать и для лечения других заболеваний организма, особенно тканей, которые не могут восстанавливаться сами по себе, например ткани головного мозга. Стволовые клетки, которые должны использоваться для возможной регенерации мозга, происходят из трех разных источников: из внутренней клеточной массы бластоцисты эмбриона, путем перепрограммирования клеток или из разных стадий развития мозга, таких как стволовые клетки мозга взрослых или плода. Возможности использования нервных стволовых клеток в качестве терапевтических сосудов безграничны. Их можно генетически манипулировать, чтобы нацелить экспрессию определенных генов больного мозга, не влияя на какой-либо другой неврологический процесс. Их также можно получить, играя с белком нестином, который экспрессируется и синтезируется во всех клетках-предшественниках эмбриональной нервной системы, но не в функционально коммитированных нейронах или глиальных клетках. Эти клетки также можно длительное время хранить в культуре и при необходимости имплантировать в мозг, что многократно доказано в экспериментах с лабораторными подопытными животными.
Их можно генетически манипулировать, чтобы нацелить экспрессию определенных генов больного мозга, не влияя на какой-либо другой неврологический процесс. Их также можно получить, играя с белком нестином, который экспрессируется и синтезируется во всех клетках-предшественниках эмбриональной нервной системы, но не в функционально коммитированных нейронах или глиальных клетках. Эти клетки также можно длительное время хранить в культуре и при необходимости имплантировать в мозг, что многократно доказано в экспериментах с лабораторными подопытными животными.
Такие клетки уже использовались в доклинических исследованиях для лечения болезней Паркинсона, Хантингтона и Мачадо-Джозефа, и они продемонстрировали большой потенциал. К сожалению, механизмы, лежащие в основе действия лечения, до сих пор полностью не изучены, хотя ранние клинические результаты показали интеграцию недавно имплантированных стволовых клеток в ткань из трансплантата и запуск иммуномодуляции, что является как положительным, так и многообещающим наблюдением. Одним из возможных преимущественных механизмов, которые трансплантированные клетки могут индуцировать в головном мозге, является высвобождение различных факторов роста, которые способствуют пролиферации, миграции и дифференцировке клеток. Они также могут быть полезны, уменьшая нейровоспаление и способствуя выживанию нейронных клеток.
Одним из возможных преимущественных механизмов, которые трансплантированные клетки могут индуцировать в головном мозге, является высвобождение различных факторов роста, которые способствуют пролиферации, миграции и дифференцировке клеток. Они также могут быть полезны, уменьшая нейровоспаление и способствуя выживанию нейронных клеток.
Большим недостатком сегодняшних исследований терапии стволовыми клетками головного мозга являются сопутствующие заболевания, которые не учитываются во многих исследованиях. Фактически, одним из распространенных побочных эффектов, которые могут изменить результаты трансплантации стволовых клеток головного мозга, является старение, которое часто вызывает потерю нейронов, нарушение миелинизации и снижение уровня нейротрансмиттеров, что, в свою очередь, может привести к снижению пластичности мозга и нейрогенеза. . Исследования, проводимые на лабораторных животных, следует повторять и в условиях старения, так как большая часть терапии стволовыми клетками предназначена для людей, страдающих возрастными заболеваниями.
Существует также риск развития рака, который является общим риском для всех методов лечения на основе стволовых клеток. Стволовые клетки могут быть индуцированы к бесконтрольному размножению, особенно если они были плюрипотентными или подвергались длительному культивированию клеток (что может изменить их эпигенетический отпечаток). Более того, если бы вирусные векторы использовались для перепрограммирования этих клеток, они могли бы запускать онкогены и приводить к образованию опухолей. Также рискованно вводить стволовые клетки внутривенно, потому что они могут легко агрегировать, образуя эмболы, или попасть в легкие, селезенку или печень.
Трансплантацию стволовых клеток всегда следует проводить вместе с различными терапевтическими подходами, такими как введение факторов роста, которые индуцируют мобилизацию стволовых клеток и улучшают имплантацию, или прием статинов, которые снижают окислительный стресс в головном мозге и способствуют лучшему восприятию трансплантата. Все вирусы и клетки, используемые в процессе производства стволовых клеток, требуют высококачественных реагентов и тщательного генетического тестирования и тестирования на безопасность. Терапия стволовыми клетками — это футуристическая концепция, ставшая доступной в реальном мире благодаря огромным научным усилиям, предпринятым за последние десятилетия. Тем не менее, он по-прежнему считается передовым терапевтическим продуктом, особенно когда он содержит неклеточные компоненты, такие как каркасы или матрицы. Поэтому перед имплантацией пациентам требуется обширное тестирование и соблюдение правил.
Все вирусы и клетки, используемые в процессе производства стволовых клеток, требуют высококачественных реагентов и тщательного генетического тестирования и тестирования на безопасность. Терапия стволовыми клетками — это футуристическая концепция, ставшая доступной в реальном мире благодаря огромным научным усилиям, предпринятым за последние десятилетия. Тем не менее, он по-прежнему считается передовым терапевтическим продуктом, особенно когда он содержит неклеточные компоненты, такие как каркасы или матрицы. Поэтому перед имплантацией пациентам требуется обширное тестирование и соблюдение правил.
Тем не менее, нервные стволовые клетки подобны чистым холстам жизни, созданным природой, и возможности, которые они открывают, огромны. Например, их можно использовать для выращивания органоидов, тканей и полных органов, по крайней мере, теоретически.
МРТ-изображение головного мозга, показывающее область пациента с болезнью Альцгеймера.
getty
Мозговые заплаты: замена частей мозга
Другой известный мне ученый, работающий над этой темой, — Джин Хеберт. Его исследования сосредоточены на замене частей мозга органоидами, выращенными в лаборатории, для лечения заболеваний ЦНС. Но некоторые из перспективных технологий, появившихся в результате его исследований, могут быть расширены в будущем для более амбициозных проектов по трансплантации мозга.
Его исследования сосредоточены на замене частей мозга органоидами, выращенными в лаборатории, для лечения заболеваний ЦНС. Но некоторые из перспективных технологий, появившихся в результате его исследований, могут быть расширены в будущем для более амбициозных проектов по трансплантации мозга.
Мозг или церебральные органоиды представляют собой очень специфические культуры нервных клеток, которые были получены из индуцированных человеком культур плюрипотентных стволовых клеток, но с немного измененным протоколом. Выращенные сфероиды культур плюрипотентных стволовых клеток могут быть интегрированы в специальные солюбилизированные мембранные матрицы, которые могут поддерживать растущие клетки в трехмерной среде и, следовательно, производить органоиды. Несколько научных публикаций уже успешно показали, что такие культуры церебральных органоидов представляют собой разнообразные популяции нейронов и демонстрируют такие процессы, как развитие коры и миграция клеток. Они также выделяют свой собственный внеклеточный матрикс со многими физиологически значимыми компонентами, такими как гиалуроновая кислота, протеогликаны и различные функциональные ферменты.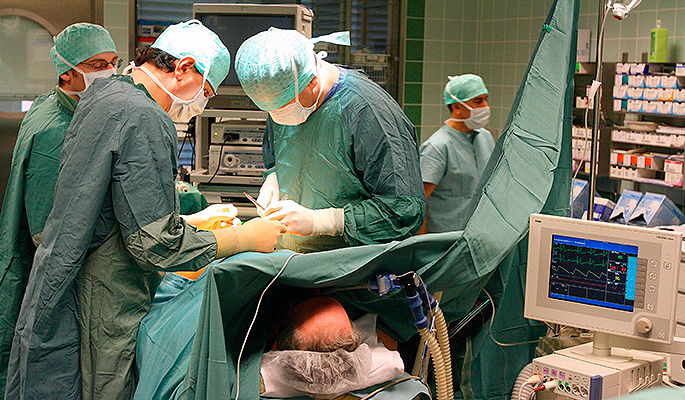
Церебральные органоиды полезны по многим причинам, первая из которых заключается в том, что они дают представление об этапах развития мозга, поскольку они могут расти от очень простых структур до более сложных. В дальнейшем их можно использовать для скрининга на наркотики, так как они растут и размножаются «довольно» быстро и просто. Эти свойства делают их прекрасными помощниками для скрининга лекарственных средств при разработке специализированных лекарств для лечения ряда заболеваний головного мозга. Одним из наиболее важных применений органоидов головного мозга является изучение и моделирование развития нейронов и метаболизма головного мозга при некоторых заболеваниях головного мозга, таких как болезни Альцгеймера, Паркинсона и Гентингтона. Например, церебральные органоиды можно вырастить из клеток кожи, взятых у пациентов, страдающих болезнью Альцгеймера, и с помощью генной инженерии превратить в нейрональные клетки. Хотя модели болезни Альцгеймера на мышах существуют, у них обычно не развивается полный спектр болезни, поэтому органоиды являются гораздо более точным выбором для изучения раннего начала и физиологии болезни. Такие культуры органоидов также можно выращивать на так называемых платформах «мозг-на-чипе», управлять которыми даже проще, чем органоидами. Эти платформы содержат многокамерные устройства слежения с засеянными совместными культурами астроцитов и нейронов. Наличие этих различных типов клеток в культуре перед их совместным выращиванием в одной камере позволяет ученым отслеживать, какие гены могут лежать в основе патологии и возможных физиологических изменений в моделях заболеваний. Церебральные органоиды могут предложить гораздо больше, чем экспериментальные исследования. Действительно, их также можно использовать в качестве трансплантатов для замены и восстановления поврежденных частей мозга пациента.
Такие культуры органоидов также можно выращивать на так называемых платформах «мозг-на-чипе», управлять которыми даже проще, чем органоидами. Эти платформы содержат многокамерные устройства слежения с засеянными совместными культурами астроцитов и нейронов. Наличие этих различных типов клеток в культуре перед их совместным выращиванием в одной камере позволяет ученым отслеживать, какие гены могут лежать в основе патологии и возможных физиологических изменений в моделях заболеваний. Церебральные органоиды могут предложить гораздо больше, чем экспериментальные исследования. Действительно, их также можно использовать в качестве трансплантатов для замены и восстановления поврежденных частей мозга пациента.
Японский ученый и новатор в области стволовых клеток Йошики Сасаи в 2008 году разработал первый мозговой органоид, но он не мог поддерживать себя из-за отсутствия сосудистой системы. Однако это только пошло на пользу. Недавно подход мозговых органоидов был использован в статье Bao et al. , где органоиды головного мозга, полученные из эмбриональных стволовых клеток, были внедрены с помощью игл в поврежденные части мозга мышей с тяжелым комбинированным иммунодефицитом, моделируемых корковым ударом. Привитые органоиды не только выживали, но и дифференцировались, проявляли электроактивность и удлиненные длинные сигнальные проекции. Кроме того, они способствовали восстановлению и васкуляризации тканей головного мозга, способности к обучению и памяти, а также уменьшали глиальное рубцевание. Исследование также подняло больше вопросов, например, насколько далеко могут зайти пересаженные трансплантаты с точки зрения восстановления травматического повреждения головного мозга и рубцевания, а также как улучшить выживаемость этих нервных стволовых клеток в мозге в будущем.
, где органоиды головного мозга, полученные из эмбриональных стволовых клеток, были внедрены с помощью игл в поврежденные части мозга мышей с тяжелым комбинированным иммунодефицитом, моделируемых корковым ударом. Привитые органоиды не только выживали, но и дифференцировались, проявляли электроактивность и удлиненные длинные сигнальные проекции. Кроме того, они способствовали восстановлению и васкуляризации тканей головного мозга, способности к обучению и памяти, а также уменьшали глиальное рубцевание. Исследование также подняло больше вопросов, например, насколько далеко могут зайти пересаженные трансплантаты с точки зрения восстановления травматического повреждения головного мозга и рубцевания, а также как улучшить выживаемость этих нервных стволовых клеток в мозге в будущем.
Исследования по внедрению нейральных стволовых клеток в мозг с целью восстановления повреждений на этом не закончились. Год спустя Рева и соавт. Медицинская школа Стэнфордского университета опубликовала исследование в журнале Nature, в котором они объясняют, как они улучшили способность церебральных органоидов связывать и интегрировать in vivo после того, как они трансплантировали органоиды коры головного мозга, полученные из стволовых клеток человека, в соматосенсорную кору новорожденных бестимусных крыс. . Органоиды были полностью выращены из нейральных стволовых клеток и введены в мозг крыс, по сути, слегка отодвигая реальный мозг немного в сторону, как объяснили авторы. Органоиды успешно выросли, протянули аксоны через мозг крысы и продемонстрировали активацию сигнала, причем с гораздо большей сложностью, чем органоиды, выращенные только в системы in vitro . Клетки человека и крысы связаны в слуховой, двигательной и соматосенсорной коре, а также в подкорковых областях, включая полосатое тело, таламус и гиппокамп, последний является областью, отвечающей за обучение, формирование памяти и сознания. Эти исследования предлагают возможность имплантации в живой мозг других нейронных клеток, таких как микроглия человека, эндотелиальные клетки человека и ГАМКергические интернейроны. Все это можно было бы использовать для изучения лечения повреждений головного мозга, формирования мозговых связей и этиологии заболеваний. Помимо болезней Альцгеймера и Паркинсона, можно было бы тщательно изучить многие другие, такие как аутизм, эпилепсия и шизофрения.
. Органоиды были полностью выращены из нейральных стволовых клеток и введены в мозг крыс, по сути, слегка отодвигая реальный мозг немного в сторону, как объяснили авторы. Органоиды успешно выросли, протянули аксоны через мозг крысы и продемонстрировали активацию сигнала, причем с гораздо большей сложностью, чем органоиды, выращенные только в системы in vitro . Клетки человека и крысы связаны в слуховой, двигательной и соматосенсорной коре, а также в подкорковых областях, включая полосатое тело, таламус и гиппокамп, последний является областью, отвечающей за обучение, формирование памяти и сознания. Эти исследования предлагают возможность имплантации в живой мозг других нейронных клеток, таких как микроглия человека, эндотелиальные клетки человека и ГАМКергические интернейроны. Все это можно было бы использовать для изучения лечения повреждений головного мозга, формирования мозговых связей и этиологии заболеваний. Помимо болезней Альцгеймера и Паркинсона, можно было бы тщательно изучить многие другие, такие как аутизм, эпилепсия и шизофрения.
Если бы мы могли трансплантировать нейронные клетки, мозговую ткань и мозговые органоиды в поврежденный или больной мозг, и если бы это сработало, могли бы мы сделать то же самое с целым мозгом или головой? Ответ может быть ближе, чем мы когда-либо ожидали.
(Оригинальная подпись) 24 сентября 1958 г. — Москва, Россия: Радио Москвы описало 24 сентября новое хирургическое … [+] устройство, которое сделало возможным пересадку головы щенка взрослой собаке. . На этом фото показана операция в процессе. Трансплантацию провел советский хирург Владимир Демихов в Московском медицинском институте. Эксперимент является частью исследовательского проекта, конечной целью которого является пересадка жизненно важных органов человека взамен тех, которые были повреждены без помощи врача.
Архив Беттманна
Трансплантация головы – это может быть ближе к реальности, чем вы думаете
Концепция трансплантации головы, технически называемая цефалосоматический анастомоз, потрясала СМИ в течение многих лет. От безумного ученого-трансплантолога Александра Беляева в 1925 году до Человека-гориллы с телом гориллы и головой человека, идея пересадки мозга всегда будоражила человеческое сознание. Он быстро распространился из письменного слова на киноэкран и привел к появлению популярных кинематографических произведений, таких как 1962-й «Мозг, который не умрет», более новый «Секретные материалы: Я хочу верить» 2008 года или самый новый под названием «Видоизмененный углерод».
От безумного ученого-трансплантолога Александра Беляева в 1925 году до Человека-гориллы с телом гориллы и головой человека, идея пересадки мозга всегда будоражила человеческое сознание. Он быстро распространился из письменного слова на киноэкран и привел к появлению популярных кинематографических произведений, таких как 1962-й «Мозг, который не умрет», более новый «Секретные материалы: Я хочу верить» 2008 года или самый новый под названием «Видоизмененный углерод».
Это не началось и не закончилось на большом экране или в литературе. Экспериментальные пересадки головы начались еще в 1908 году, когда французский хирург по имени Алексис Каррель и американский ученый по имени Чарльз Клод Гатри пересадили голову одной собаки другой, несмотря на то, что это оказалось в основном безуспешным. Собаки прошли еще одну серию экспериментов с советским хирургом по имени Владимир Демихов, который пересадил голову собаки и верхнюю часть туловища другой собаке в основном для того, чтобы показать, как соединяется кровоснабжение, но собакам удалось прожить почти месяц. На тот момент отторжение трансплантата было большой проблемой, которая была решена благодаря разработке иммунодепрессантов и методов трансплантации органов в середине 19-го века.00с. Еще одна серия экспериментов с собаками была проведена Робертом Дж. Уайтом в 1965 году, когда он пересаживал сосудистые системы изолированного собачьего мозга существующим собакам, но животные не выживали долго. Позже он также попытался соединить кровеносные сосуды противоположных голов обезьян друг с другом, но, хотя это частично сработало, произошло сильное свертывание крови и использование иммунодепрессантов, и животные не выжили. Его эксперименты подверглись широкой критике со стороны сообществ по защите прав животных за то, что они были очень жестокими и почти варварскими по отношению к животным, а Уайта называли «Доктором Уайтом». Мясник» или «Доктор. Франкенштейн». Это привело к прекращению испытаний на животных, по крайней мере, в области трансплантации головы крупных млекопитающих.
На тот момент отторжение трансплантата было большой проблемой, которая была решена благодаря разработке иммунодепрессантов и методов трансплантации органов в середине 19-го века.00с. Еще одна серия экспериментов с собаками была проведена Робертом Дж. Уайтом в 1965 году, когда он пересаживал сосудистые системы изолированного собачьего мозга существующим собакам, но животные не выживали долго. Позже он также попытался соединить кровеносные сосуды противоположных голов обезьян друг с другом, но, хотя это частично сработало, произошло сильное свертывание крови и использование иммунодепрессантов, и животные не выжили. Его эксперименты подверглись широкой критике со стороны сообществ по защите прав животных за то, что они были очень жестокими и почти варварскими по отношению к животным, а Уайта называли «Доктором Уайтом». Мясник» или «Доктор. Франкенштейн». Это привело к прекращению испытаний на животных, по крайней мере, в области трансплантации головы крупных млекопитающих.
Однако с 2012 года были предприняты некоторые усилия по трансплантации мозга на моделях мышей. Сяопин Рен, китайский хирург-ортопед, известный тем, что был частью команды, которая успешно провела первую пересадку руки, попытался пересадить голову мыши другой мыши, и пересаженные головы прожили около полугода. Чуть позже он отрезал мышам головы, но оставил стволы мозга соединенными, чтобы посмотреть, сможет ли он соединить сосудистые системы и доказать, что тела можно поддерживать в живых без жизнеобеспечения. Примерно в то же время итальянский нейрохирург Серджио Канаверо опубликовал протокол, в котором утверждалось, что он сделает возможной трансплантацию головы человека, что вызвало большой резонанс в СМИ и новостных агентствах. Позже Рен и Канаверо опубликовали обзор, в котором они обсудили различные стратегии защиты при пересадке головы, а также несколько протоколов для поддержания связи сосудистых систем и мозга при переохлаждении. Интересно, что они также предлагали использовать сероводород в качестве нейропротекторного средства и использовать кровезаменители.
Сяопин Рен, китайский хирург-ортопед, известный тем, что был частью команды, которая успешно провела первую пересадку руки, попытался пересадить голову мыши другой мыши, и пересаженные головы прожили около полугода. Чуть позже он отрезал мышам головы, но оставил стволы мозга соединенными, чтобы посмотреть, сможет ли он соединить сосудистые системы и доказать, что тела можно поддерживать в живых без жизнеобеспечения. Примерно в то же время итальянский нейрохирург Серджио Канаверо опубликовал протокол, в котором утверждалось, что он сделает возможной трансплантацию головы человека, что вызвало большой резонанс в СМИ и новостных агентствах. Позже Рен и Канаверо опубликовали обзор, в котором они обсудили различные стратегии защиты при пересадке головы, а также несколько протоколов для поддержания связи сосудистых систем и мозга при переохлаждении. Интересно, что они также предлагали использовать сероводород в качестве нейропротекторного средства и использовать кровезаменители.
В 2017 году Рен и Канаверо опубликовали работу о бицефальной модели трансплантации головы с перекрестным кровообращением для изучения долгосрочных последствий отторжения трансплантата и ограничения кровотока во время фазы переноса головы. С помощью сосудистых трансплантатов они соединили грудную аорту и верхнюю полую вену одной крысы с сонной артерией и экстракорпоральными венами другой крысы. Третью крысу использовали в качестве резервуара для крови, и ее сонная артерия и экстракраниальная вена были соединены с крысой-донором силиконовыми трубками до того, как крысе-донору была выполнена торакотомия. К силиконовым трубкам подсоединяли насос и нагревательное устройство для обеспечения регулярного кровоснабжения и предотвращения гипотермии мозга. После проведения операции по трансплантации у крысы-донора появились болевые и роговичные рефлексы, и операция открыла возможность для длительного выживания пациента. Это одна из новейших операций такого рода, потому что она значительно улучшает проблему ограниченного кровотока, которая была во всех операциях по пересадке мозга в самом начале этой области. Кроме того, поскольку в последние годы иммунотерапия была существенно модернизирована, сосудистые трансплантаты, выполняемые для соединения кровеносных сосудов донора и реципиента во время трансплантации головы, могут быть как раз тем, что отодвигает эту повестку дня в будущее.
С помощью сосудистых трансплантатов они соединили грудную аорту и верхнюю полую вену одной крысы с сонной артерией и экстракорпоральными венами другой крысы. Третью крысу использовали в качестве резервуара для крови, и ее сонная артерия и экстракраниальная вена были соединены с крысой-донором силиконовыми трубками до того, как крысе-донору была выполнена торакотомия. К силиконовым трубкам подсоединяли насос и нагревательное устройство для обеспечения регулярного кровоснабжения и предотвращения гипотермии мозга. После проведения операции по трансплантации у крысы-донора появились болевые и роговичные рефлексы, и операция открыла возможность для длительного выживания пациента. Это одна из новейших операций такого рода, потому что она значительно улучшает проблему ограниченного кровотока, которая была во всех операциях по пересадке мозга в самом начале этой области. Кроме того, поскольку в последние годы иммунотерапия была существенно модернизирована, сосудистые трансплантаты, выполняемые для соединения кровеносных сосудов донора и реципиента во время трансплантации головы, могут быть как раз тем, что отодвигает эту повестку дня в будущее. Конечно, как всегда, необходимы дополнительные эксперименты, но в 2017 году Рен провел первую в истории успешную операцию по пересадке головы трупу человека.
Конечно, как всегда, необходимы дополнительные эксперименты, но в 2017 году Рен провел первую в истории успешную операцию по пересадке головы трупу человека.
По их словам, хирургические этапы трансплантации головы следующие:
1. Одна хирургическая бригада оперирует донора, а другая – реципиента. Оба пациента находятся под полным наблюдением, а голова реципиента находится в условиях гипотермии. От донора в условиях гипотермии сохраняется только спинной мозг, что снижает кинетические скорости метаболических реакций и позволяет хирургам иметь больше времени для операций без распада тканей.
2. Подготовка шеи больных к операциям; трахея, пищевод и мышцы шеи отмечаются на каждой шее для дальнейшего использования, и подготавливаются сонные и позвоночные артерии. Гортанные нервы также перерезают и сохраняют на потом.
3. Голова реципиента отделяется, промывается и помещается на обезглавленное тело донора. Оба тела соединены трубками для сохранения кровообращения до окончания операции.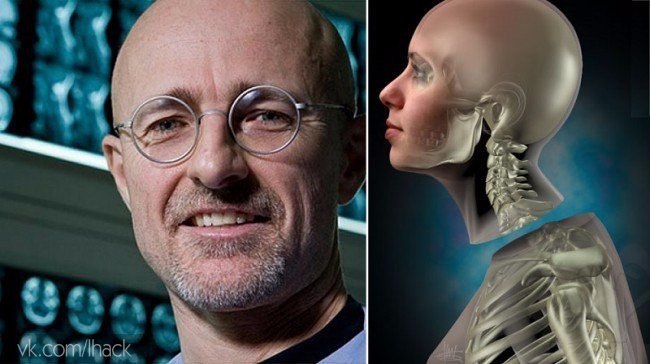 Спинной мозг прикрепляют полиэтиленгликолевым клеем, а соединенный мозг фиксируют швами. Полиэтиленгликоль также можно вводить в кровоток донора, чтобы способствовать лучшему слиянию нейронов.
Спинной мозг прикрепляют полиэтиленгликолевым клеем, а соединенный мозг фиксируют швами. Полиэтиленгликоль также можно вводить в кровоток донора, чтобы способствовать лучшему слиянию нейронов.
4. Сосудистые системы реципиента и донора соединяют через каротидную и яремную силиконовые канюли. Любой сосуд, который использовался для соединения пересаженной головы с телом донора, соединяется швами, при этом кровообращение донора обеспечивает кровоток через голову реципиента. Все остальные структуры шеи и горла повторно соединяются с шеей донора и стабилизируются. В конце все мышцы соединяются, а кожа сшивается. Когда операция завершена, пациента переводят в реанимацию.
Подобные научные процедуры всегда вызывали бурю негодования в средствах массовой информации и ставили множество этических дилемм. Первое чувство, которое возникает у людей, когда они слышат «пересадка головы» или «пересадка мозга», — это просто отвращение. Как ни странно, они не реагируют одинаково, когда слышат о пересадке печени или почек. Вполне возможно, что люди больше эмоционально связаны с трансплантацией мозга или лица, потому что они чувствуют, что это часть тела, которая делает человека тем, кто он есть, даже если человек не может функционировать без почек. Мы также не знаем, останется ли человек таким же, каким он был до операции по трансплантации, особенно если его мозг или голова просто присоединены к другому телу и учитывая тот факт, что мозг контролирует наши воспоминания, эмоции и реакции. Даже некоторые пациенты, перенесшие пересадку сердца, могли признать, что в них что-то изменилось после пересадки сердца другого человека; может быть, им начала нравиться еда или музыка, которые раньше им не нравились. Как обстоят дела с трансплантацией мозга, мы точно не знаем. Другой этической проблемой здесь является стоимость самой процедуры. Хирургия такого масштаба не может быть доступна среднему хирургу Джо и, скорее всего, будет доступна только богатым. Таким образом, использование всего тела человека для пересадки головы может лишить мир возможности использовать все донорские органы и спасти только одну жизнь вместо многих.
Вполне возможно, что люди больше эмоционально связаны с трансплантацией мозга или лица, потому что они чувствуют, что это часть тела, которая делает человека тем, кто он есть, даже если человек не может функционировать без почек. Мы также не знаем, останется ли человек таким же, каким он был до операции по трансплантации, особенно если его мозг или голова просто присоединены к другому телу и учитывая тот факт, что мозг контролирует наши воспоминания, эмоции и реакции. Даже некоторые пациенты, перенесшие пересадку сердца, могли признать, что в них что-то изменилось после пересадки сердца другого человека; может быть, им начала нравиться еда или музыка, которые раньше им не нравились. Как обстоят дела с трансплантацией мозга, мы точно не знаем. Другой этической проблемой здесь является стоимость самой процедуры. Хирургия такого масштаба не может быть доступна среднему хирургу Джо и, скорее всего, будет доступна только богатым. Таким образом, использование всего тела человека для пересадки головы может лишить мир возможности использовать все донорские органы и спасти только одну жизнь вместо многих.
Еще один важный и довольно сложный этический вопрос, который приходит на ум, — кто должен иметь право первым получить трансплантацию человеческой головы/мозга, и кто должен ее пожертвовать? Некоторые ученые согласны с тем, что идеальным реципиентом новой человеческой головы должен быть молодой и неизлечимо больной человек без повреждений головного мозга. Голова этого человека будет удалена и прикреплена к телу молодого человека с мертвым мозгом, чье тело в остальном функционально и здорово. Этот человек также должен соответствовать иммунотипу и росту реципиента. Операции у обоих пациентов будут проводиться одновременно, при этом оба тела будут находиться в условиях гипотермии и при этом будут контролироваться все физиологические функции.
До сих пор операции по пересадке головы на живых моделях животных не увенчались успехом, не говоря уже о людях. Протокол Серджио Канаверо о трансплантации головы и операция Рена по пересадке головы на трупе человека вызвали много опасений и дилемм у редакции научного издания American Journal of Bioethics (AJOB) — Neuroscience, особенно у главного редактора и профессора. биоэтики в Эмори, Пол Рут Вольпе. Вместе с директором программы нейроэтики Эмори Карен Роммельфангер Вольпе утверждал, что команда Канаверо будет проводить очень малоизученную и непроверенную операцию, которая может поставить под угрозу жизни пациентов, и все это без необходимого научного опыта, подкрепленного годами проведения экспериментальных процедур, безопасности. тестирование и контроль качества. Тем не менее, в ближайшем будущем кто-то в конце концов проведет операцию на людях, и этические соображения должны будут привести к некоторым руководящим принципам.
биоэтики в Эмори, Пол Рут Вольпе. Вместе с директором программы нейроэтики Эмори Карен Роммельфангер Вольпе утверждал, что команда Канаверо будет проводить очень малоизученную и непроверенную операцию, которая может поставить под угрозу жизни пациентов, и все это без необходимого научного опыта, подкрепленного годами проведения экспериментальных процедур, безопасности. тестирование и контроль качества. Тем не менее, в ближайшем будущем кто-то в конце концов проведет операцию на людях, и этические соображения должны будут привести к некоторым руководящим принципам.
Хотя этические последствия такой процедуры огромны, технологические ограничения таковы, что еще слишком рано думать об этике. Самым большим техническим ограничением, как и при любой трансплантации, остается иммунный ответ на новое «чужеродное» тело. Даже при увеличении числа и более частых трансплантаций органов, особенно трансплантации печени, отторжение все еще происходит очень часто, иногда даже через год после операции. Мозг также более специфичен и хрупок в том смысле, что ему необходим непрерывный кровоток для транспортировки питательных веществ и кислорода в орган и из него; повреждение может произойти очень быстро, если нормальный кровоток нарушен. Самая сложная проблема из всех, связанных с трансплантацией головного мозга, — это правильное соединение мозговых нервов с соответствующими спинномозговыми нервами и сохранение ствола мозга, который контролирует сердцебиение и дыхание, две важные жизненные функции. Разорванные аксоны должны быть должным образом механически выровнены, что потребует предельной точности во время процедуры. Кроме того, послеоперационный уход может оказаться даже более сложным, чем сама операция, поскольку пациенту придется пройти немедленную и интенсивную реабилитацию параплегии, возможно, длительную поддержку дыхания, мочевого пузыря, голосовых связок и коммуникативную терапию.
Мозг также более специфичен и хрупок в том смысле, что ему необходим непрерывный кровоток для транспортировки питательных веществ и кислорода в орган и из него; повреждение может произойти очень быстро, если нормальный кровоток нарушен. Самая сложная проблема из всех, связанных с трансплантацией головного мозга, — это правильное соединение мозговых нервов с соответствующими спинномозговыми нервами и сохранение ствола мозга, который контролирует сердцебиение и дыхание, две важные жизненные функции. Разорванные аксоны должны быть должным образом механически выровнены, что потребует предельной точности во время процедуры. Кроме того, послеоперационный уход может оказаться даже более сложным, чем сама операция, поскольку пациенту придется пройти немедленную и интенсивную реабилитацию параплегии, возможно, длительную поддержку дыхания, мочевого пузыря, голосовых связок и коммуникативную терапию.
Стереотаксическая нейрохирургическая операция, Больница Пастера 2, Ницца, Франция (Фото: BSIP/Universal . .. [+] Images Group через Getty Images)
.. [+] Images Group через Getty Images)
Universal Images Group через Getty Images
Старение мозга в молодом теле
Многие из недавних инициатив в области старения и долголетия включают переливание крови от молодых к пожилым здоровым субъектам, терапию стволовыми клетками и другие процедуры регенеративной медицины. Ни один из этих подходов не даст такого омолаживающего воздействия на мозг, как помещение его непосредственно в молодое тело. Многие теории болезни Альцгеймера и других форм деменции связаны с факторами, происходящими вне мозга. Таким образом, по сравнению со многими другими альтернативами, существует более высокая вероятность омоложения. Кроме того, единственный орган, о котором вам нужно думать в этой стратегии, — это мозг. Возможно, со временем удастся постепенно восстановить и заменить стареющие клетки мозга.
Концептуальное изображение мозга. (Фото: BSIP/Universal Images Group через Getty Images)
Universal Images Group через Getty Images
Сможем ли мы трансплантировать наш мозг в новые родовые тела? И если бы вы могли пересадить себя в новое тело, сделали бы вы это?
В то время как трансплантация мозга может быть дальше от реальности, чем трансплантация головы, так как есть еще много технологических барьеров, которые нужно преодолеть, и мы еще не знаем, как вырастить «бессознательных клонов», готовых к терапевтическому клонированию, но представьте на секунду, что вы мог бы сделать это.
Когда вы проводите мысленные эксперименты на эту тему, концепция пересадки мозга клону или пересадки головы кажется очень неудобной и странной. Поэтому я сначала спросил одного из моих хороших друзей, который управляет венчурным фондом, специализирующимся на возрастных заболеваниях, не подумает ли он когда-нибудь о пересадке своего мозга в клон «tabula rasa» без мозговой активности высшего порядка.
«Ты что, шутишь?», — сказал он. «Если эта технология доступна, зачем мне использовать клон? Вы только посмотрите на меня — я дерзкий еврейский парень. Я предпочел бы быть в теле 7-футового индийского парня-модели с шестью кубиками и двенадцатидюймовым репродуктивным органом»…
Поэтому я пошел еще дальше и провел опрос в Твиттере. И хотя большинство моих последователей занимаются биотехнологиями долголетия, я ожидал, что большинство людей вызовет отвращение и ужас от этой идеи. К моему удивлению, за 24 часа проголосовало 796 человек, из которых 70% проголосовали «за» и только 15% проголосовали «против». Указывает на высокий спрос на эту альтернативу.
Указывает на высокий спрос на эту альтернативу.
В заключение стоит отметить, что до сих пор, несмотря на многочисленные прорывы в технологиях, существует очень мало многообещающих фармакологических вмешательств, которые могут увеличить продолжительность жизни и здоровье человека. Кажется, что мы очень далеки от радикальных мер по увеличению продолжительности жизни. Трансплантация головы и трансплантация мозга клонам, находящимся в бессознательном состоянии, не требует от нас фундаментального понимания процессов старения и может быть жизнеспособным вариантом для дальнейшего исследования, поскольку большинство подходящих технологий уже могут быть доступны.
Подписывайтесь на меня в Twitter или LinkedIn. Посетите мой веб-сайт или другие мои работы здесь.
Настоящая проблема с трансплантацией головы человека
Гостевой пост: Майкл С. Добер, Массачусетс
* Примечание: эта статья публикуется в блоге практической этики.
В 2015 году Серджио Канаверо объявил, что к декабрю 2017 года он проведет терапевтическую процедуру трансплантации головы человеку. состояние остается нераскрытым. Ожидается, что процедура, заключающаяся в удалении головы пациента и прикреплении ее к обезглавленному донорскому телу, будет проведена в Китае, будет стоить десятки миллионов долларов и потребует участия десятков хирургов. Процедура снова привлекла внимание международной общественности на этой неделе, когда Канаверо объявил, что он успешно провел операцию на трупе человека, и сказал, что объявление официальной даты процедуры «неизбежно».
Медицинское сообщество громогласно заявило, что эта процедура чрезвычайно неэтична, учитывая нынешнее состояние наших медицинских технологий и непредвиденные последствия, которые такая процедура может иметь для пациента, если предположить, что пациент вообще выживет. Хотя Канаверо утверждает, что успешно провел операцию на животных и, совсем недавно, на трупе человека, в настоящее время не существует общепринятого метода слияния спинного мозга и регенерации нервных клеток, достаточно хорошего, чтобы контролировать донорское тело. В то время как Канаверо широко сообщал, что он использовал специальный раствор, чтобы совершить подвиг на животных, он не предоставил достаточно доказательств, чтобы удовлетворить строгость академического исследования, что вызывает серьезные сомнения в его результатах. Предоставленные им доказательства, в том числе фотографии и неоднозначные кадры, на которых собака прыгает с обмякшими лапами и подозрительной линией обесцвеченного меха у основания шеи, далеко не убедительны, и он вполне может убить своего пациента.
В то время как Канаверо широко сообщал, что он использовал специальный раствор, чтобы совершить подвиг на животных, он не предоставил достаточно доказательств, чтобы удовлетворить строгость академического исследования, что вызывает серьезные сомнения в его результатах. Предоставленные им доказательства, в том числе фотографии и неоднозначные кадры, на которых собака прыгает с обмякшими лапами и подозрительной линией обесцвеченного меха у основания шеи, далеко не убедительны, и он вполне может убить своего пациента.
Хотя это, безусловно, серьезные проблемы, реальная проблема с этой картиной связана с международными правилами: ни один из законов и политик, разработанных для защиты пациентов и субъектов исследования, не смог остановить их, Канаверо и Рен, и вряд ли они смогут это сделать. так.
Существует несколько всемирно известных этических документов, которые в совокупности запрещают опасные методы лечения и эксперименты. В области исследовательской этики Отчет Бельмонта, Нюрнбергский кодекс, Хельсинкская декларация и Международное этическое руководство Совета международных организаций медицинских наук (CIOMS) для биомедицинских исследований с участием человека призывают исследователей уважать автономию пациента и проводить только эксперименты. для которых существует разумная перспектива выгоды. В частности, Нюрнбергский кодекс возник в ответ на злоупотребления нацистских хирургов, которые во время Холокоста проводили ужасные эксперименты на принудительных субъектах в концентрационных лагерях, в том числе эксперименты, направленные на повторное прикрепление отрезанных частей тела. Точно так же клятва Гиппократа и многие традиционные формулировки медицинской этики побуждают клиницистов предлагать методы лечения, которые, вероятно, принесут пользу, превышающую любой возможный вред.
для которых существует разумная перспектива выгоды. В частности, Нюрнбергский кодекс возник в ответ на злоупотребления нацистских хирургов, которые во время Холокоста проводили ужасные эксперименты на принудительных субъектах в концентрационных лагерях, в том числе эксперименты, направленные на повторное прикрепление отрезанных частей тела. Точно так же клятва Гиппократа и многие традиционные формулировки медицинской этики побуждают клиницистов предлагать методы лечения, которые, вероятно, принесут пользу, превышающую любой возможный вред.
К сожалению, ни один из этих документов не имеет юридической силы. Во многих странах есть свои законы, основанные на этих документах. Например, в Соединенных Штатах 45 CFR 46, известный как «Общее правило», легализует положения доклада Бельмонта и обеспечивает конкретные институциональные и правовые механизмы для регулирования исследований и предотвращения экспериментов, таких как трансплантация головы человека. Наряду с институциональными наблюдательными советами, которые регулируют исследования на людях, большинство институциональных комитетов по уходу и использованию животных, вероятно, даже запретят эксперименты по пересадке головы животным.
Хотя законы многих стран обязывают научные исследования и медицинскую практику придерживаться общепринятой литературы по этике и документов по правам человека, таких как Всеобщая декларация прав человека, Нюрнбергский кодекс и Хельсинкская декларация, не все страны обязаны это делать. . Хуже того, нет никаких механизмов для предотвращения этих злоупотреблений в странах, где нет этих этических стандартов, а также для наказания тех, кто их нарушает.
Показательно, что Канаверо и Рен не выполняли и не будут выполнять свою работу в такой стране, как Соединенные Штаты, где правила проведения исследований и законы о врачебной халатности отражают международные документы по этике и дискурс прав человека, принятый такими организациями, как Организация Объединенных Наций. . Вместо этого он проведет первую операцию по трансплантации головы человека в Китае, стране, которая имеет историю принятия позиций по вопросам биоэтики, которые расходятся с наиболее общепринятыми концепциями медицинской и исследовательской этики. Например, есть веские доказательства того, что китайские учреждения занимались принудительным донорством органов у заключенных. Что касается исследований, то в то время как большинство стран не решались полностью изучить определенные виды стволовых клеток и методы генетического редактирования (совсем недавно — CRISPR) из-за этических соображений, китайская политика была гораздо более снисходительной. Другие страны могут настоятельно призвать Китай и другие страны, чей этический дискурс отличается от наиболее широко принятых стандартов, пересмотреть свою позицию, но нет никакого правового механизма, чтобы предотвратить злоупотребления или опасные эксперименты.
Например, есть веские доказательства того, что китайские учреждения занимались принудительным донорством органов у заключенных. Что касается исследований, то в то время как большинство стран не решались полностью изучить определенные виды стволовых клеток и методы генетического редактирования (совсем недавно — CRISPR) из-за этических соображений, китайская политика была гораздо более снисходительной. Другие страны могут настоятельно призвать Китай и другие страны, чей этический дискурс отличается от наиболее широко принятых стандартов, пересмотреть свою позицию, но нет никакого правового механизма, чтобы предотвратить злоупотребления или опасные эксперименты.
Серхио Канаверо, скорее всего, убьет своего пациента либо в ходе процедуры, либо в течение неопределенно долгого «периода восстановления», который последует. Медицинские эксперты и специалисты по биоэтике громогласно заявляют, что процедура неэтична и не должна выполняться. Но действительно спорным вопросом является потребность в сильных международных механизмах для предотвращения неэтичных медицинских исследований и методов лечения.
