3DNews Технологии и рынок IT. Новости на острие науки Учёные вырастили в лаборатории человечес… Самое интересное в обзорах 13.10.2022 [18:34], Павел Котов Учёные биотехнологического стартапа Cortical Labs вырастили в лабораторных условиях культуру (популяцию) клеток головного мозга человека и обучили их игре в Pong. Исследователи утверждают, что им впервые удалось продемонстрировать, что «мини-мозг» можно обучить выполнению конкретных задач. Источник изображения: Milad Fakurian / unsplash.com Культура из 800 тыс. клеток получила имя DishBrain — её подключили к системе, в которой была запущена компьютерная игра Pong. Посылаемые на нейроны электрические импульсы указывали положение мяча в игре, а клеточный массив в зависимости от поступающих данных перемещал виртуальную ракетку вверх и вниз. Учёные подчёркивают, что культура слишком примитивна, чтобы обрести полноценное сознание, однако её способностей достаточно для обучения игре в течение 5 минут. По истечении 20-минутной сессии игры в Pong клеточная популяция продемонстрировала улучшение навыков — по мнению авторов исследования, это указывает на реорганизацию клеток, развитие биологического массива и его значительную способность к обучению. DishBrain будет использоваться для изучения того, как на его когнитивные способности (способности играть в компьютерную игру) влияют алкоголь и различные препараты — учёные хотят понять, можно ли рассматривать эту культуру как замену человеческому мозгу. Не исключено, что в перспективе подобные органические фрагменты пригодятся для испытания методов лечения различных заболеваний вроде болезни Альцгеймера. Параллельно исследователи Стэнфордского университета (США) вырастили из стволовых клеток ткани человеческого мозга и имплантировали их новорожденным крысам. Источник: Если вы заметили ошибку — выделите ее мышью и нажмите CTRL+ENTER. Материалы по теме Постоянный URL: https://3dnews.ru/1075730/uchyonie-virastili-v-laboratorii-kletki-chelovecheskogo-golovnogo-mozga-i-obuchili-ih-igrat-v-pong Рубрики: Теги: ← В |
Ученые вырастили из стволовых клеток мини-мозг, на котором появились «глаза» — Газета.
 Ru
Ru
Ученые вырастили из стволовых клеток мини-мозг, на котором появились «глаза» — Газета.Ru | Новости
WP: соратники Трампа призвали его отложить объявление об участии в президентских…
04:43
В США назвали Трампа «неудачником» из-за результатов республиканцев…
04:39
В Госдуму внесут законопроект об индексации пенсий сотрудников НКО
04:38
Глава МАГАТЭ Гросси: переговоры Ирана с агентством прошли безрезультатно
04:34
Овечкин сравнялся со Шнайдером по количеству проведенных матчей в НХЛ
04:27
Торгпред США обсудил с вице-премьером Украины восстановление украинской экономики
04:19
Австрия пообещала выделить €10 млн на поддержку Украины ради «стабильности…
04:14
Вильфанд: морозы и снег придут в Москву 14 ноября
04:11
«Росгосстрах»: около 60% пользователей РФ получают страховые услуги…
04:09
Сериал HBO про войну во Вьетнаме «Сочувствующий» определился с актерским…
04:02
close
100%
Мини-мозг, выращенный в лаборатории из индуцированных плюрипотентных стволовых клеток, сумел спонтанно развить рудиментарные глазные структуры. Об этом сообщили германские ученые в статье в журнале Cell Stem Cell.
Об этом сообщили германские ученые в статье в журнале Cell Stem Cell.
На крошечных органоидах человеческого мозга, выращенных в чашках Петри в питательной среде, возникали пары так называемых глазных бокалов, соответствующие одному из этапов развития глаз у человеческих эмбрионов. Подобный эффект проявился у 73% органоидов из всех полученных 314. Этот эксперимент поможет ученым лучше понять процессы дифференциации глаз, а также, возможно, отыскать новые подходы к лечению глазных болезней в персонализированной медицине.
«Наша работа выявляет замечательную способность органоидов мозга генерировать примитивные сенсорные структуры, обладающие светочувствительными свойствами и содержащие те же типы клеток, что обнаруживаются в реальном организме, — утверждает нейробиолог Джей Гопалакришнан из Университетской клиники Дюссельдорфа в Германии. — Эти органоиды помогут нам изучить взаимодействия между мозгом и глазом во время развития эмбриона, позволят смоделировать врожденные заболевания глазной сетчатки, а также выращивать нужные типы клеток сетчатки для индивидуального тестирования лекарств и трансплантации».
Органоиды мозга — это, разумеется, не настоящий мозг, а лишь небольшие трехмерные структуры, выращенные из индуцированных плюрипотентных стволовых клеток — то есть из клеток, взятых у взрослых людей и преобразованных в стволовые клетки, которые обладают свойствами эмбриональных и способны развиться в самые разные типы живых тканей.
Подписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Чтобы сообщить об ошибке, выделите текст и нажмите Ctrl+Enter
Новости
Дзен
Telegram
Картина дня
Шойгу приказал отвести войска из Херсона на левый берег Днепра
По мнению Суровикина, на правом берегу возникла угроза «полной изоляции» российской группировки
Что известно о гибели замглавы Херсонской области Стремоусова
Врио главы Херсонской области Сальдо подтвердил гибель своего заместителя Стремоусова
Военная операция РФ на Украине. День 259-й
Онлайн-трансляция военной спецоперации РФ на Украине — 259-й день
Байден заявил, что США не давали Украине карт-бланш и не втянутся ради нее в мировую войну
Министр Лекорню: французская армия не способна участвовать в масштабных военных операциях
РИА Новости: скрытность связи ВС РФ повысят благодаря разведке НАТО
Началась подготовка к посланию Путина Федеральному собранию
Новости и материалы
WP: соратники Трампа призвали его отложить объявление об участии в президентских выборах
В США назвали Трампа «неудачником» из-за результатов республиканцев на выборах
В Госдуму внесут законопроект об индексации пенсий сотрудников НКО
Глава МАГАТЭ Гросси: переговоры Ирана с агентством прошли безрезультатно
Овечкин сравнялся со Шнайдером по количеству проведенных матчей в НХЛ
Торгпред США обсудил с вице-премьером Украины восстановление украинской экономики
Австрия пообещала выделить €10 млн на поддержку Украины ради «стабильности в Европе»
Вильфанд: морозы и снег придут в Москву 14 ноября
«Росгосстрах»: около 60% пользователей РФ получают страховые услуги онлайн
Сериал HBO про войну во Вьетнаме «Сочувствующий» определился с актерским составом
Россиянин сыграет на чемпионате мира по футболу в Катаре
Байден посчитал, что Россия и Китай не формируют альянс
Guardian: Арктике в ближайшие десятилетия грозит исчезновение льда в летние периоды
Фигурист Самсонов: Трусова сделала все возможное, но Олимпиаду выиграла Щербакова
На Уоррена Битти подали в суд за якобы принуждение к сексу с несовершеннолетней в 1973 году
CNBC: Евросоюз выступил едиными фронтом против американского закона о снижении инфляции
В Киеве предупредили о риске сокращения ВВП Украины из-за энергетических проблем
Reuters: Nissan сократит производство на заводе в США из-за нехватки полупроводников
Все новости
«Все еще может причинить много урона»: генсек НАТО заявил, что не стоит недооценивать Россию
Генсек НАТО заявил, что у России есть мощный военный потенциал
«Чтобы избежать конфронтации». Путин не поедет на саммит G20, пишет Bloomberg
Bloomberg: Лавров будет представлять Россию на саммите G20
Черная пятница. Как не стать жертвой интернет-мошенников в сезон распродаж
Эксперты перечислили пять мошеннических схем, которых стоит опасаться в «Черную пятницу»
Бороться с эгоизмом и разрушением семьи: о чем говорится в указе Путина о госполитике
Путин подписал указ об основах госполитики по укреплению традиционных ценностей
В одном ряду с Хрущевым и Януковичем. За что британского короля закидали яйцами
Короля Карла III с женой забросали яйцами в Йорке
Российские туристы летели в Мадрид и попали в Мардин. Но есть и другая версия
В российской туротрасли назвали фейком публикации о Мардине, Мадриде и русских туристах
Леди в черном. Звезды на премии CFDA Fashion Awards 2022
«Можно укомплектовать в течение месяца». Когда ракеты «Сармат» встанут на боевое дежурство
Генерал Есин сообщил, что ракеты «Сармат» уже произведены «в должном количестве»
Блогера Некоглая депортируют. Но не за пародию на пехотинца с гранатами
Суд постановил депортировать блогера Некоглая из России
Отхлестал человека букетом роз, станцевал в лосинах. Как прошел тур Киркорова в Казахстане
Менеджер и адвокат Киркорова объяснили, кого он отхлестал букетом роз на концерте
Пять дней или два года. В российские школы вернут начальную военную подготовку
Министр просвещения Кравцов: курсы по начальной военной подготовке школьников введут в 2023 году
Работал в КГБ, писал про «чекистский крюк». Скончался экс-глава ФСКН Виктор Черкесов
Первый руководитель ФСКН России Виктор Черкесов умер в Санкт-Петербурге
«Завтра вы проснетесь, мы будем в большинстве». Первые итоги выборов в США
NBC: республиканцы получают большинство мест в Палате представителей Конгресса
Марина Ярдаева
Битва за оценки. Как быть проигравшим?
Об аутсайдерах гонки за средний балл аттестата
Андрей Колесников
Что подумают «наверху»?
О четырех десятилетиях без Леонида Ильича
Георгий Бовт
Вам карцер или граммофон?
О том, как и зачем в России вытрезвляли
Алена Солнцева
Спасатель из киновселенной
О выставке «Балабанов» и один его незавершенный фильм
Дмитрий Воденников
Покой и селедка
О синем цвете Кузьмы Петрова-Водкина
—>
Читайте также
Найдена ошибка?
Закрыть
Спасибо за ваше сообщение, мы скоро все поправим.
Продолжить чтение
Что дальше для выращенных в лаборатории человеческих эмбрионов?
Это был 13-й день серии экспериментов в лаборатории Али Бриванлоу, и ему предстояла мучительная задача. Его команда биологов-эволюционистов разморозила десятки человеческих эмбрионов, поместила их в отдельные чашки для культивирования и наблюдала, как они растут на самых ранних стадиях развития — то, что когда-либо видели лишь несколько исследователей во всем мире. Но он знал, что это должно закончиться.
Эмбрионы вскоре столкнутся с правилом 14 дней, международным консенсусом в отношении того, что человеческие эмбрионы следует культивировать и выращивать в лаборатории только в течение 14 дней после оплодотворения. Примерно на 14-й день появляется примитивная полоса, структура, которая отмечает точку, в которой эмбрион устанавливает оси тела и начинает отличать голову от хвоста и левое от правого.
«Это было одно из самых трудных решений, которые мне приходилось принимать в своей жизни, но пришло время прекратить этот эксперимент», — говорит Бриванлоу, вспоминая исследование 2015 года в своей лаборатории в Рокфеллеровском университете в Нью-Йорке.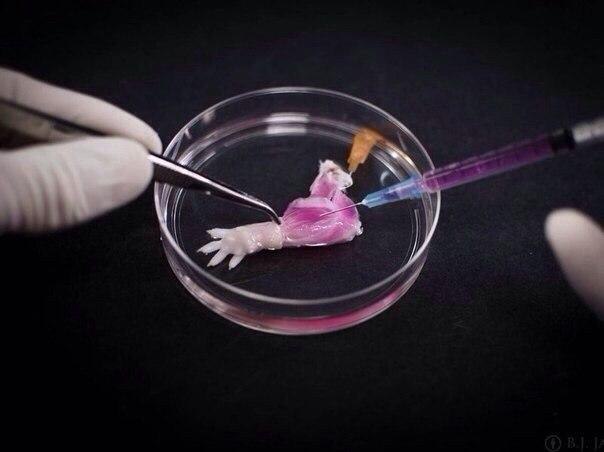 На 13-й день команда сняла эмбрионы со дна чашки и заморозила их, остановив дальнейшее развитие. «Мы не знали, что произойдет после этого момента», — говорит он.
На 13-й день команда сняла эмбрионы со дна чашки и заморозила их, остановив дальнейшее развитие. «Мы не знали, что произойдет после этого момента», — говорит он.
Теперь у Бриванлоу и других специалистов по биологии развития есть шанс это выяснить.
В мае Международное общество исследований стволовых клеток (ISSCR) опубликовало новые рекомендации 1 , которые ослабили правило 14 дней и убрали жесткий барьер. Хотя лишь несколько лабораторий по всему миру усовершенствовали методы, необходимые для культивирования человеческих эмбрионов до 14-го дня, наука быстро развивается. Смягченное правило позволяет группам лабораторий в странах, где это разрешено законом, обращаться к регулирующим органам за разрешением на продолжение исследований по истечении 14 дней. Такие исследования могли бы показать, что происходит во время развития человека после того, как эмбрион обычно имплантируется в матку, примерно через неделю после оплодотворения. Затем он проходит стадию, называемую гаструляцией, примерно между 14 и 22 днями, когда возникает основной паттерн тела и закладываются основы для образования органов.
Открытие окна на этих более поздних стадиях позволило бы ученым лучше понять почти одну треть невынашивания беременности и многочисленные врожденные дефекты, которые, как считается, возникают на этих этапах развития. Кроме того, эти стадии содержат ключи к разгадке того, как клетки дифференцируются в ткани и органы, что может способствовать развитию регенеративной медицины.
Большинство исследователей ожидают, что группа Бриванлоу и некоторые другие немедленно раздвинут технические границы выращивания человеческих эмбрионов в лаборатории на более длительные периоды. Те немногие группы, которые могут это сделать, находятся в жесткой конкуренции. В других странах для продвижения таких исследований необходимо изменить законы (см. «Снятие ограничений»). Некоторые исследователи в Китае, например, обсуждают, следует ли изменить свою национальную политику, которая в настоящее время отражает 14-дневный предельный срок, говорит Тяньцин Ли, эмбриолог из Куньминского университета науки и технологий.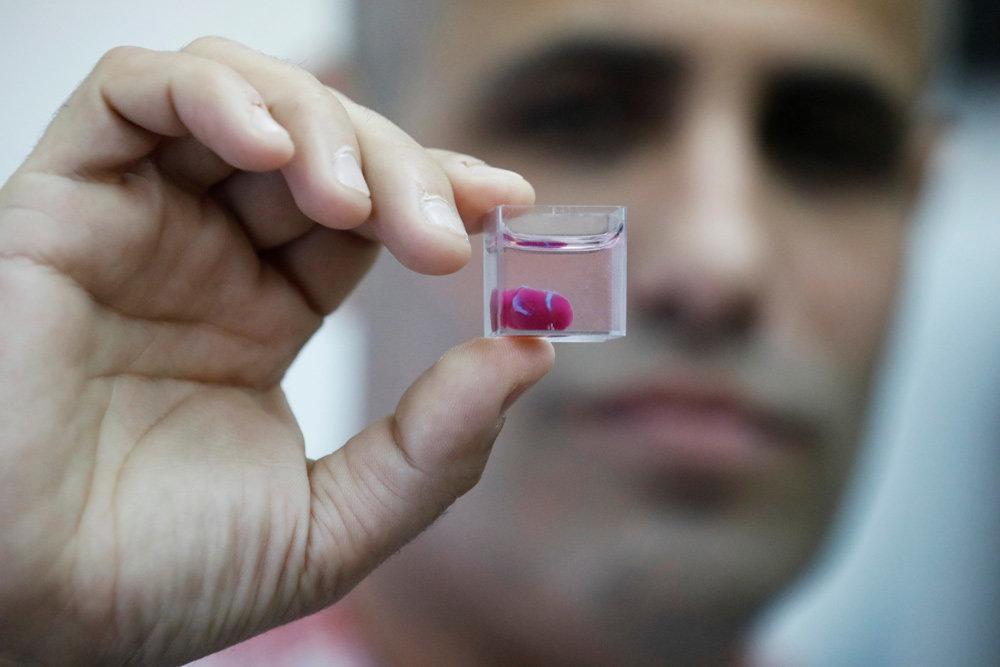
Авторы и права: Ник Спенсер/ Природа
Таким образом, исследователи пока не ожидают потока новых исследований после 14 дней — и не все они убеждены, что такие эксперименты оправданы. «Я с осторожностью отношусь к использованию человеческих эмбрионов в качестве самостоятельной исследовательской системы», — говорит Наоми Морис, специалист по биологии развития из Института Фрэнсиса Крика в Лондоне.
Чтобы обойти границы, исследователи за последние пять лет разработали множество моделей человеческих эмбрионов, большинство из которых сформированы из смесей стволовых клеток. Эти модели имитируют несколько, но кратких фаз раннего развития и могут быть созданы без использования дефицитных и этически небезопасных человеческих эмбрионов, пожертвованных людьми, перенесшими 9 лет.0019 лечение экстракорпорального оплодотворения (ЭКО) . Пока что правило 14 дней не применяется к этим моделям эмбрионов. Но по мере того, как они становятся более изощренными, с потенциалом формирования узнаваемых структур или даже органов, они попадают в свою собственную серую этическую зону.
Независимо от того, используют ли они модели или настоящие объекты, ученые говорят, что им предстоит еще многому научиться. «Эмбрионы — великие мастера», — говорит Николя Риврон, биолог по стволовым клеткам и эмбриолог из Института молекулярной биотехнологии Австрийской академии наук в Вене. «Это структуры, которые учат нас всему о том, как мы формируемся и как мы терпим неудачу».
Раздвигая границы
Правило 14 дней было впервые предложено в 1979 году, когда появилась технология ЭКО и человеческие эмбрионы впервые появились вне тела, хотя в то время максимальное время, в течение которого они могли выжить, составляло несколько дней. К 2006 году, когда ISSCR выпустила свой первый набор руководств по эмбриональным стволовым клеткам человека (ES-клетки), правило 14 дней прочно утвердилось в исследовательском сообществе.
Ограничение на выращенные в лаборатории человеческие эмбрионы, сбрасываемые телом стволовой клетки
Эти рекомендации были широко приняты исследователями и спонсорами по всему миру. В некоторых странах, включая Германию и Австрию, проведение любых исследований на человеческих эмбрионах является незаконным, а во многих других по закону установлен 14-дневный срок, например, в Великобритании, Китае, Японии, Австралии и Канаде. В некоторых странах, включая Соединенные Штаты и Израиль, существуют руководящие принципы, но нет закона, запрещающего или ограничивающего исследования человеческих эмбрионов, хотя в Соединенных Штатах они не могут финансироваться из федерального бюджета.
В некоторых странах, включая Германию и Австрию, проведение любых исследований на человеческих эмбрионах является незаконным, а во многих других по закону установлен 14-дневный срок, например, в Великобритании, Китае, Японии, Австралии и Канаде. В некоторых странах, включая Соединенные Штаты и Израиль, существуют руководящие принципы, но нет закона, запрещающего или ограничивающего исследования человеческих эмбрионов, хотя в Соединенных Штатах они не могут финансироваться из федерального бюджета.
Предыдущее обновление рекомендаций ISSCR вышло в 2016 году, как раз перед тем, как две исследовательские группы опубликовали прорывы.
Лаборатория Магдалены Зерницкой-Гетц в Кембриджском университете, Великобритания, начала работу по культивированию человеческих эмбрионов в течение семи дней в 2013 году. Группа хотела понять, что происходит после стадии бластоцисты или «клубка клеток». Ее группа разработала правильный рецепт гормонов и факторов роста, и в 2016 году ее команда 2 и Бриванлоу 3 сообщили, что они выращивали человеческие эмбрионы до 12–13 дней.
«Открытия, которые мы делаем, например, то, куда люди кладут голову в будущем, имеют большое значение», — говорит Зерницка-Гетц, которая теперь делит свое время между своей лабораторией в Соединенном Королевстве и лабораторией Калифорнийского технологического института в Пасадена. «Меня восхищают вторая, третья и четвертая недели развития, которые мы не можем увидеть с помощью УЗИ, но которые начинают развитие предшественников основных органов».
Один из вопросов касается того, как гены экспрессируются в клетках эмбриона по мере его роста. В одном из крупнейших на сегодняшний день исследований человеческих эмбрионов группа Церницкой-Гетц проанализировала 4820 одиночных клеток из 16 эмбрионов, развивающихся в лаборатории, начиная со стадии, когда эмбрион обычно имплантируется в матку (5-й день), и заканчивая подготовкой к гаструляции на следующий день. 11. Секвенирование одноклеточной РНК выявило, какие гены выключаются, а какие включаются при переходе эмбриональных клеток от тотипотентности, когда они еще могут стать любой клеткой в организме, к плюрипотентности — более дифференцированному состоянию 4 .
Хотя эти сигналы развития известны у мышей, это исследование является одним из первых, обнаруживших молекулы, лежащие в основе человеческого развития.
Выращенный в лаборатории человеческий эмбрион через десять дней после оплодотворения. Клетки, которые станут плодом, показаны фиолетовым цветом. Фото: Лаборатория Церницкой-Гетца, Кембриджский университет / Научная фототека
В других экспериментах, которые можно проводить только с человеческими эмбрионами в культуре, и Бриванлоу, и Зерницка-Гетц, и их группы проследили судьбу человеческих эмбрионов с анеуплоидными клетками. Это клетки с аномальным числом хромосом, что, как считается, вызывает до половины случаев потери беременности на ранних сроках.
Клиники ЭКО обычно проверяют всего несколько клеток эмбриона, чтобы проанализировать его генетическое здоровье. Но эксперименты показывают, что это может вводить в заблуждение. Группа Зерницкой-Гетц обнаружила, что эмбрионы, у которых диагностированы некоторые типы анеуплоидии, продолжают нормально развиваться в лаборатории 5 . Группа Бриванлоу проанализировала экспрессию генов у человеческих эмбрионов с 3-го по 14-й дни и обнаружила, что клетки с аномальным числом хромосом были элиминированы — возможно, путем развития в поддерживающие ткани или отбраковки в результате гибели клеток.0011 6 . Оба исследования предполагают, что тестирование на анеуплоидию, обычно проводимое на эмбрионах ЭКО, вероятно, приводит к тому, что многие эмбрионы ошибочно считаются «нездоровыми».
Группа Бриванлоу проанализировала экспрессию генов у человеческих эмбрионов с 3-го по 14-й дни и обнаружила, что клетки с аномальным числом хромосом были элиминированы — возможно, путем развития в поддерживающие ткани или отбраковки в результате гибели клеток.0011 6 . Оба исследования предполагают, что тестирование на анеуплоидию, обычно проводимое на эмбрионах ЭКО, вероятно, приводит к тому, что многие эмбрионы ошибочно считаются «нездоровыми».
Работа с человеческими эмбрионами необходима для этих открытий, говорит Бриванлоу. «Мы не можем узнать об этом иначе, как наблюдая, как это происходит», — говорит он. Он планирует эксперименты, некоторые из которых могут продлиться и после 14 дней, чтобы выяснить, как именно приспосабливается эмбрион, содержащий несколько анеуплоидных клеток.
Более двух недель
Исследователи, работающие с эмбрионами животных, уже культивировали их дольше, чем 14-дневный эквивалент развития, что может проложить путь к аналогичным достижениям в культивировании человеческих эмбрионов. В марте группа Джейкоба Ханны из Научного института Вейцмана в Реховоте, Израиль, удвоила время, в течение которого мышиные эмбрионы могут культивироваться в лаборатории 7 , с 5,5 до 11 дней (примерно эквивалентно человеческим дням с 13 по 30). Хотя другие исследователи описывают этот процесс как привередливый, эмбрионы хорошо идут в процесс развития органов.
В марте группа Джейкоба Ханны из Научного института Вейцмана в Реховоте, Израиль, удвоила время, в течение которого мышиные эмбрионы могут культивироваться в лаборатории 7 , с 5,5 до 11 дней (примерно эквивалентно человеческим дням с 13 по 30). Хотя другие исследователи описывают этот процесс как привередливый, эмбрионы хорошо идут в процесс развития органов.
И Бриванлоу, и Зерницка-Гетц планируют расширить границы культивирования человеческих эмбрионов, делая для людей то же, что команда Ханны сделала для мышей. Бриванлоу хочет разблокировать генетическую программу, которая превращает стволовые клетки в первые клетки мозга, а также хочет раскрыть молекулярные инструкции для четырехкамерного бьющегося сердца. Оба события возникают после 14-го дня, и их распутывание может оказаться ключом к пониманию нарушений развития нервной системы и распространенных врожденных пороков сердца.
Бриванлоу и другие исследователи говорят, что в будущем у исследователей появится техническая возможность наблюдать за имплантацией человеческого эмбриона в ткань матки в лаборатории. Его группа подает заявку в регулирующий комитет его университета с просьбой продлить свои исследования человеческих эмбрионов до 21-го дня. В эту дополнительную неделю устанавливается весь план тела, включая структуры, которые станут спинным мозгом, головным мозгом, костями, сердцем, кровью, мышцами. и лицо. «Я не знаю, сможем ли мы продвинуть человеческий эмбрион после 14-го дня», — говорит он. «Но как только мы доберемся туда, мы должны двигаться очень осторожно».
Его группа подает заявку в регулирующий комитет его университета с просьбой продлить свои исследования человеческих эмбрионов до 21-го дня. В эту дополнительную неделю устанавливается весь план тела, включая структуры, которые станут спинным мозгом, головным мозгом, костями, сердцем, кровью, мышцами. и лицо. «Я не знаю, сможем ли мы продвинуть человеческий эмбрион после 14-го дня», — говорит он. «Но как только мы доберемся туда, мы должны двигаться очень осторожно».
Модельные эмбрионы
У исследователей уже есть некоторые способы взглянуть на процесс гаструляции у млекопитающих, не используя настоящие эмбрионы, а создавая их модели из трехмерных смесей стволовых клеток.
За последние пять лет исследователи создали в лаборатории множество моделей эмбрионов, которые можно использовать для наблюдения за стадиями после 14-го дня. В большинстве случаев эти модели эмбрионов не подпадают под действие правила 14 дней или какой-либо специальной проверки. .
Эти модели эмбрионов, имитирующие стадию бластоцисты, были перепрограммированы из клеток кожи.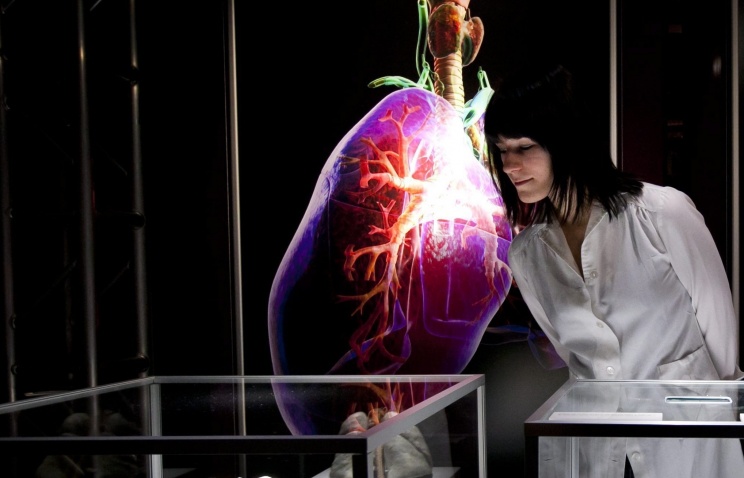 Фото: Университет Монаша
Фото: Университет Монаша
В 2017 году Цзяньпин Фу, инженер-биомедик из Мичиганского университета в Анн-Арборе, и его команда создали первую модель человеческого эмбриона, просто поместив ES-клетки в 3D-культуру, где они самоорганизовались, сформировав амниотический мешок, и первые признаки примитивной полосы 8 . Это открытие вызвало большой ажиотаж в этой области, говорит Фу. «То, что такие возможности существуют в человеческих ES-клетках — они поразительны».
Модели, подобные модели Фу, размножались и теперь могут имитировать части самых ранних эмбриональных стадий мыши и человека — имплантация 8 , гаструляция 9 , 10 и рудиментарные зачатки головного мозга 11 , спинного мозга 12 и развитие сердца. Например, Фу и другие создали человеческие нейрулоиды 12 , которые моделируют формирование предшественников спинного и головного мозга и, по словам Фу, помогут исследователям культивировать функциональные нейроны, которые однажды можно будет поместить в пациентов. Смеси клеток часто выглядят и ведут себя как эмбрионы на одной и той же стадии, но повторяют ли они молекулярные и клеточные события нормального развития, остается зияющим пробелом в знаниях.
Смеси клеток часто выглядят и ведут себя как эмбрионы на одной и той же стадии, но повторяют ли они молекулярные и клеточные события нормального развития, остается зияющим пробелом в знаниях.
Фу и другие признают, что по мере того, как модели человеческих эмбрионов формируют более сложные структуры и продвигаются дальше по временной шкале развития, они поднимают новые этические вопросы. Например, их нейроны могут начать срабатывать, а клетки сердца — биться. Или они могли бы приобрести потенциал для развития за пределами ограниченных стадий, которые они до сих пор имитировали. Большинству моделей не хватает полного набора поддерживающих жизнь тканей, которые им потребуются для формирования целого эмбриона, но за последние несколько лет несколько лабораторий сконструировали мышиные и человеческие модели стадии бластоцисты, называемые «бластоиды». Они содержат предшественники этих поддерживающих тканей и теоретически могут формировать весь организм 13 – 15 .
Выращенные в лаборатории структуры имитируют самые ранние стадии человеческого эмбриона
ISSCR внимательно следит за этой областью, и в его рекомендациях говорится, что модели, содержащие эти поддерживающие ткани, должны находиться под особым контролем и выращиваться в течение минимального времени, необходимого для достижения научной цели. По мере развития эти модели будут нуждаться в этическом пересмотре, говорит Робин Ловелл-Бэдж, биолог стволовых клеток из Института Фрэнсиса Крика, который возглавлял руководящий комитет ISSCR. «Очевидно, что за этим пространством нужно следить».
По мере того, как работа над реальными и модельными эмбрионами продвигается вперед, ученые стремятся узнать, насколько они похожи на самом деле. Выяснение того, как модели различаются в своих молекулярных деталях и как ведут себя их клетки, является основной причиной, по которой исследователи хотят выйти за рамки 14 дней в реальных эмбрионах. «Мы можем многому научиться на модели», — говорит Джесси Венвлит, специалист по биологии развития из Института молекулярно-клеточной биологии и генетики им. Макса Планка в Дрездене, Германия. «Но важно знать, где что-то идет не так».
Макса Планка в Дрездене, Германия. «Но важно знать, где что-то идет не так».
В 2020 году Морис и его коллеги провели параллельное сравнение экспрессии генов у мышиных эмбрионов и мышиных гаструлоидов и обнаружили поразительное сходство в синхронизированных волнах передачи сигналов, которые определяют план тела 16 . Она говорит, что точно такой же бенчмаркинг следует провести и для гаструлоидов человека, что потребует культивирования человеческих эмбрионов примерно до 21-го дня. Риврон предполагает молекулярные карты для каждой стадии человеческого развития.
После проведения достаточного количества бенчмаркинга исследователи могут сократить количество используемых человеческих эмбрионов, обращаясь к ним только при наличии веских оснований.
Остановите часы
Но как долго исследователи должны наблюдать за развитием человека в тарелке? Критики заявили, что со стороны ISSCR было безответственно ослаблять правило 14 дней, не давая исследователям новую точку остановки — что это дает видимость зеленого света для исследований эмбрионов.
Фу входил в комитет ISSCR, который разрабатывал новые рекомендации в течение 18 месяцев и провел более 100 встреч в Zoom. «Наука развивается так быстро, что научному сообществу было трудно нарисовать еще один знак «стоп», — говорит он. Вместо этого руководящие принципы оставили дверь открытой для проведения исследований до тех пор, пока происходят соответствующие процессы проверки.
Бриванлоу согласен с решением. «По совести я знаю, что есть большие преимущества в том, чтобы отодвинуть последние 14 дней», — говорит он, указывая на работу с аномальными хромосомами. «Это может буквально спасти жизнь следующему поколению». Он и Ловелл-Бэдж утверждают, что было бы неэтично не разрешить некоторые исследования после 14 дней, потому что они могли бы раскрыть, как возникают типы клеток органов и как происходят выкидыши и врожденные дефекты.
Также становится все более неясно, каким экспериментам и моделям следует присвоить тот же статус, что и исследованиям после 14-дневного эмбриона. Руководящие принципы ISSCR проводят четкое этическое разделение, помещая только модели, которые включают поддерживающие ткани — и которые теоретически имеют потенциал для полного развития — в ту же категорию, что и эмбрионы после 14 дней. (Руководящие принципы также запрещают перенос экспериментальных эмбрионов человека, химерных эмбрионов человека и животных или моделей человеческих эмбрионов в матку животного или человека.)
Руководящие принципы ISSCR проводят четкое этическое разделение, помещая только модели, которые включают поддерживающие ткани — и которые теоретически имеют потенциал для полного развития — в ту же категорию, что и эмбрионы после 14 дней. (Руководящие принципы также запрещают перенос экспериментальных эмбрионов человека, химерных эмбрионов человека и животных или моделей человеческих эмбрионов в матку животного или человека.)
Некоторые исследователи консервативно относятся к отмене 14-дневной линии. Морис, например, не думает, что у публики был реальный шанс оценить последствия 14-дневного эксперимента.
Специалист по биоэтике Жозефина Джонстон идет еще дальше: «Я думаю, что было бы ошибкой отказаться от правила 14 дней и не предложить другое правило». Предел свидетельствует о том, что научное сообщество понимает, что общество ценит человеческие эмбрионы и уважает это, говорит Джонстон, биоэтик из Гастингсского центра в Гаррисоне, Нью-Йорк. Снижение лимита «может по-настоящему подорвать общественное доверие». Кроме того, исследователям необходимо лучше объяснить, как изучение эмбрионов старше 14 дней «на самом деле может помочь человечеству», — говорит она. По словам Джонстона, они также должны заранее сообщать подробности исследований эмбрионов. «Многие из этих исследований кажутся очень далекими, но было бы небрежно не иметь каких-то ограничений».
Кроме того, исследователям необходимо лучше объяснить, как изучение эмбрионов старше 14 дней «на самом деле может помочь человечеству», — говорит она. По словам Джонстона, они также должны заранее сообщать подробности исследований эмбрионов. «Многие из этих исследований кажутся очень далекими, но было бы небрежно не иметь каких-то ограничений».
Ученые выращивают «синтетический» эмбрион с мозгом и бьющимся сердцем — без яйцеклеток и сперматозоидов
Естественные и синтетические эмбрионы рядом друг с другом демонстрируют сопоставимое формирование мозга и сердца. Предоставлено: Amadei and Handford
Ученые из Кембриджского университета создали модельные эмбрионы из стволовых клеток мыши, которые формируют мозг, бьющееся сердце и основу всех других органов тела. Он представляет собой новый путь для воссоздания первых этапов жизни.
Группа исследователей во главе с профессором Магдаленой Церницкой-Гетц разработала модель эмбриона без яйцеклеток и сперматозоидов. Вместо этого они использовали стволовые клетки — основные клетки организма, которые могут развиваться почти в любой тип клеток в организме.
Вместо этого они использовали стволовые клетки — основные клетки организма, которые могут развиваться почти в любой тип клеток в организме.
«Просто невероятно, что мы зашли так далеко. Это было мечтой нашего сообщества в течение многих лет и основным направлением нашей работы в течение десятилетия, и, наконец, мы это сделали». — Magdalena Zernicka-Goetz
Направляя три типа стволовых клеток, обнаруженных в раннем развитии млекопитающих, до момента, когда они начинают взаимодействовать, исследователи имитировали естественные процессы в лаборатории. Ученым удалось заставить стволовые клетки «разговаривать» друг с другом, индуцируя экспрессию определенного набора генов и создавая уникальную среду для их взаимодействия.
Стволовые клетки самоорганизовались в структуры, которые прошли через последовательные стадии развития, пока у них не появилось бьющееся сердце и основы мозга. У них также был желточный мешок, в котором эмбрион развивается и получает питательные вещества в первые недели своего существования. В отличие от других синтетических эмбрионов, модели, разработанные в Кембридже, достигли точки, когда начал развиваться весь мозг, включая переднюю часть. Это еще один этап развития, который был достигнут в любой другой модели, полученной из стволовых клеток.
В отличие от других синтетических эмбрионов, модели, разработанные в Кембридже, достигли точки, когда начал развиваться весь мозг, включая переднюю часть. Это еще один этап развития, который был достигнут в любой другой модели, полученной из стволовых клеток.
По словам команды, их результаты могут помочь исследователям понять, почему одни эмбрионы терпят неудачу, а другие развиваются в здоровую беременность. Кроме того, результаты могут быть использованы для руководства восстановлением и разработкой синтетических органов человека для трансплантации. Об исследовании, которое является результатом более чем десятилетнего исследования, которое постепенно приводило к созданию все более и более сложных эмбрионоподобных структур, было сообщено 25 августа 2022 года в журнале Nature .
Естественные и синтетические эмбрионы рядом друг с другом демонстрируют сопоставимое формирование мозга и сердца. Кредит: Амадей и Хэндфорд
«У нашей модели эмбриона мыши развивается не только мозг, но и бьющееся сердце, все компоненты, из которых состоит тело», — говорит Зерницка-Гетц, профессор кафедры развития млекопитающих и биологии стволовых клеток Кембриджского отделения физиологии. , Развитие и неврология. «Просто невероятно, что мы зашли так далеко. Это было мечтой нашего сообщества в течение многих лет и основным направлением нашей работы в течение десятилетия, и, наконец, мы это сделали».
, Развитие и неврология. «Просто невероятно, что мы зашли так далеко. Это было мечтой нашего сообщества в течение многих лет и основным направлением нашей работы в течение десятилетия, и, наконец, мы это сделали».
«Диалог» между тканями, из которых сформируется эмбрион, и тканями, которые соединят эмбрион с матерью, необходим для здорового развития человеческого эмбриона. Три разных типа стволовых клеток начинают формироваться в первую неделю после оплодотворения; один из них в конечном итоге разовьется в ткани тела, а два других поддерживают развитие эмбриона. Одним из этих внеэмбриональных типов стволовых клеток станет плацента, которая соединяет плод с матерью и обеспечивает кислородом и питательными веществами. Второй — желточный мешок, где растет эмбрион и откуда он получает питательные вещества на раннем этапе развития.
Многие беременности прерываются в тот момент, когда три типа стволовых клеток начинают посылать друг другу механические и химические сигналы, указывающие эмбриону, как правильно развиваться.
«Примерно в это время так много беременностей прерывается, прежде чем большинство женщин осознают, что они беременны», — сказала Зерницка-Гетц, которая также является профессором биологии и биологической инженерии в Калифорнийском технологическом институте. «Этот период является основой для всего остального, что следует за беременностью. Если что-то пойдет не так, беременность прервется».
Профессор Зерницка-Гетц в лаборатории. Предоставлено: Кембриджский университет
Группа профессора Зерницкой-Гетц в Кембридже изучала эти самые ранние стадии беременности в течение последнего десятилетия, чтобы понять, почему некоторые беременности заканчиваются неудачно, а некоторые успешно.
«Модель эмбриона из стволовых клеток важна, потому что она дает нам доступ к развивающейся структуре на стадии, которая обычно скрыта от нас из-за имплантации крошечного эмбриона в матку матери», — сказала Зерницка-Гетц. «Эта доступность позволяет нам манипулировать генами, чтобы понять их роль в развитии в модельной экспериментальной системе».
Чтобы управлять развитием своего синтетического эмбриона, ученые объединили культивированные стволовые клетки, представляющие каждый из трех типов тканей, в правильных пропорциях и среде, чтобы способствовать их росту и взаимодействию друг с другом, в конечном итоге самосборке в эмбрион.
Исследовательская группа обнаружила, что экстраэмбриональные клетки передают сигналы эмбриональным клеткам химическими сигналами, а также механически, или через прикосновение, направляя развитие эмбриона.
«Этот период человеческой жизни настолько загадочен, что иметь возможность увидеть, как это происходит в чашке — получить доступ к этим отдельным стволовым клеткам, понять, почему так много беременностей терпит неудачу и как мы могли бы предотвратить это от происходящее — совершенно особенное», — сказала Зерницка-Гетц. «Мы посмотрели на диалог, который должен был происходить между различными типами стволовых клеток в то время — мы показали, как это происходит и как это может пойти не так».
Важным достижением в исследовании является возможность генерировать весь мозг, в частности переднюю часть, что было главной целью при разработке синтетических эмбрионов. Это работает в системе Церницкой-Гетца, потому что эта часть мозга нуждается в сигналах от одной из внеэмбриональных тканей, чтобы иметь возможность развиваться. Команда предположила, что это может происходить из их исследований 2018 и 2021 годов, в которых использовались одни и те же составляющие клетки для развития в эмбрионы на несколько более ранней стадии. Теперь, продвинув разработку всего на один день вперед, они могут с уверенностью сказать, что их модель является самой первой, которая сигнализирует о развитии переднего и, по сути, всего мозга.
«Это открывает новые возможности для изучения механизмов развития нервной системы в экспериментальной модели», — сказала Зерницка-Гетц. «На самом деле, мы демонстрируем доказательство этого принципа в статье, отключая ген, который, как уже известно, необходим для формирования нервной трубки, предшественника нервной системы, а также для развития мозга и глаз. В отсутствие этого гена синтетические эмбрионы обнаруживают в точности известные дефекты развития мозга, как и у животных, несущих эту мутацию. Это означает, что мы можем начать применять такой подход ко многим генам с неизвестной функцией в развитии мозга».
В отсутствие этого гена синтетические эмбрионы обнаруживают в точности известные дефекты развития мозга, как и у животных, несущих эту мутацию. Это означает, что мы можем начать применять такой подход ко многим генам с неизвестной функцией в развитии мозга».
В то время как текущее исследование проводилось на моделях мышей, исследователи разрабатывают аналогичные человеческие модели, которые потенциально могут быть направлены на создание определенных типов органов, чтобы понять механизмы, лежащие в основе важнейших процессов, которые иначе было бы невозможно изучить на реальных эмбрионах. В настоящее время британское законодательство разрешает исследовать человеческие эмбрионы в лаборатории только до 14 дня развития.
Если методы, разработанные командой Церницкой-Гетц, окажутся успешными в отношении стволовых клеток человека в будущем, их также можно будет использовать для разработки синтетических органов для пациентов, ожидающих трансплантации.
«В мире так много людей, которые годами ждут пересадки органов», — сказала Зерницка-Гетц. «Что делает нашу работу такой увлекательной, так это то, что полученные в результате знания можно использовать для выращивания правильных синтетических человеческих органов, чтобы спасти жизни, которые в настоящее время потеряны. Также должна быть возможность воздействовать на органы взрослого человека и лечить их, используя имеющиеся у нас знания о том, как они устроены.
«Что делает нашу работу такой увлекательной, так это то, что полученные в результате знания можно использовать для выращивания правильных синтетических человеческих органов, чтобы спасти жизни, которые в настоящее время потеряны. Также должна быть возможность воздействовать на органы взрослого человека и лечить их, используя имеющиеся у нас знания о том, как они устроены.
«Это невероятный шаг вперед, на который ушло 10 лет напряженной работы многих членов моей команды — я никогда не думал, что мы доберемся до этого места. Никогда не думаешь, что твои мечты сбудутся, но они сбылись».
Профессор Магдалена Зерницка-Гетц совершила невероятный научный прорыв.
Создание синтетических эмбрионов мыши в пробирке, у которых развивается мозг и бьющееся сердце, начиная только с эмбриональных стволовых клеток, является кульминацией десятилетней работы.
Магда объясняет:
Меня завораживает тайна работы эмбрионов. Каждый эмбрион следует подобному пути: одна клетка становится многими, затем они взаимодействуют друг с другом и образуют структуру, которая станет образцом для всех частей тела взрослого человека. Но как клетки эмбриона решают свою судьбу, откуда они знают, куда идти и что делать? Как они формируют нужные части в нужном месте в нужное время?
Но как клетки эмбриона решают свою судьбу, откуда они знают, куда идти и что делать? Как они формируют нужные части в нужном месте в нужное время?
Создание первых моделей «синтетических эмбрионов» было процессом, который мы вели шаг за шагом. С самого начала мы знали, что эмбриональные стволовые клетки можно бесконечно долго культивировать в лаборатории, и что когда их вводят эмбриону, они потенциально могут вносить вклад в любую ткань взрослого организма. Задача состояла в том, чтобы помочь им развиться в полный эмбрион. В дополнение к эмбриональным стволовым клеткам мы использовали два вида внеэмбриональной ткани: одна из них образует плаценту, а другая — мешок, в котором развивается эмбрион. Эти ткани очень важны, так как они посылают эмбриону сигналы для развития всех его частей в нужное время и в нужном месте.
Легче сказать, чем сделать, объединить стволовые клетки, представляющие каждый из этих трех типов тканей. Нам нужно было найти среду, в которой все три различных типа клеток могли бы расти и общаться друг с другом. И нам нужно было найти правильные пропорции каждого типа клеток и добавить их в правильной последовательности. Как только мы установили эти основные принципы, стволовые клетки сделали все остальное: они самоорганизовались, чтобы пройти через последовательные стадии развития, пока у них не появилось бьющееся сердце и основа для мозга.
И нам нужно было найти правильные пропорции каждого типа клеток и добавить их в правильной последовательности. Как только мы установили эти основные принципы, стволовые клетки сделали все остальное: они самоорганизовались, чтобы пройти через последовательные стадии развития, пока у них не появилось бьющееся сердце и основа для мозга.
Ключом к нашим достижениям было нестандартное мышление. Большинство исследований на моделях эмбрионов фокусируются на эмбриональных стволовых клетках, но не учитывают значительную роль внеэмбриональных клеток. Мы смешали в правильных пропорциях как эмбриональные, так и внеэмбриональные стволовые клетки. Внеэмбриональные клетки подают сигналы эмбриональным клеткам различными способами, химическими сигналами, а также механическим «осязанием». Наши исследования помогают понять эти сигнальные события.
Мы разрабатываем аналогичную модель человеческого эмбриона, чтобы понять механизмы важнейших процессов, которые иначе было бы невозможно изучить. Это важно, потому что подавляющее большинство человеческих беременностей прерывается на этой стадии развития по причинам, которые мы не понимаем. Это также позволит выявить факторы, обеспечивающие развитие здоровых тканей человека, образующих различные органы.
Это важно, потому что подавляющее большинство человеческих беременностей прерывается на этой стадии развития по причинам, которые мы не понимаем. Это также позволит выявить факторы, обеспечивающие развитие здоровых тканей человека, образующих различные органы.
Создание нового «синтетического эмбриона» многому нас научило о механизмах, с помощью которых эмбрион строится. Мы узнали, как экстраэмбриональные ткани направляют эмбриональные стволовые клетки по правильным путям, сигнализируя о формировании правильных структур; как клетки перемещаются между отсеками по мере возникновения многослойного плана тела; и как это правильно создает сцену для нейруляции — процесса, при котором ткань складывается, образуя нервную трубку и, в свою очередь, головной и спинной мозг.
Эта модель дает нам доступ к развивающейся структуре на стадии, которая обычно скрыта от нас, когда крошечный эмбрион имплантируется в матку матери. Нашей модели не нужно имплантировать для развития, поэтому она остается полностью видимой для нас, что позволяет нам видеть продвижение эмбриона на этой стадии развития. Эта доступность позволяет нам манипулировать генами, чтобы понять их роль в развитии в модельной экспериментальной системе.
Эта доступность позволяет нам манипулировать генами, чтобы понять их роль в развитии в модельной экспериментальной системе.
Безусловно, выполнение такой работы требует страсти и упорства. Я вырос в Польше при коммунистическом режиме, а это означало, что путешествовать было запрещено, а думать по-другому не поощрялось. Было огромное социальное давление, и многие из нас восстали против этого. Серебряной подкладкой этого было желание мыслить независимо и упорствовать, несмотря на уныние. Это тоже сформировало меня как ученого.
Когда я основал свою исследовательскую группу в Кембридже, я разработал способы изучения «черного ящика развития» — развития эмбриона во время имплантации. Мои наставники отговаривали меня заниматься этим во время моей докторской диссертации, потому что они были обеспокоены тем, что будет трудно излучать свет внутри этой «коробки». и, дюйм за дюймом, мы продвигались вперед.
Мой совет всем молодым ученым: слушайте свое сердце. Изучите тему, которая вас вдохновляет, и выберите консультанта, который сможет поддержать ваш стиль работы. На мой взгляд, важно направлять молодых ученых в лаборатории, а также давать им возможность исследовать свою индивидуальность. Мой опыт показывает, что проблемы для женщин-ученых возрастают по мере их продвижения по карьерной лестнице. На более поздних этапах очень важно иметь наставников, которые разбираются не только в науке, но и в том, как сбалансировать ее с повседневной жизнью, в том числе с созданием семьи.
На мой взгляд, важно направлять молодых ученых в лаборатории, а также давать им возможность исследовать свою индивидуальность. Мой опыт показывает, что проблемы для женщин-ученых возрастают по мере их продвижения по карьерной лестнице. На более поздних этапах очень важно иметь наставников, которые разбираются не только в науке, но и в том, как сбалансировать ее с повседневной жизнью, в том числе с созданием семьи.
Во время моей собственной беременности я была потрясена, когда ранний скрининг показал аномалии. Забор был внеэмбриональных клеток, поэтому я дождалась амниоцентеза, во время которого берутся эмбриональные клетки, попавшие в амниотическую жидкость. Это было нормально, что меня успокоило. Этот опыт привел меня к изучению мозаичной анеуплоидии — состояния, при котором эмбрион имеет клетки с неправильным числом хромосом наряду с хромосомно нормальными клетками. Невероятно, но мы обнаружили, что эти аномальные клетки можно устранить, а нормальные, здоровые клетки компенсируют их отсутствие. Почему-то этот механизм не работает в тканях, из которых строится плацента, и мы до сих пор пытаемся понять, почему и как.
Почему-то этот механизм не работает в тканях, из которых строится плацента, и мы до сих пор пытаемся понять, почему и как.
Наука требовательна, это тяжелая работа, которая отнимает у вас большую часть времени бодрствования. Переключаюсь на просмотр фильмов — смотрю много зарубежных фильмов на польском, французском, датском, документальных и художественных. Но когда я хочу раствориться в другом повествовании, я смотрю дорамы. Я также недавно обратился к садоводству, где я могу способствовать успешному развитию других форм жизни!
Невероятное чувство и привилегия иметь прямое представление о происхождении новой жизни. Это как открытие новой планеты, о существовании которой мы не знали.
Для получения дополнительной информации об этом исследовании см. Ученые выращивают «синтетический» эмбрион мыши с мозгом и бьющимся сердцем.
Ссылка: «Искусственные эмбрионы завершают гаструляцию до нейруляции и органогенеза» Джанлука Амадей, Шарлотта Э. Хэндфорд, Ченгсян Цю, Иоахим Де Йонге, Ханна Гринфельд, Мартин Тран, Бет К.

 При попадании мяча в ракетку DishBrain получал сильный импульс обратной связи, а при промахе он был слабым и имел случайное значение.
При попадании мяча в ракетку DishBrain получал сильный импульс обратной связи, а при промахе он был слабым и имел случайное значение. Эти так называемые мозговые органоиды смогли интегрироваться с собственным мозгом грызунов, а через несколько месяцев было обнаружено, что органоиды заняли около трети обоих полушарий мозга крыс, взаимодействуя с их собственными мозговыми тканями. Такие органоиды смогут использоваться для изучений нейродегенеративных заболеваний и испытания препаратов для лечения нейро-психических патологий. Учёные также хотят посмотреть, как генетические дефекты органоидов повлияют на поведение животных.
Эти так называемые мозговые органоиды смогли интегрироваться с собственным мозгом грызунов, а через несколько месяцев было обнаружено, что органоиды заняли около трети обоих полушарий мозга крыс, взаимодействуя с их собственными мозговыми тканями. Такие органоиды смогут использоваться для изучений нейродегенеративных заболеваний и испытания препаратов для лечения нейро-психических патологий. Учёные также хотят посмотреть, как генетические дефекты органоидов повлияют на поведение животных.