Содержание
История открытия электромагнитных волн
Открытие электромагнитных волн — замечательный пример взаимодействия эксперимента и теории. На нем видно, как физика объединила, казалось бы, абсолютно разнородные свойства — электричество и магнетизм, — обнаружив в них различные стороны одного и того же физического явления — электромагнитного взаимодействия. На сегодня это одно из четырех известных фундаментальных физических взаимодействий, к числу которых также относятся сильное и слабое ядерные взаимодействия и гравитация. Уже построена теория электрослабого взаимодействия, которая с единых позиций описывает электромагнитные и слабые ядерные силы. Имеется и следующая объединяющая теория — квантовая хромодинамика — которая охватывает электрослабое и сильное взаимодействия, но ее точность несколько ниже. Описать все фундаментальные взаимодействия с единых позиций пока не удается, хотя в этом направлении ведутся интенсивные исследования в рамках таких направлений физики, как теория струн и квантовая гравитация.
Электромагнитные волны были предсказаны теоретически великим английским физиком Джеймсом Кларком Максвеллом (вероятно, впервые в 1862 году в работе «О физических силовых линиях», хотя подробное описание теории вышло в 1867 году). Он прилежно и с огромным уважением пытался перевести на строгий математический язык немного наивные картинки Майкла Фарадея, описывающие электрические и магнитные явления, а также результаты других ученых. Упорядочив одинаковым образом все электрические и магнитные явления, Максвелл обнаружил ряд противоречий и отсутствие симметрии. Согласно закону Фарадея переменные магнитные поля порождают электрические поля. Но не было известно, порождают ли переменные электрические поля — магнитные. Избавиться от противоречия и восстановить симметрию электрического и магнитного полей Максвеллу удалось, введя в уравнения дополнительный член, который описывал возникновение магнитного поля при изменении электрического. К тому времени благодаря опытам Эрстеда уже было известно, что постоянный ток создает вокруг проводника постоянное магнитное поле. Новый член описывал другой источник магнитного поля, но его можно было представить как некий воображаемый электрический ток, который Максвелл назвал током смещения, чтобы отличить от обычного тока в проводниках и электролитах — тока проводимости. В итоге получилось, что переменные магнитные поля порождают электрические поля, а переменные электрические — магнитные. И тогда Максвелл понял, что в такой связке колеблющиеся электрическое и магнитное поля могут отрываться от порождающих их проводников и двигаться через вакуум с определенной, но очень большой скоростью. Он вычислил эту скорость, и она оказалась около трехсот тысяч километров в секунду.
Новый член описывал другой источник магнитного поля, но его можно было представить как некий воображаемый электрический ток, который Максвелл назвал током смещения, чтобы отличить от обычного тока в проводниках и электролитах — тока проводимости. В итоге получилось, что переменные магнитные поля порождают электрические поля, а переменные электрические — магнитные. И тогда Максвелл понял, что в такой связке колеблющиеся электрическое и магнитное поля могут отрываться от порождающих их проводников и двигаться через вакуум с определенной, но очень большой скоростью. Он вычислил эту скорость, и она оказалась около трехсот тысяч километров в секунду.
Потрясенный полученным результатом, Максвелл пишет Уильяму Томсону (лорду Кельвину, который, в частности, ввел абсолютную шкалу температур): «Скорость поперечных волновых колебаний в нашей гипотетической среде, вычисленная из электромагнитных опытов Кольрауша и Вебера, столь точно совпадает со скоростью света, вычисленной из оптических опытов Физо, что мы едва ли может отказаться от вывода, что свет состоит из поперечных колебаний той же самой среды, которая является причиной электрических и магнитных явлений». И далее в письме: «Я получил свои уравнения, живя в провинции и не подозревая о близости найденной мной скорости распространения магнитных эффектов к скорости света, поэтому я думаю, что у меня есть все основания считать магнитную и светоносную среды как одну и ту же среду…»
И далее в письме: «Я получил свои уравнения, живя в провинции и не подозревая о близости найденной мной скорости распространения магнитных эффектов к скорости света, поэтому я думаю, что у меня есть все основания считать магнитную и светоносную среды как одну и ту же среду…»
Уравнения Максвелла далеко выходят за рамки школьного курса физики, но они так красивы и лаконичны, что их стоит разместить на видном месте в кабинете физики, ведь большинство значимых для человека явлений природы удается описать с помощью всего нескольких строчек этих уравнений. Так сжимается информация, когда объединяются ранее разнородные факты. Вот один из видов уравнений Максвелла в дифференциальном представлении. Полюбуйтесь.
| ∇E = 4πρ | Закон Кулона |
| ∇B = 0& | магнитные заряды не существуют в природе |
| [∇E] = –1/c(δB/δt) | закон Фарадея |
| [∇B] = (4π/c)j + (1/c)(δE/δt) | Закон Ампера, с током смещения Максвелла (второй член правой части) |
| F = q(E+ [(v/c)×B]) | Сила Лоренца |
Хочется подчеркнуть, что из расчетов Максвелла получалось обескураживающее следствие: колебания электрического и магнитного полей — поперечные (что он сам все время подчеркивал).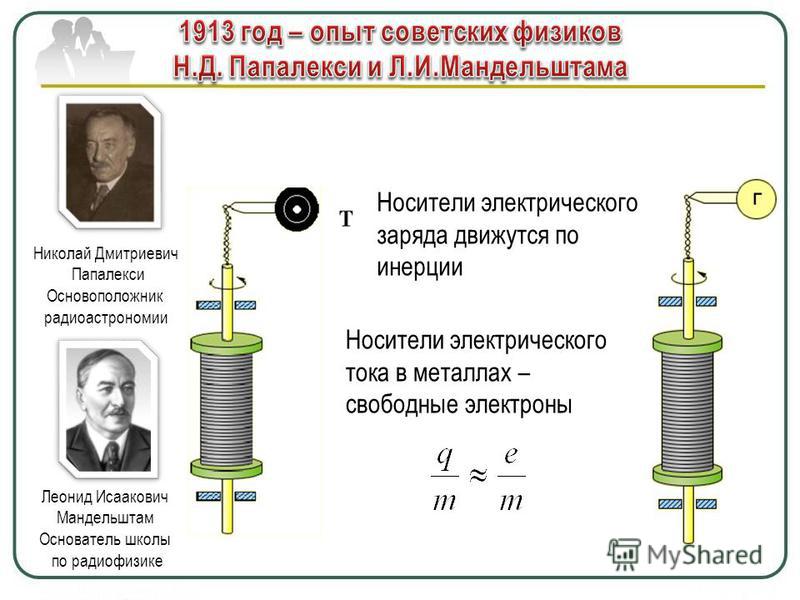 А поперечные колебания распространяются только в твердых телах, но не в жидкостях и газах. К тому времени было надежно измерено, что скорость поперечных колебаний в твердых телах (попросту скорость звука) тем выше, чем, грубо говоря, тверже среда (чем больше модуль Юнга и меньше плотность) и может достигать нескольких километров в секунду. Скорость поперечной электромагнитной волны была почти в сто тысяч раз выше, чем скорость звука в твердых телах. А надо заметить, что характеристика жесткости входит в уравнение скорости звука в твердом теле под корнем. Получалось, что среда, через которую идут электромагнитные волны (и свет), имеет чудовищные характеристики упругости. Возник крайне тяжелый вопрос: «Как же через такую твердую среду движутся другие тела и не чувствуют ее?» Гипотетическую среду назвали — эфиром, приписав ему одновременно странные и, вообще говоря, взаимоисключающие свойства — огромную упругость и необычайную легкость.
А поперечные колебания распространяются только в твердых телах, но не в жидкостях и газах. К тому времени было надежно измерено, что скорость поперечных колебаний в твердых телах (попросту скорость звука) тем выше, чем, грубо говоря, тверже среда (чем больше модуль Юнга и меньше плотность) и может достигать нескольких километров в секунду. Скорость поперечной электромагнитной волны была почти в сто тысяч раз выше, чем скорость звука в твердых телах. А надо заметить, что характеристика жесткости входит в уравнение скорости звука в твердом теле под корнем. Получалось, что среда, через которую идут электромагнитные волны (и свет), имеет чудовищные характеристики упругости. Возник крайне тяжелый вопрос: «Как же через такую твердую среду движутся другие тела и не чувствуют ее?» Гипотетическую среду назвали — эфиром, приписав ему одновременно странные и, вообще говоря, взаимоисключающие свойства — огромную упругость и необычайную легкость.
Работы Максвелла вызвали шок среди ученых-современников. Сам Фарадей с удивлением писал: «Сначала я даже испугался, когда увидел такую математическую силу, примененную к вопросу, но потом удивился, видя, что вопрос выдерживает это столь хорошо». Несмотря на то, что взгляды Максвелла опрокидывали все известные на то время представления о распространении поперечных волн и о волнах вообще, прозорливые ученые понимали, что совпадение скорости света и электромагнитных волн — фундаментальный результат, который говорит, что именно здесь физику ожидает основной прорыв.
Сам Фарадей с удивлением писал: «Сначала я даже испугался, когда увидел такую математическую силу, примененную к вопросу, но потом удивился, видя, что вопрос выдерживает это столь хорошо». Несмотря на то, что взгляды Максвелла опрокидывали все известные на то время представления о распространении поперечных волн и о волнах вообще, прозорливые ученые понимали, что совпадение скорости света и электромагнитных волн — фундаментальный результат, который говорит, что именно здесь физику ожидает основной прорыв.
К сожалению, Максвелл умер рано и не дожил до надежного экспериментального подтверждения своих расчетов. Международное научное мнение изменилось в результате опытов Генриха Герца, который через 20 лет (1886–89) в серии экспериментов продемонстрировал генерацию и прием электромагнитных волн. Герц не только в тиши лаборатории получил правильный результат, но страстно и бескомпромиссно защищал взгляды Максвелла. Причем он не ограничился экспериментальным доказательством существование электромагнитных волн, но и исследовал их основные свойства (отражение от зеркал, преломление в призмах, дифракцию, интерференцию и т. д.), показав полную тождественность электромагнитных волн со светом.
д.), показав полную тождественность электромагнитных волн со светом.
Любопытно, что за семь лет до Герца, в 1879 году английский физик Дэвид Эдвард Юз (Хьюз — D. E. Hughes) тоже продемонстрировал перед другими крупными учеными (среди них был также блестящий физик и математик Георг-Габриель Стокс) эффект распространения электромагнитных волн в воздухе. В результате обсуждений ученые пришли к выводу, что видят явление электромагнитной индукции Фарадея. Юз расстроился, не поверил самому себе и опубликовал результаты лишь в 1899 году, когда теория Максвелла-Герца стала общепринятой. Этот пример говорит, что в науке настойчивое распространение и пропаганда полученных результатов имеет часто не меньшее значение, чем сам научный результат.
Генрих Герц так подытожил результаты своих экспериментов: «Описанные эксперименты, как, по крайне мере, кажется мне, устраняют сомнения в тождественности света, теплового излучения и электродинамического волнового движения».
Далее: Великое объединение
Кто открыл нейтрон, протон и электрон, и какое значение это имело для человечества
org/Person»> От Masterweb
01.08.2018 14:00
С древних времен человека интересовала структура вещества, которое он наблюдает вокруг себя каждый день. Одна из гипотез, выдвинутая еще в Античной Греции, постулировала, что вещество состоит из элементарных частиц — атомов. Однако только в XX веке было экспериментально установлено, что атом также состоит из субатомных частиц: протонов, электронов и нейтронов. В статье раскрывается тема, кто открыл нейтрон, протон и электрон, и какое влияние оказали эти открытия на развитие человечества.
Атом и субатомные частицы
Материя Вселенной состоит из маленьких частиц, которые называются атомами. Эта концепция была выдвинута греческим математиком и философом Демокритом еще в V веке до нашей эры. С древнегреческого языка слово «атом» переводится как «неделимый». Ввиду технической невозможности проверить, что представляет собой атом, эта гипотеза существовала вплоть до XIX века, когда достижения науки и технологий позволили изучить атом более тщательно. Благодаря изучению атома в конце XIX века было установлено, что он не является элементарной единицей материи и состоит из более мелких частиц, которые были названы субатомными. К этим частицам принято относить электрон, протон и нейтрон, поскольку они образуют атомы всего вещества.
Благодаря изучению атома в конце XIX века было установлено, что он не является элементарной единицей материи и состоит из более мелких частиц, которые были названы субатомными. К этим частицам принято относить электрон, протон и нейтрон, поскольку они образуют атомы всего вещества.
В настоящее время в вопросе изучения элементарных частиц наука продвинулась далеко вперед. Так, было установлено, что даже субатомные частицы тоже имеют свою внутреннюю структуру. Кроме того, существует так называемая антиматерия, образованная атомами, состоящими из античастиц, которые тоже являются субатомными. Тем не менее начало ядерной физики и ядерной истории человечества положило именно открытие электронов, протонов и нейтронов. Кто открыл эти субатомные частицы, рассматривается в этой статье.
Современные представления о строении атома
Прежде чем переходить к ответу на вопрос, кто открыл нейтроны, протоны и электроны, рассмотрим, что с современной точки зрения представляет собой атом.
Каждое вещество, которое мы видим каждый день, состоит из молекул. Они же образованы атомами. Хотя количество различных молекул достаточно велико, все они образованы ограниченным количеством различных атомов (порядка 100). Каждый атом имеет ядро, состоящее из протонов и нейтронов, и вращающиеся вокруг ядра электроны, электрический заряд которых является отрицательным и противоположен по знаку заряду ядра.
Если применять эти представления к воде, то следует сказать, что в капле воды диаметром 4 мм находится приблизительно 1015 молекул. Молекула воды состоит из 3 атомов: 2 атома водорода и 1 атом кислорода. Атом кислорода состоит из ядра, образованного 8 протонами и 8 нейтронами, и электронной оболочки, состоящей из 8 электронов.
Открытие электрона
До 1897 года человечество считало атом неделимым, когда британский физик Джозеф Джон Томсон открыл электрон в своих экспериментах с катодными лучами. Прибор, который использовал Томсон, представлял собой герметичную трубку из стекла, в которую были помещены два катода, и был выкачан воздух. Ученый обнаружил, что испускаемые катодные лучи отклоняются от пути своего распространения, если на них воздействовать электрическим полем. В итоге ученый установил, что образующие эти лучи частицы должны иметь отрицательный заряд. Впоследствии эти частицы получили название электроны.
Ученый обнаружил, что испускаемые катодные лучи отклоняются от пути своего распространения, если на них воздействовать электрическим полем. В итоге ученый установил, что образующие эти лучи частицы должны иметь отрицательный заряд. Впоследствии эти частицы получили название электроны.
Открытие протона
Ученик Дж. Дж. Томсона, новозеландский физик Эрнест Резерфорд, считается ученым, открывшим протон. Он в начале XX века предложил планетарную модель строения атома, в которой основная масса находится в центре. К такой гипотезе Резерфорд пришел после анализа экспериментов, в которых ученые Ганс Гейгер и Эрнест Марсден бомбардировали альфа-частицами пластинку из золота.
В 1918 году Резерфорд провел самостоятельно эксперименты по взаимодействию альфа-частиц с азотом. В этих экспериментах ученый наблюдал испускание ядер атома водорода и пришел к заключению, что они являются «кирпичиками» для всех других ядер. Так Резерфорд открыл протон. Впоследствии было установлено, что ядерная масса значительно превосходила суммарную массу всех протонов атома, поэтому Резерфорд предположил, что в ядре атома существует еще некоторая тяжелая частица, не обладающая зарядом. Этой частицей стал нейтрон, который был открыт позже.
Этой частицей стал нейтрон, который был открыт позже.
Кто открыл нейтрон?
Третья составляющая атом частица была открыта в 1932 году. Ученым, открывшим существование нейтронов, стал английский физик Джеймс Чедвик. Изучая поведение атомов, когда их бомбардируют альфа-частицы, Чедвик обнаружил существование радиационного излучения, частицы которого имели массу приблизительно такую же, как протоны, но являлись электрически нейтральными, поскольку не взаимодействовали с электрическим полем. Кроме того, эти частицы были способны пронизывать вещество и заставлять атомы тяжелых элементов делиться на более легкие. Из-за физических свойств новой частицы Чедвик назвал ее нейтроном, поэтому он по праву считается ученым, открывшим нейтрон.
Энергия атомного ядра
После того, как нейтроны были открыты, ядерная физика, а также химия и технологии сделали огромный шаг вперед. Перед человеком открылся новый, практически неисчерпаемый и в то же время опасный источник энергии.
Начало ядерной эры человечество ощутило на себе в 1945 году, когда США испытало в действии разрушительную первую ядерную бомбу «Тринити», сбросив ее на японские города Хиросима и Нагасаки.
Первое использование ядерной энергии в мирных целях следует отнести к середине 50-х годов XX века, когда в 1953 году был построен первый ядерный реактор, который заменил дизельный двигатель на американской подводной лодке «Наутилус».
Джозеф Джон «Дж. Дж.” Томсон
Главная / Узнать / Исторические биографии
Британский физик Джозеф Джон (Дж. Дж.) Томсон (1856–1940) провел в 1897 году серию экспериментов, направленных на изучение природы электрического разряда в высоковакуумной электронно-лучевой трубке, область, которую в то время исследовали многие ученые.
Томсон интерпретировал отклонение лучей электрически заряженными пластинами и магнитами как свидетельство наличия «тел, намного меньших, чем атомы» (электроны), которые, как он вычислил, имеют очень большое значение отношения заряда к массе. Позже он оценил стоимость самого заряда.
Структура атома и масс-спектрография
В 1904 году Томсон предложил модель атома как сферы из положительной материи, в которой электроны располагаются под действием электростатических сил. Его усилия по оценке числа электронов в атоме по измерениям рассеяния света, рентгеновских, бета- и гамма-лучей положили начало исследовательской траектории, по которой двигался его ученик Эрнест Резерфорд. Последняя важная экспериментальная программа Томсона была сосредоточена на определении природы положительно заряженных частиц. Здесь его методы привели к развитию масс-спектрографа. Его ассистент, Фрэнсис Астон, усовершенствовал прибор Томсона и с помощью улучшенной версии смог обнаружить изотопы — атомы одного и того же элемента с разным атомным весом — в большом количестве нерадиоактивных элементов.
Дж. Дж. Томсон (слева) и Эрнест Резерфорд в 1930-е годы.
Из книги сэра Джеймса Хопвуда Джинса «Рост физических наук» (Кембридж: издательство Кембриджского университета, 1948)
Ранняя жизнь и образование
По иронии судьбы, Томсон — великий ученый и наставник физики — стал физиком по умолчанию. Его отец хотел, чтобы он стал инженером, что в те дни требовало ученичества, но его семья не могла собрать необходимую плату. Вместо этого юный Томсон поступил в Оуэнс-колледж в Манчестере, где был превосходный научный факультет. Затем его рекомендовали в Тринити-колледж в Кембридже, где он стал математическим физиком. В 1884 году он был назначен на престижную Кавендишскую профессуру экспериментальной физики в Кембридже, хотя лично он проделал очень мало экспериментальной работы. Несмотря на то, что у него были неуклюжие руки, у него был талант проектировать аппараты и диагностировать их проблемы. Он был хорошим лектором, поощрял своих студентов и уделял значительное внимание более широким проблемам преподавания естественных наук в университетах и средних школах.
Связи с химическим сообществом
Из всех физиков, связанных с определением структуры атома, Томсон оставался наиболее тесно связанным с химическим сообществом. Его нематематическая теория атома — в отличие от ранней квантовой теории — могла также использоваться для объяснения химических связей и молекулярной структуры (см. Гилберта Ньютона Льюиса и Ирвинга Ленгмюра). В 1913 году Томсон опубликовал влиятельную монографию, призывающую химиков использовать масс-спектрограф в своих анализах.
Дж. Дж. Томсон.
Институт истории науки
Нобелевская премия
Томсон получил различные награды, в том числе Нобелевскую премию по физике в 1906 году и рыцарское звание в 1908 году. включая Резерфорда по химии (1908 г.) и Астона по химии (1922 г.).
Информация, содержащаяся в этой биографии, последний раз обновлялась 9 января 2018 года.
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д. Филлипс
Филлипс
- Похожие темы:
- субатомная частица
радиоактивность
изотоп
атомизм
периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метров.
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов. Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье
Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомных частиц.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метров. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метров пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метров. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метров пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метров. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре.

 Филлипс
Филлипс