Содержание
Бактериофаг | справочник Пестициды.ru
Бактериофаги были открыты микробиологами Федериком Уильямом Туортом (Англия) и Феликсом д’Эреллем (Канада). Ф. Туорт в статье 1915 года описал инфекционную болезнь стафилококков, вызванную инфекционным агентом, способным проходит через бактериальные фильтры и быть перенесенным от одной колонии бактерий к другой. Д’Эрелль (независимо от Туорта) 3 сентября 1917 года сообщил об открытии таких же инфекционных агентов и ввел термин «бактериофаг» – пожирающий бактерии (отгреч. phagos – пожирающий)[3][1].
Скрыть
Содержание:
Скрыть
- Состояние вопроса
- Морфология и структура
- Морфологические типы
- Геномы
- Химический состав
- Классификация бактериофагов
- Жизненный цикл
- Реакция на химические и физические факторы
- Распространение
Состояние вопроса
В ходе длительных исследований достоверно установлено, что антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в клетку бактерии с последующим его размножением внутри ее и лизисом инфицированной клетки. После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления[3][1].
После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления[3][1].
Бактериофаги отличаются высокой специфичностью действия в отношении штаммов-хозяев, отсутствием токсичности, не способностью вызывать аллергические реакции и дисбактериоз. Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами[3][1].
Несмотря на масштабы накопленного научного материала многие вопросы, касающиеся биологических свойств бактериофагов, требуют дополнительных исследований. В частности не выяснена функция многих продуктов, синтезируемых фагами, нет единой схемы таксономии и морфологической классификации, нет стандартных наборов бактериофагов многих возбудителей, схем и регламента их применения[3][1].
Развитие бактериофага в культуре бактерий рода Xanthomonas
Развитие бактериофага в культуре бактерий рода
Xanthomonas
Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами.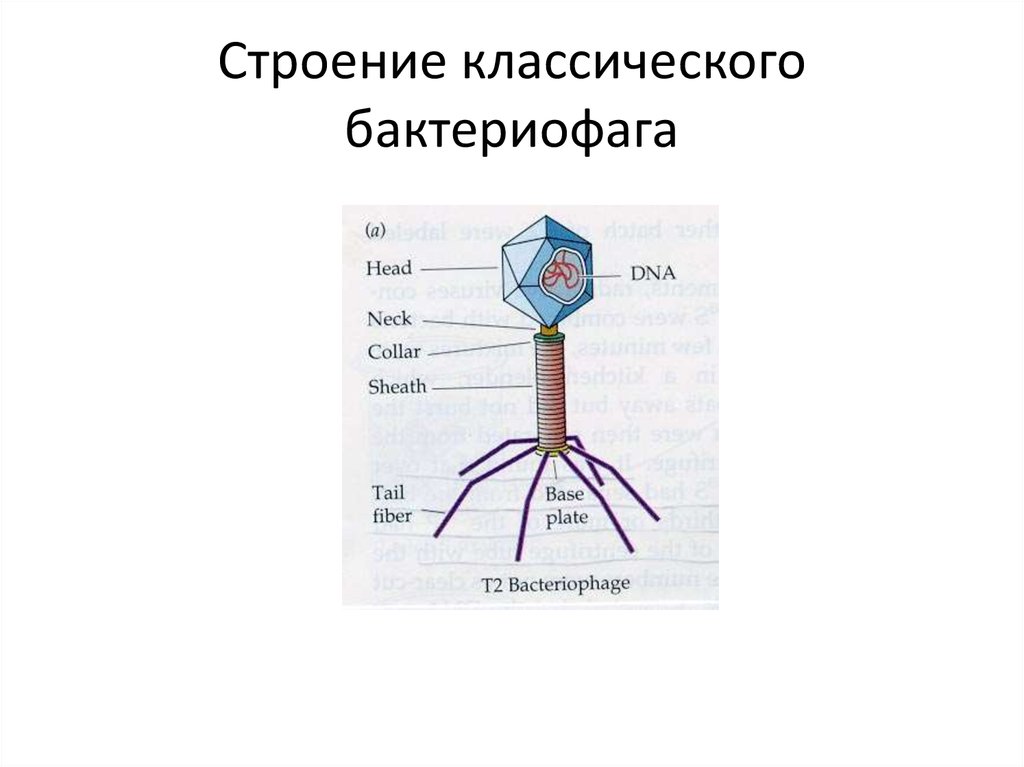 Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками[1].
Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками[1].
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2[1].
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры. Все структуры отростка имеют белковую природу. Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм. Длина хвоста, как правило, в 2–4 разабольше диаметра головки[2][1].
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид[1].
Нуклеиновая кислота и капсид вместе образуют нуклеокапсид[1].
Хвост представляет собой белковую полую трубку окруженную чехлом, содержащим сократительные белки. Чехол является продолжением белковой оболочки головки. В основании хвоста находится АТФ-аза, регенерирующая энергию для инъекции генетического материала (сокращения чехла отростка бактериофага). У некоторых вирусов чехол сокращается, обнажая часть стержня. На конце хвоста у многих фагов присутствует базальная пластинка с тонкими длинными нитями, способствующими прикреплению его к бактерии. Кроме того в области базальной пластинки присутствует фермент – бактериофаговый лизоцим, способный разрушать муреин клеточной стенки бактерии[2][1].
Морфологические типы
Описание структуры и морфологии бактериофагов приведенное выше соответствует наиболее изученным Т-фагам (типовым фагам). Они составляют группу коли-дизентерийных фагов, включающую 7 представителей: 4 нечетных Т1, ТЗ, Т5 и Т7 и 3 четных Т2, Т4, Т6[1].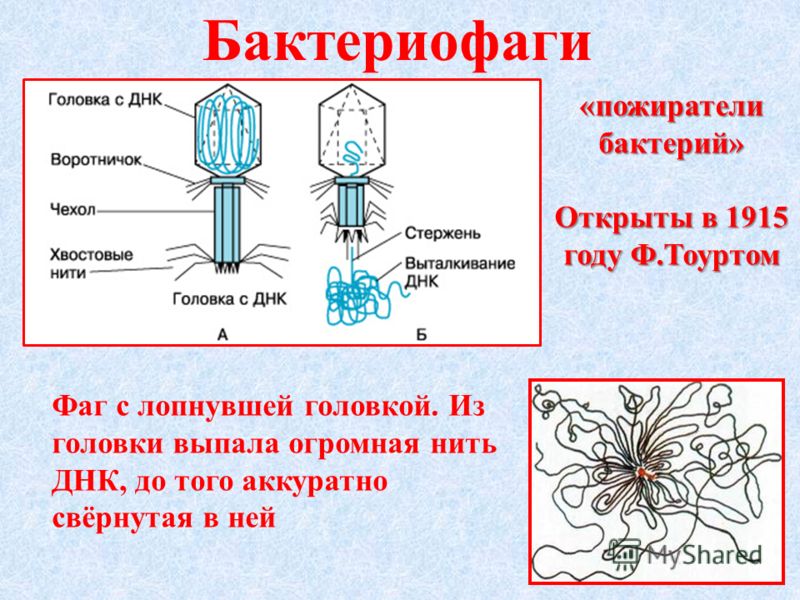
Классические иди «хвостатые» фаги составляют основную массу бактериофагов, около 96%. Однако установлено, что тонкая структура фагов более разнообразна и сложна, чем структура фитопатогенных вирусов и зоопатогенных вирусов. В настоящее время исследовано большое количество фагов с морфологией отличной от представленной выше[1].
По форме вирусных частиц фаги делятся на шесть основных морфологических типов:
- Палочковидные или нитевидные[1].
- Головка без отростка[1].
- Головка и несколько небольших выступов (отростков)[1].
- Головка и один небольшой короткий отросток[1].
- Головка и длинный отросток, чехол которого не сокращается[1].
- Головка и длинный отросток, чехол которого сокращается[1].
Строение бактериофага (на примере Т-четного фага)
Строение бактериофага (на примере Т-четного фага)
1. Головка; 2. Хвост; 3. Нуклеиновая кислота; 4. Капсид; 5. «Воротничок»; 6. Белковый сократительный чехол вокруг полого стержня хвоста; 7. Фибриллы ( нити) хвостового отростка; 8. Шипы; 9. Базальная пластинка[1].
Головка; 2. Хвост; 3. Нуклеиновая кислота; 4. Капсид; 5. «Воротничок»; 6. Белковый сократительный чехол вокруг полого стержня хвоста; 7. Фибриллы ( нити) хвостового отростка; 8. Шипы; 9. Базальная пластинка[1].
Геномы
Геномы бактериофагов характеризуются большим разнообразием. Объемы геномов варьируют от 20 до 700 kb. Длина большинства фаговых геномов составляет около 50 kb[2][1].
Длина самого крупного бактериофага (G) равна 670 kb. Это самый крупный из всех вирусных геномов. Его размер в четыре раза превышает самый маленький бактериальный геном[2][1].
Встречаются фаги, геном которых сегментирован, но в основном геномы представлены целыми линейными или кольцевыми молекулами нуклеиновых кислот. Большинство изученных бактериофагов имеют двухцепочечную ДНК. Однако обнаружены группы с одноцепочечной ДНК, двухцепочечной и одноцепочечной РНК[2][1].
Химический состав
Бактериофаги состоят из нуклеиновой кислоты и белка. Общее количество белка – 50–60%, нуклеиновых кислот – 40–50 %. В составе некоторых фагов имеются ДНК с азотистыми основаниями. Вместо цитозина может присутствовать5-оксиметилцитозин. Внутри головки фага Т2 обнаружен белок с полиамидами в составе. Он способствует суперспирализации ДНК и способствует размещению достаточно длинной ДНК в головке небольшого размера. В частицах многих фагов под чехлом присутствует фермент лизоцим[2][1].
Общее количество белка – 50–60%, нуклеиновых кислот – 40–50 %. В составе некоторых фагов имеются ДНК с азотистыми основаниями. Вместо цитозина может присутствовать5-оксиметилцитозин. Внутри головки фага Т2 обнаружен белок с полиамидами в составе. Он способствует суперспирализации ДНК и способствует размещению достаточно длинной ДНК в головке небольшого размера. В частицах многих фагов под чехлом присутствует фермент лизоцим[2][1].
Электронная микроскопия бактериофагов
Электронная микроскопия бактериофагов
Морфологические типы.
Увеличение X 400 000–600 000
1. Палочковидные или нитевидные[1]; 2. Головка без отростка[1]; 3. Головка и несколько небольших выступов (отростков)[1]; 4. Головка и один небольшой короткий отросток[1]; 5. Головка и длинный отросток, чехол которого не сокращается[1]; 6. Головка и длинный отросток, чехол которого сокращается[1].
Головка и длинный отросток, чехол которого сокращается[1].
Классификация бактериофагов
Современная классификация бактериофагов основана на строении фаговой частицы и характеристике нуклеиновой кислоты. Прежде всего фаги, как и все остальные вирусы, делятся на РНК-содержащие и ДНК-содержащие. В соответствии с Международной классификацией и номенклатурой вирусов в настоящее время из наиболее исследованных бактериофагов выделяют 13 семейств, в том числе: Myoviridae (частица без оболочки с сократительным хвостом, двухцепочечная ДНК линейная), Rudiviridae (частица без оболочки, палочкообразная, двухцепочечная ДНК линейная), Bicaudaviridae (частица без оболочки, лимонообразна, двухцепочечная ДНК кольцевая)[1].
Отдельные семейства объединены в два порядка. Для большинства порядки не определены[1].
Жизненный цикл
[2]Как указывалось выше, бактериофаги характеризуются специфичностью к определенным видам бактерий.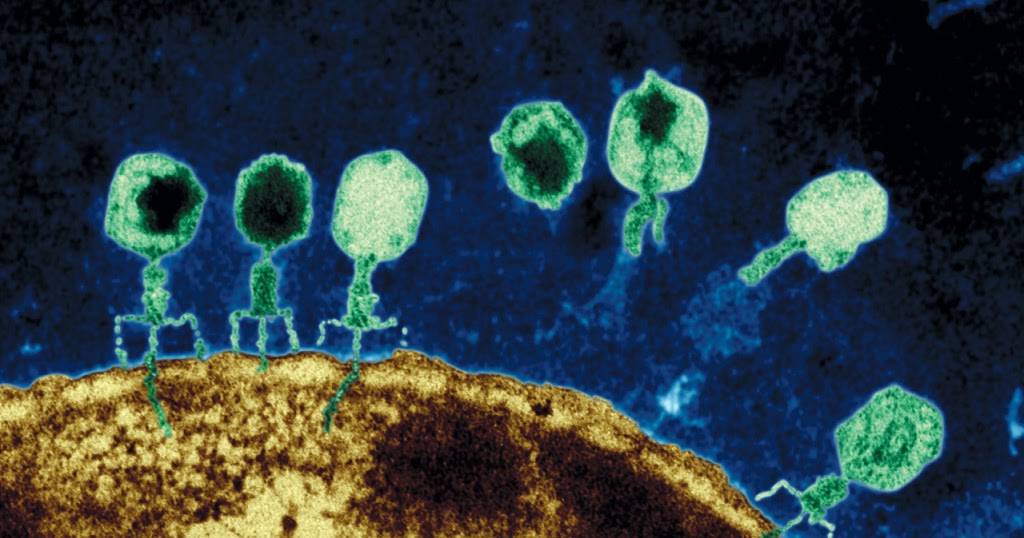 Однако, взаимоотношение между фагами и бактериями сложны и не всегда завершаются лизисом чувствительной к нему клетки и размножением фага[1].
Однако, взаимоотношение между фагами и бактериями сложны и не всегда завершаются лизисом чувствительной к нему клетки и размножением фага[1].
В зависимости от специфичности различают:
- моновалентные бактериофаги – лизируют культуры бактерий определенного вида;
- типовые бактериофаги – лизируют отдельные штаммы внутри вида;
- поливалентные бактериофаги – вызывают лизис группы родственных видов микробов.
Инфекцию клетки, заканчивающуюся ее гибелью и размножением в ней фага, называют продуктивной[1].
Главная особенность бактериофагов: размножение происходит только в живых клетках, находящихся в состоянии развития и роста. В мертвых клетках и в продуктах клеточного обмена размножение фагов не происходит[1].
По характеру взаимодействия с бактериальными клетками различают две группы:
- Вирулентные бактериофаги – всегда лизируют зараженные бактерии и имеют только один путь развития – литический цикл[1][2].

- Умеренные бактериофаги – ведут себя двояко: после проникновения в клетку нуклеиновая кислота вируса может быть вовлечена в литический цикл или вступает с клеткой-хозяином в своеобразные симбиотические отношения. Она встраивается в хромосому бактерии и превращается в профаг, передаваясь всему потомству клетки (лизогенный путь). При этом бактерии, содержащие профаг, называют лизогенными бактеиями[1][2].
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый путь развития. Период с момента инфицирования клетки до ее лизиса называется латентным периодом. Первая половина латентного периода, когда фаг не удается обнаружить в клетке, называют скрытым периодом. Каждая система бактериофаг – бактерия характеризуются конкретными величинами латентного и скрытого периода. Продолжительность этих периодов зависит от температуры, состава среды и многих других факторов. Продолжительность латентного периода варьирует от 15 минут до 5 часов и более. При низкой температуре она увеличивается[1].
При низкой температуре она увеличивается[1].
Реакция на химические и физические факторы
Бактериофаги проявляют большую устойчивость к действию физических и химических факторов окружающей среды, чем многие зоопатогенные и фитопатогенные вирусы. Большинство фагов активируются при температуре более +65°C–+70°C. Они хорошо переносят замораживание и длительно сохраняются при низких температурах и высушивании. 0,5% раствор сулема (хлористой ртути), 1,0% раствор фенола не оказывают на фаги инактивирующего действия. 10% раствор формалина инактивирует фаговые частицы в течение нескольких минут. Бактериофаги резистентны к воздействию ионизирующей радиации и ультрафиолетового излучения[3][1].
Распространение
Бактериофаги – наиболее многочисленная и широко распространенная в биосфере и скорее всего наиболее эволюционно древняя группа вирусов. Приблизительный размер популяции фагов насчитывает более 1030 фаговых частиц. Считается, что на одну бактерию приходится 10 фаговых частиц[1].
Бактериофаги обнаруживаются в воде, почве, сточных водах, организме человека и животных, в культурах бактерий. Фаги обнаруживаются в тех местах, где распространены чувствительные к ним бактерии[1].
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Иконникова Н.В. Бактериофаги – вирусы бактерий: учеб. пособие, Минск: ИВЦ Минфина, 2017. – 41 c
2.
Лысак В.В. Микробиология : учеб. пособие / В. В. Лысак. – Минск: БГУ, 2007 – 430 с
Источники из сети интернет:
3.
Колешко О.И., Завезенова Т.В. Микробиология с основами вирусологии,Иркутск: Изд-во Иркутского университета, 1999. – 452 с.
Изображения (переработаны):
4.
Xanthomonas leaf blight of onion (Xanthomonas axonopodis pv. allii) (Kadota et al. 2000) by Howard F. Schwartz & Jillian M.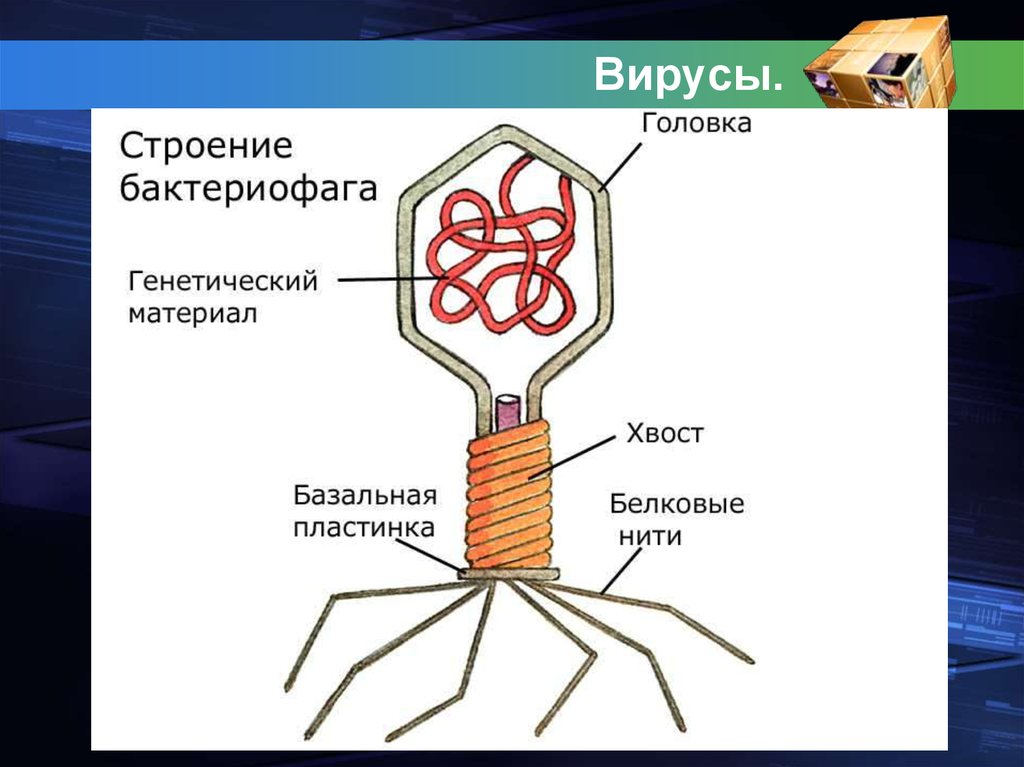 Lang
Lang
СвернутьСписок всех источников
Бактериофаги и иммунная система макроорганизма | Иванова
И. А. Иванова,
А. А. Труфанова,
А. В. Филиппенко,
И. А. Беспалова,
Н. Д. Омельченко
https://doi.org/10.36233/0372-9311-2019-6-79-85
Полный текст:
PDF (Rus)
|
HTML
|
XML
- Статья
- Об авторах
Аннотация
В связи с появлением в последние годы антибиотикорезистентных штаммов бактерий лечение и профилактика различных инфекций бактериофагами вновь стали актуальным направлением исследований.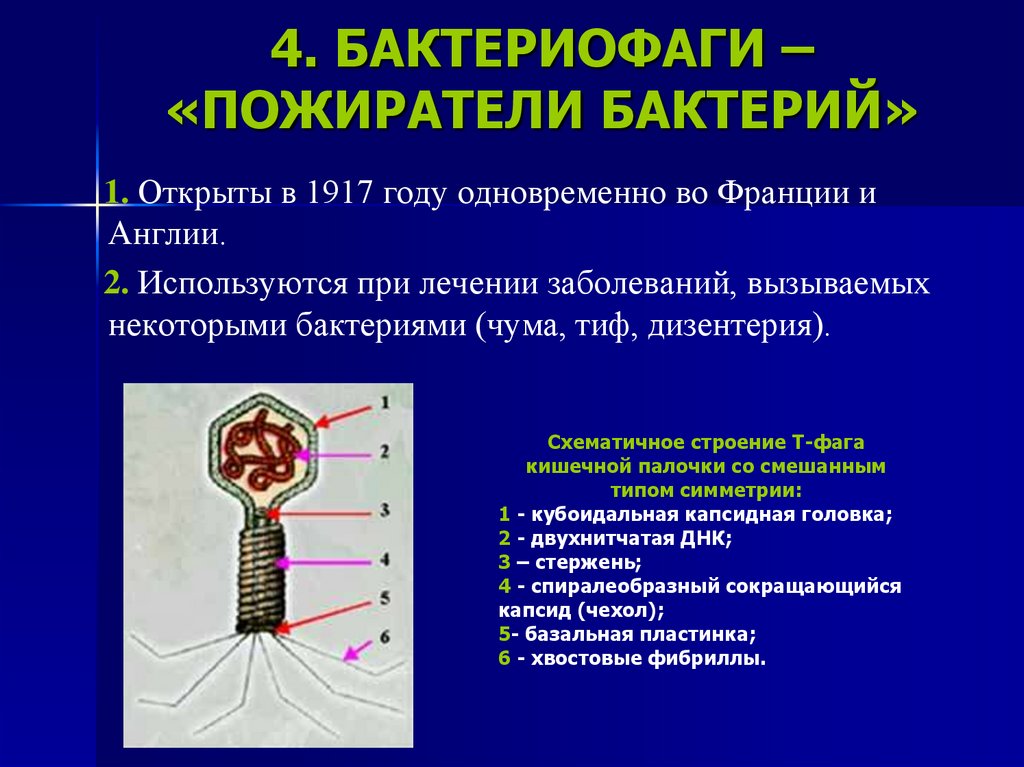 Однако при использовании фагов в этих целях необходимо учитывать иммунные ответы макроорганизма на их введение. Сведения о влиянии бактериальных вирусов на систему врождённого и адаптивного иммунитета млекопитающих в доступной литературе немногочисленны и противоречивы. Этот вопрос требует дальнейшего детального изучения, особенно при разработке новых лечебно-профилактических биопрепаратов на основе бактериофагов.
Однако при использовании фагов в этих целях необходимо учитывать иммунные ответы макроорганизма на их введение. Сведения о влиянии бактериальных вирусов на систему врождённого и адаптивного иммунитета млекопитающих в доступной литературе немногочисленны и противоречивы. Этот вопрос требует дальнейшего детального изучения, особенно при разработке новых лечебно-профилактических биопрепаратов на основе бактериофагов.
Ключевые слова
обзор,
бактериофаги,
иммунная система,
врождённый и специфический иммунитет,
терапия,
профилактика
Бактериофаги, используемые для лечения бактериальных заболеваний человека, с середины XX века были вытеснены антибиотиками. Однако, по заявлению Всемирной организации здравоохранения, лекарственная устойчивость микроорганизмов может в скором времени нивелировать достижения современной медицины, в том числе в борьбе с инфекционными заболеваниями, сделав их неуправляемыми [1]. В связи с этим в последние десятилетия лечение и профилактика вирусами бактерий вновь стали актуальными направлениями [2].
В связи с этим в последние десятилетия лечение и профилактика вирусами бактерий вновь стали актуальными направлениями [2].
Преимущества бактериофагов перед антибиотиками заключаются в следующем: они способны уничтожать бактерии, устойчивые к антибиотикам; свободно проникают в ткани организма человека и животного, не нарушая баланса микрофлоры хозяина; не вызывают побочных эффектов; сочетаются со многими лекарственными препаратами; оказывают иммуностимулирующее действие и не обладают иммуносупрессивным влиянием [3]. Благодаря вышеперечисленному в настоящее время бактериофаги активно используются в качестве антимикробных препаратов при разных бактериальных инфекциях желудочно-кишечного тракта (ЖКТ), ЛОР-органов, дыхательных путей, урогенитального тракта, генерализованных септических заболеваниях, ожоговых ранах, хирургических инфекциях и т. д. Эти препараты нашли широкое применение и с профилактической целью в условиях чрезвычайных ситуаций природного характера (наводнения и т. д.) [4, 5], а также при инфекциях, связанных с оказанием медицинской помощи [2].
Однако существуют противоречивые сведения о влиянии фагов на врождённый и адаптивный иммунитет млекопитающих [6]. Этот вопрос требует детального изучения, особенно при разработке новых лечебно-профилактических биопрепаратов на основе бактериофагов [7].
Известно, что фаги способны проникать через эпителиальные барьеры слизистых оболочек благодаря специализированным клеткам иммунной системы (М-клеткам, бокаловидным) и, возможно, клеткам эпителия кишечника и других отделов ЖКТ [8]. Независимо от способа введения, бактериофаги поступают в общий ток крови. После перорального приёма фаговые частицы обнаруживаются в кровотоке через 1 ч. Затем они транспортируются в лимфатические узлы, печень и селезёнку, где и адсорбируются [9]. Необходимо отметить, что скорость попадания фагов, так же, как и бактерий, из ЖКТ в кровь может существенно увеличиваться при воспалительном ответе [3]. Выводятся фаги из организма через кишечник [10] и почки. После однократного приёма пациентами бактериальные вирусы выделялись с мочой в течение 5-6 сут с постепенным уменьшением титра [9].
Благодаря способности проникать в кровяное русло и ткани бактериофаги взаимодействуют с клетками иммунной системы как локально, так и системно [11, 12].
При первом попадании в макроорганизм фаги встречаются с эффекторами врождённого иммунитета. Они взаимодействуют с макрофагами, дендритными и эпителиальными клетками и посредством трансмембранных рецепторов, распознающих разнообразные типы патоген-ассоциированных молекулярных маркёров, активируют экспрессию генов разнообразных цитокинов [13]. Некоторые фаги могут контактировать с клетками иммунной системы посредством клеточных рецепторов, принадлежащих к семейству β-интегринов, а также используя последовательность LysGly-Asp, находящуюся в капсидном белке gp24. Аналогичная последовательность присутствует в лиганде CD40, играющем важную роль в активации эндотелиальных клеток, тромбоцитов, Tи B-лимфоцитов, в развитии воспаления [14].
В то же время показано, что очищенный фаг T4 и лизаты фагов Echerichia coli не оказывают влияния на экспрессию TLR2 и TLR4 на моноцитах человека [15].
Иммунная система может распознавать и инактивировать вирусные частицы [16, 17]. Особенно быстро уничтожение фагов осуществляется в печени. Так, клетки Купфера поглощают их в четыре раза эффективнее, чем макрофаги селезёнки. Выявлено, что в печени уничтожается до 99% бактериофагов в течение 30 мин после введения [18].
Фаги влияют на фагоцитоз и развитие воспалительного ответа, но, в зависимости от их вида, дозы и способа введения, могут либо усиливать, либо ингибировать эти процессы [16, 17].
Иностранными авторами обнаружено, что лечение инфицированных и интактных мышей фагами не влияло на интенсивность фагоцитоза гранулоцитами и моноцитами крови. Аналогичные результаты получены при изучении действия гомои гетерологичных бактериальных вирусов в разных титрах на фагоцитарную активность нейтрофилов и моноцитов крови человека, а также на миграцию этих клеток [14].
Однако российскими исследователями показано, что препарат Пиобактериофаг, в отличие от антибиотиков, при местном введении в пазухи улучшал показатели завершённости фагоцитоза, что свидетельствовало о снижении интенсивности воспаления и восстановлении адекватного иммунного ответа слизистых оболочек носа [19].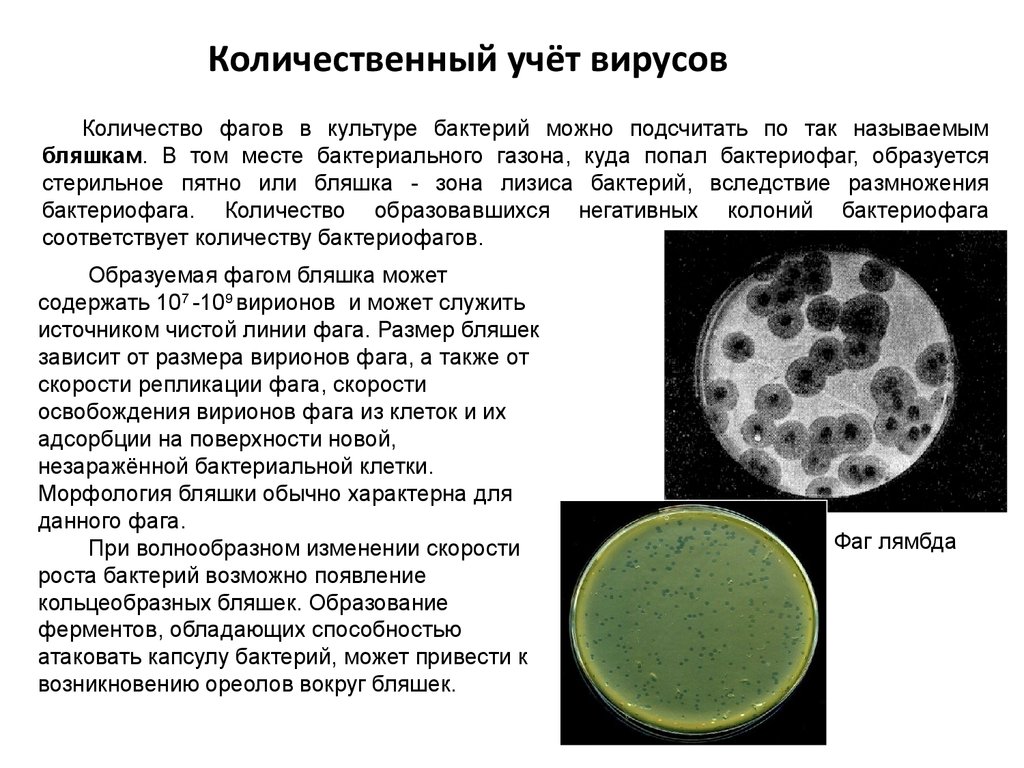 Благодаря способности бактериофагов активировать фагоцитоз и повышать метаболическую активность нейтрофилов удалось предотвратить рецидивы инфекции и хронизацию воспалительного процесса [20, 21], что особенно важно при лечении хронических воспалительных заболеваний на фоне иммуносупрессивных состояний и бактерионосительства [9, 22, 23].
Благодаря способности бактериофагов активировать фагоцитоз и повышать метаболическую активность нейтрофилов удалось предотвратить рецидивы инфекции и хронизацию воспалительного процесса [20, 21], что особенно важно при лечении хронических воспалительных заболеваний на фоне иммуносупрессивных состояний и бактерионосительства [9, 22, 23].
Описано также, что фаги снижают чрезмерную продукцию активных форм кислорода при бактериальных инфекциях, предупреждая окислительный стресс и повреждение тканей [14]. Кроме этого, сами вирусы вызывают высвобождение небольшого количества активных форм кислорода [21].
Имеются данные, свидетельствующие о том, что фаги и их белки не только не стимулируют образование медиаторов воспаления [14, 24], но и способны уменьшать воспаление, вызванное иммунным ответом на бактерии [16]. Высказано предположение, что фаги могут обладать защитным потенциалом, не только уничтожая патогены, но и подавляя местные иммунные и воспалительные реакции в кишечнике, тем самым способствуя поддержанию иммунного гомеостаза [14].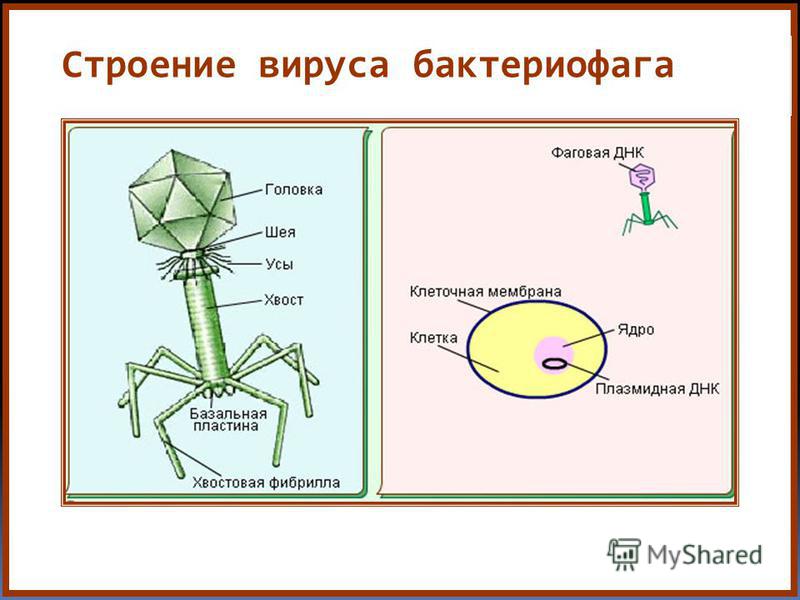 В то же время за счёт высвобождения большого количества эндотоксина бактериофаги могут вызывать воспаление и повышение уровней фактора некроза опухоли (ФНОα), интерлейкинов (ИЛ) -1β и -6 [25, 26].
В то же время за счёт высвобождения большого количества эндотоксина бактериофаги могут вызывать воспаление и повышение уровней фактора некроза опухоли (ФНОα), интерлейкинов (ИЛ) -1β и -6 [25, 26].
Как макромолекулярная структура, бактериофаг представляет собой антиген и обладает иммуногенностью [7, 27]. Показано, что на его антигенную активность могут влиять даже незначительные изменения в составе белков фаговой оболочки [17].
После попадания бактериофагов в макроорганизм запускаются механизмы специфического гуморального и клеточного иммунных ответов. Идёт процессинг фаговых антигенов антигенпредставляющими клетками. Фаговые антигены могут быть представлены дендритными клетками Т-лимфоцитам, что приводит к развитию клеточного иммунитета и высвобождению цитокинов [6].
Некоторыми авторами показано, что иммунная система позвоночных не индуцирует специфический клеточный ответ, и Т-лимфоциты не участвуют в элиминации бактериофагов [16, 17]. Однако другие исследователи отмечали, что под влиянием бактериофагов уровень лимфоцитов увеличивался, преимущественно за счёт Т-клеток [28], причём этот процесс усиливался при бустерной иммунизации фагами. Так, in vitro выявлено усиление пролиферации спленоцитов мышей, предварительно иммунизированных сальмонеллёзными бактериофагами, по сравнению с таковой у интактных животных [14]. Есть сведения о том, что фаги могут, наоборот, ингибировать активацию и пролиферацию Т-клеток человека in vitro [29].
Так, in vitro выявлено усиление пролиферации спленоцитов мышей, предварительно иммунизированных сальмонеллёзными бактериофагами, по сравнению с таковой у интактных животных [14]. Есть сведения о том, что фаги могут, наоборот, ингибировать активацию и пролиферацию Т-клеток человека in vitro [29].
Сведения, касающиеся индукции гуморального иммунного ответа на бактериофаги, в литературе тоже неоднозначны [30]. Исследования гуморального иммунитета, с одной стороны, показали отсутствие достоверных различий в содержании иммуноглобулинов на фоне применения фагов [31], а с другой стороны, повторный курс их приёма сопровождается подъёмом уровня антифаговых антител [17]. После однократного приёма фага F8 Pseudomonas продукция IgM у мышей достигала максимума примерно через 5-10 дней, а затем несколько снижалась. После повторного введения фага был зарегистрирован достаточно высокий уровень антифаговых IgG [32]. Следует отметить, что сыворотка, содержащая IgM, только снижала активность фага, а сыворотка с IgG полностью инактивировала его.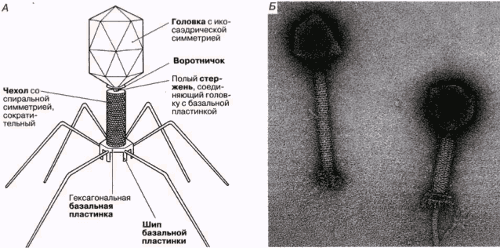 Комплемент сыворотки в присутствии специфических антител также уменьшал жизнеспособность бактериофагов. Такой механизм свидетельствует о том, что фаг вызывает иммунный ответ, характерный для эукариотических вирусов [33]. Ферменты бактериофагов, благодаря своей белковой природе, также стимулируют быстрый иммунный ответ и выработку иммуноглобулинов [16, 34].
Комплемент сыворотки в присутствии специфических антител также уменьшал жизнеспособность бактериофагов. Такой механизм свидетельствует о том, что фаг вызывает иммунный ответ, характерный для эукариотических вирусов [33]. Ферменты бактериофагов, благодаря своей белковой природе, также стимулируют быстрый иммунный ответ и выработку иммуноглобулинов [16, 34].
Экспериментально доказано, что высокий уровень продукции специфических антител способствует быстрой элиминации фагов и является одной из причин снижения эффективности фаготерапии [18, 35]. У новорождённых и детей до года нейтрализующие антитела обнаруживаются в сыворотке крови в меньшем количестве, что делает применение фагов в этих группах более эффективным [10].
Данные литературы свидетельствуют о том, что бактериофаги могут оказывать как положительное влияние на иммунный статус человека [28], стимулируя выработку цитокинов, пролиферацию Т-клеток, синтез антител, фагоцитоз [36], так и вызывать лишь кратковременное увеличение функциональной активности Ти В-лимфоцитов, NK-клеток и их количества в периферической крови [14]. Возможно, это связано с тем, что успех фаговой терапии во многом зависит от иммунной системы пациента [17].
Возможно, это связано с тем, что успех фаговой терапии во многом зависит от иммунной системы пациента [17].
Известно о способности бактериофагов выступать в роли иммуногенных носителей и адъювантов [27]. В то же время они могут подавлять специфичные и неспецифичные иммунные реакции. Например, бактериальные вирусы ингибируют продукцию ИЛ-2, ФНОа, интерферона-γ лейкоцитами человека [29].
Фаги снижают воспалительную инфильтрацию трансплантата, которая может привести к его повреждению и даже к потере, а также непосредственно ингибируют аллотрансплантат-индуцированную активацию T-клеток [27].
Препараты бактериофагов, подобно пробиотикам, регулируют механизмы иммунитета в кишечнике [37]. Доказано стимулирующее действие стафилококкового фага на бифидобактерии [28, 38, 39]. При этом описана способность бактериофагов поддерживать иммунную толерантность к чужеродным антигенам микроорганизмов кишечника [29]. Бактериальные вирусы способствуют нормализации микрофлоры, участвуют в поддержании колонизационной резистентности и оральной толерантности, что обеспечивает нормализацию механизмов гуморального и клеточного иммунитета [3].
Таким образом, данные, представленные в обзоре, отражают неоднозначное мнение исследователей о влиянии бактериофагов на иммунную систему и их участии в регуляции иммунитета. При оценке действия вирусов бактерий на макроорганизм следует учитывать природу иммунного ответа на их введение, которая зависит от физико-химических свойств фага, способа, дозы, кратности применения [13, 32, 40] и иммунного статуса пациента [32, 41, 42]. При разработке новых препаратов и использовании известных бактериофагов в лечебных и профилактических целях для создания условий их длительного персистирования в организме необходимо учитывать активацию вирусными частицами иммунных реакций человека [9], а также вероятность элиминации фагов специфическими антителами [35].
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. ВОЗ. Устойчивость к противомикробным препаратам.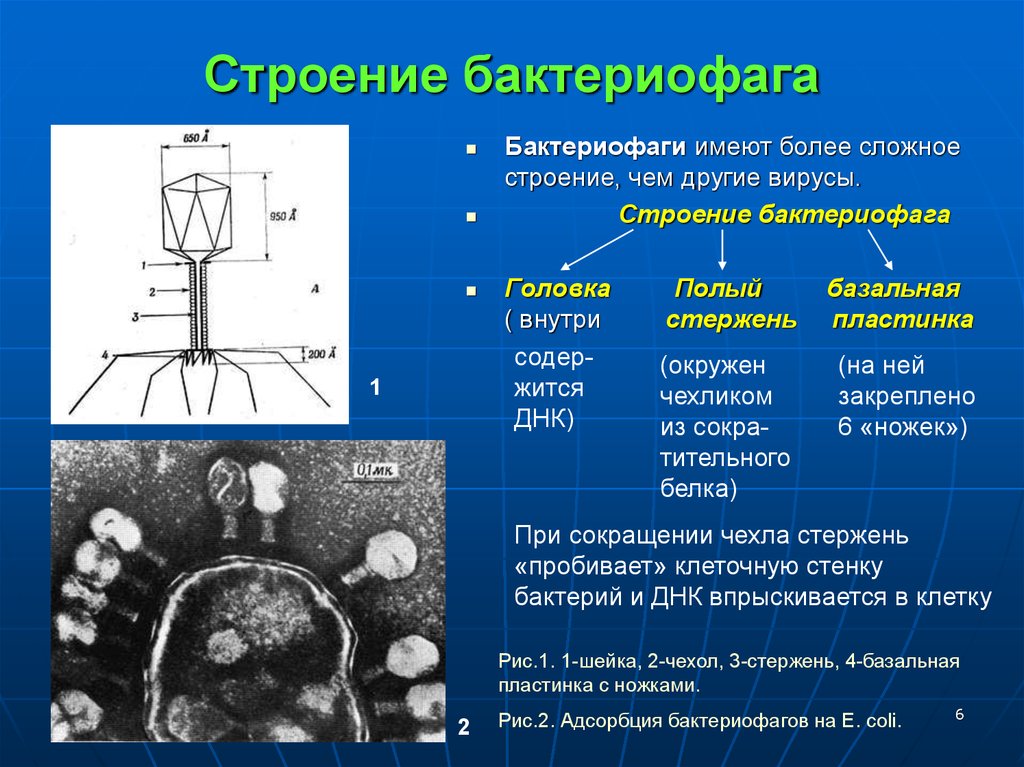 Информационный бюллетень. Available at: https://www.who.int/ru/news-room/fact-sheets/detail/antimicrobial-resistance
Информационный бюллетень. Available at: https://www.who.int/ru/news-room/fact-sheets/detail/antimicrobial-resistance
2. Зуева Л.П., Асланов Б.И., Акимкин В.Г. Современный взгляд на роль бактериофагов в эволюции госпитальных штаммов и профилактике инфекций, связанных с оказанием медицинской помощи. Журнал микробиологии, эпидемиологии и иммунобиологии. 2014; (3): 100-7.
3. Топчий Н.В., Топорков А.С. Бактериофаги в лечении острых кишечных инфекций. Медицинский совет. 2015; (8): 74-81.
4. Алсынбаев М.М., Медведев Ю.А., Туйгуно М.М. Биопрепараты и ведущие направления их лечебно-профилактического применения. Уфа; 2008.
5. Красильников И.В., Лобастова А.К., Лыско К.А. Краткий обзор современного состояния и перспективных направлений развития производства и применения лечебно-профилактических препаратов бактериофагов. Вестник биотехнологии. 2010; (2): 28-33.
6. Duerkop B.A., Hooper L.V. Resident viruses and their interactions with the immune system. Nat. Immunol. 2013; 14(7): 654-9. Doi: https://doi.org/10.1038/ni.2614
Doi: https://doi.org/10.1038/ni.2614
7. Domingo-Calap Р., Delgado-Martínez J. Bacteriophages: protagonists of a post-antibiotic era. Antibiotics (Basel). 2018; 7(3): 66. Doi: https://doi.org/10.3390/antibiotics7030066
8. Бехтерева М.К., Иванова В.В. Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта. Consilium medicum. Педиатрия. 2014; (2): 24-9.
9. Катер Э., Сулаквелидзе А. Бактериофаги: биология и практическое применение. М.: Научный мир; 2012.
10. Пагава К.И., Гачечиладзе К.К., Коринтели И.А., Дзулиашвили М.Г., Алавидзе З.И., Хойле Н. и др. Что происходит при пероральном приеме бактериофага ребенком? Georgian Medical News. 2011; (7-8): 101-5.
11. Duerr D.M., White S.J., Schluesener H.J. Identification of peptide sequences that induce the transport of phage across the gastrointestinal mucosal barrier. J. Virol. Methods. 2004; 116(2): 177-80. Doi: https://doi.org/10.1016/j.jviromet.2003.11.012
12. Hamzeh-Mivehroud M., Mahmoudpour A. , Rezazadeh H., Dastmalchi S. Non-specific translocation of peptidedisplaying bacteriophage particles across the gastrointestinal barrier. Eur. J. Pharm Biopharm. 2008; 70(2): 577-81. Doi: https://doi.org/10.1016/j.ejpb.2008.06.005
, Rezazadeh H., Dastmalchi S. Non-specific translocation of peptidedisplaying bacteriophage particles across the gastrointestinal barrier. Eur. J. Pharm Biopharm. 2008; 70(2): 577-81. Doi: https://doi.org/10.1016/j.ejpb.2008.06.005
13. Кaur T., Nafissi N., Wasfi O., Sheldon K., Wettig S., Slavcev R. Immunocompatibility of bacteriophages as nanomedicines. J. Nanotechnol. 2012; (l): 1-13. Doi: https://doi.org/10.1155/2012/247427
14. Górski A., Dąbrowska K., Międzybrodzki R., Weber-Dąbrowska B., Łusiak-Szelachowska M., Jończyk-Matysiak E., et al. Phages and immunomodulation. Future Microbiol. 2017; 12(10): 905-14. Doi: https://doi.org/10.2217/FMB-2017-0049
15. Flaherty J.E., Harbaugh B.K., Jones J.B., Somodi G.C. H-mutant bacteriophages as a potential biocontrol of bacterial blight of geraniums. Hortscience. 2001; 36: 90-100. Doi: https://doi.org/10.21273/hortsci.36.1.98
16. Górski A., Międzybrodzki R., Borysowski J., Dabrowska К., Wierzbicki P., Ohams M., et al. Phage as a modulator of immune responses: practical implications for phage therapy. Adv. Virus Res. 2012; 83: 41-71. Doi: https://doi.org/10.1016/B978-0-12-394438-2.00002-5
Adv. Virus Res. 2012; 83: 41-71. Doi: https://doi.org/10.1016/B978-0-12-394438-2.00002-5
17. Maciejewska B., Olszak Т., Drulis-Kawa Z. Applications of bacteriophages versus phage enzymes to combat and cure bacterial infections: an ambitious and also a realistic application? Appl. Microbiol. Biotechnol. 2018; 102(6): 2563-81. Doi: https://doi.org/10.1007/s00253-018-8811-1
18. Merril C.R., Scholl D., Adhya S.L. The prospect for bacteriophage therapy in Western medicine. Nat. Rev. Drug Discov. 2003; 2(6): 489-97. Doi: https://doi.org/10.1038/nrd1111
19. Арефьева Н.А., Азнабаева Л.Ф., Ворошилова Н.Н., Султанов Н.М. Сравнительное изучение влияния способов лечения на состояние местного иммунитета слизистых оболочек носа больных хроническим гнойным риносинуситом. Фундаментальные исследования. 2007; (4): 49.
20. Лазарева Е.Б. Бактериофаги для лечения и профилактики инфекционных заболеваний. Антибиотики и химиотерапия. 2003; 48(1): 36-40.
21. Przerwa A., Zimecki М.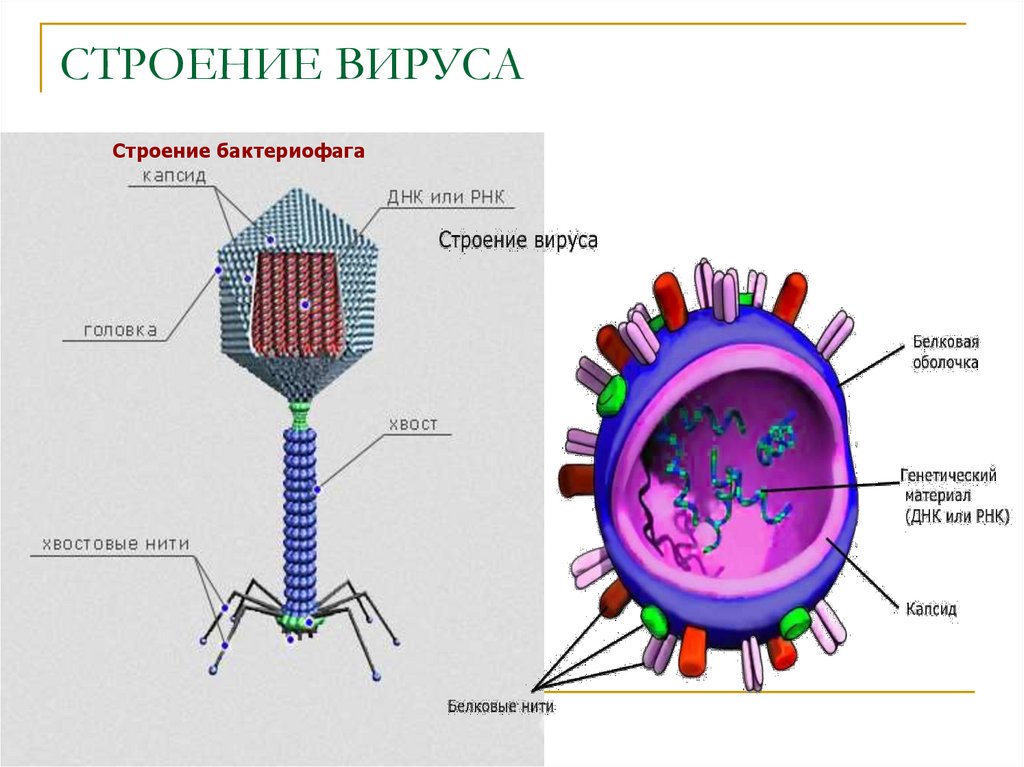 , Switała-Jeleń К., Dabrowska K., Krawczyk E., Łuczak M., et al. Effects of bacterio phages on free radical production and phagocytic functions. Med. Microbiol. Immunol. 2006; 195(3): 143-50. Doi: https://doi.org/10.1007/s00430-006-0011-4
, Switała-Jeleń К., Dabrowska K., Krawczyk E., Łuczak M., et al. Effects of bacterio phages on free radical production and phagocytic functions. Med. Microbiol. Immunol. 2006; 195(3): 143-50. Doi: https://doi.org/10.1007/s00430-006-0011-4
22. Ильина Т.С. Структурная организация и механизмы перемещений генных кассет, кодирующих резистентность к антибиотикам и факторы вирулентности бактерий. Молекулярная генетика, микробиология и вирусология. 2001; (1): 3-12.
23. Карабелеш Е.Е., Ткаченко С.А., Панкратов С.М., Демедюк О.И. Применение бактериофагов, как концепция лечебного и профилактического направления в медицине. Актуальные проблемы транспортной медицины. 2008; 1(11): 135-9.
24. Mills S., Shanahan F., Stanton C., Hill C., Coffey A., Ross RP. Movers and shakers: influence of bacteriophages in shaping the mammalian gut microbiota. Gut. Microbes. 2013; 4(1): 4-16. Doi: https://doi.org/10.4161/gmic.22371
25. Maes M., Kubera M., Leunis J., Berk M. Increased IgA and IgM responses against gut commensals in chronic depression: Further evidence for increased bacterial translocation or leaky gut. J. Affect. Dis. 2012; 141(1): 55-62. Doi: https://doi.org/10.1016/j.jad.2012.02.023
J. Affect. Dis. 2012; 141(1): 55-62. Doi: https://doi.org/10.1016/j.jad.2012.02.023
26. Tetz G.V., Ruggles K.V., Zhou H. et al. Bacteriophages as potential new mammalian pathogens. Sci. Rep. 2017; 7(1): 7043. Doi: https://doi.org/10.1038/s41598-017-07278-6
27. Бондаревич Н.В., Новик Г.И. Бактериофаги и иммунный ответ организма человека. Вестник национальной академии наук Белоруссии. Серия медицинские науки. 2015; (2): 112-6.
28. Чушков Ю.В. Бактериофаги в лечении и профилактике инфекционных заболеваний. Фарматека. 2011; (6): 34-41.
29. Górski A., Ważna E., Dąbrowska B.W., Dabrowska К. Bacteriophage translocation. FEMS Immunol. Med. Microbiol. 2006; 46(3): 313-9. Doi: https://doi.org/10.1111/j.1574-695X.2006.00044.x
30. Алешкин В.А., Новикова Л.И., Бочкарева С.С., Алешкин А.В., Ершова О.Н., Киселева И.А. и др. Проблема антифагового иммунного ответа при энтеральной фаготерапии. В кн.: Материалы научно-практической конференции «Диагностика и профилактика инфекционных болезней на современном этапе».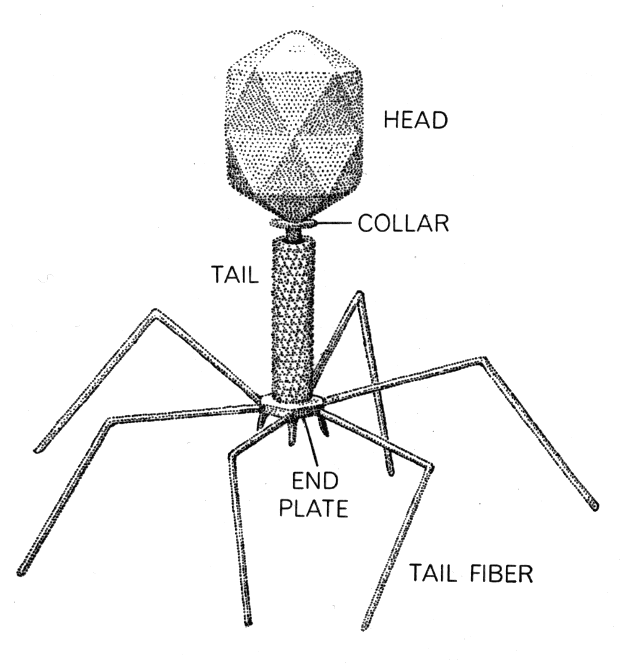 Новосибирск; 2016.
Новосибирск; 2016.
31. Дарбеева О.С., Жиленков Е.Л. Бактериофаги. В кн.: Лабинская А.С., ред. Общая и санитарная микробиология с техникой микробиологических исследований. М.; 2004.
32. Hodyra-Stefaniak K., Miernikiewicz P., Drapała J., Drab M., Jończyk-Matysiak E., Lecion D., et al. Mammalian Host-Versus-Phage immune response determines phage fate in vivo. Sci. Rep. 2015; 5: 14802. Doi: https://doi.org/10.1038/srep14802
33. Hangartner L., Zinkernagel R.M., Hengartner H. Antiviral antibody responses: the two extremes of a wide spectrum. Nat. Rev. Immunol. 2006; 6(3): 231-43. Doi: https://doi.org/10.1038/nri1783
34. Fischetti V.A. Bacteriophage endolysins: a novel anti-infective to control gram-positive pathogens. Int. J. Med. Microbiol. 2010; 300: 357-62. Doi: https://doi.org/10.1016/j.ijmm.2010.04.002
35. Бочкарева С.С., Алешкин А.В., Ершова О.Н., Новикова Л.И., Афанасьев С.С., Киселева И.А. и др. Иммунологические аспекты фаготерапии инфекций, связанных с оказанием медицинской помощи, в отделении нейрореанимации.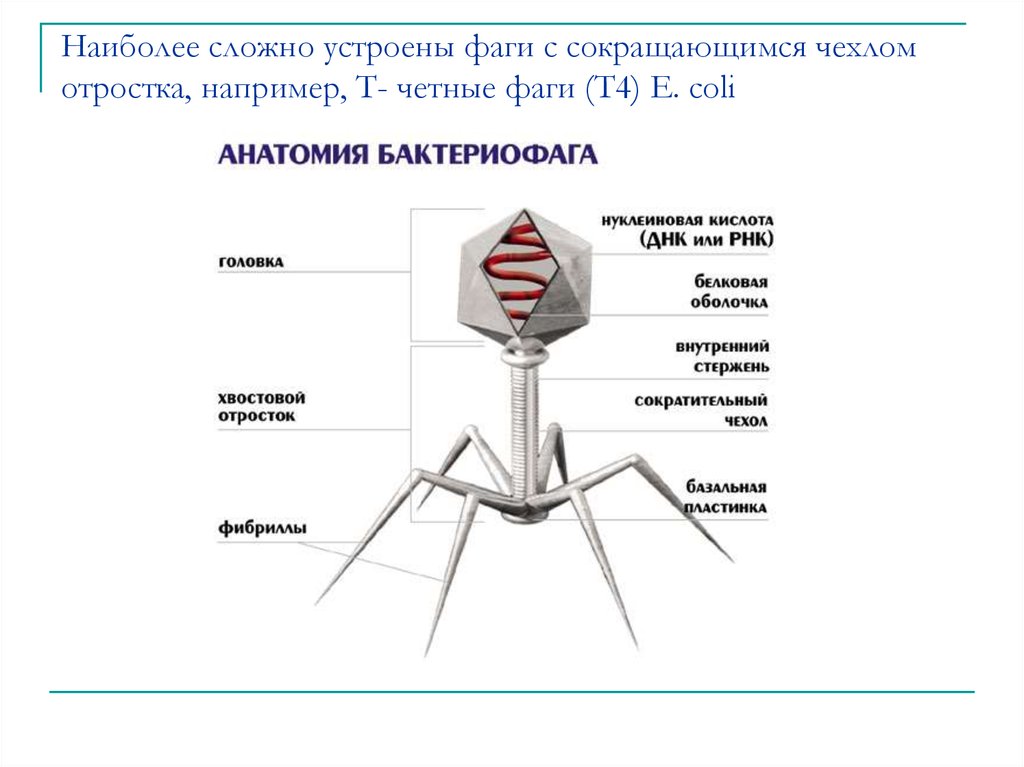 Журнал микробиологии, эпидемиологии и иммунобиологии. 2017; (4): 42-8.
Журнал микробиологии, эпидемиологии и иммунобиологии. 2017; (4): 42-8.
36. Borysowski J., Dabrowska K., Ohams M. The Response of the Immune System to Phage: Potential Associations with Phage Therapy. Bacteriophages and Probiotics – Alternatives to Antibiotics. Tbilisi, Georgia; 2012.
37. Stagg J.A., Hart A.L., Knight S.C., Kamm M.A. Microbial-gut interactions in health and disease. Interactions between dendritic cells and bacteria in the regulation of intestinal immunity. Best Pract. Res. Clin. Gastroenterol. 2004; 18(2): 255-70. Doi: https://doi.org/10.1016/j.bpg.2003.10.004
38. Алешкин А.В., Воложанцев Н.В., Светоч Э.А., Алешкин В.А., Афанасьев С.С., Борзилов А.И. и др. Бактериофаги как пробиотики и средства деконтаминации пищевых продуктов. Астраханский медицинский журнал. 2012; (3): 31-9.
39. Старкова О.М., Одегова Т.Ф., Главатских И.А. Определение емкости рынка бактериофагов на региональном уровне. В кн.: Фармация на современном этапе – проблемы и достижения.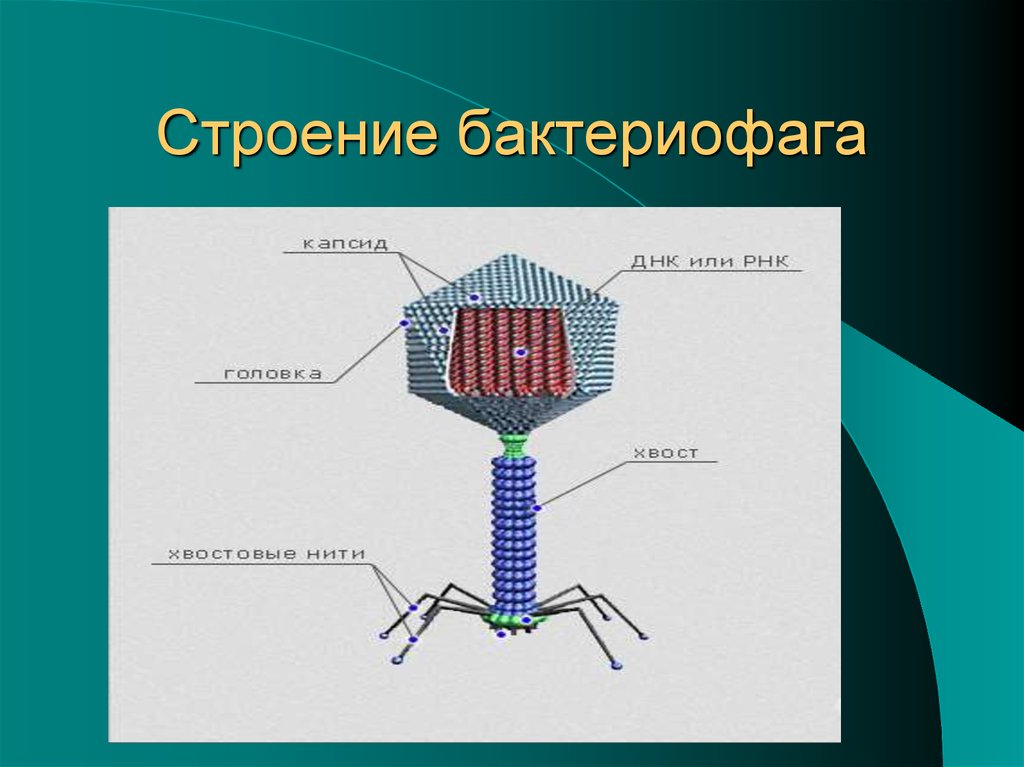 Часть 1. М.; 2000: 133-5.
Часть 1. М.; 2000: 133-5.
40. Stern A., Sorek R. The phage-host arms race: Shaping the evolution of microbes. Bioеssays. 2010; 33(1): 43-51. Doi: https://doi.org/10.1002/bies.201000071
41. Cerveny K.E., Depaola A., Duckworth D.H., Gulig P.A. Phage therapy of local and systemic disease caused by Vibrio vulnificusin iron-dextran-treated mice. Infect. Immun. 2002; 70: 6251-62. Doi: https://doi.org/10.1128/iai.70.11.6251-6262.2002
42. Nilsson A.S. Phage therapy – constraints and possibilities. Ups. J. Med. Sci. 2014; 119(2): 192-8. Doi: https://doi.org/10.3109/03009734.2014.902878
Об авторах
И. А. Иванова
ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора
Россия
Иванова Инна Александровна, канд. биол. наук, ведущий научный сотрудник с врио зав. лабораторией иммунологии особо опасных инфекций, 344002, г. Ростов-на-Дону, Россия
Ростов-на-Дону, Россия
А. А. Труфанова
ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора
Россия
344002, г. Ростов-на-Дону, Россия
А. В. Филиппенко
ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора
Россия
344002, г. Ростов-на-Дону, Россия
И. А. Беспалова
ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора
Россия
344002, г. Ростов-на-Дону, Россия
Н. Д. Омельченко
ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора
Россия
344002, г. Ростов-на-Дону, Россия
Рецензия
Просмотров: 20046
Контент доступен под лицензией Creative Commons Attribution 4. 0 License.
0 License.
что это такое, их применение
До сравнительно недавнего времени бактерии и вирусы считались исключительно «врагами» для человека. Однако научные открытия доказывают, что даже представителям микромира можно найти полезное применение. Каким образом? Об одном из таких примеров — наша статья.
Середина прошлого века была ознаменована серьёзным открытием в медицине: появились первые антибиотики и зазвучали оптимистичные прогнозы о скорой и окончательной победе человечества над большинством инфекций. Однако на тот период эта мечта оказалась несбыточной, поскольку медики столкнулись с неприятным сюрпризом: мутации и изменение морфологических и функциональных свойств позволили бактериям приобрести устойчивость (резистентность) к самым мощным антибиотикам.
Со временем проблема медленно, но неуклонно усугублялась. В современном мире существует реальная угроза развития таких микроорганизмов, которые будут обладать высокой резистентностью ко всем разработанным на сегодняшний день антибактериальным препаратам. Вот тут на помощь, по мнению учёных, и могут прийти бактериофаги – «пожиратели бактерий», которые мутируют с той же скоростью, что и бактерии.
Вот тут на помощь, по мнению учёных, и могут прийти бактериофаги – «пожиратели бактерий», которые мутируют с той же скоростью, что и бактерии.
Кто открыл бактериофаги?
У бактерий, как и у других живых существ, есть естественные враги — вирусы, которые стоят «на страже» эволюционного баланса, отслеживают состояние бактерий, и при их активном размножении начинают так же быстро увеличиваться в количестве.
Первые сведения о бактерицидном действии неизвестной субстанции появились в конце 19 века, когда британский бактериолог Эрнест Ханкин заметил, что люди, купающиеся в «святых водах» Ганга и Джамны (Индия) чудесным образом исцеляются от холеры. Спустя десятилетия в 1915 году его соотечественник Фредерик Творт обнаружил вирусы, уничтожающие бактерии. Через два года после него французский учёный Феликс д’Эрель сообщил, что открыл «невидимый микроб», поражающий дизентерийную палочку. Им же впервые был применён термин «бактериофаг» («поедатель бактерий»), которым мы пользуемся по сей день.
В это же время вдали от Франции, в Трапезунде (Турция), грузинский врач Георгий Элиава обнаружил бактерицидное действие воды в реке Кура и, благодаря публикации д’ Эреля, сделал вывод, что причина этого явления — бактериофаг. В 1920 году он открыл в Тбилиси научно-исследовательский институт, специалисты которого приступили к изучению фагов с целью их терапевтического применения. История применения бактериофагов в медицине на протяжении полувека была бы более богатой, если бы не стремительное распространение антибиотиков на Западе, которое привело в середине прошлого века к потере интереса к фагам у большинства фармацевтических компаний.
Однако грузинский НИИ бактериофагов не прекратил свою деятельность и превратился в единственный в мире центр для исследования фагов. В последние десятилетия интерес к теме бактериофагов разгорелся вновь, что, вероятно, можно объяснить развитием лекарственной устойчивости у бактерий к большинству антибиотиков.
Механизм действия бактериофагов
У каждой бактерии есть определённый вирус-фаг, который способен её разрушить.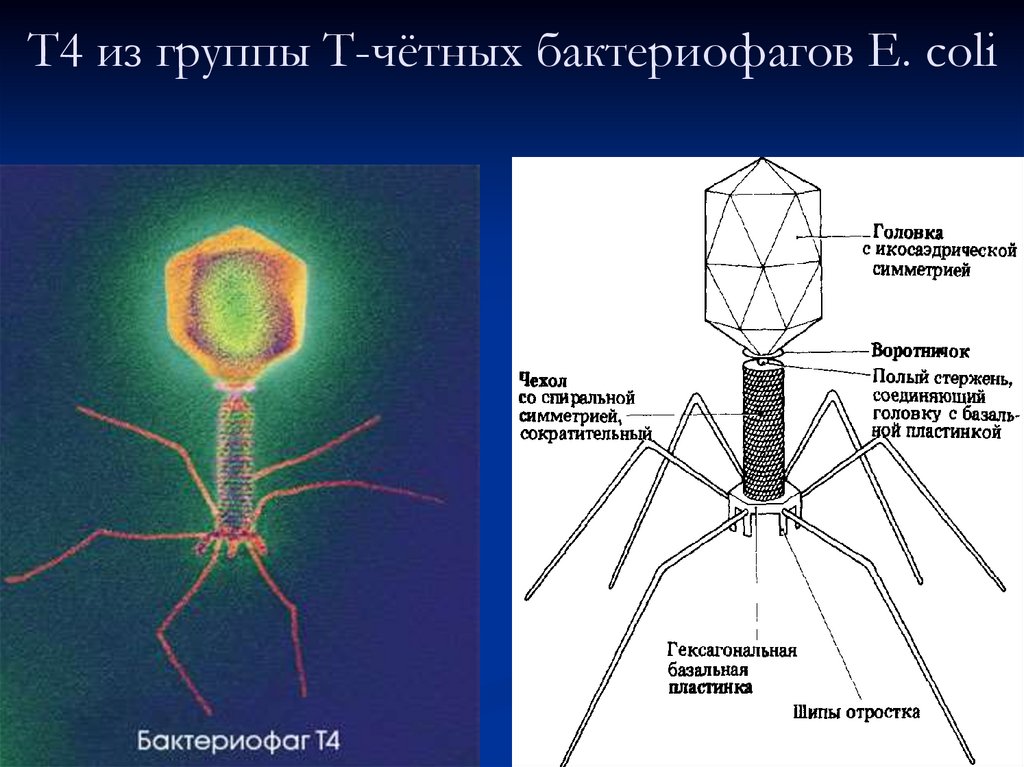 Посредством жгутиков фаги протыкают стенку бактерии и, сокращаясь, впрыскивают свой генетический материал внутрь клетки. С этого момента начинается инфекционный цикл: вначале переключаются механизмы жизнедеятельности бактерии на обслуживание бактериофага, размножается его геном, развивается ДНК вируса. В итоге бактериальная клетка разрушается и множество фагов устремляется наружу.
Посредством жгутиков фаги протыкают стенку бактерии и, сокращаясь, впрыскивают свой генетический материал внутрь клетки. С этого момента начинается инфекционный цикл: вначале переключаются механизмы жизнедеятельности бактерии на обслуживание бактериофага, размножается его геном, развивается ДНК вируса. В итоге бактериальная клетка разрушается и множество фагов устремляется наружу.
Бактериофаги отличаются специфичностью: поражая определённую бактерию, для всех остальных микроорганизмов они безвредны.
Лечение бактериофагами
Благодаря уникальным свойствам избирательного уничтожения болезнетворных бактерий, фаги стали применять для лечения и профилактики некоторых инфекционных заболеваний.
Против каких болезней врачи используют бактериофаги сегодня?
Наиболее широко применяется стафилококковый, стрептококковый, холерный бактериофаги, эффективные в терапии как острых, так и хронических форм заболевания, а также бактерионосительства.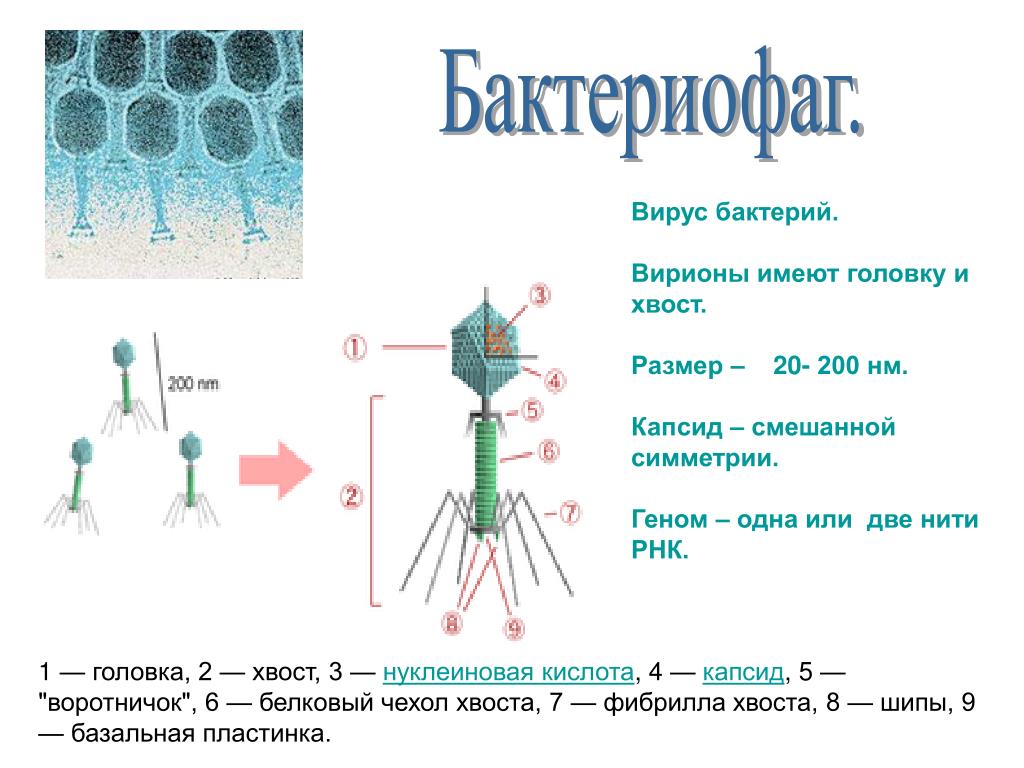 Кроме того, существуют фаги для лечения брюшного тифа, дизентерии, сальмонеллезов. Бактериофаги оказываются единственным эффективным средством в тех случаях, когда вышеуказанные инфекции вызываются не традиционными, а устойчивыми к антибиотикам штаммами.
Кроме того, существуют фаги для лечения брюшного тифа, дизентерии, сальмонеллезов. Бактериофаги оказываются единственным эффективным средством в тех случаях, когда вышеуказанные инфекции вызываются не традиционными, а устойчивыми к антибиотикам штаммами.
Использование бактериофагов не ограничивается лишь медицинской сферой. К примеру, с 2007 года в Соединённых Штатах после серии исследований фаги были признаны безвредной добавкой и стали использоваться в качестве консерванта при производстве сыров и других скоропортящихся продуктов.
Открытые вопросы
Бактериофаги не всесильны: как оказалось, бактерии могут быть устойчивы не только к антибиотикам, но и к фагам. В связи с этим применяются методы определения чувствительности бактерий, полученных от пациента, к имеющимся в арсенале доктора бактериофагам.
Другой изучаемой сегодня проблемой является роль бактериофагов в приобретении бактериями генов устойчивости к антибиотикам.
В качестве заключения
Для оценки преимуществ и широких возможностей фаготерапии, несправедливо отвергнутой в определённую эпоху большинством исследователей, потребовалось достаточно много времени. Однако забытый метод переживает в настоящее время второе рождение и имеет все шансы стать эффективным оружием в борьбе человека с миром болезнетворных микроорганизмов. Это позволит фаготерапии развиваться и завоёвывать новые горизонты в современной медицине.
Однако забытый метод переживает в настоящее время второе рождение и имеет все шансы стать эффективным оружием в борьбе человека с миром болезнетворных микроорганизмов. Это позволит фаготерапии развиваться и завоёвывать новые горизонты в современной медицине.
бактериофаг | Определение, жизненный цикл и исследования
бактериофаг
Посмотреть все СМИ
- Ключевые люди:
- Рудольф Йениш
Джордж П. Смит
Грегори П. Винтер
Феликс д’Эрель
Сальвадор Лурия
- Похожие темы:
- лизогенный фаг
бактериофаг Т4
литический фаг
профаг
фи-Х 174
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
Изучите, как бактериофаги размножаются путем введения нуклеиновой кислоты в клетку бактерии для создания вирионов
Просмотреть все видео к этой статье
бактериофаг , также называемый фаг или бактериальный вирус , любой из группы вирусов, поражающих бактерии.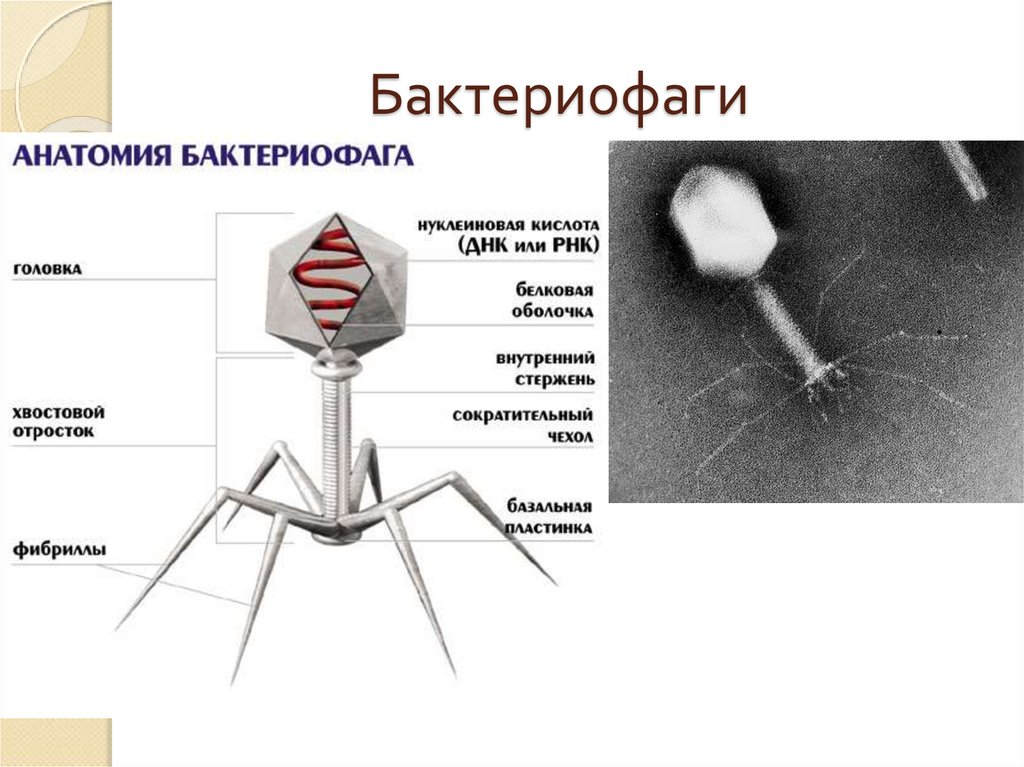 Бактериофаги были открыты независимо друг от друга Фредериком В. Туортом в Великобритании (1915) и Феликса д’Эреля во Франции (1917). Д’Эрелль ввел термин бактериофаг , что означает «пожиратель бактерий», для описания бактерицидной способности агента. Бактериофаги также заражают одноклеточные прокариотические организмы, известные как археи.
Бактериофаги были открыты независимо друг от друга Фредериком В. Туортом в Великобритании (1915) и Феликса д’Эреля во Франции (1917). Д’Эрелль ввел термин бактериофаг , что означает «пожиратель бактерий», для описания бактерицидной способности агента. Бактериофаги также заражают одноклеточные прокариотические организмы, известные как археи.
Характеристики бактериофагов
Существуют тысячи разновидностей фагов, каждая из которых может инфицировать только один или несколько типов бактерий или архей. Фаги относятся к ряду семейств вирусов; некоторые примеры включают Inoviridae, Microviridae, Rudiviridae и Tectiviridae. Как и все вирусы, фаги представляют собой простые организмы, состоящие из ядра генетического материала (нуклеиновой кислоты), окруженного белковым капсидом. Нуклеиновая кислота может представлять собой ДНК или РНК и может быть двухцепочечной или одноцепочечной. Существуют три основные структурные формы фага: икосаэдрическая (20-гранная) головка с хвостом, икосаэдрическая головка без хвоста и нитевидная форма.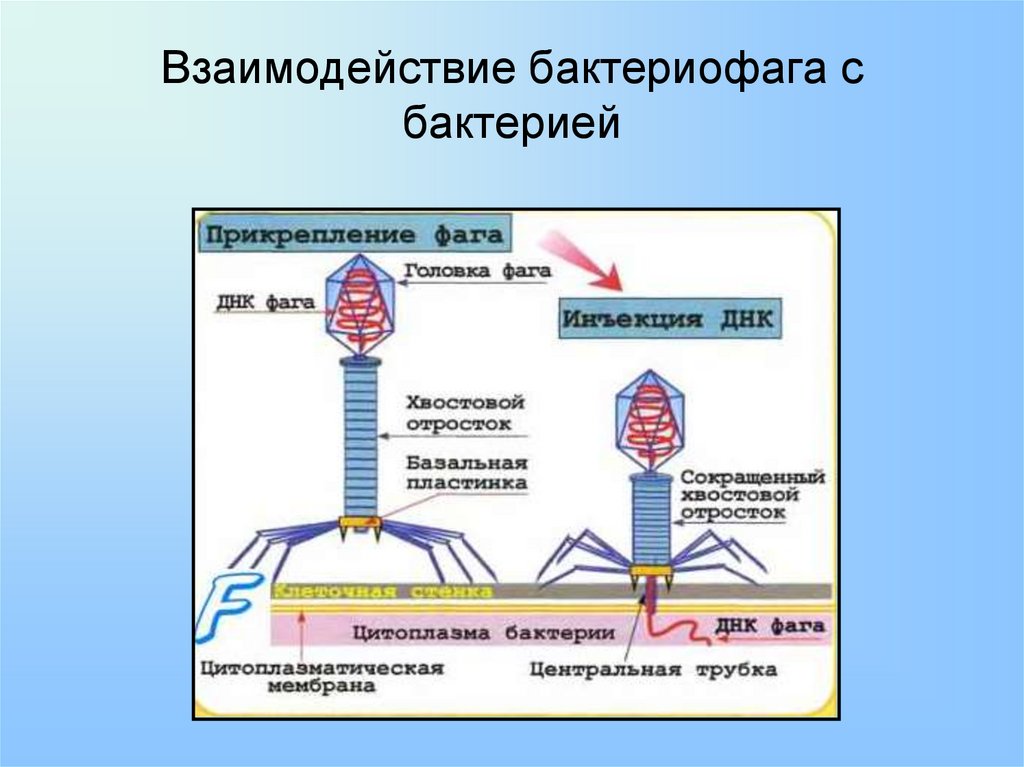
Жизненные циклы бактериофагов
Во время инфекции фаг прикрепляется к бактерии и встраивает в клетку свой генетический материал. После этого фаг обычно проходит один из двух жизненных циклов: литический (вирулентный) или лизогенный (умеренный). Литические фаги берут на себя механизмы клетки, чтобы производить компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые фаговые частицы. Лизогенные фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги можно заставить следовать литическому циклу.
Существуют и другие жизненные циклы, включая псевдолизогению и хроническую инфекцию. При псевдолизогении бактериофаг проникает в клетку, но не кооптирует механизм клеточной репликации и не интегрируется стабильно в геном хозяина. Псевдолизогения возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.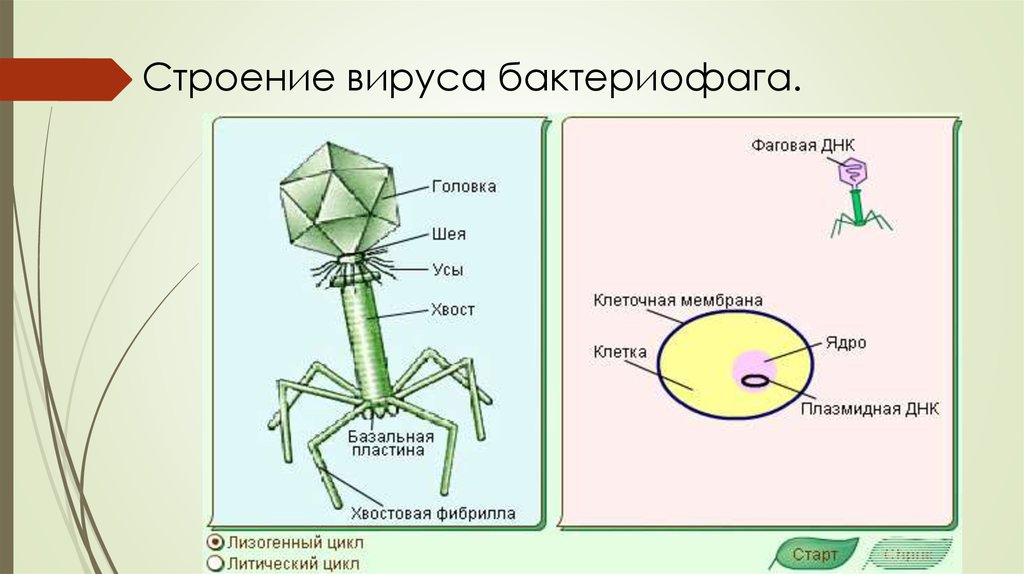 При хронической инфекции новые фаговые частицы продуцируются непрерывно в течение длительных периодов времени, но без явного уничтожения клеток.
При хронической инфекции новые фаговые частицы продуцируются непрерывно в течение длительных периодов времени, но без явного уничтожения клеток.
Роль в лабораторных исследованиях
Фаги сыграли важную роль в лабораторных исследованиях. Первыми изученными фагами были фаги, обозначенные как тип 1 (T1) — тип 7 (T7). Т-четные фаги Т2, Т4 и Т6 использовали в качестве модельных систем для изучения размножения вируса. В 1952 году Альфред Дэй Херши и Марта Чейз использовали бактериофаг Т2 в известном эксперименте, в котором они продемонстрировали, что для их репликации в бактериях необходимы только нуклеиновые кислоты молекул фага. Результаты эксперимента подтвердили теорию о том, что ДНК является генетическим материалом. За работу с бактериофагами Херши был удостоен Нобелевской премии по физиологии и медицине в 1919 г.69. Он разделил награду с биологами Сальвадором Лурией и Максом Дельбрюком, чьи эксперименты с фагом Т1 в 1943 году (флуктуационный тест) показали, что устойчивость бактерий к фагам является продуктом спонтанной мутации, а не прямой реакцией на факторы окружающей среды. Некоторые фаги, такие как лямбда, Mu и M13, используются в технологии рекомбинантной ДНК. Фаг ϕX174 был первым организмом, у которого была определена вся его нуклеотидная последовательность, и этот подвиг был совершен Фредериком Сэнгером и его коллегами в 1977.
Некоторые фаги, такие как лямбда, Mu и M13, используются в технологии рекомбинантной ДНК. Фаг ϕX174 был первым организмом, у которого была определена вся его нуклеотидная последовательность, и этот подвиг был совершен Фредериком Сэнгером и его коллегами в 1977.
В 1980-х годах американский биохимик Джордж П. Смит разработал технологию, известную как фаговый дисплей, которая позволила создавать искусственные белки. Такие белки были получены путем слияния чужеродных или сконструированных фрагментов ДНК с фаговым геном III. Ген III кодирует белок, экспрессируемый на поверхности вириона фага. Таким образом, слитые белки гена III, захваченные фагами, экспонировались на поверхности частиц вириона. Затем исследователи могли использовать антитела, разработанные для распознавания фрагмента чужеродного белка, для очистки культур слитых фагов, тем самым эффективно амплифицируя последовательность чужеродного гена для дальнейшего изучения. Британский биохимик Грегори П. Винтер впоследствии усовершенствовал технологию фагового дисплея для разработки белков человеческих антител. Такие белки могут быть использованы для лечения заболеваний у людей с меньшим риском вызвать потенциально опасные иммунные реакции по сравнению с предыдущими терапевтическими антителами, полученными от животных. Адалимумаб (Хумира), используемый для лечения ревматоидного артрита, был первым полностью человеческим антителом, полученным с помощью фагового дисплея, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (одобрено в 2002 г.). За свои открытия, связанные с фаговым дисплеем, Смит и Винтер были удостоены доли Нобелевской премии по химии 2018 года.
Такие белки могут быть использованы для лечения заболеваний у людей с меньшим риском вызвать потенциально опасные иммунные реакции по сравнению с предыдущими терапевтическими антителами, полученными от животных. Адалимумаб (Хумира), используемый для лечения ревматоидного артрита, был первым полностью человеческим антителом, полученным с помощью фагового дисплея, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (одобрено в 2002 г.). За свои открытия, связанные с фаговым дисплеем, Смит и Винтер были удостоены доли Нобелевской премии по химии 2018 года.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Фаготерапия
Вскоре после открытия Творт и д’Эрель начали использовать фаги для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Фаговая терапия не увенчалась успехом, и после открытия антибиотиков в 1940-х годах от нее практически отказались. Однако с появлением устойчивых к антибиотикам бактерий терапевтический потенциал фагов вновь привлек внимание.
Однако с появлением устойчивых к антибиотикам бактерий терапевтический потенциал фагов вновь привлек внимание.
Эта статья была недавно пересмотрена и обновлена Карой Роджерс.
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 28 сентября 2021 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации.
 Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам.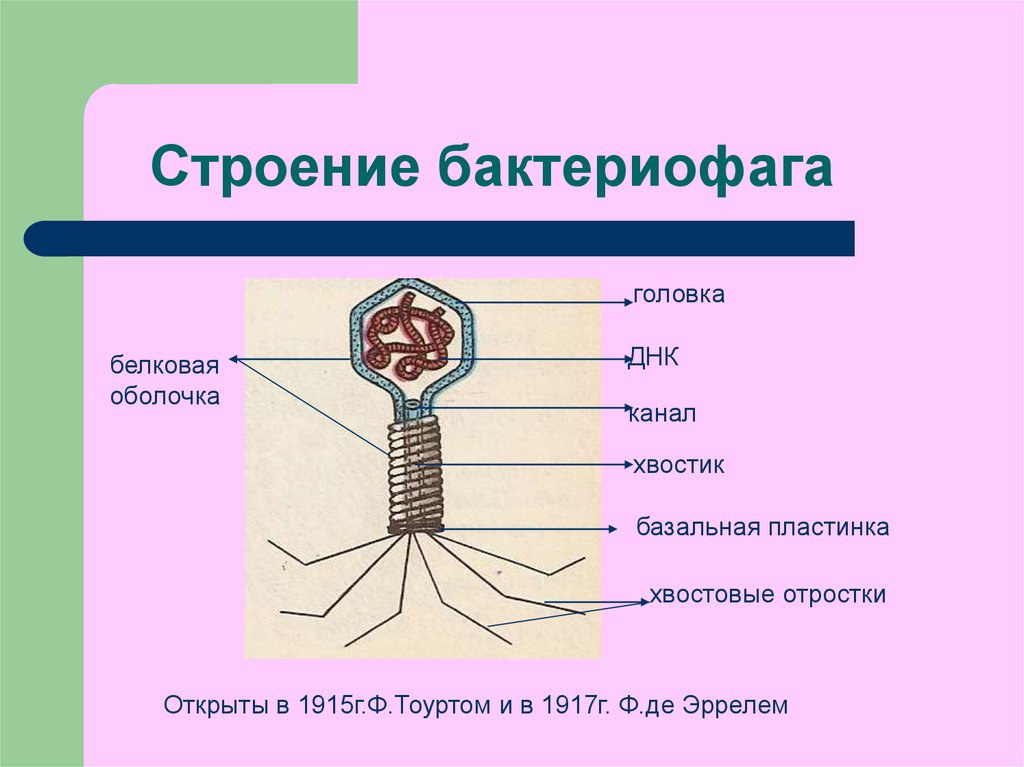 Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0094
Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0094
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5].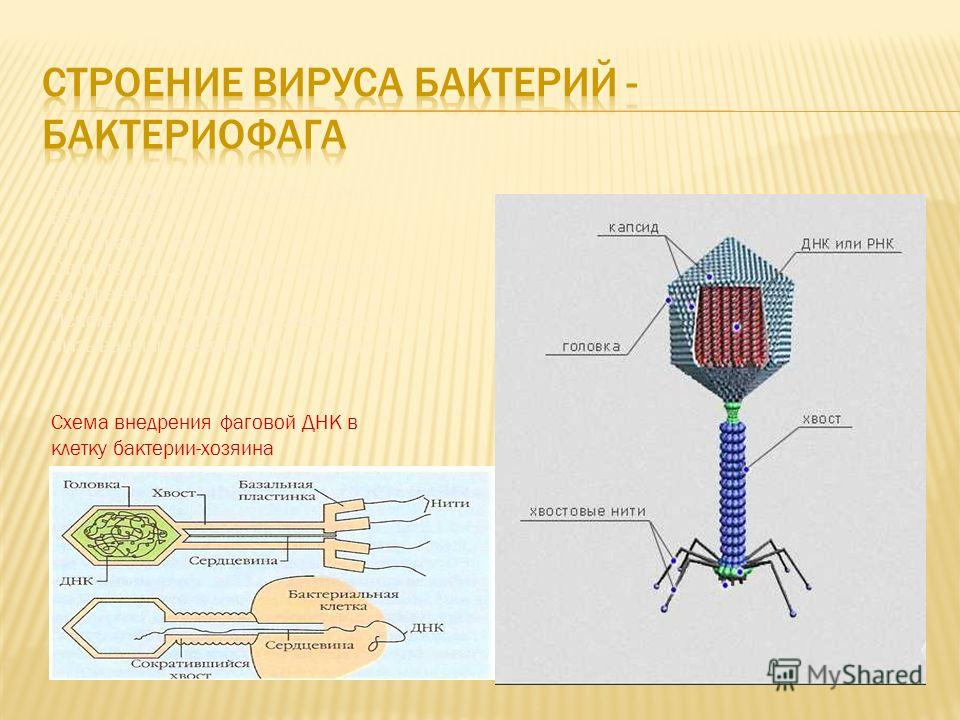 Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам.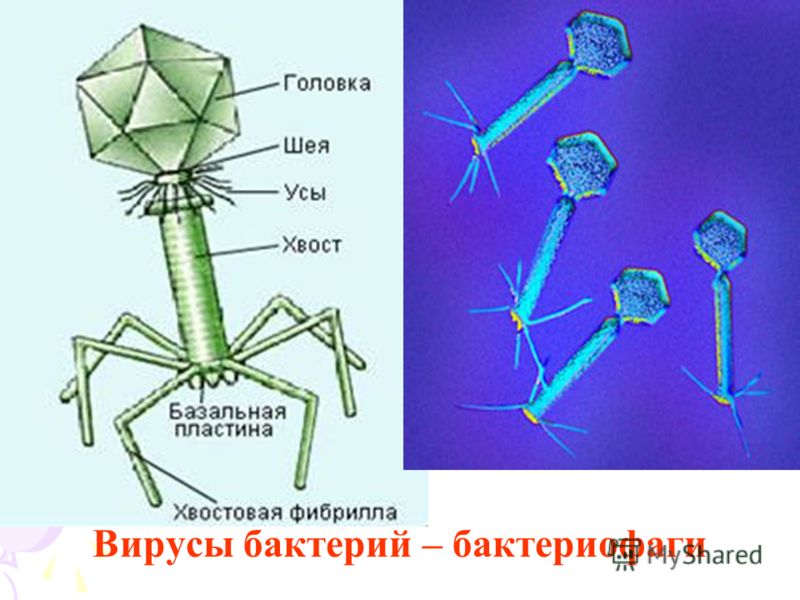 Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.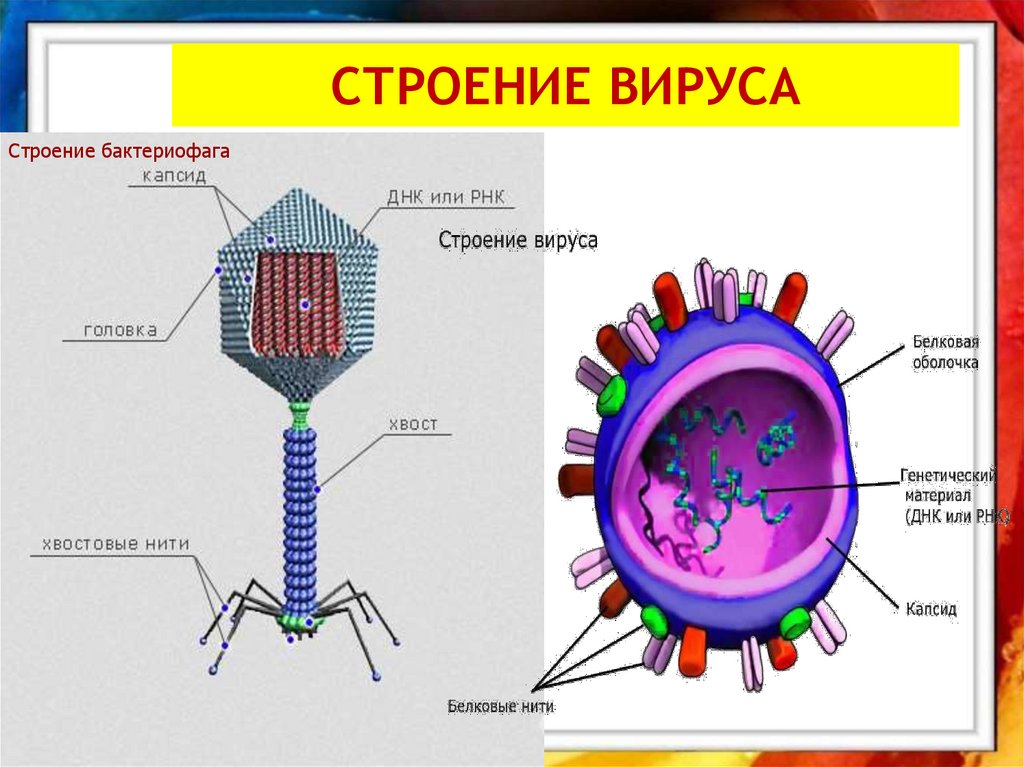
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями.
 Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 2018 Feb 13;9(1) [PMC бесплатная статья: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Статья бесплатно PMC: PMC5319590] [PubMed: 28232776]
- 9.

Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.

Fortier LC. Бактериофаги участвуют в формировании видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol. 2016 апр;32(4):67. [PubMed: 26931607]
- 16.
Schofield DA, Sharp NJ, Westwater C. Фаговые платформы для клинического обнаружения бактериальных патогенов человека. Бактериофаг. 2012 01 апреля; 2(2):105-283. [Бесплатная статья PMC: PMC3442824] [PubMed: 23050221]
- 17.
Wiśniewska K, Szewczyk A, Piechowicz L, Bronk M, Samet A, Swieć K.
 Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 28 сентября 2021 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина.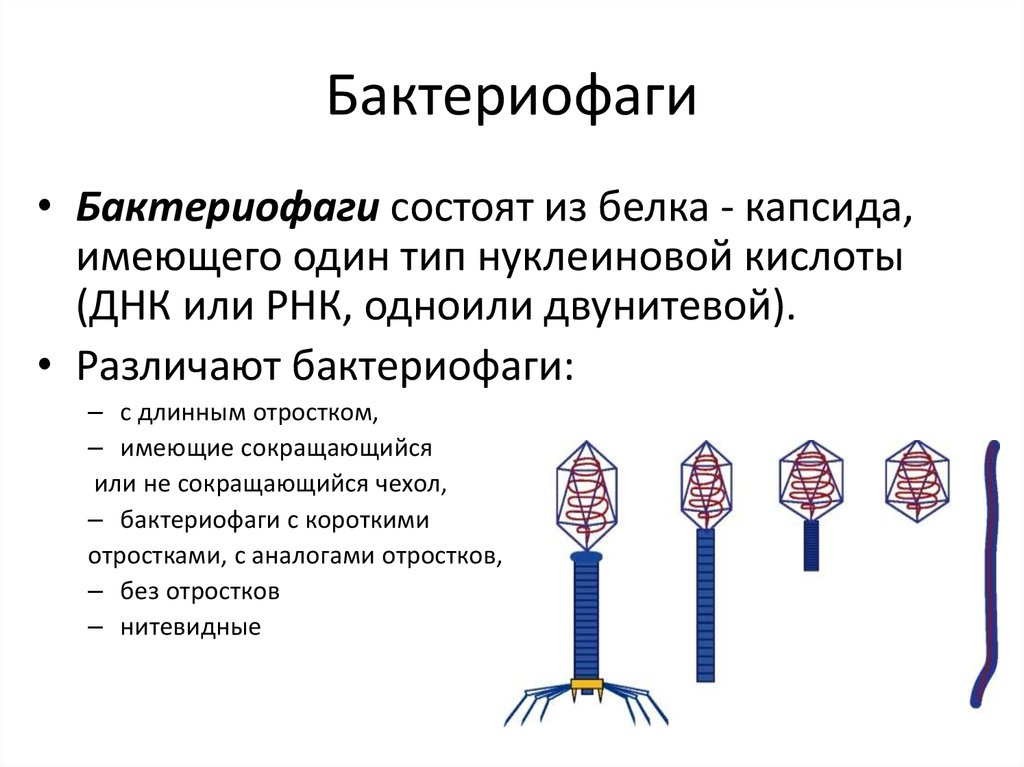 Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина.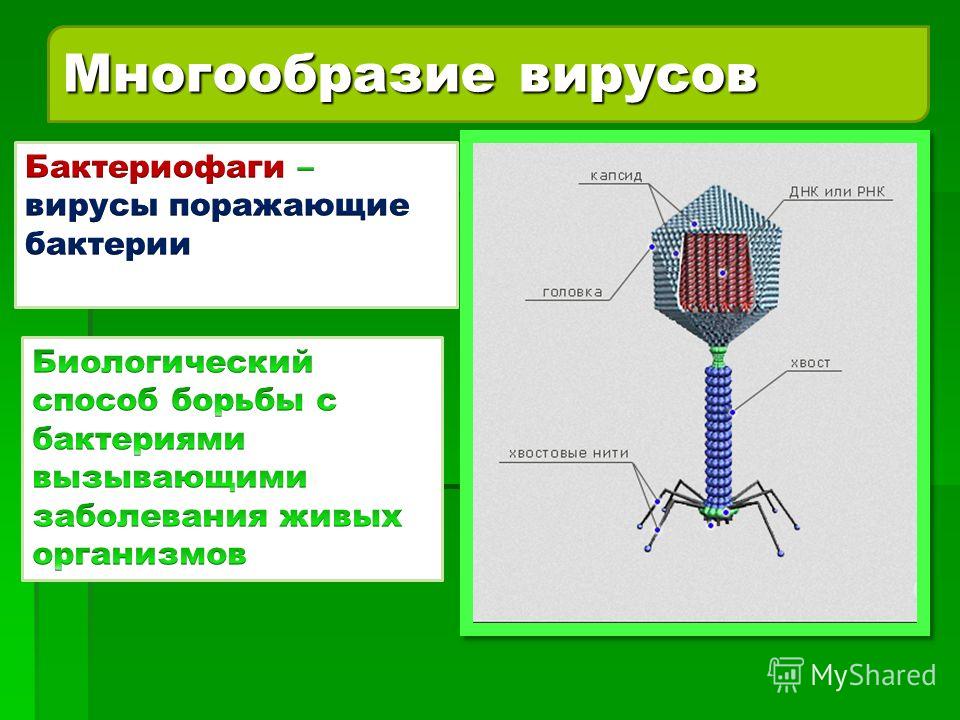 В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации.
 Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0094
Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0094
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии.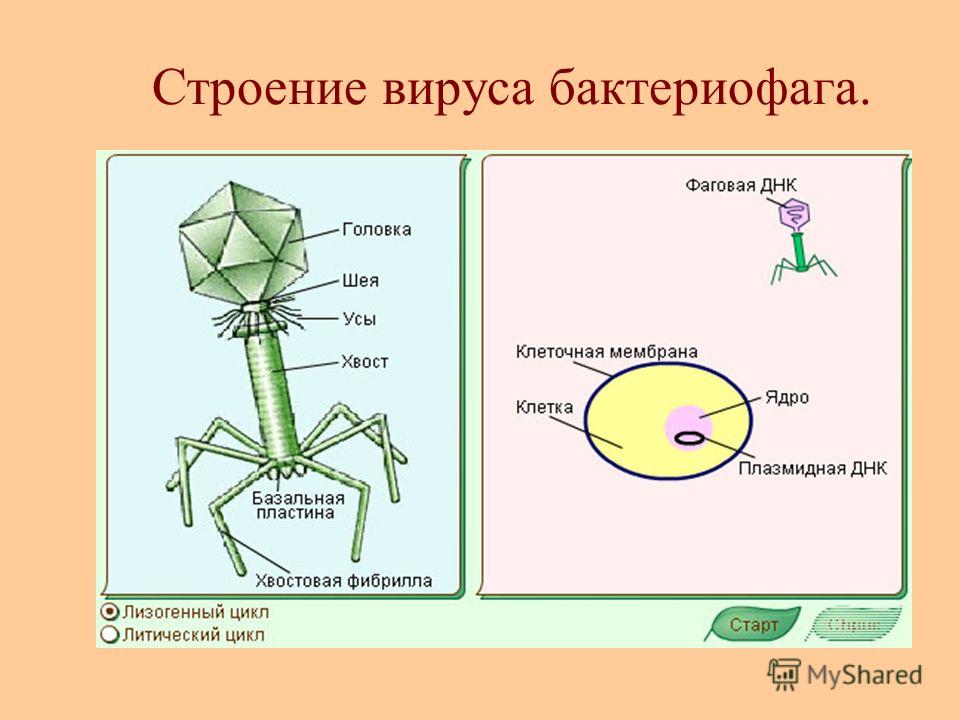 Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями.
 Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 2018 Feb 13;9(1) [PMC бесплатная статья: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Статья бесплатно PMC: PMC5319590] [PubMed: 28232776]
- 9.

Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.



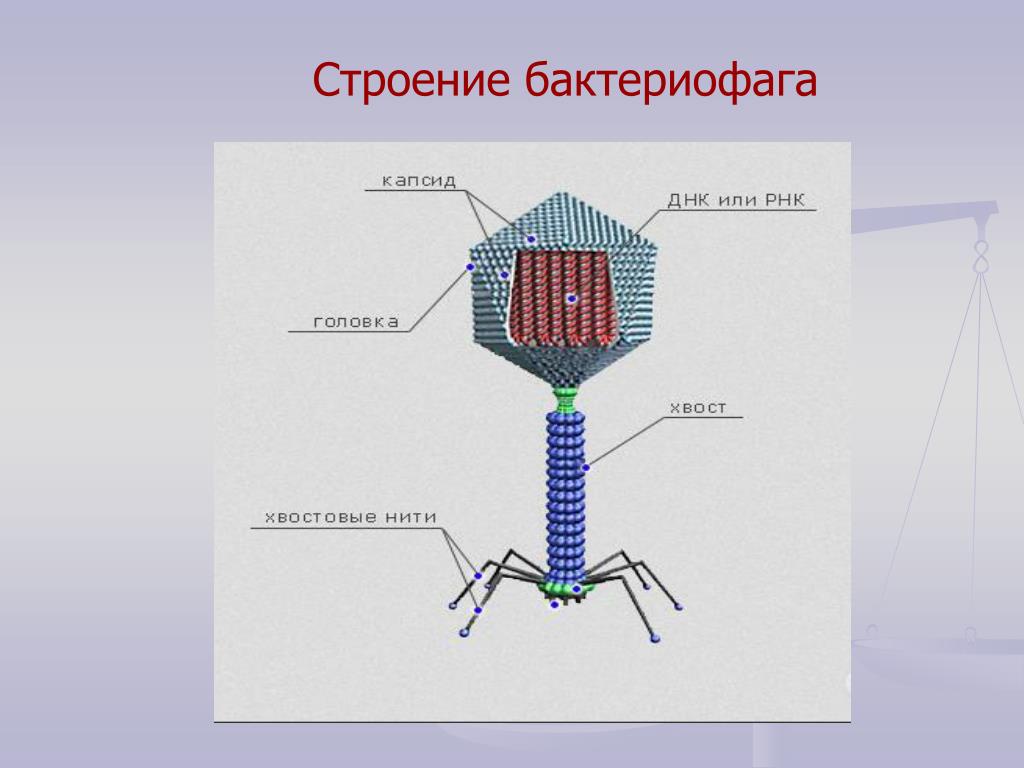 Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
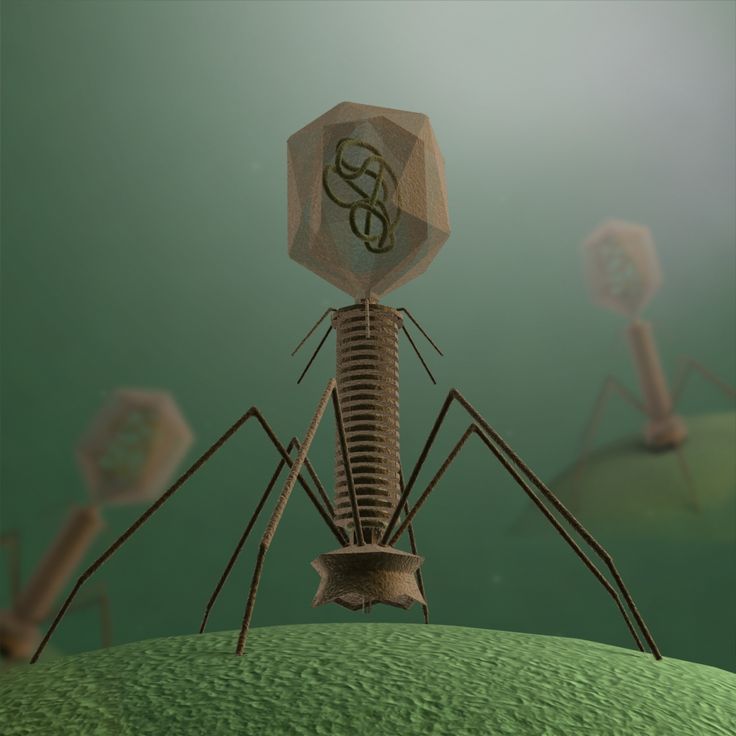
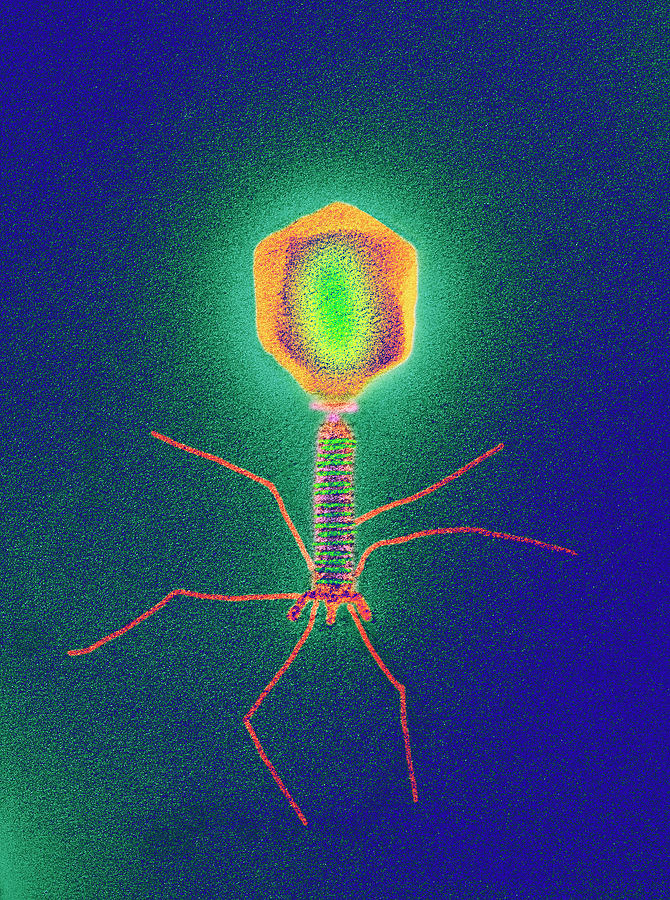 Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]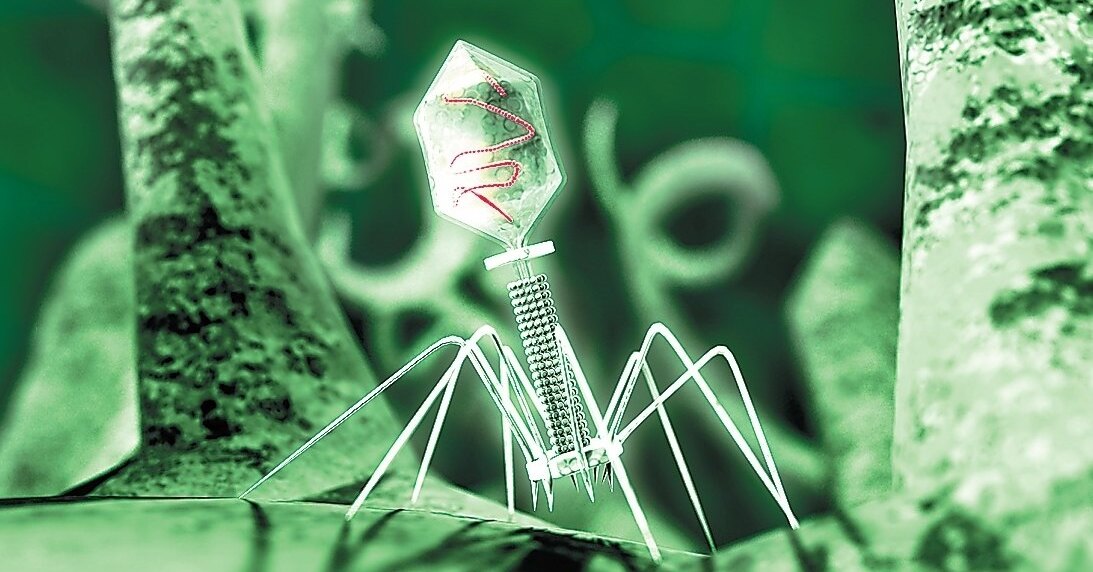 Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]