Содержание
Ученые планируют выращивать на МКС человеческие органы
Тренды
Телеканал
Газета
Pro
Инвестиции
РБК+
Новая экономика
Тренды
Недвижимость
Спорт
Стиль
Национальные проекты
Город
Крипто
Дискуссионный клуб
Исследования
Кредитные рейтинги
Франшизы
Конференции
Спецпроекты СПб
Конференции СПб
Спецпроекты
Проверка контрагентов
РБК Библиотека
Подкасты
ESG-индекс
Политика
Экономика
Бизнес
Технологии и медиа
Финансы
РБК КомпанииРБК Life
РБК
Тренды
Фото: NASA
Группа исследователей из Цюрихского университета проведет эксперимент по выращиванию органоидов в условиях невесомости
Что происходит
- Исследователи из Космического центра Цюрихского университета совместно с Airbus 28 августа 2021 года в рамках полета по пополнению запасов отправили на МКС стволовые клетки человека для выращивания органоидов, — мини-копий человеческих органов.

- Проект получил название «3D органоиды в космосе». Он был разработан исследователями Цюрихского университета Оливером Ульрихом и Корой Тиль, которые изучили, как гравитация влияет на человеческие клетки. Команда Airbus Innovations, в свою очередь, разработала необходимое оборудование и обеспечивает доступ к МКС.
- Разработка проекта заняла у создателей три года, а 18 месяцев назад завершились подготовительные испытания на МКС, в рамках которых в условиях микрогравитации стволовые клетки человека превратились в органоподобные структуры, такие как печень, кости и хрящи.
- Исследователи отмечают, что на Земле выращивать трехмерные органоиды невозможно из-за силы земного притяжения.
- Если эксперимент увенчается успехом, в будущем будет запущено промышленное производство человеческих органоидов в условиях гравитации для дальнейшего использования в медицинских исследованиях.
Что это значит
В настоящее время наблюдается усиленный интерес мирового научного сообщества к перспективам, которые предоставляет космос. Выращивание человеческих органов в условиях невесомости, — одно из многообещающих направлений в контексте изучения возможностей внеземного пространства.
Выращивание человеческих органов в условиях невесомости, — одно из многообещающих направлений в контексте изучения возможностей внеземного пространства.
Успешное проведение данного эксперимента станет настоящим прорывом для медицины. Во-первых, трехмерные органоиды представляют большой интерес для фармацевтических компаний, поскольку они позволяют проводить токсикологические исследования непосредственно на тканях человека, без необходимости проведения экспериментов на животных. Кроме того, в будущем органоиды, выращенные из стволовых клеток пациентов, могут быть использованы для трансплантации — возможно, это поможет удовлетворить мировой спрос на донорские органы.
В 2019 году NASA отправила на Международную космическую станцию биологический 3D-принтер для печати человеческих органов, а ранее в 2021 году на МКС был доставлен аппарат для 3D-печати из реголита в условиях Луны.
BioFabrication Facility для 3D-печати человеческих органов
(Фото: Techshot)
Обновлено 31. 08.2021
08.2021
Текст
Ксения Янушкевич
Главное в тренде
Материалы по теме
Выращивать органы и еду: зачем российские ученые посылают стволовые клетки в космос
В конце марта на Землю вернулся биореактор со стволовыми клетками, пробывший 13 дней на Международной космической станции. Удалось ли им пережить путешествие, зачем посылать стволовые клетки в космос и что потом из них можно вырастить, рассказали «Газете.Ru» аспирант Института регенеративной медицины Научно-технического парка биомедицины Сеченовского университета Наталья Чепелова и директор по науке Института стволовых клеток человека Роман Деев.
Эксперимент МСК-2, проводимый Первым МГМУ им. И.М. Сеченова в сотрудничестве с РКК «Энергия» и НПП «БиоТехСис» направлен на изучение того, как выживают и ведут себя различные линии клеток в условиях космического полета. В перспективе его результаты позволят понять, что происходит в организме космонавтов и как можно повлиять на эти процессы.
В перспективе его результаты позволят понять, что происходит в организме космонавтов и как можно повлиять на эти процессы.
«Микрогравитация влияет на все процессы, протекающие внутри клетки, в особенности на кальций-натриевый обмен, что сказывается на состоянии костной ткани, — рассказала «Газете.Ru» аспирант Института регенеративной медицины Научно-технического парка биомедицины Сеченовского университета Наталья Чепелова. — Отсутствие гравитации вызывает потерю костной массы у космонавтов, что становится серьезной преградой для осуществления долгосрочных космических миссий. В наши планы входит разработать модели костной и хрящевой ткани в условиях микрогравитации.
Моделирование и установление механизмов, которые приводят к развитию заболеваний опорно-двигательного аппарата в перспективе могут позволить разработать решение для профилактики и лечения остеопении не только у космонавтов, но и у людей на Земле, страдающих от таких социально значимых заболеваний, как остеопороз».
Кроме того, в условиях микрогравитации интенсивнее работает сердце, что вызывает проблемы с сердечно-сосудистой системой. Чтобы хорошо изучить последствия такой перегрузки, тоже нужны клеточные модели, наблюдение за которыми будет проходить в условиях микрогравитации. Создать их на Земле практически невозможно.
Чтобы вырастить необходимые для исследований клетки прямо на борту МКС, сначала нужно доставить туда биореактор с трехмерной коллагеновой матрицей, заселенной стволовыми клетками, к которым поступают питательные вещества. В первых полетах практически все клетки погибали, но модификация реактора, позволившая активнее снабжать их питательными веществами и удалять продукты клеточного метаболизма, значительно повысила выживаемость.
close
100%
«В предыдущих экспериментах живыми возвращалось несколько тысяч клеток, хотя отправлено было несколько миллионов. При этом у них была значительно снижена пролиферативная активность, — поясняет Чепелова. —
В последних полетах мы добились того, что по прибытии на Землю клетки лучше выживали, сохраняли способность к размножению и формировали монослой при культивировании на чашках Петри. Это важно для последующего анализа, так как, чем больше есть клеток в распоряжении, тем точнее можно интерпретировать результаты эксперимента.
Это важно для последующего анализа, так как, чем больше есть клеток в распоряжении, тем точнее можно интерпретировать результаты эксперимента.
Насколько именно улучшилась выживаемость клеток — ответить пока сложно, анализ результатов все еще продолжается».
Результаты эксперимента открывают путь к выращиванию на космических станциях клеток для массы задач, как исследовательских, так и прикладных. Помимо изучения остеопороза, стволовые клетки можно использовать для создания тканевых имплантов и выращивания органов, что пригодится в будущих длительных космических миссиях.
«В условиях микрогравитации клетки формируют ткань без воздействия силы тяжести, что в какой-то степени имитирует условия ранних этапов внутриутробного развития, — поясняет Чепелова. — Понимание фундаментальных основ протекающих процессов будет полезно для привнесения результатов в клиническую практику для реконструкции повреждений с использованием эквивалентов тканей».
Также из стволовых клеток можно культивировать мясо для питания, что снизит затраты на доставку продовольствия, в том числе при долгосрочных космических миссиях — похожий эксперимент предстоит провести участникам первой полностью частной космической миссии Axiom-1, правда, с помощью уже зрелых клеток мышечной ткани.
«Значимые прорывы только предстоят, — говорит Чепелова. — Но для нас каждый успешный эксперимент — прорыв на пути к большему открытию».
История изучения живых клеточных культур в космосе в нашей стране и за рубежом насчитывает не менее трех десятилетий, пояснил «Газете.Ru» директор по науке Института стволовых клеток человека Роман Деев. Отсутствие земного притяжения дает возможность получить из клеток самые неожиданные эквиваленты тканей, образование которых в обычных условиях невозможно. В условиях микрогравитации в клетках происходит ряд важных, неисследованных на Земле событий — изменение их способности прикрепляться к субстрату и друг к другу, перестройка их скелета и метаболической активности. В основе этого лежат изменения регуляции активности генов в ядре клеток.
«И если известный и понятный многим остеопороз все же может быть подвергнут фармакологической и физической коррекции, то утрата мышечной ткани, саркопения, являющаяся глобальной проблемой человечества, которая по прогнозам в ближайшее десятилетие затронет более 200 млн человек старше 40 лет, не имеет даже минимальных успехов в лечении, — добавляет Деев.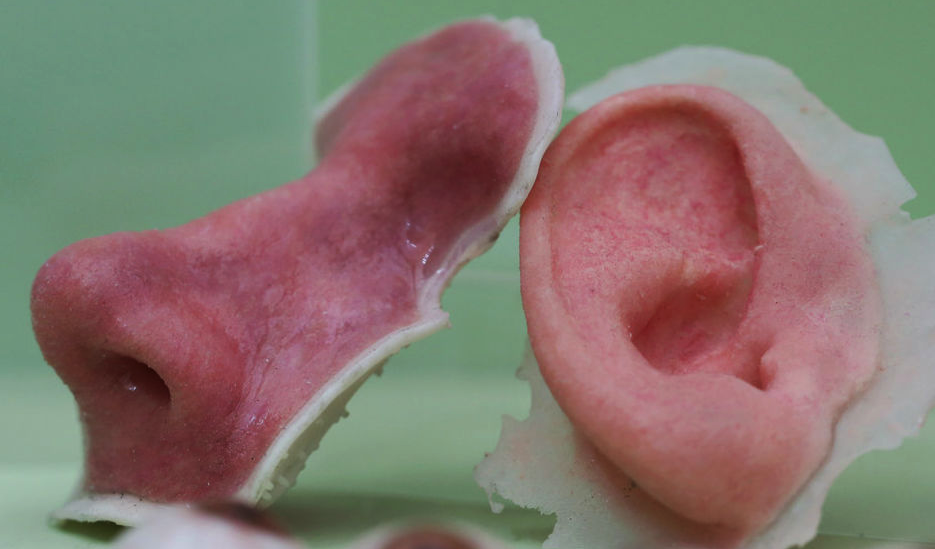 — А, значит, расшифровка эпигенетической регуляции генерации мышечных клеток и волокон становится весьма важной.
— А, значит, расшифровка эпигенетической регуляции генерации мышечных клеток и волокон становится весьма важной.
Под этим углом зрения космические клеточные эксперименты могут оказаться весьма востребованными».
Расшифровка молекулярно-генетических механизмов регуляции жизни клетки чрезвычайно важно для медико-биологического сопровождения будущих длительных космических полетов, подчеркивает Деев. Помимо микрогравитации, живые структуры в космосе сталкиваются с солнечной радиацией и другими повреждающими факторами, которые необходимо изучить, прежде чем перешагнуть порог дальнего космоса.
«Что до гастрономических перспектив, то пока и на Земле технологии получения ощутимых объемов мышечной ткани по сносной себестоимости недостижимы. В этом смысле, нельзя не согласиться с Чепеловой — значимые прорывы еще только предстоят», — заключает эксперт.
Эксперименты с клетками продлятся до 2023 года. За это время ученые планируют выяснить, насколько успешно в условиях микрогравитации клетки будут дифференцироваться — превращаться из стволовых в зрелые клетки с определенными функциями. Это позволит выращивать образцы тканей для исследований, питания и медицинского применения.
Это позволит выращивать образцы тканей для исследований, питания и медицинского применения.
БУДУЩЕЕ ЗАМЕНЕНИЯ ОРГАНОВ — ПОТРЕБНОСТИ, ПОТЕНЦИАЛЬНЫЕ ПРИМЕНЕНИЯ И ПРЕПЯТСТВИЯ К ПРИМЕНЕНИЮ
Transplant Proc. Авторская рукопись; доступно в PMC 2006 7 июня.
Опубликовано в окончательной редакции как:
Transplant Proc. 2006 март; 38(2): 362–364.
doi: 10.1016/j.transproceed.2005.12.055
PMCID: PMC1475508
NIHMSID: NIHMS9651
PMID: 16549121
3
3
Предложение органов, доступных для трансплантации, уже намного меньше спроса, и в ближайшем будущем спрос может существенно возрасти. По этой причине настало время рассмотреть вопрос о том, как в будущем может быть заменена функция органа. В этом сообщении мы рассматриваем новые технологии, которые могут быть использованы для замещения функции органа, препятствия на пути применения новых технологий, и теперь эти препятствия могут быть преодолены при разработке новых стратегий замены органов.
Будущее замены органов будет зависеть от трех переменных. Первая переменная – это потребность, в частности то, как количество органов, подлежащих замене, будет меняться с течением времени. Вторая переменная — это набор приложений и новых технологий, которые будут доступны для замены этих органов. Третья переменная представляет собой набор препятствий, биологических и социальных, которые могут препятствовать замещению функций органов. Это сообщение обобщает нашу точку зрения на то, как эти переменные могут измениться в обозримом будущем.
Потребность в замене органов может резко измениться в течение следующего периода лет 1 — 4 . Новые методы лечения болезней, лучшее питание и лучшие подходы к общественному здравоохранению снизят распространенность некоторых заболеваний, вызывающих недостаточность органов и, следовательно, потребность в трансплантации. Например, лучшая диета и лечение ингибиторами 3-гидрокси-3-метилглутарил-коэнзима А (ГМГ-коА)-редуктазы могут предотвратить атеросклероз и сердечную недостаточность у некоторых, возможно, у многих. Однако увеличение продолжительности жизни, вызванное улучшением медицинского обслуживания, питания и общественного здравоохранения, приведет к тому, что большая часть населения будет подвержена болезням старения, таким как диабет и сердечная или почечная недостаточность. Это увеличит распространенность органной недостаточности и потенциальную потребность в трансплантации.
Однако увеличение продолжительности жизни, вызванное улучшением медицинского обслуживания, питания и общественного здравоохранения, приведет к тому, что большая часть населения будет подвержена болезням старения, таким как диабет и сердечная или почечная недостаточность. Это увеличит распространенность органной недостаточности и потенциальную потребность в трансплантации.
Обстоятельства, при которых требуется замена органа, также могут вскоре измениться. Достижения в молекулярной диагностике, протеомике и других областях могут позволить выявлять смертельные заболевания задолго до появления клинических проявлений. Образец крови может выявить наличие рака почки или легкого до локализации поражения. Это событие побудит клинициста и пациента заменить потенциально «смертельные» органы трансплантатом. Такой подход уже используется в тех редких случаях, когда у младенца раннего возраста имеется дисморфология, предполагающая высокий риск развития опухоли Вильмса. Превентивная трансплантация как таковая могла бы резко увеличить потребность в замене органов и так же резко изменить представление о том, что считать адекватной заменой: нормальная функция и ограниченная или отсутствующая иммуносупрессия ценились бы даже больше, чем сегодня.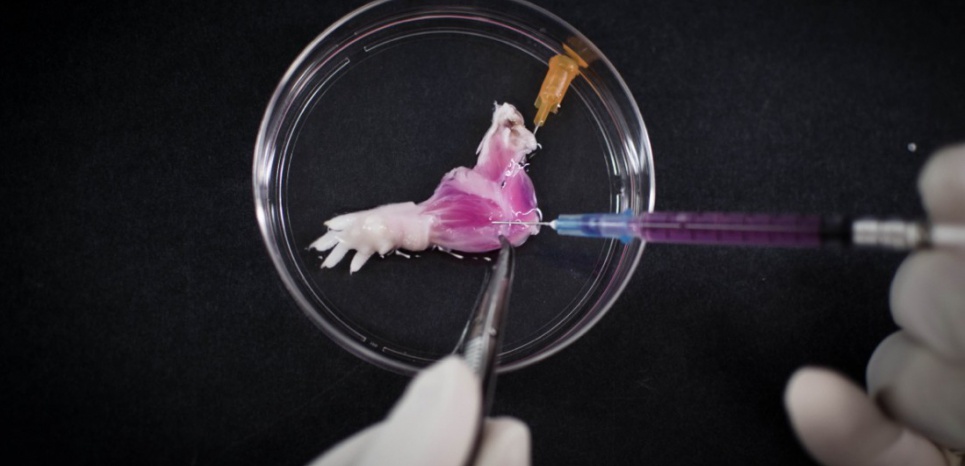
Растущая потребность в трансплантации сделает вопрос о том, какие новые технологии можно применить для удовлетворения этой потребности, станет еще более насущным. Аллотрансплантация уже далеко не удовлетворяет спрос на замену сердца, легких, почек и печени 5 , 6 . Возможно, доступность некоторых органов можно улучшить за счет увеличения донорства трупов или использования живых тканей. Тем не менее, аллотрансплантация не может обеспечить значительно большее количество органов, которое можно было бы запросить. Соответственно, мы рассмотрели достоинства других технологий, включая ксенотрансплантацию, имплантируемые устройства, стволовые клетки, тканевую инженерию, органогенез и ксенотрансплантацию 4 . Ниже мы кратко рассмотрим эту тему.
Ксенотрансплантация может обеспечить обильную, недорогую и физиологически удовлетворительную замену основных паренхиматозных органов, по крайней мере, в принципе. Мы обсуждали потенциальное применение ксенотрансплантации в другом месте и отсылаем читателя к этим обсуждениям 7 — 9 . Большое волнение вызвало потенциальное использование генной инженерии для ограничения иммунных и воспалительных реакций, ограничивающих функцию и выживаемость ксенотрансплантатов. Несмотря на этот энтузиазм, на сегодняшний день никакие генетические манипуляции не позволили органам свиней выжить и функционировать достаточно долго у приматов, чтобы предложить использовать эти органы у людей, и ни один еще не испытанный подход позволил выжить и функционировать после короткого периода без серьезных манипуляций и/или иммуносупрессия. Ниже мы обсудим другие потенциальные способы использования ксенотрансплантации, но на данный момент мы откажемся от этого подхода к замещению функции органов, за исключением, возможно, печени 10 .
Большое волнение вызвало потенциальное использование генной инженерии для ограничения иммунных и воспалительных реакций, ограничивающих функцию и выживаемость ксенотрансплантатов. Несмотря на этот энтузиазм, на сегодняшний день никакие генетические манипуляции не позволили органам свиней выжить и функционировать достаточно долго у приматов, чтобы предложить использовать эти органы у людей, и ни один еще не испытанный подход позволил выжить и функционировать после короткого периода без серьезных манипуляций и/или иммуносупрессия. Ниже мы обсудим другие потенциальные способы использования ксенотрансплантации, но на данный момент мы откажемся от этого подхода к замещению функции органов, за исключением, возможно, печени 10 .
В экспериментальном порядке доступны полностью имплантируемые устройства для замены функции сердца. Устройства используются только в экстремальных условиях, и их использование сопряжено со значительным риском. Тем не менее, мы считаем, что технология будет совершенствоваться по мере использования, и можно предположить, что однажды все замены сердца можно будет решить таким образом. К сожалению, этого нельзя сказать о других органах. Хотя внешние устройства и процедуры, такие как диализ, могут заменить функцию легких и почек, эти устройства и процедуры полностью заменяют их и вызывают серьезные осложнения. Поэтому трудно представить, что в обозримом будущем устройства обеспечат оптимальную замену функции органа, особенно если эта замена будет упреждающей.
К сожалению, этого нельзя сказать о других органах. Хотя внешние устройства и процедуры, такие как диализ, могут заменить функцию легких и почек, эти устройства и процедуры полностью заменяют их и вызывают серьезные осложнения. Поэтому трудно представить, что в обозримом будущем устройства обеспечат оптимальную замену функции органа, особенно если эта замена будет упреждающей.
Стволовые клетки обладают способностью размножаться и дифференцироваться в относительно зрелые клетки различных типов. Эмбриональные стволовые клетки могут стать любым органом тела и делают это при имплантации в бластоцисту. В принципе, тогда эмбриональные стволовые клетки можно было бы использовать для замены любого органа в организме. Однако по крайней мере два фактора ограничивают эту возможность. Во-первых, эмбриональные стволовые клетки и линии эмбриональных стволовых клеток неизбежно генетически отличаются от человека, которого лечат, и их использование, а использование тканей или органов, полученных из этих клеток, может потребовать иммуносупрессии.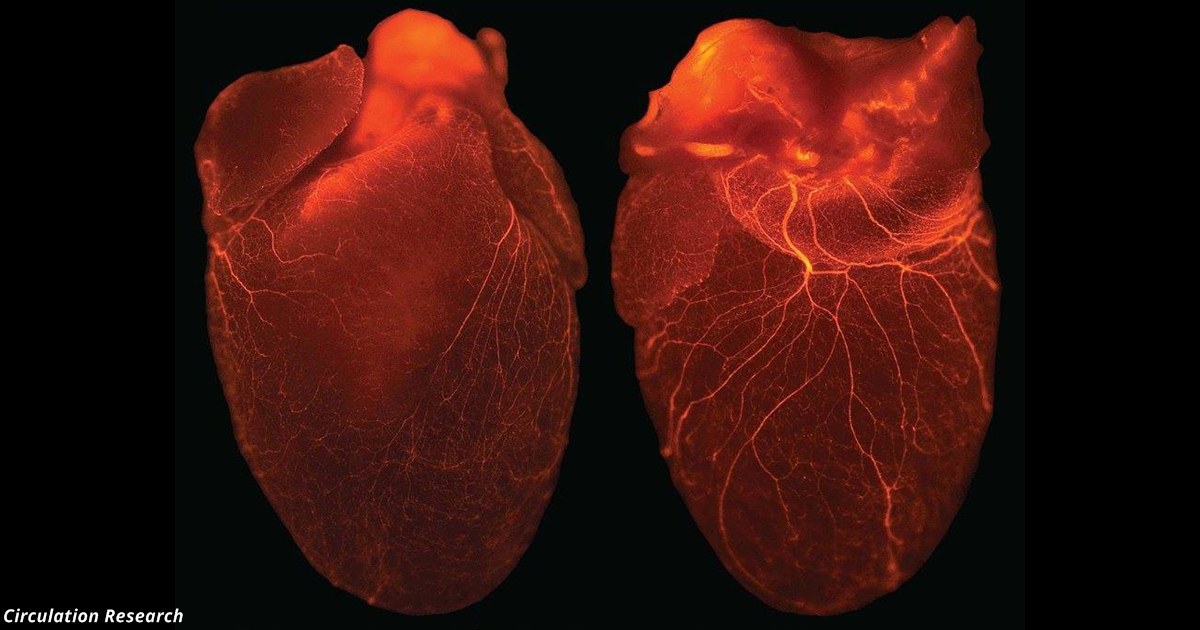 Эта проблема потенциально может быть решена путем клонирования 4 , как описано ниже. Большее ограничение использования эмбриональных стволовых клеток (или стволовых клеток, полученных ядерным клонированием) заключается в том, что, хотя эти клетки могут быть выращены в дифференцированные клетки и ткани, неизвестны средства, с помощью которых эти клетки можно уговорить сформировать органы вне эмбриона. Таким образом, пределом технологии стволовых клеток является микроокружение плода.
Эта проблема потенциально может быть решена путем клонирования 4 , как описано ниже. Большее ограничение использования эмбриональных стволовых клеток (или стволовых клеток, полученных ядерным клонированием) заключается в том, что, хотя эти клетки могут быть выращены в дифференцированные клетки и ткани, неизвестны средства, с помощью которых эти клетки можно уговорить сформировать органы вне эмбриона. Таким образом, пределом технологии стволовых клеток является микроокружение плода.
Другой технологией, которую иногда предлагают для замены органов, является органогенез. Органогенез относится к выращиванию интактных органов или органоподобных тканей из примитивных клеток. Подобно тому, как органогенез происходит естественным образом у плода, он также может происходить, когда ткани или клетки первичного органа плода помещаются в культуру или имплантируются живым животным. Например, выращенные ткани почек плода могут генерировать созревающие клубочки in vitro 11 и органы взрослых млекопитающих 12 . Ткани и клетки плода также можно использовать для создания инженерных структур 13 . Однако применение органогенеза ограничено источником и иммуногенностью тканей плода. Ткань плода человека для этой цели не подходит. Некоторые предлагали вместо этого использовать эмбриональные ткани животных 14 . Однако органогенез ксеногенного органа нарушается иммунитетом против этого органа, и этот барьер, вероятно, равен барьеру для аллотрансплантации, за некоторыми исключениями 15 .
Ткани и клетки плода также можно использовать для создания инженерных структур 13 . Однако применение органогенеза ограничено источником и иммуногенностью тканей плода. Ткань плода человека для этой цели не подходит. Некоторые предлагали вместо этого использовать эмбриональные ткани животных 14 . Однако органогенез ксеногенного органа нарушается иммунитетом против этого органа, и этот барьер, вероятно, равен барьеру для аллотрансплантации, за некоторыми исключениями 15 .
Мы предложили устранить препятствия на пути замены органов, если объединить различные технологии таким образом, чтобы использовать преимущества каждой технологии 2 , 4 . Таким образом, ядерное клонирование (перенос ядер из зрелых клеток человека, подлежащего лечению, в примитивные энуклеированные клетки, что позволяет перепрограммировать ДНК) может быть использовано для создания эмбриональных стволовых клеток. Чтобы избежать этических проблем ядерного клонирования и потенциальной иммуногенности белков, кодируемых чужеродной митохондриальной ДНК, можно было бы предусмотреть обработку зрелых клеток «факторами клонирования», полученными из ксеногенных источников, которые могли бы частично перепрограммировать ядра без переноса.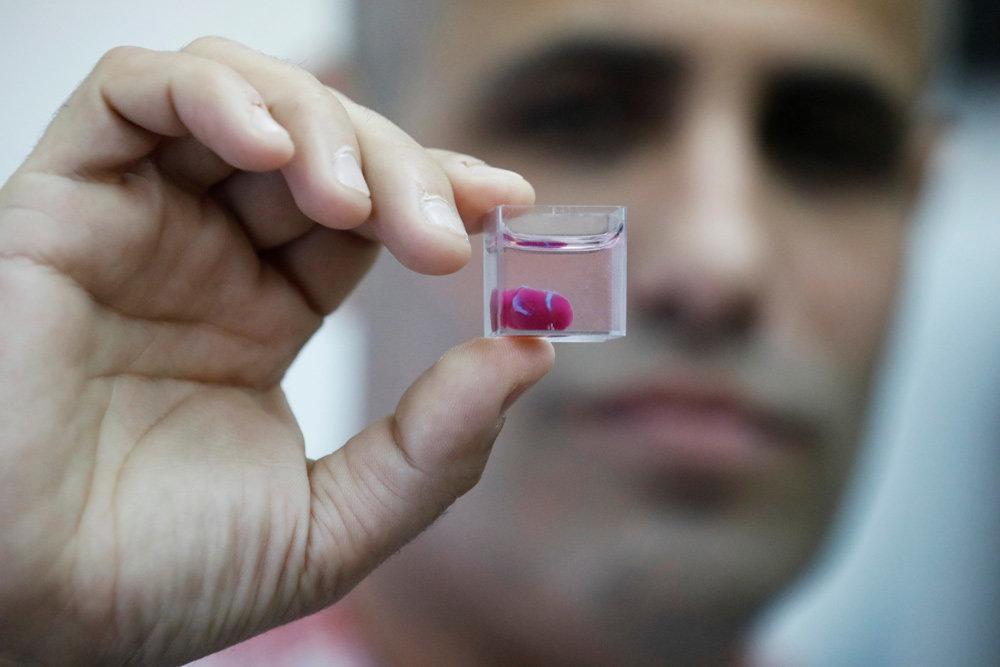 0025 16 . Стволовые клетки, полученные таким образом, можно заставить созреть, поместив их в подходящее место в ксеногенном плоде 9 . Например, мы показали, что человеческие стволовые клетки, введенные в плод свиньи, могут созревать нормальным, гистотипическим образом в соответствующих местах плода свиньи 17 , 18 . Ткани, которые начинают созревать в этой ксеногенной системе, затем могут быть собраны, а клетки человека выделены и перенесены в человека для лечения, чтобы могло произойти полное созревание и васкуляризация (т. Е. Органогенез).
0025 16 . Стволовые клетки, полученные таким образом, можно заставить созреть, поместив их в подходящее место в ксеногенном плоде 9 . Например, мы показали, что человеческие стволовые клетки, введенные в плод свиньи, могут созревать нормальным, гистотипическим образом в соответствующих местах плода свиньи 17 , 18 . Ткани, которые начинают созревать в этой ксеногенной системе, затем могут быть собраны, а клетки человека выделены и перенесены в человека для лечения, чтобы могло произойти полное созревание и васкуляризация (т. Е. Органогенез).
Обсуждаемая здесь стратегия сложна и может никогда не быть реализована. Однако каждый шаг был выполнен в той или иной экспериментальной системе, и чего не хватает, так это соединения шагов воедино. Независимо от того, будет ли эта согласованная стратегия успешной, мы считаем, что усилия, предпринятые для ее проверки, могут привести к новым знаниям и новым представлениям о том, как в будущем можно заменить органы.
Работа авторов поддерживается грантами Национального института здравоохранения (HL52297, H146810).
1. Огл Б.М., Платт Дж.Л. Подходы к замещению функции отказавших органов. Карр Опин Трансплантация органов. 2002; 7:28. [Google Scholar]
2. Огле Б.М., Каскальо М., Платт Дж.Л. Объединение подходов к лечению органной недостаточности. Ам Джей Трансплант. 2004; 4 (Приложение 6): 74. [PubMed] [Google Scholar]
3. Cascalho M, Ogle BM, Platt JL. Ксенотрансплантация и будущее замены почки. J Am Soc Нефрол. 2004; 15:1106. [PubMed] [Академия Google]
4. Каскальо М., Платт Дж. Новые технологии замены и увеличения органов. Мэйо Клин Proc. 2005;80:370. [PubMed] [Google Scholar]
5. Evans RW, Orians CE, Ascher NL. Потенциальное предложение доноров органов: оценка эффективности усилий по закупке органов в Соединенных Штатах. ДЖАМА. 1992; 267:239. [PubMed] [Google Scholar]
6. Эванс Р.В. Примирение с реальностью: почему ксенотрансплантация является необходимостью. В: Platt JL, редактор. Ксенотрансплантация. Том. 29. АСМ Пресс; Вашингтон, округ Колумбия: 2001. [Google Scholar]
В: Platt JL, редактор. Ксенотрансплантация. Том. 29. АСМ Пресс; Вашингтон, округ Колумбия: 2001. [Google Scholar]
7. Platt JL, Vercellotti GM, Dalmasso AP, et al. Трансплантация дискордантных ксенотрансплантатов: обзор прогресса. Иммунол сегодня. 1990;11:450. [PubMed] [Google Scholar]
8. Parker W, Saadi S, Lin SS, Holzknecht ZE, Bustos M, Platt JL. Трансплантация дискордантных ксенотрансплантатов: новый взгляд на проблему. Иммунол сегодня. 1996; 17:373. [PubMed] [Google Scholar]
9. Cascalho M, Platt JL. Ксенотрансплантация и другие способы замены органов. Нат Рев Иммунол. 2001; 1:154. [PubMed] [Академия Google]
10. Нагата Х., Ито М., Кай Дж., Эдж А., Платт Дж.Л., Фокс И.Дж. Лечение цирроза и печеночной недостаточности у крыс путем ксенотрансплантации гепатоцитов. Гастроэнтерология. 2003; 124:422. [PubMed] [Google Scholar]
11. Platt JL, Brown DM, Granlund K, Oegema TR, Klein DJ. Метаболизм протеогликанов, связанный с развитием метанефры мыши: морфологические и биохимические эффекты β-D-ксилозида.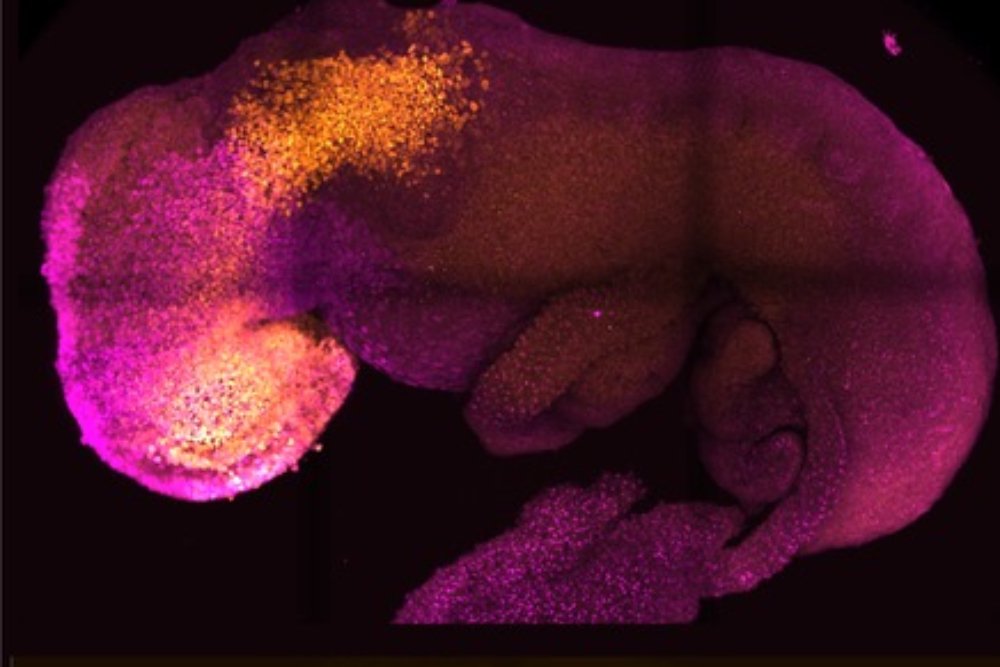 Дев биол. 1987; 123:293. [PubMed] [Google Scholar]
Дев биол. 1987; 123:293. [PubMed] [Google Scholar]
12. Роджерс С.А., Лоуэлл Дж.А., Хаммерман Н.А., Хаммерман М.Р. Трансплантация развивающихся метанефросов взрослым крысам. почки инт. 1998;54:27. [PubMed] [Google Scholar]
13. Lanza RP, Chung HY, Yoo JJ, et al. Получение гистосовместимых тканей с помощью ядерной трансплантации. Нац биотехнолог. 2002; 20:689. [PubMed] [Google Scholar]
14. Hammerman MR. Трансплантация эмбриональных органов. Ам Джей Трансплант. 2004; 4 (Приложение 6): 14. [PubMed] [Google Scholar]
15. Dekel B, Burakova T, Arditti FD, et al. Ранние предшественники почек человека и свиньи как новый источник для трансплантации. Нат Мед. 2003; 9:53. [PubMed] [Академия Google]
16. Hansis C, Barreto G, Maltry N, Niehrs C. Для ядерного перепрограммирования соматических клеток человека с помощью экстракта яиц xenopus требуется BRG1. Карр Биол. 2004; 14:1475. [PubMed] [Google Scholar]
17. Ogle BM, Butters KB, Plummer TB, et al. Спонтанное слияние клеток между видами приводит к трансдифференцировке и ретровирусу in vivo. FASEB J. 2004; 18:548. [PubMed] [Google Scholar]
FASEB J. 2004; 18:548. [PubMed] [Google Scholar]
18. Огле Б.М., Каскальо М., Платт Дж.Л. Биологические последствия слияния клеток. Nat Rev Mol Cell Biol. 2005; 6:567. [PubMed] [Академия Google]
Вызов химеры
Сейчас 2036 год, у вас почечная недостаточность. До недавнего времени это состояние означало месяцы или годы изнурительного диализа, в то время как вы надеялись, что появится подходящий донор, который предоставит вам замену почки. Сегодня, благодаря новой технологии, вы будете выращивать свои собственные.
Техник берет небольшой образец вашей крови или кожи и отправляет его в лабораторию. Там содержащиеся в нем клетки выделяют, культивируют и обрабатывают различными препаратами. Процедура трансформирует клетки в индуцированные плюрипотентные стволовые (iPS) клетки, которые, подобно клеткам раннего эмбриона, способны генерировать любую ткань организма.
Затем техник выбирает эмбрион свиньи, в котором отсутствует ген, необходимый для роста почек, и вводит в него ваши iPS-клетки. Этот эмбрион имплантируется в суррогатную свиноматку, где он развивается в молодую свинью, у которой есть две почки, состоящие из ваших человеческих клеток. В конце концов, эти почки пересаживаются в ваше тело, что значительно увеличивает продолжительность вашей жизни.
Этот эмбрион имплантируется в суррогатную свиноматку, где он развивается в молодую свинью, у которой есть две почки, состоящие из ваших человеческих клеток. В конце концов, эти почки пересаживаются в ваше тело, что значительно увеличивает продолжительность вашей жизни.
Часть Nature Outlook: стволовые клетки
Эта гипотетическая свинья — химера: животное, состоящее из клеток, полученных более чем из одной оплодотворенной яйцеклетки. Название происходит от химеры, наполовину льва, наполовину козла, наполовину змея из древней мифологии. И прямо сейчас небольшое количество ученых работает над тем, чтобы сделать описанный выше сценарий почек реальностью.
Среди них Хиромицу Накаучи, клеточный биолог из Стэнфордского университета в Калифорнии. Накаучи, получивший образование иммунолога, изначально занимался тем, как предотвратить отторжение трансплантатов иммунной системой реципиента. Но простое осознание заставило его изменить направление. «Главная проблема не в иммунологическом отторжении, — говорит он, — а в нехватке донорских органов».
По оценкам Всемирной организации здравоохранения, в настоящее время удовлетворяется лишь около 10% глобальной потребности в трансплантации органов. В Соединенных Штатах каждый день около 20 человек умирают в ожидании трансплантации. Эта ситуация является основной мотивацией и моральным основанием для проведения исследований химер.
Ранняя работа Накаучи с химерами была встречена с ужасом. «Десять лет назад я был сумасшедшим ученым, — говорит он. Сегодня он считает, что биомедицинское сообщество широко поддерживает его усилия по созданию клинически полезных органов и тканей путем слияния клеток человека и животных. Тем не менее, по мере развития химерных технологий этические вопросы продолжают возникать, о чем свидетельствуют ответы на апрельский отчет о производстве химерных эмбрионов обезьяны-человека.
«Единственным риском является смешение и стирание границ между человеком и животными», — говорит Нита Фарахани, специалист по этике из Университета Дьюка в Дареме, Северная Каролина. «Нам нужно смотреть, куда движется исследование, чтобы убедиться, что оно проводится этически допустимым образом — и что оно не выходит за рамки, которые мы, как общество, не хотели бы пересекать».
«Нам нужно смотреть, куда движется исследование, чтобы убедиться, что оно проводится этически допустимым образом — и что оно не выходит за рамки, которые мы, как общество, не хотели бы пересекать».
Создание химер
На протяжении веков ученые пересаживали ткани одного вида другому, чтобы улучшить понимание биологии. Многие люди, ходящие сегодня, могут делать это только потому, что их сердца содержат клапаны, взятые у овец или коров. Но межвидовая трансплантация стволовых клеток — это новый рубеж. В некоторых случаях эти клетки размножаются и интегрируются с видами-хозяевами, в результате чего появляются новые типы животных.
Выращивание органов одного вида внутри другого включает технику, называемую комплементацией бластоцисты. Бластоциста — это крошечный шарик клеток, образованный первыми раундами клеточного деления после оплодотворения. Из этих плюрипотентных клеток возникают все типы клеток зрелого организма. Если к бластоцисте добавляются плюрипотентные клетки другого представителя того же вида, развивается существо, состоящее из смеси двух клеточных популяций.
Когда к бластоцисте добавляют стволовые клетки другого вида, то, какой вклад они вносят в зрелое животное, по-видимому, зависит от эволюционного расстояния между хозяином и донором. Было показано, что два близкородственных вида мышей и два вида коров легко образуют химер. Другими видами, которые также сочетаются друг с другом, являются овцы и козы, а также крысы и мыши, хотя и менее успешно. В случае крыс и мышей донорские клетки обычно составляют около 20% взрослых клеток.
Донорские клетки также могут оказаться в разных местах получившихся химерных животных — они часто смешиваются с клетками-хозяевами во многих тканях, но имеют тенденцию быть более распространенными в одних регионах, чем в других. Когда в середине 2000-х годов Накаучи вышел на поле, он попытался направить донорские клетки в определенные ткани. В 2010 году, после того, как, наконец, были набраны два студента, готовые заняться неопределенным проектом, его лаборатория выпустила знаменательную статью, описывающую развитие мышей, у которых поджелудочная железа состояла из крысиных клеток 9. 0025 1 .
0025 1 .
Решающим вмешательством исследователей было удаление гена мыши-хозяина, необходимого для развития поджелудочной железы. Плюрипотентные клетки бластоцисты генерируют множество типов тканей организма путем деления и дифференциации — посредством экспрессии отдельных генов — в различные линии клеток, каждая из которых образует определенные ткани. У млекопитающих поджелудочная железа создается из линии, которая однозначно экспрессирует ген Pdx1 , поэтому, когда лаборатория Накаучи удалила этот ген из эмбрионов мыши, клетки мыши больше не могли стать клетками поджелудочной железы.
Накаучи надеялся, что это расчистит путь для донорских клеток крысы — и именно это и произошло. Поджелудочная железа клеток крысы (хотя и с сосудистой сетью, полученной от мыши) выросла до нормальных размеров поджелудочной железы мыши.
В 2017 году Накаучи показал, что работает и обратный процесс, выращивая мышиные поджелудочные железы у крыс 2 . Более того, если островки поджелудочной железы из этих выращенных на крысах мышиных органов трансплантировать мышам с диабетом, они исправят нарушенный контроль уровня сахара в крови.
Накаучи и другие с тех пор удалили гены, которые необходимы для развития почек, легких, глаз, печени и других органов у мышей, и показали, что клетки крыс также заполняют эти ниши. Однако для достижения этого результата с помощью свиней-хозяев и донорских клеток человека потребуется нечто большее, чем эта единственная тактика.
Элементы человека
В 2013 году Накаучи показал, что удаление гена Pdx1 из эмбрионов свиней и добавление к ним стволовых клеток свиней-доноров дает поджелудочную железу, полностью состоящую из донорских клеток 3 . Однако введение человеческих iPS-клеток в эмбрионы свиньи до сих пор приводило лишь к очень низким уровням образования химер.
Уточнение типа используемых иПС-клеток человека дало небольшие результаты. Но большинство исследователей считают, что свиньи и люди настолько далеки друг от друга, что существует фундаментальный барьер для образования химер. Барьер, вероятно, связан с различиями во времени развития и в сигнальных путях, которые используют отдаленно родственные виды.
Дэн и Мэри Гэрри вырастили человеческие мышечные клетки в эмбрионах свиней. Снимок: Майк Мэдисон
Некоторые из наиболее успешных усилий по преодолению этого барьера до сих пор были предприняты в лаборатории Университета Миннесоты в Миннеаполисе, где Мэри Гарри и ее муж Дэн Гарри, кардиолог-трансплантолог, работают над выращиванием свиней, у которых есть человеческие мышцы, и свиньи с человеческими сосудами. Последняя цель имеет решающее значение, потому что реципиент человеческого трансплантата может отторгнуть орган, состоящий из его собственных клеток, если он содержит кровеносные сосуды свиньи.
Удалив соответствующие гены, необходимые эмбрионам свиней для развития этих тканей, Гарри ввели человеческие iPS-клетки, которые были генетически модифицированы одним из двух способов для улучшения их выживания. В одном случае был удален ген-супрессор опухоли, который обычно ингибирует деление клеток; в другом ген, который останавливает запрограммированную гибель клеток, был сверхэкспрессирован.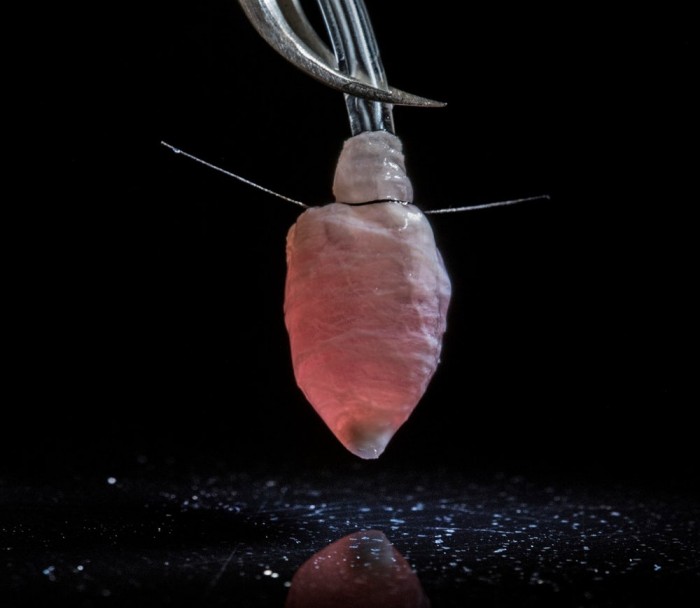
После вынашивания суррогатных свиней в течение 17–27 дней химерные эмбрионы содержали зачатки гематологической и мышечной тканей, сформированных полностью из клеток человека.
Мэри Гэрри признает, что эти генетические изменения не являются решением проблемы выращивания трансплантируемых человеческих органов у свиней, потому что эти модификации могут представлять значительный риск рака для реципиентов. «Настоящая цель состояла в том, чтобы увидеть, сможем ли мы усилить химеризм, применив метод кувалды», — говорит она. В настоящее время лаборатория анализирует выжившие человеческие клетки в надежде разработать более тонкие подходы к усилению формирования химер.
Одной из потенциальных альтернатив модификации клеток человека, которую изучают Накаучи и Гарри, может быть генетическая модификация клеток-хозяев таким образом, чтобы их рост оказался в невыгодном положении по сравнению с донорскими клетками. Другая заключается в более глубоком изучении клеточной биологии и сигнальных путей, которые играют роль, когда донорские клетки человека выживают в эмбрионе другого вида, чтобы разработать стратегии сохранения их жизни в видах животных, с которыми человеческие клетки с меньшей готовностью образуют химеры.
Это было объяснением развития эмбрионов обезьяны-человека, о котором сообщалось в апреле 4 . Международная группа ученых, разработавших эти химеры, утверждала, что если успешный химеризм более вероятен с более близкородственными видами хозяина и донора, то человеческие клетки должны лучше выживать в эмбрионах обезьян, чем в эмбрионах свиней.
Исследователи вводили стволовые клетки человека в эмбрионы макак и поддерживали эти эмбрионы в культуре. Они сказали, что некоторые эмбрионы жили до 19 лет.дней, и что в незначительном меньшинстве человеческие клетки сохранились повсюду. Это позволило им проверить профили экспрессии генов в клетках человека, чтобы увидеть, как гены реагировали на среду обитания обезьяны.
Хотя это исследование соответствовало строгим этическим нормам в принимающих учреждениях, многие комментаторы, тем не менее, выразили дискомфорт и поставили под сомнение его приемлемость. «Это породило огромное количество надежды и беспокойства», — говорит Альфонсо Мартинес Ариас, биолог по стволовым клеткам из Университета Помпеу Фабра в Барселоне, Испания, который не работает с межвидовыми химерами. Однако он не уверен, что любая реакция была оправдана. Мартинес Ариас скептически относится к тому, насколько здоровыми были культивированные эмбрионы и в какой степени в них росли здоровые человеческие клетки.
Однако он не уверен, что любая реакция была оправдана. Мартинес Ариас скептически относится к тому, насколько здоровыми были культивированные эмбрионы и в какой степени в них росли здоровые человеческие клетки.
Двух ведущих авторов исследования попросили прокомментировать эту статью, но оба отклонили приглашение.
Открытый диалог
Исследователи, пытающиеся использовать химеризм для производства новых органов для пересадки, считают, что нехватка доноров органов более чем оправдывает их работу. «Люди говорят об этичности занятия наукой, — говорит Мэри Гэрри, — но я бы также сказала, что мы должны учитывать этику отказа от этой науки».
Мартинес Ариас считает, что эту потребность можно удовлетворить исключительно за счет генетической модификации свиней для производства свиных органов, которые можно безопасно пересаживать людям. Но сторонники химеризма подчеркивают преимущества полностью «очеловеченных» органов, особенно если органы сделаны из собственных клеток реципиента. Хотя данные скудны, одно исследование предполагает, что незначительное большинство населения США поддерживает разработку человеческих органов у животных для целей трансплантации 5 .
Хотя данные скудны, одно исследование предполагает, что незначительное большинство населения США поддерживает разработку человеческих органов у животных для целей трансплантации 5 .
По мере развития технологий появятся новые приложения. Некоторые виды использования химер могут быть быстро приняты, например, для скрининга новых лекарств на гепатотоксические побочные эффекты у мышей с гуманизированной печенью. Однако другие виды использования потребуют дальнейшего обсуждения вовлеченной этики.
Одним из предложенных приложений, которое может оказаться проблематичным, будет использование iPS-клеток людей, страдающих шизофренией, например, для выращивания кортикальных нейронов в мозге обезьян 6 . Хотя это может быть полезным инструментом для изучения состояния, выращивание человеческих нейронов в коре головного мозга другого примата сопряжено с риском того, что это существо обретет некоторое человеческое познание или самосознание. Некоторые люди могут увидеть в этом причину не проводить такую работу.
Возможность такой когнитивной гуманизации, пожалуй, самый тревожный аспект исследования химер. Но есть также опасения по поводу химерных животных, производящих человеческие гаметы. Например, если такие животные могут производить человеческую сперму и яйцеклетки, существует риск зачатия человеческого эмбриона в матке животного, хотя в настоящее время существует полный запрет на разведение химерных животных. Фарахани также отмечает, что мы могли бы быть морально обеспокоены, если бы были созданы животные, которые просто больше напоминали бы людей — например, из-за того, что у них была бы человеческая кожа или лица.
В настоящее время этический надзор возлагается в основном на местные институциональные контрольные органы. Их решения о допустимости эксперимента, как правило, основаны на руководящих принципах, подготовленных Международным обществом исследований стволовых клеток (ISSCR) со штаб-квартирой в Скоки, штат Иллинойс, которые были обновлены в мае во второй раз с 2007 года. Национальные институты здравоохранения США , между тем, по существу хранит молчание по этой теме, так как в 2016 году прекратил финансирование любых исследований, связанных с эмбриональными химерами из стволовых клеток человека и животных.
Национальные институты здравоохранения США , между тем, по существу хранит молчание по этой теме, так как в 2016 году прекратил финансирование любых исследований, связанных с эмбриональными химерами из стволовых клеток человека и животных.
Инсу Хён, председатель комитета по этике ISSCR и специалист по биоэтике Гарвардского университета в Кембридже, штат Массачусетс, и Университета Кейс Вестерн в Кливленде, штат Огайо, говорит, что руководство пытается дать практические советы исследователям и регулирующим органам, чтобы решить, следует ли проводить жизнеспособные в настоящее время эксперименты. быть разрешено. Хён говорит, что при поиске одобрения для отдельного эксперимента исследователи не могут оправдать его, просто указав благородную долгосрочную цель, такую как разработка почки для пересадки или лечение шизофрении. Вместо этого специалисты по этике должны оценить возможные результаты этого конкретного эксперимента.
Используя этот подход, эксперименты с химерными эмбрионами человек-обезьяна (выдерживаемые вне матки в течение короткого времени) приемлемы, если исследователи смогут доказать, что такие эксперименты дадут истинное понимание межвидовой передачи сигналов клетками, что может помочь преодолеть препятствия к выращиванию тканей человека в животноводстве.
Фарахани согласен с тем, что исследования должны оцениваться по существу, но подчеркивает важность рассмотрения того, как область может лучше всего двигаться к своим конечным целям. «Я думаю, что всегда нужно смотреть в будущее», — говорит она. «Этика не просто реактивна — она должна быть проактивной». Вместо того, чтобы оценивать приемлемость экспериментов по мере их возникновения, она хочет, чтобы специалисты по этике помогали исследователям избегать идти по пути, который привел бы к событиям, которые общество считает нежелательными. По ее словам, только рассматривая направление исследований, специалисты по этике могут помочь проложить приемлемый путь вперед.
Еще из Nature Outlooks
Исследователи, стремящиеся использовать химер для производства трансплантируемых органов, используют различные подходы, чтобы ориентироваться в этой непростой этической области, особенно когда речь идет о мозге. Хьюн утверждает, что у грызунов или сельскохозяйственных животных, разработанных для размещения гуманизированных органов, таких как почки или поджелудочная железа, маловероятно, что небольшое количество блуждающих нейронов приведет к чему-либо близкому к человеческому познанию. Когда Гарри проверили все произведенные ими 27-дневные химерные эмбрионы свиньи и человека, они не обнаружили никаких признаков человеческих нейронов (или гамет). Это открытие помогло им получить разрешение от институциональных наблюдательных советов на вынашивание эмбрионов в течение 9 лет.0 дней (при естественном сроке беременности свиней 113–115 дней). Тем не менее, Накаучи пошел еще дальше в стремлении развеять опасения по поводу гуманизированного мозга — он работает с человеческими iPS-клетками, которые были генетически сконструированы так, что в них отсутствует ген, необходимый для превращения клеток в нейроны.
Когда Гарри проверили все произведенные ими 27-дневные химерные эмбрионы свиньи и человека, они не обнаружили никаких признаков человеческих нейронов (или гамет). Это открытие помогло им получить разрешение от институциональных наблюдательных советов на вынашивание эмбрионов в течение 9 лет.0 дней (при естественном сроке беременности свиней 113–115 дней). Тем не менее, Накаучи пошел еще дальше в стремлении развеять опасения по поводу гуманизированного мозга — он работает с человеческими iPS-клетками, которые были генетически сконструированы так, что в них отсутствует ген, необходимый для превращения клеток в нейроны.
Накаучи и Гарри также решили не создавать обезьяно-человеческих химер. Гарри изучают барьер между копытными и приматами, комбинируя бластоцисты свиней с iPS-клетками макак, а группа Накаучи изучает клетки шимпанзе или различных видов обезьян в эмбрионах макак.
«Мы должны сделать все возможное, чтобы сделать это максимально безопасным и приемлемым для общества.
