Содержание
Органы из пробирки: что уже умеют выращивать
Главная >
Новости >
Органы из пробирки: что уже умеют выращивать
Возможность вырастить человеческий орган в пробирке и пересадить его человеку, нуждающемуся в пересадке — мечта трансплантологов. Ученые по всему миру работают над этим и уже научились делать ткани, небольшие работающие копии органов, и до полноценных запасных глаз, легких и почек нам на самом деле осталось совсем немного. Пока что органеллы используются в основном в научных целях, их выращивают, чтобы понять, как работают органы, как развиваются болезни. Но от этого до трансплантации всего несколько шагов. МедНовости собрали сведения о самых перспективных проектах. Легкие. Ученые из Техасского университета вырастили легкие человека в биореакторе. Правда, без кровеносных сосудов такие легкие не функциональны. Однако команда ученых из Медицинского центра Колумбийского университета (Columbia University Medical Center, New York) недавно впервые в мире получили функциональное легкое с перфузируемой и здоровой сосудистой системой у грызунов ex vivo. Ткани сердечной мышцы. Биоинженерам из университета Мичигана удалось вырастить в пробирке кусок мышечной ткани. Правда, полноценно сердце из такой ткани пока работать не сможет, она вдвое слабее оригинала. Тем не менее пока это самый сильный образец сердечной ткани. Кости. Израильская биотехнологическая компания Bonus BioGroup использовалат трехмерные сканы для создания гелеобразного каркаса кости перед посевом стволовыми клетками, взятыми из жира. Кости, получившиеся в результате, они успешно пересадили грызунам. Уже планируются эксперименты по выращиванию человеческих костей по этой же технологии. Ткани желудка. Ученым под руководством Джеймса Уэллса из Детского медицинского клинического центра в Цинциннати (Огайо) удалось вырастить «в пробирке» трехмерные структуры человеческого желудка при помощи эмбриональных стволовых клеток и из плюрипотентных клеток взрослого человека, перепрограммированных в стволовые. Эти структуры оказались способны вырабатывать все необходимые человеку кислоты и пищеварительные ферменты. Японские ученые вырастили глаз в чашке Петри. Искусственно выращенный глаз содержал основные слои сетчатки: пигментный эпителий, фоторецепторы, ганглионарные клетки и другие. Трансплантировать его целиком пока возможности нет, а вот пересадка тканей — весьма перспективное направление. В качестве исходного материала были использованы эмбриональные стволовые клетки. Ученые из корпорации Genentech вырастили простату из одной клетки. Молекулярным биологам из Калифорнии удалось вырастить целый орган из единственной клетки. Сердечные клапаны. Швейцарские ученые доктор Саймон Хоерстрап (Simon Hoerstrup) и Дорта Шмидт (Dorthe Schmidt) из университета Цюриха (University of Zurich) смогли вырастить человеческие сердечные клапаны, воспользовавшись стволовыми клетками, взятыми из околоплодной жидкости. Ушная раковина. Используя стволовые клетки, ученые вырастили ухо человека на спине крысы. Эксперимент был проведен исследователями из Университета Токио (University of Tokyo) И Университета Киото (Kyoto University) под руководством Томаса Сервантеса (Thomas Cervantes). Кожа. Ученые из Цюрихского университета (Швейцария) и университетской детской больницы этого города впервые сумели вырастить в лаборатории человеческую кожу, пронизанную кровеносными и лимфатическими сосудами. Полученный кожный лоскут способен почти полностью выполнять функцию здоровой кожи при ожогах, хирургических дефектах или кожных болезнях. Поджелудочная железа. Ученые впервые создали васкуляризованные островки поджелудочной железы, способные вырабатывать инсулин. Еще одна попытка вылечить диабет I типа. Почки. Ученые из австралийского университета Квинсленда научились выращивать искусственные почкииз стволовых клеток кожи. Печень. Биологи сразу нескольких стран заявили о том, что смогли вырастить полноценный аналог печени, способный очищать кровь от токсинов и выполнять другие функции этого органа. Для этого ученые использовали стволовые клетки и «заготовки» из стволовых клеток. Эти разработки параллельно велись в Японии, Америке и России. Мочевой пузырь. Группа американских ученых под руководством Энтони Аталы (Anthony Atala) вырастила в лаборатории человеческие мочевые пузыри, полностью готовые к пересадке, из образцов собственных тканей пациентов. Те же ученые вырастили мочеиспускательные каналы для пациентов, у которых они были повреждены. Кроме того, ученые уже научились выращивать хрящевые ткани, ткани скелетных мышц и костей, ткани гипофиза, тимуса, а также ткани, функционирующие аналогично тканям человеческого мозга. Юлия Бондарь Источник: medportal. |
ISSN 2588-0519 (Print)
ISSN 2618-8473 (Online)
Ученые планируют выращивать на МКС человеческие органы
Тренды
Телеканал
Pro
Инвестиции
Мероприятия
РБК+
Новая экономика
Тренды
Недвижимость
Спорт
Стиль
Национальные проекты
Город
Крипто
Дискуссионный клуб
Исследования
Кредитные рейтинги
Франшизы
Газета
Спецпроекты СПб
Конференции СПб
Спецпроекты
Проверка контрагентов
РБК Библиотека
Подкасты
ESG-индекс
Политика
Экономика
Бизнес
Технологии и медиа
Финансы
РБК КомпанииРБК Life
РБК
Тренды
Фото: NASA
Группа исследователей из Цюрихского университета проведет эксперимент по выращиванию органоидов в условиях невесомости
Что происходит
- Исследователи из Космического центра Цюрихского университета совместно с Airbus 28 августа 2021 года в рамках полета по пополнению запасов отправили на МКС стволовые клетки человека для выращивания органоидов, — мини-копий человеческих органов.

- Проект получил название «3D органоиды в космосе». Он был разработан исследователями Цюрихского университета Оливером Ульрихом и Корой Тиль, которые изучили, как гравитация влияет на человеческие клетки. Команда Airbus Innovations, в свою очередь, разработала необходимое оборудование и обеспечивает доступ к МКС.
- Разработка проекта заняла у создателей три года, а 18 месяцев назад завершились подготовительные испытания на МКС, в рамках которых в условиях микрогравитации стволовые клетки человека превратились в органоподобные структуры, такие как печень, кости и хрящи.
- Исследователи отмечают, что на Земле выращивать трехмерные органоиды невозможно из-за силы земного притяжения.
- Если эксперимент увенчается успехом, в будущем будет запущено промышленное производство человеческих органоидов в условиях гравитации для дальнейшего использования в медицинских исследованиях.
Что это значит
В настоящее время наблюдается усиленный интерес мирового научного сообщества к перспективам, которые предоставляет космос. Выращивание человеческих органов в условиях невесомости, — одно из многообещающих направлений в контексте изучения возможностей внеземного пространства.
Выращивание человеческих органов в условиях невесомости, — одно из многообещающих направлений в контексте изучения возможностей внеземного пространства.
Успешное проведение данного эксперимента станет настоящим прорывом для медицины. Во-первых, трехмерные органоиды представляют большой интерес для фармацевтических компаний, поскольку они позволяют проводить токсикологические исследования непосредственно на тканях человека, без необходимости проведения экспериментов на животных. Кроме того, в будущем органоиды, выращенные из стволовых клеток пациентов, могут быть использованы для трансплантации — возможно, это поможет удовлетворить мировой спрос на донорские органы.
В 2019 году NASA отправила на Международную космическую станцию биологический 3D-принтер для печати человеческих органов, а ранее в 2021 году на МКС был доставлен аппарат для 3D-печати из реголита в условиях Луны.
BioFabrication Facility для 3D-печати человеческих органов
(Фото: Techshot)
Обновлено 31. 08.2021
08.2021
Текст
Ксения Янушкевич
Главное в тренде
Материалы по теме
Новый процесс тканевой инженерии делает выращенные в лаборатории органы на один шаг ближе
новости
59
АКЦИИ
Исследователи разработали новую технику, которая однажды позволит нам выращивать полностью функциональные человеческие органы в лаборатории.
До сих пор выращенные в лаборатории заменители органов существовали только в научной фантастике, потому что ученые изо всех сил пытались организовать клетки в сложные трехмерные (3D) устройства, достигнутые природой.
Исследователи говорят, что для успешного выращивания органов и тканей необходим биологически совместимый трехмерный каркас, который содержит все биохимические сообщения в правильной конфигурации, чтобы инициировать формирование желаемого органа или ткани.
В новом исследовании Вашингтонского университета (UW), США, ученые сделали шаг к этой цели, когда они разработали метод модификации встречающихся в природе биологических полимеров с помощью белковых биохимических сигналов, влияющих на поведение клеток. В своем исследовании, опубликованном в PNAS , они используют лазер ближнего инфракрасного диапазона, чтобы инициировать химическую адгезию белковых сообщений к каркасу, сделанному из биологических полимеров, таких как коллаген, соединительная ткань, присутствующая во всем нашем теле.
Клетки млекопитающих реагировали, как и ожидалось, на сигналы прикрепленных белков в трехмерном каркасе, сказал старший автор Коул ДеФорест, адъюнкт-профессор химии и биоинженерии Университета Вашингтона и преподаватель Института молекулярной инженерии и наук Университета Вашингтона и Института стволовых клеток и стволовых клеток Университета Вашингтона. Регенеративная медицина. Белки на этих биологических каркасах вызывают изменения в путях обмена сообщениями внутри клеток, которые влияют на рост клеток, передачу сигналов и другое поведение.
ДеФорест добавил, что эти методы могут стать основой биологических каркасов, которые в один прекрасный день могут сделать функциональные ткани, выращенные в лаборатории, реальностью.
Их метод является первым в этой области, пространственно контролируя функцию клеток внутри встречающихся в природе биологических материалов, в отличие от тех, которые получены синтетическим путем. Несколько исследовательских групп, в том числе группа ДеФорест, разработали основанные на свете методы модификации синтетических каркасов с помощью белковых сигналов; однако природные биологические полимеры могут быть более привлекательным каркасом для тканевой инженерии, потому что они врожденно обладают биохимическими характеристиками, на которые клетки полагаются для построения, коммуникации и других целей.
«Природный биоматериал, такой как коллаген, по своей природе включает многие из тех же сигнальных сигналов, что и нативные ткани», — сказал ДеФорест. «Во многих случаях эти типы материалов делают клетки «счастливее», давая им сигналы, аналогичные тем, с которыми они сталкиваются в организме».
Это вид сверху цилиндрического фибринового гидрогеля. По дизайну правая сторона гидрогеля содержит иммобилизованные белки Delta-1, которые активируют сигнальные пути Notch внутри клеток. Левая сторона не содержит иммобилизованной Дельты-1 (см. вставку). Команда ученых ввела в гидрогель клетки рака костей человека, которые светятся при активации их сигнальных путей Notch. Правая сторона гидрогеля ярко светится, указывая на то, что клетки в этой области активировали свои сигнальные пути Notch. Клетки с левой стороны гидрогеля не имеют. Масштабная линейка составляет 1 миллиметр [Источник: Баталов и др., PNAS, 2021].
В своем исследовании они работали с двумя биологическими полимерами: коллагеном и фибрином, белком, участвующим в свертывании крови. Каждую из них они собрали в заполненные жидкостью каркасы, называемые гидрогелями.
Они использовали связывание двух химических групп, алкоксиаминов и альдегидов, для присоединения белков.
Привязанные белки были полностью функциональными и доставляли нужные сигналы клеткам.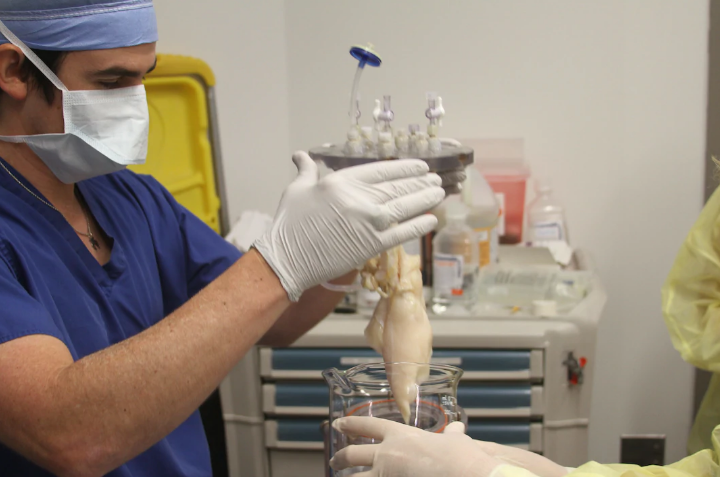 Например, когда клетки печени крысы помещали на коллагеновые гидрогели, содержащие эпидермальный фактор роста (EGF), белки, способствующие росту клеток, клетки демонстрировали признаки репликации ДНК и клеточного деления. В отдельном эксперименте исследователи украсили фибриновый гидрогель паттернами белка под названием Delta-1, который активирует передачу сигналов Notch. Когда они вводили клетки рака костей человека в гидрогель, клетки в областях с дельта-1 активировали передачу сигналов Notch, а клетки в областях без дельта-1 — нет.
Например, когда клетки печени крысы помещали на коллагеновые гидрогели, содержащие эпидермальный фактор роста (EGF), белки, способствующие росту клеток, клетки демонстрировали признаки репликации ДНК и клеточного деления. В отдельном эксперименте исследователи украсили фибриновый гидрогель паттернами белка под названием Delta-1, который активирует передачу сигналов Notch. Когда они вводили клетки рака костей человека в гидрогель, клетки в областях с дельта-1 активировали передачу сигналов Notch, а клетки в областях без дельта-1 — нет.
ДеФорест сказал, что их эксперименты, в которых использовались несколько биологических каркасов и белковых сигналов, показывают, что их подход может работать практически для любого типа белковых сигналов и систем биоматериалов.
«Теперь мы можем начать создавать каркасы из гидрогеля с множеством различных сигналов, используя наше понимание передачи сигналов клетками в ответ на определенные комбинации белков для модуляции критических биологических функций во времени и пространстве», — добавил он. ДеФорест сказал, что с более сложными сигналами, загруженными в гидрогели, ученые могут попытаться контролировать такие процессы, как дифференцировка стволовых клеток.
ДеФорест сказал, что с более сложными сигналами, загруженными в гидрогели, ученые могут попытаться контролировать такие процессы, как дифференцировка стволовых клеток.
Смежные темы
Биоинженерия, Культуры клеток, In Vitro, Белки, Протеомика, Структурная биология
19 января 2021 г.
Акции
Связанные темы
Биоинженерия, Культуры клеток, In Vitro, Белки, Протеомика, Структурная биология
БУДУЩЕЕ ЗАМЕНЕНИЯ ОРГАНОВ — ПОТРЕБНОСТИ, ПОТЕНЦИАЛЬНЫЕ ПРИМЕНЕНИЯ И ПРЕПЯТСТВИЯ К ПРИМЕНЕНИЮ
Transplant Proc. Авторская рукопись; доступно в PMC 2006 7 июня.
Опубликовано в окончательной редакции как:
Процедура трансплантации. 2006 март; 38(2): 362–364.
doi: 10.1016/j.transprocecempe.2005.12.055
PMCID: PMC1475508
NIHMSID: NIHMS9651
PMID: 16549121
Информация о плате. чем спрос, и спрос может существенно возрасти в ближайшем будущем. По этой причине настало время рассмотреть вопрос о том, как в будущем может быть заменена функция органов. В этом сообщении мы рассматриваем новые технологии, которые могут быть использованы для замещения функции органа, препятствия на пути применения новых технологий, и теперь эти препятствия могут быть преодолены при разработке новых стратегий замены органов.
По этой причине настало время рассмотреть вопрос о том, как в будущем может быть заменена функция органов. В этом сообщении мы рассматриваем новые технологии, которые могут быть использованы для замещения функции органа, препятствия на пути применения новых технологий, и теперь эти препятствия могут быть преодолены при разработке новых стратегий замены органов.
Будущее замены органов будет зависеть от трех переменных. Первая переменная – это потребность, в частности то, как количество органов, подлежащих замене, будет меняться с течением времени. Вторая переменная — это набор приложений и новых технологий, которые будут доступны для замены этих органов. Третья переменная представляет собой набор препятствий, биологических и социальных, которые могут препятствовать замещению функций органов. Это сообщение обобщает нашу точку зрения на то, как эти переменные могут измениться в обозримом будущем.
Потребность в замене органов может резко измениться в течение следующего периода лет 1 — 4 . Новые методы лечения болезней, лучшее питание и лучшие подходы к общественному здравоохранению снизят распространенность некоторых заболеваний, вызывающих недостаточность органов и, следовательно, потребность в трансплантации. Например, лучшая диета и лечение ингибиторами 3-гидрокси-3-метилглутарил-коэнзима А (ГМГ-коА)-редуктазы могут предотвратить атеросклероз и сердечную недостаточность у некоторых, возможно, у многих. Однако увеличение продолжительности жизни, вызванное улучшением медицинского обслуживания, питания и общественного здравоохранения, приведет к тому, что большая часть населения будет подвержена болезням старения, таким как диабет и сердечная или почечная недостаточность. Это увеличит распространенность органной недостаточности и потенциальную потребность в трансплантации.
Новые методы лечения болезней, лучшее питание и лучшие подходы к общественному здравоохранению снизят распространенность некоторых заболеваний, вызывающих недостаточность органов и, следовательно, потребность в трансплантации. Например, лучшая диета и лечение ингибиторами 3-гидрокси-3-метилглутарил-коэнзима А (ГМГ-коА)-редуктазы могут предотвратить атеросклероз и сердечную недостаточность у некоторых, возможно, у многих. Однако увеличение продолжительности жизни, вызванное улучшением медицинского обслуживания, питания и общественного здравоохранения, приведет к тому, что большая часть населения будет подвержена болезням старения, таким как диабет и сердечная или почечная недостаточность. Это увеличит распространенность органной недостаточности и потенциальную потребность в трансплантации.
Обстоятельства, при которых требуется замена органа, также могут вскоре измениться. Достижения в молекулярной диагностике, протеомике и других областях могут позволить выявлять смертельные заболевания задолго до появления клинических проявлений. Образец крови может выявить наличие рака почки или легкого до локализации поражения. Это событие побудит клинициста и пациента заменить потенциально «смертельные» органы трансплантатом. Такой подход уже используется в тех редких случаях, когда у младенца раннего возраста имеется дисморфология, предполагающая высокий риск развития опухоли Вильмса. Превентивная трансплантация как таковая могла бы резко увеличить потребность в замене органов и так же резко изменить представление о том, что считать адекватной заменой: нормальная функция и ограниченная или отсутствующая иммуносупрессия ценились бы даже больше, чем сегодня.
Образец крови может выявить наличие рака почки или легкого до локализации поражения. Это событие побудит клинициста и пациента заменить потенциально «смертельные» органы трансплантатом. Такой подход уже используется в тех редких случаях, когда у младенца раннего возраста имеется дисморфология, предполагающая высокий риск развития опухоли Вильмса. Превентивная трансплантация как таковая могла бы резко увеличить потребность в замене органов и так же резко изменить представление о том, что считать адекватной заменой: нормальная функция и ограниченная или отсутствующая иммуносупрессия ценились бы даже больше, чем сегодня.
Растущая потребность в трансплантации сделает вопрос о том, какие новые технологии можно применить для удовлетворения этой потребности, станет еще более насущным. Аллотрансплантация уже далеко не удовлетворяет спрос на замену сердца, легких, почек и печени 5 , 6 . Возможно, доступность некоторых органов можно улучшить за счет увеличения донорства трупов или использования живых тканей. Тем не менее, аллотрансплантация не может обеспечить значительно большее количество органов, которое можно было бы запросить. Соответственно, мы рассмотрели достоинства других технологий, включая ксенотрансплантацию, имплантируемые устройства, стволовые клетки, тканевую инженерию, органогенез и ксенотрансплантацию 4 . Ниже мы кратко рассмотрим эту тему.
Тем не менее, аллотрансплантация не может обеспечить значительно большее количество органов, которое можно было бы запросить. Соответственно, мы рассмотрели достоинства других технологий, включая ксенотрансплантацию, имплантируемые устройства, стволовые клетки, тканевую инженерию, органогенез и ксенотрансплантацию 4 . Ниже мы кратко рассмотрим эту тему.
Ксенотрансплантация может обеспечить обильную, недорогую и физиологически удовлетворительную замену основных паренхиматозных органов, по крайней мере, в принципе. Мы обсуждали потенциальное применение ксенотрансплантации в другом месте и отсылаем читателя к этим обсуждениям 7 — 9 . Большое волнение вызвало потенциальное использование генной инженерии для ограничения иммунных и воспалительных реакций, ограничивающих функцию и выживаемость ксенотрансплантатов. Несмотря на этот энтузиазм, на сегодняшний день никакие генетические манипуляции не позволили органам свиней выжить и функционировать достаточно долго у приматов, чтобы предложить использовать эти органы у людей, и ни один еще не испытанный подход позволил выжить и функционировать после короткого периода без серьезных манипуляций и/или иммуносупрессия. Ниже мы обсудим другие потенциальные способы использования ксенотрансплантации, но на данный момент мы откажемся от этого подхода к замещению функции органов, за исключением, возможно, печени 10 .
Ниже мы обсудим другие потенциальные способы использования ксенотрансплантации, но на данный момент мы откажемся от этого подхода к замещению функции органов, за исключением, возможно, печени 10 .
В экспериментальном порядке доступны полностью имплантируемые устройства для замены функции сердца. Устройства используются только в экстремальных условиях, и их использование сопряжено со значительным риском. Тем не менее, мы считаем, что технология будет совершенствоваться по мере использования, и можно предположить, что однажды все замены сердца можно будет решить таким образом. К сожалению, этого нельзя сказать о других органах. Хотя внешние устройства и процедуры, такие как диализ, могут заменить функцию легких и почек, эти устройства и процедуры полностью заменяют их и вызывают серьезные осложнения. Поэтому трудно представить, что в обозримом будущем устройства обеспечат оптимальную замену функции органа, особенно если эта замена будет упреждающей.
Стволовые клетки обладают способностью размножаться и дифференцироваться в относительно зрелые клетки различных типов.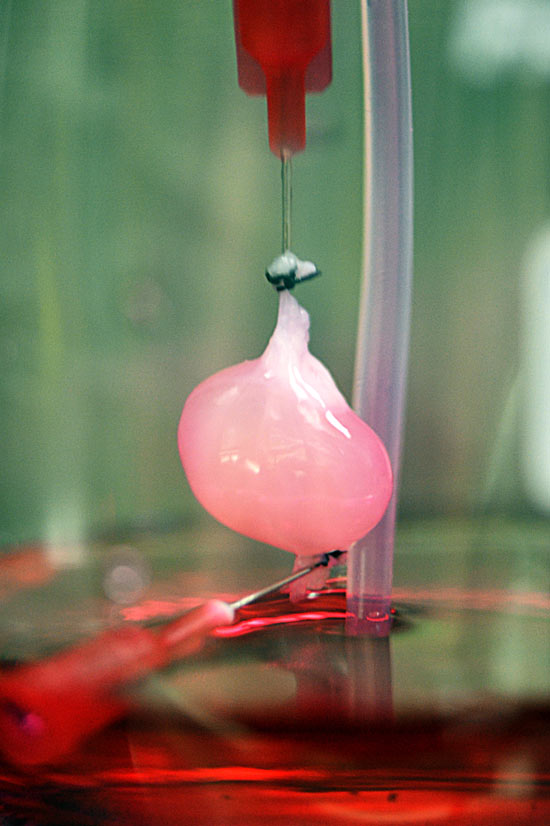 Эмбриональные стволовые клетки могут стать любым органом тела и делают это при имплантации в бластоцисту. В принципе, тогда эмбриональные стволовые клетки можно было бы использовать для замены любого органа в организме. Однако по крайней мере два фактора ограничивают эту возможность. Во-первых, эмбриональные стволовые клетки и линии эмбриональных стволовых клеток неизбежно генетически отличаются от человека, которого лечат, и их использование, а использование тканей или органов, полученных из этих клеток, может потребовать иммуносупрессии. Эта проблема потенциально может быть решена путем клонирования 4 , как описано ниже. Большее ограничение использования эмбриональных стволовых клеток (или стволовых клеток, полученных ядерным клонированием) заключается в том, что, хотя эти клетки могут быть выращены в дифференцированные клетки и ткани, неизвестны средства, с помощью которых эти клетки можно уговорить сформировать органы вне эмбриона. Таким образом, пределом технологии стволовых клеток является микроокружение плода.
Эмбриональные стволовые клетки могут стать любым органом тела и делают это при имплантации в бластоцисту. В принципе, тогда эмбриональные стволовые клетки можно было бы использовать для замены любого органа в организме. Однако по крайней мере два фактора ограничивают эту возможность. Во-первых, эмбриональные стволовые клетки и линии эмбриональных стволовых клеток неизбежно генетически отличаются от человека, которого лечат, и их использование, а использование тканей или органов, полученных из этих клеток, может потребовать иммуносупрессии. Эта проблема потенциально может быть решена путем клонирования 4 , как описано ниже. Большее ограничение использования эмбриональных стволовых клеток (или стволовых клеток, полученных ядерным клонированием) заключается в том, что, хотя эти клетки могут быть выращены в дифференцированные клетки и ткани, неизвестны средства, с помощью которых эти клетки можно уговорить сформировать органы вне эмбриона. Таким образом, пределом технологии стволовых клеток является микроокружение плода.
Другой технологией, которую иногда предлагают для замены органов, является органогенез. Органогенез относится к выращиванию интактных органов или органоподобных тканей из примитивных клеток. Подобно тому, как органогенез происходит естественным образом у плода, он также может происходить, когда ткани или клетки первичного органа плода помещаются в культуру или имплантируются живым животным. Например, выращенные ткани почек плода могут генерировать созревающие клубочки in vitro 11 и органы взрослых млекопитающих 12 . Ткани и клетки плода также можно использовать для создания инженерных структур 13 . Однако применение органогенеза ограничено источником и иммуногенностью тканей плода. Ткань плода человека для этой цели не подходит. Некоторые предлагали вместо этого использовать эмбриональные ткани животных 14 . Однако органогенез ксеногенного органа нарушается иммунитетом против этого органа, и этот барьер, вероятно, равен барьеру для аллотрансплантации, за некоторыми исключениями 15 .
Мы предложили устранить препятствия на пути замены органов, если объединить различные технологии таким образом, чтобы использовать преимущества каждой технологии 2 , 4 . Таким образом, ядерное клонирование (перенос ядер из зрелых клеток человека, подлежащего лечению, в примитивные энуклеированные клетки, что позволяет перепрограммировать ДНК) может быть использовано для создания эмбриональных стволовых клеток. Чтобы избежать этических проблем ядерного клонирования и потенциальной иммуногенности белков, кодируемых чужеродной митохондриальной ДНК, можно было бы предусмотреть обработку зрелых клеток «факторами клонирования», полученными из ксеногенных источников, которые могли бы частично перепрограммировать ядра без переноса.0074 16 . Стволовые клетки, полученные таким образом, можно заставить созреть, поместив их в подходящее место в ксеногенном плоде 9 . Например, мы показали, что стволовые клетки человека, введенные в плод свиньи, могут созревать нормальным, гистотипическим образом в соответствующих местах плода свиньи 17 , 18 . Ткани, которые начинают созревать в этой ксеногенной системе, затем могут быть собраны, а клетки человека выделены и перенесены в человека для лечения, чтобы могло произойти полное созревание и васкуляризация (т. Е. Органогенез).
Ткани, которые начинают созревать в этой ксеногенной системе, затем могут быть собраны, а клетки человека выделены и перенесены в человека для лечения, чтобы могло произойти полное созревание и васкуляризация (т. Е. Органогенез).
Обсуждаемая здесь стратегия сложна и может никогда не быть реализована. Однако каждый шаг был выполнен в той или иной экспериментальной системе, и чего не хватает, так это соединения шагов воедино. Независимо от того, будет ли эта согласованная стратегия успешной, мы считаем, что усилия, предпринятые для ее проверки, могут привести к новым знаниям и новым представлениям о том, как в будущем можно заменить органы.
Работа авторов поддерживается грантами Национального института здравоохранения (HL52297, H146810).
1. Огл Б.М., Платт Дж.Л. Подходы к замещению функции отказавших органов. Карр Опин Трансплантация органов. 2002; 7:28. [Google Scholar]
2. Огле Б.М., Каскальо М., Платт Дж.Л. Объединение подходов к лечению органной недостаточности. Ам Джей Трансплант. 2004; 4 (Приложение 6): 74. [PubMed] [Google Scholar]
Ам Джей Трансплант. 2004; 4 (Приложение 6): 74. [PubMed] [Google Scholar]
3. Cascalho M, Ogle BM, Platt JL. Ксенотрансплантация и будущее замены почки. J Am Soc Нефрол. 2004; 15:1106. [PubMed] [Академия Google]
4. Каскальо М., Платт Дж. Новые технологии замены и увеличения органов. Мэйо Клин Proc. 2005;80:370. [PubMed] [Google Scholar]
5. Evans RW, Orians CE, Ascher NL. Потенциальное предложение доноров органов: оценка эффективности усилий по закупке органов в Соединенных Штатах. ДЖАМА. 1992; 267:239. [PubMed] [Google Scholar]
6. Эванс Р.В. Примирение с реальностью: почему ксенотрансплантация является необходимостью. В: Platt JL, редактор. Ксенотрансплантация. Том. 29. АСМ Пресс; Вашингтон, округ Колумбия: 2001. [Google Scholar]
7. Platt JL, Vercellotti GM, Dalmasso AP, et al. Трансплантация дискордантных ксенотрансплантатов: обзор прогресса. Иммунол сегодня. 1990;11:450. [PubMed] [Google Scholar]
8. Parker W, Saadi S, Lin SS, Holzknecht ZE, Bustos M, Platt JL. Трансплантация дискордантных ксенотрансплантатов: новый взгляд на проблему. Иммунол сегодня. 1996; 17:373. [PubMed] [Google Scholar]
Трансплантация дискордантных ксенотрансплантатов: новый взгляд на проблему. Иммунол сегодня. 1996; 17:373. [PubMed] [Google Scholar]
9. Cascalho M, Platt JL. Ксенотрансплантация и другие способы замены органов. Нат Рев Иммунол. 2001; 1:154. [PubMed] [Академия Google]
10. Нагата Х., Ито М., Кай Дж., Эдж А., Платт Дж.Л., Фокс И.Дж. Лечение цирроза и печеночной недостаточности у крыс путем ксенотрансплантации гепатоцитов. Гастроэнтерология. 2003; 124:422. [PubMed] [Google Scholar]
11. Platt JL, Brown DM, Granlund K, Oegema TR, Klein DJ. Метаболизм протеогликанов, связанный с развитием метанефры мыши: морфологические и биохимические эффекты β-D-ксилозида. Дев биол. 1987; 123:293. [PubMed] [Google Scholar]
12. Роджерс С.А., Лоуэлл Дж.А., Хаммерман Н.А., Хаммерман М.Р. Трансплантация развивающихся метанефросов взрослым крысам. почки инт. 1998;54:27. [PubMed] [Google Scholar]
13. Lanza RP, Chung HY, Yoo JJ, et al. Получение гистосовместимых тканей с помощью ядерной трансплантации.



 Теперь медики смогут выращивать клапаны сердца специально для неродившегося еще ребенка, если у него еще в зародышевом состоянии обнаружатся дефекты сердца.
Теперь медики смогут выращивать клапаны сердца специально для неродившегося еще ребенка, если у него еще в зародышевом состоянии обнаружатся дефекты сердца. Пока это лишь маленькие органоиды размером 1 см, но по устройству и функционированию они практически идентичны почкам взрослого человека.
Пока это лишь маленькие органоиды размером 1 см, но по устройству и функционированию они практически идентичны почкам взрослого человека.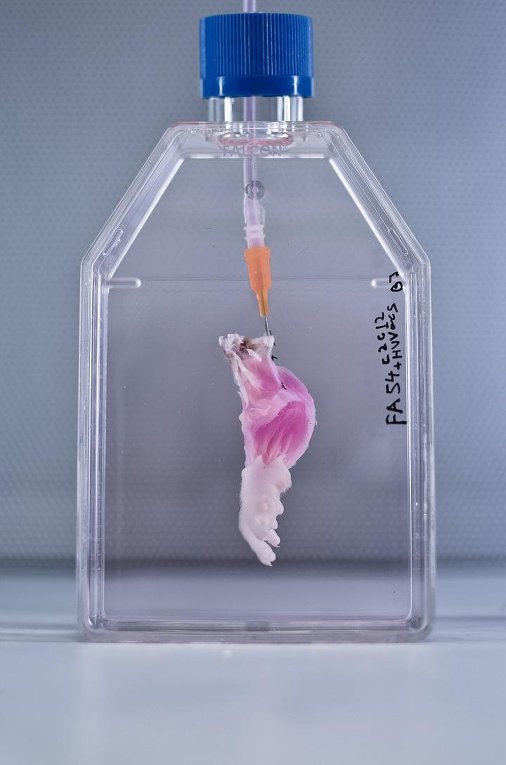 ru
ru