Содержание
В мире вирусов | Наука и жизнь
В наши дни интерес к вирусам неизмеримо возрос. Это естественно. Ведь лоток информации о вирусах, их свойствах и изменчивости сопровождает, например, каждую эпидемию гриппа.
Вирус герпеса под электронным микроскопом. На снимках довольно отчетливо просматривается строение оболочки, состоящей из пятигранных (слева) и шестигранных (справа) призм.
Схематическое изображение частицы вируса герпесе, оболочка которой построена из 150 шестигранных и 12 пятигранных призм.
Вирионы гриппа. Сквозь частично разрушенную внешнюю оболочку видна плотная упаковка трубчатого внутреннего содержимого — рибонуклепротеина.
Схематическое строение различных фагов. Вверху — фагочастица в активном состоянии, в центре и внизу — в неактивном (колющий аппарат вышел наружу).
‹
›
Открыть в полном размере
Увеличивается во всем мире и число сторонников вирусной теории рака. Исследования сотен лабораторий свидетельствуют, что именно вирусы — наиболее вероятная причина рака, саркомы, лейкемии.
И. Губарев, наш специальный корреспондент, обратился к директору Института вирусологии имени И. Д. Ивановского АМН СССР, академику АМН СССР, профессору Виктору Михайловичу Жданову с просьбой рассказать об истории и сегодняшнем дне Вирусологии, о стратегии борьбы С вирусными болезнями.
Вирусология — наука молодая. 80 лет прошло со времени открытия И. Д. Ивановским первого вируса — возбудителя мозаичной болезни табака. Много позже — в 50-х годах — было получено первое несовершенное изображение этого инфекционного агента. Самые значительные исследования в области вирусологии были выполнены лишь за последние 15—20 лет.
С исследованиями вирусологов сегодня связано уничтожение инфекционных заболеваний на планете, борьба против рака. Вирусологии же, изучающей наиболее простые формы существования, предстоит дать ответ на многие вопросы, связанные с происхождением жизни на Земле.
Итак, что же мы знаем и «его еще не знаем о вирусах?
Сколько их!
Исследовательская практика показывает, что «вирусоносители» — практически все живые существа, населяющие нашу планету.
Пример: до недавнего времени мы почти ничего не знали о специфических обезьяньих вирусах. В 1960-х годах было начато массовое производство вакцины против полиомиелита, изготавливаемой на обезьяньих почках. Необходимо было обеспечить стерильность этой вакцины, то есть полностью исключить проникновение в нее каких-либо микроорганизмов. И вот в ходе исследований, направленных на обеспечение такого рода стерильности, был открыт целый ряд до тех пор неизвестных вирусов, специфичных для обезьян.
К настоящему времени мы располагаем сведениями примерно о тысяче видах вирусов. Безусловно, лучше других нам известны вирусы, поражающие человека. Их выявлено около 500 видов. Весьма обширна группа вирусов, найденных у лабораторных животных — мышей, кроликов, морских свинок.
Сравнительно много мы знаем о вирусах сельскохозяйственных животных и растений, меньше — о вирусах, опасных для птиц и других животных, древесных и кустарниковых пород лесе. И уж вовсе малоизвестны и числом и повадками вирусы папоротников, мхов, лишайников.
Вирусы проявляют себя не всегда одинаково. В одних случаях они нападают лишь на определенные виды живых существ. Скажем, уже выявлены специфические вирусы гриппа свиней, кошек, чаек, поражающие только этих животных и безопасные для других. Подчас специализация становится своеобразно утонченной: мельчайшие вирусы бактерий — фаги Р-17 выбирают в качестве объекта лишь мужские особи только одной разновидности кишечной палочки. А вот в числе объектов онкогенных вирусов — пресмыкающиеся, птицы, млекопитающие. Рекорд побивают, пожалуй, так называемые пулевидные вирусы, названные так благодаря их характерному очертанию на микрофотографии. Внешне вирусы этой разновидности очень схожи. А болезни они вызывают самые разнообразные, поражая при этом весьма далекие друг от друга виды живых существ. Они могут стать причиной бешенства — тяжелейшего поражения нервной системы млекопитающих (в том числе, разумеется, и человека) и таких болезней, как везикулярный стоматит крупного рогатого скота (передаваемый, кстати, через насекомых), желтой карликовости картофеля и полосатой штриховатости пшеницы. Эти же вирусы провоцируют тяжелое заболевание у мухи дрозофилы, приводящее насекомое к гибели в результате повышения чувствительности к углекислому газу.
Эти же вирусы провоцируют тяжелое заболевание у мухи дрозофилы, приводящее насекомое к гибели в результате повышения чувствительности к углекислому газу.
Человек, животные, насекомые, растения. Болезни общие для многих видов и узко-специфичные… Откуда такой широкий спектр агрессивных возможностей? Под влиянием каких условий сложились эти свойства? Сколько еще существует в природе вирусов специализированных и универсальных?
На все эти вопросы лишь предстоит ответить.
Гипотезы, гипотезы…
С вирусами связано немало загадочного, неясного, а если быть точным до конца — еще не выясненного.
Признавая существование возбудителей инфекционных болезней, по размерам намного меньших, чем бактерии, ученые долго не могли прийти к единому мнению: какие они? Так, известный голландский микробиолог М. Бейеринк, к примеру, предполагал, что вирусы — необъяснимая загадка. Он дал им название Cоntagium vivum fluidum — живое жидкое заразное начало.
Другие исследователи пытались связать данные о вирусах с привычными для них представлениями о живом организме (клеточное строение, размножение путем деления с последующим ростом до размеров взрослой особи и т. д.). Не будем перечислять здесь другие предположения, высказанные на заре развития вирусологии. Все они — как наивные, так и наделенные долей предвидения — строились на одних лишь догадках, вслепую.
Правильная оценка этих представлений была дана лишь с получением сделанного в 1956 году при помощи электронного микроскопа фотоснимка, портрета вируса. Появилась возможность отмести неверные и попросту нелепые предположения, но загадок стало не меньше, а больше. Например, у вирусов было открыто удивительное разнообразие носителей наследственной информации. Все живое на Земле имеет один-единственный такой носитель — дезоксирибонуклеиновую кислоту — ДНК (двухспиральную ДНК). Причем ДНК встречается в организме любого живого существа всегда «в паре», вместе с другим веществом — рибонуклеиновой кислотой — РНК. А у вирусов — носителей генетической информации оказалось целых шесть: четыре формы ДНК и две — РНК. При этом вирусы довольствуются (всегда!) только одной нуклеиновой кислотой — ДНК или РНК. Почему?
А у вирусов — носителей генетической информации оказалось целых шесть: четыре формы ДНК и две — РНК. При этом вирусы довольствуются (всегда!) только одной нуклеиновой кислотой — ДНК или РНК. Почему?
Много неясного и в современных гипотезах о происхождении вирусов. Так, одни исследователи считают, что вирусы — это потомки древних доклеточных форм жизни, застывшие, остановившиеся в своем развитии на определенном этапе. Разнообразие генетического вещества, говорят сторонники гипотезы, отражает ход эволюции этих существ. Природа как бы опробовала на вирусах все возможные варианты наследственного вещества, прежде чем остановиться окончательно на двухспиральной ДНК.
Вирусы — потомки бактерий или других одноклеточных организмов, по неизвестным причинам двинувшиеся в своем развитии вспять, деградировавшие, говорят другие ученые. Возможно, некогда их устройство было сложней, но со временем они многое утратили, и их нынешнее состояние, в том числе и разнообразие носителей генетической информации, лишь отражает разные уровни деградации, которых достигли различные их виды.
Наконец, существует гипотеза, согласно которой вирусы представляют собой составные части клеток живых существ, по неизвестной причине ставшие автономными системами. Процесс возникновения вирусов, согласно этой гипотезе, относится не только к глубокой древности, когда они уже, безусловно, существовали, но и к нашему времени. Иными словами, эта гипотеза признает возможность повсеместного, происходящего непрерывно образования вирусов клеточными элементами. Возможно ли такое, способны ли составные части клеток стать автономными, да еще и саморепродуцирующимися (способными к воспроизведению) системами?
— Да,— отвечают сторонники этой гипотезы.— Многие клеточные структуры обладают относительной автономией. К примеру, митохондрия — органелла, ведающая энергетическим балансом клетки, — имеет собственный генетический аппарат, а цикл ее деления независим от цикла деления клеток. Значительной степенью автономии располагают и гены. Среди составных частей клетки можно найти структуры, сходные с основными типами генетического аппарата вирусов. .. Все новые и новые доводы находят исследователи, подтверждающие гипотезу «взбесившихся генов», как ее подчас именуют не без иронии. И выглядит она, эта гипотеза, сегодня гораздо убедительней, чем два десятилетия назад, в момент появления.
.. Все новые и новые доводы находят исследователи, подтверждающие гипотезу «взбесившихся генов», как ее подчас именуют не без иронии. И выглядит она, эта гипотеза, сегодня гораздо убедительней, чем два десятилетия назад, в момент появления.
Логика и парадоксы микромира
Очень часто, говоря о вирусах, мы произносим привычно: «ничтожно малые», «крохотные», «мельчайшие». Это так, бесспорно. Вес вирусов измеряется дальтонами (1 дальтон = 1/16 веса атома кислорода, то есть 1,65 · 10-24 грамма), а размеры — ангстремами, стомиллионными долями сантиметра. Однако, добавим здесь же, крохотные — не значит одинаковые: в область микровеличин как бы сдвинуто целое царство вирусов во всем его многообразии. И вирус ящура — один из мельчайших (он по размерам чуть больше молекулы) так же отличается от вируса оспы (который настолько велик, что виден даже в оптический микроскоп), как, скажем, колибри от страуса или мышь от бегемота.
Надо ли говорить, что эти «крайности» объединяет множество промежуточных видов, также чрезвычайно разнообразных и по размерам и по строению.
Устройство вирусов поражает своей чисто математической завершенностью, логикой симметрии. Возьмем, к примеру, наиболее просто организованный вирион (зрелый вирус) табачной мозаики.
Сотни белковых кристаллообразных структур уложены в виде тугой спирали. Сердцевина нити, образующей спираль, представляет собой своеобразную капсулу, где находится молекула нуклеиновой кислоты. В результате общий вид вириона — предельно лаконичный цилиндр, полая трубка.
А вот другая форма: двадцатигранник, икосаэдр, грани которого образованы треугольниками. Основной материал, из которого сложен икосаэдр, — те же белковые структуры. Внутри — полость, где покоится молекула нуклеиновой кислоты. Это вирион полиомиелита.
Описанные вирусы относятся к числу наиболее просто устроенных, «минимальных», как их называют. Впрочем, и «минимальные» и другие гораздо более сложно устроенные вирусы всегда сходны в одном: их «нуклеиновый центр» — нуклеоид построен по одному из описанных двух типов — винтовому или кубическому.
Кстати, изучая «минимальные» вирусы, исследователи столкнулись с любопытнейшим явлением, не имеющим аналогий в мире живых существ.
…Можно ли механически разделить живую клетку на части, затем вновь собрать ее и заставить не только ожить, но и исправно функционировать? «Минимальные» вирусы на такое способны. Если отделить их белковые оболочки от нуклеиновой кислоты, иными словами, если превратить их в белковые «осколки» и нуклеиновую массу, а затем эти две субстанции смешать, то вновь возникнут исходные зрелые вирусы — вирионы с их геометрически правильной структурой и прежними инфекционными свойствами.
— Позвольте, — возражали многие ученые еще в недавнем прошлом, — да можно ли вообще после этого называть вирусы живыми существами? Может быть, это кристаллообразные вещества, наделенные болезнетворными свойствами?
— Либо, — говорили другие, — это пограничные формы между живым и неживым мирами.
Кто же прав? Скорей всего наиболее многочисленная группа исследователей, которая считает, что вирусы — представители живой природы, го есть не вещества, а существа. Правда, существа крайне своеобразные, ведущие сугубо паразитический образ жизни.
Вирус проникает в клетку
Паразитизм, то есть существование одного организма за счет другого, — явление, весьма распространенное в природе. Кровососущие насекомые — клещи, вши, тли, обитающие на листьях растений, ленточные черви-глисты, бактерии — все они используют питательные вещества, содержащиеся в организме своего «хозяина», так сказать, живут за его счет.
Вирусы в этом не нуждаются. Питаться им нечем и незачем: органы, осуществляющие обмен веществ, у них отсутствуют. Однако своему «хозяину» они доверяют нечто гораздо большее — заботы о продолжении их рода.
Интимнейший процесс размножения вирусов происходит в недрах клетки. И способы проникновения в клетку, эту «святая святых» организма, и образ действий вирусных частиц на всех следующих за этим стадиях чрезвычайно показательны. Впрочем, понаблюдаем за этими действиями от начала до конца на примере вируса бактерии — бактериофага T2, «хозяином» которого является кишечная палочка.
Впрочем, понаблюдаем за этими действиями от начала до конца на примере вируса бактерии — бактериофага T2, «хозяином» которого является кишечная палочка.
Своеобразно строение этого вируса. Т2 состоит из двух частей — головки и отростка. Головка — икосаэдр, сложенный из белковых структур. Внутри — в капсуле — носительница наследственной информации фага — ДНК. Полый отросток с шестью шипами и столькими же нитями-фибриллами на конце прикреплен к одной из граней икосаэдра и снабжен наружным «чехлом» из особого белка, способного сокращаться, подобно мышце. Здесь же, в кончике отростка,— небольшое количество фермента лизоцима.
Начало сближения вируса T2 с бактерией-клеткой происходит как бы само собой, под действием сил внешних: фаг притягивается к поверхности клетки, подобно магнитной мине, «прилипающей» к днищу корабля.
Дальнейшие действия вируса, однако, далеко не столь пассивны. Ворсинки-фибриллы и шипы позволяют ему укрепиться в наиболее выгодном положении, прижаться к оболочке клетки. При этом фермент лизоцим, способный разрыхлять клеточные структуры, начинает разрушать находящийся перед ним участок оболочки. Затем следует резкое сокращение «чехла» и отросток, прокалывая истонченную стенку, вталкивается в клетку. Нить ДНК в этот момент как бы впрыскивается внутрь клетки, а ненужная больше белковая оболочка остается снаружи.
При этом фермент лизоцим, способный разрыхлять клеточные структуры, начинает разрушать находящийся перед ним участок оболочки. Затем следует резкое сокращение «чехла» и отросток, прокалывая истонченную стенку, вталкивается в клетку. Нить ДНК в этот момент как бы впрыскивается внутрь клетки, а ненужная больше белковая оболочка остается снаружи.
Экспериментально удалось установить длину нити ДНК фага Т2: она равна примерно 50 микронам, что в 500 раз превышает диаметр головки самого фага. Таким образом, можно себе представить, какой сложности задача решается вирусом во время этой своеобразной «инъекции». Используя привычные для нас категории измерений, этот процесс можно сравнить с мгновенным проталкиванием капроновой нити десятиметровой длины через небольшую соломинку.
Вирусы, имеющие иное строение, проникают в клетку не столь затейливым путем. Притянутые к оболочке клетки и воздействующие на нее ферментами, они провоцируют втягивание внутрь того участка мембраны, на котором осели. Образуется своего рода капсула-вакуоль с вирусной частицей внутри. Вакуоль эта затем отрывается, и в ней, путешествующей внутри клетки, продолжают идти одновременно два процесса — вирусная частица с помощью своих ферментов разрушает окутывающие ее стенки капсулы, а ферменты клетки разрушают внешние оболочки вируса, освобождая, как это было и в случае с фагом Т2, нуклеиновую кислоту.
Образуется своего рода капсула-вакуоль с вирусной частицей внутри. Вакуоль эта затем отрывается, и в ней, путешествующей внутри клетки, продолжают идти одновременно два процесса — вирусная частица с помощью своих ферментов разрушает окутывающие ее стенки капсулы, а ферменты клетки разрушают внешние оболочки вируса, освобождая, как это было и в случае с фагом Т2, нуклеиновую кислоту.
Фабрика вирусов
Итак, нуклеиновая кислота покинула белковую оболочку и исчезла, бесследно растворилась в клеточной среде. Что же дальше?
Внешне на первый взгляд — полное благополучие, своеобразная «немая фаза», когда ничто не напоминает о недавних событиях. И лишь через некоторое время, строго определенное для каждого вида вирусов, когда клетка гибнет, а ее оболочку покидают зрелые вирионы, можно сделать вывод: да, борьба продолжается. Где и как?
Мы еще не имеем возможности получить полный ответ на этот вопрос. До сих пор удалось установить характер лишь некоторых изменений, происходящих на этом этапе в различных частях клетки. И по этим отдельным штрихам мы воссоздаем, пытаемся представить себе полностью происходящее.
И по этим отдельным штрихам мы воссоздаем, пытаемся представить себе полностью происходящее.
Формирование вирусов начинается, по-видимому, с подавления нормальных процессов обмена веществ в клетке. Установлено, в частности, что рибонуклеиновая кислота (РНК) вируса гриппа способна синтезировать на клеточных элементах — рибосомах, ведающих выработкой белка,— особое вещество, также белковой природы,— гистон, который, в свою очередь, связывается с ДНК клетки и прекращает синтез клеточной РНК. Некоторые другие вирусы, например, вирусы полиомиелита, не нуждаются в окольном пути, так как сами способны вмешаться в деятельность рибосом и прекратить синтез клеточных белков. Выявлены и другие механизмы подавления вирусами клеточного обмена, их вмешательства в жизнедеятельность клетки, но в конечном счете все сводится к одному: клеточные ресурсы перестают расходоваться на нужды самих клеток и поступают в распоряжение вирусной нуклеиновой кислоты.
Иными словами, клеточные структуры, ведающие воспроизведением «запасных частей» для вечно обновляющейся, омолаживающейся клетки, получают приказ об изготовлении частей вирусов. И клетка, образно говоря, превращается в фабрику, где одновременно, в напряженнейшем темпе, намного превосходящем ее возможности, начинают производиться сотни конечностей, сотни туловищ, сотни наборов «внутренних органов» (нуклеиновые кислоты, ферменты и другие сложные соединения вирусов). Эти «полуфабрикаты» скапливаются в разных частях клетки, а затем в столь же интенсивном темпе идут на сборку новых вирусов.
И клетка, образно говоря, превращается в фабрику, где одновременно, в напряженнейшем темпе, намного превосходящем ее возможности, начинают производиться сотни конечностей, сотни туловищ, сотни наборов «внутренних органов» (нуклеиновые кислоты, ферменты и другие сложные соединения вирусов). Эти «полуфабрикаты» скапливаются в разных частях клетки, а затем в столь же интенсивном темпе идут на сборку новых вирусов.
Здесь-то и кончается «немая фаза»: оболочка истощенной клетки лопается, на свет появляются новорожденные, окончательно сформировавшиеся вирусы.
Беззащитна ли клетка!
Цикл превращений, связанных с размножением вирусов, как правило, краток. В одних случаях проникновение вирусной нуклеиновой кислоты в клетку отделяет от появления вирионов 13—15 минут, в других — 40 минут. Вирусы одной из наиболее распространенных инфекций, гриппа, проходят этот путь примерно за 6—8 часов. И каждый раз около погибшей клетки оказываются десятки, а порой и сотни вирионов. Причем каждый из них, в свою очередь, готов к продолжению процесса размножения. Количество вирусной инфекции нарастает буквально лавинообразно.
Причем каждый из них, в свою очередь, готов к продолжению процесса размножения. Количество вирусной инфекции нарастает буквально лавинообразно.
Так обстоит дело в условиях, идеальных для вирусной инфекции, когда ничто не препятствует ее распространению. Эти условия искусственно воссоздаются учеными в лаборатории при помощи метода культуры тканей. Заключается этот метод в следующем. В стеклянных сосудах выращиваются колонии клеток различных животных организмов. Клетки с их способностью к постоянному обновлению своих структур практически бессмертны. Взятые однажды, а затем многократно «перепрививаемые», пересаживаемые из сосуда в сосуд, они способны надолго пережить своих «хозяев».
Условия, сходные с природными, естественными, имитируют здесь специальные питательные среды и тщательно выверенные температуры. Стеклянный сосуд с тонким, прозрачным слоем культуры тканей и становится ареной, где беспрепятственно хозяйничают вирусы. За их действиями удобней всего проследить при помощи кинокамеры, установленной у объектива оптического микроскопа.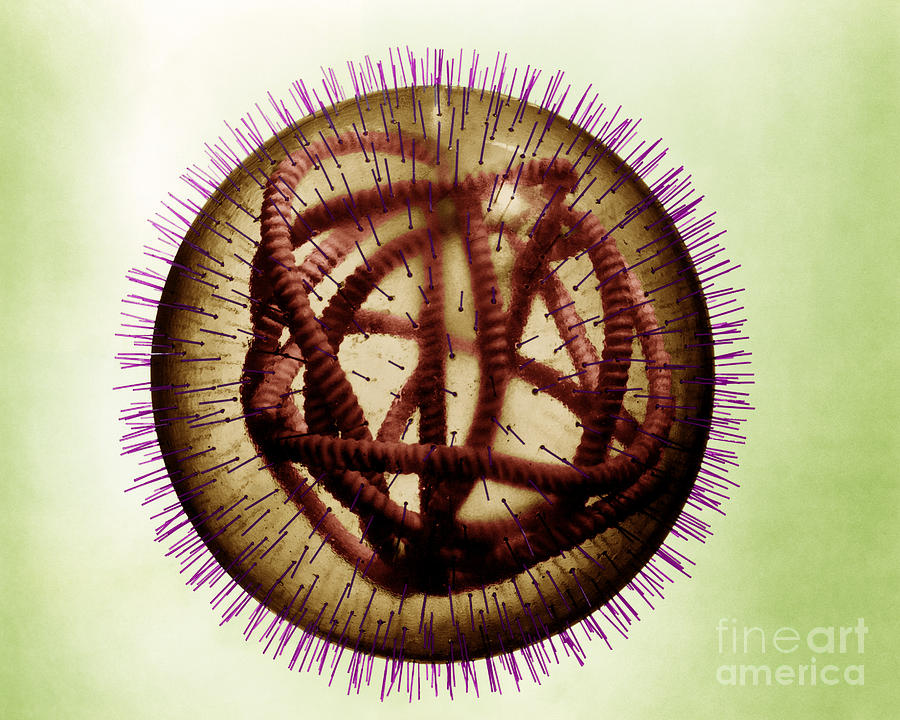 На кадрах фиксируются все наиболее важные моменты единоборства клеток с вирусами. Демонстрировать фильмы можно с любой нужной нам скоростью. Таким образом, время процесса, измеряемого в ходе опыта сутками и часами, «сжимается» до нескольких минут.
На кадрах фиксируются все наиболее важные моменты единоборства клеток с вирусами. Демонстрировать фильмы можно с любой нужной нам скоростью. Таким образом, время процесса, измеряемого в ходе опыта сутками и часами, «сжимается» до нескольких минут.
Но так как главное действующее лицо — вирус остается за кадром (в обычный микроскоп он не виден), на экране только последствия его агрессии. Картина перед наблюдателем разворачивается впечатляющая. Вначале крайние клетки, первыми подвергшиеся нападению, начинают терять свойственные им округлые очертания. Постепенно истончаются их мембраны, клеточные элементы, клетка как бы взрывается. В этот момент, как мы знаем (но не видим этого), опустошенную оболочку покидают полчища вирионов, направляющихся к очередным своим жертвам. И через самое непродолжительное время точно так же изменяются, а затем лопаются соседние клетки, за ними другие, еще и еще.
…Колония клеточной культуры как бы охвачена пламенем. Вот она рассечена обезжизненными структурами на островки. Вот сжимаются и эти островки, уменьшаются в размерах, и… все кончено. Колония разрушена дотла.
Вот сжимаются и эти островки, уменьшаются в размерах, и… все кончено. Колония разрушена дотла.
Обладай вирусы такими же возможностями в естественных условиях, и человеку и любому другому живому существу пришлось бы плохо. Однако этого не происходит, ибо на страже — отработанные за миллионы лет защитные приспособления организма, ограничивающие могущество вирусов.
Безграничному расширению вирусной агрессии препятствуют прежде всего сами вирусы. Еще в 30-х годах ученые заметили, что размножение в клетке одного вируса нередко препятствует размножению в этой же клетке другого вируса.
Чем это объяснить? Не сообщает же удачливый вирион своим собратьям: «Стоп! Клетка занята!» А если и сообщает, то как?
Кстати, если говорить серьезно, одна из многочисленных гипотез, пытавшихся объяснить это явление, так и гласила: всему причиной конкуренция вирусов, борющихся за клеточные компоненты. Без малого три десятилетия понадобилось, чтобы раскрыть существо этого явления, получившего название интерференции. И, как оказалось, в данном случае инициатива принадлежала не вирусам, а самой клетке. На проникновение вируса (чему воспрепятствовать клетка, увы, не может) она отвечает немедленной выработкой особого белкового вещества — интерферона. Правда, интерферон не спасает уже пораженную клетку, но препятствует продвижению вирусной инфекции к другим клеткам организма. Иными словами, за первыми же вирионами, прорвавшимися в организм, возникает барьер интерфероновой защиты.
И, как оказалось, в данном случае инициатива принадлежала не вирусам, а самой клетке. На проникновение вируса (чему воспрепятствовать клетка, увы, не может) она отвечает немедленной выработкой особого белкового вещества — интерферона. Правда, интерферон не спасает уже пораженную клетку, но препятствует продвижению вирусной инфекции к другим клеткам организма. Иными словами, за первыми же вирионами, прорвавшимися в организм, возникает барьер интерфероновой защиты.
Позже, обычно через несколько дней, возникает «второй эшелон» противовирусной обороны — антитела. Эти вещества, также белковой природы, нейтрализуют действие вирусов, препятствуют их размножению.
Какое же из этих естественных средств защиты лучше. Хороши и нужны оба. Интерферон, помогающий отразить первый натиск вирусной инфекции, исчезает гораздо быстрей, но если возникает необходимость, столь же быстро появляется вновь. Именно его способностью действовать в нужный момент и объясняют в наши дни латентный (скрытый) характер целого ряда вирусов, «сосуществующих» с нашим организмом.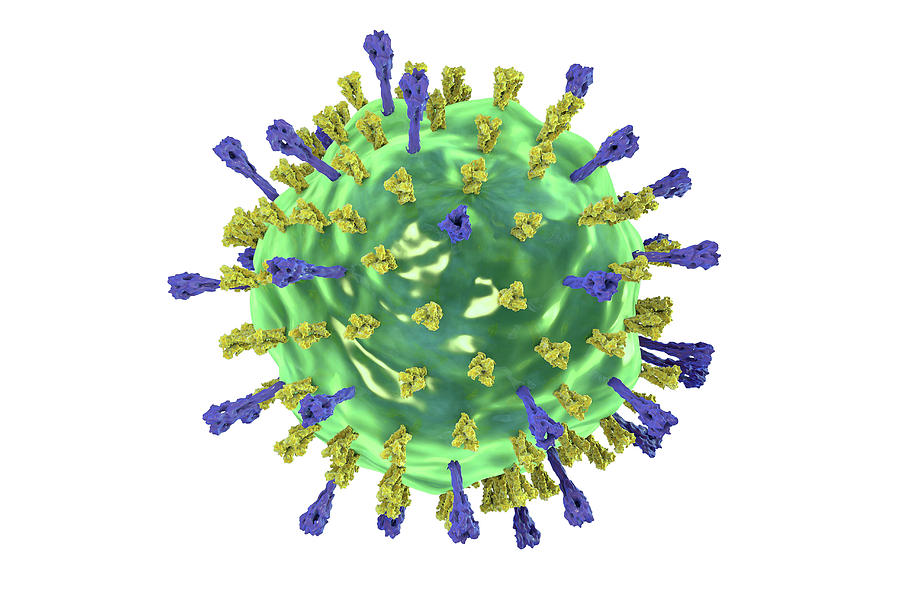 Пример — вирус герпеса, который наверняка есть в организме у каждого из нас, но может проявиться только в момент простуды, когда организм ослаблен и выработке интерферона понижена.
Пример — вирус герпеса, который наверняка есть в организме у каждого из нас, но может проявиться только в момент простуды, когда организм ослаблен и выработке интерферона понижена.
Антитела, появляющиеся позже, существуют несравненно дольше. Именно они и становятся основой стойкого иммунитета, благодаря которому многие инфекционные болезни не повторяются дважды в жизни одного индивидуума.
Медицина — в наступлении
Среди инфекционных заболеваний 80 процентов вирусных. Эта цифра — свидетельство победы человека над бактериальными инфекциями. Чума, холера, тиф, некогда безоговорочно первенствовавшие в медицинских статистических сводках, с приходом антибиотиков и сульфопрепаратов навсегда сдали свои позиции. Их место заняли болезни, вызываемые вирусами.
Как известно, и с этими недугами ведется успешная борьба. Побежден полиомиелит. Тягостным воспоминанием ушла в прошлое оспа. Широким фронтом идет наступление на корь: лишь за последнее пятилетие число перенесших заболевание корью снизилось в 5 раз; на повестке дня — полное искоренение этой инфекции на территории нашей страны.
Значительные усилия направляются на борьбу с гепатитом, гриппом, паротитом, вирусными респираторными заболеваниями, однако здесь решающие достижения еще впереди.
Можно отметить два основных направления борьбы с вирусными инфекционными болезнями. Это вакцинация и использование естественного, «предложенного» природой вещества — интерферона. Сейчас его уже получают в массовых количествах и успешно применяют для профилактики гриппа и при лечении других вирусных заболеваний.
Наряду с этим ученые работают над созданием других эффективных лекарственных веществ, способных подавить вирусную инфекцию.
Нам предстоит организовать широчайшие, в масштабе всей планеты, исследования мест обитания болезнетворных вирусов, изучение условий их существования, выявление их постоянных и промежуточных «хозяев» среди млекопитающих, насекомых и других живых существ.
Работа эта начата. Во все концы нашей страны и за рубеж отправляются специальные экспедиции вирусологов. Уже получены чрезвычайно ценные данные о перемещениях вирусной гриппозной инфекции из Всемирного противогриппового центра, в деятельность которого вносит существенный вклад региональный противогриппозный центр СССР.
Уже получены чрезвычайно ценные данные о перемещениях вирусной гриппозной инфекции из Всемирного противогриппового центра, в деятельность которого вносит существенный вклад региональный противогриппозный центр СССР.
Я не остановился на исследованиях, проводимых вирусологами в области изучения онкогенных вирусов, — это тема специальной статьи. Скажу только, что нам предстоит разработать методы «генной хирургии», чтобы уметь не только удалять вторгшиеся в клетку человека и животных геномы онкогенных вирусов, но и в ряде случаев блокировать их внутри клетки. Думаю, что это уже не фантастика, а вполне реальная перспектива.
Такова наша тактика сегодня. А стратегия будет зависеть от того, какая гипотеза о происхождении вирусов окажется верной. Если справедливы первые две — мы на правильном пути. Но если подтвердится гипотеза «взбесившихся генов», с наши планы придется внести существенные коррективы. Какие? Это покажет будущее.
Вирусы и бактерии – великое противостояние
: 26 Окт 2016 , Бактериофаги: враги наших врагов , том 70,
№4
Создание современной технологии геномного редактирования, которая уже с успехом применяется на разных животных, растениях, грибах и бактериях, базируется на исследованиях бактериальных систем CRISPR-Cas. Изначально предполагалось, что они участвуют в ликвидации повреждений бактериальной ДНК, но в 2007 г. стало ясно, что истинное предназначение этих систем – борьба с вирусами бактерий, бактериофагами. Всего за девять лет наука проделала гигантский путь от раскрытия механизма бактериального иммунитета до редактирования геномов людей – в настоящее время уже проводятся первые эксперименты по редактированию ДНК человеческих эмбрионов. У бактерий имеются и другие «иммунные» механизмы, изучение которых, возможно, создаст предпосылки для новых прорывов в биомедицине
Изначально предполагалось, что они участвуют в ликвидации повреждений бактериальной ДНК, но в 2007 г. стало ясно, что истинное предназначение этих систем – борьба с вирусами бактерий, бактериофагами. Всего за девять лет наука проделала гигантский путь от раскрытия механизма бактериального иммунитета до редактирования геномов людей – в настоящее время уже проводятся первые эксперименты по редактированию ДНК человеческих эмбрионов. У бактерий имеются и другие «иммунные» механизмы, изучение которых, возможно, создаст предпосылки для новых прорывов в биомедицине
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
В ходе эволюции происходила и сейчас происходит селекция бактерий, способных избежать гибели при инфицировании вирусами, что, в свою очередь, служит стимулом для бактериофагов совершенствовать свои агрессивные стратегии. Эта «гонка вооружений», длящаяся несколько миллиардов лет, т. е. ровно столько, сколько существуют сами бактерии и их враги, породила целый ряд изощренных механизмов защиты и нападения
Вирусная атака начинается с прикрепления фага к специфическому рецептору на поверхности бактериальной клетки, но при потере рецептора или изменении в его структуре связывания вируса не происходит. Бактерии могут менять рецепторы в зависимости от окружающих условий, таких как плотность и разнообразие микроорганизмов в среде, а также доступность питательных веществ (Bikard et al., 2012). Любопытный пример — бактерии вида Vibrio anguillarum, которые способны формировать биопленку, т. е. плотный слой клеток, прикрепленный к какой-либо поверхности. У этой бактерии имеется своего рода «чувство кворума», за счет чего при увеличении плотности клеток у них понижается выработка рецептора, с которым может связываться вирус. В результате биопленка становится почти полностью устойчивой к заражению (Tan et al., 2015).
У этой бактерии имеется своего рода «чувство кворума», за счет чего при увеличении плотности клеток у них понижается выработка рецептора, с которым может связываться вирус. В результате биопленка становится почти полностью устойчивой к заражению (Tan et al., 2015).
Однако потеря рецепторов не всегда выгодна для бактерии, поскольку они выполняют разнообразные важные функции, например, транспорт питательных веществ или формирование межклеточных контактов (Lopez-Pascua et al., 2008). В результате для каждой пары «бактерия-бактериофаг» в ходе эволюции находится оптимальное решение, обеспечивающее приемлемый уровень защиты при сохранении возможности роста бактерий в различных условиях среды.
Следующий защитный механизм – исключение суперинфекции. Для бактериофагов известны два основных пути инфекции: литический, приводящий к быстрой гибели зараженной бактерии с высвобождением вирусного потомства, и затяжной лизогенный путь, когда наследственный материал вируса находится внутри генома бактерии, удваивается только с хозяйской ДНК, не причиняя клетке вреда. Когда клетка находится в состоянии лизогенной инфекции, то, с точки зрения «домашнего» вируса (профага), ее заражение другим вирусом нежелательно.
Когда клетка находится в состоянии лизогенной инфекции, то, с точки зрения «домашнего» вируса (профага), ее заражение другим вирусом нежелательно.
Действительно, многие вирусы, встроившие свою ДНК в геном клетки, ограничивают вновь проникшего в клетку бактериофага («суперинфекцию») посредством специальных белков-репрессоров, не позволяющих генам «пришельца» работать (Calendar, 2006). А некоторые фаги даже препятствуют другим вирусным частицам проникнуть в инфицированную ими клетку, воздействуя на ее рецепторы. В результате бактерии – носительницы вируса имеют очевидное преимущество по сравнению с незараженными собратьями.
В 1978 г. за открытие ферментов рестриктаз швейцарский генетик В. Арбер и американские микробиологи Д. Натанс и Г. Смит были удостоены Нобелевской премии. Изучение систем рестрикции-модификации привело к созданию технологии молекулярного клонирования, которая широко применяется во всем мире. С помощью рестриктаз можно «вырезать» гены из генома одного организма и вставить в геном другого, получив химерную рекомбинантную ДНК, не существующую в природе. Различные вариации этого подхода используются учеными для изолирования отдельных генов и их дальнейшего изучения. Кроме того, он широко применяется в фармацевтике, например, для наработки инсулина или терапевтических антител: все лекарства такого рода созданы с помощью молекулярного клонирования, т. е. являются продуктом генной модификации
Различные вариации этого подхода используются учеными для изолирования отдельных генов и их дальнейшего изучения. Кроме того, он широко применяется в фармацевтике, например, для наработки инсулина или терапевтических антител: все лекарства такого рода созданы с помощью молекулярного клонирования, т. е. являются продуктом генной модификации
Во время инфекции все ресурсы бактериальной клетки направлены на производство новых вирусных частиц. Если рядом с такой клеткой будут находиться другие уязвимые бактерии, то инфекция быстро распространится и приведет к гибели большинства из них. Однако для таких случаев у бактерии имеются так называемые системы абортивной инфекции, которые приводят ее к запрограммированной гибели. Конечно, этот «альтруистичный» механизм не спасет саму зараженную клетку, но остановит распространение вирусной инфекции, что выгодно для всей популяции. Бактериальные системы абортивной инфекции очень разнообразны, но детали их функционирования пока изучены недостаточно.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
В ДНК бактерии, содержащей такую систему, все сайты модифицированы. И если бактерия заражается вирусом, ДНК которого не содержит подобной модификации, рестриктаза защитит от инфекции, разрушив вирусную ДНК. Многие вирусы «борются» с системами рестрикции-модификации, не используя в своих геномах последовательности, узнаваемые рестриктазой, – очевидно, что вирусные варианты с другой стратегией просто не оставили потомства.
Последней и в настоящее время самой интересной системой бактериального иммунитета является система CRISPR-Cas, с помощью которой бактерии способны «записывать» в собственный геном и передавать потомству информацию о фагах, с которыми они сталкивались в течение жизни. Наличие таких «воспоминаний» позволяет распознавать ДНК фага и эффективней противостоять ему при повторных инфекциях. В настоящее время к системам CRISPR-Cas приковано пристальное внимание, так как они стали основой революционной технологии редактирования геномов, которая в будущем, возможно, позволит лечить генетические заболевания и создавать новые породы и сорта сельскохозяйственных животных и растений.
Наличие таких «воспоминаний» позволяет распознавать ДНК фага и эффективней противостоять ему при повторных инфекциях. В настоящее время к системам CRISPR-Cas приковано пристальное внимание, так как они стали основой революционной технологии редактирования геномов, которая в будущем, возможно, позволит лечить генетические заболевания и создавать новые породы и сорта сельскохозяйственных животных и растений.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
В системах II типа эффекторный комплекс образован единственным большим белком Cas9, который в одиночку справляется со всеми задачами. Именно простота и относительная компактность таких систем послужили основой для разработки технологии редактирования ДНК. Согласно этому методу, в клетки эукариот (например, человека) доставляют бактериальный белок Сas9 и крРНК, которую называют гидовой (гРНК). Вместо спейсера вирусного происхождения такая гРНК содержит целевую последовательность, соответствующую интересному для исследователя участку генома, например, где есть мутация, вызывающая какую-то болезнь. Получить же гРНК «на любой вкус» совсем несложно.
Вместо спейсера вирусного происхождения такая гРНК содержит целевую последовательность, соответствующую интересному для исследователя участку генома, например, где есть мутация, вызывающая какую-то болезнь. Получить же гРНК «на любой вкус» совсем несложно.
Эффекторный комплекс Cas9-гРНК вносит двуцепочечный разрыв в последовательность ДНК, точно соответствующую «гидовой» РНК. Если вместе с Cas9 и гРНК внести в клетку и последовательность ДНК, не содержащую мутацию, то место разрыва будет восстановлено по матрице «правильной» копии! Таким образом, используя разные гРНК, можно исправлять нежелательные мутации или вводить направленные изменения в гены-мишени. Высокая точность программируемого узнавания мишеней комплексом Cas9-гРНК и простота метода привели к лавинообразному росту работ по редактированию геномов клеток животных и растений (Jiang & Marraffini, 2015).
Гонка вооружений
В ходе эволюции бактерии и бактериофаги выработали ряд приспособлений, которые должны обеспечить каждому из участников «гонки вооружений» преимущество в борьбе с противником или возможность уклониться от его атаки.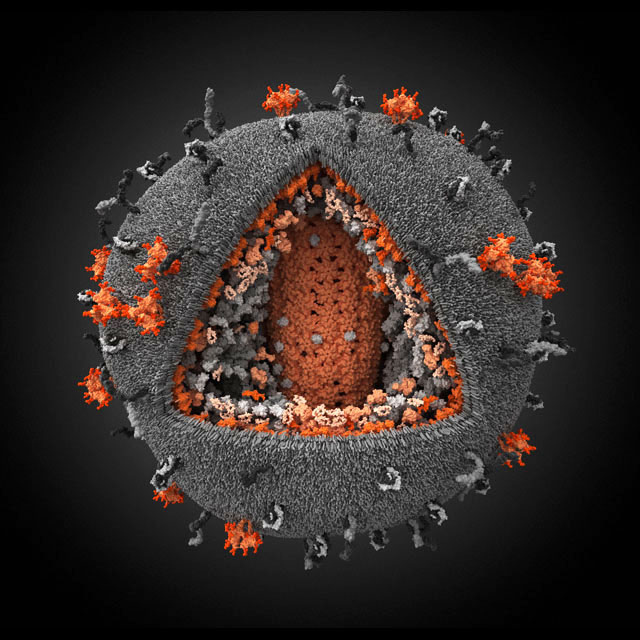
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Что касается систем CRISPR-Cas, то если фаг обзаведется мутацией в протоспейсере, эффективность его узнавания эффекторным комплексом снижается, и фаг получает возможность заразить клетку. Но и бактерия не оставит без внимания такую попытку ускользнуть от CRISPR-Cas: в качестве ответной реакции она начинает с резко возросшей эффективностью приобретать новые дополнительные спейсеры из ДНК уже «знакомого» фага, пусть и мутировавшего. Такое явление, названное праймированной адаптацией, многократно повышает эффективность защитного действия систем CRISPR-Cas (Datsenko et al., 2012).
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al. , 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
, 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
Результаты работ нашей лаборатории свидетельствуют, что зараженные клетки на самом деле погибают даже при наличии защиты CRISPR-Cas, но при этом они ограничивают численность вирусного потомства. Поэтому CRISPR-Cas правильнее относить к системам абортивной инфекции, а не к «настоящим» иммунным системам.
Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al.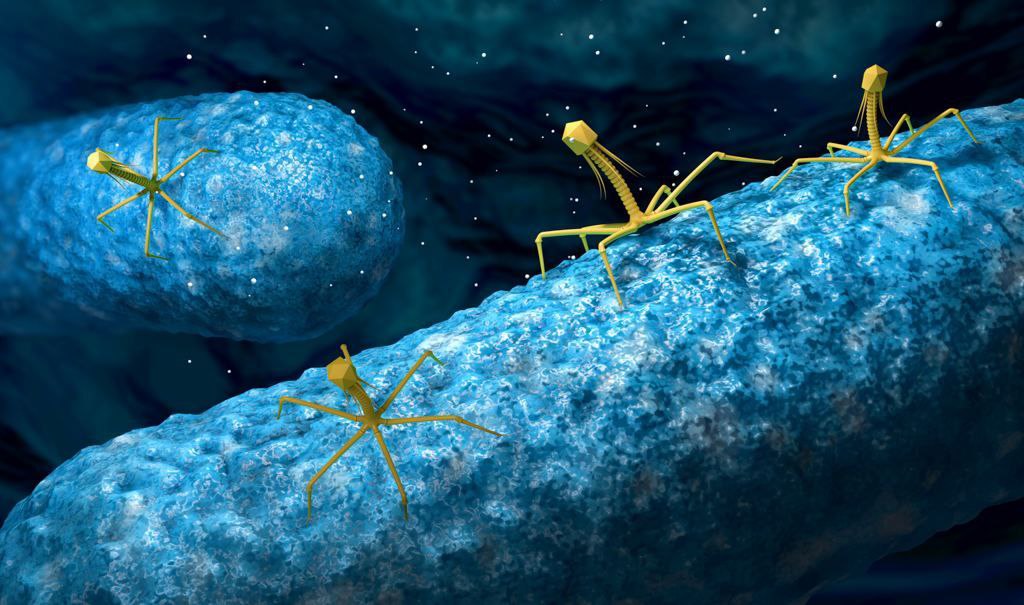 , 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
, 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Литература
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R. , Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
, Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
: 26 Окт 2016 , Бактериофаги: враги наших врагов , том 70,
№4
Вирусы и механизмы возникновения их мутаций
01. 03.2021
03.2021
Скачать статью о мутациях вирусов докт. мед. наук, профессора Писаренко Л.В.
Размер: 992 Кб
Вирусология занимает важное место среди биологических дисциплин. Современный медицинский или ветеринарный специалист должен знать не только клинико–патологическую сторону заболевания, но и иметь четкое представление о вирусах, их свойствах, методах лабораторной диагностики и свойствах постинфекционного и поствакцинального иммунитета.
Вирус (от лат. virus — яд) является простейшей неклеточной формой жизни в виде микроскопической биологической частицы, представляющей собой молекулы нуклеиновых кислот (ДНК или РНК), заключённых в защитную белковую оболочку (капсид) и способные инфицировать живые организма.
Вирусы являются облигатными внутриклеточными паразитами человека, животных, растений, насекомых, бактерий, грибов, простейших и других живых существ и изменяют свои свойства как в естественных условиях размножения, так и в экспериментах. Наследственные изменения свойств вирусов могут быть основаны на двух процессах:
Наследственные изменения свойств вирусов могут быть основаны на двух процессах:
- мутации, то есть изменении последовательности нуклеотидов в определенной области генома вируса, что приводит к фенотипически выраженному изменению свойства;
- рекомбинации, то есть обменом генетическим материалом между двумя вирусами, близкими, но различными по наследственным свойствам.
Значительная часть известных человеку вирусов имеют свои особые морфофункциональные и патогенные свойства, чем и вызывают вирусные заболевания у животных и людей. Среди таковых выделяют ДНК- и РНК-содержащие вирусы.
Мутации у вирусов
Мутация — это изменчивость, связанная с изменениями в самих генах. Она может быть прерывистой, скачкообразной и приводить к стойким изменениям наследственных свойств вирусов. Все вирусные мутации делятся на две группы:
- спонтанные;
- индуцированные (вызванные).

По своей протяжённости они делятся на точечные и аберрационные (изменения, затрагивающие значительную часть генома).
Точечные мутации вызываются замещением одного нуклеотида (для РНКсодержащих вирусов). Такие мутации иногда можно обратить вспять с восстановлением первоначальной структуры генома. Однако мутационные изменения могут захватывать большие части молекул нуклеиновых кислот, то есть несколько нуклеотидов. Также в этом случае может происходить выпадения, вставки и перемещения (транслокация) целых участков и даже повороты участков на 180° (так называемая инверсия), смещения каркаса считывания – более крупные перестройки в структуре нуклеиновых кислот, а следовательно, нарушение генетической информации.
Но точечные мутации не всегда приводят к изменению фенотипа. Существует целый ряд причин, по которым такие мутации не могут проявляться. Одна из них — вырождение генетического кода. Код синтеза белка вырождается, что означает, что некоторые аминокислоты могут быть закодированы несколькими триплетами (кодонами).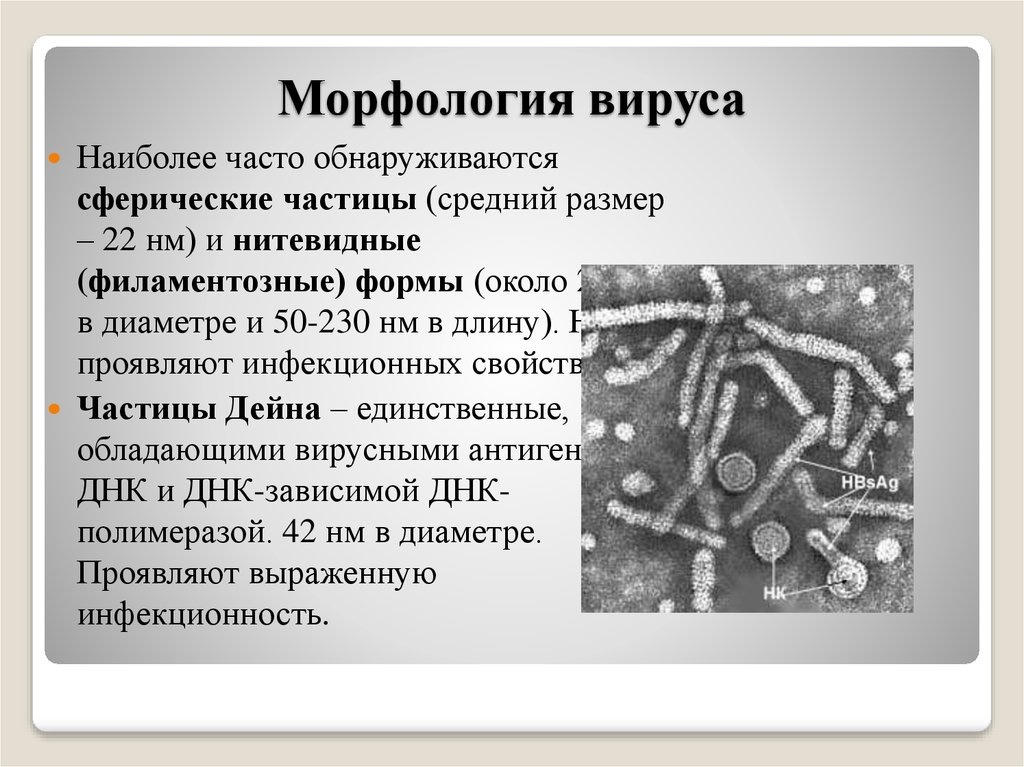 Например, аминокислота лейцин может быть закодирована шестью триплетами. Поэтому, если молекула РНК заменяет триплет ЦУУ на ЦУЦ, ЦУА на ЦУГ, то синтезированная молекула белка все еще будет содержать аминокислоту лейцин.
Например, аминокислота лейцин может быть закодирована шестью триплетами. Поэтому, если молекула РНК заменяет триплет ЦУУ на ЦУЦ, ЦУА на ЦУГ, то синтезированная молекула белка все еще будет содержать аминокислоту лейцин.
Поэтому ни структура белка, ни его биологические свойства не нарушаются. Природа использует своего рода синонимичный язык и, заменяя один кодон другим, закладывает в них одно и то же понятие (аминокислоту), тем самым сохраняя естественную структуру и функцию синтезируемого белка.
Другое дело, если аминокислота кодируется только одним триплетом, например, синтез триптофана кодируется и заменяется только триплетом УГГ, то есть синонимом, который отсутствует. В этом случае в белок включается еще одна какаялибо аминокислота, которая может привести к появлению мутантного признака.
Аберрация в фагах вызвана делециями (потерями) различного числа нуклеотидов, от одной пары до последовательности, вызывающей одну или несколько функций вируса. Как спонтанные, так и индуцированные мутации также делятся на прямые и обратные мутации. Мутации могут иметь разные последствия. В некоторых случаях они приводят к изменению фенотипических проявлений в нормальных условиях.
Мутации могут иметь разные последствия. В некоторых случаях они приводят к изменению фенотипических проявлений в нормальных условиях.
Например, увеличивается или уменьшается размер бляшек под агарным покрытием; увеличивается или ослабевает вирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. д.
В других случаях мутация является фатальной, поскольку она нарушает синтез или функцию жизненно важного вирусного белка, например, такого как вирусная полимераза. В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции при определенных условиях и теряет эту способность в неразрешающих (непермиссивных) условиях.
Типичным примером таких мутаций являются термочувствительные – ТS-мутации, при которых вирус теряет способность к размножению при повышенных температурах (+39-42°С), сохраняя эту способность при нормальных температурах роста (+36-37°С). Морфологические или структурные мутации могут влиять на размер вириона, первичную структуру вирусных белков и изменения в генах, определяющих ранние и поздние вирусные ферменты, обеспечивающие размножение вируса. Мутации также могут быть различными по своему механизму.
Морфологические или структурные мутации могут влиять на размер вириона, первичную структуру вирусных белков и изменения в генах, определяющих ранние и поздние вирусные ферменты, обеспечивающие размножение вируса. Мутации также могут быть различными по своему механизму.
В одних случаях происходит делеция, то есть потеря одного или нескольких нуклеотидов, в других — встраивание одного или нескольких нуклеотидов, а в некоторых случаях один нуклеотид заменяется другим. Мутации могут быть прямыми или обратными. Прямые мутации меняют фенотип, а обратные мутации – реверсии) — восстанавливаются. Реальная реверсия возможна, когда обратная мутация происходит вместе с первичным повреждением, и псевдореверсия, когда мутация происходит в другой области дефектного гена (интрагенное торможение мутации) или в другом гене (экстрагенное подавление мутации).
Реверсия — не редкое явление, потому что ревертанты обычно лучше приспособлены к данной клеточной системе. Поэтому при создании мутантов с определенными свой ствами, например, вакцинных штаммов, следует ожидать возможного превращения их в дикий тип. Вирусы отличаются не только своими небольшими размерами, селективной способностью к размножению в живых клетках, особенностями строения наследственного вещества, но и значительной изменчивостью от других представителей живого мира.
Вирусы отличаются не только своими небольшими размерами, селективной способностью к размножению в живых клетках, особенностями строения наследственного вещества, но и значительной изменчивостью от других представителей живого мира.
Изменения могут влиять на размер, форму, патогенность, антигенную структуру, тканевую тропность, устойчивость к физико-химическим воздействиям и на другие свойства вирусов. Значение причин, механизмов и характера изменений имеет большое значение при получении необходимых вакцин для вирусных штаммов, а также для разработки эффективных мер борьбы с вирусными эпизодами, в ходе которых, как известно, свойства вирусов могут существенно изменяться.
Мутация вирусов может происходить в результате химических изменений цистронов или нарушения последовательности их расположения в структуре молекулы вирусной нуклеиновой кислоты. В зависимости от условий различают естественную изменчивость вирусов, наблюдаемую в нормальных условиях размножения, и искусственную изменчивость, получаемую в результате многочисленных специальных пассажей или воздействия на вирусы определенных физических или химических факторов (мутагенов). В обычных природных условиях изменчивость проявляется не во всех вирусах одинаково.
В обычных природных условиях изменчивость проявляется не во всех вирусах одинаково.
Этот признак наиболее заметен у вируса гриппа и вирус ящера. Значительная изменчивость отмечается у вируса гриппа. Об этом свидетельствует большое количество вариантов у разных типов этих вирусов, а также значительные изменения его антигенных свойств в конце почти каждой эпизоотии.
Частота мутаций и механизмы их возникновения
Мутации бактериофагов изучались очень интенсивно не только с целью генетического анализа, но и с целью получения информации о свойствах самих фагов. Частота появления мутантов в потомстве фагов варьируется очень сильно: например, одни мутанты образуются с частотой не более 10, а другие-с частотой 10 и выше. Неблагоприятное воздействие высокочастотных мутаций обычно компенсируется эффектом отбора. Например, мутантный фаг может быть заменен диким типом, что дает более высокий выход фага. Высокая частота вспышек обычно характерна для таких мутаций, которые могут происходить как во многих локусах, так в одном и том же локусе.
В тех случаях, когда нормальный признак соответствует функциональной форме гена, а мутант появляется в результате изменения в любой точке локуса, частота прямых мутаций окажется выше, чем частота обратных мутаций, так как обратные мутации должны приводить к восстановлению нормального состояния. Иногда ревертанты на самом деле являются псевдоревертантами: это происходит либо из-за изменений в другом гене (мутации-супрессоры), либо из-за изменений в том же гене, которые вызывают другую, но также активную форму продукта.
У зрелых фагов частота спонтанных мутаций очень мала, но они могут быть индуцированы под влиянием таких мутагенных факторов, как рентгеновские или ультрафиолетовые лучи, азотистая кислота, гидроксиламин или алкилирующие агенты. Азотистая кислота дезаминирует основания нуклеотидов, а этилметилсульфат их этилирует. Гидроксиламин превращает шитозин в урацил. В результате ошибок, допущенных при репликации химически модифицированной нуклеиновой кислоты, происходят мутации, и потомство фагов, полученное из бактерии, содержит как нормальные, так и мутантные частицы. Однако, как и при обработке мутагенного фага, содержащего одноцепочную ДНК, образуется чистый мутантный клон.
Однако, как и при обработке мутагенного фага, содержащего одноцепочную ДНК, образуется чистый мутантный клон.
Изучение мутационного процесса, происходящего при размножении фагов, непосредственно связано с анализом развития фагов. Давайте рассмотрим процесс спонтанной мутации. В бактериальной клетке, в которой произошла мутация фага, 6 образуются как нормальный, так и мутировавший фаги. Количество мутантных фаговых частиц, содержащихся в популяции фагов, происходящих из этой отдельной бактериальной клетки, очевидно, определяется характером размножения фагов, поскольку новые гены могут быть сформированы только путем репликации уже существующих. Если вероятность мутации одинакова для каждой репликации, то число мутантов зависит от механизма репликации.
Например, если каждая новая копия гена формируется независимо от других, то распределение мутантных копий в потомках фагов от разных инфицированных бактерий будет случайным. Если же, наоборот, каждая из полученных копий воспроизводится, то в свою очередь мутантные копии будут разделены на группы или клоны, состоящие из мутантных «сибсов».
Индуцированные хозяином модификации бактериофагов
Помимо мутаций, бактериофаги подвержены негенетическим изменениям, в которых главная роль принадлежит клетке-хозяину. Это явление было названо модификациями, вызванными хозяином. Значение этих модификаций для молекулярной биологии состоит в том, что они показали способность внутриклеточной среды вызывать такие изменения в химической структуре генетического материала, которые могут быть использованы для идентификации клеточных линий, синтезирующих ДНК.
Подобные явления были впервые обнаружены на фаговой ДНК, но они также справедливы и для каждой бактериальной клеточной ДНК. Есть также наблюдения, при которых это явление относится и к эукариотическим клеткам. В особых случаях могут возникнуть более сложные ситуации. Двустороннее ограничение фага двумя хозяевами иногда наблюдается, но оно не обязательно. Фаги, отторгнутые клетками, способны адсорбироваться на них и проникать в их ДНК добавляя часть собственной ДНК. Однако последняя часть быстро разрушается, и репликация не происходит.
Однако последняя часть быстро разрушается, и репликация не происходит.
Деградация ДНК вызывается специфическими эндонуклеазами (рестриктазами или R-нуклеазами), которые могут обнаруживать и расщеплять определенные участки ДНК, если они не были модифицированы под влиянием М-ферментов. После этого ДНК расщепляется экзонуклеазами на отдельные нуклеотиды. Бактериальный штамм может иметь одну или несколько R-нуклеаз и в то же время M-ферменты, которые защищают собственную ДНК клетки. Предложена удобная номенклатура этих ферментов. Согласно ряду данных, области детекции R-нуклеазы не всегда совпадают с областями расщепления ДНК; возможно, что фермент может мигрировать по цепочке до того, как найдет область, где происходит расщепление ДНК. Функциональная роль индуцированных хозяином модификаций неясна.
Они способны защитить этот штамм бактерий от массового уничтожения фагами, растущими на различных бактериях. В более общем плане роль модификаций можно определить как защиту от проникновения неприемлемой чужеродной ДНК в бактериальную клетку и ее последующего «приживления». Бактерия А, которая отвергает фаги, размноженные на штамме В, также отвергает ДНК бактерии В, когда она вводится путем конъюгации или трансдукции.
Бактерия А, которая отвергает фаги, размноженные на штамме В, также отвергает ДНК бактерии В, когда она вводится путем конъюгации или трансдукции.
Как видим, мутирование вирусов проходит достаточно сложный и тернистый путь в приобретении новых вирулентных свойств. Эти свойства могут быть как ослабляющими для развития инфекционного процесса, так и крайне агрессивными в своём новом виде.
Возврат к списку
Поделиться:
Фейк: вирусологию и вирусы придумали Рокфеллеры, чтобы навязать человечеству вакцинацию
aA
Пользователи социальных сетей делятся видео, в котором авторы отрицают само существование вирусов, работы Пастера и Коха называют ненастоящими. Мы тщательно проверили материал и наш вердикт – видео распространяет противоречащую науке информацию и является одним большим фейком и манипуляцией.
Фейк: вирусологию и вирусы придумали Рокфеллеры, чтобы навязать человечеству вакцинацию
© Ekrano nuotr.
Тезисы видео:
1) Вирусы не имеют живой природы, отсюда возникает вопрос – что заставляет живую частицу не только оживать в человеческом организме, но и начинать убивать его? Кроме того, при каких обстоятельствах вирусы мутируют, если они неживые, ведь, как известно, мутировать могут только живые клетки и организмы?
2) История вирусологии: фонд Рокфелерра спонсировал Луи Пастера и Роберта Коха, чтобы те доказали существование вирусов, провели революцию в медицине, навязали человечеству вакцинацию;
3) Пастера и Коха пытался разоблачить исследователь Антуан Бешам (теоретик витализма, противник бактериологической теории), но ему не удалось остановить ни Коха, ни Пастера;
4) Экзосомы выглядят точно так же, как и вирусы, их когда-то ошибочно приняли за вирусы;
5) Любая болезнь – регулярный процесс очищения организма от токсинов и окисления, сопровождающийся мутацией бактерий и активным выбросом экзосом, ошибочно принятых когда-то за вирусы.
Комментарий Delfi.ru:
1) Автор видео, кажется, не очень понимает, что вирусы, находясь отдельно от, например, человеческого организма, являются инертными. Попадая в живой организм, вирусы начинают использовать клеточные механизмы для воспроизведения. В живом организме вирусы воспроизводятся как раз во время такого процесса, могут произойти мутации, некоторые из них могут оказаться для вируса полезными и таким образом дать ему возможность приобрести новые свойства;
Цитируем фрагмент из беседы наши коллег из международного информационного агентства Рейтерс с Линдой Кафлин (Lynda Coughlin), вирусологом (twitter.com/Virusnerdette) и доцентом микробиологии больницы Mount Sinai: “Известно множество примеров вирусов, вызывающих заболевания у людей. Точно так же, как мы можем отследить ДНК, оставленную на месте преступления, ученые могут идентифицировать вирусы, которые являются причиной болезней человека, выделяя их от инфицированных людей, секвенируя их генетический материал для их идентификации, непосредственно визуализируя их (с помощью электронной микроскопии). и косвенная визуализация их воздействия на клетки, а также подтверждение их способности вызывать заболевания путем тестирования изолированных и охарактеризованных вирусов на животных моделях”.
и косвенная визуализация их воздействия на клетки, а также подтверждение их способности вызывать заболевания путем тестирования изолированных и охарактеризованных вирусов на животных моделях”.
Atlaso statula priešais Rockefellerių centrą Niujorke
© Shutterstock
Фрагмент из материала наших коллег из украинского издания voxukraine.org: по приблизительным оценкам ученых, на планете существует около 10 нониллионов видов вирусов (один нониллион — цифра с тридцатью нулями). Большинство этих патогенов способны воспроизводиться и поддерживать жизнедеятельность только за счет клеток других организмов, в том числе, человеческих клеток. Известно о более 200 вирусах, которые способны вызывать заболевания у людей. Ученые идентифицируют вирусы, которые вызывают заболевания, когда изолируют вирус из организма зараженного человека и секвенируют его генетический материал.
Рост числа хронических заболеваний связан с плохим питанием, употреблением табака, отсутствием физической активности, избыточным употреблением алкоголя.
2) Теории о том, что Рокфелллер или Ротшильд стоят за появлением такой науки как вирусология, лично или при помощи своих агентов оказывали влияние на Роберта Коха или Луи Пастера, основоположников вирусологии, с тем, чтобы совершить революцию в медицине и навязать человечеству вакцинацию, относятся к конспирологическим теориям, которые основываются на фактах, не имеющих ничего общего с реальностью. И мы, и наши коллеги из различных международных изданий неоднократно писали о подобных теориях здесь и здесь;
3) Автор несколько раз противоречит сам себе: в начале видео отрицает существование вирусов, во второй половине признает их существование – сообщает о существовании вируса табачной мозаики;
4) Теории витализма не признаются современным научным сообществом. Больше о теориях витализма можно узнать здесь;
5) Экзосомы отличаются от вирусов и спутать с вирусами их довольно-таки сложно.
6) Заявление о том, что болезни являются процессом очищения организмов от токсинов, абсурдно и полностью противоречит действительности и научным знаниям человечества.
- Источники
- Проверка фактов: доказано существование вирусов, вредных для человека;
- Микробиология в цифрах;
- Вирусы живые?
- НЕПРАВДА: Вирусы не существуют, а современная медицина – это только контроль над людьми;
- О хронических заболеваниях;
- Фейк: вакцина от коронавируса — орудие для геноцида человечества и контроля над миром;
- Витализм.
Биологи выяснили, что вирусы умеют «говорить» друг с другом
https://ria.ru/20170119/1486063367.html
Биологи выяснили, что вирусы умеют «говорить» друг с другом
Биологи выяснили, что вирусы умеют «говорить» друг с другом — РИА Новости, 19.01.2017
Биологи выяснили, что вирусы умеют «говорить» друг с другом
Биологи нашли свидетельства того, что вирусы обладают некой формой коллективного разума и умеют распознавать «метки», которые оставляют в клетках их конкуренты… РИА Новости, 19.01.2017
2017-01-19T17:31
2017-01-19T17:31
2017-01-19T18:05
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/sharing/article/1486063367.jpg?14813981181484838307
img.ria.ru/images/sharing/article/1486063367.jpg?14813981181484838307
израиль
сша
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2017
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, израиль, сша
Открытия — РИА Наука, Наука, Израиль, США
МОСКВА, 19 янв – РИА Новости. Биологи нашли свидетельства того, что вирусы обладают некой формой коллективного разума и умеют распознавать «метки», которые оставляют в клетках их конкуренты и родичи, и руководствоваться ими при принятии решений, говорится в статье, опубликованной в журнале Nature.
«Эти бктериофаги (вирусы, поражающие бактерий), содержат в себе две программы поведения. Одна заставляет клетку производить огромное количество своих копий и запускает в ней программу самоуничтожения, а при включении второй он интегрируется в ее ДНК и уходит в «глубокое подполье» с возможностью возрождения в будущем», — объясняет Нонья Париенте (Nonia Pariente), молекулярный биолог и редактор журнала Nature Microbiology.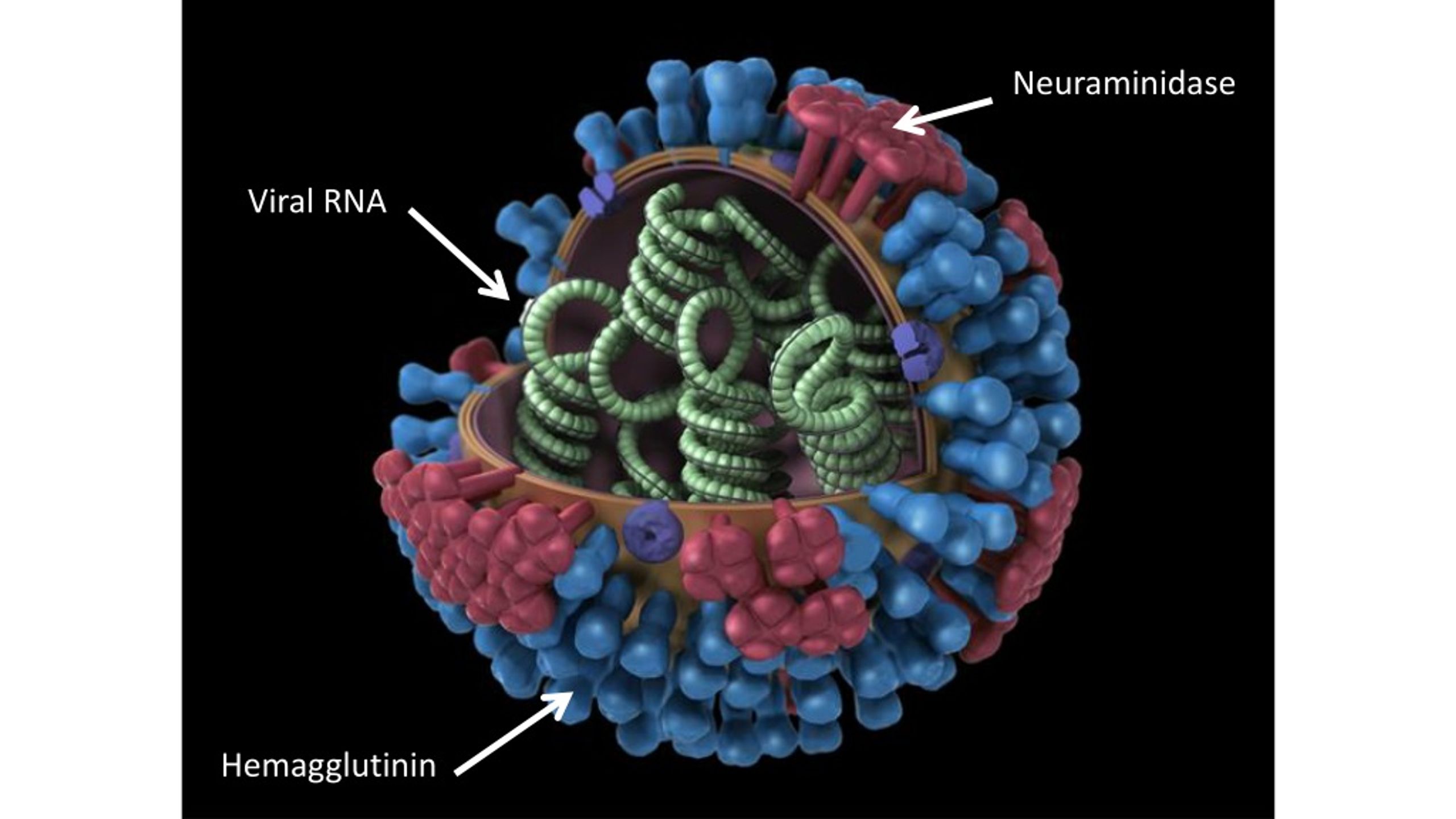
Солдаты вечной войны
Болезни и инфекции не являются чем-то, чем страдает только человек и другие многоклеточные существа – между бактериями и вирусами уже несколько сотен миллионов лет идет беспрерывная война на выживание. Следы этой войны можно встретить повсеместно – в каждом миллилитре морской воды содержится до миллиарда «боевых вирусов»-бактериофагов, и примерно 70% морских микроорганизмов заражены ими.
За миллиарды лет эволюции вирусы научились обходить внимание защитных систем микробов, а последние – разработали своеобразный генетический «антивирус», систему CRISPR-Cas9, которая находит следы вирусной ДНК в геноме микроба и заставляет его совершить суицид для защиты соседних бактерий. Вирусы ответили на эти меры «эволюционной обороны», создав анти-антивирус, подавляющий CRISPR-Cas9, и биологическая гонка вооружений продолжилась.
11 октября 2016, 18:31
Ученые нашли общую ДНК у вирусов-«киллеров» и черной вдовыГенетики неожиданно обнаружили общие черты между вирусами-бактериофагами, убивающими микробами, и пауками-черными вдовами, что указывает на необычные отношения между вирусами-«киллерами», их «коллегами»-пауками и паразитами беспозвоночных.
Ротем Сорек (Rotem Sorek) из Института науки Вейцманна в Реховоте (Израиль) и его коллеги нашли еще один крайне интересный пример «оружия», изобретенного вирусами, изучая то, как работает бактериофаг phi3T, заражающий обычных бацилл (Bacillus subtilis).
Изначально ученые пытались понять совсем другую вещь – то, как микробы оповещают друг друга о присутствии вируса и готовятся к отражению его атаки. Как считали ученые, зараженные бактерии выделяют в окружающую среду специальные сигнальные молекулы, которые сигнализируют другим микробам в их колонии об опасности.
Для проверки этой Сорек и его коллеги вырастили колонию бацилл, заразили их phi3T, после чего отфильтровали жидкость, которую выделяли микробы во время заражения колонии. Часть этого раствора биологи добавили в новую колонию бактерий, предполагая, что те сигнальные молекулы, которые их погибшие товарки выделяли в питательную среду, подготовят их к новой атаке вирусов и защитят от заражения. Реальность оказалась совершенно иной.
Тайные сигналы
Выяснилось, что короткие белковые молекулы arbitrium, которые биологи выделили из этого раствора, на самом деле были предназначены для общения вирусов друг с другом, а не бактерий, и их «авторами» были не микробы, а их непрошенные гости.
29 декабря 2016, 20:00
Биологи научились отключать «промышленный» редактор ДНКГенетики приспособили недавно открытую «защиту от редактирования ДНК» для отключения перспективного геномного редактора CRISPR/Cas9, что в перспективе сделает его более безопасным для человека.
Эти молекулы, как показали эксперименты израильских генетиков, заставляют вирус «переключиться» с одной программы размножения на другую. В присутствии arbitrium вирусы «уходят в подполье», встраиваясь в ДНК бактерий вместо того, чтобы бурно размножаться в них и уничтожать клетки.
Переключение программы происходит по той причине, что arbitrium блокирует работу вирусного белка AimR, отвечающего за запуск процедуры размножения вирусной ДНК и растворения стенок бактерии.
Зачем это нужно вирусам? Подобная система сигналов, как объясняют ученые, работает как своеобразная форма коллективного разума вирусов, который позволяет им гибко координировать свое поведение. Когда вирусов мало, им выгоднее активно размножаться, заражая новых бактерий и убивая их, однако со временем их становится слишком много и бактерии начинают коллективно реагировать на заражение, или же число бацилл падает до крайне низких значений.
В этот момент вирусы переключаются на альтернативную программу заражения, используя сигналы, подобные arbitrium, и «скрываются в толпе», выжидая новый удобный момент для заражения. По словам Сорека, его команда обнаружила более сотни других молекул, похожих на arbitrium и AimR, в других вирусах-бактериофагах, что говорит о том, что многие или даже все вирусы умеют «общаться» с себе подобными.
13 октября 2016, 21:36
Ученые «навсегда» подавили вирус иммунодефицита в организме обезьяныЛекарство от язв толстой кишки навсегда подавило развитие вируса обезьяньего иммунодефицита, близкого родича ВИЧ, сделав инфекцию относительно «беззубой» и позволив иммунной системе восстановить себя.
Возможно, что аналогичные системы существуют и в вирусах, заражающих человека, и их наличие могло бы объяснить, как ВИЧ и ряд других ретровирусов прячутся в клетках при попытке их изгнать из организма. Если ученым удастся найти молекулу, которая заставит ВИЧ навечно «окопаться» в клетке и не выходить оттуда, то проблема борьбы с ним будет решена.
Вирусологии, как hауке, 120 лет Текст научной статьи по специальности «История и археология»
ИСТОРИЯ БИОМЕДИЦИНЫ
ВИРУСОЛОГИИ, КАК НАУКЕ, 120 ЛЕТ
М.К.Мамедов
Hациональный центр онкологии, г. Баку
Днем рождения учения о вирусах, ставшего в дальнейшем основой одной из динамично развивающихся не только медицинских, но и фундаментальных биологических наук — вирусологии, принято считать 12 февраля 1892 г, когда в г.Петербурге на заседании Российской Академии Наук в докладе молодого ботаника Дмитрия Иосифовича Ивановского были представлены данные об открытии принципиально нового типа живых существ, впоследствие получивших название «вирусов».
Надо отметить, что Д.И.Ивановский описал первый вирус растений — вирус табачной мозаики. Вскоре, в 1897-1898 гг был открыт и первый вирус животных — им оказался вирус ящура, идентифицированный немецкими бактериалога-ми Фридрихом Леффлером и Паулем Фрошем. И, наконец, в 1913 г был открыт первый вирус бактерий — его идентифицировал английский военный врач Уильям Туорт. В 1917 г работавший в Институте Пастера в Париже Феликс д’Эррель назвал его «бактериофагом».
И хотя вирусы бактерий были открыты последними, простота получения бактерифагов и наблюдения за их размножением обеспечили то, что исследования фагов по темпам значительно опередили изучение вирусов животных и человека и внесли неоценимый вклад в понимание биологической природы вирусов, вообще. Изучение фагов открыло ряд фундаментальных закономерностей, позволивших понять механизмы репродукции вирусов вообще и уяснить как этот процесс оказывает воздействие на организм.
Теоретическое значение исследований по фагам имело исключительную ценность и для других областей биологии и медицины. Надо отметить, что концепция об интеграции профага в клеточный геном оказалась чрезвычайно плодотворной при трактовке молекулярных механизмов вирусного канцерогенеза и подтверждении основных положений вирусно-генетической кон-
Надо отметить, что концепция об интеграции профага в клеточный геном оказалась чрезвычайно плодотворной при трактовке молекулярных механизмов вирусного канцерогенеза и подтверждении основных положений вирусно-генетической кон-
цепции злокачественных опухолей.
Кроме того, сегодня можно уверенно говорить о том, что проведенные за период 30-50 гг ХХ в исследования фагов привели к двум важнейшим последствиям для биологии.
Во-первых, в процессе изучения фагов был сформирован тот идеологический массив и методический арсенал, который лег в основу формирования вирусологии, как биологической науки и
Во-вторых, научные данные, полученные при изучении фагов уже в 40-е гг ХХ в стали основой новой науки — молекулярной биологии, на базисе которой сформировалось прикладное современное направление биологии и биотехнологии — генная инженерия.
Необходимо отметить и то, что технология получения вирусов растений и, в первую очередь, открытого еще Д.И.Ивановским вируса табачной мозайки (ВТМ), также была довольно простой. Благодаря этому на протяжении 30-40-х гг ХХ в были получены ценные данные о химическом составе и строении частиц ВТМ.
Благодаря этому на протяжении 30-40-х гг ХХ в были получены ценные данные о химическом составе и строении частиц ВТМ.
В 1935 г американский биохимик У.Стенли получил препарат чистого ВТМ, имеющего вид мелких игольчатых кристаллов. Последние, будучи вновь растворены, оказались способными вызывать типичную мозаичную болезнь табака.
В целом получение вирусов в кристаллическом состоянии открыло новые возможности для химического анализа вирусов и имело неоценимое значение для дальнейшего развития вирусологии, и, в частности, биохимии вирусов.
В 1937 г английские биохимик Ф.Боуден и вирусолог Н.Пири установили, что ВТМ лишь на 94% состоит из рибонуклеиновой кислоты (РНК). Вскоре было доказано, что все вирусы содержат как белки, так и нуклеиновые кислоты.
В 1956 г вирусологи Альфред Гирер и Герхард Шрамм из Германии доказали, что у ВТМ носителем генетической информации явля-
ется РHК. В 1957 г Хейнц Френкель-Конрат из США химически (с помощью фенола) расщепил ВТМ на белок и РНК и показал, что последующее смешивание этих компонентов приводило к образованию вирулентного вируса. Этот феномен был назван «реконструкцией» (позднее была воспpоизведена перекрестная реконструкция компонентов разных вирусов pастений).
Этот феномен был назван «реконструкцией» (позднее была воспpоизведена перекрестная реконструкция компонентов разных вирусов pастений).
Еще в 1956 г Ф.Крик и Дж.Уотсон пришли к выводу, что генетическая информация, заключенная в РНК ВТМ недостаточна для кодирования белка, входящего в состав оболочки этого вируса, и обладающего молекулярным весом около 38 мегадальтон. Поэтому ученые предположили, что белок оболочки частиц ВТМ не является одной непрерывной полипептидной цепью, а представлен несколькими абсолютно одинаковыми по первичной структуре полипептидами, которые синтезируются на одной и той же матрице РНК.
В 1958 г англичане Р.Фрэнклин и К.Холмс подтвеpдили это пpедположение — с помощью рентгеноструктурного анализа они показали, что частицы ВТМ по конфигуpации пpедставляют собой полые цилиндрические образования, стенки котоpых постpоены более, чем из 2 тысяч абсолютно одинаковых белковых субъединиц. В 1960 г амеpиканцы Р.Маркхэм и К.Смит пришли к аналогичному выводу, но при этом показали, что некоторые растительные вирусы имеют сфеpическую форму, но также построены из упоpядоченно pасположенных белковых субъединиц. Таким образом была установлена периодичность структуры вирусных белков, характерная для кристаллоподобных образований, обpазуемых вкусами pастений.
Таким образом была установлена периодичность структуры вирусных белков, характерная для кристаллоподобных образований, обpазуемых вкусами pастений.
В заключение отметим, что в 1967 г амеpиканский фитовиpусолог Теодоp Дайнеp об-наpужил группу особых вкусных агентов, являющихся возбудителями нескольких своеобразных болезней pастений. Поскольку они, как и вирусы, имели малые pазмеpы, но пpедставляли собой лишенные белковой оболочки молекулы нуклеиновых кислот, способные к pепpодукции и больше напоминали плазмиды бактеpий, в 1971 г Дайнеp пpедложил назвать их «вироидами».
Изучение виpусов животных и человека заметно «отставало» от исследований фагов и вкусов pастений, в основном, из-за отсутствия возможности получения их в количествах, достаточных для их детального изучения — выделение и культивирование этих вирусов осуществлялось почти исключительно путем заражения доступных восприимчивых животных или, даже, лю-
дей-добpовольцев, а выделение их из крови и оpганов инфицированных животных всегда было сопряжено со значительными техническими тpудностями.
И хотя в 1925 г была доказана принципиальная возможность использования этого подхода для воспроизведения процесса pазмножения вкусов, вплоть до конца 40-х гг ХХ в технология культивации клеточных систем в искусственных питательных сpедах оставалась весьма тpудоемкой, методически несовеpшенной, а сама пpоцедуpа длительного сохpанения тканей и клеток in vitro плохо поддавалась стандаpтизации — в итоге pезультаты их инфицирования виpусами отличались низкой воспpоизводимостью.
Ситуация изменилась в лучшую стоpону лишь в 1931 г, когда американские вирусологи Эрнст Гудпасчур и Элис Вудроф показали возможность pазмножения вируса оспы внутpи куpиных яиц и пpедложили использовать метод культивиpования вирусов на куриных эмбрионах. Широкое распространение этот метод получил после его модификации, предложенной в 1933 г Ф.Бэрнетом и УБевеpиджем, позволявшей накапливать некотоpые вирусы в больших количествах. Этот метод сыграл немалую роль для прогресса в области изучения вкусных инфекций человека и животных. К пpимеpу, с его помощью Макс Тейлеp, ученый из ЮАР pазpаботал пеpвую эффективную вакцину против желтой ли-хоpадки.
К пpимеpу, с его помощью Макс Тейлеp, ученый из ЮАР pазpаботал пеpвую эффективную вакцину против желтой ли-хоpадки.
Вместе с тем, необходимо подчеpкнуть, что интенсивное исследование вкусов животных и человека началось лишь в конце 40-х гг ХХ в, после того как в 1949 г, когда амеpиканские вирусологи Дж. Эндерс, Ф.Роббинс и Т.Уэллер разработали удобный метод выращивания шиpокого спектра вирусов в среде содержащей аминокислоты, витамины и азотистые основания в культуре клеток, организованной в виде одного сплошного слоя на стекле.
Метод отличался целым рядом ценных преимуществ перед методом куриных эмбрионов и, позволяя получать большие количества вируса, был взят на вооружение вирусологами всего мира. Благодаря ему была создана первая вакцина против полиомиелита (вакцина Дж.Солка).
В 1952 г метод усовершенствовали американцы Р.Дульбекко и Мартин Фогт, которые разработали методику покрытия монослоя инфицированных вирусом клеток прозрачным агаром, что позволяло фиксировать появляющиеся (из-за размножения вируса) в монослое клеток очаги деструкции в виде «просветленных» участков.
Использование этого метода упростило титрование вирусов (расчет количества инфекционных вирусных частиц) и методически приблизило ее к известному методу титрования бактериофагов на «газоне» выросших на поверхности агара бактерий по методу, разработанному Андре Грация еще в 1936 г. И, наконец, он обеспечил возможность количественно оценивать противовирусное действие тех или иных факторов и создал предпосылки для развития противовирусной терапии.
Помимо появления почти универсальной методики культивирования вирусов in vitro, важной особенностью развития вирусологии на протяжении 50-хх гг минувшего столетия являлось широкое внедрение в вирусологию, с одной стороны, таких методов как радиометрия и авторадиография, электрофорез, гель-фильтрация и др., а с другой стороны, идеологии и новой методологии, «родившейся» в процессе интенсивного развития генетики бактерий и фагов, а также молекулярной теории наследственности.
В то же время, получение кристаллической формы вирусов человека потребовало немало усилий — это впервые удалось лишь в 1955 г, когда К.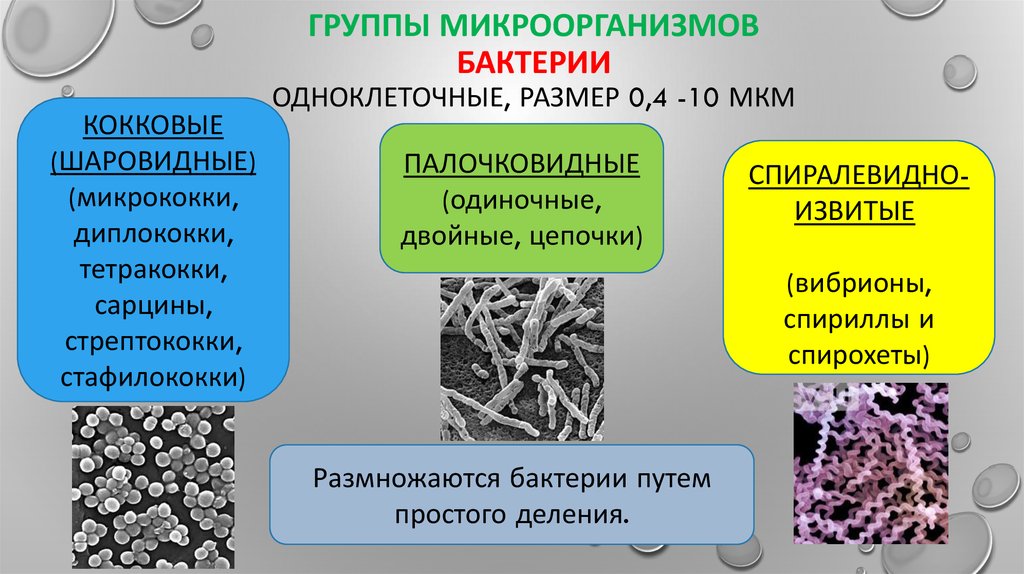 Швердт и Ф.Шеффер в США получили in vitro кристаллы вируса полиомиелита, сохраняющие свою инфекционность.
Швердт и Ф.Шеффер в США получили in vitro кристаллы вируса полиомиелита, сохраняющие свою инфекционность.
Вместе с тем, за 50-60 гг ХХ в впечатляющие успехи были достигнуты в установлении вирусной этиологии десятков инфекционных заболеваний человека и животных и в выделении соответствующих вирусов и их изучении.
Более того, именно в эти годы началось изучение особой группы, как оказалось, инфекционных по характеру распространения, заболеваний центральной нервной системы, которые исландский ученый Бьерн Сигурдсон в 1954 г предложил объединить под названием «медленных инфекций» животных и человека. К середине 60-х гг американец К.Гайдушек (на основе своих, проведенный в Новой Гвинее/Папуе наблюдений за местными жителями, у которых развивалось прогрессирующее заболевание нервной системы, известное под названием «куру», означавшем на местном языке «дрожание») доказал, что они обусловлены вирусоподобными агентами, способными передаваться из одного организма в другой, но имеющими существенные отличия от всех известных тогда вирусов — вот почему Гай-душек назвал их «некононическими вирусами».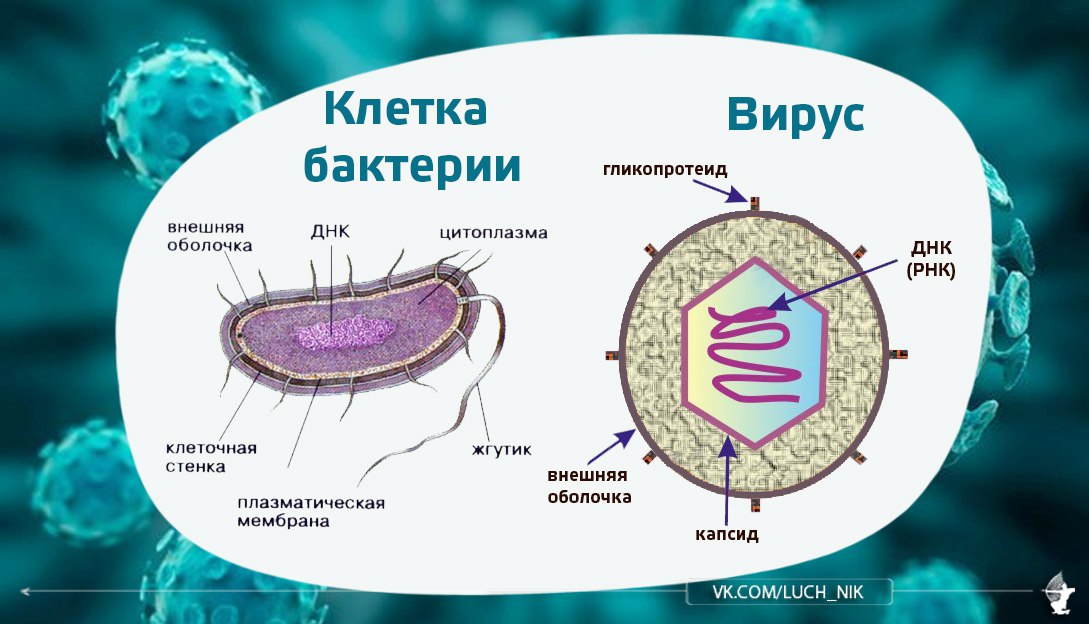
В 1963 г американский ученый Б.Бламберг идентифицировал антиген вируса гепатита В, что вскоре позволило открыть этот вирус и стало на-
чалом череды открытий вирусов других гепатитов.
60-е гг ХХ в ознаменовались началом широкого внедрения в вирусологию ряда новых аналитических методов, использованных в биохимии и иммунологии. Но особое значение для развития вирусологии в тот период имело развитие молекулярно-гибридизационных технологий, позволявших с помощью «меченной» молекулы известной ДНК (или РНК) идентифицировать наличие в тестируемых пробах и даже клетках полностью или частично гомологичных (совпадающих по первичной структуре) макромолекул.
В 1961 г Р.Дульбекко и Джордж Уэстфаль впервые в вирусологии использовали метод гибридизации ДНК, основанный на введении в клетку «меченной» радиоактивным изотопом РНК, искусственно полученной с ДНК искомого вируса и являющейся «зеркальной копией» этой ДНК. Оценивая степень связывания клеточной ДНК с РНК-копией вирусной ДНК, можно было судить о степени комплементарности (т. е., гомологии) нуклеотидных последовательностей в этих молекулах.
е., гомологии) нуклеотидных последовательностей в этих молекулах.
Этот же период ознаменовался началом направленного поиска противовирусных лекарственных препаратов и создания новых вакцин против вирусных инфекций. И, наконец, в этот период началась подготовка к созданию Международной классификации вирусов.
Важно также отметить, что период 50-60 гг ХХ в ознаменовался быстрым развитием одного из важнейших направлений вирусологии — изучением онкогенных вирусов животных, основы которого были заложены американским вирусологом Ф.Раусом еще в 1910 г.
70-е гг ХХ в ознаменовались открытием, имеющих исключительно важное значение для науки — в 1970 г два ученых, независимо друг от друга, впервые обнаружили фермент РНК-зави-симую-ДНК-полимеразу — ими оказались американец Г.Темин из университета Висконсина и англичанин Д.Балтимор из Кембриджского университета. Существование этого фермента, названного «обратной транскриптазой», поколебало «центральную догму молекулярной биологии», но объяснило механизмы не только онко-генного действия РНК-содержащих вирусов, но и их длительного латентного пребывания в клетке.
Важным успехом вирусологии этого периода стала впервые реализованная в 1972 г П.Бергом и его коллегами из Стенфордского университета технология получения рекомбинантной молекулы ДНК — используя ДНК фага лямбда (в качест-
ве «вектора», направленно переносящего клеточные гены и встраивающего их в ДНК бактериальной клетки-реципиента), ученые внедрили фрагменты ДНК вируса SV40 в геном кишечной палочки. Это исследование заложило основы метода клонирования генов в бактериях, а затем и в грибах.
За этот же период, благодаря применению радиоиммунологического метода и иммуноэ-лектроннной микроскопии был открыт ряд новых вирусов: ротавирусного гастроэнтерита, гепатита А, гепатита D (дельта) и некоторые другие.
В 80-х гг в вирусологических исследованиях начали использоваться иммуноферментный метод, иммуноблотинг и, главное, методы молекулярной амплификации ДНК и РНК, пришедшие на смену широко использовавшихся в 70-е гг методов их гибридизации.
Идеологические принципы этих методов были заложены Кери Мюллисом, американским биохимиком, который в 1983 г воспроизвел in vitro феномен амплифицированного ферментативного синтеза на матрице одной из цепей ДНК ее второй цепи de novo. Этот феномен лег в основу «полимеразной цепной реакции» (ПЦР), принципиально изменившей принципы идентификации вирусов.
Этот феномен лег в основу «полимеразной цепной реакции» (ПЦР), принципиально изменившей принципы идентификации вирусов.
Заметным событием того периода стало то, что менее, чем за 3 года была установлена вирусная этиология синдрома приобретенного иммунодефицита (СПИД), впервые обнаруженного в 1981 г — уже в 1983 г во Франции, а в 1984 г — в США был выявлен вирус, признанный возбудителем СПИД и названный «вирусом иммунодефицита человека».
В середине 80-х гг начатое Гайдушеком исследование неканонических вирусов — возбудителей медленных инфекций завершилось. Американский исследователь С.Празинер доказал, что их сходство с вирусами ограничивается лишь малыми размерами — в остальном они имеют кардинальные отличия от вирусов. Оказалось, что это особая группа не связанных с нуклеиновыми кислотами низкомолекулярных эндогенных белков с неясной функцией. Ученый предложил назвать их «прионами» — термином, образованным из фрагментов полного названия этих агентов «PRoteinaceous InfectiON».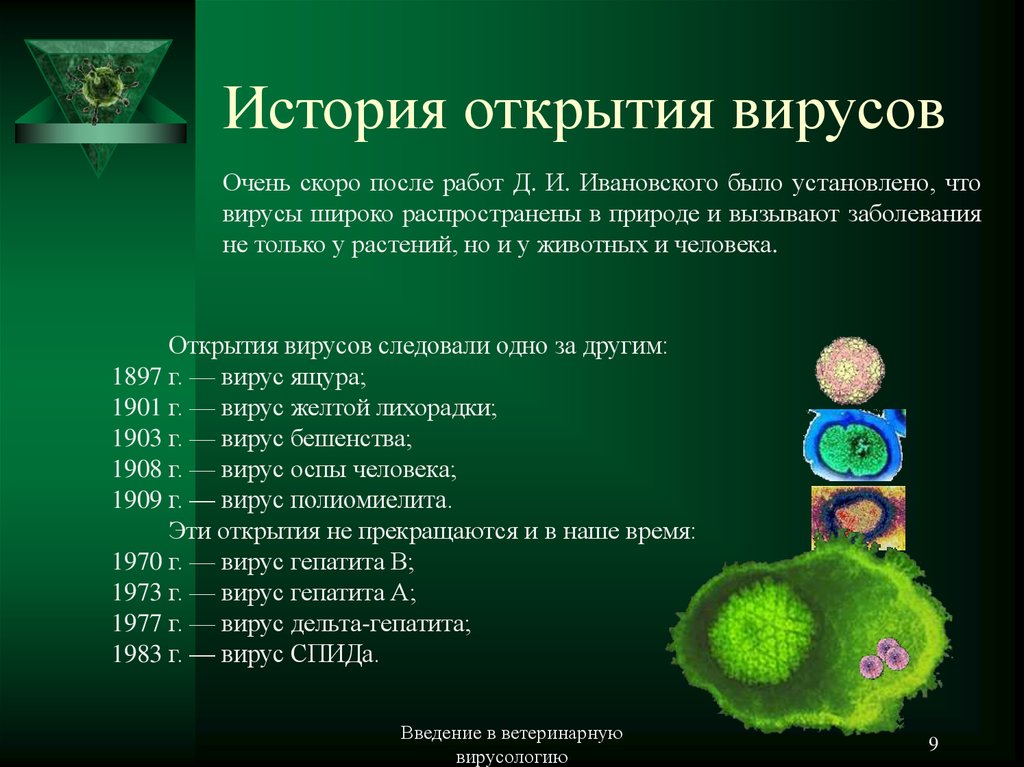
В этот период метод клонирования генов позволил решить ряд задач биотехнологии (на его основе уже в 1986 г было налажено производство интерферона человека) и диагностики (в 1989 г методом клонирования генов в бактериях
были экспрессированы белки вируса, позволившие серологически идентифицировать вирус, получивший название вируса гепатита С).
В последнем десятилетии минувшего века вирусология вступила в современный этап и развивалась на основе применения современных мо-лекулярно-генетических методов. Была доказана возможность использования аденовирусов и ретровирусов в качестве векторов, переносящих клеточные гены. Это позволило наметить пути к разработке молекулярно-генетических вакцин и методов «генной» терапии, причем как вирусных и иных инфекционных, так и онкологических заболеваний человека и животных.
В заключение, надо отметить, что открытия сделанные в вирусологии получили высокую оценку мирового научного сообщества. Для подтверждения этого положения ниже мы в форме таблицы приводим перечень всех Нобелевских премий (как по физиологии и медицине, так и по химии), присужденных ученым, внесшим наиболее весомый вклад в развитие вирусологии.
Надо особо отметить, что первоначально развитие вирусологии на протяжении более полувека было подчинено лишь стремлению ученых раскрыть этиологию тех инфекционных заболеваний растений, животных и человека, возбудителей которых было невозможно найти среди бактерий, грибов и простейших.
Иначе говоря, период своего становления вирусология начала как часть бактериологии, а позднее как прикладная медицинская, ветеринарная или сельскохозяйственная наука, занятая исследованием только вирусов, патогенных для человека, животных и растений. Эти роли вирусология частично сохранила и сегодня.
В процессе решения прикладных задач все отчетливее становилась необходимость для более глубокого изучения вирусов использования физических и химических методов, отсутствовавших в арсенале классической бактериологии. По мере внедрения этих методов в вирусологические исследования и получения с их помощью новой информации о природе вирусов постепенно формировалась своя, отличная от бактериологической, научная идеология, которая в свою очередь, «подпитывая» все новые изыскания, самосовершенствовалась, углублялась и расширялась, все более отдаляясь от бактериологии.
Это отдаление ускорилось в период после 2-й мировой войны и было связано с двумя важнейшими научными достижениями — внедрением в исследования электронной микроскопии и мето-
Таблица. Иоблевские пpемии, пpисужденные за исследования, связанные с виpусами и
виpусными болезнями
в 1946 г — Уиндэлу Стенли за получение белковых вирусов в чистом кристаллическом виде; в 1951 г — Максу Тейлеру за создание вакцины против желтой лихорадки;
в 1954 г — Джону Эндерсу, Фредерику Роббинсу и Томасу Уэллеру за разработку метода культивации вируса полиомиелита в культурах тканей;
в 1958 г — Джошуа Ледербергу за открытия, касающиеся генетической рекомбинации у бактерий и структуры их генетического аппарата;
в 1966 г — Френсису Роусу за открытие опухолеродных вирусов;
в 1969 г — Максу Дельбрюку, Альфреду Херши и Сальвадору Лурия за открытие цикла репродукции вирусов и развитие генетики бактерий и вирусов;
в 1975 г — Ренато Дульбекко за исследование механизма действия онкогенных вирусов и Говарду Темину и Дэвиду Балтимору за открытие обратной транскриптазы;
в 1976 г — Барри Бламбергу и Карлтону Гайдушеку за открытие новых механизмов возникновения инфекционных заболеваний;
в 1980 г. — Полу Бергу за фундаментальные исследования в области биохимии нуклеиновых кислот, в частности рекомбинантной ДНК;
— Полу Бергу за фундаментальные исследования в области биохимии нуклеиновых кислот, в частности рекомбинантной ДНК;
в 1982 г. — Аарону Клагу за работы в области электронной микроскопии и открытие структур биологически важных нуклеопротеиновых комплексов;
в 1988 г — Джемсу Блэку, Гертруде Элион и Джорджу Хичингсу за создание новых противовирусных лекарственных препаратов;
в 1989 г — Майклу Бишопу и Гарольжу Вармусу за открытие клеточного происхождения ретровирусных онкогенов;
в 1997 г — Стенли Празинеру за открытие прионов — инфекционных агентов нового типа; в 2008 г — Харальду зур Хаузену за открытие связи вируса папилломы человека с раком шейки матки, а также Франсуазе Барре-Синуасси и Люку Монтанье за открытие вируса иммунодефицита человека, вызывающего СПИД._
дов культивирования вирусов в клеточных системах in vitro. К этому времени, в основном, завершилось четкое отделение вирусологии от бактериологии, а сам термин «вирусология» получил широкое распространение.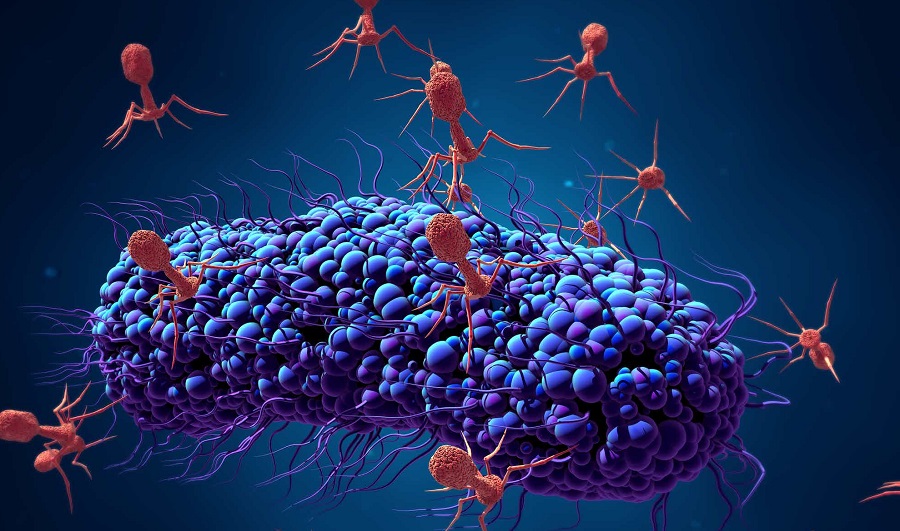
Но обретение вирусологией статуса вполне самостоятельной биологической науки стало возможным лишь во второй половине 50-х гг ХХ в после революционных открытий в биологии и генетике и, главное, после того, как было установлено, что любой вирус может содержать лишь одну из нуклеиновых кислот — или ДНК, или РНК. Именно это открытие позволило постулировать одно из кардинальных отличий вирусов от любых других живых существ и, соответственно, выделить вирусологию в качестве самостоятельной биологической науки.
Уже начиная со второй половины 50-х гг прошлого века, т.е. полвека назад, методология вирусологических исследований стала стремительно приближаться к методологии биохимии и молекулярной генетики, а научная идеология вирусологии стала развиваться в неразрывной связи с идеологией молекулярной биологии. Сли-
яние этих идеологий нашло выражение в широком внедрении методов генной инженерии в методологию изучения вирусов.
Сегодня вирусология, оставаясь «молодой» наукой, является не только одной из наиболее интенсивно развивающихся областей биологии, но и одним из ее флагманских направлений, поскольку, помимо решения важных утилитарных задач, находящихся в центре внимания медицинской и ветеринарной вирусологии, всестороннее изучение вирусов открывает широкие возможности для решения целого ряда фундаментальных биологических проблем и решения насущных практических задач.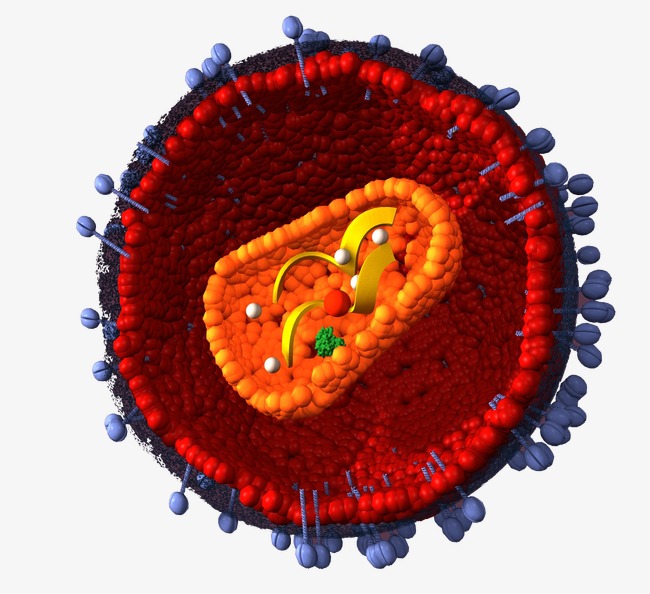
Среди них, в первую очередь, следует назвать теоретические проблемы самовоспроизведения «живых структур», происхождения и эволюции жизни на Земле и имеющие важное практическое значение проблемы выяснения молекулярных и субмолекулярных механизмов развития морфофункциональных нарушений жизнедеятельности клеток, возникновения и развития злокачественных опухолей и даже совершенствования важных биотехнологических процессов.
ЛИТЕРАТУРА
1. Мамедов М.К. Вирусы: эволюция представлений и развитие вирусологии. Баку: Билик, 2001, 144 с.;
2. Мамедов М.К. Вирусы бактерий: на переднем крае науки и биотехнологии. // Биомедицина, 2007, N.4, с.50-53;
3. Мамедов М.К. Нобелевской премии — 110 лет. // Биомедици-на,2011, N.4, c.42-47;
4. Мамедов М.К., Кадырова А.А. Культивируемые клеточные системы — столетие на службе науки. // Биомедицина, 2007, N.4, с.46-49;
5. Мамедов М.К., Кадырова А.А., Дадашева А.Э. Вирус иммунодефицита человека и вызываемая им инфекция. Н.Новгород: Изд-во НГМА, 2009, 278 с. ;
;
6. Мамедов М.К., Михайлов М.И. От вируса гепатита С до TTV и далее. // Вирусные гепатиты (Москва), 2005, N.2, с. 1115;
7. Михайлов М.И., Мамедов М.К. Эволюция взглядов на этиологию гепатита: от дискразической теории к вирусной. // Вирусные гепатиты (Москва), 2004, N.1, с.3-7.
ХРОНИКА
О ПРИСУЖДЕHИИ ШБЕЛЕВСКОЙ ПРЕМИИ ЗА 2012 г.
В 2012 г Нобелевская премия по физиологии и медицине была присуждена «за открытие возможности перепрограммирования дифференцированных клеток в плюрипотентные» Джон Гёрдон (John Bertrand Gurdon), pаботающему в кембриджском Гёрдоновском институте (Gurdon Institute) и Синъя Яманака (Shinya Yamanaka), сотруднику Института сердечно-сосудистых заболеваний Глэдстона в Сан-Франциско (Gladstone Institute of Cardiovascular Disease in San Francisco) и профессору Университета Киото (Kyoto University).
ISSN 1815-3917
Сдано в набор 25.12.2012. Подписано к печати 18.12.2012. Распространяется бесплатно. Тираж 500.
Читать о бактериях и вирусах
ЧТО ТАКОЕ БАКТЕРИИ И ВИРУСЫ?
Бактерии — это одноклеточные живые существа, встречающиеся почти повсюду на Земле. Вирусы представляют собой белковую оболочку с ДНК внутри, и для размножения им нужна клетка-хозяин. Иммунная система человека способна убивать большинство бактерий и вирусов до того, как они заразят нас.
Вирусы представляют собой белковую оболочку с ДНК внутри, и для размножения им нужна клетка-хозяин. Иммунная система человека способна убивать большинство бактерий и вирусов до того, как они заразят нас.
Чтобы лучше понять бактерии и вирусы…
ЧТО ТАКОЕ БАКТЕРИИ И ВИРУСЫ?.
Бактерии — это одноклеточные живые существа, встречающиеся почти повсюду на Земле. Вирусы представляют собой белковую оболочку с ДНК внутри, и для размножения им нужна клетка-хозяин. Иммунная система человека способна убивать большинство бактерий и вирусов до того, как они заразят нас.
Чтобы лучше понять бактерии и вирусы…
ДАВАЙТЕ РАЗЪЯСНИМ!
Бактерии — живые существа, состоящие из одной клетки.
Бактерии представляют собой одноклеточные (одноклеточные) организмы, которые размножаются путем копирования своей ДНК и деления ее пополам. Бактерии быстро размножаются; миллионы из них могут быть произведены за один день! Бактерии могут быть как полезными, так и вредными. Миллионы бактерий живут на вашей коже и в вашем теле. Некоторые из этих бактерий помогают вам переваривать пищу, а другие живут на поверхности вашей кожи и предотвращают заболевание. Бактерии также могут вызывать серьезные инфекции, такие как сальмонеллез, который возникает при употреблении недоваренной пищи. Поскольку бактерии делятся и размножаются очень быстро, их часто трудно контролировать, и для их лечения могут потребоваться антибиотики. Антибиотики — это лекарства, которые разрушают клеточные стенки бактериальных клеток и убивают их, чтобы они не размножались и не вызывали у вас болезни.
Миллионы бактерий живут на вашей коже и в вашем теле. Некоторые из этих бактерий помогают вам переваривать пищу, а другие живут на поверхности вашей кожи и предотвращают заболевание. Бактерии также могут вызывать серьезные инфекции, такие как сальмонеллез, который возникает при употреблении недоваренной пищи. Поскольку бактерии делятся и размножаются очень быстро, их часто трудно контролировать, и для их лечения могут потребоваться антибиотики. Антибиотики — это лекарства, которые разрушают клеточные стенки бактериальных клеток и убивают их, чтобы они не размножались и не вызывали у вас болезни.
Бактерии — живые существа, состоящие из одной клетки. Бактерии — это одноклеточные (одноклеточные) организмы, которые размножаются путем копирования своей ДНК и деления ее пополам. Бактерии быстро размножаются; миллионы из них могут быть произведены за один день! Бактерии могут быть как полезными, так и вредными. Миллионы бактерий живут на вашей коже и в вашем теле. Некоторые из этих бактерий помогают вам переваривать пищу, а другие живут на поверхности вашей кожи и предотвращают заболевание. Бактерии также могут вызывать серьезные инфекции, такие как сальмонеллез, который возникает при употреблении недоваренной пищи. Поскольку бактерии делятся и размножаются очень быстро, их часто трудно контролировать, и для их лечения могут потребоваться антибиотики. Антибиотики — это лекарства, которые разрушают клеточные стенки бактериальных клеток и убивают их, чтобы они не размножались и не вызывали у вас болезни.
Бактерии также могут вызывать серьезные инфекции, такие как сальмонеллез, который возникает при употреблении недоваренной пищи. Поскольку бактерии делятся и размножаются очень быстро, их часто трудно контролировать, и для их лечения могут потребоваться антибиотики. Антибиотики — это лекарства, которые разрушают клеточные стенки бактериальных клеток и убивают их, чтобы они не размножались и не вызывали у вас болезни.
Вирусы неживые и не могут воспроизводиться сами по себе.
Вирусы не являются живыми клетками, поэтому они не могут делиться самостоятельно. Им нужна клетка-хозяин для размножения. Вирус прикрепляется к поверхности клетки, вводит свою ДНК в клетку, захватывает клетку, чтобы сделать больше копий вируса, и взрывает клетку, убивая ее и высвобождая вирус, чтобы заразить другие клетки. В отличие от бактерий, большинство вирусов вредны и атакуют определенные типы клеток. Например, COVID-19поражает клетки дыхательной системы человека. Существует вирус, называемый вирусом табачной мозаики, который поражает клетки табачного растения. Вирусы обычно специфичны для типов клеток, которые они заражают, потому что они имеют определенную форму, которая позволяет им прикрепляться к определенным типам клеток.
Вирусы обычно специфичны для типов клеток, которые они заражают, потому что они имеют определенную форму, которая позволяет им прикрепляться к определенным типам клеток.
Вирусы неживые и не могут воспроизводиться сами по себе. Вирусы не являются живыми клетками, поэтому они не могут делиться самостоятельно. Им нужна клетка-хозяин для размножения. Вирус прикрепляется к поверхности клетки, вводит свою ДНК в клетку, захватывает клетку, чтобы сделать больше копий вируса, и взрывает клетку, убивая ее и высвобождая вирус, чтобы заразить другие клетки. В отличие от бактерий, большинство вирусов вредны и атакуют определенные типы клеток. Например, COVID-19поражает клетки дыхательной системы человека. Существует вирус, называемый вирусом табачной мозаики, который поражает клетки табачного растения. Вирусы обычно специфичны для типов клеток, которые они заражают, потому что они имеют определенную форму, которая позволяет им прикрепляться к определенным типам клеток.
Наша иммунная система способна уничтожать большинство вирусов и бактерий.
Иммунная система человека состоит из особых клеток, называемых лейкоцитами, которые борются с большинством бактерий и вирусов. Вакцины — это лекарства, которые врачи дают вам, чтобы помочь подготовить иммунную систему к борьбе с инфекцией еще до того, как ваше тело вступит с ней в контакт! Вакцины активируют иммунную систему для выявления вирусов и бактерий, которые могут быть опасными. Эти клетки не только готовятся к борьбе с захватчиками, но и запоминают размер и форму захватчиков, если им случится снова вступить с ними в контакт. Вот почему вы редко болеете одним и тем же вирусом более одного раза.
Наша иммунная система способна уничтожать большинство вирусов и бактерий. Иммунная система человека состоит из особых клеток, называемых лейкоцитами, которые борются с большинством бактерий и вирусов. Вакцины — это лекарства, которые врачи дают вам, чтобы помочь подготовить иммунную систему к борьбе с инфекцией еще до того, как ваше тело вступит с ней в контакт! Вакцины активируют иммунную систему для выявления вирусов и бактерий, которые могут быть опасными. Эти клетки не только готовятся к борьбе с захватчиками, но и запоминают размер и форму захватчиков, если им случится снова вступить с ними в контакт. Вот почему вы редко болеете одним и тем же вирусом более одного раза.
Эти клетки не только готовятся к борьбе с захватчиками, но и запоминают размер и форму захватчиков, если им случится снова вступить с ними в контакт. Вот почему вы редко болеете одним и тем же вирусом более одного раза.
Бактерии и вирусы могут легко распространяться при кашле, чихании и прикосновении.
Бактерии и вирусы легко переносятся через капли из носа и рта, которые могут распространяться при кашле или чихании. Эти капли формируются вашим телом в так называемых слизистых оболочках. Когда эти слизистые оболочки нарушены, вероятность заражения намного выше и заболеть от других людей намного легче. Чтобы предотвратить распространение инфекции, вы должны мыть руки, избегать совместного использования напитков и столовых приборов, а также оставаться дома, если вы заболели!
Бактерии и вирусы могут легко распространяться через кашель, чихание и прикосновение. Бактерии и вирусы легко переносятся через капли из носа и рта, которые могут распространяться при кашле или чихании. Эти капли формируются вашим телом в так называемых слизистых оболочках. Когда эти слизистые оболочки нарушены, вероятность заражения намного выше и заболеть от других людей намного легче. Чтобы предотвратить распространение инфекции, вы должны мыть руки, избегать совместного использования напитков и столовых приборов, а также оставаться дома, если вы заболели!
Эти капли формируются вашим телом в так называемых слизистых оболочках. Когда эти слизистые оболочки нарушены, вероятность заражения намного выше и заболеть от других людей намного легче. Чтобы предотвратить распространение инфекции, вы должны мыть руки, избегать совместного использования напитков и столовых приборов, а также оставаться дома, если вы заболели!
Многие научные профессии связаны с изучением бактерий и вирусов.
Микробиологи и вирусологи вместе изучают бактерии и вирусы, чтобы лучше понять, как их предотвратить. Эти ученые выращивают бактерии в своих лабораториях и проводят исследования, чтобы определить лучшие методы лечения различных типов бактерий и вирусов. В настоящее время ученые всего мира работают над тестами на антитела и вакцинами против COVID-19.
Многие научные карьеры связаны с изучением бактерий и вирусов. Микробиологи и вирусологи работают вместе над изучением бактерий и вирусов, чтобы лучше понять, как их предотвратить. Эти ученые выращивают бактерии в своих лабораториях и проводят исследования, чтобы определить лучшие методы лечения различных типов бактерий и вирусов. В настоящее время ученые всего мира работают над тестами на антитела и вакцинами против COVID-19.
В настоящее время ученые всего мира работают над тестами на антитела и вакцинами против COVID-19.
БАКТЕРИИ И ВИРУСЫ СЛОВАРЬ
Ядро
Структура внутри клетки животного, в которой хранится ДНК.
ДНК
Генетический материал, содержащий информацию для создания большего количества клеток.
Бактерии
Тип одноклеточных организмов, встречающихся почти повсюду на Земле.
Колония
Группа бактерий, растущих вместе.
Вирус
Неживая защитная оболочка с генетическим материалом внутри.
Антибиотик
Лекарство, используемое для лечения бактериальных инфекций.
Лейкоцит
Клетка иммунной системы человека, помогающая бороться с инфекцией.
Вакцина
Лекарство, которое помогает подготовить иммунную систему к борьбе с инфекцией.
Микробиолог
Ученый, изучающий микроорганизмы, такие как бактерии.
Инкубатор
Машина, которую ученые используют для выращивания и изучения бактерий.
БАКТЕРИИ И ВИРУСЫ ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ
Как узнать, живое это или неживое?
Живые существа должны получать питательные вещества, иметь генетический материал и воспроизводиться.
Как обычно распространяются бактерии и вирусы?
Бактерии и вирусы могут легко распространяться при прикосновении.
Где можно найти бактерии?
Бактерии можно найти везде! Они в почве, на вашей коже, внутри вашего тела и даже в ваших фекалиях! Бактерии растут вместе и чаще всего встречаются группами, называемыми колониями.
Почему врачи не назначают антибиотики при вирусных инфекциях?
Антибиотики убивают только бактерии и не действуют на вирусы.
Почему вирусы считаются неживыми?
Вирусы не поглощают питательные вещества и не размножаются сами по себе. Им нужна клетка-хозяин.
Если вирусы неживые, как они размножаются?
Вирусы захватывают клетки, создают копии самих себя, а затем вырываются из клетки. Копии заражают другие клетки.
Копии заражают другие клетки.
Вернуться к уроку
В чем разница между бактериями и вирусами? — Институт молекулярной биологии
И бактерии, и вирусы невидимы невооруженным глазом и вызывают у вас насморк, лихорадку или кашель, так как же мы можем отличить их?
Поскольку бактерии быстро развивают устойчивость к антибиотикам, становится все более важным знать разницу, поскольку вирусы нельзя лечить антибиотиками, а бактерии — противовирусными препаратами.
Необходимо быстрое и эффективное тестирование, чтобы мы могли успешно лечить патогенный микроорганизм.
COVID-19 учит нас горькому опыту: у нас нет лечения от нового вируса, пока у нас нет противовирусных препаратов и вакцин, специально предназначенных против него.
Терапия, разработанная против существующего вируса, часто не работает или работает плохо против нового вируса. До сих пор наше лучшее оружие — мытье рук и физическое дистанцирование.
На биологическом уровне основное отличие заключается в том, что бактерии — это свободноживущие клетки, которые могут жить внутри или вне тела, а вирусы — это неживой набор молекул, которым для выживания нужен хозяин.![]()
Многие бактерии помогают нам: живут в нашем кишечнике, переваривают и помогают усвоению пищи, фиксируют азот и разлагают органические вещества в почве. Точно так же не все вирусы плохие — теперь мы знаем, что в нашем кишечнике, коже и крови присутствуют и полезные вирусы, которые могут убивать нежелательные бактерии и более опасные вирусы.
Бактерии и вирусы окружают нас повсюду
Бактерии и вирусы могут быть невидимы человеческому глазу, но они повсюду вокруг нас в поистине ошеломляющих количествах.
В наших океанах в 10 миллиардов раз больше бактерий, чем звезд во Вселенной.
Миллионы вирусов в мире, уложенные встык, растянулись бы на 100 миллионов световых лет.
Микроорганизмы, безвредно живущие в наших телах и в них, превосходят по численности человеческие клетки в соотношении 10 к 1, играя жизненно важную роль в здоровье человека.
Но не все микроорганизмы существуют в гармонии с нами. Патогены представляют собой подмножество микроорганизмов, которые могут вызывать заболевания, и к ним относятся представители бактерий, грибов, вирусов, гельминтов и простейших.
Известно, что 1% известных в мире микробных популяций являются патогенными для человека — примерно 1400 видов.
Что такое бактерии?
Бактерии — это свободноживущие клетки, которые могут жить внутри или вне тела.
Бактерии — это прокариоты — мельчайшие, простейшие и самые древние клетки с свободно плавающим генетическим материалом. Эти микроскопические одноклеточные организмы могут иметь стержневую, спиралевидную или сферическую форму.
Существует два типа бактерий: грамотрицательные и грамположительные. Ключевым отличием является наличие дополнительной наружной мембраны у грамотрицательных бактерий. По сути, это дополнительная линия защиты, которая затрудняет проникновение антибиотиков, что затрудняет уничтожение грамотрицательных бактерий и делает их более склонными к развитию резистентности.
Бактерии в изобилии обитают в почве, населяя корневую систему растений, чтобы выполнять такие функции, как фиксация азота или действовать как противогрибковые агенты. Термофильные (теплолюбивые) бактерии фиксируют серу для производства сульфидов и энергии для фотосинтеза в водных отложениях или богатых органикой водах.
Опасные бактерии живут в почве, хороший повод надеть садовые перчатки.
В почве также обитают опасные бактерии, поэтому стоит надеть садовые перчатки. Наводнения в северном Квинсленде в 2019 году вынесли на поверхность бактерий Burkholderia pseudomallei , вызывающих серьезную инфекцию, известную как мелиоидоз.
В нашем организме бактерии обитают в пищеварительной системе человека, живут на нашей коже и способствуют энергетическому обмену, пищеварению, работе мозга и общему самочувствию. Но если баланс этих бактерий нарушается дозой антибиотиков или плохим состоянием здоровья, тогда дискомфорт в кишечнике или кожные инфекции являются обычным явлением.
Инфекционные заболевания, вызываемые бактериями, унесли жизни более половины всех людей, когда-либо живших на Земле. Исторически сложилось так, что бактериальные инфекции стали причиной крупных пандемий, таких как бубонная чума, которая, по оценкам, унесла жизни 50-60 процентов населения Европы во время Черной смерти в 14 -м -м веке.
Бактерии размножаются в основном путем бинарного деления
Бактерии размножаются в основном путем бинарного деления – реплицируют свою ДНК так, что у них появляются две копии на противоположных сторонах клетки, а затем отращивают новую клеточную стенку посередине, чтобы произвести две дочерние клетки. Это удвоение времени занимает от 20 минут до часа.
Это короткое время генерации позволяет мутациям быстро возникать и накапливаться и быстро вызывать значительные изменения в бактериях, такие как устойчивость к антибиотикам.
Ключ к коммуникации
Бактерии могут общаться друг с другом, высвобождая химические сигнальные молекулы, что позволяет популяции действовать как один многоклеточный организм.
В зависимости от плотности молекул и сигнала, который они генерируют, бактериальное сообщество может адаптироваться и реагировать, чтобы конкурировать за ресурсы в процессе, известном как определение кворума.
Общение наделяет бактерии некоторыми качествами высших организмов.
Эта способность общаться друг с другом позволяет бактериям координировать экспрессию генов и, следовательно, поведение всего сообщества.
Этот процесс придает бактериям некоторые качества высших организмов и является мощным оружием против антибиотиков. Это может привести к тому, что некоторые бактерии отключатся и станут бездействующими при воздействии антибиотика, и они могут регенерировать, когда антибиотик исчезнет.
Что такое вирусы?
Вирусы представляют собой совокупность различных типов молекул, состоящих из генетического материала (одно- или двухцепочечной ДНК или РНК) с белковой оболочкой, а иногда и с жировым слоем (оболочкой).
Они могут принимать различные формы и размеры — космические корабли, спирали, цилиндры и шары.
Вирусы, покрытые слоем жира (например, SARS-CoV-2, вызывающий COVID-19), легче уничтожаются простым мытьем рук, поскольку мыло разрушает этот жировой слой.
Вирусы не могут воспроизводиться сами по себе (в отличие от бактерий), поэтому они не считаются «живыми», но могут выживать на поверхностях в течение разного периода времени.
Вирусы — это неживой набор молекул, которым для выживания нужен хозяин.
Вирусы должны проникнуть в живую клетку (например, в человеческую клетку), чтобы иметь возможность размножаться, и, оказавшись внутри, они захватывают все клеточные механизмы и заставляют клетку производить новый вирус.
Вирусы вызывают заболевания, включая грипп, вирус простого герпеса, лихорадку Эбола, вирус Зика и грозную простуду.
Вирусы могут быть весьма избирательны в отношении того, где они живут и размножаются — многие вирусы даже не заражают людей. Некоторые вирусы заражают только бактерии, некоторые заражают только растения, а многие заражают только животных.
Тем не менее, вирус может эволюционировать и проникнуть в человека. Это часто происходит с гриппом: например, птичьим гриппом или свиным гриппом, которые возникли у птиц и свиней и сумели заразить людей. SARS-CoV-2, вирус, вызывающий COVID-19, вероятно, попал в человека от летучих мышей.
Жизненный цикл вируса можно разделить на следующие этапы: проникновение вируса в клетку-хозяина; репликация вирусного генома; производство новых вирусных белков; сборка этих вирусных белков в новые вирусы, а затем высвобождение из клетки-хозяина (либо путем уничтожения клетки, либо путем отпочкования от мембраны клетки-хозяина), готовых заразить новые клетки.
Почему так важно различать?
Молекулярные инструменты улучшают способность врачей выявлять вирусные или бактериальные инфекции быстрее и эффективнее — есть надежда, что врачи смогут тестировать пациентов в кабинете врача общей практики или в экстренной ситуации и сразу выяснять, вызвано ли их заболевание вирусом или бактерии.
Цель состоит в том, чтобы быстрые тесты были доступны в хирургии общей практики.
Важно знать разницу между вирусной и бактериальной инфекцией, чтобы врачи могли правильно лечить болезнь, а антибиотики не использовались без необходимости, способствуя росту устойчивых к антибиотикам супербактерий.
По этой же причине не следует ожидать, что врач пропишет вам антибиотики, если вы страдаете от вирусной инфекции, такой как простуда.
Исследователи из IMB работают над тем, чтобы за несколько часов выявлять и идентифицировать бактерии от инфекций — в настоящее время на это уходит несколько дней.
Использование этих молекулярных электростанций
Исследователи изменяют смертельную структуру бактерий и вирусов, чтобы найти способы остановить их инфекционные циклы.
В данный момент разрабатываются вакцины для защиты от COVID-19.
Вакцины показывают иммунной системе важные части вируса, чтобы иммунная система могла подготовить инструменты для эффективной борьбы с настоящим вирусом — вакцины обманом заставляют иммунную систему реагировать так, как будто она раньше видела вирус.
Наиболее изученными из этих иммунных «инструментов» являются антитела, которые препятствуют проникновению вирусов в новые клетки. Но иммунная система также производит клетки-киллеры, которые останавливают репликацию вируса, убивая любые инфицированные клетки-хозяева.
Традиционно вакцины представляют собой слабые или инактивированные формы вируса.
По всему миру разрабатывается множество потенциальных вакцин-кандидатов, созданных с использованием широкого спектра новых технологий.
Эти вакцинные технологии включают использование субъединичных вакцин: исследователи создают вирусные белки и вводят их в организм, чтобы иммунная система вырабатывала антитела против этих вирусных белков.
Этот метод обычно безопаснее и быстрее, чем использование живого или инактивированного вируса.
Другие технологии обманом заставляют организм самостоятельно производить эти вирусные белки, к ним относятся доставка РНК в липосомах или плазмид ДНК в наночастицах, а также модифицированные безопасные вирусы и существующие вакцины.
Изучая жизненные циклы вирусов и то, как вирусы обнаруживаются иммунной системой, мы можем открыть новые способы борьбы с вирусом и лечения вирусных заболеваний даже без вакцины.
Бактериальные и вирусные инфекции часто связаны друг с другом
Хотя бактериальные и вирусные инфекции различны, они часто связаны между собой.
Тяжелые случаи вирусной пневмонии часто заканчиваются сопутствующей бактериальной инфекцией. Это особенно верно в отношении COVID-19, когда до 50% тяжелобольных госпитализированных пациентов развили бактериальную инфекцию. Итак, несмотря на COVID-19будучи вызванным вирусом, антибиотики действительно важны для лечения ассоциированных бактериальных инфекций.
Поскольку устойчивые к антибиотикам бактерии становятся все более серьезной глобальной проблемой, исследователи IMB изучают поверхностную активность бактерий на молекулярном уровне и выяснили, как они ускользают от иммунной системы человека. Они также занимаются разработкой новых методов лечения устойчивых бактерий и помогают исследователям во всем мире открывать новые антибиотики.
Сейчас мы находимся на пути к разработке превентивных методов лечения, биомаркеров и вакцин, чтобы помешать этим неуловимым микробным убийцам заполонить наш мир.
< Предыдущая статьяСледующая статья >
Вирусы могут нам помочь, а также навредить
За последние несколько лет миллионы людей во всем мире радикально изменили свой образ жизни, чтобы избежать контакта с другими людьми и, таким образом, роман коронавирус. Несмотря на социальное дистанцирование, многие все же частично заболели другими вирусными инфекциями. Это связано с тем, что ученые все чаще узнают, что многие вирусы тихо скрываются в человеческом теле, спрятанные в клетках легких, крови и нервах, а также внутри множества микробов, которые колонизируют наш кишечник.
По оценкам биологов, прямо сейчас на вашем теле и внутри него живет 380 триллионов вирусов — в 10 раз больше, чем бактерий. Некоторые могут вызвать болезнь, но многие просто сосуществуют с вами. Например, в конце 2019 года исследователи Пенсильванского университета обнаружили в дыхательных путях 19 различных штаммов редондовируса; некоторые из них были связаны с пародонтозом или заболеваниями легких, но другие, возможно, могли бороться с респираторными заболеваниями.![]() Быстро расширяющиеся знания ученых ясно показывают, что мы состоим в основном не из «человеческих» клеток, в которые время от времени вторгаются микробы; наши тела на самом деле представляют собой суперорганизмы, сосуществующие вместе с клетками, бактериями, грибками и, что наиболее многочисленно, вирусами. Последние подсчеты показывают, что до половины всей биологической материи в вашем теле не принадлежит человеку.
Быстро расширяющиеся знания ученых ясно показывают, что мы состоим в основном не из «человеческих» клеток, в которые время от времени вторгаются микробы; наши тела на самом деле представляют собой суперорганизмы, сосуществующие вместе с клетками, бактериями, грибками и, что наиболее многочисленно, вирусами. Последние подсчеты показывают, что до половины всей биологической материи в вашем теле не принадлежит человеку.
Десять лет назад исследователи едва ли знали о существовании человеческого вирома. Сегодня мы видим огромный виром как неотъемлемую часть более крупного микробиома человека, сумасшедшее одеяло из пассивных и активных микроскопических организмов, которые занимают почти каждый уголок нашего существа. Мы занимаемся картографированием вирома уже более 10 лет, и чем глубже мы исследуем, тем больше виром выглядит как партнерство, которое может влиять на нашу повседневную жизнь как положительно, так и отрицательно. Недавние исследования показывают, что мы можем даже использовать виром для укрепления собственного здоровья. Исследователи Рокфеллеровского университета, например, выделили из вируса фермент, убивающий бактерии, обнаруженные у пациентов, борющихся с метициллин-резистентной стафилококковой инфекцией. Результаты были настолько обнадеживающими, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов назвало фермент «прорывной терапией». Сегодня мы регулярно говорим о «хороших» и «плохих» бактериях в нашей жизни. Вирусы попадают в те же категории. Теперь задача состоит в том, чтобы выяснить, как остановить плохие и продвигать хорошие.
Исследователи Рокфеллеровского университета, например, выделили из вируса фермент, убивающий бактерии, обнаруженные у пациентов, борющихся с метициллин-резистентной стафилококковой инфекцией. Результаты были настолько обнадеживающими, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов назвало фермент «прорывной терапией». Сегодня мы регулярно говорим о «хороших» и «плохих» бактериях в нашей жизни. Вирусы попадают в те же категории. Теперь задача состоит в том, чтобы выяснить, как остановить плохие и продвигать хорошие.
Заражение при рождении
Организм человека представляет собой богатую среду для микробов, изобилующую белками, жирами и углеводами. Многие вирусы придумали, как мирно процветать в нем, не заражая нас.
Вирусы должны внедряться в клетки-хозяева для размножения, и они умеют использовать все возможности нашего организма. Около десятка лет назад недорогое секвенирование генома позволило нам обнаружить множество вирусов во рту и кишечнике. Примерно к 2013 году ученые обнаружили вирусы на коже и в дыхательных путях, крови и моче. Совсем недавно мы нашли их в еще более удивительных местах. В сентябре 2019 г., например, Чандрабали Гхош, наши коллеги и я опубликовали подробности о вирусах, которые мы обнаружили в спинномозговой жидкости взрослых, которые проходили тестирование на различные состояния. Вирусы принадлежали к нескольким различным семействам и не были связаны с каким-либо известным заболеванием. Мы также обнаружили те же вирусы в плазме крови, суставной жидкости и грудном молоке. Ученые знали, что некоторые редкие инфекционные вирусы, особенно герпес, могут проникать в спинномозговую жидкость, но обнаружение случайных вирусов, которые казались простыми сторонними наблюдателями, стало неожиданностью. Центральная нервная система, которая считается стерильной средой, заселена несколько разнообразным вирусным сообществом.
Примерно к 2013 году ученые обнаружили вирусы на коже и в дыхательных путях, крови и моче. Совсем недавно мы нашли их в еще более удивительных местах. В сентябре 2019 г., например, Чандрабали Гхош, наши коллеги и я опубликовали подробности о вирусах, которые мы обнаружили в спинномозговой жидкости взрослых, которые проходили тестирование на различные состояния. Вирусы принадлежали к нескольким различным семействам и не были связаны с каким-либо известным заболеванием. Мы также обнаружили те же вирусы в плазме крови, суставной жидкости и грудном молоке. Ученые знали, что некоторые редкие инфекционные вирусы, особенно герпес, могут проникать в спинномозговую жидкость, но обнаружение случайных вирусов, которые казались простыми сторонними наблюдателями, стало неожиданностью. Центральная нервная система, которая считается стерильной средой, заселена несколько разнообразным вирусным сообществом.
Похоже, что наши виромы начинают накапливаться, когда мы рождаемся. Исследования показывают большое разнообразие вирусов в кишечнике младенцев вскоре после рождения, что позволяет предположить, что они, вероятно, исходят от матерей младенцев, а некоторые из них попадают в организм с грудным молоком. Количество некоторых из этих вирусов уменьшается по мере того, как младенцы вырастают до недель или месяцев; другие попадают в их тела из воздуха, воды, пищи и других людей. Эти вирусы растут в количестве и разнообразии, заражая клетки, в которых они сохраняются в течение многих лет. Младенческие виромы нестабильны, тогда как взрослые виромы относительно стабильны. Анелловирусы, семейство из 200 различных видов, присутствуют почти у всех, когда мы становимся старше. Это отражает то, что мы наблюдаем и для бактерий.
Количество некоторых из этих вирусов уменьшается по мере того, как младенцы вырастают до недель или месяцев; другие попадают в их тела из воздуха, воды, пищи и других людей. Эти вирусы растут в количестве и разнообразии, заражая клетки, в которых они сохраняются в течение многих лет. Младенческие виромы нестабильны, тогда как взрослые виромы относительно стабильны. Анелловирусы, семейство из 200 различных видов, присутствуют почти у всех, когда мы становимся старше. Это отражает то, что мы наблюдаем и для бактерий.
Многие из вирусов, живущих внутри нас, не нацелены на наши клетки. Вместо этого они ищут бактерии в наших микробиомах. Известные как бактериофаги или фаги, эти вирусы проникают внутрь бактериальных клеток, используют тамошние механизмы для создания своих копий, а затем часто вырываются наружу, чтобы заразить новые бактерии, убивая при этом клетки-хозяева. Бактериофаги почти повсеместно распространены в природе. Если хорошо поискать, то можно найти их в почве, в любом источнике воды, от океана до домашнего крана, и в экстремальных условиях, таких как кислотные шахты, Арктика и горячие источники. Вы даже найдете их парящими в воздухе. Они сохраняются во всех этих местах, потому что охотятся на бактерии, живущие во всех этих местах. Мы, люди, всего лишь еще одно охотничье угодье.
Вы даже найдете их парящими в воздухе. Они сохраняются во всех этих местах, потому что охотятся на бактерии, живущие во всех этих местах. Мы, люди, всего лишь еще одно охотничье угодье.
В 2017 году Софи Нгуен и Джереми Барр из Университета штата Сан-Диего продемонстрировали, что многие фаги попадают в свое окончательное место в организме, пересекая слизистые оболочки. В лабораторных экспериментах фаги работали через мембраны, выстилающие кишечник, легкие, печень, почки и даже мозг. Но когда они случайно попадают в такое место, как центральная нервная система, где мало бактерий, которые могут быть хозяевами, у них может не быть возможности размножаться, и они могут в конечном итоге погибнуть.
Ваш личный вирусный профиль
Виром может сильно варьироваться от одной части тела к другой. Когда мы с Гхошем искали вирусы в неожиданных местах, мы также определили, что вирусы во рту отличаются от вирусов в кишечнике, которые отличаются от вирусов в моче или крови. Мы знали, что это относится к бактериям, но вначале у нас не было достаточно данных о вирусах. Хотя найти добровольцев, которые будут плевать в чашку, нетрудно, трудно заставить их предоставить образцы стула или крови и убедить университеты дать согласие на получение и обработку этих образцов. Когда у нас есть товар, мы должны отфильтровать бактерии, оставив крошечные кусочки вирусного материала, которые мы можем исследовать под микроскопом и поместить в машину, которая секвенирует нуклеиновые кислоты, кодирующие присутствующие гены. Тем не менее, исследователи проделали уже достаточно этой работы, чтобы сказать, какую часть тела они исследуют, просто отметив присутствующие вирусы.
Хотя найти добровольцев, которые будут плевать в чашку, нетрудно, трудно заставить их предоставить образцы стула или крови и убедить университеты дать согласие на получение и обработку этих образцов. Когда у нас есть товар, мы должны отфильтровать бактерии, оставив крошечные кусочки вирусного материала, которые мы можем исследовать под микроскопом и поместить в машину, которая секвенирует нуклеиновые кислоты, кодирующие присутствующие гены. Тем не менее, исследователи проделали уже достаточно этой работы, чтобы сказать, какую часть тела они исследуют, просто отметив присутствующие вирусы.
Авторы и права: AXS Biomedical Animation Studio
Мы с моей коллегой Мелиссой Ли из Института человеческих вакцин Дьюка также показали, что, сравнивая виромы неродственных людей, мы можем определить, живут ли они вместе. Хотя у разных людей могут быть существенно разные виромы, люди, живущие совместно, по-видимому, имеют примерно 25 процентов вирусов в своих виромах. Вирусы могут передаваться от одного члена домохозяйства к другому не только через типичные заразные средства, такие как кашель, но также через случайный контакт и общие раковины, туалеты, столы и пищу. Хотя мы изучили лишь небольшое количество людей, данные показывают, что не романтические соседи по комнате имеют тот же процент вирусов, что и романтические соседи по комнате. Близкий контакт, кажется, мало что меняет; достаточно просто жить в одном месте.
Хотя мы изучили лишь небольшое количество людей, данные показывают, что не романтические соседи по комнате имеют тот же процент вирусов, что и романтические соседи по комнате. Близкий контакт, кажется, мало что меняет; достаточно просто жить в одном месте.
Однако загадка непростая. Шира Абелес из Калифорнийского университета в Сан-Диего выявила большие различия в оральных виромах мужчин и женщин; причиной могли быть гормоны, но никто не продемонстрировал такой связи. Мы знаем, что виромы могут значительно различаться в зависимости от географических популяций. Например, виромы людей в западных странах менее разнообразны, чем среди людей в незападных странах. Эти различия могут быть связаны как с питанием, так и с окружающей средой.
Фото: AXS Biomedical Animation Studio
Бродяги или нахлебники?
Многие вирусы в нашем вироме заражают бактерии, но меньшая их часть непосредственно заражает клетки наших тканей. Эти вирусы могут быть в меньшинстве, потому что наша иммунная система подавляет их.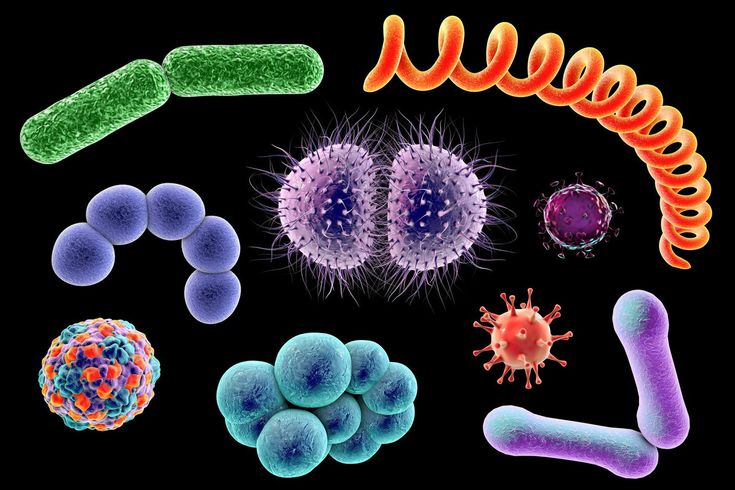 Ивейн де Вламинк, в то время работавший в Стэнфордском университете, продемонстрировал, что, когда иммунная система человека подвергается серьезной нагрузке — например, когда кто-то получил трансплантацию органа и должен принимать иммунодепрессанты, чтобы избежать отторжения органа, — присутствие определенных вирусов резко возрастает. В этих случаях мы наблюдаем рост как вирусов, о которых известно, что они вызывают заболевание, так и тех, которые этого не делают. Это наблюдение предполагает, что в нормальных условиях наша иммунная система контролирует виромы, но когда иммунитет ослаблен, вирусы могут легко размножаться.
Ивейн де Вламинк, в то время работавший в Стэнфордском университете, продемонстрировал, что, когда иммунная система человека подвергается серьезной нагрузке — например, когда кто-то получил трансплантацию органа и должен принимать иммунодепрессанты, чтобы избежать отторжения органа, — присутствие определенных вирусов резко возрастает. В этих случаях мы наблюдаем рост как вирусов, о которых известно, что они вызывают заболевание, так и тех, которые этого не делают. Это наблюдение предполагает, что в нормальных условиях наша иммунная система контролирует виромы, но когда иммунитет ослаблен, вирусы могут легко размножаться.
Мы можем наблюдать подобный оппортунизм с COVID-19. У людей, заболевших вирусом SARS-CoV-2, особенно у тяжелобольных, могут развиться коинфекции. Наиболее распространенными являются вторичная бактериальная пневмония или бактериемия (повышение количества бактерий в кровотоке), включающая такие микроорганизмы, как Staphylococcus aureus и Streptococcus pneumoniae . Хотя реже, мы также наблюдали вирусные коинфекции, такие как грипп, респираторно-синцитиальный вирус и аденовирус. Вирусы, скрывающиеся в вироме, также могут реактивироваться, например, вирус Эпштейна-Барр и цитомегаловирус. Когда иммунная система обращает внимание на COVID, пациент может быть более восприимчив к другим вирусным вспышкам.
Хотя реже, мы также наблюдали вирусные коинфекции, такие как грипп, респираторно-синцитиальный вирус и аденовирус. Вирусы, скрывающиеся в вироме, также могут реактивироваться, например, вирус Эпштейна-Барр и цитомегаловирус. Когда иммунная система обращает внимание на COVID, пациент может быть более восприимчив к другим вирусным вспышкам.
Многие фаги, несмотря на то, что они охотники, долгое время живут в гармонии со своей добычей и могут никогда не вырваться наружу. Вирус — это всего лишь белковый шарик, окутывающий молекулу генетических инструкций — генетический код вируса. Когда некоторые фаги заражают бактерию, они интегрируют свой геном в геном бактерии. Хотя некоторые вирусы размножаются немедленно, убивая свои бактерии-хозяева, другие фаги просто сохраняются внутри своего хозяина, словно в тихой спячке. Вероятно, это стратегия выживания; когда бактерия-хозяин делится, создавая копию своего генома, она также копирует геном фага. В этой модели выживание хозяина определяет выживание фага, поэтому фаг заинтересован в сохранении своего хозяина.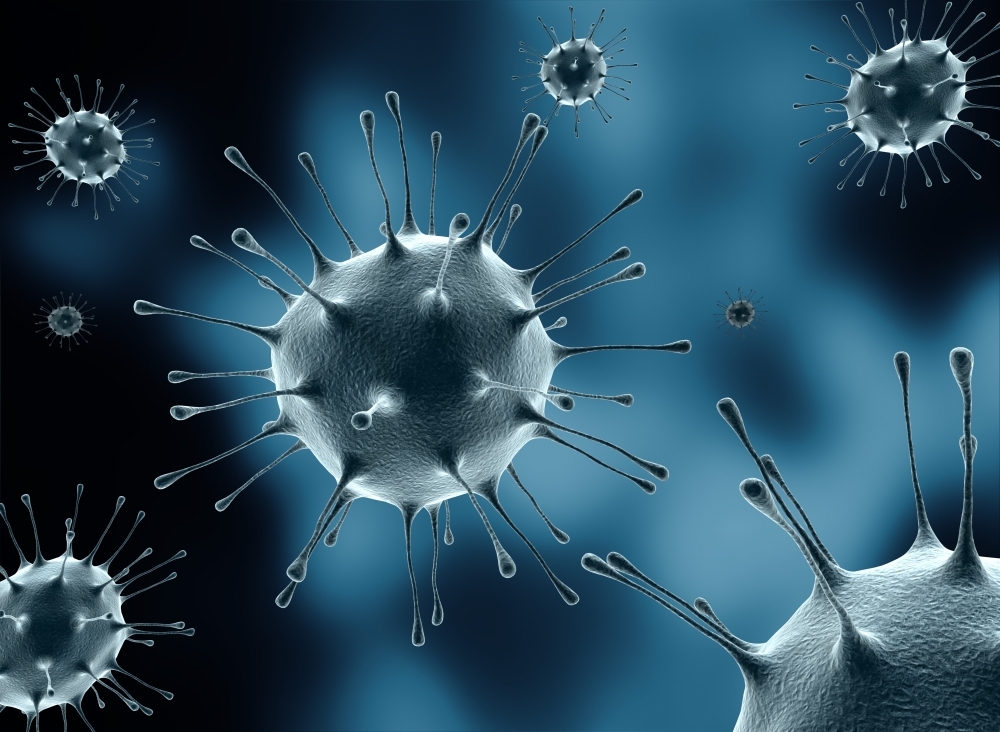 Понятно, почему такая стратегия приносит пользу фагу, но не так ясно, как она может принести пользу бактериям. По какой-то причине кажется, что многие бактерии в организме привыкли жить со своими фагами.
Понятно, почему такая стратегия приносит пользу фагу, но не так ясно, как она может принести пользу бактериям. По какой-то причине кажется, что многие бактерии в организме привыкли жить со своими фагами.
Когда представится возможность, гибернирующие фаги могут проснуться и произвести много потомства, убивая свои клетки-хозяева. Иногда уходящие фаги уносят с собой бактериальные гены. Эта полезная нагрузка может время от времени приносить пользу следующим бактериям, которые заражают фаги. Например, я обнаружил в слюне фаги, несущие гены, помогающие бактериям ускользать от нашей иммунной системы. Некоторые фаги даже несут гены, которые помогают бактериям сопротивляться антибиотикам. Фагам не нужны такие гены, потому что фаги не могут быть уничтожены антибиотиками, поэтому, когда они передают гены бактериям, они способствуют выживанию хозяев, что синонимично выживанию фагов. Мы часто видим такие переводы.
Фаги могут усилить защиту своего хозяина. Бактерия Pseudomonas aeruginosa , наиболее известная тем, что вызывает пневмонию, вызывает ряд заболеваний. Людям с такими заболеваниями легких, как кистозный фиброз, почти невозможно вывести эту бактерию из легких, даже если они принимают антибиотики, предназначенные для ее уничтожения. Некоторые P. aeruginosa интегрировали в свои геномы так называемые нитевидные фаги. В 2019 году исследователи под руководством группы из Стэнфорда, в которую входили Элизабет Бергенер и Пол Боллики, обнаружили, что нитевидные фаги могут образовывать защитный плащ — слои углеводов и белков, которые помогают бактериям прятаться от антибиотиков. Это позволяет бактериям укрыться на месте, пока антибиотики не исчезнут, и жить, чтобы вызвать инфекцию в другой день.
Людям с такими заболеваниями легких, как кистозный фиброз, почти невозможно вывести эту бактерию из легких, даже если они принимают антибиотики, предназначенные для ее уничтожения. Некоторые P. aeruginosa интегрировали в свои геномы так называемые нитевидные фаги. В 2019 году исследователи под руководством группы из Стэнфорда, в которую входили Элизабет Бергенер и Пол Боллики, обнаружили, что нитевидные фаги могут образовывать защитный плащ — слои углеводов и белков, которые помогают бактериям прятаться от антибиотиков. Это позволяет бактериям укрыться на месте, пока антибиотики не исчезнут, и жить, чтобы вызвать инфекцию в другой день.
Вирусы, которые нам помогают
Нетрудно задаться вопросом, можем ли мы использовать вирусы, живущие внутри нас, для улучшения нашего здоровья. Мы уже нашли несколько случаев, когда это происходит естественным образом. По мере того, как фаги перемещаются по телу в поисках бактерий, некоторые из них связываются с клетками на поверхности слизистых оболочек, таких как те, которые выстилают нос, горло, желудок и кишечник. Фаги не могут размножаться там, но они могут подстерегать уязвимый хозяин.
Фаги не могут размножаться там, но они могут подстерегать уязвимый хозяин.
Этот процесс теоретически может защитить нас от некоторых болезней. Допустим, вы едите пищу, зараженную бактериями Salmonella . Если бактерии соприкасаются с мембраной желудка, фаги там могут якобы заразить бактерии и убить их, прежде чем они смогут вызвать заболевание. Таким образом, фаги могут служить де-факто иммунной системой, защищающей нас от болезней. Этого пока никто не доказал, но в 2019 году исследовательская группа в Финляндии показала, что фаги, связанные со слизью свиней и радужной форели, сохраняются там в течение семи дней и защищают от одного вида бактерий, заражающих этих животных.
Одним из фагов, привлекающих большое внимание, является crAssphage, обнаруженный в 2014 году Басом Дутилом из Института Радбуда в Нидерландах. Исследования, проведенные с тех пор, показали, что он населяет большинство людей во всем мире, за исключением, по-видимому, традиционных популяций охотников-собирателей.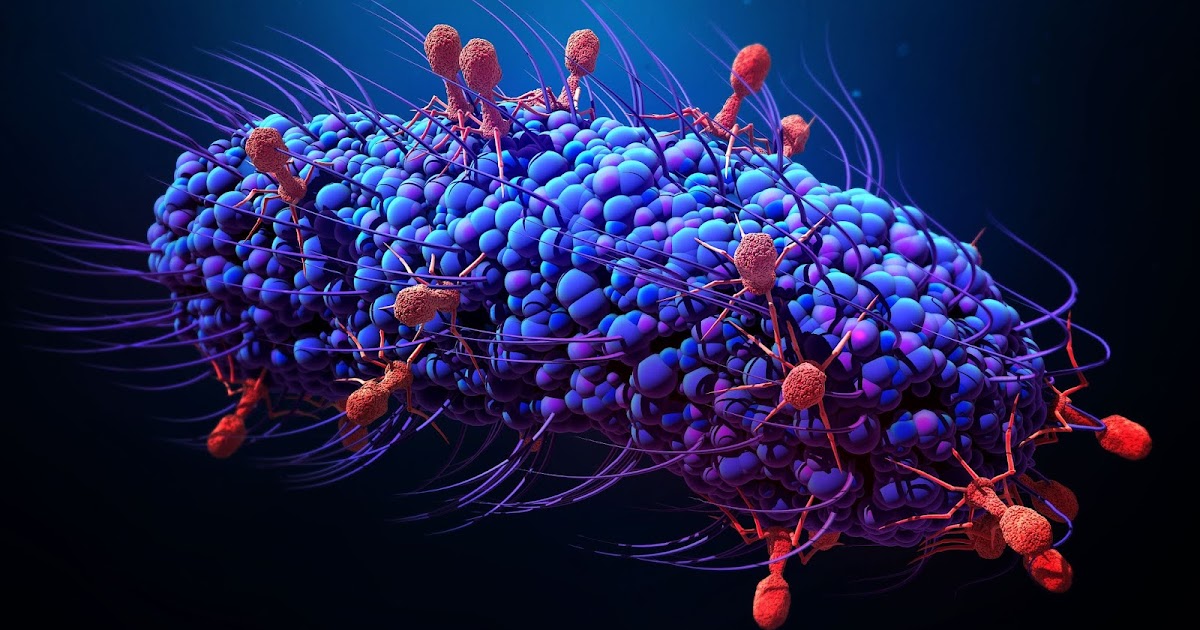 Необычно обнаружить, что один и тот же вирус распространяется так широко и широко, и никто не связал его с каким-либо заболеванием. Ученые считают, что он контролирует распространенность обычной кишечной бактерии под названием Bacteroides . Если это так, мы могли бы использовать его для улучшения состояния желудочно-кишечного тракта. Он настолько распространен в фекалиях человека, что исследователи теперь проверяют его в питьевой воде, чтобы увидеть, не была ли вода загрязнена сточными водами.
Необычно обнаружить, что один и тот же вирус распространяется так широко и широко, и никто не связал его с каким-либо заболеванием. Ученые считают, что он контролирует распространенность обычной кишечной бактерии под названием Bacteroides . Если это так, мы могли бы использовать его для улучшения состояния желудочно-кишечного тракта. Он настолько распространен в фекалиях человека, что исследователи теперь проверяют его в питьевой воде, чтобы увидеть, не была ли вода загрязнена сточными водами.
Врачи особенно заинтересованы в фагах, которые могут противодействовать агрессивному росту устойчивых к антибиотикам бактерий. Разработка новых антибиотиков не поспевает за ними. По оценкам Всемирной организации здравоохранения, к 2050 году эти патогены будут вызывать не менее 10 миллионов смертей ежегодно, поэтому альтернативные методы лечения жизненно важны. Фаги были открыты более 100 лет назад, и врачи пытались использовать их для лечения бактерий, вызывающих заболевания, хотя и без особого успеха. В 19Антибиотики 40-х годов заменили фаги в большинстве стран мира, потому что лекарства были намного эффективнее и проще в использовании. Теперь некоторые медицинские исследователи, такие как исследователи из Университета Рокфеллера, которые использовали фаговый фермент для борьбы с метициллин-резистентной инфекцией Staphylococcus , по-новому смотрят на фаги.
В 19Антибиотики 40-х годов заменили фаги в большинстве стран мира, потому что лекарства были намного эффективнее и проще в использовании. Теперь некоторые медицинские исследователи, такие как исследователи из Университета Рокфеллера, которые использовали фаговый фермент для борьбы с метициллин-резистентной инфекцией Staphylococcus , по-новому смотрят на фаги.
В течение многих лет большинство врачей боялись вводить фаги, потому что они не знали, будет ли иммунная система человека чрезмерно реагировать, вызывая опасные уровни воспаления. Фаги для терапевтического использования выращивают в бактериях, и если бактерии не будут полностью удалены до введения фагов, бактерии могут вызвать чрезмерно агрессивный иммунный ответ. Сегодня у нас есть более сложные методы очистки фагов, и опасения по поводу побочных реакций в значительной степени утихли.
Что действительно ограничивает использование фагов для лечения инфекционных заболеваний, так это то, что трудно найти эффективные вирусы.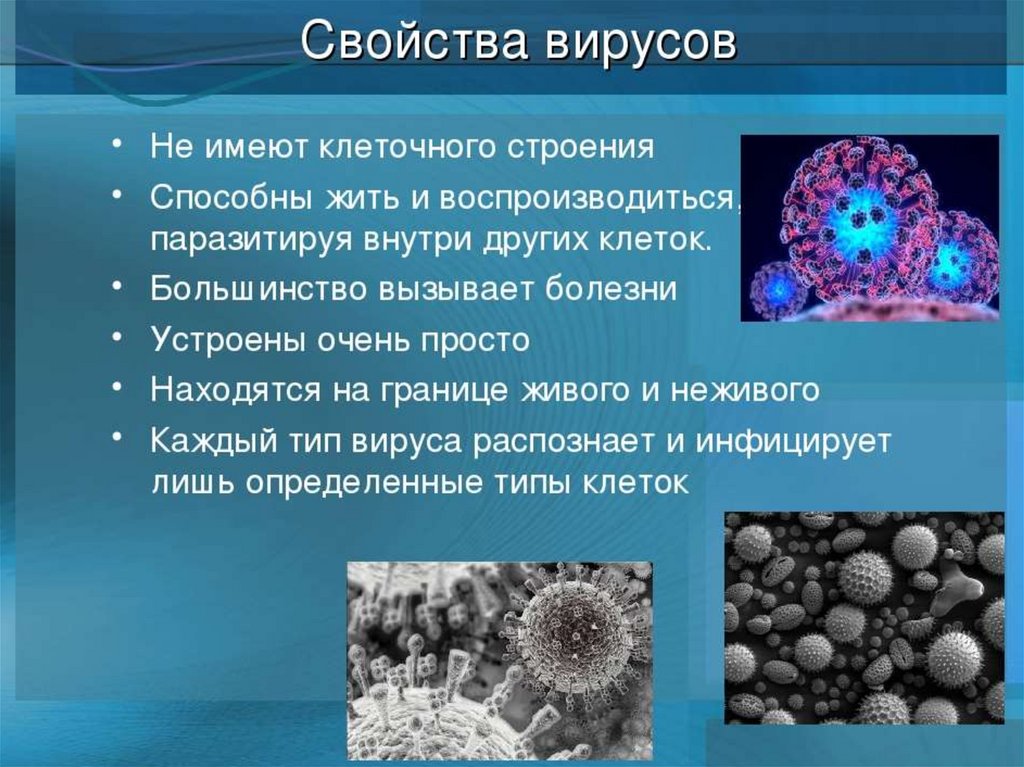 В течение многих лет исследователи прочесывали естественные места обитания в поисках фагов, которые могут быть активны против бактерий, вызывающих болезни человека. Теперь, когда мы знаем, что вирусов много в фекалиях, слюне и мокроте, исследователи поняли, что одним из самых богатых источников фагов могут быть местные очистные сооружения.
В течение многих лет исследователи прочесывали естественные места обитания в поисках фагов, которые могут быть активны против бактерий, вызывающих болезни человека. Теперь, когда мы знаем, что вирусов много в фекалиях, слюне и мокроте, исследователи поняли, что одним из самых богатых источников фагов могут быть местные очистные сооружения.
Несколько таких фагов уже используются для экспериментального лечения. В знаменательном деле 2016 года, за которым наблюдал Роберт Скули, также из Калифорнийского университета. В Сан-Диего врачи использовали фаги из сточных вод, а также фаги из окружающей среды, чтобы успешно лечить Тома Паттерсона, профессора школы, который страдал полиорганной недостаточностью из-за Acinetobacter baumannii, — бактерия, известная своей лекарственной устойчивостью.
Улучшение здоровья
По мере того, как мы узнаем больше о роли вирусов в вироме человека, мы можем открывать больше терапевтических возможностей. Алехандро Рейес из Вашингтонского университета в Сент-Луисе показал, что фаги у мышей могут формировать бактериальные сообщества грызунов, хотя мы не уверены, что меняется в первую очередь: вирусы или бактерии. Если вирусные сообщества изменятся первыми, они смогут сформировать бактериальные сообщества, которые будут служить им. Если бактериальные сообщества изменяются первыми, вирусные сообщества, вероятно, просто адаптируются, чтобы проникнуть в измененные бактерии. Исследователи показали, что виромы могут значительно изменяться при заболеваниях пародонта и воспалительных заболеваниях кишечника.
Если вирусные сообщества изменятся первыми, они смогут сформировать бактериальные сообщества, которые будут служить им. Если бактериальные сообщества изменяются первыми, вирусные сообщества, вероятно, просто адаптируются, чтобы проникнуть в измененные бактерии. Исследователи показали, что виромы могут значительно изменяться при заболеваниях пародонта и воспалительных заболеваниях кишечника.
Хотя нам потребуется много времени, чтобы разгадать человеческий виром, важно учитывать, какого прогресса мы добились всего за 10 лет. Десять лет назад многие ученые думали о микробиоме как о своего рода пассивном слое крошечных организмов внутри тела, в основном в кишечнике. Теперь мы знаем, что хотя некоторые части микробиома действительно стабильны, другие активны и меняются. И начинает казаться, что самые динамичные игроки — это вирусы. Исследование, проведенное в 2018 году в ткани головного мозга, пожертвованной людьми, умершими от болезни Альцгеймера, выявило высокий уровень герпесвирусов. Затем, в мае 2020 года, исследователи из Университета Тафтса и Массачусетского технологического института, которые разработали мозгоподобную ткань в лаборатории, заразили ее вирусом простого герпеса 1, и ткань наполнилась амилоидными бляшечными образованиями, похожими на те, что пронизывают мозг. людей, страдающих болезнью Альцгеймера. Удивительно осознавать, что мы можем обнаружить замечательную роль старых вирусов.
Затем, в мае 2020 года, исследователи из Университета Тафтса и Массачусетского технологического института, которые разработали мозгоподобную ткань в лаборатории, заразили ее вирусом простого герпеса 1, и ткань наполнилась амилоидными бляшечными образованиями, похожими на те, что пронизывают мозг. людей, страдающих болезнью Альцгеймера. Удивительно осознавать, что мы можем обнаружить замечательную роль старых вирусов.
При более глубоком изучении мы можем найти новые категории вирусов, влияющих на здоровье человека, а также новые способы использования вирусов для управления нашим микробиомом и защиты от болезней. Если мы, люди, сможем понять, как управлять плохими вирусами и использовать хорошие, мы сможем помочь себе стать более сильными сверхорганизмами.
Эта статья была первоначально опубликована под названием «Вирусы внутри вас» в журнале Scientific American 323, 6, 46-53 (декабрь 2020 г.)
doi:10.1038/scientificamerican1220-46
ОБ АВТОРАХ
Дэвид Прайд — специалист по инфекционным заболеваниям и адъюнкт-профессор патологии Калифорнийского университета в Сан-Диего. Его лаборатория фокусируется на роли микробных сообществ в гомеостазе, здоровье и болезнях человека. Фото: Ник Хиггинс
Его лаборатория фокусируется на роли микробных сообществ в гомеостазе, здоровье и болезнях человека. Фото: Ник Хиггинс
Тайная социальная жизнь вирусов
Генетик Ротем Сорек увидел, что его бактерии больны — пока все хорошо. Он намеренно заразил их вирусом, чтобы проверить, будет ли каждый больной микроб сражаться в одиночку или общаться со своими союзниками для отражения атаки.
Но когда он и его команда из Научного института Вейцмана в Реховоте, Израиль, заглянули в содержимое своих колб, они увидели нечто совершенно неожиданное: бактерии молчали, а вирусы болтали, передавая записки. друг другу на молекулярном языке, понятном только им. Они вместе решали, когда затаиться в клетке-хозяине, а когда размножиться и вырваться наружу в поисках новых жертв.
Это было случайное открытие, которое коренным образом изменило представление ученых о том, как ведут себя вирусы.
Вирусы, заражающие бактерии — шипастые существа, похожие на леденцы, известные как бактериофаги (или фаги), — имеют механизмы наблюдения, которые дают им информацию о том, оставаться ли в спящем состоянии или атаковать, в зависимости от наличия новых жертв. Но исследователи долгое время считали эти процессы пассивными; фаги, казалось, просто сидели и слушали, ожидая, когда бактериальные сигналы бедствия достигнут апогея, прежде чем действовать.
Но исследователи долгое время считали эти процессы пассивными; фаги, казалось, просто сидели и слушали, ожидая, когда бактериальные сигналы бедствия достигнут апогея, прежде чем действовать.
Сорек и его коллеги обнаружили, что фаги активно обсуждают свой выбор. Они поняли, что когда фаг заражает клетку, он высвобождает крошечный белок — пептид длиной всего шесть аминокислот, — который служит сообщением своим собратьям: «Я взял жертву». По мере того как фаги заражают все больше клеток, сигнал становится все громче, сигнализируя о том, что неинфицированных хозяев становится все меньше. Затем фаги останавливают лизис — процесс репликации и выхода из своих хозяев — вместо этого остаются скрытыми в вялотекущем состоянии, называемом лизогенией 9.0181 1 .
Вирусы, как оказалось, не зависели от бактериальных сигналов при принятии решений. Они управляли своей судьбой. «Это открытие стало большой, важной, революционной концепцией в вирусологии», — говорит Вэй Ченг, структурный микробиолог из Сычуаньского университета в Чэнду, Китай.
Сорек назвал этот вирусный пептид «арбитриумом» в честь латинского слова «решение». Похоже, это работало так же, как коммуникационная система, используемая бактериями — определение кворума — для обмена информацией о плотности клеток и соответствующей корректировки популяции. Тем не менее, это был первый случай, когда кто-либо продемонстрировал молекулярную передачу сообщений такого рода у вирусов. И это соответствовало формирующейся картине вирусов как гораздо более сложных социальных агентов, чем считали ученые.
Вирусологи долгое время изучали своих субъектов изолированно, нацеливаясь на клетки всего с одной вирусной частицей. Но становится все более очевидным, что многие вирусы кооперируются, объединяясь, чтобы совместно заражать хозяев и разрушать противовирусную иммунную защиту.
Подразумевается, что исследователи, возможно, неправильно проводили свои эксперименты. «Это потрясло один из столпов вирусологии», — говорит Сэм Диас-Муньос, биолог-эволюционист из Калифорнийского университета в Дэвисе.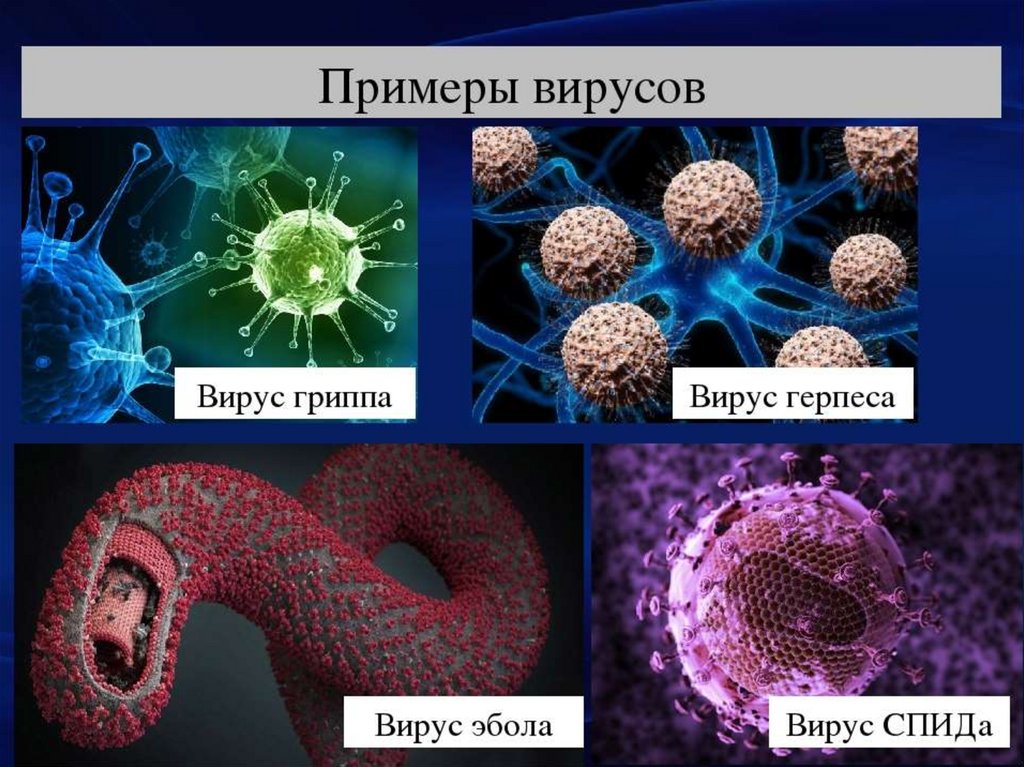
Изучение языка, лежащего в основе этих вирусных взаимодействий, может помочь в разработке новых методов лечения рака и неприятных суперинфекций. Социальные пристрастия вирусов даже помогают объяснить, как они уклоняются от бактериальной иммунной системы, известной как CRISPR. «Концептуально это действительно мощно», — говорит Диас-Муньос.
Социальные исследования
Ученые впервые обнаружили смешение вирусов в 1940-х годах, когда отдельные эксперименты биофизика Макса Дельбрюка и бактериолога Альфреда Херши показали, что две вирусные частицы могут одновременно проникать в одну и ту же клетку и обмениваться генами. Но, по словам Дейла Кайзера, молекулярного генетика из Стэнфордского университета в Калифорнии и протеже Дельбрюка, эти ранние наблюдения были действительно интересны ученым только как экспериментальный метод — они позволили исследователям создать помесь двух вирусных штаммов. Актуальность для фундаментальной биологии была упущена.
Только в 1999 году кто-либо обратил внимание на то, чего удалось добиться благодаря сотрудничеству с самими вирусами. В том же году биологи-эволюционисты Пол Тернер, ныне работающий в Йельском университете в Нью-Хейвене, штат Коннектикут, и Лин Чао, ныне работающий в Калифорнийском университете в Сан-Диего, показали, что фаги играют в свою собственную версию стратегической игры «дилемма заключенного», работая в партнерстве под руководством определенных обстоятельствах и действовать в собственных интересах в отношении других 2 .
В том же году биологи-эволюционисты Пол Тернер, ныне работающий в Йельском университете в Нью-Хейвене, штат Коннектикут, и Лин Чао, ныне работающий в Калифорнийском университете в Сан-Диего, показали, что фаги играют в свою собственную версию стратегической игры «дилемма заключенного», работая в партнерстве под руководством определенных обстоятельствах и действовать в собственных интересах в отношении других 2 .
Вирусы, известные как фаги (зеленые), могут лучше заражать клетки, такие как эта бактерия (оранжевые), когда они взаимодействуют и взаимодействуют друг с другом. Фото: AMI Images/Science Photo Library
Далее последовали другие примеры полезных вирусных взаимодействий, в том числе те, в которых участвовали патогены, ответственные за такие заболевания, как гепатит, полиомиелит, корь и грипп. Они часто происходили между различными вирусными штаммами, которые были заинтересованы в повышении своих репродуктивных шансов. Но молекулярная основа этих кооперативных черт — метод общения — в значительной степени оставалась неуловимой. И как отмечает Рафаэль Санхуан, генетик-эволюционист из Университета Валенсии в Испании: «Здесь действительно важно то, как».
И как отмечает Рафаэль Санхуан, генетик-эволюционист из Университета Валенсии в Испании: «Здесь действительно важно то, как».
Вот почему открытие арбитража стало таким большим шагом вперед в этой области.
Почти сразу после того, как Сорек впервые описал это явление, в 2017 году, четыре независимые группы, в том числе группа Ченга и одна под руководством структурного биолога Альберто Марины из Биомедицинского института Валенсии в Испании, приступили к работе, пытаясь выявить молекулярную основу, с помощью которой пептиды арбитрия производятся, ощущаются и действуют фагами.
Технические подробности, изложенные в пяти статьях 3 – 7 за последние девять месяцев помогли точно объяснить, как короткие пептиды, обнаруженные Сореком, влияют на принятие вирусных решений. Однако для Марины это только начало истории: он подозревает, что система связи, вероятно, выполняет гораздо больше функций.
Подозрение Марины основано на находке в одной из этих бумаг 6 . Работая с Хосе Пенадесом, микробиологом из Университета Глазго, Великобритания, Марина показала, что рецептор арбитрия в фаге может взаимодействовать не только с генами бактерии, которые помогают вирусу размножаться, но и с другими, неродственными участками ДНК. . Это означает, что его активность может не ограничиваться решением вируса остаться или уйти. В настоящее время исследователи изучают, влияет ли пептидный язык фага на активность ключевых генов его жертвы. «Если это правда, — говорит Марина, — это сделало бы картину намного больше и интереснее».
Работая с Хосе Пенадесом, микробиологом из Университета Глазго, Великобритания, Марина показала, что рецептор арбитрия в фаге может взаимодействовать не только с генами бактерии, которые помогают вирусу размножаться, но и с другими, неродственными участками ДНК. . Это означает, что его активность может не ограничиваться решением вируса остаться или уйти. В настоящее время исследователи изучают, влияет ли пептидный язык фага на активность ключевых генов его жертвы. «Если это правда, — говорит Марина, — это сделало бы картину намного больше и интереснее».
Развивая свое первоначальное открытие, Сорек обнаружил, что повсюду появляются пептиды арбитрия. Его команда обнаружила по крайней мере 15 различных типов фагов, каждый из которых может инфицировать почвенные микробы и использовать какой-то короткий пептид для коммуникации 8 . Примечательно, что, по словам Сорека, «каждый фаг говорит на своем языке и понимает только свой». Таким образом, вирусная болтовня, по-видимому, эволюционировала, чтобы позволить общение только между близкими родственниками.
Фаги могут говорить только с представителями своего вида, но они также могут слушать и на других языках. Молекулярный биолог Бонни Басслер и ее аспирант Джастин Сильпе обнаружили, что вирусы могут использовать химические вещества, определяющие кворум, выделяемые бактериями, чтобы определить, когда лучше начать размножаться — и убивать 9 . «Фаги подслушивают и захватывают информацию о хосте в своих целях — в данном случае, чтобы убить хоста», — объясняет Басслер.
Это молекулярное отслеживание происходит естественным образом в фагах, инфицирующих бактерию, вызывающую холеру, Vibrio cholerae . Но в своей лаборатории в Принстонском университете в Нью-Джерси Басслер и Сильпе разработали «шпионские» фаги, которые могут воспринимать сигналы, уникальные для других микробов, включая Escherichia coli и 9.0414 Salmonella typhimurium и уничтожить их. По сути, вирусы стали программируемыми убийцами, которых можно было заставить убивать любую бактерию — по желанию и по требованию.
Ради общего блага
Некоторое вирусное сотрудничество, кажется, граничит с альтруизмом. В прошлом году две независимые группы сообщили, что некоторые фаги самоотверженно преодолевают вирусные контрмеры бактерий Pseudomonas 10 , 11 .
Команды — одну возглавлял фаговый биолог Джо Бонди-Деноми из Калифорнийского университета в Сан-Франциско, другую — эксперт CRISPR Эдзе Вестра и вирусолог Стинеке ван Хаут из Эксетерского университета, Великобритания, — наблюдали, как вирусы бомбардируют бактерии специализированными белки, предназначенные для разрушения иммунной защиты клеток на основе CRISPR. Первая волна вирусов атаковала клетки, убивая себя, но также ослабляя бактерии. Первоначальная бомбардировка проложила путь другим, чтобы победить микробного врага. «Эти фаги должны были быть там, и умереть, и произвести анти-CRISPR, прежде чем другой фаг мог прийти и добиться успеха», — говорит Бонди-Деноми.
В последующей работе Вестра и его постдоктор Энн Шеваллеро продемонстрировали, как фаги, лишенные этих анти-CRISPR-белков, могут использовать совместные предложения других фагов, у которых они есть 12 . Для Вестры это показывает потенциально далеко идущие последствия альтруистического поведения среди вирусов. «На популяционном уровне существует множество возникающих свойств, — говорит он. «Очень важно помнить об экологии этих фагов».
Для Вестры это показывает потенциально далеко идущие последствия альтруистического поведения среди вирусов. «На популяционном уровне существует множество возникающих свойств, — говорит он. «Очень важно помнить об экологии этих фагов».
Эти примеры общения и сотрудничества в фагах, вероятно, являются лишь верхушкой социального копья, говорит Ланьинг Цзэн, биофизик из Центра фаговых технологий Техасского университета A&M в Колледж-Стейшн. «Это целая неизведанная область». То же самое касается вирусов, поражающих другие типы клеток, включая клетки животных и человека, которые используют свои собственные социальные трюки.
Возьмем вирус везикулярного стоматита (VSV), который в основном поражает сельскохозяйственных животных, но может вызывать гриппоподобное заболевание и у людей. Частицы этого вирусного патогена подавляют иммунитет хозяина за личный ущерб, но приносят пользу группе, как показали Санхуан и его коллеги 13 . Пока никто не уверен, как происходит это совместное уклонение, но работа подчеркивает, насколько решающим может быть альтруизм для успеха VSV. Это могло бы помочь ученым победить вирус у сельскохозяйственных животных и оптимизировать его для использования в вакцинах и терапевтических средствах.
Это могло бы помочь ученым победить вирус у сельскохозяйственных животных и оптимизировать его для использования в вакцинах и терапевтических средствах.
Другие случаи коллективного действия широко распространены среди болезнетворных вирусов. В полиовирусе, например, несколько генетически различных вирусных штаммов могут слипаться, чтобы обмениваться генными продуктами и усиливать свой потенциал уничтожения человеческих клеток 14 . А два штамма гриппа — один из которых лучше проникает в клетку, а другой — выходит из нее, — растут лучше, когда их содержат в клеточной культуре вместе, чем при раздельном содержании 15 .
Но в реальных условиях, в мазках из носа людей, больных гриппом, два вирусных штамма, похоже, не сосуществовали 16 . Джесси Блум из Онкологического исследовательского центра Фреда Хатчинсона в Сиэтле, штат Вашингтон, который руководил исследованием, считает, что это связано с некоторыми особенностями жизни вируса гриппа — размер его популяции колеблется настолько сильно, что кооперативные частицы имеют небольшой шанс слипнуться. . По его словам, для вирусов, которые не сталкиваются с такими узкими местами при передаче, «в реальных условиях сотрудничество может с большей вероятностью поддерживаться».
. По его словам, для вирусов, которые не сталкиваются с такими узкими местами при передаче, «в реальных условиях сотрудничество может с большей вероятностью поддерживаться».
Именно это обнаружила микроскопист Нихал Алтан-Боннет, изучая передачу ротавируса между детёнышами мышей. Частицы ротавируса могут вместе перемещаться между клетками в пузыревидных везикулах, разделяя ресурсы и скрываясь от иммунной системы хозяина. И, как показали Алтан-Боннет и ее коллеги, частицы становятся более заразными для мышей, когда они находятся внутри этих кооперативных кластеров, чем когда они действуют поодиночке 9.0181 17 .
В настоящее время известно, что многие другие патогенные вирусы, в том числе ответственные за вирус Зика, гепатит, ветряную оспу, норовирус и простуду, также передаются через эти везикулы.
«Эти вирусы очень коварны, — говорит Алтан-Бонне, руководитель Лаборатории динамики хозяин-патоген в Национальном институте сердца, легких и крови США в Бетесде, штат Мэриленд.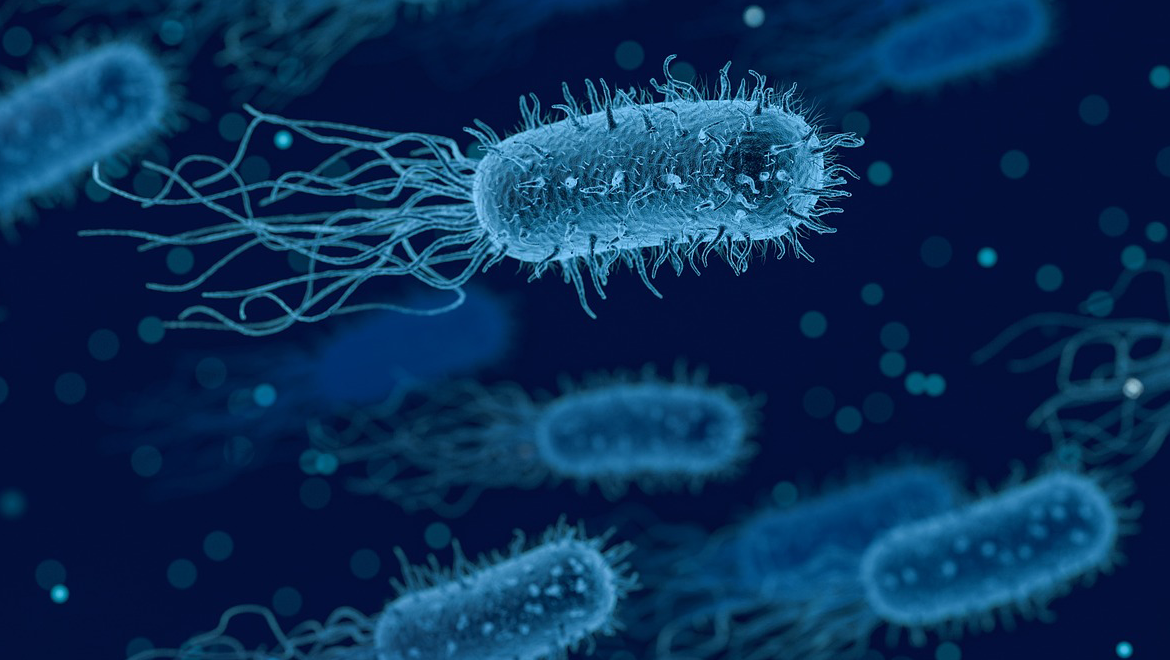 «И мы должны думать о стратегиях, которые разрушают эту кооперативность и кластеризацию вирусов».
«И мы должны думать о стратегиях, которые разрушают эту кооперативность и кластеризацию вирусов».
То есть, если разрушительная сила вирусов не может быть использована во благо. Несколько групп тестируют фаги в качестве средства для лечения бактериальных инфекций, и знание того, как они взаимодействуют друг с другом, может помочь усовершенствовать такие методы лечения, которые имеют долгую историю в медицине, но только начинают использоваться для терапевтического эффекта.
Задействовать фаг
В прошлом месяце, например, исследователи описали первое успешное клиническое использование генетически модифицированных фагов для борьбы с лекарственно-устойчивой бактериальной инфекцией 18 . Конечно, для таких инфекций идеальным решением является использование вируса для полного уничтожения бактерий. Но для состояний, которые отмечены микробным дисбалансом, таких как акне, некоторые виды рака и воспалительные заболевания кишечника, может быть лучше использовать фаг, который может помочь восстановить баланс без тотальной атаки.
А для более тонких приложений точное знание того, как взаимодействуют вирусы, «может быть очень полезным для помощи нам в разработке фагов, которые можно использовать для лечения болезней», — говорит Карен Максвелл, фаговый биолог из Университета Торонто в Канаде. Таким образом, подключение к системе арбитража может привести к более податливым или даже обратимым методам лечения.
Научиться говорить с вирусом может принести и другую терапевтическую пользу. «Это может быть дополнением к набору инструментов синтетической биологии, чтобы помочь точно настроить экспрессию генов бактерий», — говорит Кристофер Альтери, микробиолог из Мичиганского университета в Дирборне.
Сорек, например, взял пептиды arbitrium из их естественной среды обитания в фаге и вставил их в другие организмы, где они действуют как диммеры, которые включают или ослабляют активность генов. В неопубликованной работе он и его аспирант Зоар Эрез вставили механизм арбитража в бактерию 9.0414 Bacillus subtilis , что позволяет им по желанию манипулировать несколькими его генами. Сконструированные микробы однажды можно будет использовать, например, для доставки лекарств в точных дозах или в определенные места.
Сконструированные микробы однажды можно будет использовать, например, для доставки лекарств в точных дозах или в определенные места.
Более того, отмечает Сорек, если арбитриум-подобные системы окажутся консервативными в человеческих вирусах — таких патогенах, как ВИЧ и вирус простого герпеса, которые, подобно фагам, проводят часть своей жизни, прячась в клетках, — то любая коммуникационная молекула, которая вызывает спячку вируса, которая «немедленно становится лекарством».
Каждый продолжающийся научный проект получает «-ологию», и изучение общительных вирусов не исключение. Два года назад Диас-Муньос, Санхуан и биолог-эволюционист Стью Уэст из Оксфордского университета, Великобритания, придумали новый термин — социовирусология — чтобы обеспечить основу для своего направления исследований. Американское общество микробиологии проведет первый в истории семинар, посвященный этой теме, на своем ежегодном собрании в этом месяце в Сан-Франциско. «Это идея, время которой пришло, — говорит Диас-Муньос.
В социовирусологии он видит много параллелей с постепенным принятием сходного группового поведения среди бактерий в прошлые годы: только когда исследователи определили химические вещества, участвующие в ощущении кворума, и дали название этому процессу, большинство микробиологов не обращали на это явление никакого внимания. внимание.
«Это не в сознании», — говорит Диас-Муньос. Но, как и во всех социальных и вирусных вещах, сообщение распространяется.
Ссылки
Эрез, З. и др. Природа 541 , 488–493 (2017).
ПабМед
СтатьяGoogle ученый
Turner, PE & Chao, L. Nature 398 , 441–443 (1999).
ПабМед
СтатьяGoogle ученый
Ван, К. и др. Природа Микробиолог. 3 , 1266–1273 (2018).

ПабМед
СтатьяGoogle ученый
Доу, К. и др. Природа Микробиолог. 3 , 1285–1294 (2018).
ПабМед
СтатьяGoogle ученый
Чжэнь, X. и др. Protein Cell 10 , 131–136 (2019).
ПабМед
СтатьяGoogle ученый
Гальего Дель Соль, Ф., Пенадес, Дж. Р. и Марина, А. Мол. Cell 74 , 59–72.e3 (2019).
ПабМед
СтатьяGoogle ученый
Гуань З. и др. Сотовый Дисков. 5 , 29 (2019).
ПабМед
СтатьяGoogle ученый
Стокар-Авихаил А., Таль Н., Эрез З., Лопатина А. и Сорек Р.
 Микроб-хозяин клетки 25 , 746–755.e5 (2019).
Микроб-хозяин клетки 25 , 746–755.e5 (2019).ПабМед
СтатьяGoogle ученый
Силпе, Дж. Э. и Басслер, Б. Л. Cell 176 , 268–280.e13 (2019).
ПабМед
СтатьяGoogle ученый
Ландсбергер, М. и др. Cell 174 , 908–916.e12 (2018).
ПабМед
СтатьяGoogle ученый
Borges, A. L. et al. Cell 174 , 917–925.e10 (2018).
ПабМед
СтатьяGoogle ученый
Шевальеро, А. и др. . препринт на сайте bioRxiv https://doi.org/10.1101/574418 (2019 г.).
Доминго-Калап П., Сегредо-Отеро Э., Дуран-Морено М. и Санхуан Р. Nature Microbiol .
 4 , 1006–1013 (2019).
4 , 1006–1013 (2019).ПабМед
СтатьяGoogle ученый
Агилера, Э. Р., Эриксон, А. К., Джесудхасан, П. Р., Робинсон, К. М. и Пфайффер, Дж. К. mBio 8 , e02020-16 (2017).
ПабМед
СтатьяGoogle ученый
Сюэ, К. С., Хупер, К. А., Оллодарт, А. Р., Дингенс, А. С. и Блум, Д. Д. eLife 5 , e13974 (2016).
ПабМед
СтатьяGoogle ученый
Сюэ, К.С., Гренингер, А.Л., Перес-Осорио, А. и Блум, Дж.Д. mSphere 3 , e00552-17 (2018).
ПабМед
Google ученый
Сантиана, М. и др. Клеточный микроб-хозяин 24 , 208–220.e8 (2018).
ПабМед
СтатьяGoogle ученый
«>Диас-Муньос, С. Л., Санхуан, Р. и Уэст, С. Клеточный микроб-хозяин 22 , 437–441 (2017).
ПабМед
СтатьяGoogle ученый
Дедрик, Р. М. и др. Природа Мед. 25 , 730–733 (2019).
ПабМед
Статья
Google ученый
Ссылки для скачивания
Вирусы: влияние на науку и общество
- Список журналов
- Коллекция Elsevier для чрезвычайных ситуаций в области общественного здравоохранения
- PMC7833661
Энциклопедия вирусологии. 2021: 671–680.
Опубликовано в сети 1 марта 2021 г. doi: 10.1016/B978-0-12-814515-9. 00075-8
00075-8
PMCID: PMC7833661
Приглашенный редактор(ы): Деннис Х. Бэмфорд и Марк Цукерман
Информация об авторских правах и лицензиях Отказ от ответственности
Мы исследуем взаимосвязь между вирусами и человеческим обществом. После краткого обсуждения этимологии слова «вирус» мы рассмотрим взаимное влияние вирусов и науки, в том числе взаимосвязь между технологическими разработками и открытием вирусов, достижения в других биомедицинских науках, полученные благодаря вирусологии, и примеры использования вирусов для конкретных целей. целей. Затем мы изучаем влияние вирусных заболеваний с точки зрения человеческих потерь от пандемий на протяжении всей истории и до наших дней. В заключение кратко коснемся влияния вирусов на искусство, литературу и массовую культуру.
Ключевые слова: Рак, Клеточная биология, Генные векторы, Влияние на экономику, Молекулярная биология, Смертность, Пандемии, Общество и окружающая среда, Вирус
Когда мы начали писать эту статью в апреле/мае 2020 года, мы были в первая «изоляция» в Великобритании, карантинная мера, принятая в большинстве стран в попытке сдержать экспоненциально распространяющееся вирусное заболевание, которое мы называем COVID-19. Вызванный новым штаммом коронавируса, названным SARS-CoV-2, пандемией COVID-19, которая была впервые обнаружена в Ухане, Китай, в декабре 2019 года., к маю 2020 года вытеснил триллионы долларов с международных рынков и коренным образом изменил наш образ жизни, по крайней мере, на данный момент. Повседневная жизнь и средства к существованию были парализованы обязательными, но, к сожалению, необходимыми карантинными мерами, разлучившими нас с нашими семьями, друзьями и коллегами. Больницы были переполнены, магазины, театры и рестораны закрыты, многие из них уже обанкротились.
Вызванный новым штаммом коронавируса, названным SARS-CoV-2, пандемией COVID-19, которая была впервые обнаружена в Ухане, Китай, в декабре 2019 года., к маю 2020 года вытеснил триллионы долларов с международных рынков и коренным образом изменил наш образ жизни, по крайней мере, на данный момент. Повседневная жизнь и средства к существованию были парализованы обязательными, но, к сожалению, необходимыми карантинными мерами, разлучившими нас с нашими семьями, друзьями и коллегами. Больницы были переполнены, магазины, театры и рестораны закрыты, многие из них уже обанкротились.
Спустя несколько месяцев, когда эта статья будет напечатана (ноябрь 2020 г.), число погибших от COVID-19превысило один миллион, и нет никаких признаков того, что пандемия ослабевает, не говоря уже о завершении. Действительно, некоторые историки медицины утверждают, что окончание эпидемии — это форма коллективной амнезии, превращающая оставшуюся болезнь просто в чью-то проблему. Нынешняя пандемия коронавируса — не первая и, вероятно, не последняя массовая эпидемия вируса, с которой люди столкнулись.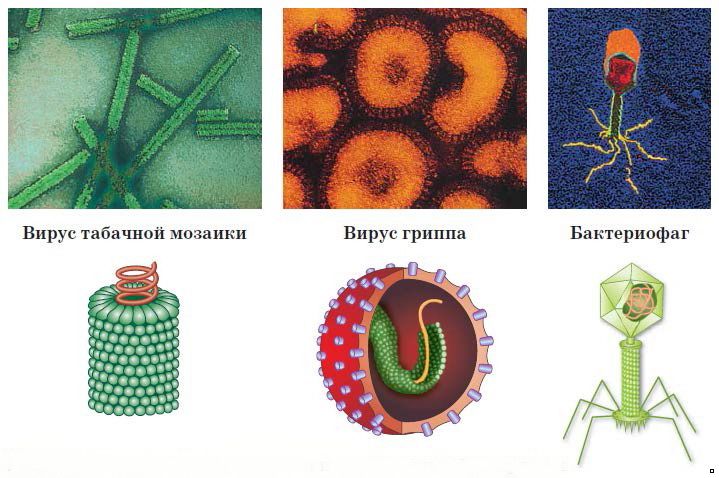 Воздействие вирусов на нашу жизнь предшествовало нашему знанию об их существовании, что проявилось в том, как общества реагировали на вирусные эпидемии, независимо от того, была ли известна причина в то время.
Воздействие вирусов на нашу жизнь предшествовало нашему знанию об их существовании, что проявилось в том, как общества реагировали на вирусные эпидемии, независимо от того, была ли известна причина в то время.
Часто описываемые как объекты, находящиеся на пороге жизни, вирусы встречаются в паразитарных, комменсальных или симбиотических ассоциациях со всем спектром живых организмов от одноклеточных архей и бактерий до растений, животных и человека. В лаборатории они играют двоякую роль: и как объекты исследования, и как экспериментальные инструменты. Они значительно расширили наше понимание не только болезней человека, но и живого мира в целом.
В этой статье мы рассматриваем огромное влияние, прошлое и настоящее (и, несомненно, будущее) вирусов на человека, как в науке, так и в обществе. Признавая, что каждое взаимодействие — это улица с двусторонним движением, мы также отмечаем, как человеческая деятельность — как преднамеренная, например, в том, как мы используем ее в лаборатории, так и неосознанно, через выбор образа жизни — влияет на вирусы. Мы также изучаем, почему современный взаимосвязанный мир мало устойчив к социально-экономическим последствиям появления пандемического вируса.
Мы также изучаем, почему современный взаимосвязанный мир мало устойчив к социально-экономическим последствиям появления пандемического вируса.
Такие выражения, как «стать вирусным», настолько широко используются сегодня, что легко забыть, что вирусы имеют более узкое и точное значение для ученых, чем для широкой публики. В популярном использовании этот термин часто опускается в отношении любого невидимого микроба (к большому раздражению вирусологов), но эта неточность не является серьезной проблемой, если только она не приводит к ненадлежащему лечению вирусных инфекций антибиотиками, нацеленными на бактерии.
Этимология и эволюция значения вируса
Понятие заражения невидимыми агентами, характерными для различных болезней, было изложено Джироламо Фракасторо в 1546 году, а слово ׳virus׳, по-видимому, было импортировано в английский язык из латыни как слово для обозначения яда или яда где-то в шестнадцатом веке. . Одно из самых ранних задокументированных упоминаний содержится в классическом отчете Эдварда Дженнера 1798 года о профилактике оспы. Использование Дженнером слова «вирус» было неточным, и только в конце девятнадцатого века, на волне микробной теории, слово «вирус» стало обозначать тип возбудителя болезни. По мере установления способности бактерий вызывать специфические инфекционные заболевания, например туберкулез, холеру и сибирскую язву, ученые находили и другие инфекционные заболевания, от которых им не удалось выделить бактерии. Двумя самыми ранними примерами были мозаичная болезнь растений табака Дмитрия Ивановского (189 г.).2) и ящур крупного рогатого скота и свиней Фридриха Леффлера и Пауля Фроша (1898). Они по-прежнему считали возбудителей бактериями, только более мелкими, чем известные. Но в 1898 году Мартинус Бейеринк предположил, что возбудитель табачной мозаики (то, что мы сейчас называем вирусом табачной мозаики, ВТМ) отличается от бактерий тем, что его размножение каким-то образом зависит от клеток хозяина. Он описал ВТМ как contagium vivum Fluidum , что на латыни означает «живая растворимая инфекция».
Использование Дженнером слова «вирус» было неточным, и только в конце девятнадцатого века, на волне микробной теории, слово «вирус» стало обозначать тип возбудителя болезни. По мере установления способности бактерий вызывать специфические инфекционные заболевания, например туберкулез, холеру и сибирскую язву, ученые находили и другие инфекционные заболевания, от которых им не удалось выделить бактерии. Двумя самыми ранними примерами были мозаичная болезнь растений табака Дмитрия Ивановского (189 г.).2) и ящур крупного рогатого скота и свиней Фридриха Леффлера и Пауля Фроша (1898). Они по-прежнему считали возбудителей бактериями, только более мелкими, чем известные. Но в 1898 году Мартинус Бейеринк предположил, что возбудитель табачной мозаики (то, что мы сейчас называем вирусом табачной мозаики, ВТМ) отличается от бактерий тем, что его размножение каким-то образом зависит от клеток хозяина. Он описал ВТМ как contagium vivum Fluidum , что на латыни означает «живая растворимая инфекция». Без адекватных методов для проверки идея Бейеринка получила распространение только 30 лет спустя, когда она помогла сделать вирусологию самостоятельной дисциплиной.
Без адекватных методов для проверки идея Бейеринка получила распространение только 30 лет спустя, когда она помогла сделать вирусологию самостоятельной дисциплиной.
Следующие несколько десятилетий стали свидетелями многих открытий вирусов и вирусных заболеваний, а также споров о природе вирусов как живых и неживых организмов. Вирусологические концепции углубились с развитием новых инструментов и методов визуализации и культивирования вирусов, а также с появлением молекулярной биологии, которая дала ученым как новые методы, так и новый язык. В 1950-х годах французский микробиолог Андре Львофф сформулировал современное определение вирусов как «облигатных внутриклеточных паразитов», состоящих из одного типа нуклеиновой кислоты (либо ДНК, либо РНК), заключенных в белковую оболочку.
Вирус как метафора
Самораспространяющееся вредоносное ПО можно назвать «компьютерным вирусом», учитывая, что оно может быстро распространяться с одного компьютера на другой, воспроизводить себя и приводить к вредоносным эпидемиям. Точно так же уместны описания слухов в социальных сетях, которые становятся «вирусными». Они позволяют «патогенным» сущностям, таким как фальшивые новости и теории заговора, прорастать, распространяться и становиться пандемическими, например, SARS-CoV-2, сбежавший из лаборатории бактериологического оружия, или влияние сетей G5 на его распространение. Подобные теории заговора применялись к появлению ВИЧ и других вирусов в прошлом.
Точно так же уместны описания слухов в социальных сетях, которые становятся «вирусными». Они позволяют «патогенным» сущностям, таким как фальшивые новости и теории заговора, прорастать, распространяться и становиться пандемическими, например, SARS-CoV-2, сбежавший из лаборатории бактериологического оружия, или влияние сетей G5 на его распространение. Подобные теории заговора применялись к появлению ВИЧ и других вирусов в прошлом.
Во времена чумы часто возникают мифы об обвинении или отрицании. Сегодня среди сильных мира сего очевидна игра по обвинению вирусов. Что касается отрицания, то бывший президент ЮАР Табо Мбеки убедился в распространенном в сети представлении о том, что ВИЧ не вызывает СПИДа, и считал, что антиретровирусные препараты были уловкой западных фармацевтических компаний для получения прибыли за счет Африки. . Его запрет на предоставление антиретровирусных препаратов, по оценкам, стоил 350 000 жизней.
Отношения между наукой, вирусами и обществом сложны. Наука — это изучение мира природы, в сферу ее компетенции попадают символические вирусы. Но в то время как вирусология стала научной дисциплиной только в двадцатом веке после научных открытий, упомянутых ранее (и рассмотренных Дэвидом Роулендсом в этом сборнике), сами вирусы формировали науку в целом гораздо дольше, так же как они влияли на общество в более широком смысле. Медицинские специальности, такие как эпидемиология и общественное здравоохранение, во многом обязаны своим развитием инфекционным заболеваниям, которые, как теперь известно, вызываются вирусами, как и такие медицинские технологии, как вакцинация. Открытие вирусов стимулировало синергетическое развитие между достижениями в области вирусологии и более широким развитием науки и техники.
Наука — это изучение мира природы, в сферу ее компетенции попадают символические вирусы. Но в то время как вирусология стала научной дисциплиной только в двадцатом веке после научных открытий, упомянутых ранее (и рассмотренных Дэвидом Роулендсом в этом сборнике), сами вирусы формировали науку в целом гораздо дольше, так же как они влияли на общество в более широком смысле. Медицинские специальности, такие как эпидемиология и общественное здравоохранение, во многом обязаны своим развитием инфекционным заболеваниям, которые, как теперь известно, вызываются вирусами, как и такие медицинские технологии, как вакцинация. Открытие вирусов стимулировало синергетическое развитие между достижениями в области вирусологии и более широким развитием науки и техники.
Влияние науки и техники на вирусологию
Распространение вирусологии во многом связано с изобретением и разработкой новых приборов и лабораторных методов. Многие из этих инструментов пришли из дисциплин, выходящих за рамки биологии; из биофизических и инженерных наук и из аналитической химии. Здесь тоже была синергия, поскольку вирусы стимулировали усовершенствование лабораторных методов, а также дизайн приборов.
Здесь тоже была синергия, поскольку вирусы стимулировали усовершенствование лабораторных методов, а также дизайн приборов.
Именно разработка Чарльзом Чемберлендом в 1884 году усовершенствованных бактериологических фильтров, первоначально предназначенных для очистки воды, позволила открыть ВТМ и вирус ящура. Уточнение фильтрации, точнее ультрафильтрации, также дало средства для определения размера вирусных частиц. Например, британский физико-химик Уильям Элфорд разработал серию фильтров с разным размером пор для определения размеров ряда различных вирусов.
Элфорд также сыграл новаторскую роль в использовании ультрацентрифуги, изобретенной в 1925 году Теодором Сведбергом в Швеции, которая позволяла разделять и концентрировать вирусные частицы различной плотности. Ультрацентрифугирование стало широко использоваться как в качестве аналитического, так и в качестве подготовительного инструмента в вирусологии, что, в свою очередь, привело к инновациям в конструкции приборов будущих поколений. В 1936 году американский физико-химик Уэнделл Стэнли использовал ультрацентрифугирование для концентрирования и очистки ВТМ. Он успешно кристаллизовал очищенный ВТМ и использовал рентгеновскую кристаллографию, чтобы определить его структуру, думая, что он содержит только белок, но Фредерик Боуден, Норман Пири и их коллеги вскоре раскрыли его важнейшее РНК-ядро. Как позже заметил Боуден, «до 1936 молчаливо предполагалось, что все вирусов были несжимаемыми сферами». Игольчатые кристаллы ВТМ показали обратное.
В 1936 году американский физико-химик Уэнделл Стэнли использовал ультрацентрифугирование для концентрирования и очистки ВТМ. Он успешно кристаллизовал очищенный ВТМ и использовал рентгеновскую кристаллографию, чтобы определить его структуру, думая, что он содержит только белок, но Фредерик Боуден, Норман Пири и их коллеги вскоре раскрыли его важнейшее РНК-ядро. Как позже заметил Боуден, «до 1936 молчаливо предполагалось, что все вирусов были несжимаемыми сферами». Игольчатые кристаллы ВТМ показали обратное.
Самые драматические изменения были вызваны изобретением и развитием электронного микроскопа, точно так же, как оптический микроскоп сделал для бактерий в семнадцатом веке, который, по словам Роберта Гука, «открыл совершенно новый невидимый мир, открытый разуму». . Первый электронный микроскоп был разработан в 1931 году Эрнстом Руской, немецким инженером-электриком, и именно его брат Гельмут Руска, в то время студент-медик, понял потенциал новой технологии в биомедицине. Он занимался визуализацией «субмикроскопических возбудителей болезней» и в 1919 году получил первые электронно-микроскопические изображения поксвирусов.38. Электронная микроскопия оказалась особенно синергичной с вирусологией; хотя он был лучшим в визуализации вирусов, он также выиграл от этого, особенно в областях подготовки образцов и технологии окрашивания (
Он занимался визуализацией «субмикроскопических возбудителей болезней» и в 1919 году получил первые электронно-микроскопические изображения поксвирусов.38. Электронная микроскопия оказалась особенно синергичной с вирусологией; хотя он был лучшим в визуализации вирусов, он также выиграл от этого, особенно в областях подготовки образцов и технологии окрашивания (
).
Открыть в отдельном окне
Электронная микрофотография частицы вируса коронавируса обычной простуды человека (диаметр ~100 нм) изолята B814, сделанная Джун Алмейда в 1966 году с использованием новой техники «негативного окрашивания». Именно «характерная бахрома выступов округлой или лепестковой формы, напоминающая солнечную корону», привела к тому, что в 1919 году для этого семейства было принято название «Коронавирус».68. Эти проекции изображают оболочечный гликопротеин «S».
Воспроизведено с разрешения Общества микробиологии. Из Almeida, JD, Tyrrell, DAH, 1967. Морфология трех ранее не охарактеризованных респираторных вирусов человека, которые растут в органной культуре. Журнал общей вирусологии 1 (2), 175–178.
Журнал общей вирусологии 1 (2), 175–178.
Хотя кристаллизация и электронная микроскопия дали ученым представление о физических и химических свойствах вирусов, они дали мало информации об их поведении и биологии. Самым большим препятствием в этой области была неспособность ученых изолировать и размножать вирусы в лаборатории так, как они могли бы это делать с бактериями, потому что, как мы теперь знаем, вирусы — это облигатные паразиты, которым для размножения нужна живая клетка-хозяин. С уже используемой техникой посева газонов бактерий в чашки Петри первыми вирусами, успешно культивируемыми в лаборатории, были бактериофаги, признанные по способности образовывать дискретные прозрачные бляшки из лизированных бактерий. Серийное разведение «фага» позволяло проводить точное титрование и биологическое клонирование, как и титрование ВТМ на листьях. Культивирование вирусов животных оказалось более трудным до тех пор, пока Эрнест Гудпасчер в США и Макфарлейн Бернет в Австралии не размножили вирусы на хорио-аллантоисной мембране птичьих эмбрионов. Размножение вируса в клеточных культурах было впервые использовано для вируса полиомиелита Джоном Эндерсом, Томасом Веллером и Фредериком Роббинсом в 1949.
Размножение вируса в клеточных культурах было впервые использовано для вируса полиомиелита Джоном Эндерсом, Томасом Веллером и Фредериком Роббинсом в 1949.
Чтобы проиллюстрировать все более быстрый темп развития технологий в вирусологии, давайте рассмотрим появление новых патогенных вирусов за последние 40 лет. После появления СПИДа в 1981 году потребовалось два года, чтобы идентифицировать вирус, ВИЧ-1, и еще год, чтобы с помощью независимых исследований убедить мир в том, что истинный виновник действительно найден. Еще 18 месяцев привели к внедрению диагностических тестов, основанных на серологии, а также к клонированию и секвенированию генома ВИЧ-1. Нам пришлось ждать разработки метода полимеразной цепной реакции (ПЦР) для мониторинга вирусной нагрузки у пациентов. Противовирусная терапия ВИЧ-1 стала эффективной только в 1996 с введением комбинации препаратов, направленных более чем на одну стадию репликационного цикла.
Когда в 2003 году появился SARS, потребовалось менее 2 месяцев, чтобы охарактеризовать вирус как члена семейства коронавирусов, тогда как в январе 2020 года китайские ученые получили полную генетическую последовательность SARS-CoV-2 от пациента с COVID-19. в течение 2 дней. Они разработали надежный ПЦР-тест для выявления инфекции в течение недели, хотя диагностические тесты на антигены и антитела SARS-CoV-2 заняли немного больше времени, особенно при крупномасштабном использовании. Псевдотипические вирусы, основанные на ретровирусных или рабдовирусных векторах, включающих репортерные гены, которые несут гликопротеин «S» (шип) оболочки SARS-CoV-2, обеспечивают высокочувствительные и специфичные анализы нейтрализации вируса без необходимости в помещениях высокого уровня сдерживания. Они используются для изучения наличия у выздоровевших пациентов защитного иммунитета и в качестве предварительного испытания вакцин на основе реакции антител.
в течение 2 дней. Они разработали надежный ПЦР-тест для выявления инфекции в течение недели, хотя диагностические тесты на антигены и антитела SARS-CoV-2 заняли немного больше времени, особенно при крупномасштабном использовании. Псевдотипические вирусы, основанные на ретровирусных или рабдовирусных векторах, включающих репортерные гены, которые несут гликопротеин «S» (шип) оболочки SARS-CoV-2, обеспечивают высокочувствительные и специфичные анализы нейтрализации вируса без необходимости в помещениях высокого уровня сдерживания. Они используются для изучения наличия у выздоровевших пациентов защитного иммунитета и в качестве предварительного испытания вакцин на основе реакции антител.
Секвенирование ДНК стало еще более производительным. В 1987 году получение полной последовательности ДНК генома человеческого цитомегаловируса размером 150 тыс. пар оснований считалось большим достижением. Сравните это с сегодняшним днем, когда группе из 1000 пациентов с COVID и здоровых людей секвенируют общий геном хозяина, чтобы выявить возможные генетические факторы риска и выяснить, инфицированы ли более тяжело пораженные люди более вирулентными вариантами SARS-CoV-2. .
.
Вирусология извлекла пользу из достижений вычислительных наук, таких как биоинформатика, анализ последовательностей, «большие данные» и математическое моделирование. Наука отслеживания и вмешательства в ход эпидемий с использованием математических моделей всерьез зародилась в 1760 году, когда швейцарский математик Даниэль Бернулли показал, как крупномасштабная вариоляция против оспы принесет пользу не только отдельному человеку, но и всему населению в целом, что положило начало концепции коллективного иммунитета. Если бы врачи, присутствовавшие на его лекции во Французской академии, прислушались к его словам, Людовик XV и многие придворные в Версале, возможно, не заболели бы оспой во время эпидемии в мае 1774 года.0003
Воздействие вирусов на науку
Благодаря своим уникальным характеристикам вирусы оказали огромное влияние на достижения в биологии и медицине, используя их как крошечные точные инструменты для выявления внутренней работы клеток, которые они заражают. Одним приблизительным показателем воздействия вирусов на науку можно считать количество Нобелевских премий, присужденных в области медицины и физиологии и химии, до открытий, сделанных в отношении вирусов и с их помощью.
Одним приблизительным показателем воздействия вирусов на науку можно считать количество Нобелевских премий, присужденных в области медицины и физиологии и химии, до открытий, сделанных в отношении вирусов и с их помощью.
).
Таблица 1
Нобелевские премии, присуждаемые за открытия, связанные с вирусами
| Year | Name | Discovery |
|---|---|---|
| 1946 | Wendell M Stanley a | Crystallization of tobacco mosaic virus |
| 1951 | Max Theiler | Development of yellow fever вирусная вакцина |
| 1954 | John F Enders | Рост вируса полиомиелита в различных типах клеточных культур |
| Thomas H Weller | ||
| Frederick C Robbins | ||
| 1958 | Joshua Lederberg | Genetic recombination of phage and bacteria |
| 1965 | François Jacob | Genetic control of enzyme and virus synthesis |
| Андре Львофф | ||
| Жак Моно | ||
| 1966 | Пейтон Роус | Открытие вирусов, вызывающих опухоли |
| 1969 | Max Delbrück | Replication and genetic structure of viruses (phage) |
| Alfred D Hershey | ||
| Salvador D Luria Renato Dulbecco | ||
| 1975 | David Baltimore | Обратная транскриптаза и взаимодействие опухолевого вируса с геномом хозяина |
| Renato Dulbecco | ||
| Howard M Temin | ||
| 1976 | Baruch Blumberg | Discovery of hepatitis B virus |
| D Carleton Gajdusek | Transmission of spongiform encephalopathy | |
| 1978 | Werner Arber | DNA restriction enzyme defense against phage infection |
| Дэниел Натанс | ||
| Гамильтон О Смит | ||
| 1982 | Аарон Клуг a | Crystallographic electron microscopy of viruses |
| 1989 | J Michael Bishop | Cellular origin of retroviral oncogenes |
| Harold E Varmus | ||
| 1992 | Richard J Roberts | Split genes и сплайсинг РНК |
| Philip A Sharp | ||
| 1996 | Peter C Doherty | Специфичность клеточно-опосредованного иммунитета к вирусам |
| Rolf M Zinkernagel | ||
| 2006 | Andrew Z Fire | RNA interference and gene silencing by double-stranded viral RNA |
| Craig C Mello | ||
| 2008 | Harald zur Hausen | Открытие вирусов папилломы человека, вызывающих рак шейки матки |
| Françoise Barré-Sinoussi | Выявление вируса иммунодефицита человека | |
| Luc Montagnier | ||
| 2018 | George Smith a | Phage display of peptides and antibodies |
| Gregory Winter a | ||
| 2020 | Harvey J. Alter Alter | Открытие вируса гепатита С |
| Michael Houghton | ||
| Charles M Rice | ||
| 20200802 | Emmanuelle Charpentier a | Development of Genome Editing |
| Jennifer A Doudna a |
Open in a separate window
a Nobel Prize in Chemistry; все остальные в физиологии или медицине.
Ведущими научными инструментами были бактериофаги, на которые обратил внимание физик, ставший биологом, Макс Дельбрюк как на средство изучения генов на индивидуальном и молекулярном уровне. Вместе с Сальвадором Лурией и Альфредом Чейзом Дельбрюк создал знаменитую «Американскую группу фагов», которая на протяжении 1940-е годы заложили основы современной молекулярной биологии и подготовили почву для исследований в области репликации ДНК, рекомбинации и изучения белков. Тем временем Андре Львофф и его коллеги из Института Пастера в Париже изучали другую группу бактериальных вирусов, известных как лизогенные или умеренные фаги, которые могут сохраняться в латентной форме внутри бактерии-хозяина. Литические и лизогенные фаги сыграли решающую роль в выделении вирусов из других реплицирующихся объектов. Жак Моно и Франсуа Жакоб использовали фаги для изучения механизмов генетической регуляции и установили большую часть наших базовых знаний об универсальных правилах репликации, транскрипции и трансляции.
Вместе с Сальвадором Лурией и Альфредом Чейзом Дельбрюк создал знаменитую «Американскую группу фагов», которая на протяжении 1940-е годы заложили основы современной молекулярной биологии и подготовили почву для исследований в области репликации ДНК, рекомбинации и изучения белков. Тем временем Андре Львофф и его коллеги из Института Пастера в Париже изучали другую группу бактериальных вирусов, известных как лизогенные или умеренные фаги, которые могут сохраняться в латентной форме внутри бактерии-хозяина. Литические и лизогенные фаги сыграли решающую роль в выделении вирусов из других реплицирующихся объектов. Жак Моно и Франсуа Жакоб использовали фаги для изучения механизмов генетической регуляции и установили большую часть наших базовых знаний об универсальных правилах репликации, транскрипции и трансляции.
Вирусолог Хайнц Френкель-Конрат метко окрестил ВТМ «почти всегда первым» в вирусологии, первым, как уже упоминалось, кристаллизовавшимся и главным игроком в коммерческом развитии ультрацентрифуг и электронного микроскопа. Вирусология животных также привела к важным открытиям в других областях, таких как внутренняя работа клеток и генов. Расщепленные гены с интронами и сплайсинг РНК были обнаружены в 1977 году в ходе исследований, проведенных Филиппом Шарпом и Ричардом Робертсом транскрипции аденовируса человека типа 2. Вирусы с оболочкой, такие как ДНК-вирус, осповакцина, и РНК-вирусы, такие как вирус гриппа и альфавирусы ( Вирусы Semliki Forest и Sindbis) были отличными инструментами, которые финский вирусолог Ари Хелениус и другие использовали для исследования эндоцитоза, слияния мембран, конформационных изменений, секреторных путей и посттрансляционной модификации белков, таких как гликозилирование. Парамиксовирусы, такие как вирус Сендай, которые проникают в клетки через клеточную поверхность, а не посредством рецептор-опосредованного эндоцитоза, использовались для осуществления межклеточного слияния путем инактивации генома РНК, не влияя на функцию гликопротеина оболочки. Инактивированный вирус Сендай был использован для слияния клеток человека с клетками мыши Джоном Уоткинсом и Генри Харрисом в новаторских исследованиях генетики соматических клеток человека.
Вирусология животных также привела к важным открытиям в других областях, таких как внутренняя работа клеток и генов. Расщепленные гены с интронами и сплайсинг РНК были обнаружены в 1977 году в ходе исследований, проведенных Филиппом Шарпом и Ричардом Робертсом транскрипции аденовируса человека типа 2. Вирусы с оболочкой, такие как ДНК-вирус, осповакцина, и РНК-вирусы, такие как вирус гриппа и альфавирусы ( Вирусы Semliki Forest и Sindbis) были отличными инструментами, которые финский вирусолог Ари Хелениус и другие использовали для исследования эндоцитоза, слияния мембран, конформационных изменений, секреторных путей и посттрансляционной модификации белков, таких как гликозилирование. Парамиксовирусы, такие как вирус Сендай, которые проникают в клетки через клеточную поверхность, а не посредством рецептор-опосредованного эндоцитоза, использовались для осуществления межклеточного слияния путем инактивации генома РНК, не влияя на функцию гликопротеина оболочки. Инактивированный вирус Сендай был использован для слияния клеток человека с клетками мыши Джоном Уоткинсом и Генри Харрисом в новаторских исследованиях генетики соматических клеток человека.
Лишь в 1950-х годах Ренато Дульбекко и Маргерит Фогт разработали анализ бляшек на литические вирусы на монослоях клеток животных под слоем агарового геля. С середины 1960-х по 1980-е годы онкогенные вирусы играли ведущую роль в открытии молекулярной биологии рака, включая открытие онкогенов, которые способствуют развитию злокачественных новообразований, и генов-супрессоров опухолей, которые контролируют его. Вирус саркомы Рауса (RSV), прототип ретровируса, был обнаружен Пейтоном Роусом в 1911, но он в значительной степени игнорировался экспертами по раку в течение многих десятилетий, которые не верили, что агент был вирусом, пока в 1958 году Гарри Рубин и Говард Темин не разработали анализ трансформации клеток RSV in vitro. Таким образом, онкогенные вирусы начали раскрывать свои секреты, включая обратную транскриптазу в 1970 году, интеграцию вирусных геномов в ДНК хозяина и идентификацию вирусных генов с онкогенным потенциалом. Обратная транскрипция позволила синтезировать комплементарную ДНК из сплайсированной матричной РНК и, следовательно, привела к производству бактериями эукариотических белков и биологических фармацевтических препаратов.
Клеточное происхождение онкогенов — генов, индуцирующих опухоли, — было впервые обнаружено Гарольдом Вармусом, Майклом Бишопом и их коллегами с помощью трансформирующего гена src RSV, и его генный продукт стал первой известной тирозинкиназой. Гомологи большинства из 30 или более онкогенов, обнаруженных в различных онкогенных ретровирусах животных, например, abl, myc, ras , играют важную роль в сигнальных путях рака. Некоторые из них стали успешными мишенями для противораковой терапии. И наоборот, открытие эндогенных провирусов в зародышевой линии кур и мышей привело к осознанию того, что значительная часть геномов позвоночных-хозяев представлена «ископаемыми» ретровирусами; примерно 8% ДНК человека составляют ретровирусные геномы, некоторые из которых были перепрофилированы хозяином для важных функций, таких как развитие плаценты.
Еще одной важной вехой в области онкогенных вирусов стало открытие белка-супрессора опухолей (TSp53) в клетках, трансформированных обезьяньим вирусом 40 (SV40). В 1979 году Дэвид Лейн и Лайонел Кроуфорд в Лондоне сообщили, что иммунопреципитация большого Т (опухолевого) антигена, кодируемого трансформирующим геном SV40, также приводит к снижению белка-хозяина массой 53 кДа. Даниэль Линцер и Арнольд Левин сообщили о сходных данных, и стало ясно, что Т-антиген блокирует естественную функцию р53, регулирующую клеточное деление и направляющую клетки на путь апоптоза. TSp53 стал «каноническим» супрессором опухоли, который Лейн назвал «хранителем генома». Мутации гена р53 при раке человека имеют эффект, аналогичный его секвестрации Т-антигеном. Многие другие типы онкогенных ДНК-вирусов кодируют белки, которые блокируют функцию TSp53, такие как Е6 ВПЧ и латентный ядерный антиген вируса саркомы Капоши. Выключение функции TSp53 запускает фазу «S» цикла клеточного деления, которая необходима вирусам для синтеза собственной ДНК.
В 1979 году Дэвид Лейн и Лайонел Кроуфорд в Лондоне сообщили, что иммунопреципитация большого Т (опухолевого) антигена, кодируемого трансформирующим геном SV40, также приводит к снижению белка-хозяина массой 53 кДа. Даниэль Линцер и Арнольд Левин сообщили о сходных данных, и стало ясно, что Т-антиген блокирует естественную функцию р53, регулирующую клеточное деление и направляющую клетки на путь апоптоза. TSp53 стал «каноническим» супрессором опухоли, который Лейн назвал «хранителем генома». Мутации гена р53 при раке человека имеют эффект, аналогичный его секвестрации Т-антигеном. Многие другие типы онкогенных ДНК-вирусов кодируют белки, которые блокируют функцию TSp53, такие как Е6 ВПЧ и латентный ядерный антиген вируса саркомы Капоши. Выключение функции TSp53 запускает фазу «S» цикла клеточного деления, которая необходима вирусам для синтеза собственной ДНК.
Использование вирусов людьми
В этом разделе мы приводим примеры того, как люди использовали или пытались использовать вирусы не только для экономических и медицинских целей, но и для более темных целей.
Коммерция и тюльпаномания
По сравнению с многовековой индустрией брожения, основанной на бактериях и дрожжах (подумайте о вине, пиве и хлебе), использование вирусов в коммерческих целях все еще находится в зачаточном состоянии. Единственным исключением было невольное использование в семнадцатом веке растительных вирусов для выведения сортов тюльпанов с различной пестротой цветков. Тюльпаномания в Нидерландах привела к продаже отдельных луковиц тюльпанов по ценам, в 10 раз превышающим средний годовой заработок фермеров. В феврале 1637 года рынок внезапно рухнул, разорив многих бизнесменов, вложивших средства в «фьючерсы» на тюльпаны. Самые ценные тюльпаны было трудно последовательно размножать, потому что рисунок «разрывов» цвета на лепестках был неустойчивым. Теперь мы знаем, что полосатость дорогих тюльпанов вызвана Potyvirus, вирусом, разрушающим тюльпаны, обнаруженным в 1928 Дороти Кейли.
Вакцины
Разработка вакцин как средства предотвращения вирусных заболеваний является одним из наиболее известных и старых примеров использования вирусов людьми. Как и в случаях ферментации и садоводства, упомянутых выше, практика предшествует фактическому знанию о существовании эффектора. Английский врач Эдвард Дженнер разработал первую безопасную вакцину против оспы, которая была основана на том факте, что коровья оспа вызывает легкое поражение при введении в кожу неинфицированных людей, но перекрестно защищает их от самой оспы. Это был большой шаг вперед по сравнению с ранее применявшейся иммунизацией низкими дозами самого вируса натуральной оспы (возбудителя оспы), который имел 2-процентный риск вызвать оспу. Живые аттенуированные вирусы, такие как полиомиелитная вакцина Сэбина, как правило, эффективны, потому что, хотя вирус размножается на более низком уровне, чем вирус дикого типа, его достаточно, чтобы вызвать иммунитет, не вызывая заболевания. Другие вирулентные вирусы могут вызывать защитный иммунный ответ после того, как они были химически инактивированы, например вакцина Солка против полиомиелита. Вакцины против вируса гриппа обычно состоят из иммуногенных компонентов разобранных вирусных антигенов.
Как и в случаях ферментации и садоводства, упомянутых выше, практика предшествует фактическому знанию о существовании эффектора. Английский врач Эдвард Дженнер разработал первую безопасную вакцину против оспы, которая была основана на том факте, что коровья оспа вызывает легкое поражение при введении в кожу неинфицированных людей, но перекрестно защищает их от самой оспы. Это был большой шаг вперед по сравнению с ранее применявшейся иммунизацией низкими дозами самого вируса натуральной оспы (возбудителя оспы), который имел 2-процентный риск вызвать оспу. Живые аттенуированные вирусы, такие как полиомиелитная вакцина Сэбина, как правило, эффективны, потому что, хотя вирус размножается на более низком уровне, чем вирус дикого типа, его достаточно, чтобы вызвать иммунитет, не вызывая заболевания. Другие вирулентные вирусы могут вызывать защитный иммунный ответ после того, как они были химически инактивированы, например вакцина Солка против полиомиелита. Вакцины против вируса гриппа обычно состоят из иммуногенных компонентов разобранных вирусных антигенов. Некоторые из текущих попыток разработать вакцину против SARS-CoV-2 нацелены на гликопротеин шипа «S».
Некоторые из текущих попыток разработать вакцину против SARS-CoV-2 нацелены на гликопротеин шипа «S».
Несмотря на то, что вакцинация привела к огромным достижениям в области общественного здравоохранения для защиты от многих инфекционных заболеваний, в последние годы наблюдается рост антагонизма к детским прививкам, таким как комбинированная вакцина против кори, эпидемического паротита и краснухи. Страх родителей подпитывается фальшивыми новостями об опасности вакцин и ложными ассоциациями вакцин с другими заболеваниями. К сожалению, эта ситуация привела к ненужным вспышкам кори и эпидемического паротита в развитых странах.
Фаговая терапия
Когда д’Эрелль впервые наблюдал литическое действие бактериофагов на бактерии в 1916 году, он сразу же предусмотрел их использование для борьбы с бактериальными заболеваниями, назвав свое открытие «настоящим микробом иммунитета». устойчивость населения к таким болезням, как дизентерия и холера в регионах мира, где эти заболевания были эндемичными, сохраняя интерес на протяжении всей своей карьеры. Фаговая терапия поначалу привлекла к себе широкое внимание, подстегнув воображение даже американского писателя Синклера Льюиса, который включил фаги в свой роман, получивший Пулитцеровскую премию, Эроусмит . Фаговая терапия практически исчезла на Западе после Второй мировой войны из-за большей эффективности и надежности антибиотиков, но в мире до антибиотиков в 1930-х и начале 1940-х годов различные продукты бактериофагов были коммерчески доступны во многих странах. Он продвигался в Советском Союзе и продолжается в Институте бактериофагов, микробиологии и вирусологии имени Элиавы, который д’Эрелль помог основать в Тбилиси, Грузия. В последнее время появление устойчивых к антибиотикам бактериальных патогенов стимулировало возрождение интереса к фаготерапии, хотя бактерии могут стать устойчивыми как к фагам, так и к антибиотикам.
Фаговая терапия поначалу привлекла к себе широкое внимание, подстегнув воображение даже американского писателя Синклера Льюиса, который включил фаги в свой роман, получивший Пулитцеровскую премию, Эроусмит . Фаговая терапия практически исчезла на Западе после Второй мировой войны из-за большей эффективности и надежности антибиотиков, но в мире до антибиотиков в 1930-х и начале 1940-х годов различные продукты бактериофагов были коммерчески доступны во многих странах. Он продвигался в Советском Союзе и продолжается в Институте бактериофагов, микробиологии и вирусологии имени Элиавы, который д’Эрелль помог основать в Тбилиси, Грузия. В последнее время появление устойчивых к антибиотикам бактериальных патогенов стимулировало возрождение интереса к фаготерапии, хотя бактерии могут стать устойчивыми как к фагам, так и к антибиотикам.
Генная терапия и терапия рака
С момента появления технологии рекомбинантной ДНК исследователи-медики использовали вирусы в качестве векторов или носителей для доставки специфических генов в клетки-мишени в качестве возможного средства терапии наследственных заболеваний с одним геном, таких как муковисцидоз, а также для лечения рака. Векторы, такие как вирус коровьей оспы и ретровирусы, также могут быть сконструированы так, чтобы нести гены, кодирующие антигены различных вирусов или других патогенов для иммунизации. Рекомбинантные вирусы, такие как аденоассоциированный вирус, могут экспрессировать высокие уровни антител в качестве средств проведения пассивной иммунотерапии. Литические вирусы могут быть модифицированы для репликации только в пролиферирующих клетках для лечения рака. Все эти подходы являются недавними разработками и, вероятно, окажут большее влияние на здоровье человека в будущем.
Векторы, такие как вирус коровьей оспы и ретровирусы, также могут быть сконструированы так, чтобы нести гены, кодирующие антигены различных вирусов или других патогенов для иммунизации. Рекомбинантные вирусы, такие как аденоассоциированный вирус, могут экспрессировать высокие уровни антител в качестве средств проведения пассивной иммунотерапии. Литические вирусы могут быть модифицированы для репликации только в пролиферирующих клетках для лечения рака. Все эти подходы являются недавними разработками и, вероятно, окажут большее влияние на здоровье человека в будущем.
Биологическое оружие
Использование вирусов для ведения биологической войны плохо задокументировано. Оспа могла быть преднамеренно распространена Франсиско Пиццаро во время завоевания империи инков, потому что ее непреднамеренное воздействие на ацтеков было отмечено 11 годами ранее. Одна запись об использовании вирусов в конфликте произошла во время франко-британской войны за контроль над Северной Америкой. Различные общины коренных американцев встали на сторону французов или англичан. Полковник в красных мундирах Генри Буке направил своему командиру, генералу лорду Джеффри Амхерсту, просьбу «привить индейцев», отправив им пропитанные оспой одеяла, которые под руководством вождя Понтиака осаждали форт Питт (Питтсбург). В постскриптуме к своему ответу от 16 июля 1763 года Амхерст одобрил эту просьбу и добавил, что Буке должен «испробовать все методы, которые могут служить для искоренения этой отвратительной расы».
Различные общины коренных американцев встали на сторону французов или англичан. Полковник в красных мундирах Генри Буке направил своему командиру, генералу лорду Джеффри Амхерсту, просьбу «привить индейцев», отправив им пропитанные оспой одеяла, которые под руководством вождя Понтиака осаждали форт Питт (Питтсбург). В постскриптуме к своему ответу от 16 июля 1763 года Амхерст одобрил эту просьбу и добавил, что Буке должен «испробовать все методы, которые могут служить для искоренения этой отвратительной расы».
250 лет спустя мы иначе взглянем на многонациональные США! В 2016 году студенческие активисты Амхерстского колледжа потребовали удалить имя Джеффри Амхерста. Попечители Амхерст-колледжа отклонили вопрос о названии колледжа, заявив, что колледж назван в честь города, а не генерала. Однако они убрали талисман колледжа «Лорд Джефф» и изменили название «Lord Jeff Inn» на территории кампуса.
В двадцатом веке большинство потенциальных бактериологических агентов были бактериальными, такими как сибирская язва и туляремия, но оказывается, что нацистский режим также испытывал высокопатогенные вирусы на жертвах концлагерей. Институт Фридриха Леффлера на острове Римс в Балтийском море, основанный в 1910 первооткрывателя вируса ящура, стал испытательным полигоном для биологического оружия во время Второй мировой войны, но теперь посвящен исследованиям и разработкам вакцин. В Советском Союзе под Новосибирском в Сибири был завод по производству биологического оружия. Остров Возрождения, который раньше был Аральским морем, был полигоном для испытаний биологического оружия до распада Советского Союза и остается загрязненным.
Институт Фридриха Леффлера на острове Римс в Балтийском море, основанный в 1910 первооткрывателя вируса ящура, стал испытательным полигоном для биологического оружия во время Второй мировой войны, но теперь посвящен исследованиям и разработкам вакцин. В Советском Союзе под Новосибирском в Сибири был завод по производству биологического оружия. Остров Возрождения, который раньше был Аральским морем, был полигоном для испытаний биологического оружия до распада Советского Союза и остается загрязненным.
После искоренения оспы как природной инфекции велись споры об уничтожении оставшихся запасов вируса, официально хранящихся в России (в Новосибирске) и в США (в Центрах по контролю и профилактике заболеваний – CDC – в Атланте). В 1996, в 200-летие первой вакцинации Дженнером молодого Джеймса Фиппса, Всемирная организация здравоохранения проголосовала за уничтожение всех официальных лабораторных запасов вируса оспы, но это преднамеренное вымирание вида еще не осуществлено. Этот вопрос остается спорным среди вирусологов, некоторые из которых говорят, что сохранение рекомендуется для будущей работы над вакцинами или любыми новыми вирусами оспы, которые могут появиться, в то время как другие утверждают, что при наличии данных о полных геномных последовательностях натуральной оспы в открытом доступе нет нужно сохранить сам вирус.
Неясно, обладают ли какие-либо террористические организации или «страны-изгои» опасными вирусами, такими как оспа или вирус конго-крымской геморрагической лихорадки (часто смертельный ортонейровирус), который естественным образом передается клещами животных, но может также распространяться среди людей через телесные жидкости и аэрозоли. Неофициальные запасы вируса оспы могут все еще существовать, либо они скрыты злонамеренными лицами, либо просто упущены из виду. Примером последнего является обнаружение в 2016 году флаконов с вирусом натуральной оспы в морозильной камере Национального института здравоохранения США в Бетесде, штат Мэриленд, которые впоследствии были отправлены в CDC.
Возможно, было бы уместно назвать этот раздел «воздействие вирусов на других аспектов общества», потому что наука, в конце концов, во многом является человеческой деятельностью и, следовательно, частью общества. Здесь мы рассматриваем воздействие вирусов за пределы лаборатории. Несомненно, наиболее узнаваемым воздействием вирусов является их способность вызывать эпидемические заболевания. Хотя наше основное внимание здесь будет сосредоточено на болезнях человека, мы также коснемся вирусных патогенов домашнего скота и сельскохозяйственных культур, прежде чем закончить кратким рассмотрением влияния вирусов на другие сферы человеческой деятельности, особенно на искусство и литературу.
Хотя наше основное внимание здесь будет сосредоточено на болезнях человека, мы также коснемся вирусных патогенов домашнего скота и сельскохозяйственных культур, прежде чем закончить кратким рассмотрением влияния вирусов на другие сферы человеческой деятельности, особенно на искусство и литературу.
Воздействие на болезни человека
Нам мало что известно о точном времени и происхождении эпидемий чумы в древности, но, похоже, они появились, когда на орошаемых землях образовались плотные популяции. Это кажется очевидным из культурных мифов этих регионов: дельты Нила, Плодородного полумесяца, долины Инда и области между реками Хуанхэ и Янцзы. Тем не менее, основываясь как на исторических записях, так и на археологических свидетельствах, можно сказать, что люди были подвержены вирусным заболеваниям с тех пор, как мы существовали.
Успех вакцин и антибиотиков в середине двадцатого века породил надежды на то, что инфекционные заболевания вообще могут стать в значительной степени явлением прошлого, как оспа. В своей замечательной книге « Natural History of Infectious Disease » (1972) Макфарлейн Бернет и Дэвид Уайт отметили: «Наиболее вероятным прогнозом будущего инфекционных заболеваний является то, что оно будет очень скучным. Может быть какое-то совершенно неожиданное появление новой и опасной инфекционной болезни, но ничего подобного не было отмечено за последние пятьдесят лет». Однако полвека спустя мы видим, что инфекции были совсем не скучными. Эбола вспыхнула в Конго в 1976, СПИД начал уносить жизни в начале 1980-х годов, и на момент написания мы переживаем кризис COVID-19, который начался в декабре 2019 года.
В своей замечательной книге « Natural History of Infectious Disease » (1972) Макфарлейн Бернет и Дэвид Уайт отметили: «Наиболее вероятным прогнозом будущего инфекционных заболеваний является то, что оно будет очень скучным. Может быть какое-то совершенно неожиданное появление новой и опасной инфекционной болезни, но ничего подобного не было отмечено за последние пятьдесят лет». Однако полвека спустя мы видим, что инфекции были совсем не скучными. Эбола вспыхнула в Конго в 1976, СПИД начал уносить жизни в начале 1980-х годов, и на момент написания мы переживаем кризис COVID-19, который начался в декабре 2019 года.
Происхождение и историческая демография вирусных инфекций у людей вирусы всегда были с нами, в то время как другие передавались от животных-хозяев. С «точки зрения микроба» кажется, что массовые изменения в человеческом обществе, произошедшие около 10 000 лет назад после доисторической сельскохозяйственной революции, дали возможность столь многим новым типам вирусов поселиться в организме человека.
 Успешная колонизация вирусами чужеземного происхождения была следствием, во-первых, расселения людей из Африки, во-вторых, одомашнивания домашнего скота и, что наиболее важно, развития крупных густонаселенных сообществ.
Успешная колонизация вирусами чужеземного происхождения была следствием, во-первых, расселения людей из Африки, во-вторых, одомашнивания домашнего скота и, что наиболее важно, развития крупных густонаселенных сообществ.
Существует множество зоонозных вирусов, напр. бешенство и грипп H5N1, которые никогда не становились эпидемиями среди людей. По оценкам, 60% из 1400 видов инфекционных микробов, которые, как известно, являются патогенными для человека, передаются животными, для которых человек обычно представляет собой тупиковый хозяин. Однако вирусы, которые действительно адаптируются к распространению от человека к человеку, могут стать самоподдерживающимися, если существует популяция людей в 250 000 или более наивных хозяев для заражения. Корь, согласно недавним исследованиям филогенетических молекулярных часов, как полагают, отделилась от чумы крупного рогатого скота примерно 2400 лет назад, а штамм оспы, существовавший до искоренения, скорее всего, возник в раннехристианскую эру от двугорбого верблюда, хотя и от роющих грызунов. были конечным источником. Эти вирусы отделились от своих предшественников и циркулируют только среди людей.
были конечным источником. Эти вирусы отделились от своих предшественников и циркулируют только среди людей.
Вирусы гриппа появляются и вновь появляются из водоемов у водоплавающих птиц. Сегментировав геномы, они могут рекомбинироваться с генами существующих штаммов, циркулирующих в организме человека и других млекопитающих, с образованием новых эпидемических вариантов. Пандемия «испанки» 1918/1919 гг. была вызвана штаммом h2N1, который, возможно, возник у лошадей в окопах во время Первой мировой войны. крыс, к вирусам экзотических видов. Вырубка лесов, пристрастие к мясу диких животных и другие экологические или поведенческие факторы увеличили возможности проникновения вирусов к людям от летучих мышей, таких как лихорадка Эбола, атипичная пневмония и нипах, часто через краткосрочного промежуточного хозяина, а также от обезьян, таких как Зика и других комаров. переносимые вирусы.
В популяциях, в которых эпидемические вирусы уже присутствуют и широко распространены, большинство выживших взрослых приобрели так называемый коллективный иммунитет, а новые инфекции обычно возникают у детей. Однако, когда вирус достигает популяции хозяев, которая ранее не сталкивалась с этим вирусом, он может заразить как детей, так и взрослых. Глобализация морских путешествий после исследований Христофора Колумба и Васко да Гамы в конце пятнадцатого века позволила оспе, кори и другим вирусам «Старого Света» проникнуть в новые человеческие популяции.
Однако, когда вирус достигает популяции хозяев, которая ранее не сталкивалась с этим вирусом, он может заразить как детей, так и взрослых. Глобализация морских путешествий после исследований Христофора Колумба и Васко да Гамы в конце пятнадцатого века позволила оспе, кори и другим вирусам «Старого Света» проникнуть в новые человеческие популяции.
Воздействие этих вирусов на общество, ранее не подвергавшееся воздействию этих вирусов, оказалось разрушительным. Ни одно другое вирусное заболевание не поражало так много людей на протяжении всей истории, как оспа. Его накопленная смертность была огромна, и он неоднократно нападал на разные популяции. Занесение оспы в Новый Свет во время завоевания империи ацтеков Эрнаном Кортесом и его бандой конкистадоров в 1521 году подробно описано Берналом Диасом в его дневнике . Завоевание Новой Испании . В последующие 100 лет густонаселенные регионы Северной Америки от Гватемалы до бассейна Миссисипи потеряли около 90% коренных жителей из-за оспы и кори. Это сокращение населения было значительно больше, чем в Европе после Черной смерти. В то время как Западной Европе потребовалось 200 лет, чтобы восстановить свой уровень населения до 1348 года, судьба выживших улучшилась. Для крестьян это стало бычьим рынком труда, и они боролись и завоевали свободу от крепостного права (наследственный кабальный труд). Истребление коренных народов Америки из-за оспы имело более серьезные и зловещие последствия: потребность в рабочей силе на плантациях Нового Света породила трансатлантическую работорговлю.
Это сокращение населения было значительно больше, чем в Европе после Черной смерти. В то время как Западной Европе потребовалось 200 лет, чтобы восстановить свой уровень населения до 1348 года, судьба выживших улучшилась. Для крестьян это стало бычьим рынком труда, и они боролись и завоевали свободу от крепостного права (наследственный кабальный труд). Истребление коренных народов Америки из-за оспы имело более серьезные и зловещие последствия: потребность в рабочей силе на плантациях Нового Света породила трансатлантическую работорговлю.
Эта схема опустошения вирусами повторялась во всем мире по мере того, как новые миры контактировали с Южной Америкой, Австралией и Океанией. Это продолжается и сегодня, когда изолированные амазонские племена вступают в контакт с «цивилизацией». Как заметил Чарльз Дарвин в своих заметках о путешествии «Бигля » в 1838 году: «Где бы ни ступал европеец, смерть, кажется, преследует аборигенов… Большинство болезней было завезено с кораблей, и этот факт делает примечательным то, что среди экипажа, передавшего этот разрушительный завоз, не могло быть никаких признаков болезни». 0003
0003
Вирусные эпидемии в прошлом веке
Возможно, нашим лучшим оружием против вирусных инфекций за последние полтора века была вакцинация; он способствовал искоренению оспы и борьбе со многими другими вирусными заболеваниями, включая бешенство, грипп, желтую лихорадку, полиомиелит, корь, эпидемический паротит и краснуху, а совсем недавно — с вирусами папилломы человека, связанными с раком шейки матки.
Но мы никоим образом не победили все вирусы. Несмотря на разработку вакцин против него, вирус гриппа продолжает сеять хаос, убивая, по оценкам, дополнительно 280 000 человек во время пандемии h2N1 в 2009 году.. С момента своего первого появления четыре десятилетия назад ВИЧ стал причиной около 39 миллионов смертей от СПИДа, 66% из них в Африке. Кроме того, СПИД оказал огромное социально-политическое воздействие.
На ранних стадиях эпидемии в Северной Америке ВИЧ был нацелен на маргинализированные социальные группы, особенно мужчин-гомосексуалистов и потребителей внутривенных наркотиков. С одной стороны, это явное пристрастие усугубляло дискриминацию гомосексуалистов со стороны фундаменталистских религиозных групп и политических консерваторов, которые выступали против определенных типов демографических исследований сексуального поведения, что было вредно для изучения эпидемиологии болезней. С другой стороны, эпидемия СПИДа мобилизовала гей-сообщество, особенно в США, на социальную активность, что привело к многочисленным призывам и финансированию исследований и информированию общественности об этой болезни. Между тем, демографические показатели заболеваемости СПИДом в странах с низким доходом, особенно в Африке, также мобилизовали усилия по развертыванию антиретровирусной терапии по всей Африке, а сообщества общественного здравоохранения — для лучшего полового просвещения и более безопасных сексуальных практик.
С одной стороны, это явное пристрастие усугубляло дискриминацию гомосексуалистов со стороны фундаменталистских религиозных групп и политических консерваторов, которые выступали против определенных типов демографических исследований сексуального поведения, что было вредно для изучения эпидемиологии болезней. С другой стороны, эпидемия СПИДа мобилизовала гей-сообщество, особенно в США, на социальную активность, что привело к многочисленным призывам и финансированию исследований и информированию общественности об этой болезни. Между тем, демографические показатели заболеваемости СПИДом в странах с низким доходом, особенно в Африке, также мобилизовали усилия по развертыванию антиретровирусной терапии по всей Африке, а сообщества общественного здравоохранения — для лучшего полового просвещения и более безопасных сексуальных практик.
Влияние на человеческий капитал в эпоху COVID-19
Мы, погруженные в пандемию COVID-19, пока не можем точно оценить уровень смертности от нее. SARS-CoV-2 имеет высокий уровень смертности среди госпитализированных пациентов с инфекцией, тогда как смертность в общей популяции, вероятно, будет намного ниже, если с помощью серологических исследований будет установлена распространенность инфекции. Коронавирусы SARS и MERS более высокопатогенны, чем SARS-Cov-2, но, к счастью, их можно сдержать. Это облегчает их выслеживание и блокировку с помощью отслеживания контактов, потому что, как и в случае с вирусом оспы, передача инфекции до появления симптомов практически невозможна.
SARS-CoV-2 имеет высокий уровень смертности среди госпитализированных пациентов с инфекцией, тогда как смертность в общей популяции, вероятно, будет намного ниже, если с помощью серологических исследований будет установлена распространенность инфекции. Коронавирусы SARS и MERS более высокопатогенны, чем SARS-Cov-2, но, к счастью, их можно сдержать. Это облегчает их выслеживание и блокировку с помощью отслеживания контактов, потому что, как и в случае с вирусом оспы, передача инфекции до появления симптомов практически невозможна.
Четыре других штамма человеческого коронавируса очень заразны и составляют около 20% «простудных заболеваний». Можно предположить, вызывали ли они такую же смертность, как SARS-CoV-2, когда они впервые были представлены человечеству. При COVID-19 пожилые люди подвергаются наибольшему риску тяжелого заболевания и смерти, что контрастирует с пандемией гриппа 1918/19 года, когда многие старики отделались «легко». Причина, по которой пожилые люди были относительно защищены в 1918-1919 годах, возможно, была связана с иммунной памятью о предыдущей вспышке родственного вируса гриппа где-то в конце девятнадцатого века.
Лучшим социальным показателем воздействия болезни, чем смертность, является год жизни с поправкой на инвалидность (DALY), выраженный как количество лет, потерянных из-за плохого состояния здоровья, инвалидности или ранней смерти. Учитывая, что COVID-19, как правило, наиболее тяжело протекает у пожилых людей, если бы мы измеряли DALY, стоимость для общества последствий COVID-19, влияющих на человеческий капитал, рабочую силу и тех, кто все еще находится в начальной стадии образования, должна быть относительно небольшой по сравнению с испанский грипп и ВИЧ. Эти две пандемии 20-го века уничтожили в основном молодых людей, те самые когорты, в которых общество вложило максимальный социальный капитал.
Инфекция SARS-CoV-19, тем не менее, по-видимому, превышает смертность от любого другого нового вируса со времен ВИЧ (~39 миллионов за «сглаженные» 40 лет) и испанского гриппа столетие назад (более 50 миллионов смертей). всего за 18 месяцев). Основной движущей силой того глубокого воздействия, которое мы в настоящее время наблюдаем на мировую экономику и наши средства к существованию, являются наши попытки смягчить последствия распространения COVID-19, к которым большинство стран были плохо готовы. Похоже, что сложные, взаимосвязанные современные общества и экономики стали более уязвимыми перед лицом новой пандемии, чем 100 лет назад.
Похоже, что сложные, взаимосвязанные современные общества и экономики стали более уязвимыми перед лицом новой пандемии, чем 100 лет назад.
Хотя мы можем восхищаться скоростью идентификации нового коронавируса и использованием быстрых тестов для ранней диагностики с помощью амплификации генома, нас смущает тот факт, что мы все еще полагаемся на вековые методы сдерживания пандемии. Мы используем методы карантина (самоизоляции), восходящие к венецианскому подходу к Черной смерти 670 лет назад, и социальное дистанцирование, навязанное прокаженным. Совет «мойте руки» — наследие Игнаца Земмельвейса, чьи коллеги-медики проигнорировали его, пока шли из морга в родильное отделение. Мы надеемся, что COVID-19скоро будет разработана вакцина, учитывая количество кандидатов, проходящих доклинические и клинические испытания, но для достижения эффективной и долговременной вакцины может потребоваться немного больше времени.
Воздействие вирусов на домашний скот и сельскохозяйственные культуры
Учебники по ветеринарной вирусологии и вирусологии растений столь же весомы, как и учебники по вирусам человека, из-за большого разнообразия вирусов, угрожающих здоровью животных и растений. Наши 120-летние знания о том, что ящур вызывается вирусом, не полностью предотвратили его, о чем свидетельствует вспышка 2001 года в Великобритании, которая привела к серьезным экономическим потерям для фермеров из-за обязательной выбраковки скота. Эпидемия, вероятно, была вызвана незаконным добавлением кухонных пищевых отходов, содержащих импортную ветчину, к свиным помоям, а затем быстро распространилась за счет перевозки крупного рогатого скота и овец, продаваемых на рынках. Вероятно, наиболее известными вирусными патогенами животных являются штаммы гриппа, резервуарами которых являются дикие водоплавающие птицы, но которые вызывают эпидемии у домашних птиц, лошадей и свиней. Клещевой вирус африканской чумы свиней, эндемичный для бородавчатых свиней и кустарниковых свиней, в последние десятилетия распространился далеко за пределы Восточной Африки и в настоящее время представляет собой серьезную проблему в Китае. Орбивирус, вызывающий блутанг у жвачных животных, расширяет свой географический ареал на север от Африки до Европы с распространением своего переносчика мошек из-за глобального потепления, а также колонизации новых видов мошек.
Наши 120-летние знания о том, что ящур вызывается вирусом, не полностью предотвратили его, о чем свидетельствует вспышка 2001 года в Великобритании, которая привела к серьезным экономическим потерям для фермеров из-за обязательной выбраковки скота. Эпидемия, вероятно, была вызвана незаконным добавлением кухонных пищевых отходов, содержащих импортную ветчину, к свиным помоям, а затем быстро распространилась за счет перевозки крупного рогатого скота и овец, продаваемых на рынках. Вероятно, наиболее известными вирусными патогенами животных являются штаммы гриппа, резервуарами которых являются дикие водоплавающие птицы, но которые вызывают эпидемии у домашних птиц, лошадей и свиней. Клещевой вирус африканской чумы свиней, эндемичный для бородавчатых свиней и кустарниковых свиней, в последние десятилетия распространился далеко за пределы Восточной Африки и в настоящее время представляет собой серьезную проблему в Китае. Орбивирус, вызывающий блутанг у жвачных животных, расширяет свой географический ареал на север от Африки до Европы с распространением своего переносчика мошек из-за глобального потепления, а также колонизации новых видов мошек. Озерный вирус тилапии впервые появился в 2014 году и поражает рыбоводство тилапии в Южной Америке, Африке и Юго-Восточной Азии, где рыба является важным источником белка в рационе человека.
Озерный вирус тилапии впервые появился в 2014 году и поражает рыбоводство тилапии в Южной Америке, Африке и Юго-Восточной Азии, где рыба является важным источником белка в рационе человека.
Самым большим успехом в ветеринарной вирусологии стала ликвидация чумы крупного рогатого скота, болезни крупного рогатого скота, вызываемой морбилливирусом. Ранее регулярные вспышки чумы крупного рогатого скота оказывали сильное воздействие на скотоводческие общины в Восточной Африке. Это заболевание вместе с трипаносомным паразитом, вызывающим сонную болезнь, сделало большие участки Африки негостеприимными для ввозимого домашнего скота. После кампании стоимостью 5 миллиардов долларов, которая началась в 1995 году, Продовольственная и сельскохозяйственная организация Объединенных Наций объявила о глобальном исчезновении чумы крупного рогатого скота в июне 2011 года, второго вируса после оспы, который удалось ликвидировать. В июне 2019 г., Институт Пирбрайта в Великобритании уничтожил хранилище различных штаммов вируса чумы крупного рогатого скота, задокументировав их генетические последовательности.
Наиболее изученным вирусным патогеном сельскохозяйственных культур, несомненно, является ВТМ, сыгравший столь важную роль в вирусологии, о которой говорилось выше. Задним числом мы знаем, что табак сам по себе является бедствием для человечества, но благодаря его ввозу в Старый Свет на колумбийской бирже шестнадцатого века он стал важным товаром. Вирус мозаики цветной капусты (не имеющий отношения к ВТМ) примечателен как в качестве возбудителя крестоцветных растений, так и в связи с тем, что он реплицируется с помощью обратной транскриптазы, подобно ретровирусам. Одним из наиболее важных растительных вирусов, который в настоящее время влияет на продовольственную безопасность, является вирус африканской мозаики маниоки, член семейства геминивирусов.
Вирусы в искусстве и литературе
Как почти все, с чем сталкивались люди, вирусы по-разному взбудоражили наше воображение и проникли в наши творческие занятия. Функциональная красота вирусных частиц привлекла внимание художников, дизайнеров и архитекторов. И наоборот, здания вдохновили вирусологов на более точное определение структуры вируса. В 1962 году Дональд Каспар и Аарон Клуг предложили модель икосаэдрических (20-гранных) частиц, взятых из геодезических куполов архитектора-дизайнера Бакминстера Фуллера, который сам был очарован этой аналогией. Он нашел способ возведения стабильных «сферических» зданий, состоящих из треугольных, пятиугольных и шестиугольных куполов, и стало очевидно, что вирусы решили эту проблему раньше, чем люди. Вирусам с небольшим геномом требуется множество копий одного или двух белков для формирования капсида, окружающего геном РНК или ДНК. Бактериофаг MS2 имеет такую структуру, как и аденовирусы человека. Рекомбинантная вакцина против вируса папилломы человека самособирается из одного вирусного белка, L1, с образованием пустых (свободных от генома) «вирусоподобных частиц», которые обладают этой структурной целостностью. Более того, структура частиц вакцины придает ей высокую иммуногенность.
И наоборот, здания вдохновили вирусологов на более точное определение структуры вируса. В 1962 году Дональд Каспар и Аарон Клуг предложили модель икосаэдрических (20-гранных) частиц, взятых из геодезических куполов архитектора-дизайнера Бакминстера Фуллера, который сам был очарован этой аналогией. Он нашел способ возведения стабильных «сферических» зданий, состоящих из треугольных, пятиугольных и шестиугольных куполов, и стало очевидно, что вирусы решили эту проблему раньше, чем люди. Вирусам с небольшим геномом требуется множество копий одного или двух белков для формирования капсида, окружающего геном РНК или ДНК. Бактериофаг MS2 имеет такую структуру, как и аденовирусы человека. Рекомбинантная вакцина против вируса папилломы человека самособирается из одного вирусного белка, L1, с образованием пустых (свободных от генома) «вирусоподобных частиц», которые обладают этой структурной целостностью. Более того, структура частиц вакцины придает ей высокую иммуногенность.
В частности, эпидемические заболевания были источником вдохновения и предметом многих литературных произведений. Один из наиболее устойчивых примеров находится в «Истории Пелопоннесской войны » Фукидида , где он предоставил отчет из первых рук об «Афинской чуме» 430 г. до н.э., которая могла быть сыпным тифом или вирусной вспышкой.
Один из наиболее устойчивых примеров находится в «Истории Пелопоннесской войны » Фукидида , где он предоставил отчет из первых рук об «Афинской чуме» 430 г. до н.э., которая могла быть сыпным тифом или вирусной вспышкой.
Никакая другая болезнь в двадцатом веке не вызвала столько, как пандемия СПИДа, в столь различных сферах литературного, исполнительского и изобразительного искусства: Пьесы Нормальное сердце Ларри Крамера (1985) и Ангелы в Америке Тони Кушера (1992) открыто критиковали социальную и медицинскую реакцию на бедственное положение гей-сообщества в первые годы эпидемии СПИДа. вспышка; Книга Рэнди Шилтса « и группа, игравшая на » (1987) представляет собой хронику новой болезни и развития научных открытий; Том Ганн выпустил антологию стихов «Человек в ночном поту » (1992), в то время как СПИД опустошал Сан-Франциско; а Абрахам Вергезе изложил точку зрения врача на лечение этой болезни в глубоко консервативном сельском Теннесси в своем переезде Моя собственная страна (1994). СПИД также придал новый облик постановке Джакомо Пуччини « Богема », основанной на туберкулезе, когда отмеченная наградами рок-опера Джонатана Ларсона « Аренда » попала на Бродвей в середине 1990-х годов. И последнее, но не менее важное: существует одно из крупнейших и, возможно, старейших произведений народного творчества в мире: Мемориальное одеяло проекта NAMES, более известное как Одеяло о СПИДе. Задуманный в 1985 году активистом Кливом Джонсом в память о тех, кто погиб из-за СПИДа, в настоящее время он весит около 54 тонн, а с 2020 года будет постоянно экспонироваться в Сан-Франциско, где и возник.
СПИД также придал новый облик постановке Джакомо Пуччини « Богема », основанной на туберкулезе, когда отмеченная наградами рок-опера Джонатана Ларсона « Аренда » попала на Бродвей в середине 1990-х годов. И последнее, но не менее важное: существует одно из крупнейших и, возможно, старейших произведений народного творчества в мире: Мемориальное одеяло проекта NAMES, более известное как Одеяло о СПИДе. Задуманный в 1985 году активистом Кливом Джонсом в память о тех, кто погиб из-за СПИДа, в настоящее время он весит около 54 тонн, а с 2020 года будет постоянно экспонироваться в Сан-Франциско, где и возник.
Мы заканчиваем аллюзией на две современные классики: роман Чинуа Ачебе « Вещи рушатся » (1958), в котором описывается напряжение и крах, когда традиционное западноафриканское общество «заражается» чужой культурой миссионеров и колониальных офицеров. Хотя название само по себе не связано с вирусными эпидемиями, оно отсылает к знаменитым строкам стихотворения У. Б. Йейтса « Второе пришествие », написанного в 1919 году в разгар пандемии испанского гриппа:
Б. Йейтса « Второе пришествие », написанного в 1919 году в разгар пандемии испанского гриппа:
Вещи разваливаются; центр не может удержаться;
Простая анархия низвергнута на мир,
Кровавый прилив выпущен, и повсюду
Церемония невинности утоплена.
- Crawford D.H. Oxford University Press; Оксфорд: 2007. Смертоносные спутники: как микробы повлияли на нашу историю. [Google Scholar]
- Creager A. Univ. из Чикаго Пресс; Чикаго: 2002. Жизнь вируса: вирус табачной мозаики как экспериментальная модель, стр. 19.30–1965. [Google Scholar]
- Драуланс Д. «Наконец-то меня достал вирус». Ученый, который боролся с лихорадкой Эбола и ВИЧ, размышляет о смерти от COVID-19. Наука. 2020 г.: 10.1126/science.abc7042. [CrossRef] [Google Scholar]
- Даймонд Дж. Винтаж; Лондон: 1998. Ружья, микробы и сталь.
 [Google Scholar]
[Google Scholar] - Гаррет Л. Фаррар, Straus & Giroux; Нью-Йорк: 1994. Грядущая чума. [Google Scholar]
- Хелениус А. Вирусная запись: оглядываясь назад и двигаясь вперед. Журнал молекулярной биологии. 2018; 430:1853–1862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лейн Д.П., Кроуфорд Л.В. Т-антиген связывается с белком-хозяином в клетках, трансформированных SV40. Природа. 1979; 278: 261–263. [PubMed] [Google Scholar]
- Львофф А. Концепция вируса. Журнал общей микробиологии. 1957; 17: 239–253. [PubMed] [Google Scholar]
- Маклин А.Р., Мэй Р.М., Паттисон Дж., Вайс Р.А., редакторы. SARS: тематическое исследование новых инфекций. Издательство Оксфордского университета; 2005. [Google Scholar]
- Санкаран Н. University of Pittsburgh Press, Питтсбург; Питтсбург: 2021. История двух вирусов: параллели в траекториях исследований опухолевых и бактериальных вирусов. Доступно по ссылке: https://upittpress.org/books/9780822946304/. [Google Scholar]
- Sharp P.
 A. Открытие расщепленных генов и сплайсинга РНК. Тенденции биохимических наук. 2005; 30: 279–281. [PubMed] [Google Scholar]
A. Открытие расщепленных генов и сплайсинга РНК. Тенденции биохимических наук. 2005; 30: 279–281. [PubMed] [Google Scholar] - Спинни Л. Джонатан Кейп; Лондон: 2017. Бледный всадник: испанский грипп 1918 года и как он изменил мир. [Google Scholar]
- Вайс Р.А., МакМайкл А.Дж. Социальные и экологические факторы риска возникновения инфекционных заболеваний. Природная медицина. 2004; 10: С70–С76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клеточная биология инфекции — Молекулярная биология клетки
Мы только что видели, что патогены представляют собой разнообразный набор агентов. Соответственно, существуют разнообразные механизмы, с помощью которых патогены вызывают заболевание. Но выживание и успех всех патогенов требуют, чтобы они колонизировали хозяина, достигли соответствующей ниши, избежали защиты хозяина, размножились и покинули зараженный хозяин, чтобы распространиться на неинфицированный. В этом разделе мы рассмотрим общие стратегии, используемые многими патогенами для выполнения этих задач.
Патогены пересекают защитные барьеры для колонизации хозяина
Первым этапом инфекции является колонизация патогеном хозяина. Большинство частей человеческого тела хорошо защищены от окружающей среды толстым и довольно прочным кожным покровом. Защитные границы в некоторых других тканях человека (глаза, носовые ходы и дыхательные пути, рот и пищеварительный тракт, мочевыводящие пути и женские половые пути) менее прочны. Например, в легких и тонком кишечнике, где кислород и питательные вещества, соответственно, поглощаются из окружающей среды, барьер представляет собой всего один монослой эпителиальных клеток.
Кожа и многие другие барьерные эпителиальные поверхности обычно густо заселены нормальной флорой. Некоторые бактериальные и грибковые патогены также колонизируют эти поверхности и пытаются превзойти нормальную флору, но большинство из них (как и все вирусы) избегают такой конкуренции, преодолевая эти барьеры, чтобы получить доступ к незанятым нишам внутри хозяина.
Раны в барьерном эпителии, включая кожу, обеспечивают прямой доступ патогенов внутрь хозяина. Этот путь проникновения требует небольшой специализации со стороны патогена. Действительно, многие представители нормальной флоры могут вызвать серьезное заболевание, если попадут через такие раны. Анаэробные бактерии рода Bacteroides , например, переносятся в виде безвредной флоры с очень высокой плотностью в толстом кишечнике, но они могут вызывать опасный для жизни перитонит, если они попадают в брюшную полость через перфорацию в кишечнике, вызванную травмой, операцией или инфекцией в кишечная стенка. Staphylococcus из кожи и носа или Streptococcus из горла и рта также являются причиной многих серьезных инфекций, возникающих в результате нарушений эпителиальных барьеров.
Выделенные патогены, однако, не должны ждать своевременного ранения, чтобы получить доступ к своему носителю. Особенно эффективным способом проникновения патогена через кожу является попадание в слюну кусающего насекомого. Многие членистоногие питаются, высасывая кровь, и различные группы бактерий, вирусов и простейших развили способность выживать в членистоногих, так что они могут использовать этих кусающих животных в качестве переносчиков для распространения от одного хозяина-млекопитающего к другому. Как уже говорилось ранее, Простейшее Plasmodium , вызывающее малярию, в своем жизненном цикле развивается в нескольких формах, в том числе для выживания человека и комара (см. ). Вирусы, передающиеся через укусы насекомых, включают возбудителей нескольких видов геморрагической лихорадки, в том числе желтой лихорадки и лихорадки Денге, а также возбудителей многих видов вирусного энцефалита (воспаления головного мозга). Все эти вирусы приобрели способность к репликации как в клетках насекомых, так и в клетках млекопитающих, что необходимо для передачи вируса насекомым-переносчиком. Вирусы, передающиеся через кровь, такие как ВИЧ, которые не способны размножаться в клетках насекомых, редко, если вообще когда-либо, передаются от насекомых к человеку.
Многие членистоногие питаются, высасывая кровь, и различные группы бактерий, вирусов и простейших развили способность выживать в членистоногих, так что они могут использовать этих кусающих животных в качестве переносчиков для распространения от одного хозяина-млекопитающего к другому. Как уже говорилось ранее, Простейшее Plasmodium , вызывающее малярию, в своем жизненном цикле развивается в нескольких формах, в том числе для выживания человека и комара (см. ). Вирусы, передающиеся через укусы насекомых, включают возбудителей нескольких видов геморрагической лихорадки, в том числе желтой лихорадки и лихорадки Денге, а также возбудителей многих видов вирусного энцефалита (воспаления головного мозга). Все эти вирусы приобрели способность к репликации как в клетках насекомых, так и в клетках млекопитающих, что необходимо для передачи вируса насекомым-переносчиком. Вирусы, передающиеся через кровь, такие как ВИЧ, которые не способны размножаться в клетках насекомых, редко, если вообще когда-либо, передаются от насекомых к человеку.
Эффективное распространение патогена через насекомых-переносчиков требует, чтобы отдельные насекомые питались кровью многочисленных хозяев-млекопитающих. В нескольких поразительных случаях патоген изменяет поведение насекомого, так что его передача становится более вероятной. Как и большинство животных, муха цеце (чей укус распространяет простейшего паразита Trypanosoma brucei , вызывающего сонную болезнь в Африке) прекращает есть, когда насытится. Но мухи цеце, несущие трипаносомы, кусаются гораздо чаще и проглатывают больше крови, чем неинфицированные мухи. Присутствие трипаносом нарушает функцию механорецепторов насекомых, которые измеряют кровоток через пищевод для оценки наполненности желудка, эффективно обманывая муху цеце, заставляя ее думать, что она все еще голодна. Бактерия Yersinia pestis , вызывающая бубонную чуму, использует другой механизм, чтобы гарантировать, что блоха-носитель ее укусит неоднократно: она размножается в передней кишке блохи, образуя агрегированные массы, которые в конечном итоге увеличиваются и физически блокируют пищеварительный тракт. Затем насекомое не может нормально питаться и начинает голодать. При неоднократных попытках удовлетворить свой аппетит некоторые бактерии из передней кишки попадают в место укуса, таким образом передавая чуму новому хозяину (4).
Затем насекомое не может нормально питаться и начинает голодать. При неоднократных попытках удовлетворить свой аппетит некоторые бактерии из передней кишки попадают в место укуса, таким образом передавая чуму новому хозяину (4).
Рисунок 25-18
Распространение чумы. На этой микрофотографии показан пищеварительный тракт блохи, которая две недели назад питалась кровью животного, зараженного чумной бактерией Yersinia pestis. Бактерии, размножающиеся в кишечнике блох, производят (подробнее…)
Патогены, колонизирующие эпителий, должны избегать проникновения хозяина начальные барьеры обороны хозяина. В то время как многие барьерные зоны, такие как кожа, рот и толстая кишка, плотно заселены нормальной флорой, другие, включая нижние отделы легких, тонкую кишку и мочевой пузырь, обычно остаются почти стерильными, несмотря на относительно прямой доступ к окружающей среде. Эпителий в этих зонах активно противостоит бактериальной колонизации. Как обсуждалось в главе 22, респираторный эпителий покрыт слоем защитной слизи, и скоординированное биение ресничек вымывает слизь, захваченные бактерии и остатки из легких вверх и наружу.
 Эпителий, выстилающий мочевой пузырь и верхние отделы желудочно-кишечного тракта, также имеет толстый слой слизи, и эти органы периодически промываются за счет мочеиспускания и перистальтики, соответственно, для вымывания нежелательных микробов. Патогенные бактерии и паразиты, инфицирующие эти эпителиальные поверхности, обладают специфическими механизмами преодоления этих механизмов очистки хозяина. Те, которые инфицируют мочевыводящие пути, например, сопротивляются моющему действию мочи, плотно прикрепляясь к эпителию мочевого пузыря через специфические адгезины , белки или белковые комплексы, которые распознают молекулы клеточной поверхности хозяина и связываются с ними. Важной группой адгезинов у уропатогенных штаммов Е. coli являются компоненты Р пили (см.), которые помогают бактериям инфицировать почки. Эти поверхностные выступы могут иметь длину в несколько микрометров и, таким образом, могут охватывать толщину защитного слоя слизи. На кончике каждой ворсинки находится белок, который прочно связывается с определенным дисахаридом, связанным с гликолипидом, который находится на поверхности клеток мочевого пузыря и почек.
Эпителий, выстилающий мочевой пузырь и верхние отделы желудочно-кишечного тракта, также имеет толстый слой слизи, и эти органы периодически промываются за счет мочеиспускания и перистальтики, соответственно, для вымывания нежелательных микробов. Патогенные бактерии и паразиты, инфицирующие эти эпителиальные поверхности, обладают специфическими механизмами преодоления этих механизмов очистки хозяина. Те, которые инфицируют мочевыводящие пути, например, сопротивляются моющему действию мочи, плотно прикрепляясь к эпителию мочевого пузыря через специфические адгезины , белки или белковые комплексы, которые распознают молекулы клеточной поверхности хозяина и связываются с ними. Важной группой адгезинов у уропатогенных штаммов Е. coli являются компоненты Р пили (см.), которые помогают бактериям инфицировать почки. Эти поверхностные выступы могут иметь длину в несколько микрометров и, таким образом, могут охватывать толщину защитного слоя слизи. На кончике каждой ворсинки находится белок, который прочно связывается с определенным дисахаридом, связанным с гликолипидом, который находится на поверхности клеток мочевого пузыря и почек.
Рисунок 25-19
Уропатогенные E. coli и Pili. (A) Сканирующая электронная микрофотография уропатогенной E. coli , частой причины инфекций мочевого пузыря и почек, прикрепленной к поверхности эпителиальных клеток в мочевом пузыре инфицированной мыши. (B) Бактерии крупным планом (подробнее…)
Желудок является одним из самых труднодоступных для микробов органов для колонизации. Помимо перистальтического омывания и защиты толстым слоем слизи желудок наполнен кислотой (средний рН ~2). Эта экстремальная среда смертельна почти для всех бактерий, попавших в пищу. Тем не менее, он заселен выносливой и предприимчивой бактерией 9.0414 Helicobacter pylori , который лишь недавно был признан основным возбудителем язвы желудка и, возможно, рака желудка. Хотя старые методы лечения язвы (снижающие кислотность препараты и мягкая диета) по-прежнему используются для уменьшения воспаления, короткий и относительно дешевый курс антибиотиков теперь может эффективно вылечить пациента с рецидивирующей язвой желудка. Гипотеза о том, что язва желудка может быть вызвана персистирующей бактериальной инфекцией слизистой оболочки желудка, первоначально была встречена со значительным скептицизмом. Окончательно это подтвердил молодой австралийский врач, сделавший первое открытие: он выпил из флакона чистую культуру H. pylori и развилась типичная язва. Одним из способов выживания H. pylori в желудке является выработка фермента уреазы , который превращает мочевину в аммиак и двуокись углерода; таким образом бактерия окружает себя слоем аммиака, который нейтрализует желудочную кислоту в непосредственной близости от нее. Бактерии также экспрессируют по крайней мере пять типов адгезинов, которые позволяют им прикрепляться к эпителию желудка, и они продуцируют несколько цитотоксинов, которые разрушают эпителиальные клетки желудка, вызывая болезненные язвы. Возникающее в результате хроническое воспаление способствует пролиферации клеток и, таким образом, предрасполагает инфицированного человека к раку желудка.
Гипотеза о том, что язва желудка может быть вызвана персистирующей бактериальной инфекцией слизистой оболочки желудка, первоначально была встречена со значительным скептицизмом. Окончательно это подтвердил молодой австралийский врач, сделавший первое открытие: он выпил из флакона чистую культуру H. pylori и развилась типичная язва. Одним из способов выживания H. pylori в желудке является выработка фермента уреазы , который превращает мочевину в аммиак и двуокись углерода; таким образом бактерия окружает себя слоем аммиака, который нейтрализует желудочную кислоту в непосредственной близости от нее. Бактерии также экспрессируют по крайней мере пять типов адгезинов, которые позволяют им прикрепляться к эпителию желудка, и они продуцируют несколько цитотоксинов, которые разрушают эпителиальные клетки желудка, вызывая болезненные язвы. Возникающее в результате хроническое воспаление способствует пролиферации клеток и, таким образом, предрасполагает инфицированного человека к раку желудка.
Более экстремальный пример активной колонизации представлен Bordetella pertussis , бактерией, вызывающей коклюш. Первым этапом инфекции B. pertussis является колонизация респираторного эпителия. Бактерии обходят механизм нормального клиренса (мукоцилиарный эскалатор , описанный в главе 22), прочно прикрепляясь к поверхности реснитчатых клеток и размножаясь на них. B. pertussis экспрессирует по крайней мере четыре типа адгезинов, которые прочно связываются с определенными гликолипидами на реснитчатых клетках. Адгезивные бактерии производят различные токсины, которые в конечном итоге убивают реснитчатые клетки, ставя под угрозу способность хозяина избавиться от инфекции. Самый известный из них коклюшный токсин , который, как и холерный токсин, представляет собой АДФ-рибозилирующий фермент. Он АДФ-рибозилирует α-субъединицу G-белка G i , вызывая нарушение регуляции аденилатциклазы клетки-хозяина и перепроизводство циклического АМФ (обсуждается в главе 15). Не довольствуясь этим, B. pertussis также продуцирует собственную аденилатциклазу, которая неактивна, если не связана с эукариотическим Ca 2+ -связывающим белком кальмодулином. Таким образом, продуцируемый бактериями фермент активен только в цитоплазме эукариотической клетки. Хотя оба B. pertussis и V. cholerae имеют схожий эффект резкого повышения уровня цАМФ в клетках-хозяевах, к которым они прилипают, симптомы заболеваний сильно различаются, поскольку эти две бактерии колонизируют разные участки тела хозяина: B .pertussis колонизирует дыхательные пути и вызывает пароксизмальный кашель, тогда как V.cholerae колонизирует кишечник и вызывает водянистую диарею.
Не довольствуясь этим, B. pertussis также продуцирует собственную аденилатциклазу, которая неактивна, если не связана с эукариотическим Ca 2+ -связывающим белком кальмодулином. Таким образом, продуцируемый бактериями фермент активен только в цитоплазме эукариотической клетки. Хотя оба B. pertussis и V. cholerae имеют схожий эффект резкого повышения уровня цАМФ в клетках-хозяевах, к которым они прилипают, симптомы заболеваний сильно различаются, поскольку эти две бактерии колонизируют разные участки тела хозяина: B .pertussis колонизирует дыхательные пути и вызывает пароксизмальный кашель, тогда как V.cholerae колонизирует кишечник и вызывает водянистую диарею.
Не все примеры специфической колонизации требуют, чтобы бактерия экспрессировала адгезины, которые связываются с гликолипидами или белками клетки-хозяина. Энтеропатогенный E. coli , вызывающая диарею у маленьких детей, вместо этого использует систему секреции типа III (см. ), чтобы доставить свой собственный бактериально-экспрессируемый рецепторный белок (называемый Tir) в клетку-хозяин (). После того, как Tir встраивается в мембрану клетки-хозяина, бактериальный поверхностный белок связывается с внеклеточным доменом Tir, вызывая замечательную серию событий внутри клетки-хозяина. Во-первых, белок рецептора Tir фосфорилируется по остаткам тирозина протеинкиназой хозяина. В отличие от эукариотических клеток, бактерии обычно не фосфорилируют остатки тирозина, однако Tir содержит пептидный домен, который является специфическим мотивом распознавания для эукариотической тирозинкиназы. Затем считается, что фосфорилированный Tir рекрутирует члена Rho семейства малых ГТФаз, которые способствуют полимеризации актина через серию промежуточных стадий (обсуждается в гл. 16). Полимеризованный актин образует уникальное выпячивание клеточной поверхности, называемое пьедестал , который отталкивает плотно прилипшие бактерии примерно на 10 мкм от поверхности клетки-хозяина (, ).
), чтобы доставить свой собственный бактериально-экспрессируемый рецепторный белок (называемый Tir) в клетку-хозяин (). После того, как Tir встраивается в мембрану клетки-хозяина, бактериальный поверхностный белок связывается с внеклеточным доменом Tir, вызывая замечательную серию событий внутри клетки-хозяина. Во-первых, белок рецептора Tir фосфорилируется по остаткам тирозина протеинкиназой хозяина. В отличие от эукариотических клеток, бактерии обычно не фосфорилируют остатки тирозина, однако Tir содержит пептидный домен, который является специфическим мотивом распознавания для эукариотической тирозинкиназы. Затем считается, что фосфорилированный Tir рекрутирует члена Rho семейства малых ГТФаз, которые способствуют полимеризации актина через серию промежуточных стадий (обсуждается в гл. 16). Полимеризованный актин образует уникальное выпячивание клеточной поверхности, называемое пьедестал , который отталкивает плотно прилипшие бактерии примерно на 10 мкм от поверхности клетки-хозяина (, ).
Рисунок 25-20
Взаимодействие энтеропатогенной E. coli (EPEC) с клетками-хозяевами. (A) Когда EPEC контактирует с эпителиальной клеткой в слизистой оболочке кишечника человека, он доставляет бактериальный белок Tir в клетку-хозяин через систему секреции типа III. Затем Tir вставляется в (подробнее…)
Эти примеры колонизации хозяина иллюстрируют важность коммуникации хозяина и патогена в процессе заражения. Патогенные организмы приобрели гены, кодирующие белки, специфически взаимодействующие с определенными молекулами клеток-хозяев. В некоторых случаях, таких как B. pertussis аденилатциклаза, предок патогена, могла получить ген от своего хозяина, тогда как в других, таких как Tir, случайная мутация могла привести к возникновению белковых мотивов, которые распознаются эукариотическим партнером по белку.
Внутриклеточные патогены имеют механизмы как для проникновения, так и для выхода из клеток-хозяев
Многие патогены, включая V. cholerae и B. pertussis , заражают своего хозяина, не проникая в клетки-хозяева. Другие, однако, включая все вирусы и многие бактерии и простейшие, внутриклеточные патогены . Их предпочтительная ниша для репликации и выживания находится в цитоплазме или внутриклеточных компартментах определенных клеток-хозяев. Эта стратегия имеет ряд преимуществ. Патогены недоступны для антител (обсуждается в главе 24) и не являются легкой мишенью для фагоцитирующих клеток (обсуждается ниже). Однако такой образ жизни требует, чтобы патоген разработал механизмы для проникновения в клетки-хозяева, для нахождения подходящей субклеточной ниши, где он может размножаться, и для выхода из инфицированной клетки для распространения инфекции. В оставшейся части этого раздела мы рассмотрим некоторые из множества способов, которыми отдельные внутриклеточные патогены используют и модифицируют биологию клетки-хозяина, чтобы удовлетворить эти требования.
cholerae и B. pertussis , заражают своего хозяина, не проникая в клетки-хозяева. Другие, однако, включая все вирусы и многие бактерии и простейшие, внутриклеточные патогены . Их предпочтительная ниша для репликации и выживания находится в цитоплазме или внутриклеточных компартментах определенных клеток-хозяев. Эта стратегия имеет ряд преимуществ. Патогены недоступны для антител (обсуждается в главе 24) и не являются легкой мишенью для фагоцитирующих клеток (обсуждается ниже). Однако такой образ жизни требует, чтобы патоген разработал механизмы для проникновения в клетки-хозяева, для нахождения подходящей субклеточной ниши, где он может размножаться, и для выхода из инфицированной клетки для распространения инфекции. В оставшейся части этого раздела мы рассмотрим некоторые из множества способов, которыми отдельные внутриклеточные патогены используют и модифицируют биологию клетки-хозяина, чтобы удовлетворить эти требования.
Вирусы связываются с молекулами, представленными на поверхности клетки-хозяина
Первым шагом для любого внутриклеточного патогена является связывание с поверхностью клетки-мишени-хозяина. Для вирусов связывание осуществляется за счет ассоциации вирусного поверхностного белка со специфическим рецептором на поверхности клетки-хозяина. Конечно, ни один рецептор клетки-хозяина не развился с единственной целью позволить патогену связываться с ним; все эти рецепторы имеют другие функции. Первым идентифицированным таким «вирусным рецептором» был E. coli поверхностный белок, позволяющий бактериофагу лямбда связываться с бактерией. Его нормальная функция заключается в транспортном белке, ответственном за поглощение мальтозы.
Для вирусов связывание осуществляется за счет ассоциации вирусного поверхностного белка со специфическим рецептором на поверхности клетки-хозяина. Конечно, ни один рецептор клетки-хозяина не развился с единственной целью позволить патогену связываться с ним; все эти рецепторы имеют другие функции. Первым идентифицированным таким «вирусным рецептором» был E. coli поверхностный белок, позволяющий бактериофагу лямбда связываться с бактерией. Его нормальная функция заключается в транспортном белке, ответственном за поглощение мальтозы.
Вирусы, инфицирующие клетки животных, обычно используют молекулы рецепторов клеточной поверхности, которые либо очень распространены (такие как олигосахариды, содержащие сиаловую кислоту, которые используются вирусом гриппа), либо уникально обнаружены на тех типах клеток, в которых вирус может реплицироваться (например, рецептор фактора роста нервов, никотиновый ацетилхолиновый рецептор или белок межклеточной адгезии N-CAM, все из которых используются вирусом бешенства для специфического заражения нейронов). Часто один тип рецептора используется многими типами вирусов, а некоторые вирусы могут использовать несколько разных рецепторов. Более того, разные вирусы, поражающие один и тот же тип клеток, могут использовать разные рецепторы. Гепатит, например, вызывается как минимум шестью вирусами, каждый из которых преимущественно размножается в клетках печени. Были идентифицированы рецепторы для четырех вирусов гепатита, и все они разные. Рецепторы не обязательно должны быть белками; Вирус простого герпеса, например, связывается с протеогликанами гепарансульфата через специфические белки вирусной мембраны.
Часто один тип рецептора используется многими типами вирусов, а некоторые вирусы могут использовать несколько разных рецепторов. Более того, разные вирусы, поражающие один и тот же тип клеток, могут использовать разные рецепторы. Гепатит, например, вызывается как минимум шестью вирусами, каждый из которых преимущественно размножается в клетках печени. Были идентифицированы рецепторы для четырех вирусов гепатита, и все они разные. Рецепторы не обязательно должны быть белками; Вирус простого герпеса, например, связывается с протеогликанами гепарансульфата через специфические белки вирусной мембраны.
Часто вирусам требуется как первичный рецептор, так и вторичный корецептор для эффективного прикрепления и проникновения в клетки-хозяева. Важным примером является ВИЧ. Его первичным рецептором является CD4, белок, участвующий в иммунном распознавании, который находится на поверхности многих Т-клеток и макрофагов (обсуждается в главе 24). Для проникновения вируса также требуется наличие корецептора, либо CCR5 (рецептор для β-хемокинов), либо CXCR4 (рецептор для α-хемокинов), в зависимости от конкретного варианта вируса. Макрофаги восприимчивы только к вариантам ВИЧ, которые используют CCR5 для входа, тогда как Т-клетки наиболее эффективно инфицируются вариантами, которые используют CXCR4. Вирусы, обнаруживаемые в течение первых нескольких месяцев после инфицирования ВИЧ, почти всегда требуют CCR5, что, по-видимому, объясняет, почему люди, являющиеся носителями дефектного ccr5 гена не восприимчивы к ВИЧ-инфекции. На более поздних стадиях инфекции вирусы могут либо переключаться на использование корецептора CXCR4, либо адаптироваться к использованию обоих корецепторов; таким образом, вирус может изменять типы клеток, которые он заражает, по мере прогрессирования болезни.
Макрофаги восприимчивы только к вариантам ВИЧ, которые используют CCR5 для входа, тогда как Т-клетки наиболее эффективно инфицируются вариантами, которые используют CXCR4. Вирусы, обнаруживаемые в течение первых нескольких месяцев после инфицирования ВИЧ, почти всегда требуют CCR5, что, по-видимому, объясняет, почему люди, являющиеся носителями дефектного ccr5 гена не восприимчивы к ВИЧ-инфекции. На более поздних стадиях инфекции вирусы могут либо переключаться на использование корецептора CXCR4, либо адаптироваться к использованию обоих корецепторов; таким образом, вирус может изменять типы клеток, которые он заражает, по мере прогрессирования болезни.
Рисунок 25-21
Рецептор и корецепторы ВИЧ. Все штаммы ВИЧ нуждаются в CD4 в качестве основного рецептора. В начале инфекции большинство вирусов используют CCR5 в качестве корецептора, что позволяет им инфицировать макрофаги и их предшественники, моноциты. По мере прогрессирования инфекции (далее…)
Вирусы проникают в клетки-хозяева путем слияния мембран, образования пор или разрушения мембран
После распознавания и прикрепления к поверхности клетки-хозяина вирус должен затем проникнуть в клетку-хозяин и высвободить свой геном нуклеиновой кислоты из защитной белковой оболочки или липидной оболочки . В большинстве случаев высвобожденная нуклеиновая кислота остается в комплексе с некоторыми вирусными белками. Вирусы с оболочкой проникают в клетку-хозяина путем слияния либо с плазматической мембраной, либо с эндосомальной мембраной после эндоцитоза (,). Слияние, как полагают, происходит посредством механизма, сходного с SNARE-опосредованным слиянием везикул во время нормального внутриклеточного везикулярного трафика (обсуждается в Главе 13).
В большинстве случаев высвобожденная нуклеиновая кислота остается в комплексе с некоторыми вирусными белками. Вирусы с оболочкой проникают в клетку-хозяина путем слияния либо с плазматической мембраной, либо с эндосомальной мембраной после эндоцитоза (,). Слияние, как полагают, происходит посредством механизма, сходного с SNARE-опосредованным слиянием везикул во время нормального внутриклеточного везикулярного трафика (обсуждается в Главе 13).
Рисунок 25-22
Четыре стратегии удаления оболочки вируса. (A) Некоторые вирусы с оболочкой, такие как ВИЧ, сливаются непосредственно с плазматической мембраной клетки-хозяина, высвобождая свой капсид (зеленый) в цитозоль. (B) Другие вирусы с оболочкой, такие как вирус гриппа, сначала связываются с поверхностью клетки (подробнее…)
Слияние регулируется как для обеспечения слияния вирусных частиц только с соответствующей мембраной клетки-хозяина, так и для предотвращения слияния вирусных частиц друг с другом. Для вирусов, таких как ВИЧ, которые сливаются при нейтральном pH на плазматической мембране, связывание с рецепторами или корецепторами обычно вызывает конформационные изменения в белке вирусной оболочки, обнажая обычно спрятанный пептид слияния (см. ). Другие вирусы с оболочкой, такие как грипп, откладывают слияние до завершения эндоцитоза; в этом случае часто именно кислая среда в ранней эндосоме запускает конформационные изменения в вирусном поверхностном белке, который высвобождает слитый пептид (14). Н + , закачанный в раннюю эндосому, проникает в частицу гриппа через ионный канал и запускает снятие оболочки вирусной нуклеиновой кислоты, которая высвобождается непосредственно в цитозоль, когда вирус сливается с эндосомальной мембраной. Для некоторых вирусов снятие оболочки происходит после выхода в цитозоль. Например, в случае лесного вируса Семлики связывание рибосом хозяина с капсидом приводит к тому, что белки капсида отделяются от вирусного генома.
Для вирусов, таких как ВИЧ, которые сливаются при нейтральном pH на плазматической мембране, связывание с рецепторами или корецепторами обычно вызывает конформационные изменения в белке вирусной оболочки, обнажая обычно спрятанный пептид слияния (см. ). Другие вирусы с оболочкой, такие как грипп, откладывают слияние до завершения эндоцитоза; в этом случае часто именно кислая среда в ранней эндосоме запускает конформационные изменения в вирусном поверхностном белке, который высвобождает слитый пептид (14). Н + , закачанный в раннюю эндосому, проникает в частицу гриппа через ионный канал и запускает снятие оболочки вирусной нуклеиновой кислоты, которая высвобождается непосредственно в цитозоль, когда вирус сливается с эндосомальной мембраной. Для некоторых вирусов снятие оболочки происходит после выхода в цитозоль. Например, в случае лесного вируса Семлики связывание рибосом хозяина с капсидом приводит к тому, что белки капсида отделяются от вирусного генома.
Рисунок 25-23
Стратегия проникновения вируса гриппа. Глобулярные головки вирусного гемагглютинина (HA) опосредуют связывание вируса с рецепторами клеточной поверхности, содержащими сиаловую кислоту. Комплексы вирус-рецептор подвергаются эндоцитозу и в кислой среде (подробнее…)
Глобулярные головки вирусного гемагглютинина (HA) опосредуют связывание вируса с рецепторами клеточной поверхности, содержащими сиаловую кислоту. Комплексы вирус-рецептор подвергаются эндоцитозу и в кислой среде (подробнее…)
Труднее представить себе, как безоболочечных вирусов проникают в клетки-хозяева, поскольку неясно, как большие сборки белков и нуклеиновых кислот могут пересекают плазматическую или эндосомальную мембраны. Когда механизм проникновения понятен, безоболочечные вирусы обычно либо образуют поры в клеточной мембране для доставки вирусного генома в цитоплазму, либо разрушают эндосомальную мембрану после эндоцитоза.
Полиовирус использует первую стратегию. Связывание полиовируса с его рецептором запускает как опосредованный рецептором эндоцитоз, так и конформационные изменения вирусной частицы. Конформационное изменение обнажает гидрофобный выступ на одном из капсидных белков, который, по-видимому, встраивается в эндосомальную мембрану, образуя пору. Затем вирусный геном проникает в цитоплазму через поры, оставляя капсид либо в эндосоме, либо на поверхности клетки, либо в обоих местах (см.
Затем вирусный геном проникает в цитоплазму через поры, оставляя капсид либо в эндосоме, либо на поверхности клетки, либо в обоих местах (см.
Adenovirus использует вторую стратегию. Первоначально он поглощается рецептор-опосредованным эндоцитозом. По мере того, как эндосома созревает и становится более кислой, вирус подвергается нескольким стадиям снятия оболочки, на которых структурные белки последовательно удаляются из капсида. Некоторые из этих стадий требуют действия вирусной протеазы, которая неактивна во внеклеточной вирусной частице (вероятно, из-за внутрицепочечных дисульфидных связей), но активируется в восстанавливающей среде эндосомы. Один из белков, высвобождаемых из капсида, лизирует эндосомальную мембрану, высвобождая остаток вируса в цитозоль. Этот урезанный вирус затем стыкуется с комплексом ядерных пор, и геном вирусной ДНК высвобождается через поры в ядро, где он транскрибируется (см.
В этих различных стратегиях проникновения вирусы используют различные молекулы и процессы клетки-хозяина, включая компоненты клеточной поверхности, рецептор-опосредованный эндоцитоз и этапы эндосомального созревания. Эти стратегии еще раз иллюстрируют изощренные способы эволюции патогенов, использующие базовую клеточную биологию своих хозяев.
Эти стратегии еще раз иллюстрируют изощренные способы эволюции патогенов, использующие базовую клеточную биологию своих хозяев.
Бактерии проникают в клетки-хозяева путем фагоцитоза
Бактерии намного крупнее вирусов, и они слишком велики, чтобы быть поглощенными рецептор-опосредованным эндоцитозом. Вместо этого они проникают в клетки-хозяева посредством фагоцитоза. Фагоцитоз бактерий является нормальной функцией макрофагов. Они патрулируют ткани тела, поглощают и уничтожают нежелательные микробы. Однако некоторые патогены приобрели способность выживать и размножаться внутри макрофагов после их фагоцитоза.
Туберкулез , серьезная легочная инфекция, широко распространенная в некоторых городских районах, вызывается одним из таких патогенов, Mycobacterium tuberculosis . Эта бактерия обычно попадает в легкие при вдыхании, где она подвергается фагоцитозу альвеолярными макрофагами. Хотя микроб может выживать и размножаться внутри макрофагов, макрофаги большинства здоровых людей с помощью адаптивной иммунной системы сдерживают инфекцию в пределах поражения, называемого бугорок. В большинстве случаев поражение замыкается в фиброзной капсуле, которая подвергается кальцификации, после чего ее можно легко увидеть на рентгенограмме легких инфицированного человека. Необычной особенностью M.tuberculosis является его способность десятилетиями выживать в макрофагах, содержащихся в таких поражениях. В более позднем возрасте, особенно если иммунная система ослаблена болезнью или лекарствами, инфекция может реактивироваться, распространяясь в легкие и даже в другие органы.
В большинстве случаев поражение замыкается в фиброзной капсуле, которая подвергается кальцификации, после чего ее можно легко увидеть на рентгенограмме легких инфицированного человека. Необычной особенностью M.tuberculosis является его способность десятилетиями выживать в макрофагах, содержащихся в таких поражениях. В более позднем возрасте, особенно если иммунная система ослаблена болезнью или лекарствами, инфекция может реактивироваться, распространяясь в легкие и даже в другие органы.
Туберкулез был очевидным присутствием в человеческом населении в течение тысяч лет, но еще одна бактерия, живущая в альвеолярных макрофагах, была впервые признана патогеном человека только в 1976 г. Legionella pneumophila обычно является паразитом пресноводных амеб, которые заражают вверх путем фагоцитоза. Когда капли воды, содержащие L. pneumophila или инфицированные амебы, вдыхаются в легкие, бактерии могут внедряться и жить внутри альвеолярных макрофагов (), которые для бактерий должны казаться большими амебами. Эта инфекция приводит к типу пневмонии, известной как Болезнь легионеров . Патоген может эффективно распространяться центральными системами кондиционирования воздуха, поскольку амебы, которые являются нормальными хозяевами бактерии, особенно хорошо размножаются в градирнях кондиционирования воздуха; кроме того, эти системы охлаждения производят микрокапли воды, которые легко вдыхаются. За последние десятилетия заболеваемость болезнью легионеров резко возросла, и вспышки часто связывают с системами кондиционирования воздуха в офисных зданиях, больницах и гостиницах. Другие формы современного распыления, в том числе декоративные фонтаны и распылители продуктов в супермаркетах, также были связаны со вспышками этого заболевания.
Эта инфекция приводит к типу пневмонии, известной как Болезнь легионеров . Патоген может эффективно распространяться центральными системами кондиционирования воздуха, поскольку амебы, которые являются нормальными хозяевами бактерии, особенно хорошо размножаются в градирнях кондиционирования воздуха; кроме того, эти системы охлаждения производят микрокапли воды, которые легко вдыхаются. За последние десятилетия заболеваемость болезнью легионеров резко возросла, и вспышки часто связывают с системами кондиционирования воздуха в офисных зданиях, больницах и гостиницах. Другие формы современного распыления, в том числе декоративные фонтаны и распылители продуктов в супермаркетах, также были связаны со вспышками этого заболевания.
Рисунок 25-24
Поглощение Legionella pneumophila человеческим мононуклеарным фагоцитом. На этой электронной микрофотографии показана необычная спиральная структура, индуцированная бактерией на поверхности фагоцита. (Из M.A. Horwitz, Cell 36:27–33, 1984. © Elsevier.) (подробнее…)
© Elsevier.) (подробнее…)
Некоторые бактерии вторгаются в клетки, которые в норме нефагоцитируют. Одним из способов, с помощью которого бактерии могут побудить такую клетку к фагоцитозу, является экспрессия адгезина, который связывается с высоким сродством с белком клеточной адгезии, который клетка обычно использует для прикрепления к другой клетке или к внеклеточному матриксу (обсуждается в главе 19).). Например, вызывающая диарею бактерия Yersinia pseudotuberculosis (близкая родственница чумной бактерии Yersinia pestis ) экспрессирует белок, называемый инвазином , который связывается с интегринами β1, и Listeria monocytogenes , который вызывает редкую диарею. но при тяжелой форме пищевого отравления экспрессирует белок, который связывается с Е-кадгерином. Связывание с этими трансмембранными адгезивными белками обманывает клетку-хозяина, пытаясь сформировать клеточное соединение, и она начинает перемещать актин и другие компоненты цитоскелета к месту прикрепления бактерий. Поскольку бактерия мала по сравнению с клеткой-хозяином, попытка клетки-хозяина распространиться по клейкой поверхности бактерии приводит к фагоцитарному поглощению бактерии — процесс, известный как механизм инвазии «молния» (3). Сходство этой формы инвазии с естественным процессом клеточной адгезии было подчеркнуто определением трехмерной структуры инвазина. Этот бактериальный белок имеет мотив RGD, структура которого почти идентична структуре нормального сайта связывания β1-интегрина в ламинине (обсуждается в главе 19).).
Поскольку бактерия мала по сравнению с клеткой-хозяином, попытка клетки-хозяина распространиться по клейкой поверхности бактерии приводит к фагоцитарному поглощению бактерии — процесс, известный как механизм инвазии «молния» (3). Сходство этой формы инвазии с естественным процессом клеточной адгезии было подчеркнуто определением трехмерной структуры инвазина. Этот бактериальный белок имеет мотив RGD, структура которого почти идентична структуре нормального сайта связывания β1-интегрина в ламинине (обсуждается в главе 19).).
Рисунок 25-25
Механизмы, используемые бактериями для индукции фагоцитоза нефагоцитирующими клетками-хозяевами. (A) Застежка-молния и (B) пусковой механизм патоген-индуцированного фагоцитоза требуют полимеризации актина в месте проникновения бактерий. (C) Кадры из замедленной съемки (подробнее…)
Второй путь проникновения бактерий в нефагоцитирующие клетки известен как триггерный механизм (). Его используют различные патогены, в том числе Salmonella enterica , вызывающая пищевое отравление. Эта драматическая форма инвазии инициируется, когда бактерия вводит набор эффекторных молекул в цитоплазму клетки-хозяина через систему секреции III типа. Некоторые из этих эффекторных молекул активируют GTPases Rho-семейства, которые стимулируют полимеризацию актина (обсуждается в главе 16). Другие взаимодействуют с элементами цитоскелета более непосредственно, разрезая актиновые филаменты и вызывая перестройку сшивающих белков. Конечный эффект заключается в том, что на поверхности клетки-хозяина возникают сильные локальные взъерошивания (1), в результате чего образуются большие, богатые актином выпячивания, которые загибаются и захватывают бактерию внутри больших эндоцитарных пузырьков, называемых 9.0414 макропиносомы . Общий вид клеток, подвергшихся вторжению с помощью триггерного механизма, похож на сильное взъерошивание, вызванное некоторыми факторами роста, что позволяет предположить, что сходные внутриклеточные сигнальные каскады активируются в обоих случаях.
Эта драматическая форма инвазии инициируется, когда бактерия вводит набор эффекторных молекул в цитоплазму клетки-хозяина через систему секреции III типа. Некоторые из этих эффекторных молекул активируют GTPases Rho-семейства, которые стимулируют полимеризацию актина (обсуждается в главе 16). Другие взаимодействуют с элементами цитоскелета более непосредственно, разрезая актиновые филаменты и вызывая перестройку сшивающих белков. Конечный эффект заключается в том, что на поверхности клетки-хозяина возникают сильные локальные взъерошивания (1), в результате чего образуются большие, богатые актином выпячивания, которые загибаются и захватывают бактерию внутри больших эндоцитарных пузырьков, называемых 9.0414 макропиносомы . Общий вид клеток, подвергшихся вторжению с помощью триггерного механизма, похож на сильное взъерошивание, вызванное некоторыми факторами роста, что позволяет предположить, что сходные внутриклеточные сигнальные каскады активируются в обоих случаях.
Внутриклеточные паразиты активно вторгаются в клетки-хозяева
Поглощение вирусов путем рецептор-опосредованного эндоцитоза и бактерий путем фагоцитоза требует энергии, выделяемой клеткой-хозяином. Патоген является относительно пассивным участником, обычно обеспечивая триггер для запуска процесса инвазии, но не внося никакой метаболической энергии. Напротив, инвазия внутриклеточных эукариотических паразитов, которые обычно намного крупнее бактерий, протекает по множеству сложных путей, обычно требующих значительных затрат энергии со стороны паразита.
Патоген является относительно пассивным участником, обычно обеспечивая триггер для запуска процесса инвазии, но не внося никакой метаболической энергии. Напротив, инвазия внутриклеточных эукариотических паразитов, которые обычно намного крупнее бактерий, протекает по множеству сложных путей, обычно требующих значительных затрат энергии со стороны паразита.
Поучительным примером является Toxoplasma gondii , кошачий паразит, который также иногда вызывает серьезные инфекции у человека. Когда этот простейший контактирует с клеткой-хозяином, он выпячивает ребристую структуру из микротрубочек, называемую коноидом , а затем переориентируется так, что коноид касается поверхности клетки-хозяина. Затем паразит медленно проникает в клетку-хозяина. Энергия для вторжения, по-видимому, полностью исходит от паразита, и этот процесс может быть нарушен путем деполимеризации актинового цитоскелета паразита, но не хозяина. Когда паразит перемещается в клетку-хозяина, он выделяет липиды из пары специализированных органелл, образуя вакуолярную мембрану, состоящую в основном из липидов и белков паразита. Таким образом, организм защищает себя в окруженном мембраной компартменте внутри клетки-хозяина, который не участвует в путях переноса через мембрану клетки-хозяина и не сливается с лизосомами (4). Специализированная вакуолярная мембрана позволяет паразиту поглощать метаболические промежуточные продукты и питательные вещества из цитозоля клетки-хозяина, но исключает более крупные молекулы.
Таким образом, организм защищает себя в окруженном мембраной компартменте внутри клетки-хозяина, который не участвует в путях переноса через мембрану клетки-хозяина и не сливается с лизосомами (4). Специализированная вакуолярная мембрана позволяет паразиту поглощать метаболические промежуточные продукты и питательные вещества из цитозоля клетки-хозяина, но исключает более крупные молекулы.
Рисунок 25-26
Жизненный цикл внутриклеточного паразита Toxoplasma gondii . (A) После прикрепления к клетке-хозяину T. gondii секретирует липиды (красный) из внутренних органелл. После инвазии паразит размножается в специальной вакуоли, образованной из липидов паразита. (подробнее…)
Совершенно иную, но не менее своеобразную стратегию инвазии используют простейшие Trypanosoma cruzi , вызывающие полиорганное заболевание (болезнь Шагаса) преимущественно в Мексике, Центральной и Южной Америке. После прикрепления к интегринам β1 на поверхности клетки-хозяина этот паразит индуцирует локальное повышение Ca 2+ в цитоплазме клетки-хозяина. Сигнал Ca 2+ рекрутирует лизосомы к месту прикрепления паразита, которые затем сливаются с плазматической мембраной, позволяя паразиту проникнуть в вакуоль, происходящую почти полностью из лизосомальной мембраны (4). Как мы обсудим ниже, большинство внутриклеточных патогенов делают все возможное, чтобы избежать воздействия враждебной протеолитической среды лизосомы, но эта трипаносома использует лизосому как средство проникновения. В вакуоли паразит выделяет фермент транссиалидазу, который удаляет сиаловую кислоту из лизосомальных гликопротеинов и переносит ее на свои собственные поверхностные молекулы, тем самым покрывая себя сахарами клетки-хозяина. Затем паразит выделяет порообразующий токсин, который лизирует вакуолярную мембрану, высвобождая паразита в цитозоль клетки-хозяина, где он размножается.
Сигнал Ca 2+ рекрутирует лизосомы к месту прикрепления паразита, которые затем сливаются с плазматической мембраной, позволяя паразиту проникнуть в вакуоль, происходящую почти полностью из лизосомальной мембраны (4). Как мы обсудим ниже, большинство внутриклеточных патогенов делают все возможное, чтобы избежать воздействия враждебной протеолитической среды лизосомы, но эта трипаносома использует лизосому как средство проникновения. В вакуоли паразит выделяет фермент транссиалидазу, который удаляет сиаловую кислоту из лизосомальных гликопротеинов и переносит ее на свои собственные поверхностные молекулы, тем самым покрывая себя сахарами клетки-хозяина. Затем паразит выделяет порообразующий токсин, который лизирует вакуолярную мембрану, высвобождая паразита в цитозоль клетки-хозяина, где он размножается.
Рисунок 25-27
Вторжение Trypansoma cruzi . Этот паразит привлекает лизосомы клетки-хозяина к месту своего прикрепления. Лизосомы сливаются с плазматической мембраной, образуя вакуоль, почти полностью состоящую из лизосомальной мембраны. После кратковременного пребывания в вакуоли (подробнее…)
После кратковременного пребывания в вакуоли (подробнее…)
Многие патогены изменяют мембранный трафик в клетке-хозяине
Два примера внутриклеточных паразитов, обсуждавшихся в предыдущем разделе, поднимают общую проблему, с которой сталкиваются все патогены с внутриклеточным образом жизни. , включая вирусы, бактерии и паразиты. Они должны каким-то образом иметь дело с мембранным движением в клетке-хозяине. После эндоцитоза клеткой-хозяином они обычно оказываются в эндосомальном компартменте, который обычно сливается с лизосомами. Следовательно, они должны либо модифицировать компартмент, чтобы предотвратить его слияние, либо покинуть компартмент до того, как будут переварены, либо найти способы выжить во враждебной среде фаголизосомы (4).
Рисунок 25-28
Выбор, с которым сталкивается внутриклеточный патоген. После проникновения, как правило, путем эндоцитоза или фагоцитоза в окруженный мембраной компартмент, внутриклеточные патогены могут использовать одну из трех стратегий для выживания и размножения. Патогены, которые следуют стратегии (подробнее…)
Патогены, которые следуют стратегии (подробнее…)
Большинство патогенов используют либо первую, либо вторую стратегию. Гораздо реже можно найти патогены, которые могут выжить в фаголизосомах. Как мы видели, Trypanosoma cruzi использует путь отхода, как и практически все вирусы (см. Ресурсы). Бактерия Listeria monocytogenes также использует эту стратегию. Он проникает в клетки с помощью механизма «молния», описанного ранее, и выделяет белок, называемый гемолизин , который образует большие поры в фагосомальной мембране, в конечном итоге разрушая мембрану и высвобождая бактерии в цитозоль. Попав в цитозоль, бактерии продолжают выделять гемолизин, но он не разрушает плазматическую мембрану. Гемолизин избирательно разрушает только мембрану фагосомы по двум причинам: во-первых, он в десять раз более активен при кислых значениях рН в фагосомах, чем при нейтральных значениях рН в цитозоле, и, во-вторых, гемолизин содержит последовательность PEST (пептидный мотив богат пролином, глутаматом, серином и треонином), который распознается механизмом деградации белка в клетке-хозяине, что приводит к быстрой деградации бактериального гемолизина в протеасоме (см. Гемолизин стабилен в фагосоме, так как механизм деградации не имеет доступа к нему там (11). Гемолизин, секретируемый L. monocytogenes тесно связан с гемолизинами, секретируемыми другими бактериями, не являющимися внутриклеточными патогенами. Однако во всех этих родственных гемолизинах отсутствуют последовательности PEST. Похоже, что гемолизин L. monocytogenes специально приобрел домен эукариотического белка, чтобы позволить регулировать его активность в клетке-хозяине.
Гемолизин стабилен в фагосоме, так как механизм деградации не имеет доступа к нему там (11). Гемолизин, секретируемый L. monocytogenes тесно связан с гемолизинами, секретируемыми другими бактериями, не являющимися внутриклеточными патогенами. Однако во всех этих родственных гемолизинах отсутствуют последовательности PEST. Похоже, что гемолизин L. monocytogenes специально приобрел домен эукариотического белка, чтобы позволить регулировать его активность в клетке-хозяине.
Рисунок 25-29
Селективное разрушение фагосомальной мембраны Listeria monocytogenes .
Л. моноцитогенес прикрепляется к Е-кадгерину на поверхности эпителиальных клеток и индуцирует собственное поглощение по механизму застежки-молнии (см. рис. 25-25А). Внутри фагосомы бактерия (подробнее…)
Наиболее распространенная стратегия, используемая внутриклеточными бактериями и паразитами, заключается в модификации эндосомного компартмента, чтобы они могли оставаться там и размножаться. Они должны модифицировать компартмент по крайней мере двумя способами: во-первых, они должны предотвращать слияние лизосом и, во-вторых, они должны обеспечивать путь для импорта питательных веществ из цитозоля хозяина. Различные патогены имеют разные стратегии для этого. Как мы видели, Toxoplasma gondii создает свой собственный компартмент, окруженный мембраной, который не участвует в нормальном движении мембраны клетки-хозяина и обеспечивает перенос питательных веществ. Этот вариант не доступен для бактерий, которые слишком малы, чтобы иметь собственный запас мембраны. Mycobacterium tuberculosis каким-то образом предотвращает созревание очень ранней эндосомы, содержащей ее, так что она никогда не подкисляется и не приобретает характеристики поздней эндосомы. Эндосомы, содержащие Salmonella enterica, , напротив, подкисляют и приобретают маркеры поздних эндосом, но они останавливают их созревание на стадии, предшествующей слиянию лизосом. Другие бактерии, по-видимому, находят убежище во внутриклеточных компартментах, которые полностью отличаются от обычного эндоцитарного пути.
Они должны модифицировать компартмент по крайней мере двумя способами: во-первых, они должны предотвращать слияние лизосом и, во-вторых, они должны обеспечивать путь для импорта питательных веществ из цитозоля хозяина. Различные патогены имеют разные стратегии для этого. Как мы видели, Toxoplasma gondii создает свой собственный компартмент, окруженный мембраной, который не участвует в нормальном движении мембраны клетки-хозяина и обеспечивает перенос питательных веществ. Этот вариант не доступен для бактерий, которые слишком малы, чтобы иметь собственный запас мембраны. Mycobacterium tuberculosis каким-то образом предотвращает созревание очень ранней эндосомы, содержащей ее, так что она никогда не подкисляется и не приобретает характеристики поздней эндосомы. Эндосомы, содержащие Salmonella enterica, , напротив, подкисляют и приобретают маркеры поздних эндосом, но они останавливают их созревание на стадии, предшествующей слиянию лизосом. Другие бактерии, по-видимому, находят убежище во внутриклеточных компартментах, которые полностью отличаются от обычного эндоцитарного пути. Например, Legionella pneumophila реплицируется в компартментах, покрытых слоями шероховатого эндоплазматического ретикулума. Chlamydia trachomatis , бактериальный патоген, передающийся половым путем, который может вызывать бесплодие и слепоту, размножается в компартменте, который, по-видимому, наиболее похож на часть экзоцитарного пути (). Механизмы, используемые этими организмами для изменения своих мембранных компартментов, еще не изучены.
Например, Legionella pneumophila реплицируется в компартментах, покрытых слоями шероховатого эндоплазматического ретикулума. Chlamydia trachomatis , бактериальный патоген, передающийся половым путем, который может вызывать бесплодие и слепоту, размножается в компартменте, который, по-видимому, наиболее похож на часть экзоцитарного пути (). Механизмы, используемые этими организмами для изменения своих мембранных компартментов, еще не изучены.
Рисунок 25-30
Модификации переноса внутриклеточных мембран бактериальными патогенами. Четыре внутриклеточных бактериальных патогена, Mycobacterium tuberculosis , Salmonella enterica , Legionella pneumophila и Chlamydia trachomatis , все реплицируются в окруженных мембраной (далее…)
Вирусы также часто изменяют мембранный трафик в клетке-хозяине. . Вирусы с оболочкой должны приобретать свою мембрану из фосфолипидов клетки-хозяина. В простейших случаях кодируемые вирусом белки встраиваются в мембрану ЭР и следуют обычным путем через аппарат Гольджи к плазматической мембране, претерпевая различные посттрансляционные модификации в пути . Затем вирусный капсид собирается на плазматической мембране и отпочковывается от поверхности клетки. Это механизм, используемый ВИЧ. Другие вирусы с оболочкой взаимодействуют сложным образом с путями переноса через мембрану в клетке-хозяине (14). Даже некоторые безоболочечные вирусы изменяют мембранный трафик в клетке-хозяине в соответствии со своими собственными целями. Репликация полиовируса, например, осуществляется ассоциированной с мембраной, кодируемой вирусом РНК-полимеразой. Репликация может происходить быстрее, если площадь поверхности мембран клетки-хозяина увеличена. Для этого вирус индуцирует повышенный синтез липидов в клетке-хозяине и блокирует секрецию из ER. Таким образом, внутриклеточные мембраны накапливаются, увеличивая площадь поверхности, на которой может происходить репликация РНК (4).
Затем вирусный капсид собирается на плазматической мембране и отпочковывается от поверхности клетки. Это механизм, используемый ВИЧ. Другие вирусы с оболочкой взаимодействуют сложным образом с путями переноса через мембрану в клетке-хозяине (14). Даже некоторые безоболочечные вирусы изменяют мембранный трафик в клетке-хозяине в соответствии со своими собственными целями. Репликация полиовируса, например, осуществляется ассоциированной с мембраной, кодируемой вирусом РНК-полимеразой. Репликация может происходить быстрее, если площадь поверхности мембран клетки-хозяина увеличена. Для этого вирус индуцирует повышенный синтез липидов в клетке-хозяине и блокирует секрецию из ER. Таким образом, внутриклеточные мембраны накапливаются, увеличивая площадь поверхности, на которой может происходить репликация РНК (4).
Рисунок 25-31
Сложные стратегии получения вирусной оболочки. (A) Капсиды вируса герпеса собираются в ядре, а затем прорастают через внутреннюю ядерную мембрану, приобретая мембранную оболочку. Затем они, по-видимому, теряют эту оболочку, когда сливаются с внешней (подробнее…)
Затем они, по-видимому, теряют эту оболочку, когда сливаются с внешней (подробнее…)
Рисунок 25-32
Изменения внутриклеточной мембраны, вызванные белком полиовируса. Полиовирус, как и другие вирусы с положительной цепью РНК, реплицирует свой РНК-геном с помощью полимеразы, которая связывается с внутриклеточными мембранами. Несколько белков, закодированных в его (далее…)
Вирусы и бактерии используют цитоскелет клетки-хозяина для внутриклеточного движения
Цитоплазма клеток млекопитающих чрезвычайно вязкая. Он переполнен органеллами и поддерживается сетями цитоскелетных филаментов, которые препятствуют диффузии частиц размером с бактериальный или вирусный капсид. Если патоген должен достичь определенной части клетки, чтобы выполнить часть своего цикла репликации, он должен активно перемещаться туда. Как и в случае транспорта внутриклеточных органелл, патогены обычно используют цитоскелет для активного движения.
Несколько бактерий, которые размножаются в цитозоле клетки-хозяина (а не в компартментах, окруженных мембраной), приобрели замечательный механизм передвижения, который зависит от полимеризации актина. Эти бактерии, в том числе Listeria monocytogenes , Shigella flexneri и Rickettsia rickettsii (вызывает пятнистую лихорадку Скалистых гор), индуцируют зарождение и сборку актиновых филаментов клетки-хозяина на одном полюсе бактерии. Растущие нити создают значительную силу и проталкивают бактерии через цитоплазму со скоростью до 1 мкм/сек. Новые филаменты формируются в задней части каждой бактерии и оставляют позади себя, как ракетный след, по мере того, как бактерия продвигается вперед, снова деполимеризуясь в течение минуты или около того, когда они сталкиваются с деполимеризующими факторами в цитозоле. Когда движущаяся бактерия достигает плазматической мембраны, она продолжает двигаться наружу, вызывая образование длинного тонкого выступа с бактерией на его конце. Этот выступ часто поглощается соседней клеткой, что позволяет бактерии проникнуть в цитоплазму соседней клетки, не подвергаясь воздействию внеклеточной среды, тем самым избегая распознавания антителами, вырабатываемыми адаптивной иммунной системой хозяина.
Эти бактерии, в том числе Listeria monocytogenes , Shigella flexneri и Rickettsia rickettsii (вызывает пятнистую лихорадку Скалистых гор), индуцируют зарождение и сборку актиновых филаментов клетки-хозяина на одном полюсе бактерии. Растущие нити создают значительную силу и проталкивают бактерии через цитоплазму со скоростью до 1 мкм/сек. Новые филаменты формируются в задней части каждой бактерии и оставляют позади себя, как ракетный след, по мере того, как бактерия продвигается вперед, снова деполимеризуясь в течение минуты или около того, когда они сталкиваются с деполимеризующими факторами в цитозоле. Когда движущаяся бактерия достигает плазматической мембраны, она продолжает двигаться наружу, вызывая образование длинного тонкого выступа с бактерией на его конце. Этот выступ часто поглощается соседней клеткой, что позволяет бактерии проникнуть в цитоплазму соседней клетки, не подвергаясь воздействию внеклеточной среды, тем самым избегая распознавания антителами, вырабатываемыми адаптивной иммунной системой хозяина.
Рисунок 25-33
Основанное на актине перемещение Listeria monocytogenes внутри и между клетками-хозяевами. (A) Эти бактерии индуцируют сборку богатых актином хвостов в цитоплазме клетки-хозяина, что позволяет им быстро двигаться. Подвижные бактерии распространяются от клетки к клетке, образуя (подробнее…)
Для двух из этих бактерий определен молекулярный механизм индуцированной патогенами сборки актина. Механизмы разные, что позволяет предположить, что они развились независимо. Хотя оба используют один и тот же регуляторный путь клетки-хозяина, который обычно контролирует зарождение актиновых филаментов, они используют разные точки пути. Как обсуждалось в главе 16, активация малой ГТФазы Cdc42 факторами роста или другими внешними сигналами вызывает активацию белка, называемого N-WASp, который, в свою очередь, активирует комплекс ARP, который может запускать рост новых актиновых филаментов. 9Поверхностный белок 0414 L. monocytogenes непосредственно связывается с ARP-комплексом и активирует его, инициируя образование актинового хвоста, в то время как неродственный поверхностный белок S. flexneri связывается и активирует N-WASp, который затем активирует ARP-комплекс. Примечательно, что вирус коровьей оспы использует еще один механизм для внутриклеточного перемещения, индуцируя полимеризацию актина, снова используя тот же самый регуляторный путь (12).
flexneri связывается и активирует N-WASp, который затем активирует ARP-комплекс. Примечательно, что вирус коровьей оспы использует еще один механизм для внутриклеточного перемещения, индуцируя полимеризацию актина, снова используя тот же самый регуляторный путь (12).
Рисунок 25-34
Молекулярные механизмы нуклеации актина различными патогенами. Бактерии Listeria monocytogenes и Shigella flexneri и вирус коровьей оспы перемещаются внутриклеточно с помощью полимеризации актина. Чтобы вызвать нуклеацию актина, все эти патогены рекрутируют (подробнее…)
Другие патогены полагаются прежде всего на транспорт на основе микротрубочек для перемещения внутри клетки-хозяина. Это движение особенно хорошо иллюстрируется вирусами, поражающими нейроны. Важным примером служат нейротропные альфа-вирусы герпеса, группа, в которую входит вирус, вызывающий ветряную оспу. При заражении сенсорных нейронов вирусные частицы транспортируются в ядро с помощью транспорта на основе микротрубочек, вероятно, опосредованного присоединением капсидов к моторному белку динеину. После репликации и сборки в ядре вирус с оболочкой транспортируется по микротрубочкам от тела нейронной клетки вниз по аксону, предположительно, путем прикрепления к моторному белку кинезина (14).
После репликации и сборки в ядре вирус с оболочкой транспортируется по микротрубочкам от тела нейронной клетки вниз по аксону, предположительно, путем прикрепления к моторному белку кинезина (14).
Рисунок 25-35
Перенос вируса герпеса в аксон. Эта нервная клетка была инфицирована альфа-вирусом герпеса, который был генетически модифицирован для экспрессии зеленого флуоресцентного белка (GFP), слитого с одним из его капсидных белков. В этом сегменте аксона несколько (подробнее…)
Одна бактерия, которая, как известно, ассоциируется с микротрубочками, это Wolbachia . Этот увлекательный род включает множество видов, являющихся паразитами или симбионтами насекомых и других беспозвоночных, живущих в цитозоле каждой клетки животного. Инфекция распространяется вертикально от матери к потомству, как Wolbachia также присутствуют в яйцах. Бактерии обеспечивают их передачу в каждую клетку, связываясь с микротрубочками, и поэтому они расщепляются митотическим веретеном одновременно с сегрегацией хромосом при делении инфицированной клетки (4). Как мы обсудим позже, инфекция Wolbachia может значительно изменить репродуктивное поведение насекомых-хозяев.
Как мы обсудим позже, инфекция Wolbachia может значительно изменить репродуктивное поведение насекомых-хозяев.
Рисунок 25-36
Микрофотография флуоресценции Wolbachia (красная) , связанная с микротрубочками (зеленый) митотических веретен у эмбриона дрозофилы . Скопления бактерий на полюсах веретена будут разделены на две дочерние клетки при делении каждой зараженной клетки. (подробнее…)
Вирусы берут на себя метаболизм клетки-хозяина
Большинство внутриклеточных бактерий и паразитов несут основную генетическую информацию, необходимую для их собственного метаболизма и репликации, и они полагаются на свои клетки-хозяева только для получения питательных веществ. Вирусы, напротив, используют основной механизм клетки-хозяина для большинства аспектов своего размножения: все они зависят от рибосом клетки-хозяина для производства своих белков, а некоторые также используют ДНК- и РНК-полимеразы клетки-хозяина для репликации и транскрипции соответственно.
Многие вирусы кодируют белки, которые модифицируют аппарат транскрипции или трансляции хозяина, чтобы способствовать синтезу вирусных белков по сравнению с белками клетки-хозяина. В результате синтетическая способность клетки-хозяина направлена главным образом на производство новых вирусных частиц. Полиовирус, например, кодирует протеазу, которая специфически расщепляет компонент ТАТА-связывающего фактора TFIID (см. Ресурсы), эффективно отключая всю транскрипцию клетки-хозяина с помощью РНК-полимеразы II. Вирус гриппа продуцирует белок, который блокирует как сплайсинг, так и полиаденилирование транскриптов мРНК, поэтому они не могут экспортироваться из ядра (см. Ресурсы).
Инициация трансляции большинства мРНК клетки-хозяина зависит от узнавания их 5′-кэпа группой факторов инициации трансляции (см. ). Инициация трансляции мРНК хозяина часто подавляется во время вирусной инфекции, так что рибосомы клетки-хозяина могут более эффективно использоваться для синтеза вирусных белков. Некоторые вирусы кодируют эндонуклеазы, которые отщепляют 5′-кэп от мРНК клетки-хозяина. Некоторые даже затем используют освобожденные 5′-кэпы в качестве праймеров для синтеза вирусных мРНК, процесс, называемый вырывание кепки . Несколько других вирусных РНК-геномов кодируют протеазы, расщепляющие определенные факторы инициации трансляции. Эти вирусы полагаются на 5′-кэп-независимую трансляцию вирусной РНК с использованием внутренних сайтов входа в рибосомы (IRES) (см. 2).
Некоторые вирусы кодируют эндонуклеазы, которые отщепляют 5′-кэп от мРНК клетки-хозяина. Некоторые даже затем используют освобожденные 5′-кэпы в качестве праймеров для синтеза вирусных мРНК, процесс, называемый вырывание кепки . Несколько других вирусных РНК-геномов кодируют протеазы, расщепляющие определенные факторы инициации трансляции. Эти вирусы полагаются на 5′-кэп-независимую трансляцию вирусной РНК с использованием внутренних сайтов входа в рибосомы (IRES) (см. 2).
Несколько ДНК-вирусов используют ДНК-полимеразу клетки-хозяина для репликации своего генома. Эти вирусы должны решить проблему: ДНК-полимераза экспрессируется на высоком уровне только во время S фазы клеточного цикла, тогда как большинство клеток, которые заражают вирусы, проводят большую часть своего времени в G9.1366 1 фаза. Аденовирус решает эту проблему, побуждая клетку-хозяина входить в S-фазу. Его геном кодирует белки, которые инактивируют как Rb, так и p53, два ключевых супрессора прогрессии клеточного цикла (обсуждается в главе 17). Как и следовало ожидать от любого механизма, индуцирующего нерегулируемую репликацию ДНК, эти вирусы часто являются онкогенными.
Как и следовало ожидать от любого механизма, индуцирующего нерегулируемую репликацию ДНК, эти вирусы часто являются онкогенными.
Патогены могут изменять поведение организма-хозяина, способствуя распространению патогена
Как мы видели, патогены часто изменяют поведение клетки-хозяина таким образом, что это способствует выживанию и размножению патогена. Точно так же патогены часто изменяют поведение всего организма-хозяина, чтобы способствовать распространению патогенов, как мы видели ранее для Trypanosoma brucei и Yersinia pestis. В некоторых случаях трудно сказать, является ли конкретная реакция хозяина более полезной для хозяина или для патогена. Например, такие патогены, как Salmonella enterica , вызывающие диарею, обычно вызывают самоограничивающиеся инфекции, поскольку диарея эффективно вымывает патоген. Однако бактериальная диарея может передать инфекцию новому хозяину. Точно так же кашель и чихание помогают очистить дыхательные пути от патогенов, но они также передают инфекцию новым людям. Человек с простудой может произвести 20 000 капель при одном чихании, и все они несут риновирус или вирус короны.
Человек с простудой может произвести 20 000 капель при одном чихании, и все они несут риновирус или вирус короны.
Пугающим примером патогена, изменяющего поведение хозяина, является бешенство, впервые описанное в египетских писаниях более 3000 лет назад. Этот вирус размножается в нейронах и вызывает у инфицированных людей или животных «бешенство»: они становятся необычно агрессивными и испытывают сильное желание укусить. Вирус выделяется со слюной и передается через укушенную рану в кровоток жертвы, распространяя инфекцию на нового хозяина.
Toxoplasma gondii , эукариотический паразит, который образует поражения в мышечной и мозговой ткани, представляет собой столь же примечательный пример. Он может завершить свой жизненный цикл только в своих обычных хозяевах — кошках. Если он заражает промежуточного хозяина, такого как грызун или человек, инфекция становится тупиковой для паразита, если только промежуточный хозяин не съеден кошкой. Поведенческие исследования показывают, что крысы, инфицированные T. gondii теряют свой врожденный страх перед кошками и вместо этого предпочитают искать места, пропахшие кошачьей мочой, а не места, пропахшие кроличьей мочой, что прямо противоположно нормальному поведению крыс.
gondii теряют свой врожденный страх перед кошками и вместо этого предпочитают искать места, пропахшие кошачьей мочой, а не места, пропахшие кроличьей мочой, что прямо противоположно нормальному поведению крыс.
Но самый яркий пример воздействия патогенов на поведение хозяина принадлежит Wolbachia . Эти бактерии манипулируют сексуальным поведением своего хозяина, чтобы максимизировать свое распространение. Как описано ранее, Wolbachia вертикально передаются потомству через яйца. Однако, если они живут в самце, они заходят в тупик, поскольку исключаются из спермы. У некоторых видов Drosophila , Wolbachia модифицируют сперму своего хозяина таким образом, что они могут оплодотворять яйцеклетки только инфицированных самок. Эта модификация создает репродуктивное преимущество для инфицированных самок по сравнению с неинфицированными самками, так что общая доля носителей Wolbachia увеличивается. У других видов-хозяев инфекция Wolbachia убивает самцов, но щадит самок, увеличивая количество самок в популяции и, следовательно, количество особей, которые могут производить яйца для передачи инфекции. У некоторых видов ос 9Инфекции 0414 Wolbachia позволяют самкам производить яйцеклетки, которые развиваются партеногенетически без необходимости оплодотворения спермой; у этого вида полностью исчезли самцы. Для некоторых своих хозяев Wolbachia стала незаменимым симбионтом, и излечение от инфекции вызывает смерть хозяина. В одном случае люди используют эту зависимость: филяриатозную нематоду, вызывающую африканскую речную слепоту, трудно убить с помощью противопаразитарных препаратов, но когда людей с речной слепотой лечат антибиотиками, они излечивают нематодную болезнь9.0414 Wolbachia инфекция, нематодная инфекция также задержана.
У некоторых видов ос 9Инфекции 0414 Wolbachia позволяют самкам производить яйцеклетки, которые развиваются партеногенетически без необходимости оплодотворения спермой; у этого вида полностью исчезли самцы. Для некоторых своих хозяев Wolbachia стала незаменимым симбионтом, и излечение от инфекции вызывает смерть хозяина. В одном случае люди используют эту зависимость: филяриатозную нематоду, вызывающую африканскую речную слепоту, трудно убить с помощью противопаразитарных препаратов, но когда людей с речной слепотой лечат антибиотиками, они излечивают нематодную болезнь9.0414 Wolbachia инфекция, нематодная инфекция также задержана.
Патогены быстро развиваются
Сложность и специфичность молекулярных взаимодействий между патогенами и их клетками-хозяевами может свидетельствовать о том, что вирулентность трудно приобрести путем случайной мутации. Тем не менее, постоянно появляются новые патогены, а старые патогены постоянно изменяются таким образом, что уже знакомые инфекции трудно поддаются лечению. У патогенов есть два больших преимущества, которые позволяют им быстро развиваться. Во-первых, они очень быстро размножаются, предоставляя много материала для механизма естественного отбора. В то время как люди и шимпанзе приобрели 2-процентную разницу в последовательностях генома примерно за 8 миллионов лет дивергентной эволюции, полиовирус справляется с 2-процентным изменением своего генома за 5 дней, примерно за то время, которое требуется вирусу, чтобы попасть из человеческого рта в рот. кишки. Во-вторых, на эту быструю генетическую изменчивость действует мощное селективное давление, обеспечиваемое адаптивной иммунной системой хозяина и современной медициной, которые уничтожают патогены, которые не могут измениться.
У патогенов есть два больших преимущества, которые позволяют им быстро развиваться. Во-первых, они очень быстро размножаются, предоставляя много материала для механизма естественного отбора. В то время как люди и шимпанзе приобрели 2-процентную разницу в последовательностях генома примерно за 8 миллионов лет дивергентной эволюции, полиовирус справляется с 2-процентным изменением своего генома за 5 дней, примерно за то время, которое требуется вирусу, чтобы попасть из человеческого рта в рот. кишки. Во-вторых, на эту быструю генетическую изменчивость действует мощное селективное давление, обеспечиваемое адаптивной иммунной системой хозяина и современной медициной, которые уничтожают патогены, которые не могут измениться.
Мелким примером постоянной борьбы между инфекцией и иммунитетом является явление антигенной изменчивости. Важным адаптивным иммунным ответом против многих патогенов является выработка антител, которые распознают специфические антигены на поверхности патогена (обсуждается в главе 24). Многие патогены избегают полной элиминации антителами, изменяя эти антигены в ходе инфекции. У некоторых паразитов, например, происходят запрограммированные перестройки генов, кодирующих их поверхностные антигены. Самый яркий пример встречается в африканских трипаносомах, таких как Trypanosoma brucei , паразит, вызывающий сонную болезнь и распространяемый насекомым-переносчиком ( T. brucei является близким родственником T. cruzi (см.), но размножается внеклеточно, а не внутри клеток). T. brucei покрыт гликопротеином одного типа, называемым вариантно-специфическим гликопротеином ( VSG ), который вызывает защитный гуморальный ответ, который быстро уничтожает большинство паразитов. Однако геном трипаносом содержит около 1000 генов VSG , каждый из которых кодирует VSG с различными антигенными свойствами. Только один из этих генов экспрессируется в любой момент времени путем копирования в активный сайт экспрессии в геноме. Экспрессируемый ген VSG может многократно изменяться путем генных перестроек, которые копируют новые аллели в сайт экспрессии.
Многие патогены избегают полной элиминации антителами, изменяя эти антигены в ходе инфекции. У некоторых паразитов, например, происходят запрограммированные перестройки генов, кодирующих их поверхностные антигены. Самый яркий пример встречается в африканских трипаносомах, таких как Trypanosoma brucei , паразит, вызывающий сонную болезнь и распространяемый насекомым-переносчиком ( T. brucei является близким родственником T. cruzi (см.), но размножается внеклеточно, а не внутри клеток). T. brucei покрыт гликопротеином одного типа, называемым вариантно-специфическим гликопротеином ( VSG ), который вызывает защитный гуморальный ответ, который быстро уничтожает большинство паразитов. Однако геном трипаносом содержит около 1000 генов VSG , каждый из которых кодирует VSG с различными антигенными свойствами. Только один из этих генов экспрессируется в любой момент времени путем копирования в активный сайт экспрессии в геноме. Экспрессируемый ген VSG может многократно изменяться путем генных перестроек, которые копируют новые аллели в сайт экспрессии. Таким образом, несколько трипаносом с измененным VSG избегают опосредованного антителами клиренса, реплицируются и вызывают рецидив заболевания, приводя к хронической циклической инфекции).
Таким образом, несколько трипаносом с измененным VSG избегают опосредованного антителами клиренса, реплицируются и вызывают рецидив заболевания, приводя к хронической циклической инфекции).
Рисунок 25-37
Антигенная изменчивость трипаносом. (A) Существует около 1000 различных генов VSG в Trypanosoma brucei , но только один сайт для экспрессии генов VSG . Неактивный ген копируется в сайт экспрессии путем генной конверсии, где он теперь экспрессируется. Редкое переключение (подробнее…)
Другой тип антигенной изменчивости возникает в ходе заражения вирусами, механизмы репликации которых подвержены ошибкам. Ретровирусы, например, приобретают в среднем одну точечную мутацию за каждый цикл репликации, потому что вирусная обратная транскриптаза, которая производит ДНК из генома вирусной РНК, не может исправить ошибки неправильного включения нуклеотидов. Типичная нелеченая ВИЧ-инфекция может в конечном итоге включать геномы ВИЧ со всеми возможными точечными мутациями. В некотором смысле высокая частота мутаций полезна для патогена. В результате микроэволюционного процесса мутации и отбора внутри каждого хозяина вирус может переключиться с заражения макрофагов на заражение Т-клеток (как описано ранее) и после начала лечения может быстро приобрести устойчивость к лекарствам. Однако, если бы частота ошибок обратной транскриптазы была слишком высокой, вредные мутации могли бы накапливаться слишком быстро, чтобы позволить вирусу выжить. Кроме того, быстрая вирусная диверсификация в одном хозяине не обязательно приводит к быстрой эволюции вируса в популяции, поскольку мутировавший вирус может быть неспособен заразить нового хозяина. Для ВИЧ-1 степень этого ограничения можно оценить, изучив разнообразие последовательностей среди разных людей, инфицированных вирусом. Примечательно, что только около одной трети нуклеотидных позиций в кодирующей последовательности вируса являются инвариантными, а нуклеотидные последовательности в некоторых частях генома, таких как env , могут отличаться на целых 30%.
В некотором смысле высокая частота мутаций полезна для патогена. В результате микроэволюционного процесса мутации и отбора внутри каждого хозяина вирус может переключиться с заражения макрофагов на заражение Т-клеток (как описано ранее) и после начала лечения может быстро приобрести устойчивость к лекарствам. Однако, если бы частота ошибок обратной транскриптазы была слишком высокой, вредные мутации могли бы накапливаться слишком быстро, чтобы позволить вирусу выжить. Кроме того, быстрая вирусная диверсификация в одном хозяине не обязательно приводит к быстрой эволюции вируса в популяции, поскольку мутировавший вирус может быть неспособен заразить нового хозяина. Для ВИЧ-1 степень этого ограничения можно оценить, изучив разнообразие последовательностей среди разных людей, инфицированных вирусом. Примечательно, что только около одной трети нуклеотидных позиций в кодирующей последовательности вируса являются инвариантными, а нуклеотидные последовательности в некоторых частях генома, таких как env , могут отличаться на целых 30%. Эта необычайная геномная пластичность значительно усложняет попытки разработки вакцин против ВИЧ, а также может привести к быстрой лекарственной устойчивости (см. ниже). Еще одним следствием стала быстрая диверсификация и появление новых штаммов ВИЧ. Сравнение последовательностей между различными штаммами ВИЧ и очень похожим обезьяньим вирусом иммунодефицита (SIV) от множества различных видов обезьян, по-видимому, указывает на то, что наиболее вирулентный тип ВИЧ, ВИЧ-1, мог перейти от шимпанзе к человеку совсем недавно, в 1930).
Эта необычайная геномная пластичность значительно усложняет попытки разработки вакцин против ВИЧ, а также может привести к быстрой лекарственной устойчивости (см. ниже). Еще одним следствием стала быстрая диверсификация и появление новых штаммов ВИЧ. Сравнение последовательностей между различными штаммами ВИЧ и очень похожим обезьяньим вирусом иммунодефицита (SIV) от множества различных видов обезьян, по-видимому, указывает на то, что наиболее вирулентный тип ВИЧ, ВИЧ-1, мог перейти от шимпанзе к человеку совсем недавно, в 1930).
Рисунок 25-38
Диверсификация ВИЧ-1, ВИЧ-2 и родственных штаммов ВИО. Генетическая дистанция между любыми двумя вирусными изолятами определяется по кратчайшему пути, соединяющему их на дереве. ВИЧ-1 делится на две группы: основные (M) и выбросы (O). ВИЧ-1 М (подробнее…)
Быстрая эволюция бактерий часто происходит за счет горизонтального переноса генов, а не за счет точечной мутации. Большая часть этого горизонтального переноса генов опосредована приобретением плазмид и бактериофагов. Бактерии легко подхватывают островки патогенности и плазмиды вирулентности (см. ) от других бактерий. Как только бактерия приобрела новый набор генов, связанных с вирулентностью, она может быстро зарекомендовать себя как новая причина эпидемий среди людей. 9Например, 0414 Yersinia pestis — это инфекция, эндемичная для крыс и других грызунов, которая впервые появилась в истории человечества в 542 году нашей эры, когда город Константинополь был опустошен чумой. Сравнение последовательностей Y. pestis с его близким родственником Y. pseudotuberculosis , вызывающим тяжелое диарейное заболевание, позволяет предположить, что Y. pestis мог появиться как отдельный штамм всего несколько тысяч лет назад, незадолго до его дебют в области городской разрухи.
Бактерии легко подхватывают островки патогенности и плазмиды вирулентности (см. ) от других бактерий. Как только бактерия приобрела новый набор генов, связанных с вирулентностью, она может быстро зарекомендовать себя как новая причина эпидемий среди людей. 9Например, 0414 Yersinia pestis — это инфекция, эндемичная для крыс и других грызунов, которая впервые появилась в истории человечества в 542 году нашей эры, когда город Константинополь был опустошен чумой. Сравнение последовательностей Y. pestis с его близким родственником Y. pseudotuberculosis , вызывающим тяжелое диарейное заболевание, позволяет предположить, что Y. pestis мог появиться как отдельный штамм всего несколько тысяч лет назад, незадолго до его дебют в области городской разрухи.
Возникновение и эволюция новых инфекционных заболеваний во многих случаях усугубляются изменениями в поведении человека. Например, скученность и грязные условия жизни в средневековых городах способствовали распространению чумы к человеку от естественного хозяина-грызуна. Склонность современных людей жить в условиях высокой плотности населения в крупных городах также создала возможность для инфекционных организмов инициировать эпидемии, такие как грипп, туберкулез и СПИД, которые не могли бы распространиться так быстро или так далеко среди более редких человеческих популяций. Воздушное путешествие может, в принципе, позволить бессимптомному, недавно инфицированному хозяину занести эпидемию в любое ранее не подвергавшееся воздействию население в течение нескольких часов или дней. Современные методы ведения сельского хозяйства также способствуют появлению определенных типов инфекционных агентов, которые не могли легко развиться в обществах охотников-собирателей древних людей. Вирусы гриппа, например, необычны тем, что их геном состоит из нескольких (обычно восьми) нитей РНК. Когда два штамма гриппа заражают одного и того же хозяина, нити двух штаммов могут перетасовываться, образуя новый и отличный тип вируса гриппа. До 1900, штамм гриппа, инфицировавший людей, вызывал очень легкое заболевание; отдельный штамм гриппа инфицировал домашнюю птицу, такую как утки и цыплята, но не мог заразить людей.
Склонность современных людей жить в условиях высокой плотности населения в крупных городах также создала возможность для инфекционных организмов инициировать эпидемии, такие как грипп, туберкулез и СПИД, которые не могли бы распространиться так быстро или так далеко среди более редких человеческих популяций. Воздушное путешествие может, в принципе, позволить бессимптомному, недавно инфицированному хозяину занести эпидемию в любое ранее не подвергавшееся воздействию население в течение нескольких часов или дней. Современные методы ведения сельского хозяйства также способствуют появлению определенных типов инфекционных агентов, которые не могли легко развиться в обществах охотников-собирателей древних людей. Вирусы гриппа, например, необычны тем, что их геном состоит из нескольких (обычно восьми) нитей РНК. Когда два штамма гриппа заражают одного и того же хозяина, нити двух штаммов могут перетасовываться, образуя новый и отличный тип вируса гриппа. До 1900, штамм гриппа, инфицировавший людей, вызывал очень легкое заболевание; отдельный штамм гриппа инфицировал домашнюю птицу, такую как утки и цыплята, но не мог заразить людей. Однако как птичий, так и человеческий штаммы способны заражать свиней и могут рекомбинировать в организме свиньи-хозяина с образованием новых штаммов, которые могут вызывать серьезные заболевания человека. В сообществах, где свиньи выращиваются вместе с курами или индейками, периодически возникают новые рекомбинированные штаммы гриппа, вызывающие всемирные эпидемии. Первой и самой серьезной из этих эпидемий была эпидемия «испанки» 1918, в результате которой погибло больше людей, чем во время Первой мировой войны.
Однако как птичий, так и человеческий штаммы способны заражать свиней и могут рекомбинировать в организме свиньи-хозяина с образованием новых штаммов, которые могут вызывать серьезные заболевания человека. В сообществах, где свиньи выращиваются вместе с курами или индейками, периодически возникают новые рекомбинированные штаммы гриппа, вызывающие всемирные эпидемии. Первой и самой серьезной из этих эпидемий была эпидемия «испанки» 1918, в результате которой погибло больше людей, чем во время Первой мировой войны.
Лекарственно-устойчивые патогены — растущая проблема
В то время как деятельность человека способствовала распространению некоторых инфекционных заболеваний, достижения в области общественной санитарии и медицины предотвратили или облегчили страдания, причиняемые многими другими. Эффективные вакцины и всемирные программы вакцинации позволили ликвидировать оспу и серьезно снизить заболеваемость полиомиелитом, а многие смертельные детские инфекции, такие как эпидемический паротит и корь, в настоящее время являются редкостью в богатых промышленно развитых странах. Однако по-прежнему существует множество широко распространенных и разрушительных инфекционных заболеваний, таких как малярия, для которых не существует эффективных вакцин. Не меньшее значение имеет разработка лекарств, которые лечат, а не предотвращают инфекции. Самый успешный класс — антибиотики, убивающие бактерии. Пенициллин был одним из первых антибиотиков, используемых для лечения инфекций у людей, который был введен в клиническую практику как раз вовремя, чтобы предотвратить десятки тысяч смертей от инфицированных ран на поле боя во время Второй мировой войны. Однако быстрая эволюция патогенов позволила целевым бактериям очень быстро развить устойчивость к антибиотикам; типичный лаг между введением антибиотика в клиническое применение и появлением резистентных штаммов составляет всего несколько лет. Подобная лекарственная устойчивость быстро возникает среди вирусов, когда инфекции лечат противовирусными средствами. Популяция вируса у ВИЧ-инфицированного человека, получающего, например, ингибитор обратной транскриптазы AZT, приобретет полную устойчивость к препарату в течение нескольких месяцев.
Однако по-прежнему существует множество широко распространенных и разрушительных инфекционных заболеваний, таких как малярия, для которых не существует эффективных вакцин. Не меньшее значение имеет разработка лекарств, которые лечат, а не предотвращают инфекции. Самый успешный класс — антибиотики, убивающие бактерии. Пенициллин был одним из первых антибиотиков, используемых для лечения инфекций у людей, который был введен в клиническую практику как раз вовремя, чтобы предотвратить десятки тысяч смертей от инфицированных ран на поле боя во время Второй мировой войны. Однако быстрая эволюция патогенов позволила целевым бактериям очень быстро развить устойчивость к антибиотикам; типичный лаг между введением антибиотика в клиническое применение и появлением резистентных штаммов составляет всего несколько лет. Подобная лекарственная устойчивость быстро возникает среди вирусов, когда инфекции лечат противовирусными средствами. Популяция вируса у ВИЧ-инфицированного человека, получающего, например, ингибитор обратной транскриптазы AZT, приобретет полную устойчивость к препарату в течение нескольких месяцев. Текущий протокол лечения ВИЧ-инфекции предполагает одновременное применение трех препаратов, что помогает свести к минимуму приобретение резистентности.
Текущий протокол лечения ВИЧ-инфекции предполагает одновременное применение трех препаратов, что помогает свести к минимуму приобретение резистентности.
Существует три основных стратегии развития лекарственной устойчивости патогенов. Патогены могут (1) продуцировать фермент, разрушающий лекарство, (2) изменить молекулярную мишень лекарства так, что оно перестанет быть чувствительным к лекарству, или (3) предотвратить доступ к мишени, например, активно перекачивая лекарство из возбудителя. Как только патоген наткнулся на эффективную стратегию, вновь приобретенные или мутировавшие гены, обеспечивающие эту устойчивость, часто распространяются по всей популяции патогена и могут даже передаваться патогенам разных видов, которые лечатся одним и тем же лекарством. Высокоэффективный и очень дорогой антибиотик 9Например, ванкомицин 0414 использовался в качестве крайней меры при многих тяжелых внутрибольничных бактериальных инфекциях, которые уже устойчивы к большинству других известных антибиотиков. Ванкомицин предотвращает один этап биосинтеза клеточной стенки бактерий, связываясь с частью растущей цепи пептидогликана и предотвращая ее перекрестное связывание с другими цепями. Резистентность может возникнуть, если бактерия синтезирует другой тип клеточной стенки, используя другие субъединицы, не связывающие ванкомицин. Наиболее эффективный тип устойчивости к ванкомицину зависит от транспозона, кодирующего семь генов. Продукты этих генов работают вместе, чтобы определить присутствие ванкомицина, перекрыть нормальный путь синтеза клеточной стенки бактерий и создать клеточную стенку другого типа. Хотя объединение этих генов в один транспозон, должно быть, было трудной эволюционной задачей (для развития устойчивости к ванкомицину потребовалось 15 лет, а не обычное отставание в год или два), транспозон теперь может легко передаваться многим другим патогенные виды бактерий.
Ванкомицин предотвращает один этап биосинтеза клеточной стенки бактерий, связываясь с частью растущей цепи пептидогликана и предотвращая ее перекрестное связывание с другими цепями. Резистентность может возникнуть, если бактерия синтезирует другой тип клеточной стенки, используя другие субъединицы, не связывающие ванкомицин. Наиболее эффективный тип устойчивости к ванкомицину зависит от транспозона, кодирующего семь генов. Продукты этих генов работают вместе, чтобы определить присутствие ванкомицина, перекрыть нормальный путь синтеза клеточной стенки бактерий и создать клеточную стенку другого типа. Хотя объединение этих генов в один транспозон, должно быть, было трудной эволюционной задачей (для развития устойчивости к ванкомицину потребовалось 15 лет, а не обычное отставание в год или два), транспозон теперь может легко передаваться многим другим патогенные виды бактерий.
Как и большинство других аспектов инфекционных заболеваний, проблема лекарственной устойчивости усугубляется поведением человека. Многие пациенты принимают антибиотики при вирусных заболеваниях, от которых лекарства не помогают, включая грипп, простуду и боль в ушах. Таким образом, постоянное и хроническое неправильное использование антибиотиков может в конечном итоге привести к устойчивости нормальной флоры к антибиотикам, которая затем может передать устойчивость патогенам. Несколько вспышек антибиотикорезистентной инфекционной диареи, вызванной Shigella flexneri , например, возникла таким образом. Проблема особенно серьезна в странах, где антибиотики доступны без рецепта врача, например, в Бразилии, где более 80% штаммов S. flexneri , обнаруженных у инфицированных пациентов, устойчивы к четырем или более антибиотикам.
Многие пациенты принимают антибиотики при вирусных заболеваниях, от которых лекарства не помогают, включая грипп, простуду и боль в ушах. Таким образом, постоянное и хроническое неправильное использование антибиотиков может в конечном итоге привести к устойчивости нормальной флоры к антибиотикам, которая затем может передать устойчивость патогенам. Несколько вспышек антибиотикорезистентной инфекционной диареи, вызванной Shigella flexneri , например, возникла таким образом. Проблема особенно серьезна в странах, где антибиотики доступны без рецепта врача, например, в Бразилии, где более 80% штаммов S. flexneri , обнаруженных у инфицированных пациентов, устойчивы к четырем или более антибиотикам.
Антибиотики также неправильно используются в сельском хозяйстве, где они обычно используются в качестве пищевых добавок для стимулирования роста здоровых животных. Антибиотик, близкий к ванкомицину, обычно добавляли в корм скоту в Европе. Широко распространено мнение, что резистентность, возникающая в нормальной флоре этих животных, является одним из первоисточников резистентности к ванкомицину, которая в настоящее время наблюдается при опасных для жизни инфекциях человека.
Резюме
Все патогены обладают способностью взаимодействовать с клетками-хозяевами способами, которые способствуют репликации и распространению патогена, но эти взаимодействия между хозяином и патогеном разнообразны. Патогены часто колонизируют хозяина, прикрепляясь или проникая через эпителиальные поверхности, выстилающие легкие, кишечник, мочевой пузырь и другие поверхности, непосредственно контактирующие с окружающей средой. Внутриклеточные патогены, включая все вирусы и многие бактерии и простейшие, размножаются внутри клетки-хозяина, в которую они вторгаются с помощью одного из множества механизмов. Вирусы в значительной степени зависят от рецептор-опосредованного эндоцитоза для проникновения в клетку-хозяин, в то время как бактерии используют клеточную адгезию и фагоцитарные пути. Простейшие используют уникальные стратегии инвазии, которые обычно требуют значительных метаболических затрат. Оказавшись внутри, внутриклеточные патогены ищут нишу, благоприятную для их репликации, часто изменяя движение мембран клетки-хозяина и используя цитоскелет для внутриклеточного движения.

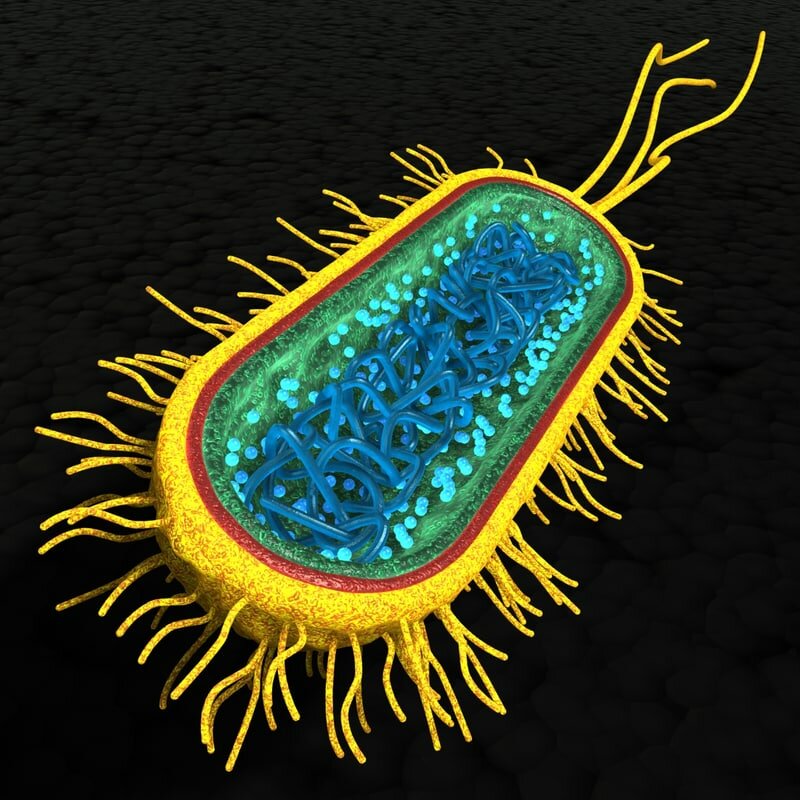

 Микроб-хозяин клетки 25 , 746–755.e5 (2019).
Микроб-хозяин клетки 25 , 746–755.e5 (2019). 4 , 1006–1013 (2019).
4 , 1006–1013 (2019).