Содержание
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула
https://ria.ru/20190729/1556966223.html
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула — РИА Новости, 29.07.2019
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула
Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с… РИА Новости, 29.07.2019
2019-07-29T13:11
2019-07-29T13:11
2019-07-29T13:11
наука
германия
открытия — риа наука
физика
атомы
молекулы
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155696/38/1556963841_32:16:2000:1123_1920x0_80_0_0_154e96d345c763a17c148af3a9ae6835.jpg
МОСКВА, 29 июл – РИА Новости. Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с предсказаниями теории. Их выводы были опубликованы в журнале Nature Communications.В последние годы, благодаря постройке мощных рентгеновских лазеров, способных вырабатывать пучки света с огромной скоростью, ученые смогли заглянуть в самые далекие глубины мира молекул и элементарных частиц. К примеру, в начале этого десятилетия они получили первые «атомные» фотографии вирусов и белков. В последующие годы физики смогли снять химическую реакцию на видео, сфотографировать электроны внутри алмаза, а также получить первые фотоснимки одиночной водородной связи, играющей ключевую роль в формировании белковых молекул, ДНК и других «молекул жизни».Все эти достижения, как отмечает Кюппер, не позволяли ученым решить более простую задачу – увидеть то, как вращается молекула и меняет свою структуру в ходе взаимодействий с соседями или во время простых химических реакций. Этому мешало то, что рентгеновские лазеры разрушают изучаемую молекулу практически сразу после того, как импульс света пролетает через нее.Немецкие физики нашли остроумное решение для этой проблемы, используя не одну, а несколько сотен молекул, два разных типа лазеров, а также определенные закономерности квантовой механики, упростившие им задачу.
Их выводы были опубликованы в журнале Nature Communications.В последние годы, благодаря постройке мощных рентгеновских лазеров, способных вырабатывать пучки света с огромной скоростью, ученые смогли заглянуть в самые далекие глубины мира молекул и элементарных частиц. К примеру, в начале этого десятилетия они получили первые «атомные» фотографии вирусов и белков. В последующие годы физики смогли снять химическую реакцию на видео, сфотографировать электроны внутри алмаза, а также получить первые фотоснимки одиночной водородной связи, играющей ключевую роль в формировании белковых молекул, ДНК и других «молекул жизни».Все эти достижения, как отмечает Кюппер, не позволяли ученым решить более простую задачу – увидеть то, как вращается молекула и меняет свою структуру в ходе взаимодействий с соседями или во время простых химических реакций. Этому мешало то, что рентгеновские лазеры разрушают изучаемую молекулу практически сразу после того, как импульс света пролетает через нее.Немецкие физики нашли остроумное решение для этой проблемы, используя не одну, а несколько сотен молекул, два разных типа лазеров, а также определенные закономерности квантовой механики, упростившие им задачу. В качестве первого «подопытного» ученые избрали сульфоксид углерода – вещество, состоящее из атомов углерода, серы и кислорода, соединенных прочными ковалентными связями. Подготовив облако из подобных молекул, физики пропустили через него два очень коротких импульса инфракрасного лазера.Пауза между этими вспышками света была подобрана таким образом, что она была короче, чем тот промежуток времени, которое сульфоксид углерода тратит на совершение одного оборота вокруг своей оси. Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.Это позволило ученым получить набор из фактически одинаковых молекул, каждую из которых они обстреливали второй, более мощной вспышкой света, позволявшей им увидеть это вещество, но разрушавшей его при контакте.»Подсвечивая» каждую копию сульфоксида углерода в «пачке», физики смогли получить короткое видео из 650 кадров, на котором можно увидеть то, как эта молекула совершает полтора оборота вокруг своей оси.
В качестве первого «подопытного» ученые избрали сульфоксид углерода – вещество, состоящее из атомов углерода, серы и кислорода, соединенных прочными ковалентными связями. Подготовив облако из подобных молекул, физики пропустили через него два очень коротких импульса инфракрасного лазера.Пауза между этими вспышками света была подобрана таким образом, что она была короче, чем тот промежуток времени, которое сульфоксид углерода тратит на совершение одного оборота вокруг своей оси. Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.Это позволило ученым получить набор из фактически одинаковых молекул, каждую из которых они обстреливали второй, более мощной вспышкой света, позволявшей им увидеть это вещество, но разрушавшей его при контакте.»Подсвечивая» каждую копию сульфоксида углерода в «пачке», физики смогли получить короткое видео из 650 кадров, на котором можно увидеть то, как эта молекула совершает полтора оборота вокруг своей оси. На один такой оборот, как показали ученые, она тратит 82 пикосекунды, триллионных долей секунды.В целом, результаты этого эксперимента полностью совпали с результатами компьютерных расчетов. Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением. В ближайшее время Кюппер и его команда планируют применить эту методику для изучения различных «закрученных» молекул, чья форма влияет на характер их взаимодействий с другими веществами. Яркий пример этого – аминокислоты и сахара в нашем теле, присутствующие в нем в исключительно «правой» и «левой» конфигурации.
На один такой оборот, как показали ученые, она тратит 82 пикосекунды, триллионных долей секунды.В целом, результаты этого эксперимента полностью совпали с результатами компьютерных расчетов. Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением. В ближайшее время Кюппер и его команда планируют применить эту методику для изучения различных «закрученных» молекул, чья форма влияет на характер их взаимодействий с другими веществами. Яркий пример этого – аминокислоты и сахара в нашем теле, присутствующие в нем в исключительно «правой» и «левой» конфигурации.
https://ria.ru/20170513/1494214972.html
https://ria.ru/20120829/733143098.html
германия
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
1
5
4. 7
7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/155696/38/1556963841_0:0:2000:1500_1920x0_80_0_0_89d7860c34f0a565ca54a3bf38461fd9.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
германия, открытия — риа наука, физика, атомы, молекулы
Наука, Германия, Открытия — РИА Наука, Физика, атомы, молекулы
МОСКВА, 29 июл – РИА Новости. Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с предсказаниями теории. Их выводы были опубликованы в журнале Nature Communications.
«Физики давно мечтали, что мы сможем запечатлеть движение атомов в каких-то сверхбыстрых процессах. Сделать это сложно, так как молекулы вращаются совсем не так, как это делает набор из шариков и палочек. Их движением управляют законы квантовой механики — положение и импульс каждого атома нельзя точно измерить», — объясняет Йохен Кюппер (Jochen Kuepper) из Гамбургского университета (Германия).
В последние годы, благодаря постройке мощных рентгеновских лазеров, способных вырабатывать пучки света с огромной скоростью, ученые смогли заглянуть в самые далекие глубины мира молекул и элементарных частиц. К примеру, в начале этого десятилетия они получили первые «атомные» фотографии вирусов и белков.
К примеру, в начале этого десятилетия они получили первые «атомные» фотографии вирусов и белков.
В последующие годы физики смогли снять химическую реакцию на видео, сфотографировать электроны внутри алмаза, а также получить первые фотоснимки одиночной водородной связи, играющей ключевую роль в формировании белковых молекул, ДНК и других «молекул жизни».
13 мая 2017, 09:30Наука
Ученые впервые увидели и «пощупали» водородную связь между молекулами
Все эти достижения, как отмечает Кюппер, не позволяли ученым решить более простую задачу – увидеть то, как вращается молекула и меняет свою структуру в ходе взаимодействий с соседями или во время простых химических реакций. Этому мешало то, что рентгеновские лазеры разрушают изучаемую молекулу практически сразу после того, как импульс света пролетает через нее.
Немецкие физики нашли остроумное решение для этой проблемы, используя не одну, а несколько сотен молекул, два разных типа лазеров, а также определенные закономерности квантовой механики, упростившие им задачу.
В качестве первого «подопытного» ученые избрали сульфоксид углерода – вещество, состоящее из атомов углерода, серы и кислорода, соединенных прочными ковалентными связями. Подготовив облако из подобных молекул, физики пропустили через него два очень коротких импульса инфракрасного лазера.
Пауза между этими вспышками света была подобрана таким образом, что она была короче, чем тот промежуток времени, которое сульфоксид углерода тратит на совершение одного оборота вокруг своей оси. Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.
Это позволило ученым получить набор из фактически одинаковых молекул, каждую из которых они обстреливали второй, более мощной вспышкой света, позволявшей им увидеть это вещество, но разрушавшей его при контакте.
«Подсвечивая» каждую копию сульфоксида углерода в «пачке», физики смогли получить короткое видео из 650 кадров, на котором можно увидеть то, как эта молекула совершает полтора оборота вокруг своей оси. На один такой оборот, как показали ученые, она тратит 82 пикосекунды, триллионных долей секунды.
В целом, результаты этого эксперимента полностью совпали с результатами компьютерных расчетов. Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением.
В ближайшее время Кюппер и его команда планируют применить эту методику для изучения различных «закрученных» молекул, чья форма влияет на характер их взаимодействий с другими веществами. Яркий пример этого – аминокислоты и сахара в нашем теле, присутствующие в нем в исключительно «правой» и «левой» конфигурации.
29 августа 2012, 21:02Наука
Рентгеновский лазер помог физикам взглянуть на электроны внутри алмазаФизики использовали сверхмощный рентгеновский лазер LCLS для получения первых фотоснимков отдельных электронов, обращающихся вокруг атомов углерода в кристалле алмаза, и опубликовали результаты своей работы в статье в журнале Nature.
Взгляни на атомы, прикоснись к молекуле
Аркадий Курамшин,
кандидат химических наук
«Химия и жизнь» №5, 2017
Принялся Трурль ловить атомы, соскабливать с них электроны, месить протоны, так что лишь пальцы мелькали, приготовил протонное тесто, выложил вокруг него электроны и — за следующий атом; не прошло и пяти минут, как держал он в руках брусочек чистого золота: подал его морде, она же, на зуб брусочек попробовав и головой кивнув, сказала:
— И в самом деле золото, только я не могу так за атомами гоняться. Слишком я большой.
— Ничего, мы дадим тебе особый аппаратик! — уговаривал его Трурль.
Станислав Лем, «Кибериада»
Можно ли с помощью микроскопа разглядеть атом, отличить его от другого атома, проследить за разрушением или образованием химической связи и увидеть, как одна молекула превращается в другую? Да, если это не простой микроскоп, а атомно-силовой. А можно и не ограничиваться наблюдением. Мы живем в то время, когда атомно-силовой микроскоп перестал быть просто окном в микромир. Сегодня этот прибор можно использовать для перемещения атомов, разрушения химических связей, изучения предела растяжения одиночных молекул — и даже для исследования генома человека.
Сегодня этот прибор можно использовать для перемещения атомов, разрушения химических связей, изучения предела растяжения одиночных молекул — и даже для исследования генома человека.
Буквы из ксеноновых пикселей
Рассмотреть атомы не всегда было так просто. История атомно-силового микроскопа началась в 1979 году, когда Герд Карл Бинниг и Генрих Рорер, работавшие в Исследовательском центре компании IBM в Цюрихе, приступили к созданию прибора, который позволил бы изучать поверхности с атомным разрешением. Чтобы придумать такое устройство, исследователи решили использовать эффект туннельного перехода — способность электронов преодолевать, казалось бы, непроходимые барьеры. Идея состояла в том, чтобы, измеряя силу туннельного тока, возникающего между сканирующим зондом и изучаемой поверхностью, определять положение атомов в образце.
У Биннига и Рорера получилось, и они вошли в историю как изобретатели сканирующего туннельного микроскопа (СТМ), а в 1986 году получили Нобелевскую премию по физике. Сканирующий туннельный микроскоп совершил настоящую революцию в физике и химии.
Сканирующий туннельный микроскоп совершил настоящую революцию в физике и химии.
В 1990 году Дон Айглер и Эрхард Швайцер, работавшие в исследовательском центре IBM в Калифорнии, показали, что СТМ можно применять не только для наблюдения за атомами, но для манипулирования ими. С помощью зонда сканирующего туннельного микроскопа они создали, возможно, самый популярный образ, символизирующий переход химиков к работе с отдельными атомами — нарисовали на никелевой поверхности три буквы 35 атомами ксенона (рис. 1).
Бинниг не стал почивать на лаврах — в год получения Нобелевской премии совместно с Кристофером Гербером и Кельвином Куэйтом, также работавшими в Цюрихском исследовательском центре IBM он начал работу над еще одним устройством для изучения микромира, лишенного недостатков, которые присущи СТМ. Дело в том, что с помощью сканирующего туннельного микроскопа нельзя было изучать диэлектрические поверхности, а только проводники и полупроводники, да и для анализа последних между ними и зондом микроскопа нужно было создать значительное разрежение. Поняв, что создать новое устройство проще, чем модернизировать существующее, Бинниг, Гербер и Куэйт изобрели атомно-силовой микроскоп, или АСМ. Принцип его работы кардинально иной: для получения информации о поверхности измеряют не силу тока, возникающую между зондом микроскопа и изучаемым образцом, а значение возникающих между ними сил притяжения, то есть слабых нехимических взаимодействий — сил Ван-дер-Ваальса.
Поняв, что создать новое устройство проще, чем модернизировать существующее, Бинниг, Гербер и Куэйт изобрели атомно-силовой микроскоп, или АСМ. Принцип его работы кардинально иной: для получения информации о поверхности измеряют не силу тока, возникающую между зондом микроскопа и изучаемым образцом, а значение возникающих между ними сил притяжения, то есть слабых нехимических взаимодействий — сил Ван-дер-Ваальса.
Первая рабочая модель АСМ была устроена сравнительно просто. Исследователи перемещали над поверхностью образца алмазный зонд, связанный с гибким микромеханическим датчиком — кантилевером из золотой фольги (между зондом и атомом возникает притяжение, кантилевер гнется в зависимости от силы притяжения и деформирует пьезоэлектрик). Степень изгиба кантилевера определялась с помощью пьезоэлектрических датчиков — сходным образом канавки и гребни виниловой пластинки превращаются в аудиозапись. Конструкция атомно-силового микроскопа позволяла ему детектировать силы притяжения до 10–18 ньютон. Через год после создания рабочего прототипа исследователям удалось получить изображение рельефа поверхности графита с разрешением в 2,5 ангстрема.
Через год после создания рабочего прототипа исследователям удалось получить изображение рельефа поверхности графита с разрешением в 2,5 ангстрема.
За три десятка лет, прошедших с тех пор, АСМ использовали для изучения практически любых химических объектов — от поверхности керамического материала до живых клеток и отдельных молекул, причем находящихся как в статическом, так и динамическом состоянии. Атомно-силовая микроскопия стала рабочей лошадкой химиков и материаловедов, а количество работ, в которых применяется этот метод, постоянно растет (рис. 2).
За эти годы исследователи подобрали условия и для контактного, и для бесконтактного изучения объектов с помощью атомно-силовой микроскопии. Контактный метод описан выше, он основан на вандерваальсовом взаимодействии между кантилевером и поверхностью. При работе в бесконтактном режиме пьезовибратор возбуждает колебания зонда на некоторой частоте (чаще всего резонансной). Сила, действующая со стороны поверхности, приводит к тому, что и амплитуда, и фаза колебаний зонда изменяются. Несмотря на некоторые недостатки бесконтактного метода (в первую очередь чувствительность к внешним шумам), именно он исключает воздействие зонда на исследуемый объект, а значит, интереснее для химиков.
Несмотря на некоторые недостатки бесконтактного метода (в первую очередь чувствительность к внешним шумам), именно он исключает воздействие зонда на исследуемый объект, а значит, интереснее для химиков.
Живо по зондам, в погоню за связями
Бесконтактной атомно-силовая микроскопия стала в 1998 году благодаря работам ученика Биннига — Франца Йозефа Гиссибла. Именно он предложил использовать в качестве кантилевера кварцевый эталонный генератор стабильной частоты. Спустя 11 лет исследователи из лаборатории IBM в Цюрихе предприняли еще одну модификацию бесконтактного АСМ: роль зонда-сенсора выполнял не острый кристалл алмаза, а одна молекула — монооксид углерода. Это позволяло перейти к субатомному разрешению, что и продемонстрировал Лео Гросс из цюрихского отдела IBM. В 2009 году с помощью АСМ он сделал видимыми уже не атомы, а химические связи, получив достаточно четкую и однозначно читаемую «картинку» для молекулы пентацена (рис. 3; Science, 2009, 325, 5944, 1110–1114, doi: 10. 1126/science.1176210).
1126/science.1176210).
Убедившись, что с помощью АСМ можно увидеть химическую связь, Лео Гросс решил пойти дальше и применить атомно-силовой микроскоп для измерения длин и порядков связей — ключевых параметров для понимания химической структуры, а следовательно, и свойств веществ.
Напомним, что различие в порядках связей указывает на разные значения электронной плотности и различные межатомные расстояния между двумя атомами (говоря проще, двойная связь короче одинарной). В этане порядок связи углерод-углерод равен единице, в этилене — двум, а в классической ароматической молекуле — бензоле — порядок связи углерод-углерод больше единицы, но меньше двух, и считается равным 1,5.
Определить порядок связи гораздо сложнее при переходе от простых ароматических систем к плоским или объемным поликонденсированным циклическим системам. Так, порядок связей в фуллеренах, состоящих из конденсированных пяти- и шестичленных углеродных циклов, может принимать любое значение от единицы до двух. Та же самая неопределенность теоретически присуща и полициклическим ароматическим соединениям.
Та же самая неопределенность теоретически присуща и полициклическим ароматическим соединениям.
В 2012 году Лео Гросс совместно с Фабианом Моном показал, что атомно-силовой микроскоп с металлическим бесконтактным зондом, модифицированным монооксидом углерода, может измерять различия в распределении зарядов у атомов и межатомные расстояния — то есть параметры, ассоциированные с порядком связи (Science, 2012, 337, 6100, 1326–1329, doi: 10.1126/science.1225621).
Для этого они изучили два типа химических связей в фуллерене — связь углерод-углерод, общую для двух шестичленных углеродсодержащих циклов фуллерена С60, и связь углерод-углерод, общую для пяти- и шестичленного циклов. Атомно-силовой микроскоп показал, что при конденсации шестичленных циклов образуется связь более короткая и с большим порядком, чем при конденсации циклических фрагментов C6 и C5. Изучение же особенностей химического связывания в гексабензокоронене, где вокруг центрального цикла C6 симметрично расположено еще шесть циклов C6, подтвердило результаты квантово-химического моделирования, согласно которым порядок связей С—С центрального кольца (на рис..jpg) 4 буква i) должен быть больше, чем у связей, объединяющих это кольцо с периферийными циклами (на рис. 4 буква j). Сходные результаты получили и для более сложного полициклического ароматического углеводорода, содержащего девять шестичленных циклов.
4 буква i) должен быть больше, чем у связей, объединяющих это кольцо с периферийными циклами (на рис. 4 буква j). Сходные результаты получили и для более сложного полициклического ароматического углеводорода, содержащего девять шестичленных циклов.
Порядки связей и межатомные расстояния, конечно же, интересовали химиков-органиков, но важнее это было тем, кто занимался теорией химической связи, предсказанием реакционной способности и изучением механизмов химических реакций. Тем не менее и химиков-синтетиков, и специалистов по изучению структуры природных соединений ждал сюрприз: оказалось, что атомно-силовой микроскоп можно применять для установления структуры молекул точно так же, как ЯМР или ИК-спектроскопию. Более того, он дает однозначный ответ на вопросы, с которыми эти методы не в состоянии справиться.
От фотографии к кинематографу
В 2010 году все тот же Лео Гросс и Райнер Эбел смогли однозначно установить строение природного соединения — цефаландола А, выделенного из бактерии Dermacoccus abyssi (Nature Chemistry, 2010, 2, 821–825, doi: 10. 1038/nchem.765). Состав цефаландола А установили ранее с помощью масс-спектрометрии, однако анализ спектров ЯМР этого соединения не давал однозначного ответа на вопрос о его структуре: возможны были четыре варианта. С помощью атомно-силового микроскопа исследователи сразу же исключили две из четырех структур, а из двух оставшихся правильный выбор сделали, сравнив результаты, полученные благодаря АСМ и квантово-химическому моделированию. Задача оказалась непростой: в отличие от пентацена, фуллерена и короненов, в состав цефаландола А входят не только атомы углерода и водорода, кроме того, у этой молекулы нет плоскости симметрии (рис. 5) — но и такую задачу удалось решить.
1038/nchem.765). Состав цефаландола А установили ранее с помощью масс-спектрометрии, однако анализ спектров ЯМР этого соединения не давал однозначного ответа на вопрос о его структуре: возможны были четыре варианта. С помощью атомно-силового микроскопа исследователи сразу же исключили две из четырех структур, а из двух оставшихся правильный выбор сделали, сравнив результаты, полученные благодаря АСМ и квантово-химическому моделированию. Задача оказалась непростой: в отличие от пентацена, фуллерена и короненов, в состав цефаландола А входят не только атомы углерода и водорода, кроме того, у этой молекулы нет плоскости симметрии (рис. 5) — но и такую задачу удалось решить.
Еще одно подтверждение того, что атомно-силовой микроскоп можно использовать как аналитический инструмент, получили в группе Оскара Кустанца, в то время работавшего в инженерной школе Университета Осаки. Он показал, как с помощью АСМ различить атомы, отличающиеся друг от друга гораздо меньше, чем углерод и водород (Nature, 2007, 446, 64–67, doi: 10. 1038/nature05530). Кустанц исследовал поверхность сплава, состоящего из кремния, олова и свинца с известным содержанием каждого элемента. В результате многочисленных экспериментов он выяснил, что сила, возникающая между острием зонда АСМ и разными атомами, различается (рис. 6). Так, например, самое сильное взаимодействие наблюдалось при зондировании кремния, а самое слабое — при зондировании свинца.
1038/nature05530). Кустанц исследовал поверхность сплава, состоящего из кремния, олова и свинца с известным содержанием каждого элемента. В результате многочисленных экспериментов он выяснил, что сила, возникающая между острием зонда АСМ и разными атомами, различается (рис. 6). Так, например, самое сильное взаимодействие наблюдалось при зондировании кремния, а самое слабое — при зондировании свинца.
Предполагается, что в дальнейшем результаты атомно-силовой микроскопии для распознавания отдельных атомов будут обрабатываться так же, как результаты ЯМР, — по сравнению относительных величин. Поскольку точный состав иглы датчика трудно контролировать, абсолютное значение силы между датчиком и различными атомами поверхности зависит от условий эксперимента и марки устройства, а вот отношение этих сил при любом составе и форме датчика остается постоянным для каждого химического элемента.
В 2013 году появились первые примеры использования АСМ для получения изображений отдельных молекул до и после химических реакций: создается «фотосет» из продуктов и полупродуктов реакции, который потом можно смонтировать своего рода документальный фильм (Science, 2013, 340, 6139, 1434–1437; doi: 10. 1126/science.1238187).
1126/science.1238187).
Феликс Фишер и Майкл Кромми из Университета Калифорнии в Беркли нанесли на поверхность серебра 1,2-бис[(2-этинилфенил)этинил]бензол, получили изображение молекул и нагрели поверхность, чтобы инициировать циклизацию. Половина исходных молекул превратилась в полициклические ароматические структуры, состоящие из конденсированных пяти шестичленных и двух пятичленных циклов. Еще четверть молекул образовала структуры, состоящие из четырех шестичленных циклов, связанных через один четырехчленный цикл, и двух пятичленных циклов (рис. 7) . Остальными продуктами были олигомерные структуры и, в незначительном количестве, полициклические изомеры.
Такие результаты дважды удивили исследователей. Во-первых, в ходе реакции образовалось всего лишь два главных продукта. Во-вторых, удивление вызвала их структура. Фишер отмечает, что химическая интуиция и опыт позволяли нарисовать десятки возможных продуктов реакции, однако ни один из них не соответствовал тем соединениям, которые образовывались на поверхности. Возможно, протеканию нетипичных химических процессов способствовало взаимодействие исходных веществ с подложкой.
Возможно, протеканию нетипичных химических процессов способствовало взаимодействие исходных веществ с подложкой.
Естественно, что после первых серьезных успехов в изучении химических связей некоторые исследователи решили применить АСМ для наблюдения более слабых и менее изученных межмолекулярных взаимодействий, в частности водородной связи. Однако в этой области работы еще только начинаются, а результаты их противоречивы. Так, в одних публикациях сообщается, что атомно-силовая микроскопия позволила наблюдать водородную связь (Science, 2013, 342, 6158, 611–614, doi: 10.1126/science.1242603), в других утверждают, что это всего лишь артефакты, обусловленные конструкционными особенностями прибора, а экспериментальные результаты нужно интерпретировать аккуратнее (Physical Review Letters, 2014, 113, 186102, doi: 10.1103/PhysRevLett.113.186102). Возможно, окончательный ответ на вопрос, можно ли наблюдать водородные и другие межмолекулярные взаимодействия с помощью атомно-силовой микроскопии, будет получен уже в этом десятилетии. Для этого необходимо еще хотя бы в несколько раз повысить разрешение АСМ и научиться получать изображения без помех (Physical Review B, 2014, 90, 085421, doi: 10.1103/PhysRevB.90.085421).
Для этого необходимо еще хотя бы в несколько раз повысить разрешение АСМ и научиться получать изображения без помех (Physical Review B, 2014, 90, 085421, doi: 10.1103/PhysRevB.90.085421).
Синтез одной молекулы
В умелых руках и СТМ и АСМ превращаются из приборов, способных изучать вещество, в приборы, способные направленно изменять строение вещества. С помощью этих устройств уже удалось получить «самые маленькие химические лаборатории», в которых вместо колбы используется подложка, а вместо молей или миллимолей реагирующих веществ — отдельные молекулы.
Например, в 2016 году международная группа ученых во главе с Такаси Кумагаи использовала бесконтактную атомно-силовую микроскопию для перевода молекулы порфицена из одной ее формы в другую (Nature Chemistry, 2016, 8, 935–940, doi: 10.1038/nchem.2552). Порфицен можно рассматривать как модификацию порфирина, во внутреннем цикле которого содержится четыре атома азота и два атома водорода. Колебания зонда АСМ передавали молекуле порфицена достаточно энергии для переноса этих водородов от одних атомов азота к другим, и в результате получалось «зеркальное отражение» этой молекулы (рис. 8).
8).
Группа под руководством неутомимого Лео Гросса также показала, что возможно инициировать реакцию отдельно взятой молекулы, — они превратили дибромантрацен в десятичленный циклический диин (рис. 9; Nature Chemistry, 2015, 7, 623–628, doi: 10.1038/nchem.2300). В отличие от Кумагаи с соавторами, они использовали сканирующий туннельный микроскоп для активации молекулы, а за результатом реакции следили с помощью атомно-силового микроскопа.
Комбинированное применение сканирующего туннельного микроскопа и атомно-силового микроскопа позволило даже получить молекулу, которую невозможно синтезировать с помощью классических приемов и методов (Nature Nanotechnology, 2017, 12, 308–311, doi: 10.1038/nnano.2016.305). Это триангулен — нестабильный ароматический бирадикал, существование которого было предсказано шесть десятилетий назад, но все попытки синтеза были неудачными (рис. 10). Химики из группы Нико Павличека получили искомое соединение, оторвав от его прекурсора два атома водорода с помощью СТМ и подтвердив синтетический результат с помощью АСМ.
Предполагается, что число работ, посвященных применению атомно-силовой микроскопии в органической химии, еще будет расти. В настоящее время все больше ученых пытаются повторить на поверхности реакции, хорошо знакомые «растворной химии». Но, возможно, химики-синтетики начнут воспроизводить в растворе те реакции, которые были первоначально осуществлены на поверхности с помощью АСМ.
От неживого — к живому
Кантилеверы и зонды атомно-силовых микроскопов можно применять не только для аналитических исследований или синтеза экзотических молекул, но и для решения прикладных задач. Уже известны случаи использования АСМ в медицине, например для ранней диагностики рака, и здесь пионером выступает тот самый Кристофер Гербер, который приложил руку к разработке принципа атомно-силовой микроскопии и созданию АСМ.
Так, Герберу удалось научить АСМ определять точечную мутацию рибонуклеиновой кислоты при меланоме (на материале, полученном в результате биопсии). Для этого золотой кантилевер атомно-силового микроскопа модифицировали олигонуклеотидами, которые могут вступать в межмолекулярное взаимодействие с РНК, а силу этого взаимодействия все также можно измерить за счет пьезоэффекта. Чувствительность сенсора АСМ настолько велика, что его уже пытаются применить для изучения эффективности популярного метода редактирования геномов CRISPR-Cas9. Здесь воедино объединяются технологии, созданные разными поколениями исследователей.
Чувствительность сенсора АСМ настолько велика, что его уже пытаются применить для изучения эффективности популярного метода редактирования геномов CRISPR-Cas9. Здесь воедино объединяются технологии, созданные разными поколениями исследователей.
Перефразируя классика одной из политических теорий, можно сказать, что мы уже сейчас видим безграничные возможности и неисчерпаемость атомно-силовой микроскопии и вряд ли в силах представить, что ждет нас впереди в связи с дальнейшим развитием этих технологий. Но уже сегодня сканирующий туннельный микроскоп и атомно-силовой микроскоп дают нам возможность увидеть атомы и прикоснуться к ним. Можно сказать, что это не только продолжение наших глаз, позволяющее заглянуть в микрокосм атомов и молекул, но и новые глаза, новые пальцы, способные прикоснуться к этому микрокосму и управлять им.
Фотография атома в электронном микроскопе. Ученые впервые увидели атом «вживую»
Предлагаем оценить снимки финалистов,
претендующих на звание«
Фотограф года» Королевского фотографического общества. Победителя объявят уже 7 октября,
Победителя объявят уже 7 октября,
а выставка лучших работ пройдет с 7 октября по 5 января в Музее науки в Лондоне.
Редакция ПМ
«Структура мыльного пузыря», автор Ким Кокс
Мыльные пузыри оптимизируют пространство внутри себя и минимизируют площадь их поверхности для заданного объема воздуха. Это делает их полезным объектом исследования во многих областях, в частности, в области материаловедения. Стенки пузырьков как бы стекают под действием силы тяжести: они тонкие вверху и толстые внизу.
«Разметка на молекулах кислорода», Ясмин Кроуфорд
Снимок входит в последний крупный проект автора в рамках магистерской работе по фотографии в университете Фалмута, где основное внимание уделялось исследованию миалгического энцефаломиелита. Кроуфорд говорит, что создает образы, которые связывают нас с неоднозначным и неизвестным.
«Спокойствие вечности», автор Евгений Самученко
Снимок сделан в Гималаях на озере Госаикунда на высоте 4400 метров. Млечный Путь — это галактика, в которую входит и наша Солнечная система: смутная полоса света на ночном небе.
Млечный Путь — это галактика, в которую входит и наша Солнечная система: смутная полоса света на ночном небе.
«Смущенный мучной жук», автор Дэвид Спирс
Этот маленький жук-вредитель заводится зерновых и мучных изделиях. Изображение было получено с помощью сканирующей электронной микрофотографии, а затем окрашено в Photoshop.
«Туманность «Северная Америка», Дэйв Уотсон
Туманность «Северная Америка» NGC7000 — это эмиссионная туманность в созвездии Лебедя. Форма туманности напоминает форму Северной Америки — можно увидеть даже Мексиканский залив.
«Жук-олень», автор Виктор Сикора
Фотограф использовал световую микроскопию с увеличением в пять раз.
«Телескоп Ловелла», автор Мардж Брэдшоу
«Я была очарована телескопом Ловелла в Джодрелл Бэнк с тех пор, как увидела ее на школьной экскурсии», — говорит Брэдшоу. Она хотела сделать несколько более детальных фотографий, чтобы показать его износ.
«Медузы вверх ногами», автор Мэри Энн Чилтон
Вместо того, чтобы плавать, этот вид проводит время, пульсируя в воде. Цвет медуз — результат поедания водорослей.
Цвет медуз — результат поедания водорослей.
Физикам из США удалось запечатлеть на фото отдельные атомы с рекордным разрешением, передает Day.Az со ссылкой на Vesti.ru
Ученым из Корнеллского университета в США удалось запечатлеть на фото отдельные атомы с рекордным разрешением — меньше половины ангстрема (0,39 Å). Предыдущие фотографии обладали вдвое низким разрешением — 0,98 Å.
Мощные электронные микроскопы, способные увидеть атомы, существуют уже полвека, однако их разрешающая способность ограничена длинной волны видимого света, которая больше диаметра атома средней величины.
Поэтому ученые используют некий аналог линз, фокусирующих и увеличивающих изображение в электронных микроскопах — им выступает магнитное поле. Однако колебания магнитного поля искажают полученный результат. Чтобы убрать искажения, используют дополнительные устройства, которые корректируют магнитное поле, но вместе с тем увеличивают сложность конструкции электронного микроскопа.
Ранее физики из Корнеллского университета разработали устройство Electron Microscope Pixel Array Detector (EMPAD), заменяющее сложную систему генераторов, фокусирующих входящие электроны одной небольшой матрицей с разрешением 128х128 пикселей, чувствительных к отдельным электронам. Каждый пиксель регистрирует угол отражения электрона; зная его, ученые при помощи техники птайкографии реконструируют характеристики электронов, включая координаты точки, откуда он был выпущен.
Атомы в самом большом разрешении
David A. Muller et al. Nature, 2018.
Летом 2018 года физики решили улучшить качество получаемых снимков до рекордного до сегодняшнего дня разрешения. Ученые закрепили на подвижной балке лист 2D материала — сульфида молибдена MoS2, и выпустили пучки электронов, поворачивая балку под разными углами к источнику электронов. С помощью EMPAD и птайкографии ученые определили расстояния между отдельными атомами молибдена и получили изображение с рекордным разрешением — 0,39 Å.
«Практически мы создали самую маленькую в мире линейку», — объясняет Сол Грюнер (Sol Gruner), один из авторов эксперимента. На полученном снимке удалось разглядеть атомы серы с рекордным разрешением 0,39 Å. Причем удалось даже разглядеть место, где одного такого атома не хватает (указано стрелочкой).
Атомы серы в рекордном разрешении
До сих пор ученые могли только предполагать наличие молекулярных структур. Сегодня же с помощью атомно-силовой микроскопии, отдельные атомные связи (каждая несколько десятков миллионных долей миллиметра длиной), соединяющие молекулу (26 атомов углерода и 14 атомов водорода), можно увидеть довольно четко.
Первоначально, команда хотела работать со структурами из графена, однослойного материала, в котором атомы углерода расположены в виде шестиугольников. Формируя соты углерода, атомы перестраиваются из линейной цепи в шестигранники; эта реакция может давать несколько различных молекул.
Феликс Фишер, химик Калифорнийского университет в Беркли, и его коллеги хотели визуализировать молекулы, чтобы убедиться, что все сделали правильно.
Кольчатая, углеродсодержащая молекула, показанная до и после реорганизации с двумя наиболее распространенными продуктами реакции, проходившей при температуре выше 90 градусов Цельсия. Размер: 3 ангстрема или трех-десяти миллиардная доля метра в поперечнике.
Чтобы задокументировать рецепт графена, Фишеру было необходимо мощное устройство обработки изображений, и он обратился к атомно-силовому микроскопу, который был у Майкла Кромми из лаборатории Калифорнийского университета.
Бесконтактная атомно-силовая микроскопия (NC-AFM) использует очень тонкий и чувствительный датчик, чтобы почувствовать электрическую силу, создаваемую молекулами. Кончик перемещается вблизи поверхности молекулы, испытывая отклонения разными зарядами, создавая образ того, как перемещаются атомы.
Одноатомный кончик бесконтактного атомно-силового микроскопа «прощупывает» поверхность с помощью острой иглы. Игла движется по поверхности исследуемого объекта подобно тому, как игла фонографа проходит по желобкам пластинки. Кроме атомов, возможно «прощупывать» и атомные связи
Кроме атомов, возможно «прощупывать» и атомные связи
Так команде удалось не только визуализировать атомы углерода, но и связи между ними, созданные общими электронами. Они поместили кольчатые структуры углерода на серебренную пластину и нагрели ее, чтобы реорганизовать молекулу. Охлажденные продукты реакции, содержали три неожиданных продукта и только одну молекулу, ожидаемую учеными.
Молекула воды Н2О состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода.
В молекуле воды главным действующим лицом является атом кислорода.
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°.
Химические связи в молекуле воды – полярные, так как кислород подтягивает к себе отрицательно заряженные электроны, а водород — положительно заряженные электроны. В результате вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный.
Поэтому вся молекула воды является диполем, то есть молекулой с двумя разноименными полюсами. Дипольная структура молекулы воды во многом определяет ее необычные свойства.
Молекула воды – это диамагнетик.
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — тетраэдр. Таково строение самой молекулы воды.
При изменении состояния молекулы воды длина сторон и угол между ними изменяются в тетраэдре.
Например, если молекула воды находится в парообразном состоянии, то угол, образованный ее сторонами, равняется 104°27″. В водном состоянии угол составляет 105°03″. И в состоянии льда угол равен 109,5°.
Геометрия и размеры молекулы воды для различных состояний
а — для парообразного состояния
б — для низшего колебательного уровня
в — для уровня, близкого к образованию кристалла льда, когда геометрия молекулы воды соответствует геометрии двух египетских треугольников с соотношением сторон 3: 4: 5
г — для состояния льда.
Если разделить пополам эти углы, то получим углы:
104°27″: 2 = 52°13″,
105°03″: 2 = 52°31″,
106°16″: 2 = 53°08″,
109,5°: 2 = 54°32″.
Значит, среди геометрических рисунков молекулы воды и льда находится знаменитый египетский треугольник, в основу построения которого заложены соотношения золотой пропорции — длины сторон относятся как 3:4:5 с углом 53°08″.
Молекула воды приобретает строение золотой пропорции на пути, когда вода переходит в лед, и наоборот, когда лед тает. Очевидно, за это состояние и ценится талая вода, когда ее структура в построении имеет пропорции золотого сечения.
Теперь становится понятным, что знаменитый египетский треугольник с соотношением сторон 3:4:5 «взят» из одного из состояний молекулы воды. Сама же геометрия молекулы воды образована двумя египетскими прямоугольными треугольниками, имеющими общий катет равный 3.
Молекула воды, имеющая в основе соотношение золотой пропорции, является физическим проявлением Божественной Природы, которая участвует в создании жизнь. Именно поэтому в земной природе заложена та гармония, которая присуща всему космосу.
Именно поэтому в земной природе заложена та гармония, которая присуща всему космосу.
И поэтому древние египтяне обожествляли числа 3, 4, 5, а сам треугольник считали священным и старались заложить его свойства, его гармонию в любую конструкцию, дома, пирамиды и даже в разметку полей. Кстати, украинские хаты строились тоже с применением соотношения золотой пропорции.
В пространстве молекула воды занимает некоторый объем, и покрыта электронной оболочкой в виде вуали. Если представить вид гипотетической модели молекулы в плоскости, то она похожа на крылья бабочки, на Х-образную хромосому, в которой записана программа жизни живого существа. И это является показательным фактом того, что сама вода — это обязательный элемент всего живого.
Если представить вид гипотетической модели молекулы воды в объеме, то она передает форму треугольной пирамиды, у которой имеется 4 грани, а у каждой грани по 3 ребра. В геометрии треугольная пирамида называется тетраэдром. Такое строение свойственно кристаллам.
Таким образом, молекула воды образует прочную уголковую структуру, которую она сохраняет даже, когда находится в парообразном состоянии, на грани перехода в лед, и когда превращается в лед.
Если «скелет» молекулы воды так устойчив, то и его энергетическая «пирамида» — тетраэдр тоже стоит непоколебимо.
Такие структурные свойства молекулы воды в различных условиях объясняются прочными связями между двумя атомами водорода и одним атомом кислорода. Эта связь примерно в 25 раз сильнее, чем связь между соседними молекулами воды. Поэтому легче отделить одну молекулу воды от другой, например, при нагревании, чем разрушить саму молекулу воды.
За счет ориентационных, индукционных, дисперсионных взаимодействий (сил Ван-дер-Ваальса) и водородных связей между атомами водорода и кислорода соседних молекул молекулы воды способны образовывать как случайные ассоциаты, т.е. не имеющие упорядоченной структуры, так и кластеры – ассоциаты, имеющие определенную структуру.
Согласно статистическим данным, в обычной воде находится случайных ассоциатов — 60% (деструктурированная вода) и кластеров — 40% (структурированная вода).
В результате исследований, проведенных российским ученым С. В. Зениным, были обнаружены стабильные долгоживущие кластеры воды.
Зенин установил, что молекулы воды первоначально образуют додекаэдр. Четыре додекаэдра соединяясь, образует основной структурный элемент воды — кластер, состоящий из 57 молекул воды.
В кластере додекаэдры имеют общие грани, а их центры образуют правильный тетраэдр. Это объёмное соединение молекул воды, в том числе гексамеров, которое имеет положительные и отрицательные полюса.
Водородные мостики позволяют молекулам воды объединяться самыми различными способами. Благодаря этому в воде наблюдается бесконечное разнообразие кластеров.
Кластеры могут взаимодействовать друг с другом за счет свободных водородных связей, что приводит к появлению структур второго порядка в виде шестигранников. Они состоят из 912 молекул воды, которые практически не способны к взаимодействию. Время существования такой структуры весьма велико.
Эту структуру, похожую на маленький острый кристаллик льда из 6 ромбических граней, С. В. Зенин назвал «основным структурным элементом воды”. Многочисленные эксперименты подтвердили; в воде — мириады таких кристалликов.
В. Зенин назвал «основным структурным элементом воды”. Многочисленные эксперименты подтвердили; в воде — мириады таких кристалликов.
Эти кристаллики льда почти не взаимодействуют друг с другом, поэтому не образуют более сложных устойчивых конструкций и легко скользят гранями относительно друг друга, создавая текучесть. В этом смысле вода напоминает переохлажденный раствор, который никак не может кристаллизоваться.
Атомы и молекулы: что о них известно
Опубликовано:
Атомы и молекулы: Freepick
С изучения атомов и молекул начинается знакомство с химией. Современной науке известны миллионы молекул. Разобраться с их строением и свойствами помогут особенности мельчайшей частицы — атома.
Разобраться с их строением и свойствами помогут особенности мельчайшей частицы — атома.
Что такое атомы
С древних времен люди стремились изучить природу вещей, которые их окружали. Постепенно пришли к мысли о том, что все вокруг состоит из мельчайших частиц.
По мере развития науки появилось понятие об атомах и молекулах. Эти частички чрезвычайно малы, и невооруженным глазом их не разглядеть. Любое крошечное количество вещества, например, пылинка, содержит невероятно большое количество атомов и молекул.
Что же такое атом? Так называют мельчайшую химически неделимую частицу вещества, а также наименьшую часть химического элемента, которая отражает его свойства. Атомы очень маленькие: их размеры находятся в диапазоне от 1 до 5 ангстрем (обозначается — Å.). Один ангстрем — это 10⁻¹⁰ м.
Когда атомы только открыли, их считали самыми маленькими из возможных частиц. Но сегодня нам известна их внутренняя структура:
- В центре каждого атома есть ядро с определенной массой.
 В нем находятся положительно заряженные протоны и нейтральные частицы нейтроны. Вместе их называют нуклоны.
В нем находятся положительно заряженные протоны и нейтральные частицы нейтроны. Вместе их называют нуклоны. - Пространство вокруг ядра заполняют частицы с отрицательными зарядами — электроны.
Например, в атоме гелия есть ядро с двумя протонами и двумя нейтронами, а вокруг него двигаются по своим орбитам два электрона.
Мир атомов: Freepick
Элементарные или субатомные частицы во всех атомах одинаковы, отличается только их количество:
- Протоны — это частицы, которые имеют положительный электрический заряд. Условно его обозначают +1. Символ протона — p⁺.
- Нейтроны — это частицы, которые не имеют электрического заряда. У нейтронов он равняется нулю. Символ нейтронов — n⁰.
- Электроны — это частицы, которые имеют отрицательный электрический заряд. Условно его обозначают -1. Символ электронов — e, е⁻.
Ядра атомов заряжены положительно, так как в них находятся положительно заряженные протоны и нейтральные нейтроны. По величине заряд соответствует количеству протонов в ядре и равен порядковому номеру элемента в периодической системе.
Заряды протонов и электронов одинаковые по величине, но имеют противоположные знаки. В любом атоме число протонов и электронов равно. Поэтому заряд ядра и суммарный заряд всех электронов также равны, но имеют противоположные знаки. Следовательно, атом — электронейтральная частица.
Каждый известный атом обозначен специальным символом — латинской буквой. Все они представлены в периодической системе Д. И. Менделеева.
На современном этапе развития науки ученые стремятся разрушить атом, чтобы получить еще более мелкие частички. Однако они очень неустойчивы, и добиться их долговременного существования пока не получается.
Что известно о молекулах
Атомы различным образом соединяются друг с другом. Как из букв алфавита составляются тысячи слов, так одни и те же атомы образуют молекулы большого количества разных веществ, которые видим в окружающем мире.
Молекулой называют наименьшую частицу вещества, которая определяет его свойства и способна к самостоятельному существованию. Каждая молекула строится из атомов, которые составляют ее массу:
Каждая молекула строится из атомов, которые составляют ее массу:
- Вещество (например, сахар) можно размолоть до состояния пыли, но все равно каждая из крупинок будет включать огромное количество одинаковых молекул сахара и сохранит свойства, которыми обладает вещество.
- Даже если измельчить вещество до отдельных молекул (например, сахар растворить в воде), то вещество продолжит существовать и будет проявлять свои свойства (раствор будет сладким на вкус). Поэтому каждую самостоятельно существующую молекулу сахара можем называть веществом.
- Продолжая дробление, будем разрушать молекулы на атомы.
- Если же несколько атомов отделить, то разрушится вещество. Конечно, атомы не исчезнут, они станут частью других молекул, но сахар как вещество прекратит свое существование.
Таким образом, вещества не вечны, так как их молекулы не могут быть вечными. Однако их атомы практически вечны. В тех веществах и предметах, которые окружают нас сегодня, находятся атомы, которые существовали еще во времена динозавров, походов Александра Македонского и открытия Колумбом Америки.
Что такое молекулы: Freepick
Хоть молекулы и очень малы, их устройство определяют с помощью различных физических и химических методов. Чистые вещества состоят из молекул одного вида.
Если в физическом теле есть молекулы разных видов, то речь идет о смеси веществ. Когда в быту говорим о чистом воздухе, то называем так сложную смесь различных газообразных веществ. Химику придется серьезно поработать, чтобы выделить из нее отдельные чистые вещества.
Все вещества делят на простые и сложные:
- Молекулы простого вещества состоят из одинаковых атомов (азот, кислород, аргон, озон).
- Молекулы в сложном веществе составлены из атомов двух и более видов: углекислый газ, вода.
Часто физические тела состоят из молекул нескольких веществ. Их называют смесями. Важно не путать сложные вещества и смеси. Если в сложном веществе содержатся молекулы одного вида, то это не смесь.
Благодаря свойству атомов объединяться в разных вариациях количество веществ, как и видов молекул, бесконечно. Никто не сможет точно назвать число веществ, которые сегодня известны людям. Ориентировочно их количество исчисляется миллионами, а химики каждый день создают новые молекулы.
Никто не сможет точно назвать число веществ, которые сегодня известны людям. Ориентировочно их количество исчисляется миллионами, а химики каждый день создают новые молекулы.
Таким образом все вещества, которые мы видим вокруг нас, состоят из молекул, а те, в свою очередь, построены из атомов. Ученым удалось исследовать мельчайшие частички — атомы — и подробно описать их структуру. Эти знания стали ключом к пониманию природы молекул и даже дали возможность создавать новые молекулы.
Оригинал статьи: https://www.nur.kz/family/school/1912401-atomy-i-molekuly-chto-o-nih-izvestno/
Фотографии атомов и молекул. Первое изображение орбитальной структуры атома водорода. Если вам всё-таки не удалось рассмотреть атом, то вот он
Физикам из США удалось запечатлеть на фото отдельные атомы с рекордным разрешением, передает Day. Az со ссылкой на Vesti.ru
Az со ссылкой на Vesti.ru
Ученым из Корнеллского университета в США удалось запечатлеть на фото отдельные атомы с рекордным разрешением — меньше половины ангстрема (0,39 Å). Предыдущие фотографии обладали вдвое низким разрешением — 0,98 Å.
Мощные электронные микроскопы, способные увидеть атомы, существуют уже полвека, однако их разрешающая способность ограничена длинной волны видимого света, которая больше диаметра атома средней величины.
Поэтому ученые используют некий аналог линз, фокусирующих и увеличивающих изображение в электронных микроскопах — им выступает магнитное поле. Однако колебания магнитного поля искажают полученный результат. Чтобы убрать искажения, используют дополнительные устройства, которые корректируют магнитное поле, но вместе с тем увеличивают сложность конструкции электронного микроскопа.
Ранее физики из Корнеллского университета разработали устройство Electron Microscope Pixel Array Detector (EMPAD), заменяющее сложную систему генераторов, фокусирующих входящие электроны одной небольшой матрицей с разрешением 128х128 пикселей, чувствительных к отдельным электронам. Каждый пиксель регистрирует угол отражения электрона; зная его, ученые при помощи техники птайкографии реконструируют характеристики электронов, включая координаты точки, откуда он был выпущен.
Каждый пиксель регистрирует угол отражения электрона; зная его, ученые при помощи техники птайкографии реконструируют характеристики электронов, включая координаты точки, откуда он был выпущен.
Атомы в самом большом разрешении
David A. Muller et al. Nature, 2018.
Летом 2018 года физики решили улучшить качество получаемых снимков до рекордного до сегодняшнего дня разрешения. Ученые закрепили на подвижной балке лист 2D материала — сульфида молибдена MoS2, и выпустили пучки электронов, поворачивая балку под разными углами к источнику электронов. С помощью EMPAD и птайкографии ученые определили расстояния между отдельными атомами молибдена и получили изображение с рекордным разрешением — 0,39 Å.
«Практически мы создали самую маленькую в мире линейку», — объясняет Сол Грюнер (Sol Gruner), один из авторов эксперимента. На полученном снимке удалось разглядеть атомы серы с рекордным разрешением 0,39 Å. Причем удалось даже разглядеть место, где одного такого атома не хватает (указано стрелочкой).
Атомы серы в рекордном разрешении
Принялся Трурль ловить атомы, соскабливать с них электроны, месить протоны, так что лишь пальцы мелькали, приготовил протонное тесто, выложил вокруг него электроны и — за следующий атом; не прошло и пяти минут, как держал он в руках брусочек чистого золота: подал его морде, она же, на зуб брусочек попробовав и головой кивнув, сказала:
— И в самом деле золото, только я не могу так за атомами гоняться. Слишком я большой.
— Ничего, мы дадим тебе особый аппаратик! — уговаривал его Трурль.
Станислав Лем, «Кибериада»
Можно ли с помощью микроскопа разглядеть атом, отличить его от другого атома, проследить за разрушением или образованием химической связи и увидеть, как одна молекула превращается в другую? Да, если это не простой микроскоп, а атомно-силовой. А можно и не ограничиваться наблюдением. Мы живем в то время, когда атомно-силовой микроскоп перестал быть просто окном в микромир. Сегодня этот прибор можно использовать для перемещения атомов, разрушения химических связей, изучения предела растяжения одиночных молекул — и даже для исследования генома человека.
Буквы из ксеноновых пикселей
Рассмотреть атомы не всегда было так просто. История атомно-силового микроскопа началась в 1979 году, когда Герд Карл Бинниг и Генрих Рорер, работавшие в Исследовательском центре компании IBM в Цюрихе, приступили к созданию прибора, который позволил бы изучать поверхности с атомным разрешением. Чтобы придумать такое устройство, исследователи решили использовать эффект туннельного перехода — способность электронов преодолевать, казалось бы, непроходимые барьеры. Идея состояла в том, чтобы, измеряя силу туннельного тока, возникающего между сканирующим зондом и изучаемой поверхностью, определять положение атомов в образце.
У Биннига и Рорера получилось, и они вошли в историю как изобретатели сканирующего туннельного микроскопа (СТМ), а в 1986 году получили Нобелевскую премию по физике. Сканирующий туннельный микроскоп совершил настоящую революцию в физике и химии.
В 1990 году Дон Айглер и Эрхард Швайцер, работавшие в исследовательском центре IBM в Калифорнии, показали, что СТМ можно применять не только для наблюдения за атомами, но для манипулирования ими. С помощью зонда сканирующего туннельного микроскопа они создали, возможно, самый популярный образ, символизирующий переход химиков к работе с отдельными атомами — нарисовали на никелевой поверхности три буквы 35 атомами ксенона (рис. 1).
С помощью зонда сканирующего туннельного микроскопа они создали, возможно, самый популярный образ, символизирующий переход химиков к работе с отдельными атомами — нарисовали на никелевой поверхности три буквы 35 атомами ксенона (рис. 1).
Бинниг не стал почивать на лаврах — в год получения Нобелевской премии совместно с Кристофером Гербером и Кельвином Куэйтом, также работавшими в Цюрихском исследовательском центре IBM он начал работу над еще одним устройством для изучения микромира, лишенного недостатков, которые присущи СТМ. Дело в том, что с помощью сканирующего туннельного микроскопа нельзя было изучать диэлектрические поверхности, а только проводники и полупроводники, да и для анализа последних между ними и зондом микроскопа нужно было создать значительное разрежение. Поняв, что создать новое устройство проще, чем модернизировать существующее, Бинниг, Гербер и Куэйт изобрели атомно-силовой микроскоп, или АСМ. Принцип его работы кардинально иной: для получения информации о поверхности измеряют не силу тока, возникающую между зондом микроскопа и изучаемым образцом, а значение возникающих между ними сил притяжения, то есть слабых нехимических взаимодействий — сил Ван-дер-Ваальса.
Первая рабочая модель АСМ была устроена сравнительно просто. Исследователи перемещали над поверхностью образца алмазный зонд, связанный с гибким микромеханическим датчиком — кантилевером из золотой фольги (между зондом и атомом возникает притяжение, кантилевер гнется в зависимости от силы притяжения и деформирует пьезоэлектрик). Степень изгиба кантилевера определялась с помощью пьезоэлектрических датчиков — сходным образом канавки и гребни виниловой пластинки превращаются в аудиозапись. Конструкция атомно-силового микроскопа позволяла ему детектировать силы притяжения до 10 –18 ньютон. Через год после создания рабочего прототипа исследователям удалось получить изображение рельефа поверхности графита с разрешением в 2,5 ангстрема.
За три десятка лет, прошедших с тех пор, АСМ использовали для изучения практически любых химических объектов — от поверхности керамического материала до живых клеток и отдельных молекул, причем находящихся как в статическом, так и динамическом состоянии. Атомно-силовая микроскопия стала рабочей лошадкой химиков и материаловедов, а количество работ, в которых применяется этот метод, постоянно растет (рис. 2).
Атомно-силовая микроскопия стала рабочей лошадкой химиков и материаловедов, а количество работ, в которых применяется этот метод, постоянно растет (рис. 2).
За эти годы исследователи подобрали условия и для контактного, и для бесконтактного изучения объектов с помощью атомно-силовой микроскопии. Контактный метод описан выше, он основан на вандерваальсовом взаимодействии между кантилевером и поверхностью. При работе в бесконтактном режиме пьезовибратор возбуждает колебания зонда на некоторой частоте (чаще всего резонансной). Сила, действующая со стороны поверхности, приводит к тому, что и амплитуда, и фаза колебаний зонда изменяются. Несмотря на некоторые недостатки бесконтактного метода (в первую очередь чувствительность к внешним шумам), именно он исключает воздействие зонда на исследуемый объект, а значит, интереснее для химиков.
Живо по зондам, в погоню за связями
Бесконтактной атомно-силовая микроскопия стала в 1998 году благодаря работам ученика Биннига — Франца Йозефа Гиссибла. Именно он предложил использовать в качестве кантилевера кварцевый эталонный генератор стабильной частоты. Спустя 11 лет исследователи из лаборатории IBM в Цюрихе предприняли еще одну модификацию бесконтактного АСМ: роль зонда-сенсора выполнял не острый кристалл алмаза, а одна молекула — монооксид углерода. Это позволяло перейти к субатомному разрешению, что и продемонстрировал Лео Гросс из цюрихского отдела IBM. В 2009 году с помощью АСМ он сделал видимыми уже не атомы, а химические связи, получив достаточно четкую и однозначно читаемую «картинку» для молекулы пентацена (рис. 3; Science
Именно он предложил использовать в качестве кантилевера кварцевый эталонный генератор стабильной частоты. Спустя 11 лет исследователи из лаборатории IBM в Цюрихе предприняли еще одну модификацию бесконтактного АСМ: роль зонда-сенсора выполнял не острый кристалл алмаза, а одна молекула — монооксид углерода. Это позволяло перейти к субатомному разрешению, что и продемонстрировал Лео Гросс из цюрихского отдела IBM. В 2009 году с помощью АСМ он сделал видимыми уже не атомы, а химические связи, получив достаточно четкую и однозначно читаемую «картинку» для молекулы пентацена (рис. 3; Science
, 2009, 325, 5944, 1110–1114, doi: 10.1126/science.1176210
).
Убедившись, что с помощью АСМ можно увидеть химическую связь, Лео Гросс решил пойти дальше и применить атомно-силовой микроскоп для измерения длин и порядков связей — ключевых параметров для понимания химической структуры, а следовательно, и свойств веществ.
Напомним, что различие в порядках связей указывает на разные значения электронной плотности и различные межатомные расстояния между двумя атомами (говоря проще, двойная связь короче одинарной).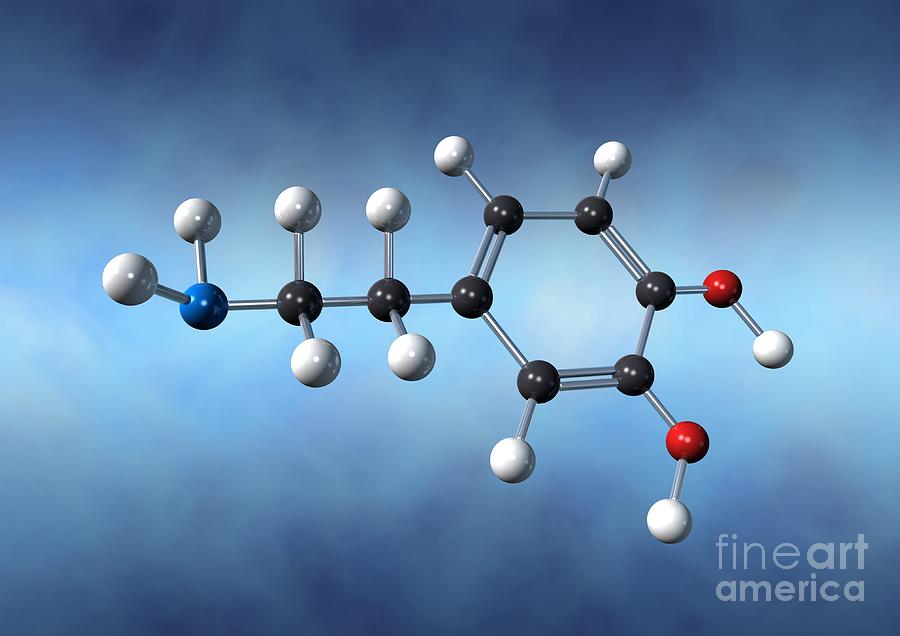 В этане порядок связи углерод-углерод равен единице, в этилене — двум, а в классической ароматической молекуле — бензоле — порядок связи углерод-углерод больше единицы, но меньше двух, и считается равным 1,5.
В этане порядок связи углерод-углерод равен единице, в этилене — двум, а в классической ароматической молекуле — бензоле — порядок связи углерод-углерод больше единицы, но меньше двух, и считается равным 1,5.
Определить порядок связи гораздо сложнее при переходе от простых ароматических систем к плоским или объемным поликонденсированным циклическим системам. Так, порядок связей в фуллеренах, состоящих из конденсированных пяти- и шестичленных углеродных циклов, может принимать любое значение от единицы до двух. Та же самая неопределенность теоретически присуща и полициклическим ароматическим соединениям.
В 2012 году Лео Гросс совместно с Фабианом Моном показал, что атомно-силовой микроскоп с металлическим бесконтактным зондом, модифицированным монооксидом углерода, может измерять различия в распределении зарядов у атомов и межатомные расстояния — то есть параметры, ассоциированные с порядком связи (Science
, 2012, 337, 6100, 1326–1329, doi: 10.1126/science.1225621
).
Для этого они изучили два типа химических связей в фуллерене — связь углерод-углерод, общую для двух шестичленных углеродсодержащих циклов фуллерена С 60 , и связь углерод-углерод, общую для пяти- и шестичленного циклов. Атомно-силовой микроскоп показал, что при конденсации шестичленных циклов образуется связь более короткая и с большим порядком, чем при конденсации циклических фрагментов C 6 и C 5 . Изучение же особенностей химического связывания в гексабензокоронене, где вокруг центрального цикла C 6 симметрично расположено еще шесть циклов C 6 , подтвердило результаты квантово-химического моделирования, согласно которым порядок связей С-С центрального кольца (на рис. 4 буква i
Атомно-силовой микроскоп показал, что при конденсации шестичленных циклов образуется связь более короткая и с большим порядком, чем при конденсации циклических фрагментов C 6 и C 5 . Изучение же особенностей химического связывания в гексабензокоронене, где вокруг центрального цикла C 6 симметрично расположено еще шесть циклов C 6 , подтвердило результаты квантово-химического моделирования, согласно которым порядок связей С-С центрального кольца (на рис. 4 буква i
) должен быть больше, чем у связей, объединяющих это кольцо с периферийными циклами (на рис. 4 буква j
). Сходные результаты получили и для более сложного полициклического ароматического углеводорода, содержащего девять шестичленных циклов.
Порядки связей и межатомные расстояния, конечно же, интересовали химиков-органиков, но важнее это было тем, кто занимался теорией химической связи, предсказанием реакционной способности и изучением механизмов химических реакций. Тем не менее и химиков-синтетиков, и специалистов по изучению структуры природных соединений ждал сюрприз: оказалось, что атомно-силовой микроскоп можно применять для установления структуры молекул точно так же, как ЯМР или ИК-спектроскопию. Более того, он дает однозначный ответ на вопросы, с которыми эти методы не в состоянии справиться.
Более того, он дает однозначный ответ на вопросы, с которыми эти методы не в состоянии справиться.
От фотографии к кинематографу
В 2010 году все тот же Лео Гросс и Райнер Эбел смогли однозначно установить строение природного соединения — цефаландола А, выделенного из бактерии Dermacoccus abyssi
(Nature Chemistry
, 2010, 2, 821–825, doi: 10.1038/nchem.765). Состав цефаландола А установили ранее с помощью масс-спектрометрии, однако анализ спектров ЯМР этого соединения не давал однозначного ответа на вопрос о его структуре: возможны были четыре варианта. С помощью атомно-силового микроскопа исследователи сразу же исключили две из четырех структур, а из двух оставшихся правильный выбор сделали, сравнив результаты, полученные благодаря АСМ и квантово-химическому моделированию. Задача оказалась непростой: в отличие от пентацена, фуллерена и короненов, в состав цефаландола А входят не только атомы углерода и водорода, кроме того, у этой молекулы нет плоскости симметрии (рис. 5) — но и такую задачу удалось решить.
5) — но и такую задачу удалось решить.
Еще одно подтверждение того, что атомно-силовой микроскоп можно использовать как аналитический инструмент, получили в группе Оскара Кустанца, в то время работавшего в инженерной школе Университета Осаки. Он показал, как с помощью АСМ различить атомы, отличающиеся друг от друга гораздо меньше, чем углерод и водород (Nature
, 2007, 446, 64–67, doi: 10.1038/nature05530). Кустанц исследовал поверхность сплава, состоящего из кремния, олова и свинца с известным содержанием каждого элемента. В результате многочисленных экспериментов он выяснил, что сила, возникающая между острием зонда АСМ и разными атомами, различается (рис. 6). Так, например, самое сильное взаимодействие наблюдалось при зондировании кремния, а самое слабое — при зондировании свинца.
Предполагается, что в дальнейшем результаты атомно-силовой микроскопии для распознавания отдельных атомов будут обрабатываться так же, как результаты ЯМР, — по сравнению относительных величин. Поскольку точный состав иглы датчика трудно контролировать, абсолютное значение силы между датчиком и различными атомами поверхности зависит от условий эксперимента и марки устройства, а вот отношение этих сил при любом составе и форме датчика остается постоянным для каждого химического элемента.
Поскольку точный состав иглы датчика трудно контролировать, абсолютное значение силы между датчиком и различными атомами поверхности зависит от условий эксперимента и марки устройства, а вот отношение этих сил при любом составе и форме датчика остается постоянным для каждого химического элемента.
В 2013 году появились первые примеры использования АСМ для получения изображений отдельных молекул до и после химических реакций: создается «фотосет» из продуктов и полупродуктов реакции, который потом можно смонтировать своего рода документальный фильм (Science
, 2013, 340, 6139, 1434–1437; doi: 10.1126/science.1238187
).
Феликс Фишер и Майкл Кромми из Университета Калифорнии в Беркли нанесли на поверхность серебра 1,2-бис[(2-этинилфенил)этинил]бензол
, получили изображение молекул и нагрели поверхность, чтобы инициировать циклизацию. Половина исходных молекул превратилась в полициклические ароматические структуры, состоящие из конденсированных пяти шестичленных и двух пятичленных циклов. Еще четверть молекул образовала структуры, состоящие из четырех шестичленных циклов, связанных через один четырехчленный цикл, и двух пятичленных циклов (рис. 7) . Остальными продуктами были олигомерные структуры и, в незначительном количестве, полициклические изомеры.
Еще четверть молекул образовала структуры, состоящие из четырех шестичленных циклов, связанных через один четырехчленный цикл, и двух пятичленных циклов (рис. 7) . Остальными продуктами были олигомерные структуры и, в незначительном количестве, полициклические изомеры.
Такие результаты дважды удивили исследователей. Во-первых, в ходе реакции образовалось всего лишь два главных продукта. Во-вторых, удивление вызвала их структура. Фишер отмечает, что химическая интуиция и опыт позволяли нарисовать десятки возможных продуктов реакции, однако ни один из них не соответствовал тем соединениям, которые образовывались на поверхности. Возможно, протеканию нетипичных химических процессов способствовало взаимодействие исходных веществ с подложкой.
Естественно, что после первых серьезных успехов в изучении химических связей некоторые исследователи решили применить АСМ для наблюдения более слабых и менее изученных межмолекулярных взаимодействий, в частности водородной связи. Однако в этой области работы еще только начинаются, а результаты их противоречивы. Так, в одних публикациях сообщается, что атомно-силовая микроскопия позволила наблюдать водородную связь (Science
Так, в одних публикациях сообщается, что атомно-силовая микроскопия позволила наблюдать водородную связь (Science
, 2013, 342, 6158, 611–614, doi: 10.1126/science.1242603), в других утверждают, что это всего лишь артефакты, обусловленные конструкционными особенностями прибора, а экспериментальные результаты нужно интерпретировать аккуратнее (Physical Review Letters
, 2014, 113, 186102, doi: 10.1103/PhysRevLett.113.186102
). Возможно, окончательный ответ на вопрос, можно ли наблюдать водородные и другие межмолекулярные взаимодействия с помощью атомно-силовой микроскопии, будет получен уже в этом десятилетии. Для этого необходимо еще хотя бы в несколько раз повысить разрешение АСМ и научиться получать изображения без помех (Physical Review B
, 2014, 90, 085421, doi: 10.1103/PhysRevB.90.085421
).
Синтез одной молекулы
В умелых руках и СТМ и АСМ превращаются из приборов, способных изучать вещество, в приборы, способные направленно изменять строение вещества. С помощью этих устройств уже удалось получить «самые маленькие химические лаборатории», в которых вместо колбы используется подложка, а вместо молей или миллимолей реагирующих веществ — отдельные молекулы.
С помощью этих устройств уже удалось получить «самые маленькие химические лаборатории», в которых вместо колбы используется подложка, а вместо молей или миллимолей реагирующих веществ — отдельные молекулы.
Например, в 2016 году международная группа ученых во главе с Такаси Кумагаи использовала бесконтактную атомно-силовую микроскопию для перевода молекулы порфицена из одной ее формы в другую (Nature Chemistry
, 2016, 8, 935–940, doi: 10.1038/nchem.2552). Порфицен можно рассматривать как модификацию порфирина, во внутреннем цикле которого содержится четыре атома азота и два атома водорода. Колебания зонда АСМ передавали молекуле порфицена достаточно энергии для переноса этих водородов от одних атомов азота к другим, и в результате получалось «зеркальное отражение» этой молекулы (рис. 8).
Группа под руководством неутомимого Лео Гросса также показала, что возможно инициировать реакцию отдельно взятой молекулы, — они превратили дибромантрацен в десятичленный циклический диин (рис. 9; Nature Chemistry
9; Nature Chemistry
, 2015, 7, 623–628, doi: 10.1038/nchem.2300
). В отличие от Кумагаи с соавторами, они использовали сканирующий туннельный микроскоп для активации молекулы, а за результатом реакции следили с помощью атомно-силового микроскопа.
Комбинированное применение сканирующего туннельного микроскопа и атомно-силового микроскопа позволило даже получить молекулу, которую невозможно синтезировать с помощью классических приемов и методов (Nature Nanotechnology
, 2017, 12, 308–311, doi: 10.1038/nnano.2016.305
). Это триангулен — нестабильный ароматический бирадикал, существование которого было предсказано шесть десятилетий назад, но все попытки синтеза были неудачными (рис. 10). Химики из группы Нико Павличека получили искомое соединение, оторвав от его прекурсора два атома водорода с помощью СТМ и подтвердив синтетический результат с помощью АСМ.
Предполагается, что число работ, посвященных применению атомно-силовой микроскопии в органической химии, еще будет расти. В настоящее время все больше ученых пытаются повторить на поверхности реакции, хорошо знакомые «растворной химии». Но, возможно, химики-синтетики начнут воспроизводить в растворе те реакции, которые были первоначально осуществлены на поверхности с помощью АСМ.
В настоящее время все больше ученых пытаются повторить на поверхности реакции, хорошо знакомые «растворной химии». Но, возможно, химики-синтетики начнут воспроизводить в растворе те реакции, которые были первоначально осуществлены на поверхности с помощью АСМ.
От неживого — к живому
Кантилеверы и зонды атомно-силовых микроскопов можно применять не только для аналитических исследований или синтеза экзотических молекул, но и для решения прикладных задач. Уже известны случаи использования АСМ в медицине, например для ранней диагностики рака, и здесь пионером выступает тот самый Кристофер Гербер, который приложил руку к разработке принципа атомно-силовой микроскопии и созданию АСМ.
Так, Герберу удалось научить АСМ определять точечную мутацию рибонуклеиновой кислоты при меланоме (на материале, полученном в результате биопсии). Для этого золотой кантилевер атомно-силового микроскопа модифицировали олигонуклеотидами, которые могут вступать в межмолекулярное взаимодействие с РНК, а силу этого взаимодействия все также можно измерить за счет пьезоэффекта. Чувствительность сенсора АСМ настолько велика, что его уже пытаются применить для изучения эффективности популярного метода редактирования геномов CRISPR-Cas9. Здесь воедино объединяются технологии, созданные разными поколениями исследователей.
Чувствительность сенсора АСМ настолько велика, что его уже пытаются применить для изучения эффективности популярного метода редактирования геномов CRISPR-Cas9. Здесь воедино объединяются технологии, созданные разными поколениями исследователей.
Перефразируя классика одной из политических теорий, можно сказать, что мы уже сейчас видим безграничные возможности и неисчерпаемость атомно-силовой микроскопии и вряд ли в силах представить, что ждет нас впереди в связи с дальнейшим развитием этих технологий. Но уже сегодня сканирующий туннельный микроскоп и атомно-силовой микроскоп дают нам возможность увидеть атомы и прикоснуться к ним. Можно сказать, что это не только продолжение наших глаз, позволяющее заглянуть в микрокосм атомов и молекул, но и новые глаза, новые пальцы, способные прикоснуться к этому микрокосму и управлять им.
Когда-нибудь видели атомы? Мы с вами из них состоим, поэтому фактически да. Но видели ли вы когда-нибудь один единственный атом? Недавно удивительная фотография всего одного атома, захваченная электрическими полями, победила в престижном конкурсе научной фотографии, удостоивших высшей награды. На конкурс фото попало под вполне логичным названием «Single Atom in Ion Trap» (Один атом в ионной ловушке), а его автором является Дэвид Надлингер из Оксфордского университета.
На конкурс фото попало под вполне логичным названием «Single Atom in Ion Trap» (Один атом в ионной ловушке), а его автором является Дэвид Надлингер из Оксфордского университета.
Британский Научно-исследовательский совет инженерных и физических наук (EPSRC) объявил победителей своего национального конкурса научной фотографии, среди которых главного приза удостоилось фото одного атома
На фото атом представлен в виде крошечного пятнышка света между двумя металлическими электродами, расположенными на расстоянии около 2 мм друг от друга.
Подпись к фото:
«В центре фотографии видна небольшая яркая точка — один положительно заряженный атом стронция. Он удерживается почти неподвижно электрическими полями, исходящими от окружающих его металлических электродов. При освещении лазером сине-фиолетового цвета атом достаточно быстро поглощает и повторно излучает светлые частицы, благодаря чему обычная камера могла сфотографировать его с длинной выдержкой.»
«Фото было сделано через окно камеры сверхвысокого вакуума, в которой находится ловушка.
Охлажденные лазером атомные ионы представляют собой отличную базу для изучения и использования уникальных свойств квантовой физики. Они используются для создания чрезвычайно точных часов или, как в этом случае, в качестве частиц для построения квантовых компьютеров будущего, которые смогут решать задачи, затмевающие сегодняшние даже самые мощнейшие суперкомпьютеры.»
Если вам всё-таки не удалось рассмотреть атом, то вот он
«Идея того, что можно увидеть один атом невооружённым глазом поразила меня до глубины души, являясь своеобразным мостом между крошечным квантовым миром и нашей макроскопической реальностью», — сказал Дэвид Надлингер.
Атом (от греч. «неделимый») — некогда мельчайшая частица вещества микроскопических размеров, наименьшая часть химического элемента, которая носит его свойства. Составляющие атома — протоны, нейтроны, электроны — этих свойств уже не имеют и образуют их в совокупности. Ковалентные атомы образуют молекулы. Ученые изучают особенности атома, и хотя они уже довольно неплохо изучены, не упускают возможности найти что-то новое — в частности, в области создания новых материалов и новых атомов (продолжающих таблицу Менделеева). 99,9% массы атома приходится на ядро.
99,9% массы атома приходится на ядро.
Не пугайтесь заголовка. Чёрная дыра, случайно созданная сотрудниками Национальной ускорительной лаборатории SLAC, получилась размером всего лишь с один атом, так что нам ничто не угрожает. Да и название «чёрная дыра» лишь отдалённо описывает наблюдаемый исследователями феномен. Мы неоднократно рассказывали вам о самом мощном в мире рентгеновском лазере, носящем название
1.
Но начнем мы совсем с другой стороны. Прежде чем отправиться в путешествие к глубинам материи, давайте обратим свой взор вверх.
Например, известно, что до Луны в среднем почти 400 тысяч километров, до Солнца — 150 миллионов, до Плутона (который уже не виден без телескопа) — 6 миллиардов, до ближайшей звезды Проксимы Центавра — 40 триллионов, до ближайшей крупной галактики туманности Андромеды — 25 квинтиллионов, и наконец до окраин обозримой Вселенной — 130 секстиллионов.
Впечатляюще, конечно, но разница между всеми этими «квадри-», «квинти-» и «сексти-» не кажется столь уж огромной, хотя они и различаются между собой в тысячу раз. Совсем другое дело микромир. Разве в нем может быть скрыто так уж много интересного, ведь ему просто негде там поместиться. Так говорит нам здравый смысл и ошибается
Совсем другое дело микромир. Разве в нем может быть скрыто так уж много интересного, ведь ему просто негде там поместиться. Так говорит нам здравый смысл и ошибается
.
2.
Если на одном конце логарифмической шкалы отложить самое маленькое известное расстояние во Вселенной, а на другом — самое большое, то посередине окажется… песчинка. Её диаметр — 0.1 мм.
3.
Если положить в ряд 400 млрд песчинок, их ряд обогнёт весь земной шар по экватору. А если собрать эти же 400 млрд в мешок, весить он будет около тонны.
4.
Толщина человеческого волоса — 50–70 микронам, то есть их 15–20 штук на миллиметр. Для того чтобы выложить ими расстояние до Луны, потребуется 8 триллионов волос (если складывать их не по длине, а по ширине, конечно). Поскольку на голове у одного человека их около 100 тысяч, то если собрать волосы у всего населения России, до Луны хватит с лихвой и даже еще останется.
5.
Размер бактерий — от 0.5 до 5 микрон. (-35) метра. Давайте проделаем наш стандартный «увеличительный» эксперимент в последний раз. Квантовая струна становится удобного размера, и мы держим ее в руке как карандаш. При этом нейтрино будет в 7 раз больше Солнца, а атом водорода в 300 раз превысит размеры Млечного Пути.
(-35) метра. Давайте проделаем наш стандартный «увеличительный» эксперимент в последний раз. Квантовая струна становится удобного размера, и мы держим ее в руке как карандаш. При этом нейтрино будет в 7 раз больше Солнца, а атом водорода в 300 раз превысит размеры Млечного Пути.
20.
Наконец мы подошли к самой структуре мироздания — масштабу, на котором пространство становится похожим на время, время на пространство, и происходят разные другие причудливые штуки. Дальше уже ничего нет (наверное)…
В эволюции человека нет «недостающего звена»
Термин «недостающее звено» вышел из обращения в научных кругах, так как связан с ошибочным предположением о том, что эволюционный процесс линеен и идёт последовательно, «по цепочке». Вместо этого биологи пользуются термином «последний общий предок».
Интересные факты о Солнечной системе
Молекулы и атомы | Физика
Гипотеза о том, что все вещества состоят из отдельных мельчайших частиц, появилась очень давно, более двух тысяч лет назад. Но лишь на рубеже XIX — XX вв. было установлено, что это за частицы и какими свойствами они обладают.
Но лишь на рубеже XIX — XX вв. было установлено, что это за частицы и какими свойствами они обладают.
Частицы, из которых состоят вещества, называют молекулами. Так, например, наименьшая частица воды — это молекула воды, наименьшая частица сахара — это молекула сахара и т. д.
Каковы размеры молекул?
Известно, что кусок сахара можно растолочь на очень маленькие крупинки, зерно пшеницы можно размолоть в муку. Капля масла, растекаясь по поверхности воды, может образовать пленку, толщина которой в десятки тысяч раз меньше диаметра человеческого волоса. Но в крупинке муки и в толще масляной пленки содержится не одна, а много молекул. Значит, размеры молекул этих веществ еще меньше, чем размеры крупинки муки и толщина пленки.
Можно привести следующее сравнение: молекула во столько же раз меньше яблока среднего размера, во сколько раз яблоко меньше земного шара. Если бы размеры всех тел увеличились в миллион раз (при этом толщина человеческого пальца стала бы равной 10 км), то и тогда молекула оказалась бы размером всего вполовину точки печатного шрифта этого учебника.
Молекулы невозможно увидеть невооруженным глазом. Они настолько малы, что их нельзя разглядеть даже с помощью микроскопа, дающего 1000-кратное увеличение.
Биологам известны микроорганизмы (например, бактерии) размером 0,001 мм. Молекулы же в сотни и тысячи раз меньше.
Для определения размеров молекул были проведены разные опыты. Опишем один из них.
В чисто вымытый большой сосуд налили воду и на ее поверхность поместили каплю масла. Масло начало растекаться по поверхности воды, образуя пленку. По мере растекания масла толщина пленки становилась все меньше и меньше. Через некоторое время растекание прекратилось. Если предположить, что это произошло из-за того, что все молекулы масла оказались на поверхности воды (образуя пленку толщиной в одну молекулу), то для определения диаметра молекулы достаточно найти толщину образовавшейся пленки.
Толщина пленки h равна отношению ее объема V к площади S:
(26.1)
Объем пленки — это объем той капли, которую поместили на поверхность воды. Его измеряют заранее; для этого пользуются измерительным цилиндром — мензуркой. При помощи пипетки в пустую мензурку капают несколько десятков капель масла и измеряют их общий объем; разделив затем этот объем на число капель, находят объем одной капли.
Его измеряют заранее; для этого пользуются измерительным цилиндром — мензуркой. При помощи пипетки в пустую мензурку капают несколько десятков капель масла и измеряют их общий объем; разделив затем этот объем на число капель, находят объем одной капли.
В описываемом опыте капля имела объем V = 0,0009 см3, а площадь образовавшейся из нее пленки была равна S = 5500 см2. Подставив эти значения в формулу (26.1), получим
h = 0,00000016 см.
Этим числом и выражается примерный размер молекулы масла.
Так как молекулы очень малы, то в каждом теле их содержится огромное количество. Чтобы создать представление об их числе, приведем пример: если в детском резиновом шарике, наполненном водородом, сделать такой тонкий прокол, что из него каждую секунду будет выходить по миллиону молекул, то для вылета всех молекул из шарика понадобится 30 миллиардов лет! И это при том, что масса водорода, наполнявшего шарик, составляла всего 3 г.
Хотя молекулы и очень маленькие частицы, но и они делимы. Частицы, из которых состоят молекулы, называют атомами.
Частицы, из которых состоят молекулы, называют атомами.
Атомы каждого вида принято обозначать специальными символами. Например:
атом кислорода — О,
атом водорода — Н,
атом углерода — С.
Специальные символы (так называемые химические формулы) существуют и для обозначения молекул. Например, молекула кислорода состоит из двух одинаковых атомов кислорода, поэтому для ее обозначения применяют следующую химическую формулу: O2. Молекула воды состоит из трех атомов: одного атома кислорода и двух атомов водорода, поэтому ее обозначают H2O.
На рисунке 68 дано условное изображение двух молекул воды. При делении двух молекул воды получаются два атома кислорода и четыре атома водорода. Каждые два атома водорода могут объединиться в молекулу водорода, а атомы кислорода — в молекулу кислорода, что схематически показано на рисунке 69.Современная техника позволяет получить фотографии отдельных атомов и молекул. На рисунке 70 приведен снимок молекулы фторида мышьяка, полученный с помощью электронно-голографического микроскопа, дающего увеличение в 70 миллионов раз. Фотографию отдельного атома можно увидеть на рисунке 71, это изображение атома аргона, увеличенное в 260 миллионов раз.Атомы очень маленькие частицы, но и они имеют сложное строение. Существуют еще более мелкие частицы, о которых вы узнаете позже.
Фотографию отдельного атома можно увидеть на рисунке 71, это изображение атома аргона, увеличенное в 260 миллионов раз.Атомы очень маленькие частицы, но и они имеют сложное строение. Существуют еще более мелкие частицы, о которых вы узнаете позже.
1. Как называются частицы, из которых состоят вещества? 2. Опишите опыт, с помощью которого можно определить размер молекулы. 3. Как называются частицы, из которых состоят молекулы? 4. Из каких атомов состоит молекула воды? Что означает формула Н2О? 5. Напишите химическую формулу молекулы водорода, если известно, что эта молекула состоит из двух одинаковых атомов водорода. 6. Из скольких (и каких) атомов состоит молекула углекислого газа, если ее химическая формула имеет вид СO2?
Ученые сделали первые изображения молекул до и после реакции
Мечта каждого химика — получить изображение химического вещества в атомном масштабе до и после его реакции — теперь сбылась благодаря новой методике, разработанной химиками и физиками в Калифорнийский университет, Беркли.
С помощью ультрасовременного атомно-силового микроскопа ученые сделали первые снимки атома за атомом, в том числе изображения химических связей между атомами, ясно показывающие, как структура молекулы изменялась во время реакции. До сих пор ученые могли получать информацию такого типа только из спектроскопического анализа.
Изображения (в центре) молекулы до и после реакции, полученные с помощью бесконтактного атомно-силового микроскопа (nc-AFM), значительно лучше изображений (вверху), полученных с помощью сканирующего туннельного микроскопа, и выглядят точно так же, как классические диаграммы молекулярной структуры (внизу).
«Несмотря на то, что я использую эти молекулы изо дня в день, возможность видеть эти картинки меня поразила. Ух ты!» сказал ведущий исследователь Феликс Фишер, доцент кафедры химии Калифорнийского университета в Беркли. «Это было то, что мои учителя говорили, что вы никогда не сможете увидеть на самом деле, и теперь у нас есть это здесь».
Способность изображать таким образом молекулярные реакции поможет не только студентам-химикам при изучении химических структур и реакций, но также впервые покажет химикам продукты их реакций и поможет им точно настроить реакции, чтобы получить продукты, которые они хотят. Фишер вместе с коллегой Майклом Кромми, профессором физики Калифорнийского университета в Беркли, сделали эти изображения с целью создания новых графеновых наноструктур, что сегодня является горячей областью исследований для материаловедов из-за их потенциального применения в компьютерах следующего поколения.
Фишер вместе с коллегой Майклом Кромми, профессором физики Калифорнийского университета в Беркли, сделали эти изображения с целью создания новых графеновых наноструктур, что сегодня является горячей областью исследований для материаловедов из-за их потенциального применения в компьютерах следующего поколения.
«Однако последствия выходят далеко за рамки простого графена», — сказал Фишер. «Эта методика найдет применение, например, при изучении гетерогенного катализа», который широко используется в нефтяной и химической промышленности. Гетерогенный катализ включает использование металлических катализаторов, таких как платина, для ускорения реакций, например, в каталитическом нейтрализаторе автомобиля.
«Чтобы понять химию, которая на самом деле происходит на каталитической поверхности, нам нужен очень избирательный инструмент, который сообщает нам, какие связи действительно образовались, а какие разорвались», — добавил он. «Этот метод сейчас уникален по точности, с которой он дает вам структурную информацию. Я думаю, что это прорыв».
Я думаю, что это прорыв».
«Атомно-силовой микроскоп дает нам новую информацию о химической связи, которая невероятно полезна для понимания того, как соединяются различные молекулярные структуры и как можно преобразовать одну форму в другую», — сказал Кромми. «Это должно помочь нам создавать новые инженерные наноструктуры, такие как связанные сети атомов, которые имеют определенную форму и структуру для использования в электронных устройствах. Это указывает путь вперед».
Фишер и Кромми вместе с другими коллегами из Калифорнийского университета в Беркли в Испании и из Национальной лаборатории Лоуренса в Беркли (LBNL) опубликовали свои выводы в Интернете 30 мая в журнале 9.0019 Научный экспресс .
От тени к снимку
Традиционно Фишер и другие химики проводят детальный анализ для определения продуктов химической реакции, и даже тогда фактическое трехмерное расположение атомов в этих продуктах может быть неоднозначным.
«В химии вы бросаете что-то в колбу, а оттуда выходит что-то еще, но обычно вы получаете очень косвенную информацию о том, что у вас есть», — сказал Фишер. «Вы должны сделать вывод, взяв ядерно-магнитный резонанс, инфракрасный или ультрафиолетовый спектры. Это больше похоже на головоломку, собирающую всю информацию воедино, а затем определяющую структуру. Но это всего лишь тень. Здесь у нас на самом деле есть техника, с помощью которой мы можем посмотреть на нее и сказать, что это именно та молекула. Это как сделать снимок».
«Вы должны сделать вывод, взяв ядерно-магнитный резонанс, инфракрасный или ультрафиолетовый спектры. Это больше похоже на головоломку, собирающую всю информацию воедино, а затем определяющую структуру. Но это всего лишь тень. Здесь у нас на самом деле есть техника, с помощью которой мы можем посмотреть на нее и сказать, что это именно та молекула. Это как сделать снимок».
Атомно-силовой микроскоп исследует молекулу, адсорбированную на поверхности, используя молекулу окиси углерода на кончике для чувствительности.
Fischer разрабатывает новые методы создания графеновых наноструктур, обладающих необычными квантовыми свойствами, которые могут сделать их полезными в электронных устройствах наномасштаба. Атомы углерода расположены шестиугольно, как проволочная сетка. Вместо того, чтобы разрезать лист чистого углерода — графена — он надеется поместить на поверхность группу более мелких молекул и заставить их собраться вместе в желаемую архитектуру. Проблема, по его словам, заключается в том, как определить, что на самом деле было сделано.
Именно тогда он обратился к Кромми, который использует атомно-силовые микроскопы для исследования поверхностей материалов с атомарным разрешением и даже перемещает атомы по отдельности на поверхности. Работая вместе, они разработали способ охладить реакционную поверхность и молекулы до температуры жидкого гелия — около 4 Кельвинов, или 270 градусов по Цельсию ниже нуля, — что предотвращает раскачивание молекул. Затем они использовали сканирующий туннельный микроскоп, чтобы определить местонахождение всех молекул на поверхности, и остановились на нескольких, чтобы более точно изучить их с помощью атомно-силового микроскопа. Чтобы улучшить пространственное разрешение своего микроскопа, они поместили одну молекулу монооксида углерода на иглу. Метод, называемый бесконтактным АСМ, впервые был использован Герхардом Мейером и его сотрудниками из IBM Zurich для изображения молекул несколько лет назад.
После визуализации молекулы — «циклической» структуры с несколькими шестиугольными кольцами углерода, которую Фишер создал специально для этого эксперимента — Фишер, Кромми и их коллеги нагревали поверхность до тех пор, пока молекула не прореагировала, а затем снова охладили поверхность до 4 Кельвинов и представили продукты реакции.
«Выполняя это на поверхности, вы ограничиваете реакционную способность, но у вас есть преимущество, заключающееся в том, что вы можете фактически посмотреть на одну молекулу, дать этой молекуле имя или номер, а затем посмотреть, во что она превращается в продуктах». он сказал.
«В конечном счете, мы пытаемся разработать новую химию поверхности, которая позволит нам строить архитектуры более высокого порядка на поверхностях, и это может привести к таким приложениям, как создание электронных устройств, устройств хранения данных или логических элементов из углеродных материалов».
Соавторами исследования являются Димас Г. де Отейза, Йен-Чиа Чен, Себастьян Викенбург, Александр Рисс, Захра Педрамрази и Хсин-Зон Цай из физического факультета Калифорнийского университета в Беркли; Патрик Горман и Гриша Эткин с химического факультета; и Дункан Дж. Моубрей и Анхель Рубио из исследовательских центров в Сан-Себастьяне, Испания. Кромми, Фишер, Чен и Викенбург также работают в Национальной лаборатории Лоуренса в Беркли.
Работа спонсируется Управлением военно-морских исследований, Министерством энергетики и Национальным научным фондом.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
- Прямая визуализация структуры ковалентной связи в одномолекулярных химических реакциях (30 мая Science Express )
- Атом за атомом, облигация за облигацией, химическая реакция, пойманная на месте преступления (исследование LBNL, 30 мая 2013 г.)
- Веб-сайт Феликса Фишера
- Веб-сайт Майкла Кромми
Атомы, молекулы и соединения | manoa.hawaii.edu/ExploringOurFluidEarth
Химические структуры
Свойства элементов и соединений определяются их структурой. Простейшей структурной единицей элемента является атом. Атомы очень малы. Сто миллионов (100 000 000) атомов водорода, поставленных рядом, составляют всего один сантиметр!
Некоторые элементы являются одноатомными , то есть состоят из одного ( мон-) атом (-атомный ) в их молекулярной форме. Гелий (He, см. рис. 2.8) является примером одноатомного элемента. Другие элементы содержат два или более атомов в своей молекулярной форме (рис. 2.8). Например, молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ) содержат по два атома. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Гелий (He, см. рис. 2.8) является примером одноатомного элемента. Другие элементы содержат два или более атомов в своей молекулярной форме (рис. 2.8). Например, молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ) содержат по два атома. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Молекулы соединений содержат атомы двух или более различных элементов. Например, вода (H 2 O) имеет три атома, два атома водорода (H) и один атом кислорода (O). Метан (CH 4 ), распространенный парниковый газ, имеет пять атомов, один атом углерода (C) и четыре атома водорода (H, см. рис. 2.9).
Электростатические силы
Электростатические силы удерживают атомы в молекулах. Электростатические силы, которые удерживают атомы вместе в молекулах, относятся к тому же типу сил, которые вызывают статическое электричество. Типичными примерами статического электричества являются случаи, когда кто-то получает удар током, когда тянется к дверной ручке, или когда волосы ребенка поднимаются дыбом при спуске с пластиковой горки (рис. 2.10).
Типичными примерами статического электричества являются случаи, когда кто-то получает удар током, когда тянется к дверной ручке, или когда волосы ребенка поднимаются дыбом при спуске с пластиковой горки (рис. 2.10).
Деятельность
Определить, как взаимодействует заряженное вещество.
Части атомов
Частицы, из которых состоит атом, называются субатомными частицами ( sub — означает «меньший размер»). Эти частицы представляют собой
- протон (p + ), который заряжен положительно (+);
- электрон (е – ), который заряжен отрицательно (–); и
- нейтрон (n 0 ), который не имеет заряда, он нейтрален (0).
Протоны и нейтроны занимают ядро , или центр атома. Электроны существуют в областях, называемых оболочками вне ядра атома (рис. 2.11).
2.11).
Электростатические силы удерживают атомы вместе в молекулах — подобно тому, как два атома водорода удерживаются вместе в газе h3. Электростатические силы также удерживают вместе электроны и протоны в атоме. Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме определяет структуру атома. сильная сила удерживает вместе нейтроны и протоны в ядре. Эта сила получила свое название потому, что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов друг от друга. Количество электронов и протонов в атоме определяет его химические свойства. К химическим свойствам относятся особые способы взаимодействия атомов и молекул и энергия, которую они выделяют или используют в этих реакциях.
Размер субатомных частиц
Сто миллионов (100 000 000) атомов водорода, поставленных рядом, составляют около сантиметра. Протоны и нейтроны составляют примерно одну тысячную (1/1000) диаметра атома водорода. Это означает, что потребуется около ста миллиардов (100 000 000 000) протонов или нейтронов, положенных бок о бок, чтобы получился сантиметр. Электроны составляют примерно одну тысячную (1/1000) диаметра протона или нейтрона. Это означает, что потребуется сто триллионов (100 000 000 000 000) электронов, положенных бок о бок, чтобы получить сантиметр!
Это означает, что потребуется около ста миллиардов (100 000 000 000) протонов или нейтронов, положенных бок о бок, чтобы получился сантиметр. Электроны составляют примерно одну тысячную (1/1000) диаметра протона или нейтрона. Это означает, что потребуется сто триллионов (100 000 000 000 000) электронов, положенных бок о бок, чтобы получить сантиметр!
Нейтральные атомы
Элементарные частицы в атоме определяют свойства атома. Некоторые атомы существуют в природе как нейтральные или незаряженные атомы. Одиночный незаряженный атом имеет равное количество протонов (+) и электронов (–). Незаряженный атом электрически нейтрален, потому что электроны и протоны имеют противоположные заряды одинаковой величины. Когда количество протонов и электронов в атоме одинаково, заряды компенсируются или противодействуют друг другу.
Протоны и нейтроны
Каждый атом определенного элемента имеет одинаковое количество протонов. Атомный номер равен количеству протонов в элементе. В периодической таблице атомный номер обычно указывается как целое число над символом элемента (см. рис. 2.13). Например, водород (Н) имеет атомный номер один (1). Это означает, что атом водорода имеет один протон. Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что нейтральный атом кислорода имеет восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89., поэтому в нейтральном атоме 89 протонов и 89 электронов. В таблице 2.2 показаны атомный номер, символ атома, атомная структура и количество протонов, нейтронов и электронов для первых трех элементов.
В периодической таблице атомный номер обычно указывается как целое число над символом элемента (см. рис. 2.13). Например, водород (Н) имеет атомный номер один (1). Это означает, что атом водорода имеет один протон. Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что нейтральный атом кислорода имеет восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89., поэтому в нейтральном атоме 89 протонов и 89 электронов. В таблице 2.2 показаны атомный номер, символ атома, атомная структура и количество протонов, нейтронов и электронов для первых трех элементов.
| Водород | Гелий | Литий | |
| Атомный номер | 1 | 2 | 3 |
| Атомный символ | Х | Он | Ли |
| Количество протонов | 1 | 2 | 3 |
| Количество электронов | 1 | 2 | 3 |
| Количество нейтронов | 0 | 2 | 4 |
| Атомная структура |
Нейтроны влияют на массу атома и играют роль в стабильности атомов. В отличие от протонов количество нейтронов в элементах различно. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. Большинство атомов гелия имеют два нейтрона, но некоторые имеют три нейтрона.
В отличие от протонов количество нейтронов в элементах различно. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. Большинство атомов гелия имеют два нейтрона, но некоторые имеют три нейтрона.
Периоды, группы и периодическая таблица
Периодическая таблица (рис. 2.12) — широко используемый метод организации элементов, предоставляющий полезную информацию об элементах и их поведении. На рис. 2.12 элементы синего цвета — это металлы, а элементы желтого цвета — неметаллы. На рис. 2.13 запись для водорода выделена размещением атомного номера, символа элемента, имени элемента и атомного веса.
Таблица Менделеева имеет три важные особенности. Во-первых, периодическая таблица выстроена в горизонтальные ряды, которые называются периодами . Есть семь периодов. В периоде 1 есть два элемента: водород (H) и гелий (He). Второй и третий периоды содержат по восемь элементов, четвертый и пятый периоды содержат по 18 элементов, а шестой и седьмой периоды содержат по 32 элемента.
Второй и третий периоды содержат по восемь элементов, четвертый и пятый периоды содержат по 18 элементов, а шестой и седьмой периоды содержат по 32 элемента.
Во-вторых, все элементы перечислены последовательно в соответствии с их атомными номерами. Атомный номер соответствует количеству протонов и находится над символом элемента. Например, на рис. 2.13 атомный номер водорода равен 1, что соответствует H.9.0003
В-третьих, периодическая таблица состоит из столбцов элементов, которые реагируют одинаково. Эти столбцы называются группами . Номер группы находится в верхней части столбца. Группы 1–12 содержат только металлы, группы 13–16 содержат как металлы, так и неметаллы, а группы 17 и 18 содержат только неметаллы. Единственным исключением является водород. Хотя технически водород является неметаллом, он обладает свойствами как металлов, так и неметаллов и часто помещается в Группу 1. Два длинных ряда в нижней части периодической таблицы являются исключениями. Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами. Эти две группы расположены в строках, а не в столбцах.
Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами. Эти две группы расположены в строках, а не в столбцах.
Металлы и неметаллы
Металлы — это элементы, проводящие тепло и электричество. Металлы обычно ковкие , их можно сгибать или формовать без разрушения, и блестящие , или блестящие. Большинство металлов имеют серебристый цвет (рис. 2.14 A–C), хотя некоторые из них не имеют серебристого цвета, например медь (Cu, рис. 2.14 D). Большинство металлов находятся в твердом состоянии при комнатной температуре. Единственным исключением является ртуть (Hg), которая при комнатной температуре представляет собой жидкость (рис. 2.14 А). Элементы группы 1, включая литий (Li), натрий (Na, рис. 2.14 B), калий (K, рис. 2.14 C) и рубидий (Rb), все являются металлами. Эти металлические элементы группы 1 обладают схожими реактивными свойствами. На рис. 2.12 металлы показаны синим цветом.
Неметаллы плохо проводят тепло и электричество; они не блестят и существуют в природе в виде твердых тел, жидкостей или газов. В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например, сера, которая отслаивается, а не изгибается, как металл (рис. 2.15 А). Элементы группы 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 Б), бром (Br 2 , рис. 2.15 В) и йод (I 2 , рис. 2.15 D), все неметаллы. Все неметаллы 17-й группы являются двухатомными (два атома) в своей элементарной форме и обладают сходными реакционными свойствами. На рис. 2.12 неметаллы показаны желтым цветом.
В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например, сера, которая отслаивается, а не изгибается, как металл (рис. 2.15 А). Элементы группы 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 Б), бром (Br 2 , рис. 2.15 В) и йод (I 2 , рис. 2.15 D), все неметаллы. Все неметаллы 17-й группы являются двухатомными (два атома) в своей элементарной форме и обладают сходными реакционными свойствами. На рис. 2.12 неметаллы показаны желтым цветом.
См. сводку свойств металлов и неметаллов в Таблице 2.3.
| Металлы | Неметаллы | |
| Физические свойства | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества |
| Ковкий — можно бить или деформировать без образования трещин; гибкий | Хрупкий | |
| Ковкий — можно превратить в проволоку | Непластичный | |
| Блестящий | Не блестящий, может быть непрозрачным или прозрачным | |
| Твердое вещество при комнатной температуре (кроме Hg и некоторых других металлов, находящихся в жидком состоянии при комнатной температуре или близкой к ней) | Твердое, жидкое или газообразное вещество при комнатной температуре | |
| Химические свойства | Обычно имеют 1-3 валентных электрона | Обычно имеют 4-8 валентных электронов |
| Склонен к потере валентных электронов | Склонен к получению электронов |
Другие организационные особенности Периодической таблицы
Существуют и другие организационные особенности таблицы Менделеева. Большинство периодов имеют первый элемент периода в Группе 1 и последний элемент в Группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17 выше фтора (F), потому что он имеет сходные свойства с неметаллами этой группы; например, в своем элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород относят и к 1-й, и к 17-й группе9.0003
Большинство периодов имеют первый элемент периода в Группе 1 и последний элемент в Группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17 выше фтора (F), потому что он имеет сходные свойства с неметаллами этой группы; например, в своем элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород относят и к 1-й, и к 17-й группе9.0003
Группы элементов имеют схожие свойства. Свойства некоторых групп настолько уникальны или важны, что группы называются специальными именами. В последнюю группу, группу 18, входят гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Элементы этой группы называются благородными газами. Благородные газы редко реагируют с другими элементами. Благородные газы имеют множество применений, например, они используются в неоновых вывесках (рис. 2.16).
Группу 1 часто называют щелочными металлами, группу 2 — щелочноземельными металлами, а группу 17 — галогенами. Две группы, расположенные в нижней части таблицы Менделеева рядами, называются рядом редкоземельных элементов лантанидов (верхний ряд) и рядом актиноидов (нижний ряд).
Две группы, расположенные в нижней части таблицы Менделеева рядами, называются рядом редкоземельных элементов лантанидов (верхний ряд) и рядом актиноидов (нижний ряд).
Набор вопросов
Иллюстрация атомов и молекул
Реферат
Поскольку атомы меньше длины волны видимого света, теоретически невозможно «увидеть» атом даже с помощью самого мощного микроскопа. Тем не менее мы признаем, что атомы состоят из «оболочек» электронов, жужжащих вокруг центрального ядра. Поэтому принято изображать атом в виде простой сферы, диаметр которой пропорционален размеру его самой внешней электронной оболочки. Кроме того, ученые разработали экспериментальные методы, такие как рентгеновская кристаллография и ЯМР-спектроскопия, для определения геометрического расположения атомов внутри молекулы. Эти данные можно использовать для построения трехмерных моделей молекул, но иллюстратор должен знать, что такая модель является абстрактным представлением и не предназначена для демонстрации того, как молекула действительно «выглядит».
Цвета атомов
Поскольку длина атома меньше длины волны видимого света, он не может отражать свет и, следовательно, не имеет цвета. Разноцветные атомы, которые вы видите в учебниках по химии, основаны на условностях, принятых химиками на протяжении нескольких столетий. Алхимики Средневековья и эпохи Возрождения использовали иконические символы для изображения различных элементов (рис. 1). Они также связывали определенные цвета с каждым элементом на основе его физических свойств, хотя эти цвета никогда не появлялись в печати из-за редкости цветной печати до конца 19 века.й век.
К середине 1800-х годов стало известно, что атомы связываются друг с другом, образуя молекулы. В 1865 году химик Август Хоффман выступил с пятничной вечерней речью в лондонском Королевском институте на тему «Объединение сил атомов». Чтобы продемонстрировать химическую связь атомов, он просверлил отверстия в шарах для крокета и соединил их металлическими трубками (рис. 2). Его выбор был ограничен доступными цветами крокетных шаров, и он полагался на многие из тех же цветовых соглашений, которые были приняты веками ранее:
- Углерод окрашен в черный цвет, потому что это цвет древесного угля.

- Кислород красный, потому что он необходим для горения.
- Азот синий, потому что это самый распространенный элемент в атмосфере Земли, а небо кажется голубым.
- Водород имеет белый цвет, потому что образует бесцветный газ.
- Хлор имеет зеленый цвет, потому что образует зеленоватый газ.
- Сера имеет желтый цвет, потому что это ее цвет в минеральной форме.
- Фосфор оранжевый, потому что он светится оранжевым в пламени.
- Железо красновато-коричневого цвета, потому что оно ржавеет.
С небольшими вариациями эти цветовые соглашения используются и сегодня. В 1950-х годах Роберт Кори и Линус Полинг из Калифорнийского технологического института разработали набор деревянных моделей атомов для построения молекулярных моделей. Вскоре после этого наборы пластиковых молекулярных моделей стали популярны на уроках химии. Модели Кори-Полинга были усовершенствованы Уолтером Колтуном из Национального института здравоохранения в начале 19 века. 60-е годы. Цветовая схема, используемая в этих моделях, теперь известна как «CPK» в честь Кори, Полинга и Колтуна. Полный список цветов CPK элементов см. в Википедии: http://en.wikipedia.org/wiki/CPK_coloring
60-е годы. Цветовая схема, используемая в этих моделях, теперь известна как «CPK» в честь Кори, Полинга и Колтуна. Полный список цветов CPK элементов см. в Википедии: http://en.wikipedia.org/wiki/CPK_coloring
Размеры атомов
атом. Строго говоря, он представляет собой «половину расстояния между двумя эквивалентными несвязанными атомами в их наиболее стабильном расположении». Иными словами, это самое близкое расстояние, на которое могут сблизиться два несвязанных атома, прежде чем они начнут отталкивать друг друга. Однако большинство людей думают об этом просто как о размере самой внешней электронной оболочки атома.
Многие молекулярные модели используют радиус Ван-дер-Ваальса, чтобы различать относительные размеры различных атомов и давать представление об общем размере и форме молекулы. На рис. 3 показаны радиусы Ван-дер-Ваальса элементов, расположенных в упрощенной периодической таблице (на нем также показаны цвета CPK обычных элементов). Обратите внимание, что водород и гелий в верхнем ряду крошечные, потому что у них всего одна оболочка с одним или двумя электронами. По мере того, как вы спускаетесь по таблице сверху вниз, элементы в каждой строке становятся больше, потому что каждая строка добавляет дополнительную электронную оболочку. По мере продвижения по таблице слева направо элементы в каждом столбце становятся несколько меньше. Это удивительно, потому что каждый столбец представляет добавление еще одного протона к ядру и еще одного электрона к самой внешней оболочке. Вы можете предположить, что это сделало бы элементы с правой стороны больше, чем с левой. Однако атомы справа меньше, потому что существует большее притяжение между положительно заряженным ядром и отрицательно заряженными электронами, заставляющее электроны вращаться ближе к ядру.
По мере того, как вы спускаетесь по таблице сверху вниз, элементы в каждой строке становятся больше, потому что каждая строка добавляет дополнительную электронную оболочку. По мере продвижения по таблице слева направо элементы в каждом столбце становятся несколько меньше. Это удивительно, потому что каждый столбец представляет добавление еще одного протона к ядру и еще одного электрона к самой внешней оболочке. Вы можете предположить, что это сделало бы элементы с правой стороны больше, чем с левой. Однако атомы справа меньше, потому что существует большее притяжение между положительно заряженным ядром и отрицательно заряженными электронами, заставляющее электроны вращаться ближе к ядру.
Представление молекул
В 1858 году английский химик Арчибальд Купер опубликовал первый рисунок молекулы, используя простые линии для соединения атомов друг с другом. В том же году Фридрих Август Кекуле фон Страдониц опубликовал то, что позже стало известно как теория валентности, согласно которой атомы каждого элемента образуют определенное количество связей (например, углерод всегда образует четыре связи, азот — три, кислород — две, так далее. ). В 1874 году Якобус ван ’т Хофф, бывший студент лаборатории Кекуле, продемонстрировал, что эти связи располагаются в определенных геометрических конфигурациях. Например, четыре связи атома углерода расположены в тетраэдре на расстоянии 109° друг от друга..5° углы. С тех пор стало возможным создавать трехмерные модели простых молекул, просто зная, какие атомы связаны друг с другом. (В более крупных молекулах, таких как белки и ДНК, действуют другие силы, и форму нельзя предсказать только по углам связи.)
). В 1874 году Якобус ван ’т Хофф, бывший студент лаборатории Кекуле, продемонстрировал, что эти связи располагаются в определенных геометрических конфигурациях. Например, четыре связи атома углерода расположены в тетраэдре на расстоянии 109° друг от друга..5° углы. С тех пор стало возможным создавать трехмерные модели простых молекул, просто зная, какие атомы связаны друг с другом. (В более крупных молекулах, таких как белки и ДНК, действуют другие силы, и форму нельзя предсказать только по углам связи.)
Программное обеспечение для молекулярной визуализации теперь упрощает создание точных 3D-моделей любой молекулы. На рис. 4 показаны три распространенных метода представления простых молекул. Палочная модель показывает только связи и не показывает сами атомы. Шарико-стержневая модель добавляет маленькие сферы, представляющие центр каждого атома. Модель заполнения пространства использует намного большие сферы, пропорциональные по размеру ван-дер-ваальсову радиусу каждого атома. Модели заполнения пространства были впервые разработаны Робертом Кори и Линусом Полингом, а затем усовершенствованы Уолтером Колтуном. Следовательно, аббревиатура «CPK» может использоваться для описания либо стиля заполнения пространства, либо цветовой схемы, используемой для отдельных атомов. На рис. 5 показан дополнительный пример моделей заполнения пространства.
Следовательно, аббревиатура «CPK» может использоваться для описания либо стиля заполнения пространства, либо цветовой схемы, используемой для отдельных атомов. На рис. 5 показан дополнительный пример моделей заполнения пространства.
Меня часто спрашивают, какой тип представления лучше всего подходит для иллюстрации молекул. Как это часто бывает в научной иллюстрации, ответ зависит от того, что вы пытаетесь показать. Многие иллюстраторы предпочитают модели, заполняющие пространство, потому что большие сферы позволяют создавать драматические световые эффекты (см. рис. 6). Однако следует понимать, что эти эффекты чисто художественные, поскольку атом не способен создавать блик, основную тень или отражения. Что еще более важно, заполняющая пространство модель полностью скрывает связи между атомами, делая практически невозможным определить, какой атом с каким связан. Таким образом, заполняющие пространство модели идеально подходят для редакционных иллюстраций, но могут не подходить для учебника по химии, где необходимо увидеть связи между атомами.
Иллюстрация ДНК
В связи с тем, что молекула ДНК имеет центральное значение для биологии, к научным иллюстраторам часто обращаются для иллюстрации молекулы ДНК. К сожалению, многие иллюстрации ДНК, даже в учебниках по естествознанию и на научных сайтах, неточны. Фактически, были созданы целые веб-сайты для каталогизации неточных изображений ДНК, например, Зал славы ДНК левшей: http://users.fred.net/tds//leftdna/
Все нуклеиновые кислоты, включая ДНК и РНК образованы из субъединиц, называемых нуклеотидами. Каждый нуклеотид состоит из основания, молекулы сахара и фосфата. В ДНК основаниями являются аденин, гуанин, цитозин и тимин (см. рис. 7). Урацил заменяет тимин в РНК. После добавления молекулы сахара каждое основание называется нуклеозидом (рис. 8). В РНК сахар называется рибозой. В ДНК это дезоксирибоза. Добавление фосфата к 5′-углероду молекулы сахара создает нуклеотид.
Нуклеотиды, в свою очередь, соединяются в длинные нити, создавая связи между фосфатом и 3′-углеродом молекулы сахара (рис. 9). В ДНК две комплементарные цепи соединены водородными связями между основаниями. Две нити напоминают лестницу, где фосфаты сахара образуют стороны лестницы (или «позвоночник»), а основания обращены внутрь, образуя «ступени» лестницы.
9). В ДНК две комплементарные цепи соединены водородными связями между основаниями. Две нити напоминают лестницу, где фосфаты сахара образуют стороны лестницы (или «позвоночник»), а основания обращены внутрь, образуя «ступени» лестницы.
«Лестница» ДНК скручивается, образуя характерную двойную спираль. Рисунок 10 представляет собой схематическое, но очень точное представление двойной спирали, показывающее точные измерения (в ангстремах) каждой части спирали. Обратите внимание, что на каждый полный оборот (длину волны или «шаг») спирали приходится десять пар оснований. Из-за того, как лестница изгибается, она образует отдельные большие и малые канавки. Большая канавка ровно в два раза шире малой канавки.
Неспособность различить две бороздки является одной из наиболее распространенных ошибок при изображении ДНК. Однако, безусловно, наиболее распространенной ошибкой является обращение хиральности спирали. Каждая спираль может быть описана как левая или правая (рис. 11). По неизвестным причинам в природе гораздо чаще встречаются правозакрученные спирали, а также рукотворные спирали типа резьбы на винте. Хотя левосторонняя форма ДНК существует (зДНК), природная форма, обнаруженная в ядре живых организмов (называемая бДНК), всегда представляет собой правостороннюю спираль.
Хотя левосторонняя форма ДНК существует (зДНК), природная форма, обнаруженная в ядре живых организмов (называемая бДНК), всегда представляет собой правостороннюю спираль.
Лево- и правосторонние спирали являются зеркальным отражением друг друга. Поскольку программное обеспечение для компьютерной графики позволяет так легко переворачивать изображение, очень легко непреднамеренно изменить хиральность спирали ДНК. Я подозреваю, что одна из причин распространенности изображений ДНК левшей заключается в том, что арт-директора невольно переворачивают искусство по чисто эстетическим причинам, не понимая, что это влияет на научное содержание иллюстрации.
ДНК может быть представлена любым из описанных выше стилей (палочка, шарик и палочка, заполнение пространства). На рис. 12 показана заполняющая пространство модель с цветами CPK, воспроизведенными в Cinema 4D. Кроме того, ДНК часто представляют в виде лестницы (как на рис. 10) или с помощью значков для представления нуклеотидных оснований. На рис. 12 показана 3D-модель ДНК с такими значками. На этом рисунке также используется цветовая схема для различения оснований. Хотя эта система не так универсальна, как цветовая схема CPK, она используется некоторым программным обеспечением для молекулярной визуализации и онлайн-базой данных нуклеиновых кислот. Система использует первую букву каждого базового имени для определения его цвета:
На рис. 12 показана 3D-модель ДНК с такими значками. На этом рисунке также используется цветовая схема для различения оснований. Хотя эта система не так универсальна, как цветовая схема CPK, она используется некоторым программным обеспечением для молекулярной визуализации и онлайн-базой данных нуклеиновых кислот. Система использует первую букву каждого базового имени для определения его цвета:
- Аденин (А) = лазурный (синий)
- Гуанин (G) = зеленый
- Цитозин (C) = малиновый (красный)
- Тимин (T) = «Tweety Bird» (желтый)
- Урацил (U) = умбра (коричневая)
Об авторе
Джим Перкинс — профессор медицинской иллюстрации Колледжа медицинских наук и технологий Рочестерского технологического института. Профессор Перкинс является сертифицированным медицинским иллюстратором (CMI), членом Ассоциации медицинских иллюстраторов (FAMI) и в настоящее время является президентом Vesalius Trust по визуальным коммуникациям в области медицинских наук. Эксперт в визуальной коммуникации сложной биомедицинской тематики, особенно в области клеточной биологии, молекулярной биологии, физиологии и патологии, он проиллюстрировал более 40 медицинских учебников и выступает консультантом крупных медицинских издательств.
Эксперт в визуальной коммуникации сложной биомедицинской тематики, особенно в области клеточной биологии, молекулярной биологии, физиологии и патологии, он проиллюстрировал более 40 медицинских учебников и выступает консультантом крупных медицинских издательств.
Профессор Перкинс получил степень бакалавра биологии и геологии в Корнельском университете (1985 г.) и изучал палеонтологию и анатомию в Техасском университете в Остине и Университете Рочестера, защитив докторскую диссертацию (1989 г.). Он получил степень магистра в области медицинской иллюстрации в RIT (1992 г.) и после работы в области медицинских публикаций и медицинских юридических выставок в 1998 г. поступил на факультет RIT. был широко доступен, для обозначения различных элементов использовались простые геометрические символы. от Далтона, Джеймс. 1808. Новая теория химической философии. 1=водород, 2=азот, 3=углерод, 4=кислород.
> Рис. 2. Химик Август Хоффман использовал цветные шары для крокета и металлические трубы, чтобы продемонстрировать соединение атомов в молекулы. От Гофмана, август. 1865. О комбинирующей способности атомов. Труды Королевского института 4: 401-430.
От Гофмана, август. 1865. О комбинирующей способности атомов. Труды Королевского института 4: 401-430.
> Рис. 3 – Упрощенная периодическая таблица, показывающая радиусы Ван-дер-Ваальса и цвета CPK элементов. Обратите внимание, что атомы увеличиваются сверху вниз и немного уменьшаются слева направо.
Рис. 4 – Витамин А (полностью транс-ретинол) изображен с использованием трех распространенных представлений. Галочковая модель подчеркивает связи и скрывает сами атомы. Шарико-стержневая модель добавляет маленькие сферы для представления атомов. Модель заполнения пространства или CPK представляет каждый атом его ван-дер-ваальсовым радиусом.
Рис. 5 — Заполняющая пространство модель химиотерапевтического препарата гемцитабин, использованная на обложке онкологического журнала.
> Рис. 6 — Сгенерированные компьютером изображения доксорубицина (вверху) и витамина Е для лечения рака. В этих иллюстрациях используется значительная доля художественной лицензии, поскольку атомы меньше длины волны видимого света и, следовательно, не могут иметь бликов. , тени или отражения.
, тени или отражения.
> Рис. 7 – Основания аденин, гуанин, цитозин, тимин и урацил.
> Рис. 8 – После добавления молекулы сахара каждое основание называется нуклеозидом. Сахар может быть либо рибозой (в РНК), либо дезоксирибозой (в ДНК). Добавление фосфатной группы создает пять нуклеотидов.
> Рис. 9 – Связь между фосфатом одного нуклеотида и сахаром другого может привести к образованию длинных нитей нуклеотидов. В ДНК две нити соединены водородными связями, соединяющими основания. Группы сахара и фосфата образуют основу или стороны «лестницы», в то время как основания обращены друг к другу, образуя ступени.
> Рис. 10 – Схематическое изображение бДНК с точными пропорциями и характеристиками. на каждый полный оборот (шаг) спирали приходится 10 пар оснований. двойная спираль имеет отдельные большие и малые бороздки, причем большая бороздка в два раза шире малой.
> Рис. 11 – Сравнение левых и правых спиралей. В левосторонней спирали, если вы обхватываете спираль пальцами левой руки, она «двигается» в направлении большого пальца левой руки. В правой спирали оберните пальцы правой руки вокруг спирали, и она движется в направлении правого большого пальца. Эти спирали являются зеркальными отражениями друг друга, поэтому переворачивание такого изображения в компьютере меняет направление спирали.
11 – Сравнение левых и правых спиралей. В левосторонней спирали, если вы обхватываете спираль пальцами левой руки, она «двигается» в направлении большого пальца левой руки. В правой спирали оберните пальцы правой руки вокруг спирали, и она движется в направлении правого большого пальца. Эти спирали являются зеркальными отражениями друг друга, поэтому переворачивание такого изображения в компьютере меняет направление спирали.
> Рис. 12— Трехмерная объемная модель бДНК, визуализированная в Cinema 4D.
Рис. 13 — Схематическое представление ДНК с использованием цветовой схемы нуклеотидов, созданной с помощью программного обеспечения для молекулярной визуализации UCSF Chimera .
Примечания
Эта статья опубликована в Journal of Natural Science Illustration за 2011 год.
Читать об атомах и молекулах
ЧТО ТАКОЕ АТОМНАЯ СТРУКТУРА?
Все атомы состоят из трех меньших частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны собираются вместе в центре атома, а электроны вращаются далеко от него. Атомы могут быть объединены в молекулы посредством химических реакций.
Протоны и нейтроны собираются вместе в центре атома, а электроны вращаются далеко от него. Атомы могут быть объединены в молекулы посредством химических реакций.
Чтобы лучше понять атомную структуру…
ЧТО ТАКОЕ АТОМНАЯ СТРУКТУРА?.
Все атомы состоят из трех меньших частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны собираются вместе в центре атома, а электроны вращаются далеко от него. Атомы могут быть объединены в молекулы посредством химических реакций.
Чтобы лучше понять строение атома…
ДАВАЙТЕ РАЗЪЯСНИМ!
Структура атома
Центр атома, часто называемый ядром, состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны заряда не имеют. Вокруг атома с огромной скоростью и на большом расстоянии вращаются электроны. Электроны являются наименьшими из трех субатомных частиц и имеют отрицательный заряд. Между атомным ядром и электронами находится пустое пространство.
Структура атома Центр атома, часто называемый ядром, состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны заряда не имеют. Вокруг атома с огромной скоростью и на большом расстоянии вращаются электроны. Электроны являются наименьшими из трех субатомных частиц и имеют отрицательный заряд. Между атомным ядром и электронами находится пустое пространство.
Микроскопические атомы
Атомы чрезвычайно малы. Атомы более чем в 10 000 раз меньше ширины волоса. Даже школьный микроскоп не смог бы увидеть что-либо близкое к размеру атома. Специализированный микроскоп, называемый сканирующим туннельным микроскопом, был разработан в XIX в.80-е могут показать нам отдельные атомы. Если бы вы посмотрели на железные опилки в сканирующий туннельный микроскоп, вы бы увидели крошечные шарики из атомов железа.
Микроскопические атомы Атомы чрезвычайно малы. Атомы более чем в 10 000 раз меньше ширины волоса. Даже школьный микроскоп не смог бы увидеть что-либо близкое к размеру атома. Специализированный микроскоп, называемый сканирующим туннельным микроскопом, разработанный в 1980-х годах, может показать нам отдельные атомы. Если бы вы посмотрели на железные опилки в сканирующий туннельный микроскоп, вы бы увидели крошечные шарики из атомов железа.
Специализированный микроскоп, называемый сканирующим туннельным микроскопом, разработанный в 1980-х годах, может показать нам отдельные атомы. Если бы вы посмотрели на железные опилки в сканирующий туннельный микроскоп, вы бы увидели крошечные шарики из атомов железа.
Идентификация атомов
Каждый элемент имеет определенное количество протонов, нейтронов и электронов. Мы можем найти эту информацию, обратившись к Периодической таблице элементов. Например, элемент номер 6 в таблице — это углерод, который обозначен буквой C. Периодическая таблица также показывает нам, что атомный номер углерода равен 6. Атомный номер говорит нам, сколько протонов и электронов присутствует в элементе. Из этой информации мы знаем, что углерод имеет 6 протонов и 6 электронов.
Идентификация атомов Каждый элемент имеет определенное количество протонов, нейтронов и электронов. Мы можем найти эту информацию, обратившись к Периодической таблице элементов. Например, элемент номер 6 в таблице — это углерод, который обозначен буквой C. Периодическая таблица также показывает нам, что атомный номер углерода равен 6. Атомный номер говорит нам, сколько протонов и электронов присутствует в элементе. Из этой информации мы знаем, что углерод имеет 6 протонов и 6 электронов.
Периодическая таблица также показывает нам, что атомный номер углерода равен 6. Атомный номер говорит нам, сколько протонов и электронов присутствует в элементе. Из этой информации мы знаем, что углерод имеет 6 протонов и 6 электронов.
Элементы и молекулы
Элементы могут быть объединены в молекулы. Вода, например, это h3O. Это означает, что 2 атома водорода связаны с одним атомом кислорода. Существуют бесконечные комбинации атомов, из которых состоит вся материя. Некоторые из них просты, как вода, а другие гораздо сложнее, например, гемоглобин. Молекула сахарозы, известная вам как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Сахарозу можно записать в сокращенной записи следующим образом: C12h32O11.
Элементы и молекулы Элементы могут быть объединены в молекулы. Вода, например, это h3O. Это означает, что 2 атома водорода связаны с одним атомом кислорода. Существуют бесконечные комбинации атомов, из которых состоит вся материя. Некоторые из них просты, как вода, а другие гораздо сложнее, например, гемоглобин. Молекула сахарозы, известная вам как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Сахарозу можно записать в сокращенной записи следующим образом: C12h32O11.
Некоторые из них просты, как вода, а другие гораздо сложнее, например, гемоглобин. Молекула сахарозы, известная вам как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Сахарозу можно записать в сокращенной записи следующим образом: C12h32O11.
Карьера в области химии
Основная область науки, изучающая атомы и молекулы, называется химия. Химики используют свои знания об атомах для создания молекул, которые можно использовать в качестве лекарств. Чтобы создавать молекулы, им нужно знать, какие из них реагируют вместе и в каком порядке. Другие ученые, такие как биохимики, изучают огромные молекулы, созданные природой, такие как белки и ДНК. Производство молекул инсулина для лечения диабета стало возможным благодаря работе биохимиков.
Карьера в области химии Основная область науки, изучающая атомы и молекулы, называется химия. Химики используют свои знания об атомах для создания молекул, которые можно использовать в качестве лекарств. Чтобы создавать молекулы, им нужно знать, какие из них реагируют вместе и в каком порядке. Другие ученые, такие как биохимики, изучают огромные молекулы, созданные природой, такие как белки и ДНК. Производство молекул инсулина для лечения диабета стало возможным благодаря работе биохимиков.
Чтобы создавать молекулы, им нужно знать, какие из них реагируют вместе и в каком порядке. Другие ученые, такие как биохимики, изучают огромные молекулы, созданные природой, такие как белки и ДНК. Производство молекул инсулина для лечения диабета стало возможным благодаря работе биохимиков.
СЛОВАРЬ АТОМОВ И МОЛЕКУЛ
Материя
Все, что имеет массу и занимает пространство.
Атом
Основная единица элемента. Вся материя состоит из атомов.
Протон
Положительно заряженная субатомная частица, расположенная в центре атома.
Нейтрон
Субатомная частица без заряда, расположенная в центре атома.
Электрон
Субатомная частица атома, которая имеет отрицательный заряд и очень быстро вращается вокруг ядра.
Ядро
Протоны и нейтроны собираются вместе в центре атома, образуя ядро атома.
Периодическая таблица
Таблица всех известных элементов, на которые ученые ссылаются при работе с атомами или молекулами.
Молекула
Два или более атомов, связанных вместе.
АТОМЫ И МОЛЕКУЛЫ ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ
Что бы вы увидели, если бы посмотрели на железные опилки в сканирующий туннельный микроскоп?
Поскольку сканирующий туннельный микроскоп настолько мощный, вы увидите крошечные сферы, которые представляют собой атомы железа (наименьшая возможная единица железа).
Опишите различные частицы, из которых состоит атом.
Атом состоит из 3 частиц; протоны, нейтроны и электроны. Протоны заряжены положительно и расположены в центре атома. Нейтроны не заряжены и также находятся в центре атома. Электроны вращаются вокруг центра очень быстро и заряжены отрицательно.
Какие примеры элементов можно привести? Откуда вы знаете, что это элементы?
Некоторыми примерами элементов являются золото, железо, медь и углерод. Все в периодической таблице является элементом. Все элементы представляют собой чистое вещество, состоящее только из атомов одного типа.
Как можно использовать Периодическую таблицу элементов, чтобы найти информацию о конкретных элементах?
Периодическая таблица элементов показывает названия и сокращения для каждого элемента. Он также сообщает вам, сколько протонов, нейтронов и электронов имеет каждый атом. Атомный номер каждого элемента соответствует количеству протонов и электронов в элементе. Более подробно о периодической таблице мы расскажем в нашем уроке под названием «Периодическая таблица».
Как ученые пришли к выводу, что большая часть атома представляет собой пустое пространство?
В 1908 году Эрнест Резерфорд провел эксперимент, в котором он пропускал лучи излучения через золотую фольгу, состоящую из атомов золота. Большая часть излучения прошла прямо через золотую фольгу, и лишь малая часть лучей отразилась обратно. Это поддерживает модель атома, в которой большая часть массы находится в центре, а электроны вращаются далеко от него.
Какие профессии доступны для людей, которые хотят изучать атомы и молекулы?
Ученые в области медицины регулярно используют молекулы для разработки новых лекарств для борьбы с болезнями. В частности, ученые-биомедики могут воспроизвести встречающиеся в природе молекулы, чтобы помочь людям с дефицитом.
В частности, ученые-биомедики могут воспроизвести встречающиеся в природе молекулы, чтобы помочь людям с дефицитом.
Вернуться к Уроку
BES Видение Материи в Атомной и …
От наноструктуры к макроскопическим свойствам
Как всего 118 строительных блоков — все известные элементы периодической таблицы — соединяются, чтобы создать каждое вещество на Земле? Как эти атомы создают материалы с, казалось бы, бесконечным разнообразием форм и свойств — мягкими и твердыми, пластичными и хрупкими, магнитными и немагнитными, изолирующими и сверхпроводящими, живыми и неживыми? Почему одни и те же атомы, соединенные по-разному, дают совершенно разные материалы? Выяснение этого является ключом к созданию материалов и технологий, необходимых для процветания в эпоху природных ресурсов, экологических и финансовых ограничений. Этот квест начинается с визуализации атомов (ядер и электронов) и их взаимодействий.
Скачать изображение с высоким разрешением
Изучение материи на уровне атомов и молекул требует измерения структур размером в миллиардные доли метра (нанометры) или меньше. В этой наносфере устанавливаются фундаментальные свойства материалов. Температура плавления, магнитные свойства, емкость заряда и даже цвет определяются расположением атомов и молекул. Способность понимать, проектировать и контролировать эти свойства приведет к созданию нового мира материалов и технологий для многочисленных областей применения. Типичный размер атома составляет десятые доли нанометра. Диапазон длин волн видимого света составляет несколько сотен нанометров, что слишком велико для обнаружения атомов. Чтобы увидеть материю на уровне атомов, нужны инструменты, которые могут измерять структуры, которые в тысячу раз меньше, чем те, которые можно обнаружить с помощью самых современных световых микроскопов. Таким образом, чтобы охарактеризовать структуры с атомарными деталями, мы должны использовать такие зонды, как рентгеновские лучи, электроны и нейтроны, которые по крайней мере столь же малы, как и исследуемые атомы.
В этой наносфере устанавливаются фундаментальные свойства материалов. Температура плавления, магнитные свойства, емкость заряда и даже цвет определяются расположением атомов и молекул. Способность понимать, проектировать и контролировать эти свойства приведет к созданию нового мира материалов и технологий для многочисленных областей применения. Типичный размер атома составляет десятые доли нанометра. Диапазон длин волн видимого света составляет несколько сотен нанометров, что слишком велико для обнаружения атомов. Чтобы увидеть материю на уровне атомов, нужны инструменты, которые могут измерять структуры, которые в тысячу раз меньше, чем те, которые можно обнаружить с помощью самых современных световых микроскопов. Таким образом, чтобы охарактеризовать структуры с атомарными деталями, мы должны использовать такие зонды, как рентгеновские лучи, электроны и нейтроны, которые по крайней мере столь же малы, как и исследуемые атомы.
Фундаментальный принцип исследования материалов заключается в том, что структура определяет функцию. Усовершенствованные инструменты, основанные на рентгеновских, электронных и нейтронных пучках, позволяют получать атомарные данные о металлических сплавах, пластмассах, ферментах, сверхпроводниках, углеродных наноструктурах и материалах при экстремальных температурах, давлении и нагрузках. Модели и симуляции, созданные с помощью суперкомпьютеров, помогают исследователям проверять теории и изучать динамику материалов в наномасштабе с большей реалистичностью. Усовершенствуя наше понимание структуры материала атом за атомом, мы открываем ошеломляющий набор возможностей для разработки новых материалов с желаемыми свойствами и функциями.
Усовершенствованные инструменты, основанные на рентгеновских, электронных и нейтронных пучках, позволяют получать атомарные данные о металлических сплавах, пластмассах, ферментах, сверхпроводниках, углеродных наноструктурах и материалах при экстремальных температурах, давлении и нагрузках. Модели и симуляции, созданные с помощью суперкомпьютеров, помогают исследователям проверять теории и изучать динамику материалов в наномасштабе с большей реалистичностью. Усовершенствуя наше понимание структуры материала атом за атомом, мы открываем ошеломляющий набор возможностей для разработки новых материалов с желаемыми свойствами и функциями.
| Передняя сторона | Задняя сторона |
|---|---|
Высокое разрешение .JPG | Высокое разрешение . |
11 x 17 дюймов Салфетка: 300 DPI PDF с высоким разрешением | 120 точек на дюйм, низкое разрешение, PDF | |
Углерод: многоликий шестой элемент
Казалось бы, незначительные изменения в положениях и связях между атомами могут привести к получению материалов с очень разными физическими свойствами. Например, атомы углерода могут собираться в различные структурные формы — алмаз, графит и графен, углеродные нанотрубки и фуллерены (бакиболы) — каждая из которых обладает уникальными характеристиками. Используя секреты природы для построения материи атом за атомом, исследователи в области нанотехнологий могут проектировать и создавать наноструктуры нового поколения, которые превосходят существующие материалы.
В алмазе каждый атом углерода образует прочные ковалентные связи с четырьмя другими атомами углерода, что делает его самым твердым известным природным веществом. В графите множество слоев углерода толщиной в один атом удерживаются вместе слабыми силами притяжения, которые делают его мягким и хрупким. Сферические фуллерены, цилиндрические углеродные нанотрубки и листы графена — это наноматериалы с исключительными механическими, химическими и электронными свойствами для передовых приложений в энергетике, медицине, вычислительной технике и других технологиях.
В графите множество слоев углерода толщиной в один атом удерживаются вместе слабыми силами притяжения, которые делают его мягким и хрупким. Сферические фуллерены, цилиндрические углеродные нанотрубки и листы графена — это наноматериалы с исключительными механическими, химическими и электронными свойствами для передовых приложений в энергетике, медицине, вычислительной технике и других технологиях.
Рентгенология
Фотосистема I представляет собой сложный мембранный молекулярный механизм в клетках растений, который преобразует солнечный свет в энергию во время фотосинтеза. Мембранные белки представляют собой важный класс макромолекул, на который нацелены промышленные биотехнологические компании и разработчики лекарств.
В течение почти века рентгеновские лучи были нашим основным средством для определения идентичности и положения атомов в кристаллизованных образцах, начиная от относительно простых металлических материалов и заканчивая очень сложными биологическими молекулами, такими как белки и ДНК. Из-за своей короткой длины волны жесткое рентгеновское излучение очень полезно для исследования атомной структуры. Сегодняшнее синхротронное излучение и лазерные источники света на свободных электронах производят рентгеновские лучи настолько интенсивно, что они значительно затмили исторические методы и породили множество новых способов проведения экспериментов.
Из-за своей короткой длины волны жесткое рентгеновское излучение очень полезно для исследования атомной структуры. Сегодняшнее синхротронное излучение и лазерные источники света на свободных электронах производят рентгеновские лучи настолько интенсивно, что они значительно затмили исторические методы и породили множество новых способов проведения экспериментов.
Кристаллизованные образцы материалов анализируются путем пропускания через них рентгеновских лучей. Рентгеновские лучи рассеиваются атомами кристалла, создавая дифракционное изображение на детекторах. Это изображение предоставляет уникальную информацию об идентичности атомов и структуре кристалла. Большие гибкие мембранные белки, такие как фотосистема I в растительных клетках, образуют очень маленькие кристаллы, которые имеют тенденцию быть несовершенными и слабо дифрагирующими. Интенсивные источники рентгеновского излучения оказались бесценными для определения структуры и свойств таких макромолекул.
Электронная наука
Мощная электронная микроскопия обеспечивает визуализацию в реальном времени атомов, перемещающихся по краю отверстия, пробитого листом графена, слоем атомов углерода толщиной в один атом. Понимание стабильного расположения кромок может ускорить разработку передовых электронных устройств на основе выдающихся электронных и структурных свойств углерода. Выступы — это адсорбированные молекулы.
Понимание стабильного расположения кромок может ускорить разработку передовых электронных устройств на основе выдающихся электронных и структурных свойств углерода. Выступы — это адсорбированные молекулы.
Из-за сильного взаимодействия между отрицательно заряженными электронами и заряженными частицами вещества электронные пучки могут предоставить важную структурную и химическую информацию, лежащую в основе поведения различных материалов. Современные электронные микроскопы могут производить настолько яркие электронные пучки, что их можно использовать для визуализации субнанометровых явлений, таких как электронная структура и связь атомов. Понимая, как атом за атомом собираются материалы в стабильные конфигурации, исследователи получают новое представление об улучшении существующих материалов и синтезе новых наноструктур с превосходной прочностью, долговечностью, коррозионной стойкостью и другими желаемыми свойствами.
Нейтронная наука
Спектр рассеяния нейтронов показывает зависящие от времени и пространства магнитные флуктуации в сверхпроводнике. Наблюдаемая четырехкратная симметрия спиновых возбуждений свидетельствует об общем происхождении сверхпроводящих состояний в разных классах материалов.
Наблюдаемая четырехкратная симметрия спиновых возбуждений свидетельствует об общем происхождении сверхпроводящих состояний в разных классах материалов.
В отличие от рентгеновских лучей и пучков электронов, которые взаимодействуют с электронами материала, нейтроны не имеют заряда и поэтому слабо взаимодействуют с электрически заряженными частицами в материалах. В результате нейтроны служат неразрушающими зондами, которые могут рассеиваться непосредственно на атомных ядрах глубоко внутри материала. Нейтронные пучки исследовательских реакторов или ускорителей также могут действовать как магниты, дифрагировать как волны и приводить в движение частицы внутри атома или молекулы. Анализ нейтронов, рассеянных образцом, позволяет получить структурную и магнитную информацию. Ученые всего мира используют нейтроны для изучения расположения, движения и взаимодействия атомов в материалах. Являясь важным дополнением к рентгеновской дифракции и электронной микроскопии, нейтронные исследования дают ценную информацию, которую невозможно получить с помощью других методов.
Знания атомного масштаба способствуют открытиям и инновациям для реальных решений
Более прочные строительные материалы
Цемент — широко используемый строительный материал, но мало что известно о наноразмерных свойствах этого «клея», скрепляющего бетонные конструкции. Исследования рассеяния рентгеновских лучей подтвердили высокоупорядоченное расположение кристаллов размером 3,5 нанометра в гидрате силиката кальция, наиболее важном связующем в цементе. Имея более подробную структурную информацию, можно было бы создавать более прочные рецептуры цемента, потенциально экономя сотни миллионов долларов на затратах на техническое обслуживание и ремонт инфраструктуры.
Высокотемпературные сверхпроводники
Около 10% всей вырабатываемой сегодня электроэнергии теряется из-за сопротивления при передаче. Сверхпроводники — это материалы, которые проводят электричество без сопротивления, но обычные типы требуют сверхнизких температур (близких к абсолютному нулю). Исследования сверхпроводников по рассеянию нейтронов дают ключевое представление о том, как магнитные свойства и расположение атомов влияют на сверхпроводимость при более высоких температурах. Раскрытие механизмов достижения высокотемпературной сверхпроводимости может привести к гораздо более эффективным системам производства, доставки и использования электроэнергии.
Исследования сверхпроводников по рассеянию нейтронов дают ключевое представление о том, как магнитные свойства и расположение атомов влияют на сверхпроводимость при более высоких температурах. Раскрытие механизмов достижения высокотемпературной сверхпроводимости может привести к гораздо более эффективным системам производства, доставки и использования электроэнергии.
Потенциальный противораковый агент
С помощью рентгеновского луча была решена трехмерная структура вируса долины Сенека-001, вируса, который атакует определенные раковые клетки, не повреждая нормальные клетки человека. Этот вирус обладает специфичностью уничтожения рака в 10 000 раз выше, чем традиционные химиотерапевтические препараты в исследованиях на животных. Изучая, как вирус использует свою неровную лоскутную белковую оболочку для взаимодействия с рецепторами раковых клеток, разработчики лекарств надеются разработать противораковые вирусы для многих различных типов раковых клеток.
Аккумуляторы энергии следующего поколения
Наше технологичное общество требует усовершенствования аккумуляторов для мобильных телефонов, ноутбуков и электромобилей, а также совершенствования систем, надежно хранящих и доставляющих электроэнергию от солнца, ветра и других источников. Новые методы микроскопии и рассеяния нейтронов отслеживают поток ионов через материалы для хранения энергии и выявляют деградацию, возникающую в результате зарядки и разрядки. Понимание этих нанопроцессов поможет разработать устройства следующего поколения, которые смогут хранить больше энергии, быстрее заряжаться и работать в течение тысяч циклов заряда-разряда.
Новые методы микроскопии и рассеяния нейтронов отслеживают поток ионов через материалы для хранения энергии и выявляют деградацию, возникающую в результате зарядки и разрядки. Понимание этих нанопроцессов поможет разработать устройства следующего поколения, которые смогут хранить больше энергии, быстрее заряжаться и работать в течение тысяч циклов заряда-разряда.
Средства пользователя: инструменты для наблюдения за атомами
Авторы изображений. Фуллерен и нанотрубка: Laguna Design/Photo Researchers. Углеродная наноструктура, спектр рассеяния нейтронов: Окриджская национальная лаборатория. Фотосистема I: Банк данных о белках (www.rcsb.org) PDB ID 3PCQ, визуализированный с использованием iMol. Отверстие в листе атомов углерода: Национальная лаборатория Лоуренса в Беркли. Мост, линия электропередач и электронные устройства: iStockphoto. Вирус долины Сенека: Аргоннская национальная лаборатория.
Атомы, молекулы и ионы
Вступительное эссе
Ангстрем (Å) не является единицей СИ, но является полезной единицей длины. Это одна десятимиллиардная часть метра, или 10 −10 м. Почему это полезная единица? Размер элементарных частиц, из которых состоит вся материя, составляет около 10 90 130 -10 90 131 м, или около 1 Å. Это делает ангстрем естественной, хотя и не одобренной, единицей для описания этих частиц.
Это одна десятимиллиардная часть метра, или 10 −10 м. Почему это полезная единица? Размер элементарных частиц, из которых состоит вся материя, составляет около 10 90 130 -10 90 131 м, или около 1 Å. Это делает ангстрем естественной, хотя и не одобренной, единицей для описания этих частиц.
Ангстрем назван в честь Андерса Йонаса Ангстрема, шведского физика девятнадцатого века. Исследование Ангстрема касалось света, излучаемого светящимися объектами, в том числе солнцем. Ангстрем изучил яркость различных цветов света, излучаемого солнцем, и смог сделать вывод, что солнце состоит из тех же видов материи, что и на Земле. Более того, теперь мы знаем, что вся материя во Вселенной похожа на материю, существующую на нашей планете.
Основным строительным элементом всей материи является атом. Любопытно, что идея атомов была впервые предложена в пятом веке до нашей эры, когда греческие философы Левкипп и Демокрит предположили их существование в удивительно современной форме. Однако их идеи так и не получили распространения среди современников, и только в начале 1800-х годов накопились доказательства, заставившие ученых пересмотреть эту идею. Сегодня концепция атома занимает центральное место в изучении материи.
Однако их идеи так и не получили распространения среди современников, и только в начале 1800-х годов накопились доказательства, заставившие ученых пересмотреть эту идею. Сегодня концепция атома занимает центральное место в изучении материи.
3.1 Атомная теория
Цели обучения
- Изложить современную атомную теорию.
- Узнайте, как устроены атомы.
Наименьшая часть элемента, сохраняющая идентичность этого элемента, называется атомом. Наименьшая часть элемента, сохраняющая идентичность этого элемента. Отдельные атомы чрезвычайно малы. Потребовалось бы около пятидесяти миллионов атомов подряд, чтобы построить линию длиной 1 см. Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией Представление о том, что атомы играют фундаментальную роль в химии. , впервые высказанное английским ученым Джоном Дальтоном в 1808 г. Оно состоит из трех частей:
, впервые высказанное английским ученым Джоном Дальтоном в 1808 г. Оно состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов различны.
- Атомы соединяются в целочисленных отношениях, образуя соединения.
Эти понятия составляют основу химии.
Хотя слово атом происходит от греческого слова, означающего «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами . Первой открытой частью был электрон — крошечная субатомная частица с отрицательным зарядом, крошечная субатомная частица с отрицательным зарядом. Он часто представляется как e − с правым верхним индексом, показывающим отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон — субатомная частица с положительным зарядом. представляет собой более массивную (но все же крошечную) субатомную частицу с положительным зарядом, представленную как p + . Нейтрон — субатомная частица без заряда. субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов. Таблица 3.1 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Нейтрон — субатомная частица без заряда. субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов. Таблица 3.1 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Таблица 3.1 Свойства трех субатомных частиц
| Имя | Символ | Масса (прибл.; кг) | Зарядка |
|---|---|---|---|
| Протон | р + | 1,6 × 10 −27 | 1+ |
| Нейтрон | н, н 0 | 1,6 × 10 −27 | нет |
| Электрон | е − | 9,1 × 10 −31 | 1− |
Как эти частицы организованы в атомы? Они расположены не случайно. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на модель ядра. Модель атома, в которой протоны и нейтроны находятся в центральном ядре, а электроны вращаются вокруг ядра. атома. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром. Центр атома, содержащий протоны и нейтроны. атома (множественное число ядер ). Электроны находятся вне ядра и проводят время, вращаясь в пространстве вокруг ядра. (См. рис. 3.1 «Структура атома».)
Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на модель ядра. Модель атома, в которой протоны и нейтроны находятся в центральном ядре, а электроны вращаются вокруг ядра. атома. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром. Центр атома, содержащий протоны и нейтроны. атома (множественное число ядер ). Электроны находятся вне ядра и проводят время, вращаясь в пространстве вокруг ядра. (См. рис. 3.1 «Структура атома».)
Рис. 3.1 Структура атома
В центре атома находятся протоны и нейтроны, составляющие ядро, а электроны вращаются вокруг ядра.
Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны. Чем отличаются атомы разных элементов? Фундаментальная характеристика, присущая всем атомам одного и того же элемента, — это число протонов . Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют 26 протонов в ядре. Это число протонов настолько важно для идентификации атома, что его называют атомным номером. Число протонов в атоме. элемента. Так, водород имеет атомный номер 1, а железо имеет атомный номер 26. Каждый элемент имеет свой характерный атомный номер.
Это число протонов настолько важно для идентификации атома, что его называют атомным номером. Число протонов в атоме. элемента. Так, водород имеет атомный номер 1, а железо имеет атомный номер 26. Каждый элемент имеет свой характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента (т. е. атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами. Атомы одного и того же элемента, имеющие разное число нейтронов. Большинство встречающихся в природе элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в ядре один протон. Однако небольшое число (около одного на миллион) атомов водорода имеют в своих ядрах протон и нейтрон. Этот особый изотоп водорода называется дейтерием. Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием. Сумма числа протонов и нейтронов в ядре называется массовым числом Сумма числа протонов и нейтронов в ядре. изотопа.
изотопа.
Нейтральные атомы имеют такое же количество электронов, как и протонов, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
Пример 1
- Ядра наиболее распространенных атомов углерода содержат шесть протонов и шесть нейтронов. Каковы атомный номер и массовое число этих атомов углерода?
- Изотоп урана имеет атомный номер 92 и массовое число 235. Каково число протонов и нейтронов в ядре этого атома?
Решение
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6. Если в ядре также шесть нейтронов, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана равен 92, то это число протонов в ядре. Поскольку массовое число равно 235, количество нейтронов в ядре равно 235 − 92, или 143.
Проверь себя
Количество протонов в ядре атома олова равно 50, а количество нейтронов в ядре равно 68. Каковы атомный номер и массовое число этого изотопа?
Каковы атомный номер и массовое число этого изотопа?
Ответ
Атомный номер = 50, массовое число = 118
Говоря об атоме, мы просто используем название элемента: термин натрий относится как к элементу, так и к атому натрия. Но постоянно использовать имена элементов может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ Одно- или двухбуквенное представление имени элемента. представляет собой одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если присутствует) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента. (Символ натрия, Na, происходит от его латинского названия, natrium .) В таблице 3.2 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вы должны запомнить символы в Таблице 3.2 «Названия и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Вы должны запомнить символы в Таблице 3.2 «Названия и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Таблица 3.2 Названия и символы общих элементов
| Наименование элемента | Символ | Имя элемента | Символ | |
|---|---|---|---|---|
| Алюминий | Ал | Меркурий | рт.ст. | |
| Аргон | Ар | Молибден | Пн | |
| Мышьяк | Как | Неон | Не | |
| Барий | Ба | Никель | Ni | |
| Бериллий | Быть | Азот | Н | |
| Висмут | Би | Кислород | О | |
| Бор | Б | Палладий | ПД | |
| Бром | Бр | Фосфор | П | |
| Кальций | Са | Платина | Пт | |
| Углерод | С | Калий | К | |
| Хлор | Кл | Радий | Ра | |
| Хром | Кр | Радон | Р-н | |
| Кобальт | Со | Рубидий | руб | |
| Медь | Медь | Скандий | Sc | |
| Фтор | Ф | Селен | Se | |
| Галлий | Га | Кремний | Си | |
| Германий | Гэ | Серебро | Аг | |
| Золото | Аи | Натрий | Нет | |
| Гелий | Он | Стронций | Старший | |
| Водород | Х | Сера | С | |
| Йод | я | Тантал | Та | |
| Иридий | Ир | Олово | Сн | |
| Железо | Фе | Титан | Ти | |
| Криптон | Вольфрам | Вт | ||
| Свинец | Пб | Уран | У | |
| Литий | Ли | Ксенон | Хе | |
| Магний | Мг | Цинк | Цинк | |
| Марганец | Мн | Цирконий | Зр |
Элементы сгруппированы в специальную таблицу, называемую периодической таблицей. Таблица всех элементов. Простая периодическая таблица показана на рис. 3.2 «Простая периодическая таблица», а более подробная таблица представлена в главе 17. «Приложение: Периодическая таблица элементов». Элементы периодической таблицы перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы будем рассматривать организацию электронов в атомах (см. главу 8 «Электронная структура»). Одно непосредственное использование периодической таблицы помогает нам идентифицировать металлы и неметаллы. Неметаллы находятся в верхнем правом углу периодической таблицы, по одну сторону жирной линии, разделяющей правую часть диаграммы. Все остальные элементы являются металлами.
Элементы периодической таблицы перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы будем рассматривать организацию электронов в атомах (см. главу 8 «Электронная структура»). Одно непосредственное использование периодической таблицы помогает нам идентифицировать металлы и неметаллы. Неметаллы находятся в верхнем правом углу периодической таблицы, по одну сторону жирной линии, разделяющей правую часть диаграммы. Все остальные элементы являются металлами.
Рисунок 3.2. Простая периодическая таблица
Существует простой способ представления изотопов с помощью символов атомов. Мы используем конструкцию
XZA
, где X — символ элемента, A — массовое число, а Z — атомный номер. Таким образом, для изотопа углерода, имеющего 6 протонов и 6 нейтронов, используется символ
C612
, где C — символ элемента, 6 — атомный номер, а 12 — массовое число.
Пример 2
- Какой символ используется для изотопа урана с атомным номером 92 и массовым числом 235?
- Сколько протонов и нейтронов в F2656e?
Раствор
- Символ этого изотопа U
- Этот атом железа имеет 26 протонов и 56 − 26 = 30 нейтронов.
.
Проверь себя
Сколько протонов в N1123a?
Ответ
11 протонов
Также принято указывать массовое число после названия элемента для обозначения конкретного изотопа. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана со 146 нейтронами.
Ключевые выводы
- Химия основана на современной атомной теории, согласно которой вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.
- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.

- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомарным символом.
- Периодическая таблица — это таблица, в которой собраны все элементы.
Упражнения
Перечислите три утверждения, из которых состоит современная атомная теория.
Объясните, как состоят атомы.
Что больше, протон или электрон?
Что больше, нейтрон или электрон?
Каковы заряды каждой из трех субатомных частиц?
Где находится большая часть массы атома?
Нарисуйте схему атома бора, в ядре которого содержится пять протонов и шесть нейтронов.

Нарисуйте схему атома гелия, в ядре которого есть два протона и два нейтрона.
Определить атомный номер . Какой атомный номер у атома бора?
Какой атомный номер гелия?
Дайте определение изотопа и приведите пример.
В чем разница между дейтерием и тритием?
Какая пара представляет изотопы?
- h34e и h33e
- F2656e и M2556n
- S1428i и P1531
Какая пара представляет изотопы?
- C2040a и K1940
- F2656e и F2658e
- U
и U
Дайте полные символы каждого атома, включая атомный номер и массовое число.
- атом кислорода с 8 протонами и 8 нейтронами
- атом калия с 19 протонами и 20 нейтронами
- атом лития с 3 протонами и 4 нейтронами
Укажите полные символы каждого атома, включая атомный номер и массовое число.
- атом магния с 12 протонами и 12 нейтронами
- атом магния с 12 протонами и 13 нейтронами
- атом ксенона с 54 протонами и 77 нейтронами
Америций-241 — изотоп, используемый в детекторах дыма. Каков полный символ этого изотопа?
Углерод-14 — это изотоп, используемый для проведения тестов радиоактивного датирования ранее жившего материала. Каков полный символ этого изотопа?
Каков полный символ этого изотопа?
Дайте атомарные символы для каждого элемента.
- натрий
- аргон
- азот
- радон
Дайте атомарные символы для каждого элемента.
- серебро
- золото
- ртуть
- йод
Дайте имя элемента.
- Си
- Мн
- Фе
- Кр
Дайте имя элемента.
- Ф
- Кл
- Бр
- я
Ответы
Вся материя состоит из атомов; атомы одного и того же элемента одинаковы, а атомы разных элементов различны; атомы соединяются в целочисленных отношениях, образуя соединения.
Протон больше электрона.
протон: 1+; электрон: 1-; нейтрон: 0
Атомный номер — это число протонов в ядре.
 Бор имеет атомный номер пять.
Бор имеет атомный номер пять.Изотопы — это атомы одного и того же элемента, но с разным числом нейтронов. h21 и h22 являются примерами.
- изотопы
- не изотопы
- не изотопы
- О816
- К1939
- Л37и
А
- Нет данных
- Ар
- Н
- Р-н
- кремний
- марганец
- железо
- хром
м
3.
 2 Молекулы и химическая номенклатура
2 Молекулы и химическая номенклатура
Цели обучения
- Дать определение молекуле .
- Назовите простые молекулы по их формулам.
- Определите формулу молекулы по ее названию.
Есть много веществ, которые существуют в виде двух или более атомов, связанных друг с другом настолько прочно, что ведут себя как одна частица. Эти многоатомные комбинации называются молекулами. Наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества. Молекула — это наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества. В некоторых отношениях молекула похожа на атом. Однако молекула состоит из более чем одного атома.
Некоторые элементы существуют в природе в виде молекул. Например, водород и кислород существуют в виде двухатомных молекул. Другие элементы также существуют в природе в виде двухатомных молекул. Молекула состоит всего из двух атомов. (см. Таблицу 3.3 «Элементы, существующие в виде двухатомных молекул»). Как и в случае любой молекулы, эти элементы помечены молекулярной формулой — формальным списком того, что и сколько атомов входит в молекулу, формальным списком того, что и сколько атомов входит в молекулу. (Иногда только слово формула , и его значение выводится из контекста.) Например, молекулярная формула элементарного водорода H 2 , где H является символом водорода, а нижний индекс 2 подразумевает, что есть два атома этого элемента в молекула. Аналогичные формулы имеют и другие двухатомные элементы: O 2 , N 2 и так далее. Другие элементы существуют в виде молекул, например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем считать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле присутствует только один атом, если справа от символа элемента нет числового нижнего индекса.
(см. Таблицу 3.3 «Элементы, существующие в виде двухатомных молекул»). Как и в случае любой молекулы, эти элементы помечены молекулярной формулой — формальным списком того, что и сколько атомов входит в молекулу, формальным списком того, что и сколько атомов входит в молекулу. (Иногда только слово формула , и его значение выводится из контекста.) Например, молекулярная формула элементарного водорода H 2 , где H является символом водорода, а нижний индекс 2 подразумевает, что есть два атома этого элемента в молекула. Аналогичные формулы имеют и другие двухатомные элементы: O 2 , N 2 и так далее. Другие элементы существуют в виде молекул, например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем считать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле присутствует только один атом, если справа от символа элемента нет числового нижнего индекса.
Таблица 3.3 Элементы, существующие в виде двухатомных молекул
| Водород |
| Кислород |
| Азот |
| Фтор |
| Хлор |
| Бром |
| Йод |
Рисунок 3.3 Молекулярное искусство молекул S 8 и P 4
Если каждый зеленый шарик представляет атом серы, то диаграмма слева представляет молекулу S 8 . Молекула справа показывает, что существует одна форма элементарного фосфора в виде четырехатомной молекулы.
На рис. 3.3 «Молекулярное искусство S» показаны два примера того, как мы будем представлять молекулы в этом тексте. Атом представлен маленьким шариком или сферой, что обычно указывает, где в молекуле находится ядро. Цилиндрическая линия, соединяющая шары, представляет собой связь между атомами, которые делают этот набор атомов молекулой. Эта связь называется химической связью. Связь между двумя атомами в молекуле. В главе 9 «Химические связи» мы исследуем происхождение химических связей. В этой книге вы встретите и другие примеры такого представления молекул в виде «шара и цилиндра».
Эта связь называется химической связью. Связь между двумя атомами в молекуле. В главе 9 «Химические связи» мы исследуем происхождение химических связей. В этой книге вы встретите и другие примеры такого представления молекул в виде «шара и цилиндра».
Многие соединения существуют в виде молекул. В частности, когда неметаллы соединяются с другими неметаллами, соединение обычно существует в виде молекул. (Соединения между металлом и неметаллом различны и будут рассмотрены в разделе 3.4 «Ионы и ионные соединения».) молекулы с различными химическими и физическими свойствами. Как мы их различаем?
Ответом является очень специфическая система именования соединений, называемая химической номенклатурой. Очень специфическая система именования соединений, в которой уникальные вещества получают уникальные имена. Следуя правилам номенклатуры, каждое соединение имеет свое собственное уникальное имя, и каждое название относится к одному и только одному соединению. Здесь мы начнем с относительно простых молекул, содержащих только два элемента, так называемых бинарных соединений :
- Определите элементы в молекуле по ее формуле.
 Вот почему вам необходимо знать названия и символы элементов в Таблице 3.2 «Названия и символы общих элементов».
Вот почему вам необходимо знать названия и символы элементов в Таблице 3.2 «Названия и символы общих элементов». Начинайте имя с имени первого элемента. Если в молекулярной формуле имеется более одного атома этого элемента, используйте числовой префикс для обозначения количества атомов, как указано в Таблице 3.4 «Числовые префиксы, используемые в названиях молекулярных соединений». Не используйте префикс моно-, если имеется только один атом первого элемента.
Таблица 3.4 Числовые префиксы, используемые в названиях молекулярных соединений
Количество атомов элемента Префикс 1 моно- 2 ди- 3 три- 4 тетра- 5 пента- 6 шестигранник 7 гепта- 8 окта- 9 нона- 10 дека- Назовите второй элемент, используя три части:
- числовой префикс, указывающий количество атомов второго элемента, плюс
- основа названия элемента (например, ox для кислорода, chlor для хлора и т.
 д.), плюс
д.), плюс - суффикс -ide .
- Соедините два слова, оставив между ними пробел.
Давайте посмотрим, как эти шаги работают для молекулы, молекулярная формула которой SO 2 , которая имеет один атом серы и два атома кислорода — это завершает шаг 1. Согласно шагу 2, мы начинаем с названия первого элемента — сера. Помните, мы не используем префикс mono- для первого элемента. Теперь для шага 3 мы объединяем числовой префикс ди- (см. Таблицу 3.4 «Цифровые префиксы, используемые в названиях молекулярных соединений») с основой ox- и суффиксом -ide , чтобы получить двуокись . Объединив эти два слова, мы получили уникальное название этого соединения — двуокись серы.
К чему все эти проблемы? Существует еще одно распространенное соединение, состоящее из серы и кислорода, молекулярная формула которого SO 3 , поэтому соединения необходимо различать. SO 3 содержит три атома кислорода, поэтому это другое соединение с другими химическими и физическими свойствами. Система химической номенклатуры рассчитана на дать этому соединению собственное уникальное имя . Название его, если пройти все этапы, триоксид серы. Разные соединения имеют разные названия.
SO 3 содержит три атома кислорода, поэтому это другое соединение с другими химическими и физическими свойствами. Система химической номенклатуры рассчитана на дать этому соединению собственное уникальное имя . Название его, если пройти все этапы, триоксид серы. Разные соединения имеют разные названия.
В некоторых случаях, когда префикс заканчивается на на или на , а имя элемента начинается на на , мы опускаем на или на в префиксе. Таким образом, мы видим монооксид или пентаоксид , а не монооксид или пентаоксид в названиях молекул.
Отличительной чертой этой системы является то, что она работает в обоих направлениях. По названию соединения можно определить его молекулярную формулу. Просто перечислите символы элемента с числовым нижним индексом, если имеется более одного атома этого элемента, в порядке имени (мы не используем нижний индекс 1, если присутствует только один атом элемента; 1 подразумевается) . Из названия трихлорид азота вы сможете получить NCl 3 в качестве формулы этой молекулы. От имени пятиокись дифосфора , вы должны получить формулу P 2 O 5 (обратите внимание на числовой префикс перед первым элементом, указывающий на наличие в формуле более одного атома фосфора).
Из названия трихлорид азота вы сможете получить NCl 3 в качестве формулы этой молекулы. От имени пятиокись дифосфора , вы должны получить формулу P 2 O 5 (обратите внимание на числовой префикс перед первым элементом, указывающий на наличие в формуле более одного атома фосфора).
Пример 3
Назовите каждую молекулу.
- ПФ 3
- СО
- Se 2 Br 2
Solution
- Молекула с одним атомом фосфора и тремя атомами фтора называется трифторидом фосфора.
- Соединение с одним атомом углерода и одним атомом кислорода правильно называется монооксидом углерода, а не монооксидом углерода.
- Есть два атома каждого элемента, селена и брома. По правилам имя собственное здесь диселениума дибромид .
Проверь себя
Назови каждую молекулу.
- СФ 4
- П 2 С 5
Ответы
- тетрафторид серы
- пентасульфид дифосфора
Пример 4
Приведите формулу каждой молекулы.
- четыреххлористый углерод
- диоксид кремния
- тетранитрид трикремния
Раствор
- Название четыреххлористый углерод подразумевает один атом углерода и четыре атома хлора, поэтому формула CCl 4 .
- Название диоксид кремния подразумевает один атом кремния и два атома кислорода, поэтому формула SiO 2 .
- У нас есть имя с числовыми префиксами в обоих элементах. Три- означает три, а тетра- означает четыре, поэтому формула этого соединения Si 3 N 4 .
Проверь себя
Назовите формулу каждой молекулы.
- дифторид серы
- пентабромид йода
Ответы
- S 2 F 2
- ИБр 5
Некоторые простые молекулы имеют общие названия, которые мы используем как часть формальной системы химической номенклатуры. Например, H 2 O получает название вода , а не монооксид дигидрогена . NH 3 называется аммиак , а CH 4 называется метан . Время от времени мы будем видеть другие молекулы, имеющие общие названия; мы будем указывать на них по мере их возникновения.
Ключевые выводы
- Молекулы — это группы атомов, которые ведут себя как единое целое.
- Некоторые элементы существуют в виде молекул: водород, кислород, сера и так далее.
- Существуют правила, которые могут выражать уникальное имя для любой заданной молекулы и уникальную формулу для любого заданного имени.

Упражнения
Какие из этих формул представляют собой молекулы? Укажите, сколько атомов содержится в каждой молекуле.
- Fe
- ПКл 3
- Р 4
- Ар
Какие из этих формул представляют собой молекулы? Укажите, сколько атомов содержится в каждой молекуле.
- I 2
- Он
- Н 2 О
- Ал
В чем разница между CO и Co?
В чем разница между H 2 O и H 2 O 2 (перекись водорода)?
Назовите соответствующую формулу для каждого двухатомного элемента.

В 1986 году, когда комета Галлея в последний раз прошла мимо Земли, астрономы обнаружили в своих телескопах присутствие S 2 . Почему серу не считают двухатомным элементом?
Какая основа слова фтор используется в названиях молекул? CF 4 является одним из примеров.
Какая основа селена используется в названиях молекул? Например, SiSe 2 .
Дайте правильное название каждой молекуле.
- ПФ 3
- TeCl 2
- Н 2 О 3
Дайте правильное название каждой молекуле.
- НЕТ
- ЧС 2
- Как 2 O 3
Дайте правильное название каждой молекуле.

- XEF 2
- О 2 Ж 2
- СФ 6
Дайте правильное название каждой молекуле.
- П 4 О 10
- В 2 О 3
- П 2 С 3
Дайте правильное название каждой молекуле.
- Н 2 О
- Н 2 О 4
- Н 2 О 5
Дайте правильное название каждой молекуле.
- СеО 2
- Класс 2 О
- XEF 6
Дайте правильную формулу для каждого имени.

- пентоксид диазота
- трикарбид тетрабора
- пентахлорид фосфора
Дайте правильную формулу для каждого имени.
- трийодид азота
- трисульфид димышьяка
- трихлорид йода
Дайте правильную формулу для каждого имени.
- дихлорид кислорода
- диазот трисульфид
- тетрафторид ксенона
Дайте правильную формулу для каждого имени.
- диоксид хлора
- дибромид селена
- триоксид диазота
Дайте правильную формулу для каждого имени.

- трифторид йода
- триоксид ксенона
- декафторид дисеры
Дайте правильную формулу для каждого имени.
- двуокись германия
- сероуглерод
- диселения дибромид
Ответы
- не молекула
- молекула; всего четыре атома
- молекула; всего четыре атома
- не молекула
CO представляет собой соединение углерода и кислорода; Co — элемент кобальт.

H 2 , O 2 , N 2 , F 2 , Cl 2 , Br 2 , I 2
фтор-
- трифторид фосфора
- дихлорид теллура
- триоксид диазота
- ксенон дифторид
- дифторид кислорода
- гексафторид серы
- монооксид диазота
- тетраоксид диазота
- пятиокись азота
- Н 2 О 5
- Б 4 С 3
- ПКл 5
- О 2 Класс 2
- Н 2 Ю 3
- ХеФ 4
- ЕСЛИ 3
- ХеО 3
- С 2 Ж 10
3.
 3 Массы атомов и молекул
3 Массы атомов и молекул
Цель обучения
- Выразите массы атомов и молекул.
Поскольку материя определяется как все, что имеет массу и занимает пространство, неудивительно, что атомы и молекулы имеют массу.
Однако отдельные атомы и молекулы очень малы, и массы отдельных атомов и молекул также очень малы. Для макроскопических объектов мы используем такие единицы, как граммы и килограммы, чтобы указать их массы, но эти единицы слишком велики, чтобы удобно описать массы отдельных атомов и молекул. Нужен другой масштаб.
Атомная единица массы Одна двенадцатая часть массы атома углерода-12. (u; в некоторых текстах используется аму, но этот старый стиль больше не принимается) определяется как одна двенадцатая массы атома углерода-12, изотопа углерода, который имеет шесть протонов и шесть нейтронов в своем ядре. По этому масштабу масса протона равна 1,00728 ед, масса нейтрона равна 1,00866 ед, а масса электрона равна 0,000549 ед. Не будет большой ошибки, если вы оцените массу атома, просто подсчитав общее количество протонов и нейтронов в ядре (т. е. определите его массовое число), и проигнорируете электроны. Таким образом, масса углерода-12 составляет около 12 ед, масса кислорода-16 — около 16 ед, а масса урана-238 — около 238 ед. Более точные массы можно найти в научных справочниках — например, точная масса урана-238 составляет 238,050788 ед., так что вы можете видеть, что мы не за горами, используя целочисленное значение в качестве массы атома.
е. определите его массовое число), и проигнорируете электроны. Таким образом, масса углерода-12 составляет около 12 ед, масса кислорода-16 — около 16 ед, а масса урана-238 — около 238 ед. Более точные массы можно найти в научных справочниках — например, точная масса урана-238 составляет 238,050788 ед., так что вы можете видеть, что мы не за горами, используя целочисленное значение в качестве массы атома.
Какова масса элемента? Это несколько сложнее, поскольку большинство элементов существуют в виде смеси изотопов, каждый из которых имеет свою массу. Таким образом, хотя легко говорить о массе атома, говоря о массе элемента, мы должны учитывать смесь изотопов.
Атомная масса Средневзвешенная масса изотопов, составляющих элемент. элемента – это средневзвешенная масса изотопов, из которых состоит элемент. Что мы подразумеваем под средневзвешенным значением? Итак, рассмотрим элемент, состоящий из двух изотопов, 50% с массой 10 ед и 50 % с массой 11 ед. Средневзвешенное значение находится путем умножения каждой массы на ее дробную часть (в десятичной форме) и последующего сложения всех произведений. Сумма является средневзвешенной и служит формальной атомной массой элемента. В этом примере у нас есть следующее:
Сумма является средневзвешенной и служит формальной атомной массой элемента. В этом примере у нас есть следующее:
| 0,50 × 10 ед. | = 5,0 х |
| 0,50 × 11 ед. | = 5,5 ед. |
| Сумма | = 10,5 u = атомная масса нашего элемента |
Обратите внимание, что ни один атом в нашем гипотетическом элементе не имеет массы 10,5 ед; скорее, это средняя масса атомов, взвешенная по проценту их появления.
Этот пример подобен реальному элементу. Бор существует в виде примерно 20% бора-10 (пять протонов и пять нейтронов в ядрах) и около 80% бора-11 (пять протонов и шесть нейтронов в ядрах). Атомная масса бора рассчитывается аналогично тому, что мы сделали для нашего гипотетического примера, но в других процентах:

Таким образом, мы используем 10,8 ед. для атомной массы бора.
Практически все элементы существуют в виде смесей изотопов, поэтому атомные массы могут значительно отличаться от целых чисел. В таблице 3.5 «Выбранные атомные массы некоторых элементов» перечислены атомные массы некоторых элементов; более обширная таблица находится в главе 17 «Приложение: Периодическая таблица элементов». Атомные массы в Таблице 3.5 «Выбранные атомные массы некоторых элементов» приведены с точностью до трех знаков после запятой, где это возможно, но в большинстве случаев требуется только один или два знака после запятой. Обратите внимание, что многие атомные массы, особенно большие, не очень близки к целым числам. Отчасти это результат увеличения количества изотопов по мере увеличения размера атомов. (Рекордное число — 10 изотопов олова.)
(Рекордное число — 10 изотопов олова.)
Таблица 3.5 Избранные атомные массы некоторых элементов
| Название элемента | Атомная масса (ед.) | Имя элемента | Атомная масса (ед.) | |
|---|---|---|---|---|
| Алюминий | 26,981 | Молибден | 95,94 | |
| Аргон | 39,948 | Неон | 20.180 | |
| Мышьяк | 74,922 | Никель | 58.693 | |
| Барий | 137. 327 327 | Азот | 14.007 | |
| Бериллий | 9.012 | Кислород | 15,999 | |
| Висмут | 208,980 | Палладий | 106,42 | |
| Бор | 10.811 | Фосфор | 30,974 | |
| Бром | 79.904 | Платина | 195.084 | |
| Кальций | 40.078 | Калий | 39.098 | |
| Углерод | 12.011 | Радий | нет данных | |
| Хлор | 35. 453 453 | Радон | нет данных | |
| Кобальт | 58,933 | Рубидий | 85.468 | |
| Медь | 63,546 | Скандий | 44,956 | |
| Фтор | 18,998 | Селен | 78,96 | |
| Галлий | 69.723 | Кремний | 28.086 | |
| Германий | 72,64 | Серебро | 107,868 | |
| Золото | 196,967 | Натрий | 22,990 | |
| Гелий | 4. 003 003 | Стронций | 87,62 | |
| Водород | 1.008 | Сера | 32.065 | |
| Йод | 126,904 | Тантал | 180,948 | |
| Иридий | 192,217 | Олово | 118.710 | |
| Железо | 55.845 | Титан | 47.867 | |
| Криптон | 83,798 | Вольфрам | 183,84 | |
| Свинец | 207,2 | Уран | 238. 029 029 | |
| Литий | 6.941 | Ксенон | 131,293 | |
| Магний | 24.305 | Цинк | 65.409 | |
| Марганец | 54,938 | Цирконий | 91.224 | |
| Меркурий | 200,59 | Молибден | 95,94 | |
| Примечание: Атомная масса дается с точностью до трех знаков после запятой, если она известна. | ||||
Теперь, когда мы понимаем, что атомы имеют массу, легко распространить это понятие на массу молекул. Молекулярная массаСумма масс атомов в молекуле. это сумма масс атомов в молекуле. Это может показаться тривиальным расширением концепции, но важно подсчитать количество атомов каждого типа в молекулярной формуле. Кроме того, хотя каждый атом в молекуле представляет собой определенный изотоп, мы используем средневзвешенное значение, или атомную массу, для каждого атома в молекуле.
это сумма масс атомов в молекуле. Это может показаться тривиальным расширением концепции, но важно подсчитать количество атомов каждого типа в молекулярной формуле. Кроме того, хотя каждый атом в молекуле представляет собой определенный изотоп, мы используем средневзвешенное значение, или атомную массу, для каждого атома в молекуле.
Например, если бы мы должны были определить молекулярную массу трехокиси азота, N 2 O 3 , нам нужно было бы дважды добавить атомную массу азота к атомной массе кислорода три раза:
| 2 массы N = 2 × 14,007 u | = 28,014 и |
| 3 массы O = 3 × 15,999 u | = 47,997 ед. |
| Всего | = 76,011 u = молекулярная масса N 2 O 3 |
Мы были бы недалеко, если бы ограничили наши числа одним или даже двумя знаками после запятой.
Пример 5
Какова молекулярная масса каждого вещества?
- NBr 3
- С 2 Н 6
Раствор
Добавить одну атомную массу азота и три атомные массы брома:
Масса 1 Н = 14,007 х 3 массы Br = 3 × 79,904 u = 239,712 ед. Итого = 253,719 u = молекулярная масса NBr 3 Добавьте две атомные массы углерода и шесть атомных масс водорода:
Массы 2 C = 2 × 12,011 u = 24,022 х 6 H масс = 6 × 1,008 u = 6,048 ед. 
Всего = 30,070 u = молекулярная масса C 2 H 6 Соединение C 2 H 6 также имеет общее название — этан.
Проверь себя
Какова молекулярная масса каждого вещества?
- СО 2
- ПФ 3
Ответы
- 64,063 u
- 87,968 у
Химия повсюду: гексафторид серы
20 марта 1995 г. японская террористическая группировка «Аум Синрикё» (санскрит «Высшая истина») выпустила зарин в токийском метро; двенадцать человек погибли, тысячи получили ранения (часть (а) на прилагаемом рисунке). Зарин (молекулярная формула C 4 H 10 FPO 2 ) представляет собой нервно-паралитический токсин, который был впервые синтезирован в 1938 году. Он считается одним из самых смертоносных известных токсинов, который, по оценкам, примерно в 500 раз сильнее цианида. Ученые и инженеры, изучающие распространение химического оружия, такого как зарин (да, такие ученые есть), хотели бы иметь менее опасный химикат, причем нетоксичный, чтобы они сами не подвергались риску.
Он считается одним из самых смертоносных известных токсинов, который, по оценкам, примерно в 500 раз сильнее цианида. Ученые и инженеры, изучающие распространение химического оружия, такого как зарин (да, такие ученые есть), хотели бы иметь менее опасный химикат, причем нетоксичный, чтобы они сами не подвергались риску.
Гексафторид серы используется в качестве модельного соединения для зарина. SF 6 (молекулярная модель которого показана в части (b) на прилагаемом рисунке) имеет такую же молекулярную массу (около 146 ед.), что и зарин (около 140 ед.), поэтому он имеет аналогичные физические свойства в паровой фазе. . Гексафторид серы также очень легко точно обнаружить даже при низких уровнях, и он не является нормальной частью атмосферы, поэтому вероятность загрязнения из природных источников невелика. Следовательно, SF 6 также используется в качестве воздушного трассера для систем вентиляции в зданиях. Он нетоксичен и очень химически инертен, поэтому работникам не нужно принимать специальные меры предосторожности, кроме наблюдения за удушьем.
Гексафторид серы имеет еще одно интересное применение: искрогаситель в высоковольтном электрооборудовании. Газ высокого давления SF 6 используется вместо старых масел, которые могут содержать загрязняющие вещества, неблагоприятные для окружающей среды (часть (c) на прилагаемом рисунке).
Ключевые выводы
- Атомная единица массы (u) — это единица, описывающая массы отдельных атомов и молекул.
- Атомная масса – это средневзвешенное значение масс всех изотопов элемента.
- Молекулярная масса – это сумма масс атомов в молекуле.
Упражнения
Определить атомную единицу массы . Какова его аббревиатура?
Определить атомную массу . Какова его единица?
Оцените массу каждого изотопа в целых числах.
- водород-1
- водород-3
- железо-56
Оцените массу каждого изотопа в целых числах.

- фосфор-31
- углерод-14
- америций-241
Определите атомную массу каждого элемента, зная изотопный состав.
- литий, который на 92,4 % состоит из лития-7 (масса 7,016 ед.) и на 7,60 % лития-6 (масса 6,015 ед.)
- кислорода, что составляет 99,76% кислорода-16 (масса 15,995 ед.), 0,038% кислорода-17 (масса 16,999 ед.), и 0,205% кислорода-18 (масса 17,999 ед.)
Определите атомную массу каждого элемента, зная изотопный состав.
- неон, который на 90,48 % состоит из неона-20 (масса 19,992 ед.), 0,27 % неона-21 (масса 20,994 ед.) и 9,25 % неона-22 (масса 21,991 ед.)
- уран, который на 99,27% состоит из урана-238 (масса 238,051 ед.
 ) и 0,720% урана-235 (масса 235,044 ед.)
) и 0,720% урана-235 (масса 235,044 ед.)
Насколько далеко был бы ваш ответ от упражнения 5а, если бы вы использовали целые числа массы для отдельных изотопов лития?
Насколько далеко был бы ваш ответ от Упражнения 6b, если бы вы использовали целые числа массы для отдельных изотопов урана?
- Какова атомная масса атома кислорода?
- Какова молекулярная масса кислорода в его элементарной форме?
- Какова атомная масса брома?
- Какова молекулярная масса брома в его элементарной форме?
Определите массу каждого вещества.

- Ф 2
- СО
- СО 2
Определите массу каждого вещества.
- Кр
- КрФ 4
- ПФ 5
Определите массу каждого вещества.
- Нет данных
- В 2 О 3
- S 2 Класс 2
Определите массу каждого вещества.
- ИБр 3
- Н 2 О 5
- ККл 4
Определите массу каждого вещества.

- ГеО 2
- ЕСЛИ 3
- XEF 6
Определите массу каждого вещества.
- НЕТ
- Н 2 О 4
- Са
Ответы
Единица атомной массы определяется как одна двенадцатая часть массы атома углерода-12. Его аббревиатура — у.
- 1
- 3
- 56
- 6.
 940 и
940 и - 16.000 ед.
- 6.
Мы получили бы 6,924 ед.
- 15,999 и
- 31,998 у
- 37,996 и
- 28.010 и
- 44.009 и
- 22.990 и
- 69,619 и
- 135.
 036 у
036 у
- 104,64 и
- 183,898 и
- 245,281 и
3.4 Ионы и ионные соединения
Цели обучения
- Знать, как образуются ионы.
- Узнайте характерные заряды ионов.
- Придумайте правильную формулу ионного соединения.
- Придумайте собственное имя для ионного соединения.
До сих пор мы обсуждали элементы и соединения, которые электрически нейтральны. У них такое же количество электронов, как и у протонов, поэтому отрицательные заряды электронов уравновешиваются положительными зарядами протонов. Тем не менее, это не всегда так. Электроны могут переходить от одного атома к другому; когда они это делают, образуются виды с общим электрическим зарядом. Такие частицы называются ионами. Вещества с общим электрическим зарядом. Вещества с общим положительным зарядом называются катионами. Вещества с общим положительным зарядом называются ионами. Вещества с общим отрицательным зарядом называются анионами. образуется только тогда, когда электронов переходят от одного атома к другому; протон никогда не переходит от одного атома к другому. Соединения, образованные из положительных и отрицательных ионов, называются ионными соединениями. Соединение, образованное из положительных и отрицательных ионов.
Электроны могут переходить от одного атома к другому; когда они это делают, образуются виды с общим электрическим зарядом. Такие частицы называются ионами. Вещества с общим электрическим зарядом. Вещества с общим положительным зарядом называются катионами. Вещества с общим положительным зарядом называются ионами. Вещества с общим отрицательным зарядом называются анионами. образуется только тогда, когда электронов переходят от одного атома к другому; протон никогда не переходит от одного атома к другому. Соединения, образованные из положительных и отрицательных ионов, называются ионными соединениями. Соединение, образованное из положительных и отрицательных ионов.
Отдельные атомы могут приобретать или терять электроны. Когда они это сделают, они станут одноатомными ионами. Когда атомы приобретают или теряют электроны, они обычно приобретают или теряют характерное число электронов и, таким образом, приобретают характерный общий заряд. В таблице 3.6 «Одноатомные ионы с различными зарядами» перечислены некоторые распространенные ионы с точки зрения того, сколько электронов они теряют (образуя катионы) или приобретают (образуя анионы). В таблице 3.6 «Одноатомные ионы с различными зарядами» следует отметить несколько особенностей ионов. Во-первых, каждый элемент, образующий катионы, является металлом, за исключением одного (водорода), а каждый элемент, образующий анионы, является неметаллом. На самом деле это одно из химических свойств металлов и неметаллов: металлы склонны образовывать катионы, а неметаллы склонны образовывать анионы. Во-вторых, большинство атомов образуют ионы с одним характеристическим зарядом. Когда атомы натрия образуют ионы, они всегда образуют заряд 1+, а не заряд 2+, 3+ или даже 1−. Таким образом, если вы запомните информацию из таблицы 3.6 «Одноатомные ионы с различными зарядами», вы всегда будете знать, какие заряды образует большинство атомов. (В главе 9
В таблице 3.6 «Одноатомные ионы с различными зарядами» следует отметить несколько особенностей ионов. Во-первых, каждый элемент, образующий катионы, является металлом, за исключением одного (водорода), а каждый элемент, образующий анионы, является неметаллом. На самом деле это одно из химических свойств металлов и неметаллов: металлы склонны образовывать катионы, а неметаллы склонны образовывать анионы. Во-вторых, большинство атомов образуют ионы с одним характеристическим зарядом. Когда атомы натрия образуют ионы, они всегда образуют заряд 1+, а не заряд 2+, 3+ или даже 1−. Таким образом, если вы запомните информацию из таблицы 3.6 «Одноатомные ионы с различными зарядами», вы всегда будете знать, какие заряды образует большинство атомов. (В главе 9
Таблица 3.6 Одноатомные ионы с различными зарядами
| Ионы, образованные при потере одного электрона | Н + |
| Нет данных + | |
| К + | |
| Руб + | |
| Аг + | |
| Золото + | |
| Ионы, образованные потерей двух электронов | мг 2+ |
| Ка 2+ | |
| Старший 2+ | |
| Fe 2+ | |
| Ко 2+ | |
| Ni 2+ | |
| Медь 2+ | |
| Цинк 2+ | |
| Сн 2+ | |
рт. ст. 2+ ст. 2+ | |
| Pb 2+ | |
| Ионы, образованные потерей трех электронов | Sc 3+ |
| Fe 3+ | |
| Ко 3+ | |
| Ni 3+ | |
| Золото 3+ | |
| Ал 3+ | |
| Кр 3+ | |
| Ионы, образованные потерей четырех электронов | Ти 4+ |
| Сн 4+ | |
| Pb 4+ | |
| Ионы, образованные присоединением одного электрона | Ф − |
| Класс − | |
| Бр − | |
| Я − | |
| Ионы, образованные присоединением двух электронов | О 2− |
| С 2- | |
| Се 2- | |
| Ионы, образованные присоединением трех электронов | Н 3− |
| П 3- |
В-третьих, есть некоторые исключения из предыдущего пункта. Несколько элементов, все металлы, могут образовывать более одного возможного заряда. Например, атомы железа могут образовывать 2+ катиона или 3+ катиона. Кобальт — еще один элемент, который может образовывать более одного возможного заряженного иона (2+ и 3+), а свинец может образовывать катионы 2+ или 4+. К сожалению, мало кто понимает, какие два заряда может иметь атом металла, поэтому лучше всего просто запомнить возможные заряды, которые может иметь тот или иной элемент.
Несколько элементов, все металлы, могут образовывать более одного возможного заряда. Например, атомы железа могут образовывать 2+ катиона или 3+ катиона. Кобальт — еще один элемент, который может образовывать более одного возможного заряженного иона (2+ и 3+), а свинец может образовывать катионы 2+ или 4+. К сожалению, мало кто понимает, какие два заряда может иметь атом металла, поэтому лучше всего просто запомнить возможные заряды, которые может иметь тот или иной элемент.
Обратите внимание на условное обозначение иона. Величина заряда указана в правом надстрочном индексе рядом с символом элемента. Если заряд единичный положительный или отрицательный, цифра 1 не пишется; если величина заряда больше 1, то число записывается как перед знаком + или -. Символ элемента без заряда, написанный рядом с ним, считается незаряженным атомом.
Дать название иону несложно. Для катиона просто используйте название элемента и добавьте слово ion (или, если вы хотите быть более конкретным, добавьте катион ) после имени элемента. Итак, Na + — это ион натрия; Ca 2+ представляет собой ион кальция. Если элемент имеет более одного возможного заряда, значение заряда указывается после имени элемента и перед словом ion . Таким образом, Fe 2+ представляет собой два иона железа, а Fe 3+ представляет собой три иона железа. В печати мы используем римские цифры в скобках для обозначения заряда иона, поэтому эти два иона железа будут представлены как катион железа (II) и катион железа (III) соответственно.
Итак, Na + — это ион натрия; Ca 2+ представляет собой ион кальция. Если элемент имеет более одного возможного заряда, значение заряда указывается после имени элемента и перед словом ion . Таким образом, Fe 2+ представляет собой два иона железа, а Fe 3+ представляет собой три иона железа. В печати мы используем римские цифры в скобках для обозначения заряда иона, поэтому эти два иона железа будут представлены как катион железа (II) и катион железа (III) соответственно.
Для одноатомного аниона используйте основу имени элемента и добавьте к нему суффикс -ide , а затем добавьте ion . Это похоже на то, как мы назвали молекулярные соединения. Так, Cl — является хлорид-ионом, а N 3- — нитрид-ионом.
Пример 6
Назовите каждый вид.
- О 2−
- Со
- Со 2+
Раствор
- Этот вид имеет заряд 2−, поэтому это анион.
 Анионы названы по основе названия элемента с добавлением суффикса -ide . Это оксид-анион.
Анионы названы по основе названия элемента с добавлением суффикса -ide . Это оксид-анион. - Поскольку этот вид не имеет заряда, в своей элементарной форме он представляет собой атом. Это кобальт.
- В этом случае атом имеет заряд 2+, поэтому это катион. Из таблицы 3.6 «Одноатомные ионы с различными зарядами» мы отмечаем, что катионы кобальта могут иметь два возможных заряда, поэтому название иона должно указывать, какой заряд имеет ион. Это катион кобальта(II).
Проверь себя
Назови каждый вид.
- Р 3-
- Ср 2+
Ответы
- анион фосфида
- катион стронция
Химические формулы ионных соединений называются ионными формулами Химическая формула ионного соединения. Правильная ионная формула содержит катион и анион; ионное соединение никогда не образуется только между двумя катионами или только двумя анионами. Ключ к написанию правильных ионных формул прост: общий положительный заряд должен уравновешивать общий отрицательный заряд. Поскольку заряды ионов носят характерный характер, иногда нам приходится иметь более одного катиона или аниона, чтобы сбалансировать общие положительные и отрицательные заряды. Обычно используют наименьшее соотношение ионов, необходимое для балансировки зарядов.
Ключ к написанию правильных ионных формул прост: общий положительный заряд должен уравновешивать общий отрицательный заряд. Поскольку заряды ионов носят характерный характер, иногда нам приходится иметь более одного катиона или аниона, чтобы сбалансировать общие положительные и отрицательные заряды. Обычно используют наименьшее соотношение ионов, необходимое для балансировки зарядов.
Например, рассмотрим ионное соединение между Na + и Cl — . Каждый ион имеет один заряд, один положительный и один отрицательный, поэтому нам нужен только один ион каждого из них, чтобы сбалансировать общий заряд. При написании ионной формулы мы следуем двум дополнительным соглашениям: (1) сначала пишем формулу катиона, а затем формулу аниона, но (2) не пишем заряды ионов. Таким образом, для соединения между Na + и Cl — мы имеем ионную формулу NaCl (рис. 3.5 «NaCl = поваренная соль»). Формула Na 2 Cl 2 также имеет сбалансированные заряды, но принято использовать наименьшее соотношение ионов, которое должно быть по одному на каждый. (Помните из наших правил написания формул, что мы не пишем нижний индекс 1, если присутствует только один атом определенного элемента.) Для ионного соединения между катионами магния (Mg 2+ ) и анионами оксида (O 2-), опять же, нам нужен только один ион каждого типа, чтобы сбалансировать заряды. По соглашению формула MgO.
(Помните из наших правил написания формул, что мы не пишем нижний индекс 1, если присутствует только один атом определенного элемента.) Для ионного соединения между катионами магния (Mg 2+ ) и анионами оксида (O 2-), опять же, нам нужен только один ион каждого типа, чтобы сбалансировать заряды. По соглашению формула MgO.
Для ионного соединения между Mg 2+ ионов и ионов Cl − , теперь мы учитываем тот факт, что заряды имеют разные величины: 2+ на ионах магния и 1– на ионах хлорида. Чтобы уравновесить заряды с наименьшим количеством ионов, нам нужно иметь два иона хлорида, чтобы уравновесить заряд одного иона магния. Вместо того, чтобы писать формулу MgClCl, мы объединяем два иона хлорида и записываем ее с индексом 2: MgCl 2 .
О чем говорит нам формула MgCl 2 ? В формуле два иона хлора. Хотя хлор как элемент представляет собой двухатомную молекулу, Cl 2 , элементарный хлор не входит в состав этого ионного соединения. Хлор находится в форме отрицательно заряженного иона , а не нейтрального элемента . Нижний индекс 2 стоит в ионной формуле, потому что нам нужны два иона Cl — , чтобы сбалансировать заряд одного иона Mg 2+ .
Хлор находится в форме отрицательно заряженного иона , а не нейтрального элемента . Нижний индекс 2 стоит в ионной формуле, потому что нам нужны два иона Cl — , чтобы сбалансировать заряд одного иона Mg 2+ .
Пример 7
Напишите соответствующую ионную формулу для каждого из двух данных ионов.
- Ca 2+ и Cl −
- Ал 3+ и F −
- Al 3+ и O 2−
Solution
- Нам нужны два иона Cl − , чтобы сбалансировать заряд одного иона Ca 2+ , поэтому правильная ионная формула CaCl 2 .
- Нам нужно три иона F − , чтобы сбалансировать заряд иона Al 3+ , поэтому правильная ионная формула будет AlF 3 .
- С Ал 3+ и O 2− , обратите внимание, что ни один из зарядов не является кратным другому.
 Это означает, что мы должны найти наименьшее общее кратное, которое в данном случае будет равно шести. Чтобы получить в сумме 6+, нам нужно два иона Al 3+ ; чтобы получить 6-, нам нужно три иона O 2- . Следовательно, правильная ионная формула Al 2 O 3 .
Это означает, что мы должны найти наименьшее общее кратное, которое в данном случае будет равно шести. Чтобы получить в сумме 6+, нам нужно два иона Al 3+ ; чтобы получить 6-, нам нужно три иона O 2- . Следовательно, правильная ионная формула Al 2 O 3 .
Проверьте себя
Напишите правильные ионные формулы для каждого из двух данных ионов.
- Fe 2+ и S 2−
- Fe 3+ и S 2−
Ответы
- FeS
- Fe 2 S 3
Назвать ионные соединения просто: соедините название катиона и название аниона, в обоих случаях опуская слово ион . Не используйте числовые префиксы, если для балансировки зарядов необходимо более одного иона. NaCl — хлорид натрия, сочетание названия катиона (натрия) и аниона (хлорида). MgO — оксид магния. MgCl 2 — это хлорид магния — , а не дихлорид магния.
MgO — оксид магния. MgCl 2 — это хлорид магния — , а не дихлорид магния.
При наименовании ионных соединений, катионы которых могут иметь более одного возможного заряда, мы должны также включать заряд в скобках и римскими цифрами как часть названия. Следовательно, FeS представляет собой сульфид железа (II), а Fe 2 S 3 представляет собой сульфид железа (III). Опять же, в имени нет числовых префиксов. Количество ионов в формуле продиктовано необходимостью уравновешивания положительных и отрицательных зарядов.
Пример 8
Назовите каждое ионное соединение.
- CaCl 2
- Альф 3
- Со 2 О 3
Раствор
- Используя названия ионов, это ионное соединение называется хлоридом кальция. Это не хлорид кальция (II) , потому что кальций образует только один катион, когда он образует ион, и имеет характеристический заряд 2+.

- Название этого ионного соединения — фторид алюминия.
- Мы знаем, что кобальт может иметь более одного возможного заряда; нам просто нужно определить, что это такое. Оксид всегда имеет заряд 2-, поэтому с тремя ионами оксида у нас есть общий отрицательный заряд 6-. Это означает, что два иона кобальта должны вносить 6+, что для двух ионов кобальта означает, что каждый из них равен 3+. Поэтому правильное название этого ионного соединения — оксид кобальта (III).
Проверь себя
Назовите каждое ионное соединение.
- Sc 2 О 3
- AgCl
Ответы
- оксид скандия
- хлорид серебра
Как узнать, относится ли формула — и, соответственно, название — к молекулярному соединению или к ионному соединению? Молекулярные соединения образуются между неметаллами и неметаллами, а ионные соединения образуются между металлами и неметаллами. Периодическую таблицу (рис. 3.2 «Простая периодическая таблица») можно использовать для определения того, какие элементы являются металлами, а какие неметаллами.
Периодическую таблицу (рис. 3.2 «Простая периодическая таблица») можно использовать для определения того, какие элементы являются металлами, а какие неметаллами.
Также существует группа ионов, которые содержат более одного атома. Их называют многоатомными ионами. Ион, содержащий более одного атома. В таблице 3.7 «Обычные многоатомные ионы» перечислены формулы, заряды и названия некоторых распространенных многоатомных ионов. Только один из них, ион аммония, является катионом; остальные — анионы. Большинство из них также содержат атомы кислорода, поэтому иногда их называют оксианионами . Некоторые из них, такие как нитраты и нитриты, а также сульфаты и сульфиты, имеют очень похожие формулы и названия, поэтому необходимо соблюдать осторожность, чтобы формулы и названия были правильными. Обратите внимание, что многоатомный ион -ite имеет в своей формуле на один атом кислорода меньше, чем -ate-ион, но с тем же ионным зарядом.
Таблица 3.7 Общие многоатомные ионы
| Наименование | Формула и заправка | Имя | Формула и заправка | |
|---|---|---|---|---|
| аммоний | НХ 4 + | гидроксид | ОХ − | |
| ацетат | C 2 H 3 O 2 − или CH 3 COO − | нитрат | НЕТ 3 − | |
| бикарбонат (гидрокарбонат) | ОХС 3 − | нитрит | НЕТ 2 − | |
| бисульфат (сульфат водорода) | ХСО 4 − | пероксид | О 2 2− | |
| карбонат | СО 3 2− | перхлорат | ClO 4 − | |
| хлорат | ClO 3 − | фосфат | ЗП 4 3- | |
| хромат | CrO 4 2− | сульфат | СО 4 2− | |
| цианид | CN − | сульфит | СО 3 2− | |
| дихромат | Cr 2 O 7 2− | трийодид | I 3 − |
Наименования ионных соединений, содержащих многоатомные ионы, следуют тем же правилам, что и наименования других ионных соединений: просто объедините название катиона и название аниона. Не используйте числовые префиксы в названии, если имеется более одного многоатомного иона; единственным исключением является случай, когда название самого иона содержит числовой префикс, например дихромат или трийодид.
Не используйте числовые префиксы в названии, если имеется более одного многоатомного иона; единственным исключением является случай, когда название самого иона содержит числовой префикс, например дихромат или трийодид.
Написание формул ионных соединений имеет одно важное отличие. Если для уравновешивания общего заряда в формуле требуется более одного многоатомного иона, заключите формулу многоатомного иона в круглые скобки и запишите соответствующий числовой индекс справа и 9.0019 вне скобок . Таким образом, формула между ионами кальция Ca 2+ и ионами нитрата NO 3 − правильно записывается Ca(NO 3 ) 2 , а не CaNO 32 1 или 8 0 2 0 9 0 8 1 О 6 . Используйте скобки там, где это необходимо. Название этого ионного соединения просто нитрат кальция.
Пример 9
Напишите соответствующую формулу и дайте собственное название для каждого ионного соединения, образованного между двумя перечисленными ионами.
- NH 4 + и S 2−
- Al 3+ и ПО 4 3−
- Fe 2+ и ПО 4 3−
Решение
- Поскольку ион аммония имеет заряд 1+, а ион сульфида имеет заряд 2–, нам нужны два иона аммония, чтобы сбалансировать заряд одного сульфид-иона. Заключая формулу для иона аммония в скобки, имеем (NH 4 ) 2 S. Название соединения – сульфид аммония.
- Поскольку ионы имеют одинаковую величину заряда, нам нужен только один из них, чтобы сбалансировать заряды. Формула — AlPO 4 , а название соединения — фосфат алюминия.
- Ни один из зарядов не является кратным другому, поэтому мы должны перейти к наименьшему общему кратному 6. Чтобы получить 6+, нам нужно три иона железа (II), а чтобы получить 6-, нам нужно два иона фосфата. Правильная формула Fe 3 (PO 4 ) 2 , а название соединения — фосфат железа (II).

Проверьте себя
Напишите правильную формулу и дайте правильное название для каждого ионного соединения, образованного между двумя перечисленными ионами.
- NH 4 + и PO 4 3−
- Co 3+ и № 2 −
Ответы
- (NH 4 ) 3 PO 4 , фосфат аммония
- Co(NO 2 ) 3 , нитрит кобальта(III)
Приложение «Еда и напитки»: натрий в вашей еде
Элемент натрия, по крайней мере, в его ионной форме Na + , является необходимым питательным веществом для жизни человека. Фактически, человеческое тело содержит примерно 0,15% натрия, при этом в организме среднего человека в любой момент времени содержится от одной двадцатой до одной десятой килограмма, в основном в жидкостях вне клеток и в других жидкостях организма.
Натрий также присутствует в нашем рационе. Обычная поваренная соль, которую мы используем для приготовления пищи, представляет собой ионное соединение натрия. Многие обработанные пищевые продукты также содержат значительное количество натрия, добавленного к ним в виде различных ионных соединений. Почему соединения натрия так широко используются? Обычно соединения натрия недороги, но, что более важно, большинство ионных соединений натрия легко растворяются. Это позволяет производителям обработанных пищевых продуктов добавлять содержащие натрий вещества в пищевые смеси и знать, что это соединение будет растворяться и равномерно распределяться по пище. Простые ионные соединения, такие как нитрит натрия (NaNO 2 ) добавляют в вяленое мясо, такое как бекон и мясные деликатесы, а соединение, называемое бензоатом натрия, добавляют во многие упакованные продукты в качестве консерванта. Таблица 3.8 «Некоторые соединения натрия, добавляемые в пищу» представляет собой неполный список некоторых добавок натрия, используемых в пищевых продуктах. Некоторые из них вы узнаете, прочитав эту главу. Другие вы можете не узнать, но все они представляют собой ионные соединения натрия с некоторым присутствием отрицательно заряженных ионов.
Некоторые из них вы узнаете, прочитав эту главу. Другие вы можете не узнать, но все они представляют собой ионные соединения натрия с некоторым присутствием отрицательно заряженных ионов.
Таблица 3.8 Некоторые соединения натрия, добавляемые в продукты питания
| Соединение натрия | Использование в пищевых продуктах |
|---|---|
| Ацетат натрия | консервант, регулятор кислотности |
| Адипинат натрия | пищевая кислота |
| Альгинат натрия | загуститель, растительная камедь, стабилизатор, желирующий агент, эмульгатор |
| Фосфат алюминия натрия | регулятор кислотности, эмульгатор |
| Алюмосиликат натрия | антислеживатель |
| Аскорбат натрия | антиоксидант |
| Бензоат натрия | консервант |
| Бикарбонат натрия | минеральная соль |
| Бисульфит натрия | консервант, антиоксидант |
| Карбонат натрия | минеральная соль |
| Карбоксиметилцеллюлоза натрия | эмульгатор |
| Цитраты натрия | пищевая кислота |
| Дегидроацетат натрия | консервант |
| Эриторбат натрия | антиоксидант |
| Эриторбин натрия | антиоксидант |
| Этилпарагидроксибензоат натрия | консервант |
| Ферроцианид натрия | антислеживатель |
| Формиат натрия | консервант |
| Фумарат натрия | пищевая кислота |
| Глюконат натрия | стабилизатор |
| Гидроацетат натрия | консервант, регулятор кислотности |
| Гидроксид натрия | минеральная соль |
| Лактат натрия | пищевая кислота |
| Малат натрия | пищевая кислота |
| Метабисульфит натрия | консервант, антиоксидант, отбеливатель |
| Метилпарагидроксибензоат натрия | консервант |
| Нитрат натрия | консервант, закрепитель цвета |
| Нитрит натрия | консервант, закрепитель цвета |
| Ортофенилфенол натрия | консервант |
| Пропионат натрия | консервант |
| Натрия пропилпара-гидроксибензоат | консервант |
| Сорбат натрия | консервант |
| Стеароиллактилат натрия | эмульгатор |
| Сукцинаты натрия | регулятор кислотности, усилитель вкуса |
| Натриевые соли жирных кислот | эмульгатор, стабилизатор, антислеживатель |
| Сульфит натрия | минеральная соль, консервант, антиоксидант |
| Сульфит натрия | консервант, антиоксидант |
| Тартрат натрия | пищевая кислота |
| Тетраборат натрия | консервант |
Использование большого количества соединений натрия в приготовленных и обработанных пищевых продуктах встревожило некоторых врачей и диетологов. Они утверждают, что среднестатистический человек потребляет слишком много натрия из своего рациона. Среднестатистическому человеку требуется всего около 500 мг натрия каждый день; большинство людей потребляют больше — до 10 раз больше. Некоторые исследования связывают повышенное потребление натрия с высоким кровяным давлением; новые исследования показывают, что эта ссылка сомнительна. Тем не менее, есть стремление уменьшить количество натрия, потребляемого большинством людей каждый день: избегайте обработанных и полуфабрикатов, читайте этикетки на упакованных продуктах (которые содержат указание на содержание натрия), не пересолите продукты и используйте другие продукты. травы и специи, кроме соли в кулинарии.
Они утверждают, что среднестатистический человек потребляет слишком много натрия из своего рациона. Среднестатистическому человеку требуется всего около 500 мг натрия каждый день; большинство людей потребляют больше — до 10 раз больше. Некоторые исследования связывают повышенное потребление натрия с высоким кровяным давлением; новые исследования показывают, что эта ссылка сомнительна. Тем не менее, есть стремление уменьшить количество натрия, потребляемого большинством людей каждый день: избегайте обработанных и полуфабрикатов, читайте этикетки на упакованных продуктах (которые содержат указание на содержание натрия), не пересолите продукты и используйте другие продукты. травы и специи, кроме соли в кулинарии.
Ключевые выводы
- Ионы образуются, когда атомы теряют или приобретают электроны.
- Ионные соединения имеют положительные и отрицательные ионы.
- Ионные формулы уравновешивают суммарные положительные и отрицательные заряды.

- Ионные соединения имеют простую систему наименования.
- Группы атомов могут иметь общий заряд и образовывать ионные соединения.
Упражнения
Объясните, как образуются катионы.
Объясните, как образуются анионы.
Определите заряд каждого атома, когда он образует ион. Если возможно более одного заряда, укажите оба.
- К
- О
- Со
Определите заряд каждого атома, когда он образует ион. Если возможно более одного заряда, укажите оба.
- Ca
- я
- Фе
Определите заряд каждого атома, когда он образует ион.
 Если возможно более одного заряда, укажите оба.
Если возможно более одного заряда, укажите оба.- Аг
- Золото
- Бр
Определить заряд, который получает каждый атом, образуя ион. Если возможно более одного заряда, укажите оба.
- С
- На
- Х
Назовите ионы из упражнения 3.
Назовите ионы из упражнения 4.
Назовите ионы из упражнения 5.
Назовите ионы из упражнения 6.
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.

- Mg 2+ и Cl −
- Fe 2+ и O 2−
- Fe 3+ и O 2−
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
- К + и S 2−
- Ag + и Br −
- Sr 2+ и N 3−
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
- Cu 2+ и F −
- Ca 2+ и O 2−
- К + и Р 3−
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.

- Na + и N 3−
- Со 2+ и я −
- Au 3+ и S 2−
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
- К + и SO 4 2−
- NH 4 + и S 2−
- НХ 4 + и ЗП 4 3−
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
- Ca 2+ и NO 3 −
- Ca 2+ и № 2 −
- Sc 3+ и C 2 H 3 О 2 −
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.

- Pb 4+ и SO 4 2−
- Na + и I 3 −
- Li + и Cr 2 O 7 2−
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
- NH 4 + и N 3−
- Mg 2+ и CO 3 2−
- Al 3+ и OH −
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.
- Ag + и SO 3 2−
- Na + и HCO 3 −
- Fe 3+ и ClO 3 −
Приведите формулу и название каждого ионного соединения, образованного двумя перечисленными ионами.

- Руб + и О 2 2−
- Au 3+ и HSO 4 −
- Sr 2+ и NO 2 −
В чем разница между SO 3 и SO 3 2− ?
В чем разница между № 2 и № 2 − ?
Ответы
Катионы образуются, теряя электроны.
- 1+
- 2−
- 2+, 3+
- 1+
- 1+, 3+
- 1−
- ион калия
- оксид-ион
- ионы кобальта(II) и кобальта(III) соответственно
- ион серебра
- ионы золота(I) и золота(III) соответственно
- бромид-ион
- хлорид магния, MgCl 2
- оксид железа(II), FeO
- оксид железа(III), Fe 2 O 3
- фторид меди(II), CuF 2
- оксид кальция, CaO
- фосфид калия, K 3 P
- сульфат калия, K 2 SO 4
- сульфид аммония, (NH 4 ) 2 S
- фосфат аммония, (NH 4 ) 3 PO 4
- сульфат свинца(IV), Pb(SO 4 ) 2
- трийодид натрия, NaI 3
- дихромат лития, Li 2 Cr 2 O 7
- сульфит серебра, Ag 2 SO 3
- гидрокарбонат натрия, NaHCO 3
- хлорат железа(III), Fe(ClO 3 ) 3
SO 3 представляет собой триоксид серы, а SO 3 2− представляет собой ион сульфита.

3.5 Кислоты
Цели обучения
- Дайте определение кислоты .
- Назовите простую кислоту.
Есть еще одна важная для нас группа соединений — кислоты, и эти соединения обладают интересными химическими свойствами. Первоначально определим кислотное ионное соединение катиона Н+, растворенного в воде. в виде ионного соединения катиона Н + , растворенного в воде. (Мы расширим это определение в главе 12 «Кислоты и основания».) Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», слово, описывающее что-то растворенное в воде). Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
Кислоты имеют собственную номенклатуру. Если кислота состоит только из водорода и одного другого элемента, ее название будет следующим: гидро- + основа другого элемента + -кислота . Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. (Если бы эти кислоты не растворялись в воде, соединения назывались бы хлористым водородом и сероводородом соответственно. Оба эти вещества хорошо известны как молекулярные соединения, однако при растворении в воде они рассматриваются как кислоты.)
Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. (Если бы эти кислоты не растворялись в воде, соединения назывались бы хлористым водородом и сероводородом соответственно. Оба эти вещества хорошо известны как молекулярные соединения, однако при растворении в воде они рассматриваются как кислоты.)
Если соединение состоит из ионов водорода и многоатомного аниона, то название кислоты происходит от основы названия многоатомного иона. Как правило, если название аниона оканчивается на -ate, название кислоты представляет собой основу названия аниона плюс -ic acid ; если название родственного аниона оканчивается на -ite, название соответствующей кислоты представляет собой основу названия аниона плюс -ous acid . В таблице 3.9 «Названия и формулы кислот» перечислены формулы и названия различных кислот, с которыми вы должны быть знакомы. Вы должны узнать большинство анионов в формулах кислот.
Таблица 3.9 Названия и формулы кислот
| Формула | Имя |
|---|---|
| HC 2 H 3 O 2 | уксусная кислота |
| HClO 3 | хлористоводородная кислота |
| HCl | соляная кислота |
| HBr | бромистоводородная кислота |
| Привет | иодистоводородная кислота |
| ВЧ | фтористоводородная кислота |
| HNO 3 | азотная кислота |
| Н 2 С 2 О 4 | щавелевая кислота |
| HClO 4 | хлорная кислота |
| Н 3 Заказ на покупку 4 | фосфорная кислота |
| Н 2 SO 4 | серная кислота |
| Н 2 SO 3 | сернистая кислота |
Примечание. Метка «водный» опущена для ясности. Метка «водный» опущена для ясности. | |
Пример 10
Назовите каждую кислоту, не обращаясь к таблице 3.9 «Названия и формулы кислот».
- HBr
- H 2 SO 4
Раствор
- Название бинарной кислоты: гидро- + название основы + -кислота . Поскольку эта кислота содержит атом брома, ее называют бромистоводородной кислотой.
- Поскольку эта кислота получена из сульфат-иона, название кислоты является основой названия аниона + -ic acid . Название этой кислоты – серная кислота.
Проверь себя
Назови каждую кислоту.
- ВЧ
- HNO 2
Ответы
- плавиковая кислота
- азотистая кислота
Все кислоты имеют схожие свойства. Например, кислоты имеют кислый вкус; на самом деле кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием в пище кислот. Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Кислоты широко распространены в окружающем нас мире. Мы уже упоминали, что цитрусовые содержат кислоту; среди прочих соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.). Щавелевая кислота, H 2 C 2 O 4 (водн.), содержится в шпинате и других зеленых листовых овощах. Соляная кислота не только содержится в желудке (желудочная кислота), но ее также можно купить в хозяйственных магазинах в качестве чистящего средства для бетона и каменной кладки. Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Ключевые выводы
- Кислота представляет собой соединение иона H + , растворенного в воде.
- Кислоты имеют собственную систему наименования.
- Кислоты обладают определенными химическими свойствами, которые отличают их от других соединений.
Упражнения
Назовите формулы каждой кислоты.
- хлорная кислота
- иодистоводородная кислота
Назовите формулы каждой кислоты.
- сероводородная кислота
- фосфористая кислота
Назовите каждую кислоту.
- HF(водн.)
- HNO 3 (водный)
- H 2 C 2 O 4 (водный)
Назовите каждую кислоту.

- H 2 SO 4 (водный)
- H 3 ПО 4 (водный)
- HCl (водн.)
Назовите кислоту, содержащуюся в пище.
Назовите некоторые общие свойства кислот.
Ответы
- HClO 4 (водный)
- HI (водн.)
- фтористоводородная кислота
- азотная кислота
- щавелевая кислота
щавелевая кислота (ответы могут быть разными)
3.
 6 Материалы в конце главы
6 Материалы в конце главы
Дополнительные упражнения
Сколько электронов нужно, чтобы получить массу одного протона?
Сколько протонов нужно, чтобы получить массу нейтрона?
Первоначальная версия современной атомной теории Дальтона гласит, что все атомы одного и того же элемента одинаковы. Это действительно правильно? Почему или почему нет?
Чем отличаются атомы одного и того же элемента? Чем отличаются атомы одного и того же элемента?
Дайте полные атомные обозначения трех известных изотопов водорода.
Редкий изотоп гелия имеет в ядре один нейтрон. Напишите полный атомный символ этого изотопа.
Используйте его место в периодической таблице, чтобы определить, является ли индий In, атомный номер 49, металлом или неметаллом.

Обнаружено всего несколько атомов астата At с атомным номером 85. Основываясь на его положении в периодической таблице, вы бы предположили, что это металл или неметалл?
Америций-241 является важной частью многих детекторов дыма. Сколько нейтронов содержится в его ядре?
Калий-40 — радиоактивный изотоп калия, присутствующий в организме человека. Сколько нейтронов содержится в его ядре?
Определите атомную массу рутения по данным содержания и массы.
Рутений-96 5,54% 95,907 и Рутений-98 1,87% 97,905 и Рутений-99 12,76% 98.  906 и
906 иРутений-100 12,60% 99,904 и Рутений-101 17,06% 100,906 и Рутений-102 31,55% 101,904 и Рутений-104 18,62% 103,905 и Определите атомную массу теллура по данным содержания и массы.
Теллур-120 0,09% 119,904 и Теллур-122 2,55% 121,903 и Теллур-123 0,89% 122.  904 и
904 иТеллур-124 4,74% 123,903 и Теллур-125 7,07% 124,904 и Теллур-126 18,84% 125,903 и Теллур-128 31,74% 127,904 и Теллур-130 34,08% 129,906 и Одна атомная единица массы имеет массу 1,6605 × 10 −24 г.
 Какова масса одного атома натрия?
Какова масса одного атома натрия?Одна атомная единица массы имеет массу 1,6605 × 10 −24 г. Какова масса одного атома урана?
Одна атомная единица массы имеет массу 1,6605 × 10 −24 г. Какова масса одной молекулы Н 2 О?
Одна атомная единица массы имеет массу 1,6605 × 10 −24 г. Какова масса одной молекулы PF 5 ?
По своему положению в периодической таблице Cu и I образуют молекулярное соединение или ионное соединение?
По своему положению в периодической таблице N и S образуют молекулярное соединение или ионное соединение?
Ртуть является необычным элементом, поскольку, когда она принимает заряд 1+ в виде катиона, она всегда существует в виде двухатомного иона.

- Предложите формулу иона ртути(I).
- Какова формула хлорида ртути(I)?
Предложите формулу перекиси водорода, вещества, используемого в качестве отбеливателя. (Любопытно, что это соединение не ведет себя как кислота, несмотря на свою формулу. Оно ведет себя скорее как классическое молекулярное соединение неметалл-неметалл.)
Катион уранила имеет формулу UO 2 2+ . Предложите формулы и названия ионных соединений между катионом уранила и F − , SO 4 2− и PO 4 3− .
Анион перманганата имеет формулу MnO 4 − . Предложите формулы и названия ионных соединений между ионом перманганата и K + , Ca 2+ и Fe 3+ .

Ответы
около 1800 электронов
Это не совсем верно из-за существования изотопов.
h21, h22 и h23
Это металл.
146 нейтронов
101.065 и
3,817 × 10 −23 г
2,991 × 10 −23 г
ионный
- рт.

- рт.

 В нем находятся положительно заряженные протоны и нейтральные частицы нейтроны. Вместе их называют нуклоны.
В нем находятся положительно заряженные протоны и нейтральные частицы нейтроны. Вместе их называют нуклоны. Охлажденные лазером атомные ионы представляют собой отличную базу для изучения и использования уникальных свойств квантовой физики. Они используются для создания чрезвычайно точных часов или, как в этом случае, в качестве частиц для построения квантовых компьютеров будущего, которые смогут решать задачи, затмевающие сегодняшние даже самые мощнейшие суперкомпьютеры.»
Охлажденные лазером атомные ионы представляют собой отличную базу для изучения и использования уникальных свойств квантовой физики. Они используются для создания чрезвычайно точных часов или, как в этом случае, в качестве частиц для построения квантовых компьютеров будущего, которые смогут решать задачи, затмевающие сегодняшние даже самые мощнейшие суперкомпьютеры.»