Содержание
CRISPR для чайников, или Краткая справка по быстрому редактированию ДНК / Хабр
Возможность изменять фрагменты ДНК всегда была святым Граалем биотехнологии и медицины. CRISPR позволяет делать это с невиданной ранее скоростью и эффективностью. Считайте, что биологи раньше работали на пишущей машинке, а благодаря CRISPR в одночасье пересели на MacBook. Не зря открытие этого метода в 2020 году удостоилось Нобелевской премии по химии.
Резка молекулы ДНК с помощью CRISPR-Cas9 (рис. Джанет Иваса)
Под катом — рассказ о появлении CRISPR, принципах работы и применении в настоящем и будущем. Да, вы все верно поняли, это про редактирование коров, синюю клубнику и арбузы размером со сливу с Aliexpress.
Эта статья — переработанная версия лекции Бориса Климовича, научного сотрудника Университетской клиники Тюбингена и Немецкого центра исследований рака (DKFZ), которая прошла в конце ноября при поддержке Точки кипения ЯрГУ.
Признание к CRISPR пришло в 2012 году — после публикации нобелевской работы. Но, как это обычно бывает в науке, открытие — не личная заслуга пары авторов. В этот раз участников событий было много, и началось все вовсе не с генетики.
Но, как это обычно бывает в науке, открытие — не личная заслуга пары авторов. В этот раз участников событий было много, и началось все вовсе не с генетики.
Все началось с «грязекопателя»
Аббревиатура CRISPR появилась в конце 80-х в ходе исследований солончаков рядом с испанским городом Аликанте. Аспирант Франсиско Мохика изучал архебактерий, живущих в соленой воде, и наткнулся на странные палиндромные последовательности в их геноме.
Фрагменты длиной около 30 нуклеотидов повторялись много раз и отделялись друг от друга уникальными участками ДНК примерно такой же длины.
Упрощенно обнаруженная структура выглядела так:
На тот момент никто не понимал, зачем нужны эти структуры. Сошлись на том, что они необходимы для некой регуляции (стандартное «объяснение» в биологии, когда ничего не понятно). Структурам сначала дали название SRSR (Short Regularly Spaced Repeats), а потом переименовали в CRISPR (Clustered Regularly Interspaced Palindromic Repeats).
Продолжив работу в том же направлении, Мохика нашел похожие повторы у многих других бактерий.
И эта закономерность привлекла внимание.
В 2002 году рядом с CRISPR-массивами у всех бактерий выявили похожие на них структуры — группу белок-кодирующих генов, которую назвали «очень оригинально» — CAS (CRISPR-Associated Genes).
Продвинуться дальше помог своего рода «генетический Google»: GenBank, куда ученые складируют все прочитанные последовательности ДНК. К началу 2000-х годов там накопилось уже достаточно информации, чтобы при помощи алгоритмов BLAST найти, в каких организмах встречаются похожие CRISPR-последовательности.
GenBank — открытая аннотированная база генетической информации. На июнь 2019 года в ней содержалась информация о 329 млрд пар оснований и 213 млн последовательностей. Источник — American Health Information Management Association
Поиск выявил интересную вещь: фрагменты CRISPR встречаются в ДНК бактериофагов — вирусов, которые инфицируют бактерии и убивают их. Получается, что бактерии хранят внутри себя фрагменты ДНК своих злейших врагов.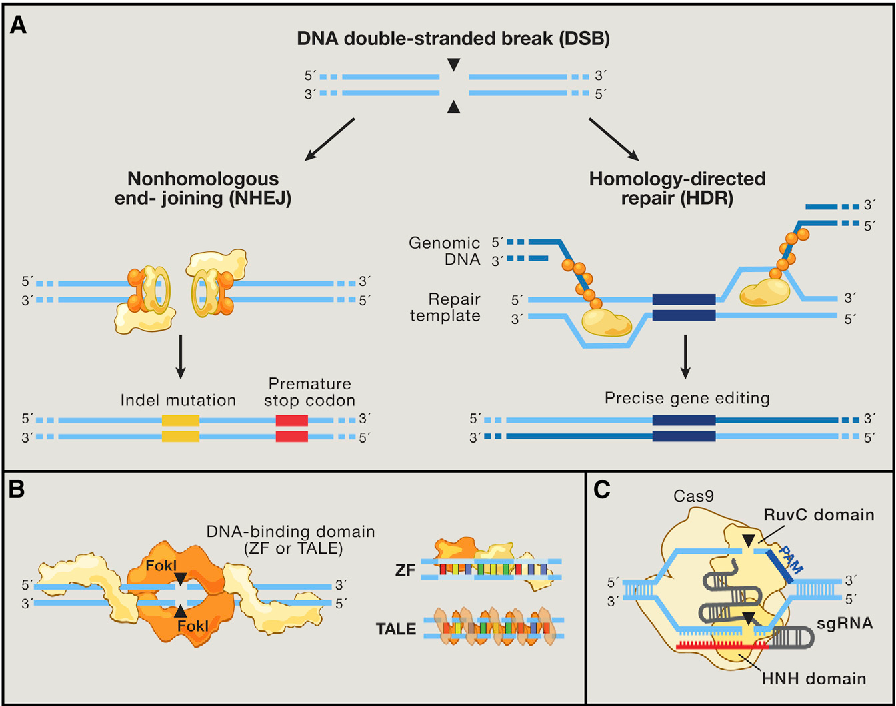
Так возникла ключевая догадка о том, что CRISPR — это иммунная память бактерий, сохраняющих информацию о вирусах, которыми болели.
Сформулировав эту теорию, Мохика сел писать статью, которую отправил в самый престижный биологический журнал — Nature. Статью отклонили. Затем он пытался ее пристроить в четыре других журнала, но успеха добился лишь через 18 месяцев.
Кстати, в этом он далеко не рекордсмен. В свое время работу Линн Маргулис, предложившую популярную нынче гипотезу симбиогенеза, отклоняли 15 раз! Можно сказать, что Мохика повезло. Его работу опубликовали быстрее, а идея нашла своих сторонников.
Основная функция CRISPR
Следующий шаг в развитии технологии сделал микробиолог Филипп Хорват. В своей докторской работе он исследовал закваски к эльзасской квашеной капусте, а если точнее — молочнокислые бактерии, которые ее квасят.
С появлением CRISPR закваска капусты стала беспроблемным делом (нет, саму капусту не трогали)
После докторской он ушел в молочную промышленность, где столкнулся с проблемой бактериофагов.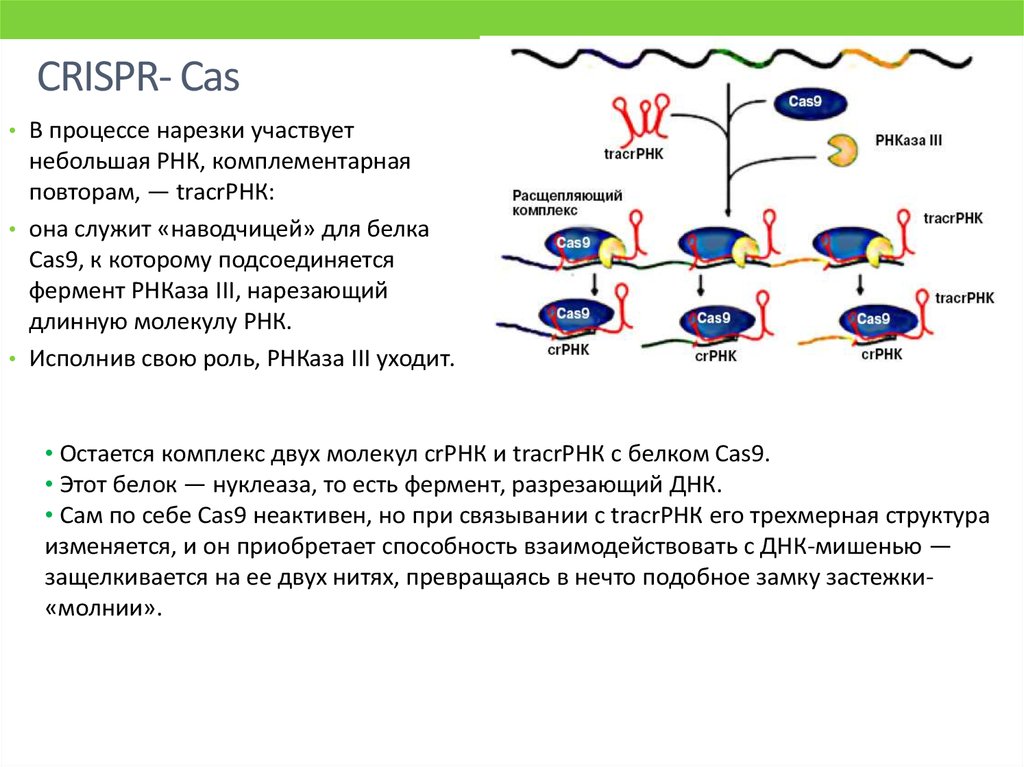 Они сильно вредили заквасочным культурам, производители молочных продуктов несли огромные убытки. Ховарт искал способы сделать закваски устойчивыми к бактериофагам и наткнулся на работы о CRISPR. Исследуя эту тему, он доказал, что устойчивые к вирусам бактерии перенимают часть их ДНК.
Они сильно вредили заквасочным культурам, производители молочных продуктов несли огромные убытки. Ховарт искал способы сделать закваски устойчивыми к бактериофагам и наткнулся на работы о CRISPR. Исследуя эту тему, он доказал, что устойчивые к вирусам бактерии перенимают часть их ДНК.
Бактериальная клетка, которая перенесла инфекцию бактериофагом и не умерла, нарезает его геном на мелкую «вермишель», встраивает в CRISPR-массивы и передает эту информацию своим потомкам, которые становятся устойчивыми к бактериофагу.
Позже компанию, в которой работал Хорват, купила корпорация DuPont. А поскольку она производит примерно 40% заквасок для современной молочной промышленности, вы практически наверняка сталкивались с CRISPR в составе йогуртов, пиццы или сыра.
Работы Хорвата показали, что CRISPR-массивы — это действительно иммунная система бактерий.
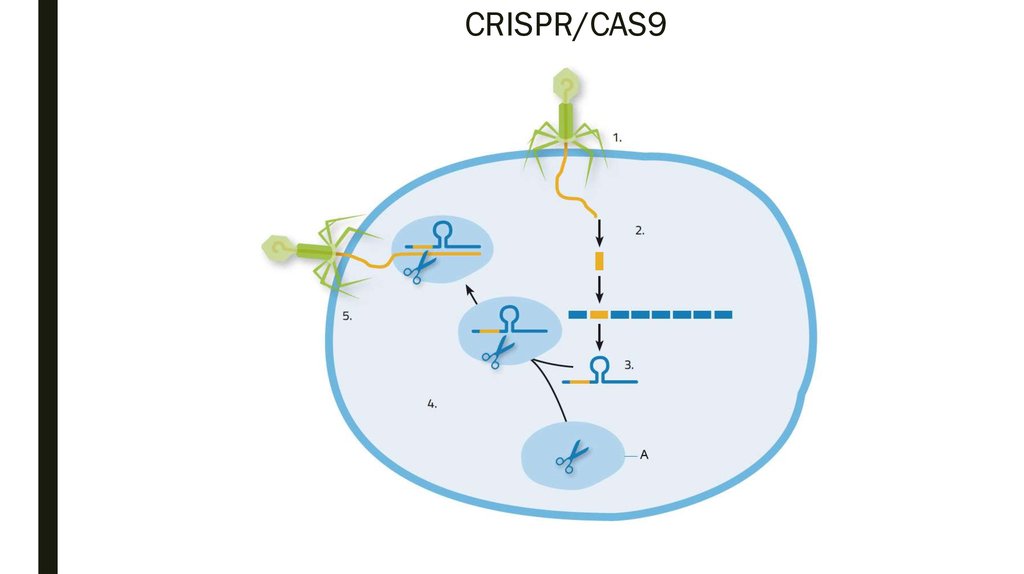
Это работает так: кусочки ДНК бактериофагов сохраняются в ДНК бактерий в виде CRISPR-массивов.Затем они превращаются в РНК. В этом же куске генома у бактерий кодируется так называемая тракр-РНК (tracrRNA). Вместе они формируют guideRNA, или наводящую РНК, которая затем объединяется с белком Cas9.
Cas9 — это нуклеаза, фермент, который умеет резать ДНК. При помощи guideRNA этот фермент наводится на специфический сегмент в ДНК бактериофага, садится на него и разрезает, как ножницами, чем нарушает размножение вируса.
Нобелевская статья по редактированию генов
Когда две замечательные женщины-ученые Эммануэль Шарпантье и Дженнифер Даудна встретились на конференции в Коста-Рике, предназначение CRISPR уже было известно. Им пришла в голову смелая идея: приспособить эту систему для резки любой ДНК. Они объединили силы своих лабораторий и в 2012 году в журнале Science опубликовали результаты работы.
Иллюстрация из оригинальной статьи
Им удалось объединить две РНК в одну single guide RNA и показать, что механизм резки работает.
Тут надо пояснить, что резка — это и есть основной этап редактирования ДНК.
А CRISPR — генетические ножницы. Все детали ниже.
За эту работу в 2020 году они получили Нобелевскую премию по химии.
Эммануэль Шарпантье и Дженнифер Даудна
Это событие уникально по двум параметрам.
Во-первых, это первая премия, которую получили две женщины без сопровождающей мужской компании.
Во-вторых, эта премия очень «быстрая». С момента публикации до ее присуждения прошло всего восемь лет.
Влияние технологии CRISPR проще всего проиллюстрировать, показав частоту упоминаний этой аббревиатуры в научной литературе, которая после 2012 года растет как на дрожжах.
Число упоминаний CRISPR в научной литературе
Второй показатель — количество патентов.
Эта статистика показывает, насколько все изменилось. Технологии редактирования генома предлагались и ранее, но ни одна из них не достигла такого успеха.
Как происходит редактирование ДНК
Первая нобелевская статья демонстрировала редактирование ДНК в пробирке. Перед учеными стояла амбициозная задача — повторить процесс в клетках человека. Фэн Чжан из MIT оптимизировал процесс, сделав его совместимым с живыми клетками, у которых есть ядра.
Перед учеными стояла амбициозная задача — повторить процесс в клетках человека. Фэн Чжан из MIT оптимизировал процесс, сделав его совместимым с живыми клетками, у которых есть ядра.
Фэн Чжан перенес технологию из пробирки в живые клетки
В 2013 году после публикации работы Чжана эта тема стала доминирующей. Появились сообщения о том, что отредактировали геном человека, мыши, дрожжей, ниматод, дрозофилы, резуховидки Таля, рыбки данио-рерио — всех имеющихся у биологов модельных объектов.
Важно понимать, что ДНК — это очень стабильная молекула. Ее можно кипятить или оставлять лежать в земле на сотни тысяч лет.
Самая старая секвенированная ДНК на сегодняшний день имеет возраст 1,7 млн лет.
Однако молекула ДНК очень чувствительна к разрывам. Если это случается, клетка запускает процесс починки ДНК. Он может идти двумя путями:
Не гомологичный вариант — когда место разрыва устраняется с дефектами. В результате в ДНК может появиться маленькая вставка или произойти потеря фрагмента.
 Генетический код — это типлеты, то есть три нуклеотида кодируют одну аминокислоту. Если вы вырезали два или вставили четыре нуклеотида, нарушится последовательность, кодирующая белок. Возникнет сдвиг рамки считывания, в результате которого ген фактически перестанет выполнять свою функцию, так как клетка не сможет использовать его информацию, чтобы синтезировать функциональный белок.
Генетический код — это типлеты, то есть три нуклеотида кодируют одну аминокислоту. Если вы вырезали два или вставили четыре нуклеотида, нарушится последовательность, кодирующая белок. Возникнет сдвиг рамки считывания, в результате которого ген фактически перестанет выполнять свою функцию, так как клетка не сможет использовать его информацию, чтобы синтезировать функциональный белок.
Сломать ген можно было и раньше, просто это довольно трудоемко: надо облучать гены радиацией, месяцами искать мутации. Благодаря CRISPR процесс стал гораздо проще.
Гомологичная рекомбинация. У всех животных в клетках как минимум две копии каждой хромосомы. Если возникает разрыв, клетка может использовать вторую хромосому и на ее основании достроить поврежденный участок — скопировать его в поврежденную хромосому. В этой ситуации клетку можно обмануть и подсунуть ей вместо второй хромосомы похожий фрагмент ДНК, но с мутацией. Тогда клетка починит разрыв, встроив в него то, что мы подсунули, — так называемую матрицу.

За счет прицельно вносимого разрыва, который делает CRISPR, появилась возможность очень просто и эффективно заменять фрагменты в геноме — вносить строго определенные мутации и чинить сломанные гены. Но есть проблема: репарация чаще всего проходит по не гомологичному пути. Существуют разные методы, позволяющие сдвинуть процесс в сторону гомологичной репликации, но пока они работают не очень хорошо.
Левая ветвь — не гомологичный вариант замены, приводящий к разрушению гена, правая — успешная починка подходящим фрагментом
Технологии редактирования генома существовали и ранее. Но они требовали сборки так называемых кастомных белков — под заказ. Для каждой операции нужно было собирать новый белок. Это занимало несколько недель и даже месяцев. Стоил каждый такой белок несколько тысяч евро. А CRISPR-реагенты стоят 10‒20 евро — в сотни раз меньше. Стало возможным проводить эксперименты гораздо быстрее и в огромных масштабах. Если вам в воскресенье пришла хорошая идея, то через неделю у вас уже будет клеточная линия с готовой мутацией, — и идею можно будет проверить.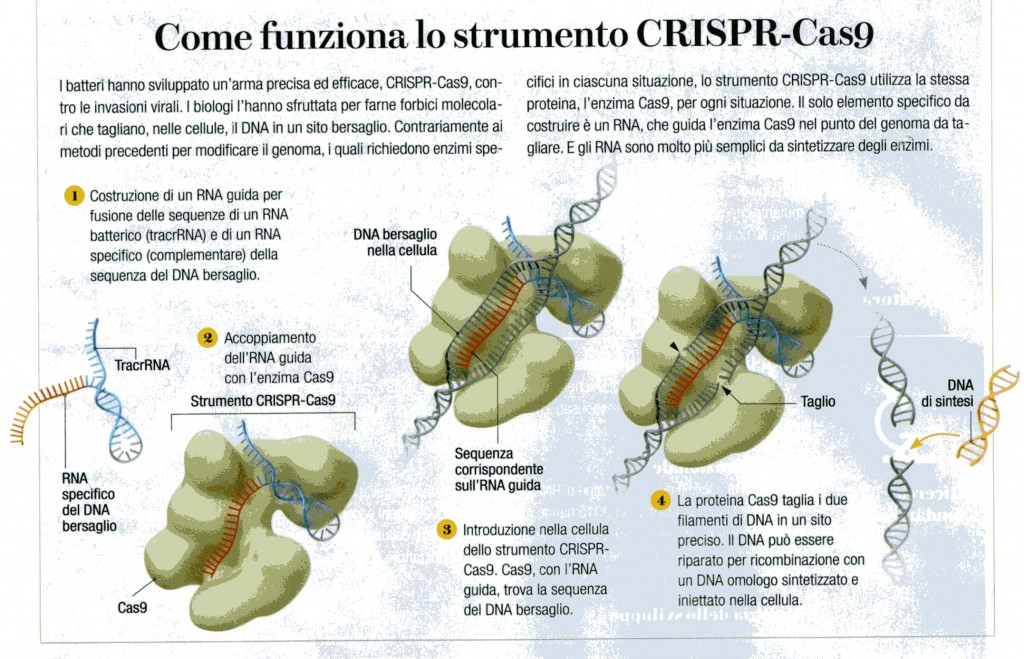
Естественно, это подтолкнуло развитие биотехнологий и промышленности. Появились тысячи компаний, которые пытаются коммерциализировать CRISPR. Параллельно идет патентная война между MIT и Университетом Беркли, где работает Дженнифер Даудна.
Применение CRISPR-Cas9
Что можно сделать с помощью CRISPR? Можно сломать, починить, заменить практически любой ген в геноме. Факт: биологи любят ломать гены, чтобы выяснить, как они работают.
Можно сделать хромосомную перестройку. Это очень важно в онкологии, где ряд заболеваний вызывают хромосомные перестройки.
На следующем этапе технологию улучшили, лишив Cas-нуклеазу активности — сделали ее не режущей. Одновременно «пристегнули» к ней другие ферменты. В итоге она просто садится на строго определенный фрагмент ДНК и может его редактировать, не вызывая повреждений. Например, менять азотистые основания без внесения разрывов в ДНК, что очень важно для биомедицинских задач.
Ученые уже научились активировать или репрессировать работу гена — редактировать эпигеном. Известно, что некоторые гены в организме метилированные, кроме того, существуют специальные белки — гистоны, которые связаны с ДНК. Все это определяет, как ведет себя клетка. CRISPR позволяет влиять и на это.
Известно, что некоторые гены в организме метилированные, кроме того, существуют специальные белки — гистоны, которые связаны с ДНК. Все это определяет, как ведет себя клетка. CRISPR позволяет влиять и на это.
При помощи CRISPR можно производить высокоточную микроскопию участков генома. Это создает огромные возможности для изучения и настоящий взрыв технологий, который до 2012 года невозможно было себе представить.
Редактируем коров, собак и помидоры
Для чего еще используется подобное редактирование? Например, пятна у породы коров сделали из черно-белых серо-белыми. Считается, что так они лучше переносят жару.
Собакам породы бигль добавили мышц. Практический смысл этой, несомненно, большой работы мне неясен. Но работу выполняли китайцы. Возможно, у них свое представление о прекрасном.
Человеческих органов для пересадки всегда не хватает, поэтому пересаживают органы свиней. Но тут есть проблема: у них в геноме присутствует много спящих ретровирусов, которые после пересадки могут активироваться и угрожать здоровью пациента. У свинок на фото эти фрагменты в геноме инактивировали.
У свинок на фото эти фрагменты в геноме инактивировали.
Еще пример: с помощью CRISPR отредактировали количество ветвлений на томатной ветке. А также размеры плодов. Все это на фото выше.
Отредактированных растений уже очень много. О масштабах можно судить по количеству публикаций в научных журналах.
Теперь вы знаете, откуда на Aliexpress семена синей клубники, черных помидоров и арбузов размером со сливу
Но в магазинах (по крайней мере в Европе) CRISPR-модифицированных продуктов нет. Это связано исключительно с осторожностью регулятора, на мой взгляд, излишней.
Раньше генетически модифицированные продукты в Европе запрещали, потому что не знали, что произойдет, если эти модифицированные растения попадут в дикую природу. Может быть, если генно-модифицированная кукуруза «ворвется» в леса, там вымрут все березы. Также не знали, как они повлияют на здоровье человека в долгосрочной перспективе, потому что при модификации использовали генетические элементы из других организмов.
CRISPR позволяет вносить мутации, не оставляя следов, поскольку внедряемые РНК и белок в клетке деградируют. От них ничего не остается, сохраняется только сама мутация. Фактически CRISPR делает то же самое, что происходит при селекции. Несмотря на это, суперосторожные регуляторы решили, что разрешать CRISPR пока не стоит.
Я, как ученый, считаю, что нужно разрешать, и тогда нас ждет настоящий взрыв технологического развития. С помощью CRISPR мы сможем решить очень многие проблемы, в том числе связанные с глобальным потеплением.
Например, вывести засухоустойчивые или более продуктивные сорта растений, которые позволят использовать меньше пахотных земель, не применять пестициды или удобрения.
CRISPR в биомедицине
Самый волнующий вопрос — применение CRISPR в биомедицинских исследованиях для улучшения жизни больных людей (а может, и здоровых — в перспективе). Главная сложность тут — в доставке «генетических ножниц» в клетки человека. Допустим, нам нужно починить неработающий ген, который вызывает болезнь.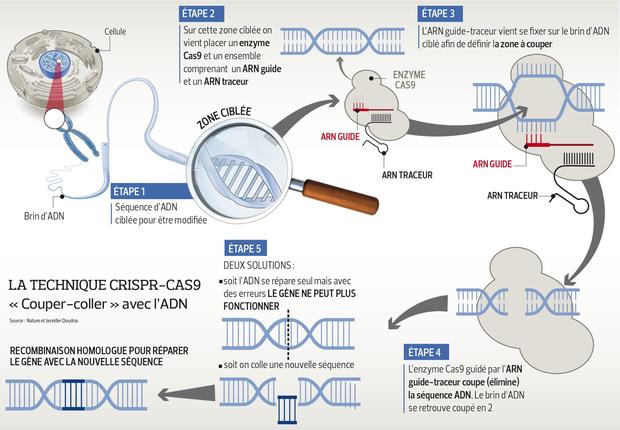 Но чинить его надо в целом органе или даже во всем теле.
Но чинить его надо в целом органе или даже во всем теле.
К примеру, мутацию, вызывающую диабет, надо чинить во всей поджелудочной железе. Это непросто, потому что клетки прекрасно себя защищают от вторжения чужеродной ДНК. Поэтому исследователи начали с тех вещей, которые можно из человека вынуть, отредактировать в пробирке, затем размножить и вернуть обратно, — с костного мозга и крови.
Здесь показано, как с помощью CRISPR лечат бета-талассемию и серповидноклеточную анемию.
Эти болезни вызваны двумя разными мутациями в гене бета-гемоглобина.
Больным бета-талассемией нужны частые переливания крови. У больных серповидноклеточной анемией эритроциты забивают сосуды. Качество жизни у них низкое, и есть риск ранней смерти.
Что в такой ситуации позволяет сделать CRISPR? У человека есть третий ген гемоглобина — фетальный гемоглобин, который активен только у эмбрионов до рождения. После рождения он выключается, работают взрослые альфа- и бета-гемоглобины. CRISPR позволяет включить ген фетального гемоглобина — выключив ген, который его контролирует.
CRISPR позволяет включить ген фетального гемоглобина — выключив ген, который его контролирует.
У двух больных женщин забрали клетки костного мозга и при помощи вируса внедрили в них CRISPR-конструкцию, которая инактивировала ген BCL11A. В этих клетках заработал фетальный гемоглобин. Правильно отредактированные, отселектированные и размноженные клетки вернули пациентам обратно — пересадили им их же костный мозг. После этого пациентке с бета-талассемией, которой нужно было в среднем 16 переливаний крови в год, в течение года не понадобилось ни одной процедуры. То же произошло и с больной серповидноклеточной анемией — их реально вылечили.
Эти работы перешли на следующую стадию клинических испытаний — в ближайшее время этот метод может войти в повсеместную практику.
Следующее направление работы — терапия ВИЧ. Есть люди, которые не заражаются вирусом иммунодефицита человека за счет мутации в гене CCR5 — делеции в 32 нуклеотида. Если у человека обе копии гена мутированы, вирус просто не может проникнуть в их клетки.
У части пациентов на фоне ВИЧ развивается лимфобластный лейкоз (рак крови). Если другие методы терапии не помогают, больным лимфобластным лейкозом часто пересаживают костный мозг. В этом случае взяли костный мозг у донора, который подходил для лечения лейкемии.
Перед пересадкой клетки отредактировали с помощью CRISPR, выключив в них ген CCR5, — повторили мутацию, которая существует в природе. Пересадка вылечила пациента и от лейкоза, и от ВИЧ.
На мой взгляд, это одна из самых ярких демонстраций возможностей CRISPR.
CRISPR и этика
Говоря о ВИЧ, нельзя не вспомнить о самом нашумевшем случае использования CRISPR. Это история 2018 года. Виновник событий — Цзянькуй Хэ, китайский ученый, который провел эксперимент с редактированием человеческих эмбрионов.
За редактирование ДНК человека Цзянькуй Хэ получил три года тюрьмы
Он занимается ЭКО. Получив эмбрионы от пар, где отцы были инфицированы ВИЧ, он попытался с помощью CRISPR выключить в них ген CCR5. В результате эксперимента родилось трое внешне здоровых детей.
В результате эксперимента родилось трое внешне здоровых детей.
Однако произошло лишь частичное редактирование. У одной девочки первая копия гена получилась с 15-нуклеотидной делецией, чего оказалось недостаточно, чтобы ген перестал функционировать. А вторая копия гена — без изменений. В итоге никакой защиты девочка не получила. Со второй девочкой получилось лучше, но ген все равно остался частично функциональным.
Проблема этого эксперимента — в нарушении этических норм и законов. Как выяснилось, Цзянькуй Хэ фальсифицировал разрешение этической комиссии, которая не одобрила это исследование. Во всех странах у нормальных ученых это означает полный запрет, но он его проигнорировал. Кроме того, эксперимент был плохо подготовлен, исследователь не взвесил возможные риски. Редактирование толком не получилось, а последствия этих экспериментов могут проявить себя позже. CRISPR не обладает стопроцентной точностью, он может вносить мутации где-то еще в геноме. И где он их внесет, предсказать сложно.
Если бы все дети с ВИЧ умирали, это меняло бы дело. Но с современными препаратами ВИЧ-инфицированные матери рожают ВИЧ-негативных детей более чем в 90% случаев. Поэтому эксперимент был еще и бессмысленный.
Ни один ученый в мире не сомневался, что технически метод CRISPR позволяет редактировать эмбрионы, то есть научной новизны в этом эксперименте тоже не было. Но это надо было делать с соблюдением всех норм и другим уровнем подготовки. А главное, технология еще недостаточно созрела, чтобы со стопроцентной гарантией отредактировать только нужное место в геноме и ничего не сломать в остальных.
Гражданин Хэ подорвал веру в ученых, получив вал критики, почти полмиллиона долларов штрафа и три года лишения свободы.
Я думаю, до широкой практики редактирования человеческих эмбрионов нам далеко. Но, безусловно, когда-то мы к этому придем, и при помощи CRISPR будут лечить тяжелые наследственные заболевания.
Кому сейчас доступен CRISPR
Поработать с CRISPR могут «не только лишь все»©. В интернете за небольшие деньги можно купить набор, где есть все необходимое.
В интернете за небольшие деньги можно купить набор, где есть все необходимое.
Некоторые экспериментируют прямо на собственной кухне
Если у вас есть мало-мальски оборудованная лаборатория для простейших молекулярно-биологических экспериментов, начать работать с CRISPR будет легко. И это действительно фантастический инструмент, который невероятно ускорил прогресс биомедицинской науки.
Вся эта история учит нас тому, что даже ковыряясь — буквально — в грязи, можно сделать невероятные открытия. Ну и еще тому, что наука интернациональна.
Нет никакой российской науки, немецкой науки, есть интернациональная наука.
Та же Эммануэль Шарпантье работала сначала в Нью-Йорке, потом в Мемфисе, в Вене, в Швеции, в Ганновере, а прямо сейчас работает в Берлине. Поэтому задача ученого — знать хотя бы один международный язык и пытаться развивать собственную мобильность — двигаться, искать связи и сотрудников, новых коллег. Шарпантье и Даудна встретились на конференции, заинтересовались общей проблемой и в итоге получили Нобелевскую премию. Кто знает, как бы сложилась история CRISPR, не будь этой встречи.
Кто знает, как бы сложилась история CRISPR, не будь этой встречи.
Технология CRISPR в иммунотерапии
Как правило, генетически скомпрометированные клетки, которым удается избежать контрольных точек пролиферации, идентифицируются и уничтожаются иммунной системой. Когда работа этой системы нарушается или ее удается обойти, онкогенные клетки выживают и размножаются, что приводит к развитию рака. Иммунотерапия – это научное направление, изучающее взаимодействие между иммунной системой и раковыми клетками с целью использования и улучшения естественных иммунных механизмов для борьбы с онкологическими заболеваниями.
В настоящее время методы иммунотерапии можно условно разделить на три широкие категории: методы на основе клеток, на основе сигнальных путей рецепторов и на основе препаратов. Методы на основе клеток, такие как адаптивный перенос клеток, направлены на повышение эффективности иммунной системы. Этого можно достичь путем усиления функционирования иммунных клеток, обеспечения более точной избирательности или просто путем увеличения количества необработанных клеток. С другой стороны, методы на основе сигнальных путей рецепторов используют экзогенные агенты, нарушающие работу механизмов, способствующих выживанию раковых клеток. Например, раковые клетки могут инактивировать Т-лимфоциты путем связывания PD-1/PD-L1, тем самым уклоняясь от иммунного обнаружения и иммуно-опосредованного уничтожения. Ингибиторы контрольных точек представляют собой молекулы, специально разработанные для противодействия этому взаимодействию и, таким образом, сохранения функции иммунных клеток. Наконец, методы на основе препаратов, в частности, антител, непосредственно используют наведение цитотоксического заряда на раковые клетки. Эти препараты разработаны таким образом, чтобы взаимодействовать только с раковыми клетками и не доставлять свой смертоносный груз к здоровым клеткам организма.
С другой стороны, методы на основе сигнальных путей рецепторов используют экзогенные агенты, нарушающие работу механизмов, способствующих выживанию раковых клеток. Например, раковые клетки могут инактивировать Т-лимфоциты путем связывания PD-1/PD-L1, тем самым уклоняясь от иммунного обнаружения и иммуно-опосредованного уничтожения. Ингибиторы контрольных точек представляют собой молекулы, специально разработанные для противодействия этому взаимодействию и, таким образом, сохранения функции иммунных клеток. Наконец, методы на основе препаратов, в частности, антител, непосредственно используют наведение цитотоксического заряда на раковые клетки. Эти препараты разработаны таким образом, чтобы взаимодействовать только с раковыми клетками и не доставлять свой смертоносный груз к здоровым клеткам организма.
Генетическая инженерия также может быть важным и ценным компонентом во всех этих подходах. Модификация генов, например, может использоваться для изменения уровней экспрессии рецепторов, стимулирования выработки определенных молекул или даже изменения клеточных фенотипов.
Открытие системы CRISPR-Cas произвело революцию в генной инженерии. Системы CRISPR (кластерные короткие палиндромные повторы, разделённые регулярными промежутками) рассекают двухспиральную ДНК, запуская механизм восстановления генома, который может инактивировать определенный ген, вводя в месте рассечения мутации по типу инсерция/делеция. Однако истинная польза от технологии CRISPR заключается в том, что место рассечения может быть точно указано с помощью направляющей РНК, что позволяет ученым инактивировать именно те гены, которые нужно. Кроме того, ученые могут вводить шаблонные последовательности для вставки в месте рассечения и проводить с помощью технологии CRISPR эксперименты по потере и усилению функциональности.
Естественно, что модификация генов с помощью CRISPR обладает огромным потенциалом для исследований в области иммунотерапии Она позволяет отсортировывать большие области и идентифицировать ключевые для функционирования иммунной системы и проявления противораковой активности гены. Технология CRISPR может обеспечить получение специализированных искусственных клеток, таких как CAR-T-лимфоциты с большей эффективностью, чем традиционные методы трансфекции и трансдукции. Система CRISPR может даже использоваться непосредственно в иммунотерапевтических методах лечения. Она может изменять раковые клетки и предотвращать уклонение от иммунной системы, инактивируя гены, ответственные за кодирование рецепторов иммунного уклонения, или даже убивать раковые клетки напрямую, инактивируя гены, необходимые для деления клеток.
Технология CRISPR может обеспечить получение специализированных искусственных клеток, таких как CAR-T-лимфоциты с большей эффективностью, чем традиционные методы трансфекции и трансдукции. Система CRISPR может даже использоваться непосредственно в иммунотерапевтических методах лечения. Она может изменять раковые клетки и предотвращать уклонение от иммунной системы, инактивируя гены, ответственные за кодирование рецепторов иммунного уклонения, или даже убивать раковые клетки напрямую, инактивируя гены, необходимые для деления клеток.
Учитывая относительную новизну самой технологии CRISPR, неудивительно, что исследования по борьбе с раковыми заболеваниями, проводимые с ее помощью, все еще находятся в зачаточном состоянии. Тем не менее, редактирование гена с использованием CRISPR дает исключительные возможности для разработки более мощных, более эффективных и менее инвазивных методов борьбы с раком.
Для получения дополнительной информации о том, как технологию CRISPR можно использовать в иммунотерапии, смотрите короткий видеосюжет ниже.
-
Иммунотерапия-
Об иммунотерапии
-
О вирусных векторах
-
Future of Pediatric
-
Manufacturing Processes for Engineered T-Cell Therapy – CAR-T
-
Исследования в иммунотерапии: Оборудование
-
Immunotherapy Shows Renewed Promise for Cancer Therapies
-
Characterizing Viral Vectors: Analyzing rAAV Vector Homogeneity
-
Developing and Producing Viral Vectors: Powering Forward Momentum for the Future of Gene Therapy
-
Хотите задать вопрос эксперту? Заполните форму ниже
CRISPR «для чайников»: краткий путеводитель по главной биотехнологии
Сергей КоленовФото: Jennifer Doudna / UC Berkeley
CRISPR — одна из самых перспективных технологий последних лет, и в ближайшие годы ее роль будет только расти. Однако далеко не все понимают, как именно работает генное редактирование. Издание Vox представило простой справочник, который поможет разобраться в CRISPR даже человеку, далекому от биологии.
Однако далеко не все понимают, как именно работает генное редактирование. Издание Vox представило простой справочник, который поможет разобраться в CRISPR даже человеку, далекому от биологии.
Говоря вкратце, CRISPR — точнее, CRISPR/Cas9 — мощный инструмент редактирования геномов. Он основан на элементе защитной системы бактерий, который биологи приспособили для внесения изменений в ДНК растений, животных и даже людей. Технология позволяет внести поправки всего за несколько дней, а не недель или месяцев. Никогда прежде у человечества не было столь точного орудия для манипуляции генами.
История CRISPR началась в 1987 году, когда японские ученые, изучавшие кишечную палочку Escherichia coli, обнаружили в ее ДНК необычные повторяющиеся последовательности. Их биологическое значение выяснить не удалось, однако вскоре аналогичные фрагменты были найдены в геноме других бактерий и архей. Последовательности получили название CRISPR — короткие палиндромные повторы, регулярно расположенные группами (Clustered Regular Interspaced Short Palindromic Repeats).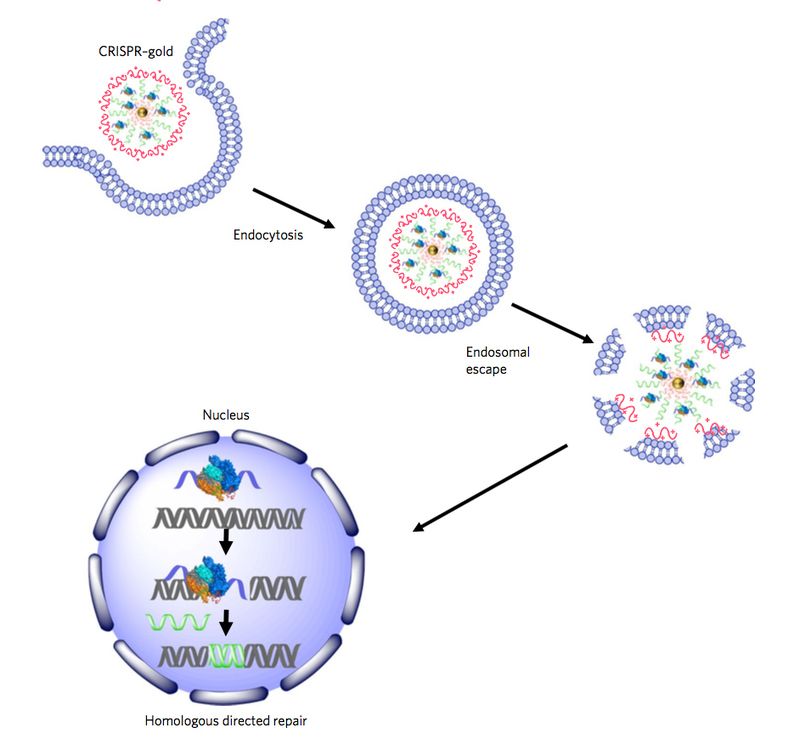
Их функция оставалась загадкой до 2007 года, когда специалисты по бактерии Streptococcus, которая используется для приготовления кисломолочных продуктов, определили: эти фрагменты — часть иммунной системы бактерий.
Дело в том, что бактерии постоянно должны отражать атаки вирусов — своих естественных врагов. Для этого они производят специальные ферменты. Каждый раз, когда бактерии удается убить вирус, она разрезает остатки его генетического материала и сохраняет их внутри последовательностей CRISPR. Затем эта информация используется в случае новой вирусной атаки. При нападении бактерия производит белки Cas9, которые несут фрагмент генетического материала вируса. Если этот участок и ДНК атакующего вируса совпадают, Cas9 разрезает генетический материал последнего и нейтрализует угрозу.
Некоторое время это открытие было интересно только микробиологам. Однако все изменилось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье решили точнее изучить механизм CRISPR. Они обнаружили, что белок Cas9 можно обмануть, дав ему искусственную РНК. Белок, несущий такую РНК, будет искать генетические фрагменты, совпадающие с тем, что он несет на себе. Обнаружив соответствие с чужой ДНК, он начнет измельчать ее, независимо от того, кому она принадлежит — вирусу, растению или животному. Как отметили в статье 2012 года Дудна и Шарпантье, этот механизм можно использовать для разрезания любого генома в нужном месте.
Они обнаружили, что белок Cas9 можно обмануть, дав ему искусственную РНК. Белок, несущий такую РНК, будет искать генетические фрагменты, совпадающие с тем, что он несет на себе. Обнаружив соответствие с чужой ДНК, он начнет измельчать ее, независимо от того, кому она принадлежит — вирусу, растению или животному. Как отметили в статье 2012 года Дудна и Шарпантье, этот механизм можно использовать для разрезания любого генома в нужном месте.
В феврале 2013 года было доказано, что CRISPR/Cas9 можно использовать для редактирования ДНК в культуре клеток мышей и человека. Более того. выяснилось, что технология позволяет не только удалять ненужные гены, но и вставлять на их место другие. Для этого достаточно добавить ферменты, восстанавливающие ДНК.
Ученые быстро поняли огромные перспективы CRISPR. Если в 2011 году было опубликовано всего 100 работ о ней, то к 2017 году эта цифра достигла более 14 000.
Помимо прочего, в них описывались аналоги белков Cas9. Например, Cas13 может редактировать не ДНК, а РНК.
Идея генной модификации не нова, и различные ее методики существуют уже много лет. Однако CRISPR превосходит все известные до сих пор технологии благодаря доступности и точности. Редактирование одного гена обойдется всего в $75 и займет несколько часов. И, что немаловажно, технология работает с любым организмом на Земле.
Существует почти бесконечное множество потенциальных применений технологии. Во-первых, CRISPR позволяет ученым выяснить функцию различных генов. Достаточно просто вырезать изучаемый ген из ДНК и увидеть, какие функции организма оказались затронуты. Однако общественность намного сильнее интересуют практические применения. Их можно разделить на несколько пунктов:
1) Изменения в сельском хозяйстве
CRISPR позволяет сделать сельскохозяйственные культуры более питательными, более вкусными и устойчивыми к жаре и стрессу. Можно придать растениям и другие свойства: например, вырезать из арахиса ген аллергена, а в бананы внедрить устойчивость к смертельному грибку.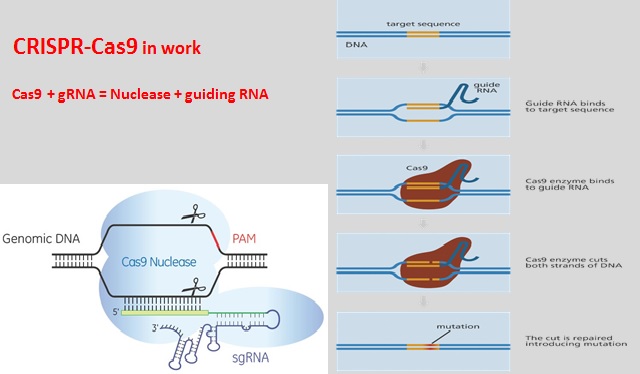 Технологию можно применить и для редактирования генома домашних животных — например, коров.
Технологию можно применить и для редактирования генома домашних животных — например, коров.
2) Борьба с наследственными заболеваниями
Ученые намерены использовать CRISPR, чтобы вырезать из человеческого генома мутации, ответственные за целый ряд заболеваний, например, серповидноклеточную анемию. Технология также позволят вырезать гены хореи Хантингтона или мутаций BRCA-1 и 2, связанных с раком молочной железы и яичников. Теоретически CRISPR-атака даже может остановить развитие ВИЧ.
Однако специалистам предстоит убедиться в безопасности методики, прежде чем ее начнут применять в больницах. Ферменты Cas9 иногда ошибаются и редактируют ДНК в неожиданных местах, что может вызвать серьезные последствия для здоровья.
3) Новые антибиотики и противовирусные препараты
Бактерии развивают устойчивость к антибиотикам, а разрабатывать новые дорого и сложно. Технология CRISPR дает возможность с высокой точностью уничтожать опредленные виды бактерий, хотя конкретную методику еще предстоит разработать. Ряд исследователей также работает над CRISPR-системами, нацеленными на вирусы.
Ряд исследователей также работает над CRISPR-системами, нацеленными на вирусы.
4) Генетический драйв
С помощью CRISPR можно изменить не просто геном отдельного животного и растения, но и генофонд целого вида. Эта концепция известна как «генетический драйв». Обычно любой организм передает потомству половину своих генов. Однако использование CRISPR позволяет повысить вероятность передачи генов по наследству почти до 100%. Это позволит нужному признаку быстро распространиться по всей популяции.
Используя эту технологию, можно, например, модифицировать комаров так, чтобы в их популяции рождались только самки. Через какое-то время популяция исчезнет.
В более щадящем варианте можно сделать комаров устойчивыми к заражению малярийным плазмодием. Они не смогут передавать паразита людям, и малярии будет положен конец. Однако для осуществления таких проектов нужно преодолеть сомнения скептиков, которые протестуют против столь масштабного вторжения в природу.
5) Создание «дизайнерских младенцев»
Этот пункт привлекает больше всего общественного внимания. Однако, по словам ученых, пока наши технологические возможности не позволяют создавать детей с заданными качествами. Например, за уровень интеллекта отвечают тысячи генов, и скорректировать их всех пока невозможно. Возможно, в будущем технологии достигнут нужного уровня, но пока беспокоиться не о чем.
Не все ученые считают CRISPR безопасной технологией. Например, согласно недавним исследованиям, генное редактирование может вызвать обширные нецелевые мутации. Авторы другой работы отмечают, что CRISPR ошибается в 15% случаев.
Системы CRISPR-Cas для редактирования, регулирования и нацеливания геномов
Кэрролл, Д. Инженерия генома с помощью нуклеаз с цинковыми пальцами. Генетика 188 , 773–782 (2011).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Wiedenheft, B.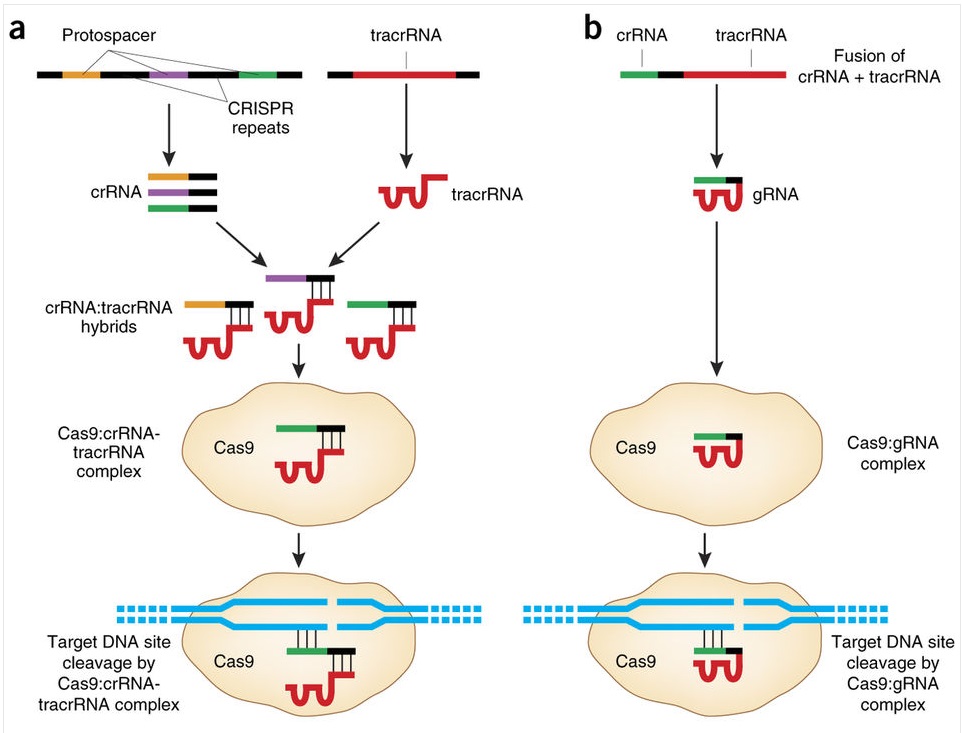 , Sternberg, S.H. и Дудна, Дж.А. Системы генетического молчания, управляемые РНК, у бактерий и архей. Природа 482 , 331–338 (2012).
, Sternberg, S.H. и Дудна, Дж.А. Системы генетического молчания, управляемые РНК, у бактерий и архей. Природа 482 , 331–338 (2012).
КАС
Статья
пабмед
Google ученый
Финеран, П.К. и Шарпантье, Э. Память о вирусных инфекциях с помощью адаптивных иммунных систем CRISPR-Cas: получение новой информации. Вирусология 434 , 202–209 (2012).
Артикул
КАС
пабмед
Google ученый
Horvath, P. & Barrangou, R. CRISPR/Cas, иммунная система бактерий и архей. Наука 327 , 167–170 (2010).
Артикул
КАС
пабмед
Google ученый
Barrangou, R. et al. CRISPR обеспечивает приобретенную устойчивость к вирусам у прокариот. Наука 315 , 1709–1712 (2007).
Артикул
КАС
пабмед
Google ученый
Делчева Е. и др. Созревание РНК CRISPR с помощью транскодируемой малой РНК и фактора хозяина РНКазы III. Природа 471 , 602–607 (2011).
и др. Созревание РНК CRISPR с помощью транскодируемой малой РНК и фактора хозяина РНКазы III. Природа 471 , 602–607 (2011).
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Джинек, М. и др. Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете. Наука 337 , 816–821 (2012).
КАС
пабмед
ПабМед Центральный
Google ученый
Jiang, W., Bikard, D., Cox, D., Zhang, F. & Marraffini, L.A. Редактирование геномов бактерий под контролем РНК с использованием систем CRISPR-Cas. Нац. Биотехнолог. 31 , 233–239 (2013).
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Паттанаяк, В. и др. Высокопроизводительное профилирование нецелевого расщепления ДНК выявляет специфичность запрограммированной РНК нуклеазы Cas9. Нац. Биотехнолог. 31 , 839–843 (2013).
Нац. Биотехнолог. 31 , 839–843 (2013).
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Эсвельт, К.М. и другие. Ортогональные белки Cas9 для регуляции и редактирования генов с помощью РНК. Нац. Методы 10 , 1116–1121 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Хоу З. и др. Эффективная инженерия генома в плюрипотентных стволовых клетках человека с использованием Cas9 из Neisseria meningitidis. Проц. Натл. акад. науч. США 110 , 15644–15649(2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Gasiunas, G., Barrangou, R., Horvath, P. & Siksnys, V. Комплекс рибонуклеопротеина Cas9-crRNA опосредует специфическое расщепление ДНК для адаптивного иммунитета у бактерий. Проц. Натл. акад. науч. США 109 , E2579–E2586 (2012 г.).
Проц. Натл. акад. науч. США 109 , E2579–E2586 (2012 г.).
Артикул
пабмед
ПабМед Центральный
Google ученый
Мали, П. и др. Инженерия генома человека с помощью РНК с помощью Cas9. Наука 339 , 823–826 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Конг Л. и др. Мультиплексная инженерия генома с использованием систем CRISPR/Cas. Наука 339 , 819–823 (2013).
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Джинек, М. и др. РНК-программированное редактирование генома в клетках человека. Elife 2 , e00471 (2013).
Артикул
пабмед
ПабМед Центральный
Google ученый
Чо С.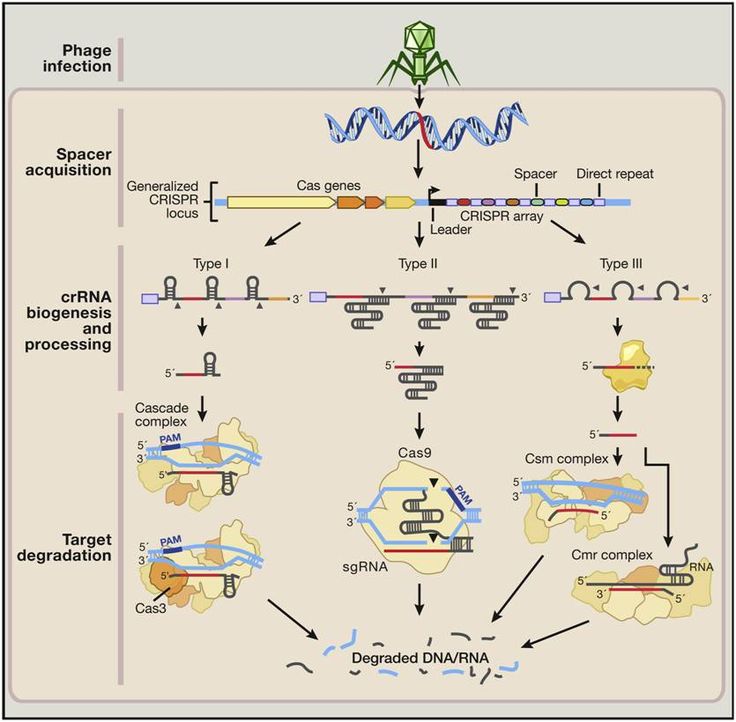 В., Ким С., Ким Дж.М. и Ким Дж.С. Целевая инженерия генома в клетках человека с эндонуклеазой, управляемой РНК Cas9. Нац. Биотехнолог. 31 , 230–232 (2013).
В., Ким С., Ким Дж.М. и Ким Дж.С. Целевая инженерия генома в клетках человека с эндонуклеазой, управляемой РНК Cas9. Нац. Биотехнолог. 31 , 230–232 (2013).
Артикул
КАС
пабмед
Google ученый
Хванг, В.Ю. и другие. Эффективное редактирование генома у рыбок данио с использованием системы CRISPR-Cas. Нац. Биотехнолог. 31 , 227–229 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
ДиКарло, Дж. Э. и др. Геномная инженерия Saccharomyces cerevisiae с использованием систем CRISPR-Cas. Рез. нуклеиновых кислот. 41 , 4336–4343 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ли, Дж. Ф. и др. Редактирование генома, опосредованное мультиплексной и гомологичной рекомбинацией, у Arabidopsis и Nicotiana benthamiana с использованием направляющей РНК и Cas9. Нац. Биотехнолог. 31 , 688–691 (2013).
Нац. Биотехнолог. 31 , 688–691 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Некрасов В., Стаскавич Б., Вейгель Д., Джонс Дж. Д. и Камун С. Направленный мутагенез в модельном растении Nicotiana benthamiana с использованием эндонуклеазы, управляемой РНК Cas9. Нац. Биотехнолог. 31 , 691–693 (2013).
Артикул
КАС
пабмед
Google ученый
Шан, К. и др. Направленная модификация генома сельскохозяйственных растений с использованием системы CRISPR-Cas. Нац. Биотехнолог. 31 , 686–688 (2013).
Артикул
КАС
пабмед
Google ученый
Xie, K. & Yang, Y. Редактирование генома растений под управлением РНК с использованием системы CRISPR-Cas. Мол. Завод 6 , 1975–1983 (2013).
Артикул
КАС
пабмед
Google ученый
Jiang, W. et al. Демонстрация целевой модификации гена, опосредованной CRISPR/Cas9/sgRNA, у Arabidopsis , табак, сорго и рис. Рез. нуклеиновых кислот. 41 , e188 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Wang, H. et al. Одноэтапное создание мышей, несущих мутации в нескольких генах, с помощью CRISPR/Cas-опосредованной инженерии генома. Cell 153 , 910–918 (2013).
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Шен Б. и др. Создание генно-модифицированных мышей с помощью Cas9/РНК-опосредованного нацеливания на гены. Сотовые Res. 23 , 720–723 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ли, Д. и др. Нацеливание на наследственные гены у мышей и крыс с использованием системы CRISPR-Cas. Нац. Биотехнолог. 31 , 681–683 (2013).
и др. Нацеливание на наследственные гены у мышей и крыс с использованием системы CRISPR-Cas. Нац. Биотехнолог. 31 , 681–683 (2013).
Артикул
КАС
пабмед
Google ученый
Ян Д. и др. Эффективное нацеливание на гены у кроликов с использованием нуклеаз Cas9, управляемых РНК. Дж. Мол. Клеточная биол. 10.1093/jmcb/mjt047 (8 января 2014 г.).
Накаяма Т. и др. Простой и эффективный направленный мутагенез, опосредованный CRISPR/Cas9, у Xenopus tropicalis. Бытие 51 , 835–843 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ю. З. и др. Высокоэффективные модификации генома, опосредованные CRISPR/Cas9, у Drosophila . Генетика 195 , 289–291 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Бассет А. Р., Тиббит К., Понтинг К.П. и Лю, Дж. Л. Высокоэффективный направленный мутагенез Drosophila с помощью системы CRISPR/Cas9. Отчеты о ячейках 4 , 220–228 (2013).
Р., Тиббит К., Понтинг К.П. и Лю, Дж. Л. Высокоэффективный направленный мутагенез Drosophila с помощью системы CRISPR/Cas9. Отчеты о ячейках 4 , 220–228 (2013).
Артикул
КАС
пабмед
Google ученый
Ван Ю. и др. Система CRISPR/Cas обеспечивает эффективную инженерию генома у Bombyx mori. Сотовые Res. 23 , 1414–1416 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Friedland, A.E. et al. Наследственное редактирование генома в C. elegans через систему CRISPR-Cas9. Нац. Методы 10 , 741–743 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Сяо, А. и др. Хромосомные делеции и инверсии, опосредованные TALEN и CRISPR/Cas у рыбок данио. Рез. нуклеиновых кислот. 41 , e141 (2013).
Рез. нуклеиновых кислот. 41 , e141 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Упадхьяй, С.К., Кумар, Дж., Алок, А. и Тули, Р. Редактирование генома с помощью РНК для мутаций целевого гена в пшенице. G3 (Bethesda) 3 , 2233–2238 (2013 г.).
Артикул
КАС
Google ученый
Horii, T. et al. Геномная инженерия гаплоидных эмбриональных стволовых клеток млекопитающих с использованием системы Cas9/РНК. PeerJ 1 , e230 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ли, В., Тенг, Ф., Ли, Т. и Чжоу, К. Одновременная генерация и передача по зародышевой линии множественных генных мутаций у крыс с использованием систем CRISPR-Cas. Нац.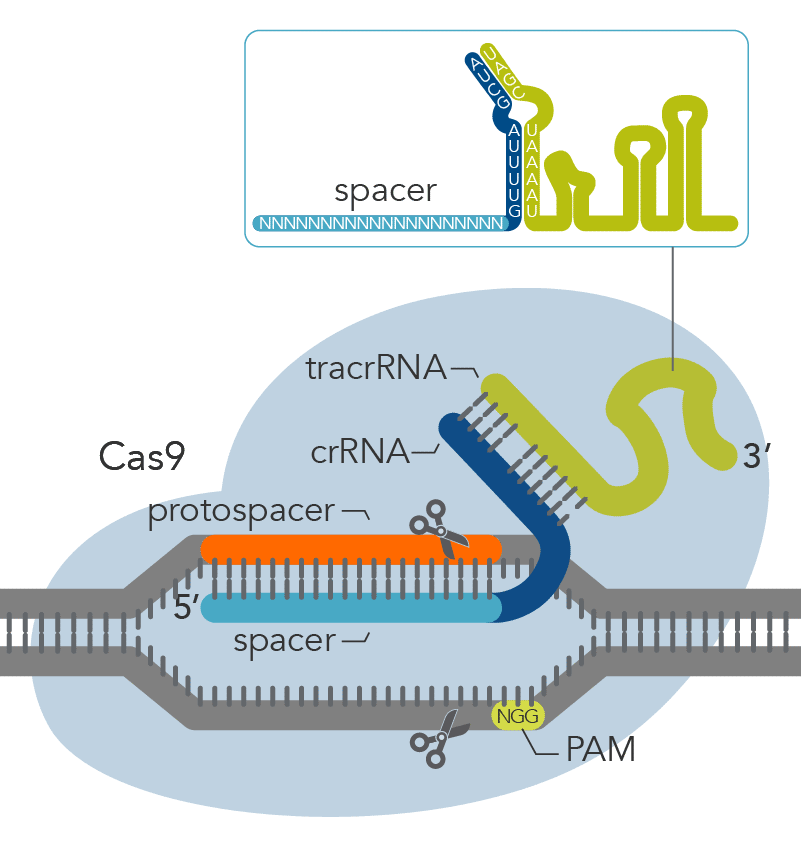 Биотехнолог. 31 , 684–686 (2013).
Биотехнолог. 31 , 684–686 (2013).
Артикул
КАС
пабмед
Google ученый
Джао, Л.Э., Венте, С.Р. & Chen, W. Эффективное мультиплексное редактирование двуаллельного генома рыбок данио с использованием нуклеазной системы CRISPR. Проц. Натл. акад. науч. США 110 , 13904–13909 (2013).
Артикул
пабмед
ПабМед Центральный
Google ученый
Ван Т., Вэй Дж.Дж., Сабатини Д.М. и Ландер, Э.С. Генетические скрининги в клетках человека с использованием системы CRISPR-Cas9. Наука 343 , 80–84 (2014).
Артикул
КАС
пабмед
Google ученый
Шалем, О. и др. CRISPR-Cas9 в масштабе геноманокаут-скрининг в клетках человека. Наука 343 , 84–87 (2014).
КАС
Статья
пабмед
Google ученый
Koike-Yusa, H. , Li, Y., Tan, EP, Velasco-Herrera, M.D.C., и Yusa, K. Полногеномный рецессивный генетический скрининг в клетках млекопитающих с использованием лентивирусной библиотеки РНК CRISPR-guide. Нац. Биотехнолог. 32 , 267–273 (2014).
, Li, Y., Tan, EP, Velasco-Herrera, M.D.C., и Yusa, K. Полногеномный рецессивный генетический скрининг в клетках млекопитающих с использованием лентивирусной библиотеки РНК CRISPR-guide. Нац. Биотехнолог. 32 , 267–273 (2014).
Артикул
КАС
пабмед
Google ученый
Хафт Д.Х., Селенгут Дж., Монгодин Э.Ф. и Нельсон К.Е. В геномах прокариот существует группа из 45 семейств CRISPR-ассоциированных (Cas) белков и несколько подтипов CRISPR/Cas. PLoS вычисл. биол. 1 , е60 (2005).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Макарова К.С., Гришин Н.В., Шабалина С.А., Вольф Ю.И. & Кунин, Е.В. Предполагаемая иммунная система прокариот, основанная на РНК-интерференции: компьютерный анализ предсказанного ферментативного механизма, функциональные аналогии с эукариотической РНКи и гипотетические механизмы действия. Биол. Директ 1 , 7 (2006).
Биол. Директ 1 , 7 (2006).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Сапранаускас Р. и др. Система Streptococcus thermophilus CRISPR/Cas обеспечивает иммунитет в Escherichia coli . Рез. нуклеиновых кислот. 39 , 9275–9282 (2011).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Рамирес, К.Л. и другие. Сконструированные никазы цинковых пальцев индуцируют направленную по гомологии репарацию с уменьшенными мутагенными эффектами. Рез. нуклеиновых кислот. 40 , 5560–5568 (2012).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Wang, J. et al. Целенаправленное добавление гена в заданный участок генома человека с использованием фермента на основе ZFN. Рез. генома. 22 , 1316–1326 (2012).
Рез. генома. 22 , 1316–1326 (2012).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Kim, E. et al. Прецизионная инженерия генома с программируемыми ферментами, разрушающими ДНК. Рез. генома. 22 , 1327–1333 (2012).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ран Ф.А. и др. Двойной разрыв с помощью CRISPR Cas9 под управлением РНКдля повышения специфичности редактирования генома. Cell 154 , 1380–1389 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Фу Ю., Сандер Д.Д., Рейон Д., Касио В.М. и Юнг, Дж.К. Улучшение специфичности нуклеазы CRISPR-Cas с использованием укороченных направляющих РНК. Нац. Биотехнолог. 10. 1038/nbt.2808 (26 января 2014 г.).
1038/nbt.2808 (26 января 2014 г.).
Мали П. и др. Активаторы транскрипции CAS9 для скрининга специфичности мишени и парные никазы для совместной инженерии генома. Нац. Биотехнолог. 31 , 833–838 (2013).
КАС
пабмед
ПабМед Центральный
Google ученый
Fu, Y. et al. Высокочастотный нецелевой мутагенез, индуцированный нуклеазами CRISPR-Cas в клетках человека. Нац. Биотехнолог. 31 , 822–826 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Хсу, П.Д. и другие. Специфичность нацеливания ДНК на РНК-управляемые нуклеазы Cas9. Нац. Биотехнолог. 31 , 827–832 (2013).
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Семенова Е. и др. Интерференция сгруппированных РНК с регулярными интервалами коротких палиндромных повторов (CRISPR) регулируется затравочной последовательностью. Проц. Натл. акад. науч. США 108 , 10098–10103 (2011 г.).
и др. Интерференция сгруппированных РНК с регулярными интервалами коротких палиндромных повторов (CRISPR) регулируется затравочной последовательностью. Проц. Натл. акад. науч. США 108 , 10098–10103 (2011 г.).
Артикул
пабмед
ПабМед Центральный
Google ученый
Wiedenheft, B. et al. РНК-управляемый комплекс из бактериальной иммунной системы усиливает распознавание мишени за счет взаимодействия последовательностей семян. Проц. Натл. акад. науч. США 108 , 10092–10097 (2011 г.).
Артикул
пабмед
ПабМед Центральный
Google ученый
Cradick, T.J., Fine, E.J., Antico, C.J. & Bao, G. CRISPR/Cas9системы, нацеленные на гены бета-глобина и CCR5, обладают значительной нецелевой активностью. Рез. нуклеиновых кислот. 41 , 9584–9592 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ран Ф. А. и др. Геномная инженерия с использованием системы CRISPR-Cas9. Нац. протокол 8 , 2281–2308 (2013).
А. и др. Геномная инженерия с использованием системы CRISPR-Cas9. Нац. протокол 8 , 2281–2308 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Чо, С.В. и другие. Анализ нецелевых эффектов CRISPR/Cas-производных РНК-управляемых эндонуклеаз и никаз. Рез. генома. 24 , 132–141 (2014).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Кузьминов А. Одноцепочечные разрывы в репликации хромосом вызывают двухцепочечные разрывы. Проц. Натл. акад. науч. США 98 , 8241–8246 (2001).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Cortes-Ledesma, F. & Aguilera, A. Двухцепочечные разрывы, возникающие в результате репликации через разрыв, восстанавливаются путем когезин-зависимого обмена сестринскими хроматидами.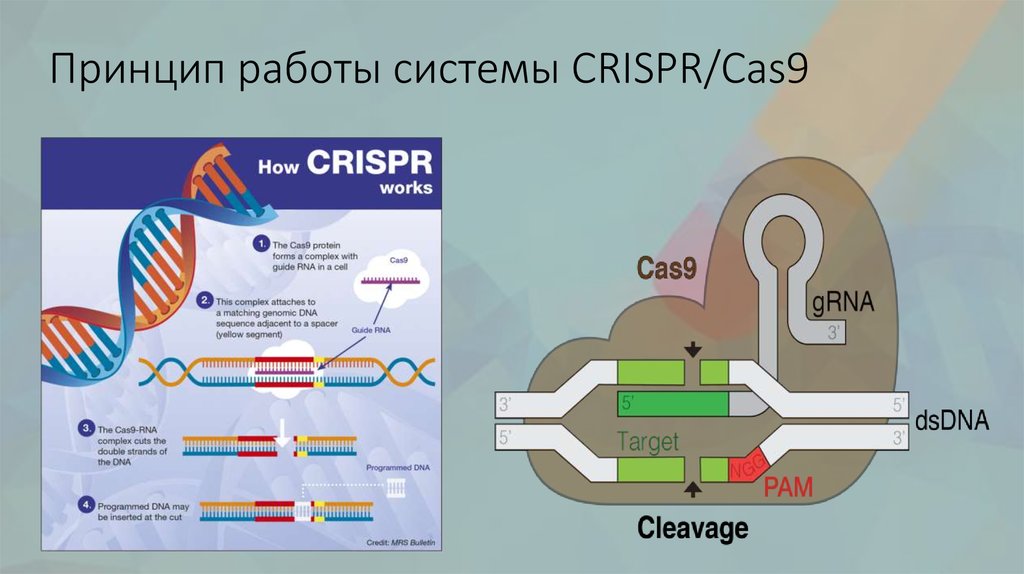 EMBO Rep. 7 , 919–926 (2006).
EMBO Rep. 7 , 919–926 (2006).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Дин, К. и др. Повышена эффективность редактирования генома плюрипотентных стволовых клеток человека за счет замены TALEN на CRISPR. Cell Stem Cell 12 , 393–394 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Хванг, В.Ю. и другие. Наследуемое и точное редактирование генома рыбок данио с использованием системы CRISPR-Cas. PLoS ONE 8 , e68708 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Грац, С.Дж. и другие. Геномная инженерия Drosophila с помощью CRISPR РНК-управляемой нуклеазы Cas9. Генетика 194 , 1029–1035 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ло, Т.В. и другие. Точное и наследуемое редактирование генома эволюционно разнообразных нематод с использованием TALEN и CRISPR/Cas9 для создания вставок и делеций. Генетика 195 , 331–348 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Waaijers, S. et al. CRISPR/Cas9-направленный мутагенез в Caenorhabditis elegans . Генетика 195 , 1187–1191 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Цур Ю.Б. и другие. Наследуемые пользовательские геномные модификации в Caenorhabditis elegans через систему CRISPR-Cas9. Генетика 195 , 1181–1185 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Katic, I. & Grosshans, H. Направленная наследуемая мутация и преобразование генов с помощью Cas9-CRISPR в Caenorhabditis elegans . Генетика 195 , 1173–1176 (2013).
& Grosshans, H. Направленная наследуемая мутация и преобразование генов с помощью Cas9-CRISPR в Caenorhabditis elegans . Генетика 195 , 1173–1176 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Чиу Х., Шварц Х.Т., Антошечкин И. и Штернберг П.В. Редактирование генома без трансгенов у Caenorhabditis elegans с использованием CRISPR-Cas. Генетика 195 , 1167–1171 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Чо, С.В., Ли, Дж., Кэрролл, Д. и Ким, Дж.С. Нокаут наследственного гена у Caenorhabditis elegans путем прямой инъекции Cas9-рибонуклеопротеины sgRNA. Генетика 195 , 1177–1180 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Гай Т. , Го Дж., Като Ю., Сирк С.Дж. и Барбас, К.Ф. III. Направленный нокаут гена путем прямой доставки белков нуклеазы цинковых пальцев. Нац. Методы 9 , 805–807 (2012).
, Го Дж., Като Ю., Сирк С.Дж. и Барбас, К.Ф. III. Направленный нокаут гена путем прямой доставки белков нуклеазы цинковых пальцев. Нац. Методы 9 , 805–807 (2012).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Бикард, Д. и др. Программируемая репрессия и активация экспрессии бактериальных генов с помощью инженерной системы CRISPR-Cas. Рез. нуклеиновых кислот. 41 , 7429–7437 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ци, Л.С. и другие. Перепрофилирование CRISPR в качестве управляемой РНК платформы для специфичного для последовательности контроля экспрессии генов. Сотовый 152 , 1173–1183 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Медер, М. Л. и другие. CRISPR РНК-управляемая активация эндогенных генов человека. Нац. Методы 10 , 977–979 (2013).
Л. и другие. CRISPR РНК-управляемая активация эндогенных генов человека. Нац. Методы 10 , 977–979 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Перес-Пинера, П. и др. Активация генов под управлением РНК с помощью CRISPR-Cas9на основе факторов транскрипции. Нац. Методы 10 , 973–976 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Konermann, S. et al. Оптический контроль эндогенной транскрипции и эпигенетических состояний млекопитающих. Природа 500 , 472–476 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ченг А.В. и другие. Мультиплексная активация эндогенных генов с помощью CRISPR-on, системы активатора транскрипции, управляемой РНК.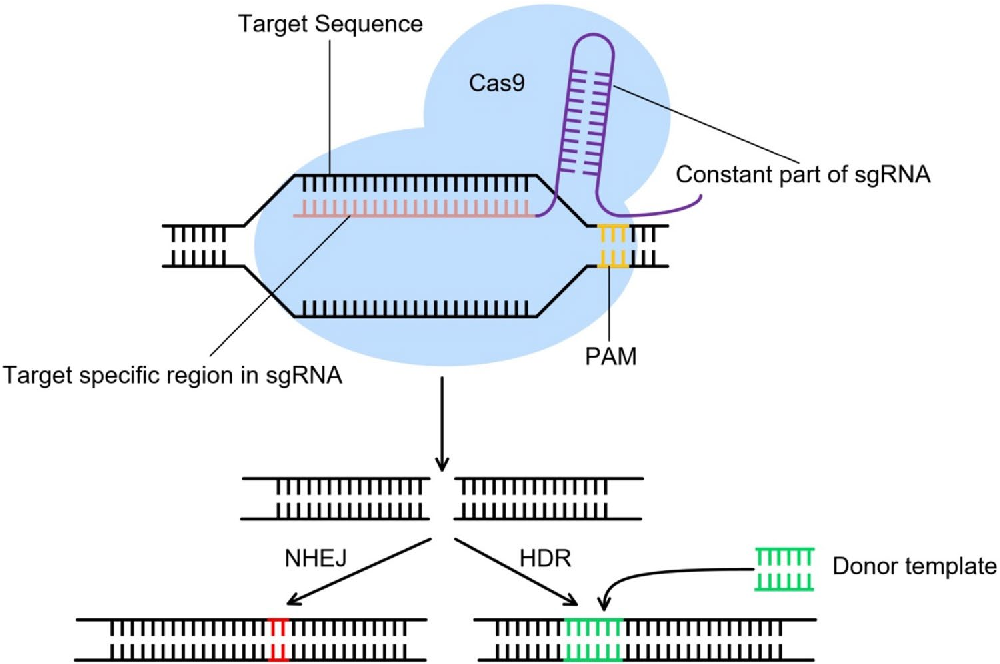 Сотовые Res. 23 , 1163–1171 (2013).
Сотовые Res. 23 , 1163–1171 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Медер, М.Л. и другие. Надежная синергетическая регуляция экспрессии генов человека с использованием активаторов TALE. Нац. Методы 10 , 243–245 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Перес-Пинера, П. и др. Синергетическая и настраиваемая активация генов человека комбинациями синтетических факторов транскрипции. Нац. Методы 10 , 239–242 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Миллер, Дж. К. и др. Нуклеазная архитектура TALE для эффективного редактирования генома. Нац. Биотехнолог. 29 , 143–148 (2011).
Артикул
КАС
пабмед
Google ученый
Чжан, Ф. и др. Эффективное конструирование специфичных к последовательности эффекторов TAL для модулирования транскрипции млекопитающих. Нац. Биотехнолог. 29 , 149–153 (2011).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Mendenhall, E.M. et al. Локус-специфическое редактирование модификаций гистонов в эндогенных энхансерах. Нац. Биотехнолог. 31 , 1133–1136 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Медер, М.Л. и другие. Направленное деметилирование ДНК и активация эндогенных генов с использованием программируемых слитых белков TALE-TET1. Нац. Биотехнолог. 31 , 1137–1142 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Чен Б. и др. Динамическая визуализация геномных локусов в живых клетках человека с помощью оптимизированной системы CRISPR/Cas. Cell 155 , 1479–1491 (2013).
и др. Динамическая визуализация геномных локусов в живых клетках человека с помощью оптимизированной системы CRISPR/Cas. Cell 155 , 1479–1491 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Gilbert, L.A. et al. CRISPR-опосредованная модульная РНК-управляемая регуляция транскрипции у эукариот. Cell 154 , 442–451 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Чилински К., Ле Рун А. и Шарпантье Э. Семейства tracrRNA и Cas9 систем иммунитета CRISPR-Cas типа II. РНК Биол. 10 , 726–737 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Эбина Х., Мисава Н., Канемура Ю. и Коянаги Ю. Использование системы CRISPR/Cas9 для разрушения латентного провируса ВИЧ-1. Научный представитель 3 , 2510 (2013).
Научный представитель 3 , 2510 (2013).
Артикул
пабмед
ПабМед Центральный
Google ученый
Чанг, Н. и др. Редактирование генома с помощью нуклеазы Cas9, управляемой РНК, у эмбрионов рыбок данио. Сотовые Res. 23 , 465–472 (2013).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Силва, Г. и др. Мегануклеазы и другие инструменты для целевой инженерии генома: перспективы и проблемы генной терапии. Курс. Джин Тер. 11 , 11–27 (2011).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Smith, J. et al. Комбинаторный подход к созданию искусственных самонаводящихся эндонуклеаз, расщепляющих выбранные последовательности. Рез. нуклеиновых кислот. 34 , e149 (2006).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Урнов Ф.Д., Ребар Э.Дж., Холмс М.К., Чжан Х.С. и Грегори, П.Д. Редактирование генома с помощью инженерных нуклеаз цинковых пальцев. Нац. Преподобный Жене. 11 , 636–646 (2010).
Артикул
КАС
пабмед
Google ученый
Вулф, С.А., Неклюдова, Л. и Пабо, К.О. Распознавание ДНК белками цинковых пальцев Cys2His2. год. Преподобный Биофиз. биомол. Структура 29 , 183–212 (2000).
Артикул
КАС
пабмед
Google ученый
Гупта, А. и др. Оптимизированный архив с двумя пальцами для ZFN-опосредованного нацеливания на гены. Нац. Методы 9 , 588–590 (2012).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Ким С. , Ли М.Дж., Ким Х., Канг М. и Ким Дж.С. Предварительно собранные массивы цинковых пальцев для быстрого создания ZFN. Нац. Методы 8 , 7 (2011).
, Ли М.Дж., Ким Х., Канг М. и Ким Дж.С. Предварительно собранные массивы цинковых пальцев для быстрого создания ZFN. Нац. Методы 8 , 7 (2011).
Артикул
КАС
пабмед
Google ученый
Медер, М.Л. и другие. Быстрая разработка индивидуальных нуклеаз с цинковыми пальцами с открытым исходным кодом для высокоэффективной модификации генов. Мол. Сотовый 31 , 294–301 (2008).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Сандер, Дж. Д. и др. Инженерия нуклеаз с цинковыми пальцами без селекции с помощью контекстно-зависимой сборки (CoDA). Нац. Методы 8 , 67–69 (2011).
Артикул
КАС
пабмед
Google ученый
Гонсалес Б. и др. Модульная система для построения библиотек цинковых пальцев и белков. Нац. протокол 5 , 791–810 (2010).
Нац. протокол 5 , 791–810 (2010).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Райт, Д.А. и другие. Стандартизированные реагенты и протоколы для разработки нуклеаз цинковых пальцев методом модульной сборки. Нац. протокол 1 , 1637–1652 (2006).
Артикул
пабмед
Google ученый
Кэрролл, Д., Мортон, Дж.Дж., Боймер, К.Дж. и Сигал, Д.Дж. Дизайн, конструирование и тестирование in vitro нуклеаз цинковых пальцев. Нац. протокол 1 , 1329–1341 (2006).
Артикул
КАС
пабмед
Google ученый
Рейон, Д. и др. FLASH-сборка TALEN для высокопроизводительного редактирования генома. Нац. Биотехнолог. 30 , 460–465 (2012).
Артикул
КАС
пабмед
ПабМед Центральный
Google ученый
Boch, J. & Bonas, U. Xanthomonas AvrBs3 эффекторы III типа семейства: открытие и функция. год. Преподобный Фитопат. 48 , 419–436 (2010).
& Bonas, U. Xanthomonas AvrBs3 эффекторы III типа семейства: открытие и функция. год. Преподобный Фитопат. 48 , 419–436 (2010).
Артикул
КАС
пабмед
Google ученый
Москва М.Дж. и Богданове А.Дж. Простой шифр управляет распознаванием ДНК эффекторами TAL. Наука 326 , 1501 (2009).
Артикул
КАС
пабмед
Google ученый
Юнг, Дж.К. & Сандер, Дж. Д. TALENs: широко применимая технология для целенаправленного редактирования генома. Нац. Преподобный Мол. Клеточная биол. 14 , 49–55 (2013).
Артикул
КАС
пабмед
Google ученый
Holkers, M. et al. Дифференциальная целостность генов нуклеаз TALE после переноса генов аденовирусных и лентивирусных векторов в клетки человека.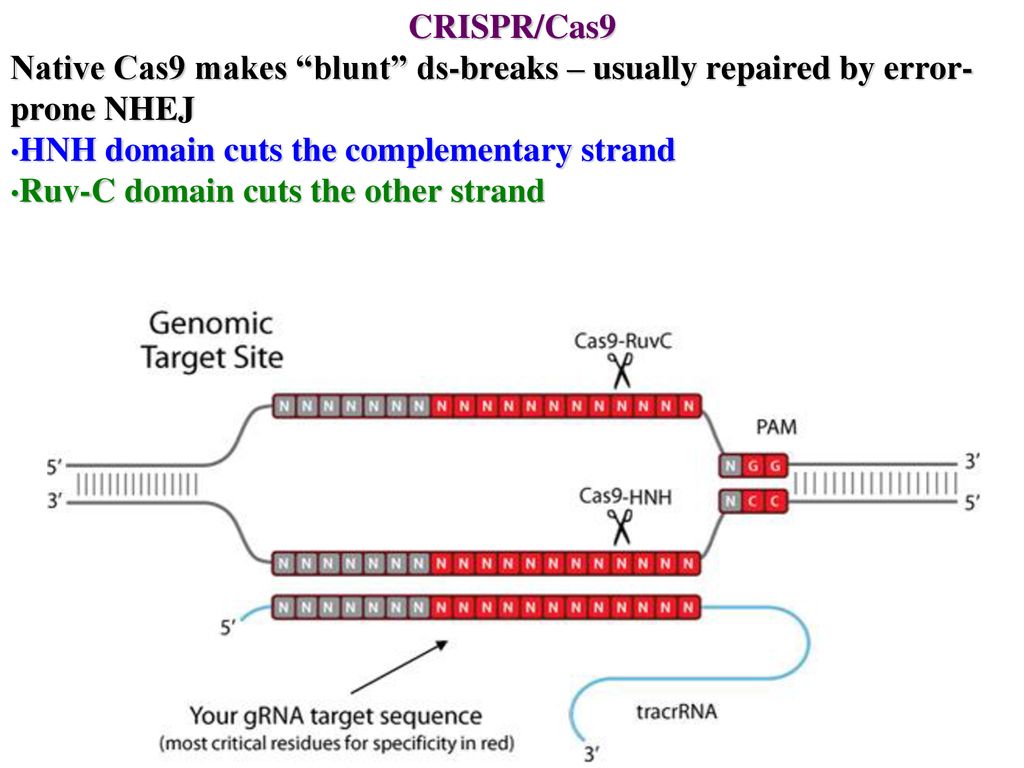 Рез. нуклеиновых кислот. 41 , е63 (2013).
Рез. нуклеиновых кислот. 41 , е63 (2013).
Артикул
КАС
пабмед
Google ученый
Инновации в селекции растений: CRISPR-Cas9 | ISAAA.org
Система CRISPR-Cas9 представляет собой инновацию в области селекции растений, в которой используются сайт-направленные нуклеазы для нацеливания и модификации ДНК с высокой точностью. 1,2 Разработанный в 2012 году учеными из Калифорнийского университета в Беркли, CRISPR-Cas9 в последние годы привлек большое внимание благодаря широкому спектру применения, включая биологические исследования, разведение и развитие сельскохозяйственных культур и животных, и приложений для здоровья человека. 1,2 К ним относятся сайленсинг генов, редактирование генов CRISPR-Cas9 без ДНК, направленная по гомологии репарация (HDR) и временное сайленсинг генов или репрессия транскрипции (CRISPRi). 1,3,4,5
Что такое CRISPR и как он работает
CRISPR, или сгруппированные регулярно расположенные короткие палиндромные повторы, является неотъемлемой частью системы защиты бактерий. Он также является основой системы CRISPR-Cas9. 1,2,3,5
Он также является основой системы CRISPR-Cas9. 1,2,3,5
Молекула CRISPR состоит из коротких палиндромных последовательностей ДНК, которые повторяются вдоль молекулы и регулярно расположены друг от друга. Между этими последовательностями находятся «спейсеры», чужеродные последовательности ДНК организмов, которые ранее атаковали бактерии. Молекула CRISPR также включает гены, ассоциированные с CRISPR, или гены Cas. Они кодируют белки, которые раскручивают ДНК и разрезают ДНК, называемые геликазами и нуклеазами соответственно. 1,6
Иммунная система CRISPR защищает бактерии от повторяющихся вирусных атак в три этапа:
1. Адаптация – когда ДНК вируса внедряется в бактерию, вирусная ДНК перерабатывается в короткие сегменты и превращается в новая прокладка между повторами. Они будут служить генетической памятью о предыдущих инфекциях.
2. Производство РНК CRISPR. Последовательность CRISPR подвергается транскрипции, включая спейсеры и гены Cas, создавая одноцепочечную РНК. Полученная одноцепочечная РНК называется CRISPR РНК, которая содержит копии вторгающейся последовательности вирусной ДНК в своих спейсерах.
Полученная одноцепочечная РНК называется CRISPR РНК, которая содержит копии вторгающейся последовательности вирусной ДНК в своих спейсерах.
3. Нацеливание — РНК CRISPR идентифицируют вирусную ДНК и направляют к ней белки, связанные с CRISPR. Затем белок расщепляет и уничтожает целевой вирусный материал.
Рисунок 1. Этапы опосредованного CRISPR иммунитета 6
Ученые используют распознавание специфических последовательностей ДНК системами CRISPR-Cas9 и применяют его в процессе создания улучшенных культур. Вместо вирусной ДНК в качестве спейсера ученые разрабатывают свои собственные последовательности на основе интересующего их конкретного гена. Если последовательность гена известна, ее можно легко использовать в CRISPR. Затем он будет действовать как распорка для системы и направлять Cas9.белка в соответствующую последовательность ДНК. 1,6
Рисунок 2.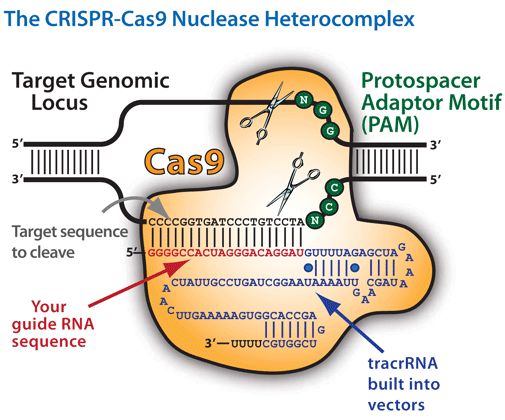 Механизм редактирования генов CRISPR/CAS96
Механизм редактирования генов CRISPR/CAS96
CRISPR-PRSPR. Выбивной
Сайленсинг генов с помощью CRISPR начинается с использования одной направляющей РНК (sgRNA) для нацеливания генов и инициирования двухцепочечного разрыва с использованием Cas9.эндонуклеаза. Затем эти разрывы восстанавливаются с помощью врожденных механизмов восстановления ДНК, негомологичного соединения концов (NHEJ). Однако NHEJ подвержен ошибкам и приводит к геномным делециям или вставкам, что затем приводит к постоянному молчанию целевого гена. 4,7,8
Редактирование генов без ДНК
CRISPR можно использовать для редактирования генов без использования ДНК без использования ДНК-векторов, требующих только РНК или белковых компонентов. Система редактирования генов без ДНК может быть хорошим выбором, чтобы избежать возможности нежелательных генетических изменений из-за интеграции плазмидной ДНК в месте разреза или случайных интеграций вектора. 4,7
4,7
Генные вставки или «вставки»
Вызванный CRISPR двухцепочечный разрыв также можно использовать для создания «вставок» генов путем использования репарации, направленной на гомологию клеток. Точная вставка донорской матрицы может изменить кодирующую область гена. Предыдущие исследования показали, что одноцепочечная ДНК может использоваться для создания точных вставок с использованием системы CRISPR-Cas9. 4,7,8
Временное замалчивание генов
Модифицируя белок Cas9 так, чтобы он не мог разрезать ДНК, также можно добиться временного молчания генов или репрессии транскрипции. Модифицированный Cas9 во главе с направляющей РНК нацеливается на промоторную область гена и снижает транскрипционную активность и экспрессию гена. Можно эффективно осуществлять временную активацию или активацию определенных генов. 4,7
Применение CRISPR-Cas9
Исследователи обнаружили, что систему CRISPR-Cas9 можно применять почти к каждому организму. Ранние исследования с использованием CRISPR — Cas9для редактирования генов сосредоточились на сельскохозяйственных культурах, важных для сельского хозяйства. Уже на раннем этапе стало понятно, что эту систему можно использовать в сельскохозяйственных культурах для улучшения таких признаков, как урожайность, архитектура растений, эстетика растений и устойчивость к болезням.
Ранние исследования с использованием CRISPR — Cas9для редактирования генов сосредоточились на сельскохозяйственных культурах, важных для сельского хозяйства. Уже на раннем этапе стало понятно, что эту систему можно использовать в сельскохозяйственных культурах для улучшения таких признаков, как урожайность, архитектура растений, эстетика растений и устойчивость к болезням.
CRISPR использовался для редактирования генома риса. Группа Ying Wang из Syngenta Biotechnology China разработала несколько sgRNA CRISPR и успешно удалила фрагменты гена плотной и прямостоячей метелки1 ( DEP1 ) в линии риса Indica IR58025B. Улучшения
в признаках, связанных с урожайностью, таких как плотные и прямостоячие метелки и уменьшенная высота растения, наблюдались у полученных мутантных растений. 9
Группа исследователей из Китайской академии сельскохозяйственных наук под руководством Юпэн Цая также использовала систему CRISPR-Cas9 для индуцирования мутаций в GmFT2a , интеграторе фотопериодного пути цветения сои.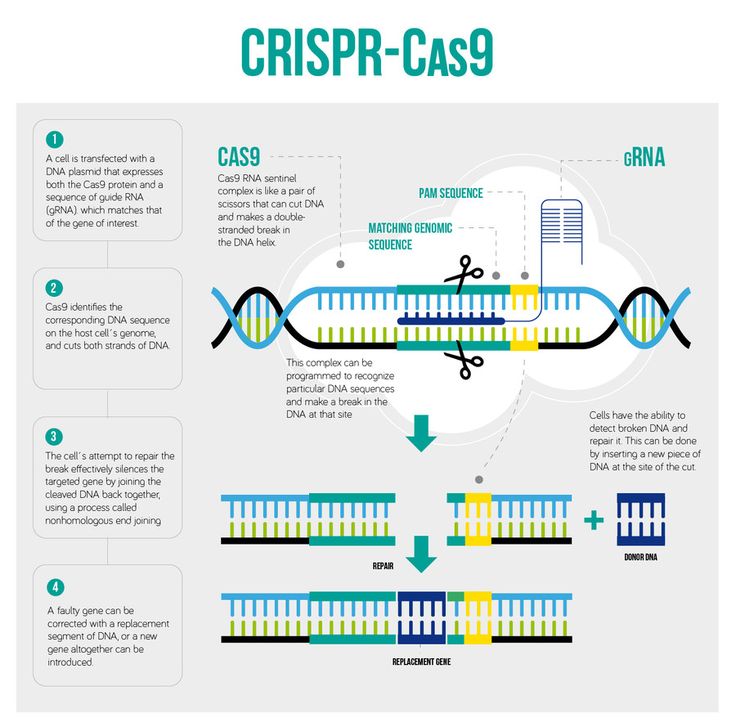 Разработанные растения сои показали позднее цветение, что привело к увеличению вегетативного размера. Также было обнаружено, что мутация стабильно наследуется в следующем поколении. 10
Разработанные растения сои показали позднее цветение, что привело к увеличению вегетативного размера. Также было обнаружено, что мутация стабильно наследуется в следующем поколении. 10
Исследователи из Пекинской ключевой лаборатории по улучшению зародышевой плазмы овощей под руководством Шоувей Тиана использовали CRISPR-Cas9 для нацеливания на ClPDS , фитоендесатуразу в арбузе, для достижения фенотипа альбиноса. Все арбузы с отредактированным геномом содержали мутации в ClPDS и демонстрировали полный или мозаичный фенотип альбиноса. Это исследование послужило доказательством концепции использования системы CRISPR-Cas9 в селекции арбузов. 11
Исследователи из Китайской академии сельскохозяйственных наук и Национального центра улучшения сортов цитрусовых и Юго-Западного университета также вывели цитрусовые растения, устойчивые к раку цитрусовых, вызываемому Xanthomonas citri subsp. citri ( Xcc ), серьезное заболевание цитрусовых, через CRISPR-Cas9.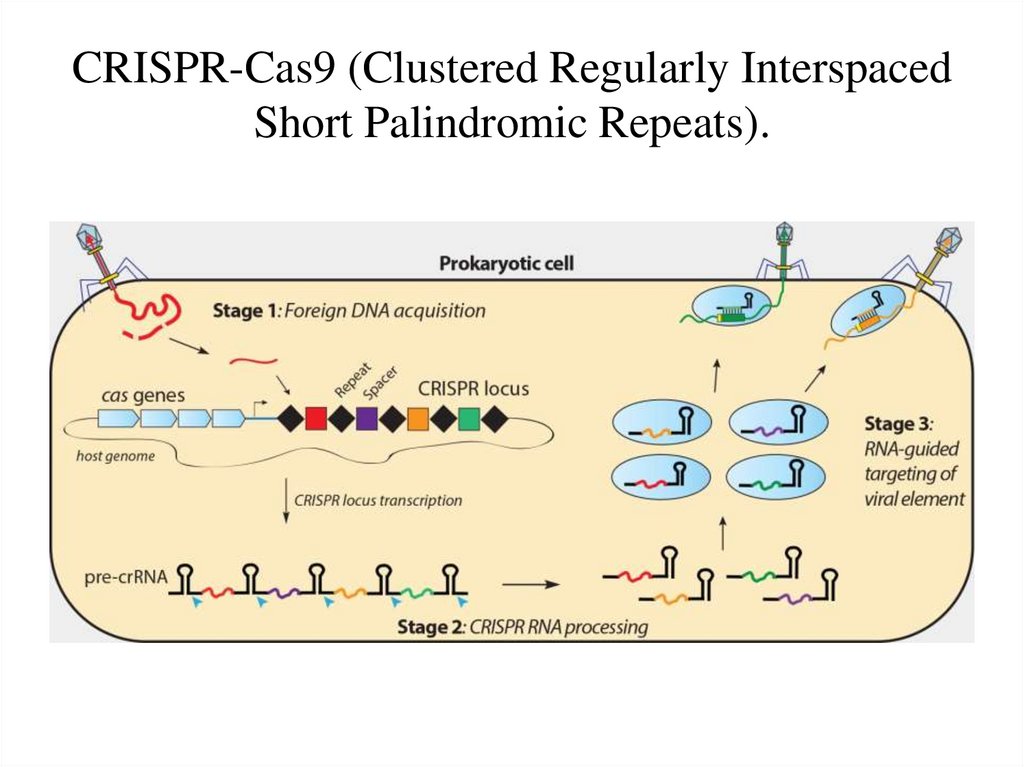
Исследователи нацелились на промотор гена CsLOB1 , который способствует развитию рака у цитрусовых. Разработанные линии показали повышенную устойчивость к раку цитрусовых по сравнению с дикими типами. 12
Лаборатория Колд-Спринг-Харбор вместе с различными исследовательскими учреждениями также использовали CRISPR-Cas9 для создания мутаций в подавителе цветения САМООБРЕЗКА5G ( SP5G ) для томатов для управления реакцией на фотопериод. Мутации, вызванные CRISPR-Cas9, вызвали быстрое цветение и усилили привычку к компактному росту полевых помидоров, что привело к быстрому всплеску цветения и раннему урожаю. 13
CRISPR-Cas9 также позволил создать животных, подходящих для моделирования заболеваний человека. Команда Юю Ню из Юньнаньской ключевой лаборатории биомедицинских исследований приматов применила CRISPR-Cas9.путем совместной инъекции мРНК Cas9 и sgRNAs в эмбрионы на стадии одной клетки. Команда создала CRISPR-отредактированных яванских макаков для лечения заболеваний головного мозга, которые не могут быть полностью изучены у мышей. 14
14
Исследователи из Калифорнийского университета также использовали CRISPR для исследований в области генной терапии. Используя CRISPR-Cas9, они исправили мутации, связанные с генетическим заболеванием, β-талассемией, путем создания индуцированных плюрипотентных стволовых клеток (ИПСК) у пациентов с β-талассемией. Команда использовала CRISPR-Cas9.для исправления мутаций в бета-гемоглобине человека (HBB) в ИПСК пациентов, что приводит к ген-скорректированным ИПСК с восстановленной экспрессией гена HBB, которые можно использовать для генной терапии. 15
Американские ученые также изучают использование CRISPR для лечения вируса иммунодефицита человека (ВИЧ). Они использовали CRISPR для редактирования генома ВИЧ из иммунных клеток, называемых Т-клетками, у пациента с ВИЧ. Ученые обнаружили, что CRISPR может вызвать мутацию вируса ВИЧ. Тем не менее, необходимы дополнительные исследования, прежде чем CRISPR можно будет использовать для лечения ВИЧ. 6
CRISPR сыграл огромную роль в увеличении количества исследований по редактированию генома в последние годы. Система имеет широкое применение в улучшении растений и животных, а также в области медицины. Поскольку это относительно молодой метод, в ближайшем будущем ожидаются различные открытия и инновации для его эффективного использования в более широких приложениях.
Система имеет широкое применение в улучшении растений и животных, а также в области медицины. Поскольку это относительно молодой метод, в ближайшем будущем ожидаются различные открытия и инновации для его эффективного использования в более широких приложениях.
Ссылки
- Баррангу, Р., Фремо, К., Дево, Х., Ричардс, М., Бояваль, П., Муано, С., Ромеро, Д. А., и Хорват, П. 2007. CRISPR обеспечивает приобретенную устойчивость к вирусам у прокариот. Наука 315 (5819): 1709–1712 гг.
- Горизонт Дискавери. 2016. CRISPR/CRISPR Cas9. https://www.horizondiscovery.com/gene-editing/crispr.
- Болотин А., Квинкис Б., Сорокин А. и Эрлих С.Д. 2005. Сгруппированные регулярно расположенные короткие палиндромные повторы (CRISPR) имеют спейсеры внехромосомного происхождения. Микробиология 151 (8): 2551–2561.
- Дхармакон. 2016. Редактирование генов. http://dharmacon.gelifesciences.com/applications/gene-editing/.
- Джинек М.
 , Чилински К., Фонфара И., Хауэр М., Дудна Дж. А. и Шарпантье Э. 2012. Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете. Наука 337 (6096): 816–821.
, Чилински К., Фонфара И., Хауэр М., Дудна Дж. А. и Шарпантье Э. 2012. Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете. Наука 337 (6096): 816–821. - Гарвардский университет. 2015. CRISPR: революционный метод генной инженерии. http://sitn.hms.harvard.edu/flash/2014/crispr-a-game-changing-genetic-engineering-technique/.
- Конг Л., Ран Ф.А., Кокс Д., Лин С., Барретто Р., Хабиб Н., Хсу П.Д., Ву С., Цзян В., Марраффини Л.А., Чжан Ф. 2013. Мультиплексная инженерия генома с использованием систем CRISPR/Cas. Наука 339(6121): 819–823.
- AddGene. 2014. История и предыстория CRISPR. https://www.addgene.org/crispr/reference/history/.
- Ван, Ю., Гэн, Л., Юань, М., Вэй, Дж., Цзинь С., Ли, М., Ю К., Чжан Ю., Джин, Х., Ван, Э., Чай, Z., Fu, X., Li, X. 2017. Делеция гена-мишени в рисе Indica с помощью CRISPR/Cas9. Отчеты о клетках растений 36 (8): 1333–1343.
- Цай, Ю., Чен, Л., Лю, X., Го, К.
 , Сунь, С., Ву, К., Цзян, Б., Хань, Т. и Хоу, В. 2017. CRISPR/Cas9опосредованный направленный мутагенез GmFT2a задерживает время цветения сои. Журнал биотехнологии растений. http://onlinelibrary.wiley.com/doi/10.1111/pbi.12758/full.
, Сунь, С., Ву, К., Цзян, Б., Хань, Т. и Хоу, В. 2017. CRISPR/Cas9опосредованный направленный мутагенез GmFT2a задерживает время цветения сои. Журнал биотехнологии растений. http://onlinelibrary.wiley.com/doi/10.1111/pbi.12758/full. - Тянь С., Цзян Л., Гао К., Чжан Дж., Цзун М., Чжан Х., Рен Ю., Го С., Гун Г., Лю Ф. , Xu, Y. 2016. Эффективный нокаут гена на основе CRISPR/Cas9 в арбузе. Отчеты о клетках растений 36 (3): 399–406.
- Пэн, А., Чен, С., Лей, Т., Сюй, Л., Хе, Ю., Ву, Л., Яо, Л. и Цзоу, X. 2017. Разработка устойчивых к раку растений с помощью CRISPR/ Cas9-целевое редактирование промотора гена восприимчивости CsLOB1 у цитрусовых. Журнал биотехнологии растений. http://onlinelibrary.wiley.com/doi/10.1111/pbi.12733/full.
- Сойк, С., Мюллер, Н.А., Парк, С.Дж., Шмаленбах, И., Цзян, К., Хаяма, Р., Чжан, Л., Ван Эк, Дж., Хименес-Гомес, Дж.М., и Липпман, З.Б. 2017. Изменение гена цветения SELF PRUNING 5G способствует нейтральности дня и ранней урожайности томатов.
 Nature Genetics, 49 (1): 162–168.
Nature Genetics, 49 (1): 162–168. - Ню Ю., Шен Б., Цуй Ю., Чен Ю., Ван Дж., Ван Л., Кан Ю., Чжао С., Си В., Ли В., Сян А.П., Чжоу Дж., Го X., Bi Y., Si C., Hu B., Dong G., Wang H., Zhou Z., Li T., Tan T., Pu X., Wang F., Ji S., Zhou Q. , Huang X., Ji W., Sha J. 2014. Создание геномодифицированных яванских макаков с помощью Cas9/РНК-опосредованного нацеливания генов на одноклеточные эмбрионы. Ячейка 156 (4): 836-843.
- Се Ф., Е Л., Чанг Дж. К., Бейер А. И., Ван Дж., Мюнх М. О. и Кан Ю.В. 2014. Бесшовная генная коррекция мутаций бета-талассемии в ИПСК, специфичных для пациента, с использованием CRISPR/Cas9.и ПиггиБак. Genome Research 24 (9): 1526–1533.
Next Pocket K: Биотехнологически улучшенные животные
Ресурсы для обучения редактированию генов CRISPR-Cas
На этой странице | Микробная иммунная система | Система редактирования генов | Применение технологии CRISPR | Занятия в классе | Каталожные номера |
На этой странице | Микробная иммунная система | Система редактирования генов | Применение технологии CRISPR | Занятия в классе | Каталожные номера | CRISPR для класса |
Одной из самых захватывающих последних разработок в области генной инженерии является CRISPR-Cas9 (CRISPR).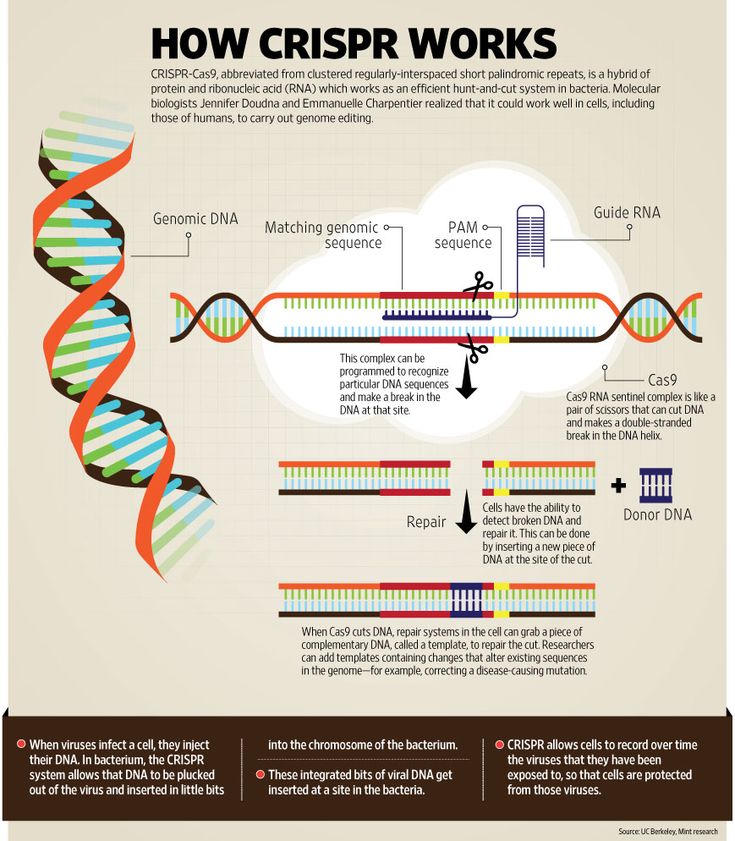 CRISPR получил свое название от «сгруппированных регулярно расположенных коротких палиндромных повторов», геномных последовательностей, которые микробы используют для защиты от вирусных атак. Наряду с белками, ассоциированными с CRISPR (Cas), бактерии используют последовательности для распознавания и обезвреживания будущих вторгающихся вирусов. Ученые приняли эту систему для использования в генной инженерии.
CRISPR получил свое название от «сгруппированных регулярно расположенных коротких палиндромных повторов», геномных последовательностей, которые микробы используют для защиты от вирусных атак. Наряду с белками, ассоциированными с CRISPR (Cas), бактерии используют последовательности для распознавания и обезвреживания будущих вторгающихся вирусов. Ученые приняли эту систему для использования в генной инженерии.
Технология CRISPR-Cas позволяет ученым редактировать гены и манипулировать экспрессией генов с такой легкостью, которая была бы невозможна при использовании других методов. Важно отметить, что это также позволяет исследователям редактировать гены в живых организмах, что поддерживает использование CRISPR-Cas в широком спектре приложений от фундаментальных исследований до разработки новых методов лечения и других биотехнологических продуктов.
Нобелевская премия по химии 2020 года была присуждена Эммануэль Шарпантье и Дженнифер Дудна за разработку этого метода редактирования генома.
На этой странице содержится справочная информация о технологии CRISPR, а также другие ресурсы и мероприятия. Также посмотрите наше видео «Объяснение CRISPR: история, технология и применение редактирования генов».
CRISPR-Cas — микробная иммунная система
У людей сложная иммунная система, которая включает скоординированную деятельность нескольких типов клеток, органов и сигнальных систем для распознавания активных инфекций и реагирования на них. Прокариоты — бактерии и археи — также обладают формой адаптивного иммунитета, которая позволяет им распознавать вирусные инфекции и реагировать на них.
Бактериальная хромосома Область CRISPR в микробном геноме.
Некоторые прокариотические геномы содержат короткие палиндромные последовательности ДНК, которые многократно повторяются, с уникальными «спейсерными» последовательностями между повторами. За этими «сгруппированными короткими палиндромными повторами с регулярными промежутками» (CRISPR) следуют короткие сегменты спейсерной ДНК, которые соответствуют последовательностям ДНК, обнаруженным в геномах бактериофагов (бактериофаги — это вирусы, которые, как известно, заражают бактерии). Группы CRISPR-ассоциированных (Cas) генов также обнаруживаются рядом с последовательностями CRISPR, и эти гены Cas кодируют ферменты, которые разрезают ДНК в определенных местах, подобно точным молекулярным ножницам.
Группы CRISPR-ассоциированных (Cas) генов также обнаруживаются рядом с последовательностями CRISPR, и эти гены Cas кодируют ферменты, которые разрезают ДНК в определенных местах, подобно точным молекулярным ножницам.
Последовательности CRISPR-Cas9 работают вместе, чтобы обеспечить иммунный ответ, при котором микроб может распознать вторгшуюся ДНК и высвободить ферменты Cas, чтобы разрезать и обезвредить ее. Последовательности CRISPR и ферменты Cas являются ключами к микробному «адаптивному иммунному ответу», который включает в себя три фазы:
- Разрезание и захват — Когда бактерии инфицируются вирусом, они используют свою систему CRISPR для разрезания вирусной ДНК и вставлять ее фрагменты (спейсеры) в собственный геном в качестве «памяти» инфекции
- Мониторинг — Бактерии транскрибируют спейсеры в РНК, которая может образовывать комплекс с ферментом Cas9. Эти комплексы контролируют клетку на наличие любой последовательности ДНК, комплементарной РНК
- Защита — Если встречается совпадающая (вирусная) ДНК, спейсерный комплекс РНК-Cas9 связывается с ней и разрезает вирусную ДНК, чтобы предотвратить ее репликацию. Это останавливает вирусную инфекцию
.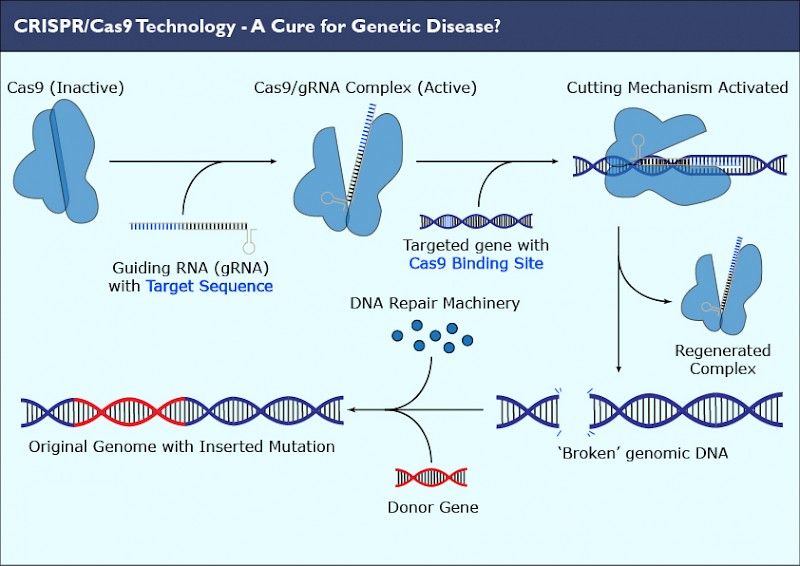
С помощью этой системы бактерии могут собирать последовательности множества различных заражающих вирусов для создания «библиотеки». Поскольку последовательность CRISPR содержится в геномной ДНК, она передается каждому поколению, а библиотека со временем продолжает меняться и адаптироваться к более распространенным угрозам.
Получение чужеродных последовательностей ДНК Защита от будущих инфекций
Система защиты от микробов CRISPR-Cas9. 1. Ферменты Cas1-Cas2 микроба распознают и вырезают сегмент чужеродной ДНК. 2. Ферменты Cas1-Cas2 вставляют сегмент ДНК в область CRISPR бактериального генома в качестве спейсера. 3. Спейсерная последовательность транскрибируется и затем связывается с Cas9белок. 4. При повторном заражении тем же захватчиком комплекс CRISPR-Cas9 может распознавать последовательность чужеродной ДНК и разрезать ее, чтобы предотвратить полное повторное заражение.
3. Спейсерная последовательность транскрибируется и затем связывается с Cas9белок. 4. При повторном заражении тем же захватчиком комплекс CRISPR-Cas9 может распознавать последовательность чужеродной ДНК и разрезать ее, чтобы предотвратить полное повторное заражение.
CRISPR-Cas9 — система редактирования генов
Система CRISPR-Cas9 использует модифицированные компоненты бактериальной системы CRISPR для направленного целевого разрезания двухцепочечной ДНК. Затем вступают в действие механизмы репарации ДНК, чтобы исправить разрыв таким образом, чтобы модифицировать разрезанную генетическую последовательность.
Разрезание ДНК
- Фермент Cas9 (Cas9) — эндонуклеаза, разрезающая обе нити ДНК в определенном месте. В природе встречается несколько типов ферментов Cas, но Cas9 обычно используется в лаборатории
- Одиночная направляющая РНК (sgRNA) — сконструированная РНК, образующая комплекс с Cas9.
 sgRNA представляет собой слияние двух областей, которые встречаются в природе как отдельные РНК:
sgRNA представляет собой слияние двух областей, которые встречаются в природе как отдельные РНК:- Направляющая область — часть CRISPR РНК или crРНК в природе, 20-нуклеотидная область, комплементарная области-мишени и определяющая последовательность ДНК-мишени, которую Cas9порезы. Ученые настраивают эту последовательность для своих целей
- Каркасная область — трансактивирующая CRISPR РНК или tracrRNA в природе, эта область образует многошпилечную петлевую структуру (скаффолд), которая связывается в расщелине белка Cas9
- Смежный мотив протоспейсера (PAM) — необходим для функции Cas9, этот мотив последовательности находится непосредственно ниже целевой последовательности. Cas9 распознает последовательность PAM 5′-NGG, где N может быть любым нуклеотидом (A, T, C или G). Когда Cas9связывает PAM, он разделяет нити ДНК соседней последовательности, чтобы обеспечить связывание sgRNA. Если sgRNA комплементарна этой последовательности, Cas9 разрезает ДНК
.
5 шагов расщепления ДНК Cas9
1.
 Cas9 связывает sgRNA
Cas9 связывает sgRNACas9 распознает и связывает область каркаса (tracrRNA) sgRNA. Нуклеотидная последовательность каркасной области определяет ее структуру, которая адаптирована к белку Cas9, как ключ подходит к замку.
2. Комплекс Cas9-sgRNA связывается с сайтом PAM на ДНК-мишени
Для Cas9 требуется, чтобы определенная последовательность PAM (5’-NGG) присутствовала непосредственно рядом с последовательностью протоспейсера. Когда комплекс Cas9-sgRNA распознает и связывает PAM, он разделяет нити ДНК соседней последовательности, чтобы обеспечить связывание sgRNA.
3. Направляющая область sgRNA связывается с целевой последовательностью ДНК
Направляющая область sgRNA пытается образовать пару оснований с ДНК. Если совпадение найдено, процесс продолжается. В противном случае комплекс высвобождается и пытается связать другой PAM и последовательность ДНК-мишени.
4. Cas9 делает двухцепочечный разрыв в ДНК на три пары оснований выше PAM
5.
 Комплекс высвобождается из ДНК
Комплекс высвобождается из ДНККомплекс Cas9-sgRNA высвобождает разрезанную ДНК и готов к повторению процесса.
Исправление разрыва для внесения изменений
Исследователи могут использовать собственный механизм восстановления ДНК клетки для модификации, вставки или удаления последовательности нуклеотидов. Ремонт может происходить двумя способами:
- Негомологичное соединение концов (NHEJ) — ферменты снова соединяют концы двухцепочечного разрыва. Этот процесс может случайным образом вставлять или удалять одно или несколько оснований и может вызывать мутации, которые могут нарушить функцию или экспрессию гена
- Направленная репарация по гомологии (HDR) — белки исправляют разрыв с использованием ДНК-матрицы донора. Исследователи разрабатывают ДНК-матрицу донора, которая может включать желаемую последовательность, окруженную с обеих сторон «плечами гомологии», которые соответствуют последовательности выше и ниже разреза.
 Комплементарная цепь ДНК создается во время репарации
Комплементарная цепь ДНК создается во время репарации
Репарация ДНК посредством репарации, направленной по гомологии, и негомологичного соединения концов (прокрутите вправо, чтобы просмотреть изображение)
Применение технологии CRISPR
С помощью CRISPR возможно целенаправленное разрушение любого гена — в большинстве организмов. Это позволяет ученым модифицировать геномную ДНК с точностью, чтобы гарантировать, что никакие другие гены или последовательности не будут непреднамеренно нарушены. Технология CRISPR проще, быстрее и дешевле, чем другие методы редактирования генов, и может использоваться для одновременного редактирования нескольких генов в одной клетке. Наконец, CRISPR требует введения только одного белка (Cas9) и одну sgRNA в клетку. Можно ожидать, что такая мощная технология будет иметь широкий спектр приложений.
Медицина
Исследователи рассматривают CRISPR как метод исправления генетических дефектов, приводящих к серповидно-клеточной анемии, муковисцидозу, гемофилии и мышечной дистрофии, а также для разработки более целенаправленных и эффективных методов лечения рака.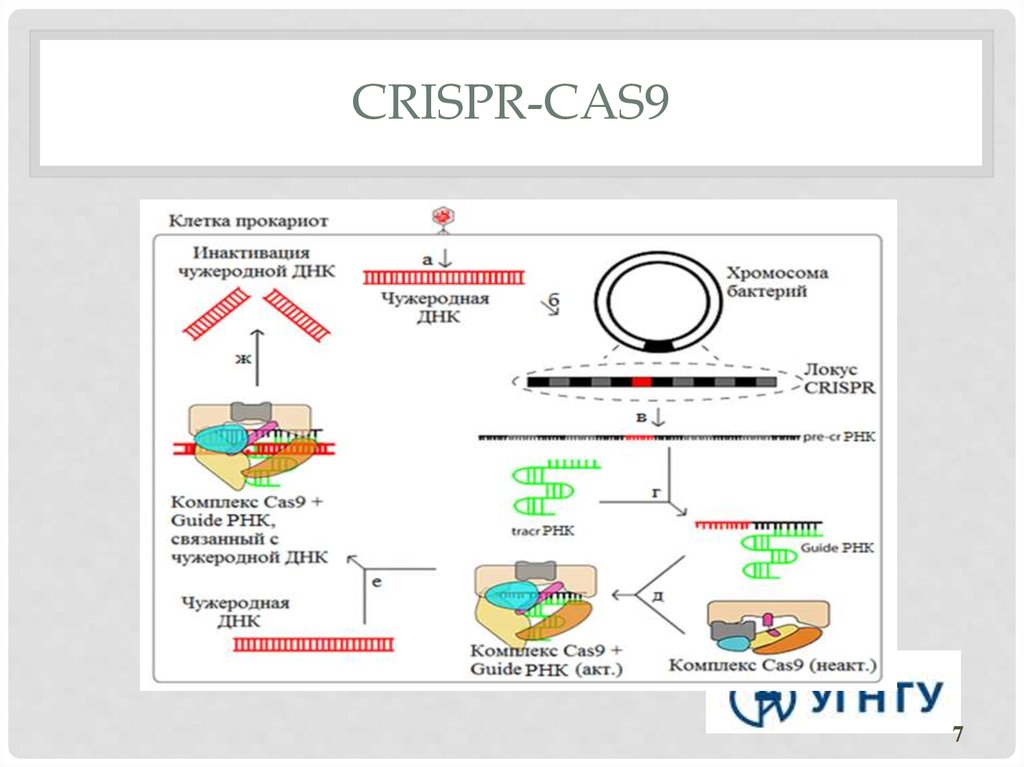 Одно исследование показало, что взрослых крыс, у которых была сконструирована генетическая форма слепоты, можно лечить с помощью генной терапии CRISPR (Berry et al. 2019).). Цель состоит в том, чтобы когда-нибудь удалить больные клетки пациентов, «исправить» их с помощью CRISPR, а затем вернуть в их тела для лечения различных заболеваний или лечения больных органов непосредственно с помощью CRISPR. Возможность использования CRISPR для изменения генетических признаков у людей вызвала серьезные опасения по поводу возможных непреднамеренных эффектов, а также этических вопросов. Простота применения CRISPR вызвала беспокойство по поводу возможного неправильного использования технологии. Несмотря на эти опасения, CRISPR революционизирует многие аспекты биотехнологии и научных исследований.
Одно исследование показало, что взрослых крыс, у которых была сконструирована генетическая форма слепоты, можно лечить с помощью генной терапии CRISPR (Berry et al. 2019).). Цель состоит в том, чтобы когда-нибудь удалить больные клетки пациентов, «исправить» их с помощью CRISPR, а затем вернуть в их тела для лечения различных заболеваний или лечения больных органов непосредственно с помощью CRISPR. Возможность использования CRISPR для изменения генетических признаков у людей вызвала серьезные опасения по поводу возможных непреднамеренных эффектов, а также этических вопросов. Простота применения CRISPR вызвала беспокойство по поводу возможного неправильного использования технологии. Несмотря на эти опасения, CRISPR революционизирует многие аспекты биотехнологии и научных исследований.
Сельское хозяйство
Ожидается, что технология CRISPR ускорит выведение новых улучшенных культур. Технология позволила получить сельскохозяйственные культуры и домашний скот с желаемыми характеристиками, такими как более быстрый рост, более высокое содержание питательных веществ и устойчивость к болезням. А поскольку технология CRISPR позволяет модифицировать гены без введения новых генов, растения, модифицированные CRISPR, могут подвергаться менее строгому регулированию, чем другие генетически модифицированные культуры.
А поскольку технология CRISPR позволяет модифицировать гены без введения новых генов, растения, модифицированные CRISPR, могут подвергаться менее строгому регулированию, чем другие генетически модифицированные культуры.
Промышленность
Ученые использовали модифицированный CRISPR-Cas9система для создания штамма дрожжей для производства липидов и полимеров. Эти молекулы могут быть полезны при разработке биотоплива, клеев и ароматизаторов. В настоящее время эти липиды и полимеры производятся синтетическим путем из невозобновляемых материалов на основе нефти, которые являются более дорогими и могут представлять угрозу безопасности.
Общественное здравоохранение
Ученые экспериментируют с использованием CRISPR для разработки «генных драйвов» для распространения определенных генов среди популяции насекомых-вредителей, что приводит к их гибели или бесплодию. Считается, что этот метод уничтожает комаров, переносящих патогены человека, такие как малярийные паразиты или вирус Зика.
Используете CRISPR в своих исследованиях? См. Решения Bio-Rad для рабочих процессов редактирования генов
Классные занятия и ресурсы
Плейлист YouTube CRISPR Gene Editing
Предложите своим учащимся узнать мнение о CRISPR от ведущих экспертов отрасли.
Занятия и ресурсы для занятий в классе
Задание с бумажной моделью CRISPR (PDF, 675 КБ)
Попросите учащихся использовать это задание с бумажной моделью CRISPR дома, чтобы узнать о CRISPR-Cas9система.
Упражнение по биоинформатике (PDF, 6,1 МБ)
Учащиеся могут использовать это задание для создания целевых участков Cas9 в геноме человека и определения риска нецелевого эффекта.
Презентация PowerPoint для использования в классе (PPT, 14,9 МБ)
Используйте и изменяйте эту презентацию, чтобы помочь своим учащимся пройти лабораторную работу по редактированию генов CRISPR-Cas9.
Редактирование генов и ссылки на CRISPR
- Berry MH et al.


 И эта закономерность привлекла внимание.
И эта закономерность привлекла внимание. Затем они превращаются в РНК. В этом же куске генома у бактерий кодируется так называемая тракр-РНК (tracrRNA). Вместе они формируют guideRNA, или наводящую РНК, которая затем объединяется с белком Cas9.
Затем они превращаются в РНК. В этом же куске генома у бактерий кодируется так называемая тракр-РНК (tracrRNA). Вместе они формируют guideRNA, или наводящую РНК, которая затем объединяется с белком Cas9. А CRISPR — генетические ножницы. Все детали ниже.
А CRISPR — генетические ножницы. Все детали ниже. Генетический код — это типлеты, то есть три нуклеотида кодируют одну аминокислоту. Если вы вырезали два или вставили четыре нуклеотида, нарушится последовательность, кодирующая белок. Возникнет сдвиг рамки считывания, в результате которого ген фактически перестанет выполнять свою функцию, так как клетка не сможет использовать его информацию, чтобы синтезировать функциональный белок.
Генетический код — это типлеты, то есть три нуклеотида кодируют одну аминокислоту. Если вы вырезали два или вставили четыре нуклеотида, нарушится последовательность, кодирующая белок. Возникнет сдвиг рамки считывания, в результате которого ген фактически перестанет выполнять свою функцию, так как клетка не сможет использовать его информацию, чтобы синтезировать функциональный белок.
 , Чилински К., Фонфара И., Хауэр М., Дудна Дж. А. и Шарпантье Э. 2012. Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете. Наука 337 (6096): 816–821.
, Чилински К., Фонфара И., Хауэр М., Дудна Дж. А. и Шарпантье Э. 2012. Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете. Наука 337 (6096): 816–821. , Сунь, С., Ву, К., Цзян, Б., Хань, Т. и Хоу, В. 2017. CRISPR/Cas9опосредованный направленный мутагенез GmFT2a задерживает время цветения сои. Журнал биотехнологии растений. http://onlinelibrary.wiley.com/doi/10.1111/pbi.12758/full.
, Сунь, С., Ву, К., Цзян, Б., Хань, Т. и Хоу, В. 2017. CRISPR/Cas9опосредованный направленный мутагенез GmFT2a задерживает время цветения сои. Журнал биотехнологии растений. http://onlinelibrary.wiley.com/doi/10.1111/pbi.12758/full.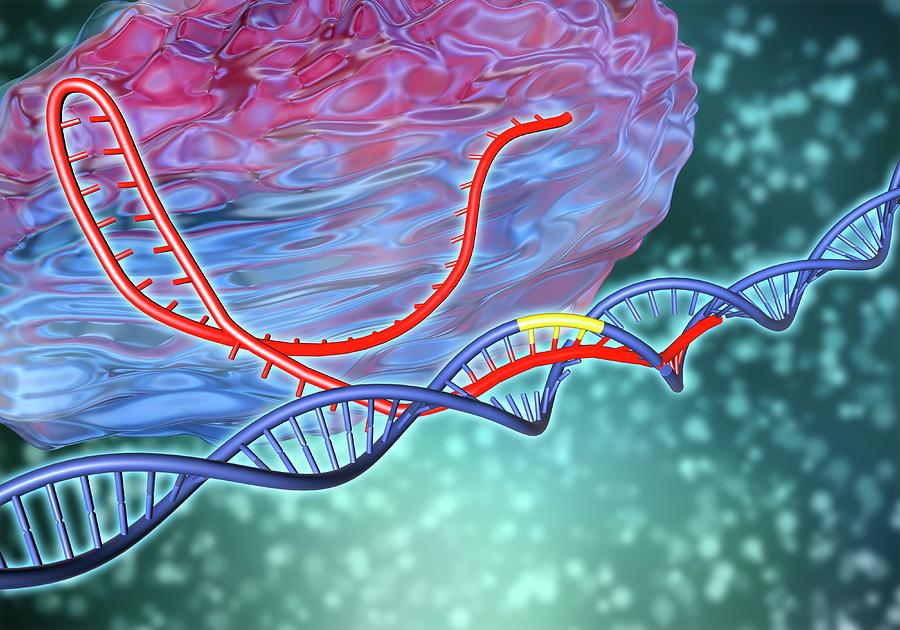 Nature Genetics, 49 (1): 162–168.
Nature Genetics, 49 (1): 162–168.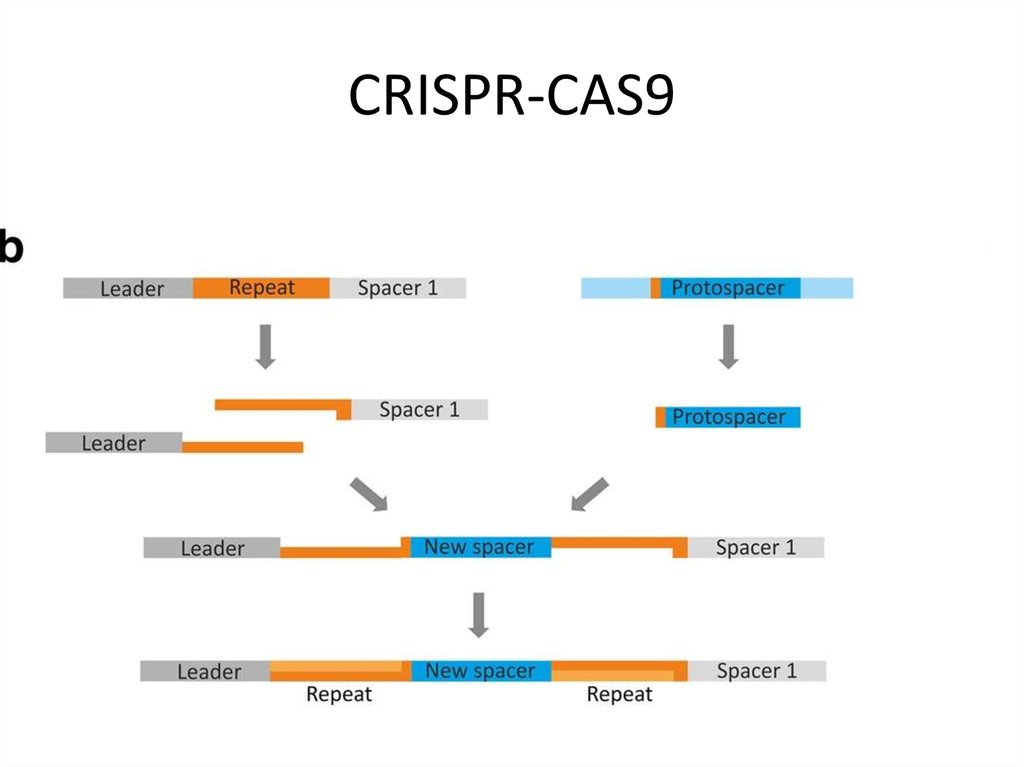 sgRNA представляет собой слияние двух областей, которые встречаются в природе как отдельные РНК:
sgRNA представляет собой слияние двух областей, которые встречаются в природе как отдельные РНК: Cas9 связывает sgRNA
Cas9 связывает sgRNA Комплекс высвобождается из ДНК
Комплекс высвобождается из ДНК Комплементарная цепь ДНК создается во время репарации
Комплементарная цепь ДНК создается во время репарации